Бифункциональные фенилизо(тио)цианаты, способ и промежуточные продукты для их получения
Номер патента: 10872
Опубликовано: 30.12.2008
Авторы: Пуль Михаэль, Гётц Норберт, Хампрехт Герхард, Вольф Бернд, Зайтц Вернер, Кайл Михаэль, Райнхард Роберт, Загассер Инго
Формула / Реферат
1. Способ получения фенилизо(тио)цианатов общей формулы I
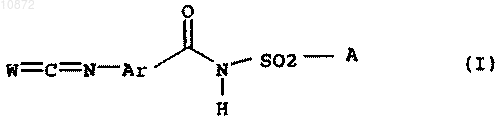
где переменные имеют следующие значения: W означает кислород или серу, Ar означает фенил, который может быть замещен один или несколько раз галогеном; А означает NR1R2, где R1 и R2 означают независимо друг от друга С1-C6-алкил, С2-C6-алкенил или С2-C6-алкинил, либо R1 и R2 образуют вместе насыщенный 6-членный азотный гетероцикл, который может быть замещен С1-С4-алкилом, отличающийся тем, что соединение общей формулы II
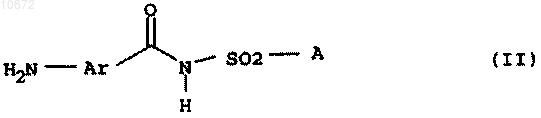
где переменные Ar и А имеют вышеприведенные значения, или его НСl-аддукт подвергают взаимодействию с фосгеном, тиофосгеном или дифосгеном.
2. Способ по п.1, отличающийся тем, что применяют HCl-аддукт соединения II.
3. Способ по п.1 или 2, отличающийся тем, что применяют от 0,9 до 2 мол.экв. фосгена, тиофосгена или дифосгена в пересчете на соединение II.
4. Способ по одному из предыдущих пунктов, отличающийся тем, что превращение хлорводородного аддукта соединения II проводят в присутствии активного угля.
5. Способ по одному из предыдущих пунктов, отличающийся тем, что соединение формулы IIA
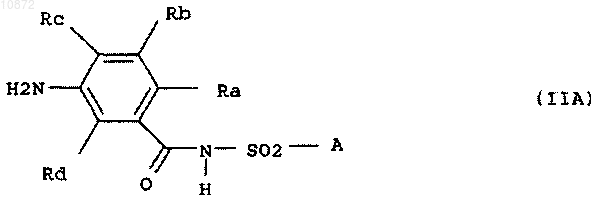
где Ra и Rc означают независимо друг от друга водород или галоген,
Rb и Rd означают водород и
А имеет вышеприведенное значение,
или его HCl-аддукт подвергают взаимодействию с фосгеном, тиофосгеном или дифосгеном и получают соединение формулы IA
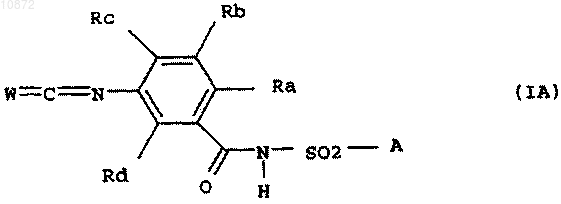
где переменные Ra, Rb, Rc и Rd, А и W имеют вышеприведенные значения.
6. Способ по п.1, отличающийся тем, что он включает дополнительно следующие стадии:
i) взаимодействие ароильного соединения общей формулы III

где переменное Ar имеет вышеприведенные значения и X означает галоген, ОН или С1-С4-алкокси, с амидом сульфаминовой кислоты формулы IV
![]()
где А имеет вышеприведенные значения, и
ii) восстановление полученного на стадии i) амида N-ароилсульфаминовой кислоты общей формулы V

где Ar и А имеют вышеприведенные значения, с получением соединения формулы II.
7. Способ по п.6, отличающийся тем, что на стадии (ii) восстановление проводят в присутствии каталитических количеств переходных металлов или соединений переходных металлов.
8. Способ по п.6, отличающийся тем, что на стадии (ii) восстановление проводят в присутствии железа и по меньшей мере одной С1-С4-карбоновой кислоты.
9. Способ по п.6, отличающийся тем, что на стадии (ii) восстановление проводят в присутствии никеля Ренея и водорода.
10. Фенилизо(тио)цианаты общей формулы I, как определено в п.1

11. Фенилизо(тио)цианаты общей формулы IA, как определено в п.5
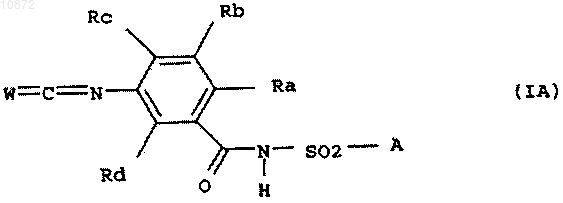
отличающиеся тем, что Ra означает фтор или хлор, Rc означает водород, фтор или хлор и каждый из Rb и Rd означает водород.
12. Способ получения соединений формулы VI
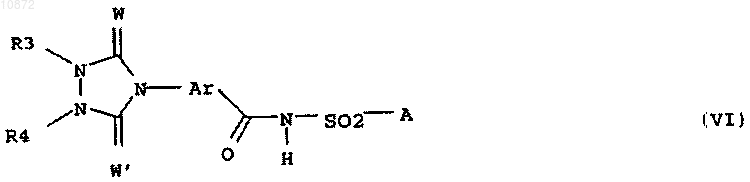
где W, Ar и А имеют приведенные в п.1 значения, W' означает О и R3 и R4 совместно с атомами азота, к которым они присоединены, образуют 6-членный, прерванный кислородом гетероцикл,
отличающийся тем, что
(i) соединение формулы I, определенное в п.1, подвергают взаимодействию с эфиром оксадиазинкарбоновой кислоты формулы VII

где Wч имеет вышеприведенное значение и R1 означает С1-С4-алкил, при этом получают производное мочевины формулы VIII

где переменные R3, R4, R1, W, W', Ar и А имеют вышеприведенные значения, и
(ii) полученный промежуточный продукт VIII циклизуют с получением соединения формулы VI.
13. Способ по п.12, отличающийся тем, что применяемое на стадии (i) соединение формулы I означает соединение формулы IA
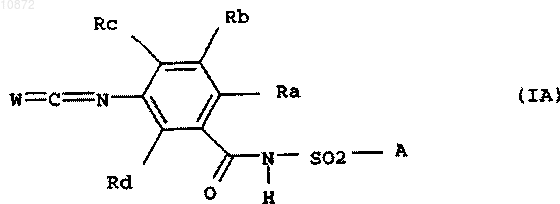
где переменные Ra, Rb, Rc, Rd, А и W имеют вышеприведенные значения.
14. Способ по п.12, отличающийся тем, что применяемое на стадии (i) соединение VII означает соединение формулы VII'

где W' означает О и R' означает С1-С4-алкил.
15. Амиды аминобензоилсульфаминовой кислоты формулы II
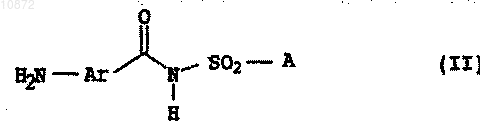
где переменные имеют следующие значения:
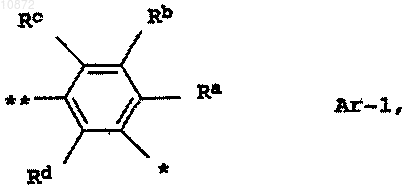
Ar означает группу формулы Ar-1
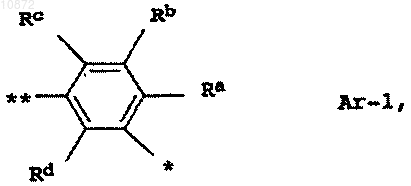
где Ra означает хлор,
Rb означает водород,
Rc означает водород или фтор,
Rd означает водород,
* означает соединение Ar с С(O)-группой и
** означает соединение Ar с атомом азота аминогруппы,
А означает группу формулы NR'R2, где остатки R1 и R2 независимо друг от друга означают C1-C6-алкил, C2-C6-алкенил или C2-C6-алкинил, либо R1 и R2 совместно образуют насыщенный 6-членный азотсодержащий гетероцикл, который может быть замещен С1-С4-алкилом.
16. Амиды нитробензоилсульфаминовой кислоты формулы V
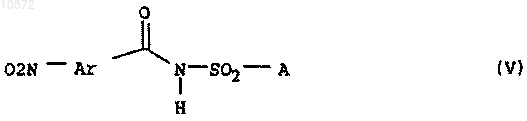
где переменные имеют следующие значения:
Ar означает группу формулы Ar-1
где Ra означает хлор,
Rb означает водород,
Rc означает водород или фтор,
Rd означает водород,
* означает соединение Ar с С(O)-группой и
** означает соединение Ar с атомом азота аминогруппы,
А означает группу формулы NR1R2, где остатки R1 и R2 независимо друг от друга означают C1-C6-алкил, C2-C6-алкенил или C2-C6-алкинил, либо R1 и R2 совместно образуют насыщенный 6-членный азотсодержащий гетероцикл, который может быть замещен C1-С4-алкилом.
17. Способ получения амидов аминобензоилсульфаминовой кислоты формулы II по п.15, отличающийся тем, что он включает следующие стадии:
а) взаимодействие ароильного соединения формулы III

где Ar имеет приведенные в п.16 значения и X означает галоген или С1-С4-алкокси, с амидом сульфаминовой кислоты формулы IV
![]()
где А имеет приведенное в п.16 значение, и
б) восстановление полученного на стадии а) амида нитробензоилсульфаминовой кислоты формулы V
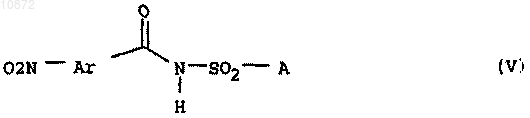
где Ar и А имеют приведенное в п.16 значения,
с получением амшфр аминобензоилсульфаминовой кислоты формулы II, определенного в п.15.
18. Способ по п.17, отличающийся тем, что на стадии б) восстановление проводят в присутствии каталитических количеств переходных металлов или соединений переходных металлов.
Текст
010872 Объектом настоящего изобретения является способ получения бифункциональных фенилизо(тио)цианатов общей формулы I с ацилсульфамидной группой где остатки имеют следующие значения:W означает кислород или серу,Ar означает фенил, который может быть замещен один или несколько раз галогеном; А означает NR1R2, где R1 и R2 означают независимо друг от друга C1-C6-алкил, C2-C6-алкенил илиC2-C6-алкинил, либо R1 и R2 образуют вместе насыщенный 6-членный азотный гетероцикл, который может быть замещен C1-C4-алкилом,взаимодействием анилинов или их гидрохлоридов с производными фосгена. Другим объектом изобретения являются бифункциональные фенилизо(тио)цианаты. Амиды изо(тио)цианатобензоилсульфаминовой кислоты являются потенциальными предварительными ступенями для получения средств защиты растений с группой триазол-3,5-дион-4-ила, пиримидин 2,6-дион-1-ила или 1,3,5-триазин-2,4,6-трион-1-ила или их S-аналогами, как они описаны в международной заявке WO 01/83459. Вследствие своей реакционной способности изо(тио)цианатовые структурные единицы могут легко переводиться в другие группы, такие как (тио)мочевинные или уретановые группы. Их получение, однако, по нижеприведенным причинам считалось до сих пор невозможным. В принципе фенилизо(тио)цианаты можно получить взаимодействием первичных ароматических аминов с фосгеном, соответственно с тиофосгеном (см., например, публикацию Houben-Weyl, Methodender organischen Chemie, 4. Aufiage, т. IX, стр. 869, 875-877 и т. VIII, стр. 120-124). Другие общие способы известны, например, из ЕР 70389, ЕР 75267 и ЕР 409025. Все описанные способы имеют общим то, что примененные фенилизо(тио)цианаты не имеют ацилсульфамидных групп. Известно, что изо(тио)цианатовая группа реагирует с сульфамидной группой с образованием сульфомочевин. Так, например, авторы J. Cervello и Т. Sastre в публикации Synthesis 1990,стр. 221-222, описывают взаимодействие сульфамида с изоцианатами согласно следующей последовательности реакций: Из US 4309209 известно, что фенилизоцианаты реагируют с хлорметан-(N-метил)сульфамидомOtto описывают в публикации Arch. Pharm (Weinheim) 326, стр. 437-441 (1993) взамодействие 3-галогеналкилсультамена с фенилизоцианатом с образованием карбамоильных соединений. Из DE 3433391 известно взаимодействие сахарина с ацилизоцианатами с получением Nацилированных производных сахарина. Авторы В.A. Arbuzov, N.N. Zobova и N.R. Fedotava описывают в публикции JZV АН СССР, SerKhim 1990, 2874 (английский перевод опубликован в: Bulletin of the Academy of Sciences of the USSR,Division of Chemical Sciences, Bd. 39, (1990) S. 2610) N- и О-ацилирование сахарина взаимодействием с трифторацетилизоцианатом. Исходя из этого, получение фенилизо(тио)цианатов, которые в одной и той же молекуле имеют еще реакционноспособную ацилсульфамидную функцию, а также их выделение без межмолекулярных последующих реакций считалось невозможным. Специалисты в данной области должны были предполагать, что сульфамиды вследствие их кислотного протона реагируют с фенилизо(тио)цианатами с получением производных сульфонилмочевины. До сих пор не был описан способ получения фенилизо(тио)цианатов, которые в качестве других функциональных групп имеют ацилсульфамидную группу. В основу изобретения положена задача разработки амидов изо(тио)цианатобензоилсульфаминовой кислоты формулы I. Неожиданным образом было установлено, что эта задача решается способом, при котором амид аминобензоилсульфаминовой кислоты общей формулы II-1 010872 где остатки Ar и А имеют вышеприведенное значение, подвергают взаимодействию с фосгеном, дифосгеном, соответственно тиофосгеном. В соответствии с этим, настоящее изобретение относится к способу получения фенилизо(тио)цианатов общей формулы I, который отличается тем, что соединение общей формулы II или егоHCl-аддукт подвергают взаимодействию с фосгеном, тиофосгеном или дифосгеном (см. схему 1). На схеме 1 остатки Ar, А и W имеют вышеприведенные значения. Схема 1 Получаемые способом согласно изобретению с высоким выходом фенилизо(тио)цианаты формулыI являются ценными промежуточными продуктами для получения средств защиты растений, в частности,3-(триазолилдион)замащенных фенилсульфамоилкарбоксамидов. Поэтому другим объектом изобретения является способ получения 3-гетероциклилзамещенных фенилсульфамоилкарбоксамидов, исходя из фенилизо(тио)цианатов формулы I. Соединения I согласно изобретению являются неожиданным образом стабильными, хорошо получаемыми также и в технических масштабах соединениями. Изобретение относится также к фенилизо(тио)цианатам общей формулы I. Стабильность соединений I согласно изобретению является неожиданной потому, что специалист в данной области ожидал бы межмолекулярную реакцию между изо(тио)цианатной структурной единицей и сульфамидной группировкой. Названные при определении заместителей органические молекулы представляют собой - как и значение галоген - сборные понятия для индивидуального перечисления отдельных членов групп, причем обозначение Cn-Cm означает возможное количество атомов углерода в части молекулы. Все углеродные цепи, т.е. все алкильные, алкенильные и алкинильные части могут быть разветвленными или неразветвленными. Если не указано по-другому, галогенированные остатки имеют предпочтительно от одного до шести одинаковых или различных атомов галогена. Галоген означает фтор, хлор, бром или йод. Далее имеются, например, следующие значения: С 1-C4-апкил означает, например, метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2 метилпропил или 1,1-диметилэтил;C1-C10-алкил означает насыщенный, алифатический углеводородный остаток с 1 до 10 атомами углерода, например С 1-C4-алкил, как приведено выше, а также, например, н-пентил, 1-метилбутил, 2 метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2 диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2 диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил,2-этилбутил, 1,1,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-3-метилпропил, н-гептил, н-нонил, ндецил, 1-метилгексил, 1-этилгексил, 1-метилгептил, 1-метилоктил, 1-метилнонил;C2-C10-алкенил означает однократно ненасыщенный олефиновый углеводородный остаток с 2-10 атомами углерода, предпочтительно с 3-6 атомами углерода, например этенил, проп-2-ен-1-ил (=аллил),проп-1-ен-1-ил, бут-1-ен-4-ил, бут-2-ен-1-ил, бут-3-ен-1-ил, 1-метилпроп-2-ен-1-ил, 2-метилпроп-2-ен-1 ил, 1-пентен-3-ил, 1-пентен-4-ил, 2-пентен-4-ил, 1-метилбут-2-ен-1-ил, 2-метилбут-2-ен-1-ил, 3-метилбут-2-ен-1-ил, 1-метилбут-3-ен-1-ил, 2-метилбут-3-ен-1-ил, 3-метилбут-3-ен-1-ил, 1,1-диметилпроп-2-ен 1-ил, 1,2-диметилпроп-2-ен-1-ил, 1-этилпроп-2-ен-1-ил, 1-этилпроп-1-ен-2-ил, н-гекс-1-ен-1-ил, н-гекс-2 ен-1-ил, гекс-3-ен-1-ил, гекс-4-ен-1-ил, гекс-5-ен-1-ил, 1-метилпент-1-ен-1-ил, 2-метилпент-1-ен-1-ил, 3 метилпент-1-ен-1-ил, 4-метилпент-1-ен-1-ил, 1-метилпент-2-ен-1-ил, 2-метилпент-2-ен-1-ил, 3-метилпент-2-ен-1-ил, 4-метилпент-2-ен-1-ил, 1-метилпент-3-ен-1-ил, 2-метилпент-3-ен-1-ил, 3-метилпент-3-ен 1-ил, 4-метилпент-3-ен-1-ил, 1-метилпент-4-ен-1-ил, 2-метилпент-4-ен-1-ил, 3-метилпент-4-ен-1-ил, 4 метилпент-4-ен-1-ил, 1,1-диметилбут-2-ен-1-ил, 1,1-диметилбут-3-ен-1-ил, 1,2-диметил-бут-2-ен-1-ил,1,2-диметилбут-3-ен-1-ил, 1,3-диметилбут-2-ен-1-ил, 1,3-диметилбут-3-ен-1-ил, 2,2-диметилбут-3-ен-1 ил, 2,3-диметилбут-2-ен-1-ил, 2,3-диметилбут-3-ен-1-ил, 3,3-диметилбут-2-ен-1-ил, 1-этилбут-2-ен-1-ил,1-этилбут-3-ен-1-ил, 2-этилбут-2-ен-1-ил, 2-этилбут-3-ен-1-ил, 1,1,2-триметилпроп-2-ен-1-ил, 1-этил-1 метилпроп-2-ен-1-ил, 1-этил-2-метилпроп-2-ен-1-ил, гекс-2-ен-1-ил, окст-2-ен-1-ил, нон-2-ен-1-ил, дец-2 ен-1-ил;C2-C10-алкинил означает углеводородный остаток с 2-10 атомами углерода, предпочтительно с 3-6 атомами углерода и тройной связью, например этинил, проп-2-ин-1-ил (=пропаргил), проп-1-ин-1-ил,бут-1-ин-1-ил, бут-1-ин-3-ил, бут-1-ин-4-ил, бут-2-ин-1-ил, пент-1-ин-1-ил, пент-1-ин-3-ил, пент-1-ин-4 ил, пент-1-ин-5-ил, пент-2-ин-1-ил, пент-2-ин-4-ил, пент-2-ин-5-ил, 3-метилбут-1-ин-3-ил, 3-метилбут-1 ин-4-ил, гекс-1-ин-3-ил, гекс-1-ин-4-ил, гекс-1-ин-5-ил, гекс-1-ин-6-ил, гекс-2-ин-1-ил, гекс-2-ин-4-ил,гекс-2-ин-5-ил, гекс-2-ин-6-ил, гекс-3-ин-1-ил, гекс-3-ин-2-ил, 3-метилпент-1-ин-3-ил, 3-метилпент-1-ин 4-ил, 3-метилпент-1-ин-5-ил, 4-метилпент-2-ин-4-ил, 4-метилпент-2-ин-5-ил, гепт-2-ин-1-ил, окст-2-ин-1 ил, нон-2-ин-1-ил, дец-2-ин-1-ил;-2 010872 С 1-С 4-галогеналкил означает С 1-С 4-алкильный остаток, как приведено выше, который частично или полностью замещен фтором, хлором, бромом и/или йодом, например хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 2 фторэтил, 2-хлорэтил, 2-бромэтил, 2-йодэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2 хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил, 2-фторпропил, 3 фторпропил, 2,2-дифторпропил, 2,3-дифторпропил, 2-хлорпропил, 3-хлорпропил, 2,3-дихлорпропил, 2 бромпропил, 3-бромпропил, 3,3,3-трифторпропил, 3,3,3-трихлорпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 1-(фторметил)-2-фторэтил, 1-(хлорметил)-2-хлорэтил, 1-(бромметил)-2-бромэтил, 4 фторбутил, 4-хлорбутил, 4-бромбутил или нонафторбутил;C1-C10-галогеналкил означает C1-C10-алкил, приведенный выше, в котором от 1 до 6 атомов водорода замещены атомами галогена, предпочтительно фтором и/или хлором, например С 1-С 4-галогеналкил,приведенный выше, а также 5-фторпентил, 5-хлорпентил, 5-бромпентил, 5-йодпентил, ундекафторпентил, 6-фторгексил, 6-хлоргексил, 6-бромгексил или 6-йодгексил;C2-C10-галогеналкенил означает C2-C10-алкенил, приведенный выше, где от 1 до 6 атомов водорода замещены атомами галогена, предпочтительно фтором и/или хлором, например 2-хлораллил, 3 хлораллил, 2,3-дихлораллил, 3,3-дихлораллил, 2,3,3-трихлораллил, 2,3-дихлорбут-2-ен-1-ил, 2-бромаллил, 3-бромаллил, 2,3-дибромаллил, 3,3-дибромаллил, 2,3,3-трибромаллил или 2,3-дибромбут-2-ен-1-ил;C2-C10-галогеналкинил означает C2-C10-алкинил, приведенный выше, где от 1 до 6 атомов водорода замещены атомами галогена, предпочтительно фтором и/или хлором, например 1,1-дифторпроп-2-ин-1 ил, 1,1-дифторбут-2-ин-1-ил, 4-фторбут-2-ин-1-ил, 4-хлорбут-2-иг-1-ил, 5-фторпент-3-ин-1-ил или 6 фторгекс-4-ин-1-ил;C3-C10-циклоалкил означает циклоалифатический остаток от 3 до 10 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил или циклодецил;C3-C10-циклоалкенил означает циклоалифатический остаток с 3-10 атомами углерода и двойной связью, например циклопропен-1-ил, циклобутен-1-ил, циклопентен-1-ил, циклогексен-1-ил, циклогептен-1 ил, циклооктен-1-ил, циклононен-1-ил, циклодецен-1-ил, циклопент-2-еп-1-ил, циклогекс-2-ен-1-ил, циклогепт-2-ен-1-ил, циклоокт-2-ен-1-ил, циклонон-2-ен-1-ил, циклодец-2-ен-1-ил, циклогекс-3-ен-1-ил,циклогепт-3-ен-1-ил, циклоокт-3-ен-1-ил, циклоокт-4-ен-1-ил, циклонон-3-ен-1-ил, циклонон-4-ен-1-ил,циклодец-4-ен-1-ил или циклодец-3-ен-1-ил; С 1-С 4-алкилкарбонил означает связанный через карбонильную группу алкильный остаток с 1-4 атомами углерода, например ацетил, пропионил, бутирил или изобутирил;(С 1-С 4-алкиламино)карбонил означает, например, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, 1-метилэтиламинокарбонил, бутиламинокарбонил, 1-метилпропиламинокарбонил, 2 метилпропиламинокарбонил или 1,1-диметилэтиламинокарбонил; ди-(С 1-С 4 алкил)аминокарбонил означает, например, N,N-диметиламинокарбонил, N,N-диэтиламинокарбонил, N,N-ди-(1-метилэтил)аминокарбонил, N,N-дипропиламинокарбонил, N,N-дибутиламинокарбонил, N,N-ди-(1-метилпропил)аминокарбонил, N,N-ди-(2-метилпропил)аминокарбонил, N,Nди-(1,1-диметилэтил)аминокарбонил, N-этил-N-метиламинокарбонил, N-метил-N-пропиламинокарбонил,N-метил-N-(1-метилэтил)аминокарбонил, N-бутил-N-метиламинокарбонил, N-метил-N-(1-метилпропил) аминокарбонил,N-метил-N-(2-метилпропил)аминокарбонил,N-(1,1-диметилэтил)-N-метиламинокарбонил,N-этил-N-пропиламинокарбонил,N-этил-N-(1-метилэтил)аминокарбонил,N-бутил-Nэтиламинокарбонил, N-этил-N-(1-метилпропил)аминокарбонил, N-этил-N-(2-метилпропил)аминокарбонил, N-этил-N-(1,1-диметилэтил)аминокарбонил, N-(1-метилэтил)-N-пропиламинокарбонил, N-бутилN-пропиламинокарбонил, N-(1-метилпропил)-N-пропиламинокарбонил, N-(2-метилпропил)-N-пропиламинокарбонил, N-(1,1-диметилэтил)-N-пропиламинокарбонил, N-бутил-N-(1-метилэтил)аминокарбонил, N-(1-метилэтил)-N-(1-метилпропил)аминокарбонил, N-(1-метилэтил)-N-(2-метилпропил)аминокарбонил, N-(1,1-диметилэтил)-N-(1-метилэтил)аминокарбонил, N-бутил-N-(1-метилпропил)аминокарбонил, N-бутил-N-(2-метилпропил)аминокарбонил, N-бутил-N-(1,1-диметилэтил)аминокарбонил, N(1-метилпропил)-N-(2-метилпропил)аминокарбонил,N-(1,1-диметилэтил)-N-(1-метилпропил)аминокарбонил или N-(1,1-диметилэтил)-N-(2-метилпропил)аминокарбонил; С 1-С 4-алкокси означает связанный через атом кислорода алкильный остаток с 1-4 атомами углерода,например метокси, этокси, пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2-метилпропокси или 1,1-диметилэтокси; С 1-С 4-алкоксикарбонил означает связанный карбонильной группой алкоксиостаток с 1-4 атомами углерода, например метоксикарбонил, этоксикарбонил, пропоксикарбонил, 1-метилэтоксикарбонил, бу-3 010872 токсикарбонил, 1-метилпропоксикарбонил, 2-метилпропоксикарбонил или 1,1-диметилэтоксикарбонил; С 1-С 4-алкилтио (C1-C4-алкилсульфанил: C1-C4-алкил-S-) означает связанный атомом серы алкильный остаток с 1-4 атомами углерода, например метилтио, этилтио, пропилтио, 1-метилэтилтио, бутилтио,1-метилпропилтио, 2-метилпропилтио или 1,1-диметилэтилтио; С 1-С 4-алкилсульфинил (С 1-С 4 алкил-S(=O)-) означает, например, метилсульфинил, этилсульфинил,пропилсульфинил, 1-метилэтилсульфинил, бутилсульфинил, 1-метилпропилсульфинил, 2-метилпропилсульфинил или 1,1-диметилэтилсульфинил; С 1-С 4-алкилсульфонил (С 1-С 4 алкил-S(=O)2-) означает, например, метилсульфонил, этилсульфонил,пропилсульфонил, 1-метилэтилсульфонил, бутилсульфонил, 1-метилпропилсульфонил, 2-метилпропилсульфонил или 1,1-диметилэтилсульфонил; 3-8-членный гетероциклил означает гетероциклический остаток, который имеет 3, 4, 5, 6, 7 или 8 членов кольца, причем 1, 2 или 3 членов кольца являются гетероатомами, которые выбраны из группы,включающей кислород, серу, азот и группу NR6 (где R6 означает водород, C1-C8-алкил, C3-C6-алкенил или С 3-C6-алкинил). Кроме того, гетероциклил необязательно может иметь одну или две карбонильные группы или тиокарбонильные группы в качестве членов кольца. Гетероцикл может быть аромтическим(гетероарил) или частично или полностью насыщенным. Примерами для насыщенных гетероциклов являются оксиран-1-ил, азиридин-1-ил, оксетан-2-ил,оксетан-3-ил, тиетан-2-ил, тиетан-3-ил, азетидин-1-ил, азетидин-2-ил, азетидин-3-ил, тетрагидрофуран-2 ил, тетрагидрофуран-3-ил,тетрагидротиофен-2-ил, тетрагидротиофен-3-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 1,3-диоксолан-2-ил, 1,3-диоксолан-4-ил, 1,3-оксатиолан-2-ил, 1,3 оксатиолан-4-ил, 1,3-оксатиолан-5-ил, 1,3-оксазолидин-2-ил, 1,3-оксазолидин-3-ил, 1,3-оксазолидин-4 ил, 1,3-оксазолидин-5-ил, 1,2-оксазолидин-2-ил, 1,2-оксазолидин-3-ил, 1,2-оксазолидин-4-ил, 1,2 оксазолидин-5-ил, 1,3-дитиолан-2-ил, 1,3-дитиолан-4-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-5-ил, тетрагидропиразол-1-ил, тетрагидропиразол-3-ил, тетрагидропиразол -4-ил, тетрагидропиран 2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-уил тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил,тетрагидротиопиран-4-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, 1,3 диоксан-2-ил, 1,3-диоксин-4-ил, 1,3-диоксан-5-ил, 1,4-диоксан-2-ил, 1,3-оксатиан-2-ил, 1,3-оксатиан-4 ил, 1,3-оксатиан-5-ил, 1,3-оксатиан-6-ил, 1,4-оксатиан-2-ил, 1,4-оксатиан -3-ил, морфолин-2-ил, морфолин-3-ил, морфолин-4-ил, гексагидропиридазин-1-ил, гексагидропиридазин-3-ил, гексагидропиридазин 4-ил, гексагидропиримидин-1-ил, гексагидропиримидин-2-ил, гексагидропиримидин-4-ил, гексагидропиримидин-5-ил, пиперазин-1-ил, пиперазин-2-ил, пиперазин-3-ил, гексагидро-1,3,5-триазин-1-ил, гексагидро-1,3,5-триазин-2-ил, оксепан-2-ил, оксепан-3-ил, оксепан-4-ил, тиепан-2-ил, тиепан-3-ил, тиепан-4 ил, 1,3-диоксепан-2-ил, 1,3-диоксепан-4-ил, 1,3-диоксепан-5-ил, 1,3-диоксепан-6-ил, 1,3-дитиепан-2-ил,1,3-дитиепан-4-ил, 1,3-дитиепан-5-ил, 1,3-дитиепан-2-ил, 1,4-диоксепан-2-ил, 1,4-диоксепан-7-ил, гексагидроазепин-1-ил, гексагидроазепин-2-ил, гексагидроазепин-3-ил, гексагидроазепин-4-ил, гексагидро 1,3-диазепин-1-ил,гексагидро-1,3-диазепин-2-ил,гексагидро-1,3-диазепин-4-ил,гексагидро-1,4 диазепин-1-ил и гексагадро-1,4-диазепин-2-ил. Примерами для ненасыщенных гетероциклов являются дигидрофуран-2-ил, 1,2-оксазолин-3-ил, 1,2 оксазолин-5-ил, 1,3-оксазолин-2-ил. Примерами для ароматического гетероциклила являются 5- и 6-членные ароматические гетероциклические остатки, например фурил, такой как 2-фурил и 3-фурил, тиенил, такой как 2-тиенил и 3-тиенил,пирролил, такой как 2-пирролили и 3-пирролили, изоксазолил, такой как 3-изоксазолил, 4-изоксазолил и 5-изоксазолил, изотиазолил, такой как 3-изотиазолил, 4-изотиазолил и 5-изотиазолил, пиразолил, такой как 3-пиразолил, 4-пиразолил и 5-пиразолил, оксазолил, такой как 2-оксазолил, 4-оксазолил и 5 оксазолил, тиазолил, такой как 2-тиазолил, 4-тиазолил и 5-тиазолил, имидазолил, такой как 2-имидазолил и 4-имидазолил, оксадиазол, такой как 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил и 1,3,4-оксадиазол-2 ил, тиадиазолил, такой как 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил и 1,3,4-тиадиазол-2-ил, триазолил,такой как 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил и 1,2,4-триазол-4-ил, пиридинил, такой как 2-пиридинил,3-пиридинил и 4-пиридинил, пиридазинил, такой как 3-пириазинил и 4-пиридазинил, пиримидинил, такой как 2-пиримидинил, 4-пиримидинил и 5-пиримидинил, далее 2-пиразинил, 1,3,5-триазин-2-ил и 1,2,4 триазин-3-ил, в особенности пиридил, фуранил и тиенил. Произведенный от первичного или вторичного амина остаток А, как правило, означает группу формулы -NR1R2, где остатки R1 и R2 имеют следующее значение:R1 и R2 независимо друг от друга означают водород, C1-C10-алкил, C2-C10-алкенид или С 2-C10 алкинил, которые могут быть незамещенными или замещенными одним из следующих остатков: C1-C4 алкокси, C1-C4-алкилтио, CN, NO2, формил, C1-C4-алкилкарбонил, C1-C4-алкоксикарбонил, С 1-С 4 алкиламинокарбонил, C1-C4-диалкиламинокарбонил, С 1-С 4-алкилсульфинил, С 1-С 4-алкилсульфонил, C3C10-циклоалкил, 3-8-членный гетероциклил с одним, двумя или тремя гетероатомами, выбранными из группы, включающей О, S, N и группу NR6 (где R6 означает водород, C1-C6-алкил, C3-С 6-алкенил или C3C6-алкинил), фенил, который, в свою очередь, может иметь 1, 2, 3 или 4 заместителя, выбранных из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, C1-C4-фторалкил, C1-C4-алкилоксикарбонил, трифторметилсульфонил, C1-C3-алкиламино, C1-C3-диалкиламино, формил, нитро или циано, C1-C10-4 010872 галогеналкил, C2-C10-галогеналкенил, C2-С 10-галогенаокинил, C3-С 8-циклоалкил, C3-C10-циклоалкенил, 38-членный гетероциклил с одним до трех гетероатомов, выбранных из группы, включающей О, S, N,группу NR6 (где R6 означает водород, C1-C6-алкил, C3-C6-аленил или C3-С 6-алкинил), фенил или нафтил,причем C3-C8-циклоалкил, C3-C10-циклоалкенил, 3-8-членный гетероциклил, фенил или нафтил в свою очередь могут иметь 1, 2, 3 или 4 заместителя, выбранных из группы, включающей галоген, C1-C4-алкил,C1-C4-алкокси, C1-C4-фторалкил, С 1-С 4-алкилоксикарбонил, трифторметилсульфонил, формил, C1-C3 алкиламино, C1-C3-диалкиламино, фенокси, нитро или циано, илиR1 и R2 совместно образуют насыщенный или частично ненасыщенный 5-8-членный гетероциклил азота, который, в свою очередь, может быть замещен C1-C4-алкилом, C1-C4-алкокси и/или С 1-С 4 галогеналкилом, может иметь одну или две карбонильные группы, тиокарбонильные группы и/или еще один или два гетероатома, выбранных из группы, включающей О, S, N и группу NR6 (где R6 имеет вышеприведенные значения), в качестве членов кольца. Предпочтительные остатки R1 и R2 выбраны независимо друг от друга из группы, включающей водород, C1-C6-алкил, который необязательно может быть замещен заместителем, выбранным из группы,включающей циано, C1-C4-алкокси, C1-C4-алкоксикарбонил, С 1-С 4-алкилтио, C3-C8-циклоалкил, фенил,который, в свою очередь, необязательно замещен галогеном или C1-C4-алкокси, фурил, тиенил, 1,3 диоксоланил. Далее предпочтительны C2-C6-алкенил, C2-C6-алкинил, C3-C8-циклоалкил или фенил, который необязательно замещен 1 или 2 заместителями, выбранными из группы, включающей галоген, C1-C4 алкил, С 1-С 4-фторалкил, C1-C4-алкокси, C1-C4-алкоксикарбонил, нитро или C1-C3-диалкиламино, нафтил или пиридил. При еще одной форме выполнения R1 и R2 совместно образуют 5-, 6- или 7-членный насыщенный или ненасыщенный азотный гетероцикл, который может иметь в качестве члена кольца еще один гетероатом, выбранный из группы, включающей N, группу NR6 (где R6 имеет вышеприведенные значения) и О, и/или может быть замещен одним или двумя заместителями, выбранными из группы,включающей C1-C4-алкил и C1-C4-галогеналкил. При одной особенно предпочтительной форме выполнения один из остатков R или R2 означает водород, C1-C6-алкил, С 2-С 6-алкенил или С 2-C6-алкинил и другой остаток R1 или R2 означает С 1-C6-алкил,C3-C8-циклоалкил или фенил. Группа Ar в частности означает группу общей формулы Ar-1 где Ra, Rb, Rc и Rd независимо друг от друга означают водород, галоген, С 1-С 4-галогеналкил или циано;характеризует соединение Ar с С(O)-группой ихарактеризует соединение Ar с атомом азота амино-, нитро-, соответственно, изо(тио)цианатогруппы. При одной особенно предпочтительной форме выполнения изобретения остатки Ra, Rb, Rc и Rd имеют следующие значения, а именно как по отдельности, так и в сочетании друг с другом:Ra означает галоген или циано, в частности фтор, хлор или циано; где остатки Ra, Rb, Rc, Rd, А и W имеют вышеприведенные значения. В частности изобретение относится к получению соединений IA.1, где А означает NR1R2. Эти соединения ниже обозначаются как соединения IA.1. Взаимодействие соединения II с фосгеном, тиофосгеном и дифосгеном, обозначаемыми ниже агентом фосгенирования, обычно осуществляется в инертном органическом растворителе. В качестве растворителя применяются для этого взаимодействия, в зависимости от температуры, углеводороды, такие как пентан, гексан, циклопентан, циклогексан, толуол, ксилол, хлорированные углеводороды, такие как метиленхлорид, хлороформ, 1,2-дихлорэтан, 1,1,2,2-тетрахлорэтан, хлорбензол, 1,2-, 1,3- или 1,4 дихлорбензол, простой эфир, такой как 1,4-диоксан, анизол, простой гликолевый эфир, такой как диметилгликолевый эфир, диэтилгликолевый эфир, диэтилгликольдиметиловый эфир, сложные эфиры, такие как этилацетат, пропилацетат, метилизобутират, изобутилацетат, амиды карбоновой кислоты, такие какN,N-диметилформамид, N-метилпирролидон, нитроуглеводороды, такие как нитробензол, тетраалкилмочевины, такие как тетраэтилмочевина, тетрабутилмочевина, диметилэтиленмочевина, диметилпропиленмочевина, нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил или изобутиронитрил или смеси отдельных растворителей. При применении фосгенов предпочтительно используют растворитель, который в основном свободен от протонных примесей, таких как вода или спирты. При получении изоцианатов можно также, следуя публикации "Houben-Weyl, Methoden der organischen Chemie, 4. Auflage, т. IX, стр. 875", проводить взаимодействие соединения II с тиофосгеном в двухфазной системе из воды и не смешиваемым с ней органическим растворителем или же в воде. Как правило, соединение II вводят в реакционную емкость предпочтительно как раствор или суспензию в одном из вышеприведенных растворителей и потом добавляют агент фосгенирования. Предпочтительно добавка агента фосгенирования производится при перемешивании. Добавка производится предпочтительно в промежуток времени от 10 до 60 мин. Агент фосгенирования может добавляться как таковой или как раствор в одном из вышеприведенных растворителей. В случае фосгена его вводят, как правило, в раствор, предпочтительно в суспензию. Температура реакции, как правило, не первышает 180 С, предпочтительно 120 С и, в частности,100 С и составляет, как правило, по меньшей мере 40 С и предпочтително 50 С. Часто реакцию проводят так, что, по меньшей мере, основное количество агента фосгенирования подают при температуре,например, в интервале от 0 до 40 С, в частности от 10 до 40 С и особенно предпочтительно от 20 до 30 С и во время или после окончания подачи нагревают на температуру в диапазоне от 40 до 180 С, в особенности от 50 до 120 С и специально от 70 до 100 С до полной конверсии. Как правило, применяют от 0,9 до 2, предпочтительно от 0,95 до 1,5, особенно предпочтительно от 0,98 до 1,09 мол.экв. агента фосгенирования на моль соединения II. В случае необходимости, реакцию взаимодействия соединения II проводят в присутствии основания. В качестве основания применяют, например, основные неорганические соединения, например, гидроксиды, гидрокарбонаты или карбонаты щелочных и щелочно-земельных металлов. Однако реакцию можно проводить в присутствии органического основания, например, третичного амина, такого как триэтиламин, три-н-пропиламин, N-этилдиизопропиламин, пиридин, -, -, -пиколин, 2,4-, 2,6-лутидин, Nметилпирролидин, диметиланилин, N,N-диметилциклогексиламин, хинолин или акридин. Основание (в пересчете на эквивалент основания) может применяться субстехиометрически, сверхстехиометрически или эквимолярно в пересчете на соединение II. На моль соединения II применяют в общем от 0,01 до 6 моль, предпочтительно от 0,1 до 3 моль основания. При другой форме выполнения способа согласно изобретению реакцию взаимодействия проводят в присутствии хлорводорода. Количество хлорводорода составляет обычно от 0,9 до 5,0 мол, предпочтительно, от 1,0 до 2,5 моль, и в частности, от 1,0 до 1,2 моль хлорводорода на моль соединения II. При этом реакцию проводят таким образом, что в раствор или суспензию вводят сначала соединение II в одном из вышеприведенных растворителей вышеприведенного количества газообразного хлорводорода и добавляют раствор хлорводорода в растворителе, потом добавляют агент фосгенирования вышеописанным образом и реакцию проводят как описано выше. Ввод хлорводорода происходит обычно при температуре между 10 С и 60 С, предпочтительно, при 20 до 30 С. Если способ проводят в присутствии хлорводорода, можно применять в качестве катализатора активный уголь. Целесообразным образом количество активного угля составляет от 1 до 10 вес.%, предпочтительно, от 1 до 3 вес.%, в пересчете на вес соединения II. Реакцию можно осуществлять без давления или под давлением, прерывно или непрерывно. Как правило, реакцию взаимодействия соединения II с агентом фосгенирования осуществляют при исключении воды. В случае необходимости, может иметь преимущество проведение взаимодействия под защит-6 010872 ной атмосферой. Обработка для получения целевого продукта может осуществляться обычными для этого способами. При применении фосгена в качестве агента фосгенирования, как правило, сначала удаляют непрореагировавший фосген, например, вводом потока азота в реакционную смесь. После этого удаляют растворитель обычным для этого способом, например дистилляцией. Для дальнейшей очистки могут применяться обычные способы, такие как кристаллизация, хроматография, например, на силикагеле. В случае необходимости, остаток можно чистить также и смешиванием с растворителем, например ароматическими углеводородами, такими как бензол, толуол или ксилол, или алифатическими углеводородами,такими как петролейный эфир, гексан, циклогексан, пентан, простые эфиры, такие как диэтиловый эфир и т.п. и их смесями. Требуемые для проведения способа согласно изобретению в качестве исходных веществ соединения формулы II являются также новыми и имеют значение в качестве интересных предварительных соединений для способа согласно изобретению. В формуле II Ar и А означают предпочтительно такие остатки, которые уже приведены в связи с описанием соединений I согласно изобретению в качестве предпочтительных для их заместителей. Соединения формулы II могут быть получены аналогично известным способам получения анилинов. Анилиновые соединения формулы II можно получать, например, согласно схеме 2, за счет того, что сначала ароиловое соединение формулы III подвергают взаимодействию с амидом сульфаминовой кислоты IV в смысле реакции конденсации с получением амида N-ароилсульфаминовой кислоты общей формулы V и затем полученный амид N-ароилсульфаминовой кислоты V восстанавливают в соединение II. Схема 2 В схеме 2 остатки А и Ar имеют вышеприведенные значения, в частности, приведенные в качестве предпочтительных значения. X означает галоген, предпочтительно хлор, гидрокси или С 1-С 4-алкоксигруппу. Конденсация ароилсоединений общей формулы III амидами сульфаминовой кислоты общей формулы IV с получением соответствующих бензоилсульфамидов общей формулы V осуществляется в соответствии с известными способами, например известными из WO 01/83459, стр. 31-35, из DE 10221910.0, на которые дается соответствующая ссылка. Ниже поясняется более подробно первая стадия реакции. Если X в формуле III означает гидрокси, предпочтительно сначала активируют карбоновую кислотуIII таким образом, что ее подвергают взаимодействию с аппретом (средством сочетания). Затем активированную карбоновую кислоту III, как правило, без предварительного выделения подвергают взаимодействию с амидом IV сульфаминовой кислоты. В качестве средства сочетания пригодны, например, N,N'карбонилдиимидазол и карбодиимиды, такие как дициклогексилкарбодиимид. Их применяют, как правило, по меньшей мере, в эквимолярном количестве и до четырехкратного избытка в пересчете на карбоновую кислоту III. В случае необходимости, полученную рекционную смесь из карбоновой кислоты III и средства сочетания нагревают и потом охлаждают до комнатной температуры. Обычно реакцию взаимодействия проводят в растворителе. В качестве растворителя пригодны, например, хлорированные углеводороды, такие как метиленхлорид, 1,2-дихлорэтан, простой эфир, например диалкиловый эфир, такой как диэтиловый эфир, метил-трет-бутиловый эфир, или циклические простые эфиры, такие как тетрагидрофуран или диоксан, амиды карбоновой кислоты, такие как диметилформамид, N-метиллактамы, такие как N-метилпирролидон, нитрилы, такие как ацетонитрил, ароматические углеводороды, такие как толуол, ароматические амины, такие как пиридин или их смеси. В заключение реакционную смесь смешивают с амидом сульфаминовой кислоты IV. Как правило, сульфамид IV оставляют в растворителе, который также применяется для активирования карбоновой кислоты. Если X в формуле III означает С 1-С 4-алкокси, сначала можно переводить сложные эфиры известным способом гидролизом в кислотной среде при применении сильных минеральных кислот, таких как концентрированная соляная кислота или серная кислота, или органических кислот, таких как уксусная кислота, или смесей из них в соответствующие карбоновые кислоты III. Альтернативно сложные эфиры-7 010872 поддаются гидролизу также и в щелочной среде при применении оснований, таких как гидроксид щелочного металла, например гидроксид натрия или гидроксид калия в присутствии воды. В заключение карбоновые кислоты III (где X = ОН) можно превращать, как описано выше, или сначала агентом хлорирования, таким как тионилхлорид или фосген, переводить сначала в хлорангидриды кислоты (X = Cl) и их подвергать описанным ниже образом взаимодействию с соединением IV. Получение хлорангидрида кислоты осуществляется известными способами, например, как описано в ЕР 1176133 и WO 01/087872. Можно также непосредственно сложный эфир карбоновой кислоты формулы III, где X означает С 1 С 4-алкокси, подвергать взаимодействию с амидом сульфаминовой кислоты формулы IV или его солью металла в смысле реакции амидирования при расщеплении остатка сложного эфира. Взаимодействие проводят, следуя публикации "Houben-Weyl, 4. Auflage, Bd. VIII, стр. 658-659". Если X в формуле III означает галоген, то, как правило, ароильное соединение III, предпочтительно разбавленное инертным растворителем, подают к амиду сульфаминовой кислоты формулы IV, предпочтительно также разбавленному инертным растворителем. Само собой разумеется можно амид сульфаминовой кислоты IV подавать к ароильному соединению III. Молярное соотношение, в котором подвергаются взаимодействию исходные соединения III и IV,составляет в общем от 0,9 до 1,2, предпочтительно от 0,95 до 1,1, особенно предпочтительно от 0,98 до 1,04 соотношения ароильного соединения III к амиду сульфаминовой кислоты IV. Обычно реакцию взаимодействия проводят при температуре в интервале от -30 до 100 С, предпочтительно от -10 до 80 С, особенно предпочтительно от 0 до 60 С. Предпочтительно на первой стадии реакции работают при нейтральных условиях. Если при реакции образуется кислотный продукт реакции, например галогенводород (если X в формуле III означает галоген), то его удаляют добавкой основного соединения. К подходящим основным соединениями относятся неорганические и органические основания. Пригодными неорганическими основными соединениями являются, например, гидроксиды, соответственно гидрокарбонаты или карбонаты щелочных или щелочно-земельных металлов. Однако реакцию можно проводить в присутствии органического основания, например триэтиламина три-н-пропиламина, N-этилдиизопропиламина, пиридина, -, -, пиколина, 2,4-, 2,6-лутидина, N-метилпирролидина, диметиланилина, N,N-диметилциклогексиламина,хинолина или акридина. Как правило, осование применяют в избытке в пересчете на соединение III. Молярное количество основания составляет от 1,0 до 2 моль, предпочтительно от 1,02 до 1,3 моль основания (рассчитано как эквивалент основания) на моль соединения III. В случае необходимости, реакционная смесь содержит пиридин или пиридиновое соединение, например 4-диалкиламинопиридин, такой как 4-диметиламинопиридин в качестве катализатора. Добавка катализатора составляет ок. 0,1-10%, в пересчете на соединение III. Реакция взаимодействия ароильных соединений III с соединениями формулы IV проводится предпочтительно в присутствии растворителя. В качестве растворителя для этого взаимодействия применяют,в зависимости от температуры, углеводороды, такие как пентан, гексан, циклопентан, циклогексан, толуол, ксилол, хлорированные углеводороды, такие как метиленхлорид, хлороформ, 1,2-дихлорэтан, 1,1,2,2 тетрахлорэтан, хлорбензол, 1,2-, 1,3- или 1,4-дихлорбензол, простые эфиры, такие как 1,4-диоксан, анизол, простые гликолевые эфиры, такие как диметилгликолевый эфир, диэтилгликолевый эфир, диэтиленгликолевый эфир, сложные эфиры, такие как этилацетат, пропилацеттат, метилизобутират, изобутилацетат, амиды карбоновой кислоты, такие как N,N-диметилформамид, N-метилпирролидон, нитроуглеводороды, такие как нитробензол, тетраалкилмочевины, такие как тетраэтилмочевина, тетрабутилмочевина, диметилэтиленмочевина, диметилпропиленмочевина, сульфоксиды, такие как диметилсульфоксид,сульфоны, такие как диметилсульфон, диэтилсульфон, тетраметиленсульфон, нитрилы, такие как ацетонитрил, пропионитрил, бутиронитрил или изобутиронитрил; вода или же смеси отдельных растворителей. Далее реакцию можно проводить в водной двухфазной системе предпочтительно в присутствии межфазных катализаторов, таких как четвертичные аммониевые или фосфониевые соли. Для двухфазной реакции пригодны описанные в ЕР-А-556737 условия реакции. В качестве межфазного катализатора могут применяться четвертичные аммониевые или фосфониевые соли. В качестве подходящих соединений следует назвать следующие: тетраалкил-(С 1-С 18)аммонийхлориды,-бромиды или -фториды, N-бензилтриалкил-(С 1-С 18)-аммонийхлориды, -бромиды или-бромид, (фенил)0(С 1-С 18-алкил)р-фосфонийхлориды или -бромиды, причем о = от 1 до 3, р = от 3 до 1 и о+р = 4. Особенно предпочтительны тетраэтиламмонийхлорид и N-бензилтриэтиламмонийхлорид. Количество межфазного катализатора составляет в общем до 20 вес.%, предпочтительно между 1 и 15 вес.% и особенно предпочтительно между 2 и 8 вес.% в пересчете на исходное соединение IV. Предпочтительно ароильное соединение III подают в течение времени от 0,25 до 2 ч к смеси амида сульфаминовой кислоты IV и, в случае необходимости, основания в вышеприведенном растворителе и перемешивают до завершения реакции еще от 0,5 до 16 ч, предпочтительно от 2 до 8 ч. Температура реакции составляет, как правило, от 0 до 60 С.-8 010872 При применении водной двухфазной системы исходные соединения III и IV можно подавать к смеси межфазного катализатора в обеих фазах в любой последовательности при перемешивании и потом в приведенном диапазоне температур при добавке основания доводить реакцию взаимодействия до конца. Реакцию можно проводить прерывно или непрерывно, без давления или под давлением. Для осуществления переработки органическую фазу экстрагируют разбавленной минеральной кислотой, сушат органическую фазу и удаляют в вакууме растворитель. В случае необходимости остаток можно далее очищать путем смешения с растворителем и смесью растворителей, например ароматических углеводородов, таких как бензол, ксилол и толуол и алифатических или циклоалифатических углеводородов, таких как петролейный эфир, пентан, гексан или циклогексан, простой эфир, такой как диэтиловый эфир и т.п. и их смесей, отсасывания и сушки. Ниже более подробно поясняется вторая стадия реакции, восстановление нитросоединения V в соединение II. Восстановление соединения V в соединение II удается, например, с помощью водорода. Для этого нитросоединение подвергают взаимодействию с кислотой в присутствии неблагородного металла. Неблагородными металлами являются естественно такие, которые растворяются в кислоте Бренстеда при образовании водорода. Подобные металлы имеют, как правило, нормальный потенциал 0 V и в частности меньше или равно -0,1 V, например в интервале от -0,1 до -1,0 V (в кислом водном растворе при 15 С и 1 бар). Примерами таких металлов являются Zn, Fe и Sn, в особенности Fe. В качестве кислот пригодны для этого как неорганические минеральные кислоты, например, соляная кислота или разбавленная серная кислота, или смеси из неорганических кислот и одного из вышеприведенных растворителей, например,газообразная HCl в простом эфире или спирте или в смеси из них, так и органические карбоновые кислоты, целесообразно уксусная кислота, пропионовая кислота или масляная кислота. Условия реакции соответствуют по сути условиям реакции, применяемым для восстановления водородом алифатических или ароматических нитрогрупп в алифатические или ароматические аминогруппы (см., например, публикацию Н. Koopman, Rec. Trav. 80 (1961), 1075; см. также публикацию N. Kornblum, L. Fischbein, J. Am. Chem. Soc. 77, (1955) 6266). В зависимости от вида металла и кислоты температура реакции составляет, как правило, в интервале от -20 до +120 С, причем при применении алкановых кислот, таких как уксусная кислота, предпочтительно используют температуру в интервале от 50 до 100 С. Продолжительность реакции может составлять от немногих минут до многих часов, например от примерно 20 мин до 5 ч. Предпочтительно подлежащее восстановлению соединение V помещают в реакционную емкость и потом к реакционной смеси добавляют при перемешивании соответствующий металл, предпочтительно в тонкоизмельченной форме,в частности как порошок. Предпочтительно добавка производится в течение времени от 10 мин до 2 ч. Само собой разумеется, можно подавать металл и кислоту и добавлять соединение V, в случае необходимости, вместе с инертным растворителем. Часто реакционную смесь оставляют еще на определенное время при температуре реакции, например в течение времени от 10 мин до 4 ч. Предпочтительно восстановление соединения V в соединение II осуществляют порошком железа в разбавленной кислоте. Пригодными кислотами являются минеральные кислоты, такие как соляная кислота или органические кислоты, как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота. Предпочтительно применяют уксусную кислоту. Количество порошка железа составляет предпочтительно от 2 до 5 моль, в частности от 2,5 до 4 моль, на моль соединения V. Количество кислоты, как правило, не является критическим. Целесообразным образом применяют, по меньшей мере, эквимолярное количество кислоты в пересчете на нитросоединение V, чтобы по возможности полностью восстановить исходное соединение. Реакция может проводиться как прерывно, так и непрерывно. Температура реакции составляет от 50 до 100 С, предпочтительно от 65 до 75 С. При одной форме выполнения порошок железа подают в уксусную кислоту и потом в реакционную емкость добавляют соединениеV. Добавка происходит предпочтительно в течение времени от 20 до 60 мин при перемешивании составных частей, например, мешалкой. После окончания добавки реакции дают реагировать еще в течение времени от 0,5 до 2 ч, предпочтительно ок. 1 ч при температуре реакции. Однако порошок железа можно подавать при перемешивании к смеси соединения V в ледяную уксусную кислоту и реакцию доводить до конца, как описано выше. Переработка для получения целевого продукта может происходить обычными для этого способами. Как правило, сначала можно удалять растворитель, например, дистилляцией. Для последующей очистки можно проводить обычные способы, например, кристаллизацию, хроматографию, например, на силикагеле, смешением с растворителем, например, неорганическими углеводородами, такими, как бензол, толуол или ксилол или алифатическими углеводородами, такими, как петролейный эфир, гексан, циклогексан, пентан, сложные эфиры карбоновой кислоты, такие, как сложный этиловый эфир уксусной кислоты и.т.п. и смеси из них. В качестве восстановителя пригодны также и гидриды металлов и гидриды полуметаллов, такие как гидрид алюминия и отведенные от этого гидриды, такие как гидрид лития и алюминия, гидрид диизобутила и алюминия, гидриды бора, такие как диборан и отведенные от них боранаты, такие как боргидрид натрия или боранат лития. Для этого нитросоединение V в инертном растворителе приводят в контакт с-9 010872 комплексным гидридом металла при темпертаруре от 10 до 65 С, предпочтительно от 20 до 50 С. Предпочтительно время реакции составляет от 2 до 10 ч, предпочтительно от 3 до 6 ч. Реакцию взаимодействия осуществляют предпочтительно в инертном по отношению к восстановителю органическом растворителе. В качестве растворителя пригодны в зависимости от выбранного восстановителя, например,спирты, например С 1-С 4-спирты, такие как метанол, этанол, н-пропанол, изопропанол или н-бутанол и их смеси с водой, или простые эфиры, такие как диизопропиловый эфир, метил-трет-бутиловый эфир, этиленгликольдиметиловый эфир, диоксан или тетрагидрофуран. Как правило, применяют от 0,5 до 3, предпочтительно от 0,75 до 2,5 моль гидрида металла, полугидрида металла, гидрида бора, соответиственно, бораната на моль нитросоединения V. Способ соответствует описанному в публикации "Organikum, VEB Deutscher Verlag der Wissenschaften, Berlin 1976, 15.Auflage, стр. 612-616" способу. Другим пригодным восстановителем для превращения соединения V в соединение II является водород в присутствии каталитического количества переходных металлов или соединений переходных металлов, в частности, 8 побочной группы. Предпочтительными переходными металлами являются никель,палладий, платина, рутений или родий. Переходные металлы могут применяться как таковые или на носителе. Примерами для носителя являются активный уголь, оксид алюминия, ZrO2, TiO2, SiO2, карбонаты и т.п. Переходные металлы могут применяться в форме активированных металлов, как никель Ренея. Переходные металлы могут также применяться в форме соединений. Пригодными соединениями переходных металлов являются, например, оксид палладия и оксид платины. Катализаторы в общем применяются в количестве от 0,05 до 10,0 мол.% (рассчитано как металл) в пересчете на подлежащее восстановлению соединение V. Реакцию проводят или без растворителя или в инертном растворителе или разбавителе. Пригодными растворителями или разбавителями для восстановления являются, в зависимости от растворимости от подлежащего гидрированию вещества и выбранного восстановителя, карбоновые кислоты, такие как уксусная кислота или водные растворы органических кислот, таких как уксусная кислота и вода, сложные эфиры карбоновых кислот, такие как сложный эфир уксусной кислоты, C1-C4 спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, или ароматические углеводороды, такие как толуол. После отделения катализатора реакционный раствор может обрабатываться обычным образом для получения целевого продукта. Гидрирование может осуществляться при нормальном давлении водорода или при повышенном давлении водорода, например, при давлении водорода от 0,01 до 50 бар, предпочтительно, от 0,1 до 40 бар. Относительно каталитического гидрирования ароматических нитросоединений см. публикацию автора Rylander в "Catalytic Hydrogenation over Platinum Metalls",Academic Press, New York, 1967, 168-202; Furst et al. Chem. Rev. 1965,65, 52; Tepko et al., J. Org. Chem. 1980, 45, 4992. При хлорсодержащих бензоилсульфамидах гидрирование проводят в зависимости от чувствительности заместителей при температуре от 20 до 170 С, целесообразным образом от 20 до 140 С, предпочтительно от 20 до 80 С. При рекционноспособных галогеновых заместителях рекомендуется гидрировать в нейтральном растворе, возможно при только слегка повышенном давлении с малым количеством никелевого, платинового или же родиевого катализатора. Пригодны также сульфиды благородных металлов,такие как сульфид платины. Способ подробно описан в публикации автора Houben-Weyl "Methoden derorganischen Chemie", Bd. IV/1C, стр. 520-526. Востановление соединения V в соединение II может происходить также и с сульфидом натрия предпочтительно в водном аммиачном растворе в присутствии хлорида аммония согласно описанному в публикации Org. Syn., Coll. Vol., 3, 82 (1955) способу. Температура реакции составляет, как правило, от 40 до 90 С, предпочтительно от 60 до 80 С. Целесообразным образом применяют от 3 до 4 моль сульфида натрия на моль нитросоединения V. Применяемые в схеме 2 ароильные соединения III могут быть получены известными из уровня техники способами или могут быть получены, следуя известным способам US 6251829, ЕР 415641, ЕР 908457, ЕР 1176133 и WO 01/087872. Амиды IV сульфаминовой кислоты известны из уровня техники или могут быть получены известными способами, например способом согласно немецкой патентной заявке DE 10221910.0 посредством взаимодействия амиака с галогенидами сульфаминовой кислоты. На это известное решение здесь дается ссылка. Предпочтительно амиды сульфаминовой кислоты IV получают согласно описанному в неопубликованной немецкой патентной заявке DE 10221910.0 способу. Этот способ включает следующие стадии: (i) взаимодействие первичного или вторичного амина, по меньшей мере, с эквимолярным количеством SO3 или источника SO3 в присутствии, по меньшей мере, эквимолярного количества третичного амида, все в пересчете на первичный или вторичный амин, причем получают аммониевую соль амидосульфокислоты;(ii) взаимодействие аммониевой соли амидосульфокислоты, по меньшей мере, со стехиометрическим количеством галогенида фосфора. Причем получают галогенид сульфаминовой кислоты и (iii) взаимодействие полученного на стадии ii) галогенида сульфаминовой кислоты с аммиаком, причем получают амид V сульфаминовой кислоты. Споосб согласно изобретению впервые позволяет получение амидов изо(тио)цианатобензоил- 10010872 сульфаминовой кислоты общей формулы I. Соединения I являются новыми и также являются объектом настоящего изобретения. Среди амидов изо(тио)цианатобензоилсульфаминовой кислоты общей формулы I предпочтительны такие формулы IA, где остатки Ra, Rb, Rc, Rd имеют вышеприведенные значения. Особенно предпочтительны соединения формулы IA.1 в которой остатки R1, R2, Ra, Rb, Rc, Rd имеют вышеприведенные значения. Среди амидов изо(тио)цианатобензоилсульфаминовой кислоты общей формулы IA.1 предпочтительны такие, в которых остатки R1, R2, Ra, Rb, Rc, Rd независимо друг от друга, предпочтительно в комбинации, имеют нижеприведенные значения:Ra означает циано или галоген, в частности циано, фтор или хлор;Rc означает водород или галоген, в частности водород, фтор или хлор;R1 и R2 независимо друг от друга означают водород, C1-C6-алкил, который необязательно замещен заместителем, выбранным из группы, включающей галоген, циано, C1-C4-алкокси, С 1-С 4 алкоксикарбонил, C1-C4-алкилтио, C3-C8-циклоалкил, фурил, тиенил, 1,3-диоксоланил, фенил, который, в свою очередь, необязательно замещен галогеном или С 1-С 4-алкокси,C2-C6-алкенил, C2-C6-алкинил, C3-C8-циклоалкил или фенил, который необязательно замещен одним или двумя заместителями, выбранными из группы, включающей галоген, С 1-С 4-алкил, С 1-С 4 фторалкил, C1-C4-алкокси, C1-C4-алкоксикарбонил, нитро или C1-C3-диалкиламино, нафтил или пиридил илиR1 и R2 образуют вместе 5-, 6- или 7-членный насыщенный или ненасыщенный азотный гетероцикл,который необязательно может содержать еще один гетероатом, выбранный из группы, включающей N,группу NR6 (где R6 имеет вышеприведенное значение) и О в качестве членов кольца, и/или может быть замещен двумя или тремя заместителями, выбранными из группы, включающей C1-C4-алкил и С 1-С 4 галогеналкил. В особенности остатки R1 и R2 означают водород, C1-C6-алкил, C2-C8-алкенил или C2-C6-алкинил и другие остатки R1 и R2 означают С 1-С 6-алкил, C3-C8-циклоалкил или фенил. Особенно предпочтительны амиды изоцианатобензоилсульфаминовой кислоты формулы IA.1-a (I с W = кислород, Ar = Ar-1 с Ra = CI и Rb = Rd = водород и Rc = F, A = NR1R2), где R1, R2 имеют вышеприведенное значение, в особенности названное в качестве предпочтительного значения. Примерами подобных соединений являются соединения от IА.1-а.1 до IA.1-a.495, в которых остатки R1, R2 совместно имеют приведенные в одной строке табл. 1 значения. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA.1-D (I где W = кислород, Ar = Ar-1, Ra = Cl и Rb = Rd = водород и Rc = Н, А = NR1R2), где R1, R2 имеют вышеприведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IA.1-D.1 до IA.1-b.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA.1-c (I где W = кислород, Ar = Ar-1 , Ra = Cl и Rb = Rd = водород и Rc = Cl, A = NR1R2), где R1, R2 имеют выше- 29010872 приведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IA.1-c.1 до IA.1-c.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA.1-d ( I где W = кислород, Ar = Ar-1, Ra = F и Rb = Rd = водород и Rc = F, А = NR1R2), где R1, R2 имеют вышеприведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IA.1-d.1 до IA.1-d.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IА.1-е (I где W = кислород, Ar = Ar-1, Ra = CN и Rb = Rd = водород и Rc = F, A = NR1R2), где R1, R2 имеют вышеприведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IА.1-е.1 до IA.1-e.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA. 1-f (I где W = кислород, Ar = Ar-1, Ra = CN и Rb = Rd = водород и Rc = Cl, A = NR1R2), где R1, R2 имеют вышеприведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IA.I-f.1 до IA.1-f.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA.1-g (I где W = сера, Ar = Ar-1 с Ra = Cl и Rb = Rd = водород и Rc = F, A = NR1R2), где R1, R2 имеют вышеприведенные значения, в частности приведенные как предпочтительные значения. Примерами таких соединений являются соединения от IA.1-g.1 до IA.1-g.495, в которых остатки R1, R2 совместно имеют приведенное в одной строке табл. 1 значение. Особенно предпочтительны амиды изоцианобензоилсульфаминовой кислоты формулы IA.1-h (I где W = сера, Ar = Ar-1 с Ra = Cl и Rb = Rd = водород и Rc = Н, А = NR1R2), где R1, R2 имеют вышеприве- 30
МПК / Метки
МПК: C07C 303/34, C07C 307/06
Метки: бифункциональные, продукты, способ, получения, промежуточные, фенилизо(тио)цианаты
Код ссылки
<a href="https://eas.patents.su/30-10872-bifunkcionalnye-fenilizotiocianaty-sposob-i-promezhutochnye-produkty-dlya-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Бифункциональные фенилизо(тио)цианаты, способ и промежуточные продукты для их получения</a>
Предыдущий патент: Трансдермальные составы и способы лечения тромбоцитемии
Следующий патент: Оконный или фасадный профиль и электрический кабель для оконного, дверного или фасадного профиля
Случайный патент: Пестицидные трис-оксимино гетероциклические соединения












