Отбор клеток-хозяев, экспрессирующих белок на высоких уровнях
Номер патента: 10863
Опубликовано: 30.12.2008
Авторы: Ван Блокланд Хенрикус Йоханнес Мария, Квакс Теодорус Хендрикус Якобус, Севалт Ричард Георг Антониус Бернардус, Отте Ари Питер
Формула / Реферат
1. Молекула ДНК, содержащая мультицистронную единицу транскрипции, кодирующую i) селектируемый маркерный полипептид, который может быть обнаружен в эукариотической клетке-хозяине, и ii) представляющий интерес полипептид, причем представляющий интерес полипептид и селектируемый маркерный полипептид имеют отдельные инициирующие трансляцию последовательности, где молекула ДНК отличается тем, что:
a) последовательность, кодирующая представляющий интерес полипептид, расположена даунстрим от последовательности, кодирующей селектируемый маркер, в указанной мультицистронной единице транскрипции;
b) последовательность нуклеиновой кислоты, кодирующая селектируемый маркерный полипептид, включает мутацию, которая приводит к неоптимальной инициирующей трансляцию последовательности селектируемого маркерного полипептида в эукариотической клетке-хозяине;
c) последовательность, кодирующая селектируемый маркерный полипептид, не содержит последовательность ATG в кодирующей цепи после инициирующего кодона селектируемого маркерного полипептида до инициирующего кодона представляющего интерес полипептида.
2. Молекула ДНК по п.1, в которой полученную инициирующую трансляцию последовательность в кодирующей цепи селектируемого маркерного полипептида выбирают из группы, состоящей из:
a) инициирующего кодона ATG в неоптимальном окружении для инициации трансляции;
b) инициирующего кодона GTG;
c) инициирующего кодона TTG;
d) инициирующего кодона CTG;
e) инициирующего кодона ATT и
f) инициирующего кодона ACG.
3. Молекула ДНК по п.1, в которой полученная инициирующая трансляцию последовательность в кодирующей цепи селектируемого маркерного полипептида включает инициирующий кодон GTG или инициирующий кодон TTG.
4. Молекула ДНК по любому из предшествующих пунктов, в которой любая последовательность ATG, присутствующая в рамке считывания и кодирующая метионин в последовательности, кодирующей селектируемый маркерный полипептид дикого типа, мутирована с возможностью кодирования валина, треонина, изолейцина или лейцина.
5. Молекула ДНК по любому из предшествующих пунктов, в которой селектируемый маркерный полипептид обеспечивает устойчивость к летальному или ингибирующему рост воздействию агента селекции.
6. Молекула ДНК по п.5, в которой указанный агент селекции является антибиотиком.
7. Молекула ДНК по п.5 или 6, в которой указанный агент селекции выбирают из группы, включающей зеоцин, пуромицин, бластицидин, гигромицин, неомицин, метотрексат, метионинсульфоксимин и канамицин.
8. Молекула ДНК по п.7, в которой агент селекции является зеоцином.
9. Молекула ДНК по п.7, в которой агент селекции является бластицидином.
10. Молекула ДНК по п.7, в которой агент селекции является пуромицином.
11. Молекула ДНК по п.5, в которой селектируемый маркерный полипептид кодирован геном устойчивости к неомицину.
12. Молекула ДНК по п.5, в которой селектируемый маркерный полипептид кодирован геном dhfr.
13. Молекула ДНК по любому из предшествующих пунктов, в которой селектируемый маркерный полипептид дополнительно включает мутацию, уменьшающую активность селектируемого маркерного полипептида по сравнению с аналогичным полипептидом дикого типа.
14. Молекула ДНК по п.13, в которой селектируемый маркерный полипептид является полипептидом устойчивости к зеоцину, в котором пролин в положении 9 заменен другой аминокислотой.
15. Молекула ДНК по любому из предшествующих пунктов, в которой кодирующая последовательность представляющего интерес полипептида включает оптимальную инициирующую трансляцию последовательность.
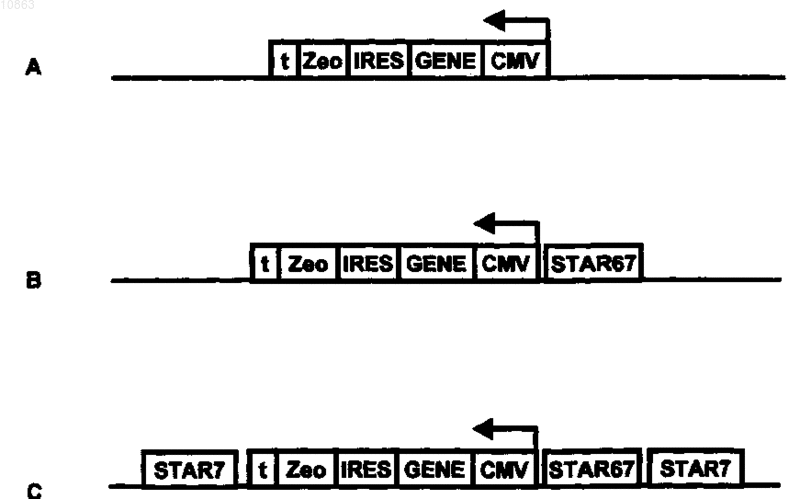
16. Кассета экспрессии, содержащая молекулу ДНК по любому из предшествующих пунктов, которая дополнительно включает промотор апстрим от указанной мультицистронной экспрессирующей единицы, являющийся функциональным в эукариотической клетке-хозяине в отношении инициации транскрипции мультицистронной экспрессирующей единицы, и дополнительно включает терминирующую транскрипцию последовательность даунстрим от мультицистронной экспрессирующей единицы.
17. Кассета экспрессии по п.16, которая дополнительно содержит по крайней мере один хроматинконтролирующий элемент, выбираемый из группы, состоящей из области присоединения матрикса или клеточного каркаса (MAR/SAR), изолирующей последовательности, универсального хроматинраскрывающего элемента (UCOE) и антирепрессорной последовательности (STAR).
18. Кассета экспрессии по п.17, в которой указанный хроматинконтролирующий элемент является антирепрессорной последовательностью.
19. Кассета экспрессии по п.18, в которой указанную антирепрессорную последовательность выбирают из группы, состоящей из:
a) любой последовательности SEQ ID NO:1-SEQ ID NO:66;
b) фрагментов любой последовательности SEQ ID NO:1-SEQ ID NO:66, обладающих антирепрессорной активностью;
c) последовательностей, которые по крайней мере на 70% идентичны нуклеотидной последовательности по п.a) или b) и обладают антирепрессорной активностью; и
d) комплементарной последовательности к любой последовательности по пп.a)-c).
20. Кассета экспрессии по п.19, которая включает одно из:
a) SEQ ID NO:66;
b) фрагмент последовательности по п.а), обладающий антирепрессорной активностью;
c) последовательность, которая по крайней мере на 70% идентична нуклеотидной последовательности по п.a) или b) и обладает антирепрессорной активностью;
причем последовательность по пп.a), b) или c) располагают апстрим от промотора, регулирующего транскрипцию мультицистронного гена.
21. Кассета экспрессии по любому из пп.16-20, в которой указанный мультицистронный ген фланкирован с обеих сторон по крайней мере одной антирепрессорной последовательностью.
22. Кассета экспрессии по п.21, содержащая 5' - антирепрессорную последовательность A - антирепрессорную последовательность B - промотор - мультицистронный ген, кодирующий функциональный селектируемый маркерный белок и расположенный даунстрим от него представляющий интерес полипептид - терминирующую транскрипцию последовательность - антирепрессорную последовательность C - 3', причем антирепрессорные последовательности A и C, которые могут быть одинаковыми или разными, выбирают из группы, состоящей из:
a) любой последовательности SEQ ID NO:1-SEQ ID NO:65;
b) фрагментов любой последовательности по п.a), обладающих антирепрессорной активностью;
c) последовательностей, которые по крайней мере на 70% идентичны нуклеотидной последовательности по п.a) или b) и обладают антирепрессорной активностью;
и антирепрессорную последовательность B выбирают из группы, состоящей из:
i) SEQ ID NO:66;
ii) фрагмента последовательности по п.i), обладающего антирепрессорной активностью; и
iii) последовательности, которая по крайней мере на 70% идентична нуклеотидной последовательности по п.i) или ii) и обладает антирепрессорной активностью.
23. Кассета экспрессии по п.22, в которой антирепрессорные последовательности A и C выбирают из группы, состоящей из:
a) SEQ ID NO:7;
b) фрагментов одной из последовательностей по п.a), обладающих антирепрессорной активностью; и
c) последовательностей, которые по крайней мере на 70% идентичны нуклеотидной последовательности по п.a) или b) и обладают антирепрессорной активностью.
24. Кассета экспрессии по любому из пп.16-23, в которой представляющий интерес полипептид является частью мультимерного белка.
25. Кассета экспрессии по п.24, в которой представляющий интерес полипептид является легкой цепью иммуноглобулина или тяжелой цепью иммуноглобулина.
26. Кассета экспрессии по любому из пп.16-25, дополнительно содержащая:
a) последовательность транскрипционной остановки транскрипции (TRAP), расположенную апстрим от указанного промотора в 5'-3' направлении; или
b) последовательность TRAP, расположенную даунстрим от указанной терминирующей транскрипцию последовательности в 3'-5' ориентации; или
c) обе последовательности TRAP по пп.a) и b);
причем последовательность TRAP является последовательностью, которая при введении в единицу транскрипции уменьшает уровень транскрипции, наблюдаемый в нуклеиновой кислоте, расположенной со стороны 3'-конца TRAP, по сравнению с уровнем транскрипции, наблюдаемым в нуклеиновой кислоте со стороны 5'-конца TRAP.
27. Кассета экспрессии по п.26, в которой указанная последовательность TRAP представляет собой SEQ ID NO:142.
28. Молекула ДНК, содержащая последовательность, кодирующую функциональный селектируемый маркерный полипептид, который может быть обнаружен в эукариотической клетке-хозяине, отличающаяся тем, что указанная молекула ДНК:
i) содержит неоптимальную инициирующую трансляцию последовательность, за которой следует другая последовательность, кодирующая функциональный селектируемый маркер; и
ii) в кодирующей цепи последовательности, определяющей селектируемый маркерный полипептид, даунстрим от неоптимального инициирующего кодона и до терминирующего кодона отсутствуют последовательности ATG.
29. Клетка-хозяин, содержащая молекулу ДНК или кассету экспрессии по любому из предшествующих пунктов.
30. Клетка-хозяин по п.29, которая является эукариотической клеткой-хозяином.
31. Клетка-хозяин по п.30, которая является клеткой-хозяином млекопитающего.
32. Клетка-хозяин по п.31, которая является клеткой яичника китайского хомячка (СНО).
33. Способ получения клетки-хозяина, экспрессирующей представляющий интерес полипептид, который включает следующие стадии:
a) введение в множество клеток-предшественников молекулы ДНК по любому из пп.1-15 или кассеты экспрессии по любому из пп.16-27; и
b) культивирование полученных клеток в условиях обнаружения экспрессии селектируемого маркерного полипептида; и
c) отбор по крайней мере одной клетки-хозяина, продуцирующей представляющий интерес полипептид.
34. Способ получения представляющего интерес полипептида, который включает культивирование клетки-хозяина, содержащей кассету экспрессии по любому из пп.16-27 и экспрессирующей представляющий интерес полипептид из кассеты экспрессии.
35. Способ по п.34, который дополнительно включает выделение представляющего интерес полипептида.
Текст
010863 Настоящее изобретение относится к области молекулярной биологии и биотехнологии. В частности, настоящее изобретение относится к усовершенствованным способам отбора клеток-хозяев, экспрессирующих белок на высоких уровнях, и к средствам для осуществления указанных способов. Белки могут быть продуцированы в разных клетках-хозяевах для целого ряда применений в биологии и биотехнологии, например, в качестве биофармацевтических препаратов. Для экспрессии многих белков, например, в тех случаях, когда такие белки подвергаются определенным посттрансляционным модификациям, таким как гликозилирование, предпочтительно используют эукариотические клетки, в частности клетки-хозяева млекопитающих. Такие способы продуцирования белков хорошо известны и обычно включают экспрессию в клетке-хозяине нуклеиновой кислоты (определяемой так же, как"трансген"), кодирующей представляющий интерес белок. Как правило, трансген вместе с селектируемым геном-маркером вводят в клетку-предшественник, при этом отбирают клетки, способные экспрессировать данный селектируемый ген-маркер, и идентифицируют один или несколько клонов, экспрессирующих представляющий интерес белок на высоких уровнях, и используют его для экспрессии требуемого белка. Одна проблема, связанная с экспрессией трансгенов, заключается в том, что нельзя прогнозировать с высокой степенью вероятности возможную инертность данного трансгена вследствие сайленсинга гена(McBurney et al., 2002), из-за чего многие клоны клеток-хозяев необходимо тестировать в отношении способности экспрессировать данный трансген на высоком уровне. Известны способы отбора рекомбинантных клеток-хозяев, экспрессирующих требуемые белки на относительно высоких уровнях. Один способ относится к применению селектируемых маркерных белков с мутациями в кодирующей последовательности, которые ослабляют, но не блокируют функцию маркера (например,WO 01/32901). Отличительной особенностью данного способа является требование более высокой экспрессии мутантного маркера в условиях отбора, и поэтому отбор производится по высокой экспрессии указанного маркера при сопутствующем отборе клеток-хозяев, которые также экспрессируют представляющий интерес ген на высоком уровне. В другом способе использован селектируемый ген-маркер, контролируемый промоторной последовательностью, которую подвергают такой мутации, при которой уровень активности промотора является значительно ниже активности соответствующего промотора дикого типа (патент США 5627033). Другой способ относится к применению измененной последовательности доминантного селектируемого маркера, такого как неомицинфосфотрансфераза с измененной консенсусной последовательностью Козака, для уменьшения числа колоний, подлежащих скринингу, и для повышения уровней экспрессии представляющего интерес гена, связанного с доминантным селектируемым маркером (патенты США 5648267 и 5733779). В предпочтительных вариантах осуществления указанных изобретений представляющий интерес ген вводят в (искусственный) интрон доминантного селектируемого маркера. Представляющий интерес ген и доминантный селектируемый маркер находятся в разных транскрипционных кассетах, причем каждая из указанных кассет в этом способе имеет свой собственный эукариотический промотор (патенты США 5648267 и 5733779). В другом способе использован принцип селектируемого гена-маркера, содержащего интрон, который обычно отсутствует в селектируемом гене, причем указанный интрон может быть сплайсирован в клетке-хозяине с образованием мРНК, кодирующей селектируемый белок, и, кроме того, интрон в селектируемом гене снижает уровень селектируемого белка, продуцируемого из селектируемого гена в клеткехозяине (европейский патент 0724639 B1). В другом способе использованы конструкции ДНК, включающие селектируемый ген, находящийся в интроне, определяемом 5'-концевой донорной областью сплайсинга, содержащей эффективную сплайсируемую донорную последовательность, для которой эффективность сплайсинга мРНК, имеющей указанную донорную область сплайсинга, составляет примерно 80-99%, и 3'-концевой акцепторной областью сплайсинга, и ген, кодирующий представляющий интерес продукт, даунстрим от 3'-концевой акцепторной области сплайсинга, причем селектируемый ген и ген продукта контролируются одной и той же областью регуляции транскрипции (патент США 5561053). В некоторых способах находят применение конструкции на основе полицистронного экспрессирующего вектора. В основе данного принципа лежит использование полицистронного экспрессирующего вектора, содержащего последовательности, кодирующие как требуемый белок, так и селектируемый белок, причем кодирующие последовательности управляются одним и тем же промотором и разделены терминирующими и инициирующими трансляцию сигнальными кодонами (патент США 4965196). В предпочтительных вариантах осуществления изобретения, описанного в патенте США 4965196, селектируемый маркер является амплифицируемым геном DHFR. В особенно предпочтительном варианте системы, описанной в патенте США 4965196, последовательность, кодирующая селектируемый маркер, расположена даунстрим от последовательности, кодирующей требуемый полипептид, поэтому способы, предназначенные для отбора клеток, трансформированных селектируемым маркером, служат также для отбора клеток, продуцирующих требуемый белок на более высоких уровнях.-1 010863 В других усовершенствованных способах, основанных на применении мультицистронных экспрессирующих векторов, описаны бицистронные векторы, предназначенные для быстрого и эффективного создания устойчивых линий клеток млекопитающих, экспрессирующих рекомбинантный белок. Указанные векторы содержат сайт введения внутренней рибосомы (Ires) между расположенной апстрим кодирующей последовательностью представляющего интерес белка и расположенной даунстрим кодирующей последовательностью селектируемого маркера (Rees et al., 1996). Такие векторы являются коммерчески доступными, например векторы pIres1 можно приобрести в компании Clontech(CLONTECHniques, октябрь 1996 г.). Использование таких векторов предполагает их введение в клеткихозяева, обнаружение достаточной экспрессии даунстрим маркерного белка и затем автоматический отбор мультицистронной мРНК с высокими уровнями транскрипции и, следовательно, с большой вероятностью высокой экспрессии представляющего интерес белка. В таких способах предпочтительно используют Ires, характеризующийся относительно низким уровнем трансляции селектируемого гена-маркера, для дальнейшего увеличения вероятности отбора клеток-хозяев с высоким уровнем экспрессии представляющего интерес белка путем выявления экспрессии селектируемого маркерного белка (см., например, международную публикацию WO 03/106684). Целью настоящего изобретения являются усовершенствованные способы отбора клеток-хозяев,экспрессирующих представляющие интерес белки на высоких уровнях, и средства для осуществления указанных способов. Сущность изобретения В настоящем изобретении использована новая и уникальная концепция отбора клеток-хозяев, экспрессирующих представляющие интерес полипептиды на высоких уровнях, которая определяется в данном описании изобретения как "обратно пропорциональная взаимозависимая трансляция". Данная концепция является уникальной по сравнению с ранее известными подходами, позволяя очень точно регулировать количество продуктов трансляции из мультицистронного транскрипта, в результате чего уменьшается уровень трансляции селектируемого маркерного полипептида, повышается уровень трансляции представляющего интерес полипептида, кодированного той же мультицистронной единицей транскрипции, т.е. уровень экспрессии представляющего интерес полипептида напрямую и более или менее обратно пропорционально зависит от уровня экспрессии селектируемого маркерного полипептида (схематическое изображение показано на фиг. 13). В отличие от этого подходы на основе использования Ires между последовательностями, кодирующими представляющий интерес полипептид и селектируемый маркерный полипептид (см. публикацию Rees et al., 1996), предполагают независимую трансляцию обоих полипептидов, поэтому в ранее известных способах отсутствует непосредственная взаимосвязь между эффективностью трансляции селектируемого маркерного полипептида и аналогичным показателем последовательности, кодирующей представляющий интерес полипептид. Одним объектом настоящего изобретения является молекула ДНК, содержащая мультицистронную единицу транскрипции, кодирующую i) селектируемый маркерный полипептид, функционирующий в эукариотической клетке-хозяине, и ii) представляющий интерес полипептид, причем представляющий интерес полипептид и селектируемый маркерный полипептид имеют разные инициирующие трансляцию последовательности (или инициирующие кодоны), которые отличаются тем, что последовательность,кодирующая представляющий интерес полипептид, расположена даунстрим от последовательности, кодирующей селектируемый маркер, в указанной мультицистронной единице транскрипции, а также тем,что последовательность нуклеиновой кислоты, кодирующая селектируемый маркерный полипептид,имеет мутацию, уменьшающую эффективность трансляции селектируемого маркера в эукариотической клетке-хозяине. Эффективность инициации трансляции селектируемого маркера предпочтительно снижается. В предпочтительном варианте осуществления изобретения пониженная эффективность инициации трансляции достигается путем создания неоптимальной инициирующей трансляцию последовательности селектируемого маркерного полипептида. В предпочтительных вариантах осуществления изобретения инициирующая трансляцию последовательность в кодирующей цепи селектируемого маркерного полипептида содержит последовательностьATG, определяющую инициирующий кодон, которая находится в неоптимальном окружении для инициации трансляции. Таким образом, последовательность ATG меньше используется в качестве инициирующего кодона по сравнению с инициирующим кодоном ATG, находящейся в оптимальном окружении. В более предпочтительном варианте осуществления изобретения инициирующая трансляцию последовательность в кодирующей цепи селектируемого маркерного полипептида включает инициирующий кодон, отличающийся от инициирующего кодона ATG, такой как один из GTG, TTG, CTG, ATT илиACG, причем первые две последовательности являются наиболее предпочтительными. Такие инициирующие кодоны, отличные от ATG, предпочтительно фланкированы последовательностями, обеспечивающими относительно хорошее узнавание отличных от ATG последовательностей в качестве инициирующих кодонов, поэтому по крайней мере некоторые рибосомы инициируют трансляцию с указанных инициирующих кодонов, т.е. инициирующая трансляцию последовательность предпочтительно включает последовательность ACC (инициирующий кодон, отличный от ATG) G или GCC (инициирующий кодон, отличный от ATG) G.-2 010863 В предпочтительных вариантах осуществления изобретения последовательность, кодирующая селектируемый маркерный полипептид, не содержит последовательность ATG в кодирующей цепи, следующей за последовательностью, кодирующей инициирующий кодон селектируемого маркерного полипептида, до последовательности, кодирующей терминирующий кодон, и во всех других последовательностях той же цепи между указанным терминирующим кодоном и инициирующим кодоном представляющего интерес полипептида (инициирующий кодон которого предпочтительно определяется последовательностью ATG в той же кодирующей цепи). В некоторых вариантах осуществления изобретения любую последовательность ATG, присутствующую в рамке считывания и кодирующую метионин в последовательности, кодирующей селектируемый маркерный полипептид дикого типа, мутируют с целью кодирования валина, треонина, изолейцина или лейцина. В предпочтительных вариантах осуществления изобретения селектируемый маркерный белок сообщает устойчивость к летальному и/или ингибирующему рост воздействию агента селекции, такого как антибиотик. Кодирующая последовательность представляющего интерес полипептида предпочтительно включает оптимальную инициирующую трансляцию последовательность. Настоящее изобретение далее относится к экспрессионным кассетам, содержащим молекулу ДНК по настоящему изобретению, которые дополнительно включают промотор апстрим от мультицистронной экспрессирующей единицы, инициирующий транскрипцию мультицистронной экспрессирующей единицы в эукариотической клетке-хозяине, и терминирующую транскрипцию последовательность даунстрим от мультицистронной экспрессирующей единицы. В предпочтительных вариантах осуществления изобретения такие кассеты экспрессии дополнительно содержат по крайней мере один хроматинконтролирующий элемент, выбираемый из группы, состоящей из области присоединения матрикса или клеточного каркаса (MAR/SAR), изолирующей последовательности, часто встречающегося хроматинраскрывающего элемента (UCOE) и антирепрессорной последовательности. Антирепрессорные последовательности являются наиболее предпочтительными в данном объекте изобретения, и в предпочтительных вариантах осуществления изобретения указанные антирепрессорные последовательности выбирают из группы, состоящей из:b) фрагментов любой последовательности SEQ ID NO:1-SEQ ID NO:66, обладающих антирепрессорной активностью;c) последовательностей, в которых нуклеотидная последовательность по крайней мере на 70% идентична последовательностям по пп.а) или b) и которые обладают антирепрессорной активностью; иd) комплементарной последовательности к любой последовательности по пп.a)-c). В некоторых предпочтительных вариантах осуществления изобретения указанные антирепрессорные последовательности выбирают из группы, состоящей изSTAR67 (SEQ ID NO:66),STAR7 (SEQ ID NO:7),STAR9 (SEQ ID NO:9),STAR17 (SEQ ID NO:17),STAR27 (SEQ ID NO:27),STAR29 (SEQ ID NO:29),STAR43 (SEQ ID NO:43),STAR44 (SEQ ID NO:44),STAR45 (SEQ ID NO:45),STAR47 (SEQ ID NO:47),STAR61 (SEQ ID NO:61) и функциональных фрагментов или производных указанных последовательностей STAR. В некоторых вариантах осуществления изобретения кассета экспрессии содержит STAR67, функциональный фрагмент или производное указанной последовательности, расположенный апстрим от промотора, стимулирующего экспрессию мультицистронного гена. В некоторых вариантах осуществления изобретения мультицистронный ген фланкирован с обеих сторон по крайней мере одной антирепрессорной последовательностью. В некоторых предпочтительных вариантах осуществления изобретения кассеты экспрессии по настоящему изобретению содержат в 5'-3' направлении антирепрессорную последовательность A антирепрессорную последовательность B - [промотор - мультицистронную единицу транскрипции по настоящему изобретению (кодирующую функциональный селектируемый маркерный белок и расположенный даунстрим от него представляющий интерес полипептид) - терминирующую транскрипцию последовательность] - антирепрессорную последовательность C, причем последовательности A, B и C могут быть одинаковыми или разными. В некоторых вариантах осуществления изобретения представляющий интерес полипептид является частью мультимерного белка, например тяжелой или легкой цепью иммуноглобулина.-3 010863 Настоящее изобретение относится также к молекулам ДНК, содержащим последовательность, кодирующую функциональный селектируемый маркерный полипептид, отличительным признаком которых является мутация, уменьшающая эффективность трансляции функционального селектируемого маркерного полипептида в эукариотической клетке-хозяине. Такая молекула ДНК предпочтительно характеризуется:i) наличием неоптимальной инициирующей трансляцию последовательности, за которой следует последовательность, кодирующая функциональный селектируемый маркер; иii) отсутствием последовательностей ATG в кодирующей цепи последовательности, определяющей селектируемый маркерный полипептид, расположенный даунстрим от неоптимального инициирующего кодона. Настоящее изобретение относится также к клеткам-хозяевам, содержащим молекулы ДНК по настоящему изобретению. Настоящее изобретение дополнительно относится к способам создания клеток-хозяев, экспрессирующих представляющий интерес полипептид, которые включают в себя следующие стадии: введение в множество предшественников клеток-хозяев кассеты экспрессии по настоящему изобретению; культивирование клеток в условиях, обеспечивающих экспрессию селектируемого маркерного полипептида; и отбор по крайней мере одной клетки-хозяина, продуцирующей представляющий интерес полипептид. Другим объектом настоящего изобретения являются способы получения представляющего интерес полипептида, которые включают культивирование клетки-хозяина, содержащей кассету экспрессии по настоящему изобретению, и экспрессию представляющего интерес полипептида из кассеты экспрессии. В предпочтительных вариантах осуществления изобретения представляющий интерес полипептид выделяют из клеток-хозяев и/или из культуральной среды клеток-хозяев. Другими объектами настоящего изобретения являются молекулы РНК, содержащие последовательность продукта транскрипции молекулы ДНК по настоящему изобретению. Другим объектом настоящего изобретения являются функциональные селектируемые маркерные полипептиды, не содержащие метионина в своей аминокислотной последовательности, которые получают путем экспрессии из определенных молекул ДНК по настоящему изобретению. Подробное описание изобретения Одним объектом настоящего изобретения является молекула ДНК, содержащая мультицистронную единицу транскрипции, кодирующую i) селектируемый маркерный полипептид, функционирующий в эукариотической клетке-хозяине, и ii) представляющий интерес полипептид, причем представляющий интерес полипептид и селектируемый маркерный полипептид имеют разные инициирующие трансляцию последовательности, которая отличается тем, что последовательность, кодирующая представляющий интерес полипептид, расположена даунстрим от последовательности, кодирующей селектируемый маркер, в указанной мультицистронной единице транскрипции, и последовательность нуклеиновой кислоты,кодирующая селектируемый маркерный полипептид, имеет мутацию, уменьшающую эффективность трансляции селектируемого маркера в эукариотической клетке-хозяине. Такую молекулу ДНК можно использовать в настоящем изобретении для получения эукариотических клеток-хозяев, экспрессирующих представляющий интерес полипептид на высоких уровнях, путем отбора на основании экспрессии селектируемого маркерного полипептида. Последовательно или одновременно можно идентифицировать одну или несколько клеток-хозяев, экспрессирующих представляющий интерес полипептид, и затем использовать для экспрессии указанного полипептида на высоких уровнях. Термин "моноцистронный ген" означает ген, способный продуцировать молекулу РНК, кодирующую один полипептид. Термин "мультицистронная единица транскрипции", определяемая также как мультицистронный ген, означает ген, способный продуцировать молекулу РНК, кодирующую по крайней мере два полипептида. Термин "бицистронный ген" означает ген, способный продуцировать молекулу РНК, кодирующую два полипептида. Таким образом, бицистронный ген входит в определение мультицистронного гена. Термин "полипептид" в значении, использованном в настоящем описании изобретения, означает по крайней мере пять аминокислот, связанных пептидными связями, и может представлять собой, например, белок или его часть, такую как субъединица. Термины "полипептид" и "белок" в основном имеют взаимозаменяемые значения в настоящем описании изобретения. Термин "ген" или "единица транскрипции" в значении, использованном в настоящем изобретении,может означать хромосомную ДНК, кДНК, искусственную ДНК, их комбинации и т.п. Единицы транскрипции, включающие несколько цистронов, транскрибируются как единичная мРНК. В отличие от известного уровня техники в мультицистронных единицах транскрипции по настоящему изобретению трансляция второй кодирующей области (т.е. области, кодирующей представляющий интерес белок),-4 010863 присутствующей в указанной РНК, зависит не от использования сайтов вторичной инициации трансляции или сайтов введения внутренней рибосомы, предназначенных для инициации трансляции второй кодирующей области, а от эффективности трансляции первой кодирующей области (т.е. области, кодирующей селектируемый маркерный белок) в виде более или менее обратно пропорциональной взаимосвязи: чем выше уровень трансляции селектируемого маркера, тем ниже уровень транскрипции представляющего интерес белка и наоборот. Мультицистронная единица транскрипции по настоящему изобретению предпочтительно является бицистронной единицей транскрипции, кодирующей в 5'-3' направлении селектируемый маркерный полипептид и представляющий интерес полипептид. Таким образом, представляющий интерес полипептид кодирован даунстрим от последовательности, кодирующей селектируемый маркерный полипептид. Кроме того, в одну единицу транскрипции можно включить несколько кодирующих последовательностей даунстрим от (первого) представляющего интерес полипептида, например кодирующих второй селектируемый маркерный полипептид или второй представляющий интерес полипептид. Такой дополнительной кодирующей последовательности, расположенной даунстрим от последовательности, кодирующей первый представляющий интерес полипептид, предшествует последовательность, кодирующая сайт повторной инициации трансляции или сайт введения внутренней рибосомы (Ires), благодаря чему трансляция второго представляющего интерес полипептида или второго селектируемого маркерного полипептида происходит независимо от двух более ранних кодирующих последовательностей. В таком варианте осуществления изобретения, например, можно иметь последовательности, кодирующие субъединицы мультимерного белка, в частности тяжелую и легкую цепи иммуноглобулина, кодированные в виде первого и второго представляющего интерес полипептида (в любом порядке), предназначенные для кодирования субъединиц мультимерного белка в одной мультицистронной экспрессирующей единице. Однако желательно использовать две отдельные единицы транскрипции для экспрессии разных представляющих интерес полипептидов, даже когда они образуют часть мультимерного белка (см., например, пример 13: тяжелая и легкая цепи антитела кодированы отдельной единицей транскрипции, причем каждая из указанных экспрессирующих единиц является бицистронной экспрессирующей единицей по настоящему изобретению). Молекулы ДНК по настоящему изобретению могут присутствовать в форме двухцепочечной ДНК,имеющей в отношении селектируемого маркерного полипептида и представляющего интерес полипептида кодирующую цепь и некодирующую цепь, причем кодирующая цепь имеет такую же последовательность, что и транслированная РНК, за исключением наличия T вместо U. Таким образом, инициирующий кодон AUG кодирован в кодирующей цепи последовательностью ATG, и цепь, содержащая указанную последовательность ATG, соответствующую инициирующему кодону AUG в РНК, определяется как кодирующая цепь ДНК. Очевидно, что инициирующие кодоны или инициирующие трансляцию последовательности действительно присутствуют в молекуле РНК, но указанные последовательности могут в равной степени рассматриваться как входящие в молекулу ДНК, кодирующую такую молекулу РНК; следовательно, настоящее изобретение относится к инициирующему кодону или инициирующей трансляцию последовательности, причем соответствующая молекула ДНК имеет такую же последовательность, что и последовательность РНК, кроме наличия T вместо U в кодирующей цепи указанной молекулы ДНК, и наоборот, за исключением особо оговоренных случаев. Другими словами, например,инициирующий кодон имеет последовательность AUG в РНК, но в настоящем изобретении в качестве инициирующего кодона в кодирующей цепи ДНК определяется соответствующая последовательностьATG. Аналогичным образом определяются "внутрирамочные" кодирующие последовательности, означающие триплеты (3 основания) в молекуле РНК, транслированные в аминокислоту, которые также могут рассматриваться как соответствующие тринуклеотидные последовательности в кодирующей цепи молекулы ДНК. Селектируемый маркерный полипептид и представляющий интерес полипептид, кодированные мульцистронным геном, имеют собственные инициирующие трансляцию последовательности и, таким образом, собственные инициирующие кодоны (а также терминирующие кодоны), т.е. указанные последовательности кодированы отдельными открытыми рамками считывания. Термин "маркер селекции" или "селектируемый маркер" обычно используют для обозначения гена и/или белка, наличие которых можно прямо или косвенно обнаружить в клетке, например, полипептида,который инактивирует агент селекции и защищает клетку-хозяина от летального или ингибирующего рост воздействия данного агента (например, ген и/или белок устойчивости к антибиотикам). В другом случае указанный селектируемый маркер индуцирует флуоресценцию или окрашивание (например, зеленый флуоресцентный белок (GFP) и его производные (например, d2EGFP), люцифераза, lacZ, щелочная фосфатаза и т.д.), которые можно использовать для отбора клеток, экспрессирующих полипептид,индуцирующий окрашивание, например, при помощи клеточного сортера с возбуждением флуоресценции (FACS), применяемого для отбора клеток, экспрессирующих GFP. Предпочтительно селектируемый маркерный полипептид по настоящему изобретению обеспечивает устойчивость к летальному и/или ингибирующему рост воздействию агента селекции. Селектируемый маркерный полипептид кодирован-5 010863 ДНК по настоящему изобретению. Селектируемый маркерный полипептид по настоящему изобретению должен функционировать в эукариотической клетке-хозяине и на этом основании может быть выбран для использования в эукариотических клетках-хозяевах. В настоящем изобретении может быть использован любой селектируемый маркерный полипептид, удовлетворяющий вышеуказанному критерию. Такие селектируемые маркерные полипептиды хорошо известны в данной области и обычно используются для получения клонов эукариотических клеток-хозяев; в настоящем описании изобретения приведено несколько примеров таких полипептидов. В некоторых вариантах осуществления изобретения селектируемым маркером, используемым в данном изобретении, является зеоцин. В других вариантах осуществления изобретения использован бластицидин. Специалисту в данной области должно быть известно о существовании других селектируемых маркеров, которые могут быть использованы для данной цели,таких как, например, неомицин, пуромицин, блеомицин, гигромицин и т.д. В других вариантах осуществления изобретения использован канамицин. В других вариантах осуществления изобретения в качестве селектируемого маркера использован ген DHFR, который можно обнаружить с помощью метотрексата, в частности увеличивая концентрацию метотрексата, можно отобрать клетки по увеличению числа копий гена DHFR. Аналогичным образом, можно использовать ген глутаминсинтетазы (GS), который может быть обнаружен в клетках с недостаточным содержанием GS (например, клетки NS-O) при культивировании в средах без глутамина, или альтернативно в клетках с достаточным содержанием GS (например,клетки CHO) путем добавления ингибитора GS, такого как метионинсульфоксимин (MSX). Другие селектируемые гены-маркеры, пригодные для использования, и агенты селекции для указанных генов представлены, например, в табл. 1 патента США 5561053; для ознакомления с указанными генами см. также публикацию Kaufman, Methods in Enzymology, 185: 537-566 (1990). При необходимости отбора двух мультицистронных единиц транскрипции по настоящему изобретению в одной клетке-хозяине каждая из указанных единиц должна предпочтительно содержать кодирующую последовательность для отличного селектируемого маркера, что позволяет обнаружить обе мультицистронные единицы транскрипции. Обе мультицистронные единицы транскрипции могут присутствовать в одной молекуле нуклеиновой кислоты или альтернативно в разных молекулах нуклеиновой кислоты. Термин "отбор" обычно означает процесс использования маркера селекции/селектируемого маркера и агента селекции для идентификации клеток-хозяев со специфическими генетическими свойствами (например, клетка-хозяин содержит трансген, встроенный в ее геном). Специалисту в данной области должно быть понятно, что возможны многочисленные комбинации селектируемых маркеров. Одним особенно эффективным антибиотиком является зеоцин, так как белок устойчивости к зеоцину (зеоцин-R) связывается с лекарственным средством и делает его безвредным. Таким образом, можно легко определить количество лекарственного средства, убивающего клетки с низкой экспрессией зеоцина-R, которое в то же время позволяет выжить клеткам с высокой экспрессией зеоцина-R. В качестве других белков устойчивости к антибиотикам обычно используют ферменты, которые оказывают каталитическое воздействие (в соотношении с лекарственным средством, отличным от 1:1). Таким образом, антибиотик зеоцин является предпочтительным селектируемым маркером. Однако настоящее изобретение относится также к другим селектируемым маркерам. Селектируемый маркерный полипептид по настоящему изобретению является белком, кодируемым нуклеиновой кислотой по настоящему изобретению, который можно обнаружить, например, благодаря устойчивости к агенту селекции, такому как антибиотик. Таким образом, при использовании антибиотика в качестве агента селекции, ДНК кодирует полипептид, сообщающий устойчивость к данному агенту селекции, который является селектируемым маркерным полипептидом. Последовательности ДНК, кодирующие такие селектируемые маркерные полипептиды, хорошо известны, и в настоящем описании изобретения приведено несколько примеров последовательностей ДНК дикого типа, кодирующих селектируемые маркерные белки (фиг. 26-32). Очевидно, что мутанты или производные селектируемых маркеров также могут быть пригодны для использования в настоящем изобретении и поэтому входят в определение термина "селектируемый маркерный полипептид" до тех пор, пока данный селектируемый маркерный белок сохраняет функциональную активность. Для удобства и в соответствии с практикой, принятой во многих публикациях и в настоящем описании изобретения, ген и белок, кодирующие устойчивость к агенту селекции, часто соответственно определяются как "ген (устойчивости) к агенту селекции" или "белок (устойчивости) к агенту селекции", хотя официальные названия могут быть другими, например ген, кодирующий белок, сообщающий устойчивость к неомицину (а также к G418 и канамицину),часто определяется как ген (устойчивости) к неомицину (или neor), хотя официальным названием данного гена является ген аминогликозид-3'-фосфотрансферазы. При осуществлении настоящего изобретения желательно обеспечить низкие уровни экспрессии селектируемого маркерного полипептида для достижения строгого отбора. Указанная цель достигается в настоящем изобретении путем использования кодирующей последовательности селектируемого маркера с неоптимальной эффективностью трансляции. При этом отбирают только клетки, которые, тем не менее,характеризуются достаточными уровнями селектируемого маркерного полипептида, так как на основании данного факта можно сделать вывод, что в таких клетках должны иметь место достаточная транс-6 010863 крипция мультицистронной единицы транскрипции и достаточная трансляция селектируемого маркерного полипептида, обеспечивающего отбор клеток со встроенной мультицистронной единицей транскрипции или каким-либо другим образом присутствующей в клетках-хозяевах в положении, где достигаются высокие уровни экспрессии, определяемые данной единицей транскрипции. В соответствии с настоящим изобретением (более или менее) обратно пропорциональный взаимозависимый характер трансляции представляющего интерес полипептида от эффективности трансляции маркера гарантирует высокие уровни трансляции представляющего интерес полипептида. Высокий уровень трансляции соответствует высоким уровням транскрипции, определяемым строгими условиями отбора (и имеющим место вследствие использования в клетках-хозяевах сильного промотора, стимулирующего транскрипцию мультицистронной единицы транскрипции). В молекулах ДНК по настоящему изобретению последовательность, кодирующая селектируемый маркерный полипептид, расположена апстрим от последовательности, кодирующей представляющий интерес полипептид, для получения мультицистронного транскрипта с обратно пропорциональной взаимозависимой трансляцией представляющего интерес полипептида и селектируемого маркерного полипептида. Таким образом, мультицистронная единица транскрипции содержит в 5'-3' направлении (как в транскрибированной цепи ДНК, так и в полученной транскрибированной РНК) последовательность, кодирующую селектируемый маркерный полипептид, и последовательность, кодирующую представляющий интерес полипептид. В соответствии с настоящим изобретением кодирующие области мультицистронного гена предпочтительно транслированы из кэп-зависимой открытой рамки считывания, поэтому селектируемый маркерный полипептид в принципе также может быть продуцирован в большом количестве. Для предотвращения такой высокой трансляции цистрона селектируемого маркера в последовательность нуклеиновой кислоты, кодирующую селектируемый маркерный полипептид, вводят мутацию (в открытую рамку считывания (ORF) или в инициирующие трансляцию последовательности, предшествующие ORF, либо в обе последовательности), которая уменьшает эффективность трансляции селектируемого маркерного полипептида в эукариотической клетке-хозяине. Эффективность трансляции должна быть ниже аналогичного показателя соответствующей последовательности дикого типа в такой же клетке, т.е. данная мутация должна способствовать меньшему образованию полипептида в одной клетке в единицу времени и,следовательно, меньшему образованию селектируемого маркерного полипептида. Мутация может быть обнаружена обычными методами, известными специалисту в данной области. Например, в случае выбора антибиотика указанная мутация должна вызывать меньшую устойчивость по сравнению с достигаемой при использовании последовательности без такой мутации и, следовательно, обладающей нормальной эффективностью трансляции, причем такое различие можно легко обнаружить путем определения числа колоний, сохраняющих жизнеспособность после нормального периода отбора, которое должно быть ниже при наличии мутации, уменьшающей эффективность трансляции. Как хорошо известно специалисту в данной области, существует ряд параметров, определяющих уровень экспрессии маркерного полипептида, таких как максимальная концентрация агента селекции, при которой клетки все еще сохраняют устойчивость, число колоний, выживающих при данной концентрации, скорость роста (время удвоения) клеток в присутствии агента селекции, комбинации вышеуказанных параметров и т.п. В особенно предпочтительном варианте осуществления изобретения мутация, уменьшающая эффективность трансляции, является мутацией, уменьшающей эффективность инициации трансляции. Подобный эффект может быть достигнут в соответствии с настоящим изобретением, например, путем введения в кодирующую последовательность селектируемого маркерного полипептида неоптимальной инициирующей трансляцию последовательности. Например, эффективность инициации трансляции селектируемого гена-маркера в эукариотических клетках можно уменьшить в соответствии с настоящим изобретением путем мутации инициирующего кодона и/или нуклеотидов в положениях от -3 до -1 и в положении +4 (когда A в инициирующем кодонеATG не находится в положении +1), например, в кодирующей цепи соответствующей последовательности ДНК с целью создания неоптимальной инициирующей трансляцию последовательности. Инициирующая трансляцию последовательность часто определяется в данной области как "последовательность Козака", и оптимальной последовательностью Козака является последовательность RCCATGG, в которой подчеркнут инициирующий кодон и R означает пурин, т.е. A или G (см. публикации Kozak, M., 1986,1987, 1989, 1990, 1997, 2002). Следовательно, помимо самого инициирующего кодона, к снижению эффективности инициации трансляции имеет отношение его окружение, в частности нуклеотиды в положениях от -3 до -1 и в положении +4, при этом оптимальная инициирующая трансляцию последовательность включает оптимальный инициирующий кодон (т.е. ATG) в оптимальном окружении (т.е. последовательности ATG непосредственно предшествует последовательность RCC и непосредственно после нее расположен остаток G). Неоптимальная инициирующая трансляцию последовательность по настоящему изобретению представляет собой любую последовательность, которая обеспечивает, по крайней мере,некоторую детектируемую трансляцию в эукариотической клетке (детектируемую с учетом возможности обнаружения селектирующего маркерного полипептида) и не имеет консенсусную последовательностьRCCATGG (инициирующий кодон подчеркнут). Трансляция рибосомами начинается предпочтительно в-7 010863 первом инициирующем кодоне, обнаруживаемом при сканировании от 5'-кэпа мРНК (механизм сканирования), и является наиболее эффективной при наличии оптимальной последовательность Козака (см. публикации Kozak, М., 1986, 1987, 1989, 1990, 1997, 2002). Однако в небольшом проценте случаев неоптимальные инициирующие трансляцию последовательности могут быть узнаны и использованы рибосомой для инициации трансляции. Настоящее изобретение, в котором использован данный принцип, позволяет уменьшить и даже точно регулировать величину трансляции и, следовательно, экспрессию селектируемого маркерного полипептида, который может быть использован для увеличения строгости системы отбора. В первом варианте осуществления изобретения инициирующий кодон ATG селектируемого маркерного полипептида (в кодирующей цепи ДНК, кодирующей соответствующий инициирующий кодонAUG в продукте транскрипции РНК) оставляют без изменения, а остатки в положениях от -3 до -1 и в положении +4 мутируют таким образом, чтобы они не образовывали оптимальную последовательность Козака, например, путем создания последовательности TTTATGT в качестве сайта инициации трансляции (инициирующий кодон ATG подчеркнут). Очевидно, что в соответствии с настоящим изобретением для достижения аналогичных результатов могут быть использованы другие мутации вокруг инициирующего кодона в положениях от -3 до -1 и/или в положении +4, что может быть легко проверено специалистом в данной области. Идея первого варианта осуществления изобретения заключается в том, что инициирующий кодон ATG помещают в "неоптимальное" окружение для инициации трансляции. Во втором, предпочтительном, варианте осуществления изобретения мутируют сам инициирующий кодон ATG селектируемого маркерного полипептида. Подобная мутация обычно еще больше уменьшает инициацию трансляции по сравнению с первым вариантом осуществления изобретения. Инициирующий кодон ATG во втором варианте осуществления изобретения мутируют в другой кодон, который, как известно, обеспечивает некоторую инициацию трансляции, например, в GTG, TTG, CTG, ATT или ACG(которые вместе определяются как "неоптимальные инициирующие кодоны"). В предпочтительных вариантах осуществления изобретения инициирующий кодон ATG мутируют в инициирующий кодонGTG. Подобная мутация обеспечивает еще более низкие уровни экспрессии (более низкую трансляцию) по сравнению с использованием неизмененного инициирующего кодона ATG, находящегося в неоптимальном положении. Более предпочтительно инициирующий кодон ATG мутируют в инициирующий кодон TTG, который обеспечивает еще более низкие уровни экспрессии селектируемого маркерного полипептида по сравнению с инициирующим кодоном GTG (публикации Kozak, M., 1986, 1987, 1989, 1990,1997, 2002; см. также приведенные ниже примеры 9-13). В случае второго варианта осуществления изобретения, т.е. при использовании инициирующего кодона, отличного от ATG, особенно желательно найти оптимальное окружение для такого инициирующего кодона, т.е. неоптимальным инициирующим кодонам предпочтительно непосредственно предшествуют нуклеотиды RCC в положениях от -3 до -1 и непосредственно за ними находится нуклеотид G (положение +4). Однако в научной литературе указано, что при использовании последовательности TTTGTGG(инициирующий кодон подчеркнут) наблюдается некоторая инициация, по крайней мере, in vitro, поэтому, несмотря на то, что данный кодон и является весьма предпочтительным, не является абсолютно необходимым создание оптимального окружения для неоптимальных инициирующих кодонов. Последовательности ATG, присутствующие в последовательности, кодирующей полипептид, но без инициирующего кодона ATG, определяются как "внутренние кодоны ATG", и если указанные последовательности находятся в открытой рамке считывания и кодируют метионин, то указанный метионин в данном полипептиде определяется как "внутренний метионин". Особенно предпочтительной в соответствии с настоящим изобретением является область (следующая за инициирующим кодоном и не обязательно включающая инициирующий кодон), кодирующая селектируемый маркерный полипептид, которая не содержит последовательность ATG в кодирующей цепи ДНК вплоть до (но не включая) инициирующего кодона представляющего интерес полипептида (очевидно, что инициирующий кодон представляющего интерес полипептида может быть и предпочтительно фактически является инициирующим кодоном ATG). Подобная область может быть создана в результате мутации любой такой последовательности ATG в кодирующей последовательности селектируемого маркерного полипептида, расположенной после инициирующего кодона (как должно быть ясно из вышеизложенного, инициирующий кодон селектируемого маркерного полипептида может, хотя и не обязательно, представлять собой последовательность ATG). Для достижения указанной цели там, где это возможно, используют вырожденность генетического кода, чтобы избежать мутации аминокислот в селектируемом маркерном полипептиде. Таким образом, последовательность ATG, которая присутствует в кодирующей цепи последовательности ДНК, кодирующей селектируемый маркерный полипептид, и при этом не находится в открытой рамке считывания селектируемого маркерного полипептида и поэтому не кодирует внутренний метионин в селектируемом маркерном полипептиде, может быть мутирована так, что полученный полипептид не будет иметь мутаций во внутренней аминокислотной последовательности. Когда ATG является внутрирамочным кодоном, кодирующим внутренний метионин, указанный кодон может быть мутирован и полученный мутированный полипептид может быть подвергнут обычной проверке на активность селектируемого маркерного полипептида. Подобным образом может быть выбрана мутация, позволяющая полу-8 010863 чить мутированный селектируемый маркерный полипептид, который все же сохраняет активность (могут иметь место количественные различия, но они являются менее значимыми и фактически могут быть даже благоприятными для получения менее активных вариантов по настоящему изобретению; минимальным требованием является возможность обнаружения данного селектируемого маркерного полипептида в эукариотических клетках). Такие аминокислоты как валин, треонин, изолейцин и лейцин в структурном отношении подобны метионину, поэтому кодоны, кодирующие одну из указанных аминокислот, являются хорошими кандидатами для тестирования вместо метионина в кодирующей последовательности после инициирующего кодона. Используя описание настоящего изобретения, специалист в данной области может протестировать другие аминокислоты вместо внутреннего метионина, используя обычные методы молекулярной биологии для мутации кодирующей ДНК и проверки функциональности селектируемого маркерного полипептида. Помимо обычных методов молекулярной биологии, применяемых для мутации ДНК, в настоящее время можно также синтезировать (если необходимо использовать стадии субклонирования) последовательности ДНК, имеющие достаточную длину для открытой рамки считывания селектируемого маркерного полипептида, и такие синтетические последовательности ДНК в настоящее время можно заказать на коммерческой основе в разных компаниях. Таким образом, используя описание настоящего изобретения, специалист в данной области может создать соответствующие последовательности по настоящему изобретению, кодирующие селектируемый маркерный полипептид (с мутацией,уменьшающей инициацию трансляции, и предпочтительно без внутренних последовательностей ATG),синтезировать такие последовательности и протестировать полученную молекулу ДНК в отношении функциональности кодированного селектируемого маркера путем введения данной молекулы ДНК в эукариотические клетки-хозяина и исследования экспрессии функционального селектируемого маркерногополипептида. Коммерческая доступность таких последовательностей без каких-либо трудностей позволяет получить кодирующие последовательности селектирующего маркера с отсутствием внутренних последовательностей ATG в отличие от кодирующей последовательности селектирующего маркерного полипептида дикого типа, которая содержит несколько таких внутренних последовательностей ATG. Благодаря созданию последовательности, кодирующей селектируемый маркерный полипептид с отсутствием любой внутренней последовательности ATG, значительно сокращается вероятность самопроизвольной инициации трансляции рибосомами, обнаруживающими (первую, неоптимальную) инициирующую трансляцию последовательность селектируемого маркерного полипептида в последующем внутреннем тринуклеотиде ATG, поэтому рибосомы продолжат сканирование до обнаружения первой оптимальной инициирующей трансляцию последовательности, т.е. последовательности представляющего интерес полипептида. Должно быть очевидно, что совершенно не обязательно удалять все внутренние последовательности ATG из кодирующей последовательности селектируемого маркера, если большинство рибосом не используют такие внутренние последовательности ATG в качестве сайта инициации трансляции, например, потому, что такие внутренние последовательности ATG обычно не находятся в оптимальном окружении для инициации трансляции. Однако с учетом того, что последовательность ATG даже в неоптимальном окружении вызывает значительную инициацию трансляции (как правило, превышающую инициацию трансляции, вызываемую инициирующим кодоном, отличным от ATG, находящимся в оптимальном окружении), совершенно ясно, что при наличии нескольких внутренних последовательностейATG в кодирующей области селектируемого маркера каждая из указанных последовательностей может отвлекать часть рибосом, инициирующих трансляцию в положении указанных последовательностейATG, не позволяя им достичь расположенной даунстрим единицы трансляции, кодирующей представляющий интерес полипептид, в результате чего сокращается экспрессия представляющего интерес полипептида. Именно по этой причине желательно, чтобы последовательность, кодирующая селектируемый маркерный полипептид, не содержала внутренние последовательности ATG. При желании соотношение рибосом, транслирующих представляющий интерес полипептид, может быть даже увеличено путем мутации любых неоптимальных потенциальных сайтов инициации трансляции в последовательности, кодирующей селектируемый маркерный полипептид. Очевидно, что любая последовательность, присутствующая в кодирующей цепи между терминирующим кодоном селектируемого маркера и инициирующим кодоном представляющего интерес полипептида, может быть легко создана без последовательностей ATG или других неоптимальных потенциальных кодонов инициации трансляции. Совершенно ясно, что в соответствии с настоящим изобретением весьма желательно, чтобы инициирующая трансляцию последовательность представляющего интерес полипептида содержала оптимальную инициирующую трансляцию последовательность, т.е. имела консенсусную последовательностьRCCATGG (инициирующий кодон подчеркнут). Такая последовательность обеспечивает очень эффективную трансляцию представляющего интерес полипептида. В результате выполнения вышеизложенных действий получают обратно пропорциональный взаимозависимый механизм трансляции по настоящему изобретению: рибосомы ведут сканирование от кэпа мРНК, содержащей мультицистронную единицу транскрипции, и небольшой процент рибосом транслируют первую открытую рамку считывания, т.е. селектируемый маркерный белок, благодаря наличию-9 010863 мутации, уменьшающей эффективность трансляции, в то время как большинство рибосом пропускают указанную открытую рамку считывания и начинают трансляцию с оптимального сайта инициации трансляции представляющего интерес полипептида, вследствие чего продуцируется небольшое количество селектируемого маркерного белка и большое количество представляющего интерес полипептида. Благодаря созданию кодирующей последовательности маркера с разными мутациями, уменьшающими эффективность трансляции на несколько порядков, увеличивается строгость отбора и соответствующим образом повышаются уровни экспрессии представляющего интерес полипептида, что делает возможной точную регулировку: например, при использовании инициирующего кодона TTG для селектируемого маркерного полипептида очень мало рибосом начинают трансляцию с данного инициирующего кодона, в результате чего селектируемый маркерный белок образуется на очень низком уровне и, следовательно,повышается строгость отбора, и в то же время почти все рибосомы транслируют представляющий интерес полипептид. В настоящем описании изобретения показано, что данный принцип может быть использован в очень надежной системе отбора, позволяя получить большое число клонов, экспрессирующих представляющий интерес полипептид на высоких уровнях. Кроме того, уровни экспрессии представляющего интерес полипептида значительно превышают уровни, имеющие место даже в случае скрининга гораздо большего числа колоний при помощи ранее известных систем отбора. Помимо уменьшения эффективности инициации трансляции весьма благоприятным может быть сокращение эффективности элонгации трансляции селектируемого маркерного полипептида, например,путем мутации кодирующей последовательности, в результате чего указанная последовательность содержит несколько непредпочтительных кодонов клетки-хозяина для дальнейшего уменьшения уровней трансляции маркерного полипептида и при желании создает условия для более строгого отбора. В некоторых вариантах осуществления изобретения помимо мутаций, которые уменьшают эффективность трансляции по настоящему изобретению, селектируемый маркерный полипептид дополнительно включает мутацию, которая снижает активность селектируемого маркерного полипептида по сравнению с аналогичным полипептидом дикого типа. Такая мутация может быть использована для еще большего увеличения строгости отбора. В качестве неограничивающих примеров можно отметить, что пролин в положении 9 полипептида устойчивости к зеоцину может быть мутирован, например, в Thr или Phe, и в случае полипептида устойчивости к неомицину может быть мутирован аминокислотный остаток 182 или 261 либо оба вместе (см., например, WO 01/32901). В некоторых вариантах осуществления изобретения даунстрим от последовательности, кодирующей инициирующий кодон селектируемого маркерного полипептида, вводят так называемую спейсерную последовательность, которая предпочтительно находится в рамке считывания с инициирующим кодоном, кодирует несколько аминокислот, не имеет вторичной структуры (Kozak, 1990) и не содержит последовательность ATG. Такая спейсерная последовательность может быть использована для дальнейшего уменьшения частоты инициации трансляции при наличии вторичной структуры в РНК (Kozak,1990) селектируемого маркерного полипептида (например, для зеоцина и, возможно, для бластицидина),благодаря чему увеличивается строгость системы отбора по настоящему изобретению. Настоящее изобретение относится также к молекуле ДНК, содержащей последовательность, кодирующую селектируемый маркерный белок по настоящему изобретению, которая имеет мутацию, уменьшающую эффективность трансляции функционального селектируемого маркерного полипептида в эукариотической клетке-хозяине. В предпочтительных вариантах осуществления изобретения указанная молекула ДНК в кодирующей цепи:i) мутирована по сравнению с последовательностью дикого типа, кодирующей указанный селектируемый маркерный полипептид, в результате чего последовательность ATG отсутствует в кодирующей области, следующей за инициирующим кодоном функционального селектируемого маркерного белка,вплоть до терминирующего кодона открытой рамки считывания указанного функционального селектируемого маркерного белка; иii) содержит неоптимальную инициирующую трансляцию последовательность функционального селектируемого маркерного полипептида. Отличительные особенности i) и ii) также могут быть получены в соответствии с приведенным выше описанием. Такие молекулы ДНК представляют собой полезный промежуточный продукт по настоящему изобретению. Указанные молекулы могут быть получены, введены в эукариотические клеткихозяева и протестированы, при желании, (полу)количественным методом, в отношении функциональной способности селектируемого маркерного полипептида (к некоторым маркерам данный метод применим даже в прокариотических клетках-хозяевах). Указанные молекулы могут быть также использованы для получения молекулы ДНК по настоящему изобретению, содержащей мультицистронную единицу транскрипции. Предпочтительным объектом настоящего изобретения является кассета экспрессии, содержащая молекулу ДНК по настоящему изобретению, включающую мультицистронную единицу транскрипции. Такая кассета экспрессии пригодна для экспрессии представляющих интерес последовательностей, например, в клетках-хозяевах.- 10010863 Термин "кассета экспрессии" в значении, использованном в настоящем описании изобретения, означает последовательность нуклеиновой кислоты, содержащую по крайней мере один промотор, функционально связанный с экспрессируемой последовательностью. Предпочтительно кассета экспрессии дополниительно содержит последовательности, определяющие терминацию транскрипции и полиаденилирование. Указанная кассета может также включать другие регуляторные последовательности, такие как энхансеры. Таким образом, настоящее изобретение относится к кассете экспрессии, включающей в себя в следующем порядке: 5' - промотор - мультицистроннную единицу транскрипции по настоящему изобретению, кодирующую селектируемый маркерный полипептид и расположенный даунстрим представляющий интерес полипептид - терминирующую транскрипцию последовательность - 3'. Промотор должен быть способен функционировать в эукариотической клетке-хозяине, т.е. он должен стимулировать транскрипцию мультицистронной единицы транскрипции. Кассета экспрессии может дополнительно необязательно содержать другие элементы, известные в данной области, например, сайты сплайсинга для введения интронов, и т.п. В некоторых вариантах осуществления изобретения интрон расположен после промотора и перед последовательностью, кодирующей селектируемый маркерный полипептид. Специалистам в данной области хорошо известно, что для достижения экспрессии последовательностей нуклеиновой кислоты, кодирующих белок, последовательности, способные стимулировать такую экспрессию, могут быть функционально связаны с последовательностями нуклеиновой кислоты, кодирующими данный белок, в результате чего образуются рекомбинантные молекулы нуклеиновой кислоты,кодирующие белок в экспрессируемом формате. В настоящем изобретении кассета экспрессии включает мультицистронную единицу транскрипции. Как правило, промоторная последовательность находится апстрим от экспрессируемых последовательностей. В данной области известно много экспрессирующих векторов, например серия векторов pcDNA и pEF компании Invitrogen, векторы pMSCV и рТК-Hyg компании BD Sciences, вектор pCMV-Script компании Stratagene и т.д., которые могут быть использованы для получения приемлемых промоторов и/или терминирующих транскрипцию последовательностей,polyA-последовательностей и т.п. Когда последовательность, кодирующая представляющий интерес полипептид, занимает правильное положение относительно последовательностей, управляющих транскрипцией и трансляцией кодированного полипептида, полученная кассета экспрессии пригодна для продуцирования представляющего интерес полипептида, определяемого как экспрессия. Стимулирующие экспрессию последовательности могут включать промоторы, энхансеры и подобные элементы, а также их комбинации. Указанные элементы должны быть способны функционировать в клетке-хозяине, стимулируя экспрессию функционально связанных с ними последовательностей нуклеиновой кислоты. Специалисту в данной области должно быть известно, что можно использовать разные промоторы для достижения экспрессии гена в клетках-хозяевах. Промоторы могут быть конститутивными или регулируемыми и могут быть получены из разных источников, включающих вирусы, прокариотические или эукариотические источники, или созданы искусственным путем. Представляющие интерес нуклеиновые кислоты могут быть экспрессированы из естественного промотора или его производного или из полностью гетерологичного промотора (Kaufman, 2000). Некоторые хорошо известные и широко применяемые промоторы для экспрессии в эукариотических клетках включают в себя промоторы, выделенные из вирусов, таких как аденовирус, например промотор E1A; промоторы, выделенные из цитомегаловируса(CMV), такие как предранний (IE) промотор CMV (определяемый в настоящем описании изобретения как промотор CMV), получаемый, например, из вектора pcDNA, Invitrogen; промоторы, выделенные из вакуолизирующего обезьяньего вируса SV40 (Das et al, 1985), и т.п. Приемлемые промоторы могут быть также выделены из эукариотических клеток, в частности металлотионеиновые (MT) промоторы, промотор фактора элонгации 10 С (EF-1) (Gill et al., 2001), убиквитиновый C-промотор или промотор UB6(Gill et al., 2001; Schorpp et al., 1996), актиновый промотор, иммуноглобулиновый промотор, промоторы теплового шока и т.п. Некоторые предпочтительные промоторы для экспрессии в эукариотических клетках, которые являются приемлемыми промоторами по настоящему изобретению, представляют собой промотор CMV, промотор EF-1 млекопитающего, убиквитиновый промотор млекопитающего, такой как убиквитиновый C-промотор, или промотор SV40 (например, получаемый из pIres,631605 (по каталогу), BD Sciences). Специалисту в данной области должны быть известны методы тестирования функциональности и силы промотора, которые, как правило, могут включать клонирование испытуемого гена, такого как lacZ, люцифераза, GFP и т.д., позади промоторной последовательности и исследование экспрессии испытуемого гена. Промоторы, конечно, могут быть изменены путем делеции, добавления,мутации входящих в них последовательностей и протестированы в отношении функциональности для обнаружения новых, ослабленных или усовершенствованных промоторных последовательностей. В соответствии с настоящим изобретением предпочтительными являются сильные промоторы, обеспечивающие высокие уровни транскрипции в выбранных эукариотических клетках. В некоторых вариантах осуществления изобретения молекула ДНК по настоящему изобретению является частью вектора, например плазмиды. Такими векторами можно легко манипулировать методами, хорошо известными специалисту в данной области, и такие векторы могут быть созданы с возможно- 11010863 стью репликации в прокариотических и/или эукариотических клетках. Кроме того, многие векторы могут быть использованы без изменения или в форме выделенного требуемого фрагмента для трансформации эукариотических клеток, для чего они полностью или частично встраиваются в геном таких клеток с образованием устойчивых клеток-хозяев, содержащих в своем геноме требуемую нуклеиновую кислоту. Известные экспрессирующие системы представляют собой молекулы ДНК в форме рекомбинантной плазмиды и рекомбинантного вирусного генома. Плазмиду или вирусный геном вводят в (эукариотические) клетки-хозяева и предпочтительно встраивают в геномы указанных клеток методами, известными в данной области. В предпочтительных вариантах осуществления изобретения указанные типы молекул ДНК используют также для создания усовершенствованной системы экспрессии трансгена. Предпочтительный вариант осуществления изобретения относится к использованию плазмидной ДНК для доставки экспрессирующей системы. Плазмида содержит целый ряд следующих компонентов: обычные компоненты, известные в данной области, включают ориджин репликации (начало репликации) и селектируемый маркер для пролиферации плазмиды в бактериальных клетках; селектируемый маркер, функционирующий в эукариотических клетках для идентификации и выделения клеток-хозяев, несущих встроенную систему экспрессии трансгена; представляющий интерес белок, транскрипция которого на высоком уровне обеспечивается промотором, функционирующим в эукариотических клетках (например, основной предранний промотор/энхансер цитомегаловируса, pCMV (Boshart et al., 1985); и вирусные терминаторы транскрипции (например, сайт полиаденилирования SV40 (KaufmanSharp,1982) для представляющего интерес трансгена и селектируемого маркера. Используемый вектор может быть любым вектором, пригодным для клонирования ДНК и используемым для транскрипции представляющей интерес нуклеиновой кислоты. При использовании клетокхозяев предпочтительным вектором является встраиваемый вектор. Альтернативно, указанный вектор может быть вектором, реплицирующимся в эписоме. Весьма желательно, чтобы структура хроматина и другие эпигенетические регуляторные механизмы могли влиять на экспрессию трансгенов в эукариотических клетках (см., например, публикациюWhitelaw et al., 2001). Мультицистронные экспрессирующие единицы по настоящему изобретению образуют часть системы отбора с достаточно строгим режимом отбора. Подобный подход обычно требует высоких уровней транскрипции в выбранных клетках-хозяевах. Для увеличения вероятности обнаружения клонов клеток-хозяев, выживающих в условиях строгого отбора и, возможно, для повышения устойчивости экспрессии в полученных клонах обычно желательно увеличить прогнозируемость транскрипции. Поэтому в предпочтительных вариантах осуществления изобретения кассета экспрессии по настоящему изобретению дополнительно включает в себя по крайней мере один хроматинконтролирующий элемент. Термин "хроматинконтролирующий элемент" в значении, использованном в настоящем описании изобретения, является общим определением последовательностей ДНК, которые могут оказывать некоторое влияние на структуру хроматина и, таким образом, на уровень экспрессии и/или устойчивость экспрессии трансгенов рядом с указанными последовательностями (они функционируют в цис-форме и поэтому предпочтительно располагаются на расстоянии 5 т.п.о., более предпочтительно 2 т.п.о., еще предпочтительнее 1 т.п.о. от указанного трансгена) в эукариотических клетках. Такие элементы иногда используют для увеличения числа клонов, обладающих требуемыми уровнями экспрессии трансгена. Механизмы действия указанных элементов могут быть различными для разных классов таких элементов и даже внутри разных классов таких элементов и полностью не известны для всех типов таких элементов. Однако такие элементы были описаны в научной литературе и в соответствии с целями настоящего изобретения хроматинконтролирующие элементы выбирают из группы, включающей области присоединения матрикса или клеточного каркаса (MAR/SAR) (см., например, публикацию Phi-Van et al., 1990;et al., 1993, 1997; Kellum and Schedl, 1991; WO 94/23046, WO 9604390, WO 01/02553, WO 2004/027072),часто встречающийся хроматинраскрывающий элемент (UCOE) (WO 00/05393, WO 02/24930,WO 02/099089, WO 02/099070) и антирепрессорные последовательности (определяемые также как последовательности "STAR") (Kwaks et al., 2003; WO 03/004704). Неограничивающие примеры последовательностей MAR/SAR, которые могут быть использованы в настоящем изобретении, включают в себя 5'-MAR лизоцима цыпленка (Phi-Van et al., 1990) или его фрагменты, например B, K и F-области,описанные в WO 02/074969); последовательности ДНК, содержащие по крайней мере один складчатый элемент ДНК и по крайней мере один сайт связывания для ДНК-связывающего белка, предпочтительно содержащий по крайней мере 10% динуклеотида TA и/или по крайней мере 12% динуклеотида AT на участке из 100 смежных пар оснований, таком как последовательность, выбираемая из группы, включающей последовательности SEQID NO:1-27, описанные в WO 2005/040377, фрагменты любых последовательностей SEQ ID NO:1-27,описанных в WO 2005/040377, имеющие длину, равную по крайней мере 100 нуклеотидам, и обладаю- 12010863 щие активностью MAR, последовательности, в которых нуклеотидная последовательность по крайней мере на 70% идентична любым последовательностям SEQ ID NO:1-27, описанным в WO 2005/040377,или их фрагментам и которые обладают активностью MAR, причем активность MAR определяется как способность связываться с нуклеарными матриксами/клеточными каркасами in vitro и/или изменять экспрессию кодирующих последовательностей, функционально связанных с промотором; последовательности, выбираемые из любых последовательностей SEQ ID NO:1-5, описанных вWO 02/074969, фрагменты любых последовательностей SEQ ID NO:1-5, описанных в WO 02/074969, и обладающие активностью MAR, последовательности, в которых нуклеотидная последовательность по крайней мере на 70% идентична любым последовательностям SEQ ID NO:1-5, описанным в WO 02/074 969, или их фрагментам и которые обладают активностью MAR; последовательности, выбираемые из SEQ ID NO:1 и SEQ ID NO:2, описанных в WO 2004/027072,их функциональные фрагменты и последовательности, идентичные им по крайней мере на 70%. Неограничивающим примером изолирующих последовательностей, которые могут быть использованы в настоящем изобретении, является последовательность, включающая SEQ ID NO:1, описанную в WO 01/02553. Неограничивающие примеры UCOE, которые могут быть использованы в настоящем изобретении, включают последовательности, показанные на фиг. 2 и 7 в WO 02/24930, их функциональные фрагменты и последовательности, идентичные им по крайней мере на 70% и сохраняющие активность; последовательности, включающие SEQ ID NO:28, описанную в заявке на патент США 2005/181428, их функциональные фрагменты и последовательности, идентичные им по крайней мере на 70% и сохраняющие активность. Указанный хроматинконтролирующий элемент предпочтительно является антирепрессорной последовательностью, предпочтительно выбираемой из группы, включающей:b) фрагменты любых последовательностей SEQ ID NO:1-66, обладающие антирепрессорной активностью ("функциональные фрагменты");c) последовательности, в которых нуклеотидная последовательность по крайней мере на 70% идентична последовательностям по п.a) или b) и которые обладают антирепрессорной активностью ("функциональные производные"); иd) комплементарную последовательность к любой последовательности по пп.a)-c). Указанный хроматинконтролирующий элемент предпочтительно выбирают из группы, включающей последовательности STAR67 (SEQ ID NO:66), STAR7 (SEQ ID NO:7), STAR9 (SEQ ID NO:9),STAR17 (SEQ ID NO:17), STAR27 (SEQ ID NO:27), STAR29 (SEQ ID NO:29), STAR4 3 (SEQ ID NO:43),STAR4 4 (SEQ ID NO:44), STAR45 (SEQ ID NO:45), STAR47 (SEQ ID NO:47), STAR61 (SEQ ID NO:61),функциональный фрагмент или производное указанных последовательностей STAR. В особенно предпочтительном варианте осуществления изобретения указанная последовательностьSTAR является последовательностью STAR67 (SEQ ID NO:66), функциональным фрагментом или производным указанной последовательности. В некоторых предпочтительных вариантах осуществления изобретения последовательность STAR67, его функциональный фрагмент или производное вводят апстрим от промотора, стимулирующего экспрессию мультицистронной единицы транскрипции. В других предпочтительных вариантах осуществления изобретения кассеты экспрессии по настоящему изобретению фланкируют с обеих сторон по крайней мере одной антирепрессорной последовательностью. Последовательности, обладающие антирепрессорной активностью, в значении, использованном в настоящем описании изобретения, представляют собой последовательности, которые способны, по крайней мере, частично подавлять репрессивное действие белков HP1 или HPC2 при связывании указанных белков с ДНК. Последовательности, обладающие антирепрессорной активностью (иногда определяемые также как антирепрессорные последовательности или антирепрессорные элементы указанных последовательностей) и пригодные для использования в настоящем изобретении, описаны в публикацииWO 03/004704, включенной в настоящее описание изобретения в качестве ссылки, где они названы последовательностями "STAR" (последовательность, определяемая в настоящем описании изобретения как последовательность STAR, является последовательностью, обладающей антирепрессорной активностью по настоящему изобретению). В качестве неограничивающего примера можно отметить, что последовательности, состоящие из 66 антирепрессорных элементов и именуемые последовательностями STAR1-65(см. WO 03/004704) и STAR67, представлены в настоящем описании изобретения соответственно как последовательности SEQ ID NO:1-65 и 66. В соответствии с настоящим изобретением функциональный фрагмент или производное данного антирепрессорного элемента считается эквивалентным указанному антирепрессорному элементу, если он сохраняет антирепрессорную активность. Специалист в данной области может легко проверить наличие такой антирепрессорной активности, например, при помощи описанного ниже анализа. Функциональные фрагменты или производные могут быть легко получены специалистом в области молекулярной биологии из данной антирепрессорной последовательности в результате делеций, добавлений, замен, инверсий и подобных модификаций (см., например, WO 03/004704). Функциональный фрагмент или производное может также включать ортологи из других видов, которые могут быть обнаружены при использовании- 13010863 известных антирепрессорных последовательностей методами, известными специалисту в данной области(см., например, WO 03/004704). Таким образом, в объем настоящего изобретения входят фрагменты антирепрессорных последовательностей, обладающие антирепрессорной активностью. В объем настоящего изобретения входят также последовательности, в которых нуклеотидная последовательность по крайней мере на 70% идентична указанным последовательностям или их функциональным фрагментам, обладающим антирепрессорной активностью, если указанные последовательности, идентичные по крайней мере на 70%, сохраняют антирепрессорную активность по настоящему изобретению. Указанные последовательности предпочтительно по крайней мере на 80%, более предпочтительно по крайней мере на 90% и еще предпочтительнее по крайней мере на 95% идентичны эталонной нативной последовательности или ее функциональному фрагменту. В случае фрагментов данной последовательности значение процентной идентичности относится к той части эталонной нативной последовательности, которая обнаружена в данном фрагменте. Последовательности, обладающие антирепрессорной активностью по настоящему изобретению,могут быть получены разными методами, которые включают, не ограничиваясь ими, клонирование из генома человека или из генома другого организма, амплификацию известных антирепрессорных последовательностей непосредственного из такого генома известными методами, например при помощи полимеразной цепной реакции (PCR), частичного или полного химического синтеза. Последовательности, обладающие антирепрессорной активностью, их функциональные фрагменты или производные определяются в структурном отношении на основании их последовательности и в функциональном отношении как последовательности, обладающие антирепрессорной активностью, которая может быть обнаружена при помощи описанного ниже анализа. Любая последовательность, обладающая антирепрессорной активностью по настоящему изобретению, должна сохранять жизнеспособность, по крайней мере, при выполнении нижеследующего функционального анализа (см. публикацию WO 03/004704, пример 1, включенную в настоящее описание изобретения в качестве ссылки). Клетки OS U-2 человека (ATCC HTB-96) устойчиво трансфицируют плазмидой pTet-Off (ClontechK1620-A) и нуклеиновой кислотой, кодирующей слитый белок LexA-репрессор, содержащий ДНКсвязывающий домен LexA и кодирующую область HP1 или HPC2 (белки группы Polycomb дрозофилы,которые подавляют экспрессию гена при связывании с ДНК; указанный анализ может быть выполнен при использовании любого слитого белка) под контролем системы регуляции транскрипции Tet-Off(Gossen and Bujard, 1992). Указанные клетки определяются ниже как репортерные клетки, предназначенные для использования в анализе антирепрессорной активности. Репортерная плазмида, сообщающая устойчивость к гигромицину, содержит полилинкерную последовательность, расположенную между сайтами оператора LexA и промотором SV40, контролирующим ген устойчивости к зеоцину. Последовательность, подлежащая тестированию в отношении антирепрессорной активности, может быть клонирована в указанном полилинкере. Создание приемлемой репортерной плазмиды, такой как pSelect, описано в примере 1 и показано на фиг. 1 WO 00/004704. Репортерную плазмиду вводят в репортерные клетки,после чего полученные клетки культивируют в условиях отбора гигромицином (25 мкг/мл; отбор по наличию репортерной плазмиды) и подавления тетрациклином (доксициклин, 10 нг/мл; подавляет экспрессию слитого белка LexA-репрессор). После выращивания клеток в указанных условиях в течение 1 недели концентрацию доксициклина уменьшают до 0,1 нг/мл для индуцирования гена LexA-репрессора и через 2 дня добавляют зеоцин до 250 мкг/мл. Клетки культивируют в течение 5 недель, пока контрольные культуры (трансфицированные пустой репортерной плазмидой, т.е. без наличия в полилинкере клонированной антирепрессорной последовательности) не будут уничтожены зеоцином (в указанной контрольной плазмиде промотор SV40 подавляется слитым белком LexA-репрессор, который связывается с функциональными сайтами LexA, что ведет к недостаточной экспрессии зеоцина в таких клетках, необходимой для выживания при отборе зеоцином). Последовательность обладает антирепрессорной активностью по настоящему изобретению, если при клонировании указанной последовательности в полилинкере репортерной плазмиды репортерные клетки сохранят жизнеспособность в течение 5 недель отбора зеоцином. Клетки из таких колоний могут быть размножены на новой среде, содержащей зеоцин, после 5 недель отбора зеоцином, в то время как клетки, трансфицированные репортерными плазмидами без антирепрессорных последовательностей, не могут быть размножены на новой среде, содержащей зеоцин. Любая последовательность, не способная сообщать рост клетке после 5 недель воздействия зеоцина при выполнении данного анализа, не может быть квалифицирована как последовательность, обладающая антирепрессорной активностью, ее функциональный фрагмент или производное по настоящему изобретению. В качестве примера можно отметить, что другие известные хроматинконтролирующие элементы,в частности, испытанные Van der Vlag и др. (2000), включая scs дрозофилы (KeHum and Schedl, 1991),5'-HS4 -глобинового локуса цыпленка (Chung et al., 1993, 1997) или области присоединения матрикса(MAR) (Phi-Van et al., 1990), не сохраняют жизнеспособность при выполнении данного анализа.- 14010863 Кроме того, желательно, чтобы антирепрессорная последовательность, ее функциональный фрагмент или производное увеличивали долю клонов сверхэкспрессирующих репортерных клеток при фланкировании гена-репортера (например, люцифераза, GFP), встроенного в геном клеток OS U-2 или CHO,по сравнению с геном-репортером, не фланкированным антирепрессорными последовательностями или фланкированным более слабыми блокирующими репрессию последовательностями, такими как scs дрозофилы. Подобный эффект можно проверить, используя, например, вектор pSDH или подобные векторы,описанные в примере 1 и показанные на фиг. 2 WO 03/004704. Антирепрессорные элементы могут оказывать по крайней мере одно из трех воздействий на продуцирование белка: указанные элементы (1) увеличивают возможность прогнозирования идентификации линий клеток-хозяев, экспрессирующих белок на промышленно приемлемых уровнях (они ослабляют способность смежного гетерохроматина инактивировать данный трансген, благодаря чему место встраивания оказывает менее выраженное воздействие на экспрессию); (2) позволяют получить линии клетокхозяев с более высоким выходом белка и/или (3) позволяют получить линии клеток-хозяев, обеспечивающих более устойчивое продуцирование белка в процессе длительного культивирования. В кассетах экспрессии по настоящему изобретению можно использовать любую последовательность STAR, но особенно пригодными являются следующие последовательности STAR:STAR67 (SEQ ID NO:66),STAR7 (SEQ ID NO:7),STAR9 (SEQ ID NO:9),STAR17 (SEQ ID NO:17),STAR27 (SEQ ID NO:27),STAR29 (SEQ ID NO:29),STAR43 (SEQ ID NO:43),STAR44 (SEQ ID NO:44),STAR45 (SEQ ID NO:45),STAR47 (SEQ ID NO:47),STAR61 (SEQ ID NO:61),функциональные фрагменты или производные указанных последовательностей STAR. В некоторых вариантах осуществления изобретения указанную антирепрессорную последовательность, предпочтительно STAR67, вводят апстрим от указанного промотора, предпочтительно так, чтобы между 3'-концом антирепрессорной последовательности и началом промоторной последовательности находилось менее 2 т.п.о. В предпочтительных вариантах осуществления изобретения между 3'-концом антирепрессорной последовательности и началом промоторной последовательности находится менее 1 т.п.о., более предпочтительно менее 500 нуклеотидов (nt), еще предпочтительнее менее примерно 200,100, 50 или 30 нуклеотидов. В некоторых предпочтительных вариантах осуществления изобретения антирепрессорную последовательность клонируют непосредственно апстрим от промотора, в результате чего между 3'-концом антирепрессорной последовательности и началом промоторной последовательности находится лишь примерно 0-20 нуклеотидов. Для продуцирования мультимерных белков можно использовать две или более кассет экспрессии. Обе кассеты экспрессии предпочтительно являются мультицистронными кассетами экспрессии по настоящему изобретению, каждая из которых кодирует разные селектируемые маркерные белки, благодаря чему возможно обнаружение обеих кассет экспрессии. Данный вариант осуществления изобретения позволяет получить хорошие результаты, например, при экспрессии тяжелой и легкой цепей антител. Очевидно, что обе кассеты экспрессии могут находиться в одной молекуле нуклеиновой кислоты или в отдельных молекулах нуклеиновой кислоты до введения в клетки-хозяева. Преимуществом их введения в одну молекулу нуклеиновой кислоты является то, что обе кассеты экспрессии находятся в заранее определенном соотношении (например, 1:1) при введении в клетки-хозяева. С другой стороны, нахождение в двух разных молекулах нуклеиновой кислоты позволяет изменять молярное отношение двух кассет экспрессии при введении их в клетки-хозяева, что может быть весьма благоприятным, если предпочтительное молярное отношение отличается от 1:1, или когда заранее не известно, каким должно быть предпочтительное молярное отношение, так как в таком случае специалист в данной области может легко изменить существующее отношение и эмпирически определить оптимальное отношение. В соответствии с настоящим изобретением предпочтительно использовать по крайней мере одну из кассет экспрессии,более предпочтительно каждая из них должна содержать хроматинконтролирующий элемент, более предпочтительно антирепрессорную последовательность. В другом варианте осуществления изобретения разные субъединицы или части мультимерного белка находятся в одной кассете экспрессии. Установлено, что вместо или помимо последовательности STAR, расположенной апстрим от промотора в кассете экспрессии, весьма желательно ввести последовательность STAR с обеих сторон кассеты экспрессии так, чтобы кассета экспрессии, содержащая трансген, была фланкирована двумя последовательностями STAR, которые в определенных вариантах осуществления изобретения, по существу,идентичны друг другу.- 15010863 Как показано в настоящем описании изобретения, комбинирование первого антирепрессорного элемента, расположенного апстрим от промотора, с фланкированием кассеты экспрессии двумя другими антирепрессорными последовательностями, позволяет получить более высокие результаты. Так как, по крайней мере, некоторые антирепрессорные последовательности могут быть направленными (WO 00/004704), антирепрессорные последовательности, фланкирующие кассеты экспрессии (антирепрессорные последовательности A и B), предпочтительно могут быть расположены в противоположном направлении относительно друг друга, так, чтобы 3'-конец каждой из указанных антирепрессорных последовательностей был обращен в сторону кассеты экспрессии (и в направлении друг друга). Таким образом, в предпочтительных вариантах осуществления изобретения 5'-концевая сторона антирепрессорного элемента обращена к ДНК/хроматину, благодаря чему уменьшается воздействие на трансген указанного антирепрессорного элемента. В том случае, когда антирепрессорная последовательность расположена апстрим от промотора в кассете экспрессии, 3'-конец обращен к промотору. Последовательности антирепрессорных элементов, приведенные в списке последовательностей (SEQ ID NO:1-66), указаны в 5'-3' направлении, за исключением особо оговоренных случаев. В некоторых вариантах осуществления изобретения использованы единицы транскрипции или кассеты экспрессии, которые дополнительно включают:a) последовательность транзиторной остановки транскрипции (TRAP) апстрим от промотора, стимулирующего транскрипцию мультицистронной единицы транскрипции, которая расположена в 5'-3' направлении;b) последовательность TRAP даунстрим от указанной открытой рамки считывания представляющего интерес полипептида и предпочтительно даунстрим от терминирующей транскрипцию последовательности указанной мультицистронной единицы транскрипции, которая ориентирована в 3'-5' направлении; илиc) обе последовательности по пп.a) и b); причем последовательность TRAP в функциональном отношении определяется как последовательность,которая при введении в единицу транскрипции снижает уровень транскрипции нуклеиновой кислоты,находящейся со стороны 3'-конца последовательности TRAP, по сравнению с уровнем транскрипции,характерным для нуклеиновой кислоты, находящейся со стороны 5'-конца последовательности TRAP. Неограничивающими примерами последовательностей TRAP являются сигналы терминации транскрипции и/или полиаденилирования. Один неограничивающий пример последовательности TRAP приведен в SEQ ID NO:142. Примеры других последовательностей TRAP, способы их обнаружения и применения описаны в публикации WO 2004/055215. Молекулы ДНК, содержащие мультицистронные единицы транскрипции и/или кассеты экспрессии по настоящему изобретению, могут быть использованы для улучшения экспрессии нуклеиновой кислоты предпочтительно в клетках-хозяевах. Термины "клетка-хозяин" и "линия клеток"/"линия клеток-хозяев" обычно означают клетку или гомогенные популяции указанных клеток, которые сохраняются в культуре клеток с помощью методов, известных в данной области, и обладают способностью экспрессировать гетерологичные или гомологичные белки. Для пролиферации и/или выполнения методов рекомбинантных ДНК с помощью молекул ДНК по настоящему изобретению могут быть использованы прокариотические клетки-хозяева, особенно при введении указанных молекул в плазмиды, способные реплицироваться в прокариотических клеткаххозяевах, таких как бактерии. Клетка-хозяин по настоящему изобретению предпочтительно является эукариотической клеткой,более предпочтительно клеткой млекопитающего, такой как клетка грызуна или человека, или гибридной клеткой, полученной из разных клеток. В некоторых неограничивающих вариантах осуществления изобретения указанная клетка-хозяин является клеткой остеосаркомы OS U-2, CHO (клеткой яичника китайского хомячка), HEK 293, миеломы HuNS-I, ретинобластомы WERI-Rb-I, BHK, Vero, несекреторной миеломы мыши Sp2/0-Ag 14, несекреторной миеломы мыши NSO, карциномы надпочечникаNCI-H295R или клеткой PER.C6. В некоторых вариантах осуществления изобретения клетка-хозяин является клеткой аденовируса, экспрессирующей, по крайней мере, E1A и предпочтительно также E1B. В качестве неограничивающего примера можно отметить, что такая клетка может быть получена, например, из клеток человека, в частности из почки (например, клетки HEK 293, см. публикацию Graham et al.,1977), легкого (например, A549, см. публикацию WO 98/39411), сетчатки глаза (например, клетки HER,продаваемые под товарным знаком PER.C6, см. патент США 5994128) или амниоцитов (например,клетки N52.E6, описанные в патенте США 6558948), и аналогичным образом из других клеток. Способы получения таких клеток описаны, например, в патентах США 5994129 и 6558948. КлеткиPER.C6 в соответствии с целями настоящего изобретения означают клетки, полученные в результате прямого или обратного пассажа, или потомство клеток, полученных в результате прямого или обратного пассажа, которые депонированы в ECACC под номером 96022940, т.е. обладающие характеристиками указанных клеток. Ранее было установлено, что такие клетки способны экспрессировать белки на высоких уровнях (см., например, WO 00/63403 и публикацию Jones et al., 2003). В других предпочтительных вариантах осуществления изобретения клетки-хозяева являются клетками CHO, например CHO-K1,- 16010863CHO-S, CHO-DG44, CHO-DUKXB11 и т.п. В некоторых вариантах осуществления изобретения указанные клетки CHO имеют фенотип dhfr-. Такие эукариотические клетки-хозяева способны экспрессировать требуемые полипептиды и часто используются для указанной цели. Указанные клетки могут быть получены путем введения в клетки молекулы ДНК по настоящему изобретению, предпочтительно в форме кассеты экспрессии. Кассету экспрессии предпочтительно встраивают в геном клеток-хозяев в разных положениях в разных клетках-хозяевах и отбирают клон, в котором трансген встроен в нужном положении, в результате чего получают клон клеток-хозяев с требуемыми свойствами в отношении уровней экспрессии, устойчивости, характеристик роста и т.п. Альтернативно может быть целенаправленно или произвольно отобрана мультицистронная единица транскрипции для введения в транскрипционно активную область хромосомы, например, позади промотора, присутствующего в геноме. Клетки, содержащие ДНК по настоящему изобретению, могут быть отобраны путем отбора селектируемого маркерного полипептида при помощи обычных методов, известных специалисту в данной области. После введения мультицистронной единицы транскрипции позади промотора в геноме кассеты экспрессии по настоящему изобретению может быть создана in situ, т.е. в геноме клеток-хозяев. Клетки-хозяева предпочтительно получают из устойчивого клона, который может быть отобран и размножен стандартными методами, известными специалисту в данной области. Культура такого клона способна продуцировать представляющий интерес полипептид, если клетки содержат мультицистронную единицу транскрипции по настоящему изобретению. Клетки по настоящему изобретению предпочтительно выращивают в суспензионной культуре в бессывороточной среде. В предпочтительных вариантах осуществления изобретения молекулу ДНК, содержащую мультицистроннную единицу транскрипции по настоящему изобретению, предпочтительно в форме кассеты экспрессии, встраивают в геном эукариотической клетки-хозяина по настоящему изобретению. Таким образом, достигается устойчивое наследование мультицистронной единицы транскрипции. Наличие селектируемого маркерного полипептида и, следовательно, его экспрессию можно обнаружить на начальной стадии получения клеток, причем экспрессия указанного маркера может быть уменьшена или полностью прекращена после получения устойчивых клонов. Однако агент селекции можно постоянно или периодически использовать на более поздних стадиях, возможно, в меньших количествах, чем на начальной стадии отбора клеток-хозяев. Представляющий интерес полипептид по настоящему изобретению может быть любым белком, в частности мономерным белком или (частью) мультимерного белка. Мультимерный белок имеет по крайней мере две полипептидные цепи. Неограничивающие примеры представляющего интерес белка по настоящему изобретению включают ферменты, гормоны, цепи иммуноглобулина, терапевтические белки,подобные противораковым белкам, белки свертывания крови, такие как фактор VIII, многофункциональные белки, такие как эритропоэтин, диагностические белки или белки или их фрагменты, пригодные для вакцинации, которые должны быть известны специалисту в данной области. В некоторых вариантах осуществления изобретения кассета экспрессии по настоящему изобретению кодирует тяжелую или легкую цепь иммуноглобулина, ее антигенсвязывающую часть, производное и/или аналог. В предпочтительном варианте осуществления изобретения использована единица экспрессии представляющего интерес белка по настоящему изобретению, который является тяжелой цепью иммуноглобулина. В другом предпочтительном варианте осуществления изобретения использована единица экспрессии представляющего интерес белка по настоящему изобретению, который является легкой цепью иммуноглобулина. Когда вышеуказанные единицы экспрессии белка присутствуют в одной клетке-хозяине, образуется мультимерный белок и, в частности, иммуноглобулин. Таким образом, в некоторых вариантах осуществления изобретения представляющий интерес белок является иммуноглобулином,таким как антитело, которое является мультимерным белком. Такое антитело предпочтительно является антителом человека или гуманизированным антителом. В некоторых вариантах осуществления изобретения такое антитело является антителом IgG, IgA или IgM. Иммуноглобулин может быть кодирован тяжелой и легкой цепями в разных кассетах экспрессии или в одной кассете экспрессии. Тяжелая и легкая цепи предпочтительно находятся в разных кассетах экспрессии и имеют свой собственный промотор(который может быть одинаковым или разным для двух кассет экспрессии) и мультицистронную единицу транскрипции по настоящему изобретению, причем тяжелая и легкая цепи являются представляющим интерес полипептидом и кодируют разные селектируемые маркерные белки, поэтому при введении и/или наличии кассет экспрессии в эукариотической клетке-хозяине можно обнаружить кассету экспрессии тяжелой и легкой цепей. Представляющий интерес полипептид может быть получен из любого источника, и в некоторых вариантах осуществления изобретения указанный полипептид является белком млекопитающего, искусственным белком (например, гибридным или мутированным белком) и предпочтительно белком человека. Очевидно, что могут быть использованы разные конфигурации кассет экспрессии по настоящему изобретению, когда конечной целью является продуцирование не представляющего интерес полипептида, а самой РНК, например, для продуцирования из кассеты экспрессии больших количеств РНК, которая может быть использована для регулирования других генов (например, иРНК, антисмысловая РНК), генотерапии, продуцирования белка in vitro и т.д.- 17010863 Одним объектом настоящего изобретения является способ получения клетки-хозяина, экспрессирующей представляющий интерес полипептид, который включает стадии:a) введение во множество клеток-предшественников кассеты экспрессии по настоящему изобретению;b) культивирование полученных клеток в условиях отбора, обеспечивающих экспрессию селектирующего маркерного полипептида; иc) отбор по крайней мере одной клетки-хозяина, продуцирующей представляющий интерес полипептид. Новый способ позволяет получить очень хорошие результаты соотношения полученных клонов и клонов с высокой экспрессией требуемого полипептида. При создании наиболее строгих условий, т.е. условий, обеспечивающих наименьшую эффективность трансляции для селектируемого маркерного полипептида (при использовании самой слабой инициирующей трансляцию последовательности), можно получить гораздо меньше колоний при использовании агента селекции в такой же концентрации, что и в известных системах отбора, при этом относительно большой процент полученных колоний продуцирует представляющий интерес полипептид на высоких уровнях. Кроме того, достигаемые уровни экспрессии превышают уровни экспрессии, имеющие место при использовании большего числа клонов с применением известных систем отбора. Дополнительным преимуществом является то, что данная система отбора позволяет быстро получить результаты, так как она не требует амплификации числа копий трансгена. Таким образом, клетки с низким числом копий мультицистронных единиц транскрипции уже обеспечивают высокие уровни экспрессии. Большое число копий трансгена может быть причиной генетической неустойчивости и индуцированного повторами сайленсинга (см., например, публикации Kim et al., 1998; McBurney et al., 2002). Поэтому дополнительным преимуществом вариантов осуществления настоящего изобретения с использованием относительно низкого числа копий трансгена является то, что меньшее число копий в меньшей степени вызывает рекомбинацию и индуцированный повторами сайленсинг и, следовательно,создает меньше проблем при использовании клеток-хозяев с ограниченным число копий трансгена по сравнению с клетками-хозяевами, полученными с помощью системы амплификации, когда в геноме клетки могут присутствовать сотни или даже тысячи копий кодирующих последовательностей селектируемого маркера и представляющего интерес белка. Настоящее изобретение дает примеры высоких уровней экспрессии с использованием системы отбора мультицистронных единиц транскрипции при относительно низком числе копий трансгена, т.е. менее 30 копий в одной клетке или даже меньшее 20 копий в одной клетке. Таким образом, настоящее изобретение позволяет создать клетки-хозяева по настоящему изобретению, содержащие в геноме менее 30 копий мультицистронной единицы транскрипции, предпочтительно менее 25, более предпочтительно менее 20 копий, обеспечивая в то же время достаточные уровни экспрессии представляющего интерес полипептида для коммерческих целей, например более 15, предпочтительно более 20 пг/клетку/день антитела. Несмотря на получение клонов, характеризующихся относительно низким числом копий мультицистронных экспрессирующих единиц и высокими уровнями экспрессии, система отбора по настоящему изобретению, тем не менее, может быть использована в сочетании с методами амплификации с целью еще большего увеличения уровней экспрессии. Данная цель, например, может быть достигнута путем амплификации одновременно встроенного гена dhfr с использованием метотрексата, в частности путем введения гена dhfr в ту же молекулу нуклеиновой кислоты, что и мультицистронной единицы транскрипции по настоящему изобретению, или путем котрансфекции при нахождении гена dhfr в другой молекуле ДНК. Одним объектом настоящего изобретения является способ получения представляющего интерес полипептида, который включает культивирование клетки-хозяина, содержащей молекулу ДНК, включающую мультицистронную экспрессирующую единицу или кассету экспрессии по настоящему изобретению, и экспрессию представляющего интерес полипептида из последовательности, кодирующей представляющий интерес полипептид. Клетка-хозяин для данного объекта изобретения является эукариотической клеткой-хозяином предпочтительно клеткой млекопитающего, такой как клетка CHO, рассмотренная выше в настоящем описании изобретения. Нуклеиновая кисла, подлежащая экспрессии в клетке, может быть введена одним из нескольких методов, известных специалисту в данной области, которые зависят также от структуры вводимой нуклеиновой кислоты. Указанные методы включают, не ограничиваясь ими, трансфекцию, инфицирование,инъекцию, трансформацию и т.п. Приемлемые клетки-хозяева, экспрессирующие представляющий интерес полипептид, могут быть получены вышеописанным методом отбора. В некоторых вариантах осуществления изобретения агент селекции присутствует в культуральной среде, по крайней мере, на протяжении части времени культивирования в концентрациях, достаточных для отбора клеток, экспрессирующих селектируемый маркерный полипептид, или в более низких концентрациях. В предпочтительных вариантах осуществления изобретения агент селекции отсутствует в культуральной среде на стадии продуцирования, когда происходит экспрессия полипептида.- 18010863 Клетку культивируют таким образом, чтобы обеспечить в ней обмен веществ, рост, деление и/или продуцирование представляющих интерес рекомбинантных белков. Указанная цель может быть достигнута способами, хорошо известными специалистам в данной области, которые включают, не ограничиваясь ими, доставку питательных веществ в клетку. Указанные способы включают выращивание клеток при сцеплении с поверхностями, выращивание клеток в суспензии или комбинации указанных методов. Клетки можно культивировать, например, в чашках, вращающихся колбах или биореакторах с использованием систем периодического или непрерывного действия и т.п. Для достижения крупномасштабного(непрерывного) производства рекоминантных белков в культуре клеток желательно иметь клетки, способные расти в суспензии, и клетки, культивируемые при отсутствии животной или человеческой сыворотки либо компонентов животной или человеческой сыворотки. Специалистам в данной области известны условия выращивания или размножения клеток (см., например, публикацию Tissue Culture, Academic Press, Kruse and Paterson, editors (1973 и условия экспрессии рекомбинантного продукта. С принципами, теорией и практическими методами максимального увеличения продуктивности культур клеток млекопитающих можно ознакомиться в публикации MammalianCell Biotechnology: a Practical Approach (M. Butler, ed., IRL Press, 1991). В предпочтительном варианте осуществления изобретения экспрессированный белок собирают(выделяют) из клеток, культуральной среды или из того и другого вместе. Затем полученный белок может быть очищен известными методами, такими как фильтрация, хроматография на колонках и т.д., которые обычно известны специалисту в данной области. Способ отбора по настоящему изобретению можно использовать при отсутствии хроматинконтролирующих элементов, но более высокие результаты достигаются при наличии таких элементов в мультицистронных экспрессирующих единицах. Способ отбора по настоящему изобретению позволяет получить особенно хорошие результаты при использовании кассеты экспрессии по настоящему изобретению,включающей по крайней мере одну антирепрессорную последовательность. В зависимости от агента селекции и созданных условий отбор в определенных случаях является настолько строгим, что выживает очень мало клеток-хозяев или такие клетки вообще не выживают при отсутствии антирепрессорных последовательностей. Таким образом, новый способ отбора в сочетании с антирепрессорными последовательностями является очень привлекательным способом получения ограниченного числа колоний со значительно большей вероятностью высокой экспрессии представляющего интерес полипептида, причем в то же время полученные клоны, содержащие кассеты экспрессии с антирепрессорными последовательностями, обеспечивают устойчивую экспрессию представляющего интерес полипептида, т.е. они в меньшей степени вызывают сайленсинг или активируют другие механизмы снижения экспрессии по сравнению с обычными кассетами экспрессии. В некоторых вариантах осуществления изобретения почти нельзя получить клоны при отсутствии антирепрессорной последовательности в кассете экспрессии по настоящему изобретению в условиях очень строгого отбора. Новая система отбора, представленная в настоящем описании изобретения, обеспечивает также возможность тестирования функциональности отдельных частей антирепрессорных элементов путем анализа воздействия таких последовательностей, присутствующих в кассетах экспрессии по настоящему изобретения, в условиях отбора. Простой скрининг, обеспечивающий почти полное или даже полное выявление различий во многих случаях, может способствовать идентификации функциональных частей или производных антирепрессорных последовательностей. При тестировании известных антирепрессорных последовательностей данный анализ можно использовать для дальнейшего исследования указанных последовательностей. При испытании фрагментов известных антирепрессорных последовательностей указанный анализ позволяет выявить функциональные фрагменты таких известных антирепрессорных последовательностей. При осуществлении настоящего изобретения использованы, за исключением особо оговоренных случаев, известные методы, применяемые в иммунологии, молекулярной биологии, микробиологии, биологии клеток, и методы рекомбинантных ДНК. См., например, публикации Sambrook, Fritsch andand Lane, eds, 1988. Настоящее изобретение далее рассмотрено в нижеследующих примерах. Приведенные примеры не ограничивают объем изобретения. Они служат для более полного раскрытия сущности изобретения. Примеры В примерах 1-7 описано испытание последовательности STAR67 и других последовательностейSTAR в разных конфигурациях и в разных условиях. В примере 8 и последующих примерах описана новая система отбора по настоящему изобретению. Пример 1. Создание векторов STAR67. Новая антирепрессорная последовательность (STAR) была выделена путем генетического скрининга, описанного в публикации WO 03/004704, и получила название STAR67. Было исследовано воздействие последовательности STAR67 на экспрессию трансгенов в линиях клеток млекопитающих. В данном- 19010863 примере описано создание разных конструкций. Материалы и методы. Были созданы три плазмиды (фиг. 1):C) STAR7-STAR67-CMV-d2EGFP-ires-Zeo-STAR7 (CMV-STAR67 7/7). Ниже описано создание конструкции A. Плазмиду pd2EGFP (Clontech 6010-1) модифицировали путем введения линкера в сайт BsiWI с образованием pd2EGFP-link. Линкер, полученный в результате гибридизации олигонуклеотидов(SEQ ID N0:68), позволял ввести сайты для рестрикционных эндонуклеаз Pad, BglII и EcoRV. Таким образом был создан сайт множественного клонирования MCSII для введения элементов STAR. Затем использовали праймеры GATCAGATCTGGCGCGCCATTTAAATCGTCTCGCGCGTTTCGGTGATGACGG(SEQ ID NO:69) и AGGCGGATCCGAATGTATTTAGAAAAATAAACAAA.TAGGGG (SEQ ID NO:70) для амплификации области, расположенной на расстоянии 0,37 т.п.о. от плазмиды pd2EGFP, которая была введена в сайт BglII плазмиды pIres (Clontech 6028-1) с образованием pIres-stuf. Таким образом были введены сайты для рестрикционных эндонуклеаз Asc1 и Swa1 в положении MCSI, служащие в качестве "заполняющего фрагмента" во избежание возможной интерференции между элементами STAR и смежными промоторами. pIres-stuf расщепляли BglII и Fsp1 для высвобождения фрагмента ДНК, состоящего из заполняющего фрагмента, промотора CMV, элемента Ires (фланкированного сайтами множественного клонирования MCS A и MCS B) и сигнала полиаденилирования SV40. Указанный фрагмент лигировали с остовом вектора pd2EGFP-link, полученным путем расщепления BamEI и Stu1, с образованием pIres-link. Открытую рамку считывания гена устойчивости к зеоцину вводили в сайты BamEI/Not1 даунстрим от pIres следующим образом: открытую рамку считывания гена устойчивости к зеоцину амплифицировали методом PCR с использованием праймеровpIres-link-zeo вводили открытую рамку считывания гена-репортера d2EGFP путем амплификацииAGGCGAATTCACCGGTGTTTAAACTTACACCCACTCGTGCAGGCTGCCCAGG (SEQ ID NO:74) и в сайт EcoRI плазмиды pIres-link-zeo вводили EcoRI-расщепленную кассету d2EGFP. Таким образом была создана конструкция A, CMV-d2EGFP-Ires-Zeo (контрольная плазмида CMV). Последовательность STAR67 клонировали апстрим от промотора CMV в сайте Ascl (междуSTAR67 и промотором оставалось примерно 15 нуклеотидов). Таким образом была создана конструкцияB, STAR67-CMV-d2EGFP-ires-Zeo (CMV-STAR67). Последовательность STAR67 тестировали также вместе с кассетой, содержащей также элементPad для фланкирования всей кассеты последовательностью STAR7. Полученная конструкция является конструкцией C (CMV-STAR67 7/7). Пример 2. Повышение элементом STAR67 уровня экспрессии при использовании промоторовCMV, EF-1 и UB6 в устойчиво трансфицированных клетках CHO. Было проведено исследование, в соответствии с которым исследовали способность последовательности STAR67, расположенной рядом с промоторами CMV, EF-1 и UB6, влиять на уровень экспрессии указанных промоторов в клетках CHO. Для указанной цели использовали конструкции A и B (фиг. 1),описанные в примере 1, которые были модифицированы для соответствующих промоторов: 1) CMV-d2EGFP-Ires-Zeo (контрольная конструкция CMV); 2) STAR67-CMV-d2EGFP-ires-Zeo (CMV-STAR67); 3) EF-1-d2EGFP-Ires-Zeo (контрольная конструкция EF1); 4) STAR67-EF-1-d2EGFP-ires-Zeo (EF-1-STAR67); 5) UB6-d2EGFP-Ires-Zeo (контрольная конструкция UB6); 6) STAR67-UB6-d2EGFP-ires-Zeo (UB6-STAR67). Материалы и методы. Промотор CMV в плазмидах, показанных на фиг. 1, был заменен промоторами UB6 и EF-1. Промотор UB6 клонировали следующим образом. Заполняющий фрагмент ДНК длиной 0,37 т.п.о. из плазмиды pd2EGFP амплифицировали методом PCR, описанным в примере 1, используя праймеры, идентифицированные SEQ ID NO:69 и 70. Полученный заполняющий фрагмент ДНК клонировали в сайте BglII плазмиды pUB6/V5-His [Invitrogen V250-20], в результате чего была создана плазмида pUB-stuf. Фраг- 20010863 мент Asc1-Sac1 из плазмиды pUB-stuf клонировали в конструкции CMV-d2EGFP-ires-Zeo, из которой удаляли промотор CMV. Промотор EF-1 амплифицировали методом PCR с использованием плазмиды pEF-1/V5-His [Invitrogen V920-20] в качестве матрицы и праймеровAGGCGGGACCCCCTCACGACACCTGAAATGGAAG (SEQ ID NO:80). Фрагмент, полученный в результате выполнения PCR, клонировали в сайтах Asc1 и PpuMI конструкции CMV-d2EGFP-ires-Zeo, из которой удаляли промотор CMV. Линию клеток яичника китайского хомячка CHO-K1 (ATCC CCL-61) культивировали в средеHAMS-F12 с 10% фетальной телячьей сыворотки, содержащей 2 мкМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при 37C/5% CO2. Клетки трансфицировали указанными плазмидами, используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями изготовителя. Клетки высевали в сосуды для культивировали и выращивали в течение ночи до 70-90% слияния. Липофектамин объединяли с плазмидной ДНК в отношении 6 мкл на 1 мкг (например, в 10 см чашку Петри вводили 20 мкг ДНК и 120 мкл липофектамина) и добавляли к клеткам. Клетки инкубировали в течение ночи, затем используемую для трансфекции смесь заменяли свежей средой и продолжали инкубировать трансфицированные клетки. Клетки культивировали в течение ночи, обрабатывали трипсином и высевали в чистые сосуды для культивирования со свежей средой. После инкубации в течение еще одной ночи добавляли зеоцин до концентрации, равной 50 мкг/мл, и продолжали культивировать клетки. Через 3 ри дня среду заменяли свежей средой, содержащей зеоцин (100 мкг/мл), и продолжали культивировать клетки. После появления отдельных колоний (примерно через 10 дней после трансфекции) среду удаляли и заменяли свежей средой без зеоцина. Отдельные клоны выделяли и переносили на 24-луночные планшеты в среду без зеоцина. Через один день после выделения колоний в среду добавляли зеоцин. Экспрессию генарепортера d2EGFP оценивали примерно через 3 недели после трансфекции. Уровни экспрессии d2EGFP в колониях измеряли через периоды времени, равные двум неделям. В течение первых двух недель после трансфекции, по истечении которых выполняли первые измерения d2EGFP, колонии культивировали в среде без зеоцина или других антибиотиков. Клетки продолжали культивировать подобным образом в течение всего остального эксперимента. Результаты. На фиг. 2 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора CMV, было получено несколько колоний CHO, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой CMV без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой CMV, было равно 34 при измерении через 25 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях уменьшилось до 13, указывая на неустойчивость экспрессии с течением времени. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой STAR67CMV, было равно 42 при измерении через 25 дней и 32 при измерении через 60 дней после трансфекции. Таким образом, через 60 дней после трансфекции конструкцией CMV, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 2,5 раза выше уровня экспрессии, стимулированной промотором CMV. Важно отметить, что после первого измерения через 25 дней после трансфекции давление отбора было снято путем культивирования колоний в среде без зеоцина. Таким образом, колонии, содержащие конструкцию STAR67, являются более устойчивыми с течением времени при отсутствии давления отбора, чем колонии, не содержащие конструкцию STAR67. На фиг. 3 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора EF10C, было получено несколько колоний CHO, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой EF10C без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой EF10C, было равно 31 при измерении через 25 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях было равно 26. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой EF10C-STAR67, было равно 60 при измерении через 25 дней и 76 при измерении через 60 дней. Таким образом, как через 25 дней, так и через 60 дней после трансфекции конструкцией EF10C, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 2,9 раза выше уровня экспрессии, стимулированной промотором EF10C. На фиг. 4 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора UB6, было получено несколько колоний CHO, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой UB6 без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой UB6, было равно 51 при измерении через 25 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях было равно 29, указывая- 21010863 на неустойчивость экспрессии с течением времени. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой UB6-STAR67, было равно 218 при измерении через 25 дней и 224 при измерении через 60 дней после трансфекции. Таким образом, через 25 дней после трансфекции конструкцией UB6, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 4,3 раза выше уровня экспрессии,стимулированной промотором UB6. Через 60 дней указанный показатель был выше в 7,7 раза вследствие неустойчивой экспрессии в контрольных колониях и устойчивой экспрессии в колониях, трансфицированных UB6-STAR67. Важно отметить, что после первого измерения через 25 дней после трансфекции давление отбора было снято путем культивирования колоний в среде без зеоцина. Таким образом, колонии, содержащие конструкцию STAR67, являются более устойчивыми с течением времени при отсутствии давления отбора по сравнению с колониями, не содержащими конструкцию STAR67. В заключение следует отметить, что STAR67 увеличивает экспрессию при использовании трех разных, неродственных промоторов. Пример 3. Повышение элементом STAR67 уровня экспрессии при использовании промоторовCMV, EF-1 и UB6 в устойчиво трансфицированных клетках PER.C6 Было проведено исследование, в соответствии с которым исследовали способность последовательности STAR67, расположенной рядом с промоторами CMV, EF-1 и UB6, влиять на уровень экспрессии указанных промоторов в клетках, отличных от CHO, а именно в клетках PER.C6 человека. Были использованы конструкции, описанные в примере 1. Материалы и методы. Трансфекция, культивирование и анализ клеток PER.C6. Клетки PER.C6 культивировали в среде DMEM, содержащей пиридоксин, 9% фетальной телячьей сыворотки (неактивированной нагреванием), 89 мкМ MgCl2, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при 37C/10% CO2. Клетки трансфицировали плазмидами, используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями изготовителя. Клетки высевали на 6-луночные планшеты и выращивали в течение ночи до 70-90% слияния. Липофектамин объединяли с плазмидной ДНК в отношении 15 мкл на 3 мкг (например, в 10 см чашку Петри вводили 20 мкг ДНК и 120 мкл липофектамина) и добавляли к клеткам после инкубации в течение 30 мин при 25C. Клетки инкубировали в течение 6 ч, затем используемую для трансфекции смесь заменяли свежей средой и продолжали инкубировать трансфицированные клетки. Клетки культивировали в течение ночи, обрабатывали трипсином и высевали(культуру разводили в отношении 1:15, 1:30, 1:60, 1:120) в чистые чашки Петри (90 мм) со свежей средой, в которую добавляли зеоцин до концентрации, равной 100 мкг/мл, и продолжали культивировать клетки. После появления колоний отдельные колонии выделяли соскабливанием и переносили на 24-луночные планшеты в среду с зеоцином. Клетки выращивали до 70% слияния и переносили на 6 луночные планшеты. Устойчивые колонии размножали в течение 2 недель на 6-луночных планшетах,после чего измеряли сигнал d2EGFP при помощи проточного цитометра XL-MCL Beckman Coulter. Среднее значение сигнала d2EGFP использовали в качестве единицы измерения уровня экспрессииd2EGFP. Колонии измеряли во второй раз через 2 недели. Затем колонии продолжали культивировать без зеоцина. Результаты. На фиг. 5 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора CMV, было получено несколько колоний PER.C6, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой CMV без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой CMV, было равно 37 при измерении через 30 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях уменьшилось до 14,указывая на неустойчивость экспрессии с течением времени. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой STAR67-CMV,было равно 101 при измерении через 30 дней и 45 при измерении через 60 дней после трансфекции. Таким образом, через 60 дней после трансфекции конструкцией CMV, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 3,2 раза выше уровня экспрессии, стимулированной промотором CMV. На фиг. 6 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора EF10C, было получено несколько колоний PER.C6, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой EF10C без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой EF10C, было равно 5 при измерении через 30 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях было равно 6. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой EF10C-STAR67, было равно 25 при измерении через 30 дней и 20 при измерении через 60 дней после трансфекции. Таким образом, как через 30 дней, так и через 60 дней после трансфек- 22010863 ции конструкцией EF10C, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 4 раза выше уровня экспрессии, стимулированной промотором EF10C. На фиг. 7 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора UB6, было получено несколько колоний PER.C6, экспрессирующих значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой UB6 без STAR67. Среднее значение сигнала d2EGFP в 10 колониях, трансфицированных контрольной плазмидой UB6, было равно 4 при измерении через 30 дней после трансфекции. Через 60 дней после трансфекции среднее значение сигнала d2EGFP в указанных 10 колониях было равно 2. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 10 колониях, трансфицированных плазмидой UB6-STAR67, было равно 27 при измерении через 30 дней и 18 при измерении через 60 дней после трансфекции. Таким образом, как через 30 дней, так и через 60 дней после трансфекции конструкцией UB6, содержащей STAR67, уровень экспрессии репортерного белка в устойчиво трансфицированных клонах был в 7-9 раз выше уровня экспрессии, стимулированной промотором UB6. Таким образом, введение последовательности STAR67 апстрим от промотора также позволяет значительно повысить уровни экспрессии белка в клетках PER.C6 по сравнению с конструкциями безSTAR67. Следовательно, последовательность STAR67 действует в разных, неродственных типах клеток. Пример 4. Новая конфигурация STAR67 в сочетании с другими элементами STAR, предназначенная для усиления промотора SV40 в клетках CHO. Было проведено исследование, в соответствии с которым испытывали способность последовательности STAR67, расположенной рядом с промотором SV40, влиять на уровень экспрессии указанного промотора как отдельно, так и в комбинации с другим элементом STAR, в данном примере с элементомSTAR7. Для указанной цели были использованы нижеследующие конструкции (см. фиг. 8): 1) SV40-d2EGFP-ires-Zeo (контрольная плазмида SV40); 2) STAR67-SV40-d2EGFP-ires-Zeo (SV40-STAR67); 3) STAR67-SV40-d2EGFP-ires-Zeo-STAR7 (SV40-STAR 7/7); 4) STAR7-STAR67-SV40-d2EGFP-ires-Zeo-SRAR7 (SV40-STAR67 7/7). Материалы и методы. Промотор SV40 амплифицировали методом PCR с использованием pIres в качестве матрицы и праймеров(SEQ ID NO:82). Фрагмент, полученный в результате выполнения PCR, клонировали в сайтах Asc1 и Sad конструкции CMV-d2FGFP-Ires-Zeo, из которой удаляли промотор CMV. Клетки CHO трансфицировали, колонии выделяли, размножали и анализировали аналогично примеру 2. Результаты. На фиг. 8 показано, что в результате трансфекции конструкцией, содержащей последовательностьSTAR67, клонированную апстрим от промотора SV40 (SV40-STAR67), или последовательность STAR7,клонированную в положении фланкирования всей конструкции (SV40-STAR 7/7), не были получены колонии CHO, экспрессирующие значительно более высокие уровни белка d2EGFP по сравнению с "пустой" контрольной плазмидой без элементов STAR (контрольная плазмида SV40). Среднее значение сигнала d2EGFP в 18 колониях, трансфицированных контрольной плазмидой SV40, было равно 86 при измерении через 40 дней после трансфекции. По сравнению с полученным выше результатом среднее значение сигнала d2EGFP в 18 колониях, трансфицированных плазмидой SV40-STAR67, было равно 82 при измерении через 40 дней и среднее значение сигнала d2EGFP в 18 колониях, трансфицированных плазмидой SV40-STAR 7/7, было равно 91 при измерении через 40 дней. Таким образом, не наблюдалось значительного воздействия указанных элементов STAR на промотор SV40 в клетках CHO. Очевидно, что уровни экспрессии при использовании промотора SV40 в указанных клетках уже являются достаточно высокими и даже гораздо выше, чем при использовании промотора CMV, который считается очень сильным промотором. Такая высокая фоновая экспрессия без элемента STAR при использовании промотора SV40 в клетках CHO может служить объяснением отсутствия значительного воздействия отдельно используемой последовательности STAR67 или последовательности STAR7,фланкирующей трансген. Однако среднее значение сигнала d2EGFP в 18 колониях, трансфицированных плазмидойSV40-STAR67 7/7, было равно 209 при измерении в колониях через 40 дней, что в 2,4 раза выше среднего значения, полученного в 18 контрольных колониях (86). Таким образом, при использовании элементаSTAR67 в комбинации с другим элементом STAR можно получить несколько устойчиво трансфицированных колоний CHO, характеризующихся значительно более высокими уровнями экспрессии d2EGFP. Поэтому в новой конфигурации по настоящему изобретению (5' - последовательность STAR A - последовательность STAR C - промотор - нуклеиновая кислота, кодирующая представляющий интерес белок - последовательность STAR B - 3', в которой последовательности STAR A и B являются элементом- 23010863 Были выполнены эксперименты, в которых фланкирующие элементы STAR7 были заменены фланкирующими элементами STAR6 или фланкирующими элементами STAR4 в комбинации с последовательностью STAR67 апстрим от промотора SV40 (соответственно SV40-STAR67 6/6 и SV40-STAR67 4/4 при использовании вышеуказанной номенклатуры) и при использовании указанных комбинаций также наблюдалась улучшенная экспрессия. Полученный результат подтверждает, что фланкирующие элементы STAR7 действительно могут быть заменены другими последовательностями STAR с созданием улучшенной новой конфигурации кассеты экспрессии с последовательностями STAR. Пример 5. Повышение комбинацией элементов STAR67 и STAR7 уровней UB6-стимулированной экспрессии антитела в устойчиво трансфицированных клетках CHO. В примере 4 было показано, что комбинация STAR67 и STAR7 повышает уровни экспрессии белкаd2EGFP в клетках CHO. В данном примере описан эксперимент, в соответствии с которым исследовали возможность использования комбинации STAR67 и STAR7 для продуцирования антитела. В качестве испытуемого белка было выбрано антитело против молекулы EpCAM (Huls et al., 1999) и использован промотор UB6. Материалы и методы. Плазмиды кДНК тяжелой цепи (НС-EpCAM) клонировали в конструкции, содержащей промоторUB6. НС-EpCAM связывали с геном устойчивости к зеоцину при помощи последовательности Ires. кДНК легкой цепи (LC-EpCAM) также клонировали в конструкции, содержащей промотор UB6.LC-EpCAM связывали с геном устойчивости к пуромицину при помощи последовательности Ires. Две указанные плазмиды вместе являются контрольной плазмидой UB6 (HC+LC) (фиг. 9). Для испытания воздействия STAR67 и STAR7 последовательность STAR67 клонировали в обеих конструкциях HC+LC апстрим от промоторов UB6. Последовательность STAR7 клонировали в положении фланкирования всех кассет экспрессии у 5'- и 3'-конца (фиг. 9). Две указанные плазмиды представляют собой STAR7-STAR67-UB6 (HC+LC) STAR7. Трансфекция и культивирование клеток CHO. Линию клеток яичника китайского хомячка CHO-K1 (АТСС CCL-61) трансфицировали и культивировали аналогично примеру 2, используя для отбора зеоцин (100 мкг/мл) и пуромицин (2,5 мкг/мл). Через 1 день после трансфекции в культуральную среду добавляли зеоцин. После появления первых колоний (примерно через 7 дней после добавления зеоцина) данную культуральную среду удаляли и заменяли культуральной средой, содержащей пуромицин. Примерно через 7 дней колонии выделяли и переносили на 24-луночные планшеты в культуральную среду, содержащую только зеоцин. Результаты. На фиг. 9 показано, что в результате трансфекции конструкциями антитела, содержащими последовательность STAR67, клонированную апстрим от промотора UB6, и два элемента STAR7, клонированных в положении фланкирования всех кассет экспрессии, было получено несколько колоний CHO, экспрессирующих значительно более высокие уровни антитела EpCAM (измерение производили методомELISA с использованием антитела против IgG человека) по сравнению с "пустой" контрольной плазмидой UB6 (HC+LC) без STAR67 и STAR7. Среднее значение продуцирования EpCAM в 18 колониях,трансфицированных контрольной плазмидой UB6 (HC+LC), было равно 2,7 пг/клетку/день при измерении через 25 дней после трансфекции. Агенты селекции зеоцин и пуромицин удаляли через 25 дней. Через 45 дней после трансфекции среднее значение продуцирования EpCAM в указанных 18 колониях было равно 2,7 пг/клетку/день. По сравнению с полученным выше результатом среднее значение сигнала продуцирования EpCAM в 18 колониях, трансфицированных плазмидой STAR7-STAR67-UB6 (HC+LC)STAR7, было равно 6,7 при измерении через 25 дней и 7,7 пг/клетку/день при измерении через 45 дней после трансфекции. Таким образом, как через 25, так и через 45 дней после трансфекции конструкциейCHO был в 2,5-2,9 раз выше уровня экспрессии, стимулированной промотором UB6. Таким образом, введение последовательности STAR67 апстрим от промотора и двух элементовSTAR7 в положении фланкирования кассет экспрессии позволило значительно повысить уровни экспрессии антитела EpCAM в клетках CHO по сравнению с конструкциями без STAR67/STAR7. Пример 6. Отсутствие у STAR67 активности блокатора энхансера и наличие указанной активности у элементов STAR6 и STAR7. Все ранее известные элементы STAR, которые испытывали с целью определения данного свойства,включая STAR6 и STAR7, являются блокаторами энхансера (WO 03/004704, Kwaks et al., 2003). Активность блокатора энхансера испытывают путем введения элемента STAR между сильным энхансером и промотором. В данном примере описано испытание с целью определения возможной активностиNco1 и Xba1 для замены гена люциферазы с образованием конструкции плазмида pGL3-промотор-GFP. Линкер (созданный путем гибридизации олигонуклеотидовGATCAGCTAGCCCAAGGCGCGCCACTAGTAGATCTCCAAGATATCGAGCT (SEQ ID NO:78) клонировали в сайтах Sad и BglII с образованием сайтов множественного клонирования. Первоначальный сайт BglII разрушали в процессе лигирования линкера с образованием нового уникального сайта BglII в линкерной ДНК. Энхансер SV40 вырезали из плазмиды pGL3-basic (Promega),используя BsaBI и BamHI, и клонировали в конструкции pGL3-линкер-промотор-GFP, используя сайтыEcoRV и BglII, с образованием конструкции плазмида pGL3-энхансер-промотор-GFP. Элемент STAR40 вводили апстрим от энхансера SV40, используя сайты Kpn1 и Sac1 для предотвращения воздействия энхансера на расположенные выше последовательности. И, наконец, элементы STAR 6, 1 и 67 вводили между энхансером SV40 и минимальным промотором SV40, используя сайты рестрикции Spe1 и Asc1. Трансфекция и культивирование клеток CHO. Линию клеток яичника китайского хомячка CHO-K1 (АТСС CCL-61) трансфицировали аналогично примеру 2. Через 1 день после трансфекции измеряли уровни d2EGFP при помощи проточного цитометра Epics XL (Beckman Coulter). Результаты. На фиг. 10 показано, что STAR67 не является блокатором энхансера, в то время как STAR6 иSTAR7 действуют в качестве блокаторов энхансера при выполнении того же анализа. Элементы STAR6,STAR7 и STAR67 клонировали между энхансером SV40 и минимальным промотором SV40 апстрим от гена d2EGFP. Когда элемент STAR клонировали между энхансером и промотором, происходила сильная активация транскрипции (произвольно принятая равной 100%). Когда элементы STAR6 или STAR7 вводили между энхансером и промотором, транскрипция снижалась до фоновых уровней, указывая на то,что STAR6 и STAR7 являются сильными блокаторами энхансера. В отличие от этого при клонированииSTAR67 между энхансером и промотором относительные уровни транскрипции составляли 80% от контрольного значения, указывая на то, что STAR67 не является хорошим блокатором энхансера в отличие от STAR6 и STAR7, а также от других элементов STAR, как было ранее описано в научной литературе(WO 03/004704, Kwaks et al., 2003). Пример 7. Повышение элементом STAR67 уровней UB6- и CMV-стимулированной экспрессии антитела в устойчиво трансфицированных клетках CHO. В примере 5 было показано, что комбинация элементов STAR67 и STAR7 повышает уровни экспрессии антитела EpCAM в клетках CHO в окружении двух разных плазмид, содержащих тяжелую и легкую цепи. В данном примере описан эксперимент, в соответствии с которым исследовали возможность использования STAR67 для продуцирования антитела EpCAM при введение тяжелой и легкой цепей в одну плазмиду. Был произведен одновременный отбор каждого селектируемого маркера. Материалы и методы. Плазмиды кДНК тяжелой цепи (HC-EpCAM), контролируемую промотором UB6, связывали с геном устойчивости к зеоцину при помощи последовательности Ires. кДНК легкой цепи (LC-EpCAM), контролируемую промотором CMV, связывали с геном устойчивости к пуромицину при помощи последовательности Ires. Созданные конструкции в основном соответствуют конструкциям, использованным в примере 5. Две указанные кассеты экспрессии вводили в одну плазмиду так, что транскрипция двух экспрессирующих единиц происходила в противоположных направлениях. В контрольной плазмиде промоторы UB6 и CMV были разделены заполняющим фрагментом длиной 500 п.о. (контрольная плазмидаEpCAM) (фиг. 10). В другой плазмиде последовательность STAR67 вводили между промоторами UB6 иCMV (EpCAM STAR67) (фиг. 10). Трансфекция и культивирование клеток CHO. Линию клеток яичника китайского хомячка CHO-K1 (ATCC CCL-61) трансфицировали и культивировали аналогично примеру 2, используя для отбора зеоцин (100 мкг/мл) и пуромицин (2,5 мкг/мл). В примере 5 производили последовательный отбор в отношении обоих селектируемых маркеров. В отличие от этого в данном примере оба агента селекции одновременно присутствовали в культуральной среде. Через 1 день после трансфекции в культуральную среду добавляли зеоцин и пуромицин. Клетки находились в избирательной среде до выделения колоний (примерно 14 дней после трансфекции). Выделенные колонии переносили на 24-луночные планшеты и клетки культивировали в присутствии зеоцина и пуромицина. Результаты. На фиг. 11 показано, что в результате трансфекции конструкцией антитела, содержащей последовательность STAR67, клонированную между промоторами UB6 и CMV, было получено несколько колонийCHO, экспрессирующих антитело EpCAM (измерение производили методом ELISA с использованием антитела против IgG человека). Среднее значение продуцирования EpCAM в 19 колониях, трансфицированных плазмидой EpCAM STAR67, было равно 9,8 пг/клетку/день при измерении через 25 дней после трансфекции.- 25010863 В отличие от вышеизложенного весьма удивительным было то, что колонии не выживали при трансфекции контрольной плазмидой EpCAM. При выполнении отбора при помощи зеоцина или пуромицина, используемых отдельно, колонии, трансфицированные контрольной плазмидой EpCAM, оставались жизнеспособными. Однако при увеличении давления отбора в результате его приложения как к тяжелой, так и к легкой цепи, в указанных условиях выживали только колонии, содержащие STAR67 в трансфицированной плазмиде. Полученные результаты также показывают, что введение STAR67 оказывает благоприятное воздействие на оба промотора, UB6 и CMV, расположенные апстрим или даунстрим от одного элементаSTAR67. Такой результат свидетельствует о том, что STAR67 может оказывать двунаправленное воздействие. Различие между контрольной плазмидой EpCAM и плазмидой EpCAM STAR67 является ярко выраженным в том смысле, что только трансфекция плазмидой EpCAM STAR67 вызывает образование колоний при высоком давлении отбора. Сделанное открытие предоставляет благоприятную возможность использовать данную плазмиду для идентификации области в STAR67, опосредующей указанное действие. Между промоторами UB6 и CMV, стимулирующими молекулу EpCAM, вводят перекрывающиеся части STAR67 меньшего размера. Если часть STAR67 является функциональной, колонии выживают при одновременном использовании зеоцина и пуромицина в качестве агента селекции. Если часть STAR67 не является функциональной, колонии погибают в идентичных условиях отбора. Таким образом, введение STAR67 апстрим от промотора позволяет значительно повысить уровни экспрессии антитела EpCAM в клетках CHO по сравнению с конструкциями без STAR. Пример 8. Создание и испытание продукта гена устойчивости к зеоцину без внутреннего метионина. Основная идея создания новой системы отбора заключается во введении гена, кодирующего ген устойчивости, апстрим от представляющего интерес гена и использовании одного промотора, стимулирующего экспрессию бицистронной мРНК. Трансляция бицистронной мРНК происходит таким образом,что лишь в небольшом числе случаев трансляции в белок транслируется ген устойчивости и в большинстве случаев в белок транслируется представляющий интерес ген, расположенный даунстрим от вышеуказанного гена. Поэтому эффективность трансляции расположенного апстрим гена устойчивости должна быть сильно уменьшена по сравнению с эффективностью трансляции расположенного даунстрим представляющего интерес гена. Для достижения подобного результата в соответствии с настоящим изобретением могут быть выполнены три условия: 1) ведущая поиск рибосома не должна обнаружить другую последовательность AUG в гене устойчивости мРНК, так как любая расположенная даунстрим последовательность AUG может служить в качестве инициирующего трансляцию кодона, что будет снижать эффективность трансляции второго, расположенного даунстрим представляющего интерес гена. Таким образом, желательно заменить любую последовательность AUG в мРНК гена устойчивости. В том случае, если указанная последовательностьAUG является функциональным кодоном, кодирующим метионин, данная аминокислота должна быть заменена другой аминокислотой, например, лейцином (фиг. 12A и B); 2) инициирующий кодон гена устойчивости должен находиться в плохом окружении (быть частью неоптимальной инициирующей трансляцию последовательности), т.е. рибосомы должны начинать трансляцию с данного инициирующего кодона только в ограниченном числе случаев и, следовательно, в большинстве случаев должны продолжать поиск лучшего, более оптимального инициирующего кодона(фиг. 12C-E). Можно указать три других условия:a) нормальный инициирующий кодон ATG, но находящийся в плохом окружении (TTTATGT)b) кодон GTG, предпочтительно находящийся в оптимальном окружении, может служить в качестве инициирующего кодона (ACCGTGG), фиг. 12D; иc) кодон TTG, предпочтительно находящийся в оптимальном окружении, может служить в качестве инициирующего кодона (ACCTTGG), фиг. 12E. Наиболее строгим условием трансляции является использование кодона TTG с последующим кодоном GTG (фиг. 12). Предполагается, что мРНК зеоцина, содержащая последовательность TTG в качестве инициирующего кодона, должна продуцировать наименьшее количество белка устойчивости к зеоцину и, следовательно, должна сообщать клеткам самую низкую функциональную устойчивость к зеоцину(фиг. 12, 13); 3) нормальный инициирующий кодон (ATG) расположенного даунстрим представляющего интерес гена предпочтительно должен находиться в оптимальном для трансляции окружении (например,ACCATGG) (фиг. 13A-D). Подобное окружение гарантирует, что после выполнения условий 1 и 2 в большинстве случаев инициирующий кодон представляющего интерес гена будет функционировать в качестве инициирующего кодона бицистронной мРНК. В примере 8 выполнено условие 1, т.е. в гене устойчивости к зеоцину один существующий внутренний метионин заменен другой аминокислотой (фиг. 12B-E). Важно, чтобы после такой замены белокZeo по-прежнему сообщал трансфицированным клеткам устойчивость к зеоцину. Так как ранее не было известно, какая аминокислота удовлетворяет указанному критерию, были испытаны три разные аминокислоты: лейцин, треонин и валин. Разные конструкции с разными аминокислотами испытывали в отношении их способности сообщать трансфицированным клеткам устойчивость к зеоцину. Материалы и методы. Создание плазмид. В первоначальной открытой рамке считывания Zeo инициирующий кодон окружен нижеследующей последовательностью: AAACCATGGCC (инициирующий кодон выделен жирным шрифтом;SEQ ID NO:83). Данный кодон является инициирующим кодоном в оптимальном для трансляции окружении (фиг. 12 А). Оптимальное окружение инициирующего кодона открытой рамки считывания Zeo изменяли путем амплификации из плазмиды pCMV-Zeo (Invitrogen V50120) при использовании пары праймеров:AGGCGAATTCAGTCCTGCTCCTCGGC с использованием плазмиды pCMV-Zeo (Invitrogen; V50120) в качесте матрицы. Амплифицированный продукт разрезали NruI-EcoRI и лигировали с pcDNA3, создаваяpZeoATGmut. Первоначальная открытая рамка считывания Zeo содержит последовательность ATG, кодирующую метионин в положении аминокислоты 94 (из 124). Указанную внутреннюю последовательность ATG,кодирующую метионин в положении 94, заменяли, соответственно, лейцином, треонином или валином. Для замены внутреннего кодона для метионина в открытой рамке считывания Zeo кодоном для лейцина (фиг. 12 В) часть открытой рамки считывания Zeo амплифицировали с использованием пары праймеров: Zeo-верхний праймер-MUT (SEQ ID NO:84) и Zeo-LEU-нижний праймер (SEQ ID NO:86)pZeo(leu). Для замены внутреннего кодона для метионина в открытой рамке считывания Zeo кодоном для треонина (не показано, но так же, как на фиг. 12 В) часть открытой рамки считывания Zeo амплифицировали с использованием пары праймеров: Zeo-верхний праймер-MUT (SEQ ID NO:84) и Zeo-THR-нижний праймер (SEQ ID NO:87) AGGCCCCGCCCCCACGGCTGCTCGCCGATCTCGGT GGT GGCCGGC. Продукт PCR разрезали BamHI-Bgl1 и лигировали с pZeoATGmut. Таким образом получали pZeo(thr). Для замены внутреннего кодона для метионина в открытой рамке считывания Zeo кодоном для валина (не показано, но так же, как на фиг. 12 В) (GTG) часть открытой рамки считывания Zeo амплифицировали с использованием пары праймеров: Zeo-верхний праймер-MUT (SEQ ID NO:84) иCAC GCCGG. Продукт PCR разрезали BamHI-Bgl1 и лигировали с pZeoATGmut. Таким образом получали pZeo(val). Трансфекция и культивирование клеток. Линию клеток яичника китайского хомячка CHO-K1 (ATCC CCL-61) культивировали в средеHAMS-F12 с 10% фетальной телячьей сыворотки, содержащей 2 мкМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при 37C/5% CO2. Клетки трансфицировали плазмидами, используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями изготовителя. Клетки высевали в сосуды для культивирования и выращивали в течение ночи до 70-90% слияния. Липофектамин объединяли с плазмидной ДНК в отношении 6 мкл на 1 мкг (например, в 10-см чашку Петри вводили 20 мкг ДНК и 120 мкл липофектамина) и добавляли к клеткам. Клетки инкубировали в течение ночи, затем используемую для трансфекции смесь заменяли свежей средой и продолжали инкубировать трансфицированные клетки. Клетки культивировали в течение ночи, обрабатывали трипсином и высевали в чистые сосуды для культивирования со свежей средой, содержащей зеоцин (100 мкг/мл). После образования отдельных колоний (примерно через десять дней после трансфекции) производили подсчет колоний. Результаты. Клетки CHO-K1 трансфицировали четырьмя плазмидами: 1) pZeo(WT), 2) pZeo(leu), 3) pZeo(thr) и 4) pZeo(val). Клетки отбирали с использованием 100 мкг/мл зеоцина. В результате трансфекции pZeo(leu) было получено такое же число устойчивых к зеоцину колоний, что и при использовании контрольной плазмиды pZeo(WT). При использовании pZeo(thr) и pZeo(val) было получено меньше колоний, но разница не превышала порядок величины. Таким образом, был сделан вывод, что в результате замены внутреннего метионина лейцином, треонином или валином образуется белок устойчивости к зеоцину, который способен сообщать трансфицированным клеткам устойчивость к зеоцину. Плазмида pZeo(leu) была выбрана на произвольной основе в качестве отправной точки для создания разных инициирующих кодонов в открытой рамке считывания Zeo. Таким образом, как будет видно из последующих примеров, метионин инициирующего кодона и внутренний метионин всегда заменяют лейцином как для зеоцина, так- 27010863 и для других селектируемых генов-маркеров. Пример 9. Создание и испытание бицистронных конструкций зеоцин-d2EGEP с дифференциальной эффективностью трансляции. Для создания бицистронной мРНК, содержащей мутированную мРНК устойчивости к зеоцину с более низкой эффективностью трансляции и ген d2EGFP в качестве расположенного даунстрим представляющего интерес гена, сначала оптимизировали инициирующий кодон гена d2EGFP (условие 3 в примере 8). Затем создавали разные варианты гена устойчивости к зеоцину. Различия между указанными вариантами заключаются в том, что они имеют разные инициирующие кодоны с разной эффективностью трансляции (условие 2 в примере 9, фиг. 12C-E). Разные варианты гена устойчивости к зеоцину клонировали апстрим от модифицированного гена d2EGFP (фиг. 13). Материалы и методы. Создание плазмид. Открытую рамку считывания гена-репортера d2EGFP вводили в pcDNA3. Инициирующий кодон кДНК указанного гена d2EGFP окружен последовательностью GAATTCATGGG (инициирующий кодон выделен жирным шрифтом; SEQ ID NO:89), которая не является оптимальной. На первой стадии d2EGFP амплифицировали из pd2EGFP (Clontech 6010-1) с использованием праймеров:AAGGAAAAAAGCGGCCGCCTACACATTGATCCTAGCAGAAG. Полученный продукт теперь содержит инициирующий кодон в оптимальном окружении для трансляции (ACCATGG). Таким образом получали pd2EGFP, после чего открытую рамку считывания Zeo лигировали с pd2EGFP с образованием pZeo-d2EGFP. Следует отметить, что оптимизация инициирующей трансляцию последовательности представляющего интерес гена (в данном случае EGFP в качестве модели гена) не имеет существенного значения, но является предпочтительной для еще большего переключения инициации трансляции на представляющий интерес ген. Были получены конструкции трех классов: 1) ATG в качестве инициирующего кодона в гене устойчивости к зеоцину, но в плохом окружении(TTTATGT) (не показано, но так же, как на фиг. 13B) и с последующей спейсерной последовательностью вместо оптимального кодона ATG (фиг. 13A). Спейсерную последовательность вводят даунстрим от последовательности ATG. B РНК зеоцина (и,возможно, бластицидина) присутствует вторичная структура, вызывающая временную задержку рибосомы. Вследствие этого рибосома иногда может использовать плохой инициирующий кодон, несмотря на его плохую конфигурацию или неоптимальное для инициации трансляции окружение. Таким образом возникает вероятность увеличения трансляции, что в связи с настоящим изобретением снижает строгость отбора. Для уменьшения указанного эффекта и, следовательно, для дальнейшего уменьшения эффективности инициации трансляции вводят спейсерную последовательность, в которой отсутствует вторичная структура (Kozak, 1990). Поэтому в настоящее описании изобретения введен термин "спейсер", который использован в названиях плазмид и праймеров для обозначения наличия такой спейсерной последовательности. Спейсер удаляет "последовательность задержки рибосомы" в положении рядом с инициирующим кодоном, благодаря чему рибосома начинает трансляцию гораздо реже, что повышает строгость отбора по настоящему изобретению. Спейсер вводит в кодирующую последовательность несколько дополнительных аминокислот. Как видно из приведенных примеров, вышеуказанную операцию в некоторых случаях выполняют как для зеоцина, так и для бластицидина. Общая номенклатура плазмид и праймеров в настоящем описании изобретения соответствует следующему принципу: название селектируемого маркерного полипептида выражено, например, Zeo, Blas и т.д.); указан инициирующий кодон (например, ATG, GTG, TTG); при нахождении указанного инициирующего кодона в неоптимальном для инициации трансляции окружении использовано дополнительное обозначение "mut" (такое обозначение обычно используют только для инициирующих кодонов ATG, так как объединение неоптимального окружения с инициирующим кодоном, отличным от ATG, обычно не вызывает достаточной инициации трансляции, необходимой для отбора); при введении спейсерной последовательности позади инициирующего кодона использовано дополнительное обозначение "спейсер" (такое обозначение обычно используют для инициирующих кодонов "ATGmut" селектируемых маркеров Zeo или Blas). Открытую рамку считывания Zeo амплифицировали с использованием пары праймеров:CAGGAGCTAAGGAAGCTAAAGCCAAGTTGACCAGTGAAGTTC (где последовательность, следующая за подчеркнутой последовательностью, включает спейсерную последовательность) иpZeo-ATGmut/спейсер-d2REFP. 2) GTG в качестве инициирующего кодона в гене устойчивости к зеоцину вместо ATG (фиг. 13 С).- 28010863 Открытую рамку считывания Zeo амплифицировали с использованием пары праймеров:pZeo-GTG-d2EGFP. 3) TTG в качестве инициирующего кодона в гене устойчивости к зеоцину вместо ATG (фиг. 130). Открытую рамку считывания Zeo амплифицировали с использованием пары праймеров:pZEI-TTG-d2EGFP. Трансфекция, культивирование и анализ клеток CHO. Линию клеток яичника китайского хомячка CHO-K1 (ATCC CCL-61) культивировали в средеHAMS-F12 с 10% фетальной телячьей сыворотки, содержащей 2 мкМ глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина при 37C/5% CO2. Клетки трансфицировали указанными плазмидами, используя липофектамин 2000 (Invitrogen) в соответствии с инструкциями изготовителя. Клетки высевали в сосуды для культивирования и выращивали в течение ночи до 70-90% слияния. Липофектамин объединяли с плазмидной ДНК в отношении 15 мкл на 3 мкг (например, в 10-см чашку Петри вводили 20 мкг ДНК и 120 мкл липофектамина) и добавляли к клеткам после инкубации при 25 С в течение 30 мин. Клетки инкубировали в течение ночи, затем используемую для трансфекции смесь заменяли свежей средой и продолжали инкубировать трансфицированные клетки. Клетки культивировали в течение ночи,обрабатывали трипсином и высевали в чистые сосуды для культивирования со свежей средой. После инкубации в течение еще одной ночи добавляли зеоцин до концентрации равной 50 мкг/мл, и продолжали культивировать клетки. Через 3 дня среду заменяли свежей средой, содержащей зеоцин (100 мкг/мл), и продолжали культивировать клетки. После появления отдельных колоний (примерно через 10 дней после трансфекции) среду удаляли и заменяли свежей средой без зеоцина. Отдельные колонии выделяли и переносили на 24-луночные планшеты в среду без зеоцина. Через один день после выделения колоний в среду добавляли зеоцин. Экспрессию гена-репортера d2EGFP оценивали примерно через 3 недели после трансфекции. Уровни экспрессии d2EGFP в колониях измеряли через периоды времени, равные 2 неделям. Результаты. Клетки CHO-K1 трансфицировали конструкциями, содержащими гены ATGmut/спейсер Zeo(фиг. 13 В), GTG Zeo (фиг. 13 С) и TTG Zeo (фиг. 13D) в качестве селектирующего гена, которые клонировали апстрим от гена-репортера d2EGFP. Три указанные конструкции не содержали элементов STAR(контрольные) или содержали элементы STAR 7 и 67 апстрим от промотора CMV и элемент STAR7 даунстрим от гена d2EGFP (фиг. 14). На фиг. 14 показано, что обе контрольные конструкции (без элементов STAR) с ATGmut/спейсер Zeo (А) и GTG Zeo (В) позволили получить колонии, экспрессирующие белок d2EGFP. Средний уровень экспрессии d2EGFP в 24 колониях с ATGmut/спейсер Zeo был равен 46 и в колониях с GTG Zeo был равен 75. Более высокий средний уровень экспрессии в колониях с GTG Zeo может отражать более высокую строгость отбора при использовании GTG по сравнению сATGmut/спейсер (пример 8). Введение в указанные конструкции элементов STAR 7 и 67 позволило получить колонии с еще более высокими средними уровнями экспрессии d2EGFP. В результате трансфекции конструкцией ATGmut/спейсер Zeo STAR 7/67/7 были получены колонии со средним уровнем экспрессии d2EGFP, равным 118, что в 2,6 раза выше среднего уровня экспрессии в контрольных клетках(46). Введение элементов STAR в конструкцию GTG Zeo вызвало средний уровень экспрессии d2EGFP,равный 99, что в 1,3 раза выше среднего уровня экспрессии в контрольных клетках (75). Важно отметить, что при трансфекции конструкцией TTG Zeo колонии не образовывались. Однако при использовании конструкции TTG Zeo, фланкированной элементами STAR 7 и 67, было получено 6 колоний со средним уровнем экспрессии d2EGFP, равным 576 (фиг. 14C). Таким образом, наибольшая строгость трансляции, вызываемая инициирующим кодоном TTG (фиг. 12), обеспечивает самые высокие уровни экспрессии d2EGFP, как показано на фиг. 13. Полученные результаты также показывают, что строгость отдельно используемой конструкцииTTG Zeo (без элементов STAR), по крайней мере, в некоторых экспериментах является слишком высокой для выживания колоний. Однако при выполнении последующих независимых экспериментов (см. ниже) было обнаружено несколько колоний с данной конструкцией без элементов STAR, из чего следует, что строгость системы отбора с инициирующим кодоном TTG в селектирующем маркере зеоцина не обязательно препятствует обнаружению колоний при отсутствии элементов STAR и что число полученных колоний может быть различным в разных экспериментах. Можно сделать вывод, что использование элементов STAR в комбинации со строгой системой отбора по настоящему изобретению позволяет легко идентифицировать клетки, продуцирующие представ- 29010863 ляющий интерес ген на высоких уровнях. Пример 10. Создание большего числа колоний с конструкцией TTG Zeo STAR и сравнение с конструкцией Ires-Zeo. Результаты, полученные в примере 9, показывают, что конструкция TTG Zeo характеризуется чрезвычайно строгой эффективностью трансляции, которая может быть слишком высокой для сообщения указанным клеткам устойчивости к зеоцину. Масштаб трансфекции был увеличен для исследования возможности выживания некоторых колоний с такими высокими уровнями экспрессии. Увеличение масштаба эксперимента могло также дать ответ на вопрос о возможном повышении высокого среднего уровня экспрессии, обеспечиваемой конструкцией TTG Zeo STAR 7/67/7, при анализе большего числа клеток. Материалы и методы. Клетки CHO-K1 трансфицировали конструкциями, содержащими ген TTG Zeo в качестве селектирующего маркера с использованием элементов STAR 7 и 67 или без них (фиг. 15). Трансфекции, отбор,культивирование и т.д. выполняли аналогично примеру 9 за исключением того, что было использовано в 6 раз больше клеток, ДНК и липофектамина 2000. Трансфекции и отбор производили в чашках Петри. Результаты. На фиг. 15A показано, что в результате трансфекции конструкцией TTG Zeo STAR 7/67/7 было получено много колоний со средним уровнем сигнала d2EGFP, равным 560. Полученное значение было таким же высоким, как в примере 9, за исключением того, что в данном случае анализу были подвергнуты 58 колоний. По сравнению с конструкцией, в которой ген устойчивости к зеоцину вводили после последовательности Ires (фиг. 15 В), средний уровень экспрессии d2EGFP был равен 61, и при введении в такую конструкцию элементов STAR 7 и 67 средний уровень экспрессии d2EGFP был равен 125, что в 2 раза выше уровня экспрессии, вызываемой контрольной конструкцией (фиг. 15 В). Таким образом, среднее значение экспрессии в колониях, содержащих конструкцию TTG Zeo STAR 7/67/7, было в 9,2 раза выше, чем в колониях, содержащих конструкцию Ires-Zeo без элементов STAR, и в 4,5 раза выше, чем в колониях, содержащих конструкцию STAR7/67/7 Ires Zeo. Установлено, что форма кривой для всех экспрессирующих колоний отличается при использовании конструкций TTG Zeo STAR7/67/7 и Ires-Zeo STAR 7/67/7. В первом случае (TTG Zeo) кривая является ровной, в то время как во втором случае (Ires-Zeo) кривая имеет более "экспоненциальную" форму. Горизонтальный участок кривой для TTG Zeo показывает, что клетки достигли максимального уровня экспрессии d2EGFP, выше которого уровни экспрессии d2EGFP становятся токсичными и клетки погибают. Однако позднее было установлено, что высокие значения были близки к максимальному значению, которое можно было обнаружить при соответствующих установках детектора анализатора FACS. При выполнении последующих экспериментов установки анализатора FACS изменяли с целью обнаружения более высоких значений и действительно в некоторых случаях (см. ниже) были измерены более высокие значения по сравнению со значениями, полученными в настоящем эксперименте. Вследствие увеличения масштаба трансфекций были обнаружены три колонии, содержащие конструкцию TTG Zeo без элементов STAR. Уровни экспрессии d2EGFP в указанных колониях были равны 475, 158 и 43. После колония погибла вскоре после выполнения первого измерения. Полученный результат показывает, что конструкция TTG Zeo может сообщать устойчивость к зеоцину, в результате чего образуются колонии, которые в некоторых случаях также характеризуются высокими уровнями экспрессии. Таким образом, новый способ отбора по настоящему изобретению может быть выполнен с использованием кассет экспрессии, не содержащих хроматинконтролирующих элементов, хотя весьма желательно использовать кассеты экспрессии, содержащие по крайней мере один такой элемент, предпочтительно элемент STAR. Полученные результаты показывают, что элементы STAR позволяют создать систему более строгого отбора по настоящему изобретению, аналогичную описанной в данном примере, благодаря чему получают колонии с очень высоким средним уровнем экспрессии белка. Пример 11. Создание и испытание бицистронных конструкций бластицидин-d2EGFP с дифференциальной эффективностью трансляции. Ген устойчивости к бластицидину имеет четыре внутренних кодона ATG, причем ни один из них не кодирует метионин (фиг. 25A). Указанные кодоны ATG необходимо удалить (фиг. 25B), так как они служат в качестве инициирующего кодона при модификации инициирующего кодона ATG (или его окружения), в результате чего образуются пептиды, не соответствующие белку устойчивости к бластицидину. Более важным фактором является то, что указанные кодоны ATG препятствуют эффективной трансляции представляющего интерес гена, который в данном примере в целях иллюстрации представлен d2EGFP. Для удаления внутренних кодонов ATG открытую рамку считывания белка устойчивости к бластицидину сначала амплифицированы с использованием 4 пар праймеров, в результате чего были получены 4 фрагмента белка устойчивости к бластицидину. Были использованы нижеследующие пары праймеров:
МПК / Метки
МПК: C12N 15/67, C12N 15/85, C12N 15/09, C12N 15/79, C12N 5/10, C12N 15/11
Метки: отбор, высоких, экспрессирующих, уровнях, белок, клеток-хозяев
Код ссылки
<a href="https://eas.patents.su/30-10863-otbor-kletok-hozyaev-ekspressiruyushhih-belok-na-vysokih-urovnyah.html" rel="bookmark" title="База патентов Евразийского Союза">Отбор клеток-хозяев, экспрессирующих белок на высоких уровнях</a>
Предыдущий патент: Способ коррекции психосоматических дисфункций
Следующий патент: Улучшенные штаммы e.coli для продуцирования плазмидной днк
Случайный патент: Единое устройство для кулинарной обработки и отрезания мяса "донер-кебаб"


































