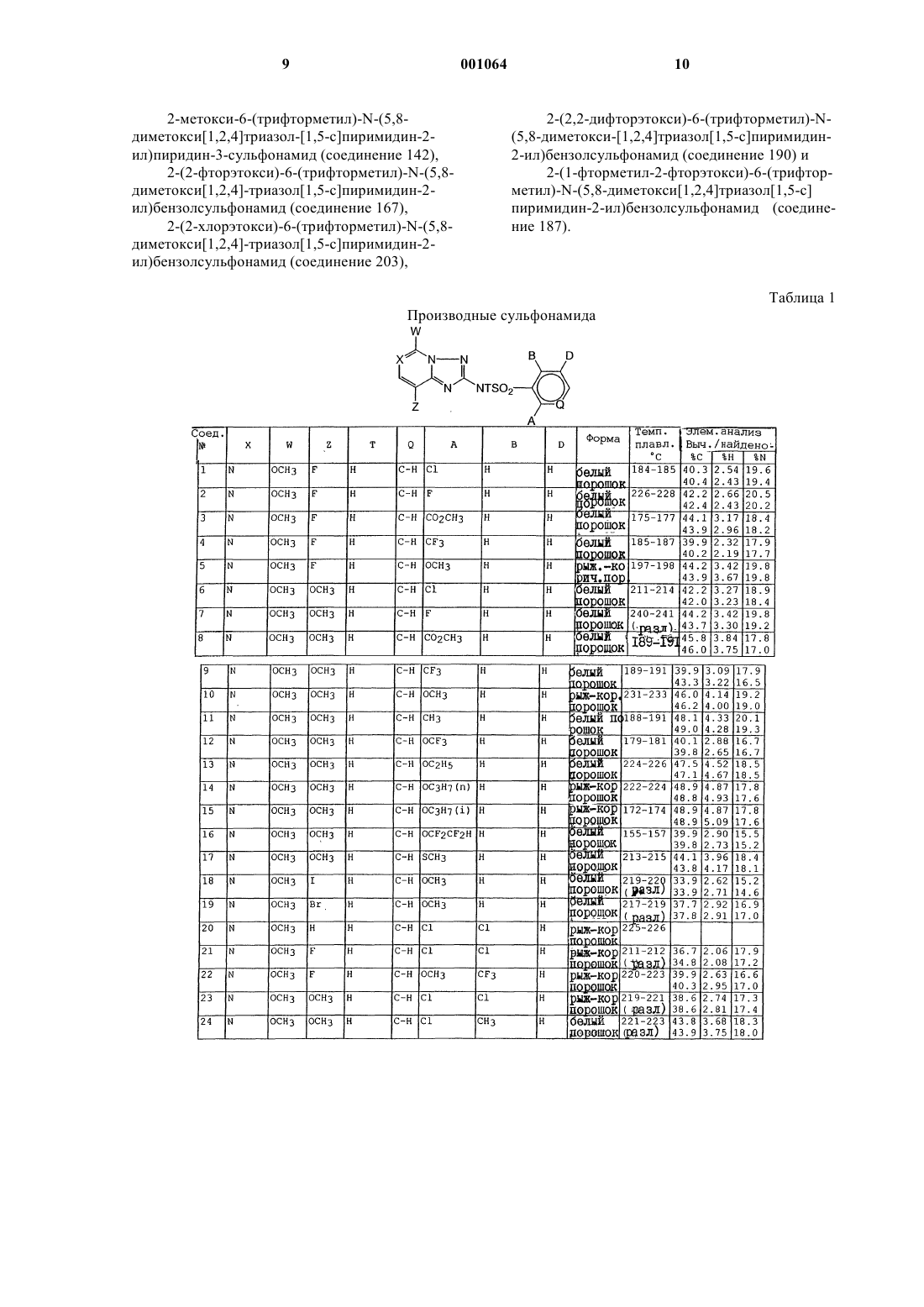
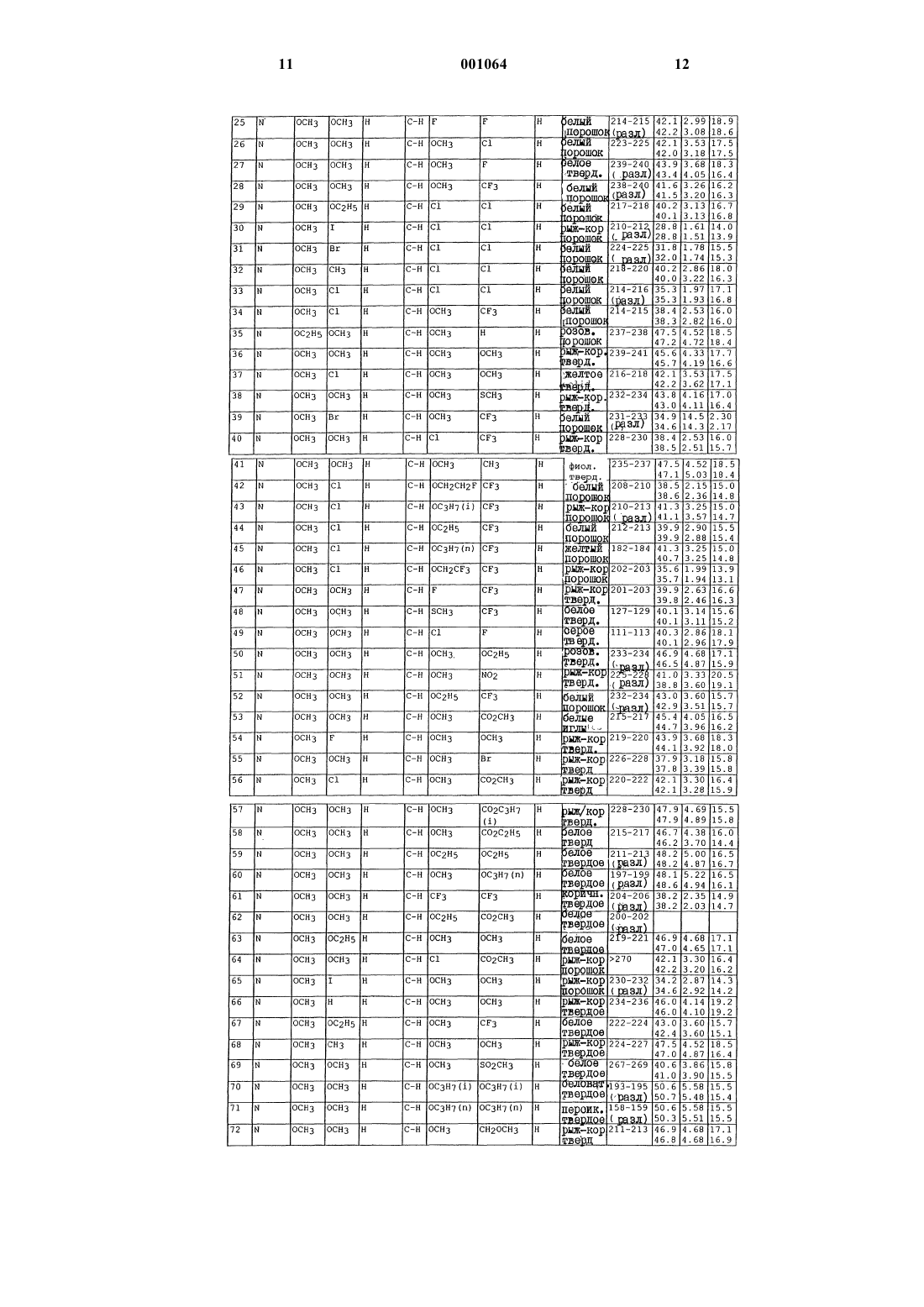
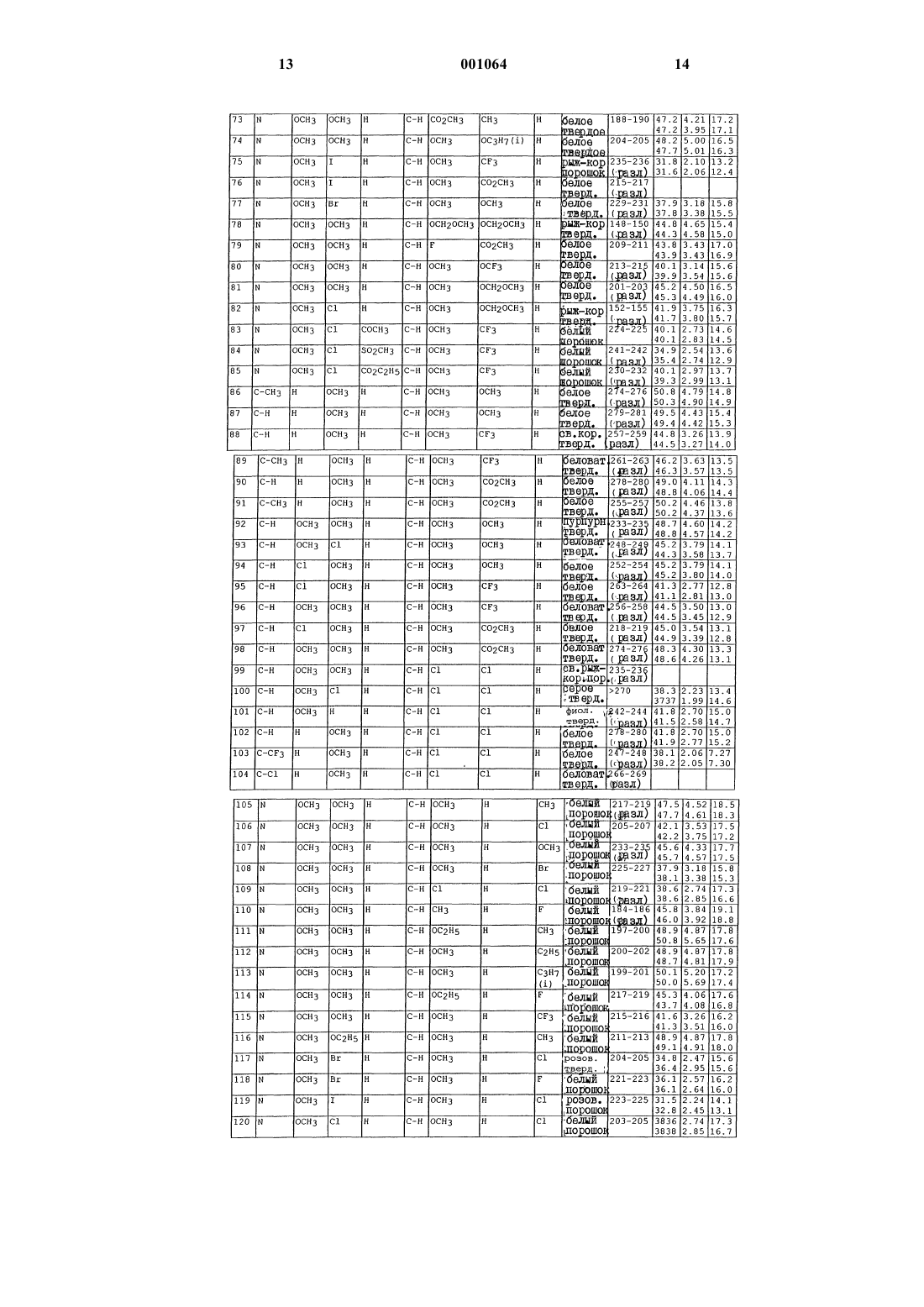
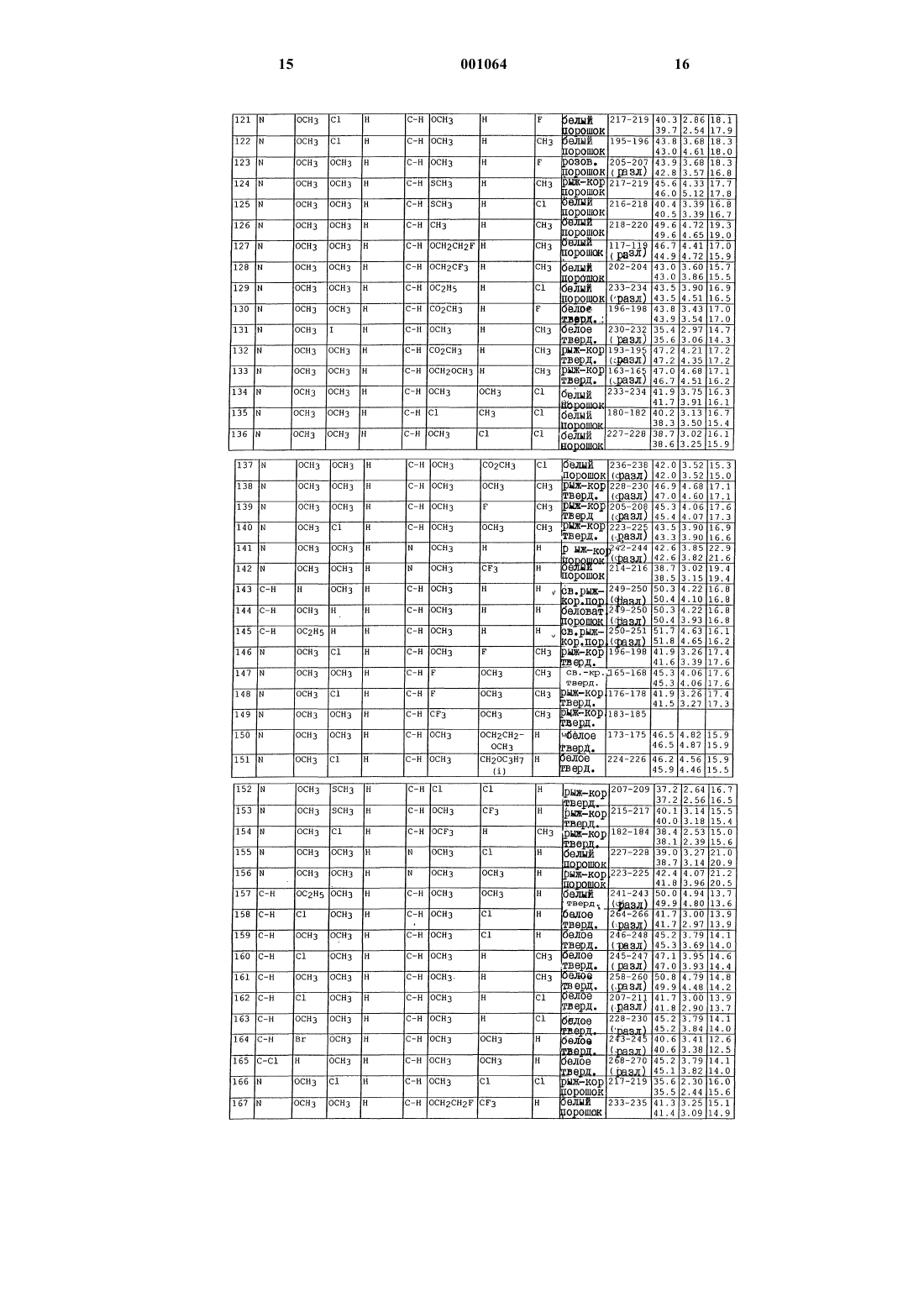
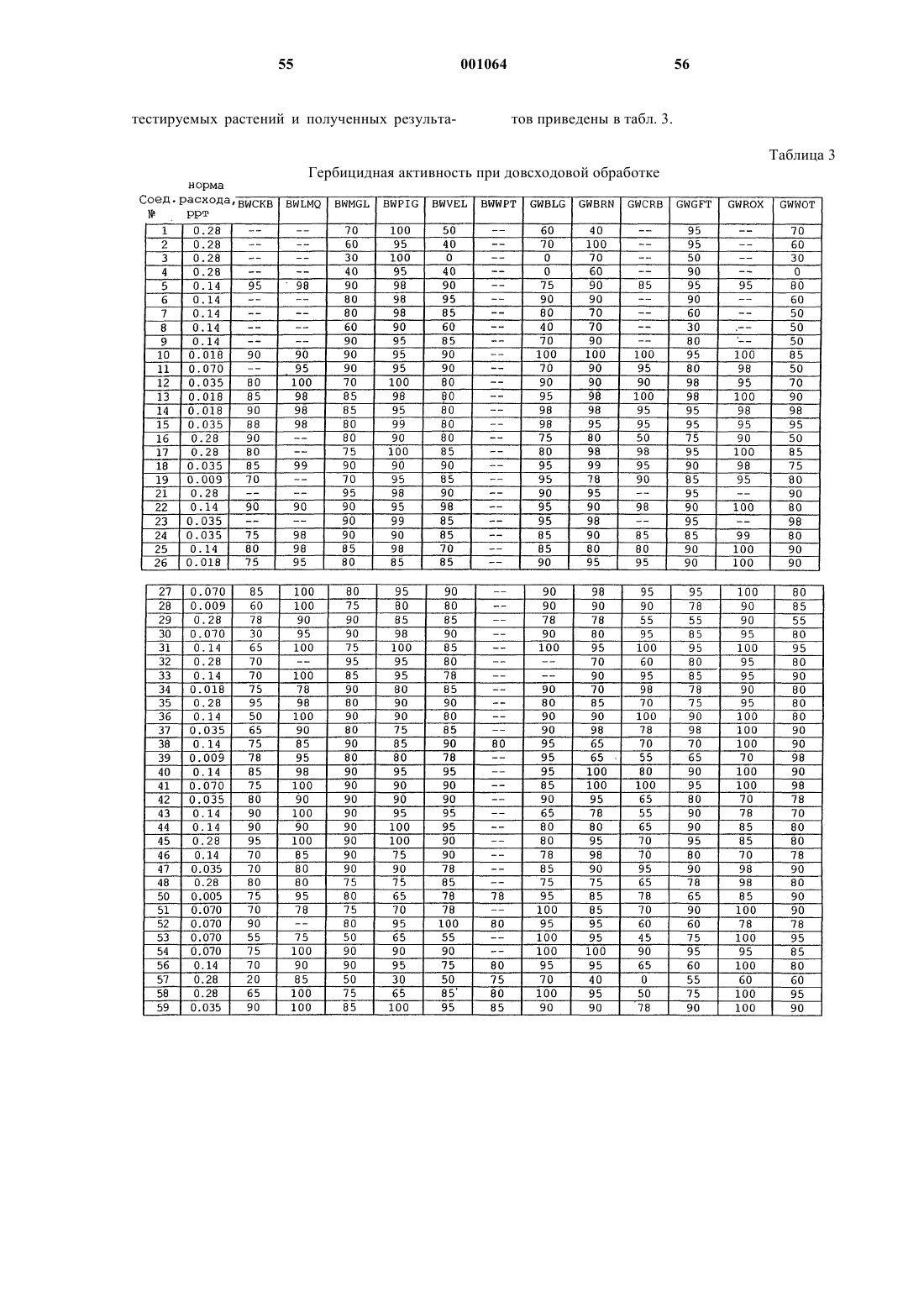
N-([1,2,4]триазолазинил)бензолсульфонамиды и пиридинсульфонамиды и их применение в качестве гербицидов
Номер патента: 1064
Опубликовано: 30.10.2000
Авторы: Клещик Уильям Э., Ван Хиртум Джон К., Эр Роберт Дж., Мартин Тимоти П., Побанц Марк Э., Эш Мэри Л., Джонсон Тимоти К., Джонстон Ричард Д., Манн Ричард К.
Формула / Реферат
1. N-(триазолазинил)арилсульфонамид формулы I
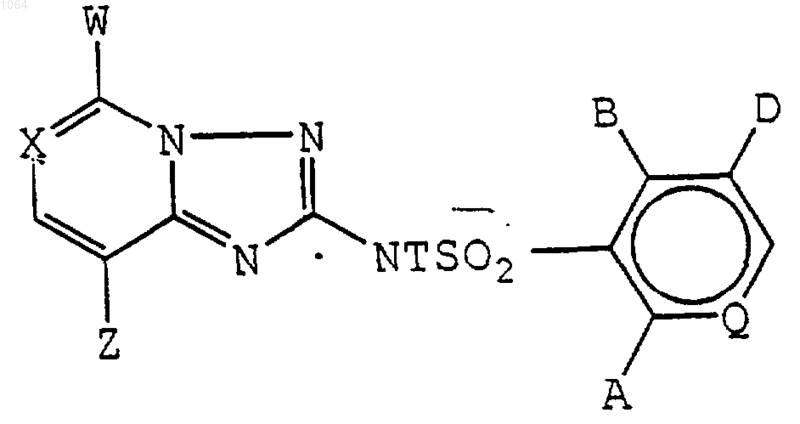
где X представляет собой N или C-Y;
W представляет собой О(C1-С3алкил), Cl, Br, F или Н;
Y представляет собой Н, ОСН3, F, Cl, Br, I или СН3, необязательно содержащий в качестве заместителей до трех атомов фтора;
Z представляет собой О(C1-С3алкил), Н, F, Cl, Br, I, S(C1-С3алкил) или СН3, необязательно содержащий в качестве заместителей до трех атомов фтора; при условии, что, по крайней мере, один из W и Z представляет собой O(C1-С3алкил);
Q представляет собой С-Н или N;
А представляет собой F, Cl, Br, I или СО2(С1-С4алкил), или представляет собой (C1-С3алкил), O(C1-С4алкил), О(C3-С4алкенил), O(С3-С4алкинил) или S(C1-С3алкил), каждый из которых необязательно замещен одним заместителем, представляющим собой O(C1-С3-алкил), S(C1-С3алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества, или представляет собой фрагмент 2-метил-1,3-диоксолан-2-ила, и когда Q представляет собой N, Н;
В представляет собой Н, F, Cl, Br, I, NO2, CN, CO2(C1-С4алкил), NН(C1-С3алкил) или N(C1-С3алкил)2, или представляет собой (C1-С3алкил), O(C1-С4алкил), О(C3-С4алкенил), О(C3-С4алкинил) или S(C1-С3алкил), SO(C1-С3алкил), SO2(C1-С3алкил), S(C3-С4алкенил), SO(C3-С4алкенил), SO2(C3-С4алкенил), S(C3-С4алкинил), SO(C3-С4алкинил) или SO2(C3-С4алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой О(C1-С3алкил), S(C1-С3алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества; при условии, что А и В одновременно не являются водородом;
D представляет собой Н, F, Cl, Вr, I, (C1-С3алкил), ОСН3, ОС2Н5, СН2F, СНF2 или СF3; или В и D, взятые вместе, представляют фрагмент формулы O-СН2-О, необязательно замещенный одним или двумя атомами F или СН3;
Т представляет собой Н, SO2R, C(O)R, С(О)OR, С(O)NR'2 или CH2CH2C(O)OR;
R представляет собой C1-С4алкил, C3-С4алкенил или C3-С4алкинил, каждый из которых необязательно имеет до двух заместителей, представляющих собой хлор, бром, O(С1-С4алкил) или фенил, и необязательно замещен атомами фтора до максимально возможного их количества; и R' представляет собой Н, С1-С4алкил, С3-С4алкенил или С3-С4алкинил; и
когда Т представляет собой Н, их сельскохозяйственно приемлемые соли.
2. Соединение по п.1, где Т представляет собой водород.
3. Соединение по п.1, где Х представляет собой N и Q представляет собой С-Н.
4. Соединение по п.1, где W представляет собой метокси и Z представляет собой метокси, фтор, хлор или бром.
5. Соединение по п.1, где А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси, 1-(фторметил)-2-фторэтокси, трифторметокси, хлор или фтор; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, метоксиметил, метилтио, метил, трифторметил, трифторметокси, фтор, хлор или метоксикарбонил; и D представляет водород, фтор, хлор, бром или метил.
6. Соединение по п.5, где В представляет собой метокси и D представляет водород; А представляет собой метокси и D представляет водород, метил или хлор; или В представляет собой трифторметил и D представляет водород.
7. Соединение по п.1, где Q представляет собой С-Н и А представляет собой метокси, этокси, пропокси или 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси или 1-(фторметил)-2-фторэтокси; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, метоксиметил, трифторметил, фтор, хлор или метоксикарбонил; и D представляет водород, хлор или метил; или где Q представляет собой N и А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси или 1-(фторметил)-2-фторэтокси; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, трифторметил или метоксикарбонил; и D представляет водород или метил.
8. Соединение по п.1, которое выбирают из группы, включающей следующие соединения:
2-метокси-6-(трифторметил)-N-(8-хлор-5-метокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид;
2,6-диметокси-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид;
2-метокси-6-метоксикарбонил-N-(5,8-диметокси[1,2,4]триазол[1,5-а]пиридин-2-ил)бензолсульфонамид;
2-метокси-5-метил-N-(5,8-диметокси[1,2,4]триазол[1,5-с]-пиримидин-2-ил)бензолсульфонамид;
5-хлор-2-метокси-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид;
2-метокси-4-(трифторметил)-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)пиридин-3-сульфонамид;
2-(2-фторэтокси)-6-(трифторметил)-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид;
2-(2-хлорэтокси)-6-(трифторметил)-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид;
2-(2,2-дифторэтокси)-6-(трифторметил)-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид; и
2-(1-фторметил-2-фторэтокси)-6-(трифторметил)-N-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид.
9. Композиция, отличающаяся тем, что включает гербицидно-эффективное количество N-(триазолазинил)арилсульфонамида по любому из пп.1-8 в смеси с сельскохозяйственно приемлемым наполнителем или носителем.
10. Способ борьбы с нежелательной растительностью, отличающийся тем, что включает применение на растительности или в ее локусе гербицидно-эффективного количества N-(триазолазинил)арилсульфонамида по любому из пп.1-8.
11. Сульфонилхлоридное соединение формулы
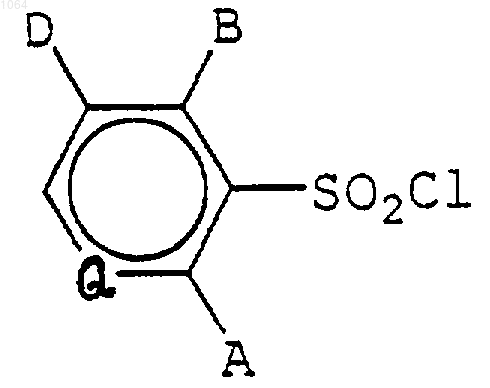
где Q представляет собой N или СН;
А представляет собой F, Cl, Вr, I или CO2(С1-С4алкил), или представляет собой С1-С3-алкил, О(С1-С4алкил), O(С3-С4алкенил), О(С3-С4алкинил) или S(С1-С3алкил), каждый из которых необязательно замещен одним заместителем, представляющим собой группу О(С1-С3-алкил), S(С1-С3алкил), хлор, бром или циано, или атомами фтора в количестве вплоть до максимально возможного, или представляет собой остаток 2-метил-1,3-диоксолан-2-ил;
В представляет собой Н, F, Cl, Br, I, NO2, CN, CO2(С1-С4алкил), NH(С1-С3алкил) или N(С1-С3алкил)2, или представляет собой O(С1-С4алкил), O(С3-С4алкенил), О(С3-С4алкинил), С1-С3алкил, S(С1-С3алкил), SO(С1-С3алкил), SO2(С1-С3алкил), S(С3-С4алкенил), SO(С3-С4-алкениы), SO2(С3-С4алкенил), S(С3-С4алкинил), SO(С3-С4алкинил) или SO2(С3-С4алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой группу O(С1-С3алкил), S(С1-С3алкил), хлор, бром или циано, или атомами фтора в количестве вплоть до максимально возможного;
D представляет собой Н, F, Cl, Вr, I, С1-С3-алкил, ОСН3, ОС2Н5, CH2F, CHF2 или СF3; или В и D, взятые вместе, представляют фрагмент формулы О-СН2-О, необязательно замещенный одним или двумя атомами F или радикалами СН3,
при условии, что, когда Q=N, по меньшей мере, один из А и В представляет собой О(С1-С4алкил), О(С3-С4алкенил) или O(С3-С4алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой группу О(С1-С3алкил), S(C1-С3алкил), хлор, бром или циано, или атомами фтора в количестве вплоть до максимально возможного; и
при условии, что, когда Q=СН, А представляет собой ОСН2СF3, OCH2CHF2, OCH2CH2F, ОСН2СF2СF3, или ОСН(СН2F)2, В представляет СF3 и D представляет Н.
12. Соединение по п.11, где Q представляет собой N, А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси, 1-(фторметил)-2-фторэтокси, трифторметокси, хлор или фтор; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, метоксиметил, метилтио, метил, трифторметил, трифторметокси, фтор, хлор или метоксикарбонил; и D представляет водород, фтор, хлор, бром или метил.
13. Соединение по п.12, где А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси или 1-(фторметил)-2-фторэтокси; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, трифторметил или метоксикарбонил; и D представляет водород или метил.
14. 2-амино[1,2,4]триазол[1,5-с]пиримидин формулы
где W представляет О(С1-С3алкил), хлор, бром, фтор или водород, и
Z представляет O(С1-С3алкил), водород, фтор, хлор, бром, иод, S(С1-С3алкил) или СН3, необязательно содержащий до трех атомов фтора в качестве заместителей;
при условии, что, по крайней мере, один из W и Z представляет собой О(С1-С3алкил).
15. Соединение по п.14, где W представляет собой метокси и Z представляет собой метокси, фтор, хлор или бром.
Текст
1 Изобретение относится к замещенным бензолсульфонамидам и пиридинсульфонамидам, к содержащим их гербицидным композициям и к использованию этих соединений для борьбы с нежелательной растительностью. Борьба с нежелательной растительностью посредством химических средств, т.е. гербицидов, является важным аспектом современного сельского хозяйства и землепользования. Хотя известно большое количество химикатов, полезных для борьбы с нежелательной растительностью, новые соединения, которые, как правило, являются более эффективными, оказывают больший эффект для конкретного вида растений, наносят меньший ущерб культурам, более безопасны для человека и окружающей среды,приводят к меньшим затратам при использовании либо имеют другие преимущества. Известно большое количество замещенных бензолсульфонамидов и известно, что некоторые из них обладают гербицидной активностью. Например, некоторые N-([1,2,4]триазол[1,5-а] пиримидин-2-ил)бензолсульфонамиды и их использование в качестве гербицидов были раскрыты в патенте США 4 638 075, а некоторыеN-([1,2,4]триазол[1,3,5]-триазин-2-ил)бензолсульфонамиды были раскрыты в патенте США 4 685 958. Кроме того, известно, что некоторые известные N-фениларилсульфонамиды также обладают гербицидной активностью. Например,некоторые N-(фенилзамещенные)[1,2,4]триазолN-(фенилзамещенные)[1,2,4]триазол[1,5-а]пиридин-2-сульфонамиды были раскрыты в патенте США 5 571 775, выданном 5 ноября 1996 г. Установлено, что класс новых N(триазолазинил)арилсульфонамидов, включающихN-([1,2,4]триазол[1,5-с]пиримидин-2-ил) бензолсульфонамид,N-([1,2,4]триазол[1,5-с] пиримидин-2-ил)пиридинсульфонамид,N([1,2,4]триазол[1,5-а]пиридин-2-ил)бензолсульфонамид и N-([1,2,4]триазол[1,5-а]пиридин-2 ил)пиридинсульфонамид, относится к потенциальным гербицидам, используемым для борьбы с нежелательной растительностью в условиях либо довсходовой, либо послевсходовой обработки. Многие из этих соединений обладают требуемой селективностью по отношению к ценным культурам и благоприятными токсикологическими свойствами и не оказывают отрицательного воздействия на окружающую среду. Изобретение включает N-(триазолазинил) арилсульфонамиды формулы IY представляет собой Н, ОСНз, F, Cl, Br, I или СНз, необязательно содержащий в качестве заместителей до трех атомов фтора;Z представляет собой O(С 1-С 3 алкил), Н, F,Cl, Вr, I, S(С 1-С 3 алкил) или СН 3, необязательно содержащий в качестве заместителей до трех атомов фтора; при условии, что, по крайней мере, один из W и Z представляет собой О(C1 С 3 алкил);(С 1-С 4 алкил), или представляет собой (C1 С 3 алкил),O(С 1-С 4 алкил),О(С 3-С 4 алкенил),O(С 3-С 4 алкинил) или S(C1-С 3 алкил), каждый из которых необязательно замещен одним заместителем, представляющим собой O(С 1-С 3 алкил),S(C1-С 3 алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества, или представляет собой фрагмент 2 метил-1,3-диоксолан-2-ила, и когда Q представляет собой N, Н; В представляет собой Н, F, Cl, Br, I, NO2,CN, CО 2(C1-C4 алкил), NН(С 1-С 3 алкил) или N(С 1 С 3 алкил)2, или представляет собой (C1-С 3 алкил),О(С 1-С 4 алкил),О(С 3-С 4 алкенил),О(С 3 С 4 алкинил) или S(C1-С 3 алкил), SO(С 1-С 3 алкил),SO2(C1-С 3 алкил),S(С 3-С 4 алкенил),SO(С 3 С 4 алкенил),SO2(С 3-С 4 алкенил),S(С 3 С 4 алкинил), SO(С 3-С 4 алкинил) или SO2(С 3 С 4 алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой O(С 1-С 3 алкил), S(C1-С 3 алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества; при условии, что А и В одновременно не являются водородом;D представляет собой Н, F, Cl, Br, I, (C1 С 3 алкил), ОСН 3 OC2H5, CH2F, CHF2 или СF3; или В и D, взятые вместе, представляют фрагмент формулы O-СН 2-О, необязательно замещенный одним или двумя атомами F или СН 3; Т представляет собой Н, SO2R, C(O)R,С(О)OR, C(O)NR'2 или CH2CH2C(O)OR;R представляет собой С 1-С 4 алкил, С 3 С 4 алкенил или С 3-С 4 алкинил, каждый из которых необязательно имеет до двух заместителей,представляющих собой хлор, бром, О(С 1 С 4 алкил) или фенил, и необязательно замещен атомами фтора до максимально возможного их количества; иR' представляет собой Н, С 1-С 4 алкил, С 3 С 4 алкенил или С 3-С 4-алкинил; и когда Т представляет собой Н, их сельскохозяйственно приемлемые соли. Соединения, где Х представляет собой каждый из N и С-Н, и соединения, где Q представляет собой каждый из N и С-Н, находятся среди предпочтительных соединений настоящего изобретения. Многие из предпочтительных соединений настоящего изобретения имеют метокси-заместитель в положении 5 (W) и метокси 3 или галоген в положении 8 (Z) триазолазинового кольца. Некоторые из предпочтительных соединений дополнительно имеют орто-метоксизаместитель (А или В) в сочетании с множеством заместителей в другом ортоположении (А или В) и водородом в метаположении; ортометоксизаместитель (А) в сочетании с водородом или мета-метилом или хлором (D) и не имеют заместителей в другом ортоположении(В); орто-трифторметильный заместитель (В) в сочетании с множеством заместителей в другом ортоположении (А) и водородом в метаположении. Изобретение дополнительно включает композиции, содержащие гербицидные количества соединений формулы I в сочетании с одним и более сельскохозяйственно приемлемыми наполнителями или носителями и применение соединений формулы I в качестве гербицидов. Применение подходящих соединений, заявленных в настоящем изобретении, для достижения полного или селективного уничтожения растительности или селективной борьбы с сорняками в посевах пшеницы, риса, рапсовых масличных культур, как правило, является предпочтительным. Уничтожению подвергаются как травянистые, так и широколиственные сорняки. Послевсходовая обработка нежелательной растительности этими соединениями, как правило,является предпочтительной. ПроизводныеN-(триазолазинил)арилсульфонамидов, заявленные в настоящем изобретении, в общем виде могут быть представлены в виде соединений, включающих N([1,2,4]триазол-[1,5-с]пиримидин-2-ил)бензолсульфонамид, N-([1,2,4]триазол[1,5-с]пиримидин-2-ил)пиридин-3-сульфонамид,N-([1,2,4] триазол[1,5-а]пиридин-2-ил)бензолсульфонамид иN-([1,2,4]триазол[1,5-а]пиридин-2-ил)пиридин-3-сульфонамид. Они могут быть определены как замещенные бензолсульфонамиды и пиридин-3-сульфонамиды, имеющие на амидном атоме азота фрагмент замещенного Те соединения, у которых Х представляет собой N, содержат фрагмент замещенного N([1,2,4]триазол[1,5-с]пиримидин-2-ила), а те соединения, у которых Х представляет собой CY, содержат фрагмент замещенного N-([1,2,4]триазол[1,5-а]пиридин-2-ила). Соединения, у которых Q представляет собой N, относятся к 4 пиридинсульфонамидам, а соединения, у которых Q представляет собой С-Н, относятся к бензолсульфонамидам. Эти соединения дополнительно характеризуются наличиемC1 С 3 алкоксизаместителя в одном или в обоих положениях 5 и 8 (соответственно, W и Z) триазолазинового кольца и наличием, по крайней мере, одного ортозаместителя (А) на фенильном или пиридиновом кольце. Соединения, заявленные в настоящем изобретении, включают соединения формулы I, где Х представляет собой N или C-Y (где Y представляет собой водород, галоген, метокси или метил, необязательно содержащий в качестве заместителей до трех атомов фтора). Соединения формулы I, где Х представляет собой N,часто являются предпочтительными. Однако соединения, где Х представляет собой С-Н, иногда также являются предпочтительными. Заявленные соединения включают соединения формулы I, где Q представляет собой N или С-Н. Каждый из этих двух вариантов является предпочтительным. Во многих случаях соединения,где Х представляет собой N и Q представляет собой С-Н, являются предпочтительными, в других случаях предпочтительными являются соединения, в которых Х и Q оба представляютN. С другой стороны, в некоторых случаях предпочтительны соединения, где Х представляет C-Y и Q представляет собой С-Н. Триазолазиновое кольцо соединений формулы I является, по крайней мере, монозамещенным. Заявленные соединения включают и те, где W представляет собой метокси, этокси,пропокси, 1-метилэтокси, циклопропокси, фтор,хлор, бром или водород, и где Z представляет метокси, этокси, пропокси, 1-метилэтокси, циклопропокси,метилтио,этилтио,1 метилэтилтио, циклопропилтио, водород, фтор,хлор, бром, иод или метил, необязательно содержащий в качестве заместителей до трех атомов фтора, при условии, что, по крайней мере,один из W и Z представляет собой один из указанных алкоксизаместителей. Соединения, где один из W и Z представляет собой алкокси, а другой представляет фтор, хлор, бром, метил,метокси или этокси, и Х представляет собой N или С-Н, часто являются предпочтительными. Те соединения, где один или оба W и Z представляют собой метокси, часто являются более предпочтительными. Соединения формулы I,где W представляет собой метокси, и Z представляет метокси, хлор или бром, часто являются наиболее предпочтительными. Те соединения, где Х представляет собой N, иногда представляют особый интерес, также как и те соединения, где Х представляет собой С-Н и Z конкретно представляет метокси. Соединения формулы I, где Q представляет собой С-Н, включают те соединения, где А представляет галоген или (C1-C4 алкокси)карбонил, или представляет C1-С 3 алкил, С 1 5 С 3 алкил, С 1-С 4 алкокси, С 3-С 4 алкенокси, С 3 С 4 алкинокси или C1-С 3 алкилтио, каждый из которых необязательно замещен одним заместителем, представляющим собой C1-С 3 алкокси, C1 С 3 алкилтио, хлор, бром или циано, или атомами фтора до максимально возможного их количества. Кроме того, он может представлять собой фрагмент 2-метил-1,3-диоксолан-2-ила. В тех случаях, когда Q представляет собой N, соединения формулы I включают те соединения, где А представляет собой водород. Метокси, этокси,пропокси, 1-метилэтокси, метоксиметокси, 2 фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси, 1(фторметил)-2-фторэтокси,трифторметокси,хлор и фтор часто являются предпочтительными. Метокси, этокси, пропокси или 1 метилэтокси, метоксиметокси, метоксиэтокси,2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси и 1-(фторметил)-2-фторэтокси часто являются более предпочтительными. Метоксизаместитель иногда представляет особый интерес. Соединения формулы I дополнительно включают те соединения, где В представляет собой водород, галоген, нитро, циано, (C1-C4 алкокси)карбонил, C1-С 3 алкиламино, ди (C1 С 3 алкил)амино или представляет C1-С 3 алкил,С 1-С 4 алкокси, С 3-С 4 алкенокси, С 3-С 4 алкинокси,C1-С 3 алкилтио,C1-С 3 алкансульфинил,C1 С 3 алкансульфонил,С 3-С 4 алкенилтио,С 3 С 4 алкенсульфинил, С 3-С 4 алкенсульфонил, С 3 С 4 алкинилтио,С 3-С 4 алкинсульфинил,С 3 С 4 алкинсульфонил, каждый из которых необязательно замещен одним заместителем, представляющим собойC1-С 3 алкокси,C1 С 3 алкилтио, хлор, бром или циано, или атомами фтора до максимально возможного их количества. Те соединения, где Q представляет собой N,и А и В оба представляют водород, исключаются из заявляемых. Таким образом, независимо от того, представляет ли Q азот (N) или группу СН, по крайней мере, один из А и В представляет собой заместитель, отличный от водорода. Такие заместители, как водород, метокси, этокси,пропокси, 1-метилэтокси, метоксиметил, метилтио, метил, трифторметил, трифторметокси,хлор, фтор и метоксикарбонил часто являются предпочтительными заместителями для В. Водород,метокси,этокси,пропокси,1 метилэтокси, метоксиметил, трифторметил,хлор, фтор или метоксикарбонил, как правило,являются более предпочтительными заместителями в тех случаях, когда Q представляет собой группу С-Н и водород, а такие заместители, как метокси, этокси, пропокси, 1-метилэтокси,трифторметил и метоксикарбонил более предпочтительны в тех случаях, когда Q представляет собой N. Метокси и трифторметил часто являются, независимо друг от друга, заместителями для В, которые представляют особый интерес. 6 Соединения, заявленные в настоящем изобретении, дополнительно включают соединения, где D представляет собой водород, галоген,метил, этил, 1-метилэтил, пропил, метокси,этокси, фторметил, дифторметил или трифторметил. Они также дополнительно включают соединения, где В и D вместе представляют фрагмент метилендиокси, необязательно замещенный одним или двумя атомами фтора или метильными группами. Соединения, где D представляет водород, фтор, бром, хлор или метил,являются, как правило, предпочтительными. Соединения, где D представляет водород, хлор или метил, часто являются более предпочтительными в тех случаях, когда Q представляет собой группу С-Н, тогда как те соединения, гдеD представляет водород или метил, обычно являются более предпочтительными в тех случаях,когда Q представляет собой N. Соединения формулы I, где А представляет собой метокси,этокси, пропокси, 1 метилэтокси, метоксиметокси, метоксиэтокси,2-фторэтокси, 2-хлорэтокси, 2,2-дифторэтокси,1-(фторметил)-2-фторэтокси, трифторметокси,хлор или фтор; В представляет собой водород,метокси, этокси, пропокси, 1-метилэтокси, метоксиметил, метилтио, метил, трифторметил,трифторметокси, хлор, фтор или метоксикарбонил; и D представляет водород, хлор, фтор,бром или метил, часто являются предпочтительными. Такие соединения, где В представляет собой метокси и D представляет водород; где А представляет метокси и D представляет водород, метил или хлор; и где В представляет собой трифторметил и D представляет водород, часто представляют особый интерес. Соединения формулы I, где Q представляет собой С-Н и один или оба В и D представляют собой водород, часто являются предпочтительными. Соединения, где Q представляет собой С-Н и А представляет собой метокси, этокси, пропокси или 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси,2,2-дифторэтокси или 1-(фторметил)-2 фторэтокси; В представляет собой водород, метокси, этокси, пропокси, 1-метилэтокси, метоксиметил, трифторметил, фтор, хлор или метоксикарбонил; и D представляет водород, хлор или метил, часто являются более предпочтительными. Такие соединения, где D представляет водород и либо А и В каждый представляет собой метокси, либо А представляет собой метокси, а В представляет трифторметил или метоксикарбонил, иногда представляют интерес независимо друг от друга. Соединения, где Q представляет собой С-Н и А представляет собой метокси, этокси, пропокси или 1-метилэтокси, В представляет водород и D представляет собой хлор или метил, иногда являются предпочтительными. Соединения формулы I, где Q представляет собой N и А представляет собой метокси, 7 этокси, пропокси, 1-метилэтокси, метоксиметокси,метоксиэтокси,2-фторэтокси,2 хлорэтокси,2,2-дифторэтокси или 1(фторметил)-2-фторэтокси; В представляет собой водород, метокси, этокси, пропокси, 1 метилэтокси, трифторметил или метоксикарбонил; и D представляет водород или метил, как правило являются предпочтительными. Соединения, где В представляет собой трифторметил и А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2 дифторэтокси или 1-(фторметил)-2-фторэтокси и D представляет водород, обычно являются более предпочтительными. Соединения формулы I включают те соединения, где Т представляет водород, алкилсульфонил (SO2R), ацил (C(O)R), алкоксикарбонил (C(O)OR), аминокарбонил (C(О)NR'2) или 2(алкоксикарбонил) этил (СН 2 СН 2 С(О)OR), где R представляет собой C1-C4 алкил, С 3-С 4 алкенил или С 3-С 4 алкинил, каждый из которых необязательно имеет до двух заместителей, представляющих собой хлор, бром, С 1-С 4 алкокси или фенил, и необязательно замещен атомами фтора до максимально возможного их количества, и R' представляет собой Н, С 1-С 4 алкил, С 3-С 4 алкенил или С 3-С 4 алкинил. Соединения, где Т представляет собой Н, являются предпочтительными. Изобретение дополнительно включает сельскохозяйственно приемлемые соли соединений формулы I, где Т представляет собой водород. Соединения формулы I, которые обладают каждой из возможных комбинаций, включающих предпочтительные, более предпочтительные, наиболее предпочтительные, желательные и представляющие особый интерес заместители,рассматриваются как важные примеры осуществления настоящего изобретения. Термины "алкил", "алкенил" и "алкинил"(включая их модификации в виде галогеналкила и алкокси) в том виде, как они используются в настоящем изобретении, включают прямые,разветвленные и циклические группы. Следовательно, к типичным алкильным группам относятся метил, этил, 1-метилэтил, пропил, 1,1 диметилэтил и циклопропил. Метил и этил часто являются предпочтительными. Алкильные группы иногда называют в описании нормальными, изо- или вторичными группами (соответственно, с приставкой "н-", "изо-" или "втор-"). Типичный алкил, содержащий в качестве заместителя атомы фтора до максимально возможного их количества, включает трифторметил, монофторметил, 2,2,2-трифторэтил, 2,3-дифторпропил и им подобные; трифторметил часто является предпочтительным. Термин "галоген" включает фтор, хлор, бром и иод. Используемый в описании термин "сельскохозяйственно приемлемые соли" относится к соединениям, где кислый сульфонамидный протон соединения формулы I замещен на катион, 001064 8 который сам по себе не оказывает гербицидного действия на обрабатываемые культуры и не является заметно губительным для специалистаобработчика, окружающей среды или конечного пользователя обработанной культуры. Подходящие катионы включают, например, катионы щелочных и щелочно-земельных металлов и катионы аммония и аминов. Предпочтительные катионы включают катионы натрия, калия, магния и аминия формулыR6R7R8NH+,6 7 8 где R , R и R независимо представляют водород или (C1-C12)алкил, (С 3-C12)циклоалкил или(С 3-С 12)алкенил, каждый из которых необязательно замещен одним или более гидрокси, (C1C8)алкокси, (C1-C8) алкилтио или фенилом; при условии, что R6, R7 и R8 стерически совместимы. Кроме того, два из R6, R7 и R8, взятые вместе, могут представлять собой алифатический бифункциональный фрагмент, содержащий от 1 до 12 атомов углерода и до двух атомов кислорода или серы. Соли соединений формулы I можно получить обработкой соединений формулы I, где V представляет собой водород, гидроксидом металла, например, гидроксидом натрия, калия или магния, или амином, например аммиаком, триметиламином, гидроксиэтиламином, бис-аллиламином, 2-бутоксиэтил-амином,морфолином, циклододециламином или бензиламином. Соединения из табл. 1 являются представителями соединений, заявленных в настоящем изобретении. Некоторые из особо предпочтительных соединений формулы I, которые отличаются разнообразием в зависимости от вида сорных растений, подлежащих уничтожению,вида сельскохозяйственной культуры (если она присутствует) и других факторов, включают следующие соединения из табл. 1: 1, 2, 10, 13,14, 15, 18, 21, 23, 26, 27, 28, 32, 34, 36, 37, 38, 39,41, 43, 46, 50, 52, 53, 54, 55, 60, 63, 65, 77, 80, 81,92, 95, 96, 98, 105, 106, 109, 120, 122, 126, 139,142, 167, 177, 184, 185, 187, 188, 190, 194, 195,203, 208, 210 и 220. Следующие соединения иногда являются более предпочтительными: 2-метокси-6-(трифторметил)-N-(8-хлор-5 метокси[1,2,4]триазол[1,5-с]-пиримидин-2-ил) бензолсульфонамид (соединение 34),2,6-диметокси-N-(5,8-диметокси[1,2,4] триазол[1,5-с]пиримидин-2-ил)бензолсульфонамид (соединение 36),2-метокси-6-метоксикарбонил-N-(5,8 диметокси[1,2,4]триазол[1,5-а]пиридин-2-ил) бензолсульфонамид (соединение 98),2-метокси-5-метил-N-(5,8-диметокси Соединения формулы I, где Т представляет собой водород, получают путем взаимодействия замещенного 2-амино[1,2,4]триазолазина формулы II где А, В, D, Q, W, Х и Z определены выше для соединений формулы I. Реакцию осуществляют путем объединения приблизительно эквимолярных количеств обоих соединений в полярном апротонном растворителе, например ацетонитриле, добавления пиридина и каталитического количества (от 5 до 25 мольных процентов сульфонилхлорида) диметилсульфоксида при комнатной температуре. Для завершения реакции при необходимости вводят добавочное количество сульфонилхлорида, пиридина и диметилсульфоксида. Продолжительность реакции составляет от нескольких часов до нескольких суток до ее полного завершения. Для исключения влаги используют,в частности, атмосферу сухого азота. Полученные соединения формулы I, которые представляют собой твердые вещества с низкой растворимостью во многих общеизвестных органических растворителях и в воде, извлекают стандартными методами. Реакцию конденсации сульфонилхлоридов формулы III и 2-амино[1,2,4]триазолазинов формулы II с успехом осуществляют сначала превращением 2-амино[1,2,4]триазолазина формулы II в N-триалкилсилильное производное формулы IV где W, Х и Z определены выше для соединений формулы I и R" представляет С 1-C4 алкил. Типичными представителями являются 21 производные. Способ сродни со способами, которые раскрыты в патентах США 4910306 и 4666501, но отличается тем, что, обычно, требует использования фторид-ионного стимулятора. Превращение 2-амино[1,2,4]триазолазина формулы II в N-триалкилсилильное производное формулы IV осуществляют путем приготовления смеси хлортриалкилсилана с иодидом натрия или калия в растворителе, таком как ацетонитрил, в отсутствие воды и последующего добавления 2-амино[1,2,4]триазолазина и триалкиламина, например триэтиламина, при температуре окружающей среды и при перемешивании. Обычно используют приблизительно эквимолярные количества хлортриалкилсилана и 2 амино[1,2,4]триазолазина. Реакция продолжается от нескольких часов до суток в зависимости от конкретно вовлеченного в реакцию триалкиламина и 2-амино[1,2,4]триазолазина. Полученные N-триалкилсилильные производные извлекают путем разбавления полученной смеси неполярным растворителем, таким как эфир или 1,2-дихлорэтан, удаления нерастворенных солей фильтрованием и последующего удаления летучих компонентов испарением при пониженном давлении. Соединения формулы IV неустойчивы в присутствии воды и должны храниться в сухом виде. Производные 2-(триалкилсилиламино)[1,2,4]триазолазина формулы IV, полученные по описанной выше методике и другим способом,можно конденсировать с дополнительной очисткой или без нее с сульфонилхлоридом формулы III. Конденсацию обычно осуществляют в растворителе, таком как ацетонитрил, в присутствии приблизительно эквимолярного количества пиридинового или метилпиридинового основания, приблизительно эквимолярного количества фторид-ионного стимулятора, такого как фторид цезия или фторид тетраалкиламмония, и каталитического количества (от 3 до 20% сульфонилхлорида) диметилсульфоксида. Конденсация, которую часто осуществляют при температуре от 10 до 60 С в безводной среде при перемешивании, обычно завершается в течение 218 ч. Полученный N-(триазолазинил)арилсульфонамид формулы I извлекают стандартными методами, такими как фильтрование для отделения твердых частиц и экстракция полученных твердых веществ для удаления водорастворимых солей и/или растворимых органических компонентов.N-(триазолазинил)арилсульфонамиды формулы I, где Т не является водородом, получают из соответствующих соединений формулыI, где Т представляет собой водород, ацилированием в реакционных условиях, известных для родственных реакций ацилирования сульфонамида. Подходящие ацилирующие агенты включают алканоилхлориды, такие как пропионилхлорид или трифторацетилхлорид; хлорформи 001064N',N'-диаллилкарбамоилхлорид, и алкилизоцианаты, такие как 2-хлорэтилизоцианат. Соединения формулы I, где W представляет собой хлор, превращают в соответствующие соединения формулы I, где W представляет фтор, бром, иод, O(С 1-С 3 алкил) или S(C1 С 3 алкил), путем обработки соответствующим нуклеофильным соединением, используя известные стандартные методики проведения таких замещений. Атомы хлора в положении 5 (X) замещаются легче, чем атомы хлора в положении 6 (Y) или в положении 8 (Z), причем их замещение можно осуществлять селективно. Многие 2-амино[1,2,4]триазол[1,5-а]пиридины формулы II (X представляет собой C-Y) получают путем взаимодействия соответствующим образом замещенных N-(2-пиридинил)-N'карбоэтокситиомочевин формулы с гидроксиламином. Реакцию обычно осуществляют в растворителе, таком как этанол, и при нагревании в течение нескольких часов. Гидроксиламин, как правило, получают нейтрализацией гидрохлорида со стерически затрудненным третичным амином, таким как диизопропилэтиламин, или алкоголятом щелочного металла,таким как этилат натрия. Желаемые соединения формулы II извлекают стандартными методами,например удалением летучих компонентов реакционной смеси испарением, и очищают также стандартными методами, например водной экстракцией и/или экстракцией с использованием других растворителей, в которых они умеренно растворимы. N-(2-пиридинил)-N'-карбоэтокситиомочевины в качестве исходных соединений для предлагаемого способа получают путем обработки соответствующим образом замещенных 2-аминопиридинов этоксикарбонилизотиоцианатом. Реакцию обычно осуществляют в инертном органическом растворителе при температуре окружающей среды. Полностью способ описан в патенте США 5 571 775. Замещенные 2-аминопиридины в качестве исходных веществ для описанного выше способа являются известными соединениями или могут быть получены по методикам, раскрытым в описании, или обычными способами, известными из литературы. Соединения формулы II, где Х представляет собой C-Y, кроме того, получают из соответствующим образом замещенных 2-цианоаминопиридинов по методике, описанной авторами B. Vercek et al. в Monatshefte fur Chemie,114, 789-798 (1983). Дополнительные методики получения этих соединений были раскрыты ав 23 торами К.Т. Potts et al. в Journal of Organic где W представляет собой метилтио, водород или хлор, и Z представляет водород, галоген,алкокси или алкилтио. Гидразинпиримидин сначала обрабатывают дицианбромидом для получения гидробромида 3-амино-8-замещенного-5-замещенного[1,2,4]триазол-[4,3-с]пиримидина формулы где W представляет собой метилтио, водород или хлор, и Z представляет водород, галоген,алкокси или алкилтио. Реакцию обычно осуществляют в органическом растворителе, таком как изопропиловый спирт, при температуре окружающей среды. Продукты извлекают стандартными методами, такими как добавление неполярного растворителя, например диэтилового эфира, и отделение твердого вещества фильтрованием. Указанные выше промежуточные соединения, где W представляет собой метилтио, затем превращают в желаемые соединения формулы II, где W представляет собой алкокси, путем обработки алкоголятом щелочного металла, например метилатом натрия или этилатом калия, и этилакрилатом в соответствующем спирте, используемом в качестве растворителя. Соединение подвергают перегруппировке и метилтио-фрагмент замещают на алкокси, получаемый от спирта, входящего в состав среды. Реакцию обычно осуществляют при температуре ниже 25 С. Желаемые соединения формулы II извлекают нейтрализацией с помощью уксусной кислоты и отделением твердого остатка, получаемого путем фильтрования или другого стандартного метода. Соединения формулы II, где Х представляет собой N и W представляет собой водород или хлор, получают из соответствующего [4,3-с]-промежуточного соединения, где W представляет водород или хлор, путем изомеризации с помощью триалкиламинового основания. Исходные 4-гидразинпиримидины для этих способов получают из соответствующих 4 хлорпиримидинов, которые хорошо известны из уровня техники, путем взаимодействия с гидразином. Другие методы получения соединений формулы II, где Х представляет собой N, описа 001064 24 ны в статье G.W. Miller et al., J. Chemical Society, 1965, p. 3357; 1963, р. 5642. Соединения формулы II, где Х представляет собой N, составляет еще один аспект настоящего изобретения. Таким образом изобретение включает 2-амино[1,2,4]триазол[1,5-с]пиримидины формулы где W представляет О(С 1-С 3 алкил), хлор, бром,фтор или водород, и Z представляет O(С 1 С 3 алкил), водород, фтор, хлор, бром, иод, S(C1 С 3 алкил) или метил, необязательно содержащий до трех атомов фтора в качестве заместителей; при условии, что, по крайней мере, один из W иZ представляет собой О(C1-С 3 алкил). Соединения этого типа, где один из W и Z представляет метокси, а другой представляет фтор, хлор,бром, метил, метокси или этокси, часто являются предпочтительным, а такие соединения, гдеW представляет метокси и Z представляет метокси, фтор, хлор или бром, часто являются более предпочтительными. Исходные замещенные бензолсульфонилхлорид и пиридинсульфонилхлорид формулы III получают либо методами, раскрытыми в настоящем описании, либо по общим или конкретным методикам, известным из уровня техники. Многие соединения такого типа, в частности 2-метокси-6-(трифторметил)бензолсульфонилхлорид и 2-метокси-4-(трифторметил)-3 пиридинсульфонилхлорид, получают "литиированием" соответствующего бензола или пиридина (например, 3-трифторметиланизола или 2 метокси-4-трифторметилпиридина) с помощью бутиллития, реакцией полученного фенил- или пиридиниллитиевого производного с дипропилдисульфидом и последующим хлороксидированием полученного пропилтиопроизводного. Используемые условия реакции на каждой из этих реакционных стадий являются общеизвестными для таких процессов такого рода. Многие пропил- и бензилтиобензолы и пиридины получают путем алкилирования соответствующего тиофенола или 3-пиридинтиола с помощью стандартных методик и последующего хлороксидирования. Фенил- и пиридиниллитиевые производные, например, те, что получают из 1,3 диметоксибензола, превращают непосредственно в соответствующие целевые сульфонилхлориды путем взаимодействия с двуокисью серы и сульфурилхлоридом в присутствии N,N,N',N'тетраметилэтилендиамина. Другие целевые сульфонилхлориды,например 2-(1,1,2,2 тетрафторэтокси)бензолсульфонилхлорид, получают путем диазотирования соответствующего анилина или 3-аминопиридина в присутствии двуокиси серы, хлоридов меди и концентрированного водного раствора соляной кислоты. 25 Бензолсульфонилхлориды, такие как 2-метокси 5-метил-бензолсульфонилхлорид,получают прямым хлорсульфированием соответствующих бензольных производных. Производные 3 алкилтиопиридина, имеющие атомы хлора в качестве заместителей в положениях 2 и/или 4,превращают до хлороксидирования в соответствующие соединения, имеющие другие гало- или алкоксизаместители, путем стандартных реакций нуклеофильного замещения для получения других пиридин-3-сульфонилхлоридов. Соединения формулы III, где Q представляет собой N, включающие замещенные пиридин-3-сульфонилхлориды формулыCO2(C1-C4-алкил), или представляет собой (C1 С 3 алкил),O(С 1-С 4 алкил),O(С 3-С 4 алкенил),О(С 3-С 4 алкинил) или S(C1-С 3 алкил), каждый из которых необязательно замещен одним заместителем, представляющим собой О(C1-С 3 алкил),S(C1-С 3 алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества, или представляет собой фрагмент 2 метил-1,3-диоксолан-2-ила; В представляет собой Н, F, Cl, Br, I, NO2,CN, СО 2(С 1-С 4 алкил), NH(C1-С 3 алкил) или N(C1 С 3 алкил)2, или представляет собой (C1-С 3 алкил),O(С 1-С 4 алкил), O(С 3-С 4 алкенил), O(С 3-С 4 алкинил) или S(C1-С 3 алкил), SO(C1-С 3 алкил),SO2(C1-С 3 алкил),S(С 3-С 4-алкенил),SO(С 3 С 4 алкенил),SО 2(С 3-С 4 алкенил),S(С 3 С 4 алкинил), SO(С 3-С 4 алкинил) или SO2(С 3 С 4 алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой О(С 1-С 3 алкил), S(C1-С 3 алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества; при условии, что, по крайней мере, один А и В представляет собой О(С 1-С 4 алкил),О(С 3-С 4 алкенил),О(С 3 С 4 алкинил), каждый из которых необязательно замещен одним заместителем, представляющим собой О(C1-С 3 алкил), S(C1-С 3 алкил), хлор, бром,или атомами фтора до максимально возможного их количества; при условии, что А и В одновременно не являются водородом; иO-СН 2-О, необязательно замещенный одним или двумя атомами F или СН 3, составляют дополнительные аспекты настоящего изобретения. Пиридин-3-сульфонилхлориды формулы III, где А представляет собой метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2-хлорэтокси, 2,2 дифторэтокси,1-(фторметил)-2-фторэтокси,трифторметокси, хлор или фтор; В представляет 26 водород, метокси, этокси, пропокси, 1 метилэтокси, метоксиметил, метилтио, метил,трифторметил, трифторметокси, хлор, фтор или метоксикарбонил; и D представляет водород,фтор, хлор, бром или метил, обычно являются предпочтительными. Такие соединения, где В представляет метокси и D представляет водород; А представляет собой метокси и D представляет водород, метил или хлор; или где В представляет собой трифторметил и D представляет водород, часто являются более предпочтительными. Соединения формулы III, где Q представляет собой N и А представляет метокси, этокси, пропокси, 1-метилэтокси, метоксиметокси, метоксиэтокси, 2-фторэтокси, 2 хлорэтокси, 2,2-дифторэтокси и 1-(фторметил)2-фторэтокси; В представляет водород, метокси,этокси, пропокси, 1-метилэтокси, трифторметил или метоксикарбонил; и D представляет водород или метил, обычно являются наиболее предпочтительными. Хотя N-(триазолазинил)арилсульфонамиды формулы I можно использовать непосредственно в качестве гербицидов, предпочтительно все же осуществлять их применение в виде смесей, содержащих гербицидно-эффективное количество этого соединения, вместе, по крайней мере, с одним сельскохозяйственно приемлемым наполнителем или носителем. Подходящие наполнители или носители не должны быть фитотоксичными по отношению к ценным культурам, в особенности в концентрациях, используемых при применении композиций для селективного уничтожения сорняков в присутствии культурных растений, и не должны химически реагировать с соединениями формулы I или другими ингредиентами композиции. Такие смеси составляют для непосредственного применения на сорняках или в их локусе или готовят на их основе концентраты или препаративные формы, которые обычно разбавляют дополнительным количеством наполнителей или носителей перед применением. Формы могут быть твердыми, такими как, например, дусты, гранулы, вододиспергируемые гранулы или смачивающиеся порошки, или жидкими, такими как,например, концентраты эмульсий, растворы или суспензии. Подходящие сельскохозяйственно приемлемые наполнители или носители, используемые при приготовлении гербицидных смесей, заявленных в настоящем изобретении,хорошо известны специалистам. Применяемые жидкие носители включают воду, толуол, ксилол, петролейный эфир, масло сельскохозяйственных культур, ацетон, метилэтилкетон, циклогексанон, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутилацетат, монометиловый эфир пропиленгликоля и диэтиленгликоля, метанол, этанол, изопропанол,амиловый спирт, этиленгликоль, пропиленгликоль, глицерин, N-метил-2-пирролидон и им подобные. В качестве носителя, используемого 27 для разбавления концентратов, обычно выбирают воду. Подходящие твердые носители включают тальк, пирофиллитовую глину, двуокись кремния, кизельгур, мел, диатомит, известь, карбонат кальция, бентонит, фуллерову землю, шелуху хлопкового семени, пшеничную муку, соевую муку, пемзу, древесную муку, муку из ореховой скорлупы, лигнин и им подобные. В композиции часто желательно включать одно или более поверхностно-активных веществ(ПАВ). Такие ПАВ успешно применяют как в твердых, так и жидких композициях, в особенности такие, которые разбавляют носителями перед использованием. ПАВ по своей природе могут быть анионными, катионными или неионными и использоваться в качестве эмульгаторов, смачивающих и суспендирующих агентов или применяться для других целей. Типичными ПАВ являются соли алкилсульфатов, такие как диэтаноламинлаурилсульфат; алкиларилсульфонаты, такие как додецилбензолсульфонат кальция; продукты реакции присоединения алкилфенола и алкиленоксида, такие как нонилфенол-С 18 этоксилат; продукты реакции присоединения спирта и алкиленоксида,такие как тридециловый спирт-С 1 бэтоксилат; мыла, такие как стеарат натрия; алкилнафталинсульфонатные соли, такие как дибутилнафталинсульфонат натрия; сульфосукцинатные соли диалкиловых эфиров, такие как ди(2-этилгексил)сульфосукцинат натрия; сложные эфиры сорбита, такие как сорбитолеат; четвертичные амины, такие как хлорид лаурилтриметиламмония; полиэтиленгликолевые сложные эфиры жирных кислот, такие как полиэтиленгликольстеарат; блоксополимеры этиленоксида и пропиленоксида; и соли моно- и диалкилфосфатных эфиров. Другие наполнители, используемые в композициях сельскохозяйственного назначения,включают агенты для улучшения совместимости компонентов, противопенные добавки, секвестирующие агенты, нейтрализующие и буферирующие агенты, ингибиторы коррозии, красители, одоранты, растекатели, смачиватели,адгезивы, диспергаторы, загустители, вещества,понижающие точку замерзания, противомикробные агенты и им подобные. Композиции могут включать и другие совместимые компоненты, например другие гербициды, гербицидные антидоты, регуляторы роста растений, фунгициды, инсектициды и им подобные продукты,и могут являться компонентами препаративных форм совместно с жидкими или твердыми сыпучими удобрениями, такими как нитрат аммония, мочевина, и им подобными. Концентрация активных ингредиентов в гербицидных композициях, заявленных настоящим изобретением, составляет обычно от 0,001 до 98 вес.%. Часто используют концентрации приблизительно от 0,01 до 90 вес.%. В компози 001064 28 циях, используемых в виде концентратов, активный ингредиент, как правило, присутствует в количестве приблизительно от 5 до 98%, предпочтительно от 10 до 90 вес.%. Такие композиции перед использованием обычно разбавляют инертным носителем, например водой. Такие композиции, обычно применяемые на сорняках или в их локусе, как правило, содержат примерно от 0,001 до 5 вес.% активного ингредиента и предпочтительно от 0,01 до 0,5 вес.%. Композиции применяют на сорняках или в их локусе с помощью стандартных наземных или воздушных приспособлений для распыления, опрыскивателей, аппликаторов для гранул,внесением ирригационной воды или другими способами, известными специалистам. Было установлено, что соединения формулы I являются полезными в качестве гербицидов для проведения довсходовой (включая предпосевную/предпосадочную) и послевсходовой обработки. Послевсходовая обработка обычно является предпочтительной. Соединения эффективны для борьбы как с широколиственными,так и травянистыми сорняками. Хотя каждый изI находится в объеме настоящего изобретения,степень гербицидной активности, селективность по отношению к культурам и спектр достигаемого действия изменяются в зависимости от присутствующих заместителей и других характеристик. Соединения применяют в высоких неселективных дозах для уничтожения сплошной растительности в зоне. Соединения 10, 13,14, 15, 18, 23, 26, 27, 28, 36, 37, 38, 39, 41, 50, 53,54, 60, 63, 65, 77, 80, 81, 92, 105, 106 и 139 находятся среди соединений, которые представляют особый интерес для этой цепи. Во многих случаях соединения можно также использовать при более низких селективных дозах для борьбы с нежелательной растительностью в травяных культурах, таких как кукуруза, сорго, пшеница,ячмень и рис, а также в широколиственных культурах, таких как масличные рапсовые, соя и хлопок. Их использование для селективного уничтожения травянистых сорняков, таких как ковыль овсоподобный и овсюг, и некоторых широколиственных сорняков в небольших зерновых культурах, таких как пшеница и ячмень,представляет особый интерес. Соединения 28,34, 53, 96, 98, 105 и 142 находятся среди лучших соединений, используемых для этой цели. Многие соединения применяют для удаления широколиственных сорняков из небольших зерновых культур, таких как пшеница. Соединения, представляющие особый интерес для этой цепи,включают соединения 1, 2, 21, 32, 43, 46, 52, 95,109, 120, 122 и 126. Многие соединения применяют для уничтожения широколиственных и травянистых сорняков в рисе. Соединения,представляющие особый интерес для этой цели,включают соединения 167, 177, 184, 185, 187,188, 190, 194, 195, 203, 209, 210, 220, 229 и 233. 29 Нежелательную растительность можно удалить из риса, который непосредственно засеян или пересажен, и выращен либо на затопляемом рисовом поле, либо на возвышенности. Селекцию риса часто улучшают путем применения антидотов. Некоторые соединения, такие как 155 и 106, используют для удаления широколиственных и травянистых сорняков из масличных рапсовых культур. Термин "гербицид" используют здесь для обозначения активного ингредиента, который уничтожает или отрицательным образом модифицирует рост растительности. Гербицидноэффективное или губительное для растительности количество представляет собой такое количество активного ингредиента, которое вызывает отрицательный модифицирующий эффект и обусловливает отклонение растения от естественного развития, его уничтожение, регулирование роста, дессикацию, замедление и им подобные процессы. Термин "растения и растительность" включает проростки семян, всходы и устойчивую растительность. Гербицидная активность у заявленных соединений обнаруживается при их применении непосредственно на растении или в его локусе на любой стадии роста, либо до посадки или появления всходов. Наблюдаемый эффект зависит от вида уничтожаемого растения, стадии его роста, разведения при применении, размера капель раствора для опрыскивания, размера частиц твердых компонентов, состояния окружающей среды в момент применения, конкретного соединения, природы используемых наполнителей и носителей и других факторов, а также от количества химического вещества. Эти и другие факторы можно подобрать на основе известных знаний в этой области с тем, чтобы способствовать неселективному или селективному гербицидному действию. Вообще, предпочтительно применять соединения формулы I в условиях послевсходовой обработки по отношению к еще неразвитым растениям для того, чтобы достигнуть максимального уничтожения сорняков. Нормы расхода, используемые при послевсходовой обработке, обычно составляют приблизительно от 0,001 до 1 кг/га, а при довсходовой обработке - приблизительно от 0,01 до 2 кг/г. Более высокие нормы расхода обычно назначают для неселективного уничтожения широкого ряда представителей нежелательной растительности. Более низкие дозы обычно дают селективное уничтожение, поэтому благодаря разумному выбору соединений, рациональным времени обработки и норм расхода их можно применять в локусе культурных растений. Соединения формулы I часто применяют в сочетании с одним и более другими гербицидами для того, чтобы достигнуть уничтожения еще более широкого ряда сорняков. При использовании с другими гербицидами примене 001064 30 ние заявленных соединений осуществляют путем приготовления препаративных форм с другим гербицидом или гербицидами, смешивания в смесительном резервуаре с другим гербицидом или гербицидами или путем последовательного применения их с другим гербицидом или гербицидами. Некоторые гербициды, которые можно с выгодой использовать в сочетании с заявленными соединениями, включают замещенные триазолпиримидинсульфонамиды, такие как N-(2,6-дихлорфенил)-5-этокси-7-фтор[1,2,4]триазол[1,5-с]пиримидин-2-сульфонамид(клорансуламметил) и N-(2,6-дифторфенил)-5-метил-[1,2,4] триазол[1,5-а]пиримидин-2-сульфонамид (флуметсулам). Можно использовать и другие гербициды, такие как ацифлуфен, бентазон, хлоримурон, кломазон, лактофен, карфентразонметил, фумиклорак, флуметурон, фомезафен,имазакин, имазетапир, линурон, метрибузин,флуазифоп, галоксифоп, глифосат, глуфозинат,2,4-Д, ацетохлор, метолахлор, сетоксидим, никосульфурон, клопиралид, флуроксипир, метсульфуронметил, амидосульфурон, трибенурон и другие. Как правило, предпочтительно использовать соединения в сочетании с другими гербицидами, которые обладают аналогичной селективностью по отношению к культурам. Кроме того, как правило, предпочтительно применять гербициды в одно и тоже время, либо в виде комбинированной препаративной формы,либо в виде смеси, приготовленной в смесительном резервуаре. Для усиления селективности соединения,заявленные в настоящем изобретении, обычно применяют в комбинации с широким рядом гербицидных антидотов, такими как клокинтокет, мефенпир, фурилазол, диклормид, беноксакор, флуразол, флуксофеним, даймурон, димепиперат, тиобенкарб и фенклорим. Гербицидные антидоты, действие которых основано на изменении метаболизма гербицидов в растениях благодаря усилению активности цитохром Р-450 оксидаз, являются особенно эффективными. Часто это является предпочтительным предметом осуществления изобретения. Соединения можно дополнительно использовать для уничтожения нежелательной растительности во многих культурах, которые толерантны или устойчивы к гербицидам благодаря проведенной генетической манипуляции или мутации и селекции. Например, ими могут быть обработаны кукуруза, пшеница, рис, соя, сахарная свекла,хлопок, канола и другие культуры, которых сделали толерантными или устойчивыми к гербицидам вообще или к гербицидам, ингибирующим фермент ацетолактат синтазу в чувствительных растениях. 31 Примеры Примеры представлены для иллюстрации различных аспектов настоящего изобретения и не служат каким-либо ограничением формулы изобретения. Принятые условные обозначения в спектрах ЯМР: s - синглет; m - мультиплет; t - триплет; d - дублет; dd - двойной дублет; brs - широкий синглет; ddd - тройной дублет; q - квадруплет; 1. Получение 2-пропилтио-3-(трифторметил)анизола. Раствор, содержащий 30 мл (208 ммоль) 3(трифторметил)анизола в 500 мл сухого тетрагидрофурана охлаждают до -70 С под азотной подушкой и к нему медленно добавляют при перемешивании и охлаждении 100 мл (250 ммоль) 2,5 М бутиллития в гексане. Красноватый раствор перемешивают при -70 С в течение 1 ч и затем медленно при перемешивании и охлаждении добавляют 42 мл (270 ммоль) дипропилдисульфида. Полученную смесь оставляют на 18 ч до достижения температуры окружающей среды и гасят 250 мл насыщенного водного раствора хлористого аммония. Органическую фазу извлекают, сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Остаток в виде желтого масла подвергают фракционной перегонке на колонкеVigreux при 0,2 мм Hg (мм рт.ст.) (27 Па), получая 37 г (71% от теоретического) фракции чистого жидкого продукта, кипящей при 92 С. Эта фракция, как установлено, представляет собой 82% целевого соединения, 10% 2-пропилтио-5(трифторметил)анизола в виде изомера. Элементный анализ С 11H13F3OS Вычислено: С 52,8%, Н 5,24%, S 12,8% Найдено: С 52,7%, Н 5,11%, S 11,9% ЯМР: 1 Н (СDСl3): 7,02 (m, 3H), 3,96 (s, 3H),2,83 (t, 2H, J=7,4), 1,54-1,04 (m, 2 Н), 0,93 (t, 3H,J=7,4). 2. Получение 2-(бензилтио)анизола. Раствор, содержащий 25,0 г (178 ммоль) 2 метокситиофенола в 50 мл сухого тетрагидрофурана, по каплям прибавляют к смеси из 22,0 г(196 ммоль) трет-бутоксида калия и 100 мл тетрагидрофурана при 0 С и при перемешивании. К смеси при охлаждении и перемешивании добавляют раствор, содержащий 25 мл (214 ммоль) бензилхлорида в 50 мл тетрагидрофурана и полученную смесь оставляют при перемешивании на 18 ч до достижения температуры окружающей среды. Полученную смесь концентрируют испарением при пониженном давлении и остаток разбавляют 300 мл дихлорметана. Полученный раствор промывают водой, сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Остаток представляет собой целевое соединение в виде твердого вещества белого цвета с т. пл. 69-70 С. Элементный анализ C14H14OS Вычислено: С 73,0%, Н 6,13%, S 13,9% 32 Найдено: С 73,0%, Н 6,13%, S 13,7% ЯМР: 1H (СDСl3): 7,2 (m, 7H), 6,8 (m, 2H),4,1 (s, 2H), 3,90 (s, 3 Н). 3. Получение метил-2-пропилтио-3 метоксибензоата. Раствор, содержащий 65,3 г (318 ммоль) 3(4,4-диметилоксазолин-2-ил)анизола в 400 мл сухого тетрагидрофурана, охлаждают до -70 С и к нему добавляют при перемешивании и охлаждении 165,5 мл (414 ммоль) 2,5 М бутиллития. Темно-красный раствор нагревают до -40 С в течение 90 мин при перемешивании, и после этого снова охлаждают до -70 С и добавляют по каплям при перемешивании и охлаждении 62,2 г(414 ммоль) дипропилдисульфида в 100 мл сухого тетрагидрофурана. Смесь оставляют на 90 мин до достижения температуры окружающей среды и полученную молочную суспензию розового цвета нейтрализуют 300 мл насыщенного водного раствора хлористого аммония. Фазы разделяют, органический слой сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Полученное масло золотистого цвета подвергают фракционной перегонке при 0,6 мм Нg (80 Па) на колонке Vigreux (210 см), получая 76,0 г(86% от теоретического) 2-пропилтио-3-(4,4 диметилоксазолин-2-ил)анизола в виде светложелтого масла с т. кип. 155-157 С (0,6 мм Hg). ЯМР: 1H (СDСl3): 7,25 (t, 1 Н, J=7,8), 7,06(s, 2H), 3,87 (s, 3H), 2,76 (t, 2H, J=7,2), 1,44 (m,2H), 1,37 (s, 6H), 0,89 (t, 3H, J=7,4). Суспензию, содержащую 58,2 г (209 ммоль) 2-пропилтио-3-(4,4-диметилоксазолин-2 ил)анизола в 6 н. водном растворе соляной кислоты, нагревают при температуре образования флегмы при перемешивании в течение 18 ч. Полученный гомогенный раствор экстрагируют диэтиловым эфиром (3100 мл), объединенные экстракты сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Полученное масло янтарного цвета подвергают флэш-хроматографии на колонке с силикагелем, элюируя смесями гексана и этилацетата. Фракции, содержащие продукт,объединяют и концентрируют испарением при пониженном давлении, получая 38,7 г (82% от теоретического) 2-пропилтио-3-метоксибензойной кислоты в виде вязкого масла золотистого цвета. ЯМР: 1H (СDСl3): 12,3 (brs, 1H), 7,55 (dd,1H, J=7,8, 1,1), 7,33 (t, 1H, J=8,1), 7,01 (dd, 1H,J=8,3, 0,9), 3,88 (s, 3H), 2,80 (t, 2H, J=7,5), 1,49(169 ммоль) 2-пропилтио-3-метоксибензойной кислоты в 100 г (843 ммоль) тионилхлорида, и перемешивают при температуре окружающей среды в течение 18 ч. Полученный раствор концентрируют испарением при пониженном дав 33 лении, получая 39,7 г сырого хлорангидрида. Порцию последнего в 8,7 г (36 ммоль) растворяют в 100 мл сухого метанола, раствор охлаждают до 0 С и добавляют к нему при перемешивании и охлаждении 4,7 г (46 ммоль) триэтиламина. Смеси дают нагреться до температуры окружающей среды в течение 18 ч при перемешивании. Полученную смесь концентрируют испарением при пониженном давлении и темный маслянистый остаток растворяют в 250 мл диэтилового эфира. Эфирный раствор промывают водой (2200 мл), сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении, получая 8,4 г(154 ммоль) 1,4 М раствора метиллития в диэтиловом эфире к 70 мл сухого тетрагидрофурана под азотной подушкой, охлаждают на бане, заполненной смесью ацетона со льдом, и к нему добавляют при охлаждении и перемешивании 12,4 г (70 ммоль) 2-метокси-4-(трифторметил)пиридина и 0,92 мл (7 ммоль) диизопропиламина. Смеси дают нагреться до -40 С и повторно охлаждают на ацетоно-ледяной бане и после этого по каплям и при перемешивании и охлаждении прибавляют дипропилдисульфид (33 мл,210 ммоль). Полученной смеси дают нагреться до температуры окружающей среды, разбавляют 150 мл воды и экстрагируют диэтиловым эфиром. Эфирный раствор сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Коричневый маслянистый остаток очищают хроматографией на колонке с силикагелем, элюируя смесью гексана и этилацетата, получая 14,1 г (80% от теоретического) целевого соединения в виде светло-желтого масла. Элементный анализ C10H12NF3OS Вычислено: С 47,8%, Н 4,81%, N 5,57%, S 12,8% Найдено: С 48,1%, Н 5,33%, N 5,33%, S 12,7% ЯМР: 1H (CDCl3): 8,18 (d, 1H, J=5,7), 7,12(d, 1H, J=5,7), 4,00 (s, 3H), 2,85 (t, 2H, J=7,4),1,47-1,46 (m, 2H), 0,93 (t, 3H, J=7,2). Аналогичным путем получают следующие 3-пропилтиопиридины: 2-метокси-3-пропилтиопиридин - бесцветное масло, кипящее при 80 С при 0,3 мм Нg (40 Па). Элементный анализ C9H13OS Вычислено: С 59,0%, Н 7,15% Найдено: С 59,1%, Н 7,12%(d, 1H, J=5,6), 4,02 (s, 3H), 2,88 (t, 2H, J=7,3),1,54-1,51 (m, 2H), 0,96 (t, 3H, J=7,8). 5. Получение 2-метокси-6-(трифторметил) бензолсульфонилхлорида. Смесь, содержащая 20,0 г (80 ммоль) смеси, включающей 2-пропилтио-3-(трифторметил)анизол,2-пропилтио-5-(трифторметил)анизол и неизвестное соединение в соотношении 82:10:8, 250 мл хлороформа и 125 мл воды охлаждают до 0 С на ледяной бане и медленно при перемешивании добавляют газообразный хлор в количестве 21,6 г (305 ммоль). Через 2,5 ч органический слой отделяют, сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Остаточное прозрачное масло смешивают с 100 мл пентана и оставляют при температуре окружающей среды на 18 ч и далее помещают в холодильник на 3 ч для кристаллизации масла. Твердые кристаллы отфильтровывают, получая 11,9 г (54% от теоретического) целевого соединения в виде белых кристаллов с т. пл. 86-88 С. ЯМР: 1H (СDСl3): 7,8 (dd, 1H, J=7,9, 8,6),7,53 (d, 1H, J=7,9), 7,46 (d, 1H, J=8,6), 4,1 (s, 3H). 6. Получение 2-метоксибензолсульфонилхлорида. Раствор, содержащий 34,1 г (149 ммоль) 2(бензилтио)анизола в 300 мл хлороформа, объединяют с 150 мл воды и полученную смесь охлаждают на ледяной бане. К смеси при охлаждении и перемешивании добавляют газообразный хлор в количестве 39 г (550 ммоль) с такой скоростью, чтобы температура оставалась ниже 5 С. После этого ледяную баню удаляют и полученную смесь желтого цвета оставляют при температуре окружающей среды при перемешивании в течение 18 ч. Образовавшиеся слои отделяют, хлороформный слой сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Остаток представляет собой масло, которое при стоянии образует 21,3 г (69% от теоретического) кристаллов белого цвета целевого соединения с т. пл. 52-53 С. ЯМР: 1H (СDСl3): 7,93-7,76 (m, 1H), 7,707,65 (m, 1H), 7,13-7,06 (m, 1H), 4,0 (s, 3H). 7. Получение метил-2-хлорсульфонил-3 метоксибензоата. Готовят смесь из 7,8 г (32 ммоль) метил-3 метокси-2-пропилтиобензоата, 2,3 г (130 ммоль) воды и 30 мл ледяной уксусной кислоты и нагревают до 45 С, после чего при перемешивании вводят газообразный хлор (7,6 г, 107 ммоль). Наблюдают переход цвета смеси от темного до светло-оранжевого и повышение 35 температуры до 75 С. Через час смесь выливают в 600 мл водно-ледяной смеси и перемешивают до тех пор, пока весь лед не расплавится. Присутствующие твердые остатки удаляют фильтрованием и растворяют в 500 мл диэтилового эфира. Эфирный раствор сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Твердый коричневый остаток подвергают флэш-хроматографии на силикагеле, элюируя смесью гексана и этилацетата. Фракции, содержащие продукт,объединяют и концентрируют испарением при пониженном давлении, получая 5,32 г (62% от теоретического) целевого соединения в виде твердого вещества светло-розового цвета с т. пл. 106,5-108,5 С. Элементный анализ С 9 Н 9 СlO5S Вычислено: С 40,8%, Н 3,43%, S 12,1% Найдено: С 40,7%, Н 3,62%, S 11,8% ЯМР: 1H (СDСl3): 7,68 (t, 1H, J=8,0), 7,21(d, 1H, J=8,7), 7,03 (d, 1H, J=7,5), 4,05 (s, 3H),3,90 (s, 3H). 8. Получение 2,6-диметоксибензолсульфонилхлорида. Готовят раствор, содержащий 15,0 г (108 ммоль) 1,3-диметоксибензола и 13,8 г (119 ммоль) N,N,N',N'-тетраметилэтиленендиамина в 225 мл сухого петролейного эфира, охлаждают его до 0 С и затем при охлаждении и перемешивании прибавляют 47,5 мл (119 ммоль) 2,5 М раствора бутиллития в гексане. Через час смесь охлаждают примерно до -72 С и при перемешивании добавляют около 70 г (1 моль) двуокиси серы в виде насыщенного раствора в 100 мл сухого диэтилового эфира. Полученную смесь светло-желтого цвета нагревают до 10 С в течение 2 ч, а затем присутствующий клейкий твердый остаток желтого цвета отделяют фильтрованием и промывают несколькими порциями сухого диэтилового эфира. Твердые частицы суспендируют в 400 мл сухого гексана, суспензию охлаждают до 0 С и далее при перемешивании и охлаждении прибавляют 14,6 г (108 ммоль) сульфурилхлорида в виде раствора в 200 мл сухого гексана. Через 45 мин при 0 С полученное твердое вещество розового цвета отделяют фильтрованием, промывают холодным гексаном и растворяют в диэтиловом эфире. Полученный раствор промывают холодной водой (3150 мл), сушат над сульфатом магния,фильтруют и концентрируют испарением при пониженном давлении, получая 19,4 г (76% от теоретического) целевого соединения в виде кристаллического твердого вещества светложелтого цвета с т. пл. 89-91 С. ЯМР: 1H (СDСl3): 7,51 (t, 1H, J=8,5), 6,64(d, 2H, J=8,5), 3,92 (s, 6H). Аналогичным путем были получены следующие соединения: 2,4-диметоксипиридин-3-сульфонилхлорид- твердое вещество коричневого цвета, плавящееся при температуре 118-120 С.(d, 1H, J=5,9), 4,11 (s, 3H), 4,05 (с, 3 Н). 9. Получение 2-этокси-5-метилбензолсульфонилхлорида. Раствор, содержащий 6,8 г (50 ммоль) 4 этокситолуола в 20 мл дихлорметана, добавляют к раствору из 10 мл (150 мл) хлорсульфокислоты в 10 мл дихлорметана при 0 С в условиях охлаждения и перемешивания. Смесь перемешивают при 0 С в течение 1 ч и затем нагревают до температуры окружающей среды и перемешивают еще час. Полученный коричневый раствор выливают в 200 мл смеси воды со льдом и смесь экстрагируют дихлорметаном. Экстракт сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Остаток в количестве 7,9 г(68% от теоретического) в виде твердого вещества светло-коричневого цвета с т. пл. 59-61 С соответствует целевому соединению. ЯМР: 1H (СDСl3): 7,71 (d, 1H, J=2,2), 7,4(dd, 1H, J=8,5, 2,2), 6,95 (d, 1H, J=8,5), 4,23 (q,2H, J=7,0), 1,49 (t, 3H, J=7,0). 10. Получение 2-метокси-4-(трифторметил) пиридин-3-сульфонилхлорида. 50 мл воды соединяют с раствором, содержащим 7,0 г (28 ммоль) 2-метокси-3-пропилтио 4-(трифторметил)пиридина в 100 мл дихлорметана, полученную смесь охлаждают на ледяной бане и медленно в условиях охлаждения и перемешивания прибавляют газообразный хлор(5,1 мл, 112 ммоль). Смесь оставляют для нагревания до температуры окружающей среды и перемешивают в течение 3 ч. Слои отделяют,органический слой сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Остаток в виде желтого масла очищают хроматографией на силикагеле, элюируя смесью гексана и этилацетата. Фракции, содержащие продукт, объединяют и концентрируют испарением при пониженном давлении, получая 4,9 г (64% от теоретического) целевого соединения в виде светло-желтого масла. ЯМР: 1H (СDСl3): 8,6 (d, 1H, J=5,4), 7,4 (d,1H, J=5,4), 4,2 (s, 3H). Масс-спектр имеет молекулярный пик M+ 275. Аналогичным путем были получены следующие производные пиридин-3-сульфонилхлорида: 4-хлор-2-метоксипиридин-3-сульфонилхлорид; ЯМР: 1H (СDСl3): 8,23 (d, 1H, J=5,6), 7,11(d, 1H, J=5,2), 4,17 (s, 3H). Масс-спектр имеет молекулярный пик М+ 275. 2-хлор-4-метоксипиридин-3-сульфонилхлорид - твердое кристаллическое вещество коричневого цвета; ЯМР: 1H (СDСl3): 8,47 (d, 1H, J=5,9), 7,03(50 ммоль) 2-(1,1,2,2 тетрафторэтокси)анилина, 18 мл концентрированной водной соляной кислоты и 5 мл уксусной кислоты, которую предварительно охлаждают до -10 С. Через 45 мин полученную смесь порциями прибавляют при -10 С к раствору,содержащему 1,3 г (18 ммоль) хлорида меди(I) и 0,5 г (4 ммоль) хлорида меди(II) в 50 мл уксусной кислоты, насыщенной двуокисью серы (более 12 г). Смесь оставляют для нагревания до температуры окружающей среды и перемешивают в течение 90 мин, после чего выливают на лед. Полученную смесь экстрагируют диэтиловым эфиром, экстракт промывают водой, сушат над сульфатом магния и концентрируют испарением при пониженном давлении. Остаток очищают хроматографией на силикагеле, элюируя смесью гексана и этилацетата. Фракции, содержащие продукт, объединяют и концентрируют испарением при пониженном давлении, получая 11,0 г(75% от теоретического) целевого соединения в виде желтого масла. ЯМР: 1H (СDСl3): 8,07 (dd, 1H, J=1,7, 8,0),7,76 (ddd, 1H, J=1,7, 7,8, 8,1), 7,59 (dd, 1H, J=1,2,8,1), 7,45 (ddd, 1H, J=1,2, 7,8, 8,0), 6,05 (tt, 1H,J=4,0, 53,0). Масс-спектр имеет молекулярный пик М+ 292. 12. Получение 3-амино-8-хлор-5-метилтио[1.2.4]триазол-[4.3-с]пиримидингидробромида. Раствор, состоящий из 40 мл (120 ммоль) 3-молярного дицианбромида в дихлорметане,объединяют с 19,0 г (100 ммоль) 5-хлор-4 гидразин-2-метилтиопиримидина и 200 мл сухого изопропилового спирта при температуре окружающей среды в условиях перемешивания. Полученную смесь перемешивают в течение 18 ч и затем разбавляют 500 мл диэтилового эфира. Образовавшиеся твердые частицы отделяют фильтрованием и сушат, получая теоретическое количество целевого соединения в виде твердого вещества желтого цвета, плавящегося при температуре более 250 С. Элементный анализ С 6 Н 7N5 ВгСlS Вычислено: С 24,3%, Н 2,38%, N 23,6%, S 10,8% Найдено: С 26,1%, Н 2,69%, N 24,0%, S 12,2% ЯМР: 1H (DMSO-d6): 7,80 (s, 1H), 2,67 (s,3H);C: 150,96, 147,90, 143,10, 138,38, 113,16,14,22. Аналогичным путем были получены следующие производные 3-амино-[1,2,4]триазол[4,3-с]пиримидина гидробромид - твердое вещество желтого цвета, плавящееся при температуре 168-170 С; Элементный анализ C6H7N5BrFS Вычислено: С 25,7%, Н 2,51%, N 25,0%, S 11,4% Найдено: С 25,7%, Н 2,52%, N 25,0%, S 11,5% 3-амино-8-метокси-5-метилтио[1,2,4]триазол[4,3-с]пиримидина гидробромид - твердое вещество коричневого цвета, плавящееся при температуре 180-182 С; Элементный анализ C7H10N5BrOS Вычислено: С 28,8%, Н 3,45%, N 24,0%, S 11,0% Найдено: С 29,0%, Н 3,44%, N 23,9%, S 11,1% 3-амино-8-иод-5-метилтио[1,2,4]триазол[4,3-с]пиримидина гидробромид - твердое вещество желтого цвета, плавящееся при температуре 197-199 С; Элементный анализ C6H7N5BrIS Вычислено: С 18,6%, Н 1,82%, N 18,1%, S 8,26% Найдено: С 19,0%, Н 2,28%, N 18,0%, S 8,54%. 3-амино-8-бром-5-метилтио[1,2,4]триазол[4,3-с]пиримидина гидробромид - твердое вещество желтого цвета, плавящееся при температуре 193-195 С; Элементный анализ С 6 Н 7N5 Вr2S Вычислено: С 21,1%, Н 2,07%, N 20,5%, S 9,40% Найдено: С 21,3%, Н 2,14%, N 20,6%, S 9,33%. 3-амино-8-метил-5-метилтио[1,2,4]триазол[4,3-с]пиримидина гидробромид - твердое вещество желтого цвета, плавящееся при температуре 234-236 С; Элементный анализ C7H10N5BrS Вычислено: С 30,6%, Н 3,30%, N 25,5%, S 11,7% Найдено: С 30,7%, Н 3,52%, N 25,3%, S 11,5%. 3-амино-8-этокси-5-метилтио[1,2,4]триазол[4,3-с]пиримидина гидробромид - порошок желтого цвета, плавящийся при температуре 160-163 С; и 3-амино-5-метилтио[1,2,4]триазол[4,3-с] пиримидина гидробромид - твердое вещество коричневого цвета; ЯМР: 1H (DMSO-d6): 7,52 (d, 1 Н, J=6,6),7,13 (d, 1H, J=6,7), 6,08 (s, 2H), 2,61 (s, 3H). 13. Получение 2-амино-8-хлор-5-метокси 39 Готовят смесь из 15,0 г (51 ммоль) 3 амино-8-хлор-5-метилтио[1,2,4]триазол[4,3-с] пиримидингидробромида, 8,2 мл (76 ммоль) этилацетата и 150 мл метанола и охлаждают на ледяной бане. К смеси медленно добавляют при охлаждении и перемешивании раствор, содержащий 17 мл (76 ммоль) 4,5 молярного раствора метилата натрия в метаноле. По окончании добавления смесь оставляют для нагревания до температуры окружающей среды и перемешивают в течение 18 ч и затем нейтрализуют 2,0 мл уксусной кислоты. Образовавшиеся твердые частицы отделяют фильтрованием, промывают диэтиловым эфиром и сушат, получая 7,7 г (75% от теоретического) целевого соединения в виде порошка коричневого цвета, плавящегося при температуре более 250 С. Элементный анализ C6H6N5ClO Вычислено: С 36,1%, Н 3,03%, N 35,1% Найдено: С 36,1%, Н 3,19%, N 34,8% ЯМР: 1H (DMSO-d6): 8,0 (s, 1H), 6,6 (brs,2H), 4,1 (s, 3H); 13 С 166,40, 151,65, 147,73, 140,95, 108,57,56,12. Аналогичным путем были получены следующие производные 2-амино[1,2,4]триазол[1,5-с]пиримидин - иглы коричневого цвета,плавящиеся при температуре более 230 С; Элементный анализ C6H6N5FO Вычислено: С 39,4%, Н 3,30%, N 38,2% Найдено: С 39,5%, Н 3,28%, N 37,7% 2-амино-5,8-диметокси[1,2,4]триазол[1,5-с] пиримидин - порошок коричневого цвета, плавящийся при температуре 201-203 С; Элементный анализ С 7 Н 9N5O2 Вычислено: С 43,1%, Н 4,65%, N 35,9% Найдено: С 43,2%, Н 4,67%, N 35,6% 2-амино-7-фтор-5-метокси[1,2,4]триазол[1,5-с]пиримидин - порошок коричневого цвета,плавящийся при температуре более 250 С; Элементный анализ C6H6N5FO Вычислено: С 39,4%, Н 3,30%, N 38,2% Найдено: С 39,6%, Н 3,31%, N 38,2% 2-амино-8-иод-5-метокси[1,2,4]триазол[1,5-с]пиримидин - твердое вещество коричневого цвета, плавящееся при температуре более 250 С; Элементный анализ C6H6N5IO Вычислено: С 24,8%, Н 2,08%, N 24,1% Найдено: С 25,0%, Н 1,96%, N 23,8% 2-амино-8-метил-5-метокси[1,2,4]триазол[1,5-с]пиримидин - твердое вещество коричневого цвета, плавящееся при температуре более 250 С; Элементный анализ С 7 Н 9N5O Вычислено: С 46,9%, Н 5,06%, N 39,1% Найдено: С 46,7%, Н 4,84%, N 39,1% 2-амино-8-этокси-5-метокси[1,2,4]триазол[1,5-с]пиримидин - твердое вещество светло 001064 40 коричневого цвета, плавящееся при температуре 190-191 С; и 2-амино-5-метокси[1,2,4]триазол[1,5-с] пиримидин - твердое вещество коричневого цвета, плавящееся при температуре более 250 С; ЯМР: 1H (DMSO-d6): 7,82 (d, 1 Н, J=6,3),7,03 (d, 1H, J=6,1), 6,31 (s, 2H) и 4,12 (s, 3H). 14. Получение 2-(N-триметилсилиламино)8-хлор-5-метокси-[1,2,4]триазол[1,5-с]пиримидина. В предварительно высушенной колбе в атмосфере азота готовят смесь из 12,7 г (85 ммоль) иодида натрия в 425 мл сухого ацетонитрила и к полученной смеси при перемешивании с помощью шприца при температуре окружающей среды прибавляют 9,25 г (10,8 мл, 85 ммоль) хлортриметилсилана. Через 10 мин при перемешивании добавляют 17,0 г (85 ммоль) 2 амино-8-хлор-5-метокси-[1,2,4]триазол[1,5-с]пиримидина и 8,62 г (11,9 мл, 85 ммоль) триэтиламина. Смесь оставляют на 12 ч при температуре окружающей среды при перемешивании и затем разбавляют 500 мл сухого диэтилового эфира. Осажденные соли отделяют фильтрованием на сухом стеклянном фильтре и фильтрат концентрируют испарением при пониженном давлении. Остаток разбавляют дополнительными 500 мл сухого диэтилового эфира и повторяют процедуру удаления осажденной соли, получая целевое соединение в виде твердого остатка в количестве 19,5 г (84% от теоретического). 15. Получение N-8-хлор-5-метокси[1,2,4] триазол[1,5-с]пиримидин-2-ил)-2-метокси-6(трифторметил)бензолсульфонамида. Готовят раствор 19,5 г (72 ммоль) 2-(Nтриметилсилиламино)-8-хлор-5-метокси[1,2,4] триазол[1,5-с]пиримидина в 150 мл сухого ацетонитрила и при перемешивании в атмосфере азота при температуре окружающей среды прибавляют 27,5 г (100 ммоль) 2-метокси-6(трифторметил)бензолсульфонилхлорида. К полученной смеси последовательно при перемешивании добавляют 6,7 г (6,9 мл, 85 ммоль) сухого пиридина, 0,66 г (0,60 мл, 8,5 ммоль) сухого диметилсульфоксида и 13,7 г (85 ммоль) фторида цезия. Смесь оставляют для реакции на 8 ч и присутствующие твердые вещества отделяют фильтрованием. Далее их суспендируют в 100 мл 0,38%-го раствора соляной кислоты, отделяют фильтрованием, повторно суспендируют в 100 мл метанола и снова фильтруют. Полученное твердое вещество белого цвета сушат,получая в итоге 21,3 г (68% от теоретического) целевого соединения с т. пл. 216-217 С. Элементный анализ C14H11N5ClF3O4S Вычислено: С 38,4%, Н 2,53%, N 16,0% Найдено: С 38,6%, Н 2,50%, N 16,1%. 16. Получение N-(8-хлор-5-метокси[1,2,4] триазол[1,5-с]-пиримидин-2-ил)-2,6-диметоксибензолсульфонамида. 41 Готовят суспензию 0,80 г (4,0 ммоль) 2 амино-8-хлор-5-метокси[1,2,4]триазол[1,5-с]пиримидина в 15 мл сухого ацетонитрила и затем при перемешивании при температуре окружающей среды и при сохранении сухой реакционной системы прибавляют 1,9 г (8,0 ммоль) 2,6-диметоксибензолсульфонилхлорида, 0,63 г(8 ммоль) сухого пиридина и 0,08 г (1 ммоль) сухого диметилсульфоксида. Через 18 ч добавляют 0,32 г сухого пиридина и еще через 18 ч 0,08 г сухого диметилсульфоксида. Еще через час смесь разбавляют 350 мл дихлорметана,промывают водой (3150 мл), сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Остаток в виде оранжевого масла растирают с диэтиловым эфиром, получая после высушивания 1,41 г(88% от теоретического) целевого соединения в виде твердого вещества светло-желтого цвета с т. пл. 215,5-217,5 С. Элементный анализ C14H14N5ClO5S Вычислено: С 42,1%, Н 3,53%, N 17,5%, S 8,02% Найдено; С 42,2%, Н 3,62%, N 17,1%. S 7,70% ЯМР: 1H (DMSO-d6): 11,74 (s, 1 Н), 8,10 (s,1 Н), 7,44 (t, 1H, J=8,5), 6,75 (d, 2H, J=8,4), 4,11(s, 3H), 3,88 (s, 3H), 3,77 (s, 6H). 17. Получение 2-карбометокси-6-метоксиN-(5,8-диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил)бензолсульфонамида. Готовят суспензию 0,70 г (3,5 ммоль) 2 амино-5,8-диметокси[1,2,4]триазол[1,5-с]пиримидина в 15 мл сухого ацетонитрила и затем при перемешивании при температуре окружающей среды и сохранении сухой реакционной системы прибавляют 1,84 г (7,0 ммоль) метил-2-хлорсульфонил-3-метоксибензоата, 0,55 г(2200 мл) и раствором 2 н. водной соляной кислоты (2200 мл), сушат над сульфатом магния,фильтруют и концентрируют испарением при пониженном давлении. Твердый коричневый остаток растирают с диэтиловым эфиром, получая целевое соединение в виде белого твердого вещества 80%-ной чистоты. Полученное вещество дважды хроматографируют на колонке с силикагелем, элюируя кислой подвижной фазой(смесь дихлорметан/этанол/уксусная кислота),что по большей части не было успешным, и затем перекристаллизовывают из горячего метанола. Выход полученного продукта в виде бле 001064 42 стящих белых игл составляет 0,274 г (19% от теоретического) с т. пл. 215-217 С. Элементный анализ C16H17N5O7S Вычислено: С 45,4%, Н 4,05%, N 16,5%, S 7,57% Найдено: С 44,7%, Н 3,96%, N 16,2%, S 7,93% ЯМР: 1H (DMSO-d6): 11,76 (s, 1H), 7,60 (t,1H, J=8,3), 7,28 (d, 1H, J=8,3), 7,05 (d, 1H, J=7,6),4,07 (s, 3H), 3,88 (s, 3H), 3,81 (s, 3H), 3,78 (s, 3H). 18. Получение 2,6-диметокси-N-(5,8 диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил) бензолсульфонамида. Готовят суспензию 0,80 г (4,1 ммоль) 2 амино-5,8-диметокси[1,2,4]триазол[1,5-с]пиримидина в 15 мл сухого ацетонитрила и затем при перемешивании при температуре окружающей среды в условиях сохранения сухой реакционной системы прибавляют 1,94 г (8,2 ммоль) 2,6-диметоксибензолсульфонилхлорида,0,65 г (8,2 ммоль) сухого пиридина и 0,08 г (1 ммоль) сухого диметилсульфоксида. Через 24 ч смесь разбавляют 200 мл дихлорметана, органическую фазу извлекают, промывают водой(2200 мл) и раствором 2 н. водной соляной кислоты (2200 мл, сушат над сульфатом магния,фильтруют и концентрируют испарением при пониженном давлении. Твердый оранжевый остаток растворяют в 5 мл дихлорметана и затем по каплям при перемешивании добавляют диэтиловый эфир. Образовавшийся твердый остаток серого цвета отделяют фильтрованием,промывают эфиром и сушат при 50 С при пониженном давлении, получая 1,11 г (68% от теоретического) целевого соединения в виде твердого вещества грязно-белого цвета с т. пл. 239-240,5 С. Элементный анализ C15H17N5O6S Вычислено: С 45,6%, Н 4,33%, N 17,7% Найдено: С 45,7%, Н 4,19%, N 17,6% ЯМР: 1H (DMSO-d6): 11,54 (s, 1H), 7,55 (s,1H), 7,44 (t, 1H, J=8,4), 6,74 (d, 2H, J=8,4), 4,06(s, 3H), 3,88 (s, 3H), 3,76 (s, 6H). 19. Получение 2-метокси-5-метил-N-(5,8 диметокси[1,2,4]триазол[1,5-с]пиримидин-2-ил) бензолсульфонамида. Готовят смесь из 1,0 г (5,1 ммоль) 2-амино 5,8-диметокси[1,2,4]триазол[1,5-с]пиримидина,2,1 г (10,0 ммоль) 2-метокси-5-метилбензолсульфонилхлорида и 15 мл сухого ацетонитрила и затем при перемешивании при температуре окружающей среды и в присутствии средства для сохранения сухой реакционной системы прибавляют 0,8 мл (10 ммоль) сухого пиридина и 71 микролитр (1,0 ммоль) сухого диметилсульфоксида. Смесь оставляют при перемешивании в течение 18 ч и затем добавляют еще 1,0 г (5,0 ммоль) 2-метокси-5-метил-бензолсульфонилхлорида. Перемешивание продолжают еще 24 ч, в течение которых добавляют еще 0,4 мл сухого пиридина и 35 микролитров сухого 43 диметилсульфоксида. После перемешивания в течение 9 суток летучие компоненты удаляют испарением при пониженном давлении. Темный остаток разбавляют 50 мл воды и 50 мл диэтилового эфира и образовавшиеся твердые вещества отделяют фильтрованием. После этого их суспендируют в дихлорметане и после 2 часового перемешивания отделяют фильтрованием, получая 1,2 г (63% от теоретического) целевого соединения в виде белого порошка с т. пл. 217-219 С. Элементный анализ C15H17N5O5S Вычислено: С 47,5%, Н 4,52%, N 18,5%, S 8,45% Найдено: С 47,7%, Н 4,61%, N 18,3%, S 8,80% ЯМР: 1H (DMSO-D6): 12,0 (brs, 1H), 8,1 (s,1H), 7,7 (t, 1H, J=8,2), 7,56-7,52 (m, 2H), 4,06 (s,3H), 4,1 (s, 3H), 3,9 (s, 3H). 20. Получение N-(5,8-диметокси[1,2,4] триазол[1,5-с]пиримидин-2-ил)-2-метокси-4(трифторметил)пиридин-3-сульфонамида. Готовят смесь из 0,75 г (93,8 ммоль) 2 амино-5,8-диметокси[1,2,4]триазол[1,5-с]пиримидина, 2,1 г (7,6 ммоль) 2-метокси-4(трифторметил)пиридин-3-сульфонилхлорида и 10 мл сухого ацетонитрила и к полученной смеси при температуре окружающей среды при перемешивании и в присутствии средства для исключения влаги из реакционной системы прибавляют 0,61 мл (7,6 ммоль) сухого пиридина, 43 микролитра (0,6 ммоль) сухого диметилсульфоксида и небольшое количество сухих молекулярных сит 4 А. Полученную смесь перемешивают в течение 5 суток. Затем к смеси прибавляют еще 1,0 г (3,4 ммоль) 2-метокси-4(трифторметил)пиридин-3-сульфонилхлорида и 0,30 мл (3,5 ммоль) сухого пиридина и смесь перемешивают еще 2 суток. Далее добавляют другие 0,30 мл (3,5 ммоль) сухого пиридина и продолжают перемешивание еще 4 суток. Смесь разбавляют 100 мл дихлорметана, промывают водным раствором 2 н. соляной кислоты (2100 мл), сушат над сульфатом магния, фильтруют и концентрируют испарением при пониженном давлении. Полученный твердый коричневый остаток хроматографируют на колонке с силикагелем, элюируя смесью дихлорметана и этанола, получая 0,90 г (54% от теоретического) целевого соединения в виде твердого вещества белого цвета с т. пл. 214-216 С. Элементный анализ С 14 Н 13N6F3O5S Вычислено: С 38,7%, Н 3,02%, N 19,4%, S 7,38% Найдено: С 38,5%, Н 3,15%, N 19,4%, S 7,43% ЯМР: 1H (DMSO-d6): 12,3 (brs, 1H), 8,64 (d,1H, J=5,3), 7,60-7,58 (m, 2H), 4,06 (s, 3H), 3,95 (s,3H), 3,86 (s, 3H). 21. Получение 2-метоксикарбонил-6 метокси-N-(5-хлор-8-метокси[1,2,4]триазол[1,5 а]пиридин-2-ил)бензолсульфонамида. 44 Готовят смесь 0,90 г (4,5 ммоль) 2-амино 5-хлор-8-метокси[1,2,4]триазол[1,5-а]пиридина и 35 мл сухого ацетонитрила и затем при перемешивании при температуре окружающей среды и сохранении сухой реакционной системы прибавляют 2,39 г (9,06 ммоль) метил-2 хлорсульфонил-3-метоксибензоата, 0,72 г (9,1 ммоль) сухого пиридина и 0,071 г (0,91 ммоль) сухого диметилсульфоксида. Через 16 ч добавляют еще 0,35 г (4,5 ммоль) сухого пиридина и после дополнительного 48-часового перемешивания летучие компоненты системы удаляют испарением при пониженном давлении. Полученный остаток разбавляют 50 мл дихлорметана и 50 мл водного раствора 2 н. соляной кислоты и смесь энергично перемешивают в течение 72 ч. Присутствующий твердый остаток отделяют фильтрованием и промывают водой (325 мл),дихлорметаном (310 мл) и диэтиловым эфиром(310 мл), получая целевое соединение в виде твердого вещества белого цвета. Суммарный фильтрат и промывные воды объединяют и разбавляют 25 мл дихлорметана и 25 мл водного раствора 2 н. соляной кислоты в делительной воронке. Фазы разделяют, органический слой промывают 350 мл водного раствора 2 н соляной кислоты, сушат над сульфатом натрия,фильтруют и концентрируют испарением при пониженном давлении, получая твердое вещество желтого цвета. Последнее суспендируют в 5,0 мл дихлорметана, твердые остатки отделяют фильтрованием и быстро промывают дихлорметаном (25 мл) и диэтиловым эфиром (215 мл),получая дополнительное количество целевого соединения в виде белого твердого вещества. Суммарное количество целевого соединения составляет 1,09 г (56% от теоретического) с т. пл. (с разложением), равной 290-292 С. Элементный анализ С 16 Н 15N4ClO6S Вычислено: С 45,0%, Н 3,45%, N 13,1%, S 7,51% Найдено: С 44,9%, Н 3,39%, N 12,8%, S 7,79% ЯМР: 1H (DMSO-d6): 11,60 (s, 1H), 7,62 (t,1H, J=7,69), 7,24 (m, 2H), 7,05 (m, 2H), 3,92 (s,3H), 3,83 (s, 3H), 3,77 (s, 3H). 22. Получение 2-метоксикарбонил-6 метокси-N-(5,8-диметокси[1,2,4]триазол[1,5-а] пиридин-2-ил)бензолсульфонамида. 0,871 г (2,04 ммоль) 2-метоксикарбонил-6 метокси-N-(5-хлор-8-метокси[1,2,4]триазол[1,5 а]пиридин-2-ил)бензолсульфонамида помещают в сухую колбу, снабженную резиновой и стеклянной пробками. Вещество растворяют в 20 мл сухого диметилсульфоксида, добавляемого посредством трубочки, и 1,39 мл 6,12 М раствора метилата натрия в метаноле, добавляемого с помощью шприца, при температуре окружающей среды и при перемешивании. Через 16 ч прибавляют еще 0,050 мл раствора метилата натрия и смесь оставляют для реакции на 18 ч. 45 Далее смесь подкисляют достаточным количеством ледяной уксусной кислоты и выливают в 250 мл дихлорметана. Смесь промывают водой(6200 мл), сушат над сульфатом натрия,фильтруют и концентрируют испарением при пониженном давлении. Полученный твердый белый остаток растворяют в 600 мл дихлорметана и очищают хроматографией на колонке с силикагелем, элюируя смесями дихлорметана и этанола со стартовой смесью 99:1 (объемн.),увеличивая количество этанола со временем. Фракции, содержащие продукт, объединяют и концентрируют испарением при пониженном давлении, получая 496 мг (57% от теоретического) целевого соединения в виде грязно-белого твердого вещества с т. пл. (с разложением), равной 274-276 С. Элементный анализ C17H18N4O7S Вычислено: С 48,3%, Н 4,30%, N 13,3%, S 7,59% Найдено: С 48,6%, Н 4,26%, N 13,1%, S 7,83% ЯМР: 1H (DMSO-d6): 11,33 (s, 1H), 7,61 (t,1H, J=8,06), 7,28 (d, 1H, J=8,51), 7,02 (d, 2H,J=7,94), 6,42 (d, 1H, J=8,55), 3,98 (s, 3H), 3,85 (s,3H), 3,82 (s, 3H), 3,75 (s, 3H). 23. Оценка послевсходовой гербицидной активности. Семена желаемых видов тестируемых растений засевают в растительной смеси GraceSierra MetroMix 306 с рН 6,0-6,8 и содержанием органического вещества около 30% в пластмассовые горшочки с площадью поверхности 64 см 2. Чтобы обеспечить хорошие ростки и в дальнейшем получить здоровые растения, при необходимости производят обработку гербицидом и/или другим химическим средством, либо осуществляют природную обработку. Растения вырастают в течение 7-21 суток в теплице в условиях фотопериода около 15 ч, который поддерживают при температуре 23-29 С в течение дня и 22-28 С в течение ночи. Удобрения и воду добавляют на регулярной основе, а дополнительное освещение обеспечивают с помощью галогенных ламп верхнего освещения мощностью 1000 В. Растения используют для испытаний по достижении ими первой или второй фазы распускания листьев. 46 Для получения стандартного раствора взвешенное количество каждого тестового соединения, исходя из определяемой наивысшей концентрации, помещают в стеклянный сосуд вместимостью 20 мл и растворяют в 4 мл смеси ацетона и диметилсульфоксида (97:3 по объему). Если соединение в смеси легко не растворяется, смесь нагревают и/или на нее воздействуют ультразвуком. Полученные концентрированные стандартные растворы разбавляют водной смесью, содержащей ацетон, воду, изопропиловый спирт, диметилсульфоксид, концентрат растительного масла Atplus 411F, поверхностно-активное вещество (ПАВ) Тритон Х-155 (Triton X-155), взятыми в соотношении 48,5:39:10:1,5:1,0:0,02 (по объему), для получения распылительных растворов известной концентрации. Растворы, содержащие наивысшую определяемую концентрацию, получают разведением аликвот в 2 мл стандартного раствора 13 мл смеси, а наименьшие концентрации получают разведением соответствующих меньших по объему порций стандартного раствора. Далее аликвоты, составляющие около 1,5 мл каждого раствора известной концентрации, равномерно распыляют на каждый из горшочков с тестовым растением с помощью пульверизатора Де Вилбисса (DeVilbiss), приводимого в движение сжатым воздухом под давлением от 140-280 кПа (24 фунта/кв. дюйм) для того, чтобы получить хорошее покрытие на каждом растении. Контрольные растения опрыскивают аналогично,используя водную смесь. В настоящем опыте наносимая концентрация в 1 мг/л (1 ppm) соответствует норме расхода в 1 г/га. Обработанные и контрольные растения помещают в теплицу, как описано выше, и проводят подпочвенное орошение для предотвращения вымывания тестовых соединений. Через две недели производят визуальное сравнение состояния тестируемых и необработанных растений и оценивают его по шкале от 0 до 100%,где 0 соответствует отсутствию какого-либо повреждения растения и 100 соответствует его полной гибели. Некоторые из тестовых соединений, применяемых норм расхода, видов тестируемых растений и полученных результатов приведены в табл. 2. Гербицидная активность при послевсходовой обработке 24. Оценка довсходовой гербицидной активности. Семена желаемых видов тестируемых растений засевают в почвенной матрице, приготовленной смешиванием суглинистой почвы, которая включает около 43% ила, около 19% глины и около 38% песка и имеет рН около 8,1, и 1,5% органического вещества и песка в соотношении 70:30. Почвенная матрица находится в пластмассовых горшочках с площадью поверхности 161 см 2. Чтобы обеспечить хорошие ростки и в дальнейшем получить здоровые растения, при необходимости производят обработку гербицидом и/или другим химическим средством, либо осуществляют природную обработку. Для получения стандартного раствора взвешенное количество каждого тестового соединения, исходя из определяемой наивысшей концентрации, помещают в стеклянный сосуд вместимостью 20 мл и растворяют в 8 мл смеси ацетона и диметилсульфоксида (97:3 по объему). Если соединение в смеси легко не растворяется, смесь нагревают и/или на нее воздействуют ультразвуком. Полученные стандартные растворы разводят смесью воды и ПАВ Твина 155 (Tween 155) для получения растворов известной концентрации. Растворы, содержащие наивысшую тестируемую концентрацию, получают разведением аликвот в 4 мл стандартного раствора 8 мл смеси, а наименьшие концентрации получают разведением соответствующих меньших по объему порций стандартного раствора. Далее, аликвоты, составляющие около 2,5 мл каждого раствора известной концентрации,равномерно распыляют на каждый из засеянных горшочков с помощью стеклянного шприца Корнуэлла (Cornwall) на 5 мл, снабженного полым коническим соплом Тиджет NN-3 (TeeJet) для того, чтобы получить хорошее покрытие на почве в каждом горшочке. Контрольные горшочки опрыскивают аналогично, используя водную смесь. Наивысшей концентрации в 4,48 кг/га достигают при использовании 50 мг тестируемого соединения. Обработанные и контрольные горшочки помещают в теплицу приблизительно с 15-часовым фотопериодом, который поддерживают при температуре 23-29 С в течение дня и 22-28 С в течение ночи. Удобрения и воду добавляют на регулярной основе, а дополнительное освещение обеспечивают с помощью галогенных ламп верхнего освещения мощностью 1000 Вт. Воду добавляют надпочвенным орошением. Через три недели производят визуальное сравнение состояния тестируемых ростков и выросших растений по сравнению с необработанными и оценивают его по шкале от 0 до 100%, где 0 соответствует отсутствию какого-либо повреждения растения и 100 соответствует его полной гибели или отсутствию прорастания. Некоторые из тестовых соединений, применяемых норм расхода, видов Гербицидная активность при довсходовой обработкеY представляет собой Н, ОСН 3, F, Cl, Br, I или СН 3, необязательно содержащий в качестве заместителей до трех атомов фтора;Z представляет собой О(C1-С 3 алкил), Н, F,Cl, Br, I, S(C1-С 3 алкил) или СН 3, необязательно содержащий в качестве заместителей до трехQ представляет собой С-Н или N; А представляет собой F, Cl, Br, I или СО 2(С 1-С 4 алкил), или представляет собой (C1 С 3 алкил),O(C1-С 4 алкил),О(C3-С 4 алкенил),O(С 3-С 4 алкинил) или S(C1-С 3 алкил), каждый из которых необязательно замещен одним заместителем, представляющим собой O(C1-С 3-алкил),S(C1-С 3 алкил), хлор, бром или циано, или атомами фтора до максимально возможного их количества, или представляет собой фрагмент 2 метил-1,3-диоксолан-2-ила, и когда Q представляет собой N, Н; В представляет собой Н, F, Cl, Br, I, NO2,CN, CO2(C1-С 4 алкил), NН(C1-С 3 алкил) или N(C1 С 3 алкил)2, или представляет собой (C1-С 3 алкил),О(C3-С 4 алкенил),О(C3O(C1-С 4 алкил),С 4 алкинил) или S(C1-С 3 алкил), SO(C1-С 3 алкил),
МПК / Метки
МПК: A01N 43/90, C07D 487/04, C07D 471/04
Метки: гербицидов, n-([1,2,4]триазолазинил)бензолсульфонамиды, применение, пиридинсульфонамиды, качестве
Код ссылки
<a href="https://eas.patents.su/30-1064-n-124triazolazinilbenzolsulfonamidy-i-piridinsulfonamidy-i-ih-primenenie-v-kachestve-gerbicidov.html" rel="bookmark" title="База патентов Евразийского Союза">N-([1,2,4]триазолазинил)бензолсульфонамиды и пиридинсульфонамиды и их применение в качестве гербицидов</a>
Предыдущий патент: Самокомпенсирующаяся балансовая пружина для механического осциллятора системы балансовая пружина / баланс хода часового механизма, и способ ее изготовления
Следующий патент: Порошок вспенивателя и способ его получения
Случайный патент: Схемное устройство для управления бытовым прибором и соответствующий способ управления