Антитело к cd33 и способы его применения
Номер патента: 10570
Опубликовано: 30.10.2008
Авторы: Таварес Даниел, Хоффи Мэри Г., Лутц Роберт Дж.
Формула / Реферат
1. Выделенное антитело или его эпитопсвязывающий фрагмент, включающие по крайней мере один определяющий комплементарность участок, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID Nos: 1-6:

и обладающие способностью связывать CD33.
2. Антитело или его эпитопсвязывающий фрагмент, обладающие способностью связывать CD33, включающие по крайней мере одну тяжелую цепь и по крайней мере одну легкую цепь, причем вариабельная область тяжелой цепи включает три определяющих комплементарность участка, имеющих аминокислотные последовательности SEQ ID Nos: 1-3, соответственно:

а вариабельная область легкой цепи включает три определяющих комплементарность участка, имеющих аминокислотные последовательности SEQ ID NOs: 4-6, соответственно:

3. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет последовательность, которая по крайней мере на 90% идентична аминокислотной последовательности SEQ ID NO: 7:
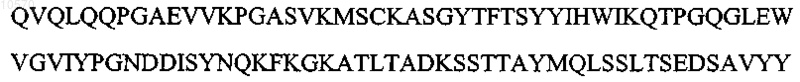
![]()
4. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет последовательность, которая по крайней мере на 95% идентична указанной аминокислотной последовательности SEQ ID NO: 7:
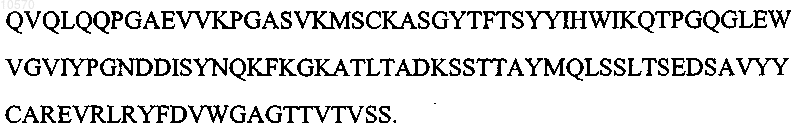
5. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность, представленную SEQ ID NO: 7:
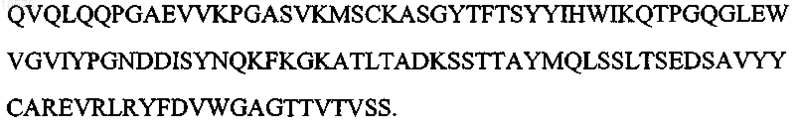
6. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет последовательность, которая по крайней мере на 90% идентична аминокислотной последовательности SEQ ID NO: 8:

7. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет последовательность, которая по крайней мере на 95% идентична аминокислотной последовательности SEQ ID NO: 8:
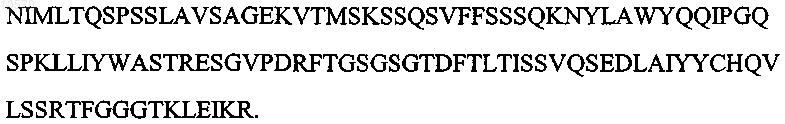
8. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет аминокислотную последовательность, представленную SEQ ID NO: 8:
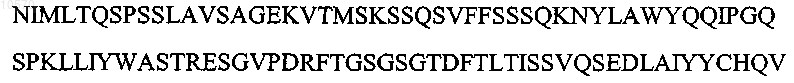
![]()
9. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет последовательность, которая по крайней мере на 90% идентична аминокислотной последовательности SEQ ID NO: 9:

10. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет последовательность, которая по крайней мере на 95% идентична аминокислотной последовательности SEQ ID NO: 9:
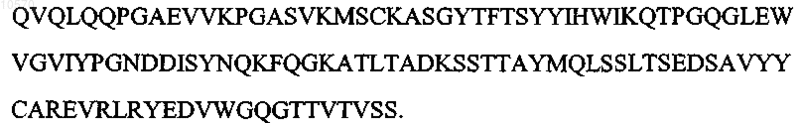
11. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 9:
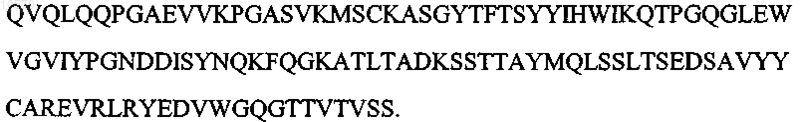
12. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет последовательность, которая по крайней мере на 90% идентична аминокислотной последовательности SEQ ID NO: 10:
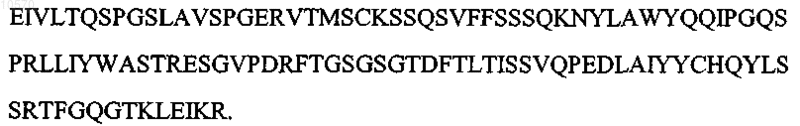
13. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет последовательность, которая по крайней мере на 95% идентична аминокислотной последовательности SEQ ID NO: 10:
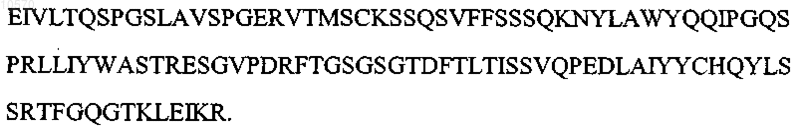
14. Антитело или его эпитопсвязывающий фрагмент по п.1 или 2, отличающиеся тем, что вариабельная область легкой цепи имеет аминокислотную последовательность, представленную SEQ ID NO: 10:
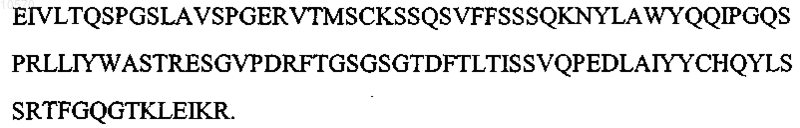
15. Выделенное антитело или его эпитопсвязывающий фрагмент, которые специфично связывают CD 33, отличающиеся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 7:

а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 8:
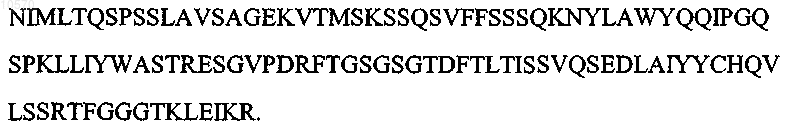
16. Гуманизированное антитело или антитело с переуложенной поверхностью или его эпитопсвязывающий фрагмент, которые специфично связывают CD33, отличающиеся тем, что вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 9:
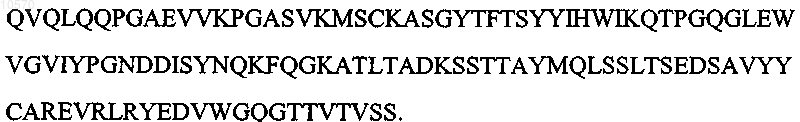
а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 10:
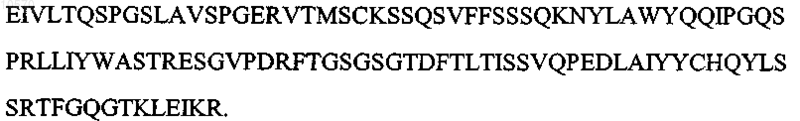
17. Иммуноконъюгат, включающий антитело или его эпитопсвязывающий фрагмент по п.1, связанное (связанный) с лекарством или пролекарством.
18. Иммуноконъюгат, включающий антитело или его эпитопсвязывающий фрагмент по п.2, связанное (связанный) с лекарством или пролекарством.
19. Иммуноконъюгат по п.17, отличающийся тем, что лекарство или пролекарство выбрано из группы, состоящей из мейтензиноида, таксоида, СС-1065, аналога СС-1065, доластатина, аналога доластатина, метотрексата, даунорубицина, доксорубицина, винкристина, винбластина, мелфалана, митомицина С, хлорамбуцила, каликеамицина и их производных.
20. Иммуноконъюгат по п.18, отличающийся тем, что лекарство или пролекарство выбрано из группы, состоящей из мейтензиноида, таксоида, СС-1065, аналога СС-1065, доластатина, аналога доластатина, метотрексата, даунорубицина, доксорубицина, винкристина, винбластина, мелфалана, митомицина С, хлорамбуцила, каликеамицина и их производных.
21. Фармацевтическая композиция, включающая антитело или его эпитопсвязывающий фрагмент по п.1 и лекарство или пролекарство.
22. Фармацевтическая композиция, включающая антитело или его эпитопсвязывающий фрагмент по п.2 и лекарство или пролекарство.
23. Фармацевтическая композиция, включающая антитело или его эпитопсвязывающий фрагмент по п.1 и фармацевтически приемлемое средство.
24. Фармацевтическая композиция, включающая антитело или его эпитопсвязывающий фрагмент по п.2 и фармацевтически приемлемое средство.
25. Фармацевтическая композиция, включающая иммуноконъюгат по п.17 и фармацевтически приемлемое средство.
26. Фармацевтическая композиция, включающая иммуноконъюгат по п.18 и фармацевтически приемлемое средство.
27. Фармацевтическая композиция, включающая композицию по п.21 и фармацевтически приемлемое средство.
28. Фармацевтическая композиция, включающая композицию по п.22 и фармацевтически приемлемое средство.
29. Диагностический реагент, включающий антитело или его эпитопсвязывающий фрагмент по п.1, причем антитело или фрагмент антитела являются мечеными.
30. Диагностический реагент, включающий антитело по п.2, причем антитело или фрагмент антитела является меченым.
31. Диагностический реагент по п.29, отличающийся тем, что указанная метка выбрана из группы, состоящей из биотиновой метки, энзимной метки, метки радиоактивного изотопа, флуорофора, хромофора, средства фыя осуществления томографии и иона металла.
32. Диагностический реагент по п.30, отличающийся тем, что указанная метка выбрана из группы, состоящей из биотиновой метки, энзимной метки, метки радиоактивного изотопа, флуорофора, хромофора, средства для осуществления томографии и иона металла.
33. Способ ингибирования роста клеток, экспрессирующих CD33, предусматривающий обеспечение контактирования указанных клеток с антителом или его эпитопсвязывающим фрагментом по п.1 или 2.
34. Способ ингибирования роста клеток, экспрессирующих CD33, предусматривающий обеспечение контактирования указанных клеток с иммуноконъюгатом по п.17 или 18.
35. Способ ингибирования роста клеток, экспрессирующих CD33, предусматривающий обеспечение контактирования указанных клеток с композицией по п.21 или 22.
36. Способ ингибирования роста клеток, экспрессирующих CD33, предусматривающий обеспечение контактирования указанных клеток с фармацевтической композицией по любому из пп.23-28.
37. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества антитела или его эпитопсвязывающего фрагмента по п.1 или 2.
38. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества иммуноконъюгата по п.17 или 18.
39. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества композиции по п.21 или 22.
40. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества фармацевтической композиции по п.23 или 24.
41. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества фармацевтической композиции по п.25 или 26.
42. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, включающий введение указанному пациенту эффективного количества фармацевтической композиции по п.27 или 28.
43. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, предусматривающий обеспечение контактирования одной из нескольких клеток указанного пациента ex vivo с эффективным количеством антитела или его эпитопсвязывающего фрагмента по п.1 или 2 и введение таких клеток пациенту.
44. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, предусматривающий обеспечение контактирования одной из нескольких клеток указанного пациента ex vivo с эффективным количеством иммуноконъюгата по п.17 или 18 и введение таких клеток пациенту.
45. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, предусматривающий обеспечение контактирования одной из нескольких клеток указанного пациента ex vivo с эффективным количеством композиции по п.21 или 22 и введение таких клеток пациенту.
46. Способ лечения пациента с заболеванием, при котором экспрессируется CD33, предусматривающий обеспечение контактирования одной из нескольких клеток указанного пациента ex vivo с эффективным количеством фармацевтической композиции по любому из пп.23-28 и введение таких клеток пациенту.
47. Способ лечения по п.37, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
48. Способ лечения по п.38, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
49. Способ лечения по п.39, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
50. Способ лечения по п.40, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
51. Способ лечения по п.41, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
52. Способ лечения по п.42, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
53. Способ лечения по п.43, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
54. Способ лечения по п.44, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
55. Способ лечения по п.45, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
56. Способ лечения по п.46, где указанным заболеванием является заболевание, выбранное из группы, состоящей из миелодипластического синдрома (MDS), острой миелоидной лейкемии (AML), хронической миелоидной лейкемии (CML) и промиелоцитной лейкемии (PML).
57. Способ определения наличия в биологическом образце миелогенных раковых клеток, включающий:
(a) обеспечение контактирования указанного биологического образца с диагностическим реагентом по п.29 или 30;
(b) определение распределения указанного реагента в указанном образце;
(c) интерпретацию результатов распределения.
58. Способ диагностики по п.57, отличающийся тем, что миелогенное раковое заболевание является выбранным из группы, включающей острую миелоидную лейкемию (AML), хроническую миелоидную лейкемию (CML) и промиелоцитную лейкемию (PML).
59. Способ получения антитела или его эпитопсвязывающего фрагмента по любому из пп.1-6, которые обладают повышенной аффинностью к CD33, включающий:
(a) получение ДНК, которая кодирует по крайней мере одну из вариабельных областей тяжелой и легкой цепей антитела или его эпитопсвязывающего фрагмента, имеющих SEQ ID NO: 7 и SEQ ID NO: 8;
(b) введение по меньшей мере одной нуклеотидной мутации, делеции, инсерции или добавление в указанную ДНК, так что аминокислотная последовательность указанных вариабельных областей, кодируемых указанной ДНК, изменяется;
(c) обеспечение экспрессии указанной ДНК с получением антитела или его эпитопсвязывающего фрагмента;
(d) скрининг указанного антитела или его эпитопсвязывающего фрагмента на наличие указанных в (b) изменений и выделение антитела или его эпитопсвязывающего фрагмента, которые обладают повышенной аффинностью к CD33.
60. Способ получения антитела или его эпитопсвязывающего фрагмента по любому из пп.1-6, которые обладают повышенной аффинностью к CD33, включающий:
(а) получение ДНК, которая кодирует по крайней мере одну из вариабельных областей тяжелой и легкой цепей антитела или его эпитопсвязывающего фрагмента, имеющих SEQ ID NO: 9 и SEQ ID NO: 10;
(b) введение по меньшей мере одной нуклеотидной мутации, делеции, инсерции или добавление в указанную ДНК, так что аминокислотная последовательность указанных вариабельных областей, кодируемых указанной ДНК, изменяется;
(c) обеспечение экспрессии указанной ДНК с получением антитела или его эпитопсвязывающего фрагмента;
(d) скрининг указанного антитела или его эпитопсвязывающего фрагмента на наличие указанных в (b) изменений и выделение антитела или эпитопсвязывающего фрагмента, которые обладают повышенной аффинностью к CD33.
61. Способ по п.59 или 60, в котором осуществляют по крайней мере одну нуклеотидную мутацию, делецию, инсерцию или добавление способом, выбранным из группы, включающей олигонуклеотид-опосредованный сайт-направленный мутагенез, кассетный мутагенез, ошибочно-направленную PCR, способ "блуждающей" ДНК и использование штаммов-мутаторов Е. coli.
62. Антитело или эпитопсвязывающий фрагмент антитела, полученные способом по п.59 или 60.
63. Выделенный полинуклеотид, кодирующий антитело или его эпитопсвязывающий фрагмент по п.1 или 2.
64. Выделенный полинуклеотид, кодирующий легкую или тяжелую цепь антитела или его эпитопсвязывающего фрагмента по п.1 или 2.
65. Рекомбинантный вектор, включающий полинуклеотид по п.63.
66. Рекомбинантный вектор, включающий полинуклеотид по п.64.
67. Клетка-хозяин, трансформированная рекомбинантным вектором по п.65.
68. Клетка-хозяин, трансформированная рекомбинантным вектором по п.66.
69. Способ получения антитела или его эпитопсвязывающего фрагмента, обладающих способностью связывать CD33, включающий:
(а) культивирование клеток-хозяев по п.67 в условиях, обеспечивающих экспрессию антитела или его эпитопсвязывающего фрагмента клетками-хозяевами; и
(b) выделение полученного в результате экспрессии антитела или его эпитопсвязывающего фрагмента.
70. Способ получения антитела или его эпитопсвязывающего фрагмента, обладающих способностью связывать CD33, включающий:
(а) культивирование клеток-хозяев по п.68 в условиях, обеспечивающих экспрессию антитела или его эпитопсвязывающего фрагмента клетками-хозяевами; и
(b) выделение полученного в результате экспрессии антитела или его эпитопсвязывающего фрагмента.
71. Способ получения CD33 из биологического материала, включающий:
(a) обеспечение контактирования биологического материала с антителом или его эпитопсвязывающим фрагментом по п.1 или 2;
(b) обеспечение возможности связывания антитела или его эпитопсвязывающего фрагмента по п.1 или 2 с CD33 в указанном биологическом материале и
(c) выделение антитела или его эпитопсвязывающего фрагмента, связанного с CD33, из биологического материала с получением CD33 из биологического материала.
Текст
010570 Область, к которой относится изобретение Настоящее изобретение относится к антителам, связывающим CD33. Более конкретно, изобретение относится к антителам, специфичным к CD33, (анти-CD33 антителам), фрагментам и гомологам указанных антител, гуманизированным вариантам таких антител с переуложенной поверхностью, функциональным эквивалентам и улучшенным вариантам этих антител, иммуноконъюгатам и композициям, содержащим эти антитела, и их применению в диагностических, исследовательских и лечебных целях. Кроме того, изобретение также относится к полинуклеотиду, кодирующему антитела, векторам,включающим полинуклеотиды, клеткам-хозяевам, трансформированным полинуклеотидами, и способам получения антител. Уровень техникиCD33-антиген дифференциации лейкоцитов представляет собой состоящий из 364 аминокислотных остатков трансмембранный гликопротеин с последовательностью, гомологичной последовательностям представителей семейства сиалоадгезинов, включая миелин-ассоциированный гликопротеин и CD22, а также и сам сиалоадгезин (S. Peiper, 2002, Leucocyte Typing VII, White Cell Differentiation, Antigens,Proceedings of the Seventh International Workshop and Conference, Oxford University Press, p. 777). Экспрессия CD33, по-видимому, очень характерна для системы кроветворения (гемопоэза), он интенсивно экспрессируется клетками-предшественниками миелоидов (S. Peiper, 2002). Он экспрессируется миелоидпредшествующими клетками, такими как CFU-GEMM, CFU-GM, CFU-G и BFU-E, моноцитами/макрофагами, предшественниками гранулоцитов, такими как промиелоциты и миелоциты, хотя и с пониженной степенью экспрессии при созревании и дифференциации, и зрелыми гранулоцитами, хотя и с низким уровнем экспрессии (S. Peiper, 2002). Напротив, полипотентные гемопоэтические стволовые клетки, которые дают начало колониям бластов in vitro (Leary, A.G. et al., 1987, Blood 69: 953) и которые индуцируют гемопоэтические долговременные культуры (клеток) костного мозга (Andrews R.G. et al., 1989, J. Exp. Med. 169: 1721; Sutherland, H.J. et al., 1989, Blood 74: 1563), похоже, утрачивают способность экспрессировать CD33. Хотя специфическая функция CD33 неизвестна, его гомологичность сиалоадгезину наводит на мысль о том, что эта роль заключается в способности связывания с лектинами, что впоследствии подтвердилось (S. Peiper, 2002). Существенно, что с помощью анти-CD33 моноклональных антител показано, что CD33 экспрессируется дающими клоны клетками, порождающими острую миелоидную лейкемию (AML) более чем в 80% случаев (LaRussa, V.F. et al., 1992, Exp. Hematol. 20: 442-448). Вследствие такого избирательного характера экспрессии CD33 иммуноконъюгаты, в которых объединены цитотоксические лекарства и моноклональные антитела, которые специфично распознают и связывают CD33, предложили использовать для избирательного нацеливания на AML клетки. Ожидалось,что такое лечебное воздействие не подействует на стволовые клетки и первичные предшественники гемопоэза. Было показано, что иммуноконъюгаты на основе анти-CD33 антител, включая иммуноконъюгаты типа анти-CD33-рицина, оказывали высоколетальное действие на AML клетки (Roy, D.C. et al., 1991,Blood, 77: 2404; Lambert, J.M. et al., 1991, Biochemistry 30: 3234), тем не менее, щадя стволовые клетки,которые поддерживают нормальный гемопоэз и воссоздание гемопоэза (LaRussa, V.F. et al., 1992, Exp.Hematol. 20: 442-448). Дополнительные исследования применения иммуноконъюгатов показали быстрое нацеливание меченных радиоактивным изотопом анти-CD33 антител на лейкемические бластные клетки в периферической кровеносной системе и костном мозге при введении их i.v. (Scheinberg, D.A. et al., 1991, J. Clin. Oncol. 9: 478-490; Schwartz, M.A. et al., 1993, J. Clin. Oncol. 11: 294-303). Быстрое поглощение антитела клеткоймишенью наблюдалось также и при исследованиях in vitro (Tanimot, M. et al., 1989, Leukemia 3: 339-348;Divgi, C.R. et al., 1989, Cancer Res. Suppl. Vol. 30: 404a). Изучение гуманизированных анти-CD33 антител,конъюгированных с эффективным противоопухолевым антибиотиком каликеамицином (Gemtuzumab озогамицин), в предклинических опытах продемонстрировало, что они оказывают специфическое поражающее воздействие на лейкемические клетки в HL-60 клеточных культурах, HL-60 опухолевых трансплантатах мыши и пробах костного мозга от AML пациентов (Hamann, P.R. et al., 2002, BioconjugateChem 13: 47-58). Исходя из положительных результатов этих предклинических испытаний, Gemtuzumab озогамицин оценивали на стадиях I и II клинических испытаний. На стадии I испытания основной тип токсичности,которую наблюдали, относился к миелосупрессии вследствие экспрессии CD33 миелоидными клеткамипредшественниками (Sievers, E.C. et al., 1999, Blood 93: 3678-3684; Sievers E.L. et al, 2001, J. Clin. Oncol. 19: 3244-3254). Ha стадии II проводили исследования действия дозы 9 мг/м 2 i.v. спустя 4 ч с повтором через 14 дней, получали уровень ответа 30%. Разрешение на поставку для продажи Gemtuzumab озогамицина было выдано FDA в мае 2000 г. с предписанием лечения пациентов с AML, характеризующейся CD33 в первом рецидиве, при возрасте 60 лет и старше, и которые не рассматриваются как кандидаты для цитотоксической химиотерапии. В отчетах после реализации лекарства отмечалась значительность степени токсичности, особенно при веноокклюзивном заболевании (VOD), что привело к специальным проверкам и разработке программы обследования пациентов. Основная доля этой токсичности может быть от-1 010570 несена к роли лекарственного компонента-каликеамицина, в отношении которого известно, что он характеризовался гепатотоксичностью в предклинических модельных опытах, и поэтому она не может быть прямым результатом прицельного действия на CD33. Несмотря на то, что обсуждаемые результаты дают возможность предполагать, что иммуноконъюгаты, включающие анти-CD33 антитела и цитотоксическое лекарство, могут быть с успехом применены для лечения AML, существует потребность в иммуноконъюгатах, которые были бы и безопасными, и эффективными. Настоящее изобретение направлено на достижение этой и других важных целей. Сущность изобретения Соответственно, объектом настоящего изобретения являются антитела, которые специфически связывают CD33 и которые могут быть использованы при лечении AML. Таким образом, первым объектом изобретения является антитело, его эпитопсвязывающий фрагмент, обладающие способностью связывать CD33. Вторым объектом изобретения является мышиное антитело Му 9-6, которое полностью охарактеризовано здесь путем приведения аминокислотных последовательностей вариабельных областей как легких, так и тяжелых цепей, а также кДНК последовательностей генов вариабельных областей легких и тяжелых цепей, а также за счет идентификации их поверхностных аминокислот, и средствами для их экспрессии в рекомбинантной форме. Третьим объектом изобретения являются гуманизированные или варианты Му 9-6 антитела с переуложенной поверхностью, в которых размещенные на поверхности остатки Му 9-6 антитела или его эпитопсвязывающих фрагментов заменены и в легких, и в тяжелых цепях для достижения обеспечения наибольшего сходства с поверхностными структурами человеческого антитела. Такие гуманизированные антитела более ценны для применения в качестве терапевтических или диагностических средств, чем Му 9-6 антитело мыши. Гуманизированные варианты Му 9-6 антитела также полно охарактеризованы здесь соответственными аминокислотными последовательностями вариабельных областей как легких,так и тяжелых цепей, ДНК последовательностями генов вариабельных областей легких и тяжелых цепей,идентификацией CDR-участков, идентификацией аминокислот их поверхности и раскрытием средств для их экспрессии в рекомбинантной форме. Другой объект изобретения представляет собой антитела или их эпитопсвязывающие фрагменты,включающие по крайней мере один определяющий комплементарность участок, имеющий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NOs: 1-6: и обладающие способностью связывать CD33. Другой объект изобретения представляет собой антитела или их эпитопсвязывающие фрагменты,включающие по крайней мере одну вариабельную область тяжелой цепи и по крайней мере одну вариабельную область легкой цепи, причем указанная вариабельная область тяжелой цепи включает три определяющих комплементарность участка, имеющих аминокислотные последовательности, представленные в SEQ ID NOs: 1-3, соответственно: а указанная вариабельная область легкой цепи включает три определяющих комплементарность участка,имеющих аминокислотные последовательности, представленные в SEQ ID NOs: 4-6, соответственно: Другой объект изобретения представляет собой антитела, имеющие вариабельную область тяжелой цепи с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной на SEQ ID NO: 7: более предпочтительно на 95% идентична аминокислотной последовательности SEQ ID NO: 7 и наиболее предпочтительно на 100% идентична последовательности SEQ ID NO: 7. Аналогично, предложены антитела, имеющие вариабельную область легкой цепи с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности, представленной на SEQ ID более предпочтительно на 95% идентична последовательности SEQ ID NO: 8, наиболее предпочтительно на 100% идентична последовательности SEQ ID NO: 8. Другой объект изобретения представляет собой антитела с гуманизированной или поверхностнопереуложенной вариабельной областью тяжелой цепи, аминокислотная последовательность которой по меньшей мере на 90% идентична аминокислотной последовательности, представленной на SEQ ID NO: 9: более предпочтительно на 95% идентична последовательности на SEQ ID NO: 9 и наиболее предпочтительно на 100% идентична последовательности на SEQ ID NO: 9. Аналогично предложены антитела, имеющие вариабельную область легкой цепи, которая по меньшей мере на 90% идентична аминокислотной последовательности, соответствующей SEQ ID NO: 10: более предпочтительно на 95% идентична последовательности на SEQ ID NO: 10 и наиболее предпочтительно на 100% идентична последовательности SEQ ID NO: 10. Другой объект изобретения относится к иммуноконъюгатам, включающим лекарство или пролекарство, ковалентно связанное непосредственно или через расщепляемый или нерасщепляемый линкер(мостик) с антителом или его эпитопсвязывающим фрагментом по данному изобретению. В предпочтительном варианте лекарство или пролекарство представляет сбой мэйтензиноид, таксоид, СС-1065, аналог СС-1065, доластатин и аналог доластатина. В другом варианте настоящее изобретение представляет собой композицию, включающую антитело или его эпитопсвязывающий фрагмент согласно данному изобретению и лекарство или пролекарство. В другом варианте настоящее изобретение включает фармацевтические композиции, включающие антитело, его эпитопсвязывающий фрагмент или иммуноконъюгат по настоящему изобретению либо по отдельности, либо в сочетании с лекарством, или пролекарством, или иным терапевтическим агентом, в совокупности с одним или несколькими фармацевтически приемлемыми средствами. В другом варианте настоящее изобретение включает антитело или его эпитопсвязывающий фрагмент, имеющие метку, для использования в исследовательских или диагностических целях. В предпочтительных вариантах меткой может служить биотин, энзим, радиоактивный изотоп, флуорофор, хромофор, средство для осуществления томографии или ион металла. В другом варианте настоящее изобретение включает способы ингибирования возрастания экспрессирования CD33 клетками за счет использования заявляемых здесь антитела, его эпитопсвязывающего фрагмента или иммуноконъюгата, по отдельности или в сочетании с лекарством, или пролекарством, или иным терапевтическим средством и, кроме того, отдельно или в совокупности с одним или несколькими фармацевтически приемлемыми средствами. В другом варианте изобретение предусматривает способы лечения пациента с заболеванием, при котором происходит экспрессия CD33, включающие введение антитела, его эпитопсвязывающего фрагмента или иммуноконъюгата данного изобретения, по отдельности или в сочетании с лекарством, или пролекарством, или иным терапевтическим средством и, кроме того, отдельно или в совокупности с одним или несколькими фармацевтическими приемлемыми средствами. Заболевание может быть одно или несколько, например миелодипластический синдром (MDS), острая миелоидная лейкемия (AML), хрони-3 010570 ческая миелоидная лейкемия (CML) и промиелоцитная лейкемия (PML) или другие заболевания, которые еще не определены, при которых экспрессируется CD33. Способы лечения включают in vivo, ex vivo и in vitro применение антител, их фрагментов и иммуноконъюгатов согласно настоящему изобретению, по отдельности или в сочетании с лекарством, или пролекарством, или иным терапевтическим средством и, кроме того, отдельно или в совокупности с одним или несколькими фармацевтически приемлемыми средствами. В другом варианте изобретения предусматривается способ определения, содержит ли биологическая проба миелогенную раковую клетку, который включает контактирование биологической пробы с диагностическим реагентом, например меченым антителом или его эпитопсвязывающим фрагментом по данному изобретению, и детектирования распределения реагента в пробе. Этот способ может использоваться для диагностики рака, такого как острая миелоидная лейкемия (AML), хроническая миелоидная лейкемия (CML) и промиелоцитная лейкемия (PML). В другом варианте настоящего изобретения предлагаются антитела и их эпитопсвязывающие фрагменты, которые обладают улучшенными свойствами. Например, антитела и их эпитопсвязывающие фрагменты, обладающие повышенным сродством (аффинностью) к CD33, могут быть получены стандартными способами иммунизации животных, гибридомной технологией и отбором антител со специфическими характеристиками. Улучшенные антитела могут быть также получены путем доведения аффинности до зрелого уровня,присущего антителу или его эпитопсвязывающему фрагменту, посредством, например, олигонуклеотидопосредованного сайт-направленного мутагенеза, кассетного мутагенеза, подверженной ошибкам ПЦР,перетасовки ДНК и использования дающих мутации штаммов Е. coli. Еще один вариант изобретения предусматривает полинуклеотиды, кодирующие антитела и их эпитопсвязывающие фрагменты по данному изобретению, рекомбинантные векторы, включающие полинуклеотиды, клетки-хозяева, трансформированные рекомбинантными векторами, и способы получения указанных антител и их эпитопсвязывающих фрагментов путем культивирования указанных хозяйских клеток. Последний объект настоящего изобретения относится к способу получения CD33 из биологического материала с использованием антитела согласно настоящему изобретению или его эпитопсвязывающего фрагмента. Краткое описание чертежей На фиг. 1 показаны результаты эксперимента по конкурентному связыванию, в котором анализировалось связывание 125I-меченного Му 9-6 антитела (310-9 М) с CD33-позитивными U-937 клетками в присутствии повышенных концентраций My9 или Му 9-6 антитела. На фиг. 2 показаны Му 9-6 выраженные праймеры для сигнальной последовательности легкой цепи. На фиг. 3 показаны файловые наименования 127 структур антитела из Brookhaven базы данных, которые использовались для прогнозирования поверхности вариабельной области мышиного Му 9-6. На фиг. 4 показаны ПЦР праймеры, используемые для создания вариантов Му 9-6 с (переуложенной) поверхностью, а также химерного Му 9-6 антитела. На фиг. 5 показаны плазмиды, используемые для создания и экспрессии гуманизированных антител.(А): плазмида для клонирования легкой цепи. (В): плазмида для клонирования тяжелой цепи. (С): плазмида экспрессии антител млекопитающего. На фиг. 6 А показаны результаты секвенирования по Edman в сравнении с аминокислотной последовательностью, полученной из произведенных с помощью RT-ПЦР клонов кДНК для muMy9-6 легкой цепи. На фиг. 6 В показаны результаты MS-MS анализа последовательностей пептидных фрагментов 1319Da и 1122Da, содержащих, соответственно, CDR1 и CDR2-последовательности. CDR последовательности показаны жирным шрифтом. На фиг. 7 показаны результаты MS-MS анализа последовательностей пептида 1788Da и соответствующая последовательность, полученная от двух кДНК клонов. На фиг. 8 А показаны последовательность кДНК и выведенная аминокислотная последовательность(SEQ ID NO: 95) вариабельной области легкой цепи Му 9-6 антитела мыши. Три CDR подчеркнуты. На фиг. 8 В показаны последовательность кДНК и выведенная аминокислотная последовательность(SEQ ID NO: 96) вариабельной области тяжелой цепи Му 9-6 антитела мыши. Три CDR подчеркнуты. На фиг. 9 показаны CDR'ы легкой и тяжелой цепей, установленные по определениям Kabat. На фиг. 10 показаны аминокислотные последовательности легкой цепи и тяжелой цепи мышиного Му 9-6 антитела, построенные последовательностями генов 8-12 и V102 зародышевой линии. На фиг. 11A и В показаны десять последовательностей легкой цепи (А) и тяжелой цепи (В) антитела, наиболее гомологичных последовательностям мышиного Му 9-6, которые имеют коммерческие файлы в Brookhaven базе данных. Последовательности следуют по порядку от наибольшей степени гомологии к наименьшей. На фиг. 12 А и В показана средняя доступность (восприимчивость) для каждой Kabat позиции легкой (А) и тяжелой (В) цепей мышиного Му 9-6 антитела. Относительные разрешающие возможности доступа для каждой Kabat позиции десяти обладающих наибольшей степенью гомологии последовательностей легкой и тяжелой цепей усредняли и наносили на ось X.-4 010570 На фиг. 13 А показаны остатки поверхности, обеспечивающие доступность для растворителя десяти в наибольшей степени гомологичных структур легкой цепи, вычисленные с помощью программного компьютерного обеспечения, и показаны средние значения для каждой Kabat позиции, сведенные в таблицу по Excel. Эта таблица содержит данные для не-CDR положений со средней разрешающей возможностью доступа более 25%. Остаток поверхности определяют как остаток со средней разрешающей доступностью более 30%. Позиции с 25-35% средней доступностью далее анализировали, вычисляя среднюю доступность структур только с идентичными остатками в этом положении, а также в двух фланкирующих положениях на другой стороне. NA относится к идентичным фланкирующим положениям, которые не доступны. Положения 15 и 70 требовали дальнейших вычислений, чтобы достичь конечной оценки поверхности, данной в предыдущем столбце. На фиг. 13 В показаны остатки, обеспечивающие доступность для растворения десяти наиболее гомологичных структур тяжелой цепи, вычисленные с помощью программного компьютерного обеспечения, и показаны средние значения для каждой Kabat позиции, сведенные в таблицу по Excel. Эта таблица содержит данные для не-CDR положений со средней разрешающей возможностью доступа более 25%. Остаток поверхности определяют как остаток со средней разрешающей возможностью доступа более 30%. Позиции с 25-35% средней доступностью далее анализировали, вычисляя среднюю доступность структур только с идентичными остатками в этом положении, а также в двух фланкирующих положениях на другой стороне. NA относится к идентичным фланкирующим положениям, которые не доступны. На фиг. 14 показаны остатки поверхности каркасных участков, которые попадают в 5 зону CDR-участка. На фиг. 15 показаны верхние концы пяти последовательностей человека, извлеченные из Kabat базы данных. Ориентация была произведена с помощью SR (Pedersen, 1993). Остатки Му 9-6 мыши, которые попадают в 5 участка CDR, подчеркнуты. На фиг. 16 А и В показаны последовательности вариабельных областей легких цепей 16 гуманизированных Му 9-6 и последовательности вариабельных областей тяжелых цепей 16 гуманизированных Му 9-6, ориентированных как мышечные Му 9-6. Точкапоказывает идентичность последовательности с гуманизированным вариантом 1.0. Остатки поверхности, которые различаются у мышиных и человеческих Му 9-6, подчеркнуты. На фиг. 17 показаны величины KD My9-6, вычисленные путем прямого связывания с помощью HL60 мембран и HL-60 целых клеток, а также анализа конкурентного связывания на HL-мембранах. N=3,кроме , где N=2. На фиг. 18 показаны графики связывания для Му 9-6 человека V1.0. (А): непосредственное связывание с помощью HL-60 мембран. (В): непосредственное связывание с помощью HL-60 целых клеток. (С): конкурентное связывание на HL-60 мембранах. На фиг. 19 показано сопоставление связывания My9-6-DM 1 с Му 9-6 антителом на HL-60 мембранах. На фиг. 20 показана in vitro цитотоксичность My9-6-DM 1 по отношению к CD33-экспрессирующим клеткам опухоли человека. На фиг. 21 показаны результаты эффективности испытаний My9-6-DM1 на SCID мышах с введенными HL-60 ксенотрансплантатами. Вычисляли действие My9-6-DM 1(A) и немодифицированного Му 96 антитела (С) на рост HL-60 опухолей. Вес мыши отслеживали как показатель токсичности (В, D). На фиг. 22 показано сопоставление действия My9-6-DM 1 со свободным лекарством мэйтензином на SCID мышах с введенными HL-60 ксенотрансплантатами (А). Вес мыши отслеживали как показатель токсичности (В). Повторно образовавшиеся опухоли у двух подвергнутых обработке мышей снова подвергли лечению повторным курсом Му 9-6-DM1. На фиг. 23 А и В показано сопоставление противоопухолевого действия Му 9-6-DM1 и стандартной химиотерапии на SCID мышах с большими HL-60 ксенотрансплантатами (А). Вес мыши отслеживали как показатель точности (В). Повторно образовавшиеся опухоли у двух подвергнутых лечению мышей были подвергнуты повторному курсу лечения My9-6-DM 1. На фиг. 24 А и В показан противоопухолевый эффект My9-6-DM 1 по сравнению с Gemtuzumab озогамицином и стандартной химиотерапией на HL-60 модельных животных. HL-60 клетки внутривенно вводили SCID мышам. Обозначенное лечение было начало спустя 11 дней после инъекции клеток. Лечение проводили i.v. ежедневно X 5, кроме Gentuzumab озогамицина (Q4D X 3). Подробное описание изобретения Настоящее изобретение предусматривает новое мышиное специфичное к CD33 антитело и гуманизированные варианты этого антитела. Кроме этого предусматриваются антитела, включающие один или несколько CDR-участков мышиного специфичного к CD33 антитела или его гуманизированного варианта, которые специфически узнают и связывают CD33. Му 9-6 антитело мыши. Специфичное к CD33 антитело мыши согласно настоящему изобретению, которое обозначено здесь по-разному: Му 9-6, мышиное Му 9-6 и muMy9-6, полностью охарактеризовано в отношении предполагаемых присущих зародышевой линии аминокислотных последовательностей вариабельных областей и легкой, и тяжелой цепей (фиг. 10), аминокислотных последовательностей вариабельных областей-5 010570 легкой и тяжелой цепей (фиг. 8 А и В), идентификации CDR-участков (фиг. 9), идентификациии поверхностных аминокислот (фиг. 13 А и В) и средствами для его экспрессии в рекомбинантной форме. Му 9-6 антитело дополнительно охарактеризовано функционально, и показано, что оно с высокой степенью аффинности связывает CD33 на поверхности CD33-позитивных U-937 клеток (фиг. 1). 125Iмеченое Му 9-6 связывается с U-937 клетками и конкурирует с немеченым Му 9-6 в отношении этих клеток и предварительно охарактеризованным как анти-CD33 антитело Му 9 (BioGenex, cat. no. 267 М). Термин вариабельная область используется здесь для описания определенных частей тяжелых цепей и легких цепей антитела, последовательность которых различна для разных антител, которые способствуют специфичному связыванию каждым конкретным антителом его антигена. Вариабельность обычно не распределена равномерно по вариабельным областям антитела. Она обычно концентрируется в трех сегментах вариабельной области, которые называются участками, определяющими комплементарность антитела к антигену (CDR), или гипервариабельными участками вариабельных областей как в легких, так и в тяжелых цепях. Более высококонсервативные части вариабельных областей называются каркасными участками. Вариабельные области легких и тяжелых цепей содержат четыре каркасных участка, принимая напоминающую буквуплоскую конфигурацию, причем каждый каркасный участок,связанный с тремя CDR, образует петли, связывающие бета-подобную плоскую структуру, а в некоторых случаях образует часть этой бета-подобной плоской структуры. В каждой цепи CDR-ы расположены очень близко от каркасных участков и вместе с CDR другой цепи обуславливают образование антигенсвязывающего сайта антитела. Константная область непосредственно не участвует в связывании антитела с антигеном, но выполняет различные эффекторные функции, например вместе с антителом обуславливает антителозависимую клеточную токсичность. Гуманизированное Му 9-6 антитело. Гуманизированные варианты Му 9-6, обозначаемые здесь как huMy9-6, гуманизированные Му 96, также были получены. Целью гуманизации является снижение иммуногенности чужеродного антитела, такого как мышиное, при введении его человеку, с полным сохранением способности аффинного связывания с антигеном и специфичности самого антитела. Гуманизированные антитела можно получать с помощью различных технологий, например путем перестройки (переукладки) поверхности антитела и заменой CDR-участков. Согласно использованному здесь технология переукладки включает комбинацию моделирования молекул, статистического анализа и мутагенеза с тем, чтобы изменить участки поверхности антитела, не являющиеся CDR-участками,вариабельных областей антитела и добиться тем самым сходства с поверхностными участками антител намеченного хозяина. Стратегии и способы конструирования антител и другие методы снижения иммуногенности антител, полученных от другого хозяина, раскрыты в US патенте 5639641 (Pedersen et al.), который во всем своем объеме упомянут здесь в качестве ссылки. В кратком изложении в предпочтительном способе: (1) позиционная группировка (выравнивание) пула вариабельных районов тяжелых и легких цепей антитела позволяет получить совокупность поверхностных расположений каркасных участков вариабельных областей тяжелых и легких цепей, в которой выравнивание позиций для всех вариабельных областей идентично по меньшей мере на 98%; (2) определяют совокупность поверхностно расположенных аминокислотных остатков каркасных участков вариабельных областей тяжелых и легких цепей для антитела грызуна (или фрагмента антитела); (3) идентифицируют совокупность поверхностно расположенных аминокислотных остатков каркасных участков вариабельных областей тяжелых и легких целей, которая в наибольшей степени идентична совокупности поверхностно расположенных аминокислотных остатков грызуна; (4) совокупность поверхностно расположенных аминокислотных остатков каркасных участков вариабельных областей тяжелых и легких цепей, определенную на стадии (2), заменяют совокупностью поверхностно расположенных аминокислотных остатков каркасных участков вариабельных областей тяжелых и легких цепей, идентифицированную на стадии (3), кроме тех аминокислотных остатков, которые находятся в области протяженностью 5 от любого атома любого остатка определяющих комплементарность участков антитела грызуна; (5) получают гуманизированное антитело грызуна, обладающее специфичностью связывания. Антитела могут быть гуманизированы с помощью различных способов, включая замену CDRучастков (ЕР 0239400; WO 91/09967; US патент 5530101; 5585089), обшивку или перестройку поверхности антитела (ЕР 0592106; ЕР 0519596; Padlan E.A., 1991, Molecular Immunology 28 (4/5): 489-498;Studnicka G.M. et al., 1994, Protein Engineering 7 (6): 805-814; Roguska M.A. et al., 1994, PNAS 91: 969973), перетасовку цепи (US патент 5565332). Антитела человека могут быть получены различными способами, известными в данной области, включая способ фагового дисплея. См. также US патенты 4444887, 4716111, 5545806 и 5814318; и опубликованные международные заявки WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741. Как далее описано, CDR-участки Му 9-6 были идентифицированы путем моделирования и их молекулярные структуры были спрогнозированы. Гуманизированные Му 9-6 антитела были затем получены и-6 010570 полностью охарактеризованы. Аминокислотная последовательность легких и тяжелых цепей рядаhuMy9-6 антител показаны на фиг. 16 А и 16 В. Сравнение уровней связывания мышиных и гуманизированных Му 9-6 антител показано на фиг. 17. Кривые связывания для этих антител приведены на фиг. 18. Эпитопсвязывающие фрагменты Му 9-6 антител. Несмотря на то, что эпитопсвязывающие фрагменты мышиного Му 9-6 антитела и гуманизированных Му 9-6 антител обсуждаются здесь по отдельности для мышиного Му 9-6 антитела и его гуманизированных вариантов, понятно, что термин антитело или антитела настоящего изобретения может подразумевать оба полноразмерных muMy9-6 и huMy9-6 антитела, а также эпитопсвязывающие фрагменты этих антител. В соответствии с использованным здесь значением термин фрагменты антитела включает любую часть антитела, которая сохраняет способность связывать CD33, в целом, называемую как эпитопсвязывающие фрагменты. Примеры фрагментов антител предпочтительно включают, но не ограничиваются,Fab, Fab' и F(ab')2, Fd, одноцепочный Fvs (scFv), одноцепочечные антитела, связанные дисульфидными мостиками Fvs (sdFv) и фрагменты, включающие либо VL, либо VH домен. Эпитопсвязывающие фрагменты, включающие одноцепочечные антитела, могут включать вариабельную область (области) саму по себе или в сочетании с частью или полным размером следующего: шарнирная область, CH1, CH2 и CH3 домены. Такие фрагменты могут содержать один или оба Fab фрагмента или F(ab')2 фрагмент. Предпочтительно фрагменты антитела содержат все шесть CDR-участков полного антитела, хотя фрагменты, содержащие меньше, чем все перечисленные области, такие как три, четыре или пять CDR-участков, также функциональны. Кроме того, функциональные эквиваленты могут представлять собой или могут сочетать в себе части любого одного из следующих классов иммуноглобулинов: IgG, IgM, IgA, IgD или IgE и их подклассов.Fab и F(ab')2 фрагменты могут быть получены протеолитическим расщеплением с помощью энзимов, такого как папаин (Fab фрагменты) или пепсин (F(ab')2 фрагменты). Одноцепочные FVs (scFvs) фрагменты представляют собой эпитопсвязывающие фрагменты, которые содержат по крайней мере один фрагмент вариабельной области тяжелой цепи антитела (VH), соединенный по крайней мере с одним фрагментом вариабельной области легкой цепи антитела (VL). Линкером может быть короткий растягивающийся пептид, подобранный, чтобы гарантировать, что в результате соответствующего произвольного трехмерного растяжения (VL) и (VH) областей они соединены так,что целевая молекула сохраняет специфичность связывания полного антитела, из которого получают одноцепочечный фрагмент. Карбоксилсодержащий конец (VL) или (VH) последовательности может быть ковалентно соединен с помощью линкера к аминокислотному концу комплементарной (VL) и (VH) последовательности. Одноцепочечные фрагменты антитела могут быть получены молекулярным клонированием, методом фагового дисплея из библиотеки антител или аналогичными методами, известными специалистам. Эти белки могут быть получены, например, в эукариотических клетках или прокариотических клетках, включая бактерии. Эпитопсвязывающие фрагменты настоящего изобретения могут быть также получены с помощью различных методов фагового дисплея, известных специалистам. В методах фагового дисплея функциональные домены антитела проявляются на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. В частности, такой фаговый дисплей может использоваться для того, чтобы показывать эпитопсвязывающие домены, экспрессируемые с помощью скомплектованной по составу или комбинаторной библиотеки антител (например, человека или мыши). Экспрессирующийся фагом эпитопсвязывающий домен, который связывает желаемый антиген, может быть выбран или идентифицирован антигеном, например, используя меченый CD33 или CD33, связанный или заключенный в твердую поверхность носителя или шарик. Фаги, используемые в этих способах, обычно являются нитчатыми фагами, включающими fd и М 13 связывающие домены, экспрессируемые фагом с Fab, Fv или стабилизированными дисульфидными связями Fv доменами антитела, рекомбинантно слитого либо с фаговым геном III, либо с геном VHI белка. Примеры способов фагового дисплея, которые можно использовать для получения эпитопсвязывающих фрагментов настоящего изобретения, включают такие, которые описаны Brinkman et al., 1995, J.Immunology 57: 191-280; опубликованные РСТ заявки PCT/GB91/01134; PCT заявки WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и US патенты 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108. После отбора фагов области фага, кодирующие фрагменты, могут быть выделены и использованы для того, чтобы воссоздать эпитопсвязывающие фрагменты путем экспрессии в выбранном хозяине,включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжей и бактерий, с помощью технологии рекомбинантных ДНК, например, как описано подробно ниже. Например, технологии рекомбинантного получения Fab, Fab' и F(ab')2 фрагментов также могут быть применены с использованием-7 010570 методов, известных в данной области, как, например, те, что описаны в опубликованной заявке РСТ WO 92/22324; Mullinax et al., 1992, Bio Techniques 12 (6); 864-869; Sawai et al., 1995, AJRI 34: 26-34; Better etal., 1988, Science 240: 1041-1043; данные источники включены здесь в качестве ссылок. Примеры способов, каждый из которых может использоваться для одноцепочечных Fvs и антител, включают описанные в US патентах 4946788 и 5258498; Huston et al., 1991, Methods in Enzymology 203: 46-88; Shu et al., 1993,PNAS 90: 7995-7999; Skerra et al., 1988, Science 240: 1038-1040. Функциональные эквиваленты. Объем настоящего изобретения охватывает также функциональные эквиваленты Му 9-6 антитела и гуманизированных Му 9-6 антител. Под термином функциональные эквиваленты подразумевают антитела с гомологичными последовательностями, химерные антитела, модифицированное антитело и искусственные антитела, причем каждый функциональный эквивалент определяется по его способности связывать CD33. Специалисту понятно, что существует частичное совпадение группы веществ, называемых фрагменты антитела, и группы, называемой функциональные эквиваленты. Антитела с гомологичными последовательностями представляют собой такие антитела, аминокислотные последовательности которых идентичны или гомологичны аминокислотным последовательностям мышиного Му 9-6 или гуманизированного Му 9-6 антител настоящего изобретения. Предпочтительно речь идет об идентичности с аминокислотной последовательностью вариабельных областей мышиного Му 9-6 и гуманизированного Му 9-6 антител настоящего изобретения. Идентичность последовательностей и гомология последовательностей в применении к аминокислотной последовательности определена здесь как последовательность с по меньшей мере примерно 90, 91, 92, 93 или 94% идентичностью последовательности и более предпочтительно по меньшей мере примерно 95, 96, 97, 98 или 99% идентичностью последовательности другой аминокислотной последовательности, что определяется, например, FASTA методом анализа согласно Pearson u Lipman, Proc. Natl. Acad. Sci. USA 85, 2444-2448 (1988). В соответствии с используемым здесь значением химерное антитело - это антитело, различные части которого получены из фрагментов животных, например антитело, имеющее вариабельную область,полученную от моноклонального антитела мыши, спаренную с константной областью иммуноглобулина человека. Методы получения химерных антител известны в данной области. См., например, Morrison,1985, Science 229: 1202; Oi et al., 1986, BioTechniques 4-214; Gillies et al., 1989, J. Immunol. Methods 125: 191-202; US патенты 5807715, 4816567 и 4816397. Искусственные антитела включают scFv фрагменты, антитела с двумерной, тримерной и тетрамерной структурой и mru (см. обзоры Winter, G. and Milstein, С., 1991, Nature 349: 293-299; Hudson, P.J.,1999, Current Opinion in Immunology 11: 548-557), каждое из которых обладает антигенсвязывающей способностью. В одноцепочечном Fv фрагменте (scFv) VH и VL домены антитела связаны растяжимым пептидом. Обычно этот линкерный пептид имеет длину около 15 аминокислотных остатков. Если линкер намного короче, например содержит 5 аминокислот, образуются димерные антитела, которые являются бивалентными scFv димерами. Если линкер уменьшен до менее 3 аминокислотных остатков, образуются тримерные и тетрамерные структуры, которые называются triabodies и tetrabodies. Самая маленькая связывающая единица антитела есть CDR, обычно CDR2 тяжелой цепи, который обладает свойством достаточно специфического распознавания и связывания, так что может использоваться отдельно. Такой фрагмент называется распознающей молекулы единицей, или mru. Несколько таких единиц (т.е. mru) могут быть соединены вместе короткими линкерными пептидами, образуя при этом искусственный связывающий белок с более высокой авидностью, чем у единичного mru. Функциональные эквиваленты настоящего изобретения включают также модифицированные антитела, например антитела, модифицированные ковалентным присоединением молекулы любого типа к антителу. Например, модифицированные антитела включают антитела, которые были модифицированы,например, гликозилированием, ацетилированием, пэгированием, фосфорилированием, амидированием,дериватизацией известных защитных/блокирующих групп, протеолитическим расщеплением, связыванием с лигандами клеток или другими протеинами и т.д. Ковалентное присоединение не предохраняет антитело от генерирования антиидиотипического ответа. Эти модификации могут осуществляться известными способами, включая (без ограничения ими) специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т.д. Кроме того, модифицированные антитела могут содержать одну или более неклассических аминокислот. Функциональные эквиваленты можно получать, взаимно заменяя различные CDR-участки на разных цепях внутри разных каркасных областей. Так, например, различные классы антител способны давать совокупность CDR-участков замещением различных тяжелых цепей, благодаря чему IgG1-4, IgM,IgA1-2, IgD, IgE типы и изотипы антител могут быть получены. Аналогично искусственные антитела,подпадающие под объем настоящего изобретения, можно получать включением имеющейся совокупности CDR-участков в полностью искусственную (синтетическую) каркасную область. Функциональные эквиваленты могут быть легко получены мутациями, делецией и/или инсерцией внутри последовательностей вариабельной и/или константной областей, которые фланкируют определенный набор CDR-участков, используя большой арсенал методов, известных в данной области. Фрагменты антител и функциональные эквиваленты настоящего изобретения охватывают такие мо-8 010570 лекулы с заметной (детектируемой) степенью связывания CD33, которая сравнима с мышиным Му 9-6 антителом. Детектируемая степень связывания включает все значения в диапазоне по меньшей мере 10100%, предпочтительно по меньшей мере 50, 60 или 70%, более предпочтительно по меньшей мере 75,80, 85, 90, 95 или 99% связывающей способности мышиного My9-6 антитела в отношении CD33. Улучшенные антитела.CDR-участки представляются самыми важными в плане распознавания эпитопа и связывающей способности антитела. Однако изменения могут быть внесены в остатки, которые содержат CDR-участки, без нарушения способности антитела распознавать и связывать его родственный эпитоп. Например,могут быть осуществлены изменения, которые не повлияют на распознавание эпитопа, даже увеличат аффинность связывания антитела с эпитопом. Таким образом, в объем настоящего изобретения включаются также улучшенные варианты и мышиных, и человеческих антител, которые также специфически распознают и связывают CD33, предпочтительно с повышенной аффинностью. В некоторых исследованиях изучались результаты одного или нескольких изменений (замен аминокислот) в различных положениях последовательности антитела, основывающиеся на знании первичной структуры антитела и его свойствах, таких как связывание и уровень экспрессии. (Yang, W.P. et al., 1995,J. Mol. Biol., 254, 392-403; Rader, С. et al., 1998, Proc. Natl. Acad. Sci. USA, 95, 8910-8915; Vaughan, T.J. etal., 1998, Nature Biotechnology, 16, 535-539). В этих исследованиях эквиваленты первичного антитела были получены путем изменения последовательностей генов тяжелых и легких цепей в CDR1, CDR2, CDR3 или каркасных участках с использованием способов олигонуклеотид-опосредованного сайт-направленного мутагенеза, кассетного мутагенеза, подверженной ошибкам ПЦР, перетасовки ДНК или дающих мутации штаммов E. coli (Vaughan,T.J. et al., 1998, Nature Biotechnology, 16, 535-539; Adey, N.B. et al., 1996, Chapter 16, pp. 277-291, inPhage Display of Peptides and Proteins, Eds, Kay, B.K. et al., Academic Press). Эти способы изменения последовательности первичного антитела привели к улучшенной аффинности вторичных антител (Gram,H. et al., 1992, Proc. Natl. Acad. Sci. USA, 89, 3576-3580; Boder, E.T. et al., 2000, Proc. Natl. Aacad. Sci.al., 2001, J. Biol. Chem., 276, 27622-27628). Благодаря аналогичной направленной стратегии изменения одного или нескольких аминокислотных остатков в структуре антитела последовательности антител, описанные здесь, могут использоваться для последующего создания антител с улучшенными функциями, включая улучшенную аффиннность по отношению к CD33. Улучшенные антитела включают также такие антитела с улучшенными характеристиками, которые получают стандартными методами иммунизации животных, создания гибридом и отбора антител со специфическими характеристиками. Иммуноконъюгаты. Настоящее изобретение относится также к иммуноконъюгатам, включающим антитела, фрагменты антител, функциональные эквиваленты, улучшенные антитела и их аналоги, которые обсуждались здесь,связанные с лекарством или пролекарством. Предпочтительными лекарствами или пролекарствами являются цитотоксические агенты, и они включают, например, мейтензиноиды и аналоги мейтензиноидов,таксоиды, СС-1065 и аналоги СС-1065, доластатин и аналоги доластатина. Иммуноконъюгаты могут быть получены in vitro способами. Для этого, чтобы связать лекарство или пролекарство с антителом, используют связывающую группу. Подходящими связывающими группами являются группы, хорошо известные в данной области, включающие дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные группы и эстеразолабильные группы. Предпочтительными связывающими группами являются дисульфидные группы и тиоэфирные группы. Например, конъюгаты могут быть получены с использованием дисульфидной обменной реакции или за счет образования тиоэфирной связи между антителом и лекарством или пролекарством. Мейтензиноиды и аналоги мейтензиноидов относятся к предпочтительным цитотоксическим агентам. Примеры подходящих мейтензиноидов включают мейтензинол и аналоги мейтензинола. Подходящие мейтензиноиды раскрыты в US патентах 4424219, 4256746, 4294757, 4307016, 4313946, 4315929,4331598, 4361650, 4362663, 4364866, 4450254,4322348, 4371533, 6333410, 5475092, 5585499 и 5846545. Что касается мейтензиноидов, связывающая группа может представлять собой реакционноспособную химическую группу. В предпочтительном варианте реакционноспособная химическая группа может быть ковалентно связана с мейтензиноидом через дисульфидный образующий связь остаток. Особенно предпочтительными химическими группами являются N-сукцинимидильные эфиры и Nсульфосукцинимидильные эфиры. Особенно предпочтительные мейтензиноиды, включающие связывающую группу, которая содержит реакционноспособную химическую группу, представляют собой С-3 эфиры мейтензинола и его аналогов, в которых связывающий остаток содержит дисульфидную связь, а химическая реакционноспособ-9 010570 ная группа включает N-сукцинимидные или N-сульфосукцинимидные эфиры. Многие положения в молекуле мейтинзинодов могут служить положением, с которым химически связывается связывающий остаток. Например, считается, что С-3 положение, где есть гидроксильная группа, С-14, модифицируемое гидроксиметилом, С-15, модифицируемое гидроксигруппой, и С-20 положение, где есть гидроксигруппа, могут оказаться полезными. Однако С-3 положение предпочтительно,а С-3 положение мейтинзинола особенно предпочтительно. Другие химические связи включают кислотолабильные связи, фотолабильные связи, пептидазолабильные связи и эстеразолабильные связи. Описание US патента 5208020, упомянутого здесь, раскрывает получение мейтензиноидов, несущих такие связи. Как описано детально ниже, в иммуноконъюгате My9-6-DM1 использован тиолсодержащий мейтинзиноид (DM1). DM1 представлен следующей структурной формулой (I): Таксаны также являются предпочтительными цитотоксическими агентами. Таксаны, пригодные для использования в настоящем изобретении, описаны в US патентах 6372738 и 6340701. Конъюгаты на основе таксанов изобретения и связывающего клетки средства можно получить с использованием любых известных на данный момент и усовершенствованных вскоре способов. Указанные способы конъюгации раскрыты в US патентах 5416064 и 5475092. СС-1065 и его аналоги также являются предпочтительными цитотоксическими лекарствами для использования в настоящем изобретении. СС-1065 и его аналоги раскрыты в US патентах 637238,6340701, 5846545 и 5585499. СС-1065 является мощным противоопухолевым антибиотиком, выделенным из культуральной жидкости Steptomyces zelensis. СС-1065 почти в 1000 раз более эффективен in vitro,чем известные используемые лекарства от рака, такие как доксорубицин, метотрексат и винкристин(B.K. Bhuyan et al., Cancer Res., 42, 3532-3537 (1982. Лекарства, такие как метотрексат, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил, каликеамицин, доластатин и аналоги доластатина, также пригодны для получения конъюгатов настоящего изобретения. Молекулы лекарств могут быть также связаны с молекулами антител с помощью промежуточной молекулы носителя, такого как альбумин сыворотки. Ингибирование роста клеток, экспрессирующих CD33. В настоящее изобретение включены также и способы ингибирования роста клеток, экспрессирующих CD33. В этих способах используются антитела или иммуноконъюгаты настоящего изобретения, а также антитела и иммуноконъюгаты настоящего изобретения в сочетании с одним или несколькими дополнительными терапевтическими агентами. Подходящие терапевтические агенты включают такие, которые ингибируют рост клеточной экспрессии CD33 непосредственно или косвенным путем. Как указано здесь, следует понимать, что термины ингибировать и ингибирование подразумевают эффект ингибирования клеточного роста, включая и гибель клеток. Ингибирующий эффект может быть временным, поддерживаемым и постоянным. Терапевтическое применение. Настоящее изобретение включает также терапевтическое использование антител или иммуноконъюгатов настоящего изобретения, при котором антитела и иммуноконъюгаты могут вводиться субъекту в фармацевтически приемлемой дозировочной форме. Они могут вводиться внутривенно в виде болюса или путем непрерывной инфузии в течение периода времени, внутримышечно, подкожно, внутрисуставно, интрасиновиально, подоболочечно, орально, местно или путем ингаляций. Они могут также вводиться внутрь опухоли, около опухоли, интралезионально, перилезионально для оказания как местного, так и общего терапевтического эффекта. Фармацевтически приемлемая дозировочная форма должна, в общем, включать фармацевтически приемлемое средство, такое как носитель, разбавитель и наполнитель. Такие средства хорошо известны, и самое подходящее такое средство может быть подобрано специалистами в данной области в зависимости от клинической ситуации. Примеры таких подходящих носителей, разбавителей и/или наполнителей включают: (1) фосфатный солевой буфер Dulbecco, рН 7,4, содержащий от около 1 до 25 мг/мл сывороточного альбумина человека, (2) 0,9% солевой раствор (0,9% вес/объем NaCl) и (3) 5% вес/объем декстрозы. При иных видах терапевтического использования антитела и иммуноконъюгаты изобретения могут- 10010570 вводиться одновременно с одним или несколькими дополнительными терапевтическими средствами. Терапевтические средства - это такие средства, которые стремятся убить раковые клетки или ограничить их рост с наименьшей опасностью (или вредом) для хозяина. Так что такие средства могут использовать отличия в свойствах раковых клеток (например, метаболизм, васкуляризация, презентация антигена на поверхности клеток) и здоровых клеток хозяина. По разнице в морфологии опухоли определяются потенциальные точки для вмешательства. Например, терапевтическое средство может быть антителом, таким как анти-VEGF антитело, которое используют для замедления васкуляризации внутреннего объема опухоли, снижая тем самым скорость ее роста. Подходящие терапевтические средства включают цитотоксические и цитостатические агенты, но не ограничены ими. Таксол представляет собой предпочтительное терапевтическое средство, которое является также цитотоксическим агентом. Другие терапевтические средства включают (но без ограничения) вспомогательные средства, такие как гранизетрон HCl, ингибиторы андрогенов, например ацетат лейпролида, антибиотики, такие как доксорубицин, антиэстрогены, например тамоксифен, антиметаболиты,например интерферон альфа-2 а, ингибиторы ферментов, например ras фарнезил-трансферазный ингибитор, иммуномодуляторы, например альдеслейкин, и азотсодержащие производные из горчицы, например мелфалан и т.п. При содержании в водной дозировочной форме, а не в лиофилизированной, антитело обычно должно присутствовать от около 0,1 до 100 мг/мл, несмотря на то, что возможны колебания вокруг указанного диапазона. Для лечения заболевания соответствующая дозировка антитела или конъюгата будет зависеть от типа заболевания, которое лечат, как определено выше, тяжести и течения заболевания, от того, вводятся ли антитела с профилактической или терапевтической целью, курса предыдущей терапии, истории болезни больного и реакции на антитело, а также выбора, сделанного лечащим врачом. Антитела удобно вводить пациенту единожды или несколькими приемами. В зависимости от типа и тяжести заболевания доза антитела от около 0,015 до 15 мг/кг массы тела пациента составляет предлагаемое начальное количество для введения пациенту либо, например, путем одного или нескольких введений, либо путем непрерывной инфузии. При повторных введениях в течение нескольких дней или дольше, в зависимости от состояния, лечение продолжают, пока не произойдет желаемое ослабление симптомов заболевания. Однако другие режимы дозировок не исключаются и тоже могут быть использованы. Терапевтические применения настоящего изобретения включают способы лечения пациента, у которого наблюдается заболевание. Заболевания, которые лечат с помощью способов настоящего изобретения, характеризуются экспрессией CD33. Такие заболевания включают миелодипластические синдромы (MDS) и рак, например острую миелоидную лейкемию (AML), хроническую миеловидную лейкемию(CML) и промиелоцитную лейкемию (PML). Специалистам будет понятно, что способы настоящего изобретения могут также использоваться для лечения других заболеваний, которые даже еще не описаны, но будут характеризоваться экспрессией CD33. Терапевтическое применение настоящего изобретения может осуществляться in vitro и ex vivo. Примеры использования in vitro включают очистку популяции клеток, контаминированных СВ 33 позитивными клетками, например клетками миелоидного рода. Способ включает культивирование клеточной популяции в присутствии цитотоксичного Му 9-6 иммуноконъюгата и затем удаление мертвыхCD33-позитивных клеток. Условия неклинического in vitro использования хорошо известны (см., например,Uckin et al., 1986, J. Exp. Med. 163, 347-368; Uckin et al., 1985, J. Immunol. 134, 3504-3515; Ramakrishnan etal., 1985, J. Immunol. 3616-3622). Примеры клинического ex vivo использования включают лечение аутологичного костного мозга до инфузии тому же самому пациенту для того, чтобы убить больные или злокачественные миелоидные клетки (Roy D.C. et al., 1995, J. Clin. Immunol. 15, 51-57). Использование для диагностики и в научно-исследовательских целях. Помимо терапевтического использования описываемых здесь антител, антитела настоящего изобретения могут быть применены в ряде известных специалистам диагностических и исследовательских направлений. Антитела настоящего изобретения могут использоваться, например, для очистки, детекции и нацеливания на CD33, включая как in vitro, так и in vivo методы диагностики. Например, антитела могут использоваться в иммуноанализе для качественного и количественного определения CD33, экспрессируемого клетками в биологических образцах. См., например, Harlow et al., Antibodies: A LaboratoryManual (Cold Spring Harbor Laboratory Press, 2nd ed. 1988), включенный здесь во всем объеме в качестве ссылки. Антитела настоящего изобретения могут использоваться, например, в исследованиях конкурентного связывания, прямого и непрямого сэндвич-анализа и иммунопреципитации (Zola, Monoclonal Antibodies:A Manual of Techniques, pp. 147-158 (CRC Press, Inc., 1987. Антитела изобретения могут также быть полезными в in vivo томографических методах, когда антитело, меченное детектируемым веществом, таким как рентгеноконтрастный агент или радиоактивный изотоп, вводят пациенту, предпочтительно в кровоток, и анализируют содержание и распределение меченого антитела в организме. Такой томографический способ полезен при определении стадии заболева- 11010570 ния и лечении злокачественных опухолей. Антитело может быть мечено любым другим веществом, которое можно детектировать в организмехозяине с помощью ядерного магнитного резонанса, радиологии и других известных средствах детекции. Меткой может быть любое детектируемое вещество, которое способно продуцировать, прямо или косвенно, сигнал, который можно определить. Например, метка может быть биотиновой, энзимной (например, люцифераза, щелочная фосфатаза, бета-галактозидаза и пероксидаза хрена), радиоизотопной(например, 3 Н, 14 С, 32 Р, 35S, 125I), флуорофорной, такой как флуоресцентное или хемилюминесцентное вещество (например, флуоресцеин изотиоцианат, родамин), средством для томографии (например, Тсm99 и индий (111In) и ионом металла (например, галлий и европий). Любой метод, известный в данной области для конъюгирования антитела с меткой, может использоваться, включая методы, описанные Hunter, et al., 1962, Nature 144: 945; David et al., 1974, Biochemistry 13: 1014; Pain et al., 1981, J. Immunol. Meth. 40: 219, Nygren, J., 1982, Histochem. and Cytochem. 30: 407. Антитела данного изобретения пригодны также в качестве средств для аффинной очистки. В этом способе антитела иммобилизуют на подходящем носителе, таком как смола Сефадекс или фильтровальная бумага, методами, известными в данной области. Таким образом, CD33 может быть выделен из биологической пробы и очищен. Полинуклеотиды, векторы, клетки-хозяева и способы создания антитела. Настоящее изобретение, кроме того, предусматривает полинуклеотиды, включающие нуклеотидную последовательность, кодирующую антитело изобретения или его эпитопсвязывающий фрагмент. Настоящее изобретение охватывает также полинуклеотиды, кодирующие полипептид, который связывает CD33 и который гибридизуется в жестких условиях с полинуклеотидами, которые кодируют антитело настоящего изобретения, причем указанные жесткие условия гибридизации включают прегибридизацию в течение 2 ч при 60 С в 6 х SSC, 0,5% SDS, 5 х Denhardt's растворе и 100 г/мл денатурированной нагреванием ДНК спермы лосося; гибридизацию в течение 18 ч при 60 С; двукратное промывание в 4 х SSC, 0,5% SDS, 0,1% пирофосфата натрия, в течение 30 мин при 60 С и дважды в 2 х SSC, 0,1% SDS в течение 30 мин при 60 С. Получение полинуклеотидов и определение нуклеотидной последовательности этих полинуклеотидов может быть сделано любым известным в данной области способом. Например, если нуклеотидная последовательность антитела известна, полинуклеотид, кодирующий антитело, может быть собран из химически синтезированных олигонуклеотидов (например, способом, описанным Kutmeier et al., 1994,BioTechiques 17: 242), который, если кратко, включает синтез частично перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, отжиг и лигирование этих нуклеотидов, а затем амплификацию лигированных олигонуклеотидов с помощью ПЦР. Методы конструирования рекомбинантных векторов, содержащих последовательности, кодирующие антитела, и соответственные сигнальные элементы контроля транскрипции и трансляции, хорошо известны в данной области. Эти способы включают, например, in vitro методы рекомбинантных ДНК,методы синтеза и in vivo генетическую рекомбинацию. Изобретение, таким образом, обеспечивает способные к репликации векторы, включающие нуклеотидную последовательность, кодирующую молекулу антитела настоящего изобретения, или его тяжелые или легкие цепи, или вариабельные домены тяжелых или легких областей, или эпитопсвязывающий фрагмент, операбельно связанные с промотором. Рекомбинантный вектор переносят в клетку-хозяин известными методами и трансформированные клетки затем культивируют известным способом для получения заявленного в настоящем изобретении антитела. Таким образом, изобретение включает объект клетка-хозяин, содержащий полинуклеотид, кодирующий антитело данного изобретения или его эпитопсвязывающий фрагмент, операбельно связанный с гетерологичным промотором. В предпочтительных вариантах векторы, кодирующие и тяжелые, и легкие цепи, могут коэкспрессироваться в клетке-хозяине для экспрессии полной молекулы иммуноглобулина. Различные хозяйские экспресионные векторные системы могут использоваться, чтобы экспрессировать молекулы антитела изобретения. Такие хозяйские экспрессионные системы представляют собой средства, с помощью которых кодирующие последовательности, которые представляют интерес, могут быть произведены и затем очищены, но также представляют собой клетки, которые могут при трансформации или трансфекции соответствующими нуклеотидными кодирующими последовательностями экспрессировать молекулы антитела изобретения in situ. Они включают (но без ограничения) микроорганизмы, такие как бактерии (например, Е. coli, В. subtilis), трансформированные рекомбинантными векторами экспрессии, являющимися ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащими кодирующие антитело последовательности; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными дрожжевыми векторами экспрессии, содержащими кодирующие антитело последовательности; системы клеток насекомых, инфицированные рекомбинантными вирусными векторами экспрессии (например, бакуловирусами), содержащими кодирующие антитело последовательности; растительные клетки, инфицированные рекомбинантными вирусными векторами экспрессии (например,вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или трансформированные рекомбинантными плазмидными векторами экспрессии (например, Ti плазмидой), содержащими кодирующие антитело последовательности; или системы клеток млекопитающего (например, COS, CHO,- 12010570BHK, 293, 3 Т 3 клетки), содержащие в себе рекомбинантные экспрессионные конструкты, содержащие, в свою очередь, промоторы, происходящие из генома клеток млекопитающего (например, металлотионеиновый промотор) или из вирусов млекопитающих (например, аденовирусный последний промотор, промотор вируса 7,5K коровьей оспы). Предпочтительно для экспрессии молекулы рекомбинантного антитела используются бактериальные клетки, такие как Escheriehia coli, и более предпочтительно эукариотические клетки, особенно для экспрессии целей молекулы рекомбинантного антитела. Например, клетки млекопитающего, такие как клетки яичника китайского хомячка (СНО), в сочетании с вектором, таким как основной промежуточный ранний генный промоторный элемент от цитомегаловируса человека, представляют собой эффективную систему для экспрессии антител (Foecking et al., 1986, Gene 45: 101; Cockett et al., 1990, Bio/Technology 8: 2). Для долговременного процесса производства рекомбинантных белков с высоким выходом предпочтительна стабильная экспрессия. Например, могут быть созданы клеточные линии, которые стабильно экспрессируют антитела. Вместо того, чтобы использовать векторы экспрессии, которые включают вирусные ориджины (начальные точки) репликации, хозяйские клетки можно трансформировать ДНК, контролируемой соответствующими элементами контроля экспрессии (например, промоторные, энхансерные последовательности, терминаторы транскрипции, сайты полиаденилирования и т.д.) и специальным маркером. После включения чужеродной ДНК полученным клеткам дают возможность расти 1-2 дня на обогащенной среде, а затем переводят их на селективную среду. Специальный маркер в рекомбинантной плазмиде не поддается отбору и обеспечивает стабильное интегрирование плазмиды клетками в их хромосомы и рост клеток с образованием ими колоний, которые, в свою очередь, могут быть клонированы с развитием до клеточных линий. Такой способ может с успехом применяться, чтобы создавать линии клеток, которые экспрессируют антитела. Такие созданные клеточные линии могут быть особенно подходящими для скрининга и оценки соединений, которые прямо или косвенно взаимодействуют с антителом. Если антитело данного изобретения уже получено с помощью рекомбинантной технологии, оно может очищено любым способом, известным для очистки иммуноглобулинов, например хроматографией(например, ионообменной хроматографией, аффинной, особенно на основе аффинности к специфическому антигену вслед за белком А и сортирующей (по размеру молекул) колоночной хроматографией),центрифугированием, по принципу различной растворимости или любым другим стандартным способом очистки протеинов. Примеры Изобретение описывается с помощью следующих примеров, которые являются только иллюстративными, и их не следует считать ограничивающими данное изобретение. Пример 1. Мышиные Му 9-6 антитела. В этом первом примере раскрываются полная первичная аминокислотная последовательность и последовательность кДНК мышиного антитела настоящего изобретения вместе с их связывающими свойствами и средствами для осуществления экспрессии в рекомбинантной форме. Соответственно, обеспечивается полное и всецелое раскрытие заявляемого антитела и способы его получения, так что любой специалист, знакомый с иммунологией, сможет получить указанные антитела без чрезмерного труда. 1.1. Создание, производство и характеристики Му 9-6 антитела. Для иммунизации использовали 3 Т 3 клеточную линию фибробластов мыши, трансфицированнуюBALB/c мышей-самок возрастом 5 месяцев иммунизировали внутрибрюшинно в день 0 с помощью трансфецированной 3 Т 3 клеточной линии фибробластов мыши (2,5106 клеток, суспендированных в 0,2 млPBS). Далее животным дополнительно вводили по 0,2 мл клеточной суспензии: на 13-й день 5106 клеток; на 20-й день 5106 клеток. На 24-й день мышей забивали и извлекали селезенку. Для получения клеточной суспензии ткань селезенки помещали между двумя замороженными стеклянными пластинками, затем промывали бессывороточной RPMI средой, содержащей пенициллин и стрептомицин (SFM). Полученный осадок клеток селезенки ресуспендировали в 10 мл 0,83% (вес/объем) водного раствора аммоний хлорида в течение 10 мин на льду, чтобы лизировать красные кровяные клетки, и затем промывали бессывороточной средой (SFM). Клетки селезенки (1,6108) объединяли в пробирке с миеломными клетками (5,4107) линии несекретирующих миелому мыши клеток P3 Х 63Ag8.653(АТСС, Rockville, MD; cat. no. CRL 1580) и промывали бессывороточной RPMI-1640 средой (SFM). Супернатант удаляли и осадок клеток разбавляли до концентрации 2107 клеток/мл. Клетки высевали на культуральные тканевые планшеты при загрузке 2107 клеток на лунку, в которые затем наносили по 15 мг/мл конканавалина А. Пластины инкубировали в течение 1 ч при 37 С. Жидкость над осадком в планшетах осторожно удаляли. Медленно прикапывали по капле 1 мл раствора полиэтиленгликоля(40% PEG вес/объем). Пластины слегка встряхнули и инкубировали в течение 30 с. PEG отделили и отбросили. Пластины дважды промыли, медленно добавляя 5 мл SFM и жидкость удалили. После последнего промывания добавили 5 мл SFM, включающей 5% фетальной сыворотки теленка (FBS). Пластины инкубировали в течение ночи при 37 С. После инкубирования клетки соскоблили с пластин скребком для клеток и собрали вместе. Пластины ополоснули и объединили промывочный раствор с клетками.- 13010570 Клетки осадили центрифугированием и ресуспендировали в RPMI-1640 среде для культивирования, в которую добавлены 5% FBS, пенициллин-стрептомицин и гипоксантин/аминоптерин/тимидин (HAT). Клетки засевали в 96-луночный культуральные планшеты для культивирования культур клеток тканей,содержащие питательный слой микрофагов при загрузке 2105 клеток на лунку. Основные условия иммунизации и получения гибридом описаны J. Langone и Н. Vunakis (Eds., Methods in Enzymology, Vol. 121,Immunochemical Techniques, Part I, 1986; Academic Press Florida) и Е. Harlow и D. Lane (Antibodies: ALaboratory Manual, 1988; Cold Spring Harbor Laboratory Press, New York). Другие методы иммунизации и получения гибридом также можно использовать, поскольку они хорошо известны специалистам в данной области. Супернатанты культур от гибридомных клонов скринировали на способность связывания клеток,трансфецированных CD33 антигеном, и клеток гистиоцитной лимфомы человека линии U-937 (АТССCRL-1953.2), а также недостаточность (снижение) способности связываться с клеточной линией фибробластов мыши. Эти клоны культивировали и снова клонировали. Культуральные супернатанты этих субклонов снова подвергали такому же скринингу, как указано выше, на способность связывания. В результате этой процедуры отобрали субклон 3E7-H2-3D8 (My 9-6), гены, соответствующие тяжелым и легким цепям, были клонированы, и последовательности секвенированы, как описано ниже. Скрининг гибридомных супернатантов на специфическое связывание CD33 антигена выполняли с помощью ELISA на клеточных линиях, которые экспрессируют этот антиген, и на клеточных линиях,негативных в отношении этого антигена. Из колб с культурами тканей по отдельности собирали клетки,суспендировали их в среде для культивирования, содержащей 10% FBS, осаждали центрифугированием и промывали PBS. Промытые клетки (100 л от примерно 1-3106 клеток/мл) добавляли в лунки Immulon2HB планшета, покрытого фитогемагглютинином (100 л от 20 г/мл РНА), центрифугировали и давали прикрепиться к ячейкам с нанесенным РНА в течение 10 мин. Планшет с клетками затем слегка встряхнули, чтобы удалить PBS, и высушивали в течение ночи при 37 С. Ячейки блокировали, залив их раствором 5 мг/мл BSA в PBS, и выдерживали в течение 1 ч при 37 С, а затем осторожно промыли PBS. Аликвоты супернатантов гибридомных клонов (100 л; разбавлено блокирующим буфером) были добавлены в ячейки, содержащие клетки, экспрессирующие CD33-антиген, и клетки, не экспрессирующиеCD33, с последующей инкубацией при комнатной температуре в течение 1 ч. Ячейки промыли PBS, инкубировали с конъюгатом IgG-антител козы против антител мыши с пероксидазой хрена (100 л; в блокирующем буфере) в течение 1 ч с последующими промывками, после чего исследовали степень связывания с использованием субстрата ABTS/H2O2. Типичный супернатант от 3 Е 7 гибридомного субклона при инкубации с клетками, обеспечивающими сверхэкспрессирование CD33 антигена, давал сигнал 0,50 единиц поглощения по сравнению с величиной 0,10 единиц поглощения, полученной при инкубации с клетками, негативными в отношении CD33 антигена. Гибридому выращивали в асцитах BALB/c мышей. Сосуду с замороженными клетками гибридомы давали оттаять, затем клетки переносили в колбы для культур тканей, чтобы получить необходимое количество клеток для производства асцитов. Отобранным для первичного введения антигена BALB/c мышам (за 10-14 дней до этого мышам было предварительно инъецировано i.p. 0,5 мл пристана) было введено путем инъекции i.p. 1106 клеток в 0,5 мл фосфатного буферного раствора (PBS). Спустя 12-18 дней после инъекции клеток асцитную жидкость удаляли шприцем из брюшной полости мышей. Собранные асцитные жидкости центрифугировали при 1000 об./мин в течение 5 мин, супернатант был затем подвергнут центрифугированию при 12000 об./мин в течение 30 мин. Антитела выделяли из чистого супернатанта следующим образом. Стадия 1. осаждение сульфатом аммония. Супернатант разбавляли на льду 2 объемами холодного PBS, перемешивали и затем медленно обрабатывали 1 объемом холодного насыщенного (100%) раствора сульфата аммония. Этот раствор оставили на льду в течение около 5 ч, затем центрифугированием собрали осадок. Осадок растворили в небольшом количестве PBS и полученный раствор диализовали в буфере для стадии аффинной очистки с протеином А. Стадия 2. Аффинная очистка на Сефароза-Протеин А. Изотип мышиного Му 9-6 представляет собой IgG 1 с каппа-легкой цепью. Поэтому аффинную колонку уравновешивали 0,1 М трис-HCl буфером, содержащим 3 М NaCl, pH 8,0. Раствор антитела в том же буфере пропускали через колонку, затем колонку хорошо промывали уравновешивающим буфером и затем элюировали 0,1 М уксусной кислотой, содержащей 0,15 М NaCl. Фракции исследовали, измеряя поглощение в ультрафиолете при 280 нм. Фракции, содержащие антитело, объединяли, нейтрализовали 1 М трис-буфером и потом диализовали в PBS и оставляли для дальнейшего использования и хранения. Выделенные антитела вначале исследовали на способность связываться с CD33-экспрессирующими клетками, такими как клетки 3 Т 3 клеточной линии трансфецированных фибробластов мыши и U-937 клеточной линии человека, и отсутствие связывания с антиген-негативными клеточными линиями согласно описанному выше в отношении скринирования гибридомных супернатантов. Для того, чтобы в большей степени удостовериться в специфичности связывания антитела с CD33 антигеном, проводили опыт по конкурентному связыванию между меченым muMy9-6 и коммерчески- 14010570 доступным анти-CD33 антителом Му 9. Эксперимент по связыванию осуществляли по способу, описанному Goldmacher et al. (1989, J. Cell. Physiol. 141, 222-234). My9-6 антитело мыши метили радиоактивным изотопом 125I методом Iodo-gene (Fraker, P.J. и Speck, J.C., 1978, Biochem. Biophys. Res. Commun. 80, 849857). Фиксированное количество (310-9 М) меченного радиоактивным 125I muMy9-6 смешивали с нерадиоактивным антителом при возрастающих концентрациях, либо с немеченым muMy9-6, либо с немеченым Му 9 и смеси затем инкубировали с клетками (1106 клеток в пробе) при 4 С в течение 30 мин. Такое инкубирование проводили в 60 л буфера, состоящего из минимальной специальной среды, модифицированной для суспензионных культур (SMEM), с добавлением 2,5% сыворотки человека. Клетки затем отделяли от среды, содержащей несвязавшийся материал, центрифугированием через смесь силиконового масла (Aldrich) и парафинового масла (Baker) с плотностью 1,009 г/мл. Клеточный осадок удаляли,срезая центрифужные турбы по поверхности масла, и затем использовали для определения радиоактивности клеток с помощью гамма-счетчика (модель RIAgamma 1274 от LKB). Определенную связанную с клетками радиоактивность наносили в виде точек в зависимости от концентраций немеченых конкурирующих антител. Результаты показаны на фиг. 1: оба антитела, Му 9 и Му 9-6, дают схожие кривые конкурентного связывания. Это показывает, что Му 9 и Му 9-6 связывают один и тот же антиген и, более того, оба антитела имеют очень схожую авидность связывания. Поскольку Му 9 является известным из публикаций и признанным анти-CD33 стандартом, был сделан вывод о том, что Му 9-6 является антиCD33 антителом. Му 9 антитело поставляется BioGenex (San Ramon, Ca94583, cat. No. AM267-5M). 1.2. Клонирование генов тяжелых и легких цепей Му 9-6 антитела. Общее количество РНК выделяли из общего содержимого Т 175 сосуда с клетками Му 9-6 гибридомы, как описано в Molecular Protocols (NB1455-p173). Целостность РНК проверяли в 1% MOPS геле, а концентрации определяли УФ-спектрофотометрией. RT реакции проводили с 4-5 г общей РНК с использованием Gibco Supercript II набора и либо олиго dT, либо произвольных гексамерных праймеров.PCR реакции выполняли как по RACE способу, описанному Со et al. (1992, J. Immunol., 148 (4): 1149-54), так и с помощью дегенеративных праймеров, описанных Wang et al. (2000, J. Immunol. Methods. 233: 167-177). Для RACE PCR нужна промежуточная стадия, чтобы добавить поли-dG-хвост к 3'-концам первых цепей кДНК. RT реакционные продукты выделяли с помощью Qianeasy (Qiagen) колонок и элюировали 50 л 1NEB буфер 4. dG-хвостовую реакцию осуществляли с использованием элюата,0,25 мМ CoCl2, 1 мМ dGTP и 5 единиц активности терминальной трансферазы (NEB) в 1NEB буфере 4. Смесь инкубировали при 37 С в течение 30 мин и затем 1/5 реакционной смеси (10 л) добавили непосредственно в PCR-реакционную смесь, чтобы она служила матрицей ДНК.RACE и характеризующаяся признаками вырождения PCR реакции были идентичны, кроме различий в праймерах и матрице. Как отмечалось выше, реакционную смесь с терминальной трансферазой использовали непосредственно как RACE PCR матрицу, тогда как RT реакционную смесь использовали непосредственно для осуществления дегенеративных PCR. В обоих реакционных наборах использовали один и тот же праймер легкой цепи, HindKL:GGAAGATCTATAGACAGATGGGGGTGTCGTTTTGGC (SEQ ID NO: 12). В RACE PCR один poly dC 5'-праймер использовали как для тяжелой, так и для легкой цепей, EcoPolydC: TATATCTAGAATTCCCCCCCCCCCCCCCCC (SEQ ID NO: 13), тогда как вырожденными 5'концевыми PCR праймерами были Sac1MK:GGGAGCTCGAYATTGTGMTSACMCARWCTMCA (SEQ ID NO: 14) для легкой цепи и смесь в равных соотношениях EcoR1MH1:CTTCCGGAATTCSARGTNMAGCTGSAGSAGTCWGG (SEQ ID NO: 16) для тяжелой цепи (смешанные основания: Н=А+Т+С, S=G+C, Y=С+Т, K=G+T, М=А+С, R=A+G, W=А+Т, V=A+C+G, N=A+T+G+C).PCR реакции осуществляли на МУ исследовательской термоциклизующей установке с использованием программы, адаптированной Wang et al. (2000, J. Immunol. Methods. 233: 167-177): 1) 94C, 3 мин; 2) 94C, 15 с; 3) 45C, 1 мин; 4) 72C, 2 мин; 5) обратный цикл постадийно 2 29 раз; 6) финиш с заключительной стадией растяжения при 72 С в течение 10 мин. PCR продукты клонировали в pBluescript IISK+ (Stratagene), используя рестриктазы, созданные PCR праймерами. Клоны тяжелой и легкой цепей были секвенированы с помощью Lark Technologies или Seqwright секвенирующих служб.RACE PCR никогда не была удачной для Му 9-6 легкой цепи. Поэтому для того, чтобы подтвердить 5'-концевые кДНК последовательности, были проведены дополнительные вырожденная PCR и клонирование. Последовательность кДНК легкой цепи Му 9-6, определенная по клонам вырожденной PCR, была введена в NCBI's Blast коксовый вебсайт (ncbi.nlm.nih.gov/BLAST), и начала 5 последовательностей мышиного антитела с представленной сигнальной последовательностью были записаны. Вырожденные PCR праймеры были сконструированы из этих сигнальных пептидов с использованием Codehep программного обеспечения (blocks.fhcrc.org/codehop.html).EcoRI рестрикционные сайты были добавлены к трем Codehop вырожденным праймерам (фиг. 2), и они были использованы в RT-PCR реакциях согласно описанному выше. 1.3. Получение и секвенирование образцов легкой и тяжелой цепей. Тяжелые и легкие цепи muMy9-6 антитела были разделены с помощью SDS-PAGE в условиях,обеспечивающих разделение. Разделенное и денатурированное антитело подвергали электрофорезу в 12% Трис-глициновом геле (Novex, San Diego, CA). После электрофореза гели размещали на Immobilonpsq мембране, используя CAPS/MeOH буфер. После перекладывания мембраны окрашивали Ponseau S. Полосы, соответствующие легкой и тяжелой цепям, были вырезаны для секвенирования белка. Легкую цепь антитела секвенировали непосредственно с мембраны автоматизированной Ealman деградационной технологией на ABI 494 Procise секвенаторе. N-Конец тяжелой цепи был блокирован, так что протеин был подвергнут перевариванию (расщеплению) in situ трипсином в соответствии сGharahdagni, et al. (1996). Переваренную смесь затем анализировали с помощью MALDI-TOF масс-спектрометрии на Kratos Kompact SEQ установке. Отобранные пептиды подвергали MS/MS для определения их последовательностей. Пример 2. Гуманизация вариабельной области антитела путем перестраивания (переукладки) поверхности. Переукладка поверхности Му 9-6 антитела для получения гуманизированных вариантов, пригодных в качестве терапевтических или диагностических средств, в общем, осуществляется согласно принципам и способам, описанным в US патенте 5639641 и следующим образом. 2.1. Прогнозирование поверхности. Восприимчивость к растворителю остатков вариабельной области для ряда антител с растворимыми структурами использовалась для прогнозирования (предсказания) поверхностных остатков для вариабельной области мышиного My9-6 антитела. Доступность в отношении растворителя у аминокислот серии из 127 своеобразных структурных файлов антител (фиг. 3) вычисляли, используя МС программное обеспечение (Pedersen et al., 1994, J. Mol. Biol. 235 (3): 959-973). Десять в наибольшей степени схожих аминокислотных последовательностей легкой цепи и аминокислотных последовательностей тяжелой цепи из этой серии 127 структур были определены путем выравнивания (выстраивания) последовательностей с помощью программного компьютерного обеспечения на NCBI веб-сайте (http://www.ncbi.nlm.nih.gov/BLAST). Среднее значение восприимчивости к растворителю для каждого остатка вариабельных областей этих 10 вариабельных областей антитела вычисляли по Excel развертке поверхности, и положения с восприимчивостью больше 30% среднего значения расценивались как остатки, расположенные на поверхности. Позиции со средней восприимчивостью между 25 и 35% дополнительно оценивались путем вычисления восприимчивости конкретного остатка только таких структур, которые фланкированы с каждой стороны двумя идентичными остатками. 2.2. Молекулярное моделирование. Молекулярную модель вариабельной области мышиного Му 9-6 создавали с помощью Oxford Molecular программного обеспечения AbM. Каркас антитела построили, пользуясь файлами структур для антител с наиболее схожими аминокислотными последовательностями (1 sbs для легкой цепи и 1 bbj для тяжелой цепи), а неканонические CDR-участки были построены в результате изучения С- базы данных по структурам, включающей недублирующиеся растворимые структуры. Модели просматривали с помощьюGlaxoSmithKline Swiss-Pdb Viewer и определяли остатки, лежащие в пределах 5CDR участка. 2.3. Отбор человеческого антитела. Поверхностное расположение вариабельной области мышиного Му 9-6 сравнивали с соответствующими положениями в последовательностях человеческого антитела по Kabat базе данных (Johnson andWu, 2001, Nucleic Acids Res. 29 (1): 205-6). Управление базой данных по антителам с помощью компьютерного программного обеспечения SR (Searle, 1998) использовалось для того, чтобы выделить и сгруппировать поверхностные остатки из пар тяжелой и легкой цепей человеческого антитела естественного происхождения. Для замены поверхностных остатков вариабельных областей мышиного Му 9-6 антитела была выбрана поверхность вариабельных областей человеческого антитела с наиболее идентичными поверхностными остатками и с особым заключением, данным в отношении положений, лежащих в пределах 5CDR-участка. 2.4. Конструирование гена гуманизированного антитела с помощью PCR-мутагенеза.PCR-мутагенез осуществляли с использованием клонов кДНК вариабельной области мышиного Му 9-6, чтобы сначала заменить 5'-концевые последовательности, подобрав последовательность пептида,а затем создать ген Му 9-6 человека (т.е. с переуложенной поверхностью). Были составлены наборы праймеров, предназначенных для создания остатков (антитела) мыши, секвенированных неприродным путем в первоначальных вырожденных PCR клонах (положения в легкой цепи N1, М 3, L4 и S7, положения в тяжелой цепи Q3 и Р 7). Планировалось, что наборы праймеров для гуманизации произведут 6 аминокислотных замен, требуемых для всех вариантов huMy9-6, а дополнительные праймеры предназначались для альтернативной замены четырех 5 остатков (фиг. 4). Реакции PCR проводили на МУ последовательной термоциклирующей установке со следующей программой: 1) 94 С, 1 мин; 2) 94 С, 15 с; 3) 55 С, 1 мин; 4) 72 С, 1 мин;- 16010570 5) обратный цикл постадийно 2 29 раз; 6) финиш с заключительной стадией растяжения при 72 С в течение 4 мин. Продукты PCR расщепляли соответствующими рестриктазами и клонировали вpBluescript клонирующих векторах. Клоны были подвергнуты секвенированию для подтверждения аминокислотных замен. 2.5. Вектор экспрессии для гуманизированных антител. Парные последовательности легкой и тяжелой цепей клонировали в одном векторе экспрессии млекопитающего. PCR праймеры для последовательностей вариабельных областей человека создали сайты рестрикции, что позволило добавлять сигнальную последовательность человека в pBluescript II клонирующий вектор. Вариабельные последовательности можно были потом клонировать в экспрессионную плазмиду млекопитающего с EcoRI и BsiWI или HindIII и ApaI для легкой цепи и тяжелой цепи, соответственно (фиг. 5). Вариабельные последовательности легкой цепи клонировали в корпусе на константную область IgKappa человека, а вариабельные последовательности тяжелой цепи клонировали в последовательность константной области IgGammal человека. В целевых плазмидах экспрессии человеческие CMV промоторы запускают экспрессию последовательности кДНК как легкой цепи, так и тяжелой цепи. 2.6. Транзиентная экспрессия гуманизированных антител. 293 Т клетки культивировали в модифицированной Dulbecco's среде Игла (DMEM, BioWhittaker, 12614F) с 10% инактивированной нагреванием фетальной сыворотки теленка (Hyclone, SH30071.03), 4 мМL-глутамина (BioWhittaker, 17-604E) и 1% смеси пенициллина и стрептомицина (BioWhittaker, 17-603E) при 6% CO2 в 37 С термостате. Трижды в неделю клетки сливали при разбавлении 1:10 для поддержания уровня возрастающей популяции. За 24 ч до трансфекции клетки обрабатывали трипсином (BioWttaker,17-161E); живые клетки подсчитывали методом tripan blue исключения и помещали на 10 см подготовленные планшеты для культур тканей (Coming, 430167) при плотности 2106 клеток на планшет. Непосредственно перед трансфекцией клетки осторожно промывали фосфатным буферным раствором (PBS,разбавленный BioWhittaker 10PBS, 17-517 Q) и на клетки наслаивали 7 мл гибридомы SFM (InvitroGen 12045-076), включающей 1% сыворотки с ультранизким содержанием IgG (Gibco BRL, 16250-078). Методы транзиентной трансфекции были адаптированы с учетом стандартной инструкции QiagenPolyfect. Например, чтобы трансфицировать 10 см планшет, 8 г CsCl типа ДНК соединяли с 300 л гибридомы SFM и 80 л Polyfect реагента для трансфекции (Qiagen, 301107). Трансфекционную смесь встряхивали около 5 с при небольшой скорости и инкубировали в течение 5 мин при комнатной температуре. После инкубации 1 мл гибридомы SFM 1% Ultra Low сывороточного IgG добавили к трансфекционной смеси и перемешивали, набирая смесь пипеткой и прикапывая ее вновь примерно 5 раз. Трансфекционную смесь добавили затем к 7 мл гибридомы SFM, наслоенной на клетки, и планшеты осторожно покрутили, чтобы удостовериться в распределении нанесенного. Трансфекционные реакционные смеси инкубировали в течение ночи, в целом, 16 ч, в инкубаторе для культур тканей. Трансфекционную среду затем осторожно удаляли с клеток и заменили 20 мл гибридомы SFM, 1% Ultra Low IgG. Трансфицированные клетки затем возвратили в инкубатор на 72 ч, после чего собрали супернатанты и определили количество продуцированных антител методом ELISA. Собранный супернатант хранили при 4 С до проведения очистки. 2.7. Очистка гуманизированных антител. Супернатант был подвергнут аффинной протеин А-хроматографии при добавлении 1/10 по объему 1 М Трис-HCl буфера, рН 8,0. Супернатант с отрегулированным рН фильтровали через 0,22 м мембранный фильтр и загружали на протеин А-сефарозную колонку (HiTrap Protein A HP, 1 мл, Amersham Biosciences),уравновешенную связывающим буфером (PBS, рН 7,3). Q-Сефарозная колонка (10 мл) была подсоединена как предшествующая к протеин А-колонке в процессе нанесения пробы для того, чтобы уменьшить загрязнение клеточными компонентами, такими как ДНК. После загрузки пробы предшествующая колонка была удалена и направление протеин А-колонки было восстановлено для промывки и элюции. Колонку промывали связывающим буфером, пока не получили стабильного выхода с отсутствием поглощения при 280 нм. Антитело элюировали 0,1 М ацетоуксусным буфером, содержащим 0,15 М NaCl, pH 2,8, со скоростью течения 0,5 мл/мин. Фракции, примерно по 0,25 мл, собирали и нейтрализовали добавлением 1/10 по объему 1 М ТрисHCl, рН 8,0. Пик фракции(-ий) диализовали в течение ночи против PBS, рН 7,3. Количество антитела определяли, измеряя поглощение при 280 нм, а концентрацию антитела вычисляли, принимая, чтоE2800,1%=1,4. Анализ спектров поглощения и SDS-PAGE антителсодержащих фракций проводили, чтобы удостовериться в их чистоте. Пример 3. Испытания гуманизированных антител. 3.1. Выращивание клеток для исследования связывания.HL-60 клетки были получены из American Type Culture Collection (ATCCCCL-240). Их поддерживали в атмосфере 5% СО 2 и 37 С в термостате с водяной рубашкой (Napco Scientific Co., Taulitan, Oregon). Клетки выращивали в RPMI среде, дополненной L-глутамином (BioWhittaker, Walkersville, MD), содержащей 10% фетальной сыворотки теленка (Hyclone, Logan, Utah), плюс 50 г/мл сульфата гентамицинаHL-60 клетки собирали из Т 75 колб (NUNCLONTM, cat. no. 153732) и центрифугировали при около 300g в течение 5 мин в Omnifuge RT настольной центрифуге (Haereus Separations, Germany) при 4 С. Клетки ресуспендировали при плотности 3106 клеток на мл в FACS буфере, включающем 2% (объем/объем) сыворотки козы (Sigma Chemical Co., Louis, МО) в MEM Alpha Medium с добавлением Lглутамина (Life Technologies, Grand Island, NY). С помощью многоканального дозирующего устройства 3105 клеток было добавлено в лунки Falcon 96-луночного круглого планшета (cat. no. 3077), и затем его поместили на лед. Используя Falcon 96-луночный пластмассовый планшет для анализа, (cat. no. 353911),11 двукратных серийных разведений каждой исследуемой пробы или контрольного образца в двух повторностях было приготовлено в FACS буфере, начиная от начальной концентрации 210-8 М. Затем 100 л каждой пробы или контрольного образца смешивали с клетками. В контрольные лунки вносили толькоFACS буфер. Планшет инкубировали на льду в течение 1 ч и затем центрифугировали в течение 5 мин при 300g в центрифуге с охлаждением. Реагенты удалили из планшетных лунок, быстро перевернув планшет над пустым лабораторным стаканом, содержащим 10% известь. Клетки ресуспендировали при осторожном встряхивании, промыли 1 раз холодным FACS буфером, отцентрифугировали и затем ресуспендировали осторожным вращательным движением. FITS меченные IgG козы к антителам человека(Jackson ImmunoResearch Laboratories, West Grove, PA, cat. no. 109-096-003) и FITS меченные IgG козы к антителам мыши (Jackson ImmunoResearch Laboratories, West Grove, PA, cat. no. 109-095-088) разбавляли 1:100 в FACS буфере и 100 л добавили в соответствующие лунки планшета с исследуемыми пробами. Планшет затем инкубировали на льду в течение еще 1 ч, защищая от света. Несвязавшиеся вторичные антитела вымывали из лунок тем же способом, что и описанный выше. Клетки ресуспендировали, осторожно покачивая планшет, и затем фиксировали их добавлением 120 л/лунку 1%-ного формальдегида в фосфатно-солевом буфере (PBS, 10 мМ фосфат натрия, 150 мМ хлорид натрия, рН 7,2). Планшет с исследуемыми пробами затем анализировали в FACScan проточном цитометре, оборудованном автоматическим устройством для отбора проб из 96 лунок (Becton Dickinson, Mountain View, CA). 3.3. Приготовление мембран плазмы. Мембраны плазмы получали в соответствии со способом, описанным Vater et al. (1995). В целом,HL-60 клетки выращивали до плотности 1106 клеток/мл RPMI с добавлением L-глутамина, содержащей 10% фетальной сыворотки теленка и 50 г/мл сульфата гентамицина. При достижении общего количества клеток 1109 клетки собирали, центрифугировали при около 300g в Omnifuge RT, промывали Hanks сбалансированным солевым раствором (Life Technologies, cat. no. 14175-095) и объединяли в 50 мл конической центрифужной пробирке. Осадок затем замораживали при -80 С в течение по меньшей мере 24 ч,чтобы облегчить лизис клеток и гомогенизацию. Чтобы приготовить мембраны плазмы, осадок быстро размораживали при 37 С и затем хранили на льду; все последующие стадии выполняли при 4 С. Осадок от HL-60 клеток ресуспендировали в 8 мл 10 мМ Трис-HCl буфера, рН 7,0, содержащего 1 мМ ЭДТА,0,25 М сахарозы и 1 мМ фенилметилсульфонилфторида (PMSF). Клеточный осадок переносили потом в 15 мл Dounce дробилку для тканей (Wheaton, Millville, NY) для разрушения клеток (20 ударов устойчивым специальным пестиком из боросиликатного стекла). Гомогенат центрифугировали в Sorval RC-5B охлаждаемой высокоскоростной центрифуге с использованием SS-34 ротора (Wilmington, DE) при 6000 об./мин в течение 10 мин, затем супернатант осторожно отделяли от осадка. Осадок дополнительно промывали 8 мл буфера и обрабатывали, как описано выше. Объединенные супернатанты наслаивали на 1 мл слои буфера,содержащего 37% сахарозы (10 мМ Трис-HCl, 1 мМ PMSF, 1 мМ ЭДТА, рН 7,0) и обрабатывали далее в предварительно охлажденной Beckman L8-M ультрацентрифуге с SW55ti ротором (Beckman Instruments,Palo Alto, CA) при 33000 об./мин в течение 70 мин. Опалесцирующий слой мембран, расположенный как раз над слоем сахарозы, удаляли из каждой пробирки и разбавили 4 объемами 10 мМ Трис-HCl, 1 мМ ЭДТА, 1 мМ PMSF, рН 7,0. Этот раствор затем центрифугировали в течение дополнительных 30 мин при 18000 об./мин в ультрацентрифуге. Супернатант осторожно сливали и полученный осадок ресуспендировали в 10 мМ Трис-HCl, 1 мМ ЭДТА, 1 мМ PMSF, рН 7,0. Препарат HL-60 мембран по аликвотам вносили в 1,5 мл Eppendorf пробирки, замораживали в жидком азоте и хранили при -80 С. Концентрацию общего белка в конечном продукте определяли с помощью PierceTM BCA Assay (Pierce Chemical Company,Rockford, IL, cat. no. 23235). 3.4. Анализ связывания с HL-мембранами.HL-60 мембраны, полученные, как описано выше, были подсушены при начальной концентрации 10 г/мл в деионизированной воде на полистироловой поверхности Immulon 2 96-луночных пластин для анализа (Dynex Laboratories, Chantilly, VA) с помощью Laboconco вакуумного дессикатора (Labconco,Corp., Kansas City, МО) в течение ночи при комнатной температуре. ELISA планшет затем блокировали 1% фракцией V бычьего сывороточного альбумина (Sigma-Aldrich, Inc., St. Louis, MO, cat. no. A-3294),0,05% раствором Твин-20 (Sigma-Aldrich, Inc. St. Louis, MO, cat. no. P-2287) в трис-солевом буфере (50 мМ Трис-HCl, 150 мМ хлорида натрия, рН 7,5, TBS), 300 л на лунку, при 37 С в течение 1 ч. После этой стадии блокирования планшеты осушали от блокирующего буфера и промокали бумажными полотенцами. Готовили двух-, трехкратные серийные разведения испытуемых и контрольных реагентов в блоки- 18010570 рующем буфере в 4 одинаковых повторностях, начиная с 3,1310-9 М до оттитровыванньгх 5,2910-14 М на универсальном 96-луночном планшете для анализов. Негативные контрольные лунки содержали только блокирующий буфер. 50 л каждого разведения переносили в предназначенные лунки на планшете для анализа с наслоенными в лунках мембранами, который затем инкубировали в течение ночи при 4 С. Содержимое лунок потом отсасывали в пустой лабораторный стакан, содержащий 10% (об./об.) извести,и планшет трижды промывали TBS, содержащим 0,1% (об./об.) Твин-20 (промывочный буфер), и промокали бумажными полотенцами. Количество связанных анти-Му 9-6 антител определяли либо с помощьюIgG-HRP козы к антителам мыши, либо с помощью IGG-HPP осла к антителам мыши, разведенным 1:1000 блокирующим буфером в соответствующих лунках. Эти вторичные антитела инкубировали на планшете для анализа в течение 1 ч при комнатной температуре, предохраняя от воздействия света. Планшет промывали и обсушивали, как и ранее. Планшет проявляли, используя ТМВ (BioFX Laboratories,Randallstown, MD, cat. no. TMBW-0100-01), затем погашали стоп-раствором (BioFX Laboratories, Randallstown,MD, cat. no. STRR-0100-01). Планшет для анализа считывался при А 450 нм с использованием TitertekMultiscan Plus MK II планшетного считывателя (Huhtsville, AL). 3.5. Анализ конкурентного связывания на HL-60 мембранах.HL-60 мембраны, приготовленные как описано выше, подсушивали от начальной концентрации 10 г/мл в деионизированной воде на полистироловой поверхности Immulon 2 96-луночного планшета для анализаCity, МО), в течение ночи при комнатной температуре. ELISA планшет блокировали затем 1% альбумином фракции V сыворотки быка (Sigma-Aldrich, Inc., St. Louis, MO, cat. no. A-3294), 0,05% раствором Твин-20 (Sigma-Aldrich, Inc., St. Louis, MO, cat. no. P-2287) в Трис-солевом буфере (50 мМ трис, 150 мМ хлорида натрия, рН 7,5, TBS), 300 л на лунку при 37 С в течение 1 ч. После этой стадии блокирования планшеты осушали от блокирующего буфера и промокали бумажными полотенцами. Готовили две серии двукратных серийных разведений испытуемых и контрольных реагентов в блокирующем буфере, в четырех одинаковых повторностях, начиная с 1,2510-8 М до оттитрованных 2,4410-11 М (2x требуемая конечная концентрация), на универсальном 96-луночном планшете для анализа. Эти немеченые конкурирующие реагенты были потом смешаны с равным объемом 2,510-10 биотинилированных мышиных анти-Му 9-6 (ImmunoGen, Inc., Cambridge, MA); позитивный контроль не содержал конкурирующего реагента, тогда как негативный контроль содержал только блокирующий буфер. 50 л этих смесей переносили в предназначенные лунки с наслоенными мембранами планшета для анализа, который затем инкубировали в течение ночи при 4 С. Содержимое лунок потом отсасывали в пустой лабораторный стакан,содержащий 10% (об./об.) извести, и планшет трижды промывали TBS, содержащим 0,1% (об./об.) Твин-20(промывочный буфер). Планшет потом осушали с помощью бумажных полотенец, а количество связанных биотинилированных мышиных анти-Му 9-6 определяли с помощью 100 л на лунку стрептавидин-щелочной фосфатазы (Jackson ImmunoResearch Laboratories, West Grove, PA, cat. no. 016-050-084), разведенной блокирующим буфером 1:5000. После часа инкубации при комнатной температуре с защитой от света реагент, представляющий собой несвязавшиеся вторичные антитела, вымывали из лунок, планшет проявляли ТМВ (BioFX Laboratories, Randallstown, MD, cat. no. TMBW-0100-01), погашали стоп-раствором(BioFX Laboratories, Randallstown, MD, cat. no. STRR-0100-01). Планшет для анализа подвергали считыванию при А 450 нм, используя Titertek Multiskan Plus MK II планшетный считыватель (Huntsville, AL). 3.6. Клонирование вариабельных областей мышиного Му 9-6 антитела. Вариабельные области мышиного My9-6 антитела клонировали RT-PCR-методами, описанными выше. Некоторые отдельные клоны легких и тяжелых цепей секвенировали, чтобы определить и избежать возможных ошибок, производимых полимеразой последовательностей. Только одна последовательность была получена для легкой цепи, и две отдельные последовательности были отобраны от RTPCR клонов тяжелой цепи. Для подтверждения фактически полученных последовательностей вариабельной области легкой цепи мышиного Му 9-6 пептидные последовательности анализировали по Edman разложению (деградации) с помощью Matrix Assisted Laser Desorption Ionisation (MALDI) и двойной масс-спектрометрии (MSMS). 22 остатка на N-конце легкой цепи Му 9-6 были секвенированы по Edman деградации и представлены на фиг. 6 А. Последовательность начальной кДНК получали от вырожденных RT-PCR клонов, которые соответствовали всем остаткам, кроме 4 остатков, которые аналогично получены с помощью вырожденных праймеров. Пептидная последовательность, определенная Edman разложением, была затем подтверждена RT-PCR клонами, полученными с помощью вырожденных праймеров на 5'-конце сигнальной пептидной последовательности. MS-MS триптически переваренных фрагментов также подтвердил последовательность CDR-участков 1 и 2 легкой цепи (фиг. 6 В). Аналогично с помощью анализа этих пептидов удостоверились в предсказанной аминокислотной последовательности легкой цепи мышиного Му 9-6, полученной на основе RT-PCR клонов вырожденной кДНК. Как обычно принято в отношении последовательностей тяжелых цепей, N-конец тяжелой цепиmuMy9-6 был блокирован пироглутаминовым остатком и поэтому не мог быть подвергнут секвенированию по N-концу Edman разложением. Вместо этого, данные по внутренней последовательности были- 19010570 получены при использовании триптического переваривания и анализа с помощью Matrix Assisted LaserDesorption Ionisation (MALDI) и двойной масс-спектрометрии (MS-MS). Фрагмент величиной 1788 Да идентифицировали с предсказанной последовательностью, идентичной части кДНК клона 2 (фиг. 2). Эта последовательность включает 5 остатков от CDR-3, соответствующих кДНК клона 2, и поэтому является идеальным пептидом для позитивной идентификации тяжелой цепи muMy9-6. Различные RACE PCR клоны, продуцирующие только последовательность, первоначально полученную от вырожденного RTPCR клона 2, также подтвердили эту пептидную последовательность. Объединенные результаты от различных кДНК клонов и анализа пептидных последовательностей обеспечили в результате последовательности легкой и тяжелой цепей мышиного Му 9-6, показанные на фиг. 8. С помощью Kabat и АВМ определений были идентифицированы 3 CDR-участка легкой и тяжелой цепей (фиг. 8 и 9). Поиск в NCBI IgBLAST базе данных показывает, что вариабельная область легкой цепи muMy9-6, вероятнее всего, производится 8-27 геном зародышевой линии мышиного IgVk, тогда как вариабельная область тяжелой цепи, вероятнее всего, производится V102 геном зародышевой IgVh (фиг. 10). 3.7. Определение поверхностных остатков вариабельной области Му 9-6 антитела. Методы переукладки поверхности (resurfacing) антитела, описанные Pedersen et al. (1994, J. Mol.Biol. 235: 959-973) и Roguska et al. (1996, Protein Eng. 9: 895-904), начинаются с прогнозирования поверхностных остатков вариабельных последовательностей мышиного антитела. Поверхностный остаток по определению означает аминокислоту, у которой по меньшей мере 30% общей площади поверхности доступны для молекулы воды. При отсутствии растворимой структуры, чтобы определить поверхностные остатки muMy9-6, 10 антител с самой высокой степенью гомологии в серии из 127 файловых структур антител были выровнены (по одной прямой) (фиг. 11 А и В). Доступность для растворителя для каждойKabat позиции усредняли для этих выравненных последовательностей, а распределение относящихся к каждому из этих остатков способности к доступу (растворителя) показано на фиг. 12. Для некоторых поверхностных положений средние значения доступности составили от 25 до 55%. К ним подходят более внимательно, когда выравнивают только антитела с 2 идентичными остатками,фланкирующими оба конца (фиг. 13 А и В). 25 прогнозируемых поверхностных остатков тяжелой цепиmuMy9-6 оказались неизменными после дополнительного исследования, но положения 15 и 70 по нумерации Kabat в легкой цепи нужно было дополнительно исследовать. Аланин в положении 15 в легкой цепи имел среднюю возможность доступа (восприимчивость) 34,4% от всех десяти структур, но только одна структура, 1 mcp, имела фланкирующие остатки, идентичные тем, что есть в muMy9-6. В этой структуре Ala15 имел относительную возможность доступа только 18,2%. Поскольку в этой единственной структуре Ala15 существенно менее доступен, чем средний остаток для положения 15, три структуры с единственным различием во фланкирующих остатках (Lah2, 1frg и 1hil) были также вместе выровнены. Средняя доступность для этих трех структур оказалась опять 33,3%, делая Ala15 узнанным (предсказанным) поверхностным остатком. Наконец, поверхностно-переуложенные анти-ВЧ, С 242 и явная перестройка их поверхности предсказывают, что положение 15 легкой цепи представляет собой поверхностный остаток. Таким образом, традиционный подход состоит в том, чтобы рассматривать положение 15 легкой цепи muMy9-6 как поверхностный остаток. Положение 70 легкой цепи muMy9-6 также требовало специального исследования, что, в конечном счете, привело к такому же предположению, что это положение является поверхностным остатком. Сначала работы по прогнозированию поверхности в отношении легкой цепи осуществлялись на основе МС данных только для пяти самых гомологичных структур легкой цепи, и в этой группе в качестве поверхностного остатка предполагали Asp70. Позже, при добавлении пяти в наибольшей степени гомологичных структур было обнаружено, что для положения 70 средняя доступность составляет 29,1%, как показано на фиг. 13 А. Кроме того, девять из десяти структур имели идентичные фланкирующие остатки и среднее значение доступности этой серии составило 29,2%. Из-за того, что этот остаток, по-видимому, приближается к 30% граничному значению, а перестройка поверхности с очевидностью позволяет рассматривать положение 70 как положение поверхностного остатка, данные по доступности были дополнительно тщательно исследованы. Положение 70 для структуры 1lve давало относительную доступность, равную 22,5%, что на 5% меньше, чем следующая самая низкая величина относительной доступности, равная 27,2%. Так как 1lve является восьмой из наиболее гомологичных структур, т.е. малозначимым членом этой группы, среднее значение было принято для этих восьми структур с идентичными фланкирующими остатками, за исключением 1lve, и эта группа имела среднее значение доступности 30,1%. Все это вместе с фактом, что первоначальный анализ легкой цепи muMy9-6 и перестройка поверхности достоверно указывают на положение 70 легкой цепи как поверхностное положение, позволило сделать обоснованное предположение, что Asp70 легкой цепи muMy9-6 является поверхностным остатком. 3.8. Молекулярное моделирование для определения, какие остатки попадают в 5 зону CDR-участка. Молекулярную модель, созданную с помощью АВМ программного обеспечения, анализировали,чтобы определить, какие поверхностные остатки muMy9-6 находятся внутри 5 района CDR-участка. Для того, чтобы переуложить поверхность антитела, все поверхностные остатки снаружи CDR-участка должны быть изменены так, чтобы соответствовать человеческим, но остатки, которые находятся внутри 5 зоны CDR-участка, могут также участвовать в связывании с антигеном и оказывать влияние на спе- 20010570 цифичность. Поэтому эти 5 участки следует идентифицировать и сделать заключение по всему способу гуманизации. Определение CDR-участков, используемых для переукладки поверхности антитела, сочетают АВМ определения для CDR2 тяжелой цепи и определения Kabat для оставшихся пяти CDRучастков (фиг. 9). Мышиную модель анализировали с помощью Swiss Viwer программного обеспечения,а на фиг. 14 показаны остатки, которые находятся в 5 зоне любого CDR-участка в последовательности как легкой, так и тяжелой цепи. 3.9. Отбор наиболее гомологичных человеческих поверхностей. Кандидатные поверхности антитела человека для переукладки поверхности muMy9-6 были отобраны по Kabat базе данных последовательностей антител с помощью SR программного обеспечения. Это программное обеспечение предусматривает поиск только обозначенных положений остатков по базе антител. Чтобы хранить исходные пары, остатки поверхности как легкой, так и тяжелой цепей сравнивались вместе. Самые гомологичные человеческие поверхности из базы данных Kabat были выровнены, чтобы классифицировать идентичность последовательностей. Верхние части пяти поверхностей, которые были выровнены с помощью программного обеспечения SR Kabat базы данных, представлены на фиг. 15. Эти поверхности потом сравнивали, чтобы идентифицировать, каким человеческим поверхностям будут доступны самые минимальные изменения внутри 5 зоны CDR-участка. Антитело к вирусу гепатита С,LC3bPB (Ivanovvski M. et al., 1998, Blond 91 (7): 2433-42), требует самого маленького числа изменений поверхностных остатков (всего 10), и только 4 из этих остатков входят в 5 зону CDR-участка. Полноразмерная последовательность вариабельной области muMy9-6 также была выровнена по базе данныхKabat для антител человека с помощью SR, и LC3bPB было идентифицировано как 14-я последовательность, в наибольшей степени сходная с последовательностью вариабельной области человека (данные не показаны). Так как LC3bPB антитело обеспечивает наиболее гомологичную поверхность и требует самого меньшего числа изменений остатков в 5 зоне, оно является самым лучшим кандидатом для переукладки поверхности muMy9-6. 3.10. Конструирование генов Му 9-6 для гуманизированных Му 9-6 антител. Десять изменений поверхностных остатков для huMy9-6 были осуществлены с помощью методаPCR-мутагенеза, как описано выше. Так как 6 поверхностных остатков LC3bPB были удалены больше чем на 5 от CDR-участка, эти остатки были заменены с мышиных на человеческие во всех вариантах гуманизированного Му 9-6 (фиг. 16 А и В). 4 поверхностных остатка, которые оказались в 5 зоне CDR,Kabat положения 1, 3 и 45 легкой цепи и положение 64 тяжелой цепи, были либо заменены человеческими, либо остались мышиными при получении 16 гуманизированных вариантов Му 9-6. Из них наиболее гуманизированным был вариант 1.0, поскольку он содержал все 10 человеческих поверхностных остатков. Наиболее консервативным вариантом в смысле обеспечения максимума аффинности связывания является вариант 1.1, который содержит 4 мышиных поверхностных остатка, находящихся внутри 5 зоны CDR. Каждый из генов гуманизированных Му 9-6 антител клонировали в экспрессионную плазмиду антитела (фиг. 5) для транзиентной и стабильной трансфекции. 3.11. Результаты исследования связывания. Основным достоинством гуманизации путем переукладки поверхности является то, что за счет сохранения мышиных, не лежащих на поверхности каркасных остатков, гуманизированное Му 9-6 должно продолжать связывать CD33 с первоначальной степенью аффинности. Тем не менее, 4 поверхностных остатка, которые лежат внутри 5 зоны CDR-участка, могут внести свой вклад в связывание с антигеном, и, следовательно, изменение (замена) этих остатков могло оказать отрицательный эффект на связывание. Чтобы решить эту задачу, в 16 вариантов гуманизированных Му 9-6 включили все сочетания как человеческих, так и мышиных остатков около каждого из четырех положений остатков, входящих в 5 зону CDR. Этот диапазон охватывает от оптимального или наиболее очеловеченного варианта, 1.0, с остатками антитела человека в каждом положении поверхности, не относящемся к CDR-участку, до самого консервативного варианта, 1.1, в котором сохраняются остатки мышиного антитела в каждом из четырех положений поверхности, входящих в 5 зону, и, следовательно, должен сохранять связывание по дикому типу. Эксперименты по прямому и конкурентному связыванию с гуманизированными вариантами мышиного Му 9-6 и с muMy9-6 проводили на экспрессирующих CD33 лейкемических клетках человека, линииHL-60. Три наиболее гуманизированных варианта (V1.0, М 1.3, V1.6), а также самый консервативный вариант (V1.1) испытывали с использованием и HL-60 мембран, и целых клеток. Фиг. 17 представляетKD величины для каждого параметра, а на фиг. 18 показан график примера связывания для huMy9-6, V 1.0, варианты muMy9-6. KD величины определены для гуманизированных Му 9-6 вариантов, включая наиболее очеловеченный вариант 1.0, попадающий в пределы ошибки опыта величины KD для мышиного Му 9-6. Результаты конкурентного связывания также показывают, что huMy9-6 антитела могут конкурировать за такое же эффективное связывание CD33, как и сами muMy9-6. Учитывая эти результаты, подтверждающие аффинность связывания практически по дикому типу для полностью гуманизированных Му 9-6, V 1.0, на HL-60 мембранах и целых клетках, нет необходимости проверять остальные варианты, т.к. вариант 1.0 является оптимальным гуманизированным Му 9-6 антителом. Мышиное Му 9-6 антитело было полностью гуманизировано без потери связывающей активности.- 21010570 Ни одна из замен поверхностных остатков мыши на остатки антитела человека не привела к потере аффинности связывания, даже несмотря на то, что 4 из этих поверхностных остатков находятся внутри 5 зоны CDR-участка. Считается, что остатки внутри 5 зоны CDR делают потенциально критическими ван-дер-Ваальсовские взаимодействия, которые поддерживают структуру этих CDR-участков. Результаты гуманизации Му 9-6 дают возможность предположить, что количество гуманизированных антител растет, тщательный анализ положений остатков, основанный на подлинных результатах связывания, может стать более эффективным путем нацеливания сомнительных остатков, чем простое наблюдение за неким остатком внутри 5 зоны CDR-участка. Гуманизированное Му 9-6 V 1.0 (huMy9-6) представляет собой четвертое антитело, которое гуманизировали описанным здесь способом. Гуманизация путем переукладки поверхности каркаса вариабельной области мышиного антитела стала усовершенствованием стандартных методов гуманизации,включая замену CDR-участков, которые нуждаются в продолжении усовершенствования и разработке новых технологий для сохранения связывающей активности. Этому может быть противопоставленоhyMy9-6 антитело с переуложенной поверхностью, которое включает замены только 10 поверхностных остатков с получением полноценного по активности антитела с поверхностью, полностью соответствующей поверхности антитела человека. Пример 4. Иммуноконъюгат на основе My9-6-DM1. Проводили предклинические исследования воздействия Му 9-6 антитела, конъюгированного с лекарственной формой DM1 мейтензиноида, на ксенотрансплантаты опухоли человека в мышах. Как обсуждается ниже, My9-6-DM1 сохраняло специфичность и аффинность связывания CD33 немодифицированного антитела и показало мощную антигенспецифичную цитотоксичность по отношению к CD33-позитивным опухолевым клеткам in vitro. Лечение SCID мышей с индуцированными подкожными HL-60 опухолевыми ксенотрансплантатами с помощью My9-6-DM1 приводило к полному исчезновению опухолей при дозах (20 мг конъюгированного антитела/кг/день i.v.5 дней), которые показали отсутствие токсичности и были значительно ниже максимально допустимой дозы. Обработка только Му 9-6 антителом, напротив, не показала эффекта на рост опухоли HL-60 по сравнению с контролем, в качестве которого был использован разбавитель. Аналогичное лечебное действие наблюдалось и в отношенииMy9-6-DM1 при обработке мышей с подкожными ТНР-1 ксенотрансплантатами. 4.1. Реагенты. Антитело представляло собой мышиное моноклональное Му 9-6 антитело против человеческогоCD33, описанного выше. Модифицирующий антитело агент представлял собой N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP) Цитотоксическим лекарством был аналог мейтензина, DM1, который синтезируют из продукта, полученного культивированием микроорганизмов, анзамитоцина Р 3. DM1 является сильным ингибитором тубулиновой полимеризации.My9-6-DM1 получали модифированием Му 9-6 с помощью SPP, чтобы ввести 3-5 пиридилдитиогрупп на молекулу антитела. Дисульфидные изменения между тиоловым радикалом в DM1 и активной дисульфидной функциональной группой в антителе обеспечили получение DM1-содержащего конъюгата с антителом.(n может быть любым целым числом.) 4.3. Анализ связывающей способности антитела и конъюгата на основе антитела с помощью проточной цитометрии.HL-60 клетки инкубировали с различными концентрациями и Му 9-6 антитела, и My9-6-DM1. Затем клетки промывали и инкубировали с вторичным FITC-меченным антимышиным IgG антителом. После дополнительного промывания клетки фиксировали 2% формальдегидом и зависимую от клеток флуоресценцию определяли с помощью BD FACScan проточного цитометра. My9-6-DM1 сохраняет способность специфического связывания с CD33, сравнимую с немодифицированным антителом (фиг. 19). 4.4. Исследование in vitro цитотоксичности. Цитотоксичность My9-6-DM1 измеряли, используя CD33-экспрессирующие ТНР-1 клетки и линиюCD33-негативных клеток Namalwa. Клетки помещали в 96-луночные планшеты, содержащие конъюгат, и инкубировали при 37 С, пока не формировались колонии (2-3 недели). Колонии подсчитывали и выжившие фракции определяли, используя при вычислениях Poisson распределение. 4.5. Изучение in vivo мышиных опухолевых трансплантатов. Подкожная модель опухоли-HL-60 промиелоцитные клетки лейкемии человека (5106 клеток в 0,1 мл) были подкожно инокулированы в правый бок SCID мышам-самкам. Мыши получали потом внутривенную инъекцию в латеральную хвостовую вену, начиная с момента, когда опухоли достигали размера 100 мм 3(400 мм 3 для крупных моделей опухолей). Размер опухоли и вес мыши измеряли дважды в неделю. Модель выживания - HL-60 клетки (5106 клеток в 0,1 мл) - внутривенно вводили в латеральную хвостовую вену SCID мышам-самкам. Спустя 11 дней после инъекции клеток опухоли начинали лечение. Каждый день мышей осматривали и проверяли на предмет умирания, массы опухоли или гибели. Массу тела определяли дважды в неделю. 4.6. In vitro специфичность и эффективность My9-6-DM1. С помощью клоногенного анализа исследовали цитотоксичность My9-6-DM1 по отношению к CD33-экспрессирующим клеткам (ТНР-1) по сравнению с линией CD33-негативньгх клеток (Namalwa),причем активность убивания клеток определяли, подсчитывая количество колоний, которые смогли вырасти после обработки. My9-6-DM1 показывает высокую активность убивать клетки в отношении CD33 позитивных клеток опухоли человека in vitro (фиг. 20). Никакой значительной токсичности в отношенииCD33-негативных клеток не наблюдалось, что показывает, что CD33-зависимая цитотоксичность была следствием специфической направленности анти-CD33 антитела, Му 9-6. 4.7. Эффективность My9-6-DM1 против ксенотрансплантатов опухоли человека в мышах. Эффективность My9-6-DM1 in vivo определяли с помощью SCID-мышей с ксенотрансплантатамиHL-6-опухолевых клеток человека. HL-60 клетки инъецировали подкожно и опухолям давали расти до среднего размера 100 мм 3. My9-6-DM1 конъюгат вводили i.v. раз в день в течение 5 дней в дозах, показанных на фиг. 21. Дозировка выражается в мг антитела в конъюгате, что соответствует дозе DM1 примерно 15 г DM1/мг антитела. Объем опухоли измеряли как показатель эффективности лечения, а массу тела мыши регистрировали, чтобы показать токсичность во время лечения. Му 9-6-DM1 обеспечивает долговременный курс лечения мышей с ксенотрансплантатами HL-60 клеток человека при дозах, обуславливающих низкую токсичность (фиг. 21). При 2 самых высоких исследуемых дозах (19 и 26 мг/кг) наблюдали полную регрессию опухолей при максимуме потери массы тела менее чем на 10% (фиг. 21 А и В). Даже при самой низкой исследуемой дозе (13 мг/кг) 2 из 5 мышей полностью вылечились, хотя- 23010570 остальные 3 мыши показали регрессию опухоли с замедлением роста опухоли приблизительно в течение 20 дней. Подобные результаты наблюдались также с ТНР-1 линией клеток лейкемии, когда My9-6-DM1 привело к долговременному курсу лечения мышей с ТНР-1 ксенотрансплантатами опухоли человека(данные не показаны). Эти результаты резко контрастируют с полученными от лечения только Му 9-6 антителом. Антитело само по себе не оказывало воздействия на рост клеток опухоли даже при дозе 50 мг/кг (фиг. 21 С). Активность My9-6-DM1 сравнивали с соответствующим анти-CD33 антитело-каликеамициновым конъюгатом Gemtuzumab озогамицином. Gemtuzumab озогамицин вводили ежедневно 4 дня в виде 3 доз. Предварительный опыт показал, что Gemtuzumab озогамицин в опубликованном MTD для бесшерстных мышей (0,3 мг/кг) был слишком токсичен для SCID мышей (данные не приводятся). Значительная токсичность наблюдалась также при дозе в 100 и 200 г/кг в этом опыте (фиг. 21F). Gemtuzumab озогамицин показал только слабую регрессию опухоли и снижение роста в этой модели (около 25 дней) при максимуме допустимой дозы (100 г/кг) (фиг. 21 Е). В другом эксперименте антиопухолевая активность My9-6-DM1 конъюгата сравнивалась с активностью неконъюгированного исходного лекарства, мейтензина. Мышей с HL-60 опухолевым ксенотрансплантатами ежедневно в течение 5 дней обрабатывали конъюгатом при 23 мг антитела/кг или 350 гDM1/кг; неконъюгированным лекарством при 350 г/кг или неконъюгированным антителом при 23 мг/кг. 3 из 6 мышей, леченных только мейтензином, умерли спустя 2 дня после лечения, что показывает, что такой уровень лекарственного средства слишком токсичен. Однако лекарство оказало значительный импульс на рост опухолей у оставшихся 3 мышей с замедлением роста приблизительно на 10 дней (фиг. 22). Му 9-6 антитело само по себе не оказало влияния на рост опухоли, в то время как My9-6-DM1 конъюгат вызвал полную регрессию опухолей. Влияние лечения конъюгатом на вес мыши (12% снижение) немного больше, чем в предыдущем опыте, и может отражать отклонения в процессе синтеза конъюгата. Разрушение опухоли 2 из 6 обработанных конъюгатом мышей наблюдалось, начиная с 70 дня. Этих животных подвергали повторному лечению My9-6-DM1, аналогично первому курсу. Повторный курс обработки привел к полной регрессии рецидивирующих опухолей без побочно наблюдаемой токсичности, что наводит на мысль о том, что прекращение роста опухоли и ее регрессия не являются следствием роста конъюгат-устойчивых клеток. Мощное действие My9-6-DM1 в этой ксенотрансплантатной модели дает возможность предполагать, что конъюгат может быть эффективным даже против больших HL-60 опухолей. Опухолям давали расти до размена опухоли 400 мм 3 до начала лечения. Кроме этого, проводили сравнение активностиMy9-6-DM1 с обычными химиотерапевтическими лекарствами. My9-6-DM1 вызвал полную регрессию больших опухолей у SCID-мышей. (фиг. 23 А и В). Снова рецидивирующие опухоли (2 из 6 мышей) оказались чувствительными ко второму курсу лечения My9-6-DM1. Лечение стандартными химиотерапевтическими средствами (Ara-С и идарубицин) оказало небольшой эффект на рост опухоли. Более высокие дозы лекарств были очень токсичными для мышей (не показано). 4.8. Эффективность My9-6-DMl в HL-60-клетках мышиных моделях выживания. В то время как эффективность My9-6-DM1 в опухолевых ксенотрансплантатных моделях является поразительной, интересно проследить за активностью конъюгата в мышиных моделях выживания, гдеHL-60 клетки инъецировали мышам непосредственно в хвостовую вену. В этой модели контрольные мыши умирали между 30 и 50 днем после инъекции клеток. У мышей, леченных My9-6-DM1, начиная с 11 дня после инъекции клеток, наблюдался значительный подъем в плане выживаемости, когда 7 из 8 мышей прожили 70 дней (фиг. 24 А). Мейтензин сам по себе дал заметный импульс выживанию мышей в этой модели, хотя 2 из 8 мышей умерли сразу после начала лечения, демонстрируя токсичность лекарства. Относительная эффективность мейтензина в этой модели в сравнении с подкожной ксенотрансплантатной моделью приводит к заключению, что HL-60 опухоли могут быть более чувствительными к действию лекарства в этой системе. Дополнительная задержка в начале лечения может демонстрировать более заметную разницу между меченым и немеченым лекарством. Однако даже в этой модели стандартная химиотерапия не обеспечивает существенного повышения выживаемости (фиг. 24 В). Самая высокая комбинированная доза показала существенную явную токсичность лекарства. И Му 9-6 антитело само по себе, и Gemtuzumab озогамицин показали очень небольшое повышение выживаемости. Заявление о депонировании Гибридома, с помощью которой были получены мышиные Му 9-6 антитела, была депонирована вAmerican Type Culture Collection, PO BOX 1549, Manassas, VA 20108, 7 ноября 2002 года согласно требованиям Будапештского Договора и зарегистрирована под номером РТА-4786. Определенные патенты и публикации упомянуты в настоящей заявке, раскрытие каждого из них во всей их полноте включено здесь в виде ссылок. Хотя изобретение описано подробно и со ссылкой на отдельные варианты изобретения, специалисту будет понятно, что возможны различные его изменения и модификации без искажения сути и объема изобретения.
МПК / Метки
МПК: A61K 39/395, C07H 21/04, A61K 39/40, A61P 35/02, C12N 5/16, C12N 15/00, A61K 39/44, A61K 39/42, C12N 5/06
Метки: применения, способы, антитело
Код ссылки
<a href="https://eas.patents.su/30-10570-antitelo-k-cd33-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитело к cd33 и способы его применения</a>


































