Усовершенствованные аденовирусные векторы и их применение
Формула / Реферат
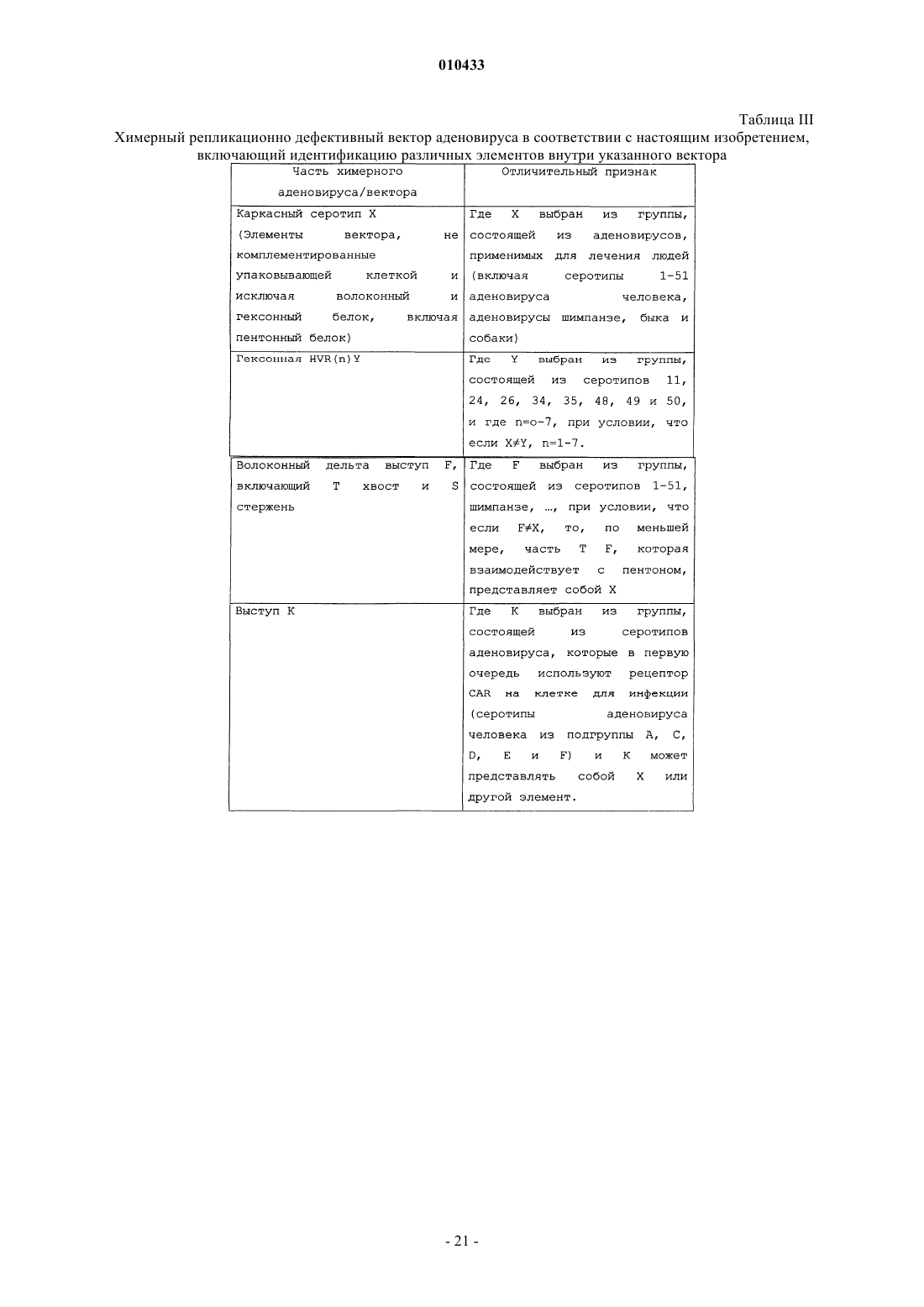
1. Партия рекомбинантного дефектного по репликации аденовируса на основе серотипа подгруппы С, причем указанный аденовирус включает химерный гексонный белок, где указанный химерный гексонный белок включает последовательности гипервариабельной области с HVR1 по HVR7 из серотипа подгруппы В или D или из серотипа Pan9 аденовируса шимпанзе и где последовательности между последовательностями HVR относятся к указанному серотипу подгруппы С.
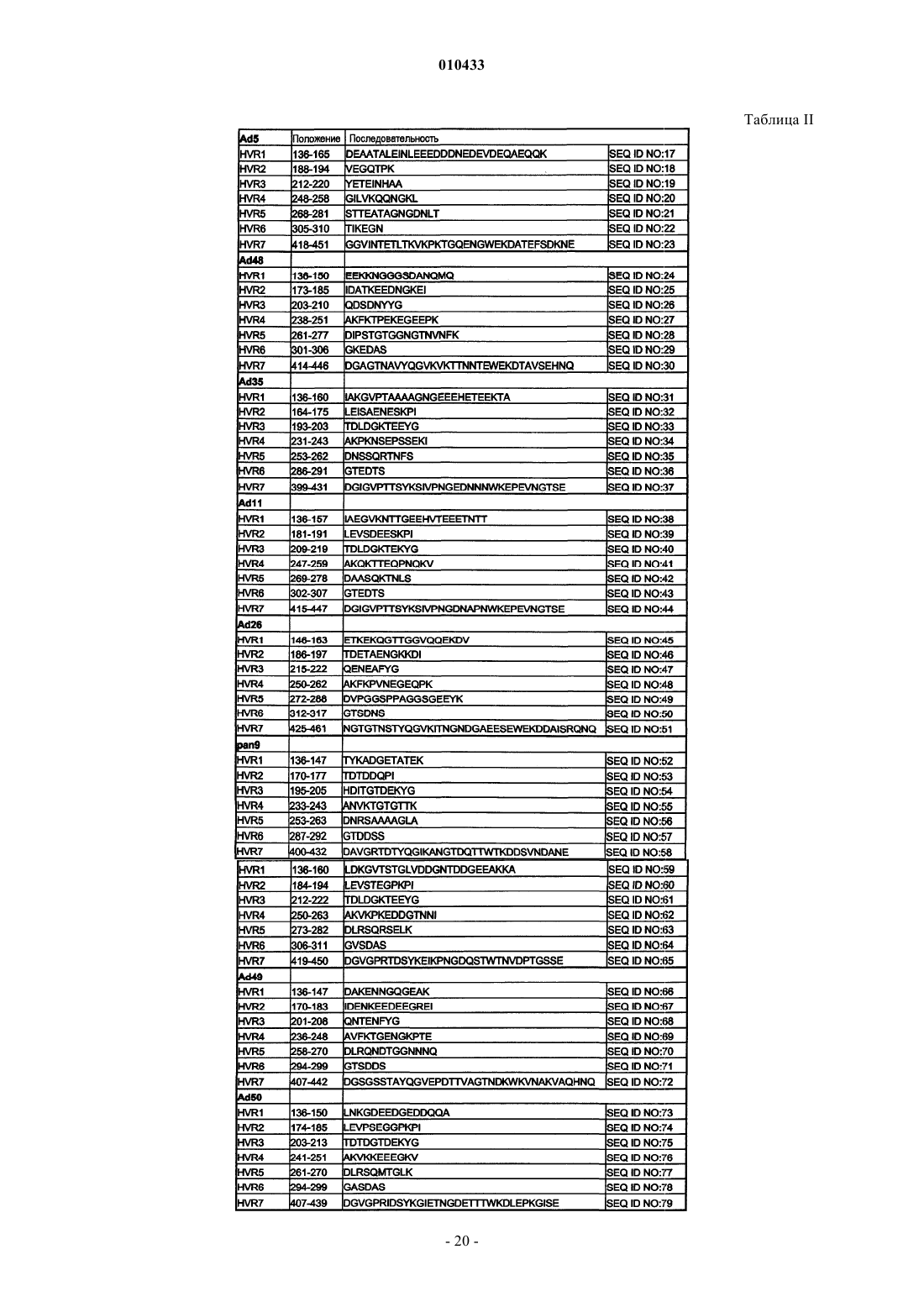
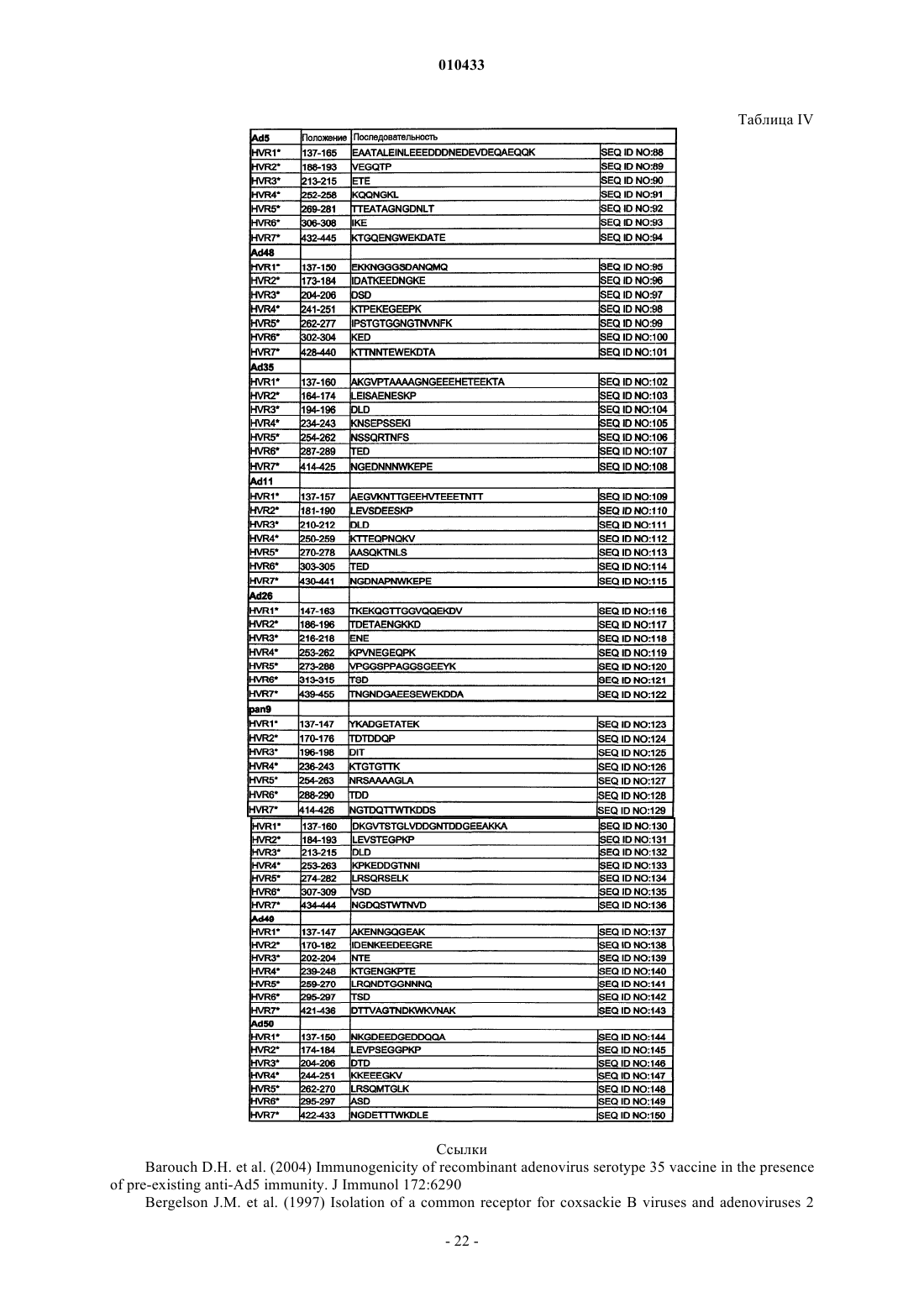
2. Партия по п.1, где последовательность HVR1 выбрана из SEQ ID NO: 24, 31, 38, 45, 52, 59, 66 и 73, где последовательность HVR2 выбрана из SEQ ID NO: 25, 32, 39, 46, 53, 60, 67 и 74, где последовательность HVR3 выбрана из SEQ ID NO: 26, 33, 40, 47, 54, 61, 68 и 75, где последовательность HVR4 выбрана из SEQ ID NO: 27, 34, 41, 48, 55, 62, 69 и 76, где последовательность HVR5 выбрана из SEQ ID NO: 28, 35, 42, 49, 56, 63, 70 и 77, где последовательность HVR6 выбрана из SEQ ID NO: 29, 36, 43, 50, 57, 64, 71 и 78 и где последовательность HVR7 выбрана из SEQ ID NO: 30, 37, 44, 51, 58, 65, 72 и 79.
3. Партия по п.1, где последовательность HVR1 выбрана из SEQ ID NO: 95, 102, 109, 116, 123, 130, 137 и 144, где последовательность HVR2 выбрана из SEQ ID NO: 96, 103, 110, 117, 124, 131, 138 и 145, где последовательность HVR3 выбрана из SEQ ID NO: 97, 104, 111, 118, 125, 132, 139 и 146, где последовательность HVR4 выбрана из SEQ ID NO: 98, 105, 112, 119, 126, 133, 140 и 147, где последовательность HVR5 выбрана из SEQ ID NO: 99, 106, 113, 120, 127, 134, 141 и 148, где последовательность HVR6 выбрана из SEQ ID NO: 100, 107, 114, 121, 128, 135, 142 и 149 и где последовательность HVR7 выбрана из SEQ ID NO: 101, 108, 115, 122, 129, 136, 143 и 150.
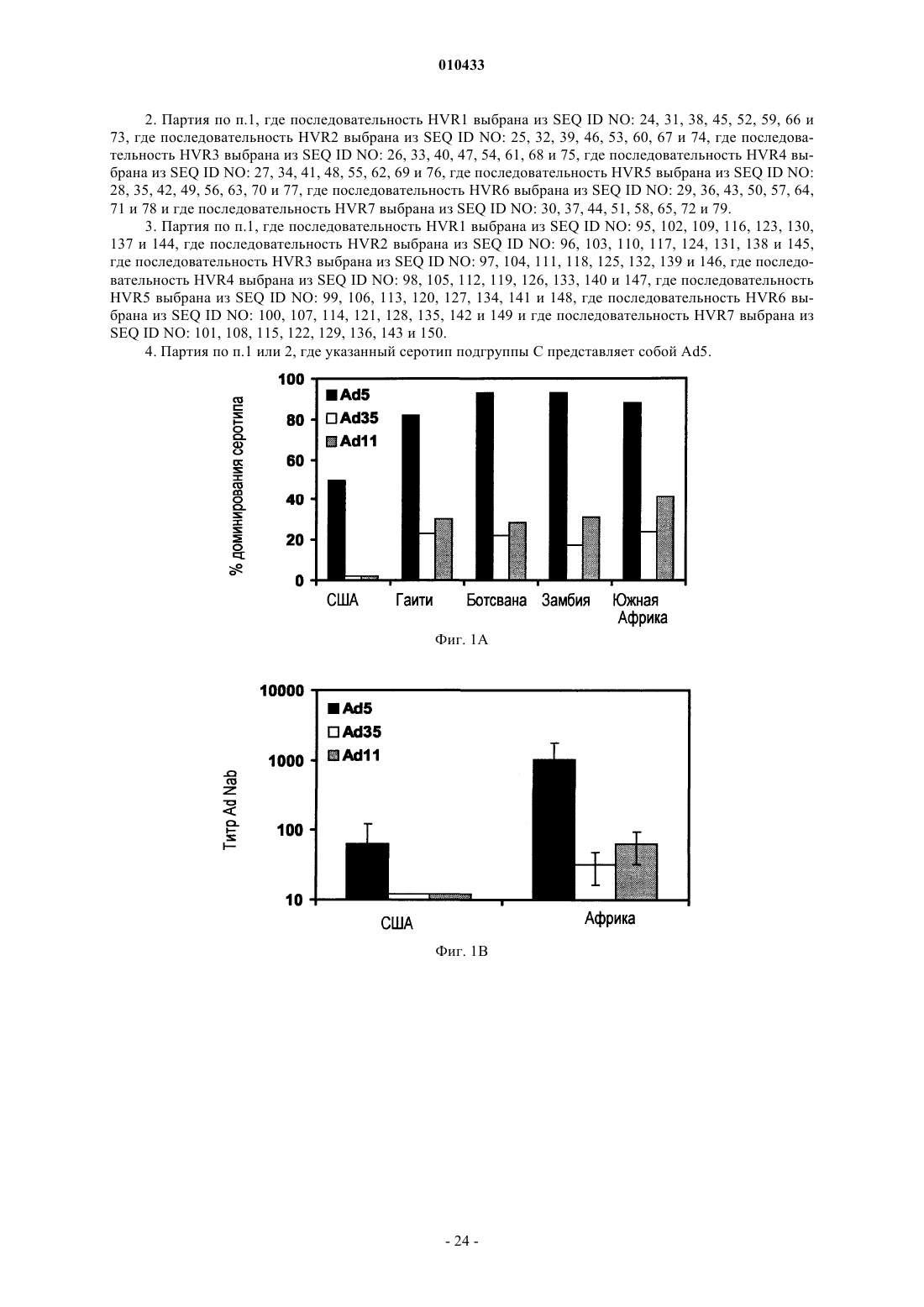
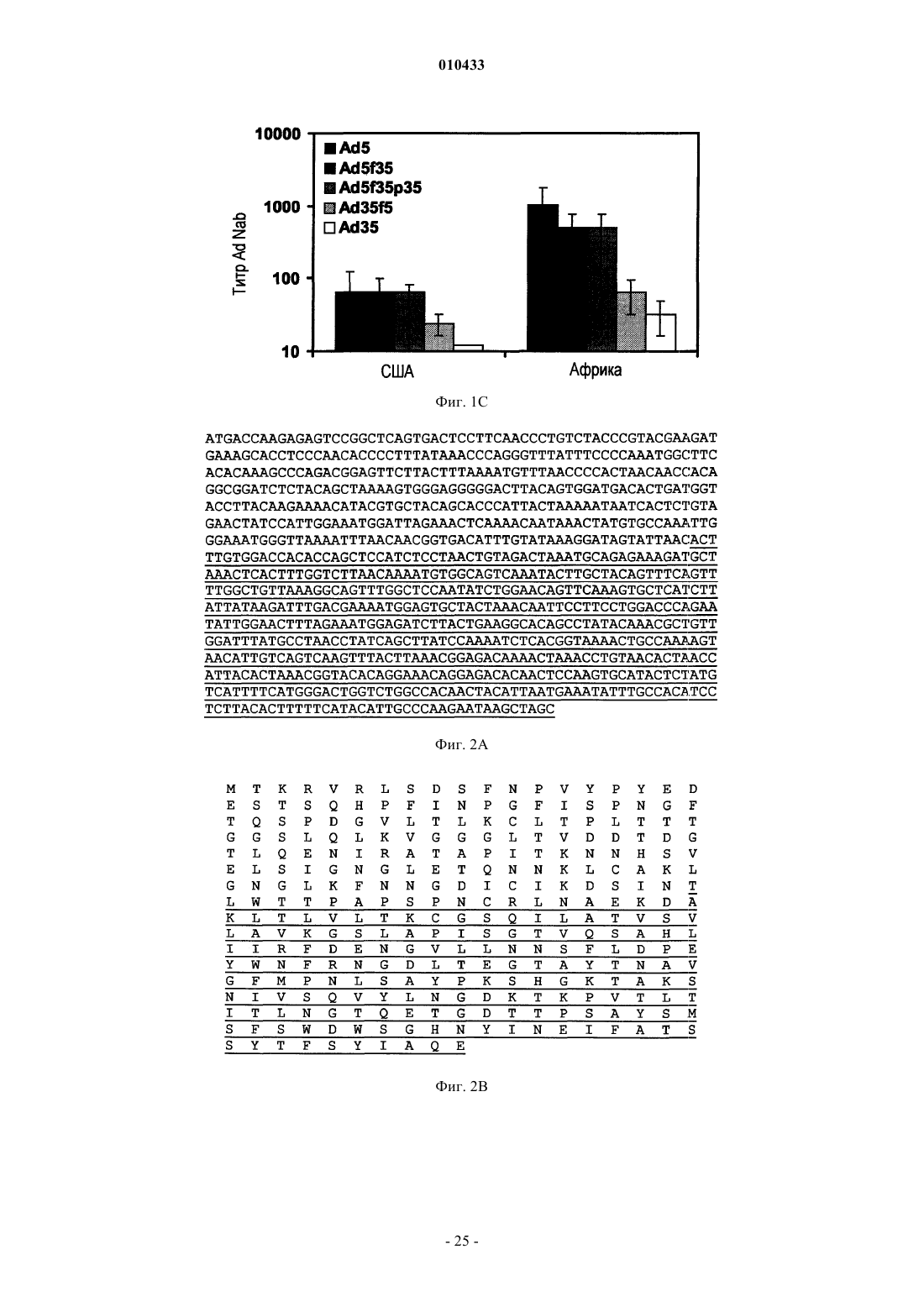
4. Партия по п.1 или 2, где указанный серотип подгруппы С представляет собой Ad5.
Текст
010433 Область, к которой относится изобретение Изобретение относится к области медицины, конкретнее, к области терапевтического и профилактического лечения с использованием рекомбинантных, химерных, аденовирусных векторов, включающих терапевтическую нуклеиновую кислоту в вакцинных композициях. Описание предшествующего уровня техники Рекомбинатные аденовирусные векторы широко применяются для способов генной терапии и вакцин. К настоящему времени идентифицирован 51 различный серотип аденовируса. Аденовирусы подгруппы С, наиболее интенсивно исследованные для таких видов применения как генная терапия, особенно серотип 2 и 5 (Ad2 и Ad5), широко используют в данной области. Рекомбинантный Ad5 используется в разнообразных целях, включая вакцинацию. Важно, что, как было показано, вакцины, основанные на векторе Ad5, вызывают сильные и защитные иммунные реакции на разнообразных моделях животных. Более того, в настоящее время ведутся крупномасштабные клинические испытания вакцинации против ВИЧ инфекции, при которых используются рекомбинантные векторы на основе Ad5 (WO 01/02607; WO 02/22080; Shiver et al. 2002; Letvin et al. 2002; Shiver and Emini. 2004). Однако возможность использования вакцин, основанных на рекомбинантном векторе Ad5, в отношении ВИЧ и других патогенов, вероятно, будет значительно ограничена высоким доминированием серотипа Ad5-специфичных нейтрализующих антител (Nabs) в популяции людей. Было показано, что существование иммунитета против Ad5 существенно подавляет иммуногенность вакцин на основе Ad5 в исследованиях на мышах и макаках резус. Предварительные данные, полученные в клинических испытаниях 1 фазы, показывают, что эта проблема может также возникнуть у людей (Shiver 2004). Одна перспективная стратегия преодоления наличия предсуществующего иммунитета у индивидуумов, ранее инфицированных самыми распространенными аденовирусами человека (такими как Ad5),включает разработку рекомбинантных векторов из серотипов аденовирусов, которые не сталкиваются с такими видами предсуществующего иммунитета. Аденовирусные векторы человека, которые были идентифицированы как особенно полезные, основаны на серотипах 11, 26, 34, 35, 48, 49 и 50, как показано вWO 00/70071, WO 02/40665 и WO 2004/037294 (см. также Vogels et al. 2003). Другие авторы обнаружили,что также аденовирус 24 (Ad24) представляет особый интерес, поскольку, как показано, он является редким серотипом (WO 2004/083418). Аналогичная стратегия основана на применении аденовирусов обезьян, поскольку они обычно не инфицируют людей. Они проявляют низкое доминирование серотипа в человеческих образцах. Однако их можно применять у людей, поскольку было показано, что эти вирусы могут инфицировать человеческие клетки in vitro (WO 03/000283, WO 2004/037189). Было показано, что вакцины на основе вектора серотипа 35 (Ad35) аденовируса могут вызвать сильные клеточные иммунные реакции, которые существенно не подавлялись иммунитетом против Ad5(Barouch et al. 2004; Vogels et al. 2003). Аналогичным образом, было показано, что аденовирусы шимпанзе вызывают иммунные реакции, на которые минимально воздействовал иммунитет против Ad5 (Farina etal. 2001; Pinto et al. 2003). Недавно было продемонстрировано, что и нейтрализующие антитела (NAb), и реакции СВ 8+ Т-лимфоцитов вносят вклад в иммунитет против Ad5, тогда как Ad5-специфичные NAb,как представляется, играют первостепенную роль (Sumida et al. 2004). Хотя эта разработка представляется очень полезным подходом, было также продемонстрировано на мышах, что вакцины на основе вектора Ad35 оказались менее иммуногенными, чем вакцины на основе вектора Ad5, в исследованиях, в которых не было предсуществующего Ad5-иммунитета (Barouch et al. 2004). Очевидно, что существует потребность в данной области в альтернативных аденовирусных векторах, которые не сталкиваются с предсуществующими видами иммунитета у хозяина, но которые, тем не менее, являются иммуногенными и способны вызвать сильные иммунные реакции против белков, кодируемых гетерологичными нуклеиновыми кислотами, вставленными в нуклеиновую кислоту, переносимую вектором. Краткое описание чертежей На фиг. 1 (А) показана процентная доля доминирования серотипа Ad5, AdI1 и Ad35 в образцах из США, Гаити, Ботсваны, Замбии и Южной Африки; (В) показан титр нейтрализующих антител противAd5, AdI1 и Ad35 в образцах из США и образцах из Африки; (С) показан титр нейтрализующих антител против Ad5, Ad5f35, Ad5f35p35, Ad35f5 и Ad35 в этих образцах. На фиг. 2 (А) показана последовательность нуклеиновой кислоты, кодирующей волоконный белокAd35k5 (SEQ ID NO:1; подчеркнута часть, кодирующая выступ волокна Ad5); (В) показывает аминокислотную последовательность Ad35k5 волоконного белка (SEQ ID NO:2; подчеркнута часть, представляющая выступ волокна Ad5); (С) показывает последовательность нуклеиновой кислоты, кодирующей волоконный белок Ad35f5 (SEQ ID NO:4; подчеркнута часть, кодирующая остающийся фрагмент волокнаAd35, тогда как сайт клонирования BsiWI представлен в мелких колпачках); (D) показывает аминокислотную последовательность волоконного белка Ad35f5 (SEQ ID NO:5; подчеркнута часть, представляющая остающийся фрагмент волокна Ad35); (E) показывает последовательность нуклеиновой кислоты,кодирующей волоконный белок Ad35k2 6 (SEQ ID NO:80; подчеркнута часть, кодирующая выступ волокна Ad2 6); (F) показывает аминокислотную последовательность волоконного белка Ad35k2 6 (SEQ IDNO:81; подчеркнута часть, представляющая выступ волокна Ad2 6); (G) показывает последовательность нуклеиновой кислоты, кодирующей волоконный белок Ad35k4 9 (SEQ ID NO:82; подчеркнута часть, кодирующая выступ волокна Ad4 9); (H) показывает аминокислотную последовательность волоконного белка Ad35k4 9 (SEQ ID NO:83; подчеркнута часть, представляющая выступ волокна Ad4 9). На фиг. 3 показана реакция T клеток, вызванная в отношении gag SIV (вируса иммунодефицита обезьян), после инъекции интактным мышам с векторами Ad5, Ad35f ib5.BSU, Ad35.BSU и Ad35, несущими ген, кодирующий gag SIV, в сравнении с мышами, которым инъецировали пустые векторы (Ad5. пустой и Ad35. пустой). Ось у изображает спленоциты SFC/106. На фиг. 4 показана иммуногенность векторов Ad5, Ad35k5 и Ad35, экспрессирующих SIV Gag у интактных мышей с 109 vp (A) и 108 vp (B), или при предварительной иммунизации одной (С) или двумя(D) инъекциями 1010 vp Ad5-пустого перед иммунизацией 108 vp соответствующих векторов. Во всех случаях Gag-специфические реакции CD8+ Т-лимфоцитов оценивали анализами связывания Db/AL11 тетрамера в множественные точки времени после иммунизации. На фиг. 5 показан иммунитет против вектора, вызванный векторами Ad35k5 у мышей. (А) Интактные мыши C57/BL6, подвергнутые первичному воздействию антигена в 0 нед. 109 vp Ad35k5-Gag, и повторно иммунизированные через 4 нед. 109 vp Ad5-Gag или Ad35-Gag. (B) Образцы сыворотки мышей,которым инъецировали 109 vp Ad5-Gag, Ad35k5-Gag или Ad35-Gag, оцененные в анализах нейтрализации вируса на основе Ad5 и Ad35 люциферазы. На фиг. 6 показана иммуногенность векторов Ad5, Ad35k5 и Ad35, экспрессирующих HIV-I Env у мышей. Интактных мышей Balb/c иммунизировали 108 vp Ad5-Env, Ad35k5-Env или Ad35-Env. (A) Envспецифичные клеточные иммунные реакции, оцененные анализами объединенных пептидов и специфичного для пептида MI10 эпитопа IFN- ELISPOT. (В) Env-специфичные гуморальные иммунные реакции по оценке ELISA. На фиг. 7 показана иммуногенность векторов Ad5, Ad35k5 и Ad35 у макак резус, подвергнутых первичному воздействию антигена в 0 нед. 1011 vp Ad5-Gag (A, В), Ad35-Gag (C, D) и Ad35k5-Gag (E, F). Через 12 нед. все обезьяны получали гомологичную повторную иммунизацию. Env- и Gag-специфичные клеточные иммунные реакции оценивали анализами объединенных пептидов IFN- ELISPOT в множественные временные точки после иммунизации (А, С, E). Вектор-специфические титры Nab оценивали анализами нейтрализации вируса Ad5 и Ad35 (B, D, F). На фиг. 8 показаны реакции CD4+ и CD8+ Т-лимфоцитов у обезьян в исследовании, описанном на фиг. 7. Анализы объединенных пептидов IFN- ELISPOT выполняли, используя PBMC (полинуклеарные клетки периферической крови) с истощенными запасами CD8 и истощенными запасами CD4 от обезьян через 16 нед. после иммунизации. Обезьяны получали 1011 vp (A) Ad5-Gag, (B) Ad35-Gag или (С)Ad35k5-Gag в 0 нед. и через 12 нед. На фиг. 9 показана иммуногенность векторов Ad5-Gag, Ad5HVR48 (l)-Gag и Ad5HVR48 (1-7) у интактных мышей, получающих (А) 109 vp, (В) 108 vp, или (С) 107 vp. Реакции Gag-специфических CD8+ Тлимфоцитов оценивали анализами связывания тетрамера Db/AL11 во множественные временные точки после иммунизации. На фиг. 10 показана иммуногенность векторов Acl5-Gag, Ad5HVR48 (1)-Gag и Ad5HVR48 (1-7) у мышей, получающих (А) 109 vp, (В) 108 vp, или (С) 107 vp, предварительно иммунизированных двумя инъекциями 1010 vp Ad5-пустого за 8 и 4 нед. до иммунизации. На фиг. 11 показана аминокислотная последовательность (SEQ ID NO:12) гексонного белка на основе Ad5 с включением семи HVR для семи соответствующих HVR (подчеркнуто) из Ad48 (Ad5HVR48(1-7. На фиг. 12 показана аминокислотная последовательность (SEQ ID NO:13) гексонного белка на основе Ad5 с включением семи HVR для семи соответствующих HVR (подчеркнуто) из Ad35 (Ad5HVR35(1-7. На фиг. 13 показана аминокислотная последовательность (SEQ ID NO:14) гексонного белка на основе Ad5 с включением семи HVR для семи соответствующих HVR (подчеркнуто) из AdI1 (Ad5HVR11(1-7. На фиг. 14 показана аминокислотная последовательность (SEQ ID NO:15) гексонного белка на основе Ad5 с включением семи HVR для семи соответствующих HVR (подчеркнуто) из Ad26 (Ad5HVR26(1-7. На фиг. 15 показана аминокислотная последовательность (SEQ ID NO:16) гексонного белка на основе Ad5 с включением семи HVR для семи соответствующих HVR (подчеркнуто) из аденовируса Pan9(Ad5HVRPan9 (1-7. На фиг. 16 показано окрашивание внутриклеточного gag в эксперименте сравнения (без инфекции,график 1 и 2 Ab) и после инфекции Ad35k5 (2 партии: 4, 5), Ad5HVR26 (2 партии: 3 дважды, 28) иAd35k49 (3 партии: 4, 5, 9). На фиг. 17 показана аминокислотная последовательность гексонного белка в Ad5HVR48 (1-7)(SEQ ID NO:84), в котором последовательность HVR1 подвергнута делеции, как определено в табл. IV,-2 010433 последовательность HVR2 в соответствии с табл. IV, замещена линкером QG и HVR3-HVR7, в соответствии с определением табл. IV, были замещены между Ad5 и Ad48. Фиг. 18; как фиг. 17, теперь для Ad5HVR35 (1-7) (SEQ ID NO:85). Фиг. 19; как фиг. 17, теперь для Ad5HVR26 (1-7) (SEQ ID NO:86). Фиг. 20; как фиг. 17, теперь для Ad5HVR49 (1-7) (SEQ ID NO:7). Фиг. 21 представляет собой график, показывающий реакцию CD8+ Т-лимфоцитов у мышей после двойной предварительной иммунизации Ad5-пустым, с последующим первичным воздействием антигена в 0 д. Ad35-Gag и повторной иммунизацией на 28 д. тремя различными векторами, как указано. Краткое описание сущности изобретения В настоящем описании раскрыты вновь разработанные рекомбинантные аденовирусные векторы для усовершенствованной доставки гена, вакцинации и генной терапии в одном предпочтительном варианте осуществления. Вектор представляет собой рекомбинантный аденовирус на основе аденовируса серотипа 35 (Ad35), где, по меньшей мере, выступ волокна Ad35 был замещен выступом волокна серотипа, который связывается с рецептором коксакивируса и аденовируса (CAR). Предпочтительнее этот серотип представляет собой выступ волокна Ad5 (приводящий к получению вектора, обозначаемогоAd35k5, в котором только выступ был замещен, или вектора, обозначаемого Ad35f5, в котором были замещены выступ, стержень и часть хвоста). Стержень и хвост волокна может быть от серотипа, несущего остов, т.е. Ad35, тогда как изобретение также относится к векторам, в которых домен стержня относится к такому же серотипу, что и серотип выступа волокна. В Ad35f5 часть хвостовой области, оставшаяся от серотипа остова, обеспечивает должное взаимодействие с оставшейся частью капсида для получения стабильных векторов. Векторы по настоящему изобретению включают интересующую терапевтическую нуклеиновую кислоту, предпочтительно нуклеиновую кислоту, которую можно применять в целях вакцинации. Изобретение относится к рекомбинантным аденовирусным векторам, которые сталкиваются с низким предсуществующим иммунитетом у большей части человеческой популяции, все же сохраняя способность вызывать сильную иммунную реакцию против антигена, кодируемого нуклеиновой кислотой,содержащейся в векторе. Это достигается получением рекомбинантных векторов на основе серотипов аденовируса, таких как AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49, Ad50 или аденовирусов обезьяны,несущих химерный капсид. Химерный капсид включает волоконные белки, которые частично основаны на волоконных белках из серотипов аденовируса человека, отличающихся от каркасного вектора, и которые в самом предпочтительном варианте осуществления связываются (через их домен выступа) с рецептором CAR. Многие различные аденовирусы, которые предпочтительно связывают CAR, можно использовать для обеспечения выступа волокна, такие как аденовирусы человека из подгрупп А, С, D, E и F, и аденовирусы овцы, которые также связывают CAR. Предпочтительные серотипы аденовируса, которые используются за их домены выступа волокна, представляют собой аденовирусы человека из подгруппы С, предпочтительнее Ad2 и Ad5. В другом варианте осуществления вирус, полученный в соответствии с изобретением, представляет собой рекомбинантный аденовирус на основе аденовируса подгруппы С, предпочтительно Ad5, который сделан дефектным по репликации функциональной делецией области E1. и в котором гексонный белок в вирусном капсиде представляет собой химерный белок, такой что одна или несколько из гипервариабельных областей (HVR) были замещены HVR, полученной из редкого серотипа аденовируса. Такие редкие серотипы не сталкиваются с NAb у большинства индивидуумов в популяции людей. Предпочтительные серотипы, которые используются для предоставления HVR, представляют собой Ad35 и Ad48. Предпочтительно рекомбинантный вирус включает интересующую гетерологичную нуклеиновую кислоту, которую предстоит доставить хозяину в профилактических или терапевтических целях. Подробное описание Как обсуждалось выше, использование рекомбинантных векторов на основе Ad5 затрудняется существованием нейтрализующих антител (Nabs), которые присутствуют у большинства людей вследствие предшествующей инфекции вирусом дикого типа. Хотя различные капсидные белки, присутствующие в вирусной оболочке, индуцируют антитела у хозяина, было продемонстрировано, что первичной мишенью Ad5-специфичных Nabs является белок Ad5 гексона (Sumida et al. 2005). Это привело к идее, что изменением гексонного белка так, чтобы его больше не могли выявить предсуществующие NAb, можно получить усовершенствованные аденовирусные векторы, которые оказывали бы благоприятное воздействие у людей, у которых уже есть NAb против Ad5, или которые были ранее иммунизированы предыдущими вакцинами на основе Ad5, или которых подвергали первичному воздействию антигена с векторами на основе Ad5 в схеме вакцинации первичного воздействия антигена/повторной вакцинации. Однако оказалось, что изменение гексонного белка является нелегкой задачей. Полные изменения гексона в целом были возможны только между аденовирусами в пределах одной и той же подгруппы Ad и приводили к получению слабо жизнеспособного вируса (Youil et al. 2002; Gall et al. 1998; Roy et al. 1998). Если бы это было ограничение, то вектор на основе Ad5 должен был содержать гексонный белок из других аденовирусов подгруппы С. Однако большинство из них, если не все, являются бесполезными в том смысле, что те серотипы не считаются редкими. Большинство индивидуумов в человеческой популяции-3 010433 однажды сталкивались с серотипами из подгруппы С. Было бы предпочтительно использовать гексон из серотипа, который бы не столкнулся с уже присутствующими NAb. Те редкие серотипы преимущественно обнаруживаются у серогруппы В (AdI1, Ad34, Ad35, Ad50) и D (Ad24, Ad26, Ad48 и Ad49). Авторы настоящего изобретения впервые показали, что путем (пересмотренного) определения определенных частей гексона и использованием консервативного подхода и имеющихся данных о структуре и последовательности, можно идентифицировать определенные области и подвергнуть обмену, приводящему к продуцируемым рекомбинантным вирусам, которые являются жизнеспособными и которые можно получать в достаточно высоких титрах. Предпочтительные серотипы, которые используются для предоставления их гексонного белка или его релевантных частей, представляют собой AdI1, Ad24, Ad26,Ad34, Ad35, Ad48, Ad49 и Ad50, поскольку известно, что эти серотипы сталкиваются с низким предсуществующим иммунитетом (см. WO 00/70071). Более предпочтительными являются AdI1, Ad26, Ad35 иAd48, тогда как Ad48 представляет собой наиболее предпочтительный серотип. В этом отношении также интересны не человеческие аденовирусы. Одним предпочтительным примером является аденовирус шимпанзе Рап 9. Области, которые были идентифицированы, представляют собой 7 поверхностных петель, также известные как гипервариабельные области гексона (HVR). Вариабельность гексона среди серотипов аденовируса концентрируется в этих 7 петлях (Crawford-Miksza and Schnurr, 1996). Следует понимать, что изобретение не ограничивается использованием HVR Ad48, как очерчено в примерах. Это, кроме того,обосновывается идентификацией HVR в Ad5, AdI1, Ad26, Ad34, Ad35, Ad48, Ad49 и Ad50 в несколько широком определении (см. табл. II) и в несколько более ограниченном, более минималистическом определении (см. табл. IV). Ad48 служит в качестве примера всех других серотипов, которые также сталкиваются с низким предсуществующим иммунитетом и которые можно также использовать при получении химерного аденовируса, на который благоприятно воздействуют известные преимущества аденовируса подгруппы С, иллюстрируемой Ad5 (сильная иммуногенность, легкое получение и т.д.) с преимуществами редких серотипов (низкий предсуществующий иммунитет). Ясно, что если предусмотреть использование схемы вакцинации в виде первичного воздействия антигена/повторной вакцинации, при которой предпочтительно использовать каркас другого серотипа, такой как Ad35, то было бы благоприятным проводить повторную вакцинацию с вектором, который не сталкивается с возросшими уровнями NAb против вектора первичного воздействия антигена. Таким образом, такие комбинации как AdI1, Ad24,Ad26, Ad35, Ad48, Ad49, Ad50 и т.д. с HVR другого редкого серотипа (такого как любой из указанных выше редких серотипов) являются также частью настоящего изобретения. Не ограничивающими примерами таких векторов являются Ad5HVR48, Ad5HVR35, Ad5HVR11, Ad5HVR48, AdI1HVR35 иAdI1HVR48, имеющие по меньшей мере один, предпочтительнее 6, а наиболее предпочтительно 7 HVR,обмениваемых между серотипами. Таким образом, предпочтительно, чтобы был взят по меньшей мере один HVR из редкого серотипа и вставлен в гексон каркасного серотипа. Авторы настоящего изобретения показали, что замещение всех семи HVR из Ad5 соответствующими HVR из Ad48, привело к жизнеспособному и продуцируемому вектору, который навряд ли сталкивался с предсуществующим иммунитетом у мышей, иммунизированными пустыми Ad5 вирусами. Однако, если замещали только первыйHVR (видимый от левого ITR до правого ITR в вирусном геноме), то эффект не наблюдался. Это не значит, что одно замещение не могло быть достаточным. Полагают, что одна область более иммуногена чем другие, и все еще предстоит исследовать, какая из 7 идентифицированных областей вносит самый большой вклад, и какой из HVR не нужно замещать в определенных наборах или для определенного вида применения. Возможно, что у определенных индивидуумов возникали различные иммунные реакции в отношении различных HVR, по сравнению с другими индивидуумами. Более того, химерные векторы,содержащие гексон, могут оказаться благоприятными в ситуациях, когда имеется лишь умеренная активность NAb у хозяина. Предсуществующий иммунитет, выработанный в соответствии с предоставленными примерами, очень высокий, благодаря 2 последовательным дозам 1010 vp пустого вектора Ad5. Тем не менее, наиболее предпочтительно, чтобы все HVR внутри гексонного белка были замещены, поскольку это предоставило бы наилучшую возможность получения вектора, не выявляемого предсуществующими NAb, присутствующими у хозяина. Для разработки усовершенствованных аденовирусных векторов, сначала провели картирование эпитопов Ad5-специфического нейтрализующего антитела (NAb). Было выявлено, что в человеческих популяциях доминирование и титры серотипа Ad5 были очень высокими (приблизительно 50% в США и 90% в части развивающихся стран). Более того, как описано здесь, было обнаружено, что функционально значимые Ad5-специфические NAb направлены почти исключительно против гексонного белка (см. также Sumida et al. 2005). Напротив, Ad5-специфические антитела, направленные против волоконного белка,не значительно подавляют иммуногенность Ad5 вакцины в релевантных, естественно существующих обстоятельствах, т.е. обстоятельствах, относящихся к титрам анти-Ad5 NAb, обнаруженных у людей. В отличие от Ad5 обнаруживается, что доминирование и титры серотипа Ad35 и AdI1 очень низкие у популяций людей во многих различных частях мира. Настоящее изобретение относится к новым аденовирусным векторам, которые несут гексон редкогоAd35, Ad48, Ad49 и Ad50, и предпочтительно домен выступа волокна из серотипа, который взаимодействует с рецептором CAR, такого как большинство серотипов аденовируса человека из подгруппы А, С,D, E и F и аденовирусов овцы. Предпочтительными серотипами, которые используются в качестве каркасного вектора и, таким образом, несут их собственный гексонный белок, в отношении которого редко обнаруживаются NAb у человеческой популяции, являются AdI1 и Ad35. Предпочтительным серотипом, который используется в качестве каркасного вектора и для его волокна, является Ad5. B данной области хорошо известно, что клетки, которые играют основную роль в иммунных реакциях, представляют собой дендритные клетки, поскольку это клетки, которые способны эффективно представлять иммуногенные пептиды на их поверхности, вызывая, посредством этого, сильную иммунную реакцию против такого пептида. Векторами, которые были предпочтительными в данной области, ввиду их способности очень эффективно инфицировать дендритные клетки, являются векторы из подгруппы В аденовируса, или векторы, которые несут волоконные белки из аденовирусов, которые эффективным образом распознают и инфицируют дендритные клетки (см., например, WO 02/24730 иWO 00/70071). Эти векторы предположительно используют CD46 в качестве рецептора. К удивлению,как показано здесь, в настоящее время авторами настоящего изобретения было обнаружено, что вектор,несущий, по меньшей мере, выступ волокна аденовирусного вектора, который, как известно, взаимодействует через CAR, а именно Ad5, при клонировании поверх вектора, который сталкивается с низкими уровнями предсуществующего иммунитета, ведет себя так, что иммунные реакции улучшаются. Это очень неожиданно, принимая во внимание желательный путь иммунной реакции через дендритные клетки. Следует понимать, что домен выступа, который средние специалисты в данной области могут легко отличить от остального волоконного белка (посредством сравнения последовательностей и общих представлений о взаимодействиях рецепторов), представляет собой домен, который преимущественно участвует в распознавании специфических клеточных рецепторов, с которыми связывается аденовирусный вектор. Ранее было показано, что волоконный выступ Ad5 взаимодействует с CAR на поверхности клеток и опосредует эффективное вирусное присоединение перед вирусным вхождением, которое дополнительно облегчается пентоновым основанием и клеточными интегринами (Bergelson et al. 1997; Bewley etal. 1999; Roelvink et al. 1998 и 1999; Wickham et al. 1993), хотя вирусы группы В, такие как AdI1 и Ad35,взаимодействуют через CD46 (Gagger et al. 2003). Настоящее изобретение относится к аденовирусным векторам, в которых обменивается, по меньшей мере, связывающий рецептор домен (определяемый доменом выступа). Таким образом, последние из указанных векторов еще могут включать волоконные домены, такие как части стержня и/или хвоста из каркасного вектора. Действительно желательно использовать по меньшей мере часть хвостовой области каркасного вектора для обеспечения должного, стабильного взаимодействия с другими капсидными белками, что приводит к получению устойчивых рекомбинантных векторов. Химерные аденовирусные векторы по настоящему изобретению более эффективны для вакцин и генной терапии, чем векторы, исключительно на основе Ad5 или Ad35 без химерных волокон. Химерные аденовирусы, несущие химерные волокна Ad5-Ad35, известны в данной области. Были раскрыты векторы Ad5, несущие химерные волокна, в которых, по меньшей мере, домен выступа был получен из Ad35(WO 00/31285, WO 00/52186; WO 02/24730; Shayakhmetov et al. 2003; Rea et al. 2001). Smith et al. (2003) описали химерное волокно, в котором хвост и стержень получены из Ad35, в то время как домен выступа получен из Ad5. Все векторы из этих приведенных ссылок основан на Ad5, свидетельствуя о том, что векторы еще столкнулись бы с предсуществующим иммунитетом вследствие присутствия гексона Ad5 в вирусном векторном капсиде. Данные, предоставленные Ophorst et al. (2004), подтвердили этот феномен. Рекомбинантные дефектные по репликации векторы Ad35 и способы их получения также известны в данной области (WO 00/70071; WO 02/40665), в то время как Ganesh et al. (2003) раскрыли использование основанного на Ad35 вектора, который включает волокно, в котором выступ волокна Ad35 был замещен выступом волокна Ad5. Однако вектор нес маркерный ген (белок зеленой флюоресценции, GFP) и, очевидно, проявлял низкую эффективность трансдукции. Следовательно, Ganesh et al. не раскрывают или не предлагают вакцины на основе векторов, в которых, по меньшей мере, выступ Ad35 был замещен выступом Ad5, не касаясь преимуществ, связанных с их использованием. Ganesh et al. раскрывают также вектор, основанный на Ad35, с полным волокном Ad5. Следует отметить, что этот вектор включает полное волокно Ad5, а не химерное волокно, и, таким образом, отличается от векторов, раскрытых здесь. Ganeshet al. предупреждают, что была обнаружена низкая эффективность трансдукции с частичным обменом волокон. Векторы в соответствии с изобретением имеют высокую эффективность трансдукции, в то время как химерные волокна обеспечивают устойчивое прикрепление в сохраняющемся капсиде. Специалист в данной области не имел бы побуждения в целях вакцинации заместить выступ волокна серотипов,которые, как известно, очень эффективно инфицируют дендритные клетки (такие как волокна подгруппы В, например, AdI1, Ad34 и Ad35) выступом волокна из серотипа, который инфицирует клетки, главным образом, через CAR. Ввиду того, что нейтрализующая активность со стороны хозяина в отношении аденовирусных век-5 010433 торов в первую очередь вызвана NAb против гексонного белка, аденовирусные векторы могут также основываться на высоконейтрализованных серотипах, иллюстрируемых Ad5, в котором гексон замещен гексоном редко нейтрализованного серотипа, таким как AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49 иAd50. Пример такого вектора обозначается Ad5h35 (вектор на основе Ad5, включающий гексонный белок из Ad35, вместо гексона Ad5). Специалист в данной области способен предвидеть и получить различные возможные комбинации на основе раскрытых здесь данных и на основе имеющихся в данной области представлений. Стало ясно, что обмен всех гексонов оказался трудным (Gall et al. 1998; Youil etal. 2002). Один новый и полезный путь конструирования химерного гексонного белка раскрыт в примерах. Другой путь клонирования векторов, включающих химерный капсид, используя гексонные белки из других серотипов, был раскрыт в примере 8 WO 00/03029. Рекомбинантные аденовирусные векторы по настоящему изобретению, а именно векторы, основанные на серотипах, которые, в целом, сталкиваются с низкой предсуществующей активностью в человеческой популяции (AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49 и Ad50, а также определенные аденовирусы обезьян), несущие домен выступа аденовируса, который в целом вызывает высокую иммунную реакцию,представляют усовершенствование относительно и аденовируса, который, в целом, вызывает высокую иммунную реакцию, а также относительно аденовируса, который избегает предсуществующей нейтрализующей активности, потому что он несет гексонный белок, который не выявляется предсуществующим иммунитетом у высокой процентной доли мировой популяции. Другими словами, и как проиллюстрировано здесь, Ad35fib5 и Ad35k5 представляют усовершенствования относительно и вектора Ad5 и Ad35. Учитывая высокие уровни иммунитета против Ad5 у популяций человека, векторы Ad5 вероятно существенно подавляются иммунитетом против вектора, по меньшей мере, на основании экспериментов,выполненных на мышах и обезьянах. Учитывая низкие уровни иммунитета против Ad35 у популяций человека, Ad35 и связанные с Ad35 векторы в этом отношении имеют существенное преимущество перед векторами Ad5. Другими словами, векторы Ad35, Ad35fib5 и Ad35k5 по существу не подавляются иммунитетом против векторов. Однако вакцины на основе вектора Ad35 менее иммуногенные, чем вакцины на основе вектора Ad5 с точки зрения антител против антигенной вставки. Важно, что в настоящее время авторы данного изобретения впервые показали, что низко нейтрализованные векторы, несущие, по меньшей мере, (гетерологичный) домен выступа другого, но высоко иммуногенного вектора, существенно более активны в индукции иммунной реакции, чем каркасный вектор с его нативным волокном. Таким образом, такие векторы представляют техническое и практическое продвижение относительно имеющихся в настоящее время аденовирусных векторов. Специалист в данной области сможет использовать представленную здесь информацию для клонирования других аденовирусных векторов на основе такого же принципа. Например, изобретение также относится к рекомбинантным аденовирусам обезьян, которые несут домен выступа волокна иммуногенного аденовируса человека. Кроме рекомбинантных аденовирусов обезьян, другие не человеческие аденовирусы, такие как рекомбинантные аденовирусы быков и собак, охватываются настоящим изобретением. Оно также относится к другим низко нейтрализованным человеческим аденовирусам, которые можно использовать в качестве каркасных векторов, которые несут, по меньшей мере, домен выступа других иммуногенных аденовирусов. Различные комбинации являются многочисленными, но ограниченными в той степени, чтобы, по меньшей мере, гексонный белок аденовируса не столкнулся с высоким уровнем предсуществующего иммунитета, в то время как, по меньшей мере, домен выступа доставляет распознавание рецептора CAR,обеспечивая, посредством этого, высокую иммунную реакцию у хозяина, которому введен вектор. Обычный специалист в данной области сможет отличить описанные признаки с использованием общих представлений в данной области об определении предсуществующего иммунитета, определении уровня вызванных иммунных реакций и стратегий получения рекомбинантных (химерных) векторов, как очерчено настоящим изобретением. Сильная иммуногенность векторов вакцины Ad35k5 свидетельствует о функционально релевантной роли белка волокна Ad5. Выступ волокна Ad5 определяет связывание с высоко аффинным рецепторомCAR, а также играет важную роль в эффективной внутриклеточной транспортировке вирусных частиц к ядру. Усиленная иммуногенность векторов Ad35k5 вероятно отражает известные биологические функции выступа волокна Ad5, хотя точный механизм еще не был определен. Рекомбинантные векторыAd35k5 проявляют в первую очередь профиль нейтрализации рекомбинантного вектора Ad35 и эффективно избегают низких/умеренных уровней иммунитета против Ad5, как показано здесь. Эти наблюдения согласуются с предыдущими исследованиями, демонстрирующими, что Ad5-специфические NAb в первую очередь направлены против гексонного белка Ad5. B поддержку этой модели, имеется также наблюдение, что векторы Ad5, содержащие белок волокна Ad35, были неспособны обойти иммунитет противAd5 (Ophorst et al. 2004). Однако высокие уровни иммунитета против Ad5 были в действительности способны снизить иммуногенность векторов Ad35k5, как показано здесь, вероятно, отражая нижний титр, но отчетливо выявляемые NAb, направленные против белка волокна Ad5. Следует также отметить, что снижение иммуногенности Ad35k5 иммунитетом против Ad5 было лишь частичным и выявляемым только при особенно высоких титрах Ad5-специфических NAb. Другим ограничением векторов Ad35k5 может быть их относительно высокие соотношения vp/pfu,-6 010433 которые были приблизительно в 10 раз выше, чем соотношения, обычно наблюдаемые для векторовAd35. Это наблюдение свидетельствует о том, что вирусная целостность и устойчивость могут быть скомпрометированы включением химерного волоконного белка, хотя это еще требует исследования и подтверждения. Как указано здесь, исследования на макаках резус, по сравнению иммуногенности векторов Ad5,Ad35k5 и Ad35, подтвердили результаты, полученные у мышей. Это уместно, поскольку у мышей нет оптимального рецептора CD46 Ad35, и поэтому можно недооценить иммуногенность векторов Ad35. У макак резус векторы Ad5 вызывали быстрые и высокие титры вектор-специфических NAb, которые эффективно предотвращали гомологичную повторную иммунизацию, как ожидалось. Напротив, векторы иAd35, и Ad35k5 вызывали более низкие титры вектор-специфических NAb по сравнению с векторамиAd5, которые способствовали усилению этих реакций после повторного введения гомологичных векторов. Предполагается, что сильные иммунные реакции, наблюдаемые у обезьян, которые получали векторы Ad35k5, вероятно, отражали то обстоятельство, что эти векторы и запускали сильные реакции, и могли эффективно стимулироваться повторной иммунизацией. Настоящее изобретение демонстрирует, что капсидные химерные рекомбинантные векторы Ad можно сконструировать для объединения благоприятных иммунологических и серологических свойств различных серотипов Ad. Генерирование химерных векторов Ad представляет новую стратегию, которая ведет к усовершенствованным векторам Ad второго поколения и для вакцинации, и для генной терапии. В соответствии с предпочтительным вариантом осуществления настоящее изобретение относится к дефектному по репликации вектору рекомбинантного аденовируса серотипа 35 (Ad35), включающему химерный волоконный белок, включающий, по меньшей мере, домен выступа из серотипа связывающегоCAR аденовируса, в котором указанный рекомбинантный вектор дополнительно включает представляющую интерес терапевтическую нуклеиновую кислоту. Терапевтическая нуклеиновая кислота определяется как нуклеиновая кислота, которая кодирует терапевтическое белковое вещество, такое как белок,пептид или полипептид, который можно использовать в диагностических, терапевтических и/или профилактических целях у млекопитающих, предпочтительно людей. Примерами терапевтических белков являются белки, которые вызывают иммунные реакции при вакцинации опухоли. Другими примерами являются белки, которые можно использовать при лечении генетических нарушений, такие как белки, используемые при генной терапии. Предпочтительными терапевтическими белками являются белки, полученные или основанные или (непосредственно) клонированные из бактерий, паразитов или инфекционных источников, таких как вирусы. Аденовирусные векторы могут широко применяться в целях вакцинации против вирусов, таких как вирус иммунодефицита человека (ВИЧ), SIV (вирус иммунодефицита обезьян), вирус Эбола, вирус бешенства, вирус простого герпеса (HSV), вирус гепатита С (HCV) и т.д. Примерами полученных из ВИЧ антигенов, которые могут кодироваться в аденовирусной нуклеиновой кислоте, являются nef, gag, pol и env. Примером антигена HSV является антиген 9D. Терапевтические белки из паразитов, таких как паразиты, вызывающие малярию, можно также использовать в векторах по настоящему изобретению. Особенно предпочтительными белками, которые можно клонировать в эти векторы, являются белки из Plasmodium falciparum, такие как белок циркумспорозоита (CS) и LSA-1. Другими предпочтительными белками могут быть белки из штаммов Mycobacterium, в частности, штаммов, которые вызывают туберкулез, таких как Mycobacterium tuberculosis. Предпочтительными антигенами из этой бактерии являются антигены 10.4, 85 А, 85 В и 85 С, которые можно, таким образом, также использовать в векторах по настоящему изобретению. Белки, используемые в качестве маркера для исследований in vitro, обычно не рассматриваются как терапевтические белки, поэтому GFP, люцифераза или CAT не рассматриваются как терапевтические. Подходящие промоторы и поли (А) последовательности, которые можно использовать для экспрессии антигенов, хорошо известны в данной области и включают, но не ограничиваются, CMV, Ad2 MLP,SV40 и т.д. Подходящие последовательности окончания транскрипции можно, например, получить изSV40 или BGH. Кодирующие последовательности антигенов могут быть кодон-оптимизированными для оптимальной экспрессии у млекопитающих, предпочтительно, людей. Способы кодон-оптимизации хорошо известны в данной области. Изобретение относится к репликационно дефективному рекомбинантному аденовирусу, выбранному из группы, состоящей из серотипов аденовируса 11, 24, 26, 34, 35, 48, 49 и 50, причем указанный аденовирус включает химерный волоконный белок, включающий, по меньшей мере, домен выступа из связывающего CAR серотипа аденовируса, и где указанный рекомбинантный вектор, дополнительно, включает гетерологичную нуклеиновую кислоту, кодирующую представляющий интерес терапевтический или антигенный белок. Предпочтительный серотип представляет собой серотип подгруппы В, предпочтительнее серотип 11, 34 и 35, наиболее предпочтительно серотип 35 (Ad35). Изобретение относится к этим серотипам, поскольку они сталкиваются с нейтрализующим предсуществующим иммунитетом в значительно низкой процентной доле образцов сыворотки людей, взятых у здоровых индивидуумов во всем мире. Используемые здесь химерные волоконные белки относятся к волокнам, которые включают части, по меньшей мере, из двух различных серотипов аденовируса, в которых домен выступа получен из аденовируса, который связывается с CAR. Предпочтительно, чтобы хвостовой домен волоконного белка-7 010433 был из каркасного вектора, так как это дополняет устойчивость вектора посредством должного взаимодействия с капсидом вектора. В предпочтительном варианте осуществления, домен выступа, который связывается с CAR, получен из волокна серотипа аденовируса из подгруппы С, предпочтительнее из серотипа Ad5. Представляющий интерес терапевтический белок, используемый здесь, относится к белкам, которые можно использовать при терапевтическом лечении млекопитающих, таком как генная терапия. Представляющий интерес антигенный белок, используемый здесь, относится к представляющему интерес белку, в отношении которого иммунная реакция вызывается после экспрессии у хозяина, или в клетках хозяина. Эта иммунная реакция требуется для различных видов программ вакцинации. Одним примером является вакцинация против опухоли, при которой иммунная реакция в отношении представляющего интерес антигенного белка дополняет удаление опухолевых клеток, которые экспрессируют белок,в то время как другое предпочтительное применение представляет собой профилактическое лечение,такое как вакцинация, для предотвращения или значительного ингибирования инфекции хозяина патогенами, такими как вирусы, бактерии, дрожжи или паразиты. Таким образом, предпочтительно, указанный представляющий интерес антигенный белок включает белок из вируса, бактерии, паразита или дрожжевого грибка. Применение рекомбинантных аденовирусов в соответствии с изобретением можно также использовать при вызывании иммунных реакций в отношении представляющих интерес антигенных белков в ходе лечения инфекции, которая уже возникла, таким образом, для предотвращения репликации, упаковки и т.д. Другими словами, векторы можно также использовать для предотвращения распространения вируса от уже инфицированного хозяина на следующего. В одном варианте осуществления рекомбинантный аденовирус в соответствии с изобретением включает гетерологичную нуклеиновую кислоту, которая находится под контролем гетерологичного промотора. В предпочтительном аспекте изобретения указанный антигенный белок включает белок из вируса,причем указанный вирус представляет собой ретровирус, HSV или вирус Эбола, тогда как предпочтительно, чтобы если антигенный белок представляет собой антигенный белок ретровируса, то чтобы указанный вирус представлял собой ретровирус иммунодефицита обезьян или человека, где указанная гетерологичная нуклеиновая кислота предпочтительно включает один или несколько генов, выбранных из генов, кодирующих группу белков вируса иммунодефицита, состоящую из gag, pol, env и nef. В другом аспекте изобретения указанный представляющий интерес антигенный белок получен из паразита, вызывающего малярию, где указанный белок представляет собой предпочтительно белок циркумспротозоита или специфический печеночный антиген (LSA-I, LSA-3), или его иммуногенную часть,из вида Plasmodium, предпочтительнее Plasmodium falciparum. Изобретение относится к новым дефектным по репликации рекомбинантным аденовирусам, включающим гетерологичную нуклеиновую кислоту и химерное волокно, где указанный аденовирус выбран из группы, состоящей из серотипов 11, 24, 26, 34, 35, 48, 49 и 50 аденовируса для применения в качестве лекарственного средства. Изобретение, кроме того, относится к применению рекомбинантного аденовирусного вектора в соответствии с изобретением при получении лекарственного средства для профилактического или терапевтического лечения инфекции малярийным плазмодием, вирусом Эбола, HSV, HCV или ВИЧ. В одном особенно предпочтительном варианте осуществления изобретение относится к химерному дефектному по репликации рекомбинантному аденовирусу, включающему домен выступа из волокнаAd5, имеющего аминокислотную последовательность, как показано на фиг. 2 В, и гексоновый белок из серотипа, отличного от Ad5, причем, кроме того, предпочтительно, чтобы указанный гексоновый белок был представлен из низко нейтрализованного аденовирусного серотипа. Низко нейтрализованные серотипы представляют собой те серотипы, которые сталкиваются с предсуществующей нейтрализующей активностью в форме NAb в меньшинстве образцов от здоровых индивидуумов. В одном определенном варианте осуществления изобретение относится к химерному дефектному по репликации рекомбинантному вектору Ad35, включающему гексон Ad35 и химерный волоконный белок, причем указанный химерный волоконный белок имеет аминокислотную последовательность SEQ ID NO:2. Обмены гексонных HVR. Поскольку NAb, специфичные для доминантного Ad5, в первую очередь, направлены против белка гексона Ad5, обосновывалось, что новые рекомбинантные векторы Ad5, содержащие целевые мутационные обмены в гексоне, могут быть способны избегать NAb, специфичных к доминантному гексону Ad5. Это не новая мысль, и были предприняты попытки получить такие скрытые аденовирусные векторы. Однако ни один из них не оказался успешным, как подчеркнуто ниже. Представляется, что более чем 99% аминокислотной вариабельности среди гексонных белков от различных серотипов концентрируется в семи относительно коротких гипервариабельных областях(HVR), которые расположены на открытой поверхности гексона, как идентифицировано Crawford-Miksza и Schnurr (1996). Эти авторы сравнили гексонные белки 15 различных аденовирусов (AdI, Ad2, Ad5, Ad,Ad8, Ad9, AdI2, AdI5, AdI6, Ad31, Ad40, Ad41, Ad48, BAV3 и MAVl). Были идентифицированы 7 HVR среди 250 вариабельных остатков в петлях 1 и 2 (также именуемых 11 и 12), где HVR1-HVR6 находятся в-8 010433 петле 1 и HVR7 находится в петле 2. Crystal с соавторами (см. WO 98/40509; патент США 6127525; патент США 6153435) заместили всю петлю 1 и 2 каркасного вектора (Ad5) петлями 1 и 2 Ad2 (Gall etal. 1998) на основании данных Crawford-Miksza et al. (1996). Также было получен вектор, в котором была замещена только петля 2. Были получены жизнеспособные вирусы. Ad2 и Ad5 представляют собой аденовирусы подгруппы С, и еще присутствовала перекрестная нейтрализация даже после замещения обеих петель, указывая на то, что такие обмены не привели бы к получению векторов, которые бы имели сниженную способность или неспособность быть распознанными нейтрализующим антителом, направленным против гексонного белка аденовируса дикого типа, по меньшей мере, когда обмены происходят в пределах одной и той же подгруппы. Тем не менее, для попытки получения таких векторов, они также пытались провести обмен петель Ad5 и заместить их петлями Ad7. Эти попытки были неудачными, жизнеспособный вирус не был получен, указывая на то, что невозможно было произвести замены из одной группы на другую, по меньшей мере, на основании идентификации HVR Crawford-Miksza. Конечно, располагая знанием вирусной геномной структуры, необходимой генетической модификации можно достичь посредством общих методов молекулярной биологии, приводящих к получению плазмид/космид,которые должны кодировать весь рекомбинантный (химерный) вирус. Однако по неизвестным причинам, но наиболее вероятно вследствие достаточно критических аспектов сложной гексонной структуры и ее роли в формировании капсида, жизнеспособные вирусы не были получены, когда была модифицирована область, кодирующая гескон (Rux et al. 2003). Gall et al. (1998) вместо обмена всего гексона предложили обмен только наружных петель. Упоминалось также, что другие капсидные белки, такие как пентон, могут иметь значимые эпитопы нейтрализации для объяснения несостоятельности обменов Ad5Ad2. Авторы настоящего изобретения также пытались создать химерные аденовирусы на основании Ad5,несущего химерные гексонные белки, включающие HVR Ad35 или Ad48 вместо HVR Ad5, как рекомендовано Crawford-Miksza and Schnurr (1996) и как, кроме того, подчеркнуто Rux and Burnett (2000). Эти попытки были неудачными. Это согласовывалось с данными Crystal et al., которые также не смогли показать какую-либо продукцию рекомбинантных вирусов, где был произведен обмен частей гексона от различных подгрупп (см. выше). Для попытки решения этого вопроса, Rux et al. (2003) показали новые высоко разрешающие кристаллографические очищения гексонных структур Ad2 и Ad5, которые были произведены для разрешения ранее найденных различий в гексонных структурах Ad2 и Ad5. Это привело к новому определению областей в белке гексона, указывая на 9 HVR вместо 7. Rux et al. (2003) также идентифицировали части белка гексона, которые не должны нарушаться при конструировании новых векторов на основе аденовирусов. Авторы настоящего изобретения также пытались получить химерные аденовирусы, включающие химерные гексонные белки с замененными HVR, на основании определений, предоставленных Rux et al.(2003). Однако снова нельзя было получить жизнеспособные вирусы. Ясно, что на основании определений, предоставленных в данной области, относительно HVR гексона, нельзя получить рекомбинантные аденовирусы, имеющие одну или несколько из HVR, обмененные между каркасным вектором и другим серотипом, по меньшей мере, между серотипами аденовируса различных подгрупп. Авторы настоящего изобретения идентифицировали 7 HVR внутри аденовирусов человека, которые отличаются от 7 HVR, идентифицированных Crawford-Miksza and Schnurr (1996), и которые также отличаются от 9 HVR, идентифицированных Rux et al. (2003). Широкое определение в соответствии с изобретением показано в табл. II, тогда как еще более минималистическое определение предоставлено в табл.IV. Одно замещение этих HVR привело к получению жизнеспособного вируса. Насколько известно авторам, впервые кто-то смог генерировать химерные аденовирусы, включающие химерные гексонные белки, в которых не все петли заменены, но в которых обменены определенные HVR. Считается также, что это первая успешная попытка получения рекомбинантных аденовирусов, включающих химерные гексонные белки, где гексоны включают части из серотипов аденовирусов из двух различных групп. Концептуальной основой для пересмотра определения HVR было использование сохраненных аминокислот в качестве точек соединения. Тем не менее, нельзя исключить, что смещение одной или двух или, вероятно, даже трех аминокислот в направлении N- и/или С-конца может дать жизнеспособные векторы. Однако определения, как обеспечено ранее в данной области, были недостаточны для предоставления жизнеспособных векторов с химерными гексонами. Тем не менее, предоставленные здесь определения не следует воспринимать слишком прямолинейно, так как небольшие сдвиги могут также обеспечить хорошие результаты (см. табл. II в сравнении с табл. IV). Предпочтительно идентифицированные последовательности HVR (как представлено SEQ ID NO:17-79 и 88-150) представляют собой области, которые обменены между серотипами. Были сконструированы основанные на Ad5 векторы, содержащие одну или несколько HVR, обмененные из Ad35 (подгруппы В) или Ad48 (подгруппы D), как раскрыто в примерах. Ясно, что можно произвести обмен одной или нескольких HVR. Поскольку вероятно, что NAb направлены на любую изHVR, предпочтительно иметь большинство, если не все, HVR от редкого серотипа вместо HVR дикого типа каркасного вектора. С другой стороны, такие большие обмены могут привести к жизнеспособным-9 010433 векторам, которые труднее получить. Здесь раскрыто, что все 7 HVR, идентифицированные в пределах каркасного вектора (иллюстрированного Ad5), можно заместить семью соответствующими HVR редкого серотипа (иллюстрированного Ad48). Это также свидетельствует о том, что обмены, основанные на определениях HVR табл. IV, также приведут к жизнеспособным вирусам. Спейсерные области между HVR предпочтительно продолжают оставаться каркасного серотипа для обеспечения должной укладки белка. Предпочтительный каркас представляет собой Ad5, хотя можно использовать другие, в целом широко применяемые серотипы из подгруппы С, такие как Ad2. Когда обмениваются HVR, предпочтительно обменивается по меньшей мере одна, предпочтительнее 2, еще предпочтительнее 3, еще предпочтительнее 4, еще предпочтительнее 5, еще предпочтительнее 6, а наиболее предпочтительно 7 HVR. Векторы Ad5HVR35 и Ad5HVR48, которые были генерированы, как раскрыто здесь, по существу более иммуногенны, чем рекомбинантные векторы Ad5 в присутствии иммунитета против Ad5, потому что NAb, которые в первую очередь направлены против гексонного белка Ad5 индивидуумов, инфицированных Ad5, больше неспособны нейтрализовать посредством HVR гексона Ad35 и Ad48. Этот признак остается справедливым для всех HVR, полученных из всех известных редких серотипов, которые можно выбрать из AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49 и Ad50. Как показано ниже, вирусы Ad5HVR48 (1-7), содержащие все 7 HVR Ad48, вместо 7 HVR Ad5,приводят к получению вируса, которому не мешает предсуществующий иммунитет, вызванный предварительной инъекцией вируса Ad5. Это позволяет использовать векторы на основе Ad5 в многочисленных процедурах, например, в схемах первичной и повторной вакцинации, где требуется, чтобы рецептор распознавания между вектором примирования и вектором повторной иммунизации оставался одним и тем же. Другим видом применения была бы вакцинация или терапевтическое применение с вектором на основе Ad5 у индивидуумов, которые столкнулись с инфекцией Ad5 дикого типа, предшествующей лечению. На основании идентификации HVR, как раскрыто здесь, теперь возможны многочисленные комбинации между каркасными векторами и другими серотипами аденовирусов. Это представление можно экстраполировать на гексоны всех известных аденовирусов человека и не человека. Когда требуется схема первично-повторной иммунизации (не только для процедур, при которых требуются векторы на основе Ad5), то предоставленные здесь знания можно применить для конструкции вектора со способностью сокрытия, а именно обхода предсуществующего иммунитета против гексонных HVR, присутствующих в ранее применявшемся вирусе. Следует понимать, что химерные векторы HVR, как раскрыто здесь, можно, кроме того, модифицировать способами, известными в данной области. Например, волокно можно изменить для получения специфической способности нацеливания (например, волоконных выступов из вирусов подгруппы В, помещенных на векторы, основанные на подгруппе С, можно нацелить на гладкомышечные клетки, в первую очередь, фибробласты, дендритные клетки и т.д.). Примером такого вектора был бы вектор на основе Ad5, включающий HVR, например, из Ad48 и, по меньшей мере, выступ волокна (главную детерминанту распознавания рецептора), например, из Ad35. Все такие векторы подпадают под объем настоящего изобретения, относящегося к аденовирусным векторам, включающим гексоны,которые являются химерными в отношении их HVR. Специалист в данной области теперь сможет, используя предоставленную здесь информацию, сконструировать и получить жизнеспособные рекомбинантные дефектные по репликации аденовирусы, которые имеют одну или несколько HVR, замещенные HVR из других аденовирусов. Более того, предоставленные здесь последовательности HVR теперь предоставят возможность удалить те последовательности и использовать эти положения внутри гексона для введения других веществ, таких как нацеливающие лиганды, для нацеливания аденовирусов на представляющие интерес клетки (in vivo и in vitro), участки связывания радиоактивной метки для прослеживания аденовирусов in vitro и определенных В клеточных эпитопов (таких как описано Worgall et al. 2005). Настоящее изобретение относится к партии рекомбинантного дефектные по репликации аденовируса, основанного на серотипе из первой подгруппы, причем указанный аденовирус включает последовательности из серотипа указанной первой подгруппы и по меньшей мере одну последовательность гипервариабельной области (HVR) из серотипа из второй подгруппы, где указанная первая и указанная вторая подгруппа не являются одинаковыми. Предпочтительно указанная первая подгруппа представляет собой подгруппу А, С, D, E или F. Также предпочтительны партии в соответствии с настоящим изобретением,где указанная вторая подгруппа представляет собой подгруппу В или D. Более предпочтительны партии,в которых указанная первая подгруппа представляет собой подгруппу С, а серотип из указанной подгруппы С представляет собой Ad5, и где указанный серотип из подгруппы В или D выбран из группы,состоящей из AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49 и Ad50. В предпочтительном варианте осуществления настоящего изобретения указанный химерный гексонный белок включает первые 6 последовательностей HVR (HVR1-HVR6) или все 7 последовательностей HVR (HVR1-HVR7) из серотипа из указанной второй подгруппы. В другом предпочтительном варианте осуществления указанный гексонный белок сохраняет аминокислотные последовательности каркасного вируса между последовательностями HVR. Таким образом,- 10010433 одну или несколько определенных здесь последовательностей HVR можно подвергнуть делеции, мутации, замещению линкером или заместить последовательностью HVR из другого серотипа, более предпочтительно последовательности, связывающие HVR, сохраняются и являются неизмененными. Это обеспечивает возможность получения вирусов, которые устойчивы вследствие их гексон-каркасной структуры, обеспеченной не HVR последовательностями. Таким образом, предпочтительно, чтобы последовательности между последовательностями HVR были из серотипа из указанной первой подгруппы. В более предпочтительном варианте осуществления настоящее изобретение предоставляет партии аденовирусов в соответствии с настоящим изобретением, где первая подгруппа представляет собой подгруппу С и где по меньшей мере одна последовательность HVR из серотипа указанной второй подгруппы выбрана из SEQ ID NO:24-79 и SEQ ID NO:95-150. В еще более предпочтительном варианте осуществления последовательность HVR выбрана из SEQ ID NO:17, 24, 31, 38, 45, 52, 59, 66 и 73, где последовательность HVR2 выбрана из SEQ ID NO:18, 25, 32, 39, 46, 53, 60, 67 и 74, где последовательность HVR3 выбрана из SEQ ID NO:19, 26, 33, 40, 47, 54, 61, 68 и 75, где последовательность HVR4 выбрана из SEQID NO:20, 27, 34, 41, 48, 55, 62, 69 и 76, где последовательность HVR5 выбрана из SEQ ID NO:21, 28, 35,42, 49, 56, 63, 70 и 77, где последовательность HVR6 выбрана из SEQ ID NO:22, 29, 36, 43, 50, 57, 64, 71 и 78, где последовательность HVR7 выбрана из SEQ ID NO:23, 30, 37, 44, 51, 58, 65, 72 и 79. В еще одном предпочтительном варианте осуществления последовательность HVR1 (HVR1) выбрана из SEQ IDNO:94, 101, 108, 115, 122, 129, 136, 143 и 150. Предпочтительнее последовательность HVR1, как представлена или последовательностью HVR1 в табл. II, или последовательностями в табл. IV, подвергнута делеции из каркасного вектора. Причина делеции области HVR1 заключается в том, что, в соответствии с кристаллической структурой гексонного белка аденовируса, фланкирующие последовательности HVR1 находятся очень близко вместе, указывая на то, что эти фланкирующие последовательности могут быть непосредственно связаны без потери структуры, за исключением делеции. В другом предпочтительном варианте осуществления последовательность HVR2, как представлена или последовательностью HVR2 в табл. II, или последовательностями в табл. IV, замещены коротким линкером, предпочтительнее линкером из двух аминокислот, наиболее предпочтительно линкером QG. Также фланкирующие последовательности HVR2 расположены близко вместе, следуя кристаллической структуре. Однако поскольку они слегка более разделены, чем видно для HVR1, предпочтительно включить небольшой связывающий линкер, предпочтительно линкер из 1, 2, 3 или 4 аминокислот, предпочтительно 2. Удаление HVR из гексона может быть идеальным решением в предотвращении атаки NAb против иммуногенных детерминант,представленных HVR. Однако ввиду кристаллической структуры не представляется вероятной делецияHVR3-7 из гексонного белка без разрушения его общей структуры и, таким образом, возможности его функции и роли в формировании капсида. Хотя гексон Ad24 также предпочтителен для его HVR, последовательность гексонного белка этого специфического редкого серотипа была неизвестна заявителям во время подачи. Тем не менее, располагая предоставленным здесь положением, специалист в данной области теперь сможет определить HVR внутри гексонного белка любого аденовируса, включая предпочтительный серотип Ad24. Использованием любого из HVR Ad24 также представляет собой часть настоящего изобретения. Изобретение также относится к применению изолированной нуклеиновой кислоты, кодирующей по меньшей мере одну последовательность HVR гексона серотипа человеческого аденовируса из серогруппы В в конструкции химерного гексонного белка, причем гексон дополнительно включает последовательности из аденовируса из подгруппы А, С, D, E или F. Кроме того, изобретение относится к применению изолированной нуклеиновой кислоты, кодирующей по меньшей мере одну последовательность HVR гексона серотипа человеческого аденовируса из серогруппы D в конструкции химерного гексонного белка, причем гексон дополнительно включает последовательности из аденовируса из подгруппы А, В, С, E или F. Предпочтительно эта по меньшей мере одна последовательность HVR выбрана из SEQ ID NO:2479 и 95-150. В табл. III обобщены различные варианты осуществления изобретения. Таблица указывает, что изобретение относится к химерному дефектному по репликации аденовирусу, основанному на каркасном аденовирусе, включающем белок пентона и гексона серотипа X, где n HVR в гексонном белке относятся к серотипу Y, кроме того, включающему волокно, включающее хвост и стержень серотипа F и выступ серотипа K, гдеX представляет собой серотип аденовируса, выбранный из группы, состоящей из аденовирусов человека 1-51, серотипа обезьяны, собаки, овцы, свиньи и быка;Y представляет собой серотип аденовируса, выбранный из группы, состоящей из аденовирусов человека 11, 24, 26, 34, 35, 48, 49 и 50, где X и Y могут быть одинаковыми или различными, и где n пред- 11010433 ставляет любое количество HVR от 0 до 7, при условии, что если X и Y, эта n=1-7;F представляет собой серотип аденовируса, выбранный из группы, состоящей из аденовирусов человека 1-51, серотипа обезьяны, собаки, овцы, свиньи и быка, где F, X и Y могут быть одинаковыми или различными, иK представляет собой серотип аденовируса, где K, F, X и Y могут быть одинаковыми или различными. Предпочтительно по меньшей мере часть хвоста волоконного белка, которая взаимодействует с пентонным белком относится к серотипу X в случае, когда F не представляет собой X. Следует понимать, что каркасный аденовирусный вектор может представлять собой любой аденовирус (сделанный рекомбинантным, так что он не реплицируется в нормальных, не упаковывающих клетках), который применим для использования у людей. Любые из известных аденовирусов человека(серотипов 1-51) в пределах шести подгрупп А, В, С, D, E и F, а также известные аденовирусы обезьяны,собаки, быка, овцы и свиньи можно использовать в качестве каркасного вектора, пока он является дефектным по репликации, и пока он применим для лечения людей. Каркасный вектор является дефектной по репликации делецией по меньшей мере одной функциональной части области E1, предпочтительно делецией всей функциональной области E1. Хотя каркасный вектор обычно включает другие ранние и поздние области, специалисту в данной области известны возможности, предоставленные в данной области, для комплементации определенных требуемых аденовирусных белков другими средствами, например посредством комплементации хелперными вирусами или трансформацией упаковочной клетки,так что она включает требуемые нуклеиновые кислоты, устойчиво интегрированные в ее геном. Обычно вирусы по изобретению включают аденовирусный геном с делецией E1, а предпочтительно также делецией Е 3 для обеспечения пространства для представляющих интерес гетерологичных нуклеиновых кислот, которые можно клонировать в области E1, или в области Е 3, или в них обеих. В целом присутствуют остающиеся области, такие как Е 2, Е 4, ITR и поздние области, хотя они могут быть комплементированы отдельно во время продукции в упаковочной клетке. Векторы предпочтительно включают областьE4orf6 (возможно, из другого серотипа), которая совместима с белком E1B-55K, присутствующим в линии упаковочных клеток, как раскрыто в WO 03/104467. Это сделано для обеспечения возможности продукции на известных упаковочных системах, таких как клетки PER.C6 или клетки 293, когда рекомбинантный вектор имеет первоначальную область E4orf6, которая не совместима с E1B-55K Ad5, присутствующих в таких клетках. Каркасный серотип указан выше как X. Кроме того, каркасный вирус можно сконструировать так,что он содержит HVR из одного или более серотипов аденовируса, выбранных из AdI1, Ad24, Ad26,Ad34, Ad35, Ad48, Ad49 и Ad50 (указанных серотипом Y). Ясно, что когда X представляет собой один из серотипов Y, то HVR, которые могут необязательно конструироваться в виде этих серотипов, считаются редкими и сталкиваются лишь с низким предсуществующим иммунитетом у большинства индивидуумов в популяции людей. Таким образом, когда X представляет собой один из серотипов Y, то количество замененных HVR (количество, указанное n), может равняться нулю, но также 1-7, в то время как, когда X не представляет собой один из серотипов Y, то по меньшей мере одна из HVR происходит из серотипа Y,где все более предпочтительно иметь больше HVR из серотипа Y и где наиболее предпочтительно иметь все 7 HVR замененными на соответствующие области из серотипа Y. Каркасный вирус по настоящему изобретению включает пентоновый белок того же серотипа, что и каркасный вирус. Каркасный вирус является химерным в том смысле, что или гексон является химерным (имеющим одну или более обмененных или замещенных HVR) и/или в том смысле, что волоконный белок является химерным и/или в том смысле, что волоконный белок происходит из серотипа, отличного от каркасного вируса. Существует возможность, что X=Y=F=K, например, рекомбинантный вектор Ad48,поскольку Ad48 связывает CAR. Однако такие векторы не являются химерными в том смысле, как описано выше, когда n=0. He химерные рекомбинантные AdI1, Ad34, Ad35 и Ad50 не подпадают под представленное выше определение, так как выступ волокна должен всегда быть из серотипа, который предпочтительно связывает CAR, который не связывают эти вирусы подгруппы B. Волокно относится к серотипу, указанному как F, включающему хвост из серотипа F, включающему стержень из серотипа F и включающему выступ из серотипа, указанного как K. Ясно, что когда K представляет собой тот же серотип, что и F, то волоконный белок не является химерным. K представляет собой серотип, который предпочтительно взаимодействует с рецептором CAR, и K может представлять собой тот же серотип, что и X, или другой. Ясно, что определенные серотипы человека, такие как серотипы из подгруппы В, предпочтительно не взаимодействуют с CAR, но предпочтительно взаимодействуют с другим клеточным рецептором, таким как CD46. Так, когда K является таким же как X, то X не является одним из аденовирусов подгруппы В. Также, когда K относится к серотипу, отличному от F (и,таким образом, волокно является химерным), то по меньшей мере часть хвоста, которая взаимодействует с пентоном в капсиде, относится к серотипу X, так как это привело бы к формированию должного и устойчивого капсида. Поскольку в настоящее время в данной области доступно большинство генов известных аденовирусов, кодирующих капсидный белок, то специалист в данной области сможет идентифицировать область хвоста, стержня и выступа для каждого известного и еще подлежащего обнаружению аденовируса.- 12010433 Предпочтительными, но не ограничивающими примерами химерных дефектных по репликации аденовирусов в соответствии с настоящим изобретением являются (Ad5HVR11 (1-7), Ad5HVR24 (1-7),Ad5HVR26 (1-7), Ad5HVR34 (1-7), Ad5HVR35 (1-7), Ad5HVR48 (1-7), Ad5HVR49 (1-7), Ad5HVR50 (1-7),Ad5HVRPan9 (1-7), Ad5HVR11 (1-6), Ad5HVR24 (1-6), Ad5HVR26 (1-6), Ad5HVR34 (1-6), Ad5HVR35 (16), Ad5HVR48 (1-6), Ad5HVR49 (1-6), Ad5HVR50 (1-6), Ad5HVRPan9 (1-6), Ad5HVR11 (1), Ad5HVR24(1), Ad2HVR34 (1), Ad2HVR35 (1), Ad2HVR48 (1), Ad2HVR49 (1), Ad2HVR50 (1), Ad2HVRPan9 (1),Ad11k2, Ad24k2, Ad26k2, Ad34k2, Ad35k2, Ad48k2, Ad49k2, Ad50k2, Pan9k2, Ad11f2, Ad24f2, Ad26f2,Ad34f2, Ad35f2, Ad48f2, Ad49f2, Ad50f2 и Pan9f2. Примеры Пример 1. Международное доминирование серотипа и титры NAb к Ad5, Ad35 и AdI1. Реакции Ad-специфических нейтрализующих антител (NAb) оценивали анализами нейтрализации вируса на основе люциферазы, в целом, как описано Sprangers et al. (2003). Вкратце, клетки карциномы легких человека А 549 высевали с плотностью 1104 клеток на лунку в 96-луночные планшеты и инфицировали подвергнутыми делеции E1, репликационно некомпетентными конструктами репортера Adлюциферазы при множественности инфекции (moi) 500 с двукратными серийными разведениями сыворотки в реакционных объемах 200 мкл. После инкубации в течение 24 ч активность люциферазы в клетках измеряли, используя аналитическую систему Steady-Glo Luciferase Reagent System (Promega). Титры нейтрализации на 90% определяли как максимальное разведение сыворотки, которое нейтрализовало 90% активности люциферазы. В дополнение к исследованиям, описанным в WO 00/70071, выполняли эксперименты для оценки доминирования серотипов и титров NAb к Ad5 и дополнительным Ad серотипам в развивающихся странах. Анализы нейтрализации вируса на основе люциферазы по Sprangers et al. (2003) применяли использованием образцов сыворотки, полученных у здоровых индивидуумов в США (N=19), Гаити (N=67),Ботсване (N=57), Замбии (N=29) и Южной Африке (N=59). Как показано на фиг. 1A, доминирование серотипа Ad5 составило 50% с относительно низкой медианой титров в США. Напротив, доминирование серотипа Ad5 составило 82% на Гаити, 93% в Ботсване, 93% в Замбии и 88% в Южной Африке. Более того, медиана титров Ad5-специфичных NAb в этих образцах была более чем в 10 раз выше, чем медиана титров, обнаруженных в США (фиг. 1B). Эти данные распространяются на предыдущие данные (Kostense et al. 2004; Vogels et al. 2003) и демонстрируют, что Ad5-специфические NAb почти универсальны и присутствуют в высоких титрах в развивающихся странах. Напротив, у этих популяций доминирование серотипов и титры AdI1 и Ad35 были существенно ниже. Пример 2. Иммунодоминантные мишени Ad5-специфических нейтрализующих антител. Образцы, описанные в предыдущем примере, далее использовали для определения доминантных антигенных мишеней Ad5-специфических NAb и в США, и в Африке, южнее Сахары. Учитывая отсутствие выявляемой перекрестной реактивности NAb между Ad5 и Ad35, в анализах нейтрализации вирусов в качестве мишеней использовали капсидные химерные Ad5/Ad35 вирусы, экспрессирующие люциферазу. Эти векторы состоят из различных комбинаций гексонных, пентонных и волоконных белков Ad5 иAd35 в контексте интактных вирусных частиц с кинетикой роста дикого типа (Havenga et al. 2002; Rea etal. 2001). Химерные векторы, использованные в этом исследовании, включали Ad5f35 (Ad5, содержащий выступ волокна, стержень Ad35 и химерный хвост Ad35-Ad5), Ad5f35p35 (Ad5, содержащий волокно и стержень Ad35, химерный хвост Ad35-Ad5 и пентон) и Ad35f5 (Ad35, содержащий выступ волокна,стержень Ad5 и химерный хвост Ad5-Ad35). Как показано на фиг. 1 С, сравнимые титры NAb наблюдались против Ad5, Ad5f35 и Ad5f35p35; все на основе Ad5. Поскольку капсид вектора Ad5f35p35 содержит гексон Ad5, но волокно, полученное изAd35, и пентон, полученный из Ad35, то эти данные свидетельствуют о том, что большая часть активности Ad5-специфических NAb была направлена против гексона Ad5. Более низкие, но отчетливо выявляемые титры также измерялись против рекомбинантного Ad35f5 (также именуемого здесь Ad35fib5), демонстрируя, что NAb, специфичные к волокну Ad5, присутствовали в титрах, которые в 5-10 раз ниже,чем Nab, специфичные к гексону Ad5, в этих образцах. При использовании этих вирусов, пентонспецифические NAb Ad5 не измерялись, но аналогичные титры NAb против Ad5f35 и Ad5f35p35 свидетельствовали о том, что пентон-специфические NAb играли не более чем относительно небольшую роль в этой нейтрализации. Пример 3. Генерация Ad35f5 и Ad35k5. Вакцины на основе рекомбинантного Ad35 являются иммуногенными в присутствии иммунитета- 13010433 против Ad5. Однако вакцины рекомбинантного Ad35 эндогенно менее иммуногены, чем вакцины рекомбинантного Ad5 в отсутствие иммунитета против Ad5 (Barouch et al. 2004). Эта проблема не была преодолена конструированием капсидных химерных векторов рекомбинантного Ad35, в которых, по меньшей мере, выступ волокна Ad35 замещен выступом волокна Ad5 (именуемым Ad35k5 для замещения выступа и Ad35f5 для большей части замещения волокна). Векторы рекомбинантного Ad35k5 получали замещением гена, кодирующего волокно Ad35, геном,кодирующим химерный волоконный белок, состоящим из хвоста и стержня волокна Ad35 (аминокислоты 1-132), связанным с выступом волокна Ad5 (аминокислоты 133-134). Антитела, специфичные для волокна Ad5, не притупляют иммуногенность вакцины рекомбинантного Ad5. Выступ волокна Ad35 не взаимодействует с CAR, поскольку это аденовирус подгруппы В (Roelvink et al. 1998), но, вместо этого,использует CD46 в качестве его рецептора (Gagger et al. 2003). Различные волоконные белки направляют эти вирусы в различные внутриклеточные пути транспортировки. Предыдущие исследования показали,что выступ волокна Ad5 содействует быстрому выходу вируса из ранних эндосом в цитозоль, приводя к эффективному перемещению вирусных геномов в ядро, тогда как выступы волокон из аденовирусов подсемейства В, включая AdI1 и Ad35, ведут к задержке вирусных частиц в поздних эндосомах и рециклингу большой фракции назад на клеточную поверхность (Shayakhmetov et al. 2003). Клонирование рекомбинантной нуклеиновой кислоты, кодирующей вектор Ad35k5, проводили следующим образом. Область, кодирующую выступ волокна Ad5, синтезировали PCR (полимеразной реакцией синтеза цепи) и клонировали в виде фрагмента BsiWI-Nhel в плазмиду pBR.Ad35.PacI-rITR.dE3 (=pBr.Ad35.PRnE3 в WO 2004/001032) для замещения соответствующей области, кодирующей выступ волокна Ad35. Затем мутантную плазмиду pBR.Ad35k5.PacI-rITR.dE3 вместе с космидой pWE.Ad35.pIXEcoRV (WO 2004/001032) и адапторной плазмидой pAdApt35-SIVGag, включающей ген SIVmac239 Gag,совместно трансфецировали в клетки PER. C6/55K (см. WO 00/70071 и WO 02/40665), и двойная гомологичная рекомбинация дала рекомбинантный вектор Ad35k5-SIVGag. Этот вектор был подвергнут очистке от пятен, секвенированию, расширению и очистке центрифугированием в градиенте CsCl в соответствии с общей методологией очистки, известной специалисту в данной области. Нуклеотидная последовательность химерного волокна показана на фиг. 2 А (SEQ ID NO:1), тогда как аминокислотная последовательность показана на фиг. 2 В (SEQ ID NO:2). Вектор Ad35f5 обычно получали как описано для Ad35fibl6 в WO 00/70071, и химер Ad5fibXX, как описано в WO 00/03029; где продукт ПЦР, кодирующий частичный хвост волокна Ad5, связанный со стержнем волокна Ad5 и выступом волокна Ad5 помещали на остающуюся часть хвоста волокна Ad35. Процедуру клонирования также выполняли, используя подвергнутый делеции Е 3 каркасный вектор, и используя BsiWI и Nhel в качестве сайтов рестрикции/клонирования. Детали вектора приведены в WO 03/104467 и WO 2004/001032. В деталях, выполняли следующие процедуры для конструкции pBr/Ad35.pacI-rITRf ib5: ПЦР выполняли на плазмиде pBr/Ad35.PacI-rITRNotI (= pBr/Ad35.PRn, см. WO 2004/001032) с праймером DF351: 5'-CAC TCA CCA CCT CCA ATT СС-3' (SEQ ID NO: 6) и DF35-2: 5'-CGG GAT CCC GTA CGG GTAGAC AGG GTT GAA GG-3' (SEQ ID NO: 7, содержащей сайт BamHI и BsiWI. Эта ПЦР привела к получению фрагмента ДНК приблизительно 650 п.н., начиная в хвостовой области волокна 35, которой вводили и сайт BsiWI, и сайт BamHI. Затем ПЦР выполняли на плазмиде pBr/Ad35.PRn праймером DF35-3: 5'-CGG GAT CCG СТА GCT GAA ATA AAG TTT AAG TGT TTT TAT TTA AAA TCA С-3' (SEQ ID NO: 8), содержащей сайт BamHI и Nhel и DF35-4: 5'-CCA GTT GCA TTG CTT GGT TGG-3' (SEQ ID NO:9). Эта ПЦР привела к получению фрагмента ДНК приблизительно 1400 п.н., начиная после терминирующего кодона волокна 35 до области Е 4. pBr/Ad35.PRn переваривали MIuI и Ndel, удаляя фрагмент ДНК 2850 п.н. из каркаса Ad35 (таким образом, удаляя большую часть области 35 волокна). Фрагмент ПЦР изDF35-1+DF35-2 расщепляли MIuI и BamHI, и фрагмент ПЦР из DF35-3+DF35-4 расщепляли BamHI иNdel. Оба фрагмента ПЦР лигировали в отрезанную плазмиду pBr/Ad35PRn, получая конструктpBr/Ad35PRndFIB. Затем вновь введенные сайты BsiWI и Nhel использовали для введения последовательности волокна Ad5 в каркас Ad35 получением продукта ПЦР, используя праймеры 35F5-5-F: 5'-CGGTTA TTC TTG GGC AAT GTA TGA АА-3' (SEQ ID NO:11) на ДНК Ad5 в качестве матрицы. После этого область Е 3 подвергали делеции, как выполнялось для конструкта pBr/Ad35PRNdE3. Специалист в данной области путем применения общих обычных представлений в отношении молекулярного клонирования и получения аденовирусов смогут генерировать эти клоны, вставить фрагменты, генерировать продукты ПЦР и провести делецию определенных фрагментов и в конечном счете получить вирусы в линиях упаковочных клеток. Более того, способы получения и очистки для получения аденовирусных партий, которые можно использовать in vivo и in vitro, хорошо известны в данной области. Все обсужденные здесь векторы были получены с использованием общих способов очистки CsCl и было обнаружено, что они устойчивы в течение по меньшей мере 5 пассажей на линиях упаковочных клеток PER.C6/55K (данные не показаны). Скорости роста и выходы векторов Ad35k5 были сравнимы с материнскими векторами Ad35 (данные не показаны). Однако отношения вирусных частиц (vp) к бляш- 14010433 кообразующим единицам (pfu) были приблизительно в 10 раз выше для векторов Ad35k5 (100-1000) в сравнении с векторами Ad35 (10-100). Исследовалось также, были ли еще векторы способны распознавать их соответствующие рецепторы посредством их естественных или замещенных волоконных выступов (связывание волокна Ad5 с CAR и связывание волокна Ad35 с CD4 6). Эти специфические взаимодействия были еще установлены с химерными векторами, а также с векторами на основе первоначального Ad5 Ad35 (данные не показаны). Следуя тем же стратегиям, были получены химерные дефектные по репликации векторы на основеAd35, включающие выступ Ad26 или Ad49. Эти вирусы называются Ad35k26 и Ad35k49 и используют связывающую CAR способность выступа волокна редких серотипов Ad26 и Ad49 в комбинации с гексоновым белком, присутствующим в капсиде каркасного вектора, который также является редким серотипом, проиллюстрированным здесь Ad35. Нуклеиновая кислота и аминокислотные последовательности,представляющие соответствующие химерные волокна Ad35k26 и Ad35k49, представлены на фиг. 2 Е-2 Н. Вирусы Ad35k5, Ad35k26 и Ad35k49 сравнивали по их способности обеспечить трансгенную экспрессию in vitro. Все векторы несли трансген SIVGag. 7,5104 клеток А 549 инфицировали исходными вакцинными вирусами (при неизвестной концентрации вируса) в течение 2 ч в объеме 2 мл. Затем клетки промывали и культивировали в течение 48 ч. Окрашивание Gag оценивали внутриклеточным окрашиванием, используя моноклональное антитело 2F12 против р 27 с последующим анализом проточной цитометрией. Ограничение этого эксперимента состоит в том, что определенное количество вирусных частиц не использовали, и, таким образом, нельзя сделать определенный вывод о том, растет ли Ad35k49 до более высокого титра, чем другие, или он имеет более высокую удельную активность. В любом случае представляется, что эти векторы имеют определенные преимущества перед другими векторами, или в репликации/росте, или в уровнях экспрессии. На фиг. 16 показано, что 3 репрезентативные партииAd35k49 проявляли значимо более высокую внутриклеточную экспрессию, по сравнению с репрезентативными партиями Ad35k5 и Ad35k26. Рекомбинантный аденовирусный вектор Ad35k49 представляет собой предпочтительный вариант осуществления изобретения. Для достаточной продукции аденовирусных векторов на упаковывающих клетках в данной области реализовано, что белок E1B-55K, в целом доступный в результате устойчивой интеграции его гена в геном упаковывающих клеток, должен быть совместим с белком E4orf6, продуцируемым областью Е 4 вирусного вектора. Ранее было обнаружено, что белок E4orf6 Ad35 был несовместим с белком E1B-55K, в целом доступном в известных упаковывающих клетках, таких как клетки 293 и клетки PER.C6 (см. WO 03/104467; WO 2004/001032; WO 2004/018627; WO 95/34671). Для обхода использования новых клеточных линий с E1B-55K из Ad35, интегрированными в геном, и, таким образом, для предоставления возможности использования установленных платформ продукции, как тех, которые предоставлены клетками PER.C6, были получены дополнительные конструкты, в которых область E4orf6 остова Ad35 была замещена областью E4orf6 из Ad5, в согласии с тем, что было детально описано в WO 03/104467. Замещение области E4orf6 применяли во всех векторах на основе Ad35, но далее не использовали в описанных здесь исследованиях иммуногенности и исследованиях нацеливания. Пример 4. Иммуногенность рекомбинантного Ad35f5 и Ad35k5 в сравнении Ad5 и Ad35. Иммуногенность векторов оценивали сравнением векторов, несущих химерное волокно, с Ad5SIVGag и Ad35-SIVGag. Интактных мышей (N=5/группу) иммунизировали внутримышечно 1010 vp Ad5-SIVGag, Ad35SIVGag, Ad35.BSU.SIVGag и Ad35f ib5.BSU.SIVGag. Термин BSU относится к использованию эндогенного промотора pIX в аденовирусной геномной нуклеиновой кислоте, которая обеспечивает должную экспрессию гена pIX во время получения рекомбинантных вирусов на основе Ad35. Детали, относящиеся к конструктам BSU, см. WO 2004/001032. Контрольных мышей (N=3/группу) иммунизировали пустыми векторами Ad5 и Ad35. Через 28 д. брали образец крови и иммунные реакции определяли, используя анализ SIV gag ELIspot, как описано ниже. На фиг. 3 показаны результаты этих экспериментов и указано, что все векторы были способны вызвать должную реакцию Т-клеток в отношении белка SIV gag, по сравнению с пустыми векторами, указывая на то, что вставка обеспечивает иммуногенный белок после инъекции мышам. Другую группу интактных мышей (N=8/группу) иммунизировали 109 vp или 108 vp векторов Ad5Gag, Ad35-Gag и Ad35k5-Gag (все кодирующие белок SIV gag). Вызванные вакциной реакции CD8+ Tлимфоцитов оценивали анализами связывания тетрамера Db/AL11, используя следующий способ. Получали тетрамерные комплексы H-2Dd, уложенные вокруг пептида доминантного эпитопа SIVmac239 GagAL11 (AAVKNWMTQTL; SEQ ID NO:3); Barouch et al. 2004) и использовали для окрашивания P18 специфических CD8+ T-лимфоцитов от мышей, используя способы, известные в данной области. Мышиную кровь собирали в среду RPMI 1640, содержащую 40 Ед/мл гепарина. После лизиса эритроцитов, 0,1 мкг меченого PE тетрамера Dd/P18 в сочетании с меченым APC анти-CD8 альфа rnAb (LY-2, Caltag, Burlingame, CA, USA) использовали для окрашивания P18-специфичных CD8+ Т-лимфоцитов. Клетки промывали в PBS (солевом растворе с фосфатным буфером), содержащем 2% FBS (фетальной телячьей сыворотки) и фиксировали в 0,5 мл PBS, содержащих 1,5% параформальдегид. Образцы анализировали двухцветной проточной цитометрией на FACS Calibur (Becton Dickinson). CD8+ Т-лимфоциты с откры- 15010433 тыми ионными каналами исследовали на окрашивание тетрамером Dd/P18. CD8+ Т-лимфоциты от интактных мышей использовали в качестве отрицательных контролей и проявляли окрашивание тетрамером 0,1%. Как показано на фиг. 4, все 3 вакцины были сравнимо иммуногенными в высокой дозе 109 vp (A). Важно, что в более низкой дозе 108 vp (B), иммунные реакции, вызванные рекомбинантным Ad35k5-Gag были значимо более сильными, чем реакции, вызванные рекомбинантным Ad35-Gag (p0,01 при сравнении средних реакций на тетрамер среди групп мышей на 14 д., используя анализы дисперсии с поправками Бонферрони для учета множественных сравнений), и почти сравнимыми по величине с реакциями,вызванными Ad5-Gag (р=незначимо). Это согласуется с полученными ранее наблюдениями (Barouch etal. 2004; Lemckert et al. 2005). Эти данные демонстрируют, что генная инженерия вектора Ad35 таким образом, что он несет домен выступа аденовируса подгруппы С (например, Ad5), обеспечивает существенное улучшение его иммуногенности в отношении антигена, вставленного в вектор. Эти эксперименты выполняли в отсутствие иммунитета против Ad5, и здесь показано, что Ad5 иAd35k5 вызывали сравнимые иммунные реакции, в то время как они были значительно выше, чем у вектора Ad35. Важно отметить, что вектор Ad35k5 несет гексон Ad35, который добавляет более высокую эффективность в вызове иммунных реакций у индивидуумов, которые имеют нейтрализующую активность против гексонного белка Ad5. Таким образом, вектор Ad35k5 значительно более эффективен в присутствии иммунитета против Ad5, чем векторы и на основе Ad5, и Ad35; Ad5 менее иммуногенный в этих условиях ввиду его нативного гексонного белка, a Ad35 менее иммуногенный в целом ввиду домена выступа его нативного волокна. Нельзя исключить, что нейтрализующие антитела против волоконного белка могут вырабатываться после инфекции. Однако считается, что в естественных условиях такие нейтрализующие активности минимальны, в то время как основная часть иммунного ответа хозяина будет направлена против гексонного белка. Важно отметить, что эксперименты, в которых рекомбинантные векторы сравниваются с предварительной иммунизацией материнскими векторами, следует выполнять в условиях, которые имитируют естественную ситуацию (у людей), где вирусы дикого типа инфицируют естественного хозяина однократно или дважды, вызывая естественно возникающие уровни нейтрализующих антител. У мышей в лабораторных условиях можно вызвать крайние иммунные реакции многократными инъекциями и введениями высоких титров. Эксперименты, имитирующие естественную ситуацию, указывают на то, действительно ли нейтрализующие антитела, которые могут быть направлены на волоконный белок, важны для нейтрализации введенного аденовирусного вектора. Они также выявляют важность присутствия стержневой области волокна, причем эта часть обычно также доступна для нейтрализующих активностей. Авторы постулируют, что векторы, включающие, по меньшей мере, выступ из аденовирусов, которые распознают и инфицируют клетки хозяина через CAR (например, Ad2, Ad5 и т.д.) и, кроме того,включают основную иммуногенную детерминанту капсида (т.е. гексонного белка) из наименее нейтрализованного серотипа (например, AdI1, Ad24, Ad26, Ad34, Ad35, Ad48, Ad49 и Ad50), являются превосходными векторами вакцинации, потому что они комбинируют доселе неизвестные преимущества низкого предсуществующего иммунитета вектора у человеческой популяции, высокой иммунной реакции антигенной вставки, воспроизводимой продукции, эффективной трансдукции и достаточной устойчивости. Пример 5. Иммуногенность Ad5, Ad35k5 и Ad35 у мышей с предсуществуюцим иммунитетом. Затем оценивали воздействие иммунитета против Ad5 на иммуногенность этих векторов. Группы мышей C57/BL6 (N=4/группу) предварительно иммунизировали однократно 10 vp Ad5-пустым за 4 н. до вакцинации для генерирования низких/умеренных уровней иммунитета против Ad5. Титры Ad5 специфического нейтрализующего антитела (NAb) у этих мышей были 64-128 (Barouch et al. 2004;Lemckert et al. 2005; Sprangers et al. 2003). Как показано на фиг. 4 С, реакции тетрамерных +CD8+ Тлимфоцитов, вызванные 108 vp Ad5-Gag, были по существу устранены у этих мышей. Напротив, на реакции 108 vp Ad35-Gag и Ad35k5-Gag по существу не воздействовал этот уровень иммунитета против Ad5. Важно, что Ad35k5-Gag оказался более иммуногенным, чем и Ad5-Gag (р 0,001), и Ad35-Gag (p0,05) у этих мышей на 14 д. после иммунизации. Способность Ad35k5-Gag избегать низких/высоких уровней иммунитета против Ad5 согласуется с ранее полученными данными о том, что Ad5-специфические NAb направлены в первую очередь против гексонного белка Ad5 (см. выше; Sumida et al. 2005). Однако в этом предыдущем исследовании были также выявлены низкие уровни NAb, направленных против волоконного белка Ad5. Поэтому этот эксперимент повторили у мышей с высокими уровнями иммунитета против Ad5. Мышей предварительно иммунизировали 1010 vp Ad5-пустым за 8 и 4 нед. перед вакцинацией. Титры Ad5-специфических NAb у этих мышей были 8192-16384 (Barouch et al. 2004; Lemckert et al. 2005; Sprangers et al. 2003), сравнимыми с самыми высокими титрами, обнаруживаемыми у индивидуумов в Африке, южнее Сахары (Kostense etal. 2004; Sumida et al. 2005). Как показано на фиг. 4D, реакции тетрамерных +CD8+ T-лимфоцитов, вызванные Ad35k5-Gag, были частично снижены у этих мышей и были сравнимы с реакциями, вызваннымиAd35-Gag (р=незначимо). Таким образом, высокие уровни иммунитета против Ad5 частично подавляли- 16010433 иммуногенность векторов Ad35k5. Для оценки дальнейших деталей специфического для вектора иммунитета, вызванного химерными векторами Ad35k5-Gag, были выполнены гетерологичные исследования первичной-повторной иммунизации, а также анализы нейтрализации вирусов. Группы интактных мышей C57/BL6 (N=4/группу) подвергали первичной иммунизации в 0 нед. 109 vp Ad35k5-Gag и затем повторно иммунизировали через 4 нед. 109 vp Ad5-Gag или Ad35-Gag. Как показано на фиг. 5 А, реакции тетрамерных +CD8+ Т-лимфоцитов,вызванные Ad35k5-Gag, эффективно стимулировались Ad5-Gag, но не Ad35-Gag. Эти данные свидетельствуют о том, что Ad35 и Ad35k5 вызывали существенный перекрестно-реактивный антивекторный иммунитет, в то время как Ad35 и Ad35k5 были в значительной мере иммунологически различны. Согласованно с этими наблюдениями мыши, однократно иммунизированные Ad35k5-Gag, генерировали Ad35 специфические NAb, сравнимые с антителами, индуцируемыми Ad35-Gag, но существенно более низкие уровни Ad5-специфических NAb (фиг. 5 В). Таким образом, векторы Ad35k5 проявляли серологические профили, более похожие на векторы Ad35, чем векторы Ad5. Для оценки возможности обобщения этих результатов, иммуногенность векторов Ad35k5, экспрессирующих другой антиген (Env: HIV-I 89.6 Р Env gpl20, детали см. здесь и Vogels et al. 2003) оценивали на другой линии мышей. Группы интактных мышей Balb/c (N=4/группу) иммунизировали однократно внутримышечно 109 vp Ad5-Env, Ad35k5-Env или Ad35-Env. Клеточные и гуморальные иммунные реакции, вызванные векторами Ad35k5-Env, были промежуточными между реакциями, вызванными векторами Ad5-Env, и векторами Ad35-Env, по данным измерения анализами IFN- ELISPOT (фиг. 6A) и Envспецифическими ELISA (фиг. 6 В).ELISA выполняли следующим образом. Сывороточные титры антител, специфичных для HIV-I Env или SIV Gag от иммунизированных мышей, измеряли прямым ELISA, как описано в публикациях (Barouch et al. 2003; Sumida et al. 2005). 96-луночные планшеты, покрытые в течение ночи 100 мкл/лунку 1 мкг/мл рекомбинантного HIV-I MN Env gp120 или полипептидом SIVmac239 Gag p27 (ImmunoDiagnostics) в PBS, блокировали в течение 2 ч PBS, содержащей 2% BSA и 0,05% Tween-20. Затем сыворотки добавляли в серийных разведениях и инкубировали в течение 1 ч. Планшеты промывали 3 раза PBS, содержащим 0,05% Tween-20, и инкубировали в течение 1 ч при разведении 1:2000 конъюгированным пероксидазой, подвергнутым аффинной очистке кроличьим антимышиным вторичным антителом (JacksonLaboratories, USA). Планшеты промывали 3 раза, проявляли тетраметилбензидином, реакцию прекращали 1% HCl и анализировали при 450 нм устройством для считывания планшет ELISA Dynatech MR5000. Пример 6. Иммуногенность векторов Ad5, Ad35k5 и Ad35 у макак резус. Для подтверждения исследований иммуногенности у мышей выполнили поисковое исследование для оценки иммуногенности этих векторов у макак резус. 9 Mamu-A01-отрицательных макак резус(N=3/группу) иммунизировали внутримышечно 1011 векторов vp Ad5, Ad35 или Ad35k5, экспрессирующих SIV Gag и HIV-I Env. Первичную иммунизацию обезьян проводили в 0 нед. и гомологичную повторную иммунизацию через 12 нед. На фиг. 7 изображены специфические в отношение антигена и вектора иммунные реакции у этих животных. Gag- и Env-специфические клеточные иммунные реакции количественно определяли анализами объединенного пептида IFN- ELISPOT, а титры векторспецифических NAb определяли анализами нейтрализации на основе люциферазы в множественные точки времени после иммунизации. Анализ нейтрализации выполняли, как описано выше. Как ожидалось, векторы Ad5 вызывали высокую частоту реакций ELISPOT после первичной иммунизации (средние реакции Gag+Env 538 SFC/106 PBMC через 12 нед.), но эти реакции существенно не увеличивались после гомологичной повторной иммунизации (в среднем 608 SFC/106 PBMC через 16 нед.; фиг. 7A), предположительно отражая быстрое генерирование высоких титров Ad5-специфическихELISPOT, которые приблизительно в 2 раза ниже, чем реакции, вызываемые векторами Ad5 после первоначальной иммунизации (в среднем 248 SFC/106 PBMC через 12 нед.). Интересно, что эти реакции существенно увеличивались после гомологичной повторной иммунизации (в среднем 876 SFC/106 PBMC через 16 нед.; фиг. 7C), что согласуется с более низкими титрами вектор-специфических NAb, первоначально генерированных у этих животных (фиг. 7D). Эти данные свидетельствуют о том, что векторыAd35 вызывали и более низкие антиген-специфические иммунные реакции, а также более низкие векторспецифические иммунные реакции, по сравнению с векторами Ad5 у макак резус. Векторы Ad35k5 вызывали антиген-специфические реакции ELISPOT, сравнимые с реакциями, вызываемыми векторами Ad5, после первичной иммунизации (в среднем 578 SFC/106 PBMC через 12 нед.; фиг. 7E). Важно, что эти реакции были существенно усилены после гомологичной повторной иммунизации (в среднем 1736 SFC/106 PBMC через 16 нед.), предположительно отражая относительно низкий уровень вектор-специфических NAb, первоначально генерированных у этих обезьян (фиг. 7F). Действительно, после повторной иммунизации векторы Ad35k5 вызывали в 2-3 раза более высокие Gag- и Envспецифические реакции ELISPOT, чем векторы и Ad5, и Ad35. Более того, векторы Ad35k5 вызывали сильные реакции фракционированных CD4+ и CD8+ T-лимфоцитов через 16 нед. после иммунизации, по данным определения анализами ELISPOT с использованием PBMC с истощенными запасами CD8 и CD4(соответственно фиг. 8 А, В, С: Ad5, Ad35, Ad35k5). Пример 7. Генерирование рекомбинантных векторов Ad5, содержащих химерные гексонные белки.HVR Ad2 в соответствии с Crawford-Miksza and Schnurr (1996), Ad5 в соответствии с Rux and Burnett (2000), Ad5 в соответствии с Rux et al. (2003) и Ad5 в соответствии с настоящим изобретением изображены в табл. I. В табл. II представлены 7 последовательностей HVR человеческих аденовирусов Ad5,AdI1, Ad2 6, Ad35 и Ad48 и аденовируса шимпанзе 68 (Pan9) в соответствии с определением HVR по настоящему изобретению. Изображены также определенные положения внутри соответствующих последовательностей гексона. Были сконструированы векторы на основе Ad5, содержащие одну или более HVR, замененные изAd35 (подгруппа В) или Ad48 (подгруппа D). В более минималистическом варианте осуществления настоящего изобретения HVR указанных выше серотипов аденовируса определены в неком укороченном виде. Эти HVR отмечены звездочкой в табл. IV в виде HVR (1-7). Используя минималистическое определение в рекомбинантных векторах,произведена делеция HVR1 из остова, HVR2 замещена коротким спейсером из двух аминокислот(QG), тогда как HVR3, HVR4, HVR5, HVR6 и HVR7 замещены их соответствующими более короткимипартнерами из других серотипов. Существеннее всего то, что HVR7 заново определен гораздо уже (сравнить табл. II и табл. IV). Частичные гексонные гены, содержащие желательные последовательности, были синтезированыGeneArt (Germany) и клонированы в виде фрагментов Apal-Hpal в челночную плазмиду, содержащую полный ген гексона Ad5. Затем более крупный фрагмент Ascl-Ascl вырезали из этой челночной плазмиды и использовали для замещения соответствующего фрагмента Ascl-Ascl в космиде Ad5 pWE .Ad5.Aflll-rITR. dE3 (векторе, несущем делецию области Е 3 и основанную на космиде pWE .Ad5 .Aflll-rITR,см. WO 02/40665). Мутантные космиды Ad5 вместе с адапторной плазмидой pAdApt-Gag (кодирующей белок gag обезьяньего вируса иммунодефицита (SIV были затем совместно трансфецирозаны в клеткиPER.C6/55K (включающие ген 55K E1B из Ad35 в клетках PER.C6, см. WO 02/40665), и гомологичная рекомбинация давала рекомбинантный Ad5HVR35(1)-Gag, рекомбинантный Ad5HVR485(1)-Gag и рекомбинантный Ad5HVR48(1-7)-Gag вирусы, где 1 указывает на замещение только HVR1, и где 1-7 указывает на замещение всех семи отдельных HVR. Эти векторы были очищены от пятен, секвенированы,расширены и очищены центрифугированием в градиенте CsCl, в соответствии с общими процедурами,известными в данной области. Последовательность гексона в Ad5HVR48 (1-7)-Gag представлена на фиг. 11. Кроме трех вирусов, указанных выше, получены также следующие рекомбинантные векторы:Ad5HVR35 (1-6), Ad5HVR35 (1-7) (фиг. 12), Ad5HVR11 (1-6), Ad5HVR11 (1-7) (фиг. 13), Ad5HVR26 (16), Ad5HVR26 (1-7) (фиг. 14), Ad5HVRPan9 (1-6) и Ad5HVRPan9 (1-7) (фиг. 15). 1-6 Указывает на замещение HVR1-HVR6, оставляя HVR7 материнского вектора. Ясно, что на основании нескольких имеющихся материнских векторов (таких как Ad2 и Ad5) и нескольких редких серотипов возможно создание большего числа комбинаций, используя положения настоящего изобретения. Другие редкие серотипы человеческих аденовирусов, которые можно использовать для предоставления HVR с целью получения векторов скрытого типа, представляют собой Ad24, Ad34, Ad49 и Ad50. Пример 8. Иммуногенность вирусов Ad5, Ad5HVR48 (1) И Ad5HVR48 (1-7) у интактных мышей и у мышей с анти-Ad5 иммунитетом. Как указано выше, жизнеспособные рекомбинантные вирусы Ad5-Gag, Ad5HVR48 (1)-Gag иAd5HVR48 (1-7)-Gag были получены на упаковывающих клетках. Выход Ad5HVR48 (1)-Gag был сравним с рекомбинантным вирусом Ad5-Gag, в то время как скорость роста, выход и отношение vp/pfu вируса Ad5HVR48 (1-7)-Gag были приблизительно в 2 раза ниже, чем вируса Ad5-Gag. Сначала экспрессиюGag проверяли на клетках А 549, инфицированных 109 или 1010 vp каждого вектора. Данные ВЭЖХ указали на то, что экспрессия внутриклеточного Gag была достаточной и сравнимой между различными векторами (данные не показаны), хотя экспрессия из Ad5HVR48 (1-7)-Gag была несколько ниже, чем изAd5-Gag. Это могло быть связано с несколько более медленной скоростью роста. Сначала иммуногенность вирусов исследовали иммунизацией интактных мышей C57/BL6 (4 мыши на группу) 109, 108 и 107 vp каждого вектора. Вызванные вакциной реакции CD8+ Т-лимфоцитов оценивали анализами связывания тетрамера Db/AL11, как описано выше, в течение 2 нед. Результаты показаны на фиг. 9. Ясно, что все 3 вектора привели к сравнимым иммунным реакциям у этих интактных мышей,несмотря на небольшие различия скорости роста и трансгенной экспрессии. В последующем, мышей C57/BL6 предварительно иммунизировали 2 инъекциями 1010 vp Ad5 пустого, соответственно за 8 и 4 нед. до иммунизации представляющими интерес вирусами (титры Ad5NAb 8, 192-16, 384) для получения предсуществующего иммунитета против вектора основания Ad5. Затем (через 8 нед. от первой предварительной иммунизации) мышей иммунизировали, как указано выше,109, 108 и 107 vp рекомбинантных Ad5-Gag, Ad5HVR48 (1)-Gag и Ad5HVR48 (1-7)-Gag. И снова, вызванные вакциной реакции CD8+ Т-лимфоцитов оценивали анализами связывания тетрамера Db/AL11, как описано выше, в течение 2 нед. Результаты показаны на фиг. 10. Результаты ELISPOT были зеркальным отражением анализов тетрамера и дали аналогичные результаты (данные не показаны).- 18010433 Как ожидалось, вектор Ad5-Gag сталкивался с предсуществующим иммунитетом у этих предварительно иммунизированных мышей, что привело к трудно выявляемой иммунной реакции. ВирусAd5HVR48 (1)-Gag также не смог преодолеть высокие уровни анти-Ad5 иммунитета, свидетельствуя о том, что предсуществующий иммунитет, по меньшей мере, не ограничивается одной HVR1. Важно, что на иммуногенность вируса Ad5HVR48 (1-7)-Gag не влиял вызванный Ad5 предсуществующий иммунитет, указывая на то, что мутация 7 HVR гексона (как идентифицировано здесь) Ad5 и замещение их соответствующими HVR редкого серотипа (проиллюстрированные Ad48) приводит к получению вектора,которому не мешает предсуществующий иммунитет против белка дикого типа. Аналогичные результаты были получены в экспериментах, где мышей дважды подвергали первичной иммунизации пустым вектором Ad5, представляя ситуацию с высокими уровнями предсуществующего иммунитета (фиг. 21). Этот эксперимент выполняли с 4 мышами C57/BL6 на группу. Группы мышей предварительно иммунизировали двумя инъекциями 1010 vp Ad5-пустого для индукции анти-Ad5 иммунитета. У мышей, которых предварительно иммунизировали Ad5-пустым, титры Ad5 NAb были 8192-16384. Затем у мышей в 0 нед. проводили первичную иммунизацию 109 vp Ad35-Gag и затем повторно иммунизировали на 28 д. или 109 vpAd5-Gag, 109 vp Ad35-Gag, или 109 vp Ad5HVR48 (1-7)-Gag. Во всех инъекциях использовали объем 50 мкл. Стрелки на оси X указывают на иммунизации. Образцы крови получали через 0, 7, 14, 21, 28, 35, 42,49, 56 д. для анализов окрашивания тетрамера Db/AL11 для количественного определения вызванных вакциной реакции CD8+ Т-лимфоцитов. На 56 д. также выполняли анализы IFN-гамма ELISPOT, и они показали сравнимые результаты (данные не показаны). Ad5-Gag не смог усилить иммунные реакции предположительно вследствие анти-Ad35 иммунитета, вызванного первичной иммунизацией. Ad5HVR48(1-7) эффективно стимулировали реакции, подтверждая то, что этот вектор функционирует как некий тип нового серотипа. Сделан вывод, что, таким образом, Ad5HVR48 (1-7) может служить в качестве эффективного стимулирующего вектора в ситуациях, когда Ad5 оказывается несостоятельным, и в ситуациях, когда гетерологичный вектор (такой как Ad35) используется в качестве вектора первичной иммунизации. В комбинации с представленными ранее проведенными исследованиями, заявители приходят к общему выводу, что векторы, представленные Ad5HVR48 (1-7), представляют собой и эффективные векторы первичной иммунизации, и эффективные векторы повторной иммунизации в ситуациях предсуществующего анти-Ad5 иммунитета, где Ad5 оказывается несостоятельным. Эти результаты в настоящее время обеспечивают возможность использования векторов на основеAd5 в ситуациях первичной и повторной иммунизации, хотя рецепторное распознавание (главным образом, осуществляемое волоконными и пентонными белками) остается неизменным. Таблица I Определения гипервариабельной области внутри гексонного белка человеческих аденовирусов Ad2(2000) точно соответствуют определениям Crawford-Miksza, основанным на последовательности Ad2. Следует отметить, что все эти определения HVR изменены положением 1 в этой таблице вследствие отсутствия первоначального остатка метионина в определениях Rux and Burnett. (2000) (HVR1: 137-181 и т.д.).- 20010433 Таблица III Химерный репликационно дефективный вектор аденовируса в соответствии с настоящим изобретением,включающий идентификацию различных элементов внутри указанного вектораHum Gene Ther 13:311. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Партия рекомбинантного дефектного по репликации аденовируса на основе серотипа подгруппы С, причем указанный аденовирус включает химерный гексонный белок, где указанный химерный гексонный белок включает последовательности гипервариабельной области с HVR1 по HVR7 из серотипа подгруппы В или D или из серотипа Pan9 аденовируса шимпанзе и где последовательности между последовательностями HVR относятся к указанному серотипу подгруппы С.SEQ ID NO: 101, 108, 115, 122, 129, 136, 143 и 150. 4. Партия по п.1 или 2, где указанный серотип подгруппы С представляет собой Ad5.
МПК / Метки
МПК: A61K 48/00, C12N 15/861
Метки: векторы, применение, усовершенствованные, аденовирусные
Код ссылки
<a href="https://eas.patents.su/30-10433-usovershenstvovannye-adenovirusnye-vektory-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Усовершенствованные аденовирусные векторы и их применение</a>
Предыдущий патент: Применение (е)-5-(4-хлорбензилиден)-2, 2-диметил-1-(1н-1,2,4-триазол-1- илметил)циклопентанола для борьбы со ржавчиной на растениях сои
Следующий патент: Способ получения цитотоксических лимфоцитов
Случайный патент: Многокамерная газовая горелка трубчатого типа