Пептиды, которые связываются с рецептором к эритропоэтину, и способы их применения
Номер патента: 10099
Опубликовано: 30.06.2008
Авторы: Иин Кан, Земеде Дженет, Шац Петер Джей, Палани Балу, Лалонде Гай, Хольмез Кристофер П., Тумелти Дэвид
Формула / Реферат
1. Пептид, содержащий примерно от 17 до 40 остатков аминокислот и содержащий последовательность аминокислот
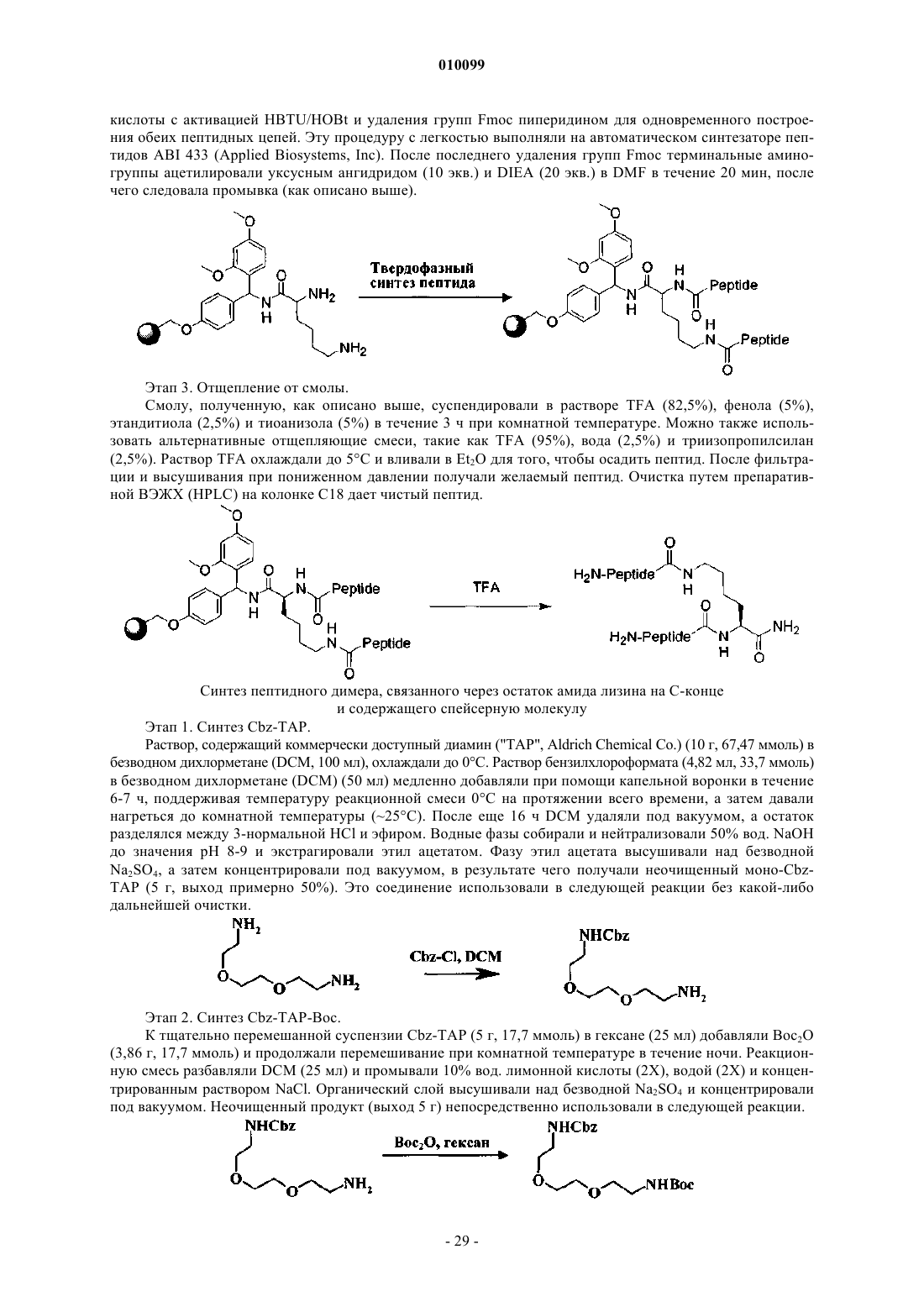
![]()
где Х0 обозначает остаток, выбранный из метионина (М) и метилового эфира гомосерина (Hsm), a X1 обозначает остаток, выбранный из триптофана (W), 1-нафтилаланина (1-nal) и 2-нафтилаланина (2-nal), где указанный пептид связывается с рецептором к эритропоэтину (ЭПО-рецептором) и активирует его.
2. Пептид согласно п.1, отличающийся тем, что N-конец указанного пептида ацетилирован.
3. Пептид согласно п.1, отличающийся тем, что указанный пептид содержит последовательность аминокислот, выбранную из


4. Пептид согласно п.1, отличающийся тем, что указанный пептид представляет собой мономер, димер или гомодимер.
5. Пептид согласно п.1, отличающийся тем, что дополнительно содержит один или более водорастворимых полимеров, ковалентно связанных с указанным пептидом.
6. Пептид согласно п.5, отличающийся тем, что указанный водорастворимый полимер представляет собой полиэтиленгликоль (ПЭГ).
7. Пептид согласно п.6, отличающийся тем, что указанный ПЭГ содержит линейную неразветвленную молекулу, имеющую молекулярную массу примерно от 500 до 60000 Да.
8. Пептид согласно п.7, отличающийся тем, что указанный ПЭГ имеет молекулярную массу меньше чем примерно 20000 Да.
9. Пептид согласно п.7, отличающийся тем, что указанный ПЭГ имеет молекулярную массу примерно от 20000 до 60000 Да, предпочтительно примерно от 20000 до 40000 Да.
10. Пептид согласно п.7, отличающийся тем, что два фрагмента ПЭГ ковалентно связаны с указанным пептидом, причем каждый из указанных ПЭГ содержит линейную неразветвленную молекулу.
11. Пептид согласно п.10, отличающийся тем, что указанный ПЭГ имеет молекулярную массу примерно от 20000 до 30000 Да.
12. Пептидный димер, содержащий:
(a) первую пептидную цепь,
(b) вторую пептидную цепь и
(с) линкерный фрагмент, соединяющий указанные первую и вторую пептидные цепи, отличающийся тем, что по меньшей мере одна из указанных первой пептидной цепи и второй пептидной цепи имеет примерно от 17 до 40 остатков аминокислот в длину и содержит последовательность аминокислот
![]()
где Х0 обозначает остаток, выбранный из метионина (М) метилового эфира гомосерина (Hsm), а X1 обозначает остаток, выбранный из триптофана (W), 1-нафтилаланина (1-nal) и 2-нафтилаланина (2-nal), где указанный пептид связывается с рецептором к эритропоэтину (ЭПО-рецептором) и активирует его.
13. Пептидный димер согласно п.12, отличающийся тем, что по меньшей мере одна из указанной первой пептидной цепи и указанной второй пептидной цепи содержит последовательность аминокислот, выбранную из

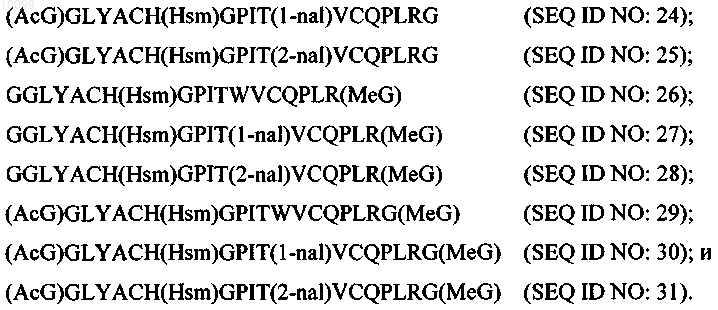
14. Пептидный димер согласно п.12, отличающийся тем, что указанный линкерный фрагмент имеет формулу
![]()
где R3 обозначает низший (С1-6)алкен.
15. Пептидный димер согласно п.14, отличающийся тем, что указанный линкерный фрагмент представляет собой остаток лизина.
16. Пептидный димер согласно п.12, отличающийся тем, что указанный линкерный фрагмент имеет формулу
![]()
где n является целым числом от 0 до 10, m является целым числом от 1 до 10, X выбирают из О, S, N(CH2)pNR1, NCO(CH2)pNR1 и CHNR1, R1 выбирают из Н, Вос и Cbz, a p является целым числом от 1 до 10.
17. Пептидный димер согласно п.16, отличающийся тем, что каждое из чисел n и m равно 1, X обозначает NCO(CH2)pNR1, р равно 2, a R1 обозначает Н.
18. Пептидный димер согласно п.12, отличающийся тем, что дополнительно содержит водорастворимый полимер.
19. Пептидный димер согласно п.18, отличающийся тем, что указанный водорастворимый полимер ковалентно связан с линкерным фрагментом.
20. Пептидный димер согласно п.12, отличающийся тем, что дополнительно содержит спейсерный фрагмент.
21. Пептидный димер согласно п.20, отличающийся тем, что указанный спейсерный фрагмент имеет формулу
![]()
где каждое из чисел a,b и e является целым, значение которого независимо выбрано из чисел от 1 до 6, d равно 0 или 1, g является целым числом, выбранным из чисел от 0 до 10, a Y выбирают из NH или СО, при условии, что b равно 2, при g большем чем 1.
22. Пептидный димер согласно п.21, отличающийся тем, что каждое из чисел a, b и e равно 2, каждое из чисел g и d равно 1, a Y обозначает NH.
23. Пептидный димер согласно п.20, отличающийся тем, что дополнительно содержит один или более водорастворимых полимеров.
24. Пептидный димер согласно п.23, отличающийся тем, что указанный водорастворимый полимер ковалентно связан со спейсерным фрагментом.
25. Пептидный димер согласно п.18 или 23, отличающийся тем, что указанный водорастворимый полимер представляет собой полиэтиленгликоль (ПЭГ, PEG).
26. Пептидный димер согласно п.25, отличающийся тем, что указанный ПЭГ представляет собой линейный неразветвленный ПЭГ, имеющий молекулярную массу примерно от 500 до 60000 Да.
27. Пептидный димер согласно п.26, отличающийся тем, что указанный ПЭГ имеет молекулярную массу примерно от 500 до менее 20000 Да.
28. Пептидный димер согласно п.26, отличающийся тем, что указанный ПЭГ имеет молекулярную массу примерно от 20000 до 60000 Да, предпочтительно примерно от 20000 до 40000 Да.
29. Пептидный димер согласно п.25, отличающийся тем, что два фрагмента ПЭГ ковалентно связаны с пептидом, причем каждый ПЭГ содержит линейную неразветвленную молекулу.
30. Пептидный димер согласно п.29, отличающийся тем, что каждый из указанных ПЭГ имеет молекулярную массу примерно от 20000 до 30000 Да.
31. Способ лечения пациента, включающий введение пациенту, который имеет нарушение, характеризующееся дефицитом (недостаточностью) эритропоэтина либо низкой или дефицитной (недостаточной) популяцией эритроцитов, терапевтически эффективного количества пептида согласно любому из пп.1-11, имеющего примерно от 17 до 40 остатков аминокислот в длину и содержащего последовательность аминокислот
![]()
где Х0 обозначает остаток, выбранный из метионина (М) и метилового эфира гомосерина (Hsm), a X1 обозначает остаток, выбранный из триптофана (W), 1-нафтилаланина (1-nal) и 2-нафтилаланина (2-nal).
32. Способ согласно п.31, отличающийся тем, что указанное нарушение выбирают из терминальной стадии почечной недостаточности или диализа, анемии на фоне СПИДа, аутоиммунного заболевания или злокачественного заболевания, бета-талассемии, кистозного фиброза, анемии недоношенных детей, анемии, ассоциированной с хроническим воспалением, повреждения спинного мозга, острой потери крови, старения, а также состояний опухолевого заболевания, сопровождающихся нарушенным эриропоэзом.
33. Фармацевтический состав, содержащий:
(i) пептид по любому из пп.1-11, имеющий длину от примерно 17 до примерно 40 остатъют аминокислот и содержащий последовательность аминокислот
![]()
где Х0 обозначает остаток, выбранный из метионина (М) и метилового эфира гомосерина (Hsm), а X1 обозначает остаток, выбранный из триптофана (W), 1-нафтилаланина (1-nal) и 2-нафтилаланина (2-nal), и
(ii) фармацевтически приемлемый носитель.
Текст
010099 Настоящая заявка испрашивает приоритет согласно предварительной заявке США 60/470,245, поданной 12 мая 2003. Содержание этой приоритетной заявки полностью включено в настоящее описание путем ссылки. Область техники Настоящее изобретение относится к пептидным соединениям, которые являются агонистами рецептора к эритропоэтину (EPO-R, ЭПО-рецептора). Данное изобретение также относится к способам терапии, в которых такие пептидные соединения применяют для лечения нарушений, ассоциированных с недостаточной или дефицитной продукцией эритроцитов. Также предусмотрены фармацевтические составы, которые содержат пептидные соединения согласно данному изобретению. Уровень техники Эритропоэтин (ЭПО) представляет собой гормон гликопротеиновой природы, состоящий из 165 аминокислот, с молекулярной массой примерно 34 килодальтон (кДа) и предпочтительными сайтами гликозилирования в 24, 38, 83 и 126 положениях аминокислот. ЭПО первоначально синтезируется в виде белка-предшественника с сигнальным пептидом из 23 аминокислот. Эритропоэтин существует в трех формах: -, - и асиало-формах. Формы - и - слегка различны в своей углеводной части, но обладают одинаковой эффективностью, биологической активностью и молекулярной массой. Асиало-форма представляет собой - или -форму без концевого углевода (сиаловой кислоты). Последовательности ДНК, кодирующие эритропоэтин, были описаны ранее (патент США U.S. Pat. No. 4703008, Lin). ЭПО стимулирует митотическое деление и дифференцировку клеток-предшественников эритроцитов,что обеспечивает продукцию эритроцитов. Продукция ЭПО происходит в почках в условиях гипоксии. В ходе индуцируемой эритропоэтином дифференцировки клеток-предшественников эритроцитов происходят индукция синтеза глобина, стимуляция синтеза гемсодержащего комплекса и увеличение числа рецепторов к ферритину. Эти изменения позволяют клетке поглощать больше железа и синтезировать функционально активный гемоглобин, который связывает кислород в зрелых эритроцитах. Таким образом, эритроциты и их гемоглобин играют ключевую роль в снабжении организма кислородом. Эти изменения инициированы взаимодействием эритропоэтина с соответствующим рецептором на поверхности клеток-предшественников эритроцитов (см., например., Graber, Krantz (1978) Ann. Rev. Med. 29: 51-66). Если организм находится в здоровом состоянии, когда существующее число эритроцитов обеспечивает достаточную оксигенацию тканей, эритропоэтин присутствует в плазме в очень низких концентрациях. Эти нормальные низкие концентрации достаточны для стимуляции замещения эритроцитов, которые естественным образом погибают в результате старения. Количество ЭПО в циркулирующей крови возрастает в условиях гипоксии, когда транспорт кислорода эритроцитами в циркулирующей крови снижен. Гипоксия может быть вызвана, например, значительной потерей крови вследствие кровотечения, разрушением эритроцитов при передозировке радиации, уменьшении количества вдыхаемого кислорода вследствие нахождения на большой высоте или продолжительного обморока либо различными формами анемии. В ответ на такой гипоксический стресс повышение уровня ЭПО увеличивает продукцию эритроцитов путем стимуляции пролиферации эритроидных предшественников. Когда количество эритроцитов превышает количество, необходимое для удовлетворения нормальной потребности тканей в кислороде, происходит снижение уровня ЭПО в циркулирующей крови. Поскольку ЭПО необходим для образования эритроцитов, существуют потенциально полезные применения этого гормона как в диагностике, так и в лечении болезней крови, характеризующихся низкой либо дефицитной (недостаточной) продукцией эритроцитов. Недавние исследования обеспечили основу для планирования эффективного терапевтического применения ЭПО в лечении разнообразных болезненных состояний, нарушений и состояний с гематологическими расстройствами, включая бета-талассемию (см. Vedovato, et al. (1984) Acta. Haematol. 71: 211-213), кистозный фиброз (муковисцедоз) (см.Vichinsky, et al. (1984) J. Pediatric. 105: 15-21), нарушения менструального цикла и беременности (см.Cotes, et al. (193) Brit. J. Ostet. Gyneacol. 90: 304-311), анемию недоношенных детей (см. Haga, et al. (1983)Acta Pediatr. Scand. 72: 827-831), повреждение спинного мозга (см. Claus-Walker, et al. (1984) Arch. Phys.(1984) J. Lab. Clin. Med. 103: 574-580 и 581-588, а также Lipschitz, et al. (1983) Blood 63: 502-509), различные опухолевые заболевания, сопровождающиеся нарушенным эритропоэзом (см. Dainiak, et al. (1983)Cancer 5: 1101-1106, а также Schwartz, et al. (1983) Otolaryngol. 109: 269-272), а также почечную недостаточность (см. Eschbach. et al. (1987) N. Eng. J. Med. 316: 73-78). Бал описан очищенный однородный ЭПО (патент США U.S. Pat. No. 4677195, Hewick). Последовательность ДНК, кодирующая ЭПО, была очищена, клонирована и экспрессирована, в результате чего были получены рекомбинантные полипептиды, обладающие биохимическими и иммунологическими свойствами природного ЭПО. Также была получена молекула рекомбинантного ЭПО с олигосахаридами,идентичными олигосахаридам природного ЭПО (см. Sasaki, et al. (1987) J. Biol. Chem. 262: 12059-12076). Оказалось, что биологическое действие ЭПО частично опосредовано взаимодействием с мембраносвязанным клеточным рецептором. Первоначальные исследования на незрелых эритроидных клетках,-1 010099 выделенных из селезенки мыши, позволили предположить, что связывающие ЭПО белки на поверхности клетки содержат два полипептида, имеющих молекулярные массы, равные приблизительно 85000 и 100000 Да соответственно (Sawyer, et al. (1987) Proc. Natl. Acad. Sci. USA 84: 3690-3694). Расчетное число сайтов связывания ЭПО составило, в среднем, от 800 до 1000 на поверхности одной клетки. Из этих сайтов связывания приблизительно 300 связывало ЭПО с Kd, равной приблизительно 90 пМ (пикомоль), в то время как остальные связывали ЭПО с пониженной аффинностью, равной приблизительно 570 пМ (Sawyer, et al. (1987) J. Biol. Chem. 262: 5554-5562). Независимое исследование позволило предположить, что ЭПО-чувствительные эритробласты селезенки, полученные от мышей, которым путем инъекции вводили ослабленный штамм (FVA) вируса лейкоза Фрейда, обладают высоко- и низкоаффинными сайтами связывания ЭПО общим числом приблизительно 400, причем значения Kd составляют 100 и 800 пМ для высоко- и низкоаффинных сайтов соответственно (Landschulz, et al. (1989) Blood 73: 1476-1486). Последующая работа показала, что единственный ген кодирует две формы рецептора к ЭПО (ЭПОрецептора). Этот ген был клонирован (см., например, Jones, et al. (1990) Blood 76, 31-35, Noguchi, et al.(1991) Blood 78: 2548-2556; Maouche, et al. (1991) Blood 78: 2557-2563). Например, последовательности ДНК и кодируемые пептидные последовательности для белков ЭПО-рецептора мыши и человека описаны в публикации РСТ номер WO 90/08822 (D'Andrea, et al.). Современные модели предполагают, что связывание ЭПО с ЭПО-рецептором приводит к димеризации и активации двух молекул ЭПО-рецептора,что приводит к ряду последовательных этапов передачи сигнала (см., например, Watowich, et al. (1992)Proc. Natl. Acad. Sci. USA 89: 2140-2144). Доступность клонированных генов ЭПО-рецептора облегчает поиск агонистов и антагонистов этого важного рецептора. Доступность рекомбинантного белка рецептора позволяет изучать лиганд-рецепторные взаимодействия во множестве систем случайной и полупроизвольной генерации разнообразия белков. Эти системы включают систему "пептиды на плазмидах" (описана в патенте США 6270170), систему "пептиды на фаге" (описана в патенте США 5432018 и Cwirla, et al. (1990) Proc. Natl. Acad. Sci. USA 87: 63786382), систему "библиотека кодированных синтетических пептидов" (описана в заявке на патент СШАScience 251: 767-773; Dower, Fodor (1991) Ann. Rep. Med. Chem. 26: 271-180; и патенте США 5424186). Были идентифицированы пептиды, которые, по меньшей мере, в некоторой степени взаимодействуют с ЭПО-рецептором. Эти белки описаны, например, в патентах США 5773569 и 5830851, а также 5986047 (Wrighton, et al.); публикации WO 96/40749 (Wrighton, et al.); патенте США 5767078 и публикации WO 96/40772 (Johnson и Zivin); публикации WO 01/38342 (Balu) и WO 01/91780 (Smith-Swintosky, etal.). В частности, была идентифицирована группа содержащих пептидный мотив пептидов, члены которой связываются с ЭПО-рецепторами и стимулируют ЭПО-зависимую пролиферацию клеток. Однако идентифицированные до сих пор пептиды, которые содержат данный мотив, стимулируют ЭПО-зависимую пролиферацию клеток in vitro со значениями ЕС 50, равными от примерно 20 наномоль (нМ) до примерно 250 нМ. То есть для того, чтобы стимулировать 50% максимальной пролиферации клеток, стимулируемой ЭПО, требуются концентрации пептида от 20 до 250 нМ. С учетом огромного потенциала агонистов ЭПО-рецепторов как для исследований важных биологических функций, опосредуемых этим рецептором, так и для лечения заболеваний остается потребность в идентификации пептидов-агонистов ЭПО-рецепторов с повышенной эффективностью и активностью. Настоящее изобретение предусматривает такие соединения. Цитирование и/или обсуждение цитируемых источников в этом разделе и во всей спецификации приведены просто для разъяснения описания настоящего изобретения и не являются признанием того,что какая-либо из ссылок представляет собой прототип настоящего изобретения. Сущность изобретения Настоящее изобретение предусматривает пептиды, которые являются агонистами ЭПО-рецепторов с существенно повышенными эффективностью и активностью. Эти агонисты включают мономерные пептидные агонисты длиной от 17 до примерно 40 аминокислот, которые содержат коровую последовательность аминокислот LYACHX0GPITX1VCQPLR (SEQ ID NO: 1), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, Х 0 обозначает метионин (М) или метиловый эфир гомосерина (Hsm), a X1 обозначает триптофан (W), 1-нафтилаланин (1-nal) или 2-нафтилаланин (2-nal), а также димерные пептидные агонисты, которые содержат два мономера пептидов, где длина каждого пептидного агониста составляет от 17 до примерно 40 аминокислот и содержит коровую последовательность аминокислот LYACHX0GPITX1VCQPLR (SEQ ID NO: 1), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, Х 0 обозначает метионин (М) или метиловый эфир гомосерина (Hsm), a X1 обозначает триптофан (W), 1-нафтилаланин (1-nal), или 2-нафтилаланин (2-nal). Эффективность этих новых пептидных агонистов может быть дополнительно увеличена путем одной или более модификаций,включающих ацетилирование, образование внутримолекулярных дисульфидных связей, а также ковалентное присоединение одного или более фрагментов полиэтиленгликоля (ПЭГ, PEG). Данное изобретение также предусматривает фармацевтические составы, содержащие такие пептидные агонисты и способы лечения разнообразных медицинских состояний с применением таких пептидных агонистов.-2 010099 Подробное описание изобретения Определения Названия остатков аминокислот в пептидах имеют следующие сокращения (аббревиатуры): фенилаланин - Phe или F, лейцин - Leu или L, изолейцин - Ile или I, метионин - Met или М, валин - Val или V,серин - Ser или S, пролин - Pro или Р, треонин - Thr или Т, аланин - Ala или А, тирозин - Tyr или Y, гистидин - His или Н, глутамин - Gln или Q, аспарагин - Asn или N, лизин - Lys или K, аспарагиновая кислота - Asp или D, глутаминовая кислота - Glu или Е, цистеин - Cys или С, триптофан -Trp или W, аргинин Arg или R, глицин - Gly или G. Минорные аминокислоты в пептидах имеют следующие аббревиатуры: 1 нафтилаланин - 1-nal или Np, N-метилглицин (также известный как саркозин) - MeG или Sc, а ацетилированный глицин (N-ацетилглицин) - AcG. Термин "полипептид" или "белок" обозначает здесь полимер, мономерами которого являются аминокислоты, которые представляют собой альфа-аминокислоты, соединенные между собой амидными связями. Длина полипептидов равна, следовательно, по меньшей мере двум остаткам аминокислот, но обычно полипептиды длиннее. Обычно термин "пептид" обозначает полипептид, длина которого составляет всего несколько остатков аминокислот. Длина новых пептидов - агонистов ЭПО-рецептора согласно настоящему изобретению составляет предпочтительно не больше, чем примерно 50 остатков аминокислот. Более предпочтительно их длина составляет примерно от 17 до 40 остатков аминокислот. Полипептид, в отличие от пептида, может содержать любое число остатков аминокислот. Следовательно, термин"полипептид" включает пептиды, а также более длинные последовательности аминокислот. Фраза "фармацевтически приемлемый" обозначает здесь молекулы или составы, которые "считают,в целом, безопасными", например те, которые являются физиологически приемлемыми и обычно не вызывают при введении человеку аллергических или аналогичных нежелательных реакций, таких как расстройство желудка, головокружение и т.п. Термин "фармацевтически приемлемый" предпочтительно употребляется здесь в понимании одобренного органом федерального или государственного регулирования либо перечисленного в Фармакопее США или другой общепризнанной фармакопее как пригодного для применения у животных, а точнее у людей. Термин "носитель" обозначает дилюент, адъювант, наполнитель или разбавитель, с которым вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла нефти, масла растительного, животного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло,кунжутное масло и т.п. В качестве носителей, особенно для инъекционных растворов, используют предпочтительно воду или водные буферные растворы, а также водные растворы декстрозы и глицерина. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences" (автор E.W. Martin). Термин "агонист" обозначает здесь биологически активный лиганд, который связывается с комплементарным ему биологически активным рецептором и активирует последний, что либо вызывает биологический ответ рецептора, либо усиливает уже существующую биологическую активность рецептора. Новые пептиды, которые являются агонистами ЭПО-рецептора Настоящее изобретение описывает пептиды, которые являются агонистами ЭПО-рецептора и обладают существенно повышенными эффективностью и активностью. Эти пептидные агонисты предпочтительно имеют длину от 17 до примерно 40 аминокислот и содержат коровую последовательность аминокислот LYACHX0GPITX1VCQPLR (SEQ ID NO: 1) где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, X0 обозначает метионин (М) или метиловый эфир гомосерина (Hsm), a X1 обозначает триптофан (W), 1-нафтилаланин (1-nal), или 2-нафтилаланин (2-nal). Пептиды согласно данному изобретению могут представлять собой мономеры, димеры или другие мультимеры. Мультимеры пептидов согласно данному изобретению могут представлять собой тримеры,тетрамеры, пентамеры или другие структуры более высокого порядка. Кроме того, такие димеры и другие мультимеры могут представлять собой гетеродимеры или гетеромультимеры. Мономеры пептидов согласно настоящему изобретению могут представлять собой продукты деградации (например, продукты окисления метионина или деаминированного глутамина, С-концевого амида). Такие продукты деградации могут быть использованы в настоящем изобретении и, следовательно, рассматриваются как его часть. В предпочтительных способах реализации гетеромультимеры согласно данному изобретению содержат многочисленные пептиды, каждый из которых является пептидом-агонистом ЭПО-рецептора. В ососбенно предпочтительных способах реализации мультимеры согласно данному изобретению представляют собой гомомультимеры, т.е. они содержат многочисленные пептиды-агонисты ЭПО-рецептора с одной и той же последовательностью аминокислот. Соответственно, настоящее изобретение также относится к димерам пептидов-агонистов ЭПО-рецептора, которые демонстрируют значительно повышенную эффективность и активность. В предпочтительных способах реализации димеры согласно данному изобретению содержат два пептида, каждый из которых представляет собой пептид-агонист ЭПО-рецепотора. Эти предпочтительные агонисты-димеры пептидов содержат два пептидных мономера, причем каждый пептидный мономер имеет в длину от 17 до примерно 40 аминокислот и содержит коровую последовательность аминокислот LYACHX0GPITX1VCQPLR(SEQ ID NO: 1), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, X0 обозначает метионин (М) или метиловый эфир гомосерина (Hsm), a X1 обозначает триптофан (W), 1-наф-3 010099 тилаланин (1-nal) или 2-нафтилаланин (2-nal). В особенно предпочтительных способах реализации димеры согласно данному изобретению содержат два пептида-агониста ЭПО-рецептора с одинаковой последовательностью аминокислот. Согласно некоторым способам реализации данного изобретения два или более, а предпочтительно от двух до шести остатков аминокислот, независимо выбранных из 20 генетически кодируемых L-аминокислот или стереоизомерных D-аминокислот, будет связано с одним из концов основной последовательности или с обоими концами коровой последовательности, описанной выше. Например, часто к одному из концов или к обоим концам основной последовательности будет добавлена последовательность GG. Стереоизомеры (например, D-аминокислоты) 20 основных аминокислот, неприродные аминокислоты, такие как а,а-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие минорные аминокислоты, могут быть подходящими компонентами для соединений согласно настоящему изобретению. Примеры минорных аминокислот включают, без ограничения, -аланин, 3-пиридилаланин,4-гидроксипролин, О-фосфосерин, N-метилглицин, N-ацетилсерин, N-формилметионин, 5-гидроксилизин, нор-лейцин и другие аналогичные аминокислоты и иминокислоты. Возможны также другие модификации, включая модификацию N-конца, модификацию С-конца,замену одной или более встречающихся в природе, генетически кодируемых аминокислот минорными аминокислотами, модификацию боковых радикалов одного или более остатков аминокислот, фосфорилирование пептида и т.п. Одной из предпочтительных модификаций N-конца является ацетилирование(например, уксусной кислотой или ее галогензамещенной аминокислотой). В предпочтительных способах реализации N-концевой глицин подвергнут ацетилированию, в результате которого образуется N-метилглицин (MeG, также известный как саркозин). Предпочтительные пептидные мономеры согласно настоящему изобретению включают, без ограничения-4 010099 В предпочтительных способах реализации мономеры пептидов согласно данному изобретению содержат внутримолекулярную дисульфидную связь между двумя остатками цистеина основной последовательности. Такие мономеры могут быть представлены следующим образом: Настоящее изобретение также предусматривает конъюгаты этих пептидных мономеров. Так, согласно одному из предпочтительных способов реализации мономеры пептидов согласно настоящему изобретению могут быть димеризованы или олигомеризованы, что приведет к повышению их активности как агонистов ЭПО-рецепторов. В одном из способов реализации мономеры пептидов согласно данному изобретению могут быть олигомеризованы с использованием системы стрептавидин/биотин. Биотинилированные аналоги мономеров пептидов могут быть синтезированы по стандартным методикам. Например, биотин может быть присоединен к С-концу мономера пептида. Затем эти биотинилированные мономеры подвергают олигомеризации путем инкубации со стрептавидином (например, в молярном отношении 4:1 при комнатной температуре в фосфатном буферном растворе (PBS) или и в среде RPMI (Invitrogen) в буфере HEPES в течение 1 ч). В одном из вариантов этого способа реализации биотинилированные мономеры пептидов могут быть олигомеризованы путем инкубации с одним или несколькими коммерчески доступными антибиотиновыми антителами (например, антибиотиновые IgG козы производства KirkegaardPerry Laboratories,Inc. (Вашингтон, округ Колумбия, США. В предпочтительных способах реализации мономеры пептидов согласно данному изобретению димеризуют путем ковалентного присоединения к линкерному фрагменту (соединяющему фрагменту). Линкерный (LK) фрагмент предпочтительно, хотя и не обязательно, представляет C1-12 линкерный фрагмент, факультативно заканчивающийся одной или двумя связями -NH- и факультативно содержащий замены в одном или двух доступных атомах углерода заместителем, который представляет собой низший алкил. Линкер LK предпочтительно содержит -NH-R-NH-, где R обозначает низший (C1-6) линейный углеводород, замещенный функциональной группой, такой как карбоксильная группа или аминогруппа, которая обеспечивает связывание с другим молекулярным фрагментом (который может, например, присутствовать на поверхности твердого носителя (подолжки. Наиболее предпочтительно линкер представляет собой остаток лизина или амида лизина (остаток лизина, в котором карбоксильная группа была трансформирована в амидный фрагмент -CONH2). В предпочтительных способах реализации линкер соединяет С-концы двух пептидных мономеров путем одновременного присоединения к С-концевой аминокислоте каждого мономера. Например, в случае, когда С-концевой линкер LK представляет собой амид лизина структура димера может быть изображена, как показано в формуле I. Обобщенное изображение дано в формуле II: В формуле I и формуле II N2 представляет атом азота -аминогруппы лизина, а N1 представляет атом азота -аминогруппы лизина. Структура димера может быть записана следующим образом: [пептид]2Lys-амид, чтобы обозначить пептиды, связанные с - и -аминогруппами лизина, или [Ас-пептид]2Lys-амид, чтобы обозначить ацетилированные на N-конце пептиды, связанные - и -аминогруппами лизина, или [Ас-пептид-дисульфид]2Lys-спейсер-ПЭГ, чтобы обозначить ацетилированные на N-конце пептиды, связанные - и -аминогруппами лизина, каждый из которых содержит внутримолекулярную дисульфидную петлю и спейсерную молекулу, образующую ковалентную связь между С-концом лизина и фрагментом ПЭГ, либо [Ас-пептид-Lys-NH2]2-иминодиуксусный-N-(Вос-Ala), чтобы обозна-5 010099 чить гомодимер ацетилированного на N-конце пептида, несущего С-концевой остаток амида лизина, где-амин лизина связан с двумя карбоксильными группами иминодиуксусной кислоты, где Вос-бетааланин ковалентно связан с атомом азота иминодиуксусной кислоты амидной связью. В одном из дополнительных способах реализации полиэтиленгликоль (ПЭГ) может служить линкером LK, который связывает два мономера в димер: например, единственный фрагмент ПЭГ может быть одновременно присоединен к N-концам обеих пептидных цепей пептидного димера. Еще в одном дополнительном способе реализации линкерный (LK) фрагмент представляет собой предпочтительно, но не обязательно, молекулу, содержащую две карбоксильные кислоты и факультативно содержащую замену по одному или более доступных атомов дополнительными функциональными группами, такими как аминогруппа, которые могут образовывать связи с одной или более молекул ПЭГ. Такую молекулу можно изобразить следующим образом: где n является целым числом от 0 до 10, m является целым числом от 0 до 10, X выбирают из О, S, N(CH2)pNR1,NCO(CH2)pNR1 и CHNR1, R1 выбирают из Н, Boc, Cbz и т.д., а р является целым числом от 1 до 10. В предпочтительных способах реализации одна аминогруппа каждого из пептидов образует амидную связь с линкером LK. В особенно предпочтительных способах реализации аминогруппа пептида, связанная с линкером LK, является эпсилон-аминогруппой остатка лизина, или альфа-аминогруппой N-концевого остатка, либо аминогруппой факультативной спейсерной молекулы. В особенно предпочтительных способах реализации и n, и m равны 1, X обозначает NCO(CH2)pNR1, p равно 2, a R1 обозначает Boc. Структура ЭПО-связывающих димеров пептидов, содержащих такой предпочтительный линкер, может быть изображена, как показано в формуле III. По желанию (факультативно), группу Boc можно удалить, чтобы освободить химически активную аминогруппу, которая может образовывать ковалентную связь с активированными подходящим образом молекулами водорастворимого полимера, например молекулами ПЭГ, такими как мПЭГ-паранитрофенилкарбонат (mPEG-NPC), мПЭГ-сукцинимидил пропионат (mPEG-SPA) и N-гидросукцинимид-ПЭГ(NHS-PRG) (см., например, патент США US Patent No. 5672662). Структура ЭПО-связывающего димерного пептида, содержащего такой предпочтительный линкер, может быть изображена, как показано в формуле IV. Обычно, хотя и не обязательно, димеры пептидов будут также содержать одну и более внутримолекулярных дисульфидных связей между остатками цистеина пептидных мономеров. Предпочтительно два мономера содержат по меньшей мере одну внутримолекулярную дисульфидную связь. Наиболее предпочтительно оба мономера пептидного димера содержат внутримолекулярную дисульфидную связь и,таким образом, каждый мономер содержит циклическую группу. Пептидный мономер или димер может также содержать один или более спейсерных (разделительных) фрагментов. Такие спейсерные фрагменты могут быть присоединены к пептидному мономеру или пептидному димеру. Предпочтительно такой спейсерный фрагмент может быть присоединен к линкерному LK фрагменту, который связывает мономеры пептидного димера. Например, такой спейсерный фрагмент может быть присоединен к пептидному димеру через атом углерода карбонильной группы лизинового линкера или через атом азота линкера на основе иминодиуксусной кислоты. Например, такой спейсер может соединять линкер пептидного димера с фрагментом водорастворимого полимера или защитной группой. В другом примере такой спейсер может связывать пептидный мономер с присоединенным фрагментом водорастворимого полимера. В одном способе реализации спейсерный фрагмент представляет собой C1-12 фрагмент, факульта-6 010099 тивно заканчивающийся -NH-связями или -С(ООН)-группами и факультативно содержащий замены у одного или нескольких доступных атомов углерода заместителями, которые представляют собой низшие алкилы. В одном способе реализации спейсер представляет собой R-COOH, где R представляет собой низший (С 1-6) алкилен, замещенный функциональными группами, такими как карбоксильная группа или аминогруппа, которые обеспечивают связывание с другим молекулярным фрагментом. Например, спейсер может представлять собой остаток глицина (G) или аминогексановую кислоту. В предпочтительных способах реализации аминогексановая кислота представляет собой 6-аминогексановую кислоту (Ahx). Например, в случаях, когда 6-аминогексановая кислота (Ahx) связана с N-концом пептида, концевая аминогруппа пептида может быть связана с карбоксильной группой Ahx стандартной амидной связью. В другом примере, в случае, когда Ahx связана с С-концом пептида, амин Ahx может быть связан с концевой карбоксильной группой концевой аминокислоты обычной амидной связью. Структура пептида может быть изображена, как показано в формуле V. Обобщенное изображение показано в формуле VI. В других способах реализации спейсер представляет собой -NH-R-NH-, где R представляет собой низший (C1-6) алкилен, замещенный функциональной группой, такой как карбоксильная группа или аминогруппа, которая обеспечивает связывание с другим молекулярным фрагментом. Например, спейсер может представлять собой остаток лизина (K) или амида лизина (K-NH2, остаток лизина, в котором карбоксильная группа была трансформирована в амидный фрагмент -CONH2). В предпочтительных способах реализации спейсерный фрагмент имеет следующую структуру: где каждое из чисел , , , , иявляется целым, а их значения выбраны независимо. В предпочтительных способах реализации каждое из чисел , , иявляется целым, значение которого выбрано независимо из чисел от 1 до 6,равно 0 или 1,является целым числом, выбранным из чисел от 1 до примерно 10, за исключением тех случаев, когдабольше 1,равно 2, a Y выбирают из NH и СО. В особенно предпочтительных способах реализации каждое из чисел , , иравно 2, оба числаиравны 1, a Y представляет собой NH. Например, пептидный димер, содержащий такой спейсер, схематически изображен в формуле VII, где линкер представляет собой лизин, а спейсер соединяет линкер с защитной группой Boc. В другом особенно предпочтительном способе реализациииравны 0,ивместе равны 5, a Y обозначает СО. В особенно предпочтительных способах реализации линкер и спейсерный фрагмент имеют структуру, показанную в формуле VIII и формуле IX.-7 010099 Мономеры, димеры или мультимеры пептидов согласно данному изобретению могут дополнительно содержать один или более фрагментов водорастворимых полимеров. Предпочтительно эти полимеры ковалентно присоединены к пептидным соединениям согласно данному изобретению. Предпочтительно для терапевтического применения препарата конечного продукта полимер будет представлять собой фармацевтически приемлемый полимер. Специалист в данной области сможет выбрать желаемый полимер, учитывая, будут ли конъюгат полимер-пептид применять в терапевтических целях, и если да, то учитывая такие параметры, как желаемая дозировка, время циркуляции, устойчивость к протеолизу и другие. Водорастворимый полимер может представлять собой, например, полиэтиленгликоль (ПЭГ,PEG), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинил пирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры), поли(n-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры оксида полипропилена и оксида этилена и полиоксиэтилированные высокомолекулярные спирты. Предпочтительным водорастворимым полимером является ПЭГ. Полимеры могут иметь любую молекулярную массу, могут быть разветвленными или неразветвленными. Предпочтительные ПЭГ для использования в настоящем изобретении включают линейный,неразветвленный ПЭГ, имеющий молекулярную массу, превышающую 10 кДа, а более предпочтительно с молекулярной массой пределах примерно от 20 до 60 кДа, причем наиболее предпочтительная молекулярная масса - 20 кДа. Понятно, что обычно в отдельно взятом препарате ПЭГ молекулярные массы отдельных молекул будут различаться. Масса некоторых молекул будет больше, а некоторых меньше указанной молекулярной массы. Такие различия обычно отражают использованием слова "примерно" для описания молекулярных масс молекул ПЭГ. Число присоединенных молекул полимера может быть различным, например к пептиду-агонисту ЭПО-рецептора согласно данному изобретению могут быть присоединены 1, 2, 3 или более молекул водорастворимых полимеров. Множественные присоединенные полимеры могут представлять собой один и тот же или разные химические компоненты (например, полиэтиленгликоли разной молекулярной массы). Так, в одном из предпочтительных способов реализации данного изобретения рассмотрены пептиды-агонисты ЭПО-рецептора с присоединенными к ним двумя или более фрагментами ПЭГ. Предпочтительно оба фрагмента ПЭГ представляют собой линейный, неразветвленный ПЭГ, каждый из которых предпочтительно имеет молекулярную массу в диапазоне примерно от 10 до 60 кДа. Более предпочтительно каждый линейный неразветвленный фрагмент ПЭГ имеет молекулярную массу в диапазоне от 20 до 40 кДа, еще более предпочтительно в диапазоне между примерно 20 и 30 кДа, причем молекулярная масса 20 кДа для каждого неразветвленного полимера особенно предпочтительна. Однако другие молекулярные массы ПЭГ также предусмотрены в таких способах реализации. Например, данное изобретение предусматривает и включает пептиды-агонисты ЭПО-рецептора с двумя или более прикрепленными к ним фрагментами ПЭГ, по меньшей мере один из которых (или оба) имеет молекулярную массу примерно от 20 до 40 кДа или примерно от 20 до 30 кДа. В других способах реализации данное изобретение предусматривает и включает пептиды-агонисты ЭПО-рецептора с двумя или более прикрепленными к ним линейными неразветвленными фрагментами ПЭГ, по меньшей мере один из которых имеет молекулярную массу примерно от 20 до 60 кДа. В одном способе реализации ПЭГ может служить линкером, который связывает два пептидных мономера в димер. В одном способе реализации ПЭГ присоединен по меньшей мере к одному концу (Nконцу или С-концу) пептидного мономера или димера. В другом способе реализации ПЭГ присоединен к спейсерному фрагменту пептидного мономера или димера. В особенно предпочтительном способе реализации ПЭГ присоединен к спейсерному фрагменту, причем указанный спейсерный фрагмент присоединен к линкерному фрагменту LK, который соединяет мономеры пептидного димера. В предпочтительном способе реализации ПЭГ присоединен к линкерному фрагменту пептидного димера. В особенно предпочтительных способах реализации ПЭГ присоединен к спейсерному фрагменту, причем указанный спейсерный фрагмент соединяет мономеры пептидного димера. В особенно предпочтительных способах реализации ПЭГ присоединен к спейсерному фрагменту, а указанный спейсерный фрагмент присоединен к пептидному димеру через атом углерода карбонильной группы лизинового линкера или через атом азота амида лизин-амидного линкера (линкера на основе амида лизина). Предпочтительные димеры пептидов согласно настоящему изобретению включают, без ограничения, следующие. Другие пептиды согласно настоящему изобретению, включая пептидные мономеры, представляют собой следующие. Последовательности пептидов согласно настоящему изобретению могут присутствовать отдельно или в соединении N-концевыми и/или С-концевыми дополнительными участками цепи пептида ("удлиннениями"). Такие "удлиннения" могут представлять собой природные кодируемые последовательности пептидов выборочно с не встречающимися в природе последовательностями или практически без них."Удлиннения" могут содержать, по желанию специалиста в данной области, любые добавления, делеции,точечные мутации или другие модификации последовательности либо их комбинации. В качестве примера, но не ограничения, встречающиеся в природе последовательности могут представлять собой полноразмерные или укороченные последовательности, а также могут включать замены аминокислот, которые создают сайт присоединения углевода, ПЭГ, другого полимера и т.п. путем присоединения к боковым радикалам. В одном из вариантов замена аминокислоты приводит к гуманизации последовательности, что делает ее совместимой с иммунной системой человека. Предусмотрены все типы белков слияния, включая такие, в которых последовательности иммуноглобулина примыкают к последовательностям согласно настоящему изобретению, активирующим ЭПО-рецепторы, или расположены вблизи от них, с последовательностью неиммуноглобулинового спейсера или без нее. Один класс способов реализации представляет собой цепь иммуноглобулина, содержащую вместо вариабельной области тяжелой и/или легкой цепи последовательность, активирующую ЭПО-рецептор. Приготовление пептидных соединений согласно данному изобретению Синтез пептидов Пептиды согласно данному изобретению могут быть приготовлены классическими способами, из- 12010099 вестными в данной области. Эти стандартные способы включают синтез полностью в твердой фазе(твердофазный синтез), способы синтеза частично в твердой фазе, конденсации фрагментов, классический синтез в растворе и технологию рекомбинантных ДНК (см., например, Merrifield J. Am. Chem. Soc. 1963 85: 2149). В одном из способов реализации мономеры пептидов пептидного димера синтезируют отдельно,после чего подвергают димеризации. В предпочтительных способах реализации мономеры пептидов в димере имеют одну и ту же последовательность аминокислот. В особенно предпочтительных способах реализации мономеры пептидов в димере соединяют через С-концы с помощью линкерного фрагмента LK, имеющего две функциональные группы, которые могут служить сайтами инициации для синтеза пептидов, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая обеспечивает связывание с другим молекулярным фрагментом (который может, например, присутствовать на поверхности твердого носителя (подложки. В этом случае два мономера пептидов могут быть синтезированы непосредственно на двух химически активных азотных группах линкерного фрагмента LK (вариант методики твердофазного синтеза). Такой синтез может быть последовательным или одновременным (параллельным). В случае, когда предстоит провести последовательный синтез пептидных цепей димера на линкере,две функциональные аминогруппы защищают двумя разными ортогонально удаляемыми защитными группами для аминогрупп (аминзащищающими группами). В предпочтительных способах реализации защищенный диамин представляет собой защищенный лизин. Защищенный линкер связывают ("сшивают") с твердым носителем через третью функциональную группу линкера. Удаляют первую аминзащищающую группу и на первом лишенном защиты аминофрагменте синтезируют первый пептид димера. Затем удаляют вторую аминзащищающую группу и на втором лишенном защиты аминофрагменте синтезируют второй пептид димера. Например, первый аминофрагмент линкера может быть защищен группой Alloc (аллилоксикрбонил), а второй - группой Fmoc (9-флуоренилметилкарбоксил). В этом случае группу Fmoc (но не группу Alloc) можно удалить обработкой слабым основанием (например, 20% пиперидина в диметилформамиде (ДМФ, DMF и синтезировать первую пептидную цепь. После этого можно удалить группу Alloc подходящим реагентом (например, Pd(PPh3)/4-метилморфолином и хлороформом) и синтезировать вторую пептидную цепь. Эту методику можно использовать для получения димеров, в которых последовательности двух пептидных цепей являются идентичными или разными. Необходимо отметить, что в тех случаях, когда предстоит использовать тиолзащищающие группы для цистеина с целью контроля образования дисульфидных связей (как обсуждается ниже), необходимо применять эту методику, даже если последовательности аминокислот пептидных цепей димера идентичны. В случае, когда предстоит провести одновременный синтез пептидных цепей димера на линкере,две функциональные аминогруппы линкерной молекулы защищают одной удаляемой аминзащищающей группой. В предпочтительных способах реализации защищенный диамин представляет собой защищенный лизин. Защищенный линкер связывают ("сшивают") с твердым носителем через третью функциональную группу линкера. В этом случае две защищенные функциональные группы линкерной молекулы освобождают от защиты одновременно и на двух лишенных защиты аминах одновременно синтезируют две пептидные цепи. Необходимо отметить, что при использовании этой методики пептидные цепи будут идентичны, а все тиолзащищающие группы для остатков цистеина являются одинаковыми. Предпочтительным способом синтеза пептидов является твердофазный синтез. Процедуры синтеза пептидов в твердой фазе хорошо известны в данной области (см., например, Stewart Solid Phase Peptide(изд-во Houben-Weyl, Stuttgart (Штедгарт 2002). В твердофазном синтезе синтез обычно начинают с Сконца пептида, используя -аминозащищенную смолу. Подходящий исходный материал можно приготовить, например, путем присоединения требуемой -аминокислоты к хлорометилированной смоле, карбоксиметиловой смоле, полистиреновой смоле, бензгидриламиновой смоле и т.п. Одну из таких хлорометилированных смол продает компания Bio Rad Laboratories (Ричмонд, Калифорния, США) под торговой маркой BIO-BEADS SX-1. Препарат гидроксиметиловой смолы был описан Bodonszky, et al. (1966)Commun. 650, а гидрохлоридная форма доступна коммерчески (Beckman Instruments, Inc, Пало Альто,Калифорния, США). Например, -аминозащищенная аминокислота может быть связана с хлорометилированной смолой с помощью бикарбоната цезия (катализатор) согласно способу, описанному у Gisin(1973) Helv. Chim. Acta 56: 1467. После первоначального связывания -аминозащищающую группу удаляют, например, используя растворы трифторуксусной кислоты (ТФА, TFA) или соляной кислоты (HCl) в органических растворителях при комнатной температуре. После этого -аминозащищенные аминокислоты успешно связываются с растущей пептидной цепью, связанной с носителем. -Аминозащищающие группы представляют собой те группы, которые применяют в области поэтапного синтеза пептидов, включая защитные группы ацильного типа (например, формил, трифторацетил, ацетил), ароматические защитные группы уретано- 13010099 вого типа (например, бензилоксикарбоил (Cbz) и замещенный Cbz), алифатические уретановые защитные группы (например, t-бутилоксикарбонил (Boc), изопропилоксикарбонил, циклогексилоксикарбонил) и защитные группы алкильного типа (например, бензил, трифенилметил), флуоренилметилоксикарбонил(Fmoc), аллилоксикарбонил (Alloc) и 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde). Группы, защищающие боковые радикалы (обычно эфиры, сложные эфиры, тритил, РМС и т.п.), остаются неповрежденными в ходе связывания и не отщепляются в ходе удаления защиты N-концевых групп или в ходе связывания. Удаление групп, защищающих боковые радикалы, должно становиться возможным после завершения синтеза конечного пептида и при таких условиях реакции, которые не приведут к изменению целевого пептида. Группы, защищающие боковой радикал тироксина, включают тетрагидропиранил, трет-бутил, тритил, бензил, Cbz, Z-Br-Cbz и 2,5-дихлоробензил. Группы, защищающие боковой радикал аспарагина, включают бензил, 2,6-дихлоробензил, метил, этил и циклогексил. Группы, защищающие боковой радикал треонина и серина, включают ацетил, бензоил, тритил, тетрагидропиранил, бензил, 2,6-дихлоробензил и Cbz. Группы, защищающие боковой радикал аргинина, включают нитрогруппу, тозил (Tos), Cbz, адамантилоксикарбонил, мезитоилсульфонил (Mts), 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфнонил (Pbf), 4-метокси-2,3,6-триметилбензенсульфонил (Mtr) или Boc. Группы, защищающие боковой радикал лизина, включают Cbz, 2-хлоробензилоксикарбонил (2-Cl-Cbz),2-бромобензилоксикарбонил (2-Br-Cbz), Toc или Boc. После удаления -аминозащищающих групп остающиеся защищенными аминокислоты поэтапно связывают в желаемом порядке. Обычно проводят реакцию каждой защищенной аминокислоты в примерно 3-кратном избытке, используя подходящий активатор карбоксильной группы, такой как 2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафлуорофосфат (HBTU) или дициклогексилкарбодимид (DDC), растворенный, например, в хлориде метилена (CH2Cl2), N-метилпирролидоне, диметилформамиде (DMF) или их смесях. После завершения синтеза желательной последовательности аминокислот желательные пептиды отсоединяют от носителя (смолы) путем обработки реагентом, таким как трифторуксусная кислота (TFA) или фтороводород (HF), который не только отщепляет пептид от смолы, но и отщепляет все оставшиеся группы, защищающие боковые радикалы. В случае использования хлорметилированной смолы в результате обработки фтороводородом получают свободные кислоты пептида. В случае использования смолы,модифицированной бензгидриламином в результате обработки фтороводородом, получают непосредственно свободный амид пептида. В качестве альтернативы в случае применения хлорметилированной смолы пептид с защищенными боковыми радикалами может быть отсоединен путем обработки смолы, к которой присоединен пептид, аммиаком, что дает желаемый амид с защищенными боковыми радикалами, или алкиламином, что дает свободные алкиламид или диалкиламид с защищенными боковыми радикалами. Затем защиту боковых радикалов удаляют обычным способом путем обработки фтороводородом, что дает в результате амиды алкиламидов или диалкиламидов. При приготовлении сложных эфиров согласно данному изобретению применяют смолы, используемые для приготовления кислот пептидов, а пептиды с защищенными боковыми радикалами отщепляют основанием или соответствующим спиртом(например, метанолом). Затем группы, защищающие боковые радикалы, удаляют обычным способом путем обработки фтороводородом, в результате чего получают желаемый эфир. Эти процедуры можно также применять для синтеза пептидов, в которых произведены замены 20 встречающихся в природе генетически кодируемых аминокислот на другие аминокислоты в одной, двух или более позициях соединения согласно данному изобретению. Синтетические аминокислоты, которые могут быть введены путем замены в пептиды согласно настоящему изобретению, включают, без ограничения, N-метил, L-гидроксипропил, L-3,4-дигидроксифенилаланин, -аминокислоты, такие как Lгидроксилизил, Dметилаланинил, Lметилаланил, -аминокислоты и изоквинолил. Не встречающиеся в природе синтетические аминокислоты могут также быть введены в пептиды согласно настоящему изобретению. Модификация пептидов Также можно модифицировать амино- и/или карбоксильные концы пептидных соединений согласно настоящему изобретению для того, чтобы получить другие соединения согласно данному изобретению. Модификации аминоконца включают метилирование (например, -NHCH3 или -N(CH3)2), ацетилирование (например, уксусной кислотой или ее галогенпроизводными, такими как -хлоруксусная кислота, -бромуксусная кислота или -йодуксусная кислота), добавление бензилоксикарбонильной (Cbz) группы или блокирование N-конца блокирующей группой, содержащей карбоксилатную функциональную группу, обозначенную RCOO-, или сульфонильную функциональную группу, обозначенную R-SO2-,где R выбирают из алкильной, арильной, гетероарильной, алкил-арильной, а также подобных им и аналогичных групп. Также можно ввести дезаминокислоту в N-конец (таким образом на нем будет отсутствовать N-концевая аминогруппа), чтобы снизить чувствительность к протеазам или чтобы ограничить разнообразие конформаций пептидного соединения. В предпочтительных способах реализации N-конец подвергнут ацетилированию, в результате которого получают N-ацетилглицин (AcG). Модификации С-конца включают замену свободных аминокислот карбоксамидной группой или об- 14010099 разование циклического лактама на С-конце с целью введения структурных ограничений. Можно также подвергать пептиды согласно данному изобретению циклизации или вводить деамино- или декарбоксиостаток на концах пептида таким образом, чтобы на концах отсутствовала концевая амино- или карбоксильная группа, с целью снизить чувствительность к действию протеаз или чтобы ограничить разнообразие конформаций пептида. С-Концевые функциональные группы соединения согласно настоящему изобретению включают амиды, амиды низших алкилов, ди(низший алкил)амиды, низшие алкокси-, гидрокси- и карбоксигруппы, а также их производные с низшими эфирами и их фармацевтически приемлемые соли. Можно заменить встречающиеся в природе боковые радикалы 20 генетически кодируемых аминокислот (или стереоизомерических D-аминоксилот) другими боковыми радикалами, например такими группами, как алкильные группы, низшие алкилы, циклические 4-, 5- , 6- до 7-членные алкилы, амиды,низший алкил-амид-, низшие алкокси-, гидрокси-, карбоксигруппы и их производные с низшими эфирами, а также 4-, 5-, 6- до 7-членные гетероциклические группы. В частности, можно применять аналоги пролина, в которых размер кольца остатка пролина измененили с 5-членного на 4-, 6- или 7-членное. Циклические группы могут являться насыщенными или ненасыщенными, а ненасыщенные - ароматическими или неароматическими. Гетероциклические группы предпочтительно содержат следующие гетероатомы (один или более): азот, кислород и/или серу. Примеры таких групп включают фуразанил-, фуранил-, имидазолидил-, имидазолил-, имидазолил-, изотиазолил-, изоксазолил-, морфолинил- (например,морфолино-), оксазолил-, пиперазинил- (например, 1-пиперазниил-), пиперидил- (например, 1-пиперидил-, пиперидино-), пиранил-, пиразинил-, пиразолидил-, пиразонил-, пиразолинил-, пиридазинил-, пиридил-, пиримидинил-, пирролидинил- (например, 1-пирролидинил-), пирролинил-, пирролил-, тиадиазолил-, тиазолил-, тиенил-, тиоморфолинил- (например, тиоморфолино-) и триазолилгруппы. Эти гетероциклические группы могут являться замещенными или незамещенными. В случае замещенной группы заместитель может представлять собой алкил, алкоксигруппу, галоген, кислород либо замещенный или незамещенный фенил. Можно также без труда модифицировать пептиды путем фосфорилирования и другими способами(например, как описано в Hruby et al. (1990) Biochem. J. 268: 249-262). Пептидные соединения согласно данному изобретению могут также служить структурной моделью непептидных соединений со сходной биологической активностью. Специалисты в данной области осознают, что доступно множество методик, позволяющих конструировать соединения с биологической активностью, идентичной или аналогичной активности пептидного соединения-образца, но с более подходящей, чем у образца, активностью в отношении растворимости, стабильности и подверженности гидролизу и протеолизу (см. Morgan and Gainor (1989) Ann. Rep. Med. Chem. 24: 243-252). Эти методики включают замену пептидного остова остовом, составленным из фосфонатов, амидатов, карбаматов,сульфонамидов, вторичных аминов и N-метиламинокислот. Образование дисульфидных связей Соединения согласно настоящему изобретению могут содержать одну или более внутримолекулярных дисульфидных связей. В одном способе реализации пептидный мономер или димер содержит по меньшей мере одну внутримолекулярную дисульфидную связь. В предпочтительных способах реализации пептидный димер содержит две внутримолекулярные дисульфидные связи. Такие дисульфидные связи могут быть образованы при окислении остатков цистеина коровой последовательности пептида. В одном из способов реализации образование связей между остатками цистеина контролируют, выбирая тип и концентрацию окисляющего вещества таким образом, чтобы эффективно оптимизировать образование желательного изомера. Например, окисления пептидного димера с преимущественным (по сравнению с образованием межмолекулярных дисульфидных связей) образованием двух внутримолекулярных дисульфидных связей (по одной в каждой пептидной цепи) достигают,когда окисляющее вещество представляет ДМСО (DMSO). В предпочтительных способах реализации образование связей между остатками цистеина контролируют путем выборочного применения тиолзащищающих групп в ходе синтеза пептидов. Например,если желательно получить димер с двумя внутримолекулярными дисульфидными связями, цепь первого мономера пептида синтезируют с двумя остатками цистеина коровой последовательности, защищенными первой тиолзащищающей группой (например, тритильной (Trt), аллилоксикарбонильной (Alloc), 1-(4,4 диметил-2,6-диоксоциклогекс-1-илиден)этильной (Dde) и т.п.), затем синтезируют второй мономер пептида с двумя остатками цистеина в основной последовательности, защищенными второй тиолзащищающей группой, отличной от первой тиолзащищающей группы (например, ацетамидометильной (Acm), tбутильной (tBu) и т.п.). После этого первую тиолзазищающую группу удаляют, что вызывает бисульфидную циклизацию первого мономера, а затем удаляют вторую тиолзащищающую группу, что вызывает бисульфидную циклизацию второго мономера. В других способах реализации данного изобретения предусмотрены аналоги этих дисульфидных производных, в которых один из атомов серы был заменен на группу CH2 или другой изотер серы. Эти аналоги могут быть приготовлены из соединений согласно настоящему изобретению, в которых каждая основная последовательность содержит по меньшей мере один остаток С или гомоцистемина и -амино- 15010099-масляную кислоту вместо второго остатка цистеина, путем внутримолекулярного или межмолекулярного замещения, которое производят известными в данной области способами (см., например, Barker, etal. (1992) J. Med. Chem. 35: 2040-2048 и Or, et al. (1991) J. Org. Chem. 56: 3146-3149). Специалист в данной области легко поймет, что этого замещения может также добиться, используя другие гомологи аминомасляной кислоты и гомосерина. В дополнение к описанным выше стратегиям циклизации, можно применять другие стратегии циклизации пептидов, не связанные с образованием дисульфидных связей. Такие альтернативные стратегии циклизации включают, например, стратегии амидной циклизации наравне со стратегиями, связанными с образованием тиоэфирных связей. Таким образом, соединения согласно настоящему изобретению могут существовать в циклической форме либо с внутримолекулярной амидной связью, либо с внутримолекулярной тиоэфирной связью. Например, может быть синтезирован пептид, в котором один цистеин основной последовательности заменен на лизин, а второй цистеин заменен на глютаминовую кислоту. После этого циклический мономер может быть образован посредством образования амидной связи между боковыми радикалами этих двух остатков. В качестве альтернативы может быть синтезирован пептид, в котором один цистеин основной последовательности заменен на лизин. Затем циклический мономер может быть образован посредством образования тиоэфирной связи между боковыми радикалами остатка лизина и второго остатка цистеина основной последовательности. По существу, в дополнение к стратегиям дисульфидной циклизации для циклизации пептидов согласно настоящему изобретению, можно без труда применять как стратегию амидной циклизации, так и стратегию тиоэфирной циклизации. В качестве альтернативы к Nконцу пептида может быть присоединена -замещенная уксусная кислота ("кэппирование конца пептида"),где -замещенной уксусная кислота представляет собой отделяемую группу, такую как -галоуксусная кислота, например -хлороуксусная кислота, -бромоуксусная кислота или -йодоуксусная кислота. Добавление линкеров В тех способах реализации, где пептиды димера димеризуют при помощи линкерного LK фрагмента,указанный линкер может быть введен в пептид в ходе синтеза пептида. Например, если линкерный LK фрагмент содержит две функциональные группы, которые могут служить сайтами инициации для синтеза пептида, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая обеспечивает связывание с другим молекулярным фрагментом, линкер может быть конъюгирован с твердым носителем. После этого можно синтезировать два пептидных мономера непосредственно на двух химически активных группах азота линкерного LK фрагмента (вариант методики твердофазного синтеза). В альтернативных способах реализации, в которых димер димеризован при помощи линкерного LK фрагмента, указанный линкер может быть конъюгирован с двумя пептидными мономерами пептидного димера после синтеза пептидов. Такая конъюгация может быть достигнута способами, хорошо разработанными в данной области. В одном из способов реализации линкер содержит по меньшей мере две функциональные группы, подходящие для присоединения к функциональным группам-мишеням синтезированных пептидных мономеров. Например, может быть проведена реакция линкера с двумя свободными аминогруппами с С-концевыми карбоксильными группами каждого из двух пептидных мономеров. В другом примере может быть проведена реакция линкера, содержащего две карбоксильные группы, либо если эти группы предварительно активированы, либо в присутствии подходящего связывающего реагента, с аминогруппами N-конца или бокового радикала, либо С-концевыми амидами лизина каждого из двух пептидных мономеров. Добавление спейсера В тех способах реализации, где пептидные соединения содержат спейсерный фрагмент, указанный спейсер может быть введен в пептид в ходе синтеза пептида. Например, если спейсер содержит свободную аминогруппу и вторую функциональную группу (например, карбоксильную группу или аминогруппу), которая дает возможность связывания с другим молекулярным фрагментом, спейсер может быть конъюнгирован с твердым носителем. После этого пептид может быть синтезирован непосредственно на свободной аминогруппе спейсера по стандартным методикам твердофазного синтеза. В предпочтительном способе реализации спейсер, содержащий две функциональные группы, вначале связывают с твердым носителем через первую функциональную группу. Затем лизиновый линкерный LK фрагмент, имеющий две функциональные группы, которые могут служить сайтами инициации синтеза пептидов, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая обеспечивает связывание с другим молекулярным фрагментом, конъюгируют со спейсером через вторую функциональную группу спейсера и третью функциональную группу линкера. После этого можно синтезировать два пептидных мономера непосредственно на двух химически активных азотных группах лизинового линкерного LK фрагмента (вариант методики твердофазного синтеза). Например,можно провести реакцию связанного с твердым носителем спейсера со свободной аминогруппой с лизиновым линкером через свободную карбоксильную группу линкера. В альтернативных способах реализации, где пептидные соединения содержат спейсерный фрагмент, указанный спейсер может быть конъюгирован с пептидом после синтеза пептидов. Такая конъюгация может быть достигнута способами, хорошо разработанными в данной области. В одном из способов- 16010099 реализации спейсер содержит по меньшей мере одну функциональную группу, подходящую для присоединения к функциональной группе-мишени синтезированного пептида. Например, может быть проведена реакция спейсера со свободной аминогруппой с С-концевой карбоксильной группой пептида. В другом примере может быть проведена реакция спейсера со свободной карбоксильной группой со свободной аминогруппой N-конца пептида или остатка лизина. Еще в одном примере спейсер, содержащий свободную сульфгидрильную группу, может быть конъюгирован с остатком цистеина пептида путем окисления с целью образования дисульфидной связи. Присоединение водорастворимых полимеров В последние годы водорастворимые полимеры, такие как полиэтиленгликоль, применяют для ковалентной модификации диагностически и терапевтически важных пептидов. Считается, что присоединение таких полимеров увеличивает биологическую активность, продлевает время циркуляции в крови,снижает иммуногенность, увеличивает растворимость в воде и повышает устойчивость к расщеплению протеазами. Например, сообщалось, что ковалентное присоединение ПЭГ к терапевтическим пептидам,таким как интерлейкины (Knauf, et al. (1988) J. Biol. Chem. 263; 15064; Tsutsumi, et al. (1995) J. Controlled(1977) J. Biol. Chem. 252: 582), супероксид дисмутаза (Beauchamp, et al. (1983) Anal. Biochem. 131: 25) и аденозин деаминаза (Chen, et al. (1981) Biochim. Biophy. Acta 660: 293), увеличивает время их полужизниin vivo и/или снижает их иммуногенность и антигенность. Пептидные соединения согласно данному изобретению могут, кроме того, содержать один или более фрагментов водорастворимых полимеров. Предпочтительно эти полимеры ковалентно присоединены к пептидным соединениям. Водорастворимый полимер может представлять собой, например, полиэтиленгликоль (ПЭГ, PEG), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры), поли(n-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры оксида полипропилена и оксида этилена и полиоксиэтилированные высокомолекулярные спирты. Предпочтительным водорастворимым полимером является ПЭГ. Пептиды, димеры пептидов и другие молекулы на основе пептидов согласно данному изобретению могут быть присоединены к водорастворимым полимерам (например, ПЭГ) при помощи разнообразных химических составов, которые связывают водорастворимый полимер(ы) с рецепторсвязывающей частью молекулы (например, пептид+спейсер). В обычном способе реализации для ковалентного присоединения водорастворимого полимера(ов) к рецепторсвязывающей части задействовано единственное место (сайт) присоединения. Однако в альтернативных способах реализации можно применять связывание во множественных сайтах присоединения, включая дальнейшие варианты, в которых разные виды водорастворимых полимеров присоединяют к рецепторсвязывающей части в разных сайтах присоединения, которые могут включать сайты ковалентного присоединения (присоединений) к спейсеру и/или одной или обеим пептидным цепям. В некоторых способах реализации димер или более крупный мультимер будет содержать различные виды пептидных цепей (т.е. будет представлять собой гетеродимер или другой гетеромультимер). В качестве примера, но не ограничения, димер может содержать одну пептидную цепь,имеющую сайт присоединения ПЭГ, а у второй пептидной цепи может либо отсутствовать сайт присоединения ПЭГ, либо для присоединения может быть использована связь не такого, как в первой цепи, химического состава. В некоторых вариантах спейсер может содержать или не содержать сайт присоединения ПЭГ, а если к указанному присоединен ПЭГ, для присоединения может быть использована связь не такого, как в первой и/или второй пептидной цепи, химического состава. В альтернативном способе реализации используют ПЭГ, присоединенный к спейсерной части рецепторсвязывающей части, а другой водорастворимый полимер (например, углеводород) конъюгирован с боковым радикалом одной из аминокислот пептидной части молекулы. Для присоединения ПЭГ (ПЭГилирования) к рецепторсвязывающей части (пептиды+спейсер) может быть использовано множество разных видов полиэтиленгликоля (ПЭГ). Можно использовать практически любой подходящий химически активный реагент ПЭГ. В предпочтительных способах реализации применение химически активного реагента ПЭГ приведет к образованию карбаматной или амидной связи после конъюгирования с рецепторсвязывающей частью. Подходящие химически активные виды ПЭГ включают, без ограничения, коммерчески доступные реагенты, которые можно приобрести по каталогу Drug Delivery Systems (2003) корпорации NOF Corporation (Yebisu Garden Place Tower, 20-3 Ebisu 4chome, Shibuya-ku, Tokyo 150-6019) и каталогу Molecular Enginering 2003 компании Nectar Therapeutics(490 Discovery Drive, Huntsville, Alabama 35806). В качестве примера, но не ограничения, здесь приводятся следующие часто предпочитаемые в разных способах реализации реагенты ПЭГ: m-PEG2-NHS,mPEG2-ALD, multi-Arm PEG, mPEG(MAL)2, mPEG(MAL), m-PEG2-NH2, mPEG-SPA, mPEG-SBA,mPEG-thioesters (тиоэфиры), mPEG-Double Esters, mPEG-BTC, mPEG-ButyrALD, mPEG-ACET, гетерофункциональные ПЭГ (NH2-PEG-COOH, Boc-PEG-NHS, Fmoc-PEG-NHS, NHS-PEG-VS, NHS-PEG-MAL),акрилаты ПЭГ (ACRL-PEG-NHS), ПЕГ-фосфодилипиды (например, mPEG-DSPE), многолучевые ПЭГ серии SUNBRITE, включая серию GL глицериновых ПЭГ, активированных химическим составом, вы- 17010099 бранным специалистом, любой из активированных ПЭГ серии SUNBRITE (включая, без ограничения,карбоксил-ПЭГи, p-NP-PEGs, Tresyl-PEGs, альдегид ПЭГи, ацеталь-ПЭГи, амино-ПЭГи, тиол-ПЭГи,имид-малеиновые ПЭГи, гидроксил-ПЭГ-амин, амино-ПЭГ-СООН, гидроксил-ПЭГ-альдегид, ПЭГ карбоксильно-ангидридного типа, функционализированные фосфолипид-ПЭГ и другие аналогичные и/или подходящие химически активные ПЭГ, выбираемые специалистами в данной области для конкретного применения и использования. Полимер может иметь любую молекулярную массу, а также быть разветвленным или неразветвленным. Предпочтительный ПЭГ для использования в настоящем изобретении включает линейный неразветвленный ПЭГ, имеющий молекулярную массу от примерно 20 до примерно 40 кДа ("примерно" указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые меньше, чем указанные молекулярные массы). Наиболее предпочтительно ПЭГ имеет молекулярную массу примерно от 30 до 40 кДа. В зависимости от желаемого терапевтического профиля (например, желательная продолжительность отложенного высвобождения, воздействие, если оно есть, на биологическую активность, степень антигенности или ее отсутствие, а также другие известные воздействия ПЭГ на терапевтический пептид) могут быть использованы и другие размеры. Число присоединенных молекул полимера может быть различным, например к пептиду-агонисту ЭПО-рецептора согласно данному изобретению могут быть присоединены 1, 2, 3 или больше молекул водорастворимых полимеров. Множественные присоединенные полимеры могут представлять собой один и тот же или разные химические компоненты (например, полиэтиленгликоли разной молекулярной массы). В некоторых случаях на степень присоединения полимера (число фрагментов полимера, присоединенных к пептиду, и/или общее число пептидов, к которым присоединен полимер) могут оказывать влияние соотношение количества молекул полимера относительно молекул пептида в реакции присоединения ПЭГ, а также общая концентрация каждого из этих компонентов в реакционной смеси. Обычно оптимальное отношение полимера к пептиду (в терминах эффективности реакции для того, чтобы избежать избытка непрореагировавших пептидов и/или фрагментов полимера) будет определяться такими факторами, как желаемая "степень ПЭГилирования" (например, моно-, ди-, три- и т.д.), молекулярная масса выбранного полимера, является ли полимер разветвленным или неразветвленным и условия реакции для конкретного способа присоединения. В предпочтительных способах реализации ковалентно присоединяемый водорастворимый полимер представляет собой ПЭГ. В иллюстративных целях ниже описаны примеры способов ковалентного присоединения ПЭГ (ПЭГилирования). Эти иллюстративные описания не предназначены быть ограничивающими. Среднему специалисту в данной области будет понятно, что в данной области хорошо разработано множество различных способов присоединения разнообразных водорастворимых полимеров. По существу, настоящее изобретение охватывает пептидные соединения, к которым любым известным в данной области способом присоединения присоединено любое число водорастворимых полимеров. В одном из способов реализации ПЭГ может служить линкером, который объединяет два мономера пептидов в димер. В одном из способов реализации ПЭГ присоединен по меньшей мере к одному из концов (N-концу или С-концу) пептидного мономера или димера. В другом способе реализации ПЭГ присоединен к спейсерному фрагменту пептидного мономера или димера. В предпочтительном способе реализации ПЭГ присоединен к линкерному фрагменту пептидного димера. В особенно предпочтительном способе реализации ПЭГ присоединен к спейсерному фрагменту, где указанный спейсерный фрагмент присоединен к линкерному LK фрагменту, который соединяет мономеры пептидного димера. Наиболее предпочтительно ПЭГ присоединен к спейсерному фрагменту, где указанный спейсерный фрагмент присоединен к пептидному димеру через атом углерода карбонильной группы лизинового линкера или амидный атом азота линкера на основе амида лизина. Существует ряд доступных специалисту в данной области способов присоединения ПЭГ (см., например, Goodson, et al. (1990) Bio/Technology 8: 343 (пегилирование интерлейкина-2 в сайте гликозилирования после сайт-направленного мутагенеза); ЕР 0401384 (присоединение ПЭГ к Г-КСФ); Malik, et al.,(1992) Exp. Hematol. 20: 1028-1035 (пегилирование ГМ-КСФ при помощи трезилхлорида); публикация РСТ Pub. No. WO 90/12874 (пэгилирование эритропоэтина, содержащего введенный по рекомбинантной технологии остаток цистеина при помощи цистеин-специфической производной мПЭГ); патент СШАU.S. Pat. No. 5757078 (пэгилирование пептидов ЭПО) и патент США U.S. Pat. No. 6077939 (пэгилирование N-концевого -углерода пептида)]. Например, ПЭГ может быть ковалентно связан с остатками аминокислот через химически активную группу. Химически активными являются те группы, с которыми может быть связана активированная молекула ПЭГ (например, свободная аминогруппа или карбоксильная группа). Например, N-концевые остатки аминокислот и остатки лизина (K) имеют свободную аминогруппу, а С-концевые остатки аминокислот имеют свободную карбоксильную группу. В качестве химически активных групп для присоединения ПЭГ могут также быть использованы сульфгидрильные группы (например, такие, как в остатках цистеина). В дополнение были описаны способы введения активированных групп при помощи ферментов (например, гидразидных, альдегидных и ароматических аминогрупп), в частности, в С-конец полипептида (Schwarz, et al. (1990) Methods Enzymol. 184: 160; Rose, et al. (1991) Bioconjugate Chem. 2: 154;Gaertner, et al. (1994) J. Biol. Chem. 269: 7224). Например, молекулы ПЭГ могут быть присоединены к аминогруппам пептида при помощи метоксилированного ПЭГ (мПЭГ, mPEG), имеющего различные химически активные фрагменты. Такие полимеры включают мПЭГ-сукцинимидил сукцинат, мПЭГ-сукцинимидил карбонат, мПЭГ-имидат, мПЭГ-4 нитрофенил и хлорид мПЭГ-цианмочевой кислоты. Аналогично, молекулы ПЭГ могут быть присоединены к карбоксильным группам пептида при помощи метоксилированного ПЭГ со свободной аминогруппой (мПЭГ-NH2, mPEG-NH2). В тех случаях, когда присоединение ПЭГ является неспецифическим, но желательно получить пептид, содержащий специфическое присоединение ПЭГ, желаемое ПЭГилированное соединение может быть выделено из смеси ПЭГилированных соединений путем очистки. Например, если желательным является пептид, ПЭГилированный на N-конце, ПЭГилированная на N-конце форма может быть выделена путем очистки из популяции случайным образом ПЭГилированных пептидов (например, разделением этого фрагмента и других моно-ПЭГилированных фрагментов). В предпочтительных способах реализации присоединение ПЭГ к пептиду является сайт-специфическим. Было проведено сайт-специфическое пегилирование N-конца, бокового радикала и С-конца эффективного аналога релизинг-фактора гормона роста путем твердофазного синтеза (Felix, et al. (1995) Int.J. Peptide Protein Res. 46: 253). Другой сайт-специфический метод включает сайт-специфическое присоединение пептида к концам выступающих с поверхности липосомы цепей ПЭГ через химически активную альдегидную группу на N-конце, полученную окислением периодатом натрия N-концевого треонина(Zalipsky, et al. (1995) Bioconj. Chem. 6: 705). Однако применение этого метода ограничено полипептидами с N-концевыми остатками треонина или серина. Другой сайт-специфический способ присоединения ПЭГ к N-концу пептида при помощи связи через гидразон, восстановленный гидразон, оксим или восстановленный оксим описан в патенте США U.S. Pat. No. 6077939 (Wei, et al.). В одном из методов селективное N-концевое ПЭГилирование может быть выполнено путем восстановительного алкилирования, использующего различную химическую активность разных типов доступных для дериватизации первичных аминогрупп (лизина по сравнению с N-концевой) конкретного белка. В подходящих реакционных условиях содержащий карбонильную группу ПЭГ селективно присоединяется к N-концу пептида. Например, можно селективно ПЭГилировать пептид на N-конце путем проведения реакции при таком рН, который позволяет использовать разницу между pKa -аминогрупп остатков лизина и -аминогруппы N-концевого остатка пептида. Благодаря такому селективному присоединению ПЭГилирование происходит преимущественно на N-конце белка без существенного изменения других химически активных групп (например, аминогрупп бокового радикала лизина). При использовании восстановительного алкилирования нужно, чтобы ПЭГ содержал единственную химически активную альдегидную группу для связывания с белком (например, можно использовать ПЭГ пропиональдегид). Следующим подходом, который может быть использован для приготовления пептидов для сайтспецифического присоединения полимеров, является сайт-специфический мутагенез. Согласно этому методу последовательность аминокислот пептида конструируют таким образом, чтобы в нее в желаемом положении пептида была введена подходящая химически активная группа. Например, в WO 90/12874 описано сайт-специфическое ПЭГилирование белков, модифицированных путем вставки остатков цистеина или замены других остатков на остатки цистеина. В этой публикации также описано приготовление мПЭГ-эритропоэтина ("мПЭГ-ЭПО", "mPEG-EPO") путем проведения реакции цистеин-специфической производной мПЭГ с введенными рекомбинантными методами остатками цистеина ЭПО. В случае, когда фрагменты ПЭГ присоединяют к спейсерному фрагменту или линкерному фрагменту, могут быть использованы аналогичные способы присоединения. В этом случае линкер или спейсер содержит химически активную группу, а для того, чтобы вызвать ковалентное присоединение, используют активированную молекулу ПЭГ, содержащую подходящую комплементарную активную группу. В предпочтительных способах реализации химически активная группа линкера или спейсера содержит терминальную химически активную группу (т.е. расположенную на конце линкера или спейсера), которая реагирует с подходящим образом активированной молекулой ПЭГ, в результате чего образуется стабильная ковалентная связь, такая как амидная или карбаматная. Активированные подходящим образом виды ПЭГ включают, без ограничения, мПЭГ-паранитрофенилкарбонат (mPEG-NPC), мПЭГсукцинимидилсукцинат (mPEG-SS), мПЭГ-сукцинимидилкарбонат (мПЭГ-СК, mPEG-SC) и мПЭГсукцинимидилпропионат (mPEG-SPA). В других предпочтительных способах реализации химически активная группа линкера или спейсера содержит карбоксильную группу, которая может быть активирована для образования ковалентной связи с аминсодержащей молекулой ПЭГ при подходящих условиях реакции. Подходящие молекулы ПЭГ включают mPEG-NH2, а подходящие реакционные условия включают карбодиимид-опосредованное образование амидов или ему подобные. Способы анализа активности агонистов ЭПО-рецепторов Функциональные способы анализа in vitro В ходе анализов конкурентного связывания in vitro количественно определяют способность тестируемого пептида конкурировать с ЭПО за связывание с ЭПО-рецептором. Например (см., например, опи- 19010099 сание в патенте США U.S. Patent 5733569), внеклеточный домен ЭПО-рецептора человека (ЭПО-связывающий белок, ЭСБ) может быть получен по технологии рекомбинантных ДНК в клетках E. coli, а рекомбинантный белок связан с твердым носителем (подложкой), таким как микротитрационный планшет или синтетическая гранула (bead) (например, Sulfolink beads от Pierce Chemical Co. (Рокфорд, Иллинойс,США. Затем иммобилизованный ЭСБ инкубируют с меченым рекомбинантным ЭПО либо с меченым рекомбинантным ЭПО и тестируемым пептидом. В таких экспериментах применяют серийные разведения тестируемого пептида. По результатам анализа без добавления тестируемого пептида определяют полное связывание ЭРО с ЭСБ. Для реакций, в которых присутствует тестируемый пептид, определяют количество связанного ЭПО и выражают его в процентных долях от связывания контроля (полное связывание=100%). Строят график, на котором эти значения откладывают против концентрации пептида. Значение IC50 определяют как концентрацию тестируемого пептида, при которой связывание ЭПО с ЭСБ уменьшается на 50% (т.е. 50% ингибирование связывания ЭПО). В другом способе анализа конкурентного связывания in vitro измеряют световой сигнал, генерируемый как функция близости двух гранул: ЭПО-конъюгированной гранулы и ЭПО-рецептор-конъюгированной гранулы. Близость гранул порождается связыванием ЭПО и ЭПО-рецептора. Тестируемый пептид, который конкурирует с ЭПО за связывание с ЭПО-рецептором, будет препятствовать этому связыванию, вызывая уменьшение свечения. Концентрацию тестируемого пептида, при которой происходит ослабление свечения на 50%, определяют как значение IC50. Пептиды согласно настоящему изобретению очень эффективно конкурируют с ЭПО за связывание с ЭПО-рецепторами. Проявлением этой усиленной функции является их способность ингибировать связывание ЭПО в очень низких концентрациях (т.е. они обладают очень низкими значениями IC50). Биологическую активность и эффективность мономерных и димерных пептидов-агонистов ЭПО-рецептора согласно данному изобретению можно измерить, используя способы функционального анализа в клеточных системах. Один из способов анализа основан на применении линии предшественников В-клеток, экспрессирующих ЭПО-рецептор человека и трансфецированных конструкцией, содержащей репортерный ген люциферазы под контролем промотора fos. На воздействие ЭПО или другого агониста ЭПО-рецептора такие клетки отвечают синтезом люциферазы. При добавлении к своему субстрату, люциферину, люцифераза вызывает свечение. Следовательно, уровень активации ЭПО-рецепторов в таких клетках можно количественно определить, измеряя активность люциферазы. Активность тестируемого пептида измеряют путем добавления серийных разведений тестируемого пептида к клеткам, которые затем инкубируют в течение 4 ч. После инкубации к клеткам добавляют субстрат - люциферин - и измеряют интенсивность свечения. Концентрацию тестируемого пептида, при которой интенсивность свечения равна половине максимального значения, заносят в протокол как ЕС 50. Пептиды согласно настоящему изобретению демонстрируют в этом способе анализе существенно повышенную способность усиливать зависимую от передачи сигнала с ЭПО-рецептора экспрессию люциферазы. Проявлением этой усиленной функции является их способность давать интенсивность свечения, равную половине максимального значения, при существенно более низких концентрациях пептида(т.е. они обладают очень низкими значениями ЕС 50). Этот анализ является предпочтительным способом оценки эффективности и активности пептида-агониста ЭПО-рецептора согласно данному изобретению. Можно провести другой анализ, используя клетки линии FDC-P1-ER (Dexter, et al. (1980) J. Exp.Med. 152: 1036-1047), хорошо описанной нетрансформированной клеточной линии, полученной из костного мозга мыши, в которую был стабильно трансфецирован ЭПО-рецептор. Эти клетки демонстрируют ЭПО-зависимую пролиферацию. В одном из таких способов анализа клетки выращивают до получения половины стационарной плотности в присутствии необходимых факторов роста (см., например, описание в патенте США U.S.Patent 5773569). Затем клетки промывают ФБР и оставляют на 16-24 ч в полной среде без факторов роста(голодание). После определения жизнеспособности клеток (например, окрашиванием трипановым синим) готовят маточные (штоковые) растворы (в полной среде без факторов роста) с концентрацией примерно 10 клеток на 50 мкл. Готовят серийные разведения пептидных соединений-агонистов ЭПО-рецептора (обычно свободный пептид в фазе раствора, в отличие от фаг-связанного или иммобилизованного пептида), которые необходимо протестировать, в 96-луночном планшете для культур тканей; конечный объем разведений - 50 мкл в каждой лунке. В каждую лунку добавляют клетки (50 мкл), клетки инкубируют в течение 24-48 ч, после чего клетки в негативных контролях должны перейти в состояние покоя или прекратить деление. Затем измеряют клеточную пролиферацию, применяя хорошо известные в данной области методики, такие как тест с МТТ, в котором определяют включение Н 3-тимидина в качестве индикатора клеточной пролиферации (см. Mosmann (1983) J. Immunol. Methods 65: 33-63). Пептиды тестируют как на линии клеток, экспрессирующих ЭПО-рецептор, так и на родительской, неэкспрессирующей клеточной линии. Концентрацию тестируемого пептида, необходимую для того, чтобы получить половину максимальной клеточной пролиферации, вносят в протокол как EC50. Пептиды согласно настоящему изобретению демонстрируют существенно повышенную способность стимулировать клеточную пролиферацию. Проявлением этой усиленной функции является их спо- 20010099 собность давать половину максимальной пролиферации при существенно более низких концентрациях пептида (т.е. они обладают очень низкими значениями ЕС 50). Этот способ анализа является предпочтительным способом оценки эффективности и активности пептида-агониста ЭПО-рецептора согласно данному изобретению. В другом способе анализа клетки выращивают до стационарной фазы в среде, дополненной ЭПО,собирают, а затем культивируют в течение дополнительных 18 ч в среде без ЭПО. Клетки делят на три группы с равной плотностью клеток: одна группа без добавления фактора (отрицательный контроль),группа с ЭПО (положительный контроль) и экспериментальная крупа с тестируемым пептидом. Затем в разные моменты времени культивируемые клетки собирают, фиксируют и красят ДНК-связывающим флуоресцентным красителем (например, коммерчески доступными (Sigma) йодидом пропидия или красителем Hoechst). Затем измеряют флуоресценцию, например, на поточном сканирующем цитометреFACS. Процентное отношение клеток в каждой фазе клеточного цикла можно определить, например,используя модель SOBR программного пакета CallFit (Becton Dickinson). Клетки, обработанные ЭПО или активным пептидом, демонстрируют увеличенную по сравнению с группой отрицательного контроля долю клеток в фазе S (что определяется по повышенной флуоресценции (индикатор повышенного содержания ДНК. Аналогичные тесты могут быть проведены с использованием клеточных линий FDCP-1 (см., например., Dexter et al. (1980) J. Exp. Med. 152: 1036-1047) или TF-1 (Kitamura, et al. (1989) Blood 73: 375-380).FDCP-1 представляет собой линию зависимых от фактора роста мультипотентных примитивных гематопоэтических клеток-предшественников, способных к пролиферации, но не к дифференцировке, в среде,кондиционированной добавлением WEHI-3 (среда, которая содержит интерлейкин IL-3, коллекция АТСС номер TIB-68). Для таких экспериментов клетки линии FDCP-1 трансфецируют ЭПО-рецептором человека или мыши, в результате чего получают клеточные линии FDCP-1-hEPO-R или FDCP-1-mEPO-R,соответственно, способные к пролиферации, но не к дифференцировке, в присутствии ЭПО. TF-1-ЭПОзависимая клеточная линия может также быть использована для измерения воздействия пептидных агонистов ЭПО-рецептора на пролиферацию клеток. Еще в одном способе анализа для выяснения способности соединений согласно настоящему изобретению служить агонистами ЭПО может быть использована процедура, изложенная в Krystal (1983)Exp. Hematol. 11: 649-660 для микроанализа, основанного на включении Н 3-тимидина в клетки селезенки. Вкратце, мышам B6C3F1 вводят ежедневно в течение 2 дней путем инъекции фенилгидразин (60 мг/кг). На третий день берут клетки селезенки и путем анализа с МТТ выясняют их способность пролиферировать в течение 24 ч. Связывание ЭПО с ЭПО-рецептором в эритрорпоэтин-чувствительных клетках индуцирует фосфорилирование остатков тирозина как рецептора, так и многочисленных внутриклеточных белков, включая киназы She, vav и JAK2. Соответственно, в другом способе анализа in vitro измеряют способность пептидов согласно данному изобретению индуцировать фосфорилирование остатков тирозина ЭПО-рецептора и следующих за ним в цепочке передачи сигнала белков системы внутриклеточной сигнализации. Пептиды, идентифицированные как активные в ходе описанных выше тестов связывания и пролиферации,вызывают фосфорилирование остатков тирозина по схеме, практически идентичной схеме фосфорилирования остатков тирозина, вызываемого ЭПО в эритропоэтин-чувствительных клетках. Для этого анализа клетки FDC-P1/ER (Dexter, et al. (1980) J. Exp. Med. 152: 1036-47) выдерживают в среде, дополненной ЭПО, до тех пор, пока не будет достигнута стационарная фаза роста. Затем эти клетки культивируют в среде без ЭПО в течение 24 ч. Затем определенное число таких клеток инкубируют с тестируемым пептидом в течение приблизительно 10 мин при 37 С. В каждый анализ также включают контрольные пробы клеток с ЭПО. Затем обработанные клетки собирают путем центрифугирования, ресуспендируют в лизирующем буфере с SDS и подвергают электрофорезу в SDS-полиакриламидном геле. После электрофореза белки переносят на нитроцеллюлозу и визуализируют фосфортирозинсодержащие белки на блоте(фильтре) по стандартным иммунологическим методикам. Например, на блот можно нанести антитело против фосфотирозина (например, антифосфотирозиновый IgG мыши, Upstate Biotechnology, Inc.), промыть, а затем нанести второе антитело (например, меченный пероксидазой IgG козы против мышиных,KirkegaardPerry Laboratories, Inc. (Вашингтон, Колумбия, США. После этого фосфотирозинсодержащие белки можно визуализировать по стандартным методикам, включающим колориметрический,хемилюминесцентный и флуоресцентный способы анализа. Например, можно провести хемилюминесцентный анализ, используя систему ECL Western Blotting System (Amersham). Другим способом клеточного анализа in vitro, который можно использовать для оценки активности пептидов, является анализ колоний, в котором используют клетки костного мозга мыши или клетки периферической крови человека. Костный мозг мыши может быть получен из бедренных костей мышей, а периферическую кровь человека можно получить у здорового донора. В случае, когда используют периферическую кровь, вначале из крови выделяют мононуклеары путем, например, центрифугирования в градиенте фиколла Ficoll-Hypaque (Stem Cell Technologies, Inc. (Ванкувер, Канада. В этом способе анализа для того, чтобы определить число и концентрацию ядерных клеток в первоначальной пробе, проводят подсчет клеток. Определенное число клеток наносят на метилцеллюлозу согласно инструкциям про- 21010099 изводителя (Stem Cell Technologies, Inc. (Ванкувер, Канада. Экспериментальную группу клеток обрабатывают тестируемым пептидом, группу положительного контроля обрабатывают ЭПО, а группу отрицательного контроля не подвергают обработке. Затем после определенных периодов инкубации (обычно 10 и 18 дней) подсчитывают число растущих колоний для каждой группы. Активный пептид стимулирует образование колоний. Другие способы биологического анализа in vitro, которые можно использовать для демонстрации активности пептидов согласно настоящему изобретению, описаны в Greenberger, et al. (1983) Proc. Natl.Wojchowski (1991) J. Biol. Chem. 266: 609-614 (фосфорилирование остатков тирозина белков в клеткахB6SUt.EP), Dusanter-Fourt, et al. (1992) J. Biol. Chem. 287: 10670-10678 (фосфорилирование остатков тирозина ЭПО-рецептора в ЭПО-чувствительных клетках человека), Quelle, et al. (1992) J. Biol. Chem. 267: 17055-17060 (фосфорилирование остатков тирозина цитоплазматического белка, рр 100 в клетках FDCER), Worthington, et al. (1987) Exp. Hematol. 15: 85-92 (колориметрический анализ для гемоглобина),Kaiho and Miuno (1985) Anal. Biochem. 149: 117-120 (определение гемоглобина при помощи 2,7-диаминофлуорена), Patel, et al. (1992) J. Biol. Chem. 267: 21300-21302 (экспрессия c-myb), Witthuhn, et al. (1993)Cell 74: 227-236 (сборка и фосфорилирование остатков тирозина белка JAK2), Leonard, et al. (1993) Blood 82: 1071-1079 (Экспрессия факторов транскрипции GATA), Ando, et al. (1993) Proc. Natl. Acad. Sci. USA 90: 9571-9575 (регуляция перехода G1 путем циклизации D2 и D3). Недавно появились сообщения о том, что прибор, разработанный Molecular Devices Corp. и известный как микрофизиометр, успешно применяют для измерения воздействия агонистов и антагонистов на различные рецепторы. Основу действия этого аппарата составляет измерение изменений скорости закисления внеклеточной среды в ответ на активацию рецептора. Функциональные анализы in vivo Одним из способов функционального анализа in vivo, которые могут быть использованы для оценки эффективности тестируемого пептида, является биотест с использованием постгипоксийных полицетемических мышей. Для этого анализа мышей в течение нескольких дней подвергают циклу чередующихся тренировок. В этом цикле мыши попеременно проходят периоды гипобарических условий и условий с нормальным давлением окружающей среды. После этого мышей в течение 2-3 дней до введения тестируемых проб держат при нормальном давлении окружающей среды. Пробы тестируемых пептидов либо, в случае положительного контроля, стандарт ЭПО вводят кондиционированным (тренированным) мышам путем подкожной инъекции. Через 2 дня вводят радиомеченное железо (например, Fe59), а через 2 дня после введения радиомеченного железа берут пробы крови. Затем для каждой пробы крови определяют гематокрит и радиоактивность по стандартным методикам. Пробы крови мышей, которым путем инъекции были введены активные тестируемые пептиды, демонстрируют более высокую радиоактивность(вследствие связывания Fe59 гемоглобином эритроцитов), чем пробы крови мышей, не получавших тестируемые пептиды или ЭПО. Другим способом функционального анализа in vivo, который можно использовать для оценки эффективности тестируемых пептидов, является анализ ретикулоцитов. Для проведения этого анализа нормальным, не получающим никаких веществ мышам, в течение 3 дней (последовательно) вводят путем подкожной инъекции либо ЭПО, либо тестируемый пептид. На третий день мышам также вводят путем внутрибрюшинной инъекции декстран железо (Iron Dextran). На пятый день у мышей отбирают кровь. Определяют процент (%) ретикулоцитов в каждом образце крови путем окраски тиазоловым оранжевым и поточного цитометрического анализа (программа подсчета эритроцитов retic-count). Дополнительно,ручным способом определяют гематокрит. Уточненный процент ретикулоцитов определяют по следующей формуле:%РЕТИКУТОЧНЕННЫЙ=%РЕТИКНАБЛЮДАЕМЫЙ(гематокритИНДИВИДУАЛЬНЫЙ/гематокритНОРМАЛЬНЫЙ) Применение пептидов-агонистов ЭПО-рецептора согласно данному изобретению Пептидные соединения согласно данному изобретению полезны в качестве применяемых in vitro инструментов для понимания биологической роли ЭПО, включая исследование многих факторов, которые, как считают, влияют на продуцирование ЭПО и связывание ЭПО с ЭПО-рецептором и на которые влияет продуцирование ЭПО и связывание ЭПО с ЭПО-рецептором (например, механизм передачи сигналов с ЭПО/ЭПО-Р/активации рецепторов). Настоящие пептиды также могут быть полезны в разработке других соединений, которые связываются с ЭПО-рецептором, поскольку настоящие пептиды дают важную информацию об отношении структура-активность, которая облегчает эти разработки. Более того, благодаря своей способности связываться с ЭПО-рецептором пептиды согласно настоящему изобретению могут быть использованы в качестве реагентов для определения ЭПО-рецептора на живых клетках, фиксированных клетках, в биологических жидкостях, в гомогенатах тканей, в очищенных, природных биологических материалах и т.д. Например, снабжая такие пептиды меткой, можно идентифицировать клетки, имеющие на своих поверхностях ЭПО-рецептор. Дополнительно, благодаря их способности связывать ЭПО-рецептор пептиды согласно настоящему изобретению можно применять для окрашивания in situ, в методе FACS (активированной флуоресценцией сортировки клеток), Westernblotting, в твердофазном ИФА (твердофазный иммуноферментный анализ) и т.д. Дополнительно, благо- 22010099 даря их способности связываться с ЭПО-рецептором пептиды согласно настоящему изобретению можно применять для очистки рецепторов или очистки клеток, экспрессирующих ЭПО-рецептор на свою поверхность (или внутри клеток с нарушенной мембраной). Пептиды согласно данному изобретению можно также применять в качестве коммерческих реагентов для различных медицинских исследовательских и диагностических целей. Такие применения включают, без ограничения, (1) применение в качестве калибровочных стандартов для количественного определения активности предполагаемых агонистов ЭПО-рецепторов в различных функциональных анализах, (2) применение в качестве блокирующих реагентов в случайном скрининге пептидов (т.е. в поиске новых семейств пептидов-лигандов ЭПО-рецептора указанные пептиды можно применять для блокирования связывания пептидов согласно настоящему изобретению), (3) применение в сокристаллизации с ЭПО-рецептором, т.е. могут быть образованы кристаллы пептида согласно настоящему изобретению,связанного с ЭПО-рецептором, что делает возможным определение структуры рецептора/пептида путем рентгеноструктурного анализа, (4) применение для измерения способности клеток-предшественников эритроцитов индуцировать синтез глобина и синтез железосодержащих комплексов, а также увеличивать число рецепторов к ферритину путем инициации дифференцировки, (5) применение для поддержания пролиферации и роста ЭПО-зависимых клеточных линий, таких как EDCP-1-mEPO-R и TF-1, и (6) другие исследовательские и диагностические приложения, в которых ЭПО-рецептор предпочтительно является активированным, либо такая активация удобно откалибрована относительно известного количества агониста ЭПО-рецептора и т.п. Еще в одном аспекте настоящего изобретения предусмотрены способы лечения и изготовления лекарства. Пептидные соединения согласно данному изобретению можно вводить теплокровным животным, включая человека, с целью стимулировать связывание ЭПО с ЭПО-рецептором in vivo. Следовательно, настоящее изобретение охватывает способы терапевтического лечения нарушений, связанных с недостаточностью (дефицитом) ЭПО, каковые методы включают введение пептида согласно данному изобретению в количествах, достаточных, чтобы стимулировать ЭПО-рецепторы и, следовательно, облегчить симптомы, связанные с недостаточностью ЭПО in vivo. Например, пептиды согласно этому изобретению найдут применение в лечении почечной недостаточности и/или терминальной стадии нарушения функции почек/диализа, анемии на фоне СПИД, анемии, ассоциированной с хроническими воспалительными заболеваниями (например, ревматоидным артритом или хроническим воспалением кишечника) и аутоиммунным заболеванием, а также для стимуляции увеличения числа эритроцитов у пациента перед операцией. Другие болезненные состояния, нарушения и состояния гематологических нарушений включают бета-талассемию, кистозный фиброз (муковисцедоз), нарушения менструального цикла и беременности, анемии недоношенных детей, повреждения спинного мозга, космический полет, старение,разнообразные опухолевые заболевания, сопровождающиеся нарушенным эритропоэзом. В других способах реализации пептидные соединения согласно данному изобретению можно применять для лечения расстройств, которые не характеризуются низким или недостаточным (дефицитным) содержанием эритроцитов, например подготовка к переливанию крови. Дополнительно, введение соединений согласно этому изобретению может привести к уменьшению продолжительности кровотечения и,следовательно, найдет применение для введения пациентам перед хирургическими операциями или в случаях, когда можно ожидать, что произойдет кровотечение. Дополнительно, соединения согласно этому изобретению найдут применение в активации мегакариоцитов. Поскольку было показано, что ЭПО обладает митогенетическим и хемотаксическим воздействием на центральные холинэргические нейроны (см., например, Amagnostou, et al. (1990) Proc. Natl. Acad. Sci.USA 87: 5978-5982 и Konishi, et al. (1993) Brain Res. 609: 29-35), соединения согласно этому изобретению также найдут применение в лечении различных сосудистых нарушений, такое как стимуляция заживления ран, стимуляция роста коллатеральных кровеносных сосудов сердца (такое, как может иметь место после инфаркта миокарда), лечение травм и лечение после трансплантации сосудов. Соединения согласно этому изобретению также найдут применение в лечении различных неврологических расстройств,характеризующихся, в целом, низким абсолютным уровнем ацетилхолина или низкими относительными уровнями ацетилхолина по сравнению с другими нейроактивными веществами, например нейротрансмиттерами. Фармацевтические составы В другом аспекте настоящего изобретения предусмотрены фармацевтические составы вышеупомянутых соединений пептидов-агонистов ЭПО-рецепторов. Состояния, которые облегчает или корректирует введение таких составов, включают указанные выше. Такие фармацевтические составы могут предназначаться для перорального, парентерального (внутримышечного, внутрибрюшинного, внутривенного или подкожного), чрескожного (пассивного либо с применением ионофореза или электропорации) путей введения, введения через слизистые оболочки (назально, ректально, вагинально или сублингвально) либо с использованием биоразрушаемых вставок и могут быть приготовлены в виде лекарственных форм,подходящих для каждого из путей введения. В целом, данное изобретение охватывает фармацевтические составы, содержащие терапевтически эффективные количества пептида-агониста ЭПО-рецептора или производных продуктов согласно данному изобретению вместе с фармацевтически приемлемыми дилю- 23010099 ентами, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями. Такие составы включают дилюенты, содержащие различные буферные вещества (например, Трис-HCl, ацетат,фосфат), с различными значениями рН и ионной силы, добавки, такие как ПАВ и солюбилизирующие вещества (например, Tween 20, Tween 80, Polysorbate 80), антиоксиданты (например, аскорбиновая кислота, метабисульфат натрия), консерванты (например, Thimersol, бензиловый спирт) и наполнители (например, лактоза, маннитол); продукты слияния данного материала с конкретными препаратами полимерных соединений, таких как полимолочная кислота, полигликолевая кислота и т.д., или с липосомами. Также может быть использована гиалуроновая кислота. Такие составы могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo настоящих белков и производных. См., например, Remington's Pharmaceutical Sciences, 18th Ed. (1990, Mack Publishing Co.,Easton, PA 18042) p. 1435-1712, которая включена сюда путем ссылки. Составы могут быть приготовлены в жидкой форме или в форме высушенного порошка (например, лиофилизированного). Пероральная доставка Предусмотрено применение твердых лекарственных форм для перорального применения, которые описаны в Главе 89 Remington's Pharmaceutical Sciences, 18th Ed. 1990 (Mack Publishing Co. Easton PA 18042), которая включена сюда путем ссылки. Твердые лекарственные формы включают таблетки, капсулы, пилюли, троше или пастилки, саше, болюсы, порошки или гранулы. Также для приготовления лекарственных форм составов согласно данному изобретению может быть применено заключение в липосомальную или белковую капсулы (как, например, белковые микросферы, описанные в патенте СШАU.S. Patent No. 4925637). Может быть применено заключение в липосому, а липосомы могут быть модифицированы разнообразными полимерами (например, патент США U.S. Patent No. 5013556). Описание возможных твердых лекарственных форм для терапевтических веществ дано в Marshall, K.B. ModernPharmaceutics, изданной G.S. Banker and C.T. Rhodes, Глава 10, 1979, и включено в данное описание путем ссылки. В целом, рецептура будет включать пептиды-агонисты ЭПО-рецептора (или их химически модифицированные формы) и инертные ингредиенты, которые обеспечивают защиту от среды желудка и высвобождение биологически активного материала в кишечнике. Также предусмотрено применение жидких лекарственных форм для перорального введения, включая фармацевтически приемлемые эмульсии, растворы, суспензии и сиропы, которые могут содержать другие компоненты, включая инертные дилюенты, адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, подслащивающие вкусовые и ароматизирующие вещества. Пептиды могут быть химически модифицированы таким образом, что пероральная доставка производных становится эффективной. Обычно рассмотренная химическая модификация заключается в присоединении по крайней мере одного фрагмента молекулы самого компонента, где указанный компонент обеспечивает: (а) ингибирование протеолиза и (b) всасывание в кровоток из желудка или кишечника. Также желательно увеличить общую стабильность компонента или компонентов, а также увеличить время циркуляции в организме. Как обсуждалось выше, присоединение ПЭГ является предпочтительной химической модификацией для фармацевтического применения. Другие фрагменты, которые могут быть использованы, включают пропиленгликоль, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, спирт поливинилпирролидона, поливинилпирролидон, полипролин, поли-1,3 диоксолан и поли-1,3,6-тиоксокан (см., например, Abuchowski and Davis (1981) "Soluble Polymer-Enzymeand Newmark, et al. (1982) J. Appl. Biochem. 4: 185-189). В случае лекарственных форм для перорального введения местом высвобождения может быть желудок, тонкий кишечник (двенадцатиперстная кишка, тощая кишка и подвздошная кишка) или толстый кишечник. Специалистам в данной области доступны лекарственные формы, которые не растворяются в желудке, но высвободят материал в двенадцатиперстной кишке или каком-либо другом участке кишечника. Предпочтительно избегать отрицательного воздействия среды желудка на высвобождение либо путем защиты пептида (или производной), либо путем высвобождения пептида (или производной) вне среды желудка, например в тонком кишечнике. Для того, чтобы обеспечить устойчивость к среде желудка, необходима оболочка, не проницаемая для рН, равного по меньшей мере 5,0. Примерами наиболее обычных инертных ингредиентов, которые применяют в качестве растворяющихся в кишечнике оболочек, являются ацетат тримеллитат целлюлозы(CAT), фталат гидроксипропилметилцеллюлозы (НРМСР), НРМСР 50, НРМСР 55, поливинилацетата фталат (PVAP), Eudragit L30D, Aquateric, ацетат фталат целлюлозы (CAP), Eudragit L, Eudragit S иShellac. Эти оболочки можно применять в виде смешанных пленок. Для таблеток можно также применять покрытие или смесь покрытий, которые не предназначены для защиты от среды желудка. Эти покрытия могут включать сахарные оболочки или оболочки, которые облегчают проглатывание таблеток. Капсулы могут состоять из твердой оболочки (такой, как желатиновая), предназначенной для доставки сухих терапевтических веществ (т.е. порошка), для жидких форм можно применять мягкий желатин. Материал оболочки каше может представлять собой густой крахмал или другой съедобный материал (например, усваиваимый полимер глюкозы). Для пилюлей, пастилок, формовых таблеток или таблетированных порошков можно применять методики обработки влажной массы.- 24010099 Пептид (или производная) может быть включен в лекарственную форму в виде отдельных мелких частиц в форме гранул или шариков с размером частиц примерно 1 мм. Лекарственная форма материала для введения в капсуле может также представлять собой порошок, прессованную пластинку или даже таблетки. Эти терапевтические вещества могут быть приготовлены путем прессования. Также могут быть включены красители и/или вкусовые добавки. Например, можно изготовить (таким способом, как инкапсулирование в липосому или микросферу) лекарственную форму, содержащую пептид (или производную) и затем ввести ее в съедобный продукт, такой как охлажденный напиток, содержащий краситель и вкусовую добавку. Пептид (или производную) можно разбавить или увеличить его объем инертным материалом. Эти дилюенты (разбавители) могут включать углеводы, в особенности маннитол, -лактозу, безводную лактозу,целлюлозу, сахарозу, модифицированные декстраны и крахмал. Также в качестве наполнителей можно использовать некоторые неорганические соли, такие как трифосфат кальция, карбонат магния и хлорид натрия. Некоторые коммерчески доступные дилюенты: Fast-flo, Emdex, STA-Rx 1500, Emcompress иAvicell. В рецептуру терапевтического вещества в твердой лекарственной форме могут также быть включены дезинтегрирующие вещества. Материалы, используемые в качестве дезинтегрирующих веществ,включают, без ограничения, крахмал, включая коммерческое дезинтегрирующее вещество на основе крахмала, Explotab. Можно использовать крахмал глколят натрия, Amberlite, натрийкарбоксиметилцеллюлозу, ультрамилопектин, альгинат натрия, желатин, желатин, кожуру апельсина, кислую карбоксиметилцеллюлозу, природную губку и бентонит. Дезинтегрирующие вещества могут также представлять собой нерастворимые катионообменные смолы. В качестве дезинтегрирующих веществ можно также применять порошковые камеди, которые могут включать такие порошковые камеди, как агар, камедь карайи или трагакантовую камедь. Альгеновая кислота и ее натриевая соль также пригодны в качестве дезинтегрирующих веществ. Для того, чтобы связать пептидное (или производное) вещество для формирования прочной таблетки, можно применять связывающие вещества, которые включают натуральные материалы, такие как акация, трагакант, крахмал и желатин. Другие включают метилцеллюлозу (МЦ, МС), этилцеллюлозу (ЭЦ,ЕС) и карбоксиметилцеллюлозу (КМЦ, CMC). Для гранулирования пептида (или производной) можно применять поливинилпирролидон (ПВП, PVP) и карбоксиметилцеллюлозу (КМЦ, CMC) в спиртовых растворах. Для того, чтобы предотвратить слипание в ходе приготовления, в рецептуру пептида (или производной) могут быть включены антифрикционные вещества. Смазывающие вещества можно применять в виде прослойки между пептидом (или производной) и стенкой формы. Эти смазывающие вещества могут включать, без ограничения, стеариновую кислоту, включая ее магниевые и кальциевые соли, политетрафлюороэтилен (ПТФЕ), вазелиновое масло, масла и воска растительного происхождения. Можно также использовать растворимые смазывающие вещества, такие как лаурилсульфат натрия, лаурилсульфат магния, полиэтиленгликоль разных молекулярных масс, Carbowax 4000 и 6000. Скользящие вещества могут улучшить реологические (пластические) свойства лекарственного вещества в ходе приготовления, и их можно добавлять для того, чтобы облегчить преобразования в ходе прессования. Скользящие вещества могут включать крахмал, тальк, пирогенный кварц и гидратный силикоалюминат. Чтобы облегчить растворение пептида (или производной) в водной среде, можно добавить поверхностно-активное вещество в качестве смачивающего вещества. Поверхностно-активные вещества могут включать анионные детергенты, такие как лаурилсульфат натрия, сульфосукцинат диоктила натрия и сульфонат диоктила натрия. Можно использовать катионные детергенты, которые могут включать хлорид бензалкония или хлорид бензетомия. Список потенциальных неионных детергентов, которые могут быть включены в рецептуру в качестве поверхностно-активных веществ, составляют lauromacrogol 400,polyoxyl 40 stearate (полиоксил стеарат), polyoxyethylene castor oil 10, 50 и 60 (полиоксиэтиленовое касторовое масло), glycerol monostearate (моностеарат глицерина), polysorbate 20, 40, 60, 65 и 80, сложный эфир сахарозы и жирной кислоты, метилцеллюлоза и карбоксиметилцеллюлоза. Эти поверхностноактивные вещества могут присутствовать в рецептуре белка или производной либо самостоятельно, либо в разных соотношениях в составе смесей. Добавки, которые потенциально повышают всасывание пептида (или производной), представляют собой, например, жирные кислоты, олеиновую кислоту, линолевую кислоту и линоленовую кислоту. Может быть желательно получить лекарственные формы для перорального введения с отложенным высвобождением. Пептид (или производная) может быть связан с инертным матриксом (основой), который делает возможным высвобождение по механизму диффузии или выщелачивания. Такой матрикс может представлять собой, например, камедь. Также в лекарственную форму могут быть введены медленно разрушающиеся матриксы. Некоторые растворяющиеся в кишечнике оболочки обладают эффектом отложенного высвобождения. Другая форма контролируемого высвобождения представлена способом, основанным на терапевтической системе Oros (Alza Corp.), т.е. лекарственное вещество заключено в полупроницаемую мембрану, которая позволяет воде проникать внутрь и выталкивать лекарственное- 25010099 вещество наружу через единственное маленькое отверстие благодаря осмотическим эффектам. Для приготовления лекарственной формы могут быть использованы другие оболочки. Эти оболочки включают разнообразные сахара, которые могут быть нанесены на форму для изготовления оболочки. Пептид (или производную) также можно давать в виде покрытой пленкой таблетки, использованные в этом примере материалы разделены на две группы. К первой группе относятся "некишечные" материалы(т.е. материалы, которые растворяются не в кишечнике). Эта группа включает метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, метилгидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу натрия, повидон и полиэтиленгликоли. Вторая группа состоит из растворяющихся в кишечнике материалов, которые обычно представляют собой сложные эфиры фталевой кислоты. Для получения оптимального пленочного покрытия можно использовать смесь материалов. Нанесение пленочного покрытия может быть произведено в формовочном устройстве для нанесения покрытий либо в псевдоожиженном слое, либо путем напрессовывания покрытия. Парентеральная доставка Препараты согласно этому изобретению для парентерального введения включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или разбавителей являются пропиленгликоль, полиэтиленгликоль, масла растительного происхождения, такие как оливковое масло и кукурузное масло, желатин и сложные органические эфиры для инъекций, такие как этилолеат. Такие лекарственные формы могут также содержать адъюванты, такие как консервирующие,смачивающие, эмульгирующие и диспергирующие вещества. Препараты могут быть стерилизованы, например, путем фильтрации через бактериальный фильтр, путем введения в состав стерилизующих средств, путем облучения составов или путем нагревания составов. Они также могут быть изготовлены с применением стерильной воды или какой-либо другой стерильной среды для инъекций непосредственно перед использованием. Ректальная или вагинальная доставка Составы для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут содержать, в дополнение к активному веществу, наполнители, такие как масло какао или воск для суппозиториев. Составы для назального или сублингвального введения также готовят со стандартными наполнителями, хорошо известными в данной области. Пульмональное введение (через легкие) Здесь также рассмотрена пульмональная доставка пептидов-агонистов ЭПО-рецептора (или их производных). Пептид (или производная) доставляется в легкие млекопитающих при вдыхании и переходит через эпителиальную выстилку легкого в кровеносное русло (см., например Adjei, et al. (1990) PharmaceuticalDrug Delivery II Keystone, Colorado (рекомбинантный гормон роста человека); Debs et al., (1988) J. Immunol. 140: 3482-3488 (интерферон- и фактор некроза опухолей ), патент США U.S. Pat. No. 5284656 (Platz, etal.) (гранулоцит-колониестимулирующий фактор). Способ и состав для пульмональной доставки лекарственного вещества для системного действия описан в патенте США U.S. Pat. No. 5451659, Wong et al. Для применения в реализации этого изобретения предусмотрен широкий ряд механических приспособлений, сконструированных для пульмональной доставки терапевтических продуктов, включающий,без ограничения, небулайзеры, дозирующие ингаляторы и порошковые ингаляторы, каждый из которых хорошо известен специалистам в данной области. Некоторые конкретные примеры коммерчески доступных приспособлений, подходящих для реализации этого изобретения: небулайзер Ultravent (MallinckrodtInc., Сент-Луис, Колорадо, США), небулайзер AcornII (Marquest Medical Products, Инглевуд, Колорадо,США), дозирующий ингалятор Ventolin и порошковый ингалаятор Spinhaler (Fisons Corp., Бедфорд, Массачусетс, США). Все подобные приспособления требуют применения лекарственных форм, подходящих для дозирования пептида (или производной). Обычно каждая лекарственная форма специфична по отношению к типу используемого приспособления и может включать применение соответствующего пропеллента в дополнение к обычным дилюентам, адъювантам и/или носителям, применяемым в терапии. Также рассмотрено применение липосом, микрокапсул или микросфер, комплексов включений или других типов носителей. Химически модифицированные пептиды также можно приготовить в виде разных лекарственных форм, в зависимости от типа химической модификации или типа используемого приспособления. Также модифицированный пептид может быть приготовлен в разных лекарственных формах, в зависимости от типа химической модификации и применяемого устройства. Лекарственные формы, подходящие для применения с небулайзерами, струевыми или ультразвуковыми, обычно содержат пептид (или производную), растворенный в воде до концентрации примерно от 0,1 до 25 мг биологически активного белка на мл раствора. Лекарственная форма может также включать- 26010099 буфер и обычный сахар (например, для стабилизации белка и регуляции осмотического давления). Лекарственная форма для небулайзера может также содержать поверхностно-активное вещество для предотвращения агрегации пептида (или производной) на поверхности, вызванное атомизацией раствора при образовании аэрозоля. Лекарственная форма для применения в дозирующем ингаляторе будет, в общем случае, содержать тонкоизмельченный порошок, содержащий пептид (или производную), суспендированный в пропелленте при помощи поверхностно-активного вещества. Пропеллент может представлять любой обыкновенный материал, употребляемый обычно для этой цели, такой как хлорофлуороуглерод, гидрохлорофлуороуглерод, гидрофлуороуглерод или углеводород, включая трихлорфлуорометан, дихлорфлуорометан, дихлортетрафлуорометанол и 1,1,1,2-тетрафлюороэтан либо их комбинации. Подходящие поверхностно-активные вещества включают триолеат сорбита и лецитин сои. Также в качестве поверхностно-активного вещества можно применять олеиновую кислоту. Лекарственные формы для дозирования из порошкового ингалятора будут содержать тонкоизмельченный сухой порошок, содержащий пептид (или производную), и также могут включать наполнитель,такой как лактоза, сорбит, сахароза, маннитол, в количествах, которые облегчают распыление порошка из приспособления, например от 50 до 90% массы лекарственной формы. Наиболее предпочтительно приготовление пептида (или производной) в форме частиц со средним размером, меньшим, чем 10 мкм(или микрон), наиболее предпочтительно от 0,5 до 5 мкм, для наиболее эффективной доставки в нижние отделы легкого. Назальная доставка Также рассмотрена назальная доставка пептидов-агонистов ЭПО-рецептора (или их производных). Назальная доставка делает возможным переход пептида в кровеносное русло непосредственно после введения терапевтического продукта в нос без необходимости накопления этого продукта в легких. Лекарственные формы для назальной доставки включают формы, содержащие декстран или циклодекстран. Дозировки По мере проведения дальнейших исследований будет появляться информация относительно подходящих уровней дозировки для лечения различных состояний у различных пациентов, и работник обычной квалификации сможет, принимая во внимание терапевтический контекст, возраст и общее состояние здоровья пациента, определить подходящую дозу. Выбранные дозировки зависят от желаемого терапевтического эффекта, пути введения и желаемой продолжительности лечения. Обычно млекопитающим ежедневно вводят дозировки от 0,001 до 10 мг/кг массы тела. Обычно дозировки для внутривенных инъекций могут быть ниже. Режим дозирования можно варьировать в зависимости от полужизни циркуляции и используемой лекарственной формы. Пептиды согласно настоящему изобретению (или их производные) можно вводить совместно с одним или более дополнительных активных ингредиентов или фармацевтических составов. Примеры Далее настоящее изобретение описано посредством следующих примеров. Однако эти и другие примеры, встречающиеся в данной спецификации, приведены исключительно в иллюстративных целях и ни в коем случае не ограничивают объем и значение изобретения или какой-либо иллюстративной формы. Аналогично, данное изобретение не ограничивается каким-либо из описанных здесь конкретных предпочтительных способов реализации. Действительно, после прочтения данной спецификации для специалиста в данной области станут очевидны многочисленные модификации и варианты данного изобретения, которые могут быть сделаны без отступления от идеи и объема изобретения. Следовательно,данное изобретение ограничено только приложенной формулой вместе с полным объемом эквивалентов,на которые данная формула предоставляет право. Пример 1. Синтез пептидных димеров-агонистов ЭПО-рецептора. 1. Синтез мономерного пептида. Разнообразные пептидные мономеры согласно данному изобретению были синтезированы с использованием методики твердофазного синтеза Мерифилда (Merrifield) (см. Stewart, Young. Solid PhasePeptide Synthesis, 2nd edition (Pierce Chemical, Rockford, IL) 1984) на автоматическом приборе AppliedBiosystems 433 А. Использовали смолу PAL (Milligen/Biosearch), которая представляет собой поперечносшитый полистерен с 5-(4'-Fmoc-аминометил-3,5'-диметоксифенокси)валериановой кислотой. При использовании PAL после отщепления пептида от смолы получают функциональную амидную группу на карбоксильном конце. Первичную защиту амина на аминокислотах производили группой Fmoc, а защитными группами для боковых радикалов были t-бутильная для гидроксилов серина, треонина и тирозина,тритильная для амидов аспарагина и глутамина, Trt и Acm для цистеина и Pcm (2,3,5,7,8-пентаметилхромансульфонат) для гуанидиногруппы аргинина. Каждое связывание проводили в течение 1 или 2 ч в ВОР присутствии (гексафлюорофосфат бензотриазолил N-окстрисдиметиламинофосфония) и HOBt (1-гидроксибензтриазол). Для синтеза пептидов с амидированным карбоксильным концом полностью собранный пептид отщепляли смесью 90% трифторуксусной кислоты, 5% этандитиола и 5% воды первоначально при 4 С,постепенно повышая температуру до комнатной в течение 1,5 ч. Лишенный защиты продукт отфильтро- 27010099 вывали от смолы и осаждали диэтилэфиром. После тщательного высушивания продукт очищали путем обращенно-фазной высокоэффективной жидкостной хроматографии на колонке С 18 с градиентом смеси ацетонитрил/вода в 0,1% трифтроуксусной кислоты (трфторацетата, TFA). 2. Синтез пептидного димера. Разнообразные пептидные димеры согласно данному изобретению синтезировали непосредственно на лизиновом линкере (вариант твердофазного синтеза). Для одновременного синтеза двух пептидных цепей Fmoc-Lys-Fmoc связывали со смолой PAL(Milligen/Biosearch), обеспечивая тем самым исходный остаток лизина, который послужит линкером между двумя синтезированными цепями. Защитные группы Fmoc удаляли мягким основанием (20% пиперидин в диметилформамиде (DMF, а пептидные цепи синтезировали, используя освободившиеся в результате аминогруппы в качестве исходных точек синтеза. Синтез пептидных цепей проводили, используя описанную выше методику твердофазного синтеза. Для защиты всех остатков цистеина использовали группу Trt. После снятия защиты с димера отщепления от смолы и очистки проводили окисление остатков цистеина путем инкубирования лишенного защиты димера в 100% ДМСО в течение 2-3 дней при температуре от 5 до 25 С. Эта реакция окисления давала преимущественно (75%) димеры с двумя внутримолекулярными дисульфидными связями. Для опоследовательного синтеза двух пептидных цепей Fmoc-Lys-Alloc связывали со смолой PAL(Milligen/Biosearch), обеспечивая тем самым исходный остаток лизина, который послужит линкером между двумя синтезированными цепями. Защитную группу Fmoc удаляли мягким основанием (20% пиперидин в диметилформамиде). Первую пептидную цепь синтезировали, используя в качестве исходной точки образовавшуюся в результате свободную аминогруппу. Синтез пептида осуществляли, используя описанную выше методику твердофазного синтеза. Два остатка цистеина первой цепи защищали группойTrt. За синтезом первой пептидной цепи следовало удаление группы Alloc со связанного с носителем лизинового линкера Pd[P(C6H5)3]4 4-метилморфолином и хлороформом. Затем синтезировали вторую пептидную цепь на второй свободной аминогруппе. Два остатка цистеина второй цепи защищали группой Acm. Внутримолекулярную дисульфидную связь в первой пептидной цепи образовывали путем удаления защитной группы Trt трифторуксусной кислотой с последующим окислением путем перемешивания в 20% ДМСО в течение ночи. Затем образовывали внутримолекулярную дисульфидную связь во второй пептидной цепи путем одновременного удаления защитных групп Acm и окисления лишенных защиты остатков цистеина с использованием йода, метанола и трифторацетата талия. 3. Присоединение спейсеров. В случае, когда спейсер представлял собой аминокислоту (например, глицин или лизин, как в соединениях AF35462 и AF35464, соответственно), спейсер вводили в пептид в ходе твердофазного синтеза пептида. В этом случае спейсерную аминокислоту связывали со смолой PAL, а ее свободная аминогруппа служила основой для присоединения другой спейсерной аминокислоты или лизинового линкера. За присоединением лизинового линкера следовал синтез димерных пептидов (как описано выше). 4. Синтез образцов пептидных димеров. Схема примеров способов реализации этого синтеза описана ниже. В одном примере описан синтез пептидного димера, связанного через С-концевой амид лизина. В другом примере описан синтез пептидного димера, связанного через С-концевой лизин и содержащего спейсерную молекулу, присоединенную к связывающему лизину. Синтез пептидного димера, связанного через остаток амида лизина на С-конце Этап 1. Образование TentaGel-Rink-Lys. Смолу TentaGel-Rink (0,18 ммоль/г (Rapp Polymere, Германия обрабатывали активированным раствором Fmoc-Lys(Fmoc)-OH (приготовленном из 5 экв. аминокислоты и 5 экв. HATU (реагент для связывания белков), растворенного в концентрации 0,5 М в DMF, с последующим добавлением 10 экв. DIEA) и оставляли при слабом встряхивании на 14 ч. Смолу промывали (DMF, THF, DCM, МеОН) и высушивали. В результате получали защищенную смолу. Остаточные аминогруппы кэппировали путем обработки смолы раствором 10% уксусного ангидрида, 20% пиридина в DCM в течение 20 мин с последующей промывкой (как описано выше). Группы Fmoc удаляли путем мягкого встряхивания смолы в 30% пиперидине в DMF в течение 20 мин, за которым следовали промывка (DMF, THF, DCM, МеОН) и высушивание. Этап 2. Образование TentaGel-Rink-Lys (пептид)2. Смолу, полученную на этапе 1, подвергали повторяющимся циклам присоединения Fmoc-амино- 28010099 кислоты с активацией HBTU/HOBt и удаления групп Fmoc пиперидином для одновременного построения обеих пептидных цепей. Эту процедуру с легкостью выполняли на автоматическом синтезаторе пептидов ABI 433 (Applied Biosystems, Inc). После последнего удаления групп Fmoc терминальные аминогруппы ацетилировали уксусным ангидридом (10 экв.) и DIEA (20 экв.) в DMF в течение 20 мин, после чего следовала промывка (как описано выше). Этап 3. Отщепление от смолы. Смолу, полученную, как описано выше, суспендировали в растворе TFA (82,5%), фенола (5%),этандитиола (2,5%) и тиоанизола (5%) в течение 3 ч при комнатной температуре. Можно также использовать альтернативные отщепляющие смеси, такие как TFA (95%), вода (2,5%) и триизопропилсилан(2,5%). Раствор TFA охлаждали до 5 С и вливали в Et2O для того, чтобы осадить пептид. После фильтрации и высушивания при пониженном давлении получали желаемый пептид. Очистка путем препаративной ВЭЖХ (HPLC) на колонке С 18 дает чистый пептид. Синтез пептидного димера, связанного через остаток амида лизина на С-конце и содержащего спейсерную молекулу Этап 1. Синтез Cbz-TAP. Раствор, содержащий коммерчески доступный диамин ("ТАР", Aldrich Chemical Co.) (10 г, 67,47 ммоль) в безводном дихлорметане (DCM, 100 мл), охлаждали до 0 С. Раствор бензилхлороформата (4,82 мл, 33,7 ммоль) в безводном дихлорметане (DCM) (50 мл) медленно добавляли при помощи капельной воронки в течение 6-7 ч, поддерживая температуру реакционной смеси 0 С на протяжении всего времени, а затем давали нагреться до комнатной температуры (25 С). После еще 16 ч DCM удаляли под вакуумом, а остаток разделялся между 3-нормальной HCl и эфиром. Водные фазы собирали и нейтрализовали 50% вод. NaOH до значения рН 8-9 и экстрагировали этил ацетатом. Фазу этил ацетата высушивали над безводнойNa2SO4, а затем концентрировали под вакуумом, в результате чего получали неочищенный моно-CbzTAP (5 г, выход примерно 50%). Это соединение использовали в следующей реакции без какой-либо дальнейшей очистки. Этап 2. Синтез Cbz-TAP-Boc. К тщательно перемешанной суспензии Cbz-ТАР (5 г, 17,7 ммоль) в гексане (25 мл) добавляли Вос 2 О(3,86 г, 17,7 ммоль) и продолжали перемешивание при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (25 мл) и промывали 10% вод. лимонной кислоты (2 Х), водой (2 Х) и концентрированным раствором NaCl. Органический слой высушивали над безводной Na2SO4 и концентрировали под вакуумом. Неочищенный продукт (выход 5 г) непосредственно использовали в следующей реакции.- 29010099 Этап 3. Синтез Boc-TAP. Неочищенный продукт предыдущей реакции растворяли в метаноле (25 мл) и гидрогенизировали в присутствии 5 мас.% катализатора "палладий на угле" под баллонным давлением в течение 16 ч. Смесь фильтровали, промывали метанолом и концентрировали фильтрат in vacuo, в результате чего получали продукт Н-ТАР-Вос (выход 3,7 г). Общий выход Вос-ТАР после этапов 1-3 составил приблизительно 44% (в расчете относительно использованного количества Cbz-Cl). Этап 4. Синтез TentaGel-линкера. Гранулированный твердый носитель (подложку) TentaGel bromide (2,5 г, 0,48 ммоль/г, Rapp Polymere,Германия), фенольный линкер (5 экв.) и K2CO3 (5 экв.) нагревали в 20 мл DMF (диметилформамид) до 70 С в течение 14 ч. После охлаждения до комнатной температуры смолу промывали (0,1-нормальная HCl,вода, ACN (ацетонитрил), DMF, МеОН) и высушивали, в результате чего получали смолу цвета янтаря. Этап 5. Синтез TentaGel-линкер-TAP(Boc). Брали 2,5 г смолы, полученной, как описано выше, Н-ТАР-Вос (1,5 г, 5 экв.) и кристаллической уксусной кислоты (34 мкл, 5 экв.) в смеси 1:1 с MeOH-THF и встряхивали в течение 7 ч. К этой смеси добавляли 1 М раствор цианоборогидрида натрия (5 экв.) в THF (тетрагидрофуран) и встряхивали в течение еще 7 ч. Смолу фильтровали, промывали (DMF, THF, 0,1-нормальная HCl, вода, МеОН) и высушивали. Небольшое количество смолы бензоилировали хлоридом бензола (Bz-Cl) и диизопропилэтиламином(DIEA) в дихлорметане (DCM), и расщепляли 70% TFA-DCM (трифтароуксусная кислота-дихлорметан),и проверяли путем жидкостной хроматомасс-спектрометрии (LCMS) и высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC). Этап 6. Синтез TentaGel-линкер-TAP-Lys. Смолу, полученную, как описано выше, обрабатывали активированным раствором FmocLys(Fmoc)-OH (приготовленного из 5 экв. аминокислоты и 5 экв. HATU (реагент для связывания белков),растворенного в концентрации 0,5 М в DMF, с последующим добавлением 10 экв. DIEA) и оставляли при слабом встряхивании на 14 ч. Смолу промывали (DMF, THF, DCM, МеОН) и высушивали. В результате получали защищенную смолу. Остаточные аминогруппы кэппировали путем обработки смолы раствором 10% уксусного ангидрида, 20% пиридина в DCM в течение 20 мин с последующей промывкой (как описано выше). Группы Fmoc удаляли путем мягкого встряхивания смолы в 30% пиперидина в DMF в течение 20 мин, за которым следовали промывка (DMF, THF, DCM, МеОН) и высушивание. Этап 7. Синтез TentaGel-линкер-TAP-Lys(пептид)2. Смолу, полученную, как описано выше, подвергали повторяющимся циклам присоединения Fmocаминокислоты с активацией HBTU/HOBt и удаления групп Fmoc пиперидином для одновременного построения обеих пептидных цепей. Эту процедуру с легкостью выполняли на автоматическом синтезаторе пептидов ABI 433 (Applied Biosystems, Inc.). После последнего удаления групп Fmoc терминальные аминогруппы ацетилировали уксусным ангидридом (10 экв.) и DIEA (20 экв.) в DMF в течение 20 мин, после
МПК / Метки
МПК: A61K 38/18, A61P 7/06, C07K 14/505
Метки: рецептором, применения, которые, эритропоэтину, способы, связываются, пептиды
Код ссылки
<a href="https://eas.patents.su/30-10099-peptidy-kotorye-svyazyvayutsya-s-receptorom-k-eritropoetinu-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды, которые связываются с рецептором к эритропоэтину, и способы их применения</a>
Предыдущий патент: Неперевариваемые in vivo пептиды, имеющие активность ингибитора ангиотензинпревращающего фермента, лекарственное средство и пищевой продукт
Следующий патент: Способ получения (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила и его производных
Случайный патент: Транспортное средство, приводимое в действие мускульной силой водителя