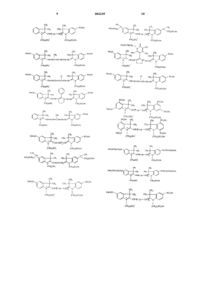
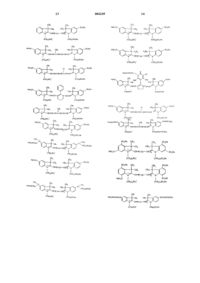
Флуоресцентный контрастный агент для ближней инфракрасной области спектра и способ флуоресцентной визуализации
Номер патента: 4249
Опубликовано: 26.02.2004
Авторы: Харада Тору, Окумура Масафуми, Мива Наото, Эгучи Хироаки, Инагаки Мичихито, Инагаки Йошио
Формула / Реферат
1. Натриевая соль соединения формулы [III-1]

содержащего в молекуле три или более групп сульфоновой кислоты, где L1-L7 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный метин, a L4 обозначает метин, замещенный алкилом, содержащим от 1 до 4 атомов углерода, R19 и R20 обозначают (низш.)алкил, имеющий 1-5 атомов углерода и замещенный группой сульфоновой кислоты, R21-R28 имеют одинаковые или различные значения и каждый обозначает атом водорода, группу сульфоновой кислоты, карбоксильную группу, гидроксильную группу, алкил(сульфоалкил)аминогруппу, бис(сульфоалкил)аминогруппу, сульфоалкоксигруппу, (сульфоалкил)сульфонильную группу или (сульфоалкил)аминосульфонильную группу и X' и Y' имеют одинаковые или различные значения и каждый обозначает группу формулы
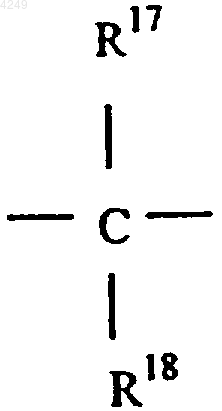
где R17 и R18 обозначают незамещенный низший алкил, содержащий от 1 до 5 атомов углерода.
2. Натриевая соль по п.1 формулы
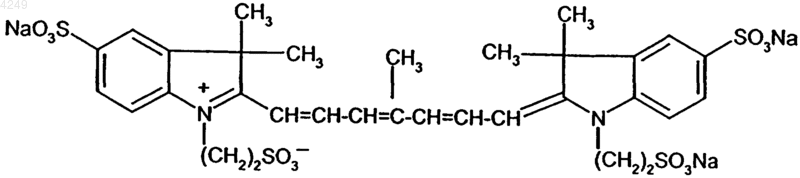
3. Флуоресцентный контрастный агент для ближней инфракрасной области спектра, содержащий натриевую соль по любому из пп.1-2.
4. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по п.3, предназначенный для визуализации опухоли.
5. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по п.3, предназначенный для ангиографии.
6. Натриевая соль по п.1, представляющая собой по крайней мере одно соединение, выбранное из группы, включающей соединения следующих формул:
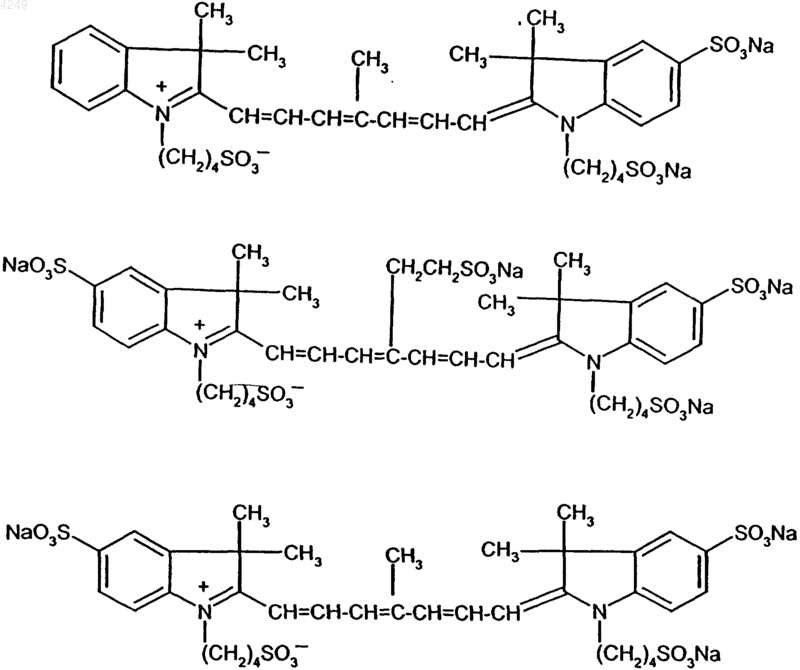
Текст
1 Область техники изобретения Настоящее изобретение относится к флуоресцентному контрастному агенту для ближней(длинноволновой) инфракрасной области спектра и способу флуоресцентной визуализации с использованием этого контрастного агента. При лечении болезней очень важно выявлять на ранних стадиях болезни морфологические и функциональные изменения в живом организме, вызываемые болезнью. При лечении рака особенно важными определяющими факторами для планирования эффективного лечения являются место расположения и размер опухоли. Известные методы, предназначенные для этой цели, включают биопсию с использованием пункции и т.п. и диагностику с использованием методов визуализации, таких как визуализация с помощью рентгеновских лучей,визуализация с помощью магнитного резонанса(MRI), визуализация с помощью ультразвука и т.п. Биопсия очень эффективна для установления диагноза, однако, в то же время она причиняет большие неудобства для обследуемого пациента и не пригодна для отслеживания происходящих с течением времени изменений в областях повреждений. Визуализация с помощью рентгеновских лучей и MRI неизбежно связаны с подверганием обследуемых пациентов действию облучения и магнитных волн. Кроме того,указанные выше общепринятые методы диагностики с использованием визуализации являются очень сложными и требуют длительного времени для проведения измерений и диагностики. Используемая для этой цели громоздкая аппаратура также затрудняет применение этих методов в процессе операции. Один из методов диагностики с помощью визуализации основан на использовании флуоресцентной визуализации (Lipson R.L. и др., J.Natl. Cancer Inst., 26, 1-11 (1961. В этом методе используется в качестве контрастного агента вещество, которое испускает флуоресценцию при освещении возбуждающими лучами света с определенной длиной волны. Таким образом,организм снаружи облучают возбуждающим светом и регистрируют флуоресценцию, испускаемую флуоресцентным контрастным агентом,находящимся внутри организма. Таким флуоресцентным контрастным агентом может быть, например, порфириновое соединение, которое накапливается в опухоли и применяется для фотодинамической терапии(ФДТ), такое как гематопорфирин. В качестве других примеров можно указать фотофрин и бензопорфирин (см. Lipson R.L. и др., выше,Meng T.S. и др., SPIE, 1641, 90-98 (1992), WO 84/04665 и т.п.). Эти соединения первоначально использовались для ФДТ, и они обладают фототоксичностью, поскольку она требуется для ФДТ. По этой причине эти соединения нежелательно использовать в качестве диагностических агентов. 2 Между тем, известен метод микроангиографии кровеносных сосудов сетчатки с использованием известного флуоресцентного красителя, такого как флуоресцеин, флуорескамин и рибофлавин (US 4945239). Эти флуоресцентные красители испускают флуоресценцию в видимой области светового спектра (400-600 нм). В этой области прохождение света через живую ткань очень мало, поэтому обнаружение повреждений в глубоко расположенной части организма практически невозможно. Кроме того, описано применение в качестве флуоресцентного контрастного агента цианиновых производных, включая индоцианиновый зеленый (в настоящем описании сокращенно называется ИЦЗ), который используют для определения функции печени и минутного сердечного выброса (Haglund M.M. и др., Neurosurgery, 35, 930 (1994), Li X. и др., SPIE, 2389, 789787 (1995. Цианиновые производные обладают абсорцией в ближней инфракрасной области спектра (700-1300 нм). Свет ближней инфракрасной области спектра хорошо проходит через живые ткани и может проходить через череп размером приблизительно 10 см. Поэтому постоянно растет интерес к его применению в клинической медицине. Например, оптический СТ-метод на основе использования прохождения света через среду привлекает внимание в области клинических исследований в качестве новой технологии. Это обусловлено тем, что свет ближней инфракрасной области спектра может проходить через живой организм и это может использоваться для наблюдения за концентрацией и циркуляцией кислорода в живом организме. Цианиновые производные испускают флуоресценцию в ближней инфракрасной области спектра. Флуоресценция в этой области может проходить через живые ткани и это дает возможность использовать такие соединения в качестве флуоресцентного контрастного агента. В последние годы были разработаны и испытаны в качестве флуоресцентных контрастных агентов различные цианиновые производные(WO 96/17628, WP 97/13490 и т.п.). Однако не известен агент, обладающий достаточной растворимостью в воде и безопасный для живого организма, а также дающий возможность отличать здоровые ткани от больных тканей (т.е. избирательностью в отношении визуализации места-мишени). Краткое изложение сущности изобретения Таким образом, объектом настоящего изобретения является флуоресцентный контрастный агент. Агент по изобретению обладает низкой токсичностью и очень хорошей растворимостью в воде. Кроме того, он испускает флуоресценцию в ближней инфракрасной области спектра, которая может проходить через живые ткани, что позволяет визуализировать конкретную опухоль и/или кровеносный сосуд. 3 Другим объектом настоящего изобретения является способ флуоресцентной визуализации с использованием этого контрастного агента для ближней инфракрасной области спектра. Настоящее изобретение основано на открытии того, что введение трех или большего количества групп сульфоновой кислоты в цианиновый краситель приводит к образованию флуоресцентного контрастного агента, обладающего высокой растворимостью в воде. При создании изобретения также было обнаружено,что при использовании такого контрастного агента может быть разработан способ флуоресцентной визуализации. Таким образом, объектами настоящего изобретения являются следующие объекты.(1) Флуоресцентный контрастный агент для ближней инфракрасной области спектра,содержащий соединение, имеющее в молекуле три или большее количество групп сульфоновой кислоты, представленное формулой [I] где R1 и R2 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный алкил; Z1 и Z2 обозначают атомы, отличные от атомов металла, необходимые для образования замещенного или незамещенного конденсированного бензокольца или конденсированного нафтокольца; r равно 0, 1 или 2;L1-L7 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный метин,при условии, что, когда r равно 2, L6 и L7,которые присутствуют в виде двух пар, имеют одинаковые или различные значения; и Х и Y имеют одинаковые или различные значения и каждый обозначает группу формулы где R3 и R4 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный алкил, или его фармацевтически приемлемая соль.(2) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по указанному выше п.(1), в молекуле которого отсутствует группа карбоновой кислоты.(3) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по указанному выше в п.(1) или (2), где в формуле(4) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по любому из указанных выше пп.(1)-(3), в молекуле которого содержатся 4 или более групп сульфоновой кислоты.(5) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по любым из указанных выше пп.(1)-(4), в молекуле которого содержатся 10 или менее групп сульфоновой кислоты.(6) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по любому из указанных выше пп.(1)-(4), в молекуле которого содержатся 8 или менее групп сульфоновой кислоты.(7) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по любому из указанных выше пп.(1)-(6), где фармацевтически приемлемая соль представляет собой натриевую соль.(8) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по любому из указанных выше пп.(1)-(7), предназначенный для визуализации опухоли и/или ангиографии.(9) Натриевая соль соединения формулы[II], имеющего в молекуле три или более группы сульфоновой кислоты где R1, R2, L1-L7, X и Y имеют указанные выше значения, и R5-R16 имеют одинаковые или различные значения и каждый обозначает атом водорода, группу сульфоновой кислоты, карбоксильную группу, гидроксильную группу,алкил(сульфоалкил)аминогруппу, бис(сульфоалкил)аминогруппу,сульфоалкоксигруппу,(сульфоалкил)сульфонильную группу или(сульфоалкил)аминосульфонильную группу, за исключением групп следующих формул: 6 группу, гидроксильную группу, алкил(сульфоалкил)аминогруппу,бис(сульфоалкил)аминогруппу,сульфоалкоксигруппу,(сульфоалкил)сульфонильную группу или (сульфоалкил)аминосульфонильную группу и X' и Y' имеют одинаковые или различные значения и каждый обозначает группу формулы где R17 и R18 имеют указанные выше значения,за исключением групп следующих формул:(10) Натриевая соль по указанному выше п.(9), где в формуле [II] каждый из R1 и R2 обозначает (низш.)алкил, имеющий 1-5 атомов углерода, замещенный группой сульфоновой кислоты, и Х и Y имеют одинаковые или различные значения и каждый обозначает группу формулы(11) Натриевая соль по указанному выше п.(10), имеющая формулу(12) Натриевая соль соединения формулы имеющего в молекуле три или более групп сульфоновой кислоты, где L1-L7 имеют указанные выше значения, R19 и R20 обозначают(низш.)алкил, имеющий 1-5 атомов углерода и замещенный группой сульфоновой кислоты,R21-R28 имеют одинаковые или различные значения и каждый обозначает атом водорода,группу сульфоновой кислоты, карбоксильную(13) Натриевая соль по указанному выше п.(12), где в формуле [III-1] L4 обозначает метин, замещенный алкилом, имеющим 1-4 атома углерода.(14) Натриевая соль, указанная выше в п.(12), представляющая собой натриевую соль соединения формулы [III-2], имеющего в молекуле три или более группы сульфоновой кислоты, где R19-R28, X' и Y' имеют указанные выше значения, Z3 обозначает группу атома, отличного от атома металла, необходимую для образования 5- или 6-членного кольца, и А обозначает атом водорода или одновалентную группу.(15) Натриевая соль по указанному выше п.(14), имеющая формулу(16) Натриевая соль по указанному выше п.(12), имеющая формулу(17) Натриевая соль по любому из указанных выше пп.(9), (10), (12), (13) и (14), имеющая в молекуле 4 или более групп сульфоновой кислоты.(18) Натриевая соль по любому из указанных выше пп.(9), (10), (12), (13), (14) и (17),имеющая в молекуле 10 или менее групп сульфоновой кислоты.(19) Натриевая соль по любому из указанных выше пп.(9), (10), (12), (13), (14) и (17),имеющая в молекуле 8 или менее групп сульфоновой кислоты.(20) Флуоресцентный контрастный агент для ближней инфракрасной области спектра,содержащий натриевую соль по любому из указанных выше пп.(9)-(19).(21) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по указанному выше п.(20), предназначенный для визуализации опухоли и/или ангиографии.(22) Способ флуоресцентной визуализации, предусматривающий введение флуоресцентного контрастного агента для ближней инфракрасной области спектра по указанному выше п.(1), в живой организм, освещение организма возбуждающим светом и регистрацию флуоресценции контрастного агента в ближней инфракрасной области спектра.(23) Натриевая соль по указанному выше п.(9), представляющая собой по крайней мере одно соединение, выбранное из группы, включающей соединения следующих формул:(24) Натриевая соль по указанному выше п.(12), представляющая собой по крайней мере одно соединение, выбранное из группы, включающей соединения следующих формул:(25) Флуоресцентный контрастный агент для ближней инфракрасной области спектра по указанному выше п.(1), содержащий по крайней мере одно соединение, выбранное из группы,включающей соединения следующих формул: 20 На фиг. 12 представлен график, иллюстрирующий инфракрасный спектр поглощения для соединения (31). На фиг. 13 представлен график, иллюстрирующий инфракрасный спектр поглощения для соединения (6). На фиг. 14 представлен график, иллюстрирующий инфракрасный спектр поглощения для соединения (54). Подробное описание изобретения Понятия, используемые в настоящем описании, имеют следующие значения. Флуоресцентный контрастный агент для ближней инфракрасной области спектра обозначает контрастный агент, испускающий флуоресценцию в ближней инфракрасной области спектра. В контексте настоящего изобретения группа сульфоновой кислоты может обозначать сульфонат (-SO3-), когда указанная группа сульфоновой кислоты используется для образования внутренней соли. В контексте настоящего изобретения Х и Y предпочтительно имеют следующую формулу:(26) Натриевая соль по указанному выше п.(14), где одновалентная группа А обозначает замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил, (низш.)алкоксигруппу, необязательно замещенную замещенную аминогруппу, алкилкарбонилоксигруппу,замещенную или незамещенную алкилтиогруппу, замещенную или незамещенную арилтиогруппу, циано-, нитрогруппу или атом галогена. Краткое описание чертежей На фиг. 1-4 представлены фотографии, на которых приведена флуоресцентная визуализация через 24 ч после введения соединения, когда вводились следующие соединения A: ICG (5 мг/кг), Б: NK-1967 (5 мг/кг), В: соединение (29)(0,5 мг/кг) и Г: соединение (6) К соль (5 мг/кг). На фиг. 5 представлена фотография, на которой приведена флуоресцентная визуализация через 24 ч после введения соединения, когда вводилось следующее соединение Д: соединение (31) (5 мг/кг). На фиг. 6-9 представлены фотографии, на которых приведена флуоресцентная визуализация через 20 с и через 5 мин после введения 5 мг/кг каждого из следующих соединений: А:ICG (через 20 с), Б: ICG (через 5 мин), В: соединение (29) (через 20 с) и Г: соединение (29) (через 5 мин). На фиг. 10 представлен график концентрации соединения в плазме через 0,5, 1, 4 и 24 ч после введения соединения, на котором по оси ординат отложена концентрация (мкг/мл) соединения в плазме в каждый момент времени. На фиг. 11 представлен график, иллюстрирующий инфракрасный спектр поглощения для соединения (29). где R3 и R4 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный алкил. Алкил в понятии "замещенный или незамещенный алкил" применительно к R1, R2, R3 иR4 предпочтительно обозначает линейный или разветвленный (низш.)алкил, имеющий 1-5 атомов углерода, такой как метил, этил, пропил,изопропил, бутил, изобутил, втор-бутил, третбутил, пентил, изопентил, неопентил, третпентил, 2-метилпропил, 1,1-диметилпропил и т.п. Заместители могут представлять собой, например, группу сульфоновой кислоты, карбоксил, гидроксигруппу и т.п. Примеры замещенного алкила включают гидроксиметил, 1 гидроксиэтил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 4-гидроксибутил, карбоксиметил, карбоксиэтил, карбоксибутил,сульфометил, 2-сульфоэтил, 3-сульфопропил, 4 сульфобутил и т.п. Предпочтительно R1 и R2 обозначают (низш.)алкил, имеющий 1-5 атомов углерода, замещенный группой сульфоновой кислоты (например, 2-сульфоэтил, 3-сульфопропил, 4-сульфобутил и т.п.) и R3 и R4 обозначают незамещенный (низш.)алкил, имеющий 15 атомов углерода (например, метил, этил и т.п.). Примерами незамещенного (низш.)алкила,имеющего 1-5 атомов углерода, применительно к R17 и R18 являются группы, перечисленные выше для алкила при определении понятия "за 21 мещенный или незамещенный алкил" применительно к R1, R2, R3 и R4. Примерами алкильной группы в(низш.)алкиле, имеющем 1-5 атомов углерода,замещенном группой сульфоновой кислоты,применительно к R19 и R20 являются группы,перечисленные выше для алкила при определении понятия "замещенный или незамещенный алкил" применительно к R1, R2, R3 и R4, и примеры замещенного (низш.)алкила, имеющего 15 атомов углерода, включают 2-сульфоэтил, 3 сульфопропил и 4-сульфобутил. Алкильный фрагмент алкил(сульфоалкил) аминогруппы, бис(сульфоалкил)аминогруппы,сульфоалкоксигруппы, (сульфоалкил)сульфонильной группы и (сульфоалкил)аминосульфонильной группы применительно к R21-R28 предпочтительно обозначает линейный или разветвленный (низш.)алкил, имеющий 1-5 атомов углерода, примерами которого являются группы, перечисленные выше для алкила при определении понятия "замещенный или незамещенный алкил" применительно к R1, R2, R3 и R4. В контексте настоящего изобретения понятие "атомы, отличные от атомов металлов, необходимые для образования замещенного или незамещенного конденсированного бензокольца или конденсированного нафтокольца" обозначает связующую группу, необходимую для образования конденсированного бензокольца или конденсированного нафтокольца, имеющую формулу Если конденсированное бензокольцо или конденсированное нафтокольцо имеет заместитель, то указанная связующая группа может содержать заместитель. Конкретные примеры включают атом углерода, атом азота, атом кислорода, атом водорода, атом серы, атом галогена (например, атом фтора, атом хлора, атом брома и атом йода) и т.п. Примерами заместителя в конденсированном бензокольце или конденсированном нафтокольце, образованном с помощью атомов, отличных от атомов металлов, применительно к Z1 и Z2 являются группа сульфоновой кислоты,карбоксил, гидроксигруппа, атом галогена (например, атом фтора, атом хлора, атом брома и атом йода), циано-, замещенная аминогруппа(например, диметиламино-, диэтиламино-, этил 4-сульфобутиламино-,ди-(3-сульфопропил) аминогруппа и т.п.) и замещенный или незамещенный алкил как он определен выше, связанный с кольцом непосредственно или посредством двухвалентной связующей группы. Предпочтительной двухвалентной связующей группой может являться, например, -О-, -NHCO-,-NHSO2-, -NHCONH-, -COO-, -CO-, -SO2- и т.п. 22 Предпочтительными примерами алкила в замещенном или незамещенном алкиле, связанном с кольцом непосредственно или посредством двухвалентной связующей группы, являются метил, этил, пропил и бутил, а предпочтительными примерами заместителя являются группа сульфоновой кислоты, карбоксил и гидроксигруппа. Примерами заместителя метина в L1-L7 являются замещенный или незамещенный алкил(как он определен выше), атом галогена (как он определен выше), замещенный или незамещенный арил, (низш.)алкокси и т.п. Примерами арила в понятии "замещенный или незамещенный арил" являются фенил, нафтил и т.п., предпочтительно фенил. Примеры заместителя включают атом галогена (как он определен выше, предпочтительно атом хлора) и т.п. Примерами замещенного арила являются 4-хлорфенил и т.п. (Низш.)алкоксигруппа предпочтительно представляет собой линейную или разветвленную алкоксигруппу, имеющую 1-6 атомов углерода, конкретными примерами которой являются метокси-, этокси-, пропокси-, бутокси-, третбутокси-, пентилоксигруппа и т.п., предпочтительно метокси- и этоксигруппа. Кроме того,заместители метина в L1-L7 могут быть связаны друг с другом с образованием кольца, содержащего три метиновые группы, и, кроме того, это кольцо может быть сконденсировано с кольцом,содержащим другую метиновую группу. Примерами кольца, содержащего три метиновые группы, образованные путем связывания заместителей метина в L1-L7, являются 4,4 диметилциклогексеновое кольцо и т.п. Конъюгированная метиновая цепь, состоящая из групп L1-L7, и образующая кольцо,предпочтительно представляет собой группу формулы (а) где Z3 обозначает атомы, отличные от атомов металлов, необходимые для образования 5- или 6-членного кольца, и А обозначает атом водорода или одновалентную группу. Примерами "атомов, отличных от атомов металлов, необходимых для образования 5- или 6-членного кольца" являются указанные выше группы. В формуле (а) и приведенной далее формуле [III-2] примерами 5- или 6-членного кольца в Z3 являются циклопентеновое кольцо, циклогексеновое кольцо, 4,4-диметилциклогексеновое кольцо и т.п., предпочтительным является циклопентеновое кольцо. Одновалентная группа, обозначенная символом А, представляет собой, например, замещенный или незамещенный алкил (как он определен выше), замещенный или незамещенный 23 арил (как он определен выше), замещенный или незамещенный аралкил (как он определен выше), (низш.)алкоксигруппу (как она определена выше), замещенную аминогруппу, которая является необязательно замещенной, алкилкарбонилоксигруппу (например, ацетоксигруппу),замещенную или незамещенную алкилтиогруппу, замещенную или незамещенную арилтио-,циано-, нитрогруппу, атом галогена (как он определен выше) и т.п. В настоящем описании примерами аралкила в "замещенном или незамещенном аралкиле" являются бензил, 2 фенилэтил, 1-фенилэтил, 3-фенилпропил и т.п.,а заместитель может представлять собой группу сульфоновой кислоты, карбоксил, гидроксигруппу, замещенный или незамещенный алкил(как он определен выше), алкоксигруппу (как она определенa выше), атом галогена (как он определен выше) и т.п. Замещенная аминогруппа в "замещенной аминогруппе, которая является необязательно замещенной", представляет собой, например, алкиламиногруппу (например,метиламино-, этиламиногруппу и т.п.), диалкиламиногруппу (диметиламино-, диэтиламиногруппу и т.п.), дифениламинo-, метилфениламино-, циклическую аминогруппу (например,морфолино-, имидазолидино-, этоксикарбонилпиперадиногруппу и т.п.) и т.п. Примеры заместителя применительно к необязательному замещению "замещенной аминогруппы, которая является необязательно замещенной", включают группу сульфоновой кислоты, карбоксил и т.п. Алкилтиогруппа в "замещенной или незамещенной алкилтиогруппе" может представлять собой, например, метилтио-, этилтиогруппу и т.п. Примеры заместителей включают группу сульфоновой кислоты, карбоксил и т.п. Примерами арилтиогруппы в "замещенной или незамещенной арилтиогруппе" являются фенилтио-,нафтилтиогруппа и т.п. Примеры заместителей включают группу сульфоновой кислоты, карбоксил и т.п. Одновалентная группа, обозначенная символом А, предпочтительно представляет собой атом фтора, атом хлора, диалкиламиногруппу(предпочтительно имеющую 6 или менее атомов углерода и необязательно образующую кольцо) или морфолиногруппу. Наиболее предпочтительно эта группа содержит группу сульфоновой кислоты. В формуле [I] r предпочтительно равно 1. Фармацевтически приемлемая соль может представлять собой любую нетоксичную соль соединения формулы [I]. Примеры таких солей включают соли щелочных металлов, такие как соль натрия, соль калия; соли щелочноземельных металлов, такие как соль магния,соль кальция и т.п.; органическую аммонийную соль, такую как соль аммония, соль триэтиламмония, соль трибутиламмония, соль пиридиния и т.п.; соль аминокислоты, такую как соль лизина, соль аргинина и т.п. Наиболее предпочти 004249 24 тельной является соль натрия, обладающая наименьшей токсичностью для живого организма. Для применения в живом организме флуоресцентный контрастный агент прежде всего должен обладать растворимостью в воде. Согласно настоящему изобретению флуоресцентный контрастный агент для ближней инфракрасной области спектра обладает значительно увеличенной растворимостью в воде, обусловленной введением 3 или более групп сульфоновой кислоты в указанное выше соединение. Для очень хорошей растворимости в воде количество групп сульфоновой кислоты предпочтительно должно быть равно 4 или более. Для облегчения синтеза количество групп сульфоновой кислоты не должно превышать 10, предпочтительно не должно превышать 8. Улучшение растворимости в воде может быть оценено путем измерения коэффициента распределения каждого соединения, который, например, может быть измерен в двухфазной системе бутанол/вода. Более конкретно, введение 3 или большего количества групп сульфоновой кислоты позволяет получить коэффициент распределения log Po/w(коэффициент распределения в системе масло/вода) в системе н-бутанол/вода, не превышающий -1,00. Группы сульфоновой кислоты наиболее предпочтительно вводят в положения R1, R2, Z1 и/или Z2 для соединений формулы [I] и в положения R1, R2, R5, R7, R11 и/или R13 для соединений формулы [II]. Кроме того, эти группы сульфоновой кислоты предпочтительно вводят в L4 конъюгированной метиновой цепи в положении А вышеуказанной формулы (а) посредством двухвалентной группы, такой как алкилен. Среди натриевых солей соединений формулы [II], имеющих в молекуле три или более групп сульфоновой кислоты, предпочтительной является натриевая соль соединения, где R1 и R2 обозначают (низш.)алкил, имеющий 1-5 атомов углерода, который замещен группой сульфоновой кислоты, и где Х и Y имеют одинаковые или различные значения и каждый из них обозначает группу формулы где R17 и R18 имеют одинаковые или различные значения и каждый из них обозначает незамещенный (низш.)алкил, имеющий 1-5 атомов углерода, причем указанная соль имеет в молекуле три или более групп сульфоновой кислоты,при этом наиболее предпочтительным является соединение формулы 26 предпочтительным является соединение следующей формулы: Среди соединений формулы [I], имеющих в молекуле три или более групп сульфоновой кислоты, и их фармацевтически приемлемых солей предпочтительной является натриевая соль соединения формулы [III-1] где L1-L7 имеют указанные выше значения, R19 иR20 обозначают (низш.)алкил, имеющий 1-5 атомов углерода, который замещен группой сульфоновой кислоты, и R21-R28 имеют одинаковые или различные значения и каждый из них обозначает атом водорода, группу сульфоновой кислоты, карбоксильную группу, гидроксильную группу, алкил(сульфоалкил)аминогруппу,бис(сульфоалкил)аминогруппу, сульфоалкоксигруппу, (сульфоалкил)сульфонильную группу или (сульфоалкил)аминосульфонильную группу и X' и Y' имеют одинаковые или различные значения и каждый обозначает группу формулы где R17 и R18 имеют указанные выше значения,причем указанная соль имеет в молекуле три или более групп сульфоновой кислоты, при этом наиболее предпочтительным является следующее соединение формулы: Среди натриевых солей соединений формулы [III-1], имеющих в молекуле три или более групп сульфоновой кислоты, предпочтительной является натриевая соль соединения формулы где R19-R28, X' и Y' имеют указанные выше значения, Z3 обозначает атомы, отличные от атомов металла, необходимые для образования 5- или 6-членного кольца, и А обозначает атом водорода или одновалентную группу, причем указанная соль имеет в молекуле три или более групп сульфоновой кислоты, при этом наиболее Соединения, содержащиеся в флуоресцентном контрастном агенте для ближней инфракрасной области спектра по изобретению,могут представлять собой любые соединения,описываемые формулой [I] или [II] и имеющие в молекуле 3 или более, предпочтительно 4 или более групп сульфоновой кислоты. Эти соединения могут быть синтезированы согласно известному методу получения цианиновых красителей, описанном в The Cyanine Dyes and Related Compoundes, F.M. Hamer, John Wiley and(1989), Cytometry, 11, 418-430 (1990), Cytometry,12, 723-730 (1990), Bioconjugate Chem., 4, 105111 (1993), Anal. Biochem., 217, 197-204 (1994),Tetrahedron, 45, 4845-4866 (1989), ЕР-А 0591820 А 1, ЕР-А 0580145 А 1 и т.п. В альтернативном варианте частичный синтез этих соединений может быть осуществлен известным методом, исходя из имеющегося в продаже цианинового красителя. Более конкретно они могут быть синтезированы путем взаимодействия дианильного производного и гетероциклической четвертичной соли. Соединение формулы [I] по настоящему изобретению может быть синтезировано, например, следующим образом.(a) L1 имеет то же значение, что и L5, Х имеет то же значение, что и Y, R1 имеет то же значение, что и R2, и Z1 имеет то же значение,что и Z2. Гетероциклическую четвертичную соль соединения (2 моля) формулы [VI-1] где L1, X, Z1 и R1 имеют указанные выше значения, и дианильное производное (1 моль) формулы [V-1] где L2, L3 и L4 имеют указанные выше значения,подвергают взаимодействию в присутствии основания и растворителя, получая соединение формулы [VI-1] где L1, L2, L3, L4, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы [VI1] (1 моль) подвергают взаимодействию с необ 27 ходимым молярным количеством соединения формулы [VII][VII] 1 где Т обозначает фрагмент органической кислоты, получая натриевую соль соединения указанной выше формулы [VI-1].(б) L1 имеет значение, отличное от L5, или Х имеет значение, отличное от Y, или R1 имеет значение, отличное от R2, или Z1 имеет значение, отличное от Z2. Гетероциклическую четвертичную соль соединения (1 моль) указанной выше формулы[VI-1] и указанное выше дианильное производное (1 моль) формулы [V-1] подвергают взаимодействию в присутствии основания и растворителя, получая соединение формулы [VIII-1] где L1, L2, L3, L4, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы[VIII-1] (1 моль) подвергают взаимодействию с гетероциклической четвертичной солью соединения (1 моль) формулы [XI-1] где L5, Y, Z2 и R2 имеют указанные выше значения, получая соединение формулы [Х-1] где L1, L2, L3, L4, L5, R1, R2, Z1, Z2, Х и Y имеют указанные выше значения, и это соединение формулы [X-1] (1 моль) подвергают взаимодействию с необходимым молярным количеством вышеуказанного соединения формулы [VII],получая натриевую соль соединения указанной выше формулы [Х-1].(а) L1 имеет то же значение, что и L7, Х имеет то же значение, что и Y, R1 имеет то же значение, что и R2, и Z1 имеет то же значение,что и Z2. Гетероциклическую четвертичную соль соединения (2 моля) формулы [IV-1] где L1, X, Z1 и R1 имеют указанные выше значения, и дианильное производное (1 моль) формулы [V-2] где L2, L3, L4, L5 и L6 имеют указанные выше значения, подвергают взаимодействию в при 004249 28 сутствии основания и растворителя, получая соединение формулы [VI-2] где L1, L2, L3, L4, L5, L6, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы [VI-2] (1 моль) подвергают взаимодействию с необходимым молярным количеством соединения формулы [VII][VII] 1 где Т имеет указанное выше значение, получая натриевую соль соединения указанной выше формулы [VI-2];(б) L1 имеет значение, отличное от L7, или Х имеет значение, отличное от Y, или R1 имеет значение, отличное от R2, или Z1 имеет значение, отличное от Z2. Гетероциклическую четвертичную соль соединения (1 моль) указанной выше формулы[IV-1] и указанное выше дианильное производное (1 моль) формулы [V-2] подвергают взаимодействию в присутствии основания и растворителя, получая соединение формулы [VIII-2] где L1, L2, L3, L4, L5, L6, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы [VIII-2] (1 моль) подвергают взаимодействию с гетероциклической четвертичной солью соединения (1 моль) формулы [IX-2] где L7, Y, Z2 и R2 имеют указанные выше значения, получая соединение формулы [Х-2] где L1, L2, L3, L4, L5, L6, L7, R1, R2, Z1, Z2, Х и Y имеют указанные выше значения, и это соединение формулы [Х-2] (1 моль) подвергают взаимодействию с необходимым молярным количеством вышеуказанного соединения формулы[VII], получая натриевую соль соединения указанной выше формулы [Х-2].(III) если r равно 2. Если r равно 2, то L6 и L7 дублируются в формуле [I]. Для того чтобы этого избежать и внести ясность, дублирующие символы L6 и L7 обозначены как L8 и L9.(a) L1 имеет то же значение, что и L9, Х имеет то же значение, что и Y, R1 имеет то же значение, что и R2, и Z1 имеет то же значение,что и Z2. 29 Гетероциклическую четвертичную соединения (2 моля) формулы [IV-1] где L1, X, Z1 и R1 имеют указанные выше значения, и дианильное производное (1 моль) формулы [V-3] где L2, L3, L4, L5, L6 и L7 имеют указанные выше значения и L8 обозначает необязательно замещенную метиновую группу, подвергают взаимодействию в присутствии основания и растворителя, получая соединение формулы [VI-3] где L1, L2, L3, L4, L5, L6, L7, L8, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы [VI-3] (1 моль) подвергают взаимодействию с необходимым молярным количеством соединения формулы [VII][VII] 1 где Т имеет указанное выше значение, получая натриевую соль соединения указанной выше формулы [VI-3];(б) L1 имеет значение, отличное от L9, или Х имеет значение, отличное от Y, или R1 имеет значение, отличное от R2, или Z1 имеет значение, отличное от Z2. Гетероциклическую четвертичную соль соединения (1 моль) указанной выше формулы[IV-1] и указанное выше дианильное производное (1 моль) формулы [V-3] подвергают взаимодействию в присутствии основания и растворителя, получая соединение формулы [VIII-3] где L1, L2, L3, L4, L5, L6, L7, L8, R1, Z1 и Х имеют указанные выше значения, и это соединение формулы [VIII-3] (1 моль) подвергают взаимодействию с гетероциклической четвертичной солью соединения (1 моль) формулы [IX-3] где L7, Y, Z2 и R2 имеют указанные выше значения и L9 обозначает необязательно замещенную метиновую группу, получая соединение формулы [Х-3] 30 где L1, L2, L3, L4, L5, L6, L7, L8, L9, R1, R2, Z1, Z2,Х и Y имеют указанные выше значения, и это соединение формулы [Х-3] (1 моль) подвергают взаимодействию с необходимым молярным количеством вышеуказанного соединения формулы [VII], получая натриевую соль соединения указанной выше формулы [Х-3]. Необходимое молярное количество соединения формулы [VII] должно быть не меньше,чем количество, эквивалентное количеству натрия, содержащегося в одной молекуле целевой натриевой соли соединения формулы [I]. Примерами заместителя в замещенной метиновой группе применительно к L8 и L9 являются заместители, перечисленные для указанных выше метиновых групп применительно к[IX-3] осуществляют при температуре от -20 до 80 С, предпочтительно от -10 до 40 С, предпочтительно в присутствии ацилирующего агента,такого как уксусный ангидрид. В методах синтеза, описанных выше в (I),(II) и (III), взаимодействие соединений [IV-1] и[VI-3] и [VII] и соединений [X-3] и [VII] предпочтительно осуществляют при температуре от 0 до 40 С, предпочтительно в присутствии растворителя, такого как спирт и вода. В методах синтеза, описанных выше в (I),(II) и (III), основание, которое требуется применять, может представлять собой, например, триэтиламин, трибутиламин, пиридин, диазабициклоундецен, метоксид натрия и т.п.; растворитель, который требуется применять, может представлять собой, например, амидное производное, такое как N,N-диметилацетамид, Nметилпирролидон и N,N-диэтилформамид, или спирты, такие как метанол; а фрагмент органической кислоты может представлять собой, например, СН 3 СОО и т.п. Что касается получения различных фармацевтически приемлемых солей соединений вышеупомянутой формулы [I], то аммонийная соль и калиевая соль соединений формулы [I] могут быть получены, например, путем замены соединения формулы [VII], используемого в описанных выше в (I), (II) и (III) методах синтеза, соединением формулы [VII], где атом натрия заменен на аммонийную группу или атом калия; а различные катионные соли соединений вышеупомянутой формулы [I] при необходимости могут быть получены путем превращения указанной аммонийной соли и калиевой соли в различные катионные соли с использованием ионообменных смол. 31 Ниже приведены конкретные примеры соединений вышеупомянутой формулы [I], включая соединения формулы [II], предназначенные для применения согласно настоящему изобретению, однако, объем изобретения не ограничен ими. Вышеуказанное соединение,которое должно содержаться в флуоресцентном контрастном агенте для ближней инфракрасной области спектра по настоящему изобретению, обладает поглощающей способностью и флуоресценцией в ближней инфракрасной области спектра при длинах волн 700-1300 нм, прежде всего приблизительно при 700-900 нм, и имеет коэффициент молярного поглощения не менее 100000. На флуоресцентный контрастный агент для ближней инфракрасной области спектра по настоящему изобретению не накладывается особых ограничений за исключением того, что он содержит соединение формулы [I] или формулы [II] и/или его фармацевтически приемлемую соль и имеет в молекуле 3 или более, предпочтительно 4 или более групп сульфоновой кислоты. Это соединение или его соль может содержаться в указанном контрастном агенте индивидуально или в сочетании друг с другом. Более конкретно указанный контрастный агент включает указанное соединение или указанное соединение, суспендированное или растворенное в растворителе, таком как дистиллированная вода для инъекций, физиологический раствор, раствор Рингера и т.п. При необходимости могут быть добавлены фармакологически приемлемые добавки, такие как носитель, эксципиент и т.п. Эти добавки содержат такие вещества, как фармакологически приемлемый электролит, буфер, поверхностно-активное вещество и вещества для регулирования осмотического давления и улучшения стабильности и растворимости (например, циклодекстрин, липосома и т.п.). Могут использоваться различные добавки, обычно применяемые в соответствующих областях. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по настоящему изобретению, если предполагается его применение в фармацевтических целях, предпочтительно получают с использованием процесса стерилизации. Указанный контрастный агент может вводиться в живой организм путем инъекции, разбрызгивания или нанесения покрытия, внутрисосудисто (внутривенно, внутриартериально),перорально, внутрибрюшинно, чрезкожно, подкожно, внутрь кисты или внутрибронхиально. Предпочтительно агент вводят в кровеносные 38 сосуды в форме водного агента, эмульсии или суспензии. На дозу флуоресцентного контрастного агента для ближней инфракрасной области спектра по настоящему изобретению не накладывается особых ограничений, если доза является достаточной для обнаружения места, которое в конечном счете должно быть диагностировано. Ее соответствующим образом регулируют в зависимости от применяемого соединения, испускающего флуоресценцию в ближней инфракрасной области спектра, возраста, веса тела и органа-мишени обследуемых пациентов и т.п. Обычно доза составляет 0,1-100 мг/кг веса тела, предпочтительно 0,5-20 мг/кг веса тела, в пересчете на количество указанного соединения. Контрастный агент по настоящему изобретению может применяться соответствующим образом для различных животных, а не только людей. Форму введения, путь и дозу определяют соответствующим образом в зависимости от веса тела и состояний животного-мишени. Кроме того, согласно настоящему изобретению вышеуказанное соединение формулы [I],наиболее предпочтительно соединение формулы [II], имеющее в молекуле 3 или более, предпочтительно 4 или более групп сульфоновой кислоты, имеет тенденцию в значительной степени накапливаться в тканях опухоли. С использованием этой особенности применение флуоресцентного контрастного агента по изобретению позволяет визуализировать конкретно ткань опухоли. Кроме того, целый ряд из указанных соединений может оставаться в кровеносном сосуде в течение длительного времени и поэтому следует ожидать, что они могут успешно применяться в качестве контрастных агентов для ангиографии. Способ флуоресцентной визуализации по настоящему изобретению отличается применением флуоресцентного контрастного агента для ближней инфракрасной области спектра по изобретению. Это способ осуществляют на практике с использованием известных методов и в зависимости от типа флуоресцентного контрастного агента для ближней инфракрасной области спектра, подлежащего введению, и мишени для введения соответствующим образом определяют каждый параметр, такой как длина волны возбуждения и длина волны флуоресценции,которую требуется обнаружить, для того, чтобы добиться оптимальной визуализации и возможности оценки. Время, проходящее с момента введения флуоресцентного контрастного агента для ближней инфракрасной области спектра по изобретению в мишень, подлежащую оценке, до начала оценки с помощью способа флуоресцентной визуализации по настоящему изобретению варьируется в зависимости от типа флуоресцентного контрастного агента для ближней инфракрасной области спектра, подлежащего 39 введению, и мишеней для введения. Например,если агент содержит соединение формулы [I] для визуализации опухоли, то промежуток времени составляет приблизительно 4-120 ч после введения. В случае соединения формулы [II] промежуток времени составляет приблизительно 24-120 ч после введения. Если промежуток времени слишком короткий, флуоресценция является настолько интенсивной, что местомишень не может быть четко отделена от других областей. Если он слишком велик, то контрастный агент может быть выведен из организма. Если требуется визуализация кровеносного сосуда, то соединение формулы [I] или формулы [II] обнаруживают сразу после введения или спустя приблизительно 30 мин. Способ обычно предусматривает проведение следующих стадий. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по настоящему изобретению вводят в мишень, подлежащую обнаружению, и мишень, подлежащую обнаружению, облучают возбуждающим светом от источника возбуждающего света. Затем с помощью флуоресцентного детектора обнаруживают флуоресценцию от флуоресцентного контрастного агента для ближней инфракрасной области спектра, вызванную возбуждающим светом. Длина волны возбуждения варьируется в зависимости от используемого флуоресцентного контрастного агента для ближней инфракрасной области спектра. На нее не накладывается ограничений, если соединение эффективно испускает флуоресценцию в ближней инфракрасной области спектра. Предпочтительно используют свет ближней инфракрасной области спектра,обладающий хорошей способностью проходить через биологические объекты. Длина волны флуоресценции в ближней инфракрасной области спектра, подлежащая обнаружению, также варьируется в зависимости от используемого контрастного агента. В целом применяют возбуждающий свет с длиной волны 600-1000 нм, предпочтительно 700-850 нм, и обнаруживают флуоресценцию в ближней инфракрасной области спектра при длине волны 700-1000 нм, предпочтительно 750-900 нм. В этом случае источником возбуждающего света может служить обычный источник возбуждающего света, такой как различные типы лазеров(например, ионный лазер, лазер на красителе и полупроводниковый лазер), галогеновый источник света, ксеноновый источник света и т.п. При необходимости могут применяться различные оптические фильтры для получения оптимальной длины волны возбуждения. Аналогично этому флуоресценцию можно обнаруживать с использованием различных оптических фильтров для выявления флуоресценции только от указанного флуоресцентного контрастного агента для ближней инфракрасной области спектра. 40 Обнаруженную флуоресценцию подвергают обработке с получением информации о флуоресценции, которую используют для создания флуоресцентных изображений, которые могут быть записаны на соответствующем носителе. Флуоресцентные изображения получают путем освещения большой области, включающей ткань-мишень, обнаружения флуоресценции с помощью CCD-камеры (телекамера на приборах с зарядовой связью) и обработки полученной информации в виде флуоресцентного изображения. В альтернативном варианте может применяться оптический СТ-аппарат, может применяться эндоскоп или может применяться офтальмоскоп. Способ флуоресцентной визуализации по настоящему изобретению позволяет визуализировать системные болезни, опухоли, кровеносные сосуды и т.п. без повреждения живого организма. Настоящее изобретение более подробно с помощью примеров и экспериментальных примеров, не ограничивающих объема настоящего изобретения. Номера соединений в приведенных ниже примерах и экспериментальных примерах соответствуют номерам соединений,представленных структурными формулами. Соединение, для которого символ, обозначающий "калиевую соль", "кальциевую соль" или "пиридиниевую соль" указан после номера соединения (например, соединение (29) К соль) обозначает соединение, которое является тем же самым, что и соединение с указанным номером соединения (натриевая соль), за исключением того, что противоион представляет собой калиевую соль, кальциевую соль или пиридиниевую соль, а не натриевую соль. Например, "соединение (31) К соль" обозначает соединение, которое является тем же самым, что и соединение(31), за исключением того, что противоион представляет собой калий, а не натрий; "соединение (31) Са соль" обозначает соединение, которое является тем же самым, что и соединение(31), за исключением того, что противоион представляет собой кальций, а не натрий; и "соединение (31) пиридиниевая соль" обозначает соединение, которое является тем же самым, что и соединение (31), за исключением того, что противоион представляет собой пиридиний, а не натрий. Метод синтеза соединения, содержащегося в качестве действующего вещества в флуоресцентном контрастном агенте для ближней инфракрасной области спектра по настоящему изобретению, пояснен в примерах. Описанные ниже методы синтеза в основном заключаются во взаимодействии гетероциклической четвертичной соли соединения,представленного в табл. 1, и дианильных производных, представленных в табл. 2 и 3. Таблица 1 Гетероциклическая четвертичная соль соединения Примеры В приведенных ниже примерах для удобства соединения обозначены символами (например, A1, Q1 и т.п.), используемыми в табл. 1-3. Пример 1. Синтез соединения (29). К гетероциклической четвертичной соли соединения Q1 (5 г) добавляли метанол (100 мл), N,N-диметилформамид (25 мл), триэтиламин (5,6 мл), дианильное производное A1 (1,83 г) и уксусный ангидрид (3 мл) и смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли триэтиламин (2,2 мл) и уксусный ангидрид (2 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (2 г) в метаноле (15 мл), после чего перемешивали при комнатной температуре в течение 1 ч. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К полученным неочищенным кристаллам (3,5 г) добавляли для растворения воду (20 мл). Добавляли ацетат натрия (1 г), а затем метанол (30 мл), после чего перемешивали в течение 1 ч. Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 3 г соединения (29). Полученное соединение (29) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 780 нм Молярный коэффициент поглощения(Н 2 О): 243000 Максимальная длина волны испускания флуоресценции (Н 2 О): 802 нм 43 Инфракрасный спектр поглощения полученного соединения (29) измеряли методом таблетки бромида калия с использованием инфракрасного спектрометра с фурье-преобразованием (типа VALOR-III, производитель фирмаJASCO). Были обнаружены приведенные ниже пики. Спектр показан на фиг. 11. ИК (max(KBr: 1414, 1086, 1037, 995,889 см-1 Пример 2. Синтез соединения (34). К гетероциклической четвертичной соли соединения Q2 (2,13 г) добавляли метанол (20 мл) и смесь охлаждали до 10 С. К ней добавляли дианильное производное А 2 (0,75 г), триэтиламин (4 мл) и уксусный ангидрид (2 мл) и смесь перемешивали в течение 20 мин. Добавляли уксусный ангидрид (2 мл) и смесь перемешивали при 10 С в течение 4 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (2 г) в небольшом количестве метанола. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К полученным неочищенным кристаллам добавляли для растворения воду (7 мл). Для осаждения кристаллов добавляли метанол (7 мл). Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 1,2 г соединения (34). Полученное соединение (34) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 794 нм Молярный коэффициент поглощения(Н 2 О): 176000 Максимальная длина волны испускания флуоресценции (Н 2 О): 812 нм Пример 3. Синтез соединения (6). К гетероциклической четвертичной соли соединения Q3 (9,5 г) добавляли метанол (50 мл), триэтиламин (7 мл), дианильное производное A3 (1,83 г) и уксусный ангидрид (3,9 мл) и смесь перемешивали при комнатной температуре в течение 7 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (5 г) в небольшом количестве метанола. Смеси давали выстояться в течение ночи. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли для растворения воду (30 мл). Добавляли ацетат натрия (2 г), а затем метанол (30 мл). Образовавшиеся кристаллы собирали фильтрацией,промывали небольшим количеством метанола и сушили, получая соединение (6). Пример 4. Синтез соединения (45). К гетероциклической четвертичной соли соединения Q3 (4,8 г) добавляли метанол (50 мл), триэтиламин (4 мл), дианильное производное А 4 (1,7 г) и уксусный ангидрид (2 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Нерастворившийся продукт 44 отфильтровывали и к фильтрату добавляли раствор ацетата натрия (4 г) в небольшом количестве метанола. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли для растворения воду (10 мл). Затем добавляли метанол (10 мл). Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили на воздухе,получая 1,6 г соединения, которое представляло собой такое же соединение, что и соединение(45) за исключением того, что заместитель в метиновой цепи представлял собой -Сl вместо-SCH2CH2SO3Na. Описанную выше стадию повторяли, получая 4,2 г указанного соединения. К нему добавляют воду (30 мл), триэтиламин (1,2 мл) и 2 меркаптоэтансульфонат натрия (0,8 г) и смесь перемешивали при комнатной температуре в течение 4 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (2 г) в небольшом количестве метанола. Образовавшиеся кристаллы собирали фильтрацией, промывали метанолом (20 мл) и сушили на воздухе, получая 2,3 г соединения (45). Полученное соединение (45) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 815 нм Молярный коэффициент поглощения(Н 2 О): 196000 Максимальная длина волны испускания флуоресценции (Н 2 О): 827 нм Пример 5. Синтез соединения (2). К гетероциклической четвертичной соли соединения Q3 (4,7 г) добавляли метанол (25 мл), триэтиламин (2,8 мл), дианильное производное А 5 (1,5 г) и уксусный ангидрид (2,4 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем к ней добавляли триэтиламин (3,5 мл) и уксусный ангидрид (1,5 мл) и смесь перемешивали при комнатной температуре в течение 3,5 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (3 г) в небольшом количестве метанола. Смесь перемешивали при комнатной температуре в течение 1 ч. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли для растворения воду (15 мл). Затем добавляли метанол (15 мл). Образовавшиеся кристаллы собирали фильтрацией,промывали небольшим количеством метанола и сушили на воздухе, получая соединение (2). Пример 6. Синтез соединения (43). К гетероциклической четвертичной соли соединения Q3 (3,75 г) добавляли метанол (25 мл), триэтиламин (3,5 мл), дианильное производное А 6 (1,95 г) и уксусный ангидрид (2,4 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Нерастворившийся продукт 45 отфильтровывали и к фильтрату добавляли раствор ацетата натрия (3,9 г) в небольшом количестве метанола. Смесь перемешивали при комнатной температуре в течение 1 ч. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли для растворения воду (10 мл). Добавляли ацетат натрия (2 г) и затем метанол (10 мл). Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 1,8 г соединения (43). Полученное соединение (43) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 773 нм Молярный коэффициент поглощения(Н 2 О): 204000 Максимальная длина волны испускания флуоресценции (Н 2 О): 789 нм Пример 7. Синтез соединения (4). К гетероциклической четвертичной соли соединения Q3 (3,5 г) добавляли метанол (20 мл), триэтиламин (3,5 мл), дианильное производное А 7 (1,2 г) и уксусный ангидрид (1,9 мл) и смесь перемешивали при комнатной температуре в течение 10 ч, после чего давали выстояться в течение ночи. Смесь перемешивали,поддерживая температуру 50 С, в течение 5 ч. Добавляли воду (2 мл) и отфильтровывали нерастворившийся продукт. К фильтрату добавляли раствор ацетата натрия (5 г) в небольшом количестве воды. Смесь перемешивали при комнатной температуре в течение 30 мин. Образовавшиеся кристаллы собирали фильтрацией,промывали небольшим количеством метанола и сушили, получая соединение (4). Пример 8. Синтез соединения (31). К гетероциклической четвертичной соли соединения Q4 (3,5 г) добавляли метанол (35 мл), триэтиламин (3,5 мл) и уксусный ангидрид(2 мл) и порциями при перемешивании добавляли дианильное производное А 2 (1,8 г). Смесь перемешивали еще в течение 1 ч. Добавляли уксусный ангидрид (2 мл) и смесь перемешивали при комнатной температуре в течение 5 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия(4 г) в небольшом количестве метанола. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли для растворения воду(10 мл). Добавляли метанол (10 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 1,3 г соединения (31). Полученное соединение (31) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 228000 Максимальная длина волны испускания флуоресценции (Н 2 О): 774 нм Инфракрасный спектр поглощения полученного соединения (31) измеряли методом таблетки бромида калия с использованием инфракрасного спектрометра с фурье-преобразованием (типа VALOR-III, производитель фирмаJASCO). Были обнаружены приведенные ниже пики. Спектр показан на фиг. 12. ИК (max(KBr: 1518, 1183, 1149,1111, 995 см-1 Пример 9. Синтез соединения (41). К гетероциклической четвертичной соли соединения Q1 (12 г) добавляли метанол (120 мл), триэтиламин (13,6 мл), дианильное производное А 8 (4,4 г) и уксусный ангидрид (2,4 мл) и смесь перемешивали в течение 30 мин. Добавляли уксусный ангидрид (2,4 мл) и смесь перемешивали в течение 1,5 ч, после чего добавляли уксусный ангидрид (2,4 мл) и смесь перемешивали при комнатной температуре в течение 6 ч. Затем еще раз добавляли гетероциклическую четвертичную соль соединения Q1 (1 г), триэтиламин (3 мл) и уксусный ангидрид (3 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Смеси давали выстояться в течение ночи. Добавляли ацетат натрия (5 г) и образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К неочищенным кристаллам добавляли для растворения воду (200 мл). Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия (10 г). Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. К кристаллам добавляли воду (200 мл) и триэтиламин (10 мл), затем для образования кристаллов добавляли раствор ацетата натрия (10 г) в метаноле (100 мл). Эту стадию повторяли дважды. Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 9,7 г соединения (41). Полученное соединение (41) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 811 нм Молярный коэффициент поглощения(Н 2 О): 230000 Максимальная длина волны испускания флуоресценции (Н 2 О): 822 нм Пример 10. Синтез соединения (3). Соединение (3) получали согласно процессу, описанному в примере 5, используя в качестве исходных продуктов гетероциклическую четвертичную соль соединения Q3 и соответствующее дианильное производное. Пример 11. Работая согласно процессу, описанному для синтеза соединения (29) в примере 1, за ис 47 ключением того, что вместо ацетата натрия (2 г) использовали ацетат калия (2 г), получали соединение, представляющее собой такое же соединение, что и соединение (29), за исключением того, что оно в качестве противоиона содержит калий вместо натрия. Ниже в настоящем описании оно обозначено как соединение (29) К соль. Полученное соединение (29) К соль давало пурпурную окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 780 нм Молярный коэффициент поглощения(Н 2 О): 254000 Максимальная длина волны испускания флуоресценции (Н 2 О): 800 нм Таким же образом, как это описано в данном примере, обрабатывали другие соединения,получая соединения, содержащие в качестве противоиона калий вместо натрия. Для того чтобы отличить эти соединения,содержащие в качестве противоиона калий вместо натрия, от указанных выше соединений, после соответствующих номеров соединений добавлено "К соль". Пример 12. Таким же образом, как это описано в примере 11, получали соединение (6) К соль. Полученное соединение (6) К соль давало пурпурную окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 788 нм Молярный коэффициент поглощения(Н 2 О): 226000 Максимальная длина волны испускания флуоресценции (Н 2 О): 806 нм Пример 13. Таким же образом, как это описано в примере 11, получали соединение (2) К соль. Полученное соединение (2) К соль давало пурпурную окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 743 нм Молярный коэффициент поглощения(Н 2 О): 266000 Максимальная длина волны испускания флуоресценции (Н 2 О): 762 нм Пример 14. Таким же образом, как это описано в примере 11, получали соединение (4) К соль. Полученное соединение (4) К соль давало пурпурную окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 753 нм Молярный коэффициент поглощения(Н 2 О): 212000 Максимальная длина волны испускания флуоресценции (Н 2 О): 767 нм Пример 15. Таким же образом, как это описано в примере 11, получали соединение (3) К соль. Полу 004249 48 ченное соединение (3) К соль давало пурпурную окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 751 нм Молярный коэффициент поглощения(Н 2 О): 241000 Максимальная длина волны испускания флуоресценции (Н 2 О): 767 нм Пример 16. Соединение (6) К соль (50 мг) растворяли в небольшом количестве воды и пропускали через ионообменную смолу для того, чтобы превратить калий, содержащийся в соединении (6) К соль, в протон. К образовавшемуся продукту добавляли метанол, насыщенный ацетатом натрия, для осаждения кристаллов. Эту процедуру повторяли дважды. Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 32 мг соединения (6). Полученное соединение (6) давало желтую окраску в анализе по окрашиванию пламени. Инфракрасный спектр поглощения полученного соединения (6) измеряли методом таблетки бромида калия с использованием инфракрасного спектрометра с фурье-преобразованием (типа VALOR-III, производитель фирмаJASCO). Были обнаружены приведенные ниже пики. Спектр показан на фиг. 13. ИК (max(KBr: 1395, 1372, 1188, 1102,1020 см-1 Пример 17. Синтез соединения (54). К гетероциклической четвертичной соли соединения Q4 (3,5 г) добавляли метанол (20 мл), триэтиламин (3,5 мл) и уксусный ангидрид(2 мл) и порциями при перемешивании добавляли дианильное производное А 1 (1,4 г). Смесь перемешивали еще в течение 20 мин. Добавляли уксусный ангидрид (1 мл) и смесь перемешивали при комнатной температуре в течение 1,5 ч. Нерастворившийся продукт отфильтровывали и к фильтрату добавляли раствор ацетата натрия(4 г) в небольшом количестве метанола. Образовавшиеся кристаллы собирали фильтрацией и промывали небольшим количеством метанола. Кристаллы растворяли в небольшом количестве воды. Затем раствор разбавляли метанолом (10 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Образовавшиеся кристаллы собирали фильтрацией, промывали небольшим количеством метанола и сушили, получая 1,5 г соединения (54). Полученное соединение (54) давало желтую окраску в анализе по окрашиванию пламени. Максимальная длина волны поглощения(Н 2 О): 743 нм Молярный коэффициент поглощения(Н 2 О): 244000 Максимальная длина волны испускания флуоресценции (Н 2 О): 766 нм Инфракрасный спектр поглощения полученного соединения (54) измеряли методом таб 49 летки бромида калия с использованием инфракрасного спектрометра с фурье-преобразованием (типа VALOR-III, производитель фирмаJASCO). Были обнаружены приведенные ниже пики. Спектр показан на фиг. 14. ИК (max(KBr: 1511, 1421, 1099, 1004,926 см-1 Экспериментальный пример 1. Для соединения (29), соединения (43), соединения (45), соединения (31), соединения (3) К соль, соединения (11) [поступающего в продажу от фирмы Nippon Kankoh-Shikisp Kenkyusho CO., LTD. под названием NK-3261], соединения (6) К соль, соединения (2) К соль, соединения (4) К соль, соединения (34) и соединения(log Po/w) в системе н-бутанол/вода. В качестве контрольного соединения использовали NK-1967 (фирма Nippon KankohShikisp Kenkyusho CO., LTD.) и ICG (Tokyo Kasei Kogyo), имеющие в молекуле только 2 группы сульфоновой кислоты. Результаты приведены в табл. 4. Таблица 4 Экспериментальный пример 2. Флуоресцентная визуализация - тест (1). Кусочки опухолевой ткани карциномы ободочной кишки мыши (линия карциномы ободочной кишки 26) подкожно имплантировали в левую часть груди бестимусным мышам линии BALB/c (возраст 5 недель, фирма CleaJapan, Inc.). Через 10 дней, когда диаметр опухоли достигал приблизительно 8 мм, проводили тест на мышах. В качестве источника возбуждающего флуоресценцию света использовали титановосапфировый лазер. Тестируемых мышей равно 50 мерно облучали светом от лазера с использованием световода кольцевого типа (фирма SumitaOptical Glass Co.), при этом дисперсия облучения была менее 10%. Выходную мощность облучения регулировали таким образом, чтобы она составляла приблизительно 40 мкВт/см 2 ближайшего участка поверхности кожи мышей. Флуоресценцию возбуждали при максимальной длине возбуждения каждого соединения, а испускание флуоресценции из организма мыши обнаруживали и фотографировали через фильтр с частотой среза, позволяющей отсекать короткие волны (типа IR84, IR86, IR88, фирма FujiPhotonic К.К.). Частоту среза фильтра выбирали таким образом, чтобы она соответствовала длине волны возбуждения соединения. Время экспозиции регулировали в зависимости от интенсивности флуоресценции каждого соединения. Тестируемыми соединениями были соединение (29), соединение (31) и соединение (6) К соль по настоящему изобретению, а контрольными соединениями - соединения NK-1967 иICG, имеющие в молекуле только 2 группы сульфоновой кислоты. Каждое тестируемое соединение (0,5 мг/мл) растворяли в дистиллированной воде и вводили мышам через хвостовую вену. Доза составляла 5,0 мг/кг для соединения(31), соединения (6) К соль, NK-1967 и ICG и 0,5 мг/кг для соединения (29). Через 24 ч после введения соединений мышей анестезировали диэтиловым эфиром и фотографировали флуоресцентные световые изображения всего тела мышей. Результаты приведены на фиг. 1-5. Соединение (29), имеющее бензотрикарбоцианиновую структуру и шесть групп сульфоновой кислоты, а также соединение (6) К соль и соединение 31, которые оба имели трикарбоцианиновую структуру и четыре группы сульфоновой кислоты, давали выражение более четкие изображения опухоли по сравнению с контрольными соединениями (NK-1967, имеющим бензотрикарбоцианиновую структуру, и ICG,имеющим трикарбоцианиновую структуру),несущими две группы сульфоновой кислоты. В частности, соединение (29) позволяло получать четкое изображение опухоли даже при введении в низкой дозе и оказалось очень эффективным. Экспериментальный пример 3. Флуоресцентная визуализация - тест (2). В тесте использовали бестимусных мышей. Соединение (29) по настоящему изобретению и контрольное соединение ICG вводили путем внутривенной инъекции в хвостовую вену в дозе 5,0 мг/кг каждого соединения при постоянной анестезии путем ингаляции севофлурана. В этот момент начинали фотографирование флуоресцентного изображения через определенные интервалы времени. Для фотографирования флуоресцентных изображений объект подвергали облучению возбуждающим лучом 51 лазера и осуществляли выделение флуоресценции с помощью фильтра, при этом время экспозиции составляло 1 с. Через 20 с после введения соединений оказывалось возможным получить удовлетворительное изображение кровеносного сосуда. Флуоресцентные изображения фотографировали в течение 5 мин после введения. На фиг. 6-9 представлены флуоресцентные изображения всего тела мышей через 20 с и 5 мин после введения. Соединение ICG не позволяло получить контрастное изображение кровеносного сосуда через 5 мин, в то время как соединение (29) позволяло визуализировать кровеносный сосуд в течение более длительного времени по сравнению с ICG. Экспериментальный пример 4. Способность сохраняться в кровеносном сосуде. Таким же образом, как это описано в экспериментальном примере 2, кусочки опухолевой ткани имплантировали мышам линии SDF1(самки, возраст 5 недель, фирма Japan SLC, Inc.) и приблизительно через 2 недели, когда диаметр опухоли достигал приблизительно 1 см, мышей подвергали тестированию. Тестируемые соединения представляли собой соединение (29) К соль и соединение (41) К соль, имеющие бензотрикарбоцианиновую структуру и 6 групп сульфоновой кислоты; соединение (6) К соль, соединение (4) К соль, соединение (45) К соль, соединение (31), соединение (31) К соль, соединение (3) К соль, соединение (2) К соль, соединение (43) К соль и соединение (11), имеющие трикарбоцианиновую структуру и 4-5 групп сульфоновой кислоты; и контрольные соединения ICG и NK-1967. Каждое тестируемое соединение перед применением растворяли в дистиллированной воде (0,5 мг/мл). Приготовленные растворы каждого соединения вводили мышам в хвостовую вену (5,0 мг/кг). У мышей брали образцы крови через 0,5,1, 4 и 24 ч после введения соединения и подвергали центрифугированию, получая плазму. Интенсивность флуоресценции в плазме измеряли спектрофлуорометром (типа RF 5300PC, фирма SHIMADZU CORPORATION). Для каждого соединения вычерчивали калибровочную кривую и вычисляли концентрацию соединения в плазме. Результаты приведены на фиг. 10. Соединения по настоящему изобретению сохраняются в плазме в высокой концентрации в течение длительного периода времени. Экспериментальный пример 5. Острая токсичность. Изучали уменьшение токсичности, обусловленное введением группы сульфоновой кислоты и ее уменьшение при превращении соединения в натриевую соль. Тестируемые соединения перечислены в табл. 5. 52 Каждое тестируемое соединение растворяли в дистиллированной воде, получая раствор соединения. Этот раствор вводили путем внутривенной инъекции находящимся в сознании мышам в хвостовую вену. Мышей наблюдали в течение 3 дней после введения и оценивали острую токсичность [LD50 (мг/кг веса тела)]. Результаты представлены в табл. 5. Таблица 5 Кол-во групп сульфоновой кислоты Увеличение количества групп сульфоновой кислоты в молекуле или превращение соединения в натриевую соль приводило к сильному уменьшению острой токсичности. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по настоящему изобретению возбуждается возбуждающим светом и испускает флуоресценцию в ближней инфракрасной области спектра. Эта инфракрасная флуоресценция хорошо проходит через биологические ткани. Вследствие этого оказывается возможным обнаруживать повреждения в глубоко расположенных областях живого организма. Кроме того, контрастный агент по изобретению обладает хорошей растворимостью в воде и малотоксичен и, следовательно,безопасен для применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Натриевая соль соединения формулы содержащего в молекуле три или более групп сульфоновой кислоты, где L1-L7 имеют одинаковые или различные значения и каждый обозначает замещенный или незамещенный метин,a L4 обозначает метин, замещенный алкилом, 53 содержащим от 1 до 4 атомов углерода, R19 и R20 обозначают (низш.)алкил, имеющий 1-5 атомов углерода и замещенный группой сульфоновой кислоты, R21-R28 имеют одинаковые или различные значения и каждый обозначает атом водорода, группу сульфоновой кислоты, карбоксильную группу, гидроксильную группу,алкил(сульфоалкил)аминогруппу, бис(сульфоалкил)аминогруппу,сульфоалкоксигруппу,(сульфоалкил)сульфонильную группу или(сульфоалкил)аминосульфонильную группу и X' и Y' имеют одинаковые или различные значения и каждый обозначает группу формулы 54 3. Флуоресцентный контрастный агент для ближней инфракрасной области спектра, содержащий натриевую соль по любому из пп.1-2. 4. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по п.3,предназначенный для визуализации опухоли. 5. Флуоресцентный контрастный агент для ближней инфракрасной области спектра по п.3,предназначенный для ангиографии. 6. Натриевая соль по п.1, представляющая собой по крайней мере одно соединение, выбранное из группы, включающей соединения следующих формул: где R17 и R18 обозначают незамещенный низший алкил, содержащий от 1 до 5 атомов углерода. 2. Натриевая соль по п.1 формулы
МПК / Метки
МПК: A61K 49/00
Метки: флуоресцентной, флуоресцентный, агент, ближней, контрастный, инфракрасной, области, спектра, способ, визуализации
Код ссылки
<a href="https://eas.patents.su/29-4249-fluorescentnyjj-kontrastnyjj-agent-dlya-blizhnejj-infrakrasnojj-oblasti-spektra-i-sposob-fluorescentnojj-vizualizacii.html" rel="bookmark" title="База патентов Евразийского Союза">Флуоресцентный контрастный агент для ближней инфракрасной области спектра и способ флуоресцентной визуализации</a>
Предыдущий патент: Производные 4-, 5-, 6- и 7-замещенного индола и индолина, их получение и применение
Следующий патент: Терапевтический агент для диабета
Случайный патент: Способ лечения или предотвращения бактериальной респираторной или кишечной инфекции домашнего скота