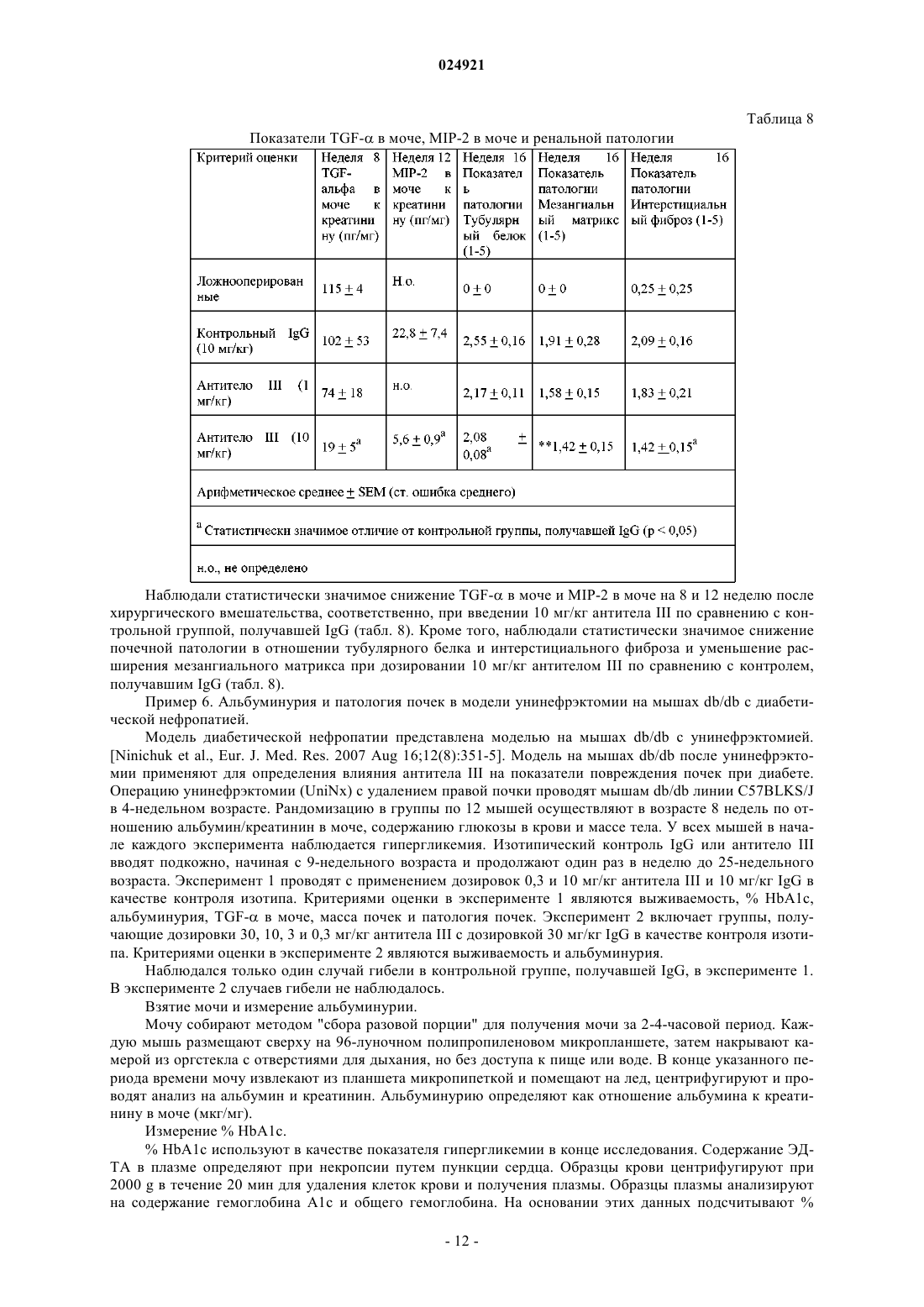
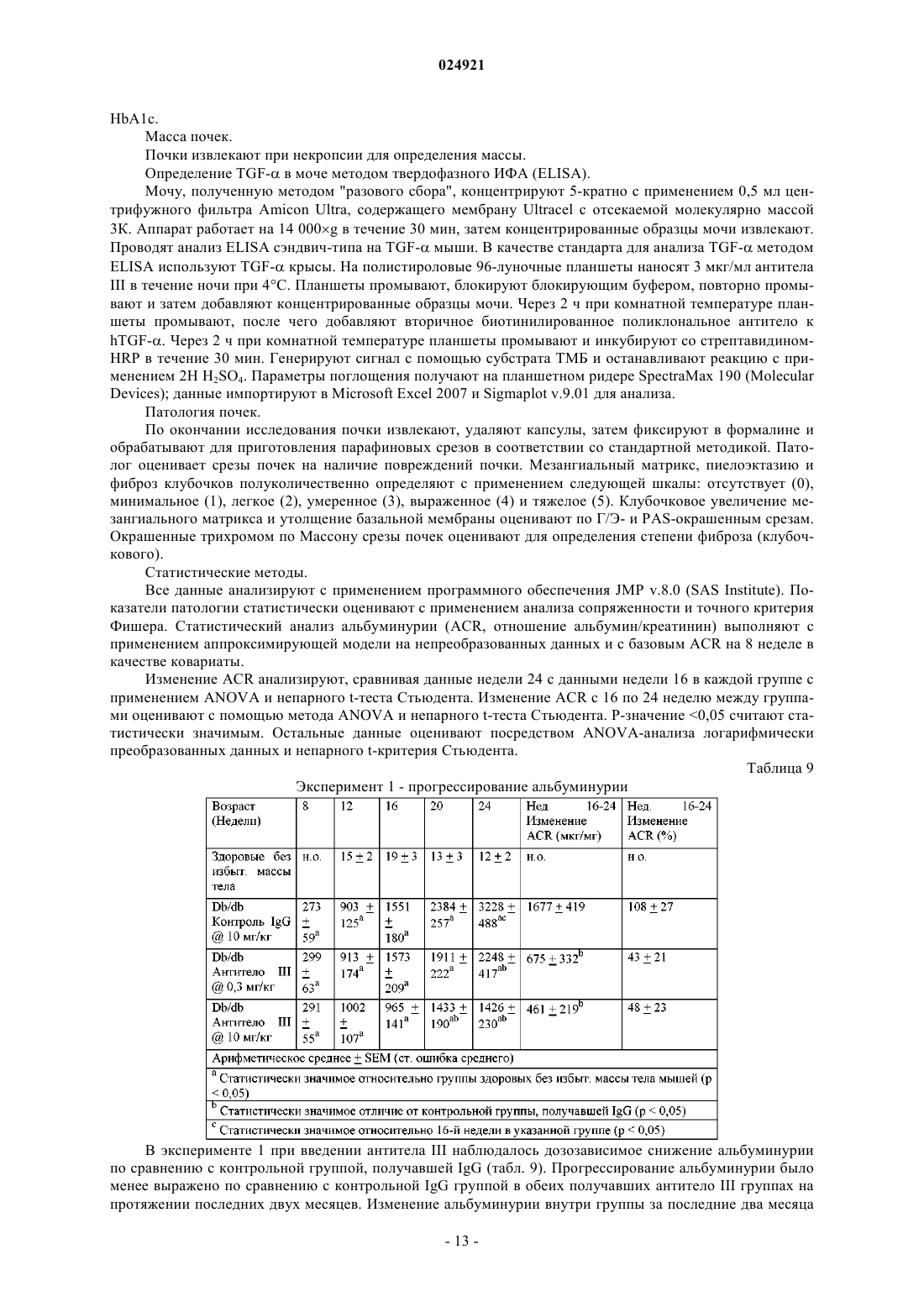
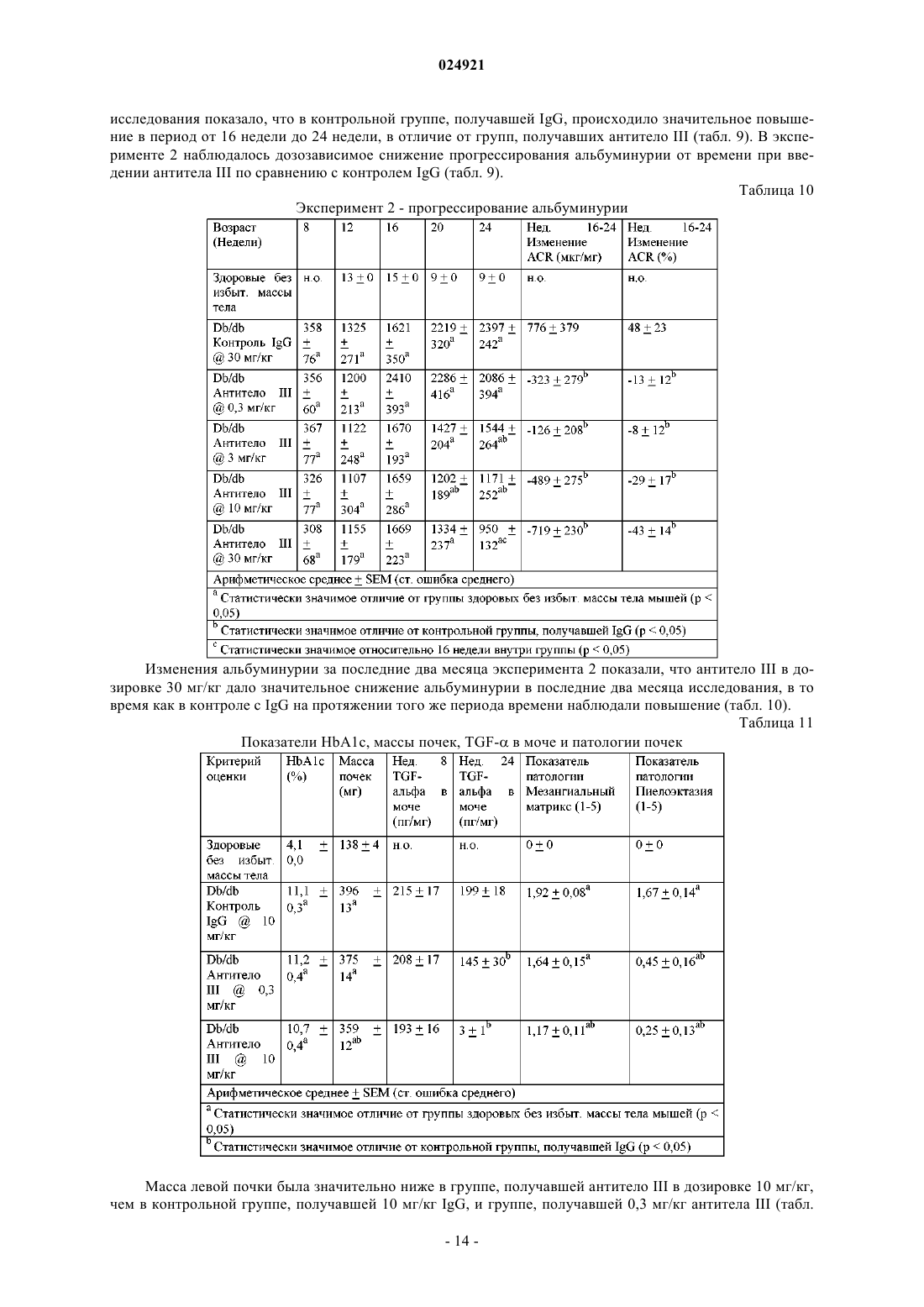
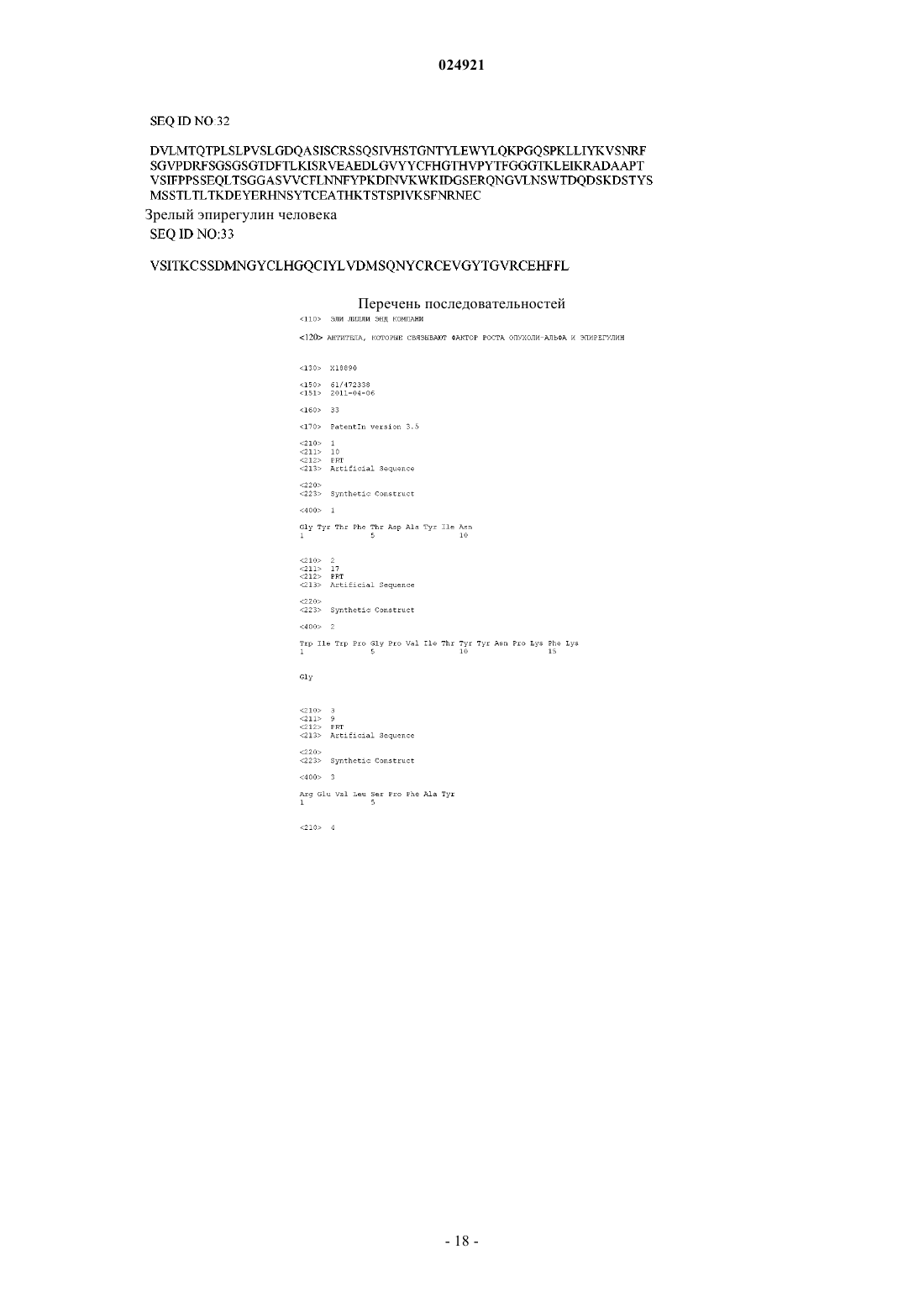
Антитела, которые связывают фактор роста опухоли-α и эпирегулин
Номер патента: 24921
Опубликовано: 30.11.2016
Авторы: Петрован Рамона Джудита, Хоер Джозеф Джордж, Бейдлер Кейтрин Бротингем
Формула / Реферат
1. Антитело, которое связывает фактор роста опухоли-α (TGF-α) и эпирегулин, содержащее легкую цепь и тяжелую цепь, отличающееся тем, что указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причем указанная LCVR содержит аминокислотные последовательности LCDR1, LCDR2 и LCDR3, и указанная HCVR содержит аминокислотные последовательности HCDR1, HCDR2 и HCDR3, и при этом LCDR1 представляет собой SEQ ID NO: 4, LCDR2 представляет собой SEQ ID NO: 5, LCDR3 представляет собой SEQ ID NO: 6, HCDR1 представляет собой SEQ ID NO: 1, HCDR2 представляет собой SEQ ID NO: 2, и HCDR3 представляет собой SEQ ID NO: 3.
2. Антитело по п.1, отличающееся тем, что последовательность аминокислот LCVR представляет собой SEQ ID NO: 9 или SEQ ID NO: 10.
3. Антитело по п.1 или 2, отличающееся тем, что последовательность аминокислот HCVR представляет собой SEQ ID NO: 7.
4. Антитело по любому из пп.1-3, отличающееся тем, что последовательность аминокислот LCVR представляет собой SEQ ID NO: 9, и последовательность аминокислот HCVR представляет собой SEQ ID NO: 7.
5. Антитело по любому из пп.1-4, отличающееся тем, что последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 13 или SEQ ID NO: 14.
6. Антитело по любому из пп.1-5, отличающееся тем, что последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 12.
7. Антитело по любому из пп.1-6, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 13, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12.
8. Антитело по любому из пп.1-3 или 5-6, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 14, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12.
9. Фармацевтическая композиция для лечения диабетической нефропатии, содержащая антитело по любому из пп.1-8 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
10. Способ лечения диабетической нефропатии у пациента, включающий введение указанному пациенту антитела по любому из пп.1-8.
11. Применение антитела по любому из пп.1-8 в терапии осложнений диабета.
12. Применение антитела по любому из пп.1-8 в лечении диабетической нефропатии.
13. Антигенсвязывающий фрагмент антитела по любому из пп.1-8.
14. Фармацевтическая композиция для лечения диабетической нефропатии, содержащая антигенсвязывающий фрагмент по п.13 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
15. Способ лечения диабетической нефропатии у пациента, включающий введение указанному пациенту антигенсвязывающего фрагмента по п.13.
16. Применение антигенсвязывающего фрагмента по п.13 в терапии осложнений диабета.
17. Применение антигенсвязывающего фрагмента по п.13 в лечении диабетической нефропатии.
Текст
АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ФАКТОР РОСТА ОПУХОЛИ- И ЭПИРЕГУЛИН В настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин человека и характеризующиеся высокой аффинностью, селективностью и высокой нейтрализующей способностью. Указанные антитела подходят для применения в лечении диабетической нефропатии. Бейдлер Кейтрин Бротингем, Хоер Джозеф Джордж, Петрован Рамона Джудита (US) Лыу Т.Н. (RU)(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Настоящее изобретение относится к антителам, которые связывают TGF- (фактор роста опухоли) человека и эпирегулин, и их применению.TGF- и эпирегулин представляют собой два из семи лигандов рецептора эпидермального фактора роста (EGFR), в норме функционирующих при заживлении раны после повреждения. Диабетическая нефропатия (ДН) представляет собой серьезное осложнение диабета и является основной причиной развития терминальной стадии почечной недостаточности (ESRD). Протеинурия представляет собой клинический маркер снижения функции почек, сопровождающей ДН, и связана с прогрессированием заболевания и повышенным риском сердечно-сосудистых заболеваний, таких как сердечная недостаточность,заболевания сосудов, дизритмия. Стандарт лечения ДН включает ингибиторы АПФ и блокаторы ангиотензиновых рецепторов (ARB/EAP), которые всего лишь замедляют прогрессирование заболевания и дают значительный остаточный риск. Блокирование EGFR уменьшает не только протеинурию, но и патологию почек в доклинических моделях заболеваний почек на животных. Тем не менее, ингибиторам EGFR, таким как ERBITUX, хотя они и одобрены для применения при раковых заболеваниях, сопутствуют побочные эффекты, например тяжелые кожные высыпания на лице и плечах, связанные с направленным ингибированием в коже. Таким образом, по-прежнему существует потребность в альтернативных методах терапии ДН. Кроме того,существует потребность в более эффективном терапевтическом лечении ДН. Описаны антитела, связывающие TGF- (например, см. US 5190858). Кроме того, описаны антитела, связывающие эпирегулин (например, см. US 2009/0324491). В настоящем изобретении предложены антитела к TGF- и эпирегулину для лечения ДН. Кроме того, в настоящем изобретении предложены антитела к TGF- и эпирегулину, которые захватывают мишень in vivo и, соответственно, приводят к уменьшению протеинурии с сопутствующим снижением прогрессирования заболевания и риска сердечно-сосудистых заболеваний. В настоящем изобретении предложены пригодные для применения в терапии антитела, связывающие как TGF-, так и эпирегулин, обладающие рядом желаемых качеств. Антитела согласно настоящему изобретению обладают высокой аффинностью и являются селективными, с полной нейтрализующей активностью в отношении TGF- человека и эпирегулина человека. Введение антитела согласно настоящему изобретению также приводит к снижению альбуминурии и почечной патологии, связанной с тубулярным белком, интерстициальным фиброзом, увеличением мезангиального матрикса и пиелоэктазии invivo. Кроме того, предпочтительные антитела согласно настоящему изобретению не вызывают видимой токсичности для кожи, связанной с полным ингибированием EGFR. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), а указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причемLCVR содержит аминокислотные последовательности LCDR1, LCDR2 и LCDR3, и HCVR содержит аминокислотные последовательности HCDR1, HCDR2 и HCDR3, где LCDR1 представляет собой SEQ IDNO: 4, LCDR2 представляет собой SEQ ID NO: 5, LCDR3 представляет собой SEQ ID NO: 6, HCDR1 представляет собой SEQ ID NO: 1, HCDR2 представляет собой SEQ ID NO: 2 и HCDR3 представляет собой SEQ ID NO: 3. Настоящее изобретение обеспечивает также фармацевтическую композицию, содержащую антитело согласно настоящему изобретению, описанное в настоящей заявке, и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Настоящее изобретение обеспечивает антитело согласно настоящему изобретению для применения,описанное в настоящей заявке, в лечении диабетической нефропатии. Везде в настоящем описании антитело согласно настоящему изобретению, описанное в настоящей заявке, связывает TGF- и эпирегулин и содержит легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), а указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причем LCVR содержит аминокислотные последовательности LCDR1, LCDR2 и LCDR3, и HCVR содержит аминокислотные последовательности HCDR1, HCDR2 и HCDR3, где LCDR1 представляет собой SEQ ID NO: 4, LCDR2 представляет собой SEQ ID NO: 5,LCDR3 представляет собой SEQ ID NO: 6, HCDR1 представляет собой SEQ ID NO: 1, HCDR2 представляет собой SEQ ID NO: 2 и HCDR3 представляет собой SEQ ID NO: 3. Настоящее изобретение обеспечивает антитело, описанное в настоящей заявке, отличающееся тем,что указанное антитело является селективным в отношении TGF- человека и эпирегулина человека. Также настоящее изобретение обеспечивает антитело, описанное в настоящей заявке, отличающееся тем,что указанное антитело обладает полной нейтрализующей активностью в отношении TGF- человека и эпирегулина человека. Далее настоящее изобретение предпочтительно относится к антителу, описанному в настоящей заявке, отличающемуся тем, что указанное антитело является селективным и обладает полной нейтрализующей активностью в отношении TGF- человека и эпирегулина человека. Настоящее изобретение обеспечивает антитело, описанное в настоящей заявке, отличающееся тем,что константа равновесия диссоциации указанного антитела, Kd, составляет от 0,0110-9 до 1,010-9 М для TGF- человека (SEQ ID NO: 18). В более предпочтительном варианте константа равновесия диссоциации антитела согласно настоящему изобретению, описанного в настоящей заявке, Kd, составляет от 0,0510-9 до 0,810-9 М для TGF- человека. Значения Kd определяют по равновесному связыванию при 25 С согласно описанию в примере 2. Настоящее изобретение обеспечивает также антитело, описанное в настоящей заявке, отличающееся тем, что константа равновесия диссоциации указанного антитела, Kd, составляет от 0,110-9 до 3010-9 М для метэпирегулина человека (SEQ ID NO: 22). В более предпочтительном варианте константа равновесия при диссоциации антитела согласно настоящему изобретению, описанного в настоящей заявке, Kd,составляет от 0,510-9 до 1010-9 М для эпирегулина человека. Значения Kd определяют по равновесному связыванию при 25 С согласно описанию в примере 2. Настоящее изобретение обеспечивает антитело, описанное в настоящей заявке, отличающееся тем,что константа равновесия диссоциации указанного антитела, Kd, составляет от 0,0110-9 до 1,010-9 M для TGF- человека (SEQ ID NO: 18) и от 0,110-9 до 3010-9 M для метэпирегулина человека (SEQ IDNO: 22). В более предпочтительном варианте константа равновесия при диссоциации антитела согласно настоящему изобретению, описанного в настоящей заявке, Kd, составляет от 0,0510-9 до 0,810-9 M дляTGF- человека и от 0,510-9 до 1010-9 M для эпирегулина человека. Значения Kd определяют по равновесному связыванию при 25 С согласно описанию в примере 2. В настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин и вызывающие дозозависимое уменьшение альбуминурии, снижение креатинина сыворотки и азота мочевины крови (АМК) in vivo в модели на мышах с частичной резекцией почек и в модели унинефрэктомии на мышах db/db согласно описанию в примере 5 и примере 6 соответственно. В настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин и вызывающие при патологии почек снижение тубулярного белка и интерстициального фиброза и уменьшение увеличения мезангиального матрикса и пиелоэктазии in vivo в модели на мышах с частичной резекцией почек и модели унинефрэктомии на мышах db/db согласно описанию в примере 5 и примере 6 соответственно. В настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин и предположительно способные приводить к уменьшению протеинурии с сопутствующим снижением прогрессирования заболевания и риска сердечно-сосудистых заболеваний у человека. Также в настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин, предположительно эффективные при лечении диабетической нефропатии у человека. В настоящем изобретении предложены антитела, связывающие TGF- человека и эпирегулин и не вызывающие наблюдаемой токсичности для кожи при исследовании токсичности у яванских макак согласно описанию в примере 7. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причемLCVR содержит аминокислотные последовательности LCDR1, LCDR2 и LCDR3, и HCVR содержит аминокислотные последовательности HCDR1, HCDR2 и HCDR3, где LCDR1 представляет собой SEQ IDNO: 4, LCDR2 представляет собой SEQ ID NO: 5, LCDR3 представляет собой SEQ ID NO: 6, HCDR1 представляет собой SEQ ID NO: 1, HCDR2 представляет собой SEQ ID NO: 2, и HCDR3 представляет собой SEQ ID NO: 3. Кроме того, настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR),причем последовательность аминокислот LCVR представляет собой SEQ ID NO: 9 или SEQ ID NO: 10. Настоящее изобретение обеспечивает также антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR),где последовательность аминокислот HCVR представляет собой SEQ ID NO: 7. Настоящее изобретение обеспечивает также антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR),причем последовательность аминокислот LCVR и последовательность аминокислот HCVR выбраны из группы, состоящей из(ii) LCVR представляет собой SEQ ID NO: 10, и HCVR представляет собой SEQ ID NO: 7. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причем последовательность аминокислот LCVR представляет собой SEQ ID NO: 9, а последовательность аминокислот HCVR представляет собой SEQ ID NO: 7. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), а указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR), причем последовательность аминокислот LCVR представляет собой SEQ ID NO: 10, а последовательность аминокислот HCVR представляет собой SEQ ID NO: 7. Кроме того, настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 13 или SEQ ID NO: 14. Настоящее изобретение обеспечивает также антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, причем последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 12. Кроме того, настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее легкую цепь и тяжелую цепь, при этом последовательность аминокислот тяжелой цепи и последовательность аминокислот легкой цепи выбраны из группы, состоящей из(i) тяжелая цепь представляет собой SEQ ID NO: 12, и легкая цепь представляет собой SEQ ID NO: 13, и(ii) тяжелая цепь представляет собой SEQ ID NO: 12, и легкая цепь представляет собой SEQ ID NO: 14. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ IDNO: 13, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12. Настоящее изобретение обеспечивает антитело, связывающее TGF- и эпирегулин, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ IDNO: 14, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12. Кроме того, в настоящем изобретении предложен антигенсвязывающий фрагмент антитела, описанного в настоящей заявке. В настоящем изобретении предложена также фармацевтическая композиция, содержащая антитело согласно настоящему изобретению, описанное в настоящей заявке, и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая антитело согласно настоящему изобретению, описанное в настоящей заявке, в комбинации по меньшей мере с одним фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом,и необязательно другими терапевтическими ингредиентами. В настоящем изобретении предложен также способ лечения диабетической нефропатии у пациента,включающий введение указанному пациенту предложенного в настоящем изобретении антитела, описанного в настоящей заявке. Кроме того, настоящее изобретение обеспечивает антитело согласно настоящему изобретению,описанное в настоящей заявке, для применения в терапии. Предпочтительно настоящее изобретение обеспечивает антитело согласно настоящему изобретению, описанное в настоящей заявке, для применения в лечении диабетической нефропатии. Кроме того, настоящее изобретение обеспечивает применение предложенного в настоящем изобретении антитела, описанного в настоящей заявке, для получения лекарственного средства для лечения диабетической нефропатии. Настоящее изобретение обеспечивает также способ лечения диабетической нефропатии у пациента,включающий введение указанному пациенту антитела согласно настоящему изобретению, описанного в настоящей заявке, в комбинации, одновременно или последовательно, со стандартом лечения. Кроме того, настоящее изобретение обеспечивает антитело согласно настоящему изобретению,описанное в настоящей заявке, для применения в терапии, причем указанное антитело применяют в комбинации, одновременно или последовательно, со стандартом лечения. В предпочтительном варианте настоящее изобретение обеспечивает антитело согласно настоящему изобретению, описанное в настоящей заявке, для применения в лечении диабетической нефропатии, причем указанное антитело прияеняют в комбинации, одновременно или последовательно, со стандартом лечения. Кроме того, настоящее изобретение обеспечивает применение предложенного в настоящем изобретении антитела, описанного в настоящей заявке, в получении лекарственного средства для лечения диабетической нефропатии, причем указанное антитело применяют в комбинации, одновременно или последовательно, со стандартом лечения. В настоящем изобретении предложена также фармацевтическая композиция, содержащая антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, в сочетании по меньшей мере с одним фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом и необязательно другими терапевтическими ингредиентами. В настоящем изобретении предложен также способ лечения диабетической нефропатии у пациента,включающий введение указанному пациенту антигенсвязывающего фрагмента предложенного в настоящем изобретении антитела, описанного в настоящей заявке. Кроме того, в настоящем изобретении предложен антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, для применения в терапии. Предпочтительно в настоящем изобретении предложен антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, для применения в лечении диабетической нефропатии. Кроме того, настоящее изобретение обеспечивает применение антигенсвязывающего фрагмента предложенного в настоящем изобретении антитела, описанного в настоящей заявке, для получения лекарственного средства для лечения диабетической нефропатии. В настоящем изобретении предложен также способ лечения диабетической нефропатии у пациента,включающий введение указанному пациенту антигенсвязывающего фрагмента антитела согласно настоящему изобретению, описанного в настоящей заявке, в комбинации, одновременно или последовательно, со стандартом лечения. Кроме того, в настоящем изобретении предложен антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, для применения в терапии, причем указанный антигенсвязывающий фрагмент применяют в комбинации, одновременно или последовательно, со стандартом лечения. Предпочтительно в настоящем изобретении предложен антигенсвязывающий фрагмент антитела согласно настоящему изобретению, описанного в настоящей заявке, для применения в лечении диабетической нефропатии, причем указанный антигенсвязывающий фрагмент применяют в комбинации, одновременно или последовательно, со стандартом лечения. Кроме того, настоящее изобретение обеспечивает применение антигенсвязывающего фрагмента антитела согласно настоящему изобретению, описанного в настоящей заявке, для получения лекарственного средства для лечения диабетической нефропатии, причем указанный антигенсвязывающий фрагмент применяют в комбинации, одновременно или последовательно, со стандартом лечения. Указанный стандарт лечения ДН включает, не ограничиваясь перечисленными, ингибиторы АПФ и блокаторы ангиотензиновых рецепторов (ARB, БРА). Общая структура антитела общеизвестна в данной области техники. Антитело типа IgG содержит четыре аминокислотные цепи (две тяжелые цепи и две легкие цепи), поперечно-сшитые внутри- и межцепочечными дисульфидными связями. При экспрессии в определенных биологических системах антитела, содержащие немодифицированные последовательности Fc человека, гликозилируются в Fcобласти. Антитела могут быть гликозилированы и по другим положениям. Структуры субъединиц и трехмерная конфигурации антител общеизвестны в данной области техники. Каждая тяжелая цепь состоит из N-концевой вариабельной области тяжелой цепи (HCVR) и константной области тяжелой цепи(HCCR). Указанная константная область тяжелой цепи состоит из трех доменов (CH1, CH2 и СН 3) у IgG,IgD и IgA; и 4 доменов (СН 1, СН 2, СН 3 и СН 4) у IgM и IgE. Каждая легкая цепь состоит из вариабельной области легкой цепи (LCVR) и константной области легкой цепи (LCCR). Вариабельные области каждой пары легкой/тяжелой цепей образуют сайт связывания антитела. Далее области HCVR и LCVR могут быть подразделены на области гипервариабельности, называемые гипервариабельными участками (CDR), перемежающимися с участками, которые являются более консервативными, называемыми каркасными участками (FR). Каждая HCVR и LCVR составлена тремя CDR и четырьмя FR, расположенными от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1,FR2, CDR2, FR3, CDR3, FR4. В настоящей заявке 3 CDR тяжелой цепи обозначены как CDRH1, CDRH2 и CDRH3, а 3 CDR легкой цепи обозначены как CDRL1, CDRL2 и CDRL3. CDR содержат большую часть остатков, образующих специфичные связи с антигеном. Отнесение каждой аминокислоты к определенному соответствует общепринятым правилам [например, Kabat, "Sequences of Proteins of ImmunologicalInterest", National Institutes of Health, Bethesda, Md. (1991)]. Антитело согласно настоящему изобретению может содержать константную область тяжелой цепи,выбранную из любого класса иммуноглобулинов (IgA, IgD, IgG, IgM и IgE). Кроме того, антитело согласно настоящему изобретению содержит фрагмент Fc, полученный из области Fc IgG4 человека, ввиду его сниженной способности к связыванию факторов комплемента по сравнению с другими подтипамиIgG. Антитело может быть получено из уникальной копии или клона, включая, например, любой эукариотический, прокариотический или фаговый клон. В предпочтительном варианте антитело согласно настоящему изобретению существует в виде гомогенной или, по существу, гомогенной популяции молекул антитела. Полноразмерное антитело содержит полноразмерные или, по существу, полноразмерные константные области, в том числе область Fc. Антигенсвязывающий фрагмент такого антитела представляет собой укороченную форму полноразмерного антитела, которая содержит антигенсвязывающий фрагмент и сохраняет способность к связыванию антигена. Такие укороченные формы включают, например, Fab-фрагмент, Fab'-фрагмент или F(ab')2-фрагмент, включающий CDR или вариабельные области описываемых антител. Кроме того, такие укороченные формы антител могут представлять собой одноцепочечный Fv-фрагмент, который может быть получен при соединении ДНК, кодирующей LCVR иHCVR, с линкерной последовательностью (см. Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315, 1994). Термин "антитело" не включает такие фрагменты, если не указано иное. Антитело согласно настоящему изобретению может быть получено с применением методов, общеизвестных в данной области техники, например рекомбинантной технологии, технологий фагового дисплея, технологий синтетического получения или комбинации таких технологий или других технологий, хорошо известных в данной области техники. Антитело согласно настоящему изобретению представляет собой искусственное антитело, сконструированное так, что оно содержит каркасные области, шарнирные области и константные области человеческого происхождения, которые идентичны или, по существу, идентичны каркасным областям и константным областям, полученным из геномных последовательностей человека (являются, по существу,человеческими). Полностью человеческие каркасные участки, шарнирные области и константные области представляют собой указанные последовательности зародышевой линии человека, а также последовательности с встречающимися в природе соматическими мутациями и последовательности с искусственными мутациями. Антитело согласно настоящему изобретению может содержать каркасные участки,шарнирные или константные области, полученные из полностью человеческих каркасного участка, шарнирной или константной области, содержащих одну или более замен, делеций или добавлений аминокислот. Также антитело согласно настоящему изобретению, по существу, неиммуногенно у человека. В качестве основы для предложенного в настоящем изобретении антитела может применяться ряд различных последовательностей каркасных участков человека по отдельности или в комбинации. Предпочтительно каркасные участки предложенного в настоящем изобретении антитела представляют собой участки человеческого происхождения или, по существу, являются человеческими (по меньшей мере на 95, 97 или 99% человеческого происхождения). Последовательности каркасных областей человеческого происхождения могут быть найдены в "The Immunoglobulin Factsbook", авторы Marie-Paule Lafranc,Gerard Lefranc, Academic Press 2001, ISBN 012441351. Каркасная последовательность для предложенного в настоящем изобретении антитела служит в качестве "донорной" вариабельного каркасного участка и может применяться для создания дополнительных антител с теми же CDR, указанными в настоящем описании, с применением методик, известных в данной области техники. Кроме того, каркасную последовательность для предложенного в настоящем изобретении антитела можно сравнить с другими известными каркасными последовательностями человека для синтеза дополнительных антител. Соответственно, эта информация может быть использована для "обратного мутагенеза" другого выбранного гомологичного каркасного участка человека к донорному аминокислотному остатку в этих положениях. Далее любые "редкие" аминокислоты могут быть обнаружены в дополнительных каркасных областях человека, таким образом, в соответствующем положении может быть использован консенсусный или донорный аминокислотный остаток."Эпирегулин" или "эпирегулин человека" относится к белку-эпирегулину человека (SEQ ID NO: 33). Метэпирегулин человека (SEQ ID NO: 22) согласно настоящей заявке применяют для экспериментовin vitro. Указания на способность предложенного в настоящем изобретении антитела, описанного в настоящей заявке, связывать или нейтрализовать эпирегулин человека относятся также и к их способности связывать и нейтрализовать метэпирегулин человека в экспериментах in vitro."Пациент" представляет собой млекопитающее, предпочтительно человека. Термин "лечение" (или "лечить") означает замедление, остановку, снижение или обращение прогрессирования или тяжести симптома, расстройства, состояния или заболевания. Термин "терапевтически эффективное количество" относится к количеству или дозе антитела согласно настоящему изобретению, которое(ая) обеспечивает необходимое лечение при однократном или многократном введении дозы пациенту. Следующие примеры могут быть осуществлены, по существу, как описано ниже. Примеры Пример 1. Получение антител. Антитела I и II могут быть получены и очищены следующим образом. Подходящую клетку-хозяина, такую как HEK 293 или СНО, транзиентно или стабильно трансфицируют экспрессионной системой для секреции антител с применением оптимального предварительно определенного соотношения векторов HC:LC или системы с одним вектором, кодирующей и НС, например SEQ ID NO: 15, и LC, например SEQ ID NO: 16 или SEQ ID NO: 17. Осветленные среды, в которые секретировано антитело, очищают с применением любой из множества рутинно используемых методик. Например, среда может быть легко помещена в колонку с белком А или G, уравновешенную подходя-5 024921 щим буфером, таким как фосфатный буферный раствор (рН 7,4). Колонку отмывают для удаления неспецифически связывающихся компонентов. Связанное антитело элюируют, например, в градиенте рН(например, в 0,1 М натрий-фосфатном буфере рН 6,8 - 0,1 М натрий-цитратном буфере рН 2,5). Фракции антитела регистрируют, например, посредством ДСН-ПААГ-электрофореза, а затем смешивают. Дальнейшую очистку проводят (но не обязательно), в зависимости от предполагаемого использования. Антитело может быть подвергнуто концентрированию и/или подвергают фильтрации с применением обычных методов. Растворимые агрегаты и мультимеры могут быть эффективно удалены с применением обычных методик, в том числе эксклюзионную хроматографию, с хроматографию гидрофобного взаимодействия, ионообменной хроматографии или хроматографии с гидроксиапатитом. Чистота антитела после указанных этапов хроматографии составляет более 99%. Продукт может быть немедленно заморожен при -70 С или лиофилизован. Аминокислотные последовательности этих антител приведены ниже. Пример 2. Оценка связывающей способности антитела I с применением поверхностного плазмонного резонанса (BIAcore). Для анализа методом поверхностного плазмонного резонанса применяют аппаратуру Biacore T2000(BIAcore AB, Упсала, Швеция), реагенты и программное обеспечение для анализа Biacore T2000 Evaluation Software Ver 4.1. Чип СМ 5 получают с применением предлагаемого производителем способа аминного сочетания EDC/NHS. Поверхности всех четырех проточных ячеек активируют введением смеси 1:1EDC/NHS в течение 7 мин со скоростью 10 мкл/мин. Специфическое антитело козы к Fc человека разводят до 50 мкг/мл в 10 мМ ацетатном буфере с рН 4,0 и иммобилизуют до уровня приблизительно 10000RU (резонансных единиц) на всех четырех проточных ячейках путем инжекции на протяжении 7 мин со скоростью потока 10 мкл/мин. Непрореагировавшие участки блокируют введением этаноламина на протяжении 7 мин со скоростью 10 мкл/мин. Для удаления нековалентно связанного белка вводят глицин (рН 1,5), 320 с, со скоростью 30 мкл/мин. В качестве подвижного буфера используют HBS-EP [10 мМ HEPES, 150 мМ хлорида натрия, 3 мМ ЭДТА, 0,005% полисорбата 20]. В эксперименте 1 антитело I разводят до 50 мкг/мл в подвижном буфере, и в проточной ячейке 2 регистрируется приблизительно 400-600 RU. TGF- человека (SEQ ID NO: 18), TGF- крысы (SEQ ID NO: 20), метэпирегулин человека (SEQ ID NO: 22) и эпирегулин яванского макака (SEQ ID NO: 24) разводят от 100 мкг/мл до 200 нМ в подвижном буфере и затем готовят серию двукратных развдений в подвижном буфере до 6,25 нМ. Эпирегулин мыши (SEQ ID NO: 23) разводят от 100 мкг/мл до 4 мкМ в подвижном буфере и готовят серию двукратных развдений в подвижном буфере до 125 нМ. Повторную инжекцию каждой концентрации лиганда проводят со скоростью 30 мкл/мин в течение 300 с, затем следует фаза диссоциации. Фаза диссоциации длится 1800 с для TGF- человека и крысы, 1200 с для эпирегулина человека и яванского макака и 120 с для эпирегулина мыши. Регенерацию осуществляют введением 10 мМ глицина с рН 1,5, 320 с, со скоростью 30 мкл/мин над всей проточной ячейкой. В эксперименте 2 антитело III разводят до 100 мкг/мл в подвижном буфере, и в проточной ячейке 2 регистрируется приблизительно 400-600 RU. TGF- мыши (SEQ ID NO: 19) разводят от 100 мкг/мл до 200 нМ в подвижном буфере и затем готовят серию двукратных разведений в подвижном буфере до 6,25 нМ. Эпирегулин мыши (SEQ ID NO: 23) разводят от 100 мкг/мл до 4 мкМ в подвижном буфере и затем готовят серию двукратных разведений в подвижном буфере до 125 нМ. Повторную инжекцию каждой концентрации лиганда проводят со скоростью 30 мкл/мин в течение 300 с, затем следует фаза диссоциации. Фаза диссоциации длится 1800 с для TGF- мыши и 120 с для эпирегулина мыши. Регенерацию осуществляют введением 10 мМ глицина с рН 1,5 на протяжении 30 с со скоростью 30 мкл/мин над всей проточной ячейкой. Данные с вычтенным контролем получают как Fc2-Fcl. Измерения проводят при 25 С. Скорость ассоциации (kon) и скорость диссоциации (koff) для каждого лиганда оценивают с применением модели связывания "связывание 1:1" (Langmuir). Аффинность (KD) рассчитывают исходя из кинетики связывания в соответствии с соотношением: KD = koff/kon. Таблица 1 Параметры связывания антитела I Таблица 2 Параметры связывания антитела III Антитело I связывается с TGF- человека и эпирегулином человека с аффинностью, составляющей приблизительно 98 пМ и 1,3 нМ соответственно. Антитело I также связывается с TGF- крысы и эпирегулином мыши с аффинностью, составляющей приблизительно 70 пМ и 340 нМ соответственно. Кроме того, антитело I связывается с эпирегулином яванского макака с аффинностью, составляющей приблизительно 1 нМ. Антитело III связывается с TGF- мыши и эпирегулином мыши с аффинностью, составляющей приблизительно 38 пМ и 220 нМ соответственно. Таким образом, антитело I и антитело III согласно настоящему изобретению обладают высокой аффинностью в отношении TGF- человека и эпирегулину человека. Пример 3. Интернализация целевых лигандов EGF клетками линии НТ-29 карциномы толстой кишки человека. Конъюгирование Alexa Fluor 488 с антителами.Alexa Fluor 488 конъюгируют с антителом I и контрольным IgG в соответствии с протоколом производителя. Белок разводят до 2 мг/мл в ФСБ. К 0,5 мл указанного 2 мг/мл раствора добавляют 50 мл 1 М бикарбоната натрия с рН 9. Затем белковый раствор переносят в сосуд с красителем и перемешивают при комнатной температуре в течение 1 ч. Меченый белок очищают с применением смолы Bio-Rad BioGel Р 30, входящей в состав набора для мечения. Анализ интернализации in vitro. В эксперименте 1 по 10000 клеток НТ-29, клеточной линии карциномы толстой кишки, которые,как известно, экспрессируют TGF- и эпирегулин, высевают в лунки 96-луночную планшету и инкубируют в течение ночи в полной среде [модифицированная по Дульбекко среда Игла/среда F12 (Хэма) (1:1)(DMEM/F12), содержащей L-глутамин, 10% термоинактивированной эмбриональной бычьей сыворотки(ЭБС), 1 антибиотик и 2,438 г/л бикарбоната натрия]. На следующий день клетки промывают ФСБ, содержащим 0,1% БСА, и затем инкубируют с Alexa Fluor 488-конъюгированным антителом I или контрольным IgG в ФСБ с 0,1% БСА в концентрациях, варьирующих от 0 до 88 мкг/мл, в течение 2 ч при 37 С в инкубаторе для клеточных культур. После периода инкубирования клетки несколько раз промы-7 024921 вают ФСБ с 0,1% БСА и затем фиксируют в 4% формальдегиде для анализа. Количественное определение интернализации выполняют следующим образом: отбирают 500 клеток/лунку с помощью CellomicsArrayscan VTI (Thermo Scientific). Анализ изображений осуществляют с применением биологических приложений системы для "компартментализационного анализа". Ядра клеток идентифицируют методомHoechst-окрашивания (синий). Настраивают две области выделения (ROI) для регистрации флуоресцентных сигналов от внутриклеточных областей (красной) и общей зеленой флуоресценции (красной и синей) от изображения с наложенной маской. Подсчитывают число, площадь и интенсивность флуоресценции каждого пятна и клетки. Среднюю общую интенсивность флуоресценции внутриклеточных пятен(красной) используют для измерения индуцированной антителом 1 интернализации. В эксперименте 2 10000 клеток НТ-29 подготавливают согласно приведенному ранее описанию и в клетки добавляют в количестве 40 мкг/мл Alexa Fluor 488-конъюгированное(ый) антитело I или контрольный IgG в ФСБ, содержащем 0,1% БСА. Клетки инкубируют при 37 С в инкубаторе для клеточных культур в течение различного времени, варьирующего от 0 до 120 мин, затем несколько раз промывают ФСБ, содержащим 0,1% БСА, и фиксируют в 4% формальдегиде для анализа. Количественное определение сигнала выполняют в основном согласно приведенному выше описанию. Таблица 3 а Эксперимент 1 - средняя общая интенсивность флуоресценции кольцевого пятна Таблица 3b Эксперимент 1 - средняя общая интенсивность флуоресценции кольцевого пятна Результаты анализа изображений из эксперимента 1 показали, что флуоресцентный сигнал интернализировался клетками и был дозозависимым при введении антитела I, но не контрольного IgG (табл. 3 а и 3b). Таблица 4 Эксперимент 2 - средняя общая интенсивность флуоресценции кольцевого пятна Результаты эксперимента 2 показали, что антитело I быстро интернализировалось, и через 2 ч после добавления к клеткам интернализация завершалась полностью (табл. 4). Антитело I индуцировало интернализацию мишени на клетках НТ-29 in vitro с временной зависимостью (табл. 4). Пример 4. Измерение нейтрализации стимулированной лигандами EGFR пролиферации клеток клеточной линии миофибробластов. Клонированную клеточную линию миофибробластов мыши (MFc7) применяют для тестирования способности антител согласно настоящему изобретению блокировать пролиферативную активность лигандов EGFR. Семь лигандов, способных активировать EGFR, представлены TGF- (TGFA), эпирегулином (EREG), EGF, гепаринсвязывающим EGF (FIB-EGF), эпигеном (EPGN), амфирегулином (AREG) и бетацеллюлином (ВТС). Указанные лиганды EGFR имеют общий структурный мотив, EGF-подобный домен, характеризующийся тремя внутримолекулярными дисульфидными связями, образованными шестью располагающимися на одинаковом расстоянии консервативными остатками цистеина. Пролиферативную активность определяют по включению бромдезоксиуридина (BrDU) и измеряют с помощью колориметрического BrDU-набора для ИФА в соответствии с инструкциями производителя. Сначала 2000 MFc7 клеток/лунку помещают в подготовленный для тканевых культур 96-луночный микропланшет с 0,1 мл модифицированной по Дульбекко среды Игла/среды F12 (Хэма) (1:1)(DMEM/F12), содержащей L-глутамин, 10% термоинактивированной ЭБС, 1 антибиотика и 2,438 г/л бикарбоната натрия. Клетки оставляют для прикрепления на 6 ч, затем среду удаляют и заменяют 0,1 мл бессывороточной DMEM/F12, содержащей 0,1% БСА, для сывороточного голодания в течение ночи. На следующий день готовят серийные разведения лигандов EGFR с применением бессывороточной среды,содержащей 0,1% БСА, в 96-луночных полипропиленовых планшетах в объеме 0,12 мл/лунку, из концентраций, варьирующих от 0,001 до 3000 нг/мл. После разведений среду из клеток с сывороточным голоданием удаляют и затем стимулируют лигандом EGFR в течение 24 ч. После стимуляции клетки нагружают BrDU на протяжении 4 ч и затем анализируют с помощью колориметрического набора BrDU для ИФА в соответствии с инструкциями производителя. При проверке специфичности антитела I в отношении лигандов EGFR готовят 2 или 3 серийные разведения указанного антитела в 96-луночных полипропиленовых планшетах в объеме 0,06 мл/лунка из концентраций, варьирующих от 3000 до 0,059 нМ. После серийного разведения добавляют антитела 0,06 мл лиганда EGFR на лунку. Затем планшет инкубируют при 37 С в инкубаторе для культур тканей с увлажнением на протяжении 30 мин. После инкубирования раствор переносят в клетки по 0,1 мл на лунку. Клетки стимулируют на протяжении 24 ч. После стимуляции клетки нагружают BrDU в течение 4 ч и затем анализируют с помощью колориметрического набора BrDU для ИФА. На планшетном ридереSpectraMax 190 (Molecular Devices) получают значения поглощающей способности (450-690 нМ) и анализируют данные. Таблица 5 Анализ MFc7 В этом анализе обнаружено, что эпирегулин мыши и TGF- крысы, а также все лиганды EGFR человека, кроме эпигена и амфирегулина, являются эффективными стимуляторами пролиферации клеток(табл. 5). Антитело I и антитело III обладают высоким сродством (аффинностью) к TGF- человека и крысы и эпирегулину человека (табл. 5). В табл. 5 обобщены рассчитанные значения ЕС 50 для протестированных лигандов EGFR и абсолютные значения IC50 для антител к указанным лигандам. Рассчитанное среднее значение IC50 для антитела I составило 0,460,03 нМ в отношении TGF- человека и 3,151,04 нМ в отношении эпирегулина человека. Рассчитанное среднее значение IC50 для антитела III составило 0,520,04 нМ в отношении TGF- человека и 1,120,36 нМ в отношении эпирегулина человека. Рассчитанное среднее значение IC50 для антитела III составило 0,130,01 нМ в отношении TGF- крысы и 21449 нМ в отношении эпирегулина мы-9 024921 ши. Таким образом, антитело I и антитело III обладают высокой аффинностью и селективны с полной нейтрализующей активностью в отношении TGF- человека и эпирегулина человека. Пример 5. Почечная функция и патология в модели гипертонической болезни почек у мышей с остаточными почками. В качестве доклинической модели гипертонической болезни почек используют мышиную модель с частичной резекцией почек, включающую хирургическое удаление 75% общей массы почек. [Ma L.J.,Fogo A.B. Kidney Int. 2003 Jul; 64(1):350-5]. Хирургическое удаление почечной массы или ложную операцию проводят самцам мышей 129 Svev в возрасте 9-10 недель. Рандомизацию в группы по 12 мышей проводят через 2 недели после хирургического вмешательства по отношению альбумин/креатинин в моче (ACR) и массе тела. Изотипический контрольный IgG (10 мг/кг) или антитело III (1 и 10 мг/кг) вводят подкожно после рандомизации и продолжают вводить один раз в неделю до 16 недели после хирургического вмешательства. Оцениваемыми параметрами в исследовании являются выживаемость, систолическое давление крови, альбуминурия, креатинин сыворотки, АМК сыворотки, TGF- в моче, MIP-2 в моче и патология почек. К концу исследования отмечено 3 случая гибели в контрольной группе, получавшей IgG (25% смертность), и не отмечено случаев гибели в экспериментальных группах, получавших антитело III. Измерение систолического давления крови. Кровяное давление измеряют через 12 недель после хирургического вмешательства с помощью хвостовой манжеты. Отобранных мышей из каждой группы (N = 3-4 на группу) приучают к фиксации,помещая ежедневно на 5 мин в держатель для мышей, с закрепленной хвостовой манжетой, за 3-5 дней до измерения. Температуру в аппаратном помещении повышали до 24 С, чтобы обеспечить дополнительное тепло во время процесса измерения кровяного давления. Мышей помещают в фиксатор для мышей и устанавливают на площадку для прогрева (31-33 С) для обеспечения расширения сосудов хвоста. Хвост продевают в хвостовую манжету и каждую мышь фиксируют на время около 30 мин, но не более 45 мин. Указанное время включает начальное прогревание, измерение давления и последующее немедленное возвращение в место обычного содержания. Анестезию не используют. Хвостовую манжету надувают, сдавливая хвост достаточно сильно для моментальной остановки артериального кровотока, и затем постепенно ослабляют, сдувая воздух, для определения возвращения артериального пульса. При появлении артериального пульса манжету полностью сдувают. Измерение альбуминурии. Мочу собирают каждые 4 недели в метаболических клетках Nalgene на протяжении периода времени в 24 ч. Каждая мышь (размещенная отдельно) получает пищу и воду на протяжении 24-часового периода сбора мочи. В конце 24-часового периода собранную мочу помещают на лед, центрифугируют и проводят анализ на альбумин и креатинин. Альбуминурию определяют как отношение альбумина к креатинину в моче (мкг/мг). Креатинин и АМК в сыворотке. По окончании исследования сыворотку, полученную путем пункции сердца, исследуют на АМК и креатинин. ИФА-анализ (ELISA) TGF- и MIP-2. Мочу, полученную за 24 ч, концентрируют в 5 раз центрифугированием на мембране с отсекаемой молекулярной массой 3 К при 14 000g в течение 30 мин. Проводят твердовазный иммноферментный анализ в модификации сэндвич (ELISA) на TGF- мыши. В качестве стандарта используют TGF- крысы. На полистироловые 96-луночные планшеты наносят 3 мкг/мл антитела III в течение ночи при 4 С. Планшеты промывают, блокируют блокирующим буфером, повторно промывают и затем добавляют концентрированные образцы мочи. Через 2 ч при комнатной температуре планшеты промывают, затем добавляют вторичное биотинилированное поликлональное антитело к hTGF-. Через 2 ч при комнатной температуре планшеты промывают и инкубируют со стрептавидином-пероксидазой хрена в течение 30 мин. С использованием субстрата ТМБ генерируют сигнал и останавливают реакцию 2 Н H2SO4. Для обнаружения MIP-2 в моче применяют коммерческий набор для сэндвич-ИФА Quantikine для макрофагального белка воспаления-2 мыши (MIP-2, эквивалент IL-8 человека) в соответствии с инструкциями производителя. Параметры поглощения для обоих анализов ELISA определяют на планшетном ридереSpectraMax 190 (Molecular Devices) и анализируют данные. Патология почек. Остатки почек извлекают по окончании исследования, фиксируют в формалине и обрабатывают для приготовления парафиновых срезов в соответствии со стандартной методикой. Патолог оценивает срезы почек на наличие повреждений почек. Тубулярный белок, увеличение мезангиального матрикса и интерстициальный фиброз полуколичественно определяют с применением следующей шкалы: отсутствует (0),минимальное (1), легкое (2), умеренное (3), выраженное (4) и тяжелое (5). Клубочковое расширение мезангиального матрикса и утолщение базальной мембраны оценивают по срезам, окрашенным гематоксилином/эозином (Г/Э) и реактивом Шиффа (PAS/IIMK). Окрашенные трихромом по Массону срезы почек оценивают для определения степени фиброза (интерстициального и клубочкового). Статистические методы. Все данные анализируют с использованием программного обеспечения JMP v.8.0 (SAS Institute). Показатели патологии статистически оценивают с применением анализа сопряженности и точного критерия Фишера. Остальные данные оценивают посредством вариационного анализа ANOVA логарифмически преобразованных данных и непарного t-критерия Стьюдента. Р-значение 0,05 считают статистически значимым. Таблица 6 Прогрессирование альбуминурии с течением времени Наблюдали дозозависимое снижение альбуминурии при введении антитела III по сравнению с контрольной группой, получавшей IgG (табл. 6). Лечение антителом III в дозировке 10 мг/кг приводило к значительному снижению альбуминурии на 8 и 12 неделе после хирургического вмешательства относительно контрольной группы, получавшей IgG, но не на 2, 4 или 16 неделе (табл. 6). Таблица 7 Систолическое давление крови, креатинин и АМК сыворотки Влияния антитела III на систолическое давление крови не наблюдалось, так как во всех группах наблюдалось гипертензия через 12 недель после хирургического вмешательства (табл. 7). Кроме того, лечение антителом III в дозировке 10 мг/кг не приводило к улучшению почечной функции, что видно по значительному снижению креатинина сыворотки и АМК относительно контрольной группы, получавшей Наблюдали статистически значимое снижение TGF- в моче и MIP-2 в моче на 8 и 12 неделю после хирургического вмешательства, соответственно, при введении 10 мг/кг антитела III по сравнению с контрольной группой, получавшей IgG (табл. 8). Кроме того, наблюдали статистически значимое снижение почечной патологии в отношении тубулярного белка и интерстициального фиброза и уменьшение расширения мезангиального матрикса при дозировании 10 мг/кг антителом III по сравнению с контролем,получавшим IgG (табл. 8). Пример 6. Альбуминурия и патология почек в модели унинефрэктомии на мышах db/db с диабетической нефропатией. Модель диабетической нефропатии представлена моделью на мышах db/db с унинефрэктомией.[Ninichuk et al., Eur. J. Med. Res. 2007 Aug 16;12(8):351-5]. Модель на мышах db/db после унинефрэктомии применяют для определения влияния антитела III на показатели повреждения почек при диабете. Операцию унинефрэктомии (UniNx) с удалением правой почки проводят мышам db/db линии C57BLKS/J в 4-недельном возрасте. Рандомизацию в группы по 12 мышей осуществляют в возрасте 8 недель по отношению альбумин/креатинин в моче, содержанию глюкозы в крови и массе тела. У всех мышей в начале каждого эксперимента наблюдается гипергликемия. Изотипический контроль IgG или антитело III вводят подкожно, начиная с 9-недельного возраста и продолжают один раз в неделю до 25-недельного возраста. Эксперимент 1 проводят с применением дозировок 0,3 и 10 мг/кг антитела III и 10 мг/кг IgG в качестве контроля изотипа. Критериями оценки в эксперименте 1 являются выживаемость, % HbA1c,альбуминурия, TGF- в моче, масса почек и патология почек. Эксперимент 2 включает группы, получающие дозировки 30, 10, 3 и 0,3 мг/кг антитела III с дозировкой 30 мг/кг IgG в качестве контроля изотипа. Критериями оценки в эксперименте 2 являются выживаемость и альбуминурия. Наблюдался только один случай гибели в контрольной группе, получавшей IgG, в эксперименте 1. В эксперименте 2 случаев гибели не наблюдалось. Взятие мочи и измерение альбуминурии. Мочу собирают методом "сбора разовой порции" для получения мочи за 2-4-часовой период. Каждую мышь размещают сверху на 96-луночном полипропиленовом микропланшете, затем накрывают камерой из оргстекла с отверстиями для дыхания, но без доступа к пище или воде. В конце указанного периода времени мочу извлекают из планшета микропипеткой и помещают на лед, центрифугируют и проводят анализ на альбумин и креатинин. Альбуминурию определяют как отношение альбумина к креатинину в моче (мкг/мг). Измерение % HbA1c.% HbA1c используют в качестве показателя гипергликемии в конце исследования. Содержание ЭДТА в плазме определяют при некропсии путем пункции сердца. Образцы крови центрифугируют при 2000 g в течение 20 мин для удаления клеток крови и получения плазмы. Образцы плазмы анализируют на содержание гемоглобина A1c и общего гемоглобина. На основании этих данных подсчитывают %HbA1c. Масса почек. Почки извлекают при некропсии для определения массы. Определение TGF- в моче методом твердофазного ИФА (ELISA). Мочу, полученную методом "разового сбора", концентрируют 5-кратно с применением 0,5 мл центрифужного фильтра Amicon Ultra, содержащего мембрану Ultracel с отсекаемой молекулярно массой 3 К. Аппарат работает на 14 000g в течение 30 мин, затем концентрированные образцы мочи извлекают. Проводят анализ ELISA сэндвич-типа на TGF- мыши. В качестве стандарта для анализа TGF- методомIII в течение ночи при 4 С. Планшеты промывают, блокируют блокирующим буфером, повторно промывают и затем добавляют концентрированные образцы мочи. Через 2 ч при комнатной температуре планшеты промывают, после чего добавляют вторичное биотинилированное поликлональное антитело кhTGF-. Через 2 ч при комнатной температуре планшеты промывают и инкубируют со стрептавидиномHRP в течение 30 мин. Генерируют сигнал с помощью субстрата ТМБ и останавливают реакцию с применением 2 Н H2SO4. Параметры поглощения получают на планшетном ридере SpectraMax 190 (MolecularDevices); данные импортируют в Microsoft Excel 2007 и Sigmaplot v.9.01 для анализа. Патология почек. По окончании исследования почки извлекают, удаляют капсулы, затем фиксируют в формалине и обрабатывают для приготовления парафиновых срезов в соответствии со стандартной методикой. Патолог оценивает срезы почек на наличие повреждений почки. Мезангиальный матрикс, пиелоэктазию и фиброз клубочков полуколичественно определяют с применением следующей шкалы: отсутствует (0),минимальное (1), легкое (2), умеренное (3), выраженное (4) и тяжелое (5). Клубочковое увеличение мезангиального матрикса и утолщение базальной мембраны оценивают по Г/Э- и PAS-окрашенным срезам. Окрашенные трихромом по Массону срезы почек оценивают для определения степени фиброза (клубочкового). Статистические методы. Все данные анализируют с применением программного обеспечения JMP v.8.0 (SAS Institute). Показатели патологии статистически оценивают с применением анализа сопряженности и точного критерия Фишера. Статистический анализ альбуминурии (ACR, отношение альбумин/креатинин) выполняют с применением аппроксимирующей модели на непреобразованных данных и с базовым ACR на 8 неделе в качестве ковариаты. Изменение ACR анализируют, сравнивая данные недели 24 с данными недели 16 в каждой группе с применением ANOVA и непарного t-теста Стьюдента. Изменение ACR с 16 по 24 неделю между группами оценивают с помощью метода ANOVA и непарного t-теста Стьюдента. Р-значение 0,05 считают статистически значимым. Остальные данные оценивают посредством ANOVA-анализа логарифмически преобразованных данных и непарного t-критерия Стьюдента. Таблица 9 Эксперимент 1 - прогрессирование альбуминурии В эксперименте 1 при введении антитела III наблюдалось дозозависимое снижение альбуминурии по сравнению с контрольной группой, получавшей IgG (табл. 9). Прогрессирование альбуминурии было менее выражено по сравнению с контрольной IgG группой в обеих получавших антитело III группах на протяжении последних двух месяцев. Изменение альбуминурии внутри группы за последние два месяца исследования показало, что в контрольной группе, получавшей IgG, происходило значительное повышение в период от 16 недели до 24 недели, в отличие от групп, получавших антитело III (табл. 9). В эксперименте 2 наблюдалось дозозависимое снижение прогрессирования альбуминурии от времени при введении антитела III по сравнению с контролем IgG (табл. 9). Таблица 10 Эксперимент 2 - прогрессирование альбуминурии Изменения альбуминурии за последние два месяца эксперимента 2 показали, что антитело III в дозировке 30 мг/кг дало значительное снижение альбуминурии в последние два месяца исследования, в то время как в контроле с IgG на протяжении того же периода времени наблюдали повышение (табл. 10). Таблица 11 Показатели HbA1c, массы почек, TGF- в моче и патологии почек Масса левой почки была значительно ниже в группе, получавшей антитело III в дозировке 10 мг/кг,чем в контрольной группе, получавшей 10 мг/кг IgG, и группе, получавшей 0,3 мг/кг антитела III (табл. 11). Наблюдали значительное снижение TGF- в моче на протяжении эксперимента в группе, получавшей антитело III в дозировке 10 мг/кг (табл. 11). Кроме того, % HbA1c во всех экспериментальных группах был значительно повышен по сравнению с контрольной группой мышей без избыточной массы тела(табл. 11). Лечение антителом III не оказывало влияния на % HbA1c по сравнению с контрольной группой, получавшей IgG (табл. 11). Кроме того, наблюдалось значительное снижение уровней патологии почек в отношении расширения мезангиального матрикса и пиелоэктазии при введении 10 мг/кг антитела III по сравнению с контролем IgG (табл. 11). Пример 7. Исследование токсичности и токсикокинетики у яванских макак, получавших еженедельные внутривенные болюсные инъекции в течение 6 недель. Токсикологическое исследование длительностью 6 недель проводят на обезьянах, чтобы определить, приводит ли ингибирование TGF- и эпирегулина к токсичности для кожи. Обезьянам внутривенно инъецируют носитель, 10 или 100 мг/кг антитела I (IV) еженедельно на протяжении 6 недель. В качестве места инъекции поочередно используют правую и левую подкожные вены. Пища предоставляется дважды в день (один раз утром и один раз днем). В дни введения дозы утренняя порция пищи предоставляется в скором времени после введения. Добавки и лакомства с высоким содержанием кальция во время эксперимента не дают. Один раз в неделю по субботам дают детские мультивитамины (после взятия образцов крови через 96 ч после дозирования, в уместных случаях). На протяжении эксперимента обезьяны находятся в стальных решетчатых/сетчатых клетках с разделяющей перегородкой для пары животных. В первые три недели животных размещают поодиночке. На протяжении оставшегося периода исследования животных размещают попарно внутри групп, ежедневно с дневного периода и до утра следующего дня, для обеспечения дополнительной возможности социализации. Уровень, не вызывающий видимых неблагоприятных воздействий (NOAEL), в этом эксперименте составил 100 мг/кг антитела I. У получавших лечение животных не наблюдалось изменений состояния кожи. Не наблюдалось и других патологических изменений. Перечень последовательностей (SEQ ID) Вариабельные области тяжелой цепи Вариабельные области легкой цепи Нуклеотидные последовательности вариабельной области тяжелой цепи Нуклеотидные последовательности вариабельных областей легкой цепи Зрелый эпирегулин человека - добавление N-концевого метионина Зрелый эпирегулин мыши (Mus musculus) - добавление N-концевого метионина Зрелый эпирегулин яванского макака (Масаса fascicularis) Зрелый эпиген мыши (Mus musculus) Антитело III с полной тяжелой цепью - антитело мыши Антитело III с полной легкой цепью - антитело мыши ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Антитело, которое связывает фактор роста опухоли- (TGF-) и эпирегулин, содержащее легкую цепь и тяжелую цепь, отличающееся тем, что указанная легкая цепь содержит вариабельную область легкой цепи (LCVR), и указанная тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR),причем указанная LCVR содержит аминокислотные последовательности LCDR1, LCDR2 и LCDR3, и указанная HCVR содержит аминокислотные последовательности HCDR1, HCDR2 и HCDR3, и при этомNO: 2, и HCDR3 представляет собой SEQ ID NO: 3. 2. Антитело по п.1, отличающееся тем, что последовательность аминокислот LCVR представляет собой SEQ ID NO: 9 или SEQ ID NO: 10. 3. Антитело по п.1 или 2, отличающееся тем, что последовательность аминокислот HCVR представляет собой SEQ ID NO: 7. 4. Антитело по любому из пп.1-3, отличающееся тем, что последовательность аминокислот LCVR представляет собой SEQ ID NO: 9, и последовательность аминокислот HCVR представляет собой SEQ IDNO: 7. 5. Антитело по любому из пп.1-4, отличающееся тем, что последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 13 или SEQ ID NO: 14. 6. Антитело по любому из пп.1-5, отличающееся тем, что последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 12. 7. Антитело по любому из пп.1-6, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 13, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12. 8. Антитело по любому из пп.1-3 или 5-6, содержащее две легких цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 14, и две тяжелых цепи, причем последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 12. 9. Фармацевтическая композиция для лечения диабетической нефропатии, содержащая антитело по любому из пп.1-8 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. 10. Способ лечения диабетической нефропатии у пациента, включающий введение указанному пациенту антитела по любому из пп.1-8. 11. Применение антитела по любому из пп.1-8 в терапии осложнений диабета. 12. Применение антитела по любому из пп.1-8 в лечении диабетической нефропатии. 13. Антигенсвязывающий фрагмент антитела по любому из пп.1-8. 14. Фармацевтическая композиция для лечения диабетической нефропатии, содержащая антигенсвязывающий фрагмент по п.13 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. 15. Способ лечения диабетической нефропатии у пациента, включающий введение указанному пациенту антигенсвязывающего фрагмента по п.13. 16. Применение антигенсвязывающего фрагмента по п.13 в терапии осложнений диабета. 17. Применение антигенсвязывающего фрагмента по п.13 в лечении диабетической нефропатии.
МПК / Метки
МПК: C07K 16/22
Метки: антитела, опухоли-&alpha, эпирегулин, которые, связываюt, роста, фактор
Код ссылки
<a href="https://eas.patents.su/29-24921-antitela-kotorye-svyazyvayut-faktor-rosta-opuholi-alpha-i-epiregulin.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела, которые связывают фактор роста опухоли-α и эпирегулин</a>
Предыдущий патент: Анастомат для обрезания
Следующий патент: Сухой порошковый препарат, содержащий ингибитор фосфодиэстеразы
Случайный патент: Способ получения эзетимиба и промежуточных продуктов, используемых в этом способе