Редокс-активные терапевтические средства для лечения митохондриальных заболеваний и модуляции биомаркера коэнзима q
Номер патента: 19675
Опубликовано: 30.05.2014
Авторы: Хехт Сидней М., Вессон Кирон Е., Моллард Пол, Янковски Орион Д., Миллер Гай М.
Формула / Реферат
1. Соединение, выбранное из
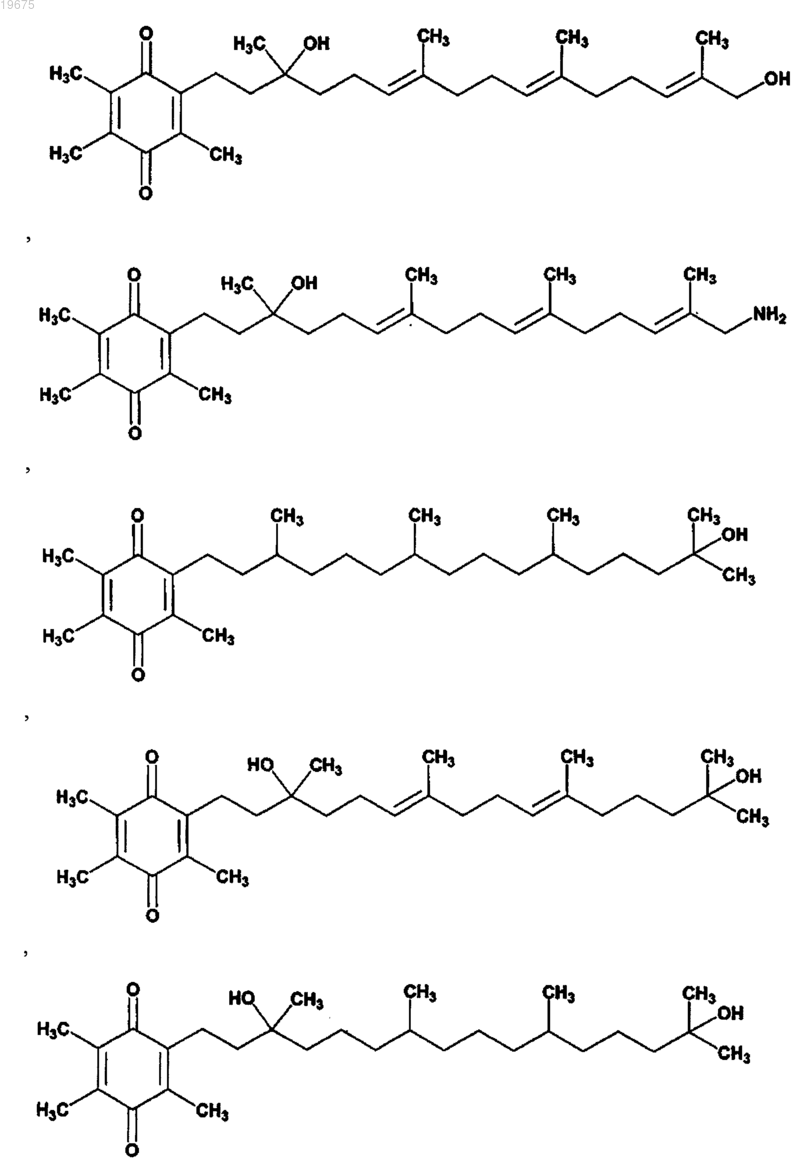
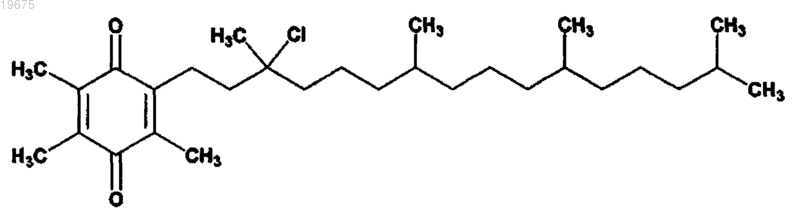
или его стереоизомера, смеси стереоизомеров, его фармацевтически приемлемой соли, фосфатзамещенной формы, сульфатзамещеннной формы, фосфат/сульфатзамещенной формы или сольвата.
2. Композиция для лечения или подавления митохондриального заболевания, содержащая одно или более соединений по п.1 в эффективном количестве и фармацевтически приемлемый эксципиент.
3. Способ лечения или подавления митохондриального заболевания, включающий введение субъекту терапевтически эффективного количества одного или нескольких соединений по п.1 или композиции по п.2.
4. Способ по п.3, где митохондриальное заболевание выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с "разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии, лактацидоза, инсульта (MELAS); наследственной невропатии зрительного нерва Лебера (LHON), болезни Ли, синдрома Кирнса-Сейра (KSS), наследственной атаксии Фридрейха (FA); других видов миопатии, кардиомиопатии, энцефаломиопатии, почечноканальцевого ацидоза; нейродегенеративных заболеваний, болезни Паркинсона, болезни Альцгеймера, бокового амиотрофического склероза (ALS), заболеваний двигательных нейронов, других неврологических заболеваний, эпилепсии, генетических заболеваний, болезни Гентингтона, аффективных расстройств, шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дегенерации сетчатки; диабета и рака.
5. Способ по п.4, где митохондриальное заболевание выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с "разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии, лактацидоза, инсульта (MELAS); наследственной невропатии зрительного нерва Лебера (LHON), болезни Ли, синдрома Кирнса-Сейра (KSS), наследственной атаксии Фридрейха (FA).
6. Способ по п.5, где митохондриальное заболевание представляет собой наследственную атаксию Фридрейха (FA).
7. Способ по п.5, где митохондриальное заболевание представляет собой наследственную невропатию зрительного нерва Лебера (LHON).
8. Способ по п.4, где митохондриальное заболевание представляет собой болезнь Гентингтона.
9. Способ по п.4, где митохондриальным заболеванием является дегенерация сетчатки, диабет или рак.
10. Способ по п.4, где митохондриальным заболеванием является болезнь Паркинсона.
11. Применение соединения по п.1 для модулирования биомаркера энергетического обмена коэнзима Q10.
12. Применение соединения по п.1 для лечения или подавления заболевания, при котором необходимо воздействие на коэнзим Q10.
13. Применение композиции по п.2 для модулирования биомаркера энергетического обмена коэнзима Q10.
14. Применение композиции по п.2 для лечения или подавления заболевания, при котором необходимо воздействие на коэнзим Q10.
Текст
РЕДОКС-АКТИВНЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ И МОДУЛЯЦИИ БИОМАРКЕРА КОЭНЗИМА Q Описаны способы лечения или подавления митохондриальных заболеваний, таких как наследственная атаксия Фридрейха (FRDA); наследственная оптическая невропатия Лебера(MELAS) или синдрома Кирнса-Сейра (KSS), а также соединения, применимые в способах по изобретению. Раскрываются также способы и соединения, применимые в лечении других заболеваний. Описаны также биомаркеры энергии, применимые для анализа метаболического состояния субъекта и эффективности лечения. Раскрываются также способы модуляции биомаркеров энергии, а также соединения, применимые для таких способов. Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет предварительной заявки США 60/776028, поданной 22 февраля 2006 г., и предварительной заявки США 60/873395, поданной 6 декабря 2006 г. Полное содержание указанных заявок включено в настоящую заявку путем ссылки. Область техники, к которой относится изобретение Настоящая заявка раскрывает композиции и способы, применимые для лечения или подавления заболеваний, обусловленных митохондриальными нарушениями, таких как наследственная атаксия Фридрейха, наследственная оптическая невропатия Лебера, синдром Кирнса-Сейра и митохондриальная миопатия, энцефалопатия, лактацидоз, инсульт, и для модуляции биомаркеров энергии у субъекта. Предшествующий уровень техники Митохондрии представляют собой органеллы в эукариотических клетках, обычно называемые"валюта" или носитель энергии в клетке, и эукариотические клетки производят большинство АТФ в результате биохимических процессов, осуществляемых митохондриями. Эти биохимические процессы включают цитратный цикл (цикл трикарбоновой кислоты или цикл Кребса), который генерирует восстановленный никотинамидадениндинуклеотид (NADH+Н+) из окисленной формы никотинамидадениндинуклеотида (NAD+), и окислительное фосфорилирование, во время которого NADH+Н+ опять окисляется в NAD+ (цитратный цикл также восстанавливает флавинадениндинуклеотид, или FAD, в FADH2; FADH2 также участвует в окислительном фосфорилировании). Электроны, высвобождаемые окислением NADH+H+, участвуют в движении в ряде белковых комплексов (комплекс I, комплекс II, комплекс III и комплекс IV), известных как дыхательная цепь. Эти комплексы встроены во внутреннюю мембрану митохондрии. Комплекс IV на конце цепи переносит электроны к кислороду, который восстанавливается до воды. Энергия, высвобождаемая при перемещении электронов в комплексах, используется для генерирования градиента протонов во внутренней мембране митохондрии, который создает электрохимический потенциал между концами внутренней мембраны. Еще один белковый комплекс, комплекс V (который не связан непосредственно с комплексами I,II, III и IV), использует энергию, сохраняемую электрохимическим градиентом для превращения АДФ в АТФ. Перед цитратным циклом и окислительным фосфорилированием происходит гликолиз, при гидролизе молекула глюкозы разрушается и дает две молекулы пирувата, причем генерируются две молекулы АТФ на молекулу глюкозы. Молекулы пирувата затем входят в митохондрии, где они полностью окисляются в СО 2 и H2O путем окислительного фосфорилирования (процесс в целом известен как аэробное дыхание). Полное окисление двух молекул пирувата в диоксид углерода и воду дает по меньшей мере около 28-29 молекул АТФ наряду с 2 молекулами АТФ, генерированными трансформацией глюкозы в две молекулы пирувата. Если кислород отсутствует, молекула пирувата не входит в митохондрии, а превращается в лактат в процессе анаэробного дыхания. Таким образом, общий "нетто" выход АТФ на молекулу глюкозы составляет по меньшей мере приблизительно 30-31 молекулу АТФ. АТФ используется для питания энергией непосредственно или опосредованно почти каждой биохимической реакции в клетке. Следовательно, по меньшей мере 28 или 29 дополнительных молекул АТФ, предоставляемых окислительным фосфорилированием во время аэробного дыхания, являются крайне важными для правильного функционирования клетки. Отсутствие кислорода делает невозможным аэробное дыхание, что в результате приводит к последующей гибели почти всех аэробных организмов; некоторые организмы, такие как дрожжи, способны выживать, используя или аэробное, или анаэробное дыхание. Когда клетки в организме временно лишены кислорода, до тех пор пока кислород вновь становится доступным, используется анаэробное дыхание, или клетка умирает. Пируват, образовавшийся в результате гликолиза, во время анаэробного дыхания превращается в лактат. Полагают, что накапливание молочной кислоты является ответственным за усталость мышц во время периодов интенсивной активности,когда кислород не может быть доставлен к клеткам мышц. Когда кислород вновь становится доступным,лактат превращается обратно в пируват для использования в окислительном фосфорилировании. Генетические дефекты в белках, составляющих дыхательную цепь, приводят к серьзным заболеваниям. Одним из таких заболеваний является наследственная атаксия Фридрейха (FRDA или FA). Наследственная атаксия Фридрейха представляет собой аутосомное рецессивное нейродегенеративное и кардиодегенеративное расстройство, вызываемое пониженными уровнями белка фратаксина. Фратаксин важен для сборки кластеров железо-сера в митохондриальных комплексах дыхательной цепи. Распространнность FRDA в Соединенных Штатах составляет, по имеющимся оценкам, от 1 случая на каждые 22000-29000 человек [см. World-Wide-Web address.nlm.nih.gov/medlineplus/ency/article/001411.htm] до 1 случая на каждые 50000 человекaddress.umccares.org/healthinfo/ADAM/Articles/001411, asp]. Заболевание вызывает прогрессирующую потерю координации произвольных движений (атаксию) и осложнения на сердце. Симптомы обычно появляются в детстве, и заболевание постепенно прогрессирует по мере того, как пациент становится старше; пациенты в конце концов становятся прикованными к инвалидному креслу из-за нарушений двигательной спо-1 019675 собности. Ещ одним заболеванием, связанным с митохондриальной дисфункцией, является наследственная оптическая нейропатия Лебера (LHON). Заболевание характеризуется слепотой, которая наступает в среднем в возрасте 37 и 34 лет [World-Wide-Web address .ncbi.nlm.nih.gov/entrez/dispomim.cgiid=535000]; слепота может развиваться на обоих глазах одновременно или последовательно (развивается слепота одного глаза, затем слепнет второй глаз, в среднем, через два месяца). Другие симптомы также могут иметь место, такие как сердечные аномалии и неврологические осложнения. Еще одним разрушительным синдромом, возникающим в результате митохондриальных дефектов,является синдром MELAS (митохондриальная миопатия, энцефалопатия, лактацидоз, инсульт). Заболевание может проявляться у младенцев, детей или молодых людей. Инсультоподобные приступы, сопровождающиеся тошнотой и судорогами, являются одним из наиболее серьезных симптомов; постулируется, что за гибель клеток и неврологические повреждения ответственны поражения митохондрий в некоторых участках мозга, а не нарушение кровотока, как при ишемическом инсульте. Часто имеют место другие серьезные осложнения, включая неврологические симптомы и повышенный уровень молочной кислоты в крови. Еще одним митохондриальным заболеванием является синдром Кирнса-Сейра (KSS). KSS характеризуется триадой признаков, включающих: (1) типичное начало болезни у людей моложе 20 лет; (2) хроническая прогрессирующая наружная офтальмоплегия и (3) пигментная дегенерация сетчатки. Кроме того, KSS может включать дефекты сердечной проводимости, мозжечковую атаксию и повышенные уровни белка в спинно-мозговой жидкости (CSF) (например, более 100 мг/дл). Дополнительные признаки, связанные с KSS, могут включать миопатию, дистонию, эндокринные аномалии (например, диабет,замедление роста или невысокий рост или гипопаратиреоз), двустороннюю нейросенсорную глухоту,деменцию, катаракту и проксимальный почечный канальцевый ацидоз. Следовательно, KSS может влиять на множество систем органов. Четыре вышеупомянутых заболевания, по-видимому, вызываются дефектами в комплексе I дыхательной цепи. Перенос электрона(ов) из комплекса I к остальной дыхательной цепи опосредован соединением коэнзимом Q (известным также под названием убихинон). Окисленный коэнзим Q (CoQox или убихинон) восстанавливается комплексом I в восстановленный коэнзим Q (CoQred или убихинол). Восстановленный коэнзим Q затем переносит свои электроны к комплексу III дыхательной цепи (не затрагивая комплекс II), где он повторно окисляется в CoQox (убихинон). CoQox может затем участвовать в дальнейших операциях переноса электронов. Для больных, страдающих вышеупомянутыми заболеваниями, существует очень мало видов лечения. Недавно для лечения наследственной атаксии Фридрейха было предложено соединение идебенон. Хотя клиническое действие идебенона относительно умеренное, осложнения митохондриальных заболеваний могут быть такими серьзными, что по сравнению с течением болезни без какого-либо лечения,предпочтительны даже те виды лечения, которые полезны в незначительной степени. Для лечения митохондриальных заболеваний предложено ещ одно соединение MitoQ (см. публикацию патентной заявки США 2005/0043553); сообщения о клинических результатах применения MitoQ ещ отсутствуют. Введение коэнзима Q10 (CoQ10) и добавок витаминов для лечения KSS, показывает только временный положительный эффект в отдельных случаях. Следовательно, существует очень большая и неудовлетворенная потребность в эффективных видах лечения митохондриальных заболеваний, таких как наследственная атаксия Фридрейха, наследственная оптическая нейропатия Лебера, MELAS и синдром Кирнса-Сейра. Способность регулировать биологическое получение энергии может применяться не только для лечения заболеваний, описанных выше. Различные другие заболевания могут приводить в результате к субоптимальным уровням биомаркеров энергии (иногда также называемым индикаторами энергетической функции), например уровням АТФ. Виды лечения указанных заболеваний также требуются для того,чтобы модулировать один или несколько биомаркеров энергии для улучшения состояния здоровья больного. В другихслучаях применения желательно изменять определенные нормальные значения биомаркеров энергии у индивидуума, не страдающего заболеванием. Например, если индивидуум подвергается чрезвычайно сильной физической нагрузке, может потребоваться повысить уровень АТФ у данного индивидуума. Подробное описание изобретения Изобретение охватывает способы лечения митохондриальных заболеваний, модулирующие биомаркер коэнзим Q, включающие введение субъекту терапевтически эффективного количества или эффективного количества одного или нескольких соединений, как описано здесь. Изобретение также охватывает соединения, описанные здесь, которые применимы для лечения митохондриальных заболеваний,модулирующие биомаркер энергии: нормализующие биомаркер энергии или увеличивающие биомаркер энергии. В одном варианте осуществления изобретение включает в себя способ лечения митохондриальных заболеваний, модулирующий биомаркер энергии: нормализующий биомаркер энергии или увеличивающий биомаркер энергии, включающий введение субъекту терапевтически эффективного количества со-2 019675 единения, выбранного из или его стереоизомера, смеси стереоизомеров, его фармацевтически приемлемой соли, фосфатзамещенной формы, сульфатзамещеннной формы, фосфат/сульфатзамещенной формы или сольвата. В любом из этих способов соединение или соединения для введения можно объединять с фармацевтически приемлемым эксципиентом. В любом из вышеуказанных способов митохондриальное заболевание может быть выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с"разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии, лактацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON); болезни Ли; синдрома Кирнса-Сейра (KSS); наследственной атаксии Фридрейха (FA); других видов миопатии, кардиомиопатии, энцефаломиопатии, почечноканальцевого ацидоза; нейродегенеративных заболеваний, болезни Паркинсона, болезни Альцгеймера, бокового амиотрофического склероза (ALS), заболеваний двигательных нейронов, других неврологических заболеваний, эпилепсии, генетических заболеваний, хореи Гентингтона, аффективных расстройств, шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дегенерации сетчатки; диабета и рака. В ещ одном варианте осуществления изобретения митохондриальное заболевание может быть выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпи-3 019675 лепсии с "разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии,лактацидоза, инсульта (MELAS); наследственной оптической невропатии Лебера (LHON), болезни Ли,синдрома Кирнса-Сейра (KSS), наследственной атаксии Фридрейха (FA). В любом из вышеуказанных способов для модуляции биомаркера энергии: нормализации биомаркера энергии или увеличения биомаркера энергии биомаркер представляет собой уровни восстановленного, или окисленного, или общего коэнзима Q. В любом из вышеуказанных способов субъект может быть выбран из группы, состоящей из субъекта с митохондриальным заболеванием; субъекта, испытывающего сильную или продолжительную физическую нагрузку, субъекта с хроническими энергетическими проблемами; субъекта с хроническими дыхательными проблемами; беременной женщины; беременной женщины в родах; новорожденного; недоношенного новорожденного; субъекта, подвергавшегося воздействию экстремальной среды; субъекта,подвергавшегося воздействию высокотемпературной среды; субъекта, подвергавшегося воздействию холодной среды; субъекта, подвергавшегося воздействию среды с содержанием кислорода ниже среднего; субъекта, подвергавшегося воздействию среды с содержанием диоксида углерода выше среднего; субъекта, подвергавшегося воздействию среды с уровнями загрязнения воздуха выше средних; субъекта с заболеванием легких; субъекта с объемом легких ниже среднего; пациента с туберкулзом; пациента с раком легких; пациента с эмфиземой; пациента с кистозным фиброзом; субъекта, выздоравливающего после хирургической операции; субъекта, выздоравливающего после болезни; субъекта, получившего сильную травму; субъекта в шоке; субъекта, которому требуется однократное введение кислорода; субъекта, которому требуется постоянное введение кислорода, субъекта пожилого возраста; пожилого субъекта, испытывающего снижение энергии, и субъекта, страдающего хронической усталостью. Биомаркер энергии можно измерять в цельной крови, плазме, спинномозговой жидкости или в церебровентрикулярной жидкости, артериальной крови, венозной крови или в любой другой жидкости организма, газе организма или других биологических образцах, применимых для таких измерений. В одном варианте осуществления изобретения уровни модулируют к значению уровней у здорового субъекта в пределах двух стандартных отклонений. В ещ одном варианте осуществления изобретения уровни модулируют к значению уровней у здорового субъекта в пределах одного стандартного отклонения. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 10% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 20% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 30% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 40% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 50% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 75% выше или ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения уровни у субъекта изменяют по меньшей мере примерно на 100% выше или на 90% ниже уровня биомаркера у субъекта до модуляции. В ещ одном варианте осуществления изобретения, включающем любые из вышеупомянутых вариантов осуществления, субъект или субъекты, для которых осуществляют способ лечения или подавления митохондриального заболевания, модулирующий биомаркер выбран(ы) из группы, состоящей из субъектов, испытывающих сильную или продолжительную физическую нагрузку; субъектов с хроническими энегетическими проблемами; субъектов с хроническими дыхательными проблемами; беременных женщин, беременных женщин в родах; новорожденных; недоношенных новорожденных; субъектов, подвергавшихся воздействию экстремальной среды; субъектов, подвергавшихся воздействию высокотемпературной среды; субъектов, подвергавшихся воздействию холодной среды; субъектов, подвергавшихся воздействию среды с содержанием кислорода ниже среднего; субъектов, подвергавшихся воздействию среды с содержанием диоксида углерода выше среднего; субъектов, подвергавшихся воздействию среды с уровнями загрязнения воздуха выше средних; авиапутешественников; бортпроводников; субъектов в условиях высоты над уровнем моря; субъектов, живущих в городах с качеством воздуха ниже среднего уровня; субъектов, работающих в закрытой среде с плохим качеством воздуха; субъектов с заболеванием легких; субъектов с объемом легких ниже среднего; пациентов с туберкулзом; пациентов с раком легких; пациентов с эмфиземой; пациентов с кистозным фиброзом; субъектов, выздоравливающих после хирургической операции; субъектов, выздоравливающих после болезни; субъектов пожилого возраста; пожилых субъектов, испытывающих снижение энергии, и субъектов, страдающих синдромом хронической усталости, субъектов, получивших сильную травму; субъектов в шоке; субъектов, которым требуется однократное введение кислорода; субъектов, которым требуется постоянное введение кислорода,или других субъектов с острой, хронической или постоянной потребностью в энергии, для которых увеличение биомаркеров энергии может быть выгодным. В ещ одном варианте осуществления изобретение включает в себя одно или несколько соединений,-4 019675 описанных здесь, в сочетании с фармацевтически приемлемым эксципиентом, носителем или средой. В ещ одном варианте осуществления изобретение включает в себя применение одного или нескольких соединений, описанных в настоящем документе в терапии. В ещ одном варианте осуществления изобретение включает в себя применение одного или нескольких соединений, описанных в настоящем документе, в терапии митохондриального заболевания. В ещ одном варианте осуществления изобретение включает в себя применение одного или нескольких соединений, описанных в настоящем документе, для изготовления лекарственного средства для применения в терапии митохондриального заболевания. Для всех соединений и способов, описанных выше, когда требуется, можно также использовать хинонную форму в восстановленном виде (гидрохинон). Аналогично, когда требуется, гидрохинон можно использовать также и в его окисленной форме (хинон). Методики осуществления изобретения Изобретение включает в себя соединения, применимые для лечения или подавления митохондриальных заболеваний, и способы использования таких соединений для модуляции биомаркера энергии. Редокс-активные терапевтические средства для лечения или подавления митохондриальных заболеваний и связанные с ними объекты изобретения описаны здесь более подробно. Терминами "субъект", "индивидуум" или "пациент" обозначают отдельный организм, предпочтительно позвоночного, более предпочтительно млекопитающего, наиболее предпочтительно человека. Термин "лечение" заболевания соединениями или способами, обсуждаемыми в данной заявке, определн как введение одного или нескольких соединений, обсуждаемых здесь (без дополнительных терапевтических средств или вместе с ними), с целью уменьшения или устранения либо заболевания, либо одного или нескольких симптомов заболевания, или для замедления прогрессирования либо заболевания,либо одного или нескольких симптомов заболевания, или для ослабления тяжести заболевания или одного или нескольких симптомов заболевания. Термин "подавление" заболевания соединениями или способами, обсуждаемыми здесь, определн как введение одного или нескольких соединений, обсуждаемых здесь (без дополнительных терапевтических средств или вместе с ними), с целью подавить клиническое проявление заболевания или подавить проявление неблагоприятных симптомов заболевания. Различиемежду лечением и подавлением состоит в том, что лечение имеет место после проявления неблагоприятных симптомов заболевания у субъекта, тогда как подавление имеет место до проявления неблагоприятных симптомов заболевания у субъекта. Подавление может быть частичным, по существу, полным или полным. Так как многие из митохондриальных заболеваний являются наследственными, для выявления пациентов с повышенным риском заболевания может быть использован генетический скрининг. Соединения и способы по изобретению можно затем назначать пациенту с повышенным риском развития клинических симптомов заболевания, у которого отсутствуют симптомы заболевания, для того, чтобы подавить появление любых неблагоприятных симптомов. "Терапевтическое применение" соединений, обсуждаемых здесь, определено как применение одного или нескольких соединений, обсуждаемых здесь, для лечения или подавления заболевания, как определено выше. "Эффективное количество" соединения представляет собой количество соединения, достаточное для того, чтобы модулировать (нормализовать или увеличивать) биомаркер энергии (термины "модулирование", "нормализация" и "увеличение" определены ниже). "Терапевтически эффективное количество" соединения представляет собой такое количество соединения, которое при введении субъекту является достаточным для ослабления или устранения либо заболевания, либо одного или нескольких симптомов заболевания, или для замедления прогрессирования либо заболевания, либо одного или нескольких симптомов заболевания, или для ослабления тяжести заболевания или одного или нескольких симптомов заболевания, или для подавления либо клинического проявления заболевания, либо для подавления проявления неблагоприятных симптомов заболевания. Терапевтически эффективное количество может быть получено пациентом в результате одного или нескольких введений. Термин "эффективное количество" соединения охватывает как терапевтически эффективное количество, так и количество, эффективное для модулирования, нормализации или увеличения биомаркера энергии у субъекта."Модулирование" биомаркера энергии или "модулировать" биомаркер энергии означает изменение уровня биомаркера энергии в сторону нужного значения или изменение уровня биомаркера энергии в нужном направлении (например, в сторону увеличения или уменьшения). Модулирование может включать нормализацию и увеличение, как определено ниже, но не ограничено ими."Нормализация" биомаркера энергии или "нормализовать" биомаркер энергии определяется как изменение уровня биомаркера энергии от патологического значения в сторону нормального значения, где нормальное значение биомаркера энергии может быть 1) уровнем биомаркера энергии у здорового человека или субъекта или 2) уровнем биомаркера энергии, который ослабляет один или несколько нежелательных симптомов у индивидуума или субъекта. То есть нормализовать биомаркер энергии, который понижен в состоянии болезни, означает увеличить уровень биомаркера энергии в сторону нормального(здорового) значения или в сторону значения, которое ослабляет нежелательный симптом; нормализовать биомаркер энергии, который повышен в состоянии болезни, означает уменьшить уровень биомаркера энергии в сторону нормального (здорового) значения или в сторону значения, которое ослабляет не-5 019675 желательный симптом."Увеличение" биомаркера энергии или "увеличивать" биомаркер энергии означает специальное изменение уровня одного или нескольких биомаркеров энергии или от нормального значения, или от значения, имевшего место перед увеличением, для того, чтобы достичь предпочтительного или нужного эффекта. Например, в ситуации, когда у субъекта существуют значительные потребности в энергии, может потребоваться увеличение уровня АТФ у субъекта до уровня, превышающего нормальный уровень АТФ у такого субъекта. Под терминами "модуляция", "нормализация" или "увеличение" биомаркера энергии коэнзима Q подразумевается модуляция, нормализация или увеличение варианта или вариантов коэнзима Q, который является преобладающим у видов, представляющих интерес. Например, вариантом коэнзима Q, который преобладает у человека, является коэнзим Q10. Если вид или субъект имеет несколько вариантов коэнзима Q, присутствующих в значительных количествах (т.е. присутствующих в количествах, которые при модулировании, нормализации или увеличении могут оказывать полезное действие на вид или субъект),модуляция, нормализация или увеличение коэнзима Q может относиться к модуляции, нормализации или увеличению любых или всех вариантов коэнзима Q, имеющихся у вида или субъекта. Хотя соединения, описываемые здесь, могут встречаться и применяться в виде нейтрального соединения (не соли), описание предназначено для того, чтобы включить в себя все соли соединений, описываемых здесь, а также способы применения таких солей соединений. В одном варианте осуществления изобретения соли соединений включают фармацевтически приемлемые соли. Фармацевтически приемлемые соли представляют собой такие соли, которые можно вводить в качестве лекарств или фармацевтических препаратов человеку и/или животным и которые при введении сохраняют, по меньшей мере,некоторую биологическую активность свободного соединения (нейтрального соединения или несолевого соединения). Нужную соль основного соединения можно получить способами, известными специалистам в данной области техники, путем обработки соединения кислотой. Примеры неорганических кислот включают (но не ограничиваются перечисленными ниже) хлористо-водородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту. Примеры органических кислот включают (но не ограничиваются перечисленными ниже) муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, сульфоновые кислоты и салициловую кислоту. Можно также получать соли основного соединения с аминокислотами, такие как аспартаты и глутаматы. Нужную соль кислотного соединения можно получать способами, известными специалистам в данной области техники, путем обработки соединения основанием. Примеры неорганических солей включают (но не ограничиваются перечисленными ниже) соли щелочных и щелочноземельных металлов, такие как натриевые соли, калиевые соли, магниевые соли и кальциевые соли; соли аммония и соли алюминия. Примеры органических солей кислотных соединений включают (но не ограничиваются перечисленными ниже) соли прокаина, дибензиламина, н-этилпиперидина, N,N'дибензилэтилендиамина и триэтиламина. Можно также получать соли кислотных соединений с аминокислотами, такие как соли лизина. Изобретение включает также все стереоизомеры и геометрические изомеры соединений, включающие диастереомеры, энантиомеры и цис/транс (E/Z)-изомеры. Изобретение включает также смеси стереоизомеров и/или геометрических изомеров в любом соотношении, включая рацемические смеси, но не ограничиваются ими. Соединения можно вводить в виде пролекарства. Пролекарства представляют собой производные соединений, которые сами являются относительно неактивными, но которые превращаются в активное соединение при введении субъекту, для лечения которого оно используется, химическим или биологическим способом in vivo, таким как ферментативное превращение. Подходящие рецептуры пролекарств включают (но не ограничиваются ими) пептидные конъюгаты соединений по изобретению. Кроме того,подходящие пролекарства обсуждаются в работах [Н. Bundgaard, Design of prodrugs, New York: Elsevier,1985; in R. Silverman, The Organic Chemistry of Drug Design and Drug Action, Boston: Elsevier, 2004; in R.L.Sciences, v. 507), New York: New York Academy of Sciences, 1987; and in E.B. Roche (ed.), Design of Biopharmaceutical Properties Through Prodrugs and Analogs (Symposium sponsored by Medicinal Chemistry Section, APhA Academy of Pharmaceutical Sciences, November 1976 national meeting, Orlando, Florida), Washington: The Academy, 1977]. Изобретение включает производные соединений, описываемых в настоящем документе, замещенных одной или несколькими фосфатными группами и/или сульфатными группами. Соединение является"фосфатзамещенным", когда содержит одну или несколько фосфатных групп, и является "сульфатзамещенным", когда содержит одну или несколько сульфатных групп. "Фосфат/сульфатзамещенное" соединение содержит по меньшей мере одну фосфатную и по меньшей мере одну сульфатную группу. Например, одна или несколько гидроксильных групп в фенильном кольце могут быть замещены с образованием соединения, такого как где R1, R2 и R3 - метильные группы и где R100 и R200 могут быть независимо выбраны из -Н, -РО 3-2 и -SO3-. В одном варианте осуществления изобретение включает в себя соединения, в которых R100 представляет собой -Н и R200 представляет собой -РО 3-2. В ещ одном варианте осуществления изобретение включает в себя соединения, в которых R100 представляет собой -Н и R200 представляет собой -SO3-. В ещ одном варианте осуществления изобретение включает в себя соединения, в которых R100 представляет собой-РО 3-2 и R200 представляет собой -Н. В ещ одном варианте осуществления изобретение включает в себя соединения, в которых R100 представляет собой -SO3- и R200 представляет собой -Н. В ещ одном варианте осуществления изобретение включает в себя соединения, в которых R100 и R200 представляют собой -РО 3-2. В ещ одном варианте осуществления изобретение включает в себя соединения, в которых R100 и R200 представляют собой -SO3-. Кроме того, настоящее изобретение включает в себя все протонированные и частично протонированные формы и сольваты соединений, замещенных фосфатами и/или сульфатами. Различные соединения можно или сами вводить в виде терапевтических средств, или в составе таких средств, или в виде пролекарств, которые в организме превращаются в другие терапевтически эффективные или эффективные вещества. Метаболиты соединений также охватываются изобретением. Однако метаболиты веществ, которые встречаются в природе у данных субъектов, исключены из заявляемых соединений по изобретению. Термин "защитная группа" относится к химической группе, которая обладает следующими характеристиками: 1) селективно реагирует с нужной функциональной группой с хорошим выходом и дает защищнный субстрат, который стабилен в условиях планируемых реакций, для которых требуется защита; 2) селективно удаляется из защищнного субстрата с образованием требуемой (нужной) функциональной группы и 3) удаляется с хорошим выходом реагентами, совместимыми с другой(ими) функциональной(ыми) группой(ами), которая(ые) присутствует(ют) или образует(ют)ся в таких планируемых реакциях. Примеры подходящих защитных групп можно найти в монографии [Greene et al. (1991) Protective Groups in Organic Synthesis, 3rd Ed. (John WileySons, Inc., New York)]. Аминозащитные группы включают (но не ограничены перечисленными ниже) мезитиленсульфонил (Mts), бензилоксикарбонил(CBz или Z), трет-бутилоксикарбонил (Boc), трет-бутилдиметилсилил (TBS или TBDMS), 9 флуоренилметилоксикарбонил (Fmoc), тозил, бензолсульфонил, 2-пиридилсульфонил или подходящие светочувствительные защитные группы, такие как 6-нитровератрилоксикарбонил (Nvoc), нитропиперонил, пиренилметоксикарбонил, нитробензил, ,-диметилдиметоксибензилоксикарбонил (DDZ), 5-бром 7-нитроиндолинил и т.п. Гидроксизащитные группы включают (но не ограничены перечисленными ниже) Fmoc, TBS5 светочувствительные защитные группы (такие как нитровератрилоксиметиловый эфир(Nvom, Mom (метоксиметиловый эфир) и Mem (метоксиэтоксиметиловый эфир), NPEOC (4 нитрофенетилоксикарбонил) и NPEOM (4-нитрофенетилоксиметилоксикарбонил). Синтез соединений Соединения по изобретению можно легко синтезировать множеством способов. Подходящие защитные группы для реакций, описываемых здесь, подробно рассматриваются в тексте монографии [Theodora W. Greene and Peter G.M. Wuts, Protective Groups in Organic Synthesis, 3rd edition, Hoboken, NJ:Wiley-Interscience, 1999]. Синтезы, приведенные ниже, иллюстрируются примерами, где R1, R2 и R3 представляют собой метил; однако способы обычно применимы в тех случаях, когда R1, R2 и R выбраны из других заместителей с подходящей защитой, если необходимо. Способ синтеза соединения формулы I состоит в применении представленного ниже синтеза для соединения 1 где conc. - конц.; THF - ТГФ; rtкомн. температура; h - ч; g - г,где гидрохинон 2 растворяют в этаноле и обрабатывают основным раствором Me2SO4. После обработки кислотой и колоночной хроматографии получают гидрохинон 3, защищенный двумя метоксигруппами. Хлорметильную группу вводят растворением 3 в растворе концентрированной HCl и параформальдегида при прибавлении газообразного HCl. Нейтрализация и выделение дают продукт 4. Кросссочетание по способу, описанному в работе [Lipshutz, B.H. et.al. J. Am. Chem. Soc. 1996, 118, 5512-5513],приводит к образованию Е-аллилированного ароматического продукта 5. Соединение 5 восстанавливают гидрированием, катализируемым Pd/C в соответствующем растворителе, таком как EtOH, MeOH илиEtOAc, и получают рацемическую смесь восстановленных продуктов 6. Затем защищенный гидрохинон окисляют в хинон обработкой CAN в ацетонитриле и получают непосредственно 1,4-бензохинон 7 и затем восстанавливают его в гидрохинон 1 обработкой двухфазной смесью эфирного растворителя и основного водного раствора Na2S2O4 [Vogel, A.I. et.al. Vogel's Textbook of Practical Organic Chemistry, 5thEdition, Prentice Hall: New York, 1996]. Стандартная обработка при отсутствии кислорода дат требуемый гидрохинон. Индивидуальные энантиомеры доступны, если заменить катализатор гидрирования Pd/C соответствующим хиральным катализатором гидрирования [Bell, S. et.al. Science 2006, 311, 642-644]. Ещ один способ получения соединения формулы I состоит в применении следующего синтеза соединения 8 формулы: где предшественник 5, полученный как и в случае соединения 1, окисляют в хинон 8 обработкой CAN в смеси ацетонитрил/вода. Альтернативно, хинон 8 может быть получен непосредственно путем сочетания с 2-хлорметил-3,5,6-триметил-[1,4]-бензохиноном, как описано в [Lipshutz, B.H. et al. Tetrahedron 1998,54, 1241-1253]. Ещ один способ синтеза соединения формулы I состоит в применении следующего синтеза соединения 9: где: conc. - конц.; THF - ТГФ; rtкомн. температура; h - ч; g - г,где гидрохинон метилируют метилйодидом и получают соединение 11, которое затем метилируют,получая бензилхлорид 12, который подвергают кросс-сочетанию с винилаланом с образованием соединения 13. Соединение 13 окисляют CAN в смеси ацетонитрил/вода и получают хинон 14, который затем исчерпывающе восстанавливают водородом при катализе палладием на угле, получая гидрохинон 15. Соединение 15 затем окисляют в хинон 9 действием атмосферного кислорода в присутствии силикагеля. Альтернативно, хинон 14 можно получить непосредственно сочетанием с 2-хлорметил-3-трет-бутил-5,6 диметил-[1,4]-бензохиноном, как описано в работе [Lipshutz, B.H. et al. Tetrahedron 1998, 54, 1241-1253]. Ещ один способ синтеза соединений формулы I состоит в применении следующего синтеза соединения 16 формулы: где предшественник 14, полученный, как в случае соединения 9, превращают в соответствующий гидрохинон 16 восстановлением тетрахлоридом олова. Способ синтеза соединений формулы II является применением следующего синтеза соединения 17: где then - затем,где 2,2,7,8-тетраметил-5-(3-метилбут-2-енил)хроман-6-ол получают, как описано в работе [Walkinshaw, et al., US 2005/0065099 A1, Mar. 24, 2005]. Окисление обработкой CAN дает соответствующий хинон, который можно исчерпывающе восстановить, затем повторно окислить и получить 17. Ещ один способ синтеза соединения формулы I представляет собой применение нижеследующего синтеза соединения 23 формулы где 2,3-диметил-[1,4]-бензохинон, полученный окислением 2,3-диметилбензол-1,4-диола хлоридом железа, подвергают сочетанию с 4-метилпентановой кислотой через окислительное декарбоксилирование,медиированному персульфатом и нитратом серебра и получают непосредственно соединение 23. Ещ один способ получения соединения формулы II состоит в применении синтеза соединения 27 формулы где Pyridine - пиридин, Reflux - кипячение с обратным холодильником где -токотриенолхинон 28 селективно окисляют трет-бутилгидропероксидом при катализе диоксидом селена в соответствии с [Tet. Lett. 1989, 30(29), 3749-3752] и получают аллиловый спирт 29. Спирт 29 превращают в его тозилат 30 действием тозилхлорида и пиридина. Тозилат 30 превращают в азид 31 действием азида натрия при кипячении в этаноле. Азид 31 селективно восстанавливают трифенилфосфином и получают амин 27. Еще один способ получения соединений формулы II состоит в применении нижеследующего синте- 10019675 за соединения 32 формулы где предшественник азид 31, полученный при синтезе соединения 27, обрабатывают водородом при катализе палладием на угле с последующим повторным окислением действием атмосферного кислорода в присутствии катализатора SiO2 и получают требуемый амин. Еще один способ получения соединений формулы II состоит в применении нижеследующего синтеза соединения 33 формулы где -токотриенолхинон 28 селективно гидробромируют по терминальному олефину по методике,описанной в [J. Am. Chem. Soc. 2005, 127(42), 14911-14921]. Полученное промежуточное соединение затем подвергают циклизации с образованием эпоксида 34 обработкой карбонатом калия. Эпоксид 34 избирательно раскрывают действием CdCl2/Mg и получают третичный спирт 35 по методике, описанной в[Tet. Lett. 1993, 34(10), 1681-1684], спирт 35 повторно окисляют действием атмосферного кислорода в- 11019675 присутствии катализатора SiO2 и получают хинон 36. Оставшиеся олефины восстанавливают водородом при катализе палладием на угле и получают 37, который повторно окисляют в хинон 33 действием атмосферного кислорода в присутствии катализатора SiO2. Еще один способ получения соединений формулы II состоит в применении нижеследующего синтеза соединения 38 формулы где -токотриенолхинон 28 защищают как его диметилгидрохинон 39 с последующим превращением в третичный хлорид 40 обработкой диметилхлорсиланом, бензилом и каталитическим количеством хлорида индия, как описано в [Org. Syn. 2006, 83, 38-44]. Затем метильные группы удаляют обработкой трибромидом бора и получают дигидрохинон 38, который можно окислить в соответствующий хинон 41 обработкой CAN. Этот способ синтеза соединения формулы II может быть приспособлен для нижеследующего синтеза соединения 42 формулы где -токоферолхинон 43 защищают, получая его диметилгидрохинон 44 с последующим превращением в третичный хлорид 45 обработкой диметилхлорсиланом, бензилом и при катализе хлоридом индия, как описано в [Org. Syn. 2006, 83, 38-44]. Затем метильные группы удаляют обработкой трибромидом бора и получают дигидрохинон 42, который можно окислить в соответствующий хинон 46 обработкой CAN. Взаимопревращаемость форм хинонов и гидрохинонов Хиноновая и дигидрохиноновая формы соединений, раскрываемых в настоящей заявке, легко превращаются друг в друга действием соответствующих реагентов. Например, хиноновую форму соединения можно восстанавливать в дигидрохиноновую форму действием восстановителей, таких как дитионит натрия. Гидрохиноновую форму можно окислять действием окислителей, таких как церий аммоний нитрат (CAN) или хлорид железа. Хиноновые и гидрохиноновые формы легко также превращаются электрохимически, как известно в данной области техники. См., например, [Section 33.4 of Streitweiser Sc Heathcock, Introduction to Organic Chemistry, New York: Macmillan, 1976]. Когда соединения по изобретению изображают в виде хинона или гидрохинона, подразумевается конкретная форма. Однако когда изображают хиноновую форму и сопровождают е фразой "его восстановленный аналог" или "его восстановленная форма" или т.п., подразумевается, что структура и последующая фраза включают в себя как хинон, так и гидрохинон. Аналогично, когда изображают гидрохиноновую форму и сопровождают формулу фразой "его окисленный аналог" или "его окисленная форма" или т.п., подразумевается, что структура и последующая фраза включают в себя как гидрохинон, так и хинон. Заболевания, поддающиеся лечению или подавлению соединениями и способами по изобретению Считается, что многие заболевания вызываются или обостряются митохондриальными нарушениями и энергетическими нарушениями и их можно лечить или подавлять с помощью соединений и способов по изобретению. Такие заболевания включают (но не ограничиваются ими) наследственные митохондриальные заболевания, такие как миоклоническая эпилепсия с "разорванными красными волокнами"(MERRF); митохондриальная миопатия, энцефалопатия, лактацидоз, инсульт (синдром MELAS); наследственная оптическая нейропатия Лебера (LHON, также называется болезнь Лебера, оптическая атрофия Лебера (LOA) или оптическая невропатия Лебера (LON, болезнь Ли или синдром Ли, синдром КирнсаСейра (KSS), наследственная атаксия Фридрейха (FA), другие виды миопатии (включающие кардиомиопатию и энцефаломиопатию) и почечноканальцевый ацидоз; нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз (ALS, известный также под названием болезнь Лу Герига); заболевания двигательных нейронов; другие неврологические заболевания, такие как эпилепсия; генетические заболевания, такие как хорея Гентингтона (которая также является неврологическим заболеванием); аффективные расстройства, такие как шизофрения и биполяр- 13019675 ные расстройства, и некоторые заболевания, связанные с возрастом, особенно заболевания, для лечения которых предложен CoQ10, такие как дегенерация сетчатки, диабет и рак. Анализ эффективности соединений in vitro Соединения по изобретению могут быть тестированы in vitro на их эффективность. Один такой анализ представляет собой определение способности соединения "спасать" FRDA фибробласты, подвергавшиеся стрессу, присоединением L-бутионина-(S,R)-сульфоксимина (BSO), как описано в работах [Jauslinet al., Hum. Mol. Genet. 11(24):3055 (2002), Jauslin et al, FASEB J. 17: 1972-4 (2003)] и публикации международной патентной заявки WO 2004/003565. Фибробласты кожи людей больных наследственной атаксией Фридрейха, как было показано, являются гиперчувствительными к ингибированию de novo синтеза глутатиона (GSH) L-бутионин-(S,R)-сульфоксимином (BSO), специфическим ингибитором GSH синтетазы [Jauslin et al., Hum. Mol. Genet. 11(24):3055 (2002)]. Эту специфическую BSO-медиированную гибель клеток можно предотвратить введением антиоксидантов или молекул, участвующих в антиоксидантном пути, таких как -токоферол, хинонов с короткой цепью, селена или небольших молекул миметиков глутатионпероксидазы. Однако антиоксиданты отличаются по своей силе, т.е. по концентрации, при которой они способны деблокировать FRDA фибробласты после BSO-стресса. С помощью данного анализа можно определять ЕС 50 концентрации соединений по изобретению и сравнивать с известными эталонными антиоксидантами. Клиническая оценка митохондриалъной дисфункции и эффективности терапии Несколько легко измеряемых клинических маркеров применяют для анализа метаболического состояния больных с митохондриальными заболеваниями. Указанные маркеры можно также применять в качестве индикаторов эффективности данной терапии, так как уровень маркера изменяется от патологического значения к здоровому значению. Эти клинические маркеры включают (но не ограничиваются ими) один или несколько биомаркеров энергии, обсуждавшихся ранее, такие как уровни молочной кислоты (лактата), или в цельной крови, плазме, спинномозговой жидкости, или в церебральной вентрикулярной жидкости; уровней пировиноградной кислоты (пирувата) или в цельной крови, плазме, спинномозговой жидкости, или в церебровентрикулярной жидкости; отношений лактат/пируват или в цельной крови, плазме, спинномозговой жидкости, или в церебровентрикулярной жидкости; уровни креатинфосфата (фосфоркреатина), уровни NADH (NADH+Н+); уровни NADPH (NADPH+H+); уровни NAD; уровниNADP; уровни АТФ; уровни восстановленного коэнзима Q (CoQred); уровни окисленного коэнзима Q(CoQox); уровни общего коэнзима Q (CoQtot); уровни окисленного цитохрома С; уровни восстановленного цитохрома С; отношение окисленный цитохром С/восстановленный цитохром С; уровни ацетоацетата,уровни -гидроксибутирата, отношения ацетоацетат/-гидроксибутират, уровни 8-гидрокси-2'дезоксигуанозина (8-OHdG); уровни реакционноспособных кислородных частиц; уровни расхода кислорода (VO2); уровни выхода диоксида углерода (VCO2); дыхательного коэффициента (VCO2/VO2); толерантность к физической нагрузке и анаэробный порог. Некоторые из этих клинических маркеров измеряют по стандартной методике в лабораториях физиологии физических упражнений и получают удобные оценки метаболического состояния субъекта. В одном варианте осуществления изобретения уровень одного или нескольких биомаркеров энергии у больного, страдающего митохондриальным заболеванием, таким как наследственная атаксия Фридрейха,наследственная оптическая невропатия Лебера, MELAS, или KSS, улучшается в пределах до двух стандартных отклонений среднего уровня для здорового субъекта. В ещ одном варианте осуществления изобретения уровень одного или нескольких указанных биомаркеров энергии у больных, страдающих митохондриальным заболеванием, таким как наследственная атаксия Фридрейха, наследственная оптическая невропатия Лебера, MELAS или KSS улучшается в пределах до двух стандартных отклонений среднего уровня для здорового субъекта. Непереносимость физических нагрузок может также быть использована в качестве индикатора эффективности данной терапии, где улучшение в переносимости физических нагрузок (т.е. уменьшение непереносимости физических нагрузок) указывает на эффективность данной терапии. Несколько метаболических биомаркеров уже используют для оценки эффективности CoQ10 и можно осуществлять мониторинг этих метаболических биомаркеров. Пируват, продукт анаэробного метаболизма глюкозы, удаляют путем восстановления в молочную кислоту в анаэробной системе или при окислительном метаболизме, который зависит от функциональной митохондриальной дыхательной цепи. Дисфункция дыхательной цепи может приводить к неадекватному удалению лактата и пирувата из кровотока и повышенные соотношения лактат/пируват наблюдаются при митохондриальных цитопатиях[см. Scriver C.R., The metabolic and molecular bases of inherited disease, 7th ed., New York: McGraw-Hill,Health Professions Division, 1995; and Munnich et al., J. Inherit. Metab. Dis. 15(4):448-55 (1992)]. Соотношение лактат/пируват в крови [Chariot et al., Arch. Pathol. Lab. Med. 118(7):695-7 (1994)] широко используют в качестве неинвазивного теста для обнаружения митохондриальных цитопатий [см. и в этом случаеProfessions Division, 1995; and Munnich et al., J. Inherit. Metab. Dis. 15(4):448-55 (1992)] и токсических митохондриальных цитопатий [Chariot et al., Arthritis Rheum. 37(4):583-6 (1994)]. Изменения в редокс- 14019675 состоянии митохондрий печени можно исследовать путем измерения соотношения кетонов организма(ацетоацетат/3-гидроксибутират: AKBR) [Ueda et al., J. Cardiol. 29(2):95-102 (1997)]. Выделение 8 гидрокси-2'-дезоксигуанозина (8-OHdG) с мочой часто используют в качестве биомаркера для оценки степени репарации индуцированного ROS повреждения ДНК как в клинических, так и профессиональных условиях [Erhola et al., FEBS Lett. 409(2):287-91 (1997); Honda et al., Leuk. Res. 24(6):461-8 (2000);Pilger et al, Free Radic. Res. 35(3):273-80 (2001); Kim et al. Environ Health Perspect 112(6):666-71 (2004)]. Спектроскопия магнитного резонанса (ЯМР) применима для диагностирования митохондриальных цитопатий путем демонстрации повышенных уровней лактата в спинномозговой жидкости (CSF) и кортикальном белом веществе, используя ЯМР на протонах (1 Н-ЯМР) [Kaufmann et al, Neurology 62(8): 1297-302 (2004)]. ЯМР на ядрах фосфора (31 Р-ЯМР) используют для демонстрации низких уровней кортикального фосфоркреатина (PCr) [Matthews et al., Ann. Neurol. 29(4):435-8 (1991)], и задержки PCr кинетики отдыха после нагрузки в скелетных мышцах (Matthews et al., Ann. Neurol. 29(4):435-8 (1991); Barbiroli et al., J. Neurol. 242(7):472-7 (1995); Fabrizi et al., J. Neurol. Sci. 137(l):20-7 (1996. Низкий уровеньPCr в скелетных мышцах больных митохондриальной цитопатией подтверждается также непосредственными биохимическими измерениями. Тест на переносимость физической нагрузки особенно полезен в качестве инструмента оценки и скрининга при митохондриальных миопатиях. Одной из отличительных характеристик митохондриальных миопатий является уменьшение максимального потребления кислорода целым организмом(VO2max) [Taivassalo et al., Brain 126 (Pt 2):413-23 (2003)]. При условии, что VO2max определяют по разнице минутного сердечного выброса (Qc) и (Qc) периферической экстракции кислорода (артериальновенозное общее содержание кислорода), некоторые митохондриальные цитопатии влияют на сердечную функцию, где доставка может быть изменена; однако большинство митохондриальных миопатий показывают характерный дефицит в периферической экстракции кислорода (разница A-VO2) и усиленная доставка кислорода (гиперкинетический кровоток) [Taivassalo et al., Brain 126(Pt 2):413-23 (2003)]. Это может быть продемонстрировано нехваткой физической нагрузки, индуцированной деоксигенацией венозной крови, непосредственными измерениями AV баланса [Taivassalo et al., Ann. Neurol. 5l(l):38-44(2002)] и неинвазивно инфракрасной спектроскопией в ближней зоне [Lynch et al., Muscle Nerve 25(5):664-73 (2002); van Beekvelt et al., Ann. Neurol. 46(4):667-70 (1999)]. Уровни молочной кислоты (лактата): митохондриальная дисфункция обычно приводит к аномальным уровням молочной кислоты, поскольку уровни пирувата увеличиваются и пируват превращается в лактат для сохранения способности к гликолизу. Митохондриальная дисфункция может также приводить к аномальным уровням NADH+H+, NADPH+H+, NAD или NADP, так как восстановленные никотинамидадениндинуклеотиды эффективно не перерабатываются дыхательной цепью. Уровни лактата можно измерять, отбирая образцы соответствующих жидкостей организма, таких как цельная кровь, плазма или спинномозговая жидкость. С помощью магнитного резонанса уровни лактата можно измерять в практически любом объме нужного организма, например в мозге. Измерение церебрального лактоцидоза с помощью магнитного резонанса у больных с MELAS описано в работе [Kaufmann et al., Neurology 62(8): 1297 (2004)]. Значения уровней молочной кислоты в боковых желудочках мозга представлены для двух мутаций, приводящих в результате к MELAS, A3243G иA8344G. Уровни лактата в цельной крови, плазме и спинномозговой жидкости могут быть измерены на коммерчески доступном оборудовании, таком как анализатор YSI 2300 STAT Plus GlucoseЛактат (YSI(NADPH+H+) можно измерять многими флуоресцентными, ферментативными или электрохимическими методами, например электрохимическим анализом, описанным в патенте США 2005/0067303. Потребление кислорода (vO2 или VO2), объм диоксида углерода (vCO2 или VCO2) и дыхательный коэффициент (VCO2/VO2): vO2 обычно измеряют или во время покоя (vO2) или при максимальной интенсивности физической нагрузки (vO2max). Оптимальным является измерение обоих значений. Однако для совсем нетрудоспособных больных измерение vO2max может быть практически неосуществимо. Измерение обеих форм vO2 легко осуществить на стандартном оборудовании от многих поставщиков, например Korr Medical Technologies, Inc. (Salt Lake City, Utah). VCO2 также легко измерять и отношение VCO2 к VO2 в одних и тех же условиях (VCO2/VO2 или в состоянии покоя, или при максимальной интенсивности физической нагрузки) дат дыхательный коэффициент (RQ). Окисленный цитохром С, восстановленный цитохром С и отношение окисленного цитохрома С к восстановленному цитохрому С: параметры цитохрома С, такие как уровни окисленного цитохрома С(Cyt Сох), уровни восстановленного цитохрома С (Cyt Cred) и отношение окисленный цитохром С/восстановленный цитохром С (Cyt Cox)/(Cyt Cred) можно измерять in vivo инфракрасной спектроскопией в ближней зоне. См., например, работы [Rolfe, P., "In vivo near-infrared spectroscopy", Armu. Rev.Biomed. Eng. 2:715-54 (2000) and Strangman et al., "Non-invasive neuroimaging using near-infrared light" Biol. Psychiatry 52:679-93 (2002)]. Переносимость физической нагрузки/непереносимость физической нагрузки: непереносимость физической нагрузки определяют как "пониженную способность осуществлять деятельность, в которую- 15019675 вовлечено динамическое движение больших скелетных мышц из-за симптомов одышки или усталости"[Pifia et al., Circulation-107:1210 (2003)]. Непереносимость физической нагрузки часто сопровождается миоглобинурией, обусловленной разрушением мышечной ткани и последующим выведением мышечного миоглобина с мочой. Можно использовать различные показатели измерения непереносимости физической нагрузки, такие как время хождения или бега на тренажре до истощения, время езды на велосипеде (стационарный велосипед) до истощения и т.п. Лечение соединениями или способами по изобретению может привести в результате к примерно 10%-му улучшению переносимости физической нагрузки(например, примерно 10%-ное или больше увеличение времени до истощения, например от 10 до 11 мин), примерно 20%-ное (или больше) улучшение в переносимости физической нагрузки, примерно 30%-ное (или больше) улучшение в переносимости физической нагрузки, примерно 40%-ное (или больше) улучшение в переносимости физической нагрузки, примерно 50%-ное (или больше) улучшение в переносимости физической нагрузки, примерно 75%-ное (или больше) улучшение в переносимости физической нагрузки или примерно 100% (или больше) улучшение в переносимости физической нагрузки. Хотя переносимость физической нагрузки, строго говоря, не является биомаркером энергии, для целей изобретения модуляция, нормализация или увеличение биомаркера энергии включает модуляцию, нормализацию или увеличение переносимости физической нагрузки. Аналогично, тесты нормальных и аномальных значений уровней пировиноградной кислоты (пирувата), отношения лактат/пируват, уровней АТФ, анаэробного порога, уровней восстановленного коэнзима Q (CoQred), уровней окисленного коэнзима Q (CoQox), уровней общего (суммарного) коэнзима Q (CoQtot), уровней окисленного цитохрома С, уровней восстановленного цитохрома С, отношения окисленный цитохром С/восстановленный цитохром С, уровней ацетоацетата, уровней -гидроксибутирата, отношения ацетоацетат/-гидроксибутират, уровней 8-гидрокси-2'-дезоксигуанозина (8-OHdG) и уровней реакционноспособных частиц кислорода известны в данной области техники и могут быть использованы для оценки эффективности соединений и способов по изобретению (для целей изобретения модуляция,нормализация или увеличение биомаркеров энергии включает модуляцию, нормализацию или увеличение анаэробного порога). Табл. 1, приведнная ниже, иллюстрирует действие, которое различные дисфункции могут оказывать на биомаркеры биохимии и энергии. Она также показывает физический эффект (такой как симптом заболевания или другое действие дисфункции), обычно связанный с этой дисфункцией. Следует отметить, что любой из биомаркеров энергии обычно связан с данной дисфункцией. Следует отметить, что любой из биомаркеров энергии, перечисленных в таблице, наряду с биомаркерами энергии, перечисленными где-либо ещ, можно также модулировать, увеличивать или нормализовать соединениями и способами по изобретению. RQ - дыхательный коэффициент; BMR - скорость основного обмена веществ;HR(СО) - частота сердечных сокращений (минутный сердечный выброс); Т - температура тела (предпочтительно измеряемая как внутренняя температура); AT - анаэробный порог; рН - рН крови (венозной и/или артериальной). Таблица 1 Лечение субъекта, страдающего митохондриальным заболеванием, в соответствии со способами по изобретению может в результате вызвать уменьшение или ослабление симптомов у субъекта, например приостановить дальнейшее прогрессирование болезни. Частичное или полное подавление митохондриального заболевания может привести к уменьшению тяжести одного или нескольких симптомов, которые иначе бы субъект испытывал. Например, частичное подавление MELAS могло бы привести к уменьшению числа инсультов и судорожных припадков. Любой из биомаркеров энергии, описанных здесь, или любая комбинация этих биомаркеров энергии предоставляет удобно измеряемые контрольные точки (показатели) для оценки эффективности лечения или подавляющей терапии. Кроме того, специалистам в данной области известны и другие биомаркеры энергии, мониторинг которых позволяет оценивать эффективность лечения или подавляющей терапии. Применение соединений для модуляции биомаркера энергии Наряду с мониторингом биомаркера энергии для оценки статуса лечения или подавления митохондриальных заболеваний соединения по изобретению можно использовать для того, чтобы модулировать биомаркер энергии у субъектов или пациентов. Нормализация биомаркера энергии определяется или как возвращение уровня биомаркера энергии к нормальным или почти нормальным уровням у субъекта, у которого уровнь биомаркера энергии указывает на патологические отличия от нормального уровня (например, уровня у здорового субъекта), или изменение биомаркера энергии для ослабления патологических симптомов у субъекта. В зависимости от природы биомаркера энергии измеренные значения таких уровней могут быть либо выше, либо ниже нормального значения. Например, патологический уровень лактата обычно выше, чем уровень лактата у нормального (т.е. здорового) человека, и, возможно, требуется уменьшение уровня лактата. Патологический уровень АТФ обычно ниже, чем уровень АТФ у нормального (т.е. здорового) человека, и, возможно, требуется повышение уровня АТФ. Соответственно нормализация биомаркеров энергии может включать возвращение уровня биомаркеров энергии в пределах приблизительно по меньшей мере двух стандартных отклонений от нормального у субъекта, более предпочтительно в пределах приблизительно по меньшей мере одного стандартного отклонения от нормального у субъекта, в пределах приблизительно, по меньшей мере, половины стандартного отклонения от нормального у субъекта или в пределах приблизительно по меньшей мере одной четверти стандартного отклонения от нормального. Когда увеличение уровня биомаркера энергии требуется для нормализации одного или нескольких таких биомаркеров энергии, уровень биомаркера энергии может быть увеличен в пределах приблизительно по меньшей мере двух стандартных отклонений от нормального у субъекта, более предпочтительно увеличен в пределах приблизительно по меньшей мере одного стандартного отклонения от нормального у субъекта, увеличен в пределах приблизительно, по меньшей мере, половины стандартного отклонения от нормального или в пределах приблизительно по меньшей мере одной четверти стандартного отклонения от нормального введением одного или нескольких соединений по изобретению. Альтернативно, уровень одного или нескольких биомаркеров энергии может быть увеличен в пределах по меньшей мере примерно на 10% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, по меньшей мере примерно на 20% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, по меньшей мере примерно на 30% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, по меньшей мере примерно на 40% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, по меньшей мере примерно на 50% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, по меньшей мере примерно на 75% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением или по меньшей мере примерно на 100% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением. Когда уменьшение уровня биомаркера энергии требуется для нормализации одного или нескольких биомаркеров энергии, уровень одного или нескольких таких биомаркеров энергии можно уменьшить в пределах приблизительно по меньшей мере двух стандартных отклонений от нормального у субъекта,- 17019675 более предпочтительно уменьшен в пределах приблизительно по меньшей мере одного стандартного отклонения от нормального у субъекта, уменьшен в пределах приблизительно по меньшей мере до половины стандартного отклонения от нормального или в пределах приблизительно по меньшей мере одной четверти стандартного отклонения от нормального, введением одного или нескольких соединений по изобретению. Альтернативно, уровень одного или нескольких биомаркеров энергии можно уменьшать в пределах по меньшей мере примерно на 10% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, в пределах по меньшей мере примерно на 20% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, в пределах по меньшей мере примерно на 30% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением, в пределах по меньшей мере примерно на 40% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением по меньшей мере примерно на 50% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением по меньшей мере примерно на 75% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением или по меньшей мере примерно на 100% ниже уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта перед введением. Увеличение уровня одного или нескольких биомаркеров энергии определяют как изменение существующих уровней одного или нескольких биомаркеров энергии у субъекта до уровня, который обеспечивает предпочтительное или требуемое действие на субъект. Например, на человека, подвергаемого напряжению всех сил или продолжительной сильной физической нагрузке, например альпинизму, могут оказывать благоприятное действие повышенные уровни АТФ или пониженные уровни лактата. Как описано выше, нормализация биомаркеров энергии может не достигать оптимального состояния для субъекта с митохондриальным заболеванием, и на таких субъектов может благоприятно влиять увеличение биомаркеров энергии. Примеры субъектов, на которых благоприятно действуют повышенные уровни одного или нескольких биомаркеров энергии, включают (но не ограничиваются перечисленными ниже) субъектов, подвергаемых сильной и продолжительной физической нагрузке; субъектов с хроническими энегетическими проблемами; субъектов с хроническими дыхательными проблемами; беременных женщин, беременных женщин в родах; новорожденных; недоношенных новорожденных; субъектов, подвергавшихся воздействию экстремальной окружающей среды, такой как условия жаркого климата (окружающая среда, температура которой обычно ниже 32 Фаренгейта или около 0 С в течение 4 ч в день или больше) или условия холодного климата; субъектов, подвергавшихся воздействию окружающей среды с содержанием кислорода ниже среднего; среды с содержанием диоксида углерода выше среднего; среды с уровнями загрязнения воздуха выше средних (авиапутешественников; бортпроводников; субъектов в условиях высоты; субъектов, живущих в городах с качеством воздуха ниже среднего уровня; субъектов, работающих в закрытых пространствах, где качество воздуха ухудшилось); субъектов с заболеваниями легких или субъектов с объемом легких ниже среднего, таких как больные туберкулзом; больные раком легких; больные с эмфиземой; больные с кистозным фиброзом; субъектов, выздоравливающих после хирургической операции или болезни; субъектов пожилого возраста, включающих пожилых субъектов, испытывающих снижение энергии, и субъектов, страдающих хронической усталостью, включая страдающих синдромом хронической усталости; субъектов, получивших сильную травму; субъектов в шоке; субъектов, которым требуется однократное введение кислорода; субъектов, которым требуется постоянное введение кислорода, или других субъектов с острой, хронической или непрерывной потребностью в энергии, на которых благоприятно действует повышение уровней одного или нескольких биомаркеров энергии. Соответственно, когда увеличение уровней одного или нескольких биомаркеров энергии благоприятно действует на субъекта, усиление одного или нескольких биомаркеров энергии может включать увеличение уровня соответствующего биомаркера энергии или биомаркеров энергии до примерно по меньшей мере одной четверти стандартного отклонения выше нормального, до примерно по меньшей мере половины стандартного отклонения выше нормального, до примерно по меньшей мере одного стандартного отклонения выше нормального или до примерно по меньшей мере двух стандартных отклонений выше нормального. Альтернативно, уровень одного или нескольких биомаркеров энергии можно увеличивать на примерно по меньшей мере 10% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 20% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 20% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 20% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 30% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 40% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 50% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, примерно по меньшей мере на 75% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления, при- 18019675 мерно по меньшей мере на 100% выше уровня, соответствующего одному или нескольким биомаркерам энергии у субъекта до усиления. Когда уменьшение уровня одного или нескольких биомаркеров энергии требуется для усиления одного или нескольких биомаркеров энергии, уровень одного или нескольких биомаркеров энергии может быть уменьшен количеством около по меньшей мере одной четверти стандартного отклонения от нормального у субъекта, может быть уменьшен количеством около по меньшей мере половины стандартного отклонения от нормального у субъекта, может быть уменьшен количеством около по меньшей мере одного стандартного отклонения от нормального у субъекта, может быть уменьшен количеством около по меньшей мере двух стандартных отклонений от нормального у субъекта. Альтернативно, уровень одного или нескольких биомаркеров энергии может быть уменьшен на примерно по меньшей мере 10% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления,на примерно по меньшей мере 20% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления, на примерно по меньшей мере 30% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления, на примерно по меньшей мере 40% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления, на примерно по меньшей мере 50% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления, на примерно по меньшей мере 75% ниже уровня у субъекта,соответствующего одному или нескольким биомаркерам энергии до усиления, на примерно по меньшей мере 90% ниже уровня у субъекта, соответствующего одному или нескольким биомаркерам энергии до усиления. Применение соединений в научных исследованиях, экспериментальных системах и анализах Соединения по изобретению можно также использовать в научных исследованиях, таких как invitro, in vivo или ex vivo экспериментах, с целью модулировать один или несколько биомаркеров энергии в экспериментальной системе. Такими экспериментальными системами могут быть образцы клеток, образцы тканей, компоненты клеток или смеси компонентов клеток, частичные органы, целые органы или организмы. Такие научные исследования могут включать (но не ограничиваются ими) применение в качестве реагентов для анализа, выяснение биохимических путей или оценку эффектов других агентов на метаболическое состояние экспериментальной системы в присутствии/в отсутствие одного или нескольких соединений по изобретению. Кроме того, соединения по изобретению можно использовать в биохимических тестах или анализах. Такие тесты могут включать инкубирование одного или нескольких соединений по изобретению с образцом ткани или клетки, взятым у субъекта, чтобы оценить потенциальную реакцию субъекта (или реакции конкретной подгруппы субъектов) на введение указанных одного или нескольких соединений или чтобы определить, какое из соединений по изобретению обеспечивает оптимальное действие на конкретного субъекта или подгруппу субъектов. Один такой тест или анализ включал бы 1) получение образца клетки или образца ткани от субъекта или подгруппы субъектов, у которых можно оценить модуляцию одного или нескольких биомаркеров энергии; 2) введение одного или нескольких соединений по изобретению в образец(цы) клетки или образец(цы) ткани; 3) определение количества модуляции одного или нескольких биомаркеров энергии после введения по меньшей мере двух соединений по сравнению со статусом биомаркера энергии до введения по меньшей мере двух соединений и 4) выбор соединения для применения в лечении, подавлении или модуляции на основании количества модуляции, определнной на стадии 3). Фармацевтические рецептуры Соединения, описанные в настоящей заявке, могут изготавливаться как фармацевтические композиции путем составления их с добавками, такими как фармацевтически приемлемые эксципиенты, фармацевтически приемлемые носители и фармацевтически приемлемые среды. Подходящие фармацевтически приемлемые эксципиенты, носители и среды включают агенты для обработки и модификаторы доставки лекарственных средств и энхансеры, такие, например, как фосфат кальция, стеарат магния, тальк,моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, декстроза, гидроксипропилциклодекстрин, поливинилпирролидинон, низкоплавкие воски,ионообменные смолы и т.п., а также комбинации любых двух или нескольких из них. Другие подходящие фармацевтически приемлемые эксципиенты описаны в книгах ["Remington's PharmaceuticalSciences", Mack Pub. Co., New Jersey (1991), and "Remington: The Science and Practice of Pharmacy", Lippincott WilliamsWilkins, Philadelphia, 20th edition (2003) and 21st edition (2005)], включнных в настоящую заявку путем ссылки. Фармацевтическая композиция может содержать рецептуру стандартной дозы, где стандартная доза представляет собой дозу, достаточную для того, чтобы оказывать терапевтическое или подавляющее действие, или количество, эффективное, чтобы модулировать, нормализовать или усиливать биомаркер энергии. Стандартная доза может быть достаточна как одноразовая доза, чтобы оказывать терапевтическое или подавляющее действие или количество, эффективное, чтобы модулировать, нормализовать или усиливать биомаркер энергии. Альтернативно, стандартная доза может быть дозой, вводимой через определнные промежутки- 19019675 времени в ходе лечения или подавления заболевания, или для модуляции, нормализации или усиления биомаркера энергии. Фармацевтические композиции, содержащие соединения по изобретению, могут находиться в любой форме, подходящей для намечаемого способа введения, включающей, например, раствор, суспензию или эмульсию. Жидкие носители обычно используют для получения растворов, суспензий и эмульсий. Жидкие носители, рассматриваемые для применения в практике настоящего изобретения, включают,например, воду, физиологический раствор, фармацевтически приемлемый(е) органический(е) растворитель(и), фармацевтически приемлемые масла и жиры и т.п., а также смеси двух или нескольких из них. Жидкий носитель может содержать другие подходящие фармацевтически приемлемые добавки, такие как солюбилизаторы, эмульгаторы, питательные вещества, буферы, консерванты, суспендирующие агенты, загустители, регуляторы вязкости, стабилизаторы и т.п. Подходящие органические растворители включают, например, одноатомные спирты, такие как этанол, и многоатомные спирты, такие как гликоли. Подходящие масла включают, например, соевое масло, кокосовое масло, оливковое масло, подсолнечное масло, хлопковое масло и т.п. Для парентерального введения носитель также может представлять собой сложный эфир жирных кислот, такой как этилолеат, изопропилмиристат и т.п. Композиции по настоящему изобретению могут также быть в виде микрочастиц, микрокапсул, липосомных инкапсулятов и т.п., а также в виде комбинаций любых двух или нескольких из них. Можно использовать системы доставки с замедленным или контролируемым высвобождением, такие как система матрицы с контролем диффузии или эродируемая система, как описано, например, в работах [Lee, "Diffusion-Controlled Matrix Systems", pp. 155-198 and Ron and Langer, "Erodible Systems", pp. 199-224, in "Treatise on Controlled Drug Delivery", A. Kydonieus Ed., Marcel Dekker, Inc., New York 1992]. Матрица может представлять собой, например, способное к биологическому разрушению вещество, которое может разрушаться самопроизвольно in situ and in vivo, например гидролизом или ферментативным расщеплением, например протеазами. Система доставки может представлять собой, например,встречающийся в природе или синтетический полимер или сополимер, например, в виде гидрогеля. Типичные полимеры со способными расщепляться связями - сложные полиэфиры, сложные полиортоэфиры, полиангидриды, полисахариды, поли(фосфоэфиры), полиамиды, полиуретаны, поли(имидокарбонаты) и поли(фосфазены). Соединения по изобретению можно вводить энтерально, перорально, парентерально, сублингвально, путем ингаляции (например, в виде туманов или спреев), ректально или местно в виде лекарственных форм, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и среды, если требуется. Например, подходящие варианты введения включают пероральное, подкожное,трансдермальное, трансмукозальное, ионтофоретическое, внутривенное, внутриартериальное, внутримышечное, внутрибрюшинное, интраназальное (например, через слизистую носа), субдуральное, ректальное, желудочно-кишечное и т.п. и непосредственно в конкретные или пораженные орган или ткань. Для доставки в центральную нервную систему можно использовать спинальное и эпидуральное введение или введение в желудочки мозга. Местное введение может также включать применение трансдермального введения, например трансдермального пластыря или приборов для ионтофореза. Термин парентеральный, используемый в настоящей заявке, включает подкожные инъекции, внутривенные, внутримышечные, надчревные инъекции или метод инфузии. Соединения смешивают с фармацевтически приемлемыми носителями, адъювантами и средами, соответствующими нужному пути введения. Пероральное введение является предпочтительным путем, и рецептуры, подходящие для перорального введения, являются предпочтительными рецептурами. Соединения, описанные для применения здесь, можно вводить в твердой форме, в жидкой форме в аэрозольной форме или в виде таблеток, пилюль, порошкообразных смесей гранул, препаратов для инъекций, кремов, растворов, суппозиториев, клизм, форм для промывания толстой кишки, эмульсий, дисперсий, пищевых смесей и других подходящих формах. Соединения можно также вводить в виде пролекарств, где пролекарство претерпевает трансформацию в субъекте,подвергаемом лечению, для образования соединения, которое является терапевтически эффективным. Дополнительные способы введения известны в данной области техники. Препараты для инъекций, например стерильные инъецируемые водные или масляные суспензии,могут быть приготовлены, как известно в данной области техники, с использованием подходящих диспергирующих и увлажняющих средств и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в пропиленгликоле. В числе приемлемых сред и растворителей, которые можно использовать, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое асептическое нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, для получения препаратов для инъекций применяют олеиновую кислоту. Суппозитории для ректального введения лекарственного средства можно получать, смешивая лекарственное средство с подходящим нераздражающим эксципиентом, таким как масло какао и полиэтиленгликоли, которые представляют собой тврдые вещества при комнатной температуре, но становятся- 20019675 жидкими при ректальной температуре и поэтому плавятся в прямой кишке и высвобождают лекарство. Твердые лекарственные формы для перорального введения могут включать капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение может быть смешано по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также содержать дополнительные вещества, отличающиеся от инертных разбавителей, например смазывающие вещества, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферы. На таблетки и пилюли может быть дополнительно нанесено энтеросолюбильное покрытие. Жидкие лекарственные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители. Обычно используемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области техники, такие как вода. Такие композиции могут также содержать адъюванты, такие как увлажняющие вещества, эмульгаторы, суспендирующие агенты, циклодекстрины и подслащивающие вещества и вещества, придающие вкус и аромат. Соединения по настоящему изобретению можно также вводить в виде липосом. Как известно в данной области техники, липосомы обычно получаются из фосфолипидов или других липидных веществ. Липосомы образуют одно- или многослойные гидратированные жидкие кристаллы, которые диспергированы в водной среде. Можно использовать любой нетоксичный физиологически приемлемый метаболизирующий липид, способный образовывать липосомы. Настоящие композиции в липосомной форме могут содержать, кроме соединения по настоящему изобретению, стабилизаторы, консерванты, эксципиенты и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины) как натуральные, так и синтетические. Способы формирования липосом известны в данной области техники. См., например, [Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.W., p. 33et seq (1976)]. Количество активного ингредиента, которое можно объединять с веществами-носителями, чтобы получить монолитную лекарственную форму, будет варьироваться в зависимости от хозяина, которому вводят активный ингредиент, и конкретного метода введения. Однако понятно, что конкретная дозировка для любого конкретного пациента будет зависеть от множества факторов, включающих активность конкретного применяемого соединения, возраста, массы тела, участка тела, индекса массы тела (BMI),общего состояния здоровья, пола, режима питания, времени введения, пути введения, скорости выведения, комбинации лекарственных средств и типа, хода и тяжести конкретного заболевания, которое подвергается лечению. Выбранную стандартную лекарственную форму обычно готовят и вводят для того,чтобы обеспечить определнную конечную концентрацию лекарственного средства в крови, тканях, органах или другой таргетной области организма. Терапевтически эффективное количество или эффективное количество для заданной ситуации можно легко определить с помощью общепринятых экспериментов, о которых знает и которыми владеет обычный практикующий врач. Примеры дозировок, которые можно использовать, представляют собой эффективные количества в интервале доз от около 0,1 мкг/кг до около 300 мг/кг, или от около 1,0 мкг/кг до около 40 мг/кг массы тела, или от около 1,0 мкг/кг до около 20 мг/кг массы тела, или от около 1,0 мкг/кг до около 10 мг/кг массы тела, от около 10,0 мкг/кг до около 10 мг/кг массы тела, или от около 100 мкг/кг до около 10 мг/кг массы тела, или от около 1,0 до около 10 мг/кг массы тела, от около 10 до около 100 мг/кг массы тела,или от около 50 до около 150 мг/кг массы тела, или от около 100 до около 200 мг/кг массы тела, от около 150 до около 250 мг/кг массы тела, или от около 200 до около 300 мг/кг массы тела, или от около 250 до около 300 мг/кг массы тела. Другие дозировки, которые можно применять, составляют около 0,01 мг/кг массы тела, около 0,1 мг/кг массы тела, около 1 мг/кг массы тела, около 10 мг/кг массы тела, около 20 мг/кг массы тела, около 30 мг/кг массы тела, около 40 мг/кг массы тела, около 50 мг/кг массы тела, около 75 мг/кг массы тела, около 100 мг/кг массы тела, около 125 мг/кг массы тела, около 150 мг/кг массы тела,около 175 мг/кг массы тела, около 200 мг/кг массы тела, около 225 мг/кг массы тела, около 250 мг/кг массы тела, около 275 мг/кг массы тела или около 300 мг/кг массы тела. Соединения по настоящему изобретению можно вводить как одну дневную дозу, а можно разделить е и вводить два, три или четыре раза в день. Изобретение дополнительно поясняется следующими ниже не ограничивающими примерами. Примеры Пример 1. Синтез соединений. 2,3-Диметил-5,6-бис(3-метилбутил)[1,4]бензохинон Раствор FeCl36H2O (81,0 г, 300 ммоль) в воде (100 мл) прибавляют к раствору 2,3-диметилбензол- 21019675 1,4-диола (13,8 г, 100 ммоль) в МТВЕ (150 мл) при температуре окружающей среды. К энергично перемешиваемой смеси прибавляют водный раствор гидроксида натрия (2,5 М, 60 мл, 150 ммоль) и реакционную смесь нагревают при 50 С в течение 5 ч. Прибавляют МТВЕ (150 мл) и воду (150 мл) и далее экстрагируют водный слой МТВЕ (2100 мл). Объединенные органические экстракты промывают насыщенным раствором хлорида натрия (100 мл), сушат (Na2SO4), концентрируют и получают промежуточный продукт 2,3-диметил[1,4]бензохинон в виде оранжево-жлтого тврдого вещества (12,0 г, 88%), который используют на следующей стадии без дополнительной очистки. Раствор нитрата серебра (I) (3,40 г, 20 ммоль) в воде (50 мл) прибавляют к смеси 2,3 диметил[1,4]бензохинона (1,36 г, 10 ммоль) и 4-метилпентановой кислоты (1,26 мл, 1,16 г, 20 ммоль) в ацетонитриле (50 мл) при температуре окружающей среды. Смесь энергично перемешивают, нагревают до 75-80 С и прибавляют по каплям через шприцевой насос раствор персульфата аммония (4,56 г, 20 ммоль) в воде (30 мл) в течение 4 ч. После 20 ч большую часть ацетонитрила удаляют на роторном испарителе, остаток распределяют между МТВЕ (100 мл) и водой (100 мл) и водный слой далее экстрагируют МТВЕ (50 мл). Объединенные органические экстракты промывают системой насыщенный раствор хлорида натрия-вода (1:1) (50 мл) и затем концентрируют. Оранжево-красный остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование от 1 до 2,5% EtOAc-смесь гексанов,и получают 2,3-диметил-5,6-бис(3-метилбутил)[1,4]бензохинон в виде желтого масла (200 мг, 7%). 1 Н-ЯМР (CDCl3, 400 МГц,м.д.): 2,42-2,38 (4 Н, м), 1,99 (6 Н, с), 1,62 (2 Н, нонет, J=7 Гц), 1,28-1,22 К перемешиваемому раствору 113 мг 2,2,7,8-тетраметил-5-(3-метилбут-2-енил)хроман-6-ола (полученного по методу Уокиншоу и др., патент США 2005/0065099 A1, Mar. 24, 2005) в 3,75 мл смеси ацетонитрил-вода (5:1) при 5 С прибавляют жлтый раствор церий(IV) аммоний нитрата (475 мг) в смеси ацетонитрил-вода (1:4, 2,75 мл) в течение 5 мин. Реакционную смесь оставляют перемешиваться в течение дополнительных 5 мин, затем е выливают в делительную воронку, содержащую дихлорметан (30 мл) и воду (30 мл). Водный слой удаляют и оставшийся органический слой промывают один раз 1,0 М раствором хлорида натрия (30 мл), затем сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Хроматографией на силикагеле (15% этилацетат-85% смесь гексанов) получают 58 мг 2-(3 гидрокси-3-метилбутил)-5,6-диметил-3-(3-метилбут-2-енил)[1,4]бензохинона. 1 Н ЯМР (CDCl3, 400 МГц) 4,92 (т, 1 Н), 3,18 (д, 2 Н), 2,54 (т, 2 Н), 1,99 (с, 6 Н), 1,74 (с, 3 Н), 1,66 (с,3 Н), 1,52 (м, 2 Н), 1,26 (с, 6 Н). 2-(3-Гидрокси-3-метилбутил)-5,6-диметил-3-(3-метилбутил)[1,4]бензохинон К раствору 2,2,7,8-тетраметил-5-(3-метилбут-2-енил)хроман-6-ола (68 мг) в этилацетате (2,4 мл) прибавляют Pd/C (26 мг, 5% мас./мас.). Полученную суспензию продувают газообразным водородом,сосуд плотно закрывают и содержимое перемешивают при давлении газа водорода 1 атм в течение 30 мин. Затем смесь фильтруют и концентрируют в вакууме. Полученный остаток растворяют в смеси ацетонитрил-вода (5:1, 2,6 мл) и раствор охлаждают до 5 С на бане лд-вода. В реакционную смесь прибавляют раствор церий(IV)аммоний нитрата (287 мг) в смеси ацетонитрил-вода (1:4, 1,6 мл) в течение 5 мин. Реакционную смесь оставляют перемешиваться в течение дополнительных 5 мин, затем е выливают в делительную воронку, содержащую дихлорметан (30 мл) и воду (30 мл). Водный слой удаляют и оставшийся органический слой промывают один раз 1,0 М раствором хлорида натрия (30 мл), затем сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Хроматографией на силикагеле Цирконоцендихлорид (1,66 г, 5,6 ммоль) обрабатывают дихлорэтаном (22 мл) и прибавляют раствор триметилалюминия (23 ммоль, 2,0 М в гептане). Прозрачный жлтый раствор перемешивают в течение 0,75 ч и охлаждают до 0 С. Прибавляют чистый 5-хлор-1-пентин в течение 1 ч при 0 С и перемешивают в течение 10 ч при комнатной температуре. Прозрачный коричневый раствор концентрируют в вакууме и растирают в безводной смеси гексанов (35 мл), причем растворитель удаляют в вакууме после каждого цикла. Затем прибавляют смесь гексанов (10 мл) и раствор удаляют пипеткой из твердых веществ. Твердые вещества промывают смесью гексанов (5 мл) и объединенные гексановые растворы разбавляют ТГФ(80 мл). Полученный раствор 1-(хлорметил)-2,5-диметокси-3,4,6-триметилбензола (4,009 г, 17,5 ммоль) в ТГФ (10 мл) прибавляют к винилалану через пипетку и объединнный раствор охлаждают до 10 С. Катализатор получают обработкой бис-(трифенилфосфин)никельдихлорид (579 мг, 0,87 ммоль) в ТГФ (5 мл)n-BuLi (1,6 М в смеси гексанов, 1,75 ммоль). Затем кроваво-красный прозрачный раствор катализатора прибавляют через пипетку к раствору винилалана при 10 С и дают реакционной смеси нагреться до комнатной температуры в течение 7 ч. Реакционную смесь охлаждают до 0 С и гасят, медленно прибавляя 2,5 М HCl (100 мл) в течение 0,5 ч, затем прибавляют смесь гексанов (100 мл) и разделяют. Водный слой экстрагируют смесью гексанов (2100 мл), смесью 50% EtOAc/смесь гексанов (150 мл) и объединяют органические слои, промывают один раз насыщенным водным раствором хлорида натрия, сушат над безводным Na2SO4 и концентрируют, получая коричневое масло. Многократная флэш-хроматография дат 5,2 г (E)-1-(7-хлор-3-метилгепт-2-енил)-2,5-диметокси-3,4,6-триметилбензола в виде прозрачного масла (94,6%). 1 Н ЯМР (400 МГц, CDCl3) : 5,05 (т, J=6,4 Гц, 1H), 3,63 (с, 6 Н), 3,49 (т, J=6,4 Гц, 2 Н), 3,35 (д, J=8,4 Гц, 1H), 2,16 (с, 9 Н), 1,98 (т, J=7,6 Гц, 2 Н), 1,76 (с, 3 Н), 1,70 (м, 2 Н), 1,52 (м, 2 Н). 13 С ЯМР (100 МГц,CDCl3) : 153,0; 152,7; 134,4; 131,4; 128,3; 127,9; 127,6; 123,8; 60,9; 60,1; 45,0; 38,8; 32,2; 26,1; 25,1; 16,1; 12,8; 12,7; 12,2.CAN (709 мг, 1,29 ммоль) растворяют в AcCN (7 мл) и воде (3 мл), затем охлаждают до 0 С. В отдельной колбе растворяют (E)-1-(7-хлор-3-метилгепт-2-енил)-2,5-диметокси-3,4,6-триметилбензол (175 мг, 0,53 ммоль) растворяют в AcCN (2 мл) и 1 капле H2O и переносят в перемешиваемый раствор CAN. Перемешивают в течение 1 ч, затем прибавляют дополнительную загрузку CAN (350 мг) и дают перемешиваться в течение 1 ч. Прибавляют воду (10 мл) и EtOAc (10 мл), слои разделяют и объединенные органические слои промывают H2O (25 мл). Объединенные водные фазы экстрагируют EtOAc (25 мл) и объединнные органические слои промывают насыщенным водным раствором хлорида натрия (25 мл),сушат над безводным Na2SO4, концентрируют и получают желтое масло. Флэш-хроматография (SiO2) дат 29,7 мг (E)-2-(7-хлор-3-метилгепт-2-енил)-3,5,6-триметилциклогекса-2,5-диен-1,4-дион в виде желтого масла (18,7%). 1 Н ЯМР (400 МГц, CDCl3)4,95 (т, J=6,8 Гц, 1 Н), 3,50 (т, J=6,8 Гц, 2 Н), 3,19 (д, J=6,8 Гц, 2 Н), 2,00 Цирконоцендихлорид (982 мг, 3,36 ммоль) обрабатывают триметилалюминием (13,1 мл, 2,0 М в гептане) и дихлорэтаном (13 мл). Ярко-жлтый раствор охлаждают до 0 С и прибавляют 5-хлор-1-пентин в течение 5 мин. Реакцию проводят при 0 С в течение 0,25 ч и нагревают до комнатной температуры. Через 5,5 ч объм темно-жлтого раствора уменьшают в вакууме до примерно 70% первоначального объема и растирают в смеси гексанов (210 мл). Прибавляют последнюю порцию смеси гексанов (10 мл) и удаляют растворитель пипеткой из выпавших в осадок солей, которые дополнительно промывают гексаном (22 мл), обеспечивая полный перенос. Винилалан, который затем разбавляют ТГФ (40 мл) и обра- 23019675 батывают 1-(хлорметил)-2,5-диметокси-3,4,6-триметилбензолом (1,35 г) в ТГФ (15 мл) через пипетку. В отдельной колбе бис-(трифенилфосфин)никельдихлорид (967 мг, 1,47 ммоль) в ТГФ (5 мл) обрабатывают н-BuLi (260 мл, 1,6 М в гептане, 0,416 ммоль) и получают темно-красный прозрачный раствор, который прибавляют к раствору винилалана. Реакционную смесь помещают в водяную баню с температурой 15 С, чтобы контролировать экзотермическую реакцию и оставляют перемешиваться на ночь при комнатной температуре. Реакционную смесь гасят обработкой лимонной кислотой (11 г) в H2O (50 мл) путем е медленного прибавления, затем прибавляют смесь гексанов (50 мл) и Н 2 О (50 мл) при перемешивании дополнительно в течение 20 мин. Слои разделяют и водную фазу экстрагируют смесью гексанов (350 мл), затем МТВЕ (250 мл). Объединенные органические слои промывают насыщенным раствором хлорида натрия (220 мл), сушат над безводным Na2SO4 и концентрируют, получая коричневое масло. Флэш-хроматография дат 2,011 г (74,0%) (E)-1-(6-хлор-3-метилгекс-2-енил)-2,5-диметокси-3,4,6 триметилбензола в виде прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3) : 5,11 (т, J=7,2 Гц, 1 Н), 3,65 (с, 6 Н), 3,48 (т, J=6,8 Гц, 2 Н), 3,76 (д, J=6,4 Гц, 2 Н), 2,18 (с, 9 Н), 2,10 (т, J=7,2 Гц, 2 Н), 1,84 (квинтет, J=7,2 Гц, 2 Н), 1,78 (с, 3 Н). 13 С ЯМР (100 МГц,CDCl3) : 153,0; 152,6; 133,4; 131,3; 128,4; 127,9; 127,6; 124,5; 60,9; 60,1; 44,6; 36,6; 30,8; 26,1; 16,2; 12,8; 12,7; 12,2. 1-E)-6-Йод-3-метилгекс-2-енил)-2,5-диметокси-3,4,6-триметилбензолNal (3,09 г, 20,61 ммоль) растворяют в ацетоне (10 мл) и кипятят с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и мутный раствор прибавляют к Н 2 О (50 мл) и 50% раствору EtOAc/смесь гексанов (50 мл), слои разделяют и водную фазу экстрагируют смесью гексанов (325 мл), затем МТВЕ (225 мл). Органические слои объединяют и промывают насыщенным раствором NaCl (225 мл) и сушат над безводным Na2SO4. После концентрирования получают 930,0 мг Цирконоцендихлорид (220 мг, 0,755 ммоль) обрабатывают триметилалюминием в гептане (3 мл 2,0 М) и удаляют растворитель в вакууме. Прибавляют дихлорэтан (3 мл) и желтый раствор охлаждают до 0 С перед медленным прибавлением 450 мкл 1-октина (336 мг, 3,05 ммоль). Через 20 мин удаляют ледяную баню и реакционную смесь нагревают до комнатной температуры в течение 2,5 ч, в это время реакционную смесь концентрируют в вакууме, получая жлтую взвесь, растирают в смеси гексанов (4 мл) и удаляют растворитель в вакууме. Прибавляют смесь гексанов (3 мл) и жидкость удаляют пипеткой с белых твердых веществ. Твердые вещества промывают 2 мл смеси гексанов и промывные воды объединяют, концентрируют, получая желтое масло, растворяют в ТГФ (5 мл) и охлаждают до -78 С. 2(Хлорметил)-3,5,6-триметил-1,4-бензохинон (400 мг, 2,01 ммоль) растворяют в ТГФ (3 мл) и переносят в винилалан пипеткой с ТГФ (21 мл), чтобы способствовать переносу. Бис-(трифенилфосфин)никельдихлорид (66,2 мг, 0,101 ммоль) суспендируют в ТГФ (2 мл), обрабатывают н-BuLi в смеси гексанов (1,6 М, 0,20 ммоль) и получают прозрачный кроваво-красный раствор, который прибавляют пипеткой к охлажденному раствору винилалана хлорметилхинона. Реакционную смесь нагревают до комнатной температуры в течение ночи и охлаждают до -20 С перед прибавлением 1 М раствора лимонной кислоты (20 мл). Раствор перемешивают в течение 0,75 ч, прибавляют EtOAc (10 мл) и слои разделяют. Водную фазу экстрагируют EtOAc (210 мл), объединенные органические слои промывают насыщенным раствором хлорида натрия (210 мл), сушат над безводным Na2SO4 и концентрируют, получая желтое масло. Многократная флэш-хроматография дает 138,7 мг (23,9%) (E)-2,3,5-триметил-6-(3 метилнон-2-енил)-1,4-бензохинона в виде жлтого масла. 1 Н ЯМР (400 МГц, CDCl3) : 4,91 (т, J=6,8 Гц, 1 Н), 3,18 (д, J=6,8 Гц, 2 Н), 2,00 (с, 9 Н), 1,92 (т, J=8,0 Гц, 2 Н), 1,70 (с, 3 Н), 1,34-1,21 (м, 8 Н), 0,84 (т, J=6,8 Гц, 3 Н). 13 С ЯМР (100 МГц, CDCl3)187,8; 187,0; 1-E)-6-Йод-3-метилгекс-2-енил)-2,5-диметокси-3,4,6-триметилбензол (412 мг, 1,024 ммоль) объединяют с NaCN (247,7 мг) и растворяют в DMF (2 мл). Реакционную смесь перемешивают в течение 25 ч при 45 С, затем охлаждают до комнатной температуры. К смеси прибавляют H2O (10 мл), затем МТВЕ (6 мл) и слои разделяют. Водную фазу экстрагируют МТВЕ (46 мл) и объединенные органические слои промывают Н 2 О (25 мл), насыщенным раствором NaCl (25 мл) и сушат над Na2SO4. Органические слои концентрируют и получают (E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5-еннитрил в виде светло-жлтого масла, 306,4 мг (99,0%). 1 Н ЯМР (400 МГц, CDCl3) : 5,14 (т, J=6,4 Гц, 1H), 3,65 (с, 6 Н), 3,37 (д, J=6,8 Гц, 2 Н), 2,26 (т, J=7,2 Гц, 2 Н), 2,18 (с, 9 Н), 2,12 (т, J=7,2 Гц, 2 Н), 1,76 (м, 4 Н). 13 С ЯМР (100 МГц, CDCl3) : 153,1; 152,6; 132,5; 131,0; 128,5; 128,0; 125,4; 119,7; 60,8; 60,1; 38,2; 38,2; 26,1; 23,5; 16,4; 15,9; 12,8; 12,7; 12,2. К LAH (102 мг, 2,69 ммоль) в ТГФ (5 мл) прибавляют (Е)-7-(2,5-диметокси-3,4,6-триметилфенил)-5 метилгепт-5-еннитрил (150,9 мг, 0,5006 ммоль) в ТГФ (5 мл) из капельной воронки в течение 10 мин. Через 4,25 ч мутный серый раствор помещают в водяную баню с комнатной температурой и осторожно обрабатывают Na2SO410 H2O (996 мг). Баню убирают и реакционную смесь энергично перемешивают в течение 1 ч, затем прибавляют дополнительное количество Na2SO410 H2O (959 мг) и перемешивают в течение ночи. От органических продуктов отделяют белый осадок, промывают EtOAc (55 мл) и концентрируют, получая прозрачное бесцветное масло (E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт 5-ен-1-амина. Неочищенный амин растворяют в Et3N (2 мл) и обрабатывают чистым Ас 2 О (0,75 мл) в течение 5 мин. Реакция немного экзотермична и реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи, прежде чем гасить прибавлением H2O (10 мл) и EtOAc (10 мл). Слои разделяют и водную фазу экстрагируют EtOAc (310 мл). Объединенные органические слои промывают H2O(210 мл) насыщенным раствором NaCl (215 мл), сушат над безводным Na2SO4 и концентрируют, получая коричневое масло. Флэш-хроматография на силикагеле дат N-E)-7-(2,5-диметокси-3,4,6 триметилфенил)-5-метилгепт-5-енил)ацетамид в виде не совсем белого кристаллического твердого вещества, 130 мг (74,7%). Данные для (E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5-ен-1-амина: 1 Н ЯМР (400 МГц, CDCl3) : 5,05 (т, J=6,0 Гц, 1H), 3,63 (с, 6 Н), 3,35 (д, J=6,0 Гц, 2 Н), 2,64 (т, J=6,8 Гц, 2 Н), 2,16 (с, 9 Н), 1,97 (м, 2 Н), 1,75 (с, 3 Н), 1,63 (м, 2 Н), 1,38 (м, 3 Н). 13 С ЯМР (100 МГц, CDCl3) : 152,9; 152,6; 134,9; 131,5; 128,1; 127,8; 127,6; 123,2; 62,1; 60,7; 60,0; 42,0; 39,3; 33,4; 26,0; 16,1; 12,7; 12,6; 12,0. Данные для N-E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5-енил)ацетамида: 1 Церий-аммоний нитрат (90,1 мг, 0,164 ммоль) растворяют в Н 2 О (0,5 мл) и AcCN (0,5 мл) и охлаждают до 0 С. Прибавляют раствор, содержащий 25,2 мг N-E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5 метилгепт-5-енил)ацетамида (0,0725 ммоль) в AcCN (1 мл) и CH2Cl2 (0,25 мл) в течение 0,5 мин. Реакционную смесь перемешивают в течение 0,75 ч при 0 С, затем разбавляют Н 2 О (2 мл). Слои разделяют, ор- 25019675 ганическую фазу разбавляют EtOAc (5 мл) и промывают Н 2 О (32 мл). Объединенную водную фазу экстрагируют EtOAc (34 мл) и отбрасывают. Объединенные органические слои промывают насыщенным раствором хлорида натрия (23 мл), сушат над Na2SO4, концентрируют в вакууме, подвергают флэшхроматографии (SiO2) и получают N-5E)-5-метил-7-(2,4,5-триметил-3,6-диоксоциклогекса-1,4 диенил)гепт-5-енил)ацетамид в виде ярко-жлтой жидкости. 1 Н ЯМР (400 МГц, CDCl3) : 5,61 (уш.с, 1 Н), 3,20 (м, 4 Н), 2,01 (м, 14 Н), 1,72 (с, 3 Н), 1,41 (м, 2 Н). 1 С ЯМР (100 МГц, CDCl3) : 187,9, 187,1, 170,0, 143,1, 140,43, 140,37, 136,7, 119,9, 60,1, 39,5, 39,2, 29,1 ,25,6,25,0, 23,3, 16,1, 12,4, 12,2.(E)-7-(2,5-Диметокси-3,4,6-триметилфенил)-5-метилгепт-5-еннитрил (178 мг, 0,59 ммоль) сушат азеотропно с толуолом в вакууме (32 мл), повторно растворяют в толуоле (3 мл) и охлаждают до 0 С. Прибавляют по каплям DIBALH (1,0 М в гептане, 0,9 ммоль) в течение 3 мин. Через 1 ч прибавляют Н 2 О(2 мл) и водную H2SO4 (6 мл 2,5 М) и смеси дают нагреться до комнатной температуры в течение 2,5 ч. Прибавляют МТВЕ (5 мл), слои разделяют и водную фазу экстрагируют МТВЕ (35 мл). Объединенные органические слои промывают насыщенным раствором хлорида натрия (10 мл), сушат над безводным Неочищенный (E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5-еннитрил в МеОН (3 мл) охлаждают до 0 С и обрабатывают NaBH4 (64,3 мг, 1,74 ммоль), что сразу же приводит к бурному вспениванию. Через 12 ч прибавляют Н 2 О (10 мл) (осторожно: обильное выделение газа), прибавляют МТВЕ(10 мл), разделяют слои и водную фазу экстрагируют МТВЕ (310 мл). Объединенные органические слои промывают Н 2 О (10 мл), насыщенным раствором хлорида натрия (10 мл), сушат над Na2SO4, концентрируют и получают (Е)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5-ен-1-ол в виде светложлтого масла.(E)-7-(2,5-Диметокси-3,4,6-триметилфенил)-5-метилгепт-5-ен-1-ол в пиридине (2 мл) обрабатывают Ас 2 О (2 мл) при 0 С и оставляют перемешиваться на ночь. Реакционную смесь гасят Н 2 О (10 мл), затем прибавляют EtOAc (10 мл) и разделяют. Водную фазу экстрагируют EtOAc (310 мл) и объединенные органические слои промывают насыщенным раствором хлорида натрия (15 мл), сушат над безводнымNa2SO4 и концентрируют, получая жлтое масло. Флэш-хроматография на силикагеле дат 77,9 мг Церий-аммоний нитрат (270 мг, 0,498 ммоль) растворяют в Н 2 О (0,75 мл) и AcCN (1,5 мл) и раствор охлаждают до 0 С. Прибавляют 77,9 мг (E)-7-(2,5-диметокси-3,4,6-триметилфенил)-5-метилгепт-5 енилацетата (0,223 ммоль) в AcCN (1,5 мл) в течение 2 мин и темно-оранжевый раствор перемешивают в течение 0,5 ч. Затем прибавляют Н 2 О (3 мл) и EtOAc (3 мл), слои разделяют и органический слой промывают Н 2 О (22 мл). Объединнную водную фазу экстрагируют EtOAc (35 мл) и объединенные органические слои промывают насыщенным раствором NaCl (25 мл) и сушат над безводным Na2SO4. Полученную жлтую жидкость концентрируют, получая жлтое масло, которое подвергают флэшхроматографии, и получают 25,8 мг (E)-5-метил-7-(2,4,5-триметил-3,6-диоксоциклогекса-1,4- 26019675 диенил)гепт-5-енилацетата в виде ярко-жлтого масла (36,2%). 1 Н ЯМР (400 МГц, CDCl3) : 4,95 (т, J=6,4 Гц, 1 Н), 4,02 (т, J=6,8 Гц, 2 Н), 3,19 (д, J=6,8 Гц, 2 Н), 2,01(0,5 мл) с 2 каплями Н 2 О охлаждают до 0 С. К полученному перемешиваемому раствору спирта прибавляют CAN (114,7 мг, 0,209 ммоль), растворнный в AcCN (0,2 мл) и Н 2 О (0,5 мл), при 0 С. Реакционную смесь перемешивают при 0 С в течение 1 ч и прибавляют Н 2 О (2 мл) и EtOAc (2 мл), слои разделяют и водную фазу экстрагируют EtOAc (32 мл). Объединенные органические слои промывают насыщенным раствором хлорида натрия (22 мл), сушат над безводным Na2SO4 и концентрируют, получая жлтое масло. Флэш-хроматография дат (Е)-2-(7-гидрокси-3-метилгепт-2-енил)-3,5,6-триметилциклогекса-2,5 диен-1,4-дион (2,2 мг) в виде жлтого масла (8,2%). 13 С ЯМР (100 МГц, CDCl3) : 187,9; 187,0; 143,1; 140,4; 104,3; 134,0; 119,7; 77,2; 62,9; 39,3; 32,3; 25,6; 24,0; 16,2; 12,4; 12,3; 12,2. Раскрытие всех публикаций, патентов, патентных заявок и опубликованных патентных заявок, относящихся к данной заявке, имеет место путем цитирования и включено в данную заявку путм ссылки во всей полноте. Хотя вышеизложенное изобретение подробно описано и иллюстрировано примерами для ясности понимания, специалистам в данной области очевидно, что на практике будут применяться некоторые незначительные изменения и модификации. Следовательно, описание и примеры не следует толковать как ограничивающие объм настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из или его стереоизомера, смеси стереоизомеров, его фармацевтически приемлемой соли, фосфатзамещенной формы, сульфатзамещеннной формы, фосфат/сульфатзамещенной формы или сольвата. 2. Композиция для лечения или подавления митохондриального заболевания, содержащая одно или более соединений по п.1 в эффективном количестве и фармацевтически приемлемый эксципиент. 3. Способ лечения или подавления митохондриального заболевания, включающий введение субъекту терапевтически эффективного количества одного или нескольких соединений по п.1 или композиции по п.2. 4. Способ по п.3, где митохондриальное заболевание выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с "разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии, лактацидоза, инсульта (MELAS); наследственной невропатии зрительного нерва Лебера (LHON), болезни Ли, синдрома Кирнса-Сейра (KSS),наследственной атаксии Фридрейха (FA); других видов миопатии, кардиомиопатии, энцефаломиопатии,почечноканальцевого ацидоза; нейродегенеративных заболеваний, болезни Паркинсона, болезни Альцгеймера, бокового амиотрофического склероза (ALS), заболеваний двигательных нейронов, других неврологических заболеваний, эпилепсии, генетических заболеваний, болезни Гентингтона, аффективных расстройств, шизофрении; биполярных расстройств; заболеваний, связанных с возрастом; дегенерации сетчатки; диабета и рака. 5. Способ по п.4, где митохондриальное заболевание выбрано из группы, состоящей из наследственных митохондриальных заболеваний; миоклонической эпилепсии с "разорванными красными волокнами" (MERRF); митохондриальной миопатии, энцефалопатии, лактацидоза, инсульта (MELAS); наследственной невропатии зрительного нерва Лебера (LHON), болезни Ли, синдрома Кирнса-Сейра (KSS),наследственной атаксии Фридрейха (FA). 6. Способ по п.5, где митохондриальное заболевание представляет собой наследственную атаксию Фридрейха (FA). 7. Способ по п.5, где митохондриальное заболевание представляет собой наследственную невропатию зрительного нерва Лебера (LHON). 8. Способ по п.4, где митохондриальное заболевание представляет собой болезнь Гентингтона. 9. Способ по п.4, где митохондриальным заболеванием является дегенерация сетчатки, диабет или рак. 10. Способ по п.4, где митохондриальным заболеванием является болезнь Паркинсона. 11. Применение соединения по п.1 для модулирования биомаркера энергетического обмена коэнзима Q10. 12. Применение соединения по п.1 для лечения или подавления заболевания, при котором необходимо воздействие на коэнзим Q10. 13. Применение композиции по п.2 для модулирования биомаркера энергетического обмена коэнзима Q10. 14. Применение композиции по п.2 для лечения или подавления заболевания, при котором необходимо воздействие на коэнзим Q10.
МПК / Метки
МПК: A61P 25/28, A61P 3/00, A61K 31/355
Метки: биомаркера, коэнзима, заболеваний, лечения, терапевтические, средства, модуляции, редокс-активные, митохондриальных
Код ссылки
<a href="https://eas.patents.su/29-19675-redoks-aktivnye-terapevticheskie-sredstva-dlya-lecheniya-mitohondrialnyh-zabolevanijj-i-modulyacii-biomarkera-koenzima-q.html" rel="bookmark" title="База патентов Евразийского Союза">Редокс-активные терапевтические средства для лечения митохондриальных заболеваний и модуляции биомаркера коэнзима q</a>
Предыдущий патент: Способ оценки коррозионного воздействия нефтезаводского сырья на металлические части
Следующий патент: Гербицидные композиции, содержащие пироксасульфон iv
Случайный патент: Композиция на основе диклофенака для местного лечения заболеваний орофарингеальной полости












