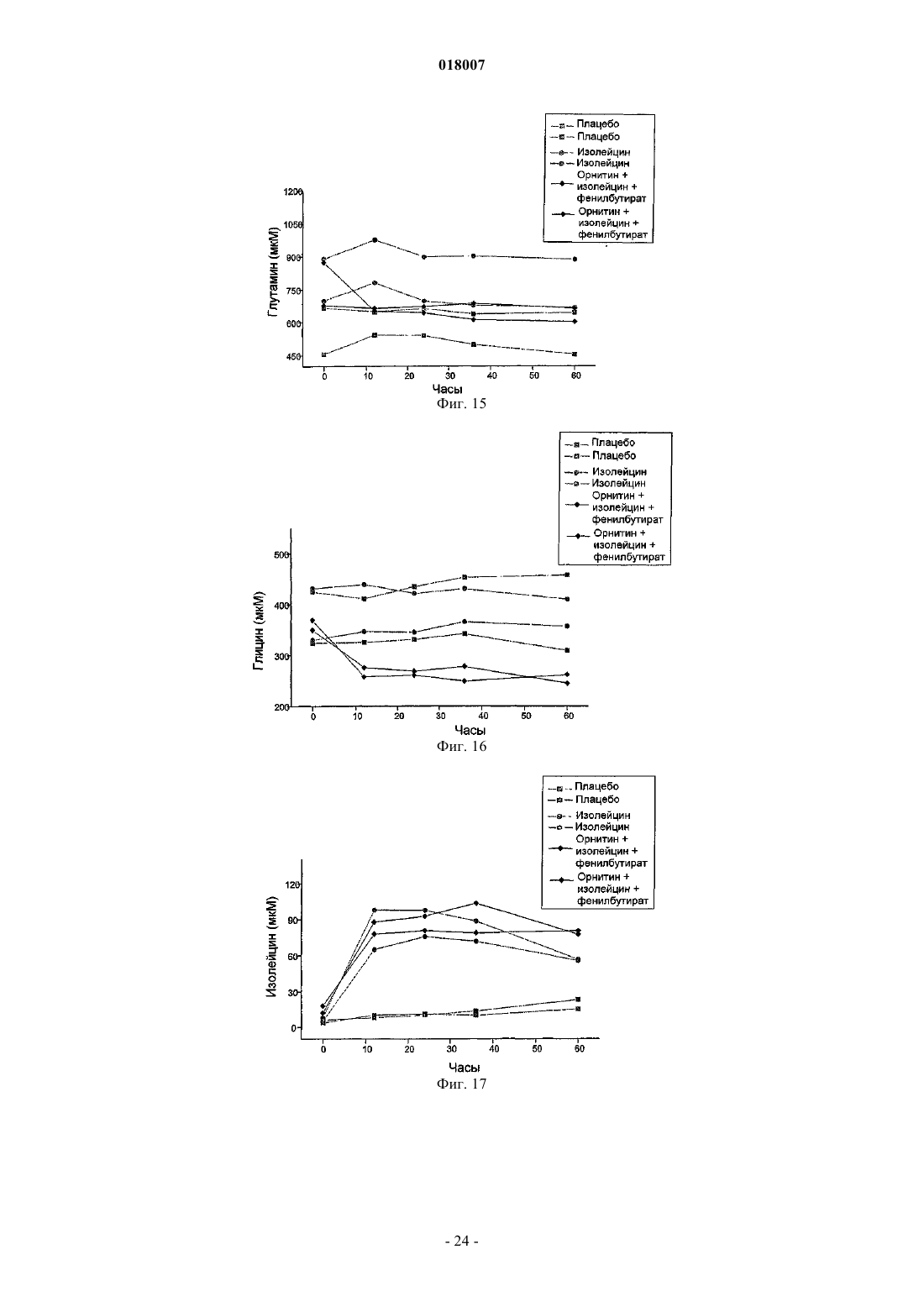
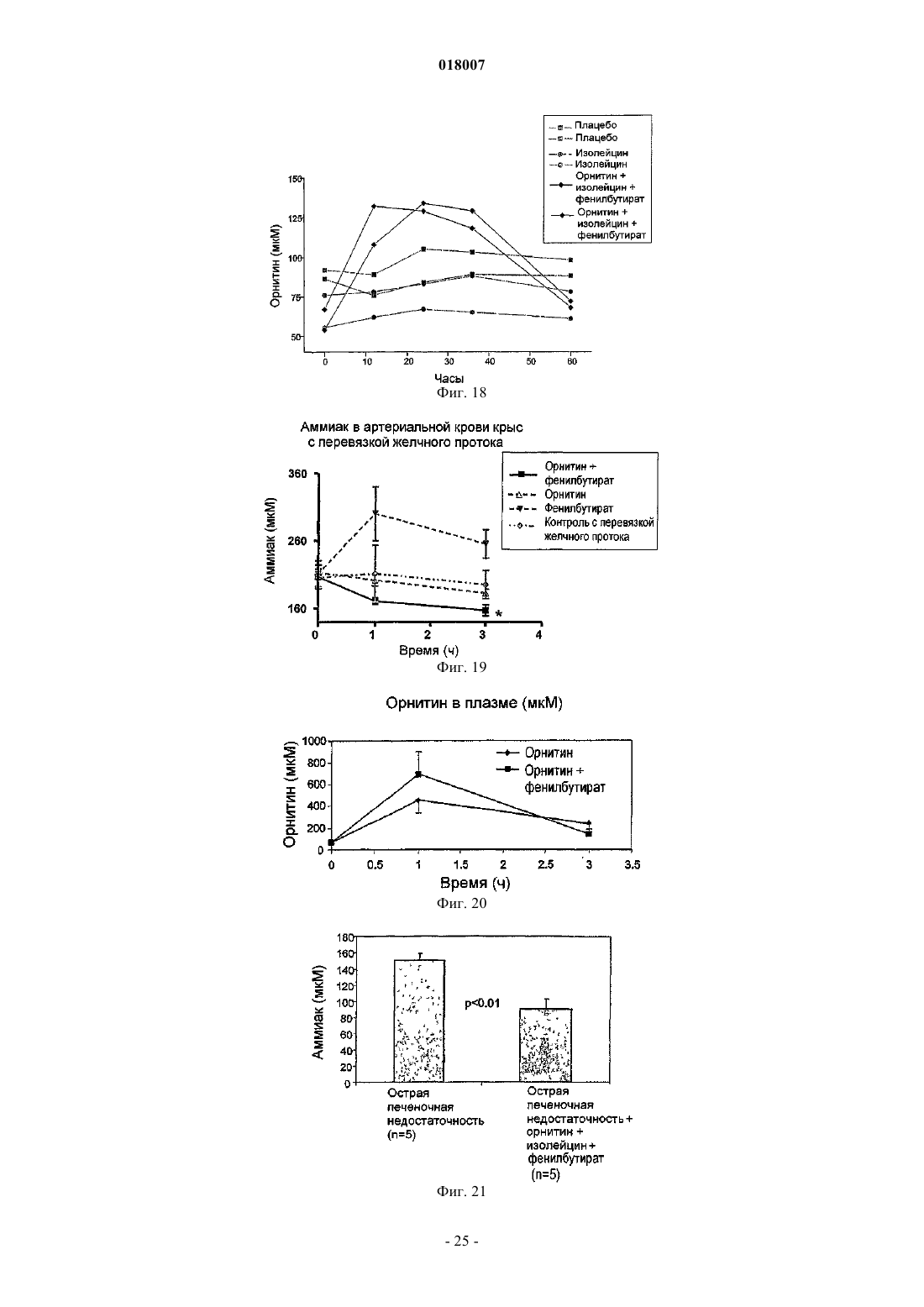
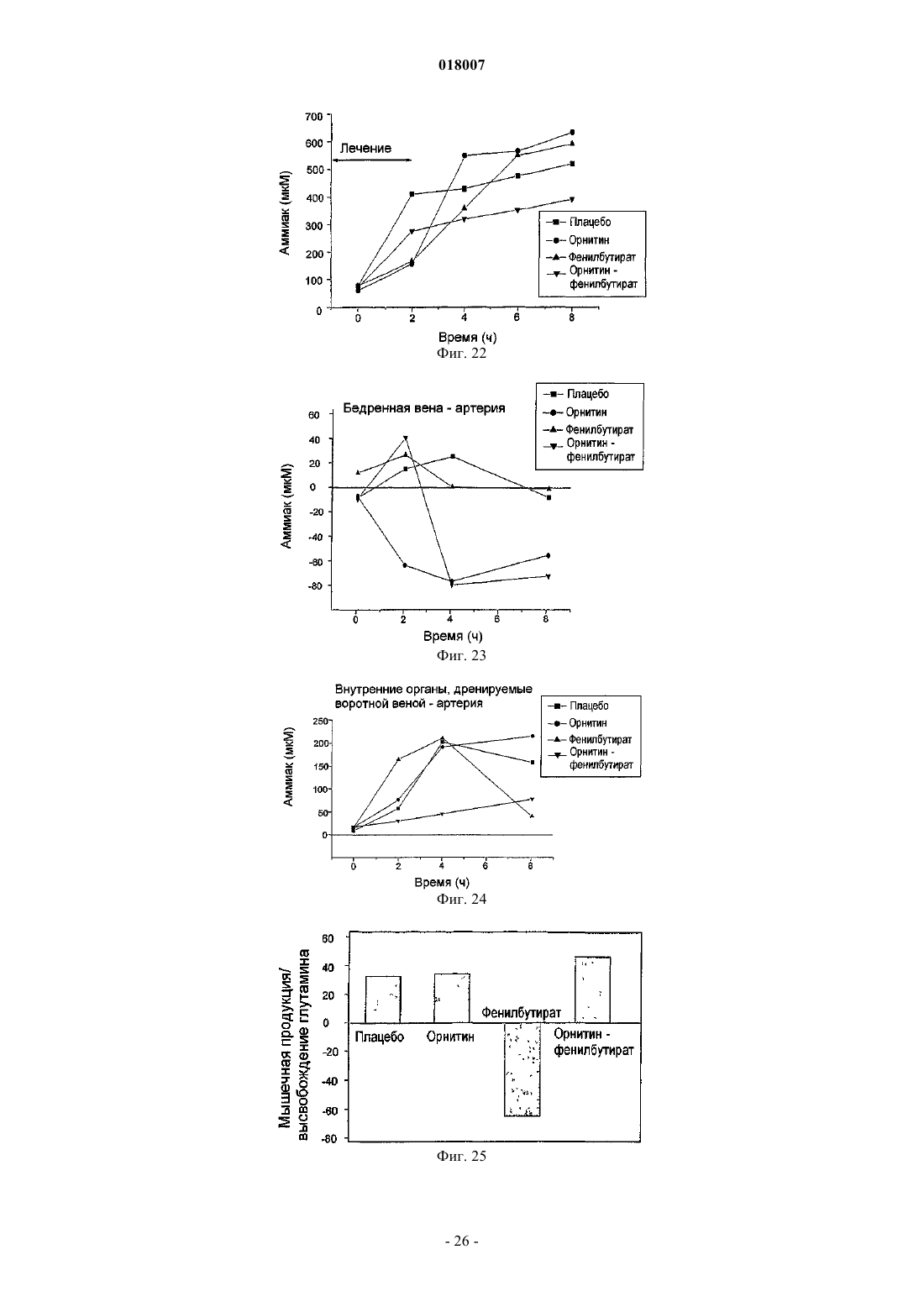
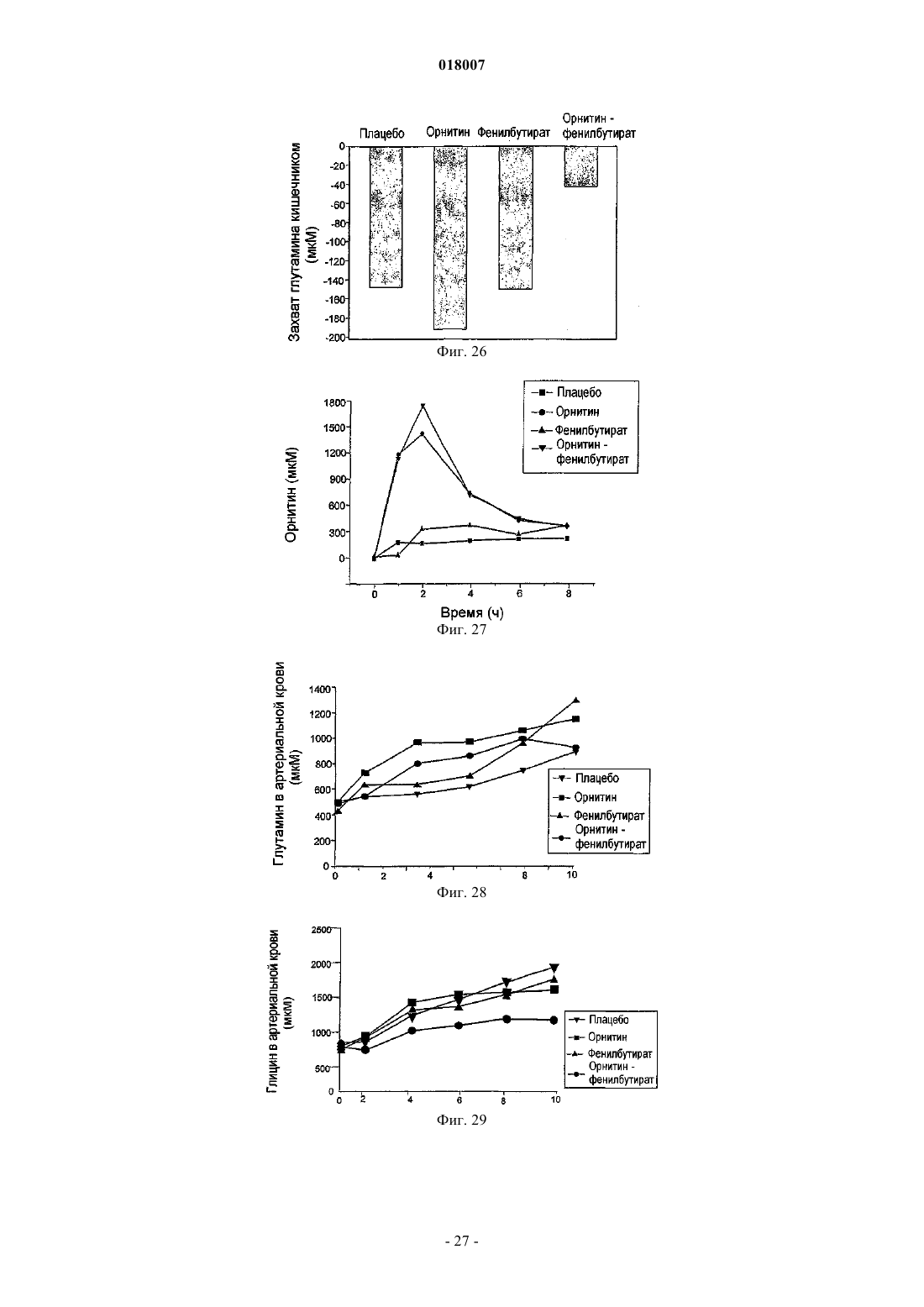
Композиция, содержащая орнитин и фенилацетат или фенилбутират, для лечения печеночной энцефалопатии
Формула / Реферат
1. Фармацевтическая композиция, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 10:1-1:10.
2. Фармацевтическая композиция по п.1, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 5:1-1:5.
3. Фармацевтическая композиция по п.1, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 2:1-1:2.
4. Фармацевтическая композиция по п.1, 2 или 3, которая, по существу, не содержит других аминокислот.
5. Фармацевтическая композиция по п.1, 2 или 3, которая, по существу, не содержит аспартата.
6. Способ лечения хронического заболевания печени, включающий
идентификацию индивида, страдающего хроническим заболеванием печени; и
введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата.
7. Способ лечения цирроза печени, включающий
идентификацию индивида, страдающего циррозом печени; и
введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата.
8. Способ лечения острой недостаточности печени, включающий
идентификацию индивида с острой недостаточностью печени и
введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата.
9. Способ по любому из пп.6-8, где индивид имеет риск декомпенсации печени или печеночной энцефалопатии.
10. Способ по любому из пп.6-8, где индивид имеет декомпенсацию печени.
11. Способ по любому из пп.6-8, где пациент, по существу, не получает аспартат с пищей.
12. Способ по любому из пп.6-8, где пациент не получает аспартат с пищей.
13. Способ по любому из пп.6-8, где пациент, по существу, не получает других аминокислот с пищей.
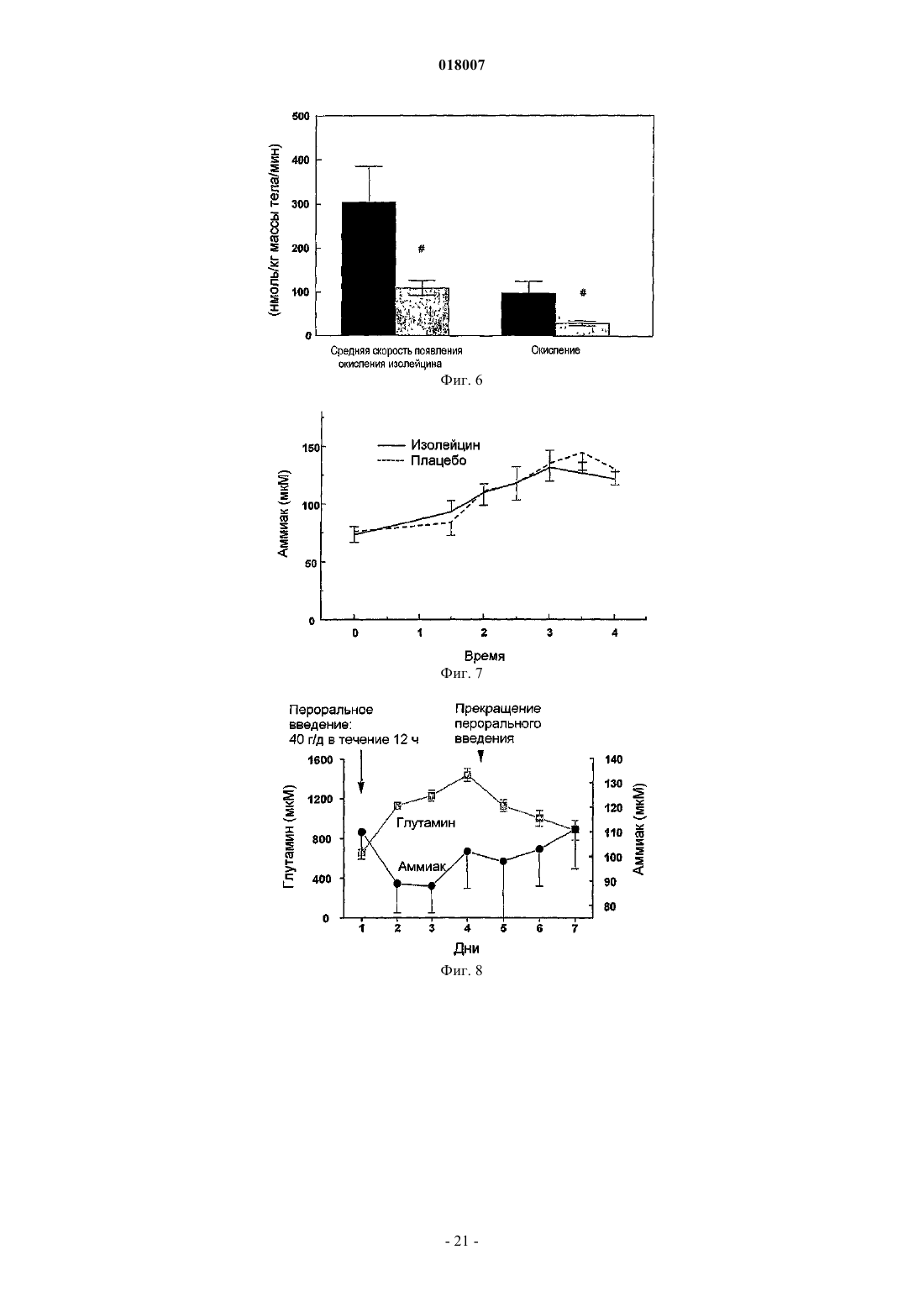
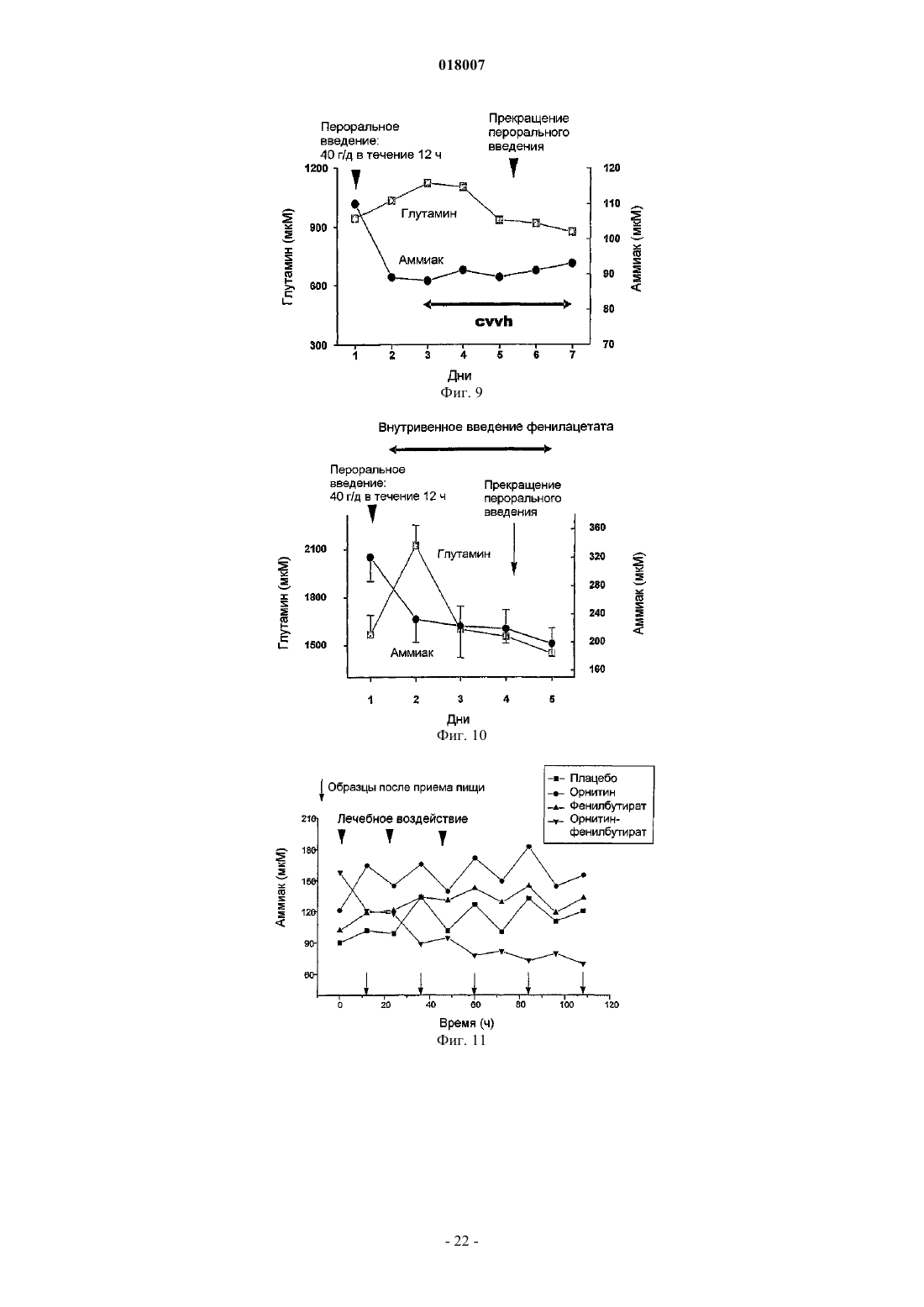
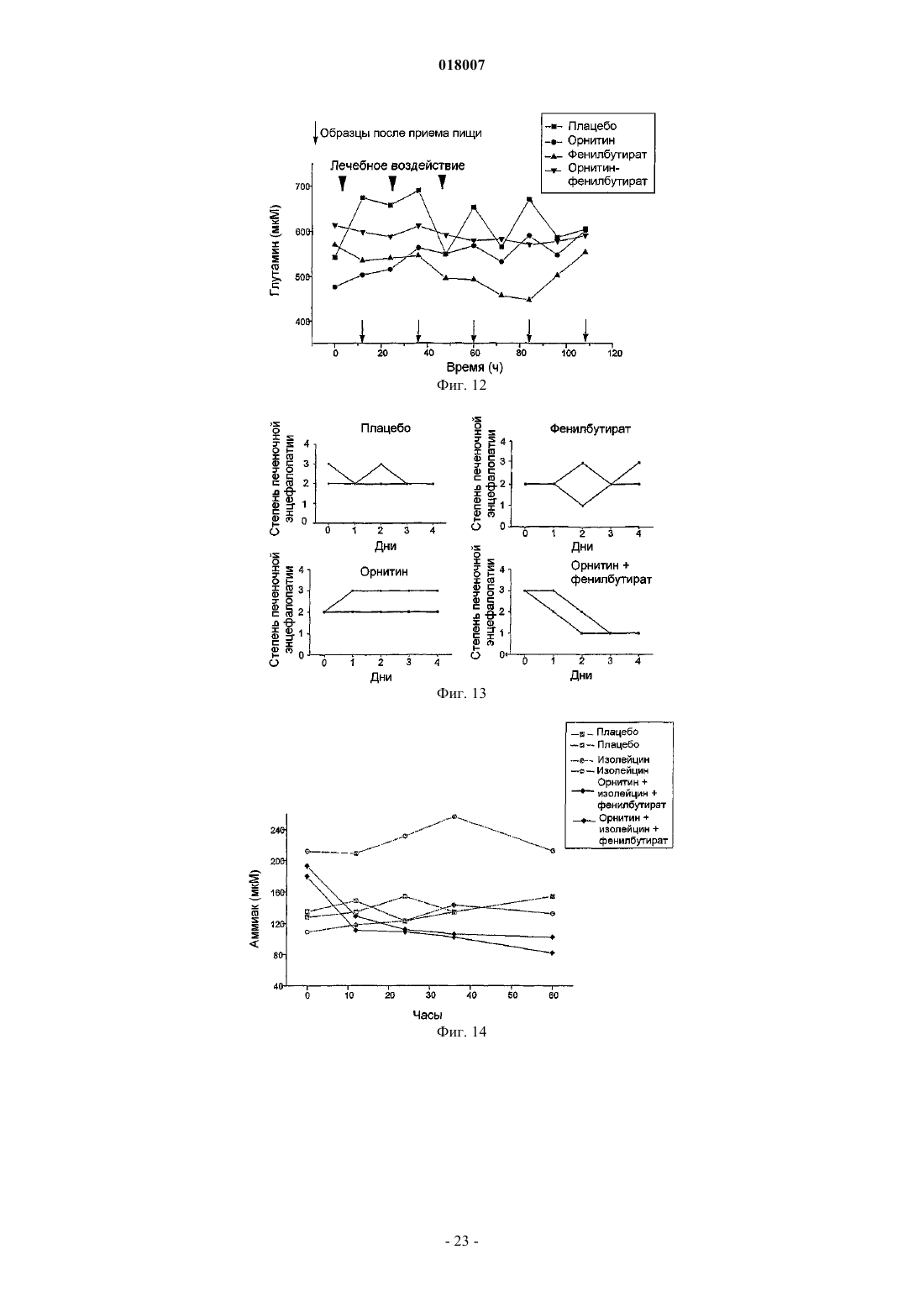
14. Способ по любому из пп.6-8, где орнитин и, по меньшей мере, фенилацетат или фенилбутират вводят в таком количестве, которое приводит к длительному снижению уровней аммония.
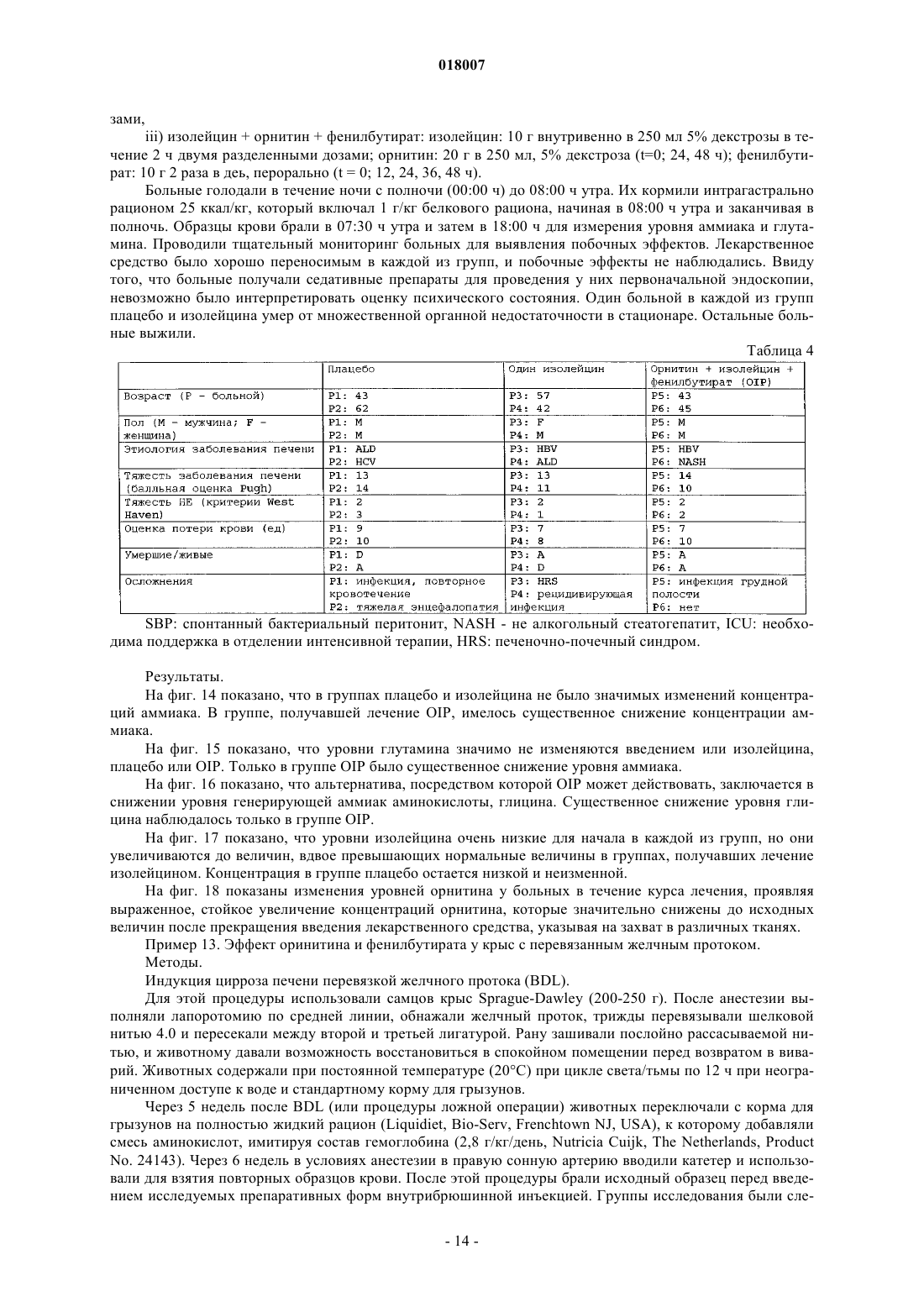
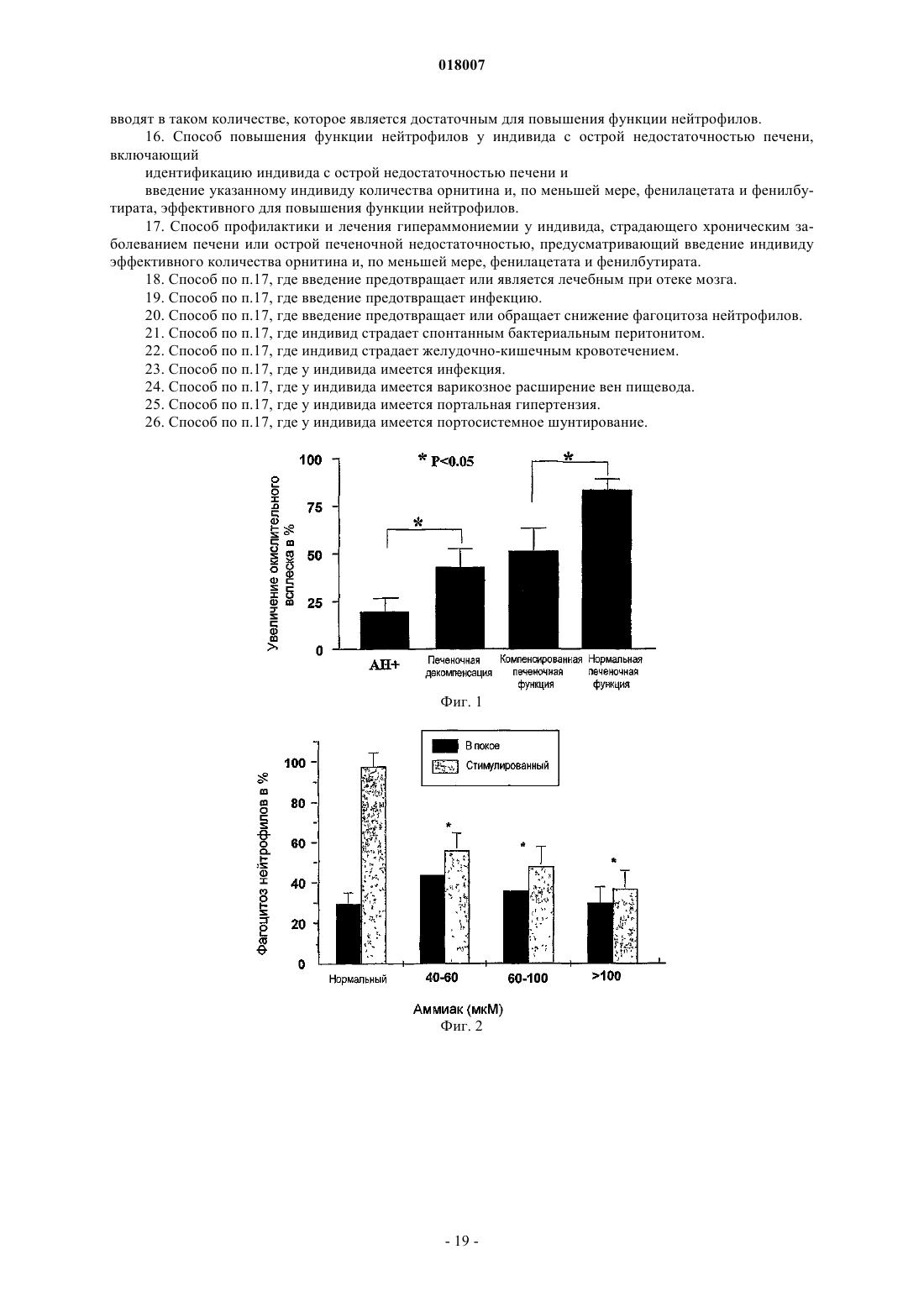
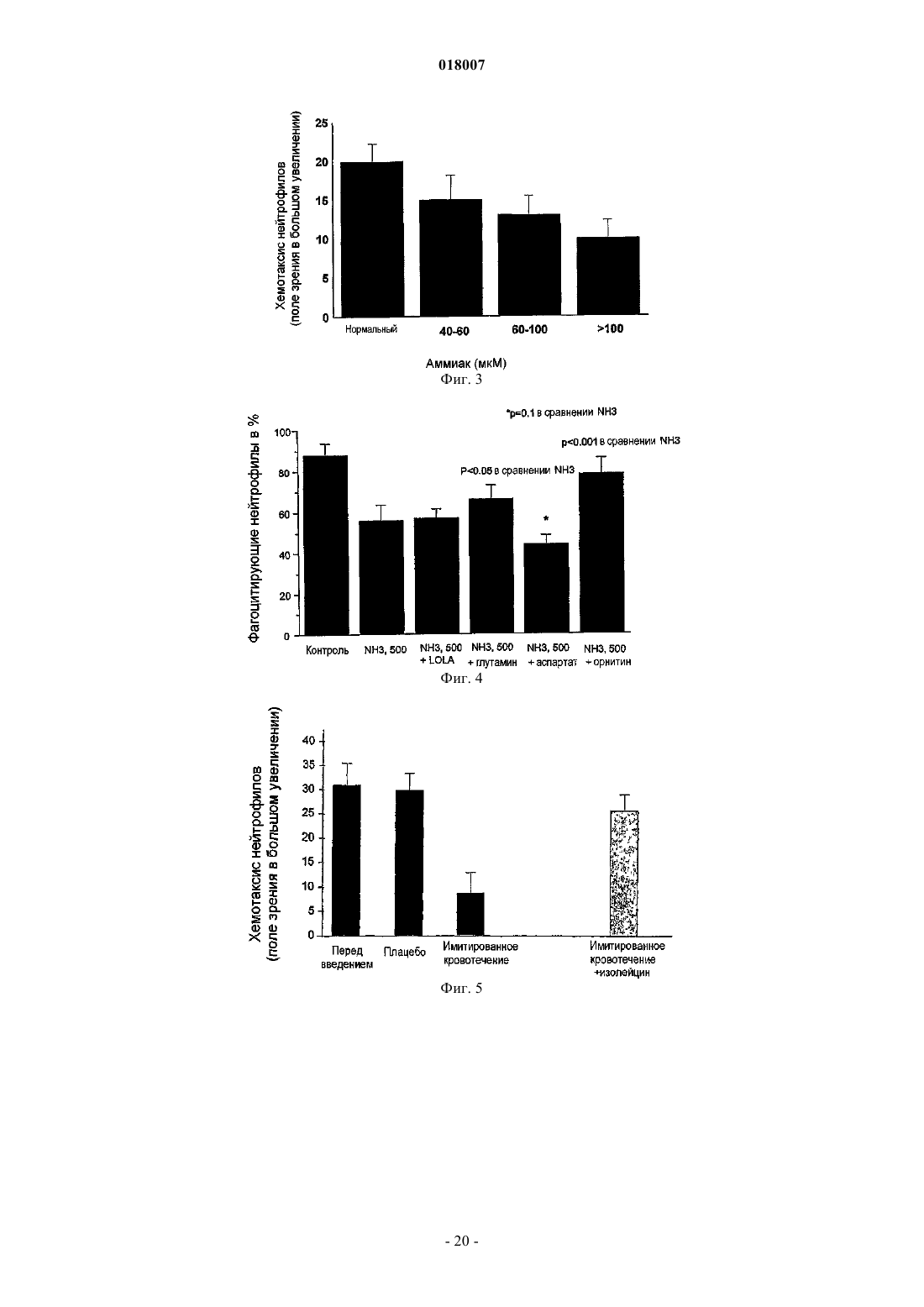
15. Способ по любому из пп.6-8, где орнитин и, по меньшей мере, фенилацетат или фенилбутират вводят в таком количестве, которое является достаточным для повышения функции нейтрофилов.
16. Способ повышения функции нейтрофилов у индивида с острой недостаточностью печени, включающий
идентификацию индивида с острой недостаточностью печени и
введение указанному индивиду количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата, эффективного для повышения функции нейтрофилов.
17. Способ профилактики и лечения гипераммониемии у индивида, страдающего хроническим заболеванием печени или острой печеночной недостаточностью, предусматривающий введение индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата.
18. Способ по п.17, где введение предотвращает или является лечебным при отеке мозга.
19. Способ по п.17, где введение предотвращает инфекцию.
20. Способ по п.17, где введение предотвращает или обращает снижение фагоцитоза нейтрофилов.
21. Способ по п.17, где индивид страдает спонтанным бактериальным перитонитом.
22. Способ по п.17, где индивид страдает желудочно-кишечным кровотечением.
23. Способ по п.17, где у индивида имеется инфекция.
24. Способ по п.17, где у индивида имеется варикозное расширение вен пищевода.
25. Способ по п.17, где у индивида имеется портальная гипертензия.
26. Способ по п.17, где у индивида имеется портосистемное шунтирование.
Текст
КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ОРНИТИН И ФЕНИЛАЦЕТАТ ИЛИ ФЕНИЛБУТИРАТ, ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ ЭНЦЕФАЛОПАТИИ Настоящее изобретение относится к применению орнитина для изготовления лекарственного препарата для применения в комбинации по меньшей мере с одним из фенилацетата и фенилбутирата для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии. Изобретение также относится к применению по меньшей мере одного из фенилацетата и фенилбутирата для изготовления лекарственного препарата для применения в комбинации с орнитином для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии. Джалан Раджив (GB), Джалан Камал Наян (IN) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: Ю Си Эл БИЗНЕС Пи Эл Си (GB) Область, к которой относится изобретение Настоящее изобретение относится к профилактике или лечению декомпенсации печени или печеночной энцефалопатии. Описание предшествующего уровня техники Хроническое заболевание печени характеризуется постепенным разрушением ткани печени с течением времени, в результате чего здоровая и регенерирующаяся ткань печени медленно замещается соединительной и некротической тканью. Этот процесс известен как цирроз печени. Нормальная функция печени нарушена, а рубцовая ткань вызывает прогрессирующее уменьшение кровотока через печень. По мере утраты нормальной, регенерирующейся печеночной ткани прекращается эффективная переработка питательных веществ, гормонов, лекарственных препаратов и токсинов. Прекращение эффективной переработки может привести к возникновению симптомов, в том числе аномальному клиренсу белков, абсорбированных через кишечный тракт, приводящему к накоплению аммиака; аномальной экскреции, ведущей к накоплению билирубина в крови, вызывающему желтуху; повышенному синусоидальному давлению, ведущему к накоплению жидкости в брюшной полости (асциту); и портальной гипертензии (и портосистемному шунтированию), при которой рубцовая печеночная ткань действует в качестве барьера кровотоку, приводя к увеличению портального кровяного давления и варикозному расширению вен пищевода. Пациенты с хроническим заболеванием печени могут находиться в достаточно стабильном клиническом состоянии и у них могут проявляться некоторые симптомы, или симптомы могут отсутствовать. Однако у таких пациентов имеется риск резкого ухудшения состояния, что может привести к развитию печеночной недостаточности на фоне хронической печеночной недостаточности. Этот переход из "компенсированного" состояния, когда печень способна функционировать, хотя и на сниженном уровне, в"декомпенсированное" состояние, когда печеночная функция становится несостоятельной, включает эффект ускоряющих событий. Ускоряющие явления, связанные с хроническим заболеванием печени,включают желудочно-кишечное кровотечение, инфекцию (сепсис), тромбоз воротной вены и дегидратацию. Например, у 50% пациентов с циррозом печени имеется варикозное расширение вен пищевода, а у трети пациентов в пределах двух лет после установления диагноза происходит разрыв варикозно расширенных вен пищевода, что вызывает желудочно-кишечное кровотечение (Grace ND (1992) GastroenterolClin. North. Am. 21: 149-161). Известно, что кровотечение из верхних отделов желудочно-кишечного тракта увеличивает восприимчивость к угрожающим жизни осложнениям, таким как бактериальный перитонит, сепсис, почечная недостаточность и печеночная энцефалопатия (Teran et al. (1997) Gastroenterology 112: 473-482; Garden et al. (1985) Br. J. Surg. 72: 91-95; Pauwels et al. (1996) Hepatology 24: 802806; Bleichner et al. (1986) Br. J. Surg. 73: 724-726), приводящая к смерти примерно 30% пациентов, несмотря на адекватную борьбу с кровотечением (Grace, 1992, см. выше). Печеночная энцефалопатия (НЕ, ПЭ) представляет собой сложное нейропсихиатрическое расстройство, которое возникает при различных клинических ситуациях, таких как острое или хроническое заболевание печени и спонтанное портосистемное венозное шунтирование. На ранних стадиях печеночной энцефалопатии происходят небольшие психические изменения, такие как снижение концентрации, спутанное сознание и дезориентация. В тяжелых случаях печеночная энцефалопатия может привести к ступору, коме, набуханию мозга (отеку мозга) и смерти. В случае пациентов, у которых развивается ПЭ в результате хронического заболевания печени, начало ПЭ часто является результатом клинически ускоряющего явления, такого как желудочно-кишечное кровотечение, сепсис (инфекция), тромбоз воротной вены или дегидратация. Желудочно-кишечное кровотечение и портосистемное шунтирование дает возможность токсическим веществам, которые обычно метаболизируются печенью, попасть в системную циркуляцию и пройти через гематоэнцефалический барьер, что оказывает прямой или косвенный нейротоксические эффекты на центральную нервную систему. Считают, что накопление аммиака играет важную роль в прогрессировании печеночной энцефалопатии и множественной органной недостаточности (дыхательной недостаточности, сердечно-сосудистой недостаточности, почечной недостаточности). Кроме накопления аммиака, септицемия (или бактериальный перитонит), которая развивается вскоре после желудочнокишечного кровотечения, вероятно, также является фактором, вносящим вклад в развитие печеночной энцефалопатии. Затем печеночная декомпенсация может привести к множественной органной недостаточности и печеночной энцефалопатии. На ранних стадиях печеночной энцефалопатии происходят психические изменения, такие как плохая концентрация или неспособность строить простые объекты. В тяжелых случаях печеночная энцефалопатия может привести к ступору, коме, отеку мозга и смерти. Прогноз для пациентов с хроническим заболеванием печени трудно оценить, потому что это состояние имеет много причин. Профилактические меры для максимального уменьшения прогрессирования компенсированного состояния до декомпенсированного состояния включают устранение воздействия дополнительных патогенных агентов, которые ухудшат состояние, например полное воздержание от алкоголя и вакцинация против гепатита А и В. Однако после возникновения печеночной декомпенсации, вероятность благоприятного прогноза снижается, и трансплантация печени представляет собой единственный способ лечения, который может продлить жизнь. Поскольку именно декомпенсация печени ведет к уменьшению продолжительности жизни, предотвращение возникновения печеночной декомпенсации является очень желательным. Обычное лечение пациентов с печеночной энцефалопатией включает стратегии по снижению концентрации аммиака. Они включают ограничение потребления белка в рационе; введение лактулозы, Lорнитин-L-аспартата (LOLA) или бензоата натрия и очистительные клизмы. Краткое описание сущности изобретения Настоящее изобретение относится к применению орнитина и по меньшей мере одного из фенилацетата и фенилбутирата для лечения печеночной декомпенсации или печеночной энцефалопатии (ПЭ) у пациентов. Изолейцин можно также вводить тем пациентам, у которых, кроме того, имеется недостаточность изолейцина, которую можно отнести на счет, например, желудочно-кишечного кровотечения. Соответственно, изобретение относится к применению орнитина для изготовления лекарственного средства для применения в комбинации по меньшей мере с одним из фенилацетата и фенилбутирата для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии; применению по меньшей мере одного из фенилацетата и фенилбутирата для изготовления лекарственного средства для использования в комбинации с орнитином для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии; применению орнитина и по меньшей мере одного из фенилацетата и фенилбутирата для изготовления лекарственного средства для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии; продуктам, содержащим орнитин и по меньшей мере один из фенилацетата и фенилбутирата, для одновременного, отдельного или последовательного применения для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии; фармацевтической композиции, содержащей орнитин и по меньшей мере один из фенилацетата и фенилбутирата; средству для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии, содержащему орнитин и по меньшей мере один из фенилацетата и фенилбутирата; и способу лечения пациента с печеночной декомпенсацией, или печеночной энцефалопатией, или с риском их развития, где способ включает введение указанному пациенту эффективного количества орнитина и по меньшей мере одного из фенилацетата и фенилбутирата. Краткое описание чертежей На фиг. 1 показано, что функция нейтрофилов нарушена у пациентов с циррозом и ухудшается с увеличением тяжести печеночного заболевания; на фиг. 2 показано, что аммиак снижает фагоцитоз нейтрофилов; на фиг. 3 показано, что аммиак снижает хемотаксис нейтрофилов; на фиг. 4 показано, что воздействие аммиака на фагоцитоз нейтрофилов можно устранить лечебными вмешательствами; на фиг. 5 показано, что имитированное желудочно-кишечное кровотечение снижает хемотаксис нейтрофилов, что может быть частично устранено введением изолейцина; на фиг. 6 показано, что имитированное кровотечение снижает синтез белка и неадекватно стимулирует окисление изолейцина; на фиг. 7 показано, что введение изолейцина во время имитированного кровотечения уменьшает синтез белка, но не снижает концентрацию аммиака; на фиг. 8 показано, что введение LOLA снижает концентрацию аммиака, но обеспечивает возможность регенерации аммиака; на фиг. 9 показано, что активное удаление глутамина предотвращает вторичный подъем концентрации аммиака; на фиг. 10 показано, что фенилацетат связывает глутамин с получением выводимого соединения и предотвращает вторичный подъем концентрации аммиака; на фиг. 11 показано воздействие орнитина и фенилбутирата на уровни аммиака у пациентов с запущенным циррозом; на фиг. 12 показано воздействие орнитина и фенилбутирата на уровни глутамина у пациентов с запущенным циррозом; на фиг. 13 показаны изменения психического состояния пациентов, получавших лечение плацебо,орнитина (О), фенилбутирата (Р) или О+Р; на фиг. 14 показано воздействие орнитина, фенилбутирата и изолейцина на уровни аммиака у пациентов с запущенным циррозом; на фиг. 15 показано воздействие орнитина, фенилбутирата и изолейцина на уровни глутамина у пациентов с запущенным циррозом; на фиг. 16 показано воздействие орнитина, фенилбутирата и изолейцина на уровни глицина у паци-2 018007 ентов с запущенным циррозом; на фиг. 17 показано воздействие орнитина, фенилбутирата и изолейцина на уровни изолейцина у пациентов с запущенным циррозом; на фиг. 18 показано воздействие орнитина, фенилбутирата и изолейцина на уровни орнитина у пациентов с запущенным циррозом; на фиг. 19 показано воздействие орнитина и фенилбутирата на содержание аммиака в артериальной крови на модели перевязки желчных протоков у крыс; на фиг. 20 показано воздействие орнитина и фенилбутирата на содержание орнитина в плазме на модели перевязки желчных протоков у крыс; на фиг. 21 показано воздействие орнитина, фенилбутирата и изолейцина на содержание аммиака в плазме артериальной крови на модели острой печеночной недостаточности с повышенным содержанием аммиака в крови у крыс; на фиг. 22 показано ослабленное увеличение содержания аммиака в артериальной крови под воздействием лечения орнитином и фенилбутиратом на модели острой печеночной недостаточности в результате деваскуляризации печени у крыс; на фиг. 23 показано, что аммиак захватывается из крови мышцами у животных, получавших лечение О и ОР (образцы брали из бедренной вены-артерии). Напротив, у животных, получавших плацебо и один Р, выявлено увеличение продукции аммиака мышцами; на фиг. 24 показано, что аммиак продуцируется кишечником у всех животных, за исключением животных, получавших лечение ОР (образцы брали из артерии внутренних органов, отток из которых осуществляется через воротную вену); на фиг. 25 показано, что высвобождение глутамина мышцами увеличивается под воздействием О,но не Р, используемыми отдельно. Лечение ОР вызывало заметно большее высвобождение мышечного глутамина (захватывая, посредством этого, аммиак в виде глутамина в мышцах); на фиг. 26 показано, что захват глутамина в кишечнике усиливается О, но снижается ОР (посредством этого, снижая образование аммиака в кишечнике); на фиг. 27 показано, что уровни орнитина в артериальной крови увеличиваются у двух животных (у групп, получавших один О и ОР), которым его вводили; на фиг. 28 показано, что уровни глутамина в артериальной крови возрастают при лечении О, но в меньшей степени - при лечении ОР; на фиг. 29 показано, что комбинация ОР предотвращает возрастание содержания вызывающей образование аммиака аминокислоты глицина; на фиг. 30 показано, что один орнитин вызывает увеличение содержания воды в мозге, фенилацетат вызывает небольшое увеличение содержания воды в мозге, в то время как комбинация этих средств вызывает существенное снижение содержания воды в мозге (% от контроля). Подробное описание изобретения Во всем настоящем описании и сопровождающей его формуле изобретения слова "содержат" и"включая". То есть эти слова предназначены для выражения возможного включения других элементов или целых чисел, которые конкретно не указаны, если это позволяет контекст. Настоящее изобретение относится к раннему лечению пациентов с заболеванием печени до развития печеночной декомпенсации и, таким образом, перед возникновением печеночной энцефалопатии для предотвращения или задержки начала печеночной декомпенсации. Альтернативно, настоящее изобретение относится к лечению печеночной энцефалопатии эффективным снижением концентрации аммиака и поддержанием функции нейтрофилов. Подлежащие лечению индивидуумы Настоящее изобретение относится к профилактике или лечению печеночной декомпенсации или печеночной энцефалопатии. Таким образом, печень индивидуума может находиться в компенсированном состоянии. У индивидуума может быть хроническое заболевание печени. У индивидуума может быть цирроз печени. У индивидуума может быть острая печеночная недостаточность. У подлежащего лечению индивидуума может быть печеночная энцефалопатия. Начало как острого, так и хронического заболевания печени может быть вызвано ксенобиотической причиной. Например, индивидуум может контактировать с химическим, лекарственным или каким-либо другим агентом, который вызывает поражение печени. У индивидуума может быть реакция на отпускаемое без рецепта, прописанное или "оздоровительное" лекарственное средство, которая вызывает поражение печени. Индивидуум мог принимать Rezulin (троглитазон; Parke-Davis), Serzone (нефазодон;Bristol-Myers Squibb) или другие лекарственные средства, которые, как считается, вызывают поражение печени. Индивидуум может представлять собой лицо, у которого имелась передозировка определенного лекарственного средства, или который превысил рекомендуемую дозировку лекарственного средства,что могло вызвать поражение печени. Например, индивидуум мог принимать избыточную дозу парацетамола. Индивидуум мог контактировать с химическими веществами, которые могут вызвать поражения печени, такие как, например, на месте его работы. Например, индивидуум мог контактировать с такими химическими веществами в промышленной или сельскохозяйственной среде. Индивидуум мог употребить в пищу растения, которые содержат соединения, способные вызвать поражение печени, в частности,это может быть в том случае, если индивидуум представляет собой животное, такое как травоядное животное. Например, индивидуум мог употребить в пищу растение, содержащее пирролизидиновый алкалоид, такое как крестовник. Индивидуум мог контактировать с токсинами внешней среды, которые, как считается, могут вызвать заболевание печени. Токсическое поражение печени, связанное с приемом лекарственных средств, составляет более 50% всех случаев острого заболевания печени (острой печеночной недостаточности). Токсическое действие ацетаминофена (также известного как парацетамол и N-ацетил-п-аминофенол) является самой распространенной причиной острой печеночной недостаточности в США и Великобритании. У лиц, длительно употребляющих умеренные и большие дозы алкоголя, при приеме ацетаминофена в терапевтических или умеренно избыточных дозах, имеется риск тяжелого повреждения печени и, возможно, острой печеночной недостаточности. Алкоголь потенцирует токсические эффекты ацетаминофена. Идиосинкратическая лекарственная токсичность также вносит вклад в развитие острой печеночной недостаточности. Считают, что идиосинкратическая лекарственная токсичность представляет собой реакцию гиперчувствительности, при которой индивидуум реагирует на лекарственное средство фармакологически аномальным образом. Такая аномальная реакция может привести к острой печеночной недостаточности. Острая печеночная недостаточность или хроническое заболевание печени может быть вызвано инфекцией патогенным организмом. Например, заболевание печени может быть вызвано вирусной инфекцией. В частности, индивидуум может быть инфицирован или был инфицирован вирусом, который вызывает гепатит. У индивидуума может быть хронический вирусный гепатит. Вирус может, например,представлять собой вирус гепатита В, С или D. В некоторых случаях, и, в частности, когда у индивидуума имеется вирусный гепатит, индивидуум может также быть инфицирован ВИЧ-I или II. У индивидуума может быть СПИД. Возможно, что индивидуум был или является инфицированным другими организмами, которые вызывают заболевание печени, и, в частности, теми, которые присутствуют в печени в течение некоторой стадии их жизненного цикла. Например, у индивидуума может быть или была печеночная двуустка. У индивидуума может быть наследственное заболевание, которое вызывает или увеличивает риск хронического заболевания печени. Например, у индивидуума может быть одно из следующих заболеваний: гемохроматоз печени, болезнь Вильсона или недостаточность -1-антитрипсина. У индивидуума может быть наследственное расстройство, которое вызывает некоторый вид печеночной структурной или функциональной аномалии, которая увеличивает вероятность фиброза печени. Индивидуум может быть генетически предрасположен к развитию аутоиммунного расстройства, которое повреждает печень и,следовательно, которое может внести вклад в развитие фиброза печени. Хроническое заболевание печени может быть вызвано алкоголем. Подлежащие лечению мужчина или женщина могут страдать или страдали алкоголизмом. Он или она могут употреблять или употребляли в среднем 50 или более единиц алкоголя в неделю, 60 или более единиц алкоголя в неделю, 75 или более единиц алкоголя в неделю и даже 100 или более единиц алкоголя в неделю. Мужчина или женщина могут употреблять или употребляли в среднем до 100 единиц алкоголя в неделю, до 150 единиц алкоголя в неделю и даже до 200 единиц алкоголя в неделю. Измерение одной единицы алкоголя отличается от страны к стране. Здесь одна единица равна 8 г этанола, в соответствии со стандартом Великобритании. Мужчина или женщина могли употреблять такие уровни алкоголя в течение 5 или более лет, 10 или более лет, 15 или более лет или 20 или более лет. Индивидуум мог употреблять такие уровни алкоголя в течение периода до 10 лет, до 20 лет, до 30 лет и даже до 40 лет. В случае вызванного алкоголем цирроза печени возраст индивидуума может быть, например, 25 лет или более, 35 лет или более, 45 лет или более и даже более 60 лет. Индивидуум может быть мужчиной или женщиной. Женщина может быть более восприимчива к неблагоприятным эффектам алкоголя, чем мужчина. У женщины алкогольное хроническое заболевание печени может развиться в более короткие временные рамки и от меньших количеств алкоголя, чем у мужчины. Представляется, что не существует только одного фактора, которым можно объяснить повышенную восприимчивость к алкогольному повреждению печени у женщин, но важную роль может играть воздействие гормонов на метаболизм алкоголя. В других вариантах осуществления у индивидуума может быть одно или более из ряда других состояний, которые, как известно, приводят к такому повреждению печени, как, например, первичный билиарный цирроз, аутоиммунный хронический активный гепатит и/или шистозомоз (паразитарная инфекция). У индивидуума может быть или была блокада желчных протоков. В некоторых случаях причина,лежащая в основе хронического заболевания печени, может быть неизвестна. Например, индивидууму может быть поставлен диагноз криптогенного цирроза. В одном варианте осуществления у индивидуума может быть подозрение на любое из перечисленных здесь состояний. Способы диагностики хронических заболеваний печени, острой печеночной недостаточности и печеночной энцефалопатии хорошо известны в данной области и, в частности, клиницистам и ветеринарам в данной области. Предпочтительно диагноз заболевания печени и печеночной энцефалопатии будет по-4 018007 ставлен, например, врачом или ветеринаром. У индивидуума может проявляться один или более симптомов, связанных с заболеванием печени, такой как один или более из желтухи, асцита, изменений кожи,задержки жидкости, изменений ногтей, легкого возникновения синяков, носовых кровотечений, варикозного расширения вен пищевода, а у мужчин может быть увеличение молочных желез. У индивидуума может проявляться изможденность, усталость, потеря аппетита, тошнота, слабость и/или потеря массы тела. У индивидуума может также проявляться один или более симптомов, связанных с печеночной энцефалопатией, таких как один или более из спутанного сознания, дезориентации, деменции, ступора,комы, отека мозга, многоорганной недостаточности (дыхательной недостаточности, сердечнососудистой недостаточности или почечной недостаточности), мышечной тугоподвижности/ригидности,судорог или нарушения речи. Подлежащий лечению индивидуум может принимать или принимал другие лекарственные средства для лечения заболеваний печени. У подлежащего лечению индивидуума может быть риск развития печеночной энцефалопатии. Печеночное заболевание могло быть подтверждено или подтверждено физикальным обследованием, включающим такие методики, как ультразвук. Можно брать биопсии печени для контроля нарастания фиброза, появления некротических клеток, клеточной дегенерации и/или воспаления и других характерных признаков печеночных заболеваний. У индивидуума могла быть проведена оценка функции печени для определения того, нарушена ли она у индивидуума. Может быть охарактеризована природа и причина, лежащая в основе печеночного заболевания. Может быть определен любой анамнез контакта с патогенными агентами печеночных заболеваний. У подлежащего лечению индивидуума может быть риск эпизодов печеночной энцефалопатии, например у пациентов, которые ожидают трансплантатов печени, хирургических больных и/или пациентов с портальной гипертензией. Индивидуум с риском печеночной энцефалопатии представляет собой индивидуум, который не страдал никакими эпизодами печеночной энцефалопатии или не страдал ни одним эпизодом печеночной энцефалопатии в течение продолжительного периода времени (примерно 12 недель или дольше), но у него имеется расстройство или медицинское состояние, которое создает риск эпизодов печеночной энцефалопатии. Эпизод печеночной энцефалопатии представляет собой состояние,характеризуемое наличием дисфункции мозга у пациентов с заболеванием или дисфункцией печени. Существует широкий спектр психических расстройств при печеночной энцефалопатии, который находится в диапазоне от минимальных, при которых основные эффекты представляют собой снижение качества жизни, до явных, которые ведут к коме и, в конечном счете, к смерти. Для оценки тяжести печеночного заболевания и печеночной энцефалопатии, а также прогноза у индивидуумов можно использовать системы балльной оценки. Можно использовать систему балльной оценки Child-Pugh, West Haven Criteria, Glasgow Coma Scale или модифицированную систему балльной оценки Child-Pugh. Альтернативно, можно использовать систему балльной оценки (APACHE) II. Баллы присуждаются параметрам, включающим уровни билирубина в сыворотке, уровни альбумина в сыворотке, и признакам, включающим наличие асцита или энцефалопатии. Подлежащие лечению индивидуумы могут быть отнесены к классу А, В или С по системе балльной оценки Child-Pugh. Как правило, подлежащие лечению индивидуумы относятся к классу С по системе балльной оценки Child-Pugh. Мужчина или женщина, подлежащие лечению, могут быть в возрасте, например, от 25 до 80 лет. В одном варианте осуществления возраст мужчины или женщины составляет от 45 до 70 лет. В другом варианте осуществления возраст мужчины или женщины составляет от 25 до 44 лет. В еще одном варианте осуществления возраст мужчины или женщины составляет более 65 лет. Однако изобретение может применяться в ветеринарии. Подлежащий лечению субъект может быть сельскохозяйственным животным, например коровой или быком, овцой, свиньей, волом, козой или лошадью, или может быть домашним животным, таким как собака или кошка. Субъектом может быть или не быть экспериментальная модель печеночного заболевания у животного. Возраст животного может быть любой, но это часто будет половозрелое, взрослое животное. Препаративная форма Аминокислоты, используемые в настоящем изобретении, могут представлять собой чистые кристаллические аминокислоты. Как правило, аминокислоты представлены в L-форме, а не в D-форме или в виде смеси D и L. Обычно используются выделенные формы аминокислот. Для профилактики или лечения печеночной декомпенсации или печеночной энцефалопатии можно использовать любую активную форму аминокислоты. Можно применять фармацевтически приемлемую форму аминокислоты. Аминокислоты можно использовать в виде свободных аминокислот или солей или производных аминокислот. Орнитин может быть в форме чистой кристаллической аминокислоты. Как правило, орнитин представлен в L-форме, а не в D-форме или в виде смеси D и L. Обычно используются выделенные формы орнитина. Можно использовать любую активную форму орнитина или фармацевтически приемлемую форму орнитина. Орнитин можно использовать в виде свободной аминокислоты или соли или производного аминокислоты. Обычно орнитин используется в виде единственной мономерной аминокислоты. Орнитин можно использовать в форме соли, например можно использовать гидрохлорид орнитина. Орнитин может быть в форме физиологически приемлемой соли в свободной форме. Поэтому орнитин или соль орнитина обычно химически не связаны или ковалентно соединены с любым другим агентом. Можно использовать производные орнитина. Например, кето- или гидроксианалоги орнитина можно вводить в виде солей натрия или кальция. Кетокислоты орнитина включают кетоглутарат орнитина,кетолейцин орнитина и кетовалин орнитина. Соли или производные орнитина можно использовать вместо или в дополнение к свободному орнитину. Можно использовать по меньшей мере один из фенилацетата и фенилбутирата. Фенилацетат и/или фенилбутират могут быть в виде физиологически приемлемой соли, такой как соль щелочного металла или щелочно-земельного металла. Этой солью может быть фенилацетат натрия или фенилбутират натрия. Солевая форма фенилацетата и фенилбутирата может быть в свободной форме. Поэтому фенилацетат и фенилбутират или соль фенилацетата и соль фенилбутирата обычно химически не связаны или ковалентно соединены с любым другим агентом. Необязательно, используется изолейцин. Изолейцин может быть в форме чистой кристаллической аминокислоты. Как правило, изолейцин представлен в L-форме, а не в D-форме или в виде смеси D и L. Обычно используются выделенные формы изолейцина. Можно использовать любую активную форму изолейцина или фармацевтически приемлемую форму изолейцина. Изолейцин можно использовать в виде свободной аминокислоты или соли или производного аминокислоты. Обычно изолейцин используется в виде единственной мономерной аминокислоты. Изолейцин можно использовать в форме соли, например можно использовать гидрохлорид изолейцина. Изолейцин может быть в форме физиологически приемлемой соли в свободной форме. Поэтому изолейцин или соль изолейцина обычно химически не связаны или ковалентно соединены с любым другим агентом. Фармацевтическиекомпозиции Орнитин и фенилацетат и/или фенилбутират обычно составляют для введения с фармацевтически приемлемым носителем или разбавителем. Таким образом, орнитин и фенилацетат и/или фенилбутират могут быть составлены в виде лекарственного препарата со стандартным фармацевтически приемлемым носителем (носителями) и/или эксципиентом (эксципиентами), что является обычной процедурой в фармацевтической области. Точная природа препаративной формы будет зависеть от нескольких факторов,включая желаемый путь введения. Обычно орнитин и фенилацетат и/или фенилбутират составляют для перорального, внутривенного, внутрижелудочного, внутрисосудистого или внутрибрюшинного введения. Фармацевтическим носителем или разбавителем может быть, например, изотонический раствор, такой как физиологический солевой раствор. Твердые пероральные формы могут содержать наряду с активным соединением, например, лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту,стеарат магния или кальция, и/или полиэтиленгликоли; связывающие вещества, например крахмалы,гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, например крахмал, альгиновую кислоту, альгинаты или натриевый гликолят крахмала; вспенивающие смеси; красители; подслащивающие вещества; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и, как правило, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических препаративных формах. Такие фармацевтические препараты могут быть изготовлены известным образом, например посредством способов смешивания, гранулирования,таблетирования, сахарного покрытия или пленочного покрытия. Жидкие дисперсии для перорального введения могут представлять собой сиропы, эмульсии или суспензии. Сиропы могут содержать в качестве носителей, например, сахарозу или сахарозу с глицерином, и/или маннит, и/или сорбит. Суспензии и эмульсии могут содержать в качестве носителя, например, натуральную смолу, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать наряду с орнитином и по меньшей мере одним из фенилацетата и фенилбутирата фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, при желании, подходящее количество лидокаина гидрохлорида. Лекарственные препараты по изобретению могут включать орнитин в качестве единственного аминокислотного компонента. Лекарственные препараты по изобретению могут включать орнитин и изолейцин в качестве единственных аминокислотных компонентов. Лекарственный препарат может состоять, по существу, из орнитина и по меньшей мере одного из фенилацетата и фенилбутирата. Лекарственный препарат может состоять, по существу, из орнитина, изолейцина и по меньшей мере одного из фенилацетата и фенилбутирата. Лекарственный препарат может состоять, по существу, из орнитина, фенилацетата и/или фенилбутирата и фармацевтически приемлемого носителя. Поэтому такой лекарственный препарат, по существу,не содержит другую аминокислоту в дополнение к орнитину. Лекарственный препарат может состоять,по существу, из орнитина, изолейцина, фенилацетата и/или фенилбутирата и фармацевтически приемлемого носителя. Поэтому такой лекарственный препарат, по существу, не содержит другую аминокислоту в дополнение к орнитину и изолейцину. Фенилацетат может присутствовать в количестве от 5 до 100%, например от 10 до 50 или от 20 до 40 мас.% орнитина. Фенилбутират может присутствовать в количестве от 5 до 100%, например от 10 до 50 или от 20 до 40 мас.% орнитина. Однако лекарственный препарат может включать свободный аспартат, глутамат или аргинин в непептидной форме, обычно в незначительном количестве. Как правило, количество по массе аспартата,глутамата или аргинина не превышает количество по массе орнитина. Под незначительным количеством подразумевается, что количество по массе аспартата, глутамата или аргинина или комбинации этих аминокислот не превышает 20 мас.% орнитина. Поэтому лекарственный препарат может, по существу, не включать аспартат. В одном варианте осуществления композиция не включает аспартат, глутамат или аргинин. В композиции могут присутствовать следовые количества аспартата, глутамата или аргинина. Под следовыми количествами подразумевается, что количество по массе аспартата, глутамата или аргинина или комбинации этих аминокислот не превышает 1 мас.% орнитина. Предпочтительно количество по массе аспартата, глутамата или аргинина не превышает 0,5 мас.% орнитина. В другом варианте осуществления композиция может включать еще одну аминокислоту в непептидной форме, обычно в виде свободной аминокислоты или ее физиологически приемлемой соли в свободной форме. Количество этих других аминокислот в основном не превышает количество по массе орнитина. Например, другие аминокислоты могут присутствовать в количестве по массе до 20%, например от 5 до 20 мас.% орнитина. Такие другие аминокислоты, которые могут присутствовать в композиции,включают незаменимые и не незаменимые аминокислоты. Композиция может включать другие аминокислоты с разветвленной цепью (ВСАА). ВСАА включают изолейцин, валин и лейцин. Таким образом,композиция по изобретению может дополнительно включать изолейцин и/или валин, и/или лейцин. Лечение Орнитин и по меньшей мере один из фенилацетата и фенилбутирата вводят в комбинации индивидууму для предотвращения или задержки начала печеночной декомпенсации или печеночной энцефалопатии. Таким образом, орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для улучшения состояния индивидуума, например индивидуума, страдающего хроническим заболеванием печени, после ускоряющего явления. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для облегчения симптомов у индивидуума,например симптомов, связанных с хроническим заболеванием печени у индивидуума, после ускоряющего явления. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для борьбы или задержки начала печеночной декомпенсации или печеночной энцефалопатии. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации индивидууму для лечения печеночной энцефалопатии. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для улучшения состояния пациента, страдающего печеночной энцефалопатией. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для облегчения симптомов, связанных с печеночной энцефалопатией. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для борьбы с печеночной энцефалопатией. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для предотвращения первоначального эпизода печеночной энцефалопатии у индивидуума с риском эпизодов печеночной энцефалопатии. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для уменьшения тяжести первоначального эпизода печеночной энцефалопатии у индивидуума с риском эпизодов печеночной энцефалопатии. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации для задержки первоначального эпизода печеночной энцефалопатии у индивидуума с риском эпизодов печеночной энцефалопатии. Развитие печеночной декомпенсации и печеночной энцефалопатии включает "ускоряющие явления" (или "острые приступы"). Такие ускоряющие явления включают желудочно-кишечное кровотечение, инфекцию (сепсис), тромбоз воротной вены и дегидратацию. Начало такого острого приступа может привести к госпитализации. Пациент может страдать одним из этих острых приступов или комбинацией этих острых приступов. Индивидуума, у которого имелось или подозревается наличие острого приступа, лечат в соответствии с изобретением орнитином и фенилацетатом и/или фенилбутиратом в комбинации для предотвращения прогрессирования поражения печени в декомпенсированное состояние. Поэтому лечение по изобретению может предотвратить медицинские последствия печеночной декомпенсации, такие как печеночная энцефалопатия. Орнитин и фенилацетат и/или фенилбутират можно применять для сохранения печеночной функции. Таким образом, применение орнитина и фенилацетата и/или фенилбутирата может продлить жизнь пациента с заболеванием печени. В одном варианте осуществления предотвращаются метаболические последствия желудочно-кишечного кровотечения, такие как повышенное содержание аммиака в крови, пониженное содержание изолейцина в крови и сниженный синтез белка в период после кровотечения. Обычно лечение индивидуумов можно начинать как можно раньше после начала или подозреваемого начала ускоряющего явления (острого приступа). Предпочтительно лечение индивидуума начинают перед повторными острыми приступами. Более предпочтительно лечение индивидуума начинают после первого острого приступа. Лечение обычно проводят вскоре после начала острого приступа. Лечение может начинаться после выявления симптома (симптомов) острого приступа или подозреваемого острого приступа медиком, таким как врач, помощник врача или медсестра. Лечение может начинаться после госпитализации индивидуума. Таким образом, лечение может начинаться в пределах 6 ч, в пределах 3 ч, в пределах 2 ч или в пределах 1 ч после выявления симптома (симптомов) острого приступа или подозреваемого острого приступа. Поэтому лечение индивидуума может начинаться через 1-48 ч, например через 1-36 ч или через 124 ч после выявления симптома (симптомов) острого приступа или подозреваемого острого приступа. Лечение может происходить в течение периода до 8 недель, например до 6 недель, до 4 недель или до 2 недель после выявления симптома (симптомов) острого приступа или подозреваемого острого приступа. Поэтому лечение может происходить в течение периода до 48 ч, например до 36 ч или до 24 ч после выявления симптома (симптомов) острого приступа или подозреваемого острого приступа. Обычно лечение происходит до того времени, когда очевидно выздоровление от острого ускоряющего явления. Индивидуума лечат орнитином и фенилацетатом и/или фенилбутиратом. Орнитин и по меньшей мере один из фенилацетата и фенилбутирата можно вводить в комбинации в виде одного лекарственного препарата или в виде двух или трех различных лекарственных препаратов. Когда орнитин и по меньшей мере один из фенилацетата и фенилбутирата предстоит ввести в виде комбинированного лекарственного препарата, то комбинацию можно получить непосредственно перед введением или можно хранить в виде комбинированного лекарственного препарата. Когда орнитин и фенилацетат и/или фенилбутират предстоит ввести отдельно, то лекарственные препараты можно вводить одновременно или последовательно в течение периода времени. Два или три отдельных лекарственных препарата можно вводить в течение периода времени. Когда вводят два лекарственных препарата, сначала можно вводить орнитин с последующим введением фенилацетата и фенилбутирата, фенилацетата или фенилбутирата. Альтернативно, сначала можно вводить фенилацетат и фенилбутират, фенилацетат или фенилбутират с последующим введением орнитина. В другом варианте осуществления сначала можно вводить комбинацию орнитина и фенилацетата с последующим введением фенилбутирата. Альтернативно, сначала можно вводить комбинацию орнитина и фенилбутирата с последующим введением фенилацетата. В другом варианте осуществления сначала можно вводить фенилацетат с последующим введением комбинации орнитина и фенилбутирата. Альтернативно, сначала можно вводить фенилбутират с последующим введением комбинации орнитина и фенилацетата. Когда вводят три лекарственных препарата, то орнитин, фенилацетат и фенилбутират вводят в разное время. Орнитин можно вводить первым, вторым или третьим. Когда сначала вводят орнитин, то вторым можно вводить фенилацетат или фенилбутират с последующим введением фенилбутирата или фенилацетата. Когда орнитин вводят вторым, то сначала вводят фенилацетат или фенилбутират, а фенилбутират или фенилацетат вводят третьим. Когда орнитин вводят третьим, то сначала вводят фенилацетат или фенилбутират, а фенилбутират или фенилацетат вводят вторым. Второй лекарственный препарат можно вводить через интервал до 5 ч, например до 2 ч или до 1 ч после введения первого лекарственного препарата. Таким образом, второй лекарственный препарат можно вводить через интервал от 15 мин до 5 ч, например от 30 мин до 4 ч или от 1 до 3 ч после введения первого лекарственного препарата. Третий лекарственный препарат можно ввести через интервал до 5 ч, например до 2 ч или до 1 ч после введения второго лекарственного препарата. Таким образом, третий лекарственный препарат можно вводить через интервал от 15 мин до 5 ч, например от 30 мин до 4 ч или от 1 до 3 ч после введения второго лекарственного препарата. Лекарственные препараты по изобретению можно вводить в один и тот же участок или в различные участки. Лекарственные препараты по изобретению можно вводить одним и тем же путем или различными путями. Лекарственный препарат по изобретению можно вводить любым подходящим путем. Предпочтительно его вводят пероральным, внутривенным, внутрижелудочным, внутрибрюшинным или внутрисосудистым путем. Например, когда орнитин и по меньшей мере один из фенилацетата и фенилбутирата вводят отдельно, то они все могут быть введены перорально, или они могут быть введены внутривенно, или орнитин можно вводить перорально, а фенилацетат и/или фенилбутират можно вводить внутривенно, или фенилацетат и/или фенилбутират можно вводить перорально, а орнитин можно вводить внутривенно. Индивидууму вводят терапевтически эффективные количества орнитина, фенилацетата и/или фенилбутирата и необязательного изолейцина. Дозы орнитина, фенилацетата и/или фенилбутирата и изолейцина можно определить в соответствии с различными параметрами, такими как возраст, масса тела и состояние подлежащего лечению индивидуума; типа и тяжести заболевания печени; пути введения; и требуемой схемы лечения. В зависимости от таких параметров обычная доза орнитина, фенилацетата и/или фенилбутирата или изолейцина составляет от 0,02 до 1,25, например от 0,1 до 0,5 г/кг массы тела. Следовательно, дозировка орнитина, фенилацетата и/или фенилбутирата или изолейцина может составлять от 1 до 50 г, например от 5 до 30 г. Дозировка орнитина может составлять от 10 до 30 г. Дозировка изолейцина может составлять от 5 до 15 г. Орнитин и фенилацетат/фенилбутират можно вводить в массовом соотношении от 10:1 до 1:10, например от 5:1 до 1:5, или от 2:1 до 1:2, или примерно 1:1. Врач сможет определить требуемую дозировку орнитина и фенилацетата или фенилбутирата и необязательного изолейцина для любого конкретного индивидуума. Можно ввести разовую дозу орнитина и разовую дозу фенилацетата и/или фенилбутирата. Необязательно, можно также ввести разовую дозу изолейцина. Альтернативно, можно ввести многократные дозы, например 2, 3, 4 или 5 доз орнитин,а и/или фенилацетата, и/или фенилбутирата, и/или необязательного изолейцина. Такие многократные дозы можно вводить в течение 1 месяца, или 2 недель, или 1 недели. В другом варианте осуществления разовую дозу или многократные дозы, например 2, 3, 4 или 5 доз орнитина, и/или фенилацетата, и/или фенилбутирата можно вводить ежедневно. Как отмечено выше, индивидууму можно вводить другие аминокислоты. Каждую такую или другую аминокислоту можно вводить в том же лекарственном препарате, что и орнитин, и/или фенилацетат,и/или фенилбутират, или можно вводить отдельно. При введении отдельно каждую такую или другую аминокислоту можно вводить одновременно с введением орнитина, и/или фенилацетата, и/или фенилбутирата, или в другое время, например до введения или через интервал до 5 ч, до 2 ч или до 1 ч после их введения. Каждую такую или другую аминокислоту обычно вводят перорально или внутривенно. Индивидууму вводят терапевтически эффективное количество каждой такой или другой аминокислоты. Доза будет зависеть от различных параметров, таких как параметры, отмеченные выше для орнитина, фенилацетата и фенилбутирата. Обычная доза каждой такой или другой аминокислоты составляет от 0,02 до 1,25, например от 0,1 до 0,5 г/кг массы тела. Поэтому дозировка каждой такой или другой аминокислоты может составлять от 1 до 50 г, например от 5 до 30 г. Можно вводить разовую дозу каждой такой или другой аминокислоты. Альтернативно, можно вводить многократные дозы, например 2, 3, 4 или 5 доз. Такие многократные дозы можно вводить в течение 1 месяца, или 2 недель, или 1 недели. В другом варианте осуществления разовую дозу или многократные дозы, например 2, 3, 4 или 5 доз, можно вводить ежедневно. Следующие примеры иллюстрируют изобретение. Пример 1. Функция нейтрофилов изменена у пациентов с циррозом и ухудшается с увеличением тяжести заболевания печени. Способы измерения фагоцитоза нейтрофилов и окислительного всплеска. Фагоцитарный тест: гепаринизированную цельную кровь инкубировали с опсонизированными,FITC-мечеными (флуоресцеином-изотиоцианатом) E.coli и CD16. Затем клетки анализировали проточной цитометрией (FACScan Becton Dickinson), пропускали через прямой или боковой рассеиватель и затем оценивали на основании экспрессии флуорохрома R-фикоэритрина (РЕ) [Immunotech, Marseille, France] для идентификации CD16 положительных клеток. Прошедшую через рассеиватель популяцию затем оценивали на присутствие FITC-меченых бактерий. Фагоцитарный всплеск: гепаринизированную цельную кровь инкубировали с суспензией опсонизированных E.coli для стимуляции окислительного всплеска. Добавляли раствор субстрата для определения превращения дигидрородамина (DHR) 123 во флуорогенное соединение родамин (R) 123. Реакцию останавливали и фиксировали перед инкубацией антителом против CD16 для идентификации положительных нейтрофилов. Затем проводили анализ проточной цитометрией. Хемотаксис нейтрофилов: хемотаксис нейтрофилов измеряли, применяя модифицированный способ камеры Бойдена с использованием интерлейкина-8 в качестве хемоаттрактанта для имитации хемокинеза. Пациенты и методы. Заявители исследовали 30 пациентов с циррозом [алкогольный цирроз; средний возраст 53,2 г (SEM 4,6)] и 20 здоровых добровольцев. Пациентов с циррозом делили на пациентов, имеющих привнесенный алкогольный гепатит (АН+), и пациентов с декомпенсированной или компенсированной печенью. Фаготест использовали для определения фагоцитарной способности и фагоцитарный всплеск использовали для определения того, способны ли были клетки генерировать окислительный всплеск при контакте сE.coli. Результаты. Наблюдалось, что нейтрофилы от пациентов с циррозом имели значительно сниженную способность фагоцитировать бактерии. Было также обнаружено, что у пациентов с циррозом была снижена способность реагировать на стимуляцию нейтрофилов E.coli с точки зрения увеличения скорости генерирования окислительного всплеска (фиг. 1). Это снижение способности коррелировалось с тяжестью заболевания печени, указывая на то, что чем более продвинута стадия заболевания печени, тем меньше способность реагировать и бороться с инфекцией. Пример 2. Аммиак снижает фагоцитарную способность нейтрофилов. Способы измерения фагоцитоза нейтрофилов и окислительного всплеска. Как в примере 1. Пациенты и методы. Кровь брали у здоровых добровольцев (n=15) и инкубировали в течение 1 ч с увеличивающимися концентрациями аммиака. Способность нейтрофилов фагоцитировать бактерии измеряли, используя анализы фаго-тест и хемотаксиса нейтрофилов. В анализе хемотаксиса нейтрофилов использовали 10 нг/мл IL-8. Результаты. При инкубации с увеличивающимися концентрациями аммиака наблюдалось значительное снижение фагоцитоза нейтрофилов (фиг. 2), а также хемотаксиса нейтрофилов (фиг. 3). Пример 3. Влияние аммиака на фагоцитоз нейтрофилов можно устранить вмешательствами. Способы измерения фагоцитоза нейтрофилов и окислительного всплеска. Как в примере 1. Пациенты и методы. Кровь брали у здоровых добровольцев (n=15) и инкубировали в течение 1 ч с аммиаком и выбранными аминокислотами. Способность нейтрофилов фагоцитировать бактерии измеряли, используя анализы фаго-тест. Результаты. Наблюдалось, что вызванное аммиаком снижение фагоцитоза нейтрофилов можно частично устранить орнитином и глутамином (фиг. 4). Однако фагоцитоз нейтрофилов становился хуже под влиянием совместной инкубации аммиака с аспартатом, но оставался неизменным с L-орнитин-L-аспартатом. Пример 4. Имитированное желудочно-кишечное кровотечение снижает хемотаксис нейтрофилов,что можно частично устранить введением изолейцина. Методы. 10 метаболически стабильных пациентов [9 мужчин и 1 женщина; средний возраст 49,6 лет (SEM 9,1); средний балл по шкале Child-Pugh 7,8 (SEM 1,2)] с подтвержденным биопсией циррозом печени исследовали после голодания в течение ночи перед и через 2 ч после перорального введения 75 г смеси аминокислот, которая имитирует молекулу гемоглобина (Nutricia, Cuijk, Netherlands). Семи другим пациентам [(4 мужчины и 3 женщины; средний возраст 51,4 лет (SEM 6,7); средний балл по шкале Child-Pugh 8,1 (SEM 1,4)] после введения смеси аминокислот внутривенно вводили изолейцин в течение 2-часового периода (изоосмотический раствор, содержащий 40 мг/л изолейцина, со скоростью 100 мл/ч). В образцах периферической венозной крови измеряли хемотаксис нейтрофилов (метод см. в примере 1) и аммиак плазмы. Результаты. У этих больных с циррозом хемотаксис нейтрофилов был значительно ниже по сравнению с подобранными по возрасту контролями (53,34,6), и он был значительно снижен после имитированного кровотечения с 31 (4,2) до 8 (5,4) клеток/поле высокой мощности (р 0,0001) (фиг. 5). Концентрация аммиака в плазме значимо возросла с 75,1 (4,2) до 124 (8,5) (р 0,001). Изменение концентрации аммиака коррелировалось с изменением хемотаксиса нейтрофилов (r=0,65 и р 0,05). Уменьшение хемотаксиса нейтрофилов, наблюдаемое при имитированном кровотечении, устранялось у группы больных, получавших лечение изолейцином 25,4 (6,0) клеток/поле с большим увеличением. Пример 5. Имитированное кровотечение снижает синтез белка и неадекватно стимулирует окисление изолейцина. Методы. В исследование были включены 5 больных с циррозом, голодавших в течение ночи. Образец крови и пробы выдыхаемого воздуха брали перед началом вливания стабильных изотопов для измерения фонового обогащения изотопами. Затем больные получали примированное постоянное внутривенное вливание [I-13 С]-изолейцина (1 мг/кг массы тела/ч) до конца эксперимента (t=480 мин). Результаты. На фиг. 6 показана средняя скорость появления окисления изолейцина (Wb Ra) и изолейцина во всем организме в течение последнего часа вливания солевого раствора (черные столбики) и аминокислот(серые столбики) (средние величиныSEM;представляет р 0,05). Кровотечение из верхнего отдела желудочно-кишечного тракта у больных с циррозом привело к снижению уровня изолейцина и выраженному уменьшению синтеза белка во всем организме. Фракция тока изолейцина, используемая для окисления, не изменялась после имитированного кровотечения, несмотря на выраженное снижение концентрации изолейцина, указывая на возникновение антагонизма в отношении ВСАА. Пример 6. Введение изолейцина во время имитированного кровотечения увеличивает синтез белка,но не снижает концентрацию аммиака. Методы. Исследовали 16 метаболически стабильных пациентов с подтвержденным биопсией циррозом печени. Пациентов методом рандомизации включали или в группу добавления изолейцина (40 мг/л раствора; 50 мл/ч), или в группу плацебо во время имитированного кровотечения в течение 4-часового периода. Синтез белка (измеряемый с использованием примированного постоянного вливания L-[кольцевого- 10018007 2 Н 5]фениламина), L-[кольцевого-2 Н 4]тирозина) и L-[кольцевого-2 Н 2]тирозина) и аммиака. Результаты. Результаты показали, что вливание изолейцина во время имитированного кровотечения у больных с циррозом печени восстанавливает синтез белка печени и мышц, приводя к чистому анаболическому состоянию в этих органах (табл. 1). Концентрация аммиака существенно увеличилась в обеих группах, но значимо не отличалась в группах, получавших изолейцин или плацебо (фиг. 7). Таблица 1 Кинетика белка, определенная с использованием модели Phe в t=0 ч и в конце исследования Данные представляют собой среднюю величину + SEM в нмоль/кг массы тела/мин. Конечные величины представляют средние величины заключительного часа вливания аминокислоты. Данные синтеза белка в печени и почках корригированы на гидроксилирование (см методы). Статистика: величины р для критерия Mann-Whitney для различий внутри групп; между группами не было обнаружено статистических различий. Пример 7. Накопление аспартата после вливания L-орнитин-L-аспартата у больных с запущенным циррозом. Методы. 5 пациентов с запущенным циррозом, которые ожидали трансплантации печени (возраст 59 лет; 3 мужчин, заболевание класса С по Child, тяжелый асцит, креатинин 102 ммоль/л) подвергались лечению 40 г/день L-орнитин-L-аспартата. Результаты. В течение 3-дневного периода было значительное и прогрессирующее увеличение концентрации аспартата, превышающей в 5 раз исходную величину (табл. 2). Таблица 2 Пример 8. Введение LOLA снижает концентрацию аммиака, но дает возможность аммиаку регенерироваться. Больные и методы. 8 больных с циррозом (возраст 56 (5,6), 5 мужчин, ALD-6; НЕ (печеночная энцефалопатия) 2 степени: 4 пациента; НЕ 3-4 степени: 4 пациента) получали лечение вливанием LOLA (40 г в течение 8 ч). Образцы крови брали для измерения уровня аммиака и глутамина. Результаты. Результаты показали, что введение LOLA привело к значительному снижению концентрации аммиака с сопутствующим ростом концентрации глутамина (фиг. 8). Это снижение уровня аммиака оказало благоприятные эффекты на тяжесть НЕ. Однако когда введение LOLA прекращалось, то происходило реактивное увеличение уровней циркулирующего аммиака, приводившее к рецидиву НЕ у 3 из 6 пациентов, состояние которых ранее улучшилось. Пример 9. Активное удаление глутамина предотвращает вторичный подъем концентрации аммиака. Больные и методы. 3 больных [возраст 45 (4,1), 2 мужчин, ALD; у всех НЕ 3, у всех 3 HRS], подвергавшихся продолжительной вено-венозной гемофильтрации (CVVH), получали лечение вливанием LOLA (40 г в течение 8 ч). Образцы крови брали для измерения уровня аммиака и глутамина. Результаты. Результаты показали, что введение LOLA привело к снижению концентрации аммиака, но добавление диализа предотвращало сопутствующее увеличение концентрации глутамина (фиг. 9). Поэтому заявители считают, что имелось стойкое снижение концентрации аммиака. Пример 10. Фенилацетат связывает глутамин с получением экскретируемого соединения и предотвращает вторичный подъем содержания аммиака. Больные и методы. 6 больных с острой печеночной недостаточностью (5 больных с не-А не-В гепатитом) и тяжелой энцефалопатией (3-4 степени) лечили LOLA и фенилацетатом (40 г/день в течение 8 ч). Результаты. При комбинированном лечении не было значимого увеличения концентрации глутамина, и уровни аммиака были снижены (фиг. 10). Реактивного увеличения содержания аммиака не наблюдалось. Пример 11. Эффект орнитина и фенилбутирата у больных с печеночной энцефалопатией. Пациенты. 1. Группы - 3 пациента на группу. Всего 12. 2. Критерии включения взрослые пациенты в возрасте 18-80 лет, - цирроз печени, документированный гистологией или клиническими критериями,НЕ типа С, - концентрация аммиака 80 ммоль/л, информированное согласие/разрешение. 3. Критерии исключения: другое сопутствующее неврологическое расстройство, - применение другого специфического лекарственного средства, снижающего уровень аммиака, - дыхательная недостаточность, требующая искусственной вентиляции легких и седативного лечения, - профузное желудочно-кишечное кровотечение,- гипотония, требующая применения инотропных средств, - явная почечная недостаточность (креатинин 2 мг/дкл), гемодиализ, - экстракорпоральная поддержка печени, известная гиперчувствительность к любому из исследуемых лекарственных средств, - беременность. Оценка психического состояния. Определение степени печеночной энцефалопатии (критерии West Haven) Методы. В открытое исследование были включены 8 больных с циррозом и повышенным уровнем аммиака в крови. Они были подобраны по тяжести поражения печения (см. табл. 3). Их лечили одной из следующих схем в течение 3-дневного периода и наблюдения проводили в течение 5 дней. Группы исследования были следующие:(iv) орнитин + фенилбутират: 20 г в 500 мл, 5% декстроза от 08:00 до 12:00 утра + 10 г 2 раза в день,перорально (в 08:00 и в 16:00). Больные голодали в течение ночи с полночи (00:00 ч) до 08:00 ч утра. Их кормили интрагастрально рационом 25 ккал/кг, который включал 1 г/кг белкового рациона, начиная в 08:00 ч утра и заканчивая в полночь. Образцы крови брали в 07:30 ч утра и затем в 18:00 ч для измерения уровня аммиака и глутамина. Проводили тщательный мониторинг больных для выявления побочных эффектов. Лекарственное средство было хорошо переносимым в каждой из групп, и побочные эффекты не наблюдались.SBP: спонтанный бактериальный перитонит, не алкогольный стеатогепатит, ICU: необходима поддержка в отделении интенсивной терапии, HRS: печеночно-почечный синдром. Результаты. На фиг. 11 показано, что в группе плацебо средние уровни аммиака оставались в значительной степени неизменными в течение периода лечения. В группе L-орнитина и фенилбутирата концентрация аммиака увеличилась по сравнению в исходными величинами. В группе, получавшей лечение и Lорнитином, и фенилбутиратом, имелось существенное снижение уровня аммиака. Увеличение уровня аммиака после приема пищи было снижено у животных, получавших лечение ОР, в дополнение к снижению концентрации аммиака. У обоих больных в группе ОР балльная оценка энцефалопатии улучшилась на 2 степени к 3-му дню, что не наблюдалось ни у одного из 6 других больных. На фиг. 12 показано, что средние уровни глутамина оставались в значительной степени неизменными в течение периода лечения в группе ОР, несмотря на снижение уровня аммиака. Имелось снижение уровня глутамина в группе фенилбутирата, что может быть достаточно вредным. В группах L-орнитина и плацебо было увеличение концентраций глутамина, которое заметно усиливалось в состоянии после приема пищи. На фиг. 13 показаны изменения психического состояния в группах, получавших лечение плацебо,орнитином (О), фенилбутиратом (Р) и ОР. Пример 12. Эффект оринитина, фенилбутирата и изолейцина у больных с печеночной энцефалопатией. Больные 1) группы - 2 больных на группу. Всего 6 больных. 2) Критерии включения - взрослые больные в возрасте 18-80 лет, цирроз печени, документированный гистологией или клиническими критериями, В или С Child, недавнее желудочно-кишечное кровотечение из варикозно расширенных вен пищевода (6 ч после проявления), информированное согласие/разрешение. 3) Критерии исключения - другое сопутствующее неврологическое расстройство, применение другого специфического лекарственного средства, снижающего уровень аммиака, дыхательная недостаточность, требующая искусственной вентиляции легких и седативного лечения, профузное желудочнокишечное кровотечение, гипотония, требующая применения инотропных средств, явная почечная недостаточность (креатинин 2 мг/дкл), гемодиализ, экстракорпоральная поддержка печени, известная гиперчувствительность к любому из исследуемых лекарственных средств, беременность/лактация. Методы. В открытое исследование были включены 6 больных с циррозом, которые были доставлены для лечения кровотечения их варикозно расширенных вен пищевода. Они были подобраны по тяжести поражения печения (см. табл. 4). Их лечили одной из следующих схем в течение 3-дневного периода и наблюдения проводили в течение 5 дней. Группы исследования были следующие: зами,iii) изолейцин + орнитин + фенилбутират: изолейцин: 10 г внутривенно в 250 мл 5% декстрозы в течение 2 ч двумя разделенными дозами; орнитин: 20 г в 250 мл, 5% декстроза (t=0; 24, 48 ч); фенилбутират: 10 г 2 раза в деь, перорально (t = 0; 12, 24, 36, 48 ч). Больные голодали в течение ночи с полночи (00:00 ч) до 08:00 ч утра. Их кормили интрагастрально рационом 25 ккал/кг, который включал 1 г/кг белкового рациона, начиная в 08:00 ч утра и заканчивая в полночь. Образцы крови брали в 07:30 ч утра и затем в 18:00 ч для измерения уровня аммиака и глутамина. Проводили тщательный мониторинг больных для выявления побочных эффектов. Лекарственное средство было хорошо переносимым в каждой из групп, и побочные эффекты не наблюдались. Ввиду того, что больные получали седативные препараты для проведения у них первоначальной эндоскопии,невозможно было интерпретировать оценку психического состояния. Один больной в каждой из групп плацебо и изолейцина умер от множественной органной недостаточности в стационаре. Остальные больные выжили. Таблица 4SBP: спонтанный бактериальный перитонит, NASH - не алкогольный стеатогепатит, ICU: необходима поддержка в отделении интенсивной терапии, HRS: печеночно-почечный синдром. Результаты. На фиг. 14 показано, что в группах плацебо и изолейцина не было значимых изменений концентраций аммиака. В группе, получавшей лечение OIP, имелось существенное снижение концентрации аммиака. На фиг. 15 показано, что уровни глутамина значимо не изменяются введением или изолейцина,плацебо или OIP. Только в группе OIP было существенное снижение уровня аммиака. На фиг. 16 показано, что альтернатива, посредством которой OIP может действовать, заключается в снижении уровня генерирующей аммиак аминокислоты, глицина. Существенное снижение уровня глицина наблюдалось только в группе OIP. На фиг. 17 показано, что уровни изолейцина очень низкие для начала в каждой из групп, но они увеличиваются до величин, вдвое превышающих нормальные величины в группах, получавших лечение изолейцином. Концентрация в группе плацебо остается низкой и неизменной. На фиг. 18 показаны изменения уровней орнитина у больных в течение курса лечения, проявляя выраженное, стойкое увеличение концентраций орнитина, которые значительно снижены до исходных величин после прекращения введения лекарственного средства, указывая на захват в различных тканях. Пример 13. Эффект оринитина и фенилбутирата у крыс с перевязанным желчным протоком. Методы. Индукция цирроза печени перевязкой желчного протока (BDL). Для этой процедуры использовали самцов крыс Sprague-Dawley (200-250 г). После анестезии выполняли лапоротомию по средней линии, обнажали желчный проток, трижды перевязывали шелковой нитью 4.0 и пересекали между второй и третьей лигатурой. Рану зашивали послойно рассасываемой нитью, и животному давали возможность восстановиться в спокойном помещении перед возвратом в виварий. Животных содержали при постоянной температуре (20 С) при цикле света/тьмы по 12 ч при неограниченном доступе к воде и стандартному корму для грызунов. Через 5 недель после BDL (или процедуры ложной операции) животных переключали с корма для грызунов на полностью жидкий рацион (Liquidiet, Bio-Serv, Frenchtown NJ, USA), к которому добавляли смесь аминокислот, имитируя состав гемоглобина (2,8 г/кг/день, Nutricia Cuijk, The Netherlands, ProductNo. 24143). Через 6 недель в условиях анестезии в правую сонную артерию вводили катетер и использовали для взятия повторных образцов крови. После этой процедуры брали исходный образец перед введением исследуемых препаративных форм внутрибрюшинной инъекцией. Группы исследования были сле- 14018007(0,22 г/кг/0,3 г/кг, n=7) в солевом растворе внутрибрюшинно. Образцы крови брали в предварительно охлажденные гепаринизированные пробирки и хранили на льду перед переработкой. Плазму собирали после центрифугирования (3000 об/мин, 10 мин) и хранили при -80 С перед анализами. Содержание аммиака, глюкозы, лактата и мочевины измеряли, используя набор COBAS Mira S, в соответствии с инструкциями изготовителя. Содержание аминокислот количественно определяли ВЭЖХ с флуоресцентным детектированием. Результаты. На модели цирроза печени вследствие перевязки желчного протока у крыс происходит существенное увеличение уровня аммиака в плазме артериальной крови (20511 мкмоль/л, средняя величинаSEM) по сравнению со здоровыми контролями (25,62 мкмоль/л, р 0,001, данные не показаны). На этой модели заявители обнаружили, что в группе плацебо, получавшей лечение солевым раствором, не было изменения уровней аммиака в артериальной крови в течение 3 ч. На фиг. 19 показано изменение уровней аммиака в плазме артериальной крови у крыс с циррозом печени, вызванном BDL, после внутрибрюшинных инъекций солевого раствора (контроль BDL, n=5),орнитина (Orn, 0,22 г/кг, n=6), фенилбутирата (РВ, 0,3 г/кг, n=7) и орнитина и фенилбутирата (ОР, 0,22 г/кг + 0,3 г/кг, n=7).обозначает р 0,05 для ОР в сравнении с Orn через 3 ч (двухсторонний вариационный анализ - ANOVA). На этом чертеже показано, что у животных, получавших лечение орнитином, было выявлено небольшое снижение концентрации аммиака, хотя не было обнаружено, что оно отличается от плацебо. У группы, получавшей лечение фенилбутиратом, через 1 ч было обнаружено значительное увеличение содержания аммиака в плазме (р 0,01, в сравнении с со всеми другими группами), хотя было обнаружено,что эта разность была меньше в момент времени через 3 ч. Эти данные согласуются с гипотезой, что фенилбутират (фенилацетат) эффективен только у индивидуумов с возросшими концентрациями глутамина. У животных без добавления орнитина, который может метаболизироваться с образованием глутамина, эффекты одного Р нежелательны и являются потенциально вредными. Значительно более низкий уровень аммиака наблюдали в группе, получавшей лечение орнитином плюс фенилбутиратом (ОР). У этих животных длительное снижение уровня измеряли в течение 3 ч длительности исследования, уровни которого, как было обнаружено в конце исследования, значительно меньше, чем уровни в группе, получавшей только орнитин (р 0,05). Это ясно показывает, что комбинация ОР более эффективна для снижения содержания аммиака в плазме, чем один О или Р. Кроме того, у животных, получавших лечение только Р, возросшие уровни аммиака в плазме могут оказывать вредное воздействие. В поднаборе образцов заявители исследовали захват орнитина в поток крови после внутрибрюшинной инъекции О или ОР. На фиг. 20 показана концентрация орнитина в артериальной крови у групп с добавлениями. Ясно видно, что в обеих группах после внутрибрюшинной инъекции концентрация орнитина в плазме заметно возросла через 1 ч, с последующим снижением через 3 ч, поскольку орнитин метаболизируется в организме. В любой момент времени не было обнаружено значимого различия концентрации орнитина в плазме между этими группами. Эти данные важны, так как показано, что выбранный способ введения эффективен при доставке орнитина этим животным. Кроме того, быстрый захват и наблюдаемое снижение уровней в плазме указывают на то, что происходит активный метаболизм этой аминокислоты. Пример 14. Эффект орнитина, фенилбутирата и изолейцина у крыс с перевязанным желчным протоком. Методы. Для этой процедуры использовали самцов крыс Sprague-Dawley (200-250 г). За 48 ч до умерщвления животных переводили со стандартного корма для грызунов на полностью жидкий рацион (Liquidiet, BioServ, Frenchtown NJ, USA), в который добавляли аминокислотную смесь, имитирующую состав гемоглобина (2,8 г/кг, Nutricia Cuijk, The Netherlands, Product No. 24143). Острую печеночную недостаточность(ALF) вызывали за 24 ч до умерщвления внутрибрюшинной инъекцией галактозамина (1 г/кг, Sigma,Poole, UK) в солевом растворе (n=5 в каждой группе). За 3 ч до умерщвления животным вводили или препаративную форму OIP (0,22 г/кг орнитина, 0,25 г/кг изолейцина, 0,3 г/кг фенилбутирата в солевом растворе внутрибрюшинно), или контроль солевого раствора. В конце эксперимента артериальную кровь собирали в предварительно охлажденные гепаринизированные пробирки и хранили на льду до переработки. Плазму собирали и хранили, как описано выше. Содержание аммиака определяли, как указано выше. Результаты. Было обнаружено, что уровни аммиака в артериальной крови были значительно снижены у крыс с острой печеночной недостаточностью, получавших OIP, по сравнению с контролями, получавшими пла- 15018007 цебо (фиг. 21). Это исследование было предназначено для испытания того, будет ли изолейцин в комбинации с орнитином и фенилбутиратом (фенилацетатом) способен эффективно снижать уровень аммиака в плазме. Ранее было продемонстрировано, что один изолейцин не влияет на уровни аммиака в исследованиях у людей, хотя его эффективность в комбинации с О и Р ранее не испытывали. На фиг. 21 показаны уровни аммиака в плазме артериальной крови на модели острой печеночной недостаточности с повышенным уровнем аммиака в крови при лечении плацебо (солевым раствором)(ALF) и OIP (ALF + OIP). Между этими двумя группами был обнаружен уровень значимости различий р 0,01 (Т-критерий). Эти данные подтверждают гипотезу, что изолейцин в комбинации с орнитином и фенилбутиратом эффективен при снижении уровней аммиака. Это является дополнением к благоприятным эффектам изолейцина, ранее описанным для синтеза белка. Пример 15. Эффект орнитина и фенилбутирата на модели деваскуляризации у свиней. Методы. 5 свиней методом рандомизации делили на 4 группы: острая печеночная недостаточность (ALF) + плацебо + плацебо (n=2); ALF + орнитин + плацебо; ALF + фенилбутират + плацебо; ALF + орнитин и фенилбутират. Свиньям вводили катетеры в бедренную артерию и вену, воротную вену, почечную вену и легочную артерию. Эксперимент начинали во время = -1 ч, когда начинали плацебо или лечебное вливание. 1) плацебо: 5% декстроза в течение 3 ч, перорально вода в качестве плацебо,2) один орнитин: 0,3 г/кг, 5% декстроза в течение 3 ч внутрисосудистое капельное введение,3) фенилбутират: 0,3 г/кг, 5% декстроза в течение 3 ч внутрижелудочное кормление. Орнитин + фенилбутират: 0,3 г/кг, 5% декстроза в течение 3 ч внутрисосудистое капельное введение, 0,3 г/кг, 5% декстроза в течение 3 ч внутрижелудочное кормление.ALF вызывали анастомозом воротной вены с нижней полой веной и последующей перевязкой печеночной артерии (деваскуляризация) во время = 0 ч, вливания прекращали во время t = +2 ч, и эксперимент прекращали во время = 8 ч. Образцы крови и мочи брали во время = 0, 1, 3, 5, 7 и 9 ч для измерения изменений регионального содержания аммиака и аминокислот. В конце эксперимента удаляли срез лобной коры для измерения содержания воды в ткани мозга. Результаты. После вливания орнитина, генерирующего внутриклеточный глутамат, и внутрижелудочной подачи конъюгированного фенилацетата полученные результаты свидетельствуют о глубоком изменении общих уровней аммиака и утилизации глутамина на этой катастрофической модели печеночной недостаточности. Наблюдается согласованный подъем концентрации аммиака в артериальной крови со временем от момента деваскуляризации у животных, получавших лечение плацебо (фиг. 22), при некоторой продукции в мышцах (фиг. 23) и большом количестве аммиака, поступающем из кишечника (фиг. 24). Это животное проявляет самое умеренное высвобождение мышечного глутамина (фиг. 25) и определяемый захват глутамина в кишечнике (фиг. 26). В случае лечения животного одним орнитином, ранний подъем уровня аммиака первоначально сглажен, но он после этого возрастает до самого высокого уровня в конце эксперимента (фиг. 22). Имеется чистый захват аммиака мышцами у этого животного (фиг. 24) при сравнимом количестве глутамина,высвобождаемого из мышц, по сравнению с животным, получавшим плацебо (фиг. 25) при повышенном захвате глутамина кишечником (фиг. 26). Один фенилбутират также проявляет первоначальное сглаживание уровней аммиака в артериальной крови, которые быстро возрастают до уровней, сравнимых с одним орнитином, в конце эксперимента(фиг. 22) с небольшим изменением захвата аммиака мышцами (фиг. 23), но определяемую продукцию аммиака в кишечнике (фиг. 24). Интересно, что имеется чистое удаление глутамина мышцами при лечении одним фенилбутиратом (фиг. 25) с небольшим явным воздействием на захват глутамина кишечником по сравнению с животным, получавшим лечение плацебо (фиг. 26). Комбинация орнитина и фенилбутирата оказывает самое большое воздействие на уровни аммиака в артериальной крови при выраженном снижении его уровней в циркулирующей крови в конце эксперимента, по сравнению со всеми другими животными (фиг. 22). Аммиак активно удаляется из крови мышцами у этого животного (фиг. 23) при значительно сниженной продукции аммиака в кишечнике (фиг. 24). Интересно отметить, что высвобождение глутамина из мышц увеличено по сравнению с животными,получавшими лечение и плацебо, и одним орнитином (фиг. 25). Несмотря на эту увеличенную продукцию глутамина в мышцах, захват глутамина в кишечнике существенно снижен (фиг. 26). Повышенные уровни орнитина в циркулирующей крови у животных, получавших лечение орнитином, показано на фиг. 27. Воздействие деваскуляризации и лечебных вмешательств на глутамин в артериальной крови показано на фиг. 28. Имеется увеличение уровня глутамина в циркулирующей крови у животного, получавшего лечение орнитином, которое снижается совместным введением фенилацетата. Интересные данные состояли в существенном снижении уровней глицина в артериальной крови, которые были обнаружены у животного, получавшего лечение и орнитином, и фенилбутиратом (фиг. 29). В конце эксперимента лобную кору удаляли и измеряли содержание воды в мозге (фиг. 30). Независимый патологоанатом сообщал о клеточной анатомии мозга у этих экспериментальных животных. Его отчет кратко представлен ниже.ALF + О + Р: микрососуды с околососудистым отеком с окружающими пузырьками (меньше, чем в результате ALF без какого-либо лечения). Внутриклеточный отек. Ложное вмешательство: ткань мозга с минимальными ультраструктурными изменениями = нормальная ткань мозга. Выводы. Заявители обнаружили, что имитация некоторых из симптомов острого приступа, связанного с хроническим заболеванием печени, таких как увеличение концентрации аммиака или имитация желудочнокишечного кровотечения, приводит к снижению функции нейтрофилов, и это снижение может быть частично устранено орнитином или изолейцином. Восстановление функции нейтрофилов как орнитином,так и изолейцином, играет важную роль в предотвращении сепсиса, который представляет собой обычный ускоряющий фактор в прогрессировании печеночной декомпенсации. Кроме того, заявители обнаружили, что изолейцин не воздействует на подъем концентрации аммиака после имитированного желудочно-кишечного кровотечения. Поэтому в отличие от гипотезы, что уровни аммиака будут снижаться после введения изолейцина из-за стимуляции синтеза белка, нет воздействия на уровни аммиака. Таким образом, особенно предпочтительно применение изолейцина в комбинации с орнитином который, как известно, снижает уровни аммиака. Следовательно, введение орнитина и изолейцина предотвращает метаболические последствия желудочно-кишечного кровотечения. Возрастающие уровни аммиака сглаживаются, недостаточность изолейцина корригируется и восстанавливается функция нейтрофилов. Поэтому комбинированное применение орнитина и изолейцина обеспечивает новый способ лечения пациентов после ускоряющего события для предотвращения возникновения печеночной декомпенсации. Заявители также обнаружили, что L-орнитин-L-аспартат (LOLA), который применяется для снижения уровня аммиака у пациентов с печеночной энцефалопатией, не устраняет влияние аммиака на функцию нейтрофилов. Таким образом, применение одного орнитина более предпочтительно, чем применение LOLA, поскольку орнитин может и снизить содержание аммиака, и сохранить функцию нейтрофилов. Аспартатный компонент LOLA также накапливается в организме. Это накопление аспартата может быть в действительности вредным для пациентов, поскольку аспартат усугубляет влияние аммиака на функцию нейтрофилов, вызывая дальнейшее снижение функции нейтрофилов. Соответственно, предотвращения или задержки начала печеночной декомпенсации можно достичь, используя орнитин в комбинации с изолейцином, предпочтительно в отсутствие аспартата. Кроме того, заявители обнаружили, что лечение пациентов с печеночной энцефалопатией (НЕ) Lорнитин-L-аспартатом (LOLA) снижает уровни аммиака и, как следствие, увеличивает уровни глутамина. Однако глутамин представляет собой лишь временный буфер аммиака, поскольку он может рециклировать и регенерировать аммиак в почках и тонкой кишке. Следовательно, лечение LOLA может также привести к вторичному подъему уровней аммиака, внося дополнительный вклад в патологию печеночной энцефалопатии. Применение фенилацетата или фенилбутирата у детей с расстройствами цикла мочевины снижает патологически высокие уровни глутамина. Напротив, у пациентов, страдающих НЕ, имеются нормальные уровни глутамина, пока, как показано в примере 1, их лечат LOLA, который снижает уровни аммиака, но увеличивает уровни глутамина. Поэтому применение фенилацетата и/или фенилбутирата позволяет удалять глутамин для предотвращения вторичного подъема уровней аммиака у пациентов с НЕ. Соответственно, усовершенствованного лечения по поводу печеночной энцефалопатии можно достичь введением орнитина в комбинации по меньшей мере с одним из фенилацетата и фенилбутирата,предпочтительно в отсутствие аспартата. Обширные исследования заявителей на экспериментальных моделях, а также у людей с циррозом печени подтверждают точку зрения, что основным органом, удаляющим аммиак у пациентов с циррозом печени, являются мышцы, превращающие аммиак в глутамин, реакцию, при которой используется глутамин. При печеночной недостаточности индуцируется фермент, ответственный за это снижение, глутамин-синтетаза, и предоставление глутамата увеличило бы детоксификацию аммиака. Орнитин, предшественник глутамата, детоксифицирует аммиак трансформацией в глутамин. Однако предварительные исследования заявителей показали, что этот глутамин рециркулирует и регенерирует аммиак. Изобретение предоставляет новый способ не только детоксификации аммиака в глутамин, но также устранения избытка генерируемого глутамина. Таким образом, ОР снижает концентрацию аммиака у пациентов с циррозом печени, и повышенное содержание аммиака в крови значительно более выражено, чем каждый по отдельности. Этот эффект отчетливо синергический, а не аддитивный. Кроме того,увеличение уровня аммиака после приема пищи устраняется введением ОР. Это может позволить корм- 17018007 ление пациентов с декомпенсированным циррозом печени рационами, богатыми белками, без риска повышенного содержания аммиака в крови. Снижение уровня аммиака было связано с улучшением психического состояния. Оно достигает снижения концентрации аммиака предотвращением увеличения уровня глутамина. Это согласуется с гипотезой, что орнитин стимулирует продукцию орнитина в мышцах(захватывая, посредством этого, 1 молекулу аммиака), но этот глутамин выделяется (возможно, в качестве аддукта фенилацетата), предотвращая подъем системного уровня глутамина, посредством этого, предотвращая реактивное повышенное содержание аммиака в крови. Установленный факт, что фенилацетат снижает уровень аммиака у маленьких детей с повышенным содержанием аммиака в крови с проявлениями расстройств цикла мочевины, состоит в том, что аммиак захватывается в глутамин и что глутамин переносится в почки для выделения в качестве аддукта фенилацетатглутамина. У этих маленьких детей проявляется высокий уровень аммиака и, что важно, высокий уровень глутамина. Напротив, у больного с цирротическим состоянием проявляется высокий уровень аммиака и уровень глутамина от нормального до низкого. В описанной выше модели у свиней с циррозом нет повышенного уровня глутамина, и уровни аммиака резко возрастают после изоляции печени. Лечение одним орнитином вызывает увеличение уровня глутамина в крови, в то время как на уровни аммиака нет воздействия. Один фенилбутират вызывает пограничное увеличение глутамина и снова оказывает незначительные эффекты на уровни аммиака. В разительном контрасте от этого, на данной катастрофической модели возрастающего уровня аммиака в крови, комбинация и орнитина, и фенибутирата (ОР) вызывает определяемое снижение циркулирующего аммиака и снижает увеличение уровня глутамина, наблюдаемое при введении одного орнитина. Уровень глицина, генерирующей аммиак аминокислоты, увеличился у всех животных, однако увеличение уровня этой аминокислоты было существенно сглажено только у животного, получавшего лечение ОР, свидетельствуя о дополнительной выгоде этой формы вмешательства. Установленным последствием повышенного уровня аммиака является отек мозга, поскольку увеличивается содержание воды в мозге. В мозге свиньи, получавшей лечение одним орнитином, проявляется значительное увеличение содержания воды, хотя комбинированное лечение орнитином и фенилбутиратом снижает содержание воды в мозге. Гистологически имеется менее выраженное повреждение микроструктуры мозга у животного, получавшего комбинированное лечение орнитином и фенилбутиратом, по сравнению с животным, получавшим лечение плацебо. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 10:1-1:10. 2. Фармацевтическая композиция по п.1, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 5:1-1:5. 3. Фармацевтическая композиция по п.1, содержащая орнитин и, по меньшей мере, фенилацетат и фенилбутират с весовым соотношением 2:1-1:2. 4. Фармацевтическая композиция по п.1, 2 или 3, которая, по существу, не содержит других аминокислот. 5. Фармацевтическая композиция по п.1, 2 или 3, которая, по существу, не содержит аспартата. 6. Способ лечения хронического заболевания печени, включающий идентификацию индивида, страдающего хроническим заболеванием печени; и введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата. 7. Способ лечения цирроза печени, включающий идентификацию индивида, страдающего циррозом печени; и введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата. 8. Способ лечения острой недостаточности печени, включающий идентификацию индивида с острой недостаточностью печени и введение указанному индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата. 9. Способ по любому из пп.6-8, где индивид имеет риск декомпенсации печени или печеночной энцефалопатии. 10. Способ по любому из пп.6-8, где индивид имеет декомпенсацию печени. 11. Способ по любому из пп.6-8, где пациент, по существу, не получает аспартат с пищей. 12. Способ по любому из пп.6-8, где пациент не получает аспартат с пищей. 13. Способ по любому из пп.6-8, где пациент, по существу, не получает других аминокислот с пищей. 14. Способ по любому из пп.6-8, где орнитин и, по меньшей мере, фенилацетат или фенилбутират вводят в таком количестве, которое приводит к длительному снижению уровней аммония. 15. Способ по любому из пп.6-8, где орнитин и, по меньшей мере, фенилацетат или фенилбутират вводят в таком количестве, которое является достаточным для повышения функции нейтрофилов. 16. Способ повышения функции нейтрофилов у индивида с острой недостаточностью печени,включающий идентификацию индивида с острой недостаточностью печени и введение указанному индивиду количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата, эффективного для повышения функции нейтрофилов. 17. Способ профилактики и лечения гипераммониемии у индивида, страдающего хроническим заболеванием печени или острой печеночной недостаточностью, предусматривающий введение индивиду эффективного количества орнитина и, по меньшей мере, фенилацетата и фенилбутирата. 18. Способ по п.17, где введение предотвращает или является лечебным при отеке мозга. 19. Способ по п.17, где введение предотвращает инфекцию. 20. Способ по п.17, где введение предотвращает или обращает снижение фагоцитоза нейтрофилов. 21. Способ по п.17, где индивид страдает спонтанным бактериальным перитонитом. 22. Способ по п.17, где индивид страдает желудочно-кишечным кровотечением. 23. Способ по п.17, где у индивида имеется инфекция. 24. Способ по п.17, где у индивида имеется варикозное расширение вен пищевода. 25. Способ по п.17, где у индивида имеется портальная гипертензия. 26. Способ по п.17, где у индивида имеется портосистемное шунтирование.
МПК / Метки
МПК: A61K 31/192, A61K 31/198, A61K 31/222, A61P 1/16
Метки: печеночной, композиция, содержащая, орнитин, лечения, фенилацетат, энцефалопатии, фенилбутират
Код ссылки
<a href="https://eas.patents.su/29-18007-kompoziciya-soderzhashhaya-ornitin-i-fenilacetat-ili-fenilbutirat-dlya-lecheniya-pechenochnojj-encefalopatii.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция, содержащая орнитин и фенилацетат или фенилбутират, для лечения печеночной энцефалопатии</a>
Предыдущий патент: α-аминоамидные производные, полезные в лечении когнитивных расстройств
Следующий патент: Способ быстрого развертывания спирального заграждения из колючей проволоки
Случайный патент: Растворимый рецептор т- клетки