Эмульсии, содержащие свободное поверхностно-активное вещество в водной фазе в качестве адъюванта сплит вакцин против гриппа
Формула / Реферат
1. Иммуногенная композиция, включающая сплит антиген вируса гриппа и эмульсию типа масло-в-воде, в которой эмульсия включает свободное ПАВ в ее водной фазе, и где композиция представляет собой моновалентную вакцину против пандемического штамма вируса гриппа.
2. Способ по п.1, в котором антиген вируса гриппа является подтипом H1, H2, Н3, Н5, Н7 или Н9 вируса гриппа А.
3. Композиция по п.1 или 2, где композиция выращивается в клеточной культуре и свободна от овалбумина, овомукоида и куриной ДНК.
4. Композиция по п.3, в которой вирус выращивается на клеточной культуре клеточной линии, выбранной из группы, состоящей из MDCK; Vero и PER.C6.
5. Композиция по п.3 или 4, которая содержит менее 10 нг клеточной ДНК из культуры клеток хозяина.
6. Композиция по любому одному из пп.3-5, где композиция содержит менее чем 10 нг ДНК, которая состоит из 100 нуклеотидов или более.
7. Композиция по любому предшествующему пункту, которая содержит от 0,1 до 20 mг гемагглютинина на вирусный штамм.
8. Композиция по любому предшествующему пункту, в которой эмульсия включает сквален.
9. Композиция по любому предшествующему пункту, в которой эмульсия включает токоферол.
10. Композиция по п.9, в которой токоферолом является DL-a-токоферол.
11. Композиция по любому предшествующему пункту, в которой эмульсия содержит капли субмикронного диаметра.
12. Композиция по любому предшествующему пункту, в которой антиген вируса гриппа получают из вируса гриппа, имеющего один или более сегментов РНК из вируса гриппа A/PR/8/34.
13. Композиция по любому предшествующему пункту, в которой антиген вируса гриппа получают из вируса гриппа, полученного методом обратной генетики.
14. Композиция по любому одному из пп.3-13, в которой клеточная культура является культурой-микроносителем, адгезивной культурой или суспензионной культурой.
15. Композиция по любому одному из пп.3-14, в которой клеточная культура свободна от сыворотки.
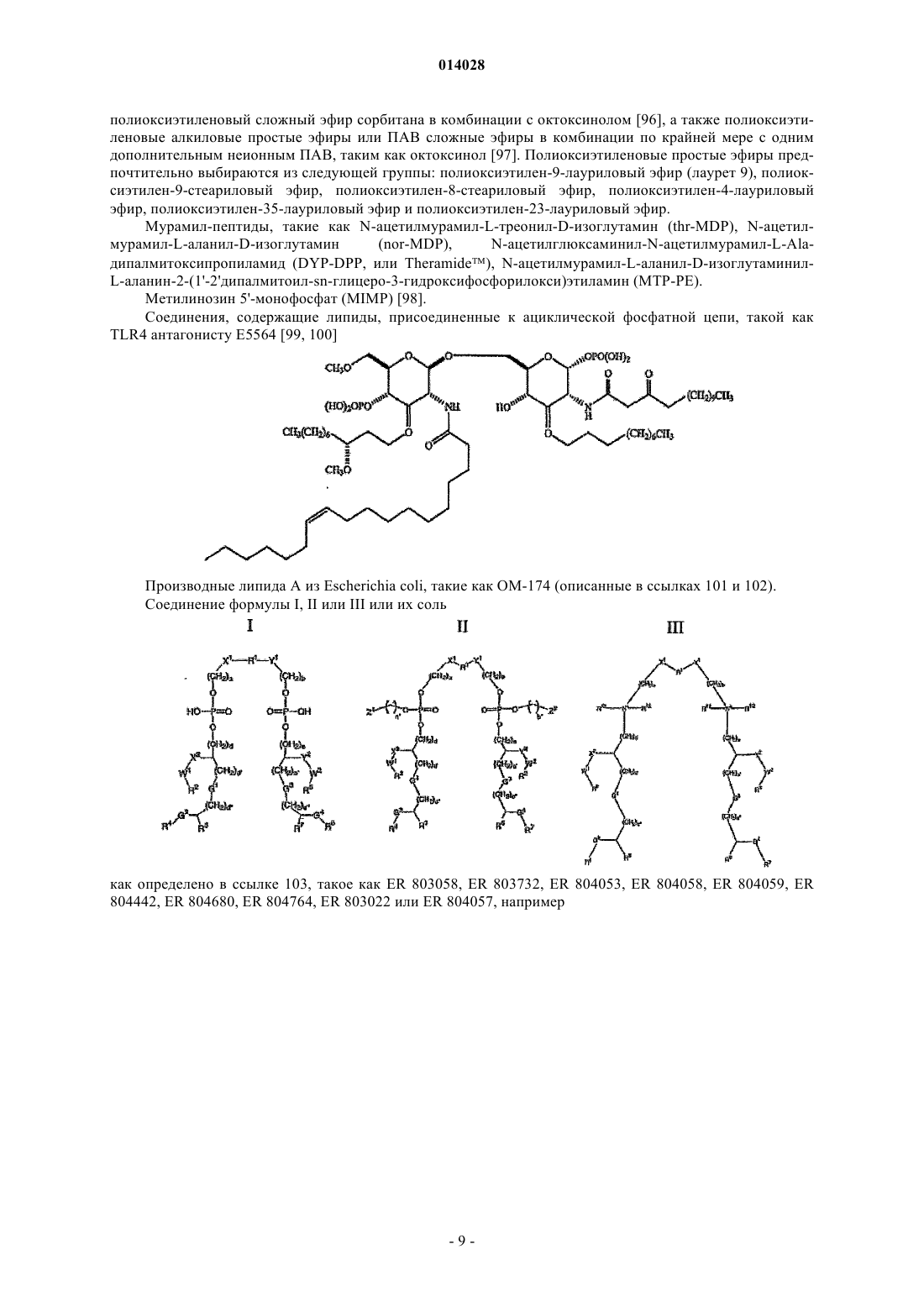
16. Композиция по любому предшествующему пункту, в которой эмульсия включает 3-О-деацилированный монофосфорил-липид A (3dMPL).
17. Композиция по п.16, в которой по крайней мере 10 вес.% 3dMPL имеют форму гексаацильной цепи.
18. Композиция по п.16 или 17, в которой 3dMPL находится в виде частиц с диаметром <150 нм.
19. Композиция по любому предшествующему пункту, являющаяся, по существу, свободной от соединений ртути.
20. Композиция по любому предшествующему пункту, включающая от 1 до 20 мг/мл хлорида натрия.
21. Композиция по любому предшествующему пункту, имеющая осмоляльность между 200 и 400 мОсм/кг.
22. Композиция по любому предшествующему пункту, включающая один или более буферов.
23. Композиция по п.22, в которой буфер(ы) включают фосфатный буфер; буфер Tris; боратный буфер; сукцинатный буфер; гистидиновый буфер или цитратный буфер.
24. Композиция по любому предшествующему пункту, имеющая рН между 5,0 и 8,1.
25. Композиция по любому предшествующему пункту, содержащая <1 единицы эндотоксина на дозу.
26. Композиция по любому предшествующему пункту, являющаяся свободной от глютена.
27. Композиция по любому предшествующему пункту, включающая два штамма гриппа А и один штамм гриппа В.
28. Набор, включающий: (i) первый компонент набора, включающий сплит антиген вируса гриппа; и (ii) второй компонент набора, включающий адъювант в виде эмульсии типа масло-в-воде, которая включает свободное ПАВ в ее водной фазе.
29. Набор по п.28, в котором первый и второй компоненты находятся в отдельных емкостях.
30. Набор по п.29, в котором первый и второй компоненты находятся в ампулах.
31. Набор по п.29, в котором один из первого и второго компонентов находится в шприце и в котором другой компонент находится в ампуле.
32. Набор по п.30 или 31, в котором ампула изготовлена из стекла или пластика.
33. Набор по пп.30, 31 или 32, в котором ампула запечатана пробкой, не содержащей латекс.
Текст
ЭМУЛЬСИИ, СОДЕРЖАЩИЕ СВОБОДНОЕ ПОВЕРХНОСТНО-АКТИВНОЕ ВЕЩЕСТВО В ВОДНОЙ ФАЗЕ В КАЧЕСТВЕ АДЪЮВАНТА СПЛИТ ВАКЦИН ПРОТИВ ГРИППА(71)(73) Заявитель и патентовладелец: НОВАРТИС ВЭКСИНС ЭНД ДИАГНОСТИКС СРЛ (IT) Сплит вакцина против вирусов гриппа с адъювантом в виде эмульсии типа масло-в-воде, содержащей свободное поверхностно-активное вещество в ее водной фазе. Это свободное поверхностно-активное вещество может продолжать оказывать "расщепляющее действие" на антиген, разрушая тем самым любые нерасщепленные вирионы и/или агрегаты вирионов, которые могут присутствовать. 014028 Все цитируемые здесь документы полностью введены в качестве ссылок. Область техники изобретения Данное изобретение относится к области вакцин для защиты против вирусной инфекции гриппа и в частности сплит вакцинам. Предпосылки создания изобретения Вакцины против гриппа описаны в главах 17 и 18 ссылки 1. Они основаны на живых или инактивированных вирусах, и инактивированные вакцины могут быть основаны на целых вирусах, "сплит" вирусах или поверхностно очищенных антигенах (включая гемагглютинин и нейраминидазу). Гемагглютинин(НА) является основным иммуногеном в инактивированных вакцинах гриппа, и дозы вакцин стандартизируются относительно уровня НА, при этом вакцины обычно содержат около 15 г НА на штамм."Сплит" вакцины получают обработкой вирионов детергентами для получения субвирионных препаратов, используя способы расщепления, такие как "Твин-эфирный" способ расщепления. Сплит вакцины обычно включают разнообразные антигены из вириронов гриппа. Продукты BEGRIVAC,FLUARICS, FLUZONE и FLUSHIELD представляют собой сплит вакцины. В период 2000-2001 гг. в Канаде наблюдался идентифицированный новый глазодыхательный синдром (ORS) у пациентов, которые получали сплит вакцины. ORS был связан с неполным расщеплением вирионов во время производства, дающего композиции с высокой долей микроагрегатов нерасщепленных вирионов [2]. Нет никаких объяснений связи между сплит вакцинами и ORS, однако, клинические и эпидемиологические признаки наводят на мысль о гиперчувствительности, так что можно предположить, что вакцина может нарушать природный баланс Th1/Th2, при этом крупнодисперсные нерасщепленные вирионы вызывают смещение в направлении Th2-фенотипа. В ссылке 3, например, присутствие агрегатов в сплит вакцинах гриппа, как было найдено, отклоняет иммунный ответ к более высокому уровню цитокина Th2. В ссылке 4, однако, не подтвердилось никакой связи между ORS и балансом Th1/Th2. В ситуации, когда вакцины гриппа должны быть получены быстро (например, в случае пандемии),давление на производителей может непреднамеренно привести к выпуску вакцин, которые имеют те же проблемы, что и частично нерасщепленные агрегированные канадские партии 2000-2001 гг. Действительно, в ссылке 2 установлено, что "нельзя полностью исключить нерасщепленные вирионы и агрегаты" и что "нельзя избежать некоторого риска возникновения офтальмологических и респираторных симптомов". Целью данного изобретения является снижение до минимума риска того, что сплит вакцина гриппа будет иметь те же самые проблемы, что и вакцина в Канаде в 2000-2001 гг. Сущность изобретения Данное изобретение решает эту задачу с помощью адъюванта сплит вакцины против вирусов гриппа, представляющего эмульсию типа масло-в-воде, которая содержит свободное поверхностно-активное вещество (ПАВ) в ее водной фазе. Свободное ПАВ может продолжать оказывать "расщепляющее действие" на антиген, разрушая тем самым любые нерасщепленные вирионы и/или агрегаты вирионов, которые так или иначе могут присутствовать. Более того, хотя свободное ПАВ, как можно ожидать, с течением времени будет иметь денатурирующий эффект на мембранные гликопротеины, такие как важный антиген нейраминидаза (NA), однако, короткий срок годности, требуемый для обычных вакцин против гриппа, означает, что это не вызовет проблем на практике. Таким образом, изобретение представляет собой иммуногенную композицию, включающую антиген сплит вируса гриппа и эмульсию типа масло-в-воде, где эмульсия включает свободное ПАВ в ее водной фазе. Изобретение также представляет собой способ приготовления иммуногенной композиции, включая этапы объединения: (i) антигена сплит вируса гриппа и (ii) эмульсии типа масло-в-воде, которая включает свободное ПАВ в ее водной фазе. Изобретение также представляет собой комплект, включающий: (i) первый компонент комплекта,содержащий антиген сплит вируса гриппа; и (ii) второй компонент комплекта, содержащий эмульсию типа масло-в-воде, которая включает свободное ПАВ в ее водной фазе. Хотя в настоящее время на рынке нет никаких адъювантных сплит вакцин против гриппа, все же имеется несколько предложений для введения адъювантов в вакцины против гриппа для того, чтобы позволить производить увеличенное число доз из фиксированного количества антигена. Например, ссылки 5-8 раскрывают использование солей алюминия в качестве адъювантов вакцин, содержащих целые вирионы, против гриппа. Настоящее изобретение не признает использование алюминиевых солей как отдельного адъюванта для сплит вакцин, поскольку они ускоряют иммунный ответ Th2-типа, когда используются сами по себе, что приводило к вспышке ORS в Канаде (см. выше). Антиген сплит вируса гриппа. Композиции изобретения включают антиген, полученный расщеплением вирионов гриппа. Сплит вирион обычно может включать разнообразные антигены из вириона гриппа, включая гемагглютинин,нейраминидазу, матрикс и нуклеопротеин. Изобретение не охватывает вакцины из живых вирусов (такие-1 014028 как продукт FLUMIS), вакцины из инактивированных целых вирионов (такие как продуктINFLEXAL), вакцины из поверхностно-очищенных антигенов (которые основаны на очищенных поверхностных гликопротеинах: гемагглютинине и нейраминидазе, такие как продукты FLUVIRIN,AGRIPPAL и INFLUVAC) или вирус-липосомные вакцины (которые принимают форму вирусоподобных липосомных частиц, свободных от нуклеиновой кислоты [9], как в продуктах INFLEXAL V иINVAVAC). Вирионы могут быть собраны из жидкостей, содержащих вирус, различными способами. Например,способ очищения может включать зональное центрифугирование, используя раствор с линейным градиентом сахарозы, который включает детергент для разрушения вирионов. Сплит вирионы могут быть получены обработкой очищенных вирионов детергентами (например,этиловым эфиром, полисорбатом 80, дезоксихолатом, три-N-бутилфосфатом, Triton Х-100, Triton N101,цетилтриметиламмоний бромидом, Tergitol NP9 и др.) для получения субвирионных препаратов, включая "Твин-эфирный" способ расщепления. Способы расщепления вирусов гриппа хорошо известны в данной области техники, например, см. ссылки 10-15 и др. Расщепление вируса обычно выполняется разрушением или фрагментацией целого вируса, либо инфекционной, либо неинфекционной, расщепляющим агентом с разрушающей концентрацией. Разрушение приводит к полной или частичной растворимости вирусных белков, изменяющих целостность вируса. Предпочтительно расщепляющими агентами являются неионные и ионные (например, катионные) ПАВ, например алкилгликозиды, алкилтиогликозиды, ацилсахара, сульфобетаины, бетаины, полиоксиэтиленалкилэфиры, N,N-диалкилглюкамиды,Hecameg, алкилфеноксиполиэтоксиэтанолы, четвертичные соединения аммония, саркозил, ЦТАБы (цетилтриметиламмонийбромиды), три-N-бутилфосфат, Cetavlon, миристилтриметиламмониевые соли, липофектин, липофектамин и DOT-MA, октил- или нонил-феноксиполиоксиэтанолы (например, Triton ПАВы, такие как Triton Х-100 или Triton N101), полиоксиэтиленсорбитан сложные эфиры (Твин ПАВы),полиоксиэтилен простые эфиры, полиоксиэтилен сложные эфиры и др. В одном применяемом способе расщепления используются последовательные воздействия дезоксихолата натрия и формальдегида, и расщепление может происходить во время начальной очистки вирионов (например, в растворе с градиентом плотности сахарозы). Сплит вирионы могут быть эффективно ресуспендированы в изотоническом растворе хлорида натрия, забуференном фосфатом натрия. Вирус гриппа может быть ослабленным. Вирус гриппа может быть чувствительным к температуре. Вирус гриппа может быть адаптирован к холоду. Штаммы вирусов гриппа, используемые в вакцинах, меняются от сезона к сезону. В текущем межпандемическом периоде типичными являются трехвалентные вакцины, включающие два штамма гриппаA (H1N1 и H3N2) и один штамм гриппа В. В изобретении может быть использован межпандемический штамм этого типа, но могут также быть использованы вирусы пандемических штаммов (то есть штаммов, к которым реципиент и вообще человеческая популяция иммунологически не подготовлены), таким как подтипы штаммов Н 2, Н 5, Н 7 или Н 9 (в частности вируса гриппа А), при этом вакцины гриппа пандемических штаммов могут быть одновалентными или, например, могут быть основаны на обычной трехвалентной вакцине, дополненной пандемическим штаммом. Однако в зависимости от ситуации и природы антигена, введенного в вакцину, изобретение может защищать против одного или более подтипов НА вируса гриппа A H1, Н 2, Н 3, Н 4, Н 5, Н 6, Н 7, Н 8, Н 9, Н 10, Н 11, Н 12, Н 13, Н 14, Н 15 или H16. Изобретение может защитить против одного или более подтипов НА вируса гриппа А N1, N2, N3, N4,N5, N6, N7, N8 или N9. Являясь подходящей для иммунизации против межпандемических штаммов, композиция изобретения особенно применима для иммунизации против штаммов пандемических. Характеристиками штамма гриппа, который может вызвать вспышку пандемии являются следующие: (а) он содержит новый НА в отличие от НА в циркулирующих в настоящее время человеческих штаммах, то есть тот, который не был заметен в человеческой популяции в течение десятилетия (например, Н 2), или вообще не был заметен в человеческой популяции (например, Н 5, Н 6 или Н 9, которые были найдены, в основном, только в популяции птиц), так что человечество будет иммунологически неподготовлено к НА этого штамма; (б) он способен передаваться горизонтально в человеческой популяции; и (с) он является патогенным для людей. Вирус с гемагглютинином подтипа Н 5 является предпочтительным для иммунизации против пандемического гриппа, такого как H5N1 штамм. Другие возможные штаммы включают H5N3, H9N2, H2N2,H7N1 и H7N7 и некоторые другие потенциально возможные пандемические штаммы. В пределах подтипа Н 5 вирус может подразделяться на НА группа 1, НА группа 1', НА группа 2 или НА группа 3 [16], при этом группы 1 и 3 являются особенно патогенными. Штаммы вирусов гриппа, используемые изобретением, могут быть устойчивы к антивирусной терапии (например, устойчивы к оселтамивиру [17] и/или занамивиру), включая устойчивые пандемические штаммы [18]. Композиции изобретения могут включать антиген(ы) из одного или более (например, 1, 2, 3, 4 или более) штаммов вируса гриппа, включая вирус гриппа А и/или вирус гриппа В. Если вакцина включает более чем один штамм, разные штаммы обычно выращиваются раздельно и смешиваются после того, как-2 014028 вирусы будут выращены и расщеплены. Таким образом, способ изобретения может включать этап смешения антигенов из более одного штамма гриппа. Трехвалентная вакцина, включающая два вирусных штамма гриппа А и один вирусный штамм гриппа В, является предпочтительной. В некоторых осуществлениях изобретения композиции могут включать антиген из одного штамма гриппа А. В некоторых осуществлениях композиции могут включать антиген из двух штаммов гриппа А,при условии, что эти два штамма не являются H1N1 и H3N2. В некоторых осуществлениях композиции могут включать антиген из более двух штаммов гриппа А. Вирус гриппа может быть реассортантным штаммом и может быть получен способами обратной генетики. Способы обратной генетики [например, 19-23] позволяют получать вирусы гриппа с желаемыми геномными сегментами in vitro, используя плазмиды. Обычно они включают экспрессирующие (a) молекулы ДНК, которые кодируют желаемые молекулы вирусной РНК, например из polI промоторов, и(b) молекулы ДНК, которые кодируют вирусные белки, например из роlII промоторов, так что экспрессия обоих типов ДНК в клетке ведет к образованию полного интактного инфекционного вириона. ДНК предпочтительно обеспечивает все вирусные РНК и белки, но также, возможно, следует использовать вирус-помощник, чтобы обеспечить некоторые из РНК и белки. Основанные на плазмидах способы, использующие отдельные плазмиды для получения каждой вирусной РНК, являются предпочтительными[24-26], и эти способы также включают использование плазмид для экспрессии всех или некоторых (например, только РВ 1, РВ 2, РА и NP белков) вирусных белков, при этом в некоторых способах используются 12 плазмид. Для того чтобы снизить число необходимых плазмид, в одном из предыдущих решений [27] объединили множество транскрипционных кассет РНК-полимеразы I (для синтеза вирусной РНК) на одной и той же плазмиде (например, последовательности, кодирующие 1, 2, 3, 4, 5, 6, 7 или все 8 сегментов вРНК гриппа А) и множество белок-кодирующих областей с промоторами РНК полимеразы II на другой плазмиде (например, последовательности, кодирующие 1, 2, 3, 4, 5, 6, 7 или все 8 транскриптов мРНК гриппа А). Предпочтительные аспекты приведенного метода [27] включают: (a) РВ 1, РВ 2 и РА мРНКкодирующие области на одной плазмиде; и (b) все 8 вРНК-кодирующих сегмента на одной плазмиде. Можно также облегчить задачу, включая NA и НА сегменты на одной плазмиде и шесть других сегментов на другой плазмиде. В качестве альтернативы использования polI промоторов для кодирования сегментов вирусной РНК можно использовать промоторы полимеразы бактериофага [28]. Например, обычно могут быть использованы промоторы для SP6, Т 3 или Т 7 полимераз. Благодаря видовой специфичности polI промоторов промоторы полимеразы бактериофага могут быть более пригодны для многих типов клеток (например,MDCK), хотя клетка также должна быть трансфецирована плазмидой, кодирующей экзогенный полимеразный фермент. В других методах возможно использование двойных polI и polII промоторов, чтобы одновременно кодировать вирусные РНК, и для экспрессируемых мРНК из одной матрицы [29, 30]. Таким образом, вирус гриппа А может включать один или более сегментов РНК из вирусаA/PR/8/34 (обычно 6 сегментов из A/PR/8/34, с сегментами НА и N из штамма вакцины, то есть с реассортацией 6:2), особенно когда вирусы выращиваются в яйцах. Можно также включить один или более РНК сегментов из вируса A/WSN/33 или из любого другого вирусного штамма для получения реассортантных вирусов при изготовлении вакцины. В основном, защита предлагается изобретением от штамма,который способен передаваться от человека к человеку, и поэтому геном штамма будет в основном включать по крайней мере один сегмент РНК, который присутствует в вирусе гриппа млекопитающих,(например, человека). Он также может включать сегмент NS из вируса птичьего гриппа. Вирусы, используемые как источник антигенов, могут быть выращены либо на яйцах, либо на клеточной культуре. Современный стандартный способ выращивания вирусов гриппа использует куриные яйца, свободные от особых патогенов (SPF) с зародышем, при этом вирус очищают от яичного содержания (аллантоисной жидкости). Совсем недавно, однако, вирусы были выращены в клеточной культуре животных, и по причине скорости и аллергий у пациентов этот метод выращивания является предпочтительным. Если используется способ выращивания вирусов на основе яиц, то в аллантоисную жидкость яйца вместе с вирусом могут быть введены одна или более аминокислота [15]. Когда используется клеточная культура, субстратом для роста вирусов будет клеточная линия, полученная от млекопитающих. Подходящие клетки млекопитающих включают, но не ограничиваются,клетки хомяков, крупного рогатого скота, приматов (включая людей и обезьян) и собак. Могут быть использованы различные типы клеток, такие как клетки почки, фибробласты, ретинальные, легочные клетки и др. Примером подходящих клеток хомяков являются клеточные линии, имеющие название BHK21 или HKCC. Подходящими клетками обезьян, являются, например, клетки Африканской зеленой мартышки, такие как клетки почки, как в клеточной линии Vero. Подходящими клетками собак являются,например, клетки почки, такие как в клеточной линии MDCK. Таким образом, подходящие линии клеток включают, но не ограничиваются, MDCK; СНО; 293 Т; BHK; Vero; MRC-5; PER.C6; WI-38 и другие. Предпочтительные клеточные линии млекопитающих для выращивания вирусов гриппа включают клетки MDCK [31-34], полученные из почки собаки Madin Darby; клетки Vero [35-37], полученные из почки-3 014028 Африканской зеленой мартышки (Cercopithecus aethiops); или клетки PER.C6 [38], полученные из ретинобластов эмбриона человека. Эти клеточные линии широко представлены, например, в Американской коллекции Культур Типовых Клеток (АТСС) [39], в клеточных хранилищах Coriell [40] или в Европейской Коллекции Клеточных Культур (ЕСАСС). Например, АТСС поставляет различные клетки Vero по каталогу под номерами CCL-81, CCL-81.2, CRL-1586 и CRL-1587 и поставляет клетки MDCK по каталогу под номером CCL-34. PER.C6 имеются в наличии в ЕСАСС под депозитным номером 96022940. Как менее предпочитаемая альтернатива клеточным линиям млекопитающих, вирус может быть выращен на клеточных линиях птиц [например, ссылки 41-43], включая клеточные линии уток (например, сетчатка глаза уток) или кур, например фибробласты куриных эмбрионов (ФКЭ) и др. Примеры включают стволовые клетки птичьих эмбрионов [41, 44], включая ЕВх клеточную линию, полученную из стволовых клеток куриных эмбрионов, ЕВ 45, ЕВ 14 и ЕВ 14-074 [45]. Наиболее предпочтительными клеточными линиями для выращивания вирусов гриппа являются клеточные линии MDCK. Первоначальная клеточная линия MDCK представлена от АТСС как CCL-34,однако, могут быть использованы также производные этой клеточной линии. Например, ссылка 31 раскрывает клеточную линию MDCK, которая была адаптирована для выращивания в суспензионной культуре (MDCK 33016, представленная как DSM АСС 2219). Аналогично, ссылка 46 раскрывает клеточную линию, имеющую происхождение от MDCK, которая растет в свободной от сыворотки суспензионной культуре (В-702, представленная как FERM ВР-7449). В ссылке 47 раскрываются неонкогенные клетки MDCK, включающие MDCK-S (ATCC PTA-6500),MDKC-SF101 (ATCC PTA-6501), MDKC-SF102 (ATCC PTA-6502) и MDCK-SF103 (РТА-6503). Ссылка 48 раскрывает клеточные линии MDCK с высокой чувствительностью к инфекции, включающие клеткиMDCK.5F1 (ATCC CRL-12042). Могут быть использованы любые из этих клеточных линий MDCK. При выращивании на клеточных линиях, таких как клетки MDCK, вирус можно вырастить в суспензии [31, 49, 50] или в адгезивной культуре. Одной из подходящих клеточных линий MDCK для суспензионной культуры является MDCK 33016 (представленная, как DSM АСС 2219). В качестве альтернативы может быть использована культура на микроносителях. Клеточные линии, поддерживающие репликацию вирусов гриппа, предпочтительно выращивают в культуральной среде свободной от сыворотки и/или в среде свободной от белка. В контексте данного изобретения среда относится к бессывороточной, когда она не содержит никаких добавок сыворотки человеческого или животного происхождения. Безбелковой средой принято обозначать культуры, в которых размножение клеток происходит в отсутствие белков, факторов роста, других белковых добавок и белков, свободных от сыворотки, но можно выборочно включать белки, такие как трипсин или другие протеазы, которые могут быть необходимы для роста вирусов. Клетки, растущие в такой культуре,обычно сами содержат белки. Клеточные линии, поддерживающие репликацию вирусов гриппа, предпочтительно растут при температуре ниже 37 С [51] (например, 30-36 С или около 30, 31, 32, 33, 34, 35, 36 С), например, во время вирусной репликации. Когда вирус растет на клеточной линии, то эта растущая культура, а также вирусный инокулум, используемый для затравки культуры, предпочтительно свободны (то есть при испытании дает негативный результат на инфицирование) от вируса простого герпеса, респираторно-синциального вируса, вируса парагриппа 3, коронавируса SARS, аденовируса, риновируса, респираторно-кишечных вирусов, полиомавирусов, бирнавирусов, цирковирусов и/или парвовирусов [52]. Отсутствие вирусов простого герпеса особенно предпочтительно. Когда вирус выращен на клеточной линии млекопитающих, тогда композиция преимущественно будет свободна от яичных белков (например, яичного альбумина и овомукоида) и от куриной ДНК и,таким образом, будет иметь пониженную аллергенность. Исключение аллергенов является дополнительным способом минимизации Th2 ответов. Когда вирус выращен на клеточной линии, то композиция преимущественно содержит менее чем 10 нг (предпочтительно менее чем 1 нг и более предпочтительно менее чем 100 пг) остатков ДНК клеткихозяина на дозу, хотя следы ДНК клетки-хозяина могут присутствовать. Вообще, ДНК клетки-хозяина,которую желательно исключить из композиции изобретения, является ДНК, которая длиннее, чем 100 п.о. Измерение остаточной ДНК клетки-хозяина в настоящее время является обычным нормативным требованием для биологических препаратов и находится в пределах обычных возможностей специалистов. Анализ, используемый для измерения ДНК, будет обычным признанным анализом [53, 54]. Показательные характеристики утвержденного анализа могут быть описаны в математических и количественных терминах и возможные источники ошибки могут быть определены. Анализ обычно выполняется для установления характеристик, таких как аккуратность, точность, специфичность. После того как проба проверена (например, относительно известного стандартного количества ДНК клетки-хозяина) и исследована, затем могут быть выполнены обычным образом количественные измерения ДНК. Для количественных измерений ДНК могут быть использованы три основных метода: методы гибридизации, такие как Саузерн-Блоттинг или слот-блоттинг [55]; методы иммуноанализа, такие как Threshold System [56];-4 014028 и количественная ПЦР [57]. Эти методы знакомы всем специалистам, хотя точные характеристики каждого метода могут зависеть от исследуемой клетки-хозяина, например от выбора проб для гибридизации,выбора праймера и/или проб для амплификации и др. Система Threshold из Molecular Devices представляет собой количественный анализ пикограммовых уровней общей ДНК и используется в биофармацевтике для контроля уровней загрязнения ДНК [56]. Типичный анализ включает непоследовательноеспецифичное образование реакционного комплекса между биотинилированным оцДНК-связывающим белком, уреаза-конъюгированным антителом анти-оцДНК и ДНК. Все компоненты для анализа включены в комплект для анализа общей ДНК (Total DNA Assay Kit), предоставляемый производителем. Различные промышленные производители предоставляют количественные ПЦР-анализы для определения остаточной ДНК клетки-хозяина, например AppTec Laboratory Services, BioReliance, Althea Technologies и др. Сравнение хемилюминесцентного гибридизационного анализа и системы Threshold общей ДНК для определения загрязнения вирусной вакцины для человека ДНК клетки-хозяина могут быть найдены в ссылке 58. Загрязняющая ДНК может быть удалена во время изготовления вакцины с помощью стандартных очистительных процедур, таких как хроматография и др. Удаление остаточной ДНК клетки-хозяина может быть улучшено с помощью нуклеазы, например, используя ДНКазу. Обычный метод для снижения загрязнения ДНК клетки-хозяина раскрывается в ссылках 59 и 60, включающий двухэтапную обработку,используя сначала ДНКазу (например, бензоназу), которая может быть использована во время роста вируса, а затем катионный детергент (например, ЦТАБ), который может быть использован во время разрушения вирионов. Обработка алкилирующим агентом, таким как -пропиолактон, также может быть использована для удаления ДНК клетки-хозяина и преимущественно может также быть использована для инактивации вирионов [61]. Вакцины, содержащие 10 нг (например, 1 нг, 100 пг) ДНК клетки-хозяина на 15 г гемагглютинина, являются предпочтительными по сравнению с вакцинами, содержащими 10 нг (например, 1 нг,100 пг) ДНК клетки-хозяина на 0,25 мл объема. Вакцины, содержащие 10 нг (например, 1 нг, 100 пг) ДНК клетки-хозяина на 50 г гемагглютинина, являются более предпочтительными по сравнению с вакцинами, содержащими 10 нг (например, 1 нг, 100 пг) ДНК клетки-хозяина на 0,5 мл объема. Способ размножения вируса в культивируемых клетках обычно включает этапы посева культивируемых клеток со штаммом, который должен быть выращен, культивации зараженных клеток в течение желаемого периода времени для репродуцирования вируса, такого как, например, определенный титром вируса или экспрессией антигена (например, от 24 до 168 ч после заражения) и сбора выращенного вируса. Культивируемые клетки заражаются вирусом (измеренным PFU или TCID50) в отношении к клеткам от 1:500 до 1:1, предпочтительно 1:100 до 1:5, более предпочтительно 1:50 до 1:10. Вирус добавляется к суспензии клеток или наносится на монослой клеток, и вирус абсорбируется клетками по крайней мере 60 мин, но обычно менее 300 мин, предпочтительно между 90 и 240 мин при 25-40 С, предпочтительно от 28 до 37 С. Зараженная клеточная культура (например, монослои) может быть удалена либо методом замораживания-оттаивания, либо ферментацией, чтобы увеличить вирусное содержание собранной культуры в кондиционированной среде. Собранные жидкости затем либо активируются, либо хранятся в замороженном виде. Культивированные клетки могут подвергнуться множественному заражению (м.з.) от около 0,0001 до 10, предпочтительно от 0,002 до 5, более предпочтительно от 0,001 до 2. Еще более предпочтительно клетки заражаются при м.з. около 0,01. Зараженные клетки могут быть собраны через 30-60 ч после заражения. Предпочтительно клетки собирают через 34-48 ч после заражения. Еще более предпочтительно клетки собирают через 38-40 ч после заражения. Чтобы выделить вирус, во время выращивания клеток обычно добавляют протеазы (в основном трипсин), которые могут быть добавлены на любой подходящей стадии выращивания. Гемагглютинин (НА) является главным иммуногеном инактивированных вакцин гриппа, включая сплит вакцины, и дозы вакцин стандартизируются относительно уровней НА, измеряемых обычно анализом одномерной радиальной иммунодиффузии (SRID). Существующие сплит вакцины обычно содержат около 15 г НА на штамм, хотя используются и более низкие дозы, например для детей или в ситуациях пандемии. Были использованы дробные дозы, такие как 1/2 (то есть 7,5 г НА на штамм), 1/4 и 1/8 [7, 8],так же как и более высокие дозы (например, 3 х или 9 х дозы [62, 63]). Такие вакцины могут содержать от 0,1 до 150 цг НА на штамм гриппа, предпочтительно от 0,1 до 50 цг, например 0,1-20, 0,1-15, 0,1-10, 0,17,5, 0,5-5 г и др. Отдельные дозы включают, например, около 45, около 30, около 15, около 10, около 7,5, около 5, около 3,8, около 1,9, около 1,5 и т.д. на штамм. Включение адъюванта в вакцину может компенсировать более низкую иммуногенность, присущую этим более низким дозам. НА, используемый в изобретении, может быть натуральным, в том виде, в котором он находится в вирусе, или может быть модифицированным. Например, чтобы модифицировать НА, нужно, как известно, удалить детерминанты (например, гиперосновные области около сайта расщепления между НА 1 и НА 2), которые делают вирус высокопатогенным у птиц, так как эти детерминанты иначе могут помешать росту вируса в яйцах. Композиции изобретения могут включать детергент, например ПАВ сложный эфир полиоксиэти-5 014028 ленсорбитана (известный как Tweens), октоксинол (такой как октоксинол-9 (Triton Х-100) или третоктилфеноксиполиэтоксиэтанол), цетилтриметиламмонийбромид (ЦТАБ), или дезоксихолат натрия, в частности для сплит вакцины или вакцины из поверхностных антигенов. Детергент может присутствовать только в виде следов. Так, вакцина может включать менее чем 1 мг/мл каждого из октоксинола-10,-токоферил водород сукцината и полисорбата-80. Другие остаточные компоненты в виде следов могут быть антибиотиками (например, неомицин, канамицин, полимиксин В). Эмульсия типа масло-в-воде. Было обнаружено, что эмульсии типа масло-в-воде особенно хорошо подходят в качестве адьювантов для вакцин против вирусов гриппа. Известны различные такие эмульсии, и они обычно включают по крайней мере один масляный компонент и по крайней мере одно ПАВ, при этом масло(а) и ПАВ(ы) являются биологически разрушаемыми (преобразующимися в ходе обмена веществ) и биологически совместимыми. Масляные капли эмульсии обычно имеют диаметр менее 5 м и могут иметь даже субмикронный диаметр, при этом такие маленькие размеры достигаются с помощью микрофлюидизатора, чтобы обеспечить устойчивость эмульсии. Капли размером менее 220 нм являются предпочтительными, так как они могут быть подвергнуты стерилизации путем фильтрования. Изобретение может быть использовано с маслами, такими как масла из животных (например, рыб) или растительных источников. Источники растительных масел включают орехи, семена, зерна. Арахисовое, соевое, кокосовое и оливковое масла обычно используются в наибольшей степени и являются примером ореховых масел. Может быть использовано масло жожоба, полученное, например, из плодов жожоба. Масла из семян включают сафлоровое, хлопковое, подсолнечное, кунжутное масло и другие. Из зерновых наиболее доступным является кукурузное масло, но масло других зерновых злаков, таких как пшеница, овес, рожь, рис, метличка абиссинская, тритикале и другие, также могут быть использованы. Сложные эфиры жирных кислот с 6-10 атомами углерода и глицерина и 1,2-пропандиол, при условии,что они не содержатся в природе в маслах семян, могут быть получены посредством гидролиза, выделения и сепарации соответствующих материалов, начиная от ореховых и семенных масел. Жиры и масла из молока млекопитающих преобразуются в ходе обмена веществ и поэтому могут быть использованы в практике этого изобретения. Процедуры выделения, очищения, омыления и другие способы получения чистых масел из животных источников хорошо известны в данной области техники. Большинство рыб содержат преобразующиеся в ходе обмена веществ масла, которые легко могут быть выделены. Например, масло печени трески, печени акулы и китовое масло, такое как спермацетовое, являются примерами некоторых масел из рыб, которые могут быть здесь использованы. Ряд масел с разветвленной цепью с 5 углерод изопреновыми звеньями синтезируются биохимически и относятся к терпеноидам. Масло печени акулы содержит разветвленные ненасыщенные терпеноиды, известные как сквален, 2,6,10,15,19,23 гексаметил-2,6,10,14,18,22-тетракозагексаен, который здесь особенно предпочтителен. Сквалан, насыщенный аналог сквалена, также является предпочтительным маслом. Рыбные масла, включающие сквален и сквалан, легко доступны из промышленных источников и могут быть получены известными в данной области способами. Другими предпочтительными маслами являются токоферолы (см. ниже). Могут быть использованы смеси масел. ПАВ могут быть систематизированы по их ГЛБ (гидрофильно/липофильный баланс). Предпочтительно ПАВ изобретения имеют ГЛБ по крайней мере 10, предпочтительно по крайней мере 15 и более предпочтительно по крайней мере 16. Изобретение может быть использовано с ПАВ, включающими, но не ограничивающимися, ПАВ полиоксиэтиленовый эфир сорбитана (обыкновенно относящийся кTweens), особенно полисорбат 20 и полисорбат 80; сополимеры окиси этилена (ОЭ), окиси пропилена(ОП) и/или окиси бутилена (ОБ), продаваемые под торговой маркой DOWFAX, такие как линейные блок-сополимеры ОЭ/ОП; октоксинолы, которые могут различаться по числу повторяющихся этокси(окси-1,2-этандиил) групп, с октоксинолом-9 (Triton Х-100, или трет-октилфеноксиполиэтоксиэтанол),представляющим особый интерес; (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); нонилфенолэтоксилаты, такие как Tergitol NP серий; полиоксиэтиленовые эфиры жирных спиртов, лаурилового, цетилового, стеарилового и олеилового (известных как Brij ПАВы), такие как триэтиленгликолевый эфир монолаурилового спирта (Brij 30); и эфиры сорбитана (в общем известные как SPANs), такие как сорбитантриолеат (Span 85) и сорбитанмонолаурат. Неионные ПАВ являются предпочтительными. Предпочтительными ПАВ для включения в эмульсии являются Tween-80 (полиоксиэтиленсорбитанмоноолеат), Span 85 (сорбитантриолеат), лецитин и Triton Х-100. Можно использовать смеси ПАВ, например смеси Tween 80/Span 85. Комбинация полиоксиэтиленового эфира сорбитана, такого как полиоксиэтиленсорбитанмоноолеат (Tween 80) и октоксинола, такого как трет-октилфеноксиполиэтоксиэтанол (Triton Х-100), также подходят. Другая используемая комбинация включает лаурет 9 и полиоксиэтиленовый эфир сорбитана и/или октоксинол. Предпочтительные количества ПАВ (вес.%) составляют полиоксиэтиленовые эфиры сорбитана (такие как Tween 80) - 0,01-1%, в частности около 0,1%; октил- или нонилфеноксиполиоксиэтанолы (такие как (Triton Х-100 или другие детергенты серий Triton) - 0,001-0,1%, в частности 0,005-0,02%; полиокси-6 014028 этиленовые эфиры (такие как лаурет 9) - 0,1-20%, предпочтительно 0,1-10% и в частности 0,1-1% или около 0,5%. Каким бы ни был выбор масла(масел) и ПАВ(ов), ПАВ(ы) включаются в количестве, избыточном по сравнению с количеством, требуемым для получения эмульсии, так что свободное ПАВ остается в водной фазе. Свободное ПАВ в полученной эмульсии может быть определено различными способами. Например, для отделения эмульсионных капель от водной фазы может быть использован метод центрифугирования в градиенте плотности сахарозы, и затем может быть проанализирована водная фаза. Центрифугирование может быть использовано для разделения двух фаз, при этом масляные капли слипаются и поднимаются на поверхность, после чего можно определить содержание ПАВ в водной фазе, например,используя ВЭЖХ или другой подходящий аналитический метод. Специальные адъюванты эмульсий типа масло-в-воде, используемые с изобретением, включают, но не ограничиваются,субмикронную эмульсию из сквалена, Tween 80 и Span 85. Композиция эмульсии может включать по объему около 5% сквалена, около 0,5% полисорбата 80 и около 0,5% Span 85. В весовом выражении эти доли составят 4,3% сквалена, 0,5% полисорбата 80 и 0,48% Span 85. Этот адъювант известен какMF59 [64-66], как описывается более детально в главе 10 ссылки 67 и главе 12 ссылки 68. ЭмульсияMF59 предпочтительно включает цитратные ионы, например 10 мМ буфера лимоннокислого натрия; эмульсию из сквалена, токоферола и Tween 80. Эмульсия может включать фосфатно-соляной буфер(PBS). Она может также включать Span 85 (например, около 1%) и/или лецитин. Эти эмульсии могут включать 2-10% сквалена, 2-10% токоферола и 0,3-3% Tween 80, и весовое отношение сквален:токоферол предпочтительно 1, так как это обеспечивает более стабильную эмульсию. Сквален иTween 80 могут находится в объемном отношении около 5:2. Одна такая эмульсия может быть изготовлена растворением Tween 80 в PBS с образованием 2% раствора, затем смешением 90 мл этого раствора со смесью (5 г DLтокоферола и 5 мл сквалена) и последующей микрофлюидизацией смеси. Полученная эмульсия может иметь субмикронные масляные капли, например, со средним диаметром между 100 и 200 нм, предпочтительно около 180 нм; эмульсию из сквалена, токоферола и детергента Triton (например, Triton Х-100). Эмульсия может также включать 3d-MPL (см. ниже). Эмульсия может содержать фосфатный буфер; эмульсию, включающую полисорбат (например, полисорбат 80), детергент Triton (например, TritonX-100) и токоферол (например. -токоферол сукцинат). Эмульсия может включать эти три компонента в массовом отношении около 75:11:10 (например, 750 г/мл полисорбата 80, 110 г/мл Triton Х-100 и 100 г/мл -токоферол сукцината), и любая доля этих компонентов должна создавать эти концентрации. Эмульсия может также включать сквален. Эмульсия может также включать 3d-MPL (см. ниже). Водная фаза может содержать фосфатный буфер; эмульсию из сквалана, полисорбата 80 и полоксамера 401 (Pluronic L121). Эмульсия может быть образована в фосфатно-соляном буфере, рН 7.4. Эта эмульсия является пригодной системой доставки для мурамилдипептидов и используется с треонил-MDP в адъюванте SAF-1 [69] (0,05-1% Thr-MDP, 5% сквалана, 2,5% Pluronic L121 и 0,2% полисорбата 80). Она может также использоваться без Thr-MDP, как в адъюванте AF [70] (5% сквалана, 1,25% Pluronic L121 и 0,2% полисорбата 80). Предпочтительна микрофлюидизация; эмульсию, содержащую 0,5-50% масла, 0,1-10% фосфолипида и 0,01-5% неионного ПАВ. Как описано в ссылке 71, предпочтительными фосфолипидными компонентами являются фосфатидилхолин,фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидная кислота, сфингомиелин и кардиолипин. Субмикронный размер капель является предпочтительным; субмикронную эмульсию типа масло-в-воде с маслом, не подвергающимся метаболизму в ходе обмена веществ (таким как легкое минеральное масло), и по крайней мере одним ПАВ (таким как лецитин,Tween 80 или Span 80). Могут быть включены добавки, такие как сапонин QuilA, холестерин, сапонинлипофильный конъюгат (такой как GPI-0100, описанный в ссылке 72, полученный присоединением алифатического амина посредством карбоксильной группы глюкуроновой кислоты), диметилдиоктадециламмоний бромид и/или N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин; эмульсию, в которой сапонин (например, QuilA или QS21) и стероидный спирт (например, холестерин) ассоциированы в спиральные мицеллы [73]. Эмульсии и сплит антиген могут быть смешаны в процессе изготовления, перед упаковкой, или они могут быть смешаны перед приемом, во время доставки. Таким образом, адъювант и антиген могут храниться отдельно в упакованной или раздаваемой вакцине, готовой для окончательного приготовления ко времени использования. Антиген обычно будет в водной форме, так что вакцина окончательно готовится смешением двух жидкостей. Соотношение объемов двух жидкостей для смешивания может варьироваться (например, между 5:1 и 1:5), но обычно оно составляет около 1:1. Соответствующий набор более подробно описан ниже. После того как антиген и адъювант смешаны, антиген гемагглютинина будет оставаться в водном растворе, но может распределяться около поверхности раздела масло/вода. В большинстве случаев, со-7 014028 всем незначительно, гемагглютинин будет переходить в жировую фазу эмульсии. В случаях, когда композиция включает токоферол, могут быть использованы также , , , ,илитокоферолы, но -токоферолы предпочтительны. Токоферол может принимать несколько форм, например различных солей и/или изомеров. Соли включают органические соли, такие как янтарной, уксусной, никотиновой кислоты и др. DТокоферол и DLтокоферол, оба, могут быть использованы. Токоферолы преимущественно используются в вакцинах для пожилых пациентов (например, 60 лет и более), поскольку витамин Е, как отмечалось, оказывает положительный эффект на иммунный ответ в этой группе пациентов [74]. Они также обладают антиоксидантными свойствами, что может способствовать стабилизации эмульсий [75]. Предпочтительным -токоферолом является DLтокоферол, и предпочтительной солью этого токоферола является сукцинат. Эта соль, как было найдено, объединяется с TNFсвязанными лигандами in vivo. Более того, -токоферол сукцинат, как известно, совместим с вакцинами против гриппа и является полезным консервантом в качестве альтернативы ртутным соединениям [14]. В дополнение, стимулирование витамином Е иммунных клеток может непосредственно вести к увеличенному образованию IL-2 (то есть Th1-типу ответа) [76], который может помочь избежать явный фенотипTh2. Дополнительные адъюванты. Так же как включение эмульсий типа масло-в-воде, композиции изобретения могут включать один или более других адъювантов. Такие адъюванты включают, но не ограничиваются: Композиции, содержащие минералы, включая соли кальция и алюминия (или их смеси). Соли кальция включают фосфат кальция (например, САР частицы, описанные в ссылке 77). Алюминиевые соли включают гидроокиси, фосфаты, сульфаты и др., при этом эти соли имеют любую приемлемую форму(например, гелеобразную, кристаллическую, аморфную и др.). Адсорбция к этим солям является предпочтительной. Композиции, содержащие минералы, могут быть также составлены как частицы солей металлов [78]. Адъюванты алюминиевых солей описаны более детально ниже. Цитокин-индуцирующие агенты (см. более детально ниже). Сапонины [глава 22 ссылки 67], которые являются гетерологической группой стеролгликозидов и тритерпеноидгликозидов, которые найдены в коре, листьях, стеблях, корнях и даже цветках большого ряда растительных образцов. Сапонин из коры дерева Molina Quillaia saponaria широко изучался в качестве адъювантов. Сапонин может быть также получен в промышленных масштабах из Smilax ornata (сарсапарель), Gypsophilla paniculata (гипсофила ползучая) и Saponaria officianalis (мыльный корень). Адъювантные составы из сапонинов включают очищенные составы, такие как QS21, а также липидные составы, такие как ISCOM, QS21, который маркируется как Stimulon. Композиции сапонина очищают с использованием ВЭЖХ и обращено-фазовой ВЭЖХ. Специальные очищенные фракции, использующие эти методы, идентифицированы, включая QS7, QS17, QS18, QS21, QH-A, QH-В и QH-C. Предпочтительно сапонином является QS21. Способ производства QS21 раскрывается в ссылке 79. Композиции сапонинов могут также включать стероидный спирт, такой как холестерин [80]. Комбинации сапонинов и холестеринов могут быть использованы для образования уникальных частиц, называемых иммуностимулирующими комплексами (ISCOMs) [глава 23 ссылка 67]. ISCOM обычно также включает фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любой известный сапонин может быть использован вISCOMs. Предпочтительно ISCOMs включают один или более QuilA, QHA и QHC. ISCOMs, кроме того,описаны в ссылках 80-82. Необязательно, ISCOMs могут быть свободны от дополнительного детергента[83]. Обзор получения адъювантов на основе сапонинов можно найти в ссылках 84 и 85. Алифатические адъюванты (детально см. ниже). Бактериальные АДФ-рибозилирующие токсины (например, термолабильный энтеротоксин LTE.coli, токсин холеры СТ или токсин коклюша ТР) и их обезвреженные производные, такие как мутантные токсины, известные как LT-K63 и LT-R72 [86]. Использование обезвреженных АДФрибозилирующих токсинов в качестве мукозальных адъювантов описано в ссылке 87 и в качестве парентеральных адъювантов - в ссылке 88. Биоадгезивы и мукоадгезивы, такие как микросферы этерифицированной гиалуроновой кислоты[89] или хитозан и его производные [90]. Микрочастицы (то есть частицы от 100 нм до 150 м в диаметре, более предпочтительно от 200 нм до 30 м и наиболее предпочтительно от 500 нм до 10 м в диаметре), образованные из биодеградируемых и нетоксичных материалов (например, поли(-гидроксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и др.), при этом полимер лактида с гликолидом является предпочтительным, не обязательно обработанные для получения отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионным детергентом, таким как ЦТАБ). Липосомы (главы 13 и 14, ссылка 67). Примеры липосомных составов, подходящих для использования в качестве адъювантов, описаны в ссылках 91-93. Липосомы могут вызвать сильные Th1 ответы,особенно катионные липосомы, содержащие липиды на основе микобактерий [94]. Полиоксиэтиленовые простые и сложные эфиры [95]. Такие составы, кроме того, включают ПАВ-8 014028 полиоксиэтиленовый сложный эфир сорбитана в комбинации с октоксинолом [96], а также полиоксиэтиленовые алкиловые простые эфиры или ПАВ сложные эфиры в комбинации по крайней мере с одним дополнительным неионным ПАВ, таким как октоксинол [97]. Полиоксиэтиленовые простые эфиры предпочтительно выбираются из следующей группы: полиоксиэтилен-9-лауриловый эфир (лаурет 9), полиоксиэтилен-9-стеариловый эфир, полиоксиэтилен-8-стеариловый эфир, полиоксиэтилен-4-лауриловый эфир, полиоксиэтилен-35-лауриловый эфир и полиоксиэтилен-23-лауриловый эфир. Мурамил-пептиды, такие как N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилмурамил-L-аланил-D-изоглутамин Соединение полигидроксильного пирролизидина [104], имеющее формулу где R выбран из группы, включающей водород, линейные или разветвленные, незамещенные или замещенные, насыщенные или ненасыщенные ацильные, алкильные (например, циклоалкильную), алкенильные, алкинильные и арильные группы, или его фармацевтически приемлемую соль, или его производное. Примеры включают, но не ограничиваются, казуарин, казуарин-6D-глюкопиранозу, 3-epi-казуарин, 7epi-казуарин, 3,7-диepi-казуарин и др. Препарат наружного мембранного белка протеосомы, полученный из первой грамотрицательной бактерии в комбинации с препаратом липосахарида, полученным из второй грамотрицательной бактерии, в котором препараты наружного мембранного белка протеосомы и липосахарида образуют устойчивый нековалентный адъювантный комплекс. Такие комплексы включают IVX-908, комплекс, состоящий из наружной мембраны Neisseria meninitidis и липополисахаридов. Они использовались как адъюванты для вакцин гриппа [105]. Гамма инулин [106] или его производные, такие как алгаммулин. Эти и другие активные адъюванты обсуждаются более детально в ссылках 67 и 68. Композиции могут включать два или более названных адъюванта. Например, они могут преимущественно включать как эмульсию масло в воде, так и агент, индуцирующий цитокин, так как эта комбинация улучшает ответы цитокина, вызванные вакциной гриппа, такие как ответное появление интерферона при этом улучшение является гораздо большим, чем в случае, когда используется только либо эмульсия, либо агент. Антигены и адъюванты в композиции будут в основном в виде смеси. Предпочтительно дополнительными адъювантами являются те, которые содействуют иммунному ответу типа Th1. Такие адъюванты включают, но не ограничиваются, иммуностимулирующие олигонуклеотиды [107]; 3dMPL [108]; ISCOMs; QS21; микрочастицы PLG; фосфат кальция [109]; полигидроксильные пирролизидины; гамма инулины [110]; имидазохинолины [123]; локсорибин и фосфатные производные аминоалкилглюкозаминида [111]. Цитокин-индуцирующие агенты. Цитокин-индуцирующие агенты, предназначенные для композиций изобретения, при введении пациенту могут стимулировать иммунную систему к выделению цитокинов, включая интерфероны и интерлейкины. Ответы цитокинов, как известно, включаются на ранних и решающих стадиях защиты хозяина против инфекции гриппа [112]. Предпочтительно агенты могут вызвать выделение одного или более из -интерферона; интерлейкина-1; интерлейкина-2; интерлейкина-12; TNF-; TNF- и GM-CSF. Предпочтительно агенты вызывают выделение цитокинов, связанных с иммунным ответом типа Th1,- 10014028 например -интерферона, TNF-, интерлейкина-2. Стимуляция как -интерферона, так и интерлейкина-2 предпочтительна. В результате получения композиции изобретения пациент будет иметь, таким образом, Т-клетки,которые после стимуляции антигеном гриппа будут выделять желаемый цитокин(ы) антигенспецифическим образом. Например, Т-клетки, очищенные от их крови, подверженные воздействию гемагглютинина вируса гриппа in vitro, будут выделять -интерферон. Способы измерения таких ответов в мононуклеарах периферической крови (РВМС) известны в данной области техники и включают ELISA,ELISPOT, проточную цитометрию и количественную ПЦР в реальном времени. Например, ссылка 113 представляет исследование, в котором наблюдались опосредованные антиген-специфическими Тклетками иммунные ответы против столбнячного токсина, особенно ответы -интерферона, и было найдено, что ELISPOT является наиболее чувствительным методом, чтобы различить ответы, вызванные антиген-специфическими ТТ, от спонтанных ответов, но что внутрицитоплазматическое определение цитокина с помощью проточной цитометрии является наиболее эффективным методом для определения эффектов повторного стимулирования. Цитокин-индуцирующие агенты включают, но не ограничиваются,иммуностимуляторный олигонуклеотид, такой как содержащий мотив CpG (динуклеотидная последовательность, содержащая неметилированный цитозин, связанный фосфатной связью с гуанозином),или двухцепочечная РНК, или олигонуклеотид, содержащий палиндромную последовательность, или олигонуклеотид, содержащий поли(dG)последовательность. 3-О-Деацилированный монофосфорил липид A (3dMPL, также известный как MPL) [114-117]. Соединение имидазохинолин, такие как имиквимод (R-837) [118, 119], резиквимод (R-848) [120] и их аналоги; и их соли (например, гидрохлориды). Более детальную информацию об иммуностимулирующих имидазохинолинах можно найти в ссылках 121-125. Соединение тиосемикарбазона, такое как раскрыто в ссылке 126. Методы составления составов,производства и скрининга на активные соединения также описаны в ссылке 126. Тиосемикарбазоны особенно эффективны при стимуляции мононуклеарных клеток периферической крови человека для образования цитокинов, таких как TNF-. Соединение триптантрина, такое как раскрыто в ссыпке 127. Методы составления составов, производства и скрининга на активные соединения также описаны в ссылке 127. Тиосемикарбазоны особенно эффективны при стимуляции мононуклеарных клеток периферической крови человека для образования цитокинов, таких как TNF-. Аналог нуклеозида, такой как где R1 и R2, каждый независимо, является Н, гало, -NRaRb, -ОН, С 1-6 алкокси, замещенный С 1-6 алкокси,гетероциклил, замещенный гетероциклил, С 6-10 арил, замещенный С 6-10 арил, С 1-6 алкил или замещенный С 1-6 алкил;R3 отсутствует, H, С 1-6 алкил, замещенный С 1-6 алкил, С 6-10 арил, замещенный С 6-10 арил, гетероциклил или замещенный гетероциклил;R4 и R5, каждый независимо, является Н, гало, гетероциклил, замещенный гетероциклил, -C(O)-Rd,С 1-6 алкил, замещенный С 1-6 алкил или связаны вместе с образованием 5-членного кольца, как в R4-5R9 является Н, C1-6 алкил, замещенный C1-6 алкил, гетероциклил, замещенный гетероциклил или R9a,где R9a является при этом соединение достигается по связи, показанной-ОН; каждый Ra и Rb независимо является Н, C1-6 алкил, замещенный C1-6 алкил, -C(O)Rd,C6-10 арил; каждый Rc независимо является Н, фосфат, дифосфат, трифосфат, C1-6 алкил или замещенный C1-6 алкил; каждый Rd независимо является Н, гало, C1-6 алкил, замещенный C1-6 алкил, C1-6 алкокси, замещенный C1-6 алкокси, -NH2, NH(C1-6 алкил), -NH(замещенный C1-6 алкил), -N(C1-6 алкил)2, -N(замещенный C1-6 алкил)2, С 6-10 арил или гетероциклил; каждый Rf независимо является Н, С 1-6 алкил, замещенный C1-6 алкил, C(O)Rd, фосфат, дифосфат или трифосфат; каждый n независимо является 0, 1, 2 или 3; каждый р независимо является 0, 1 или 2; или(g) фармацевтически приемлемая соль любого от (а) до (f), таутомер любого от (а) до (f), или фармацевтически приемлемая соль таутомера. Локсорибин (7-аллил-8-оксогуанозин) [131]. Соединения, раскрытые в ссылке 132, включающие соединения ацилпиперазина, соединения индоледиона, соединения тетрагидраизохинолина (THIQ),соединения бензоциклодиона, соединения аминоазавинила, соединения аминобензимидазол хинолина (ABIQ) [133, 134], соединения гидрапталамида, соединения бензофенона, соединения изоксазола, соединения стероидного спирта, соединения хиназилинона, соединения пиррола [135], соединения антрахинона, соединения хиноксалина, соединения триазина, соединения пиразалопиримидина и соединения бензазола [136]. Полимер полиоксидония [137, 138] или другое N-окисленное производное полиэтилен-пиперазина. Соединения, раскрытые в ссылке 139. Производное аминоалкил глюкозаминидфосфата, такое как RC-529 [140, 141]. Фосфазен, такой как поли[ди(карбоксилатфенокси)фосфазен] (РСРР), как описано, например, в ссылках 142 и 143. Низкомолекулярные иммуностимуляторы (SMIPs), такие какN4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1H-имидазо[4,5-с]хинолин-2,4-диамин. Цитокин-индуцирующие агенты для использования в данном изобретении могут быть модуляторами и/или агонистами Toll-подобных рецепторов (TLR). Например, они могут быть агонистами одного или более TLR1, TLR2, TLR3, TLR4, TLR7, TLR8 и/или TLR9 белков человека. Предпочтительными агентами являются агонисты TLR7 (например, имидазохинолины) и/или TLR9 (например, CpG олигонуклеотиды). Эти агенты используются для активации путей генетически предетерминированного иммунитета. Цитокин-индуцирующий агент может быть добавлен к композиции на различных стадиях во время ее производства. Например, он может быть в составе антигенной композиции, и эта смесь может быть добавлена к эмульсии масло-в-воде. Или он может быть в составе эмульсии типа масло-в-воде, и в этом случае агент может быть добавлен к эмульсионным компонентам перед приготовлением эмульсии, или он может быть добавлен к эмульсии после ее приготовления. Подобно агент может сливаться в эмульсионных каплях. Место и распределение цитокин-индуцирующего агента в составе окончательной композиции будет зависеть от его гидрофильных/липофильных свойств, например агент может находиться в водной фазе, в масляной фазе и/или на границе раздела фаз масло-вода. Цитокин-индуцирующий агент может быть связан с отдельным агентом, таким как антиген (напримр, GRM197). Общий обзор способов конъюгации для маленьких молекул представлен в ссылке 144. Альтернативно, адъюванты могут быть нековалентно связаны с дополнительными агентами с помощью гидрофобных или ионных взаимодействий. Предпочтительными цитокин-индуцирующими агентами являются (а) иммуностимулирующие олигонуклеотиды и (b) 3dMPL. Иммуностимулирующие олигонуклеотиды. Иммуностимулирующие олигонуклеотиды могут включать модификации/аналоги нуклеотидов, такие как фосфоротиоатные модификации и могут быть двухцепочечные или (исключая РНК) одноцепочечные. Ссылки 145, 146 и 147 раскрывают возможные аналогичные замены, например замена аденозинна на 2'-деокси-7-деазагуанозин. Адъювантный эффект олигонуклеотидов CpG, кроме того, обсуждался в ссылках 148-153. Последовательность CpG может быть направлена на TLR9, такой как мотив GTCGTT или TTCGTT [154]. Последовательность CpG может быть специфической для индуцирования Th1 иммунного ответа, такого как CpG-A ODN (олигодеоксинуклеотид), или она может быть специфической для индуцирования В клеточного ответа, такого как CpG-B ODN. CpG-A и CpG-B ODNs обсуждаются в ссылках 155-157. Предпочтительно CpG является CpG-A ODN. Предпочтительно олигонуклеотид CpG построен так, что конец 5' является доступным для рецепторного распознавания. Выборочно две олигонуклеотидные последовательности CpG могут быть присоединены к их 3' концам для образования "иммуномеров". См., например, ссылки 154 и 158-160. Используемый адъювант CpG является CpG7909, так же известным, как ProMune (Coley Pharmaceutical Group, Inc.). В качестве альтернативы или в дополнение к использованию последовательностей CpG могут быть использованы последовательности TpG [161]. Эти олигонуклеотиды могут быть свободны от неметилированных мотивов CpG. Иммуностимулирующий олигонуклеотид может быть обогащен пиримидином. Например, он может включать более одного последовательного нуклеотида тимидина (например, ТТТТ, как показано в ссылке 161) и/или может иметь нуклеотидную композицию с 25% тимидина (например, 35, 40, 50, 60,80% и т.д.). Например, он может включать более одного последовательного нуклеотида цитозина (например, СССС, как показано в ссылке 161), и/или может иметь нуклеотидную композицию с 25% цитозина (например, 35, 40, 50, 60, 80% и т.д.). Эти олигонуклеотиды могут быть свободны от неметилированных мотивов CpG. Иммуностимулирующие олигонуклеотиды типично будут включать по крайней мере 20 нуклеотидов. Они могут включать менее 100 нуклеотидов. Комбинация липосом и иммуностимулирующих олигонуклеотидов может использоваться особенно в том случае, когда олигонуклеотиды капсулированы в липосомы. Эта комбинация может вызывать сильные иммунные ответы Th1 [162]. 3dMPL. 3dMPL (также известный как 3-де-О-ацилированный монофосфорил липид А или 3-O-дезацил-4'монофосфорил липид А) является адъювантом, у которого позиция 3 восстанавливающего концевого глюкозамина в моносульфорил липиде А была деацилирована. 3dMPL получен из свободного от гептозы мутанта Salmonella minessota и химически подобен липиду А, но лишен кислотно-лабильной фосфорильной группы и основно-лабильной ацильной группы. Он активирует моноцитарные/макрофагальные клеточные линии и стимулирует высвобождение некоторых цитокинов, включая IL-1, IL-12, TNF- и GM- 13014028CSF (см. ссылку 163). Приготовление 3dMPL первоначально было описано в ссылке 164. 3dMPL может иметь форму смеси связанных молекул, различающихся путем их ацилирования (например, 3, 4, 5 или 6 ацильных цепочек, которые могут различаться по своей длине). Два глюкозамина(также известных как 2-дезокси-2-аминоглюкоза) моносахаридов являются N-ацилированными по углеродам в позиции 2 (например, в позициях 2 и 2'), и имеется также О-ацилирование в позиции 3'. Группа,присоединенная к углероду 2, имеет формулу -NH-CO-CH2-CR1R1'. Группа, присоединенная к углероду 2', имеет формулу -NH-CO-CH2-CR2R2'. Группа, присоединенная к углероду 3', имеет формулу -O-COCH2-CR3R3'. Его структура представляет собой Группы R1, R2 и R3, каждая независимо, является -(СН 2)n-СН 3. Значение n предпочтительно находится между 8 и 16, более предпочтительно между 9 и 12 и наиболее предпочтительно составляет 10. Группы R1, R2 и R3 могут, каждая независимо, быть (а) -Н; (b) -ОН или (с) -О-СО-R4, где R4 является либо -Н, либо -(CH2)m-СН 3, в котором значение m предпочтительно находится между 8 и 16 и более предпочтительно является 10, 12 или 14. В позиции 2 m предпочтительно составляет 14. В позиции 2' m предпочтительно составляет 10. В позиции 3' m предпочтительно 12. Группы R1, R2 и R3 также предпочтительно являются -О-ацил-группами додекановой кислоты, тетрадекановой кислоты или гексадекановой кислоты. Когда все R1', R2' и R3' являются -Н, тогда 3dMPL имеет только 3 ацильные цепочки (одну на каждую из позиций 2, 2' и 3'). Когда только два из R1' , R2' и R3' являются -Н, тогда 3dMPL может иметь 4 ацильные цепочки. Когда только один из R1, R2 и R3 является -Н, тогда 3dMPL может иметь 5 ацильных цепочек. Когда ни один из R1, R2 и R3 не является -Н, тогда 3dMPL может иметь 6 ацильных цепочек. 3dMPL адъювант, используемый согласно изобретению, может быть смесью этих форм, с числом ацильных цепочек от 3 до 6, но предпочтительно включать в смесь 3dMPL с 6 ацильными цепочками, и, в частности, для того, чтобы гарантировать, что форма с гексаацильными цепочками составляет по крайней мере 10 вес.% от общего количества 3dMPL, например 20, 30, 40, 50 или более. Как было найдено,3dMPL с 6 ацильными цепочками является наиболее активной формой адъюванта. Таким образом, наиболее предпочтительной формой 3dMPL для включения в композиции изобретения является- 14014028 В случае если 3dMPL используется в виде смеси, тогда рекомендации по количеству или концентрациям 3dMPL в композициях изобретения относятся к объединенным препаратам 3dMPL в смеси. В водных растворах 3dMPL может образовывать мицеллярные агрегаты или частицы различных размеров, например диаметром 150 или 500 нм. Любая или обе эти формы могут быть использованы в изобретении, лучшие частицы могут быть выбраны путем обычного анализа. Более мелкие частицы (например, достаточно мелкие, для того чтобы получить прозрачную водную суспензию 3dMPL) являются предпочтительными для использования согласно изобретению, благодаря их самой высокой активности[165]. Предпочтительно частицы имеют средний диаметр менее 220 нм, более предпочтительно менее 200 нм, или менее 150 нм, или менее 120 нм, и могут даже иметь средний диаметр менее 100 нм. В большинстве случаев, однако, средний диаметр будет не ниже чем 50 нм. Эти частицы достаточно малы, чтобы применить стерилизацию путем фильтрации. Диаметр частиц может быть определен обычным методом динамического рассеяния света, который показывает средний диаметр частиц. Когда говорят, что частица имеет диаметрнм, то, как правило, распределение частиц будет около этого среднего значения, но по крайней мере 50% по количеству (например, 60, 70, 80, 90% или более) частиц будут иметь диаметр в пределах 25%. 3dMPL может с успехом использоваться в комбинации с эмульсией типа масло-вводе. По существу,любой из 3dMPL может размещаться в водной фазе эмульсии. Обычное количество 3dMPL в вакцине составляет 1-100 г/дозу, например примерно 25 г или примерно 50 г. 3dMPL может использоваться самостоятельно или в комбинации с одним или более другими соединениями. Например, известно использование 3dMPL в комбинации с сапонином QS21 [166] (включенным в эмульсию типа масло-в-воде [167]), с иммуностимулирующим олигонуклеотидом как с QS21, так и с иммуностимулирующим олигонуклеотидом с фосфатом алюминия [168], с гидроокисью алюминия[169], или как с фосфатом алюминия, так и с гидроокисью алюминия. Фармацевтические композиции. Композиции изобретения являются фармацевтически приемлемыми. Они могут включать компоненты в дополнение к сплит антигену и эмульсии, например, они обычно включают один или более фармацевтических носителей и/или формообразующих. Детальное обсуждение таких компонентов приводится в ссылке 170. Композиции обычно бывают в водной форме. Обычно добавляются сплит антиген и эмульсия. Композиция может включать консерванты, такие как тиомерсал или 2-феноксиэтанол. Предпочтительно, однако, чтобы вакцина была существенно свободной (то есть менее 5 г/мл) от соединений ртути, то есть свободной от тиомерсала [14, 171]. Вакцины, не содержащие ртути, более предпочтительны, и это может быть просто достигнуто, если при использовании адъюванта, содержащего токоферол, следовать ссылке 14. Вакцины, свободные от консервантов, особенно предпочтительны. При контроле тонуса предпочтительно следует включить физиологическую соль, такую как соль натрия. Хлорид натрия (Nad) является предпочтительным, он может присутствовать в количестве от 1 до 20 мг/мл. Другие соли, которые могут присутствовать, включают хлорид калия, дигидрофосфат калия,дегидрат фосфата динатрия, хлорид магния, хлорид кальция и др. Композиция обычно будет иметь осмоляльность между 200 и 400 мОсм/кг, предпочтительно в пределах 240-360 мОсм/кг и более предпочтительно в пределах 290-310 мОсм/кг. Осмоляльность, как было указано ранее, не оказывает влияния на боль при введении вакцины [172], однако, поддержание осмоляльности в этих пределах является предпочтительным. Композиции могут включать один или более буферов. Типичными буферами являются фосфатный буфер; буфер Tris; боратный буфер; сукцинатный буфер; гистидиновый буфер или цитратный буфер. Буферы обычно включаются в количестве 5-20 мМ. Можно с успехом использовать эмульсию, образованную в фосфатно-соляном буфере. рН Композиции обычно находится между 5,0 и 8,1 и более типично между 6,0 и 8,0, то есть 6,5 и 7,5 или между 7,0 и 7,8. Способ согласно изобретению может таким образом включать этап установления рН объема вакцины перед упаковкой. Композиция предпочтительно является стерильной. Композиция предпочтительно является непирогенной, то есть содержащей 1 ЭЕ (эндотоксиновая единица, стандартная величина) на дозу и предпочтительно 0,1 ЭЕ на дозу. Композиция предпочтительно является свободной от глютена. Композиция может включать материал для одной вакцинации или для многоразовых вакцинаций(то есть упаковку для многократных доз). Включение консерванта является предпочтительным в случае многократных доз. В качестве альтернативы (или в дополнение) включению консерванта в состав многократных доз композиции могут содержаться в емкости, имеющей асептическое приспособление для выемки материала. Вакцины гриппа обычно вводятся в дозируемом объеме около 0,5 мл, хотя половина дозы (то есть около 0,25 мл) может вводиться, например, детям. Композиции и наборы предпочтительно хранятся при температуре от 2 до 8 С. Их не следует замо- 15014028 раживать. В идеальном варианте их следует беречь от прямого света. Наборы изобретения. Композиции могут быть приготовлены непосредственно перед введением. Таким образом, изобретение представляет собой наборы, включающие различные компоненты, готовые для смешения. Набор позволяет хранить адъювант и антиген раздельно до времени использования, что может быть применимо для случая, когда используется адъювант в форме эмульсии типа масло-в-воде. Компоненты физически отделены друг от друга в наборе, и это разделение может быть достигнуто различными способами. Например, два компонента могут быть в двух разных емкостях, таких как ампула. Содержание двух ампул может быть смешано, например, удалением содержимого из одной ампулы и добавлением его в другую ампулу или отдельным удалением содержимого из обеих ампул и смешением его в третьей емкости. В предпочтительном исполнении один из компонентов набора это - шприц, а другой - емкость, такая как ампула. Шприц может быть использован (например, с иглой) для введения его содержимого во вторую емкость для смешивания, и смесь затем может быть извлечена обратно в шприц. Смешанное содержимое шприца затем может быть введено пациенту, обычно через новую стерильную иглу. Помещение одного компонента в шприц исключает необходимость использования отдельного шприца для введения пациенту. В другом предпочтительном исполнении два компонента набора находятся вместе в одном и том же шприце, но разделены, например, в двухкамерном шприце, таком как описано в ссылках 173-180 и др. Когда шприц используется (например, при введении пациенту), тогда содержимое двух камер смешивается. Такое исполнение позволяет исключить этап отдельного смешения во время использования. Компоненты набора будут в основном в водной форме. В некоторых исполнениях компонент(обычно скорее антиген, чем адъювант) находится в сухом виде (например, в лиофилизированной форме), при этом другой компонент находится в водной форме. Эти два компонента могут быть смешаны для того, чтобы реактивировать сухой компонент и получить водную композицию для введения пациенту. Лиофилизированный компонент будет в основном размещен скорее в ампуле, чем в шприце. Высушенные компоненты могут включать стабилизаторы, такие как лактоза, сахароза или маннитол, а также их смеси, например смеси лактоза/сахароза, смеси сахароза/маннитол и др. Один возможный вариант использует водный адъювант в предварительно заполненном шприце и лиофилизированный антиген в ампуле. Упаковка композиций или набор компонентов. Подходящие емкости для композиций изобретения (или компоненты набора) включают ампулы,шприцы (например, одноразовые шприцы), распылители для носа и др. Эти емкости должны быть стерильны. Если композиция/компонент помещается в ампулу, то ампула может быть изготовлена из стекла или пластического материала. Она может быть стерилизована до того, как туда помещается композиция/компонент. Чтобы избежать проблем с пациентами, чувствительными к латексу, ампулы могут быть запечатаны не содержащими латекс пробками, и отсутствие латекса в каждом упаковочном материале является предпочтительным. Ампула может содержать одноразовую дозу вакцины или более чем одну дозу (многодозовая ампула), например 10 доз. Предпочтительные ампулы изготовлены из бесцветного стекла. Ампула может иметь наконечник (например, наконечник Люэра), устроенный так, что предварительно наполненный шприц может быть введен в наконечник, содержимое шприца вытеснено в ампулу(например, чтобы разбавить в ней лиофилизированный материал) и содержимое ампулы может быть удалено обратно в шприц. После удаления шприца из ампулы затем может быть присоединена игла, и композиция может быть введена пациенту. Наконечник предпочтительно размещается внутри герметика или крышки, так что герметик или крышка должны быть удалены перед тем, как наконечник сможет быть доступным. Ампула может иметь наконечник, который позволяет асептическое удаление содержимого,особенно ампулы с лекарственными средствами для многократного приема. Когда композиция/компонент помещается в шприц, шприц обыкновенно не будет иметь иглу присоединенной, хотя может быть приложена отдельная игла со шприцем для комплекта и использования. Предпочтительными являются безопасные иглы. Размеры игл 1-дюйм 23-калибр, 1-дюйм 25-калибр и 5/8-дюйма 25-калибр являются типичными. Шприцы могут быть снабжены несмываемой меткой, на которой напечатаны номер партии, сезон гриппа и истечение срока годности содержимого, чтобы знать сроки хранения. Поршень в шприце предпочтительно имеет фиксатор, чтобы предотвратить его случайное удаление во время аспирации. Шприцы могут иметь колпачок и/или поршень из латексного каучука. Одноразовые шприцы содержат одну дозу вакцины. У этого шприца обычно имеется колпачок с кончиком, чтобы запечатать этот кончик до присоединения иглы, и этот колпачок с кончиком предпочтительно изготовлен из бутилкаучука. Если шприц и игла упакованы раздельно, тогда игла предпочтительно снабжена защитой из бутилкаучука. Предпочтительно используются шприцы, поставляемые под торговой маркой Tip-Lok. Емкости могут быть маркированы с указанием объема половины дозы, чтобы облегчить инъекцию детям. Например, шприцы, содержащие дозу 0,5 мл, могут иметь отметку, показывающую объем 0,25 мл.- 16014028 В случае стеклянной емкости (шприца или ампулы) предпочтительно использовать емкость, изготовленную из боросиликатного стекла, а не известково-натриевого стекла. Набор или композиция могут иметь (например, в той же самой коробке) листок-вкладыш с информацией о вакцине, например с инструкциями по введению, данными об антигенах в вакцине и т.д. Инструкции могут также содержать предупреждения, например держать раствор адреналина готовым к использованию в случае анафилактической реакции, вследствие вакцинации. Предпочтительное осуществление изобретения Предпочтительная композиция включает (i) эмульсию типа масло-в-воде, включающую сквален и полисорбат 80, и (ii) сплит антиген вируса гриппа. Предпочтительный набор включает (i) первый компонент набора, включающий сплит антиген вируса гриппа, и (ii) второй компонент набора, включающий эмульсию типа масло-в-воде, которая включает сквален и полисорбат 80. Предпочтительный способ состоит из этапов соединения: (i) сплит антигена вируса гриппа и (ii) эмульсии типа масло-в-воде, при этом эмульсия включает сквален и полисорбат 80. Перед выполнением этого способа антиген и эмульсия имеют более высокие концентрации, чем те,которые необходимы для конечного продукта, так как соединение отдельных компонентов вызовет разбавление. Если, например, смешиваются, по существу, равные объемы двух компонентов, то концентрации компонентов перед смешением будут в два раза выше желаемых конечных концентраций. Сплит антиген вируса гриппа и эмульсия, таким образом, будут приготовляться раздельно и затем соединяться. Хотя получение двух компонентов может выполняться в разное время разными людьми в разных местах, изобретение представляет собой способ, включающий этапы: (i) изготовление сплит антигена вируса гриппа; (ii) изготовление эмульсии типа масло-в-воде, при котором эмульсия включает сквален и полисорбат 80; и (iii) соединение сплит антигена вируса гриппа и эмульсии типа масло-в-воде. Эмульсия может быть изготовлена объединением масла(масел) и ПАВ(ов) в водной среде с последующей микрофлюидизацией комбинации для образования эмульсии, например, чтобы образовались субмикронные капли. Когда антиген и эмульсия объединяются в промышленном масштабе, тогда способ может включать дополнительный этап получения единичной дозы смеси. Сплит антиген вируса гриппа может быть одновалентным или многовалентным (таким как трехвалентным, например из двух вирусов гриппа А и одного вируса гриппа В). В дополнение к сквалену и полисорбату-80 эмульсия может включать один или более из следующих продуктов: (a) Span 85; (b) токоферол; (с) полиоксиэтанол, такой как Triton Х-100 (октилфеноксиполиэтоксиэтанол); (d) цитратный буфер и/или (е) фосфатный буфер. Методы лечения и введения вакцины Композиции изобретения подходят для введения людям, и изобретение представляет собой способ повышения иммунного ответа у пациента, включающий этап введения композиции изобретения пациенту. Изобретение также представляет собой набор или композицию изобретения для использования в качестве лекарственного средства. Изобретение также представляет собой использование (i) сплит антигена вируса гриппа и (ii) эмульсии типа масло-в-воде, которая включает свободное ПАВ в ее водной фазе, в производстве лекарственного средства для повышения иммунного ответа у пациента. Иммунный ответ, повышенный этими методами и их использованием, будет обычно включать гуморальный иммунный ответ, предпочтительно защитный иммунный ответ. Способы оценки иммунных ответов, нейтрализующая способность и защита после вакцинации вируса гриппа хорошо известны в данной области знаний. Изучения человека показали, что титры антивирусных антител против гемагглютинина человеческого вируса гриппа соотносятся с защитой (титр образца сыворотки, ингибирующей гемагглютинин, около 30-40 дает около 50% защиты от инфекции гомологичным вирусом) [181]. Иммунные ответы обычно измеряются ингибированием гемагглютинина, микронейтрализацией, одномерной радиальной иммунодиффузией (SRID) и/или простым радиальным гемолизом (SRH). Эти способы анализа хорошо известны в данной области техники. Композиции изобретения могут быть введены различными способами. Наиболее предпочтительным способом иммунизации является внутримышечная инъекция (например, в руку или ногу), но другие подходящие способы введения включают подкожную инъекцию, интраназально [182-184], орально [185],внутрикожно [186, 187], через кожу [188] и др. Вакцины, приготовленные согласно изобретению, могут быть использованы как для детей, так и для взрослых. Вакцины гриппа в настоящее время рекомендованы для использования при иммунизации взрослого населения и детей в возрасте от 6 месяцев. Так, пациенту может быть менее 1 года, 1-5 лет, 515 лет, 15-55 лет или по крайней мере 55 лет. Предпочтительными пациентами для вакцинации являются пожилые люди (например, 50, 60 лет, предпочтительно 65 лет), дети (например 5 лет), госпитализированные пациенты, медицинские работники, военнослужащие и военный персонал, беременные женщины, хронически больные, пациенты с иммунодефицитом, пациенты, которые приняли антивирусный препарат (например, оселтамивир или занамивир, см. ниже) за 7 дней перед получением вакцины, люди,- 17014028 страдающие аллергией на яйца и люди, уезжающие за границу. Вакцины подходят не только для этих групп, однако, и могут быть использованы более широко среди населения. В отношении пандемических штаммов, введение всем возрастным группам предпочтительно. Предпочтительные композиции изобретения удовлетворяют 1, 2 или 3 критериям Комитета по патентованным лекарственным препаратам (СРМР) по эффективности. Для взрослых (18-60 лет) эти критерии составляют: (1) 70% серозащиты; (2) 40% сероконверсии и/или (3) увеличение -токоферолметилтрансферазы (ГМТ) в 2,5 раза. В пожилом возрасте (60 лет) эти критерии составляют: (1) 60% серозащиты; (2) 30% сероконверсии и/или (3) увеличение ГМТ в 2 раза. Эти критерии основаны на открытых исследованиях по крайней мере 50 пациентов. Лечение может быть проведено в режиме введения одной дозы или многократных доз. Многократные дозы могут быть использованы при первичной иммунизации и/или при ускоренном режиме иммунизации. В случае режима многократных доз, различные дозы могут быть даны тем же самым или другим образом, например сначала парентерально, повторно через слизистую; сначала через слизистую, повторно - парентерально и др. Введение более чем одной дозы (в основном две дозы) особенно полезно для иммунологически неподготовленных пациентов, например для людей, которым никогда ранее не вводили противогриппозную вакцину, или при вакцинации против новых подтипов НА (как при вспышке пандемии). Многоразовые дозы в основном будут вводится с интервалом по крайней мере в 1 неделю (например, около 2, около 3, около 4, около 6, около 8, около 10, около 12, около 16 недель и т.д.). Вакцины, произведенные с помощью изобретения, могут быть введены пациентам в основном в то же самое время (например, во время той же самой медицинской консультации, или визита к врачу, или в центр вакцинации), как и другие вакцины, например, в основном в то же самое время, как и вакцины против кори, эпидемического паротита, краснухи, тривакцины против кори, эпидемического паротита и коревой краснухи (КСК), вакцины против ветряной оспы, КСКВ, вакцины против дифтерита, вакцины против столбняка, вакцины против коклюша, вакцины против КДС (коклюш, дифтерит, столбняк),конъюгированной вакцины против H. Influenzae типа b, инактивироанной поливирусной вакцины, вирусной вакцины против гепатита В, менингококковой конъюгированной вакцины (такой как четырех валентная вакцина A-C-Wl 35-Y), вакцины против респираторно-синцитиального вируса, пневмококковой конъюгированной вакцины и др. Введение в одно и то же время пневмококковой вакцины или менингококковой вакцины особенно полезно для пациентов преклонного возраста. Подобно вакцины изобретения могут быть введены пациентам в основном в то же самое время (например, во время той же самой медицинской консультации или визита к врачу), что и антивирусное соединение, и, в частности, антивирусное соединение, активное против вируса гриппа (например, оселтамивир и/или занамивир). Эти антивирусы включают ингибиторы нейраминидазы, такие как (3R,4R,5S)-4 ацетиламино-5-амино-3-(1-этилпропокси)-1-циклогексен-1-карбоновую кислоту или 5-(ацетиламино)-4[(аминоиминометил)амино]-2,6-ангидро-3,4,5-тридеокси-D-глицеро-D-галактонон-2-энониевую кислоту,включая их сложные эфиры (например, этиловые эфиры) и их соли (например, фосфатные соли). Предпочтительным антивирусным агентом является (3R,4R,5S)-4-ацетиламино-5-амино-3-(1-этилпропокси)-1 циклогексен-1-карбоновая кислота, этиловый сложный эфир, фосфат (1:1), известный также как оселтамивир фосфат (TAMIFLU). Общие сведения Понятие "включающий" охватывает "содержащий", также как и "состоящий", например композиция, "включающая" X, может состоять только из X или может содержать что-нибудь дополнительное,например X+Y. Выражение "по существу" не исключает "полностью", например композиция, которая "по существу свободна" от Y, может быть полностью свободна от Y. Там, где необходимо, выражение "по существу" может быть пропущено в описании изобретения. Понятие "около" в связи с числовым значением х означает, например, х 10%. Если не указано специально, способ, включающий этап смешения двух или более компонентов, не требует какого-либо специфического порядка смешения. Так компоненты могут быть смешаны в любом порядке. Когда имеются три компонента, тогда два компонента могут быть смешаны друг с другом, и затем эта смесь может быть соединена с третьим компонентом и т.д. Там, где используются животные (и в особенности крупного рогатого скота) материалы в культуре клеток, их следует получать из источников, которые свободны от передающихся губчатых энцефалопатий (TSEs) и, в частности, свободны от губчатой энцефалопатии крупного рогатого скота (BSE). В целом,предпочтительным является культивирование клеток при полном отсутствии материалов животного происхождения. Когда соединение вводится в организм как часть композиции, тогда такое соединение может в качестве альтернативы быть заменено на подходящее пролекарство. Когда клеточный субстрат используется для рекомбинации или методов обратной генетики, предпочтительным является, чтобы это было одобрено для использования в производстве человеческой вакцины, например, как в Ph Eur general chapter 5.2.3.- 18014028 Варианты осуществления изобретения Определение свободного ПАВ в эмульсии сквален-в-воде. Адъювант в виде микрофлюидизированной эмульсии сквален-в-воде, включающий ПАВ Tween 80,был приготовлен, как показано в главе 10 ссылки 67. В эмульсии было определено содержание Tween 80 в ее водной фазе. Масляная фаза адъюванта была удалена, и сложные эфиры в водной фазе были омылены и флюоресцентно модифицированы. После хроматографического разделения общее количествоTween 80 в водной фазе определяли с использованием флуоресцентного детектирования. Для определения общего количества Tween 80 в водной фазе также был использован метод обращено-фазовой ВЭЖХ. Оба способа дают подобные результаты, такие как 121% всего Tween 80 в эмульсии было найдено в водной фазе. Сплит-вакцины с адъювантом MF59. Две промышленно доступные трехвалентные сплит вирионные вакцины гриппа без адъюванта(SPLIT (А) и SPLIT (В были получены и использованы для вакцинации мышей. Вакцины были разбавлены, чтобы получить дозу 0.2 г каждого НА. Для разбавления использовали либо один буфер, либо буфер и эмульсию сквален-в-воде. Группы из 8 самок мышей Balb/C в возрасте 8 недель были иммунизированы внутримышечно вакцинами по 50 л без адъюванта и с адъювантом на 0 и 28 день. Сыворотки были получены на 14 и 42 день и проанализированы на титр анти-НА (IgG), титр HI и Т клетки. Титры антител сывороточного иммуноглобулина (ELISA) были следующие для каждого вируса отдельно: Титры антител сыворотки HI на 42 день были следующие:- 19014028 Таким образом, эмульсия масло-в-воде может усиливать иммунные ответы, достигнутые сплит вакцинами гриппа. Путем включения свободного ПАВ в водную фазу эмульсия также может продолжать усиливать расщепляющее действие на вирус, разрушая еще не расщепленные вирионы и/или агрегаты вирионов, которые могут присутствовать. Следует понимать, что изобретение только было описано посредством примера, и могут иметь место модификации, которые остаются в масштабе и духе изобретения. Ссылки (содержание которых введено здесь в качестве ссылки) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Иммуногенная композиция, включающая сплит антиген вируса гриппа и эмульсию типа масло-вводе, в которой эмульсия включает свободное ПАВ в ее водной фазе, и где композиция представляет собой моновалентную вакцину против пандемического штамма вируса гриппа. 2. Способ по п.1, в котором антиген вируса гриппа является подтипом H1, H2, Н 3, Н 5, Н 7 или Н 9- 27014028 вируса гриппа А. 3. Композиция по п.1 или 2, где композиция выращивается в клеточной культуре и свободна от овалбумина, овомукоида и куриной ДНК. 4. Композиция по п.3, в которой вирус выращивается на клеточной культуре клеточной линии, выбранной из группы, состоящей из MDCK; Vero и PER.C6. 5. Композиция по п.3 или 4, которая содержит менее 10 нг клеточной ДНК из культуры клеток хозяина. 6. Композиция по любому одному из пп.3-5, где композиция содержит менее чем 10 нг ДНК, которая состоит из 100 нуклеотидов или более. 7. Композиция по любому предшествующему пункту, которая содержит от 0,1 до 20 г гемагглютинина на вирусный штамм. 8. Композиция по любому предшествующему пункту, в которой эмульсия включает сквален. 9. Композиция по любому предшествующему пункту, в которой эмульсия включает токоферол. 10. Композиция по п.9, в которой токоферолом является DLтокоферол. 11. Композиция по любому предшествующему пункту, в которой эмульсия содержит капли субмикронного диаметра. 12. Композиция по любому предшествующему пункту, в которой антиген вируса гриппа получают из вируса гриппа, имеющего один или более сегментов РНК из вируса гриппа A/PR/8/34. 13. Композиция по любому предшествующему пункту, в которой антиген вируса гриппа получают из вируса гриппа, полученного методом обратной генетики. 14. Композиция по любому одному из пп.3-13, в которой клеточная культура является культуроймикроносителем, адгезивной культурой или суспензионной культурой. 15. Композиция по любому одному из пп.3-14, в которой клеточная культура свободна от сыворотки. 16. Композиция по любому предшествующему пункту, в которой эмульсия включает 3-Одеацилированный монофосфорил-липид A (3dMPL). 17. Композиция по п.16, в которой по крайней мере 10 вес.% 3dMPL имеют форму гексаацильной цепи. 18. Композиция по п.16 или 17, в которой 3dMPL находится в виде частиц с диаметром 150 нм. 19. Композиция по любому предшествующему пункту, являющаяся, по существу, свободной от соединений ртути. 20. Композиция по любому предшествующему пункту, включающая от 1 до 20 мг/мл хлорида натрия. 21. Композиция по любому предшествующему пункту, имеющая осмоляльность между 200 и 400 мОсм/кг. 22. Композиция по любому предшествующему пункту, включающая один или более буферов. 23. Композиция по п.22, в которой буфер(ы) включают фосфатный буфер; буфер Tris; боратный буфер; сукцинатный буфер; гистидиновый буфер или цитратный буфер. 24. Композиция по любому предшествующему пункту, имеющая рН между 5,0 и 8,1. 25. Композиция по любому предшествующему пункту, содержащая 1 единицы эндотоксина на дозу. 26. Композиция по любому предшествующему пункту, являющаяся свободной от глютена. 27. Композиция по любому предшествующему пункту, включающая два штамма гриппа А и один штамм гриппа В. 28. Набор, включающий: (i) первый компонент набора, включающий сплит антиген вируса гриппа; и (ii) второй компонент набора, включающий адъювант в виде эмульсии типа масло-в-воде, которая включает свободное ПАВ в ее водной фазе. 29. Набор по п.28, в котором первый и второй компоненты находятся в отдельных емкостях. 30. Набор по п.29, в котором первый и второй компоненты находятся в ампулах. 31. Набор по п.29, в котором один из первого и второго компонентов находится в шприце и в котором другой компонент находится в ампуле. 32. Набор по п.30 или 31, в котором ампула изготовлена из стекла или пластика. 33. Набор по пп.30, 31 или 32, в котором ампула запечатана пробкой, не содержащей латекс.
МПК / Метки
МПК: A61K 39/145, A61K 39/39
Метки: против, фазе, содержащие, свободное, поверхностно-активное, сплит, водной, эмульсии, вакцин, адъюванта, вещество, качестве, гриппа
Код ссылки
<a href="https://eas.patents.su/29-14028-emulsii-soderzhashhie-svobodnoe-poverhnostno-aktivnoe-veshhestvo-v-vodnojj-faze-v-kachestve-adyuvanta-split-vakcin-protiv-grippa.html" rel="bookmark" title="База патентов Евразийского Союза">Эмульсии, содержащие свободное поверхностно-активное вещество в водной фазе в качестве адъюванта сплит вакцин против гриппа</a>
Предыдущий патент: Способ получения четвертичных аммониевых солей с кислотой
Следующий патент: Комбинация фунгицидно-активных соединений
Случайный патент: Винилароматические пенополимеры с улучшенными свойствами