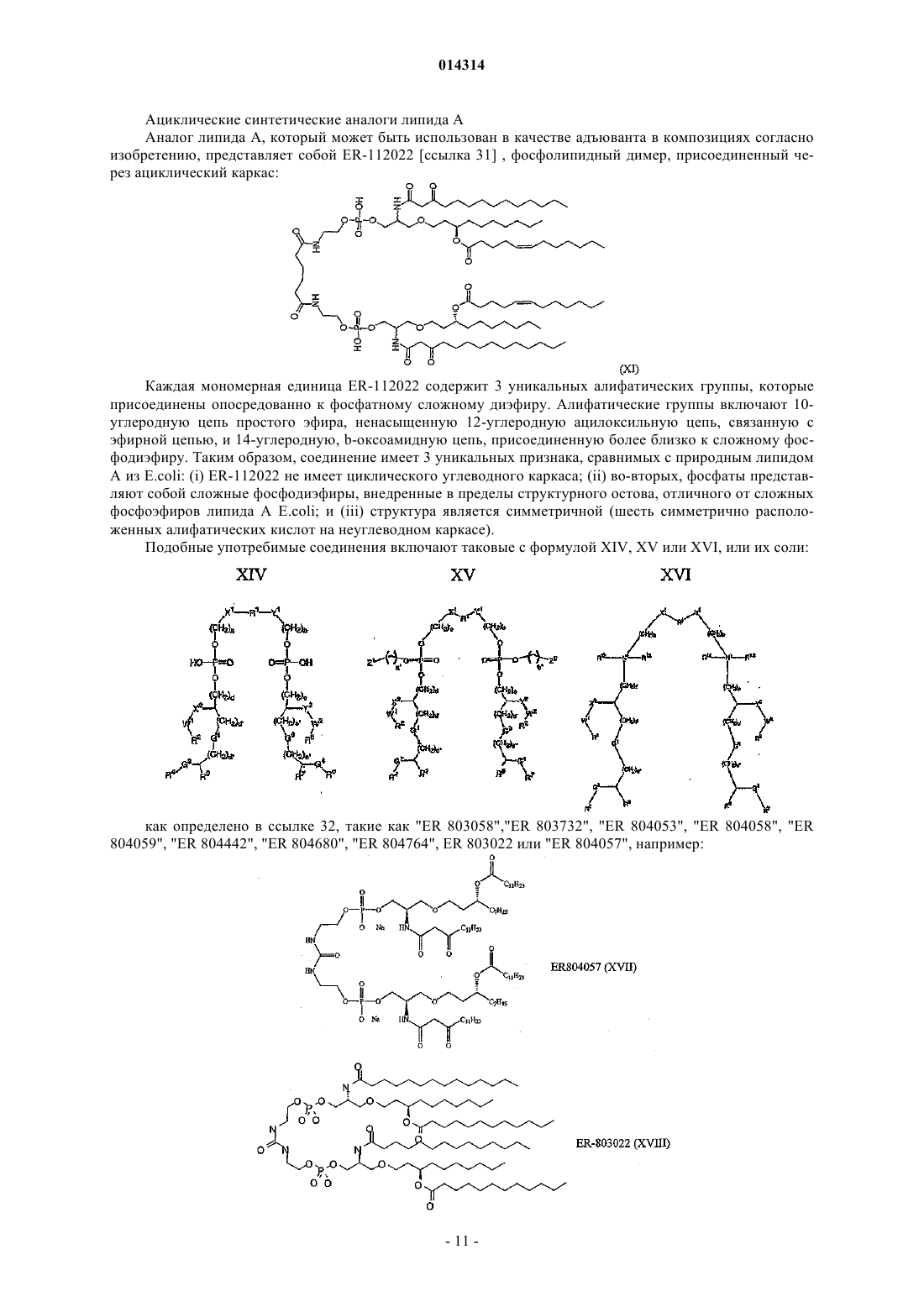
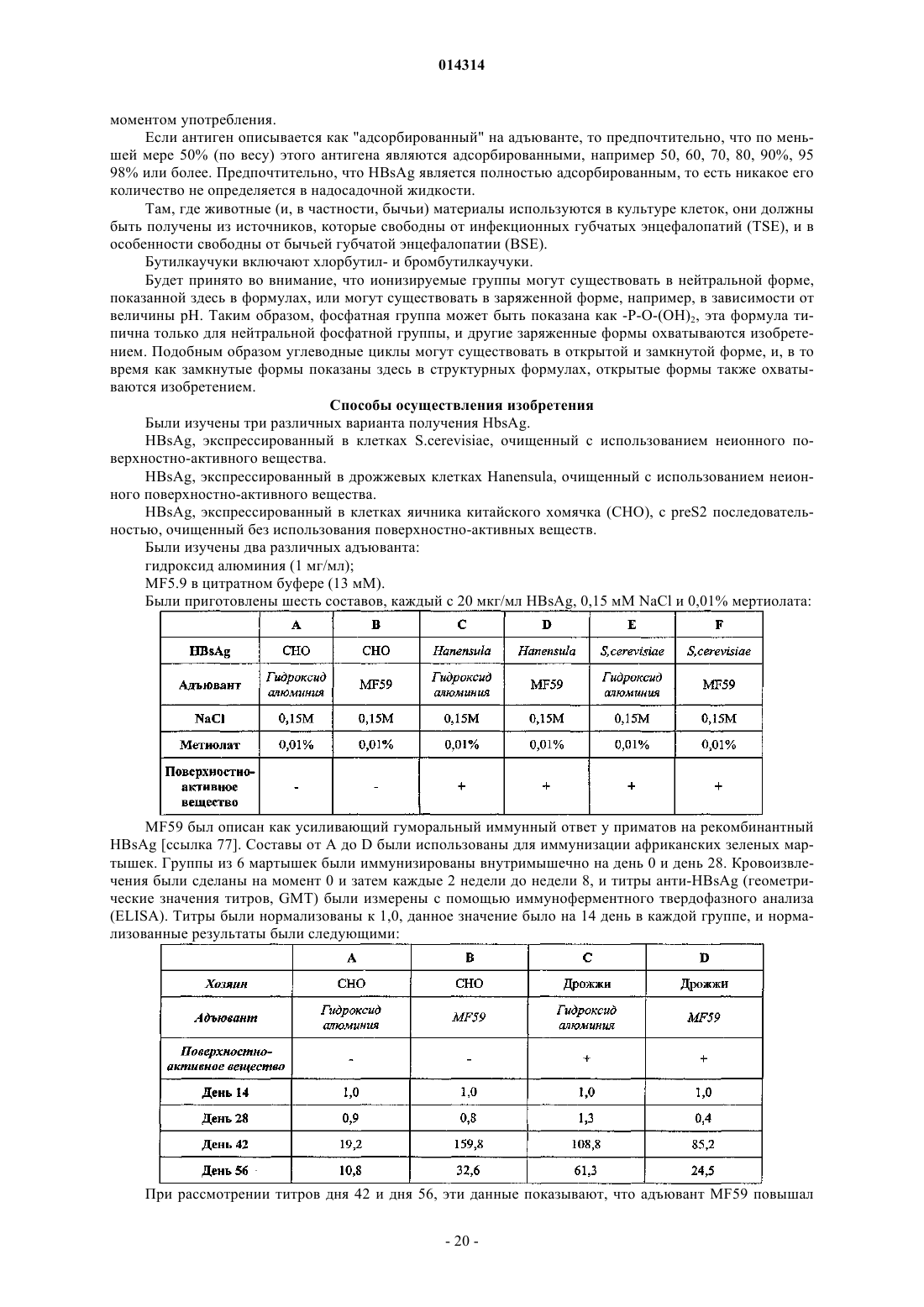
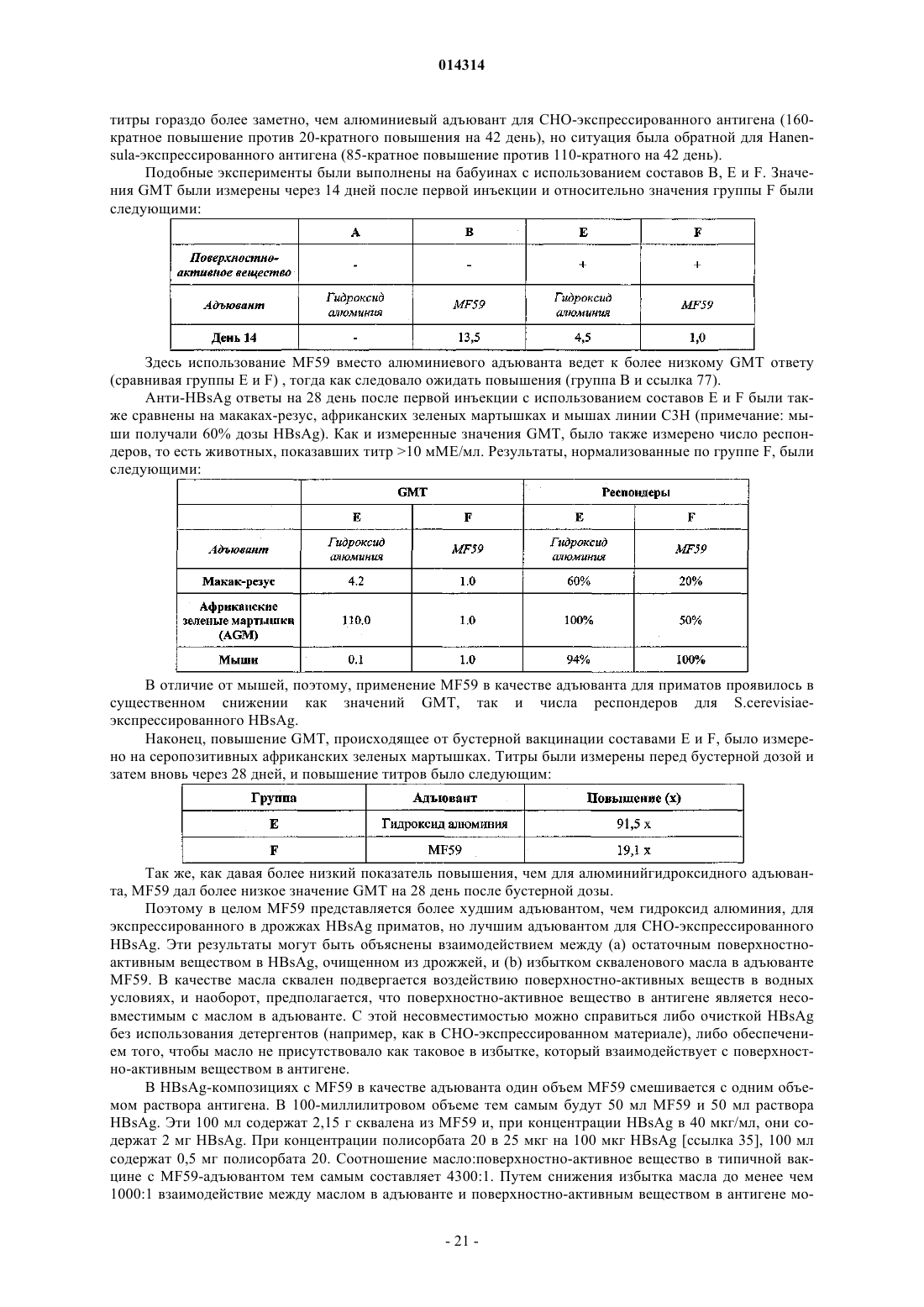
Пониженная интерференция между маслосодержащими адъювантами и антигенами, содержащими поверхностно-активные вещества
Формула / Реферат
1. Способ получения иммуногенной композиции, включающий стадии комбинирования (i) антигенного компонента, который включает поверхностно-активное вещество, и (ii) алифатического адъювантного компонента, причем весовое отношение алифатического адъюванта к поверхностно-активному веществу в композиции составляет менее чем 1000:1.
2. Иммуногенная композиция, содержащая антигенный компонент, включающий поверхностно-активное вещество и алифатический адъювантный компонент, причем весовое отношение алифатического адъюванта к поверхностно-активному веществу в композиции составляет менее чем 1000:1.
3. Способ или композиция по п.1 или 2, в которых алифатический адъювант включает масло, преобразуемое в ходе обмена веществ.
4. Способ или композиция по п.3, в которых алифатический адъювант включает субмикронную эмульсию типа "масло в воде" сквалена и полисорбата 80.
5. Способ или композиция по п.1 или 2, в которых алифатический адъювант включает молекулу, включающую фрагмент алифатической кислоты.
6. Способ или композиция по п.5, в которых алифатический адъювант представляет собой 3-дезоксиацилированный монофосфориллипид A (3D-MPL).
7. Способ или композиция по п.6, в которых 3D-MPL представляет собой смесь молекул, различающихся по их ацилированию.
8. Способ или композиция по п.6 или 7, в которых алифатический адъювант включает
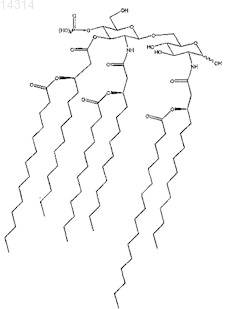
9. Способ или композиция по любому из пп.6-8, в которых 3D-MPL находится в форме частиц.
10. Способ или композиция по п.9, в которых частицы могут быть стерилизованы фильтрованием.
11. Способ или композиция по любому из пп.6-10, в которых 3D-MPL находится в комбинации с солью алюминия.
12. Способ или композиция по п.11, в которых соль алюминия представляет собой фосфат алюминия.
13. Способ или композиция по п.12, в которых 3D-MPL адсорбирован на соли алюминия.
14. Способ или композиция по любому из предшествующих пунктов, в которых поверхностно-активное вещество представляет собой полиоксиэтиленсорбитановый сложный эфир.
15. Способ или композиция по п.14, в которых сложный эфир представляет собой полисорбат 20.
16. Способ или композиция по п.14 или 15, в которых концентрация поверхностно-активного вещества не более чем 50 мкг/мл.
17. Способ или композиция по любому из предшествующих пунктов, в которых антиген представляет собой вирусный поверхностный антиген.
18. Способ или композиция по п.17, в которых антиген представляет собой корпускулярный поверхностный антиген гепатита В (HBsAg), очищенный в присутствии поверхностно-активного вещества.
19. Способ или композиция по п.18, в которых HBsAg экспрессирован в дрожжевой клетке.
20. Способ или композиция по п.19, в которых дрожжи представляют собой Saccharomyces cerevisiae.
21. Способ или композиция по любому из пп.18-20, в которых HBsAg является негликозилированным и/или включает фосфатидилинозит.
22. Способ или композиция по любому из пп.18-21, в которых HBsAg происходит из субтипа adw2 вируса гепатита В.
23. Способ или композиция по любому из предшествующих пунктов, в которых антиген представляет собой гибридный белок, включающий вирусный поверхностный антиген и гетерологичный антиген.
24. Способ или композиция по п.23, в которых вирусный поверхностный антиген представляет собой HBsAg, и гетерологичный антиген представляет собой малярийный антиген.
25. Способ или композиция по п.24, в которых гибридный белок включает HBsAg и фрагмент циркумспорозоитного белка Plasmodium falciparum.
26. Способ или композиция по п.25, в которых гибридный белок включает С-концевую часть P.falciparum циркумспорозоитного белка Plasmodium falciparum, четыре или более тандемных повтора иммунодоминантной области циркумспорозоитного белка и HBsAg.
27. Способ или композиция по любому из предшествующих пунктов, в которых весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 500:1.
28. Способ или композиция по любому из предшествующих пунктов, в которых весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 50:1.
29. Способ или композиция по любому из предшествующих пунктов, в которых алифатический адъювант представляет собой 3D-MPL, и весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет 2,5:1-25:1.
30. Способ или композиция по любому из предшествующих пунктов, в которых композиция имеет осмоляльность 200-400 мОсм/кг.
31. Способ или композиция по любому из предшествующих пунктов, в которых композиция включает фосфатный буфер.
32. Способ или композиция по любому из предшествующих пунктов, в которых композиция имеет величину рН 6,0-7,0.
33. Применение (i) антигенного компонента, который включает поверхностно-активное вещество, и (ii) алифатического адъюванта в производстве лекарственного средства для введения пациенту, в котором весовое отношение алифатического адъюванта в (ii) к поверхностно-активному веществу в (i) составляет менее чем 1000:1.
34. Способ получения иммуногенной композиции, включающий стадии комбинирования (i) HBsAg компонента, который включает полисорбат 20, и (ii) адъювантного компонента, включающего 3D-MPL, адсорбированный на фосфате алюминия, причем весовое отношение 3D-MPL к полисорбату 20 в композиции составляет менее чем 1000:1.
35. Иммуногенная композиция, содержащая HBsAg, полисорбат 20, 3D-MPL и фосфат алюминия как адъювант, причем весовое отношение 3D-MPL к полисорбату 20 в композиции составляет менее чем 1000:1.
36. Способ получения иммуногенной композиции, включающий стадии комбинирования (а) антигена и алифатического адъюванта; и (b) антигена, который был очищен в отсутствие поверхностно-активного вещества.
Текст
ПОНИЖЕННАЯ ИНТЕРФЕРЕНЦИЯ МЕЖДУ МАСЛОСОДЕРЖАЩИМИ АДЪЮВАНТАМИ И АНТИГЕНАМИ, СОДЕРЖАЩИМИ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА Включение алифатических адъювантов в вакцинные композиции может вызывать осложнения с некоторыми антигенными компонентами, в особенности с антигенами, которые включают поверхностно-активное вещество в качестве компонента. Способ получения иммуногенной композиции, включающей антиген и алифатический адъювант, включает очистку антигена, по существу, в отсутствие поверхностно-активного вещества. Там, где присутствия поверхностноактивных веществ избежать нельзя, комбинируются следующие: (i) антигенный компонент, который включает поверхностно-активное вещество, и (ii) алифатический адъювантный компонент с образованием композиции, в которой весовое отношение указанного алифатического адъюванта к указанному поверхностно-активному веществу составляет менее 1000:1.(71)(73) Заявитель и патентовладелец: НОВАРТИС ВЭКСИНЕС ЭНД ДАЙЭГНОСТИКС СРЛ (IT) 014314 Все цитированные здесь документы включены ссылкой во всей их полноте. Область техники, к которой относится изобретение Настоящее изобретение относится к области производства вакцин с адъювантами. В частности, оно касается применения алифатических адъювантов в производстве вакцин, основанных на антигенах, содержащих поверхностно-активные вещества. Уровень техники Применение адъювантов для усиления иммунных ответов на вакцинные антигены хорошо известно(например, см. ссылки 1 и 2). В течение многих лет адъювантами, утвержденными к использованию для людей, были только соли алюминия, но вакцины, содержащие адъювант MF59 и адъювант RC-529, были утверждены в различных странах, включая Италию (в продукте FLUAD фирмы Chiron) и Аргентину (в продукте SUPERVAX фирмы Berna Biotech). Прочие адъюванты, находящиеся на последней стадии экспериментальных испытаний на людях, включают смеси холестерина и сапонинов, ISCOM, MPL,AS04, виросомы, SBA4 и т.д. Общим признаком некоторых альтернатив солям алюминия является наличие алифатического компонента. Например, адъювант MF59 включает сквален (масло), и MPL содержит деацилированную форму монофосфориллипида А, имеющую множественные цепи алифатических кислот, присоединенные к диглюкозаминному каркасу. Настоящее изобретение касается предотвращения интерференции, которая может возникать между этими алифатическими адъювантами и антигенами, которые включают поверхностно-активное вещество в качестве компонента. Сущность изобретения Автор обнаружил, что алифатические адъюванты в вакцинных композициях могут быть несовместимыми с антигенами, которые включают поверхностно-активное вещество в качестве компонента. Во многих случаях, однако, остается желательным сочетание алифатического адъюванта и смеси антигена с поверхностно-активным веществом, и целью настоящего изобретения является выявление путей предотвращения трудностей, которые могут возникать при выполнении этого. Другая цель состоит в обеспечении способов комбинирования адъювантов и антигенов, в которых несовместимость предотвращается. Чтобы предотвратить эти проблемы несовместимости при использовании антигенов, которые обычно очищаются с использованием поверхностно-активных веществ, первый аспект изобретения представляет способ получения иммуногенной композиции, в котором: (а) композиция включает антиген и алифатический адъювант; и (b) антиген очищается в основном в отсутствие поверхностно-активного вещества. С помощью очистки антигена альтернативным путем, в котором не используется поверхностно-активное вещество, может быть преодолена любая несовместимость с алифатическими адъювантами. Однако, по клиническим, историческим причинам или вопросам правового регулирования может оказаться невозможным очистить антиген без использования поверхностно-активных веществ, или же полностью устранить поверхностно-активные вещества из вакцин. В этом случае изобретение предотвращает интерференцию путем уменьшения отношения масла к поверхностно-активному веществу в композиции. Типичная вакцина MF59/HBsAg содержит огромный избыток масла относительно поверхностно-активного вещества, с соотношением "масло:поверхностно-активное вещество" более 4000:1 (по весу). Настоящее изобретение имеет целью минимизировать количество алифатического адъюванта в композиции и, во втором аспекте, изобретение использует самое большее 1000-кратный избыток масла по весу. Таким образом, изобретение обеспечивает способ получения иммуногенной композиции, включающий стадии комбинирования (i) антигенного компонента, который включает поверхностно-активное вещество, и (ii) алифатического адъювантного компонента, с образованием композиции, в которой весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 1000:1. Подобным образом, изобретение представляет иммуногенную композицию, в которой: (а) композиция включает антигенный компонент и алифатический адъювантный компонент; (b) антигенный компонент включает поверхностно-активное вещество и (с) весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 1000:1. Алифатический адъювант Как первый, так и второй аспекты изобретения используют алифатический адъювант, то есть адъювантный компонент, который включает алифатическую молекулу. Типичные алифатические адъюванты включают масло, преобразуемое в ходе обмена веществ, алифатическую кислоту и/или молекулу, включающую фрагмент алифатической кислоты. Два предпочтительных алифатических адъюванта представляют собой адъюванты, известные как"MF59" и "MPL". "MF59" представляет собой алифатический адъювант, поскольку он содержит сквален,который является маслом, преобразуемым в ходе обмена веществ. "MPL" представляет собой алифатический адъювант, поскольку он содержит дисахарид, замещенный многочисленными цепями алифатических кислот. Наряду с MF59, могут быть также использованы другие адъюванты в форме эмульсий типа-1 014314 Таким образом, предпочтительные композиции согласно изобретению включают: (а) эмульсию типа "масло в воде", такую как субмикронная эмульсия типа "масло в воде", включающая сквален и полиоксиэтиленсорбитанмоноолеат (и, необязательно, сорбитантриолеат); и/или (b) 3-О-деацилированный монофосфориллипид А. Полиоксиэтиленсорбитанмоноолеат также известен как полисорбат 80. В дополнение к "MF59" и "MPL", другие алифатические адъюванты, которые могут быть использованы согласно изобретению, включают, но не ограничиваются таковыми: производные глюкозаминидфосфата; N-ацилпсевдодипептиды; растворимый адъювант, производный от липида A Escherlchla. coli, известный как "OM-174"; соединения, содержащие липиды, связанные с фосфатсодержащим ациклическим остовом; и ациклические синтетические аналоги липида А. Когда используется эмульсия адъюванта типа "масло в воде", такого как MF59, то, как правило, она добавляется к равному объему водной антигенной композиции так, что эмульсия составляет 50 об.% от всей композиции. Когда используется адъювант 3D-MPL, типичная доза составляет 25 мкг/мл 200 мкг/мл, например в диапазоне 50-150 мкг/мл, 75-125 мкг/мл, 90-110 мкг/мл или примерно 100 мкг/мл. Является обычным введение 25-75 мкг 3D-MPL на дозу, например, 45-55 мкг или примерно 50 мкг 3DMPL на дозу. Эмульсионный адъювант, такой как MF59, типично поставляется в контейнере отдельно от антигена для немедленного смешения в момент использования, или же он может быть поставлен уже смешанным с антигеном. Адъювант 3D-MPL, как правило, является уже смешанным с антигеном перед поставкой конечным пользователям.MF59 Адъювант "MF59" представляет собой эмульсию типа "масло в воде", образованную из сквалена,Твина 80 (полиоксиэтиленсорбитанмоноолеата) и Спана 85 (сорбитантриолеата). Эмульсия подвергается микрофлюидизированию для формирования эмульсии микрокапелек субмикронного размера. ПолучениеMF59 было первоначально описано в ссылке 3, и продукт изготавливался и продавался фирмой ChironCorporation. Дальнейшие подробности могут быть найдены в главе 10 ссылки 2, главе 12 ссылки 1 и в ссылках 4-6. Состав MF59 по объему представляет собой 5% сквалена, 0,5% полисорбата 80 и 0,5% Спана 85. В весовых единицах эти соотношения составляют 4,3% сквалена, 0,5% полисорбата 80 и 0,48% Спана 85. Собственное содержание поверхностно-активного вещества в MF59 не принимается в расчет,когда соотношение "масло:поверхностно-активное вещество" рассчитывается во втором аспекте изобретения, так как соотношение основывается на содержании поверхностно-активного вещества в антигене. Эмульсия MF59 преимущественно включает цитрат-ионы, например буфер цитрата натрия с концентрацией 10 мМ. Другие эмульсии типа "масло в воде" В качестве альтернативы адъюванту MF59 могут быть использованы другие эмульсии типа "масло в воде". Адъювантные эмульсии типично включают по меньшей мере одно масло и по меньшей мере одно поверхностно-активное вещество, при том, что масло(масла) и поверхностно-активное(-ые) вещество(-а) являются биоразлогаемыми (преобразуемыми в ходе обмена веществ) и биосовместимыми. Микрокапельки масла в эмульсии имеют в общем менее чем 5 мкм в диаметре, обычно с субмикронным диаметром. Малые размеры микрокапелек могут быть достигнуты с помощью микроэмульгатора для создания стабильных эмульсий. Микрокапельки с размером менее чем 220 нм предпочтительны, так как они могут быть подвергнуты стерилизации фильтрованием. Эмульсии могут включать масла, такие как таковые из животных (таких как рыба) или растительных источников, а не минеральные масла. Источники растительных масел включают орехи, семена и зерна. Арахисовое масло, соевое масло, кокосовое масло и оливковое масло являются наиболее общедоступными и представляют собой примеры ореховых масел. Может быть использовано масло жожоба, например, полученное из бобов жожоба. Растительные масла из семян включают сафлоровое масло, масло из семян хлопка, масло из семян подсолнечника, масло из семян кунжута и тому подобные. В зерновой группе кукурузное масло является наиболее легкодоступным, но может быть также использовано масло других злаковых зерен, таких как пшеница, овес, рожь, рис, метличка абиссинская, тритикале и тому подобные. Сложные эфиры алифатических кислот, содержащих 6-10 атомов углерода, с глицерином и 1,2 пропандиолом, если они природно не присутствуют в маслах из семян, могут быть получены путем гидролиза, отделения и этерификации подходящих материалов, начиная с ореховых и зерновых масел. Жиры и масла из молока млекопитающих являются преобразуемыми в ходе обмена веществ и поэтому могут быть использованы в практике настоящего изобретения. Методы отделения, очистки, омыления и другие средства, необходимые для получения чистых масел из животных источников, хорошо известны в данной области. Большинство рыб содержит преобразуемые в ходе обмена веществ масла, которые могут быть легко извлечены. Например, рыбий жир, жир акульей печени и китовый жир, такой как спермацет, представляют собой примеры нескольких масел рыбьего происхождения, которые могут быть использованы в настоящем изобретении. Некоторые масла с разветвленными цепями биохимическим путем преобразуются в пятиуглеродные изопреновые блоки, которые обычно называются терпеноидами. Масло акульей печени содержит разветвленные ненасыщенные терпеноиды, известные как сквален,-2 014314 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексаен, который в особенности предпочтителен здесь. Сквалан, насыщенный аналог сквалена, также является предпочтительным маслом. Рыбьи масла,включая сквален и сквалан, являются легкодоступными из коммерческих источников или могут быть получены известными в данной области способами. Другими предпочтительными маслами являются токоферолы (см. ниже). Могут быть использованы смеси масел. Поверхностно-активные вещества могут быть классифицированы по их гидрофильнолипофильному балансу (HLB). Предпочтительные поверхностно-активные вещества согласно изобретению имеют HLB, равный по меньшей мере 10, предпочтительно по меньшей мере 15, и более предпочтительно по меньшей мере 16. Изобретение может быть использовано с поверхностно-активными веществами, включающими, но не ограничивающимися таковыми: полиоксиэтиленсорбитановые сложноэфирные поверхностно-активные вещества (обычно называемые как Твины), в особенности полисорбат 20 и полисорбат 80; сополимеры этиленоксида (ЕО), пропиленоксида (РО), и/или бутиленоксида (ВО), которые продаются под торговым наименованиемDOWFAX, такие как линейные ЕО/РО-блок-сополимеры; октоксинолы, которые могут варьировать по числу повторяющихся этоксигрупп (окси-1,2-этандиильных фрагментов), из которых октоксинол-9 (Тритон X-100, или t-октилфеноксиполиэтоксиэтанол) представляет особенный интерес; (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); полиоксиэтиленовые алифатические простые эфиры, производные лаурилового, цетилового, стеарилового и олеилового спиртов (известные как поверхностно-активные вещества Brij), такие как монолауриловый простой эфир триэтиленгликоля (Brij 30); и сорбитановые сложные эфиры (общеизвестные как Спаны), такие как сорбитантриолеат (Спан 85) и " сорбитанмонолаурат. Предпочтительными поверхностно-активными веществами для включения в эмульсию являются Твин 80 (полиоксиэтиленсорбитанмоноолеат), Спан 85 (сорбитантриолеат), лецитин и Тритон Х-100. Могут быть использованы смеси поверхностно-активных веществ, например смеси Твин 80/Спан 85, или смеси Твин 80/Тритон Х-100. Эмульсионные адъюванты типа "масло в воде", пригодные для изобретения, включают, но не ограничиваются таковыми. Эмульсия сквалена, токоферола и Твина 80. Эмульсия может включать фосфатно-солевой буферный раствор. Она может также включать Спан 85 (например, на уровне 1%) и/или лецитин. Эти эмульсии могут содержать от 2 до 10% сквалена, от 2 до 10% токоферола и от 0,3 до 3% Твина 80, и весовое отношение сквален:токоферол составляет предпочтительно 1, так как это обеспечивает более стабильную эмульсию. Одна такая эмульсия может быть получена путем растворения Твина 80 в фосфатно-солевом буферном растворе (PBS) с образованием 2%-ного раствора, затем смешивания 90 мл этого раствора со смесью (5 г DLтокоферола и 5 мл сквалена), затем микрофлюидизирования смеси. Полученная эмульсия может иметь субмикронные масляные микрокапельки, например, со средним диаметром 100-250 нм,предпочтительно примерно 180 нм. Эмульсия сквалена, токоферола и Тритона как детергента (например, Тритона Х-100). Эмульсия сквалана, полисорбата 80 и Полоксамера 401 ("Pluronic L121"). Эмульсия может быть приготовлена в составе с фосфатно-солевым буферным раствором, с рН 7,4. Эта эмульсия представляет собой полезный носитель доставки для мурамилдипептидов и была использована с треонил-MDP (треонил-мурамилдипептид, Thr-MDP) в адъюванте "SAF-1" [ссылка 7] (0,05-1% Thr-MDP, 5% сквалана, 2,5%Pluronic L121 и 0,2% полисорбата 80). Она может быть также использована без Thr-MDP, как в адъюванте "AF" [ссылка 8] (5% сквалана, 1,25% Pluronic L121 и 0,2% полисорбата 80). Предпочтительно микрофлюидизирование. Эмульсия, содержащая от 0,5 до 50% масла, 0,1-10% фосфолипида и 0,05-5% неионного поверхностно-активного вещества. Как описано в ссылке 9, предпочтительными фосфолипидными компонентами являются фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит, фосфатидилглицерин, фосфатидная кислота, сфингомиелин и кардиолипин. Предпочтительны микрокапельки субмикронного размера. Субмикронная эмульсия типа "масло в воде" масла, непреобразуемого в ходе обмена веществ (такого как легкое минеральное масло), и по меньшей мере одного поверхностно-активного вещества (такого как лецитин, Твин 80 или Спан 80). Могут быть включены добавки, такие как сапонин QuilA, холестерин, сапонин-липофильный конъюгат (такой как GPI-0100, описанный в ссылке 10, получаемый присоединением алифатического амина к деацилированному сапонину по карбоксильной группе глюкуроновой кислоты), бромид диметилдиоктадециламмония и/или N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин. Эмульсия, в которой сапонин (например, QuilA или QS21) и стерин (например, холестерин) ассоциированы в виде спиральных мицелл [ссылка 11]. Эмульсии предпочтительно смешиваются с антигеном непосредственно перед использованием в момент поставки. Таким образом, адъювант и антиген обычно хранятся по отдельности в упакованной или распределенной вакцине, готовой для конечного составления в момент использования. Антиген-3 014314 обычно находится в водной форме, так что вакцина в конце концов готовится смешиванием двух жидкостей. Объемное соотношение двух жидкостей для смешивания может варьировать (например, 5:1 - 1:5),но обычно оно составляет примерно 1:1. Когда композиция включает токоферол, может быть использован любой из -, -, -, -,- или токоферолов, но предпочтительны-токоферолы. Токоферол может быть взят в нескольких формах, например, различных солей и/или изомеров. Соли включают органические соли, такие как сукцинаты, ацетаты, никотинаты и т.д. Dтокоферол и DLтокоферол могут быть использованы оба. Предпочтительным -токоферолом является DLтокоферол, и предпочтительной солью этого токоферола является сукцинат. 3D-MPL 3-О-деацилированный монофосфориллипид A (3D-MPL; также называемый как 3-де-О-ацилированный монофосфориллипид А или 3-O-дезацил-4'-монофосфориллипид А) является известным адъювантом. Наименование показывает, что положение 3 на восстанавливающем конце глюкозамина в монофосфориллипиде А является деацилированным. 3D-MPL был получен из не содержащего гептозы мутанта Salmonella minnesota, и химически он подобен липиду А, но лишен кислото-лабильной фосфорильной группы и основно-лабильной ацильной группы. Он активирует клетки моноцит/макрофаговой линии дифференцировки и стимулирует выделение некоторых цитокинов, включая IL-1, IL-12, TNF- и GMCSF. Приготовление 3D-MPL было первоначально описано в ссылке 12, и продукт производится и продается фирмой Corixa Corporation под торговым наименованием "MPL". Дальнейшие подробности могут быть найдены в ссылках 13-16. 3D-MPL может принимать форму смеси родственных молекул, с вариацией степени их ацилирования (например, имеющих 3, 4, 5 или 6 ацильных цепей, которые могут иметь различную длину). Два глюкозаминных (также известных как 2-дезокси-2-аминоглюкоза) моносахаридных фрагмента являютсяN-ацилированными по их углеродам в положениях 2 (то есть по положениям 2 и 2'), и имеет место также О-ацилирование по кислороду в положении 3'. Группа, присоединенная к углероду в положении 2, имеет формулу -NH-CO-CH2-CR1R1'. Группа, присоединенная к углероду в положении 2' , имеет формулу -NHCO-CH2-CR2R2'. Группа, присоединенная к углероду в положении 3', имеет формулу -O-CO-CH2-CR3R3'. Иллюстративная структура такова: Каждая из групп R1, R2 и R3 независимо представляет собой -(CH2)n-CH3. Значение n предпочтительно составляет от 8 до 16, более предпочтительно от 9 до 12, и наиболее предпочтительно равно 10. Каждая из групп R1', R2' и R3' независимо может быть: (а) -Н; (b) -ОН; или (с) -O-CO-R4, где R4 представляет собой либо -Н, либо - (СН 2)m-СН 3, где значение m составляет предпочтительно от 8 до 16, и более предпочтительно оно равно 10, 12 или 14. В положении 2 m предпочтительно равно 14. В положении 2' m предпочтительно равно 10. В положении 3' m предпочтительно равно 12. Группы R1', R2' и R3' тем самым представляют собой предпочтительно -О-ацильные группы из лауриновой кислоты, миристиновой кислоты или пальмитиновой кислоты. Когда все из групп R1', R2' и R3' являются -Н, тогда 3D-MPL имеет только 3 ацильных цепи (каждая из которых в положениях 2, 2' и 3') . Когда только две из групп R1', R2' и R3' являются -Н, тогда 3D-MPL может иметь 4 ацильных цепи. Когда только одна из групп R1', R2' и R3' является -Н, тогда 3D-MPL может иметь 5 ацильных цепей. Когда же ни одна из групп R1', R2' и R3' не является -Н, тогда 3D-MPL может иметь 6 ацильных цепей. Адъювант 3D-MPL, используемый согласно изобретению, может быть смесью этих форм, содержащих от 3 до 6 ацильных цепей, но предпочтительно включать в смесь 3D-MPL с 6 ацильными цепями, и в особенности для обеспечения того, что форма с шестью ацильными цепями составляет по меньшей мере 10% по весу от общего 3D-MPL, например 20%, 30%, 40%, 50% или более. Было показано, что 3D-MPL с 6 ацильными цепями является наиболее активной формой адъюванта. Таким образом, наиболее предпочтительной формой 3D-MPL для включения в композицию согласно изобретению является: Там, где 3D-MPL используется в форме смеси, указания о количествах или концентрациях 3D-MPL в композициях согласно изобретению касаются комбинированных частиц 3D-MPL в смеси. В водных условиях 3D-MPL может образовывать мицеллярные агрегаты или частицы с различными размерами, например, с диаметром 150 нм или 500 нм. Каждая из них или обе могут быть использованы согласно изобретению, и лучшие частицы могут быть отобраны общепринятым анализом. Наименьшие частицы (например, в достаточной степени маленькие, чтобы образовать прозрачные водные суспензии 3D-MPL) предпочтительны для использования согласно изобретению благодаря их превосходной активности [ссылка 17]. Предпочтительные частицы имеют средний диаметр менее чем 220 нм, более предпочтительно менее чем 200 нм или менее чем 150 нм или менее чем 120 нм, и могут даже иметь средний диаметр менее чем 100 нм. Однако во многих случаях средний диаметр не составляет меньше чем 50 нм. Эти частицы малы в достаточной степени, чтобы быть пригодными для стерилизации фильтрованием. Диаметр частиц может быть оценен с помощью общепринятого метода динамического рассеяния света, которым определяется средний диаметр частиц. Там, где частица называется имеющей диаметр х нм, на самом деле имеет место распределение частиц примерно этого среднего значения, но по меньшей мере 50% числа (например, 60, 70, 80, 90 или более) частиц будут иметь диаметр в пределах диапазона х 25%. 3D-MPL может быть использован в качестве адъюванта и сам по себе, или в сочетании с одним или несколькими дополнительными адъювантными соединениями. Например, известно применение 3D-MPL в комбинации с сапонином QS21 [ссылка 18], с QS21 и эмульсией типа "масло в воде" [ссылка 19], с фосфатом алюминия [ссылка 20], с гидроксидом алюминия [ссылка 21], или с сапонинами и интерлейкином-12 [ссылка 22]. Предпочтительная смесь адъювантов, в частности, для использования с HBsAg включает смесь 3DMPL и соли алюминия, преимущественно фосфата алюминия. Преимущественно 3D-MPL адсорбируется на соли алюминия. Предпочтительно адсорбируются по меньшей мере 50% (по весу) 3D-MPL, например 60, 70, 80, 90, 95, 98 или более. Алюминиевые адъюванты, используемые в настоящее время, типично обозначаются либо как адъюванты из "гидроксида алюминия", либо как адъюванты из "фосфата алюминия". Однако эти наименования приняты для удобства, поскольку нет ни одного точного описания реального химического соединения, которое наличествует (например, см. главу 9 ссылки 2). Для комбинации с алифатическим адъювантом, таким как 3D-MPL, изобретение может использовать любую из "гидроксидной" или "фосфатной" солей, которые в общем используются как адъюванты. Адъюванты, известные как "гидроксид алюминия", на самом деле представляют собой соли оксигидроксида алюминия, которые обычно, по меньшей мере частично, являются кристаллическими. Оксигидроксид алюминия, который может быть представлен формулой AlO(OH), можно отличить от прочих соединений алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной (ИК) спектроскопии, в частности по присутствию полосы поглощения при 1070 см-1 и сильному плечу при 3090-3100 см-1 (глава 9 в ссылке 2). Адъюванты, известные как "фосфат алюминия", обычно представляют собой гидроксифосфаты алюминия, часто содержащие также небольшое количество сульфата. Они могут быть получены осаждением, и реакционные условия и концентрации в способе осаждения влияют на степень замещения фос-5 014314 фата на гидроксил в соли. Гидроксифосфаты в общем имеют молярное соотношение РО 4/Al 0,3-0,99. Гидроксифосфаты можно отличить от чистого AlPO4 по присутствию гидроксильных групп. Например,полоса в ИК-спектре при 3164 см-1 (например, при нагревании до 200 С) показывает присутствие структурных гидроксилов (глава 9 в ссылке 2). Молярное отношение PO4/Al3+ в алюминийфосфатном адъюванте обычно составляет 0,3-1,2, предпочтительно 0,8-1,2 и более предпочтительно 0,950,1. Фосфат алюминия обычно является аморфным, в особенности в случае гидроксифосфатных солей. Типичный адъювант представляет собой аморфный гидроксифосфат алюминия с молярным отношением "PO4/Al" 0,84-0,92, включаемый на уровне 0,6 мгAl3+/мл. Фосфат алюминия обычно является дисперсным. Типичные диаметры частиц колеблются в интервале 0,5-20 мкм (например, примерно 5-10 мкм) после адсорбции любого антигена. Точка нулевого заряда (PZC) фосфата алюминия обратно пропорционально соотносится со степенью замещения фосфата на гидроксил, и эта степень замещения может варьировать в зависимости от реакционных условий и концентрации реактантов, использованных для получения соли путем осаждения. Точка нулевого заряда (PZC) также сдвигается при изменении концентрации свободных фосфатных ионов в растворе (больше фосфата = более кислая PZC) или при добавлении буфера, такого как гистидиновый буфер (делает PZC более щелочной). Фосфаты алюминия, использованные согласно изобретению,обычно имеют точку нулевого заряда (PZC) 4,0-7,0, более предпочтительно 5,0-6,5, например, примерно 5,7. Раствор фосфата алюминия, использованный для получения композиции согласно изобретению,может содержать буфер (например, фосфатный или гистидиновый или Трис-буфер), но это не всегда является необходимым. Раствор фосфата алюминия преимущественно стерильный и апирогенный. Раствор фосфата алюминия может включать свободные гидратированные фосфатные ионы, например, присутствующие в концентрации 1,0-20 мМ, предпочтительно 5-15 мМ, и более предпочтительно примерно 10 мМ. Раствор фосфата алюминия может также включать хлорид натрия. Концентрация хлорида натрия предпочтительно колеблется в диапазоне от 0,1 до 100 мг/мл (например, 0,5-50 мг/мл, 1-20 мг/мл, 2-10 мг/мл), и более предпочтительно составляет примерно 31 мг/мл. Присутствие NaCl облегчает правильное измерение величины рН перед адсорбцией антигенов. Фосфат алюминия предпочтительно используется в форме водного раствора, к которому добавляется 3D-MPL (и, необязательно, антиген) (Примечание: является стандартным называть водный фосфат алюминия как "раствор", хотя, строго говоря с физико-химической точки зрения, соль нерастворима и образует суспензию). Является предпочтительным разбавлять фосфат алюминия до требуемой концентрации и обеспечивать однородность раствора перед добавлением 3D-MPL и/или антигена.N-Ацилпсевдодипептидный адъювант предпочтительно включает гидроксильную группу, которая этерифицирована кислотным фрагментом в нейтральной или заряженной форме. Ацильные группы придают псевдодипептидам алифатический характер. Адъювант предпочтительно имеет формулу (I):R1 представляет собой ацильную группу, происходящую из насыщенной или ненасыщенной, линейной или разветвленной карбоновой кислоты, имеющей от 2 до 24 атомов углерода, и карбоновая кислота является незамещенной или замещенной одним или более заместителями, выбираемыми из группы, состоящей из гидроксильной, алкильной, алкоксильной, ацилоксильной, аминной, ациламинной,ацилтиогруппой и ( (С 1-24)алкил)тиогрупп;R2 представляет собой ацильную группу, происходящую из насыщенной или ненасыщенной, линейной или разветвленной карбоновой кислоты, имеющей от 2 до 24 атомов углерода, и карбоновая кислота является незамещенной или замещенной одним или более заместителями, выбираемыми из группы, состоящей из гидроксильной, алкильной, алкоксильной, ацилоксильной, аминной, ациламинной,ацилтиогруппой и ( (С 1-24)алкил)тиогрупп;X представляет собой атом водорода или кислотную группу, либо в нейтральной, либо в заряженной форме;Y представляет собой атом водорода или кислотную группу, либо в нейтральной, либо в заряженной форме; А представляет собой атом кислорода, атом серы или иминогруппу -NH-; В представляет собой атом кислорода, атом серы или иминогруппу -NH-;q равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,-6 014314 при условии, что по меньшей мере один из заместителей X или Y обозначает кислотную группу в нейтральной или ионной форме. Адъювант может быть использован либо в кислотной, либо в солевой форме, с органическим или минеральным основанием. Солеобразующие основания, предназначенные для терапевтического использования, по большей части включают основания щелочных металлов, такие как гидроксиды натрия, калия или лития, соли аммония; основания щелочно-земельных металлов, такие как гидроксиды кальция или стронция и соли магния; соли железа и подобные; органические основания, такие как таковые, производные из первичных, вторичных, третичных аминов, таких как метиламин, диэтиламин, моноэтаноламин, диэтаноламин,бензиламин, N-метилбензиламин, вератриламин, триметоксибензиламин; основные аминокислоты, такие как лизин и орнитин или аминосахара. Примерами оснований, не предназначенных для терапевтического использования, являются бруцин, стрихнин, агматин, гомарин, глюкозамин, N-метилглюкозамин или Nметилморфолин. Предпочтительные заместители X и Y выбирают из карбокси[(C1-5)алкильных]; СН-[(CH2)rCOOH][(CH2)sCOOH], где r равно 0, 1, 2, 3, 4 или 5; s равно 0, 1, 2, 3, 4 или 5; фосфоно[(C1-5)алкильных]; дигидроксифосфорилокси[(C1-5)алкильных]; диметоксифосфорильных; фосфоновых; гидроксисульфонильных; гидроксисульфонил [(C1-5)алкильных]; гидроксисульфонилокси[(C1-5)алкильных]групп. Там, где заместители X и/или Y обозначают кислотную группу в нейтральной форме, речь идет о свободной карбоновой, сульфоновой или фосфорной форме. Там, где кислотная группа находится в заряженной форме, речь идет о карбоновой, сульфоновой или фосфорной солевой форме, а именно путем добавления органического или минерального основания, предпочтительно такого, какое предназначается для терапевтического использования. Подобные рассуждения применимы, где X и/или Y обозначают карбоксиалкильную, алкенилбискарбоксильную, гидроксисульфонильную, гидроксисульфонилалкильную, гидроксисульфонилоксиалкильную, фосфоноалкильную или фосфорилоксиалкильную группу. Там, где m=1 и n=0, адъювант происходит из серина. Там, где m=2 и n=0, адъювант происходит из гомосерина. Если m=3 и n=0, речь идет о пентагомосериновом соединении. Если m=4 и n=0, речь идет о гексагомосериновом соединении. Там, где р=3 и q=1, обсуждаемый продукт может быть цитруллиновым, орнитиновым или аргининовым соединением. Там, где р=4 и q=1, речь идет о гомоаргининовом или лизиновом соединении.R1 и R2 включают насыщенные или ненасыщенные, разветвленные или линейные, ацильные производные, имеющие цепи переменного размера, различающейся или идентичной природы, которые могут иметь один или более заместителей, выбираемых из группы, состоящей из алкильной, аминной, ациламинной, гидроксильной, алкоксильной, ацилоксильной групп, ацилтиогрупп и алкилтиогрупп. Примерами таких ацилированных, замещенных производных являются рицинолеильный, 1,2 гидроксистеароильный, 2-гидрокси-3-метилбутироильный, 3-гидрокси-2-аминопентаноильный, пальмитоильный, элаидильный, элеостеароильный, арахидоильный, арахидонильный, гадолеильный, бегениловый, эруциловый, 8-метилдеканоильный, 9-метилдеканоильный, докозогексаноильный или эйкозапентаноильный радикалы. Предпочтительные адъюванты имеют формулу (Ia), где оба А и В представляют собой атомы кислорода: В формуле (Ia), X и Y предпочтительно представляют собой либо атом водорода, либо фосфоновую группу. Пригодные адъюванты формулы (Ia) включают 3-(3-додеканоилокситетрадеканоиламино)-9-(3-гидрокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-1 и/или 10-дигидрофосфат и его аддитивные соли, полученные добавлением органического или минерального основания,3-(3-додеканоилокситетрадеканоиламино)-9-(3-гидрокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-1,10-бис(дигидрофосфат) и его аддитивные соли, полученные добавлением органического или минерального основания,3-(3-гидрокситетрадеканоиламино)-9-(3-додеканоилокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-1,10-бис(дигидрофосфат) и его аддитивные соли, полученные добавлением органического или минерального основания,-7 014314 3-(3-додеканоилокситетрадеканоиламино)-9-(3-гидрокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-1-дигидрофосфат и его аддитивные соли, полученные добавлением органического или минерального основания,3-(3-гидрокситетрадеканоиламино)-9-(3-додеканоилокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-1-дигидрофосфат и его аддитивные соли, полученные добавлением органического или минерального основания,3-(3-гидрокситетрадеканоиламино)-9-(3-додеканоилокситетрадеканоиламино)-4-оксо-5-азадекан 1,10-диол-10-дигидрофосфат и его аддитивные соли, полученные добавлением органического или минерального основания. Способы синтеза адъювантов формулы (I) подробно раскрыты в ссылке 23 и включают способы,включающие стадии: защита аминных функциональных групп в положениях (q+1) идиаминокислоты с помощью блокирующих реагентов, легко подвергаемых ацидолизу и гидрогенолизу, соответственно; реакция свободной карбоксильной функциональной группы с восстанавливающим реагентом с образованием соответствующего спирта; снятие защитной группы с аминной функциональной группы в положении (q+1) и затем ацилирование с помощью функционального производного карбоновой кислоты формулы R2OH, и затем освобождение концевой аминной функциональной группы путем гидрогенолиза с образованием диаминоспирта общей формулы II каковой аминоспирт конденсируется в присутствии пептидного конденсирующего реагента в инертном растворителе вместе с -гидрокси-, -амино- или -тиоаминокислотным соединением общей формулы III с образованием дипептидного соединения формулы (IV) концевая свободная спиртовая функциональная группа которого, если необходимо, может быть защищена (например, алкильной или ацильной группой, или любой другой подходящей защитной группой) или, в противном случае, замещена, если необходимо, в присутствии, сшивающего реагента. Защищенный спирт может быть подвергнут каталитическому гидрированию или другой обработке для снятия защиты, чтобы получить производное общей формулы I. Способы синтеза адъювантов формулы (II) также подробно раскрыты в ссылке 23 и включают способы, включающие стадии: защита аминных функциональных групп в положениях (q+1) идиаминокислоты формулы H2N (CH2)pCHNH2(CH2)q+1COOH с помощью создающих защиту реагентов, которые легко подвергаются ацидолизу и гидрогенолизу, соответственно; реакция свободных карбоксильных функциональных групп с восстанавливающим реагентом с образованием соответствующего спирта, снятие защитной группы с аминной функциональной группы в положении (q+1) и затем ацилирование с помощью функционального производного карбоновой кислоты формулы R2OH, и затем снятие защитной группы с концевой аминной функциональной группы путем гидрогенолиза с образованием аминоспирта общей формулы II; каковой аминоспирт конденсируется в присутствии пептидного конденсирующего реагента в инертном растворителе вместе с функциональным производным -гидроксиаминокислоты общей формулы IIIa: где X представляет собой диалкилокси- или диарилоксифосфорильный радикал формулы (RO)2P-O с образованием пептидоподобного соединения формулы IVa:-8 014314 где R представляет собой радикал, который легко подвергается гидрогенолизу, другая спиртовая функциональная группа которого, если желательно, может быть фосфорилирована с помощью фосфорилирующего реагента в присутствии сшивающего реагента, если нужно. Защищенный спирт может быть подвергнут каталитическому гидрированию, с одной стороны, чтобы снять защиту со спиртовой функциональной группы, необязательно присутствующей в ацильной группе R2, и с другой стороны, чтобы освободить фосфатную функциональную группу и затем снять защиту путем гидрогенолиза со второй,необязательно присутствующей фосфатной функциональной группы, чтобы получить производное общей формулы V: и, необязательно, выполнить дальнейшую стадию образования соли с помощью органического или минерального основания. Стереохимия хиральных центров ациламиногрупп определяется конфигурацией первоначально используемой аминокислоты, тогда как стереохимия ациламиногрупп зависит от конфигурации первоначально использованной алифатической кислоты. Здесь можно исходить из диаминокислот, имеющих Lили D-конфигурацию, или же имеющих рацемическую природу. Можно исходить из гидроксилированной аминокислоты с L,D-конфигурацией или из рацемической смеси. Все такие стереоизомеры или диастереоизомеры включены в рамки изобретения. В особенности предпочтительные адъюванты, и заслуживающие внимания моно- и бисфосфорилированные соединения, являются таковыми, которые известны как "ОМ-294-МР" (формула VI) и "OM-294-DP" (формула VII) [ссылка 23]: ОМ-174 ОМ-174 может быть получен химическим синтезом и содержит триацилированный фрагмент липида А. Это более подробно описано в ссылках 24-26. Ссылка 26 приводит формулу ОМ-174 как: Таким образом, ОМ-174 имеет 1,4'-бис-фосфорилированный(16)-связанный диглюкозаминный каркас, как найдено в природном липиде А. ОМ-174 может быть представлен в форме агрегатов с мицеллярной HI-структурой, то есть в которой липидные молекулы упакованы со своим каркасом в виде ци-9 014314 линдрической поверхности, с ацильными цепями, направленными внутрь, и с самими цилиндрами, упакованными гексагонально. Кубическая фаза может отсутствовать. Может также отсутствовать HII-фаза. Глюкозаминидфосфатные производные Аминоалкильные глюкозаминидфосфатные (AGP) производные (например, RC-529 [ссылки 27, 28]) являются алифатическими адъювантами благодаря их ацильным цепям. В общем эти производные могут иметь следующую формулу [ссылка 29]:X представляет атом кислорода или серы, либо в аксиальном, либо в экваториальном положении;Y представляет атом кислорода или NH-группу;n", "m", "р" и q" являются одинаковыми или различными и являются целыми числами от 0 до 6;R1, R2 и R3, которые могут быть одинаковыми или различными, представляют собой остатки алифатических кислот, имеющих от 1 до примерно 20 атомов углерода, и где один из R1, R2 или R3 представляет собой необязательно водород;R4 и R5 являются одинаковыми или различными и представляют собой водород или метильную группу;R6 и R7 являются одинаковыми или различными и представляют собой водород, гидроксильную,алкоксильную, фосфоновую, фосфонооксильную, сульфоновую, сульфоксильную, аминную группу, меркаптогруппу, цианогруппу, нитрогруппу, формильную или карбоксильную группу и их сложные эфиры и амиды;R8 и R9 являются одинаковыми или различными и представляют собой фосфоновую группу или водород, с предпочтением, что по меньшей мере один из R8 и/или R9 представляет собой фосфоновую группу. Конфигурация 3'-стереогенных центров, к которым присоединены нормальные алифатические ацильные остатки, это R или S, но предпочтительно R-конфигурация. Стереохимия атомов углерода, к которым присоединены R4 или R5, может быть R- или S-конфигурацией. Все стереоизомеры, как энантиомеры, так и диастереомеры, и их смеси рассматриваются как входящие в рамки предмета изобретения. Пригодные адъюванты включают соли этих соединений. Предпочтительное аминоалкильное глюкозаминидфосфатное (AGP) соединение представляет собой"RC-529", которое может быть приготовлено, как описано в ссылке 30:- 10014314 Ациклические синтетические аналоги липида А Аналог липида А, который может быть использован в качестве адъюванта в композициях согласно изобретению, представляет собой ER-112022 [ссылка 31] , фосфолипидный димер, присоединенный через ациклический каркас: Каждая мономерная единица ER-112022 содержит 3 уникальных алифатических группы, которые присоединены опосредованно к фосфатному сложному диэфиру. Алифатические группы включают 10 углеродную цепь простого эфира, ненасыщенную 12-углеродную ацилоксильную цепь, связанную с эфирной цепью, и 14-углеродную, b-оксоамидную цепь, присоединенную более близко к сложному фосфодиэфиру. Таким образом, соединение имеет 3 уникальных признака, сравнимых с природным липидом А из E.coli: (i) ER-112022 не имеет циклического углеводного каркаса; (ii) во-вторых, фосфаты представляют собой сложные фосфодиэфиры, внедренные в пределы структурного остова, отличного от сложных фосфоэфиров липида A E.coli; и (iii) структура является симметричной (шесть симметрично расположенных алифатических кислот на неуглеводном каркасе). Подобные употребимые соединения включают таковые с формулой XIV, XV или XVI, или их соли:- 11014314 Соединения, содержащие липиды, присоединенные к фосфатсодержащему ациклическому каркасу,могут быть также использованы в качестве адъювантов, таких как TLR4 антагонист Е 5564 [ссылки 33,34]: Поверхностно-активное вещество Первый аспект изобретения в значительной степени избегает использования поверхностноактивного вещества в ходе очистки антигена так, что поверхностно-активное вещество не находится внутри антигенного компонента, использованного в изобретении. Однако во втором аспекте поверхностно-активное вещество используется, но на контролируемом уровне относительно алифатического адъюванта. Поверхностно-активное вещество обычно представляет собой неионное поверхностно-активное вещество, в особенности такое, которое уже находятся в вакцинных составах. Предпочтительны органические поверхностно-активные вещества. Обычно они представляют собой продукты реакций алкиленоксида (например, этиленоксида) с алифатическим спиртом, алифатической кислотой, алкилфенолом,алкиламином или другим подходящим соединением, имеющим по меньшей мере один активный атом водорода. Для большинства поверхностно-активных веществ наиболее распространенные спирты, амины и кислоты имеют углеродную цепь с длиной в пределах C8-C18. Наиболее распространенные алкилфенолы представляют собой нонилфенол и октилфенол. Поверхностно-активные вещества, содержащие полиоксиэтиленовые остатки, являются в особенности предпочтительными. Например, изобретение может быть использовано с поверхностно-активными веществами, включающими, но не ограничивающимися таковыми: сложноэфирные полиоксиэтиленсорбитановые поверхностно-активные вещества (обычно называемые как Твины), в особенности полисорбат 20 и полисорбат 80; сополимеры этиленоксида (ЕО), пропиленоксида (РО), и/или бутиленоксида (ВО), которые продаются под торговым наименованием DOWFAX, такие как линейные ЕО/РО-блок-сополимеры; октоксинолы, которые могут варьировать по числу повторяющихся этоксигрупп (окси-1,2-этандиильных фрагментов), из которых октоксинол-9 (Тритон Х-100, или t-октилфеноксиполиэтоксиэтанол) представляет особенный интерес; (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); полиоксиэтиленовые алифатические простые эфиры, производные лаурилового, цетилового, стеарилового и олеилового спиртов(известные как поверхностно-активные вещества Brij), такие как монолауриловый простой эфир триэтиленгликоля (Brij 30); и сорбитановые сложные эфиры (общеизвестные как Спаны), такие как сорбитантриолеат (Спан 85) и сорбитанмонолаурат. Два конкретных особенно интересных поверхностно-активных вещества представляют Тритон Х 100 и полисорбат 20. Таким образом, предпочтительные варианты осуществления первого аспекта изобретения избегают использования этих двух неионных поверхностно-активных веществ в частности, и предпочтительно в основном избегают использования любого неионного поверхностно-активного вещества. Подобным образом, предпочтительные варианты осуществления второго аспекта изобретения используют антигенный компонент, который включает одно из этих двух неионных поверхностноактивных веществ. Изобретение в особенности пригодно для применения с полисорбатом 20. Это поверхностноактивное вещество имеет установленный профиль безопасности для введения людям, в том числе в составе вакцин. Поверхностно-активные вещества могут быть классифицированы по их гидрофильнолипофильному балансу (HLB). Предпочтительные поверхностно-активные вещества согласно изобретению имеют HLB, равный по меньшей мере 10, предпочтительно по меньшей мере 15, и более предпочтительно по меньшей мере 16. Чтобы избежать введения больших доз поверхностно-активного вещества пациенту во втором аспекте изобретения, предпочтительно, чтобы концентрация поверхностно-активного вещества в композиции была не более чем 50 мкг/мл, например 40, 35, 30, 25, 20, 15, 10, 5 и т.д. Предпочтительна концентрация 20 мкг/мл. Антиген Изобретение включает применение антигена. Изобретение в особенности пригодно для применения- 12014314 с антигенами, которые обычно очищаются с использованием поверхностно-активных веществ. Эти антигены обычно являются липофильными. Они обычно включают по меньшей мере одну трансмембранную область, которая функционирует in vivo для локализации антигена внутри липидного бислоя, например на поверхности болезнетворного микроорганизма. Изобретение в особенности применимо для использования с поверхностными антигенами вирусов. Во втором аспекте изобретения антигенный компонент включает поверхностно-активное вещество. Является скорее предпочтительным, чтобы антиген и поверхностно-активное вещество были в форме комплекса, нежели составляли бы простую смесь антигена и поверхностно-активного вещества. Комплексы "антиген/поверхностно-активное вещество" включают стабилизированные поверхностноактивным веществом липосомы, содержащие антиген, и ниосомы, которые являются носителями, сформированными из синтетических неионных амфифильных соединений. Предпочтительным комплексом"антиген/поверхностно-активное вещество" является корпускулярный поверхностный антиген гепатита В, очищаемый в присутствии поверхностно-активного вещества. Ссылка 35 описывает, как рекомбинантные частицы HBsAg могут удерживать Твин 20, который был использован во время их очистки (до 25 мкг Твина 20 на 100 мкг HBsAg). Таким образом, наиболее предпочтительным антигеном для применения во втором аспекте изобретения является поверхностный антиген вируса гепатита В (HBV) в форме, по существу, сферических частиц (средний диаметр примерно 20 нм), включающих липидную матрицу, включающую как фосфолипиды, так и неионное поверхностно-активное вещество, такое как полисорбат 20. Неионное поверхностно-активное вещество может быть внедрено в частицу в процессе очистки. Однако для первого аспекта изобретения предпочтительной формой HBsAg является такая, в которой HBsAg очищается без использования неионных поверхностно-активных веществ, так что частицыHBsAg не включают никакого поверхностно-активного вещества, тем самым избегая интерференции с алифатическим адъювантом. Вирус гепатита В (HBV) является одним из известных агентов, который вызывает вирусный гепатит. Вирион HBV состоит из внутреннего кора, окруженного внешней белковой оболочкой, или капсидом, и вирусный кор содержит вирусный ДНК геном. Главный компонент капсида представляет собой белок, известный как HBV-поверхностный антиген, или, как более принято, "HBsAg", который типично представляет собой полипептид из 226 аминокислот, имеющий молекулярную массу примерно 24 килодальтонов (кДа). Все существующие вакцины гепатита В содержат HBsAg, и когда этот антиген вводится при нормальной вакцинации, он стимулирует продуцирование анти-HBsAg антител, которые защищают организм от инфицирования HBV. Для производства вакцины HBsAg может быть приготовлен двумя путями. Первый способ включает очистку антигена в корпускулярной форме от плазмы хронических носителей гепатита В, так как большие количества HBsAg синтезируются в печени и выбрасываются в кровоток во время инфицирования HBV. Второй путь включает экспрессирование белка методом рекомбинантных ДНК. HBsAg для применения в способе согласно изобретению является рекомбинантно экспрессированным в дрожжевых клетках. Пригодные дрожжи включают Saccharomyces (такие как S.cerevisiae), Pichia (такие какP.pastoris) или Hanensula (такие как H.polymorpha) в качестве клетки-хозяина. В качестве альтернативы,антиген может быть экспрессирован в клетках рекомбинантного млекопитающего (например, в яичнике китайского хомячка (СНО), COS-клетках, Bu3-клетках, и т.д.), насекомого (например, с использованием бакуловирусных векторов), или растительных клетках. В общем, однако, используется дрожжевая экспрессия. Экспрессированный в дрожжах HBsAg предпочтительно является негликозилированным. В отличие от нативного HBsAg (то есть, как в очищенном из плазмы продукте), экспрессированный в дрожжахHBsAg в общем является негликозилированным, и он представляет собой наиболее предпочтительную форму HBsAg для использования согласно изобретению, поскольку он является высокоиммуногенным и может быть приготовлен без риска загрязнения продуктами крови. Частицы экспрессированного в дрожжах HBsAg могут включать фосфатидилинозит, который не находится в натуральных HBV-вирионах. Частицы могут также включать нетоксичное количество липополисахаридного (LPS) эндотоксина, чтобы стимулировать иммунную систему [ссылка 36]. В данной области известны многие способы очистки HBsAg (например, см. ссылки 37-62). Из этих разнообразных способов первый аспект изобретения использует один, в котором не применяется неионное поверхностно-активное вещество. Напротив, второй аспект изобретения использует неионное поверхностно-активное вещество во время очистки, так что поверхностно-активное вещество становится внедренным в конечный корпускулярный HBsAg продукт. Применение полисорбата 20 в способе разрушения рекомбинантных дрожжевых клеток в начале очистки является предпочтительным путем для внедрения поверхностно-активного вещества в частицы HBsAg. Предпочтительный способ очистки HBsAg включает, после разрушения клеток: ультрафильтрацию; гель-проникающую хроматографию; анионообменную хроматографию; ультрацентрифугирование; обессоливание и стерилизацию фильтрованием. Лизаты могут быть осаждены после разрушения клеток (например, с использованием полиэтиленгликоля), оставляя HBsAg в растворе, готовом для ультрафильтра- 13014314 ции. До или после стерилизации фильтрованием возможна стабилизация частиц HBsAg путем обработки формальдегидом. Избыток формальдегида может быть затем удален ультрафильтрацией или с помощью хроматографии. Может быть применена последующая стерилизация фильтрованием.HBsAg предпочтительно относится к HBV-субтипу adw2. В дополнение к "S-последовательности, поверхностный антиген может включать все или часть пре-S-последовательности, такие как все или часть пре-S1- и/или пре-S2-последовательности. Другие вирусные поверхностные антигены, которые могут быть использованы согласно изобретению, в общем представляют собой капсульные гликопротеины из капсульных вирусов. Вирусные поверхностные антигены для применения согласно изобретению могут включать, но не ограничиваться таковыми. Ретровирусный белок. Семейство Retroviridae включает лентивирусы и спумавирусы. Представляющие интерес вирусы включают HTLV-I, HTLV-II, вирус кошачьего иммунодефицита (FIV), вирус иммунодефицита человека (ВИЧ, HIV, включая HIV-1 и HIV-2), вирус иммунодефицита обезьяны (SIV),пенистый вирус обезьяны (шимпанзе) и человеческий спумавирус. Парамиксовирусный белок, такой как F-белок. Семейство Paramyxoviridae включает (а) подсемейство Paramyxovirinae, которое включает парамиксовирусы, рубулавирусы и морбилливирусы, и (b) подсемейство Pneumovirinae, которое включает пневмовирусы. Представляющие интерес вирусы включают вирус параинфлюенцы (PIV), человеческий парамиксовирус, Rinderpest вирус, Peste Des Petit Ruminant вирус, Measles вирус кори, Mumps вирус, респираторный синцитальный вирус (RSV), Нипах вирус, вирус Хендра, Equine Morbillivirus (EMV), лисса-вирус и Menangle вирус. Филовирусный белок. Семейство Filoviridae включает вирусы Marburg и Ebola. Гликопротеины оболочечного шипа коронавирусов. Семейство Coronaviridae включает коронавирусы и торовирусы. Вирусы, представляющие интерес, включают человеческие коронавирусы (в том числеSARS-коронавирусы), Avian вирус инфекционного бронхита, Feline вирус инфекционного перитонита,Murine вирус гепатита, Porcine вирус эпидемической диареи, Porcine вирус гемагглютинирующего энцефаломиелита, Porcine вирус трансмиссионного гастроэнтерита и Berne вирус. Рабдовирусный белок, такой как G-белок. Семейство Phabdoviridae включает рабдовирусы, везикуловирусы, лиссавирусы, эфемеровирусы, циторабдовирусы и нуклеорабдовирусы. Представляющие интерес вирусы включают вирус везикулярного стоматита, вирус бешенства, вирус Мокола, коровий рабдовирус (bovine ephemeral fever). Тогавирусный белок. Семейство Togaviridae включает альфавирусы и рубивирусы. Представляющие интерес вирусы включают Sindbis вирус, вирусы восточного и западного энцефалита, Semliki Forest вирус, вирус краснухи, Aura вирус, Babanki вирус, Barmah Forest вирус avis-А, вирус Бебару, Buggy Creek вирус, вирус тропической лихорадки чикунгунья, Everglades вирус, Fort Morgan вирус, вирус Гета, Highlands J вирус, Kyzylagach вирус, Mayaro вирус, Middelburg вирус, Mucambo вирус, Ndumu вирус, Ockelbo вирус, вирус лихорадки о'ньонг-ньонг, Pixuna вирус, Ross River вирус, Sagiyama вирус, Una вирус, вирус венесуэльского лошадиного энцефалита и Whataroa вирус. Капсульный ("Е") гликопротеин флавивируса. Семейство Flaviviridae включает флавивирусы, пестивирусы и гепацивирусы. Представляющие интерес вирусы включают вирус лихорадки денге, вирус гепатита С, вирус желтой лихорадки, вирус японского энцефалита, вирус Западного Нила, вирус энцефалита Сент-Луис, вирус бычьей диареи и вирус клещевого энцефалита (ТВЕ). Буньявирусный белок. Семейство Bunyaviridae включает буньявирусы, наировирусы, флебовирусы,хантавирусы и тосповирусы. Представляющие интерес вирусы включают буньявирус, вирусBunyamwera, вирус калифорнийского энцефалита, La Cross вирус, Hantaan вирус, Sin Nombre вирус, вирус Крым-Конго геморрагической лихорадки, вирус лихорадки Sandfly fever Sicilian и вирус лихорадки долины Рифт. Аренавирусный белок. Семейство Arenaviridae включает вирус лимфоцитарного хориоменингита,вирус Иппи и вирус Ласса. Гепаднавирусный белок (в том числе HBsAg). Семейство Hepadnaviridae включает ортогепаднавирусы и авигепаднавирусы. Наряду с вирусом человеческого гепатита В, это семейство вирусов включает вирус гепатита В сусликов, вирус гепатита В лесного сурка, вирус гепатита В шерстистой обезьяны, вирус гепатита арктической белки, вирус гепатита В уток, вирус гепатита В цапли и вирус гепатита В гусей Росс. Белок вируса герпеса. Семейство Herpesviridae включает симплексвирусы, варицелловирусы, розеоловирусы, цитомегаловирусы, муромегаловирусы, лимфокриптовирусы и радиновирусы. Представляющие интерес вирусы включают вирусы человеческого герпеса, в том числе вирусы простого герпеса(HSV), Varicella-zoster вирус (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), вирус герпеса 6 человека (HHV6), вирус герпеса 7 человека (HHV7) и вирус герпеса 8 человека (HHV8) и т.д. Пригодные антигены могут быть избраны из гликопротеинов gB, gC, gD и gH (например, в HSV). В особенности предпочтителен HSV gD2. Ортомиксовирусный белок. Семейство Orthomyxoviridae включает вирус гриппа и вирусы thogoto. Антигены из вирусов гриппа являются предпочтительными (вирус гриппа А, В или С), включая поверх- 14014314 ностные антигены гемагглютинин (НА) и/или нейраминидазу (NA). Эти вирусные поверхностные антигены обычно очищают с использованием поверхностноактивных веществ, и тем самым антигенный компонент может включать поверхностно-активное вещество, в особенности если он находится в корпускулярной форме, включая липиды. Изобретение также применимо с корпускулярными антигенами, основанными на гибридных или составных белках, которые включают вирусный поверхностный антиген и гетерологичный антиген. Например, известно присоединение HBsAg последовательности к гетерологичным антигенам, чтобы использовать способность HBsAg собираться в частицы. Например, работа в ссылке 63 сообщает об интеграции HIV-1 gp120 с HBsAg с образованием белка,который самопроизвольно собирается в частицы, которые похожи на частицы нативного HBsAg по размеру и плотности, совпадающие по липидному составу примерно на 25% и с содержанием gp120 примерно 100 на частицу. Белок gp120 был способен сворачиваться в свою нативную конформацию при сшивании и сохранял свою биологическую активность. Подобным образом, HIV gp41 эпитопы были улучшены выполнением внутренних сшивок с HBsAg, и составной белок включался в самосборку в дрожжах с образованием липопротеиновых частиц размером 22 нм [ссылка 64]. Этот подход был также использован для малярийных вакцин. Работа в ссылке 65 сообщает, что эпитопы до 61 аминокилоты (аа) из малярийного gp190 антигена были введены в последовательностьHBsAg и что экспрессированные гибридные частицы могли вызывать анти-gp190 иммунный ответ у животных. Работа в ссылке 66 сообщает о белке, имеющем 16 повторений 4-мерной последовательности циркумспорозоитного (circumsporozoite) белка, экспрессированного как составной белок с HBsAg. Работа в ссылке 67 сообщает о продуцировании в дрожжах вирусоподобных частиц, состоящих из Pfs16,конъюгированного с HBsAg. Работа в ссылке 68 представляет гибридный антиген, в котором циркумспорозоитный (circumsporozoite) белок конъюгирован с HBsAg. Работа в ссылке 69 представляет конъюгацию С-концевой области мерозоитного (merozoite) поверхностного белка 1 из P.vivax, который образует иммуногенные частицы размером 20-45 нм. Применение HBsAg для представленных малярийных антигенов в самособираемой корпускулярной форме поэтому хорошо известно в данной области. Таким образом, изобретение может быть использовано с гибридными антигенами, которые включают вирусный поверхностный антиген и гетерологичный антиген. Гетерологичный антиген может быть внедрен в последовательность вирусного поверхностного антигена, или может быть конъюгирован с Nконцевым или С-концевым фрагментом последовательности вирусного поверхностного антигена. Если нативный вирусный поверхностный антиген может собираться в частицы (например, HBsAg), то внедрение или конъюгирование не будет препятствовать этой сборке. В этих гибридных белках гетерологичный антиген может быть из бактерии, из грибка, из паразита,из вируса (но, по определению, гетерологичный антиген не является HBsAg) и т.д. Возможно включение полного гетерологичного антигена в гибридный белок, но более обычным является включение антигенного фрагмента из антигена. В особенности там, где вирусный поверхностный антиген представляет собой HBsAg, гетерологичный антиген может быть из HIV, Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae илиPlasmodium ovale. Подходящие HIV антигены для приготовления HBsAg-гибридов включают капсульный гликопротеин gp120 или его антигенные фрагменты [ссылка 63]. Пригодные P.falciparum антигены для приготовления HBsAg-гибридов могут быть основаны на субъединице циркумспорозоитного (circumsporozoite) поверхностного антигена ("CSP"), например они могут включать от 3 до 20 повторов ихNANP-фрагмента (идентификатор последовательности SEQ ID NO: 2), и/или они могут включать Сконцевую область CSP (но типично не включая концевые 12 аминокислот из С-конца). Например, изобретение может использовать антиген, известный как "RTS", который содержит большую часть С-концаHBsAg четырьмя аминокислотами из pre32 части HBsAg. Будучи экспрессированным в дрожжах, RTS формирует частицы, которые включают липиды (первоначально фосфолипид) в дополнение к белку. Последовательность RTS тем самым может содержать: (i) N-концевой метиониновый остаток; (ii) Met-AlaPro; (iii) 189 аминокислот, соответствующих либо аминокислотам 210-398 CS-белка из P.falciparum 7G8,либо аминокислотам 207-395 CS-белка из P.falciparum NF54; (iv) Arg или Gly; (v) Pro-Val-Thr-Asn из preS2 белка гепатита В и (vi) HBsAg. Выделенный из 7G8 полный RTS имеет последовательность, приведенную как SEQ ID NO:1 в ссылке 70 (см. также фиг. 5 в ссылке 71): Гибридный белок может быть экспрессирован в дрожжах, с использованием последовательности,- 15014314 кодирующей SEQ ID NO:1. Предпочтительно соэкспрессировать гибридный белок в дрожжах с нормальным HBsAg. Этот подход был ранее использован с RTS, и продукт соэкспрессии обозначается как"RTS,S". Применимо соотношение RTS:S примерно 1:4. Предпочтительна экспрессия в дрожжах S. cerevisiae с использованием плазмиды, имеющей последовательность, кодирующую гибридный белок, и включающей: (1) вышерасположенный промотор из гена глицеральдегид-3-фосфатдегидрогеназы, для контролируемой экспрессии кодирующей последовательности; и (2) ARG3 транскрипционный терминатор, расположенный ниже кодирующей последовательности. Эти плазмиды обычно также включают: (3)RTS,S может быть комбинирован с другими малярийными антигенами, такими как родственный тромбоспондину анонимный белок (TRAP). Предпочтительный алифатический адъювант для использования с RTS,S включает эмульсию типа "масло в воде", 3D-MPL и QS-21 сапонин. Соотношение алифатического адъюванта и поверхностно-активного вещества Во втором аспекте изобретения весовое отношение в композиции алифатического адъюванта к поверхностно-активному веществу антигена составляет менее чем 1000:1. Для адъюванта MF59 весовое соотношение основывается на количестве сквалена. Для композиции,содержащей 0,1 мкг/мл поверхностно-активного вещества в антигенном компоненте, концентрация сквалена составляет менее чем 100 мкг/мл. Для композиции, содержащей 1 мкг/мл поверхностно-активного вещества в антигенном компоненте, концентрация сквалена составляет менее чем 1 мг/мл. Для композиции, содержащей 10 мкг/мл поверхностно-активного вещества в антигенном компоненте, концентрация сквалена составляет менее чем 10 мг/мл, тогда как концентрация сквалена в типичной композиции сMF59 как адъювантом должна быть 43 мг/мл (то есть 4300:1). Для адъюванта 3D-MPL весовое соотношение основывается на общем количествое 3D-MPL, то есть включая все из различных ацильных форм, которые могут присутствовать. Для композиции, содержащей 0,1 мкг/мл поверхностно-активного вещества в антигенном компоненте, общая концентрация 3D-MPL составляет менее чем 100 мкг/мл. Для композиции, содержащей 1 мкг/мл поверхностно-активного вещества в антигенном компоненте, общая концентрация 3D-MPL составляет менее чем 1 мг/мл. Соотношение 1000:1 является максимальным. Для дальнейшего сокращения возможностей интерференции между маслом в адъюванте и поверхностно-активным веществом в антигене соотношение может быть уменьшено. Так, соотношение может быть 500:1, 400:1, 300:1, 200:1, 100:1, 50:1 или даже 25:1. При соотношении 100:1 композиция, содержащая 10 мкг/мл поверхностно-активного вещества в антигенном компоненте, должна иметь содержание масла (например, содержание сквалена или 3D-MPL) 1 мг/мл. При соотношении 25:1 композиция, содержащая 10 мкг/мл поверхностно-активного вещества в антигенном компоненте, должна иметь содержание масла (например, содержание сквалена или 3D-MPL) 250 мкг/мл; и наоборот, композиция, включающая 100 мкг/мл 3D-MPL, должна иметь не менее чем 4 мкг/мл поверхностно-активного вещества как части антигена. Предпочтительно соотношение выше чем 1,5:1, например 2:1, 2,5:1, 3:1, 4:1, 5:1 или более. Для 3D-MPL соотношение 2,5:1-25:1 является предпочтительным, более предпочтительно 2,5:1 10:1, и еще более предпочтительно между 2,5:1-5:1. Так, композиция, содержащая 10 мкг/мл поверхностно-активного вещества в антигенном компоненте, должна иметь содержание 3D-MPL 25-250 мкг/мл,предпочтительно 25-100 мкг/мл и еще более предпочтительно 25-50 мкг/мл; и наоборот, композиция,включающая 100 мкг/мл 3D-MPL, должна включать антиген, имеющий содержание поверхностноактивного вещества 4 мкг/мл - 40 мкг/мл, предпочтительно 10-40 мкг/мл и еще более предпочтительно 20- 40 мкг/мл. Иммуногенная композиция Наряду с содержанием антигена и алифатического адъюванта (и, во втором аспекте, низкого уровня поверхностно-активного вещества), композиции согласно изобретению могут включать носители, адъюванты, наполнители, буферы и т.д., как более подробно описано ниже. Эти неантигенные компоненты могут иметь различные источники. Например, они могут присутствовать в одном из материалов антигенов или адъювантов, которые используются во время получения, или могут быть добавлены отдельно от этих компонентов. Предпочтительные композиции согласно изобретению включают один или несколько фармацевтических носителя(-ей) и/или наполнителя(-ей). Для регулирования тоничности предпочтительно включение физиологической соли, такой как натриевая соль. Предпочтителен хлорид натрия (NaCl), который может присутствовать в количестве 1-20 мг/мл. Композиции в общем имеют осмотическую концентрацию между 200 и 400 мОсм/кг, предпочтительно между 240 и 360 мОсм/кг, более предпочтительно в пределах интервала 280-320 мОсм/кг. Осмоляльность была ранее описана как не оказывающая влияния на боль, вызываемую вакцинацией [ссылка 72], но тем не менее предпочтительно удерживать осмоляльность в этом интервале. Композиции согласно изобретению могут включать один или несколько буферов. Типичные буфе- 16014314 ры включают: фосфатный буфер; Трис-буфер; боратный буфер; сукцинатный буфер; гистидиновый буфер или цитратный буфер. Буферы типично включаются в диапазоне концентраций 5-50 мМ и предпочтительно в диапазоне 5-20 мМ. Величина рН композиции согласно изобретению в общем составляет 5,0-7,5, и более типично 5,06,0 для оптимальной стабильности, или 6,0-7,0. Способ согласно изобретению поэтому может включать стадию регулирования величины рН в полном объеме вакцины перед ее упаковкой в контейнерыдозаторы. Вакцина, содержащая дифтерийный и столбнячный анатоксины, предпочтительно имеет величину рН 6, во избежание риска возврата токсичности анатоксинов (в особенности в дифтерийном анатоксине), и тем самым вакцина, содержащая анатоксины и HBsAg антигены, предпочтительно имеет величину рН 6,0-7,0. Для других вакцин, включая моновалентные HBsAg вакцины, величина рН 6 может быть приемлемой. Композиции согласно изобретению предпочтительно являются стерильными. Композиции согласно изобретению предпочтительно являются апирогенными, например, содержащими 1 EU (единиц эндотоксина, стандартная мера) на дозу, и предпочтительно 0,1 EU на дозу. Композиции согласно изобретению предпочтительно не содержат глютена. Если HBsAg применяется адсорбированным, конечный вакцинный продукт может быть суспензией с мутным внешним видом. Этот внешний вид означает, что микробиальное загрязнение не является легкоразличимым визуально и что вакцина преимущественно содержит антимикробное средство. Это в особенности важно, когда вакцина упаковывается в контейнеры для многократного приема. Предпочтительные консерванты для включения представляют собой 2-феноксиэтанол и/или тимеросал (Thimerosal). Однако рекомендуется не применять ртутные консерванты в способе согласно изобретению, даже если тимеросал находится во многих существующих вакцинах. Однако для надежности предпочтительно, что конечная композиция содержит менее чем примерно 25 нг/мл ртути. Более предпочтительно, что конечный вакцинный продукт не содержит определяемого количества тимеросала. В общем это достигается удалением ртутного консерванта при приготовлении антигена до его добавления в способе согласно изобретению, или без применения тимеросала во время получения компонентов, используемых для составления композиции. HBsAg может быть подвергнут диализу (например, с цистеином) для удаления любых ртутных консервантов, таких как тимеросал, который мог быть использован в ходе полученияHBsAg [ссылки 73, 74]. В ходе получения разбавление компонентов с образованием желаемых конечных концентраций обычно выполняется с использованием воды для инъекций (WFI). Концентрация любого фосфата алюминия в композиции согласно изобретению, выраженная в расчете на Al3+, составляет предпочтительно менее чем 5 мг/мл, например 4, 3, 2, 1 мг/мл и т.д. Концентрация HBsAg в композиции согласно изобретению предпочтительно составляет менее чем 100 мкг/мл, например 90, 80, 70, 65, 60, 55, 50, 45, 40 мкг/мл и т.д. Типична концентрация примерно 40 мкг/мл или примерно 20 мкг/мл. Композиции согласно изобретению предпочтительно вводятся пациентам в дозах по 0,5 мл. Обозначение доз как 0,5 мл понимается как включающее нормальное отклонение, например 0,5 мл 0,05 мл. Изобретение может представлять нефасованный материал, который пригоден для упаковывания на индивидуальные дозы, которые могут быть затем распределены для введения пациентам. Концентрации,упомянутые выше, типично являются концентрациями в конечной упакованной дозе, и тем самым концентрации в полной вакцине могут быть выше (например, могут быть понижены до конечной концентрации путем разбавления). Композиции согласно изобретению в общем представлены в водной форме. Упаковывание композиций согласно изобретению После комбинирования антигена и адъюванта, способы согласно изобретению могут включать стадию выборки и упаковывания 0,5-миллилитрового образца смеси в контейнер. Для случаев многоразового употребления количества многоразовых доз выбираются и упаковываются вместе в один контейнер. Как упомянуто выше, в альтернативной компоновке антиген и адъювант упаковываются по отдельности,для смешивания непосредственно перед моментом использования. Способы согласно изобретению могут включать дополнительную стадию упаковки вакцины в контейнеры для использования. Пригодные контейнеры включают микропробирки (виалки) и одноразовые шприцы (предпочтительно стерильные шприцы). Когда композиция согласно изобретению упаковывается в микропробирки, они предпочтительно изготавливаются из стекла или пластического материала. Микропробирка предпочтительно стерилизуется перед внесением в нее композиции. Во избежание проблем с пациентами, чувствительными к латексу,микропробирки предпочтительно закупориваются пробкой, не содержащей латекса. Микропробирка может включать однократную дозу вакцины, или она может включать более чем одну дозу ("мультидозовая" микропробирка), например 10 доз. Когда используется мультидозовая микропробирка, каждая доза должна извлекаться стерильными иглой и шприцем при строго асептических условиях, соблюдая предосторожности во избежание загрязнения содержимого микропробирки. Предпочтительные микропро- 17014314 бирки изготавливаются из бесцветного стекла. Микропробирка может иметь крышку (например, наконечник Люэра), приспособленную так, что предварительно наполненный шприц может быть введен в крышку, содержимое шприца может быть вытеснено в микропробирку, и содержимое микропробирки может быть удалено обратно в шприц. После удаления шприца из микропробирки затем может быть присоединена игла, и композиция может быть введена пациенту. Крышка предпочтительно располагается внутри уплотнения или колпачка так, что уплотнение или колпачок должны быть удалены, прежде чем может быть открыт доступ к крышке. Там, где композиция упаковывается в шприц, который предпочтителен, шприц, как правило, не имеет присоединенной к нему иглы, хотя игла отдельно может быть поставлена со шприцем для сборки и употребления. Предпочтительны безопасные иглы. Типичны 1-дюймовые иглы 23-его размера, 1 дюймовые иглы 25-ого размера и 5/8-дюймовые иглы 25 размера. Шприцы могут быть поставлены с отрывными этикетками, на которых могут быть напечатаны номер партии и дата истечения срока годности содержимого, для облегчения ведения учета. Поршень в шприце предпочтительно имеет ограничитель для предотвращения случайного извлечения во время отсасывания. Предпочтителен ограничитель поршня из бутилкаучука. Шприцы могут иметь крышку и/или поршень из латексного каучука. Одноразовые шприцы содержат однократную дозу вакцины. Шприц в общем имеет крышку на наконечнике, чтобы закрывать наконечник до подсоединения иглы, и крышка на наконечнике предпочтительно сделана из бутилкаучука. Если шприц и игла упаковываются отдельно, то игла предпочтительно снабжается защитным щитком из бутилкаучука. Предпочтителен серый бутилкаучук. Предпочтительны такие шприцы,которые продаются под торговым наименованием "Tip-Lok". Если используется стеклянный контейнер (например, шприц или микропробирка), то является предпочтительным применение контейнера, изготовленного из боросиликатного стекла, нежели из натриево-кальциевого стекла. После того как композиция упаковывается в контейнер, контейнер может быть затем помещен в коробку для распределения, например внутрь картонной коробки, и коробка маркируется с подробностями о вакцине, например ее торговое наименование, список антигенов в вакцине (например, "гепатит В рекомбинант", и т.д.), информация о контейнере (например, "Одноразовые предварительно заполненные шприцы Tip-Lok" или "Микропробирки с однократными дозами 100,5 мл"), его доза (например, "каждая содержит одну дозу 0,5 мл"), предостережения (например, "Только для применения взрослыми" или"Только для педиатрического употребления"), дата истечения срока годности, показания (например, "активная иммунизация против инфицирования вирусом гепатита В (HBV), вызываемого всеми известными субтипами для пациентов с почечной недостаточностью (включая пре-гемодиализ и гемодиализ), для пациентов старше 15 лет", и т.д.), номер патента, и т.д. Каждая коробка может содержать более чем одну упакованную вакцину, например пять или десять упакованных вакцин (в особенности для микропробирок). Если вакцина содержится в шприце, то на коробке может быть картинка с изображением шприца. Вакцина может быть распределена совместно (например, в одной и той же коробке) с брошюрой,включающей подробности о вакцине, например инструкции по употреблению, подробности об антигенах в вакцине и т.д. Инструкции могут также содержать предостережения, например, о том, чтобы держать раствор адреналина в легкодоступном месте в случае анафилактической реакции после вакцинации, и т.д. Упакованная вакцина предпочтительно хранится при температуре 2 С - 8 С. Ее не следует замораживать. Способы лечения и введения вакцины Композиции согласно изобретению пригодны для введения пациентам, и изобретение представляет способ повышения иммунного ответа у пациента, включающий стадию введения композиции согласно изобретению пациенту. Изобретение также представляет композицию согласно изобретению для применения в медицине. Изобретение также представляет применение (i) антигена, очищенного по существу в отсутствие поверхностно-активного вещества, и (ii) алифатического адъюванта в производстве лекарственного средства для введения пациенту. Изобретение также представляет применение (i) антигенного компонента, который включает поверхностно-активное вещество, и (ii) алифатического адъюванта в производстве лекарственного средства для введения пациенту, в котором весовое отношение алифатического адъюванта в (ii) к поверхностноактивному веществу в (i) составляет менее чем 1000:1. Иммуногенные композиции согласно изобретению предпочтительно представляют собой вакцины,например, для использования в профилактике и/или лечении вирусной инфекции гепатита В. Пациенты,которые получили композиции согласно изобретению, предпочтительно имеют геометрическое значение(GM) титра анти-HBsAg сыворотки 500 мМЕ/мл (mIE/ml, милли-международных единиц на мл), измеренное через 6 недель после первой иммунизации. Более предпочтительно титр составляет 500 мМЕ/мл,когда измерение проводится через 12 месяцев. Композиции в особенности применимы для защиты против и/или лечения вирусных инфекций ге- 18014314 патита В у пациентов, для которых существующие адъювантные вакцины (такие как продукт ENGERIX В) неэффективны. Субгруппы пациентов, для которых композиции в особенности пригодны, включают: пациенты с иммунной недостаточностью; пациенты, находящиеся на гемодиализе; пациенты перед гемодиализом; пациенты с почечной недостаточностью; пациенты с отказом почек; пациенты с отказом почек на ранней стадии перед тем, как им потребуется гемодиализ; пациенты в ожидании трансплантации печени, например, находящиеся в листе ожидания; пациенты на конечной стадии почечной недостаточности; пациенты, которые получили орган-трансплантат (в особенности трансплантат печени), например, в шестимесячный период, предшествующий первой дозе вакцины согласно изобретению; пациенты, которые получают (или получали, например, в шестимесячный период, предшествующий первой дозе вакцины согласно изобретению) лечение иммуноглобулином (HBIg) гепатита В; пациенты с гаплотипом HLA DQ3 [ссылка 75]; пациенты с гаплотипом HLA DR3 [ссылка 75]; пациенты с гаплотипомHLA DR7 [ссылка 75]; пациенты с HLA-аллелем DQBl0202 [ссылка 76]; пациенты, инфицированные ВИЧ; хронические носители вируса гепатита В (HBV); пациенты, которые недавно перенесли переливание крови; пациенты, получающие иммунодепрессивные препараты; пациенты, страдающие СПИДом; пациенты с асцитом; пациенты с циррозом печени; пациенты с энцефалопатией; пациенты, получающие лечение интерфероном, и в особенности inf-; пациенты, которые курят сигареты; пациенты, которые курят сигары; пациенты с индексом массы тела 30 кг/м 2; и пациенты, которые получали HBsAgвакцину, но не достигшие сероконверсии (например, они имеют титр анти-HBsAg сыворотки 10 мМЕ/мл после стандартного курса первичной дозировки, такого как 3 дозы ENGERIX В). Эти пациенты могут иметь скорость клиренса креатинина менее чем 30 мл/мин (нормальный здоровый диапазон составляет 100-140 мл/мин для мужчин и 90-130 мл/мин для женщин). Пациенты предпочтительно имеют возраст по меньшей мере 15 лет, например, между 15-40 годами, между 15-60 годами, между 40-60 годами, или даже свыше 60 лет. Пациенты старше 55 лет могут получать эффективное лечение независимо от любых испытываемых болезней. Композиции согласно изобретению могут быть введены внутримышечно, например в дельтовидную мышцу. Если композиции согласно изобретению включают адъювант на основе алюминия, во время хранения может происходить расслоение компонентов. Поэтому композицию следует встряхивать перед введением пациенту. Взболтанная композиция имеет вид мутной белой суспензии. Предпочтительные способы и вакцины согласно изобретению Предпочтительный способ получения иммуногенной композиции включает стадии комбинирования(i) HBsAg-компонента, который включает полисорбат 20, и (ii) адъювантного компонента, включающего 3D-MPL, адсорбированный на фосфате алюминия, с образованием композиции, в которой весовое отношение 3D-MPL к полисорбату 20 составляет менее чем 1000:1. Предпочтительная иммуногенная композиция представляет собой таковую, в которой: (а) композиция включает HBsAg, полисорбат 20, 3D-MPL и алюминийфосфатный адъювант; и (b) весовое отношение 3D-MPL к полисорбату 20 составляет менее чем 1000:1. 3D-MPL и HBsAg предпочтительно адсорбированы на фосфате алюминия. Концентрация HBsAg составляет примерно 40 мкг/мл. Концентрация 3D-MPL составляет примерно 100 мкг/мл. Концентрация ионов Al3+ составляет примерно 1 мг/мл. Еще одна предпочтительная композиция согласно изобретению включает (i) HBsAg, очищенный изS.cerevisiae, и (ii) адъювант, включающий смесь фосфата алюминия и 3D-MPL. Концентраци HBsAg составляет примерно 40 мкг/мл. Концентрация 3D-MPL составляет примерно 100 мкг/мл. Концентрация ионов Al3+ составляет примерно 1 мг/мл. HBsAg включает полисорбат 20, и весовое соотношение масло:поверхностно-активное вещество (то есть весовое соотношение 3D-MPL:полисорбат 20) составляет 2,5:1-100:1, то есть, полисорбат 20 присутствует на уровне 1-40 мкг/мл (то есть, 2,5-100 мкг полисорбата 20 на 100 мкг HBsAg). Соотношение предпочтительно составляет 2,5:1-25:1, то есть, полисорбат 20 присутствует на уровне 4-40 мкг/мл. Оба компонента 3D-MPL и HBsAg адсорбированы на фосфате алюминия. Обобщение Термин "включающий" охватывает понятие "заключающий в себе", а также "состоящий", например,композиция, "включающая" X, может состоять исключительно из X, или может включать что-нибудь дополнительное, например, X + Y. Слова "главным образом" не исключают понятия "полностью", например, композиция, которая"главным образом не содержит" Y, может вообще не содержать Y. Если необходимо, слова "главным образом" могут быть изъяты из определения изобретения. Термин "примерно" в отношении цифрового значения х означает, например, х 10%. Если иное не оговорено конкретно, способ, включающий стадию смешивания двух или более компонентов, не требует какого-либо определенного порядка смешивания. Таким образом, компоненты могут быть смешаны в любом порядке. Там, где наличествуют три компонента, два компонента могут быть смешаны друг с другом, и затем комбинация может быть соединена с третьим компонентом и т.д. Как описано выше, компоненты могут быть смешаны в ходе производства, или же непосредственно перед- 19014314 моментом употребления. Если антиген описывается как "адсорбированный" на адъюванте, то предпочтительно, что по меньшей мере 50% (по весу) этого антигена являются адсорбированными, например 50, 60, 70, 80, 90%, 95 98% или более. Предпочтительно, что HBsAg является полностью адсорбированным, то есть никакое его количество не определяется в надосадочной жидкости. Там, где животные (и, в частности, бычьи) материалы используются в культуре клеток, они должны быть получены из источников, которые свободны от инфекционных губчатых энцефалопатий (TSE), и в особенности свободны от бычьей губчатой энцефалопатии (BSE). Бутилкаучуки включают хлорбутил- и бромбутилкаучуки. Будет принято во внимание, что ионизируемые группы могут существовать в нейтральной форме,показанной здесь в формулах, или могут существовать в заряженной форме, например, в зависимости от величины рН. Таким образом, фосфатная группа может быть показана как -Р-О-(ОН)2, эта формула типична только для нейтральной фосфатной группы, и другие заряженные формы охватываются изобретением. Подобным образом углеводные циклы могут существовать в открытой и замкнутой форме, и, в то время как замкнутые формы показаны здесь в структурных формулах, открытые формы также охватываются изобретением. Способы осуществления изобретения Были изучены три различных варианта получения HbsAg.HBsAg, экспрессированный в клетках яичника китайского хомячка (СНО), с preS2 последовательностью, очищенный без использования поверхностно-активных веществ. Были изучены два различных адъюванта: гидроксид алюминия (1 мг/мл);MF5.9 в цитратном буфере (13 мМ). Были приготовлены шесть составов, каждый с 20 мкг/мл HBsAg, 0,15 мМ NaCl и 0,01% мертиолата:MF59 был описан как усиливающий гуморальный иммунный ответ у приматов на рекомбинантныйHBsAg [ссылка 77]. Составы от А до D были использованы для иммунизации африканских зеленых мартышек. Группы из 6 мартышек были иммунизированы внутримышечно на день 0 и день 28. Кровоизвлечения были сделаны на момент 0 и затем каждые 2 недели до недели 8, и титры анти-HBsAg (геометрические значения титров, GMT) были измерены с помощью иммуноферментного твердофазного анализа(ELISA). Титры были нормализованы к 1,0, данное значение было на 14 день в каждой группе, и нормализованные результаты были следующими: При рассмотрении титров дня 42 и дня 56, эти данные показывают, что адъювант MF59 повышал- 20014314 титры гораздо более заметно, чем алюминиевый адъювант для СНО-экспрессированного антигена (160 кратное повышение против 20-кратного повышения на 42 день), но ситуация была обратной для Hanensula-экспрессированного антигена (85-кратное повышение против 110-кратного на 42 день). Подобные эксперименты были выполнены на бабуинах с использованием составов В, Е и F. Значения GMT были измерены через 14 дней после первой инъекции и относительно значения группы F были следующими: Здесь использование MF59 вместо алюминиевого адъюванта ведет к более низкому GMT ответу(сравнивая группы Е и F) , тогда как следовало ожидать повышения (группа В и ссылка 77). Анти-HBsAg ответы на 28 день после первой инъекции с использованием составов Е и F были также сравнены на макаках-резус, африканских зеленых мартышках и мышах линии С 3 Н (примечание: мыши получали 60% дозы HBsAg). Как и измеренные значения GMT, было также измерено число респондеров, то есть животных, показавших титр 10 мМЕ/мл. Результаты, нормализованные по группе F, были следующими: В отличие от мышей, поэтому, применение MF59 в качестве адъюванта для приматов проявилось в существенном снижении как значений GMT, так и числа респондеров для S.cerevisiaeэкспрессированного HBsAg. Наконец, повышение GMT, происходящее от бустерной вакцинации составами Е и F, было измерено на серопозитивных африканских зеленых мартышках. Титры были измерены перед бустерной дозой и затем вновь через 28 дней, и повышение титров было следующим: Так же, как давая более низкий показатель повышения, чем для алюминийгидроксидного адъюванта, MF59 дал более низкое значение GMT на 28 день после бустерной дозы. Поэтому в целом MF59 представляется более худшим адъювантом, чем гидроксид алюминия, для экспрессированного в дрожжах HBsAg приматов, но лучшим адъювантом для СНО-экспрессированногоHBsAg. Эти результаты могут быть объяснены взаимодействием между (а) остаточным поверхностноактивным веществом в HBsAg, очищенном из дрожжей, и (b) избытком скваленового масла в адъювантеMF59. В качестве масла сквален подвергается воздействию поверхностно-активных веществ в водных условиях, и наоборот, предполагается, что поверхностно-активное вещество в антигене является несовместимым с маслом в адъюванте. С этой несовместимостью можно справиться либо очисткой HBsAg без использования детергентов (например, как в СНО-экспрессированном материале), либо обеспечением того, чтобы масло не присутствовало как таковое в избытке, который взаимодействует с поверхностно-активным веществом в антигене. В HBsAg-композициях с MF59 в качестве адъюванта один объем MF59 смешивается с одним объемом раствора антигена. В 100-миллилитровом объеме тем самым будут 50 мл MF59 и 50 мл раствораHBsAg. Эти 100 мл содержат 2,15 г сквалена из MF59 и, при концентрации HBsAg в 40 мкг/мл, они содержат 2 мг HBsAg. При концентрации полисорбата 20 в 25 мкг на 100 мкг HBsAg [ссылка 35], 100 мл содержат 0,5 мг полисорбата 20. Соотношение масло:поверхностно-активное вещество в типичной вакцине с MF59-адъювантом тем самым составляет 4300:1. Путем снижения избытка масла до менее чем 1000:1 взаимодействие между маслом в адъюванте и поверхностно-активным веществом в антигене мо- 21014314 жет быть существенно уменьшено, тем самым снижая интерференцию. Понятно, что изобретение было описано только с помощью примеров, и модификации могут быть сделаны в такой степени, пока будут оставаться в рамках и в смысле изобретения. Список цитированной литературы (содержание которой включается ссылками)- 23014314 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения иммуногенной композиции, включающий стадии комбинирования (i) антигенного компонента, который включает поверхностно-активное вещество, и (ii) алифатического адъювантного компонента, причем весовое отношение алифатического адъюванта к поверхностно-активному веществу в композиции составляет менее чем 1000:1. 2. Иммуногенная композиция, содержащая антигенный компонент, включающий поверхностноактивное вещество и алифатический адъювантный компонент, причем весовое отношение алифатического адъюванта к поверхностно-активному веществу в композиции составляет менее чем 1000:1. 3. Способ или композиция по п.1 или 2, в которых алифатический адъювант включает масло, преобразуемое в ходе обмена веществ. 4. Способ или композиция по п.3, в которых алифатический адъювант включает субмикронную эмульсию типа "масло в воде" сквалена и полисорбата 80. 5. Способ или композиция по п.1 или 2, в которых алифатический адъювант включает молекулу,включающую фрагмент алифатической кислоты. 6. Способ или композиция по п.5, в которых алифатический адъювант представляет собой 3 дезоксиацилированный монофосфориллипид A (3D-MPL). 7. Способ или композиция по п.6, в которых 3D-MPL представляет собой смесь молекул, различающихся по их ацилированию. 8. Способ или композиция по п.6 или 7, в которых алифатический адъювант включает 9. Способ или композиция по любому из пп.6-8, в которых 3D-MPL находится в форме частиц. 10. Способ или композиция по п.9, в которых частицы могут быть стерилизованы фильтрованием. 11. Способ или композиция по любому из пп.6-10, в которых 3D-MPL находится в комбинации с солью алюминия. 12. Способ или композиция по п.11, в которых соль алюминия представляет собой фосфат алюминия. 13. Способ или композиция по п.12, в которых 3D-MPL адсорбирован на соли алюминия. 14. Способ или композиция по любому из предшествующих пунктов, в которых поверхностноактивное вещество представляет собой полиоксиэтиленсорбитановый сложный эфир. 15. Способ или композиция по п.14, в которых сложный эфир представляет собой полисорбат 20. 16. Способ или композиция по п.14 или 15, в которых концентрация поверхностно-активного вещества не более чем 50 мкг/мл. 17. Способ или композиция по любому из предшествующих пунктов, в которых антиген представляет собой вирусный поверхностный антиген. 18. Способ или композиция по п.17, в которых антиген представляет собой корпускулярный поверхностный антиген гепатита В (HBsAg), очищенный в присутствии поверхностно-активного вещества. 19. Способ или композиция по п.18, в которых HBsAg экспрессирован в дрожжевой клетке. 20. Способ или композиция по п.19, в которых дрожжи представляют собой Saccharomyces cerevisiae. 21. Способ или композиция по любому из пп.18-20, в которых HBsAg является негликозилирован- 24014314 ным и/или включает фосфатидилинозит. 22. Способ или композиция по любому из пп.18-21, в которых HBsAg происходит из субтипа adw2 вируса гепатита В. 23. Способ или композиция по любому из предшествующих пунктов, в которых антиген представляет собой гибридный белок, включающий вирусный поверхностный антиген и гетерологичный антиген. 24. Способ или композиция по п.23, в которых вирусный поверхностный антиген представляет собой HBsAg, и гетерологичный антиген представляет собой малярийный антиген. 25. Способ или композиция по п.24, в которых гибридный белок включает HBsAg и фрагмент циркумспорозоитного белка Plasmodium falciparum. 26. Способ или композиция по п.25, в которых гибридный белок включает С-концевую частьP.falciparum циркумспорозоитного белка Plasmodium falciparum, четыре или более тандемных повтора иммунодоминантной области циркумспорозоитного белка и HBsAg. 27. Способ или композиция по любому из предшествующих пунктов, в которых весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 500:1. 28. Способ или композиция по любому из предшествующих пунктов, в которых весовое отношение алифатического адъюванта к поверхностно-активному веществу составляет менее чем 50:1. 29. Способ или композиция по любому из предшествующих пунктов, в которых алифатический адъювант представляет собой 3D-MPL, и весовое отношение алифатического адъюванта к поверхностноактивному веществу составляет 2,5:1-25:1. 30. Способ или композиция по любому из предшествующих пунктов, в которых композиция имеет осмоляльность 200-400 мОсм/кг. 31. Способ или композиция по любому из предшествующих пунктов, в которых композиция включает фосфатный буфер. 32. Способ или композиция по любому из предшествующих пунктов, в которых композиция имеет величину рН 6,0-7,0. 33. Применение (i) антигенного компонента, который включает поверхностно-активное вещество, и(ii) алифатического адъюванта в производстве лекарственного средства для введения пациенту, в котором весовое отношение алифатического адъюванта в (ii) к поверхностно-активному веществу в (i) составляет менее чем 1000:1. 34. Способ получения иммуногенной композиции, включающий стадии комбинирования (i) HBsAg компонента, который включает полисорбат 20, и (ii) адъювантного компонента, включающего 3D-MPL,адсорбированный на фосфате алюминия, причем весовое отношение 3D-MPL к полисорбату 20 в композиции составляет менее чем 1000:1. 35. Иммуногенная композиция, содержащая HBsAg, полисорбат 20, 3D-MPL и фосфат алюминия как адъювант, причем весовое отношение 3D-MPL к полисорбату 20 в композиции составляет менее чем 1000:1. 36. Способ получения иммуногенной композиции, включающий стадии комбинирования (а) антигена и алифатического адъюванта; и (b) антигена, который был очищен в отсутствие поверхностноактивного вещества.
МПК / Метки
МПК: A61K 39/39, A61K 39/29
Метки: пониженная, содержащими, интерференция, поверхностно-активные, между, антигенами, маслосодержащими, адъювантами, вещества
Код ссылки
<a href="https://eas.patents.su/28-14314-ponizhennaya-interferenciya-mezhdu-maslosoderzhashhimi-adyuvantami-i-antigenami-soderzhashhimi-poverhnostno-aktivnye-veshhestva.html" rel="bookmark" title="База патентов Евразийского Союза">Пониженная интерференция между маслосодержащими адъювантами и антигенами, содержащими поверхностно-активные вещества</a>
Предыдущий патент: Гербицидные средства и способ борьбы с ростом нежелательных растений
Случайный патент: Способ модификации некрахмального углеводного материала