Соединения бензо [α] пирано [3,2-h] акридин-7-она и фармацевтические композиции, содержащие их
Номер патента: 7790
Опубликовано: 27.02.2007
Авторы: Хикман Джон, Пфеффер Брюно, Тилликен Франсуа, Леонс Стефан, Ренар Пьер, Пьер Ален, Кох Мишель, Мишель Сильви
Формула / Реферат
1. Соединения формулы (I)
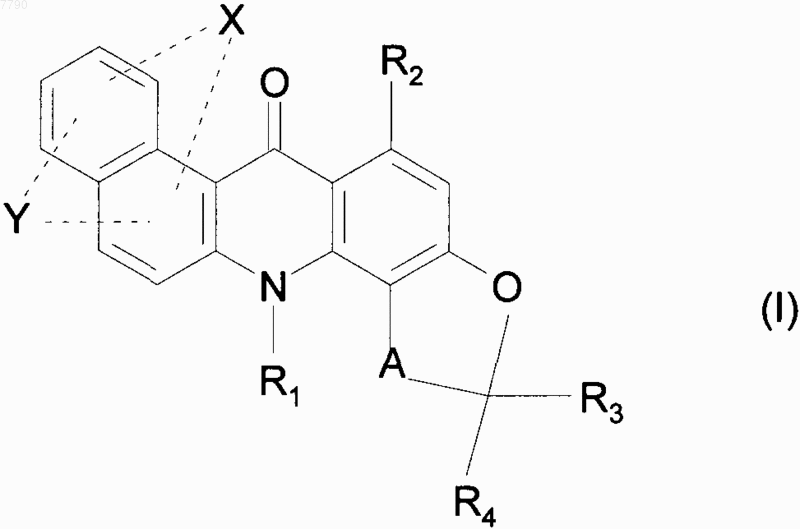
в которой
X и Y, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из водорода и атомов галогена,
причем подразумевают, что заместители X и Y могут присутствовать на любом из двух смежных бензольных колец,
R1 представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу,
R2 представляет собой группу, выбранную из атома водорода и -OR"a, где R"a представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С1-С6)алкильной группы,
R3 и R4, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, атом водорода или линейную или разветвленную (С1-С6)алкильную группу,
А представляет собой группу формулы
a) -CH(R5)-CH(R6)-,
в которой
R5 и R6, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из:
1) атома водорода,
2) ORc, NRcRd и SRc групп, в которых
Rc и Rd, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, линейной или разветвленной (С1-С6)алкильной группы и C(O)-Re группы, в которой Re представляет собой группу, выбранную из атома водорода и NR'"aR'"b, где R'"a и R'"b, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу,
3) W1-C(W2)-U-V, в которой:
a ) W1 представляет собой атом кислорода,
b ) W2 представляет собой атом кислорода,
g ) U представляет собой линейную или разветвленную (С1-С8)алкиленовую цепь или линейную или разветвленную (С2-С8)алкениленовую цепь,
d ) V представляет собой группу, выбранную из
атома водорода,
арильной группы,
CO2Rc,
4) W1-C(W2)-W3-T1, в которой:
a ) W1 и W2 принимают значения, указанные выше,
b ) W3 представляет собой NRс,
или R5 и R6 вместе образуют группу 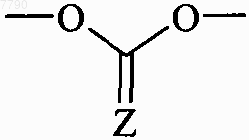 , в которой Z представляет собой атом кислорода,
, в которой Z представляет собой атом кислорода,
b) -CH=C(R7)- или -C(R7)=CH-, где R7 представляет собой атом водорода,
c) -C(O)-CH(R8)-, где R8 представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием,
при этом арил понимают в значении фенильной группы, необязательно содержащей один или более одинаковых или различных заместителей, выбранных из гидрокси, галогена, линейной или разветвленной (С1-С6)алкоксигруппы.
2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
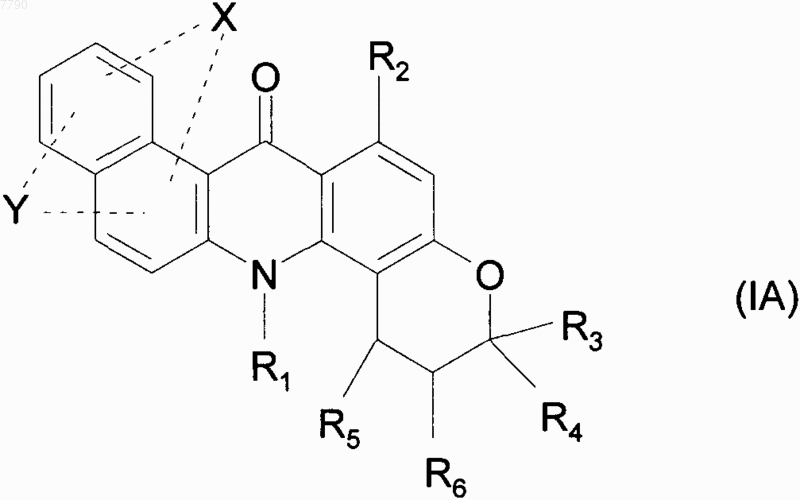
в которой X, Y, R1, R2, R3, R4, R5 и R6 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы -ORc, W1-C(W2)-U-V, W1-C(W2)-W3-T1, или R5 и R6 вместе образуют группу 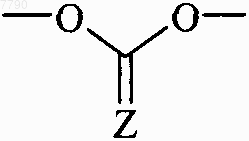 , в которой Rc, W1, W2, W3, U, V, T1 и Z принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rc, W1, W2, W3, U, V, T1 и Z принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 являются одинаковыми и каждый представляет собой группу формулы -ORc, в которой Rc представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по любому из пп.1-4, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U принимает значения, указанные для формулы (I), и V представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по любому из пп.1-5, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 представляет собой группу формулы -ORc, в которой Rc представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С1-С8)алкиленовую цепь и V представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по любому из пп.1-6, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 представляет собой группу формулы -ORc, или W1-C(W2)-U-V, в которой Rc представляет собой атом водорода, W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С1-С8)алкиленовую цепь и V представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С2-С8)алкениленовую цепь и V представляет собой атом водорода или арильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по любому из пп.1-7, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-W3-T1, в которой W1 и W2 каждый представляет собой атом кислорода, W3 представляет собой группу -NRc, в которой Rc представляет собой линейную или разветвленную (С1-С6)алкильную группу, и T1 представляет собой линейную или разветвленную (С1-С6)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлеьющ кислотой или основанием.
9. Соединения формулы (I) по любому из пп.1-8, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 вместе образуют группу 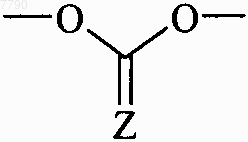 , в которой Z представляет собой атом кислорода, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Z представляет собой атом кислорода, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB)
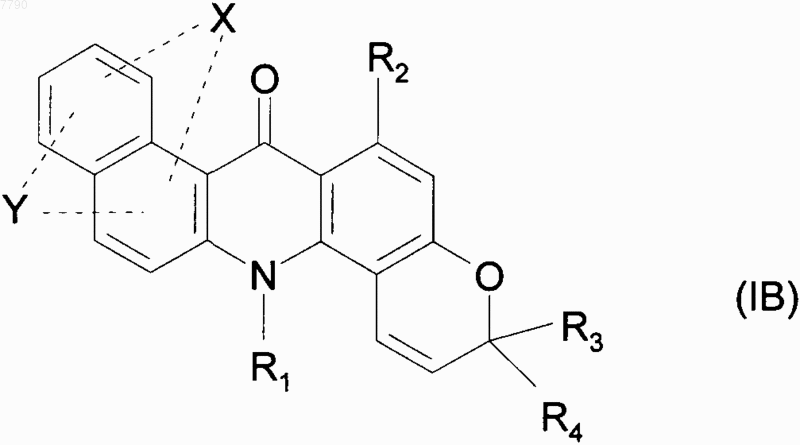
в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по любому из пп.1-10, отличающиеся тем, что R3 и R4 каждый представляет собой линейную или разветвленную (С1-С4)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по любому из пп.1-11, отличающиеся тем, что R3 и R4 каждый представляет собой метильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по любому из пп.1-12, отличающиеся тем, что R2 представляет собой группу -OR"a, где R"a принимает значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по любому из пп.1-13, отличающиеся тем, что X и Y каждый представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
15. Соединения формулы (I) по п.1, которые представляют собой
(+)-цис-1,2-дигидрокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[a]пирано[3,2-h]акридин-7-он,
(+)-цис-1,2-диацетокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[a]пирано[3,2-h]акридин-7-он,
(+)-цис-7-метокси-4,4,15-триметил-15,15с-дигидро-4H-бензо[a][1,3]диоксоло[4',5':4,5]пирано[3,2-h]акридин-2,8(3аH)-дион,
6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[a]пирано[3,2-h]акридин-7-он,
6-гидрокси-3,3,14-триметил-3,14-дигидро-7H-бензо[a]пирано[3,2-h]акридин-7-он,
6-гидрокси-3,3-диметил-3,14-дигидро-7H-бензо[a]пирано[3,2-h]акридин-7-он,
их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
16. Фармацевтические композиции, включающие в качестве активного компонента по крайней мере одно соединение по любому из пп.1-15 в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями.
17. Фармацевтические композиции по п.16, включающие по крайней мере один активный компонент по любому из пп.1-15, для использования в качестве лекарственных средств при лечении раковых опухолей.
Текст
Настоящее изобретение относится к новым соединениям бензо[]пирано[3,2-h]акридин-7-она, к способу их получения и к фармацевтическим композициям, содержащим их. Соединения настоящего изобретения являются производными акроницина, алкалоид которого обладает противоопухолевыми свойствами, что было продемонстрировано на экспериментальных моделях(J. Pharm. Sci., 1966, 55 (8), 758-768). Однако, несмотря на наличие весьма широкого спектра активности,акроницин обладает низкой эффективностью и умеренной активностью. Кроме того, растворимость соединения является низкой, что ограничивает его биологическую усвояемость, так же как и его использование в фармацевтических композициях для применения путем внутривенного введения. В молекуле были сделаны различные модификации, например, описанные в J. Med. Chem., 1996, 39,4762-4766 или ЕР 1042326, которые позволили значительно улучшить активность, противоопухолевую эффективность и растворимость продуктов. Тем не менее, противоопухолевая терапия требует постоянной разработки новых противоопухолевых препаратов с целью получения лекарственных средств, которые одновременно являются и более активными и лучше переносятся организмом. Более определенно,солидные опухоли составляют главную проблему для противоопухолевой химиотерапии по причине их свойственной и/или приобретенной устойчивости к существующим соединениям. Поэтому первоочередное значение имеет доступность самого широкого спектра соединений, которые показывают мощную цитотоксическую активность, для обеспечения наиболее эффективного лечения множества опухолевых заболеваний. Помимо того факта, что соединения настоящего изобретения являются новыми, они также обладают неожиданной in vitro и in vivo цитотоксической активностью, которая является большей, чем наблюдалась до настоящего времени. Соединения, открытые заявителем, соответственно обладают противоопухолевыми свойствами, которые делают их особенно полезными при лечении раковых опухолей. Среди типов раковых опухолей, которые могут лечиться соединениями настоящего изобретения, могут быть упомянуты, не подразумевая никакого ограничения, аденокарциномы и карциномы, саркомы, глиомы и лейкемии. Более определенно, настоящее изобретение относится к соединениям формулы (I)X и Y, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из водорода и атомов галогена,гидрокси, линейной или разветвленной (С 1-С 6)алкокси, нитро, циано, линейной или разветвленной(С 1-С 6)алкильной, линейной или разветвленной (С 2-С 6)алкенильной и линейной или разветвленной (С 1 С 6)полигалоалкильной группы и группы формулы -NRaRb, в которойRa и Rb, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, -C(O)-CF3, -C(O)-NH2 и линейной или разветвленной (С 1 С 6)алкильной группы, необязательно замещенной группой NR'aR'b, в которойR'a и R'b, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, линейной или разветвленной (С 1-С 6)алкильной группы,арильной группы и арил-(С 1-С 6)алкильной группы, в которой алкильный остаток является линейным или разветвленным,или R'a и R'b вместе с атомом азота, несущим их, образуют моноциклический, 5-7-членний гетероцикл, необязательно содержащий в циклической системе второй гетероатом, выбранный из кислорода и азота,или Ra и Rb вместе с атомом азота, несущим их, образуют моноциклический, 5-7-членний гетероцикл,необязательно содержащий в циклической системе второй гетероатом, выбранный из кислорода и азота,причем подразумевают, что заместители X и Y могут присутствовать на любом из двух смежных бензольных колец,R1 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,R2 представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы; -OR"a; -NR'aR'b; -O-Ta-OR"a; -NR"a-Ta-NR'aR'b; -NR"a-C(O)-TaH; -O-C(O)-TaH; -O-TaNR'aR'b; -NR"a-Ta-OR"a; -NR"a-Ta-CO2R"a ; и -NR"a-C(O)-Ta-NR'aR'b групп, в которыхTa представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,-1 007790R'a и R'b принимают значения, указанные выше,R"a представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1 С 6)алкильной группы,R3 и R4, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, или R3 и R4, вместе с атомом углерода несущим их, образуют моноциклическую, 3-6-членную циклическую группу,А представляет собой группу формулы:R5 и R6, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из 1) атома водорода,2) ORc, NRcRd и SRc групп, в которыхRc и Rd, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, линейной или разветвленной (С 1-С 6)алкильной группы,арильной группы и арил-(С 1-С 6)алкильной группы, в которой алкильный остаток является линейным или разветвленным, и C(O)-Re группы, в которой Re представляет собой группу, выбранную из атома водорода, арильной группы и NR'"aR'"b группы, где R'"a и R'"b, которые могут быть одинаковыми или разными,каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,или R'"a и R'"b, вместе с атомом азота, несущим их, образуют моноциклический 5-7-членный гетероцикл,необязательно содержащий в циклической системе второй гетероатом, выбранный из кислорода и азота,3) W1-C(W2)-U-V, в которой:) W1 представляет собой атом кислорода, атом серы или NRc (в которой Rc принимает значения,указанные выше),) W2 представляет собой атом кислорода или атом серы,) U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь или линейную или разветвленную (С 2-С 8)алкениленовую цепь,) V представляет собой группу, выбранную из атома водорода,арильной группы,ORc, CO2Rc, CORc, CONR'aR'b, NR'aR'b, N(Rc)-CO2R'c и N(Rc)-COR'c групп, в которых R'a, R'b и Rc принимают значения, указанные выше и R'c представляет собой группу, выбранную из атома водорода,линейной или разветвленной (С 1-С 6)алкильной группы, арильной группы и арил-(С 1-С 6)алкильной группы, в которой алкильный остаток является линейным или разветвленным,) U представляет собой связь, когда W2 не представляет собой атом кислорода и когда одновременно V не представляет собой группу, выбранную из атома водорода,арильной группы,-NH2,4) W1-C(W2)-W3-T1, в которой:) W1 и W2 принимают значения, указанные выше,) W3 представляет собой атом кислорода, атом серы или NRc, где Rc принимает значения, указанные выше,) T1 представляет собой группу, выбранную из атома водорода,линейной или разветвленной (С 1-С 6)алкильной группы,линейной или разветвленной (С 2-С 6)алкенильной группы,арила, арил-(С 1-С 6)алкильной группы, в которой алкильный остаток является линейным или разветвленным,линейной или разветвленной (С 1-С 6)алкиленовой цепи и линейной или разветвленной (С 2 С 6)алкениленовой цепи, причем каждая замещена ORc группой, в которой Rc принимает значения, указанные выше, или замещена группой NR'aR'b, в которой R'a и R'b принимают значения, указанные выше,5) W1-S(O)n-W3-T1, в которой:) W1, W3 и T1 принимают значения, указанные выше,) n представляет собой целое число, выбранное из 1 и 2,6) W1-S(O)n-U'-V', в которой:) U' представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь или линейную или разветвленную (С 2-С 8)алкениленовую цепь,) V' представляет собой группу, выбранную из атома водорода,арильной группы,-2 007790) W1 и n принимают значения, указанные выше,7) C(W2)-T1, в которой W2 и T1 принимают значения, указанные выше,или R5 и R6 вместе образуют 1) группу или в которых Z представляет собой атом кислорода или атом серы,2) группу -O-(СН 2)m-O-, в которой m представляет собой целое число от 1 до 4 включительно,3) группу или в которой В представляет собой простую связь, линейную или разветвленную (С 1-С 6)алкиленовую цепь или линейную или разветвленную (С 2-С 6)алкениленовую цепь,или R5 и R6 вместе с атомами углерода, несущими их, образуют оксирановую группу или азиридиновую группу, необязательно замещенную на атоме азота линейной или разветвленной (С 1-С 6)алкильной группой,b) -CH=C(R7)- или -C(R7)=CH-, в которых R7 представляет собой группу, выбранную из атома водорода,OR"a, W1-C(W2)-U-V, W1-C(W2)-W3-T1, W1-S(O)n-W3-T1, W1-S(O)n-U'-V', и C(W2)-T1 групп, в которых R"a, W1, W2, W3, U, V, U', V, T1 и n принимают значения, указанные выше, или с) -C(O)-CH(R8)- или -CH(R8)-C(O)-, в которых R8 представляет собой группу, выбранную из атома водорода,линейной или разветвленной (С 1-С 6)алкилкарбонилокси и OR"a групп, где R"a принимает значения,указанные выше,к их энантиомерам, диастереоизомерам и N-окисям, а также к их солям присоединения с фармацевтически приемлемой кислотой или основанием, арил понимают в значении фенильной или нафтильной группы, необязательно содержащей один или более, одинаковых или различных, заместителей, выбранных из гидрокси, галогена, карбокси, нитро, амино, линейной или разветвленной (С 1-С 6)алкиламино,ди(С 1-С 6)алкиламино, в которой каждый алкильный остаток может быть линейным или разветвленным,линейной или разветвленной (С 1-С 6)алкокси, линейной или разветвленной (С 1-С 6)ацильной и линейной или разветвленной (С 1-С 6)алкилкарбонилоксигруппы. Из числа моноциклических, от 5- до 7-членных гетероциклов, необязательно содержащих в циклической системе второй гетероатом, выбранный из кислорода и азота, могут быть упомянуты, не ограничиваясь представленными примерами, группы пирролидил, изоксазолидил, оксазолидил, пиразолидил,имидазолил, пиперидил, оксазинил, морфолил, гексагидропиридазил, гексагидропиримидил, пиперазил,азепанил, оксазепанил, диазепанил. Из числа моноциклических, от 3- до 6-членных циклических групп, могут быть упомянуты, не ограничиваясь представленными примерами, группы циклопропильная, циклобутильная, циклопентильная и циклогексильная. Из числа фармацевтически приемлемых кислот могут быть упомянуты, не ограничиваясь представленными примерами, хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота,малеиновая кислота, лимонная кислота, аскорбиновая кислота, щавелевая кислота, метансульфоновая кислота, бензолсульфоновая кислота, камфорная кислота, лизин и т.д Из числа фармацевтически приемлемых оснований могут быть упомянуты, не ограничиваясь представленными примерами, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д Согласно преимущественному воплощению изобретения предпочтительные соединения представляют собой соединения формулы (IA) в которой X, Y, R1, R2, R3, R4, R5 и R6 принимают значения, указанные для формулы (I). Предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 и R6,которые могут быть одинаковыми или разными, каждый представляет собой группу формулы -ORc, W1W2, W3, U, V, T1 и Z принимают значения, указанные для формулы (I). Особенно преимущественно предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 и R6 являются одинаковыми и каждый представляет собой группу формулы -ORc,в которой Rc представляет собой атом водорода. Также особенно преимущественно предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U принимает значения, указанные для формулы (I), и V представляет собой атом водорода или U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь и V представляет собой группу NR'aR'b, в которой R'a и R'b, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу. Наиболее преимущественно предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 представляет собой группу формулы -ORc, в которой Rc представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь и V представляет собой атом водорода. Также наиболее преимущественно предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 представляет собой группу формулы -ORc, или W1-C(W2)-U-V, в которойRc представляет собой атом водорода, W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь и V представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 2-С 8)алкениленовую цепь иV представляет собой атом водорода или арильную группу. Преимущественно предпочтительные соединения формулы (IA) представляют собой соединения, в которых R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-W3-T1, в которой W1 и W2 каждый представляет собой атом кислорода, W3 представляет собой группу -NRc, в которой Rc представляет собой линейную или разветвленную (С 1 С 6)алкильную группу, и T1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу. Также очень преимущественно предпочтительные соединения формулы (IA) представляют собой, в которой Z представляет собой атом соединения, в которых R5 и R6 вместе образуют группу кислорода. Согласно второму преимущественному воплощению изобретения, предпочтительные соединения представляют собой соединения формулы (IB) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные для формулы (I). Заместители R3 и R4, которые являются предпочтительными согласно изобретению, представляют собой линейные или разветвленные (С 1-С 6)алкильные группы. Даже более преимущественно заместители R3 и R4, которые являются предпочтительными согласно изобретению, представляют собой метильные группы. Заместители R2, которые являются предпочтительными согласно изобретению, представляют собой-OR"a и -NR"a-Ta-NR'aR'b группы, в которых R'a, R'b, R"a и Та принимают значения, указанные для формулы (I). Даже более преимущественно заместители R2, которые являются предпочтительными согласно изобретению, представляют собой группу -OR"a, в которой R"a принимает значения, указанные для формулы(I), и группу -NR"a-Ta-NR'aR'b, в которой R"a представляет собой атом водорода, Та принимает значения,указанные для формулы (I), и R'a и R'b, которые могут быть одинаковыми или разными, каждый представляет собой линейную или разветвленную (С 1-С 6)алкильную группу. Заместители X и Y, которые являются предпочтительными согласно изобретению, представляют собой атомы водорода. Наиболее особенно преимущественно предпочтительными соединениями согласно изобретению являются акридин-7-он,-цис-1,2-диацетокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h] акридин-7-он,-цис-7-метокси-4,4,15-триметил-15,15 с-дигидро-4H-бензо[][1,3]диоксоло[4',5':4,5]пирано[3,2-h] акридин-2,8(3 аH)-дион,6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он,6-гидрокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он,6-гидрокси-3,3-диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Энантиомеры, диастереоизомеры, N-оксиды, а также соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений образуют неотъемлемую часть изобретения. Настоящее изобретение касается также способа получения соединений формулы (I), этот способ отличается тем, что в нем в качестве исходного вещества используют соединение формулы (II) в которой X и Y принимают значения, указанные для формулы (I),это соединение формулы (II) обрабатывают диметилсульфатом в основной среде с получением соединений формулы (III) в которой X и Y принимают значения, указанные выше,это соединение формулы (III) обрабатывают щелочным раствором Кляйзена (раствор гидроксида калия в водно-метанольной смеси) и затем раствором хлористо-водородной кислоты с получением соединений формулы (IV) в которой X и Y принимают значения, указанные выше,это соединение формулы (IV) обрабатывают тионилхлоридом и затем в безводной среде соединением формулы (V) в которой R представляет собой атом водорода, гидроксигруппу, линейную или разветвленную (С 1 С 6)алкильную группу или линейную или разветвленную (С 1-С 6)алкоксигруппу, с получением соединений формулы (VI) в которой X, Y и R принимают значения, указанные выше,это соединение формулы (VI) обрабатывают суспензией гидрида натрия в безводном апротонном растворителе с получением соединений формулы (VII) в которой X, Y и R принимают значения, указанные выше,это соединение формулы (VII) обрабатывают водным раствором бромисто-водородной кислоты в уксусной кислоте с получением соединений формулы (VIII) в которой X, Y и R принимают значения, указанные выше,это соединение формулы (VIII) затем обрабатывают в основных условиях в безводном апротонном растворителе алкином формулы (IX) в которой Hal представляет собой атом галогена, и R3 и R4 принимают значения, указанные для формулы(I), с получением соединений формулы (I/а), частного случая соединений формулы (I) в которой X, Y, R, R3 и R4 принимают значения, указанные выше,атом азота этого соединения формулы (I/а), при необходимости, замещают действием алкилгалогенида или диалкилсульфата в присутствии депротонирующего агента, в полярном апротонном растворителе, с получением соединений формулы (I/b), частного случая соединений формулы (I) в которой R'1 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу и X, Y, R, R3 иR4 принимают значения, указанные выше,эти соединения формулы (I/b), когда R представляет собой гидроксигруппу, при необходимости,подвергают действию алкилирующего или ацилирующего агента с получением соединений формулы(I/с), частного случая соединений формулы (I) в которой R'2 представляет собой группу, выбранную из -OR"a, -O-Ta-OR"a, -O-С(O)-ТаН и -O-Ta-NR'aR'b,в которых R"a, R'a, R'b и Та принимают значения, указанные для формулы (I), и X, Y, R'1, R3 и R4 принимают значения, указанные выше,эти соединения формулы (I/с), когда R'2 представляет собой линейную или разветвленную (С 1 С 6)алкоксигруппу, при необходимости обрабатывают соединением формулы (X)(X) в которой R10 представляет собой группу, выбранную из R'a и R"a, которые принимают значения, указанные для формулы (I), и R11 представляет собой группу, выбранную из R'b, -Ta-NR'aR'b, -C(O)-TaH,-6 007790-Ta-OR"a и -Ta-CO2R"a, в которых Та, R'a, R'b и R"a принимают значения, указанные выше, с получением соединений формулы (I/d), частного случая соединений формулы (I) в которой X, Y, R'1, R3, R4, R10 и R11 принимают значения, указанные выше,множество соединений формул от (I/а) до (I/d) составляет соединения формулы (I/е) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные для формулы (I),эти соединения формулы (I/е) могут быть подвергнуты а) действию восстанавливающего агента с получением соединений формулы (I/f), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,b) или действию тетроксида осмия в полярной среде и в присутствии N-оксида 4-метилморфолина с получением соединений формул (I/g1) и (I/g2), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,эти цис-диольные соединения формулы (цис-I/g), при необходимости, подвергают действию соединения формулы (XI) в которой Z принимает значения, указанные для формулы (I), с получением соединений формулы (цисI/h), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,с) или действию перманганата калия в полярной среде с получением соединений формулы (I/i), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, причем соединения формулы (I/i) могут быть подвергнуты:) действию алкилирующего или ацилирующего агента с получением соединений формулы (I/j),частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, и R20 представляет собой группу,выбранную из линейной или разветвленной (С 1-С 6)алкильной группы и линейной или разветвленной (С 1 С 6)алкилкарбонильной группы,) или восстанавливающим условиям в присутствии NaBH4 с получением соединений формулы(I/k), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,множество соединений формул (цис-I/g) и (I/k) составляет соединения формулы (I/l) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,) или действию тозилхлорида, с последующим действием NaN3 в присутствии перекиси водорода,и последующей стадии восстановления, с получением соединений формулы (I/m), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, эти соединения формулы (I/m) подвергают 1) или действию диоксида углерода, в присутствии дифенилфосфита, с получением соединений формулы (I/n), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,2) или действию соединения формулы (XII)(XII) в которой Hal принимает значения, указанные выше, и G'1 представляет собой группу, выбранную из -Rc,C(W2)-U-V, C(W2)-W3-T1, S(O)n-W3-T1 и S(O)n-U'-V', в которых Rc, W2, W3, U, V, U', V', T1 и n принимают значения, указанные для формулы (I), с получением соединений формул (I/o1), (I/o2) и (I/о 3), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4 и G'1 принимают значения, указанные выше,первичные амино функции этих соединений формул (I/о 2) и (I/о 3) защищают защитными группами для первичных аминогрупп с получением соединений формул (ХIII/а) и (ХIII/b) в которых X, Y, R1, R2, R3, R4 и G'1 принимают значения, указанные выше, и P1 представляет собой защитную группу для первичных аминогрупп,эти соединения формул (I/о 1), (ХIII/а) и (ХIII/b), при необходимости, подвергают действию соединения формулы (XIV)(XIV) в которой Hal представляет собой галоген и Rc1 представляет собой группу, выбранную из линейного или разветвленного (С 1-С 6)алкила, арила и арил-(С 1-С 6)алкила, в котором алкильний остаток является линейным или разветвленным, и затем, в случае соединений формул (ХIII/а) и (ХIII/b), подвергают условиям снятия защитной группы первичной аминофункциональной группы с получением соединений формул(I/p1), (I/р 2) и (I/р 3), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4, G'1 и Rc1 принимают значения, указанные выше,эти соединения формул (I/р 2) и (I/р 3), при необходимости, последовательно подвергают действию соединения формулы (XIV), как указано выше, и затем соединения формулы (XV)(XV) в которой Hal принимает значения, указанные выше, и Rd'1 может принимать те же значения, что и Rc1, с получением соединений формул (I/q2) и (I/q3), частных случаев соединений формулы (I) причем соединения формулы (I/l) могут быть подвергнуты:) действию соединения формулы (XII), как указано выше, с получением соединений формул (I/r1),(I/r2) и (I/r3), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4 и G'1 принимают значения, указанные выше,соединения формулы (I/r1) подвергают: 1) или, когда G'1 представляет собой группу C(W2)-U-V, действию спирта формулы R30-OH, в которой R30 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, с получением соединений формулы (I/s1), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4, G'1 и R30 принимают значения, указанные выше,2) или, когда G'1 представляет собой группу C(W2)-U-V, действию тиола формулы (XVI)(XVI) в которой G1 представляет собой группу, выбранную из Rc, C(W2)-U-V и C(W2)-W3-T1, в которых Rc, W2,W3, U, V и T1 принимают значения, указанные для формулы (I), с получением соединений формулы (I/t1),частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4, G1 и G'1 принимают значения, указанные выше,эти соединения формулы (I/t1), при необходимости, обрабатывают восстанавливающим агентом и затем подвергают реакции снятия защитной группы с гидрокси функциональной группы с получением соединений формулы (Iu1), частного случая соединений формулы (I) подвергают: 1) или действию ангидрида формулы (XVII) или хлорангидрида кислоты формулы (XVIII)(XVIII) в которых W2, U и V принимают значения, указанные для формулы (I), с получением соединений формул(I/v2) и (I/V3), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4, G'1, W2, U и V принимают значения, указанные выше,2) или условиям дегидратирования в кислотной среде с получением соединений формул (I/w2) и(I/w3), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4 и G'1 принимают значения, указанные выше,) или действию соединения формулы (XIX) или (XX) в которых В принимает значения, указанные для формулы (I), и W представляет собой атом галогена или гидроксильную группу, с получением соединений формулы (I/х), частного случая соединений формулы в которой X, Y, R1, R2, R3, R4 и В принимают значения, указанные выше,) или действию линейного (С 1-С 6)алкил дигалогенида с получением соединений формулы (I/у), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, и m принимает значения, указанные для формулы (I),) или действию эквивалента соединения формулы (XVII) или (XVIII) с получением соединений формулы (I/z), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4, W2, U и V принимают значения, указанные выше,эти соединения формулы (I/z) могут быть подвергнуты избытку ангидрида формулы (XVII') или хлорангидрида кислоты формулы (XVIII')(XVIII') в которых U1 и V1 могут иметь те же значения, что и U и V, и W2 принимает значения, указанные выше, с получением соединений формулы (I/аа), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4, W2, U, V, U1 и V1 принимают значения, указанные выше,) или условиям дегидратирования в кислотной среде с получением соединений формулы (I/ab), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,эти соединения формулы (I/ab), при необходимости, восстанавливают в присутствии NaBH4 с получением соединений формулы (I/ас), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,d) или действию перкислоты или диметилдиоксирана с получением соединений формулы (I/ad), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,эти соединения формулы (I/ad) при необходимости обрабатывают аммиаком или первичным или вторичным амином с получением соединений формул (I/ae1) и (I/ае 2), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, Rc принимает значения, указанные для формулы (I), и Rd1 представляет собой группу, выбранную из Rd, -C(W2)-U-V, -C(W2)-W3-T1, -S(O)nW3-T1 и -S(O)n-U'-V', где Rd, W2, W3, U, V, T1, U' и V' принимают значения, указанные выше,причем соединения формул (I/ае 1) и (I/ае 2) могут быть подвергнуты:) когда Rc и Rd1 каждый представляет собой атом водорода, действию соединения формулы (XI), как указано выше, с получением соединений формул (I/af1) и (I/af2), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4 и Z принимают значения, указанные выше,) или действию соединения формул (XIX) или (XX), как указано выше, с получением соединений формул (I/ag1) и (I/ag2), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4 и В принимают значения, указанные выше,) или действию соединения формулы (XII), как указано выше, с получением соединений формул(I/ah1) и (I/аh2), частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4, Rc, Rd1 и G'1 принимают значения, указанные выше,) или действию дибромида трифенилфосфина в присутствии триэтиламина с получением соединений формул (I/ai), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4 и Rd1 принимают значения, указанные выше,) или условиям дегидратирования в кислой среде с получением соединений формул (I/аj2) и (I/aj3),частных случаев соединений формулы (I) в которых X, Y, R1, R2, R3, R4, Rc и Rd1 принимают значения, указанные выше,е) или действию соединения формулы (XXI)(XXI) в которой Hal представляет собой атом галогена и W2 и T1 принимают значения, указанные для формулы(I), с получением соединений формулы (I/aj), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4, W2 и Т 1 принимают значения, указанные выше,соединения (I/a)-(I/aj) составляют множество соединений изобретения, которые подвергают очистке, если необходимо, согласно обычной технике очистки, которые могут быть, при необходимости, разделены на их различные изомеры согласно обычной технике разделения и которые превращают, при необходимости, в их N-оксиды и, где целесообразно, в их соли присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (IV), (IX)-(XII), (XIV)-(XXI), (XVII') и (XVIII') или являются коммерчески доступными соединениями, или их получают в соответствии с обычными методами органического синтеза, которые хорошо известны специалисту, квалифицированному в данном уровне техники. Соединения формулы (I), в которой А представляет собой группу формулы -CH(R5)-CH(R6), в которой R5 и R6, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, ORc группы и W1-C(W2)-U-V группы, где Rc принимает значения, указанные для формулы (I), W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь и V представляет собой атом водоро, в которой Z принимает значения, указанные для форда, или R5 и R6 вместе образуют группу мулы (I), могут преимущественно быть получены исходя из соединений формулы (I/е) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, которые подвергают действию тетраоксида осмия в полярной среде и в присутствии N-оксида 4-метилморфолина, или действию перманганата калия с последующим восстановлением, применяя боргидрид натрия с получением, в зависимости от способа, цис- или транс-диола соединений формулы (I/ak), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше,цис-диольные соединения формулы (цис-I/ak), при необходимости, подвергают или действию N,N'-карбонилдиимидазола или N,N'-тиокарбонилдиимидазола в присутствии 2 бутанона с получением соединений формулы (циc-I/al), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные выше, и Z принимает значения, указанные для формулы (I),или действию соединения формулы (XXII) или соединения формулы (XXIII)(XXIII) в которой Hal представляет собой атом галогена и G2 представляет собой группу, выбранную из-C(W2)-U-V, -C(W2)-W3-T1, -S(O)n-W3-T1 и -S(O)n-U'-V', где W2, W3, U, V, U', V' и n принимают значения,указанные для формулы (I), с получением соединений формулы (I/am), частного случая соединений формулы (I) в которой X, Y, R1, R2, R3, R4 и G2 принимают значения, указанные выше, соединение формулы (I/am) составляет множество соединений изобретения, которые подвергают очистке, если необходимо, согласно обычной технике очистки, которые могут быть, при необходимости, разделены на их различные изомеры согласно обычной технике разделения и которые превращают, при необходимости, в их N-оксиды и где целесообразно, в их соли присоединения с фармацевтически приемлемой кислотой или основанием. Соединения формул (XXII) и (XXIII) или являются коммерчески доступными соединениями, или их получают в соответствии с обычными методами органического синтеза, которые хорошо известны специалисту, квалифицированному в данном уровне техники. Соединения формулы (I) обладают особенно ценными противоопухолевыми свойствами. Они имеют превосходную in vitro цитотоксичность по отношению к опухолевым линиям клеток происходящим от мыши и человека, посредством специфичной блокировки клеточного цикла, а также активны in vivo,на мыши, по отношению к перевиваемым мышиным и человеческим опухолям. Характерные свойства этих соединений позволяют использовать их терапевтически как противоопухолевые средства. Настоящее изобретение также относится к фармацевтическим композициям, включающим в качестве активного компонента по крайней мере одно соединение формулы (I), его энантиомер или диастереоизомер, или его N-окись, или его соль присоединения с фармацевтическими приемлемой кислотой или основанием, самостоятельно или в комбинации с одним или более инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. Среди фармацевтических композиций согласно настоящему изобретению можно особенно отметить те, которые являются подходящими для перорального, парентерального (внутривенного, внутримышечного или подкожного), под- или чреcкожного, интравагинального, ректального, назального, подъязычного, буккального, глазного или респираторного применения. Фармацевтические композиции согласно настоящему изобретению для парентерального введения в особенности включают водные и безводные стерильные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для воссоздания инъекционных растворов или дисперсий. Фармацевтические композиции согласно настоящему изобретению для перорального применения в твердой форме в особенности включают таблетки или драже, подъязычные таблетки, сашеты, желатиновые капсулы и гранулы, и для перорального, назального, буккального или глазного применения в жидкой форме, в особенности включают эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального применения представляют собой предпочтительно суппозитории, и для под- или чреcкожного применения в особенности включают порошки, аэрозоли, кремы, мази, гели и пластыри. Фармацевтические композиции, упомянутые выше, иллюстрируют настоящее изобретение, но никоим образом не ограничивают его. Из числа инертных, нетоксичных, фармацевтически приемлемых наполнителей или носителей могут быть упомянуты, посредством неограничивающего примера, разбавители, растворители, консерванты, смачивающие вещества, эмульгаторы, диспергирующие вещества, связующие вещества, вещества,способствующие набуханию, разлагающие вещества, ингибиторы, смазки, абсорбирующие вещества,суспендирующие вещества, красящие вещества, ароматизирующие вещества и т.д. Полезную дозу варьируют в зависимости от возраста и веса пациента, способа применения, используемой фармацевтической композиции, характера и серьезности заболевания, а также применения любого сопутствующего лечения. Доза находится в пределах от 0,1 до 1000 мг в сутки в один или большее количество приeмов. Следующие примеры иллюстрируют настоящее изобретение, но никоим образом не ограничивают его. Используемые исходные вещества представляют собой известные продукты или продукты, полученные известными способами получения. Различные получения приводят к промежуточным продуктам синтеза, которые являются полезными для получении соединений согласно изобретению. Структуры соединений, описанных в примерах и получениях, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс (ЯМР),масс-спектрометрия). Точки плавления были определены с использованием столика Кофлера или электрической плитки под микроскопом. В случае, когда соединение находится в форме соли, данная точка плавления относится к соединению в форме соли. Получение 1. N-(3,5-Диметоксифенил)ацетамид. Раствор 15,3 г 3,5-диметоксианилина и 57,5 мл уксусного ангидрида в 40 мл безводного пиридина нагревают при орошении в течение 1 ч. Затем реакционную смесь охлаждают и выливают в 350 мл воды. Образовавшийся осадок суспендируют в 20% водного раствора Nа 2 СО 3 и затем отфильтровывают с использованием воронки Бюхнера, промывают водой и высушивают в вакууме над фосфором. Осадок в количестве 14,5 г ожидаемого продукта получают в форме белого аморфного твердого вещества. Масс-спектр (DIC/NH3): m/z=196 (М+Н)+. Полчение 2. 9,11-Дигидроксибензо[а]акридин-12(7H)-он. Стадия А. Метил 2-метокси-1-нафтоат. 54 мл диметилсульфата добавляют к раствору 26,32 г 2-гидрокси-1-нафтойной кислоты в 70 мл 4,5N водного раствора NaOH. После этого реакционную смесь поддерживают при комнатной температуре, с перемешиванием, в течение 4 ч, разбавляют при помощи 250 мл воды и экстрагируют дихлорметаном (4100 мл). Объединенные органические фазы промывают водой, высушивают над сульфатом натрия и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (циклогексан и затем градиент от 1 до 10% ацетона в циклогексане) позволяет выделить 21,5 г ожидаемого продукта. Масс-спектр (DIC/NH3): m/z=217 (М+Н)+. Стадия В. 2-Метокси-1-нафтойная кислота. Раствор 21,6 г соединения, полученного на стадии А выше, в 48 мл щелочного раствора Кляйзена(раствор 21 г КОН в 15 мл воды, доведенный до 60 мл метанолом), нагревают при орошении в течение 4 ч. После этого реакционную смесь разбавляют при помощи 50 мл воды и выливают в 75 мл 15,5% раствора хлористо-водородной кислоты, охлажденного до 0 С при перемешивании. Затем образовавшийся белый осадок отфильтровывают через воронку Бюхнера и затем промывают водой и высушивают в вакууме над фосфором. Полученный сухой остаток растворяют в растворе этанола и воды (80:20, об./об.) при кипячении. После охлаждения до 0 С получают 13,7 г ожидаемого продукта. Точка плавления: 56-57 С. Масс-спектр (DIC/NH3): m/z=203 (М+Н)+. Стадия С. N-[3,5-Диметокси-2-(2-метокси-1-нафтоил)фенил]ацетамид. 30 мл SOCl2 добавляют по каплям на протяжении 30 мин к 15,15 г соединения, полученного на стадии В выше, в колбу, снабженную холодильником и присоединенную к газовой ловушке. После этого реакционную смесь нагревают при 60 С в течение 3 ч и упаривают досуха при пониженном давлении. Полученный хлорангидрид 2-метокси-1-нафтойной кислоты растворяют в 50 мл безводного дихлорэтана и добавляют по каплям к смеси 12,5 г AlCl3 и 12,7 г соединения получения 1 в 100 мл безводного дихлорэтана, предварительно охлажденного до 0 С. Реакционную смесь поддерживают при 0 С в течение 3 ч и затем при 20 С в течение 3 ч. После этого реакционную смесь выливают в 250 мл 15% раствора хлористо-водородной кислоты, предварительно охлажденного на ледяной бане с перемешиванием, и экстрагируют дихлорметаном (340 мл). Объединенные органические фазы промывают раствором NаНСО 3 и затем водой, высушивают над безводным сульфатом натрия, отфильтровывают и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (дихлорметан и затем градиент от 0,2 до 4% метанола в дихлорметане) позволяет выделить 7,74 г ожидаемого продукта. Точка плавления: 149-150 С. Масс-спектр (DIC/NH3): m/z=379 (М+Н)+. Стадия D. 9,11-Диметоксибензо[]акридин-12(7H)-он. Раствор 3,79 г соединения, полученного на стадии С выше в 60 мл безводного диметилформамида,добавляют по каплям к суспензии 1,2 г NaH в 50 мл безводного диметилформамида, предварительно охлажденного до 0 С. Реакционную смесь поддерживают при 0 С при перемешивании и в инертной атмосфере в течение 15 мин и затем поддерживают при 20 С в течение 4 ч 30 мин. После этого реакционную смесь выливают в 200 мл воды и экстрагируют этилацетатом (350 мл). Объединенные органические фазы последовательно промывают раствором NaOH и затем водой, высушивают над безводным сульфатом натрия, отфильтровывают и затем упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (дихлорметан и затем градиент от 0,5 до 5% метанола в дихлорметане) позволяет получить 2,05 г ожидаемого продукта. Точка плавления: 258-259 С. Масс-спектр (DIC/NH3): m/z=305 (М+Н)+. Стадия Е. 9,11-Дигидроксибензо[]акридин-12(7H)-он. 80 мл 48% водного раствора НВr добавляют к раствору 1,89 г соединения, полученного на стадии D выше в 90 мл уксусной кислоты, и затем нагревают при орошении в течение 4 дней. После охлаждения,реакционную смесь выливают в 1000 мл ледяной воды. Образовавшийся коричневый осадок отфильтровывают через воронку Бюхнера, промывают водой и высушивают в вакууме над фосфором. Хроматографирование на силикагеле (дихлорметан и затем градиент от 1 до 10% метанола в дихлорметане) позволяет получить 1,55 мг ожидаемого продукта. Точка плавления: 311-312 С. Масс-спектр (DIC/NH3): m/z=278 (М+Н)+. Получение 3. N-(3-Метоксифенил)ацетамид. Соединение получено в соответствии с процедурой получения 1, применяя 3-метоксианилин вместо 3,5-диметоксианилина. Получение 4. 9-Гидроксибензо[]акридин-12(7H)-он. Стадия А. N-[5-Метокси-2-(2-метокси-1-нафтоил)фенил]ацетамид. Соединение получено в соответствии с процедурой стадии С получения 2, применяя соединение получения 3 вместо соединения получения 1. Стадия В. 9-Метоксибензо[]акридин-12(7H)-он. Соединение получено в соответствии с процедурой стадии D получения 2, применяя соединение стадии А, указанной выше. Стадия С. 9-Гидроксибензо[]акридин-12(7H)-он. Соединение получено в соответствии с процедурой стадии Е получения 2, применяя соединение стадии В, указанной выше. Получение 5. 3-Бром-9,11-дигидроксибензо[]акридин-12(7H)-он. Соединение получено в соответствии с процедурой получения 2, стадия А по стадию Е, применяя 6 бром-2-гидрокси-1-нафтойную кислоту вместо 2-гидрокси-1-нафтойной кислоты. Масс-спектр (ESI+): m/z=354 (М+Н)+. Пример 1. 6-Гидрокси-3,3-диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. 732 мг соединения получения 2 растворяют в 20 мл безводного диметилформамида и затем добавляют 732 мг безводного карбоната калия. Таким образом, полученную смесь перемешивают в атмосфере аргона, при 65 С, в течение 15 мин и затем добавляют 876,5 мг безводного иодида калия и 2,47 г 3-хлор 3-метил-1-бутина. В конце 5 ч реакционную смесь нагревают при 130 С в течение 2 ч для осуществления перегруппировки пропаргилового эфира. После этого реакционную смесь разбавляют при помощи 50 мл воды и экстрагируют дихлорметаном (340 мл). Объединенные органические фазы промывают водой и затем 1 М раствором гидроксида калия, высушивают над безводным сульфатом натрия, отфильтровывают и затем упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (циклогексан и затем градиент от 1 до 5% ацетона в циклогексане) позволяет получить 326 мг ожидаемого продукта. Масс-спектр (DIC/NH3): m/z=345 (М+Н)+. Пример 2. 6-Гидрокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. 1,324 г карбоната натрия добавляют к 411,6 мг соединения примера 1, растворенного в 50 мл безводного ацетона. Смесь поддерживают, при перемешивании, в атмосфере аргона и при 0 С в течение 15 мин и затем, после добавления 852 мг метилиодида, реакционную смесь нагревают при орошении в течение 2 ч. После охлаждения от избытка метилиодида избавляются добавлением 40 мл метанола и 50 мл воды. Метанол удаляют дистилляцией и водную фазу экстрагируют дихлорметаном (330 мл). Объединенные органические фазы промывают 10% водным раствором NaOH и после этого водой, высушивают над безводным сульфатом натрия и затем отфильтровывают и упаривают досуха при пониженном давлении. Выполнение хроматографирования на силикагеле (циклогексан и затем градиент от 0,5 до 5% ацетона в циклогексане) позволяет выделить 374,2 мг ожидаемого продукта. Масс-спектр (DIC/NH3): m/z=358 (М+Н)+. Пример 3. 6-Метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Раствор 604,3 мг соединения примера 2 в 40 мл безводного ацетона постепенно добавляют к суспензии, которую поддерживают в атмосфере аргона и при 0 С, 61 мг гидрида натрия в 10 мл ацетона. Таким образом, полученную смесь поддерживают при 0 С в течение 30 мин и затем добавляют 1,2 г метилиодида. Реакционную смесь нагревают при орошении в течение 6 ч. После охлаждения от избытка метилиодида избавляются добавлением 40 мл метанола и 50 мл воды. Метанол удаляют дистилляцией и водную фазу экстрагируют дихлорметаном (330 мл). Объединенные органические фазы промывают 10% водным NaOH раствором и затем водой, высушивают над безводным сульфатом натрия и затем отфильтровывают и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле(циклогексан и затем градиент от 1 до 10% ацетона в циклогексане) позволяет выделить 469,5 мг ожи- 19007790 даемого продукта. Масс-спектр (DIC/NH3): m/z=372 (М+Н)+. Пример 4. -цис-1,2-Дигидрокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Смесь 0,4859 г соединения примера 3, осмия тетроксида (2,5%), растворенного в 1,05 мл 2-метил-2 пропанола, и 96,7 мг 4-метилморфолин N-оксид моногидрата растворяют в 40 мл смеси третBuOH:THF:Н 2 О (10:3:1). Реакционную смесь поддерживают, при перемешивании, при комнатной температуре в течение 4 дней. Затем добавляют насыщенный NaHSO3 раствор (30 мл). После перемешивания в течение одного часа, реакционную смесь экстрагируют дихлорметаном (425 мл). Объединенные органические фазы высушивают над безводным сульфатом натрия и затем отфильтровывают и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (циклогексан и затем градиент от 1 до 15% ацетона в циклогексане) позволяет выделить 452,7 мг ожидаемого продукта. Масс-спектр (DIC/NH3): m/z=406 (М+Н)+. Пример 5. -цис-1,2-Диацетокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h]акридин-7-он. 61 мг соединения примера 4 и 1 мг DMАР добавляют к смеси, предварительно охлажденной (в ледяной бане), безводного пиридина (4 мл) и уксусного ангидрида (0,4 мл). Реакционную смесь поддерживают при перемешивании при комнатной температуре в течение 3 дней, без доступа света. После этого реакционную смесь выливают в 10 мл ледяной Н 2 О, образовавшийся осадок отфильтровывают, промывают Н 2 О (25 мл) и затем высушивают в вакууме над фосфором. 62,4 мг ожидаемого продукта кристаллизуется из смеси дихлорметан:этилацетат (9:1, об./об.) в форме тонких белых призм. Точка плавления: 161-162 С. Масс-спектр (DIC/NH3): m/z=477 (M+Н)+. Пример 6. -цис-7-Метокси-4,4,15-триметил-15,15 с-дигидро-4H-бензо[][1,3]-диоксоло[4',5':4,5] пирано[3,2-h]акридин-2,8[3 аH]-дион. 230,5 мг N,N'-карбонилдиимидазола добавляют к раствору 109,4 мг соединения примера 4 в 5 мл 2 бутанона. Реакционную смесь выдерживают при орошении в течение 3 ч и затем, после охлаждения, разбавляют при помощи 5% водного Nа 2 СО 3 раствора (7 мл) и экстрагируют этилацетатом (310 мл). Объединенные органические фазы высушивают над безводным сульфатом натрия и затем отфильтровывают и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (дихлорметан и затем градиент от 1 до 7% ацетона в дихлорметане) позволяет получить 65,7 мг ожидаемого продукта. Масс-спектр (DIC/NH3): m/z=432 (М+Н)+. Пример 7. -цис-1-[(Диметиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14 тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил диметилкарбамат. При -10 С раствор 0,123 ммоль соединения примера 4 в 4 мл безводного тетрагидрофурана добавляют к 0,698 ммоль гидрида калия, промытого гексаном. После добавления по каплям, при -10 С, 0,327 ммоль N,N-диметилкарбамоил хлорида, проводят перемешивание в течение 3 ч 30 мин при комнатной температуре. После добавления 50 мл этилацетата и 10 мл насыщенного NaHCO3 раствора, органическую фазу промывают водой, сушат над сульфатом магния и затем выпаривают при пониженном давлении с получением ожидаемого продукта. Пример 8. -цис-6-Метокси-3,3,14-триметил-2-[(4-метилфенил)сульфонил]окси-7-оксо-2,3,7,14 тетрагидро-1H-бензо[]пирано[3,2-h]акридин-1-ил 4-метилбензолсульфонат. Соединение получают в соответствии с процедурой примера 7, применяя тозилхлорид вместо N,Nдиметилкарбамоил хлорида. Пример 9. -цис-[1-(ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1Hбензо[]пирано[3,2-h]акридин-2-ил]окси-4-оксобутановая кислота. К раствору 0,5 ммоль соединения примера 4 в 3 мл безводного пиридина добавляют 1,1 экв. янтарного ангидрида и 1 мг диметиламинопиридина. Перемешивают в течение 2 дней в темноте и при комнатной температуре, затем добавляют 25 мл уксусного ангидрида при -15 С и перемешивают в течение 1,5 ч перед концентрированием при пониженном давлении. Хроматографирование на силикагеле (дихлорметан/уксусная кислота: 99/1) позволяет выделить ожидаемый продукт. Пример 10. -цис-5-[1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1Hбензо[]пирано[3,2-h]акридин-2-ил]окси-5-оксопентановая кислота. Соединение получают в соответствии с процедурой примера 9, применяя глутаровый ангидрид вместо янтарного ангидрида. Пример 11. -цис-1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил[(трет-бутоксикарбонил)амино]ацетат. 0,6 ммоль дициклогексилкарбодиимида медленно добавляют к раствору, при 0 С, 0,5 ммоль соединения примера 4 и 0,5 ммоль 2-[(трет-бутоксикарбонил)амино]уксусной кислоты в 10 мл диметилформамида. Реакционную смесь поддерживают при 0 С в течение 5 ч и затем при комнатной температуре в течение 16 ч. После фильтрования и выпаривания при пониженном давлении, осадок растворяют в 2 мл безводного пиридина; добавляют 2 мл уксусного ангидрида, и смесь перемешивают в течение 48 ч при комнатной температуре и в темноте. После концентрирования реакционной смеси при пониженном давлении хроматографирование осадка на силикагеле (дихлорметан) позволяет выделить ожидаемый продукт. Пример 12. -цис-1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-иламиноацетат. 0,14 л йодтриметилсилана добавляют к раствору, при комнатной температуре, 0,1 ммоль соединения примера 11 в 1 мл хлороформа. Реакционную смесь перемешивают при комнатной температуре в течение 5 мин и затем упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (дихлорметан/метанол: 85/15) позволяет выделить ожидаемый продукт. Пример 13. 2-Бутирил-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7 он. Смесь 0,81 ммоль бутирилхлорида и 0,673 ммоль АlСl3 в 2 мл безводного дихлорметана добавляют,маленькими порциями, к 0,135 ммоль продукта примера 3 в 2 мл дихлорметана при 0 С. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре и затем выливают в 10% НСl раствор. После обычной обработки органических фаз и их выпаривания при пониженном давлении, хроматографирование осадка на силикагеле (дихлорметан/метанол) позволяет выделить ожидаемый продукт. Пример 14. -цис-1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил бутират. 2 экв. бутирилхлорида добавляют к раствору 0,74 ммоль соединения примера 4 в присутствии 4 диметиламинопиридина в 7 мл безводного пиридина. Перемешивают при комнатной температуре в течение 72 ч и затем добавляют 5 экв. бутирилхлорида и проводят заключительное перемешивание в течение 72 ч; затем выпаривают досуха. Хроматографирование на силикагеле позволяет выделить ожидаемый продукт. Пример 15. 6-Метокси-3,3,14-триметил-7-оксо-7,14-дигидро-3H-бензо[]пирано[3,2-h]акридин-2-ил бутират. 4 капли 10% НСl раствора добавляют к раствору 0,29 ммоль соединения примера 14 в 6 мл дихлорметана. Реакционную смесь перемешивают в течение 3 дней при комнатной температуре и затем высушивают и концентрируют при пониженном давлении. Хроматографирование осадка на силикагеле (дихлорметан/метанол) позволяет выделить ожидаемый продукт. Пример 16. 2-Гидрокси-6-метокси-3,3,14-триметил-2,3-дигидро-1 Н-бензо[]пирано[3,2-h]акридин 1,7(14H)-дион. На протяжении 30 мин суспензию 1,28 г КМnO4 в 15 мл воды добавляют по каплям к раствору 0,5 г продукта примера 3, растворенного в 25 мл ацетона. Реакционную смесь перемешивают при комнатной температуре в течение 8 ч и затем, после экстракции и обычной обработки, выделяют ожидаемый продукт путем хроматографирования осадка на силикагеле (дихлорметан/метанол: 98/2). Пример 17. 6-Метокси-3,3,14-триметил-1,7-диоксо-2,3,7,14-тетрагидро-1 Н-бензо[]пирано[3,2-h]акридин-2-ил ацетат. Соединение получают в соответствии с процедурой примера 14, начиная с соединения примера 16,применяя уксусный ангидрид вместо бутирилхлорида. Пример 18. 3,3-Диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Соединение получают в соответствии с процедурой примера 1, применяя соединение получения 4 вместо соединения получения 2. Пример 19. 3,3,14-Триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Соединение получают в соответствии с процедурой примера 2, применяя соединение примера 18 вместо соединения примера 2. Пример 20. -цис-1,2-Дигидрокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h] акридин-7-он. Соединение получают в соответствии с процедурой примера 4, применяя соединение примера 19 вместо соединения примера 3. Пример 21. -цис-1-(Ацетилокси)-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил ацетат. Соединение получают в соответствии с процедурой примера 5, применяя соединение примера 20 вместо соединения примера 4. Пример 22. 1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил ацетат. 2,2 ммоль уксусного ангидрида добавляют к раствору, охлажденному до 0 С, 2 ммоль соединения примера 4 в 5 мл безводного пиридина. После перемешивания при комнатной температуре в течение 3 ч реакционную смесь концентрируют при пониженном давлении. Хроматографирование на силикагеле(дихлорметан, и затем дихлорметан/метанол: 99/1) позволяет выделить ожидаемый продукт. Пример 23. 1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил бензоат. Соединение получают в соответствии с процедурой примера 9, применяя бензойный ангидрид вместо янтарного ангидрида. Пример 24. 1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил пропионат. Соединение получают в соответствии с процедурой примера 22, применяя пропионовый ангидрид вместо уксусного ангидрида. Пример 25. 6-Метокси-3,3,14-триметил-7-оксо-1-(пропионилокси)-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил пропионат. Соединение получают в соответствии с процедурой примера 5, применяя пропионовый ангидрид вместо уксусного ангидрида. Пример 26. 1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил 4-пентеноат. Соединение получают в соответствии с процедурой примера 14, применяя пентеновый ангидрид вместо бутирил хлорида. Пример 27. 6-Метокси-3,3,14-триметил-7-оксо-1-(4-пентеноилокси)-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил 4-пентеноат. Соединение получают в соответствии с процедурой примера 14, применяя пентеновый ангидрид вместо бутирил хлорида. Хроматографирование на силикагеле (дихлорметан и затем дихлорметан/метанол: 99/1 до 98/2) позволяет выделить ожидаемый продукт. Пример 28. 1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил 4-пентеноат. Соединение получают в соответствии с процедурой примера 9, применяя пентеновый ангидрид вместо янтарного ангидрида. Пример 29. 6-Метокси-3,3,14-триметил-1-[(3-метилбутаноил)окси]-7-оксо-2,3,7,14-тетрагидро-1Hбензо[]пирано[3,2-h]акридин-2-ил 3-метилбутаноат. Соединение получают в соответствии с процедурой примера 5, применяя изовалерилхлорид вместо уксусного ангидрида. Пример 30. 4-[1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил]окси-4-оксобутановая кислота. Соединение получают в соответствии с процедурой примера 9, применяя избыток янтарного ангидрида. Хроматографирование на силикагеле (дихлорметан, и затем дихлорметан/метанол: 99/1) позволяет получить ожидаемый продукт. Пример 31. 5-(1-[(4-карбоксибутаноил)окси]-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-илокси)-5-оксопентановая кислота. Соединение получают в соответствии с процедурой примера 9, применяя глутаровый ангидрид в избытке вместо янтарного ангидрида. Пример 32. 1-[(Диэтиламино)карбонил]окси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[]пирано[3,2-h]акридин-2-ил диэтилкарбамат. Соединение получают в соответствии с процедурой примера 7, применяя N,N-диэтилкарбамоилхлорид вместо N,N-диметилкарбамоилхлорида. Пример 33. 6-[2-(Диметиламино)этил]амино-3,3,14-триметил-3,14-дигидро[]пирано[3,2-h]акридин-7-он. 4 мл N,N-диметилэтилендиамина добавляют к 0,15 г продукта примера 3. После прохождения реакции в течение 5 дней при 70 С в инертной атмосфере, реакционную смесь выпаривают при пониженном давлении. Полученный осадок хроматографируют на силикагеле (циклогексан/этилацетат: 80/20), позволяя получить ожидаемый продукт. Точка плавления: масло. Пример 34. 6-[3-(Диэтиламино)пропил]амино-3,3,14-триметил-3,14-дигидро[]пирано[3,2-h]акридин-7-он. Процедуру проводят как в примера 33, применяя N,N-диэтилпропилдиамин в качестве реагента. Точка плавления: масло. Пример 35. 1-Гидрокси-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1 Н-бензо[]пирано[3,2-h]акридин-2-ил (2 Е)-3-фенил-2-пропеноат. 1,33 ммоль циннамоилхлорида добавляют к предварительно охлажденному раствору 0,30 ммоль соединения примера 4 в 4 мл пиридина. После перемешивания при 0 С в течение 90 мин, реакционную смесь выпаривают при пониженном давлении. Хроматографирование на силикагеле (циклогексан, и за- 22007790 тем циклогексан/ацетон: 94/6 до 90/10) позволяет выделить ожидаемый продукт. Пример 36. 1-(Ацетилокси)-6-метокси-3,3,14-триметил-7-оксо-2,3,7,14-тетрагидро-1H-бензо[] пирано[3,2-h]акридин-2-ил (2E)-3-фенил-2-пропеноат. 31 ммоль уксусного ангидрида добавляют к предварительно охлажденному раствору 0,18 ммоль соединения примера 35 в 3 мл пиридина. После перемешивания при комнатной температуре в течение 3 дней, реакционную смесь выпаривают при пониженном давлении. Хроматографирование на силикагеле(циклогексан/ацетон: 94/6) позволяет выделить ожидаемый продукт. Пример 37. 6-Метокси-3,3-диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Раствор 300 мг соединения примера 1 в 15 мл безводного диметилформамида добавляют по каплям к суспензии 125 мг гидрида натрия в 10 мл безводного диметилформамида, предварительно охлажденного до 0 С. Реакционную смесь поддерживают при 0 С в течение 15 мин, при комнатной температуре в течение 30 мин и затем добавляют 0,57 мл диметилсульфата. Через 17 ч реакционную смесь выливают в 150 мл ледяной воды и экстрагируют дихлорметаном (350 мл). Объединенные органические фазы высушивают над безводным сульфатом натрия и затем отфильтровывают и упаривают досуха при пониженном давлении. Хроматографирование на силикагеле (циклогексан и затем градиент ацетона от 5 до 20%) позволяет получить ожидаемый продукт. Масс-спектр (ESI): m/z=358 (М+Н)+. Пример 38. -цис-1-Гидрокси-6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2h]акридин-2-ил диметилкарбамат. При -10 С раствор 0,124 ммоль соединения примера 4 в 8 мл безводного тетрагидрофурана добавляют к 1,24 ммоль гидрида калия, промытого гексаном. После добавления по каплям, при -10 С, 0,49 ммоль N,N-диметилкарбомоилхлорида, проводят перемешивание в течение 3 ч 20 мин при комнатной температуре. После добавления 25 мл этилацетата и 10 мл насыщенного NaHCO3 раствора, органическую фазу промывают водой, высушивают над сульфатом натрия и затем выпаривают при пониженном давлении. Хроматографирование на силикагеле (дихлорметан/ацетон: 80/20) позволяет получить ожидаемый продукт. Масс-спектр (ESI): m/z=477 (M+Н)+. Пример 39. 10-Бром-6-гидрокси-3,3-диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он. Соединение получают в соответствии с процедурой примера 1, применяя соединение получения 5 вместо соединения получения 2. Масс-спектр (ESI+): m/z=422 (М+Н)+. Пример 40. 10-Бром-6-метокси-3,3,14-триметил-3,14-дигидро-7 Н-бензо[]пирано[3,2-h]акридин-7-он. Соединение получают в соответствии с процедурой примера 3, применяя соединение примера 39 вместо соединения примера 2. Масс-спектр (ESI+): m/z=450 (М+Н)+. Пример 41. 10-Бром-6-гидрокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7 он. Соединение получают в соответствии с процедурой примера 2, применяя соединение примера 39 вместо соединения примера 1. Фармакологическое исследование соединений настоящего изобретения Пример 42. In vitro цитотоксичность. Были использованы четыре линии клеток: 1 мышиная лейкемия: L1210,1 эпидермоидный рак человека: КВ-3-1,1 карцинома толстой кишки человека: НТ 29,1 карцинома простаты человека: LNCap. Клетки культивировали в RPMI 1640 полной среде культивирования, содержащей 10% эмбриональной бычьей сыворотки, 2 мМ глутамина, 50 единиц/мл пенициллина, 50 г/мл стрептомицина и 10 мМ Hepes, pH: 7,4. Клетки равномерно распределили на микропластинках и подвергали действию цитотоксических соединений. Затем клетки инкубировали в течение 2 дней (L1210) или 4 дней (линии человека). Затем количество жизнеспособных клеток квантовали путем колориметрического количественного анализа, Microculture Tetrazolium Assay (J. Carmichael и др., Cancer Res.: 47, 936-942 (1987. Результаты выразили в виде IC50 (концентрация цитотоксических агентов, ингибирующая пролиферацию обработанных клеток на 50%). В качестве примера, соединения примеров 5 и 6 имеют IC50 0,73 и 0,06 М, соответственно, по отношению к L1210 и 0,14 и 0,015 М, соответственно, по отношению к КВ 3-1. Соединение примера 5 имеют IC50 1,18 М по отношению к НТ-29 и 0,57 М по отношению кLNCap. Пример 43. In vivo активность. Противоопухолевая активность по отношению к С 38 аденокарциноме толстой кишки. Фрагменты опухоли С 38 аденокарциномы толстой кишки, взятые с навеской 30 мг, имплантирова- 23007790 ли под кожу B6D2F1 мышей (Iffa CRedo, FRance) в день 0. После того как опухоли выросли, мышей разделили на контрольную (18 животных) и обрабатываемую (6 или 7 животных) группы, которые были одинаковыми по отношению к размеру опухоли. Продукты применяли дважды путем внутривенного введения на 12 и 22 день при их максимально переносимой дозе (MTD), MTD/2 и MTD/4. Опухоли измеряли дважды в неделю и объемы опухолей рассчитывали согласно следующей формуле объем (мм 3) = длина (мм)ширина (мм 2)/2 Противоопухолевую активность выражают как % Т/СV0 и Vt обозначают начальный объем опухоли и ее объем во время измерения t соответственно. Оптимальной дозой является доза, дающая самое низкое Т/С значение без токсичности (ранняя смерть или потеря веса более чем на 20%). В качестве примера, соединение примера 5 показывает ингибирование роста опухоли 95%(Т/С=5%) при оптимальной дозе 4 мг/кг, тогда как акроницин показывает значение Т/С 27% при оптимальной дозе 100 мг/кг, таким образом демонстрируя их мощный терапевтический потенциал. Пример 44. Фармацевтическая композиция: инъекционный раствор. Соединение примера 6 10 мг Дистиллированная вода для инъекционных препаратов 25 мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)X и Y, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из водорода и атомов галогена,причем подразумевают, что заместители X и Y могут присутствовать на любом из двух смежных бензольных колец,R1 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,R2 представляет собой группу, выбранную из атома водорода и -OR"a, где R"a представляет собой группу, выбранную из атома водорода и линейной или разветвленной (С 1-С 6)алкильной группы,R3 и R4, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,А представляет собой группу формулыR5 и R6, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из: 1) атома водорода,2) ORc, NRcRd и SRc групп, в которыхRc и Rd, которые могут быть одинаковыми или разными, представляют, каждый независимо друг от друга, группу, выбранную из атома водорода, линейной или разветвленной (С 1-С 6)алкильной группы иC(O)-Re группы, в которой Re представляет собой группу, выбранную из атома водорода и NR'"aR'"b, гдеR'"a и R'"b, которые могут быть одинаковыми или разными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,3) W1-C(W2)-U-V, в которой:) W1 представляет собой атом кислорода,) W2 представляет собой атом кислорода,) U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь или линейную или разветвленную (С 2-С 8)алкениленовую цепь,) V представляет собой группу, выбранную из, в которой Z представляет собой атом кислорода,b) -CH=C(R7)- или -C(R7)=CH-, где R7 представляет собой атом водорода,c) -C(O)-CH(R8)-, где R8 представляет собой атом водорода, их энантиомеры, диастереоизомеры иN-оксиды, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием,при этом арил понимают в значении фенильной группы, необязательно содержащей один или более одинаковых или различных заместителей, выбранных из гидрокси, галогена, линейной или разветвленной (С 1-С 6)алкоксигруппы. 2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) в которой X, Y, R1, R2, R3, R4, R5 и R6 принимают значения, указанные для формулы (I), их энантиомеры,диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1 или 2, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы -ORc, W1-C(W2)-U-V, W1-C(W2)-W3-T1, или R5 и R6 вместе образуют группу, в которой Rc, W1, W2, W3, U, V, T1 и Z принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1-3, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6 являются одинаковыми и каждый представляет собой группу формулы -ORc, в которой Rc представляет собой атом водорода, их энантиомеры, диастереоизомеры иN-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1-4, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U принимает значения, указанные для формулы (I), и V представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по любому из пп.1-5, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 представляет собой группу формулы -ORc, в которой Rc представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 иW2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 1 С 8)алкиленовую цепь и V представляет собой атом водорода, их энантиомеры, диастереоизомеры и Nоксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по любому из пп.1-6, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 представляет собой группу формулы -ORc, или W1-C(W2)-U-V, в которой Rc представляет собой атом водорода, W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 1-С 8)алкиленовую цепь и V представляет собой атом водорода, и R6 представляет собой группу формулы W1-C(W2)-U-V, в которой W1 и W2 каждый представляет собой атом кислорода, U представляет собой линейную или разветвленную (С 2 С 8)алкениленовую цепь и V представляет собой атом водорода или арильную группу, их энантиомеры,диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по любому из пп.1-7, отличающиеся тем, что они представляют собой соединения формулы (IA), в которой R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой группу формулы W1-C(W2)-W3-T1, в которой W1 и W2 каждый представляет собой атом кислорода, W3 представляет собой группу -NRc, в которой Rc представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, и T1 представляет собой линейную или разветвленную (С 1 С 6)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по любому из пп.1-8, отличающиеся тем, что они представляют собой, в которой Z представлясоединения формулы (IA), в которой R5 и R6 вместе образуют группу ет собой атом кислорода, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IB) в которой X, Y, R1, R2, R3 и R4 принимают значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по любому из пп.1-10, отличающиеся тем, что R3 и R4 каждый представляет собой линейную или разветвленную (С 1-С 4)алкильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по любому из пп.1-11, отличающиеся тем, что R3 и R4 каждый представляет собой метильную группу, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по любому из пп.1-12, отличающиеся тем, что R2 представляет собой группу -OR"a, где R"a принимает значения, указанные для формулы (I), их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по любому из пп.1-13, отличающиеся тем, что X и Y каждый представляет собой атом водорода, их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 15. Соединения формулы (I) по п.1, которые представляют собой-цис-1,2-дигидрокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h] акридин-7-он,-цис-1,2-диацетокси-6-метокси-3,3,14-триметил-1,2,3,14-тетрагидро-7H-бензо[]пирано[3,2-h] акридин-7-он,-цис-7-метокси-4,4,15-триметил-15,15 с-дигидро-4H-бензо[][1,3]диоксоло[4',5':4,5]пирано[3,2-h] акридин-2,8(3 аH)-дион,6-метокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он,6-гидрокси-3,3,14-триметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он,6-гидрокси-3,3-диметил-3,14-дигидро-7H-бензо[]пирано[3,2-h]акридин-7-он,их энантиомеры, диастереоизомеры и N-оксиды, и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 16. Фармацевтические композиции, включающие в качестве активного компонента по крайней мере одно соединение по любому из пп.1-15 в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. 17. Фармацевтические композиции по п.16, включающие по крайней мере один активный компонент по любому из пп.1-15, для использования в качестве лекарственных средств при лечении раковых опухолей.
МПК / Метки
МПК: C07D 311/00, C07D 219/00, C07D 498/14, C07D 491/052, A61K 31/473, A61P 35/00, C07D 491/14
Метки: 3,2-h, пирано, бензо, фармацевтические, акридин-7-она, alpha, композиции, соединения, содержащие
Код ссылки
<a href="https://eas.patents.su/27-7790-soedineniya-benzo-alpha-pirano-32-h-akridin-7-ona-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения бензо [α] пирано [3,2-h] акридин-7-она и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Новый способ синтеза (7- метокси-1-нафтил)ацетонитрила и его применение при синтезе агомелатина
Следующий патент: Состав со стабилизированными окислительно-восстановительными свойствами и способ стабилизации окислительно-восстановительных свойств
Случайный патент: Вакцины против хламидиоза