Полипептид белка-106 наружной мембраны moraxella catarrhalis, днк, его кодирующие, и их применение
Формула / Реферат
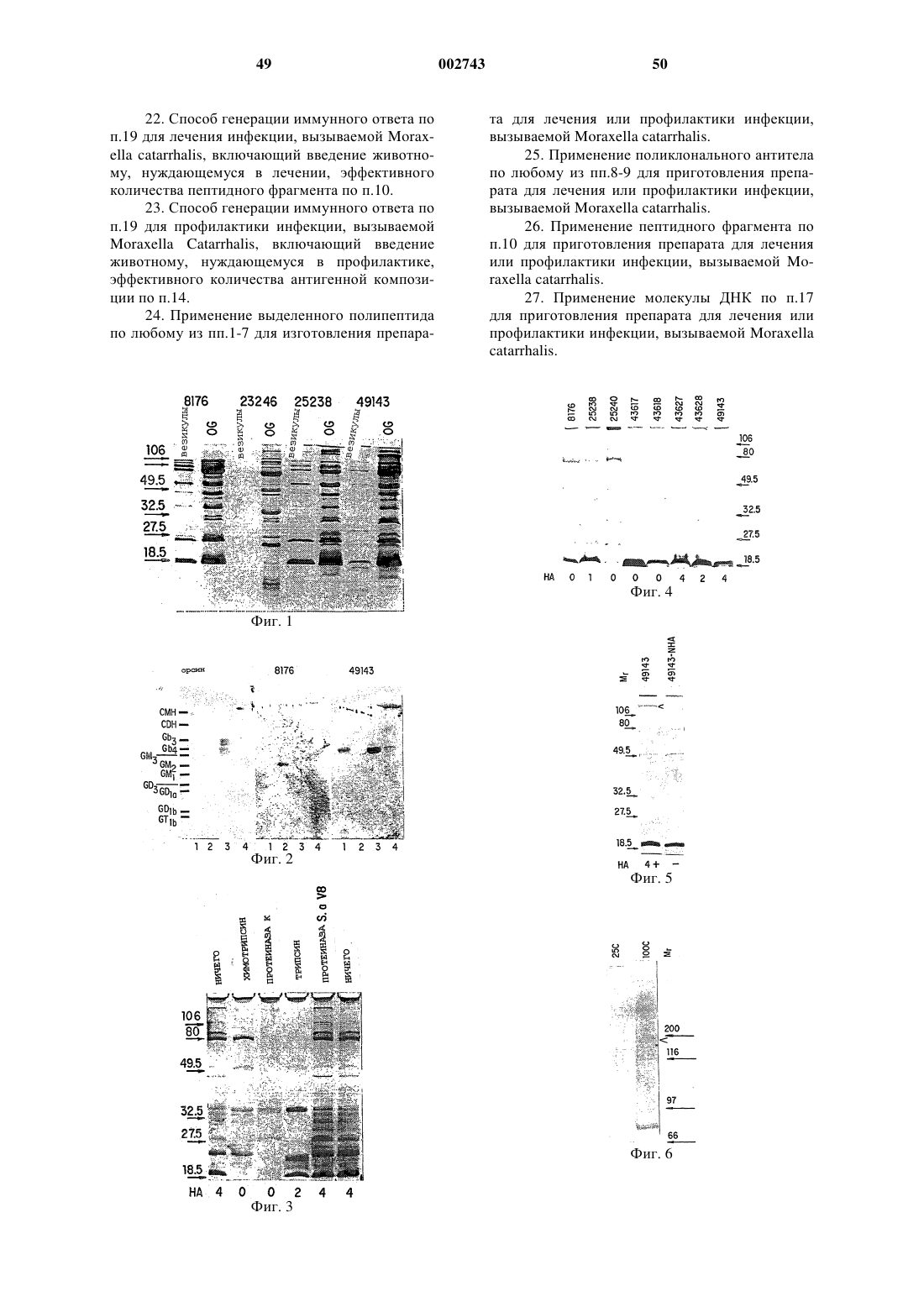
1. Выделенный полипептид ОМP 106, который является полипептидом наружной мембраны Moraxella catarrhalis и имеет молекулярную массу приблизительно от 180 кДа до приблизительно 230кДа, как определено электрофорезом в SDS-полиакриламидном геле с использованием миозина скелетных мышц кролика и 3-галактозидазы E.coli в качестве стандартов молекулярных масс 200 кДа и 116,25 кДа соответственно, и включает либо последовательность SEQ ID NО:1, либо последовательности SEQ ID NО:1 и SEQ ID NО:2.
2. Выделенный полипептид ОМР 106 по п.1, отличающийся тем, что включает последовательности SEQ ID NО:1 и SEQ ID NО:2.
3. Выделенный полипептид ОМР 106 по п.1 или 2, отличающийся тем, что он имеет молекулярную массу приблизительно 190 кДа.
4. Выделенный полипептид ОМР 106 по любому из пп.1-3, отличающийся тем, что он является полипептидом наружной мембраны штамма Moraxella catarrhalis, выбранного из группы, состоящей из АТСС 25238, АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627, АТСС 43628 и АТСС 49143.
5. Выделенный полипептид ОМР 106 по любому из пп.1-4, отличающийся тем, что штамм Moraxella catarrhalis представляет собой АТСС 49143.
6. Выделенный полипептид ОМР 106 по любому из пп.1-5, отличающийся тем, что штамм бактерий Moraxella catarrahalis является гемагглютинирующим культиваром.
7. Выделенный полипептид ОМР 106 по любому из пп.1-6, отличающийся тем, что он взаимодействует с содержащим серебро красителем.
8. Выделенное поликлональное антитело, отличающееся тем, что оно специфично связывает выделенный полипептид ОМР 106 по любому из пп.1-7 или его фрагмент.
9. Выделенное поликлональное антитело по п.8, отличающееся тем, что оно является цитотоксическим антителом, опосредующим уничтожение бактерий Moraxella catarrhalis с помощью комплемента.
10. Пептидный фрагмент полипептида ОМР 106 по любому из пп.1-7, характеризующийся тем, что он специфически связывает антитело по п.8 и включает аминокислотную последовательность SEQ ID NО: 5.
11. Вакцина, содержащая выделенный полипептид ОМР 106 по любому из пп.1-7.
12. Вакцина, содержащая пептидный фрагмент по п.10.
13. Антигенная композиция, содержащая выделенный полипептид ОМР 106 по любому из пп.1-7.
14. Антигенная композиция, содержащая пептидный фрагмент по п.10.
15. Выделенная молекула ДНК, кодирующая выделенный полипептид ОМР 106 по любому из пп.1-7, включающий последовательность SEQ ID NО:1 либо последовательности SEQ ID NО:1 и SEQ ID NО:2, выведенная на основе принципа генетического кода.
16. Выделенная молекула ДНК, кодирующая полипептид ОМР 106 по любому из пп.1-7, включающий SЕQ ID N0:1, выведенная на основе принципа генетического кода.
17. Выделенная молекула ДНК, кодирующая пептидный фрагмент по п.10, включающая последовательность SEQ ID NО:4, а также варианты, полученные на основе вырожденности генетического кода.
18. Способ генерации иммунного ответа у животного, включающий иммунизацию животного эффективным количеством выделенного полипептида ОМР 106 по любому из пп.1-7.
19. Способ генерации иммунного ответа у животного, включающий иммунизацию животного эффективным количеством пептидного фрагмента по п.10.
20. Способ генерации иммунного ответа в животном по п.18 для лечения инфекции, вызываемой Moraxella catarrhalis, включающий введение животному, нуждающемуся в лечении, эффективного количества выделенного полипептида по любому из пп.1-7.
21. Способ генерации иммунного ответа в животном по п.18 для профилактики инфекции, вызываемой Moraxella Catarrhalis, включающий введение животному, нуждающемуся в профилактике, эффективного количества вакцины по п.11.
22. Способ генерации иммунного ответа по п.19 для лечения инфекции, вызываемой Moraxella catarrhalis, включающий введение животному, нуждающемуся в лечении, эффективного количества пептидного фрагмента по п.10.
23. Способ генерации иммунного ответа по п.19 для профилактики инфекции, вызываемой Moraxella Catarrhalis, включающий введение животному, нуждающемуся в профилактике, эффективного количества антигенной композиции по п.14.
24. Применение выделенного полипептида по любому из пп.1-7 для изготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella catarrhalis.
25. Применение поликлонального антитела по любому из пп.8-9 для приготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella catarrhalis.
26. Применение пептидного фрагмента по п.10 для приготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella catarrhalis.
27. Применение молекулы ДНК по п.17 для приготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella catarrhalis.
Текст
1 1. Область техники, к которой относится изобретение Данное изобретение относится в общем к полипептиду белка-106 наружной мембраны(ОМР 106) Moraxella catarrhalis. Данное изобретение включает очищенный полипептид ОМР 106 и производные от него полипептиды(производные от ОМР 106 полипептиды). Данное изобретение включает также антитела, в том числе, цитотоксические антитела, которые специфически связывают полипептид ОМР 106 и/или производные от ОМР 106 полипептиды. Кроме того, данное изобретение включает профилактические или терапевтические композиции, в том числе, вакцины, которые содержат полипептид ОМР 106 и/или производные от ОМР 106 полипептиды. Дополнительно данное изобретение обеспечивает способы индукции иммунных ответных реакций на М. catarrhalis в млекопитающих. Далее, данное изобретение обеспечивает выделенные нуклеотидные последовательности,кодирующие полипептид ОМР 106 и производные от ОМР 106 полипептиды, векторы, имеющие эти последовательности,и клетки-хозяева, содержащие эти векторы. 2. Уровень техникиMoraxella (Branhamella) catarrhalis или Branhamella catarrhalis и ранее известная как Neisseria catarrhalis или Micro coccus catarrhalis, является грамотрицательной бактерией, часто обнаруживаемой в дыхательных путях людей. Moraxella catarrhalis, которую сначала считали безопасным комменсальным организмом, теперь признают как важный патоген в инфекциях верхних и нижних дыхательных путей животных. У людей М. catarrhalis вызывает серьезные инфекции нижних дыхательных путей у пациентов с ослабленной иммунной системой и воспаление среднего уха и синусит у младенцев и детей. См. Helminen еt al., 1993, Infect. Immun. 61:2003-2010; Catlin, B.W., 1990, Clin. Microbiol.Rev. 3:293-320; и цитированные в них ссылки. 2.1. Белки наружной мембраны и защитные антитела Компоненты наружной поверхности Moraxella catarrhalis исследовались в попытке выяснения патогенного процесса инфекций М.catarrhalis и разработки применимых терапевтических способов и профилактических мер против таких инфекций. Белки наружной мембраны(ОМР), в частности, привлекли большое внимание как возможные факторы вирулентности и как потенциальные вакцинные антигены. М.catarrhalis имеет приблизительно 10-20 различных ОМР, причем 6-8 из них, ОМР А - Н, являются преобладающими типами (Murphy andLoeb, 1989, Micribial Pathogen. 6:159-174). Молекулярные массы ОМР А - Н находятся в диапазоне от 97 до 20 кДа, соответственно. См.Immun. 60:804-809. Сравнения белковых профилей при помощи электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСНПААГ) препаратов наружной мембраны из 50 штаммов М. catarrhalis показали почти гомогенные распределения ОМР А - Н (Bartos and Murphy, 1988, J.Infect. Dis. 158:761-765). Кроме ОМР А - Н, высокомолекулярные ОМР, названные HMW-OMP, имеющие среднюю мол. массу 350-720 кДа, согласно ПААГДСН, были идентифицированы также в качестве другого существенного поверхностного компонента, присутствующего во многих штаммах М.catarrhalis. HMW-OMP дают при денатурации муравьиной кислотой одну полосу 120-140 кДа и, следовательно, представляют собой, повидимому, олигомерный белок (Klingman andHMW-OMP, по-видимому, является тем же белком, который был назван UspA Helminen et al.,(1994, J.Infect.Dis. 170:867-872) и, как было показано, присутствует в ряде штаммов М. catarrhalis. В интактной бактерии или полученных из бактерий везикулах наружных мембран некоторые из идентифицированных выше ОМР представляют поверхностно экспонированные эпитопы, которые индуцируют образование антител, которые связывают эти ОМР. Эти антигенные ОМР включают ОМР Е и ОМР G (Murphyand Bartos, 1989, Infect. Immun. 57:2938-2941); ОМР C/D (Sarwar et al., 1992, Infect. Immun. 60:804-809); CopB, OMP 80 кДа, Helminen et al.,1993, Infect. Immun. 61:2003-2010; и UspA (Helminen et al., 1994, J.Infect. Dis. 170:867-872). Терапевтический потенциал антител к поверхностно экспонированным (доступным) эпитопам CopB и UspA оценивали в модели животного. Модель включала непосредственное болюсное инокулирование легких BALB/c VAF/Plus мышей контролируемым количеством клеток М. catarrhalis и последующее исследование скорости легочного клиренса этих бактерий(Unhand et al., 1992, J.Infect. Dis. 165:644-650). Различные клинические изоляты М. catarrhalis обнаруживали различные скорости клиренса,которые коррелировали с уровнем рекрутмента гранулоцитов в сайт инфекции. Пассивная иммунизация моноклональными антителами против поверхностно экспонированного эпитопаCopB или UspA увеличивала скорость легочного клиренса М. catarrhalis (Helminen et al., 1993,Infect. Immun. 61:2003-2010; Helminen et al.,1994, J.Infect. Dis. 170:867-872). 2.2. Адгезия бактерий/клеток-хозяев и гемагглютинация Прикрепление (адгезия) бактериальных патогенов к поверхности клеток-хозяев усиливает колонизацию и инициирует патогенез. См. Е.Н. Beachey, 1981, J.Infect. Dis. 143:325-345. 3 Обычно грамотрицательные бактерии экспрессируют поверхностные лектины, которые связываются со специфическими олигосахаридами гликопротеинов и/или гликолипидов на поверхности клеток-хозяев. Такие лектины часто связаны со жгутиками или фимбриями. Бактериальное прикрепление (адгезия) может также происходить в результате неспецифического связывания, имеющего в основе гидрофобное и/или связанное с зарядами взаимодействие с поверхностью клетки-хозяина. Механизм адгезии М. catarrhalis к клеткам дыхательных путей остается слабо выясненным. Этот организм прикрепляется к культивируемым человеческим эпителиальным клеткам ротоглотки (Mbaki et al., 1987, Tohuku J. Exp. Med. 153:111-121). Исследование Rikitomi et al. предполагает, что фимбрии могут играть роль в адгезии к таким клеткам, так как денатурация фимбрий или обработка антителами против фимбрий снижала адгезию имеющих фимбрии штаммов (Rikitomi et al., 1991, Scand. J.Infect.Dis. 23:559-567). Однако опосредованное фимбриями связывание не может быть единственной основой этой адгезии, так как в наибольшей степени прикрепляющимся штаммом, среди испытанных штаммов, был штамм, не имеющий фимбрий. Реакции гемагглютинации часто заменяют более сложные тесты адгезии при классификации бактериальных адгезинов. Однако Rikitomiet al. не нашли корреляции между адгезией к человеческим эпителиальным клеткам ротоглотки и гемаглютинацией при использовании штаммов М. catarrhalis (Id.). А именно, три штамма с высокой адгезией не агглютинировали человеческие эритроциты. Таким образом, в адгезии человеческих эпителиальных клеток ротоглотки и гемагглютинации участвуют различные механизмы связывания. В противоположность этому, недавнее исследование Kellens et al. предполагает, что гемагглютинация посредством М. catarrhalis коррелирует с адгезией клетки-хозяина (Kellens etal., 1995, Infection 23:37-41). Однако это исследование использовало тест адгезии, основанный на бактериальном связывании с отрезками трахеи свиньи. Неизвестно, может ли ткань трахеи свиньи рассматриваться как гомологичная с тканью дыхательных путей человека в отношении адгезии патогенных штаммов М. catarrhalis. Несмотря на проблематичный тест адгезии, Kellens et al. исследовали активность гемагглютинации более восьмидесяти клинических изолятов М. catarrhalis (Kellens et al., 1995,Infection 23:37-41). Почти три четверти испытанных штаммов агглютинировали эритроциты человека, кролика, морской свинки, собаки или крысы, тогда как остальные штаммы не вызывали агглютинации. Активность агглютинации для некоторых из гемагглютинирующих штаммов характеризовались дополнительно, и было 4 обнаружено, что она зависит от ионов кальция и ингибируется расщеплением трипсином или высокотемпературной обработкой или добавлением D-глюкозамина или D-галактозамина. Обследование гемагглютинирующих и негемагглютинирующих штаммов M.catarrhalisTucker et al. показало, что все штаммы связывают гликолипид ганглиотетраозилцерамид, но только гемагглютинирующие штаммы связывают гликолипид глоботетраозилцерамид (TuckerM.catarrhalis ингибируется различными моносахаридами, которые содержат углеводную часть молекулы глоботетраозилцерамида. Это наблюдение позволило Tucker et al. предположить, чтоM.catarrhalis производит гемагглютинацию путем связывания с глоботетраозилцерамидами в клеточных мембранах чувствительных эритроцитов, в том числе, эритроцитов человека. До настоящего времени не была идентифицирована молекула на наружной поверхности M.сatarrhalis, которая ответственна либо за адгезию клетки-хозяина, либо за гемагглютинацию. Цитирование или идентификация любой ссылки в этом разделе или в любом другом разделе этой заявки не должна рассматриваться как указание на то, что такая ссылка доступна в качестве прототипа данного изобретения. 3. Сущность изобретения Данное изобретение включает полипептид ОМР 106 M.catarrhalis и производные от ОМР 106 полипептиды и способы получения этих полипептидов. Данное изобретение включает также антисыворотки и антитела, в том числе цитотоксические антитела, специфические для полипептида ОМР 106 и/или производных от ОМР 106 полипептидов. Далее данное изобретение включает иммуногенные, профилактические или терапевтические композиции, в том числе вакцины, содержащие один или несколько указанных полипептидов. Дополнительно данное изобретение включает нуклеотидные последовательности, кодирующие эти полипептиды. Далее данное изобретение включает иммуногенные, профилактические или терапевтические композиции, в том числе вакцины, содержащие аттенуированный или инактивированный негемагглютинирующий культиварM.catarrhalis. Данное изобретение имеет много применений. Например, полипептид ОМР 106 и производные от ОМР 106 полипептиды могут быть использованы в качестве лигандов для обнаружения антител, индуцированных в ответ на инфекции M.catarrhalis (например, в диагностике инфекций M.catarrhalis). Полипептид ОМР 106 и производные от ОМР 106 полипептиды могут быть также использованы в качестве иммуногенов для индуцирования М.catarrhalis-специфических антител. Такие антитела применимы в 5 иммуноанализах для детектирования M.catarrhalis в биологических образцах. Цитотоксичные антитела данного изобретения применимы в пассивных иммунизациях против инфекцийM.catarrhalis. Кроме того, полипептид ОМР 106 и производные от ОМР 106 полипептиды могут быть использованы в качестве активных ингредиентов в вакцинах против инфекций М.catarrhalis. Данное изобретение основано на неожиданном обнаружении, что гемагглютинирующие штаммы и культивары M.catarrhalis имеют белок наружной мембраны, полипептид ОМР 106,который имеет молекулярную массу примерно от 180 до 230 кДа, и что негемагглютинирующие штаммы и культивары M.catarrhalis не имеют полипептида ОМР 106 или имеют неподходящим образом модифицированный полипептид ОМР 106, который неактивен в гемагглютинации и не окрашивается серебром. Далее данное изобретение основано на открытии, что поликлональная антисыворотка, индуцируемая полипептидом ОМР 106, выделенным из гемагглютинирующего штамма M.catarrhalis, имеет цитотоксическую активность против отличающегося гемагглютинирующего штамма M.catarrhalis, но не против негемагглютинирующего штамма M.catarrhalis. 3.1. Определения и аббревиатуры Анти-ОМР 106 = антитело или антисыворотка против полипептида ОМР 106; АТСС = American Type Culture Collection; пузырьки= природновстречающиеся везикулы наружных мембранGb4 = GаlNас 1-3Gаl1-4Gа 11-4Gа 1 с 11-церамид; НА = гемагглютинация; иммунореактивный = способный провоцировать клеточный или гуморальный иммунный ответ; кДа = килодальтон;OMP106 = полипептид белка-106 наружной мембраны Moraxella catarrhalis, имеющий молекулярную массу приблизительно 180 -230 кДа, согласно электрофорезу в ПААГ=ДСН; экстрагируемый из везикул или интактных клеток M.catarrhalis при помощи OG или содержащего саркозил детергента; производный от OMP106 полипептид = фрагмент полипептида OMP106; вариант полипептида OMP106 дикого типа или его фрагмент,содержащий одну или несколько делеций, инсерций (вставок) или замен аминокислот; или 6 химерный белок, содержащий гетерологичный полипептид, слитый с С-концевым, N-концевым или внутренним сегментом целого или части полипептида OMP106; ОМР = белок наружной мембраны; белки ОМР = белки наружной мембраны;PBS = забуференный фосфатом солевой раствор;PAG = полиакриламидный гель; полипептид = пептид любой длины, предпочтительно имеющий десять или более аминокислотных остатков;SDS-PAGE (ПААГ-ДСН) = электрофорез в додецилсульфатполиакриламидном геле. Нуклеотидные последовательности или последовательности нуклеиновых кислот, определенные здесь, представлены однобуквенными символами для оснований, такими как: А (аденин); С (цитозин);N (А или С или G или T/U) или (неизвестное). Пептидные или полипептидные последовательности, определенные здесь, представлены однобуквенными символами для аминокислотных остатков, такими как: А (аланин); 7 Данное изобретение может быть более полно понятым со ссылкой на следующее далее подробное описание данного изобретения, неограничивающие примеры характерных вариантов данного изобретения и прилагаемые рисунки. 4. Краткое описание чертежей Фиг. 1: сравнение при помощи PAGE(электрофореза в полиакриламидном геле) профилей белков наружной мембраны везикул М.catarrhalis или октилглюкозидных (OG) экстрактов целых клеток М.catarrhalis. Цифры над дорожками относятся к АТСС-обозначениям штаммов. Предварительно окрашенный стандарт SDS-PAGE (BioRad catalog161-0305) использовали в качестве маркеров молекулярных масс. Стандарт состоял из следующих полипептидов с их приблизительными молекулярными массами, указанными в скобках: фосфорилазы В мышц кролика (106 кДа); бычьего сывороточного альбумина (80 кДа); овальбумина белка куриного яйца (49,5 кДа); бычьей карбоангидразы(32,5 кДа); ингибитора трипсина сои (27,5 кДа); лизоцима белка куриного яйца (18,5 кДа). Положения маркеров молекулярных масс в геле показаны на левой стороне рисунка стрелками с молекулярными массами (кДа) некоторых маркеров над этими стрелками. Фиг. 2: результаты разделения на тонкослойных хроматограммах гликолипидов с 125Iмечеными везикулами наружных мембран. В Панелях А-С, дорожка 1 содержит гликолипидные стандарты, указанные слева; дорожка 2 содержит асиало-GM1; дорожка 3 содержит Gb3,Gb4 и антиген Форссмана; и дорожка 4 содержит экстракт по Фолчу эритроцитов человека. Хроматограмма, показанная в Панели А, окрашена орсином, хроматограмма, показанная в Панели В, покрыта сверху 125I-мечеными везикулами штамма АТСС 8176 (негемагглютинирующего штамма), а хроматограмма, показанная в Панели С, покрыта сверху 125I-мечеными везикулами штамма АТСС 49143 (гемагглютинирующего штамма). Только гемагглютинирующий штамм связывался с полосой гликолипидаGb4 на третьей и четвертой дорожках. Фиг. 3: белковые профили при окрашивании серебром октилглю-козидных экстрактов белков наружных мембран после расщепления клеток M.catarrhalis протеазами, указанными на рисунке. Активность гемагглютинации клеток после расщепления показана ниже рисунка в ряду, обозначенном НА. Использованные маркеры молекулярных масс соответствовали маркерам на фиг. 1. Фиг. 4: сравнение белковых профилей при окрашивании серебром белков наружных мембран из различных штаммов АТСС M.catarrhalis. Обозначения штаммов указаны над дорожками. Активность гемагглютинации штаммов указана в ряду НА ниже рисунка. Обратите внимание,что белок, имеющий среднюю молекулярную массу, большую, чем молекулярная масса фос 002743 8 форилазы В мышц кролика (106 кДа), является общим для гемагглютинирующих штаммов, но отсутствует в негемагглютинирующих штаммах. Этот полипептид назван ОМР 106. Использованные маркеры молекулярных масс соответствовали маркерам на фиг. 1. Фиг. 5: сравнение белковых профилей при окрашивании серебром белков наружных мембран из двух культиваров M.catarrhalis АТСС 49143: 49143 (гемагглютинирующего культивара) и 49143-NHA (негемагглютинирующего культивара). Активности гемагглютинации этих культиваров указаны ниже рисунка в ряду НА. Обратите внимание на отсутствие полосы полипептида ОМР 106 (указанной ) в негемагглютинирующем культиваре. Использованные маркеры молекулярных масс соответствовали маркерам на фиг. 1. Фиг. 6: оценка молекулярной массы ОМР 106 в 6% денатурирующем полиакриламидном геле с использованием OG-экстрактов штамма АТСС 49143, которые инкубировали в буфере для нанесения проб при 25 С или при 100 С перед нанесением на гель. Белки в геле визуализировали восстановительным окрашиванием серебром. Обратите внимание, что полоса полипептида ОМР 106 (указанная ) видна только в пробе, инкубированной при 100 С. В качестве маркеров молекулярных масс использовали стандарт широкого диапазона для SDSPAGE (BioRad catalog161-0317). Стандарт состоял из следующих полипептидов (приблизительно молекулярные массы указаны в скобках): миозина скелетных мышц кролика (200 кДа); -галактозидазы E.coli (116 кДа); фосфорилазы В мышцы кролика (97,4 кДа); бычьего сывороточного альбумина (66,2 кДа). Положения маркеров молекулярных масс в геле указаны на правой стороне рисунка стрелками с молекулярными массами (кДа) маркеров над этими стрелками. Фиг. 7: блот-анализ по Саузерну гидролизатов рестриктаз DraI и HindIII хромосомной ДНК M.catarrhalis, зондированных Мс 5-72. ДНК штамма M.catarrhalis 49143 расщепляли DraI или HindIII. Анализ по Саузерну расщепленной ДНК проводили с использованием Мс 5-72 (SEQID N 4) в качестве зонда. Промывка высокой строгости была 2 хSSC, 1% ДСН при 50 С в течение приблизительно 20-30 мин. Дорожка 1 содержит гидролизат HindIII; гибридизующаяся полоса имеет приблизительный размер 8,0 т.п.н. Дорожка 2 содержит гидролизат DraI: гибридизующаяся полоса имеет приблизительный размер 4.2 т.п.н. Фиг. 8 А и 8 В: Вестерн-блоты белковых экстрактов M.catarrhalis и родственных видов с использованием кроличьей антисыворотки к ОМР 106 в качестве зонда (фиг. 8 А) сравнивали с реактивностью этой сыворотки перед иммунизацией кролика ОМР 106 (фиг. 8 В). Пробы в дорожках фиг. 8 А и 8 В являются следующими:ovis; дорожка С, Moraxella lacunata; дорожка D,Moraxella osloensis; дорожка Е, Moraxella bovis: дорожка F: Neisseria meningitidis; дорожка G,Neisseria gonorrhoeae. Использованные маркеры молекулярных масс соответствовали маркерам на фиг. 1. Фиг. 9 А: Вестерн-блот, показывающий,что кроличья антисыворотка к полипептиду ОМР 106 из штамма M.catarrhalis 49143 перекрестно реагирует с полипептидом той же молекулярной массы в ряде НА- и NHA штаммовM.catarrhalis (положение полипептида ОМР 106 указано стрелкой). В этом Вестерн-блоте исследовали октилглюкозидные экстракты различных штаммов M.catarrhalis. Номера доступа в АТСС этих штаммов указаны над дорожками. Использованные процедуры переноса и Вестернблоттинга были идентичны процедурам, использованным для получения блотов, показанных на фиг. 8. Фиг. 9 В: Вестерн-блот тех же самых экстрактов, что и в фиг. 9 А, с использованием преиммунной сыворотки, соответствующей сыворотке, использованной в фиг. 9 А. 5. Сведения, подтверждающие возможность осуществления изобретения 5.1. Гемагглютинирующий и негемагглютинирующий культивары Данное изобретение обеспечивает выделенный или, по существу, чистый полипептид ОМР 106 M.catarrhalis. Полипептид ОМР 106 содержит весь белок или субъединицу белка,погруженные в наружную мембрану или расположенные на наружной поверхности наружной мембраны гемагглютинирующих (НА) штаммов и многих негемагглютинирующих (NHA) штаммов и культиваров M.catarrhalis. OMP106 прямо или опосредованно способствует созданию фенотипа гемагглютинации НА штаммов и культиваров. Согласно данному изобретению,НА клетки M.catarrhalis агглютинируют эритроциты человека или кролика в любом стандартном тесте гемагглютинации, таком как описанный Soto-Hernandez et al. 1989, J. Clin. Microbiol. 27:903-908. Хотя и без намерения ограничения каким-либо конкретным механизмом действия,в настоящее время рассматривается вопрос о том, что M.catarrhalis агглютинирует эритроциты путем связывания с глоботетрозной (Gb4) частью гликолипидных и гликопротеиновых рецепторов на поверхностях клеток-хозяев и что активность гемагглютинации опосредована отчасти подходящим образом модифицированным полипептидом OMP106, который обладает специфическим свойством чувствительности к окрашиванию серебром. В противоположность этому, немодифицированный или неподходящим образом модифицированный полипептид 10 полипептидом, имеющим среднюю молекулярную массу приблизительно 180 - 230 кДа при электрофорезе в ПААГ-ДСН (SDS-PAGE), который может экстрагироваться OG или саркозилом из НА или NHA везикул или интактных клеток M.catarrhalis. Гемагглютинирующая активность НА клеток M.catarrhalis ингибируется глоботетрозой(GalNac1-3Ga11-4Ga11-4Ga1c1; Gb4) и моносахаридами, которые содержат Gb4, в том числе, N-ацетил-D-галактозамином, D-галактозой и глюкозой и их производными, такими как метилгалактоза или метилгалактоза. Гемагглютинирующая активность НА клетокM.catarrhalis ингибируется также относительно более высокими концентрациями ряда других сахаров, в том числе (но не только) D-маннозы,L-фукозы, D-глюкозы и N-ацетил-О-глюкозамина. Гемагглютинирующая активность и полипептид ОМР 106 интактных НА клетокM.catarrhalis уменьшаются или разрушаются при расщеплении интактных клеток M.catarrhalis различными протеазами, в том числе (но не только) обработанным TLCK (Н-п-тозил-Lлизин-хлорметилкетоном [также известным как 1-хлор-3-тозиламино-7-амино-L-2-гептанон]) трипсином. Однако расщепление протеазой V8 интактных НА клеток M.catarrhalis не влияет ни на гемагглютинирующую активность, ни на физическую целостность полипептида ОМР 106 таких клеток. Неагглютинирующий (NHA) культивар может быть произведен из НА штамма или культивара M.catarrhalis серийным пассажем в статических жидких культурах (т.е. жидких культурах, поддерживаемых при 35 С без встряхивания). Например, НА штамм или культивар M.catarrhalis выращивают в бульоне Мюллера-Хинтона и каждые 5 дней берут инокулят (посевной материал) с поверхности статической культуры для инокулирования последующей статической культуры. Предпочтительным инокулятом является любой плавающий ковер клеток на поверхности культуры. Серийный пассаж в статических культурах поддерживают, пока не образуется NHA культивар.NHA культивар данного изобретения может быть использован для получения защитных вакцин, таких как цельно-клеточные вакцины, против инфекций M.catarrhalis. В противоположность этому гемагглютинирующий фенотип НА штамма или культивара М.catarrhalis может быть сохранен пассажем этого штамма или культивара во встряхиваемых жидких культурах. В одном варианте НА штамм или культивар М.catarrhalis выращивают в бульоне Мюллера-Хинтона при 35-37 С со встряхиванием при приблизительно 200 об/мин, и пассируют каждые 24-48 ч. Гемагглютинирующий фенотип НА штамма или культивара М.catar 11rhalis может быть также сохранен пассажем на твердых средах. Например, НА штамм или культивар выращивают на чашке, содержащей кровяной агар или агар Мюллера-Хинтона. 5.2. Полипептид ОМР 106 Полипептид ОМР 106 данного изобретения является единственным белком наружной мембраны НА штамма или культивара М.catarrhalis,который имеет среднюю молекулярную массу вSDS-PAGE приблизительно 180 - 230 кДа,предпочтительно примерно 190 кДа. Согласно данному изобретению, белок наружной мембраны М.catarrhalis представляет собой полипептид, который присутствует в пузырьках (везикулах) М.catarrhalis или который может быть экстрагирован из везикул или интактных клеток М.catarrhalis н-октилD-глюкопиранозидом(OG) или содержит саркозил детергентом в буферном растворе при комнатной температуре. См. Murphy and Loeb, 1989, Microbial Pathogenesis 6:159-174, в отношении обсуждения везикул М. catarrhalis, которые являются природновстречающимися везикулами, состоящими из наружной мембраны М. catarrhalis. NHA штаммы или культивары М.catarrhalis либо не имеют полипептида ОМР 106, либо имеют полипептид ОМР 106 в форме, которая связывает антитела против ОМР 106 (см. раздел 5.5, infra), но не взаимодействует с содержащим серебро красителем (а именно, при использовании красителяSilver Stain Plus BioRad [Richmond, CA] или процедуры, описанной Gottlieb and Chauko,1987, Anal. Biochem. 165:33). В противоположность этому, полипептид ОМР 106 из НА штаммов или культиваров связывает антитела против ОМР 106 и реагирует с содержащим серебро красителем. Полипептид ОМР 106 может быть идентифицирован в НА везикулах или штаммахM.catarrhalis по его чувствительности к деградации при обработке протеазой, которая также уничтожает или аттенуирует гемагглютинирующую активность того же НА штамма (См. Раздел 5.1. выше в отношении примеров протеаз, которые разрушают или не разрушают гемагглютинирующую активность интактных клеток M.catarrhalis). Другими словами, расщепление протеазой, которая разрушает или снижает гемагглютинирующую активность НА штамма или культивара, будет также изменять, в SDSPAGE, обилие или положение полипептида ОМР 106, выделенного из штамма или культивара после такого расщепления, в сравнении с полипептидом ОМР 106, выделенным из того же самого штамма или культивара перед расщеплением. Полипептид ОМР 106 может быть также идентифицирован в виде полилептида в OGили саркозильном экстракте везикул или интактных клеток M.catarrhalis, который имеет среднюю молекулярную массу более 196 кДа,определенную при помощи денатурирующегоSpring Harbor Laboratory Press, Cold Spring Harbor, NY, Appendix I, 1988). Обработка нагреванием OG- или саркозильного экстракта при 100 С в течение 5 мин может дать полипептид ОМР 106, имеющий среднюю молекулярную массу приблизительно 180 - 230 кДа, как определено SDS-PAGE в 6% ПААГ без восстанавливающих агентов с использованием процедур,описанных в Harlow and Lane, id. В специфическом варианте, полипептид ОМР 106 в обработанном нагреванием OG- или саркозильном экстракте штамма АТСС 49143 M.catarrhalis имеет среднюю молекулярную массу около 190 кДа. В специфических вариантах полипептид ОМР 106 является полипептидом, полученным из любого из штаммов M.catarrhalis (но не только), включающих АТСС 49143, АТСС 25238,АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627 и АТСС 43628. Предпочтительным источником полипептида ОМР 106 является НА культивар таких штаммов. Более предпочтительным источником является НА культивар АТСС штамма 49143. В конкретном варианте полипептид ОМР 106 содержит, предпочтительно при аминоконце, аминокислотную последовательностьQSIAIGDNKIV (SEQ ID N 1) или последовательность, по существу, гомологичную ей. Полипептид ОМР 106 может дополнительно содержать карбоксилдистально относительно вышеупомянутой последовательности октапептид,имеющий аминокислотную последовательностьGTVLGGKK (SEQ ID N 2) или последовательность, по существу, гомологичную ей. В применении здесь, по существу, гомологичная аминокислотная последовательность, по меньшей мере, на 80%, предпочтительно на 100%, идентична цитированной выше аминокислотной последовательности. В соответствии с различными аспектами данного изобретения полипептиды данного изобретения характеризуются их средними молекулярными массами на основе миграции полипептидов в SDS-PAGE относительно маркеров известных молекулярных масс. Хотя в электрофорезе в ПААГ-ДСН (SDS-PAGE) могут быть использованы любые стандарты молекулярных масс, известные в данной области, предпочтительные маркеры молекулярных масс включают, по меньшей мере, миозин скелетных мышц кролика, -галактозидазу E.coli и фосфорилазу В мышц кролика. Специалисту в данной области будет понятно, что полипептиды данного изобретения могут мигрировать различно в различных типах систем геля (например, в различных буферах; при различной концентрации геля,сшивающего средства или ДСН). Специалисту в данной области будет также понятно, что поли 13 пептиды могут иметь различные средние молекулярные массы в зависимости от различных маркеров молекулярных масс, используемых при SDS-PAGE. Таким образом, характеристика при помощи молекулярных масс полипептидов данного изобретения предполагает охват одних и тех же полипептидов на любой системе SDSPAGE и с любыми маркерами молекулярных масс, которые могут показывать слегка отличающиеся молекулярные массы для этих полипептидов, в сравнении со средними молекулярными массами, описанными здесь. 5.3. Производные от ОМР 106 полипептиды Производный от ОМР 106 полипептид данного изобретения может быть фрагментом полипептида ОМР 106. Интактный полипептид ОМР 106 может содержать один или несколько аминокислотных остатков, которые не являются необходимыми для его иммуногенности. Может быть, например, так, что только аминокислотные остатки, образующие специфический эпитоп полипептида ОМР 106, являются необходимыми для иммуногенной активности. Необязательные аминокислотные последовательности могут быть удалены способами, хорошо известными в данной области. Например, нежелательные аминокислотные последовательности могут быть удалены ограниченным протеолитическим расщеплением с применением таких ферментов, как трипсин, папаин или родственные протеолитические ферменты, или химическим расщеплением с использованием таких агентов,как цианогенбромид, с последующим фракционированием продуктов гидролиза или расщепления. Производный от ОМР 106 полипептид данного изобретения может быть также модифицированным полипептидом ОМР 106 или его фрагментом (т.е. полипептидом ОМР 106 или фрагментом, имеющим одну или несколько замен, вставок и/или делеций аминокислот последовательности ОМР 106 дикого типа). Такие модификации могут усиливать иммуногенность полученного полипептидного продукта или не влиять на эту активность. Способы модификации, которые могут быть использованы, включают способы, описанные в U.S. Patent N 4 526 716. Производный от ОМР 106 полипептид может, кроме того, быть химерным полипептидом,содержащим один или несколько гетерологичных полипептидов, слитых с аминоконцевым или карбокси-концевым или внутренним сегментом полного полипептида ОМР 106,или его частью или фрагментом. Применимые гетерологичные полипептиды, содержащие такой химерный полипептид, включают (но не ограничиваются ими) а) пре- и/или пропоследовательности, которые облегчают транспорт,транслокацию и/или процессинг производного от ОМР 106 полипептида в клетке-хозяине, b) последовательности для аффинной очистки и с) 14 любые применимые иммуногенные последовательности (например, последовательности, кодирующие один или несколько эпитопов поверхностно-экспонированного белка микробного патогена). Предпочтительно,производные от ОМР 106 полипептиды данного изобретения являются иммунологически перекрестнореактивными с полипептидом ОМР 106 и, таким образом, способными индуцировать в животном иммунный ответ на M.catarrhalis. Более предпочтительно, производные от ОМР 106 полипептиды данного изобретения содержат последовательности, образующие один или несколько эпитопов наружной поверхности нативного полипептида ОМР 106 M.catarrhalis (т.е. поверхностно-экспонированных эпитопов полипептида ОМР 106 в том виде, в котором он существует в интактных клетках M.catarrhalis). Такие предпочтительные производные от ОМР 106 полипептиды могут быть идентифицированы по их способности специфически связывать антитела,индуцированные интактными клетками M.catarrhalis (например, антитела, индуцированные фиксированными формальдегидом или глутаровым альдегидом клетками M.catarrhalis; такие антитела называются здесь антицельноклеточными антителами). Например, полипептиды или пептиды из ограниченного или полного протеазного гидролиза полипептида ОМР 106 фракционируют при помощи стандартных способов и тестируют на их способность связывать антицельноклеточные антитела. Peaкционноспособные полипептиды включают предпочтительные произведенные из ОМР 106 полипептиды. Их выделяют и их аминокислотные последовательности определяют способами, известными в данной области. Также предпочтительно, произведенные из ОМР 106 полипептиды данного изобретения содержат последовательности, которые образуют один или несколько эпитопов нативного полипептида ОМР 106, которые медиируют (опосредуют) гемагглютинацию, вызываемую НА клетками M.catarrhalis. Такие предпочтительные производные от ОМР 106 полипептиды могут быть идентифицированы по их способности противодействовать гемагглютинации, вызываемой НА клетками M.catarrhalis. Например,полипептиды ограниченного или полного протеазного гидролиза или химического расщепления полипептида ОМР 106 фракционируют при помощи стандартных способов и тестируют на способность препятствовать гемагглютинации,вызываемой клетками M.catarrhalis. После идентификации и выделения аминокислотные последовательности таких предпочтительных производных от ОМР 106 полипептидов определяют при помощи стандартных способов секвенирования. Определенная последовательность может быть использована для получения таких поли 15 пептидов синтетическими химическими и/или генно-инженерными способами. Эти предпочтительные производные от ОМР 106 полипептиды могут быть также идентифицированы с использованием антител против целых клеток для скрининга бактериальных библиотек, экспрессирующих случайные фрагменты геномной ДНК M.catarrhalis или клонированных нуклеотидных последовательностей,кодирующих полипептид ОМР 106. См., например, Sambrook et al., Molecular Cloning; A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, NY, Vol.1, Chapter 12. Реактивные клоны идентифицируют и их вставки выделяют и секвенируют для определения аминокислотных последовательностей предпочтительных производных от ОМР 106 полипептидов. 5.4. Выделение и очистка полипептида ОМР 106 и производных от ОМР 106 полипептидов Данное изобретение обеспечивает выделенные полипептиды ОМР 106 и производные от ОМР 106 полипептиды. В применении здесь,термин выделенный обозначает, что продукт,по существу, свободен от других биологических материалов, с которыми он природно связан. Т.е., например, содержащая выделенный полипептид ОМР 106 композиция имеет между 70 и 94 мас.% чистого полипептида ОМР 106. Предпочтительно, полипептид ОМР 106 и производные от ОМР 106 полипептиды являются очищенными. В применении здесь, термин очищенный обозначает, что продукт, по существу,свободен от другого биологического материала,с которым он природно связан. Т.е. содержащая очищенный полипептид ОМР 106 композиция имеет, по меньшей мере, 95 мас.% чистого полипептида ОМР 106, предпочтительно, по меньшей мере, 98 мас.% чистого полипептида ОМР 106 и, наиболее предпочтительно, по меньшей мере, 99 мас.% чистого полипептида ОМР 106. Полипептид ОМР 106 данного изобретения может быть выделен из белковых экстрактов, в том числе цельно-клеточного экстракта, любого штамма или культивара M.catarrhalis. Предпочтительно, белковым экстрактом является октилглюкозидный или саркозильный экстракт везикул наружных мембран (т.е. пузырьков) или целых клеток M.catarrhalis, в том числе (но не только) любых из штаммов АТСС 49143, АТСС 25238, АТСС 25240, АТСС 43617, АТСС 43618,АТСС 43627 и АТСС 43628. Предпочтительным источником таких экстрактов является НА культивар таких штаммов. Более предпочтительным источником таких экстрактов является НА культивар АТСС 49143. Другим источником полипептида ОМР 106 являются белковые препараты из генных экспрессионных систем, экспрессирующих клонированные последовательности,кодирующие полипептид ОМР 106 или производные от ОМР 106 полипептиды (см. Раздел 5.8. infra). 16 Полипептид ОМР 106 может быть выделен и очищен из материала источника при помощи любого биохимического способа и подхода, хорошо известного специалистам в данной области. При одном подходе наружную мембрануM.catarrhalis получают стандартными способами и белки наружной мембраны солюбилизируют с использованием солюбилизирующего соединения, такого как детергент. Предпочтительным солюбилизирущим раствором является раствор около 1,25% октилглюкопиранозида (м/об)(OG). Другим предпочтительным солюбилизирующим раствором является раствор, содержащий около 1,25% саркозил. Полипептид ОМР 106 находится в солюбилизированной фракции. Клеточные остатки и нерастворимый материал в этом экстракте отделяют и удаляют предпочтительно центрифугированием. Полипептиды в экстракте концентрируют, инкубируют в буфере Лэммли для проб для содержащего ДСН геля при 100 С в течение 5 мин и затем фракционируют при помощи электрофореза в 6% денатурирующем содержащем додецилсульфат натрия (ДСН) полиакриламидном(ПААГ) геле без восстанавливающего агента. См. Laemmli, 1970, Nature 227:680-685. Полоса или фракция, идентифицированная как полипептид ОМР 106, как описано выше (например,окрашенная серебром полипептидная полоса,которая присутствует в OG- или саркозильном экстракте НА, но не в экстракте соответствующего NHA культивара или в экстракте НА культивара после гидролиза протеазой, который уничтожает гемагглютинирующую активность) может быть затем выделена непосредственно из этой фракции или кусочка геля, содержащего полипептид ОМР 106. В предпочтительном варианте, полипептид ОМР 106 имеет среднюю молекулярную массу 190 кДа, как определено сравнением его расстояния или скорости миграции в денатурирующем SDS-PAGE относительно расстояния или скорости миграции миозина скелетных мышц кролика (200 кДа) и галактозидазы E.coli (116 кДа). Другим способом очистки полипептида ОМР 106 является аффинная хроматография с использованием антител против ОМР 106 (см. Раздел 5.5). Предпочтительно, используют моноклональные антитела против ОМР 106. Эти антитела ковалентно связывают с агарозными гелями, активированными цианогенбромидом или сложными эфирами сукцинамида (Affi-Gel,BioRad, Inc.), или другими способами, известными специалистам в данной области. Белковый экстракт нагружают на верхнюю часть геля, как описано выше. Это контактирование проводят в течение периода времени и при стандартных условиях реакции, достаточных для связывания полипептида ОМР 106 с антителом. Предпочтительно твердый носитель представляет собой материал, используемый в хроматографической колонке. Затем полипептид ОМР 106 удаляют из 17 антитела, что позволяет извлечь полипептид ОМР 106 в выделенном или, предпочтительно,очищенном виде. Производный от ОМР 106 полипептид данного изобретения может быть получен химическим и/или ферментативным расщеплением или деградацией выделенного или очищенного полипептида ОМР 106. Производный от ОМР 106 полипептид может быть также химически синтезирован на основе известной аминокислотной последовательности полипептида ОМР 106 и, в случае химерного полипептида, аминокислотных последовательностей гетерологичного полипептида, способами, хорошо известными в данной области. См., например, Creighton, 1983,Proteins: Structures and Molecular Principles, W.H.Freeman and Co., NY. Производный от ОМР 106 полипептид может быть также получен в генной экспрессионной системе, экспрессирующей рекомбинантную нуклеотидную конструкцию, содержащую последовательности, кодирующие производные от ОМР 106 полипептиды. Нуклеотидные последовательности, кодирующие полипептиды данного изобретения, могут быть синтезированы и/или клонированы и экспрессированы в соответствии со способами, хорошо известными специалистам в данной области. См., например,Sambrook et al., Molecular Cloning: A LaboratoryPress, NY, Chapter 9. Производные от ОМР 106 полипептиды данного изобретения могут быть фракционированы и очищены с применением стандартных способов очистки белков, модифицированных и примененных в соответствии с приведенными здесь открытиями и описаниями. В частности,предпочтительные полипептиды ОМР 106 данного изобретения, те, которые образуют эпитоп наружной поверхности нативного полипептида ОМР 106, могут быть выделены и очищены в соответствии с аффинными способами, описанными выше для выделения и очистки полипептида ОМР 106 (например, аффинной очисткой с использованием антител против ОМР 106). Если желательно, полипептиды данного изобретения могут быть очищены дополнительно с применением стандартных способов очистки белков или пептидов, в том числе (но не только) электрофореза, центрифугирования,гель-фильтрации, преципитации, диализа, хроматографии (в том числе ионообменной хроматографии, аффинной хроматографии, иммуноадсорбентной аффинной хроматографии, жидкостной хроматографии высокого разрешения с обращенной фазой и гель-проникающей жидкостной хроматографии высокого разрешения),изоэлектрического фокусирования и их вариаций и комбинаций. Один или несколько из этих способов могут быть применены последовательно в проце 002743 18 дуре, предназначенной для разделения молекул в соответствии с их физическими или химическими характеристиками. Эти характеристики включают гидрофобность, заряд, связывающую способность и молекулярную массу белка. Различные фракции веществ, полученные после каждого способа, тестируют на их способности связывать рецептор или лиганд ОМР 106 или препятствовать гемагглютинации, вызываемой НА клетками M.catarrhalis (тест - активности). Затем фракции, обнаруживающие такую активность, подвергают следующему способу в последовательной процедуре, и новые фракции снова тестируют. Этот процесс повторяют до тех пор, пока не остается только одна фракция,имеющая вышеописанные темст-активности,и эта фракция дает только единственную полосу или молекулярную частицу при электрофорезе в полиакриламидном геле или хроматографии. 5.5. Иммуногены ОМР 106 и антитела против ОМР 106 Данное изобретение обеспечивает антитела, которые специфически связывают полипептид ОМР 106 или производные от ОМР 106 полипептиды. Для получения таких антител выделенные или предпочтительно очищенные препараты полипептида ОМР 106 или производных от ОМР 106 полипептидов используют в качестве иммуногенов. В одном варианте полипептид ОМР 106 отделяют от других белков наружной мембраны,присутствующих в OG- или саркозильном экстракте наружной мембраны НА клеток или везикулов M.catarrhalis, при помощи SDS-PAGE(См. раздел 5.2. выше) и срезы геля, содержащие полипептид ОМР 106, используют в качестве иммуногена и инъецируют в кролика для получения антисывороток, содержащих поликлональные антитела против ОМР 106. Тот же самый иммуноген может быть использован для иммунизации мышей для получения гибридомных линий, продуцирующих моноклональные антитела против ОМР 106. В конкретных вариантах ломтик ПААГ, содержащий выделенный или очищенный ОМР 106 из любого из штаммов АТСС 49143, АТСС 25238, АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627 и АТСС 43628, используют в качестве иммуногена. В предпочтительных вариантах, в качестве иммуногена используют вырезанный ломтик ПAАГ,содержащий выделенный или очищенный ОМР 106 из НА культивара этих штаммов. В более предпочтительном варианте, в качестве иммуногена используют ломтик ПААГ, содержащий выделенный или очищенный ОМР 106 из НА культивара штамма АТСС 49143. В других вариантах в качестве иммуногенов используют пептидные фрагменты полипептида ОМР 106. Предпочтительно, используют пептидные фрагменты очищенного полипептида ОМР 106. Пептиды могут быть получены протеазным гидролизом, химическим расщеп 19 лением выделенного или очищенного полипептида ОМР 106 или химическим синтезом и затем могут быть выделены или очищены. Такие выделенные или очищенные пептиды могут быть использованы непосредственно в качестве иммуногенов. В специфических вариантах, применимые пептидные фрагменты включают (но не ограничиваются ими) последовательностьQSIAIGDNKIV (SEQ ID N 10 или любую ее часть длиной 6 или более аминокислот. В другом варианте пептидный фрагмент имеет последовательность GTVLGGKK (SEQ ID N 2). Применимые иммуногены могут также содержать такие пептиды или пептидные фрагменты,конъюгированные с молекулойносителем, предпочтительно белком-носителем. Белки-носители могут быть любыми обычно используемыми в иммунологии белкаминосителями, и включают (но не ограничиваются ими) бычий сывороточный альбумин (БСА),куриный альбумин, гемоцианин фиссуреллы(KLH) и т.п. В отношении обсуждения конъюгатов гаптен-белок см., например, Hartlow et al.,Antibodies: A Laboratory Manual, Cold SpringHarbor Laboratory Press, Cold Spring Harbor, NY,1988, или стандартный учебник по иммунологии, такой как Roitt, I. Et al., IMMUNOLOGY,C.V. Mosby Co., St. Louis, МО (1985), или Klein,J., IMMUNOLOGY, Blackwell Scientific Publications, Inc., Cambridge, MA (1990). Еще в одном варианте, для получения антител, которые специфически связывают один или несколько эпитопов нативного полипептида ОМР 106, в качестве иммуногена используют интактные НА клетки M.catarrhalis или везикулы, полученные из них. Эти клетки или везикулы могут быть фиксированы такими агентами, как формальдегид или глутаровый альдегид, перед иммунизацией. См. Hartlow etHarbor Laboratory Press, Cold Spring Harbor, NY,1988, Chapter 15. Предпочтительно, такие антицельноклеточные антитела являются моноклональными антителами. Гибридомные линии,продуцирующие желательные моноклональные антитела, могут быть идентифицированы с применением очищенного полипептида ОМР 106 в качестве скринирующего лиганда. Клетки или везикулы любого штамма M.catarrhalis, в том числе (но не только) АТСС 49143, АТСС 25238,АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627 и АТСС 43628, используют в качестве иммуногена для индуцирования этих антител. Предпочтительно, используют в качестве иммуногена клетки или везикулы НА культивара таких штаммов. Более предпочтительно, в качестве иммуногена для индуцирования этих антител используют клетки или везикулы НА культивара штамма АТСС 49143. Поликлональные антитела, продуцируемые при иммунизации целыми клетками или 20 везикулами, содержат антитела, которые связывают другие белки наружной мембраныM.catarrhalis (антитела не против ОМР 106) и,следовательно, являются более трудными для использования, когда известно или предполагается, что проба содержит другие белки наружной мембраны M.catarrhalis или вещества, которые перекрестно реагируют с этими другими белками наружной мембраны. В этих обстоятельствах любое связывание антицельноклеточными антителами данной пробы или полосы должно подтверждаться соответствующим связыванием той же самой пробы или полосы антителами, которые специфически связывают полипептид ОМР 106 (например, антителами против ОМР 106) и/или произведенный из ОМР 106 полипептид, или конкурентными тестами с использованием антител против ОМР 106, полипептида ОМР 106 или произведенных из ОМР 106 полипептидов в качестве конкурента(т.е. добавление антител против ОМР 106, полипептида ОМР 106 или произведенного из ОМР 106 полипептида к реакционной смеси снижает или устраняет связывание пробы с анти-цельноклеточными антителами). Альтернативно, такие поликлональные антисыворотки,содержащие антитела не против ОМР 106,могут быть очищены от таких антител стандартными подходами и способами. Например,антитела не против OМР 106 могут быть удалены преципитацией с клетками NHA культиваров M.catarrhalis или штаммов M.catarrhalis, о которых известно, что они не имеют полипептида ОМР 106 (например, АТСС 8176, более предпочтительно NHA культивара АТСС 49143); или адсорбцией на колонках, содержащих такие клетки или белки наружной мембраны таких клеток. В других вариантах, применимые иммуногены для индуцирования антител данного изобретения включают смеси двух или более из любых вышеупомянутых индивидуальных иммуногенов. Иммунизацию млекопитающих описанными здесь иммуногенами, предпочтительно людей, кроликов, крыс, мышей, овец, коз, коров или лошадей, проводят согласно процедурам,хорошо известным специалистам в данной области, для получения антисывороток, содержащих поликлональные антитела или гибридомных линий, секретирующих моноклональные антитела. Моноклональные антитела могут быть получены стандартными способами, с учетом содержащегося здесь описания. Такие способы описаны, например, в U.S. Patent N 4 271 145 иU.S. Patent N 4 196 265. Вкратце, животное иммунизируют иммуногеном. Гибридомы получают слиянием клеток селезенки из иммунизированного животного с миеломными клетками. Продукты слияния подвергают скринингу на клетки, продуцирующие антитела, которые свя 21 зываются с этим иммуногеном. Позитивные гибридомные клоны выделяют, и из этих клонов выделяют моноклональные антитела. Схемы иммунизации для получения как поликлональных, так и моноклональных антител хорошо известны в данной области. Иммуноген можно инъецировать любым из ряда путей, в том числе, подкожным, внутривенным,внутрибрюшинным, интрадермальным, внутримышечным, через слизистую оболочку или сочетанием этих путей введения. Иммуноген может быть инъецирован в растворенном виде, в форме агрегата, присоединенным к физическому носителю или смешанным с адъювантом при помощи способов и материалов, хорошо известных в данной области. Согласно данному изобретению, полипептиды ОМР 106 штаммов M.catarrhalis, НА илиNHA, являются иммуно-перекрестно-реактивными. Так, антитела, индуцированные полипептидом ОМР 106 одного штамма или культивараM.catarrhalis, специфически связывают полипептид ОМР 106 и производные от ОМР 106 полипептиды других штаммов и культиваровM.catarrhalis. Например, поликлональные антитела против ОМР 106, индуцированные полипептидом ОМР 106 штамма АТСС 49143, специфически связывают не только гомологичный полипептид ОМР 106 (т.е. полипептид ОМР 106 штамма АТСС 49143), но также полипептид ОМР 106 и/или производные от ОМР 106 полипептиды других штаммов M.catarrhalis, в том числе, но не только, АТСС 43628, АТСС 43627,АТСС 43618, АТСС 43617, АТСС 25240 и АТСС 25238. Антитела данного изобретения, в том числе (но не только) антитела против ОМР 106, могут быть использованы для облегчения выделения и очистки полипептида ОМР 106 и производных от ОМР 106 полипептидов. Эти антитела могут быть также использованы в качестве зондов для идентификации клонов в экспрессионных библиотеках, имеющих инсерции, кодирующие полипептид ОМР 106 или его фрагменты. Эти антитела могут быть также использованы в иммунотестах (например, ELISA, РИА,Вестерн-блоттинге) для специфического обнаружения и/или количественного определения М.catarrhalis в биологических образцах. Антитела против ОМР 106 данного изобретения специфически связывают полипептид ОМР 106 и не связывают белки из родственных бактериальных патогенов, таких как Moraxella ovis, Moraxella lacunata, Moraxella osloensis, Moraxella bovis,Neisseria meningitidis, Neisseria gonorrhoeae. Таким образом, антитела против ОМР 106 могут быть использованы для диагностики инфекций М. catarrhalis. Антитела данного изобретения, в частности, антитела, которые являются цитотоксическими, могут быть также использованы в пассивной иммунизации для предупреждения или 22 аттенуирования инфекций М.catarrhalis животных, в том числе человека. (В применении здесь, цитотоксическим антителом является антитело, которое усиливает опсонизацию и/или киллинг (убивание) комплементом бактерии,связываемой этим антителом). Эффективная концентрация поликлональных или моноклональных антител, выработанных против иммуногенов данного изобретения, может быть введена хозяину для достижения таких эффектов. Точная концентрация вводимых антител будет меняться в соответствии с каждым конкретным препаратом антител, но она может быть определена при помощи стандартных способов, хорошо известных специалистам в данной области. Введение этих антител может выполняться при помощи различных способов, в том числе, но не только, описанных в Разделе 5.6. для доставки вакцин. Профилактическая и терапевтическая эффективности антител данного изобретения могут быть определены стандартными фармацевтическими процедурами на экспериментальных животных. Данные, полученные в исследованиях на животных, могут быть использованы в приготовлении диапазона доз применимых для людей. 5.6. Вакцины Данное изобретение обеспечивает также терапевтические и профилактические вакцины против инфекций М.catarrhalis животных, в том числе млекопитающих и, более конкретно, грызунов, приматов и человека. Предпочтительным использованием этих вакцин является использование для людей. Вакцины могут быть приготовлены способами, известными специалистам в данной области, и могут, например, включать антиген в форме иммуногена, фармацевтически приемлемый носитель, возможно, подходящий адъювант и, возможно, другие материалы, традиционно применяемые в вакцинах. Иммунологически эффективное количество иммуногена,которое должно быть использовано в вакцине,определяют способами, известными в данной области с учетом приведенного здесь описания. Вакцины данного изобретения содержат иммунологически эффективное количество любого из иммуногенов, описанных в разделе 5.5.,в фармацевтически приемлемом носителе. Согласно другому варианту, вакцины данного изобретения содержат иммунологически эффективное количество инактивированного или аттенуированного НА культивара M.catarrhalis или NHA культивара M.catarrhalis данного изобретения. Инактивированный или аттенуированный НА культивар M.catarrhalis или 23 Термин иммунологически эффективное количество используют здесь для обозначения количества, достаточного для индуцирования иммунного ответа, который может предупреждать инфекции M.catarrhalis или ослаблять тяжесть любой предсуществующей или последующей инфекций M.catarrhalis. Точная концентрация будет зависить от конкретного вводимого иммуногена, но может быть определена при помощи стандартных способов, хорошо известных специалистам в данной области, для тестирования развития иммунного ответа. Применимые полипептидные иммуногены включают выделенный полипептид ОМР 106 и производные от ОМР 106 полипептиды. Предпочтительные иммуногены включают очищенный полипептид ОМР 106 и произодные от ОМР 106 полипептиды или пептиды. Объединенные иммуноген и носитель могут находиться в водном растворе, эмульсии или суспензии. В общем, количество полипептидного иммуногена должно находиться между 0,1 и 500 мкг на дозу. Эти носители известны специалистам в данной области и включают стабилизаторы, разбавители и буферы. Подходящие стабилизаторы включают углеводы, такие как сорбит, лактоза, маннит, крахмал, сахароза, декстран и глюкоза, и белки, такие как альбумин или казеин. Подходящие разбавители включают солевой раствор,сбалансированный солевой раствор Хенкса и раствор Рингера. Подходящие буферы включают фосфат щелочного металла, карбонат щелочного металла или карбонат щелочноземельного металла. Вакцина может также содержать один или несколько адъювантов для улучшения или усиления иммунологического ответа. Подходящие адъюванты включают (но не ограничиваются ими) пептиды, гидроксид алюминия; фосфат алюминия; оксид алюминия; композицию, которая состоит из минерального масла, такого как Marcol 52, или растительного масла и одного или нескольких эмульгаторов,или поверхностно-активных веществ, таких как лизолецитин, поликатионы, полианионы; и потенциально применимых используемых для людей адъювантов, таких как BCG и Corinebacterium parvum. Вакцина может также содержать другие иммуногены. Такая смешанная вакцина имеет преимущество, заключающееся в том, что иммунитет против нескольких патогенов может быть получен одним введением. Примерами других иммуногенов являются иммуногены,применяемые в известных ассоциированных коклюшно-дифтерийно-столбнячных(АКДС) вакцинах. Вакцины данного изобретения получают способами, известными специалистам в данной области, с учетом содержащегося здесь описания. Как правило, иммуноген смешивают с носителем с образованием раствора, суспензии или эмульсии. Одна или несколько добавок,рассмотренных свыше, могут находиться в но 002743 24 сителе или могут быть добавлены впоследствии. Препараты вакцин могут быть высушены, например, лиофильно, для целей хранения. В этом случае они могут быть впоследствии воссозданы в жидкие вакцины путем добавления соответствующего жидкого носителя. Эти вакцины вводят людям или другим млекопитающим, в том числе грызунам и приматам, в виде одной или нескольких доз. Вакцины могут быть введены известными способами введения. Могут использоваться многие способы для введения препаратов вакцин, описанных здесь. Эти способы включают (но не ограничиваются ими) пероральное, интрадермальное,внутримышечное,внутрибрюшинное,внутривенное, подкожное и интраназальное введение. Предпочтительными способами введения являются внутримышечная или подкожная инъекция. Данное изобретение обеспечивает также способ индуцирования иммунного ответа наM.catarrhalis в млекопитающем для защиты этого млекопитающего против инфекции и/или для ослабления заболевания, вызываемого M.catarrhalis. Способ предусматривает введение иммунологически эффективного количества иммуногенов данного изобретения хозяину и, предпочтительно, введение вакцин данного изобретения хозяину. 5.7. Нуклеиновые кислоты, кодирующие полипептид ОМР 106 и производные от ОМР 106 полипептиды Данное изобретение обеспечивает также нуклеиновые кислоты, ДНК и РНК, кодирующие полипептид ОМР 106 и производные от ОМР 106 полипептиды. В одном аспекте, нуклеиновые кислоты данного изобретения могут быть синтезированы при помощи способов, известных в данной области. Конкретно, часть всей аминокислотной последовательности или вся аминокислотная последовательность полипептида ОМР 106 или производного от ОМР 106 полипептида может быть определена при помощи способов, хорошо известных специалистам в данной области, таких как способ деградации Эдмана (см., например, Creighton, 1983, Proteins:and Co., N.Y., pp. 34-49). Полученную аминокислотную последовательность используют в качестве направляющей для синтеза ДНК, кодирующей полипептид ОМР 106 или производной от ОМР 106 полипептид, с использованием общепринятых химических подходов или амплификации при помощи полимеразной цепной реакции (ПЦР) перекрывающихся олигонуклеотидов. В другом аспекте эта аминокислотная последовательность может быть использована в качестве направляющей для синтеза смесей олигонуклеотидов, которые в свою очередь могут быть использованы для скрининга на кодирующие последовательности полипептида ОМР 106 25 в геномных библиотеках M.catarrhalis. Предпочтительно, ДНК, используемую в качестве источника кодирующей последовательности полипептида ОМР 106, как для геномных библиотек, так и для ПЦР-амплификации, получают из клеток любого штамма M.catarrhalis, в том числе(но не только) АТСС 49143, АТСС 25238, АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627 и АТСС 43628. При получении геномных библиотек генерируют фрагменты ДНК, некоторые из которых кодируют части полипептида ОМР 106 M.catarrhalis или весь полипептид ОМР 106 M.catarrhalis. ДНК может быть расщеплена в специфических сайтах различными рестриктазами. Альтернативно, можно использовать ДНКазу в присутствии марганца для фрагментирования этой ДНК или ДНК может быть физически разрезана,например, обработкой ультразвуком. Затем фрагменты ДНК могут быть разделены по размеру стандартными способами, в том числе (но не только) электрофорезом в агарозном или полиакриламидном геле, колоночной хроматографией и центрифугированием в сахарозном градиенте. Затем фрагменты ДНК могут быть вставлены в подходящие векторы, в том числе(но не только) в плазмиды, космиды, бактериофаг лямбда или Т 4 и искусственную хромосому дрожжей (YAC). (См., например, Sambrook etCloning: A Practical Approach, MRL Press, Ltd.,Oxford, U.K. Vol. I, II.). Геномная библиотека может быть подвергнута скринингу при помощи гибридизации нуклеиновых кислот с меченым зондом (Benton and Davis, 1977, Science 196:180;Sci. USA 72:3961). Геномные библиотеки могут быть подвергнуты скринингу меченым вырожденным олигонуклеотидом, соответствующим аминокислотной последовательности любого пептида полипептида ОМР 106, с использованием оптимальных подходов, хорошо известных в данной области. В специфических вариантах, зондом для скрининга является вырожденный олигонуклеотид, который соответствует пептиду,имеющему последовательность IGISEADGGKG(SEQ ID N 1) или ее часть. В другом варианте зонд для скрининга может быть вырожденным олигонуклеотидом, который соответствует пептиду,имеющему последовательностьGTVLGGKK (SEQ ID N 2). В дополнительном варианте в качестве зонда используют олигонуклеотидыRAAR (SEQ ID N 3) и GGNACNGTNTTRGGNGGNAARAAR (SEQ ID N 7), каждый из которых соответствует пептиду GTVLGGKK (SEQID N 2). В следующих вариантах в качестве зонда могут быть использованы последователь 002743TTGGTGACATTGCGCAA (SEQ TD N 4) или ее фрагменты. Любой используемый зонд имеет длину 15 или более нуклеотидов. Клоны в библиотеках с ДНК-вставкой, кодирующей полипептид ОМР 106 или его фрагменты, будут гибридизоваться с одним или несколькими вырожденными олигонуклеотидными зондами. Гибридизацию таких олигонуклеотидных зондов с геномными библиотеками проводят при помощи способов, хорошо известных в данной области. Например, гибридизацию с двумя вышеупомянутыми олигонуклеотидными зондами можно проводить в 2-х SSC, 1,0% ДСН при 50 С и промывку можно проводить при тех же самых условиях. В конкретном варианте,последовательность ДНК АТСС 49143, кодирующая весь полипептид ОМР 106 или его часть, является рестрикционным фрагментомHindIII длиной около 8000 п.н. или рестрикционным фрагментом DraI длиной около 4200 п.н. Еще в одном аспекте, клоны нуклеотидных последовательностей, кодирующих часть полипептида ОМР 106 или целый полипептид ОМР 106 или произведенные из ОМР 106 полипептиды, могут быть также получены скринингом экспрессионных библиотек M.catarrhalis. Например, ДНК M.catarrhalis выделяют и получают случайные фрагменты и лигируют их в экспрессирующий вектор (например, бактериофаг, плазмиду, фагмиду или космиду), так что вставленная последовательность в векторе способна экспрессироваться клеткой-хозяином, в которую затем вводят этот вектор. Затем могут быть использованы различные тесты скрининга для отбора на экспрессированый полипептид ОМР 106 или производные от ОМР 106 полипептиды. В одном варианте могут быть использованы различные антитела против ОМР 106 (см. Раздел 5.5) для идентификации желательных клонов с использованием способов, известных в данной области. См., например, Hartlow andHarbor, NY, Appendix IV. Клоны и фаги из библиотеки приводят в контакт с этими антителами для идентификации клонов, которые связывают антитела. В одном варианте колонии или бляшки,содержащие ДНК, которая кодирует полипептид ОМР 106 или производный от ОМР 106 полипептид, могли бы детектироваться с использованием гранул DYNA согласно Olsvick et al.,29th ICAAC, Houston, Тех. 1989, включенных здесь в качестве ссылки. Антитела против ОМР 106 сшивают с тозилированными гранулами DYNA Beads M280, и эти содержащие антитела гранулы могут быть затем использованы для адсорбции колоний или бляшек, экспрессирующих полипептид ОМР 106 или производный из ОМР 106 полипептид. Колонии или бляшки, 27 экспрессирующие полипептид ОМР 106 или производный от ОМР 106 полипептид, идентифицируют как любые из тех, которые связывают эти гранулы. Альтернативно, антитела против ОМР 106 могут быть неспецифически иммобилизованы на подходящем носителе, таком как диоксид кремния или смола Celite. Затем этот материал может быть использован для адсорбции бактериальных колоний, экспрессирующих полипептид ОМР 106 или производный от ОМР 106 полипептид, как описано в предыдущем абзаце. В другом аспекте, ПЦР-амплификация может быть использована для получения, по существу, чистой ДНК, кодирующей часть полипептида ОМР 106 или целый полипептид ОМР 106, из геномной ДНК M.catarrhalis. В качестве праймеров могут быть использованы олигонуклеотидные праймеры, вырожденные или иные, соответствующие известным последовательностям полипептида ОМР 106. В специфических вариантах, олигонуклеотид, вырожденный или иной, кодирующий пептидQSIAIGDNKIV (SEQ ID N 1) или любую его часть, может быть использован в качестве 5'праймера. Например, 5'-праймер может быть нуклеотидной последовательностью GAAGCATTGCGCAA (SEQ ID N 4) или любой ее частью. Нуклеотидные последовательности, вырожденные или иные, которые являются обращенными комплементарными последовательности, кодирующей GTVLGGKK (SEQ ID N 2),могут быть использованы в качестве 3'праймера. Например, олигонуклеотид, вырожденный или иной, который имеет вырожденную олигонуклеотидную последовательность YTTYTTNCCNCCNAGNACNGTNCC (SEQ ID N 6) или YTTYTTNCCNCCYAANACNGTNCC (SEQID N 8), может быть использован в качестве 3'праймера в сочетании с различными 5'праймерами, рассмотренными выше. ПЦР может проводиться, например, с использованием термоблока Perkin-Elmer Cetusthermal cycler и полимеразы Tag (Gene Amp). Можно синтезировать несколько различных вырожденных праймеров для применения в ПЦР-реакциях. Можно также менять условия строгости гибридизации, используемые в праймировании ПЦР-реакций, для создания возможности большей или меньшей степеней сходства нуклеотидной последовательности между вырожденными праймерами и соответствующими последовательностями в ДНК М.catarrhalis. После успешной амплификации сегмента последовательности, кодирующей полипептид ОМР 106,этот сегмент может быть молекулярно клонирован и секвенирован и использован в качестве зонда для выделения полного геномного клона. Это, в свою очередь, позволит определить пол 002743 28 ную нуклеотидную последовательность гена,анализировать его экспрессию и получить его белковый продукт для функционального анализа, как описано infra. После выделения кодирующей последовательности полипептид ОМР 106 из одного штамма или культивара М.catarrhalis можно использовать тот же подход для выделения кодирующих последовательностей полипептид ОМР 106 из других штаммов и культиваров М.catarrhalis. Специалистам в данной области должно быть понятно, что последовательность ДНК или РНК, кодирующая полипептид ОМР 106 (или его фрагменты) данного изобретения, может быть использована для получения других последовательностей ДНК или РНК,которые гибридизуются с ней при условиях умеренной-высокой строгости, с использованием обычных способов, известных в данной области. Гибридизация с последовательностью ОМР 106 из одного штамма или культивара М.catarrhalis в условиях высокой строгости будет идентифицировать соответствующую последовательность из других штаммов и культиваров. Условия высокой строгости меняются в зависимости от длины зонда и состава оснований. Формула для определения таких условий хорошо известна в данной области. См. Sambrook et al., Molecular Cloning: A LaboratoryManual, Cold Spring Harbor Laboratory Press, NY,Chapter 11. В применении здесь, условия гибридизации высокой строгости, применяемые к зондам более 300 оснований в длину, включают конечную промывку в 0,1xSSC/0,1% ДСН при 68 С в течение, по меньшей мере, 1 ч (Ausubel,et al., Eds., 1989, Current Protocols in Molecularand Jojn Wiley and Sons, Inc., New York, p. 2.10.3). В конкретных вариантах, промывка высокой строгости в гибридизации с использованием зонда, имеющего последовательность SEQID N 4 или комплементарную ей последовательность, проводится 2 х SSC, 1% ДСН при 50 С в течение приблизительно 20-30 мин. Специалист в данной области должен быть способен идентифицировать полные клоны кодирующей последовательности полипептида ОМР 106 с применением подходов, хорошо известных в данной области. Протяжение кодирующей последовательности полипептида ОМР 106, содержащейся в выделенном клоне,может быть определено секвенированием клонированной вставки и сравнением расшифрованного размера полипептида, кодируемого открытыми рамками считывания (ORF), с размером полипептида ОМР 106 и/или сравнением расшифрованной аминокислотной последовательности с последовательностью очищенного полипептида ОМР 106. Если был выделен частичный клон кодирующей последовательности полипептида ОМР 106, полные клоны могут быть выделены с использованием вставки час 29 тичного клона в качестве гибридизационного зонда. Альтернативно, полная кодирующая последовательность полипептида ОМР 106 может быть реконструирована из перекрывающихся частичных клонов сплайсингом их вставок вместе. Полные клоны могут быть любыми клонами, которые имеют ORF с расшифрованной аминокислотной последовательностью, совпадающей с последовательностью полипептида ОМР 106, или, когда полная аминокислотная последовательность последнего недоступна,совпадающей с последовательностью пептидного фрагмента полипептида ОМР 106, и имеющей молекулярную массу, соответствующую молекулярной массе полипептида ОМР 106. Далее,полные клоны могут быть идентифицированы по способности их вставок, при помещении в экспрессирующий вектор, продуцировать полипептид, который связывает антитела, специфические для аминоконца полипептида ОМР 106, и антитела, специфические для карбокси-конца полипептида ОМР 106. Последовательности нуклеиновых кислот,кодирующие производные от ОМР 106 полипептиды, могут быть получены способами, хорошо известными в данной области. В одном аспекте,последовательности, кодирующие производные от ОМР 106 полипептиды, могут быть произведены из последовательностей, кодирующих полипептид ОМР 106, способами рекомбинантных ДНК с учетом рассмотренных здесь положений. Например, кодирующая последовательность полипептида ОМР 106 может быть изменена созданием аминокислотных замен, которые не будут влиять на иммуногенность полипептида ОМР 106 или которые могут улучшать его иммуногенность. Могут быть использованы различные способы, в том числе (но не только) управляемый олигонуклеотидом,сайтспецифический мутагенез. Эти и другие способы, известные в данной области, могут быть использованы для создания одиночных или множественных мутаций, таких как замены,инсерции, делеции и транспозиции, описанные вBotstein and Shortle, 1985, Science 229:1193-1210. Далее, ДНК, кодирующая последовательности полипептида ОМР 106, может быть укорочена расщеплением рестриктазой или экзонуклеазой. Гетерологичная кодирующая последовательность может быть присоединена к последовательности, кодирующей полипептид ОМР 106, лигированием или ПЦР-амплификацией. Кроме того, ДНК, кодирующая весь производный от ОМР 106 полипептид или его часть,может быть синтезирована химически или при помощи ПЦР-амплификации на основе известной или расшифрованной аминокислотной последовательности полипептида ОМР 106 и любых желательных изменений в этой последовательности. 30 Идентифицированные и выделенные ДНК,содержащие последовательность, кодирующую полипептид ОМР 106 или производного от ОМР 106 полипептида, могут быть вставлены в подходящий клонирующий вектор. Могут быть использованы многочисленные системы векторхозяин, известные в данной области. Возможные векторы включают, но не ограничиваются ими, плазмиды или модифицированные вирусы,но векторная система должна быть совместима с используемой клеткой-хозяином. Такие векторы включают, но не ограничиваются ими, бактериофаги, такие как производные бактериофага лямбда, или плазмиды, такие как производные плазмид pBR322 или pUC. Встраивание в клонирующий вектор может быть, например, выполнено лигированием фрагмента ДНК в клонирующей вектор, имеющий комплементарные липкие концы. Однако, если комплементарные сайты рестрикции, используемые для фрагментирования этой ДНК, не присутствуют в этом клонирующем векторе, концы этих молекул ДНК могут быть модифицированы ферментативно. Альтернативно, любой желательный сайт может быть произведен лигированием нуклеотидных последовательностей (линкеров) на концы ДНК; эти лигированные линкеры могут содержать специфические химически синтезированные олигонуклеотиды, кодирующие последовательности узнавания рестриктаз. В альтернативном способе расщепленная ДНК может быть модифицирована присоединением гомополимерного хвоста. Рекомбинантные молекулы могут быть введены в клетки-хозяева трансформацией, трансфекцией, инфицированием, электропорацией и т.д., так что образуются многочисленные копии этой генной последовательности. В альтернативном способе желательная ДНК, содержащая кодирующую последовательность полипептида ОМР 106 или производного от ОМР 106 полипептида, может быть идентифицирована и выделена после введения в подходящий клонирующий вектор способом дробовика (shot gun). Обогащение желательной последовательностью, например, фракционированием по размеру, может быть выполнено перед инсерцией в клонирующий вектор. В специфических вариантах трансформация клеток-хозяев рекомбинантными молекулами ДНК, которые содержат последовательность,кодирующую полипептид ОМР 106 и производного от ОМР 106 полипептида, делает возможной образование многочисленных копий такой кодирующей последовательности. Таким образом, эта кодирующая последовательность может быть получена в больших количествах путем выращивания трансформантов, выделения из трансформантов рекомбинантных молекул ДНК и, если необходимо, выделением вставленной кодирующей последовательности из выделенной рекомбинантной ДНК. 31 5.8. Рекомбинантное получение полипептида ОМР 106 и производного oт OMP106 полипептида Полипептид OMP106 и производные отOMP106 полипептиды данного изобретения могут быть получены способами генной инженерии. В этом случае их получают с применением подходящей клетки-хозяина, которая была трансформирована ДНК, кодирующей этот полипептид. Нуклеотидная последовательность,кодирующая полипептид OMP106 или производные от OMP106 полипептиды, может быть вставлена в подходящий экспрессирующий вектор, т.е. вектор, который содержит необходимые элементы для транскрипции и трансляции вставленной кодирующей полипептид последовательности. Нуклеотидные последовательности, кодирующие полипептид OMP106 или производные от OMP106 полипептиды, вставляют в эти векторы таким образом, что они будут экспрессироваться при подходящих условиях (например, в правильной ориентации и правильной рамке считывания и с подходящими экспрессионными последовательностями, в том числе,связывающей РНК-полимеразу последовательностью и последовательностью связывания рибосом). Многие системы хозяин-вектор могут быть использованы для экспрессии кодирующей полипептид последовательности. Они включают(например, вирусом коровьей оспы, аденовирусом и т.д.); системы клеток насекомых, инфицированных вирусом (например, бакуловирусом); микроорганизмы, такие как дрожжи, содержащие векторы дрожжей, или бактерии,трансформированные ДНК бактериофага, плазмидной ДНК или космидной ДНК. Предпочтительно, клетка-хозяин является бактерией и,наиболее предпочтительно, эта бактерия представляет собой E.coli, B.subtilis или Salmonella. Элементы экспрессии векторов различаются по их длине и специфичности. В зависимости от используемой системы хозяин-вектор может быть использован любой из ряда подходящих элементов транскрипции и трансляции. В характерном варианте экспрессируется химерный белок, содержащий последовательность полипептида ОМР 106 или его производного и преи/или про-последовательность клетки-хозяина. В других характерных вариантах, экспрессируется химерный белок, содержащий последовательность полипептида ОМР 106 или производного от ОМР 106 полипептида и пептида для аффинной очистки. В других специфических вариантах, экспрессируется химерный белок,содержащий последовательность полипептида ОМР 106 или его производного и ценного иммуногенного пептида или полипептида. В предпочтительных вариантах, экспрессируемый производный от ОМР 106 полипептид содержит 32 последовательность, образующую либо эпитоп наружной поверхности,либо рецепторсвязывающий домен нативного полипептида ОМР 106. Любой способ, известный в данной области, для встраивания фрагментов ДНК в вектор может быть использован для конструирования экспрессирующих векторов, содержащих химерный ген, состоящий из подходящих регуляторных сигналов транскрипции/трансляции и кодирующих полипептид последовательностей. Эти способы могут включать способы in vitro рекомбинантных ДНК и синтетические способы и in vivo рекомбинанты (генетическую рекомбинацию). Экспрессия последовательности нуклеиновой кислоты, кодирующей полипептид ОМР 106 или произведенный из ОМР 106 полипептид, может регулироваться другой последовательностью нуклеиновой кислоты таким образом, что введенная последовательность экспрессируется в хозяине, трансформированном рекомбинантной молекулой ДНК. Например, экспрессия вставленной последовательности может регулироваться любым промоторным/энхансерным элементом, известным в данной области. Промоторы, которые могут быть использованы для регуляции экспрессии вставленных последовательностей, включают (но не ограничиваются ими) район раннего промотора SV40 (Bernoist and Chambon, 1981, Nature 290:304-310),промотор, содержащийся в 3'-длинном концевом повторе вируса саркомы Рауса (Yamamotoet al., 1980, Cell 22:787-797), промотор тимидинкиназы вируса герпеса (Wagner et al., 1981, Proc.Natl.Acad.Sci. USA 78:1441-1445), регуляторные последовательности гена металлотионеинаbacteria in Scientific American, 1980, 242:74-94); промоторный район нопалинсинтазы или промотор 35S РНК вируса мозаики цветной капусты (Gardner et al., 1981, Nucl.Acids Res. 9:2871),и промотор фотосинтетического фермента рибулозобисфосфаткарбоксилазы (Yerrera-Estrellaet al., 1984, Nature 310:115-120) для экспрессии в клетках растений; промоторные элементы из дрожжей или других грибов, такие как промотор Ga14, промотор ADC (алкогольдегидрогеназы), промотор PGK (фосфоглицерокиназы),промотор щелочной фосфатазы. Экспрессирующие векторы, содержащие последовательности, кодирующие полипептид ОМР 106 или производного от ОМР 106 полипептида, могут быть идентифицированы тремя основными подходами: (а) гибридизацией нуклеиновых кислот, (b) присутствием или отсутст 33 вием функций маркерного гена и (с) экспрессией вставленных последовательностей. В первом подходе, присутствие чужеродного гена,вставленного в экспрессирующий вектор, может быть обнаружено гибридизацией нуклеиновых кислот с использованием зондов, содержащих последовательности, которые гомологичны вставленной последовательности, кодирующей полипептид ОМР 106 или производный от ОМР 106 полипептид. Во втором подходе, система рекомбинантный вектор/хозяин может быть идентифицирована и отобрана на основании присутствия или отсутствия функций определенного маркерного гена (например, активности тимидинкиназы, устойчивости к антибиотикам, трансформированного фенотипа, образования тел включения в бакуловирусе и т.д.),обусловленных вставлением чужеродных генов в вектор. Например, если последовательность,кодирующая полипептид ОМР 106 или его производного вставлена в последовательность маркерного гена вектора, рекомбинанты, содержащие эту вставку, могут быть идентифицированы по отсутствию функции маркерного гена. В третьем подходе, рекомбинантные экспрессирующие векторы могут быть идентифицированы анализом продукта чужеродного гена, экспрессируемого рекомбинантом. Такие анализы могут быть основаны, например, на физических или функциональных свойствах полипептида ОМР 106 или его производного в системах анализа in vitro, например, на связывании с лигандом или рецептором ОМР 106 или на связывании с антителами против ОМР 106 данного изобретения, или на способности клетки-хозяина к гемагглютинации или на способности клеточного экстракта препятствовать гемагглютинации,вызываемой М.catarrhalis. После идентификации и выделения молекулы рекомбинантной ДНК для ее размножения могут быть использованы несколько способов,известных в данной области. После установления подходящей системы хозяина и условий выращивания, рекомбинантные экспрессирующие векторы могут быть размножены и получены в больших количествах. Как объяснялось выше, экспрессирующие векторы, которые могут быть использованы, включают (но не ограничиваются ими) следующие векторы или их производные: вирусы человека или животных,такие как вирус коровьей оспы или аденовирус; вирусы насекомых, такие как бакуловирус; вирусы дрожжей; векторы-бактериофаги (например, лямбда) и плазмидные и космидные ДНКвекторы, называемые в качестве нескольких примеров из большого числа возможных векторов. Кроме того, может быть выбран штамм клетки-хозяина, который модулирует экспрессию вставленной последовательности или модифицирует и процессирует продукт гена специфическим желательным образом. Экспрессия 34 от определенных промоторов может быть повышена в присутствии определенных индукторов; таким образом, экспрессия генетически сконструированного полипептида ОМР 106 или его производного может быть регулируемой. Кроме того, различные клетки-хозяева имеют характерные и специфические механизмы трансляционного и посттрансляционного процессинга и модификации белков. Могут быть выбраны подходящие клеточные линии или системы хозяев для обеспечения желательных модификации и процессинга экспрессируемого чужеродного белка. 5.9. Реагенты Полипептиды, пептиды, антитела и нуклеиновые кислоты данного изобретения применимы в качестве реагентов для клинической и медицинской диагностики инфекций M.catarrhalis и для исследований свойств патогенности,вирулентности и инфекционности M.catarrhalis,а также защитных механизмов хозяина. Например, ДНК и РНК данного изобретения может быть использована в качестве зондов для идентификации присутствия M.catarrhalis в биологических образцах посредством гибридизации или ПЦР-амплификации. Эта ДНК или РНК может быть также использована для идентификации других бактерий, которые могут кодировать полипептид, родственный ОМР 106 M.catarrhalis. Полипептиды и пептиды данного изобретения могут быть использованы для получения поликлональных и моноклональных антител,которые могут быть использованы для дальнейшей очистки композиций, содержащих полипептиды данного изобретения, аффинной хроматографией. Эти полипептиды и пептиды могут быть также использованы в стандартных иммунотестах для скрининга на присутствие антител к M.catarrhalis в пробе. Должно быть понятно, что применение положений данного изобретения к конкретной проблеме или конкретным обстоятельствам также будет в рамках способностей специалиста с обычной квалификацией в данной области в свете содержащихся здесь описаний. В следующем далее примере приведены примеры продуктов данного изобретения и способов их получения и использования. 6. Пример: выделение и характеристика полипептида ОМР 106 и гена, кодирующего его,из штамма АТСС 49143 или из других штаммов 6.1. Материал и способы 6.1.1. Тест гемагглютинации Гемагглютинацию, вызываемую M.catarrhalis, тестировали, как описано Soto-Hernandezet al., (J.Clin.Microbiol. 27:903-908), за исключением того, что в тесте с реакцией агглютинации на предметном стекле вместо 3% использовали 5% (об/об) эритроциты. Исходные тесты гемагглютинации выполняли с использованием 20 мкг бактериальных клеток (сырой вес). Поскольку 35 штамм 49143 M.catarrhalis, выращиваемый на чашках с кровяным агаром, давал сильную реакцию гемагглютинации, он был отобран в качестве сравнительного штамма. Серийное разведение штамма АТСС 49143 в разведениях 1:2 приводило к снижающимся реакциям гемагглютинации. Оценки в баллах отдо + были основаны на гемагглютинации, наблюдаемой с использованием штамма АТСС 49143, после серийных разведений 1:2, таким образом, что реакция + была при использовании 1/4 числа клеток, необходимого для достижения реакции. 6.1.2. Ингибирование гемагглютинации Суспензию клеток M.catarrhalis 49143 серийно разводили 1:2 и разведение, которое давало реакцию гемагглютинации + при 7 мкл забуференного фосфатом солевого раствора Дульбекко и 7 мкл 5% (об/об) 0+-эритроцитов человека, использовали для анализа ингибирования гемагглютинации простыми сахарами и производными cахаров. Для определения,могут ли простые сахара и производные сахаров ингибировать гемагглютинацию, вызываемую M.catarrhalis, 7 мкл конкретного сахара при 500 мМ смешивали с 7 мкл клеток M.catarrhalis и инкубировали в течение 5 мин, чтобы позволить сахару взаимодействовать с клетками. Затем добавляли 7 мкл 5% (об/об) 0+- эритроцитов человека и гемагглютинацию оценивали в баллах после 1 мин. Каждый сахар и каждое производное сахара тестировали на способность ингибировать гемагглютинацию. Затем исходный раствор каждого сахара и производного сахара серийно разводили 1:2 и эти разведения тестировали на их способность ингибировать гемагглютинацию при помощи описанной выше процедуры. Таким образом определяли минимальную концентрацию углевода, необходимую для ингибирования гемаглютинации. 6.1.3. Связывание лиганда и рецептора Связывание M.catarrhalis с гликолипидными рецепторами клеток животного исследовали фракционированием при помощи тонкослойной хроматографии (ТСХ) гликолипидов клеткихозяина и покрытия хроматограммы мечеными клетками согласно процедурам, описаннымMatreya Inc. (Pleasant Gap, PA), разделяли на пластинках для тонкослойной хроматографии высокого разрешения (HPTLC) в смеси хлороформ:метанол:вода (5:4:1). Пластинки либо окрашивали орсином при 100 С, либо покрывали 125I-мечеными пузырьками М.catarrhalis, приготовленными, как описано ранее (Murphy andLoeb, 1989, Microbial Pathogen. 6:159-174) при 2 х 106 имп/мин. на мл в течение 2 ч. Затем пластинки промывали 5 раз, сушили и экспонировали на рентгеновской пленке. 6.1.4. ОG-Экстракция ОМР 36 Штаммы М.catarrhalis выращивали отдельно при 35 С при 200 об/мин, в 1 л бульона Мюллера-Хинтона в колбе на 4 л. Препараты белка (ОМР) наружной мембраны выделяли обработкой 50 мг клеток (сырой вес) 0,67 мл 1,25% н-октилD-глюкопиранозида (т.е. октилглюкозида; OG) в забуференном фосфатом солевом растворе (PBS) в течение 30 мин при комнатной температуре. Клетки осаждали в микроцентрифуге в течение 5 мин и супернатант использовали в качестве октилглюкозидного экстракта. Сравнение белковых профилей этих экстрактов из ряда штаммов М.catarrhalis с экстрактами пузырьков (т.е. везикулы наружной мембраны), выделенных дифференциальным центрифугированием, которые являются в сильной степени обогащенными белками наружной мембраны (ОМР) из М.catarrhalis (Murphy andLoeb, 1989, Microbial Pathogen. 6:159-174), показывает, что октилглюкозидные экстракты содержат преимущественно белки наружной мембраны М.catarrhalis (фиг. 1). Это свидетельствовало о том, что экстракция октилглюкозидом обеспечила более быструю процедуру с более высоким выходом белков наружной мембраны в сравнении с белками наружной мембраны, полученными из пузырьков (везикул наружной мембраны). 6.1.5. Протеолитическое расщепление ОМР 106 50 мг Клеток из штамма АТСС 49143 в 1 мл забуференного фосфатом солевого раствора Дульбекко расщепляли в течение 1 ч при комнатной температуре следующими протеазами: обработанным TLCK химотрипсином (5 мг),протеиназой К (5 мг), обработанным ТРСК трипсином (5 мг) или протеазой V8 (100 единиц). Все протеазы получали из Sigma Chemicals(St. Louis, МО). Сразу же после протеазной обработки клетки промывали один раз в PBS и ресуспендировали в 1 мл PBS и тестировали на гемагглютинирующую активность. Кроме того,обработанные протеазами бактериальные клетки экстрагировали октилглюкозидом, чтобы белки наружной мембраны могли быть разделены для идентификации специфических белков,которые могли быть гидролизованы этими протеазами. 6.1.6. Негемагглютинирующие культивары Обычно гемагглютинирующие культурыM.catarrhalis выращивают во встряхиваемых колбах, содержащих бульон Мюллера-Хинтона,при 35-37 С при 200 об/мин, в течение 24-48 ч. Клетки, взятые непосредственно из чашки с кровяным агаром на среде Мюллера-Хинтона,также экспрессируют гемагглютинирующий фенотип. Для отбора на негемагглютинирующий (NHA) культивар штамм 49143 подвергали серийному пассажу каждые 5 дней в статических культурах, выращиваемых в бульоне Мюллера-Хинтона при 35 С. При каждом пассаже инокулят брали только с поверхности бульонной культуры. При втором пассаже развивался 37 плавающий ковер клеток и этот ковер клеток использовали в качестве инокулята для последующих культур. Серийное культивирование таким образом давало NHA культивары АТСС 49143 обычно после трех пассажей. 6.1.7. Выделение полипептида ОМР 106 Полипептид ОМР 106 из экстракта наружных мембран M.catarrhalis АТСС 49143 детектируют (например, окрашиванием серебром или антителами против ОМР 106) в денатурирующих гелях только после того, как этот экстракт был инкубирован при 100 С в течение 5 мин. Для определения, является ли появление полосы ОМР 106 после инкубирования при 100 С результатом агрегации белков более низкой молекулярной массы во время кипячения, или позволяет ли кипячение нормально агрегированному белку входить в гель, непрокипяченный октилглюкозидный экстракт наружных мембран АТСС 49143 анализировали на нативном полиакриламидном геле. Специфические участки геля, в том числе непосредственно ниже колодца для пробы, вырезали и кипятили. Затем полученные пробы разделяли на денатурирующем полиакриламидном геле и окрашивали содержащим серебро красителем (Silver Stain Plus, Catalognumber 161-0449, BioRad Laboratories, Richmond, CA). Для N-концевого секвенирования октилглюкозидный экстракт наружных мембран АТСС 49143 смешивали с буфером для пробPAGE, содержащим ДСН, и инкубировали в течение 5 мин в кипящей водяной бане. Затем белки разделяли на 12% ПААГ с ДСН и переносили на мембрану PVDF электроблоттингом. Затем область мембраны, содержащую полосу ОМР 106, вырезали для аминоконцевого секвенирования. Ни одна из процедур PAGE, использованных для выделения полипептида ОМР 106,не применяла восстанавливающие агенты в буферах для проб или для гелей. 6.1.8. Антисыворотка против ОМР 106 Антисыворотку к ОМР 106 получали разделением полипептида ОМР 106 из НА культивара АТСС 49143 в денатурирующем содержащем додецилсульфат натрия полиакриламидном геле, как описано ранее (Lammeli, 1970, Nature 227: 680-685), и вырезанием содержащей ОМР 106 полосы из этого геля. Вырезанную полосу мацерировали и инъецировали в кролика для генерирования антисыворотки к полипептиду ОМР 106. Эту антисыворотку использовали для ингибирования гемагглютинации, как описано в разделе 6.1.2. supra, но с применением антисыворотки вместо углевода. Эту антисыворотку исследовали также на медиируемую комплементом цитотоксическую активность против М.catarrhalis, как описано в разделе 7. 6.1.9. Вестерн-блоты с антисывороткой против ОМР 106 М.catarrhalis АТСС 49143, АТСС 43628,АТСС 43627, АТСС 43618, АТСС 43617, АТСС 25240, АТСС 25238 и АТСС 8176; M.ovis АТСС 38 33078; M.lacunata АТСС 17967; M.bovis АТСС 10900; M.osloensis АТСС 10973; Neisseria gonorrhoeae (клинический изолят); и N.meningitidis АТСС 13077 выращивали на чашках с шоколадным агаром в течение 48 ч при 35 С в 5% СО 2. Клетки удаляли выскребанием колоний из поверхности агара при помощи полистироловой петли для посева. Затем клетки солюбилизировали суспендированием 30 мкг клеток в 150 мкл буфера для проб PAGE (360 мМ Трис-HCl [рН 8,8], содержащий 4% додецилсульфат натрия и 20% глицерин) и инкубированием суспензии при 100 С в течение 5 мин. Солюбилизированные клетки разделяли на 12% полиакриламидных гелях по Лэммли и разделенные белки электрофоретически переносили на мембраныPVDF при 100 В в течение 1,5 ч, как описано ранее (Thebain et al., 1979, Proc.Natl. Acad. Sci.USA 76:4350-4354), за исключением того, что к буферу для переноса добавляли 0,05% додецилсульфат натрия для облегчения выхода белков из геля. Затем мембраны PVDF предобрабатывали 25 мл забуференного фосфатом солевого раствора Дульбекко, содержащего 0,5% казеин натрия, 0,5% бычий сывороточный альбумин и 1% козью сыворотку. Все последующие инкубации проводили с использованием этого буфера для преодобработки. Мембраны PVDF инкубировали с 25 мл разведения 1:500 преиммунной кроличьей сыворотки или сыворотки из кролика, иммунизированного полипептидом ОМР 106 (как описано выше), в течение 1 ч при комнатной температуре. Затем мембраны PVDF промывали дважды буфером (20 мМ Трис-буфер [рн 7,5], содержащий 150 мМ хлорид натрия и 0,05% Твин-20). Мембраны PVDF инкубировали с 25 мл разведения 1:5000 меченого пероксидазой козьего антитела против IgG кролика (Jackson ImmunoResearch Laboratories, West Grove Penn. Catalog number 111-035-003) в течение 30 мин при комнатной температуре. Затем мембраны PVDF промывали 4 раза промывным буфером и проявляли тетрагидрохлоридом 3,3' - диаминобензидина и пероксидом мочевины, поставляемымиSigma Chemical Co. (St. Louis, МО, catalog number D-4418), в течение 4 мин в каждом. 6.1.10. Иммунофлуоресцентное окрашивание антителами против ОМР 106 клеточной поверхности М.catarrhalis ATCC 49143 выращивали в течение ночи при 35 С во встряхиваемой водяной бане в бульоне Мюллера-Хинтона. Клетки осаждали центрифугированием и затем ресуспендировали в равном объеме модифицированного Дульбекко забуференного фосфатом солевого раствора без кальция или магния(PBS/MC). 20 мкл клеточной суспензии наносили на каждое из 5 чистых предметных стекол для микроскопа. После отстаивания в течение 10 с избыток жидкости удаляли микропипеткой и предметным стеклам давали высохнуть на 39 воздухе в течение 1 ч. Затем стекла фиксировали нагреванием на открытом пламени до тех пор, пока стекло не становилось теплым (при прикосновении). Предметные стекла сначала обрабатывали 40 мкл разведения 1:40 антисыворотки против ОМР 106 или преиммунной сыворотки из того же животного, разведенной вPBS/MC, или PBS/MC в течение 10 мин, затем промывали 5 раз PBS/MC. Стекла обрабатывали 40 мкл 5 мкг/мл PBS/MC меченых изотиоцианатом флуоресцеина козьих антител к IgG кролика(Kirkegaard and Perry Laboratories, Inc,Gaithersburg, MD catalog number 02-15-06). Предметные стекла инкубировали в темноте в течение 10 мин и промывали 5 раз в PBS/MC. Каждое предметное стекло хранили покрытымPBS/MC под покровным стеклом и просматривали под флуоресцентным микроскопом, снабженным фильтром 489 нм. Для каждой пробы визуально просматривали пять полей для оценки степени окрашивания. 6.2. Результаты 6.2.1. Гемагглютинирующая активность Агглютинирующая активность M.catarrhalis в отношении эритроцитов является вид о специфической с наиболее сильной активностью, наблюдаемой с эритроцитами человека. Эритроциты кролика также агглютинируютсяM.catarrhalis, но в меньшей степени, чем эритроциты человека. Эритроциты из мыши, лошади или овцы не агглютинируются (см. табл. 1). Таблица 1. Интенсивность гемагглютинации эритроцитов из различных видов с использованием M.catarrhalis АТСС 49143 Источник Оценка эритроцитов гемагглютинацииa Человек Мышь Лошадь Овца а= самая интенсивная агглютинация, - показывает отсутствие агглютинации. 6.2.2. Лиганды и рецепторы ОМР 106 Гемагглютинирующая активность M.catarrhalis обусловлена связыванием с глоботетрозой(Gb4). Пузырьки (везикулы) из гемагглютинирующих штаммов связываются с гликолипидом,имеющим Gb4, тогда как негемагглютинирующие штаммы не связываются с этим гликолипидом (см. фиг. 2). Гемагглютинирующая активность М.саtаrrhаlis ингибируется моносахаридными компонентами Gb4 или производными таких моносахаридов, причем наиболее сильными ингибиторами являются N-ацетилгалактозамин и галактоза (особенно альфа-аномер галактозы) (см. табл. 2). 40 Таблица 2. Минимальная концентрация cахаров,требующаяся для ингибирования гемагглютинации (МИК), вызываемой M.catarrhalis Сахар МИК (мМ)Meтилманноза 10 Метилгалактоза 83 МетилгалактозаМинимальная концентрация сахара, требующаяся для ингиби-рования реакции гемагглютинации 1+, вызываемой M.catarrhalis АТСС 49143, с 5% промытыми 0+ эритроцитами. Как N-ацетилгалактозамин, так и альфагалактоза являются частью тетрасахарида Gb4. Корреляция между гемагглютинацией и связыванием с Gb4 и наблюдение, что гемагглютинация ингибируется моносахаридами, которые содержат Gb4 рецептор, предполагают, что клетки M.catarrhalis связываются с тетрасахаридом Gb4. Этот тетрасахарид присутствует на эритроцитах и тканях человека и мог бы медиировать присоединение M.catarrhalis к мембранам эритроцитов. 6.2.3. Идентификация полипептида ОМР 106 Протеолитическое расщепление клетокM.catarrhalis и последующий анализ гемагглютинации, вызываемой расщепленными клетками, показали, что протеазная обработка химотрипсином и протеиназой К разрушала гемагглютинирующую активность, а обработка трипсином частично разрушала гемагглютинирующую активность, что указывало на то, что гемагглютинирующая активность опосредована белком. Анализ профилей белков ОМР обработанных протеазами клеток M.catarrhalis показал,что в каждой пробе были деградированы многочисленные белки, так что эти профили не дают ответа на вопрос, какой белок непосредственно или опосредованно участвует в гемагглютинирующей активности (см. фиг. 3). Поскольку протеазная обработка показала,что полипептид прямо или опосредованно ответственен за гемагглютинирующую активность, мы использовали электрофорез в полиакриламидном геле с ДСН (PAGE-SDS) для сравнения профилей ОМР из гемагглютинирующих штаммов с профилями ОМР из негемагглютинирующих штаммов (фиг. 4). Анализ различий между этими профилями показал, что гемагглютинирующие штаммы имеют два уникальных полипептида, один со средней молекулярной массой 27 кДа (обозначенный ОМР 27) и другой,являющийся единственным белком со средней молекулярной массой более 106 кДа (обозна 41 ченный ОМР 106). Следует отметить, что полоса полипептида ОМР 106 отсутствовала в препаратах ОМР обработанных различными протеазами клеток, которые имели уменьшенную гемагглютинирующую активность или не имели гемагглютинирующей активности, тогда как полоса ОМР 27 присутствовала в препарате ОМР обработанных протеиназой К клеток, которые не имели гемагглютинирующей активности. Кроме того, полоса полипептида ОМР 106 не разрушалась гидролизом протеиназой V8, который не влиял на гемагглютинирующую активность обработанных клеток. 6.2.4. Профиль ОМР NHA Культиваров Последовательное (серийное) культивирование NHA культивара АТСС 49143 в статической культуре при 35 С давало NHA культивар(названный 49143-NHA) при третьем пассаже этой культуры. Эта потеря гемагглютинирующей активности была воспроизводимой. Анализ профилей ОМР OG-экстрактов наружных мембран НА и NHA культиваров показал, что полоса полипептида ОМР 106 отсутстствовала в экстракте 49143-NHA (фиг. 5). Это предполагает,что полипептид ОМР 106 является гемагглютинином M.catarrhalis (т.е. полипептид ОМР 106 связывает рецептор Gb4 или является субъединицей гомополимерного белка, который связывает рецептор Gb4) или образует часть гемагглютинина(т.е. полипептид ОМР 106 является субъединицей гетерополимерного белка, который связывает рецепторGb4). 6.2.5. ОМР 106 и гемагглютинация Поликлональная антисыворотка, индуцированная полипептидом ОМР 106 АТСС 49143,нейтрализовала гемагглютинацию, вызываемую АТСС 49143, а также гемагглютинацию, вызываемую гетерологичным штаммом АТСС 43627. Это дополнительно подтверждает вывод о том,что гемагглютинирующая активность M.catarrhalis включает полипептид ОМР 106 и что полипептид ОМР 106 является антигенно консервативным среди штаммов. См. также фиг. 9 А, который показывает антитела в поликлональной антисыворотке,связывающие полипептид ОМР 106 гетерологичных штаммов M.catarrhalis. 6.2.6. Локализация ОMP106 в наружной мембране Для определения, экспонирован ли полипептид ОМР 106 на наружной мембране клетокM.catarrhalis, использовали кроличью антисыворотку против ОМР 106 в непрямом иммунофлуоресцентном окрашивании. Клетки M.catarrhalis, обработанные антисывороткой против ОМР 106, окрашивались более интенсивно и однородно, чем клетки, обработанные преиммунной сывороткой или PBS/MC. Это свидетельствует о том, что в интактных клеткахM.catarrhalis полипептид ОМР 106 был реактивен с антителами против ОMP106. Этот результат показывает, что полипептид ОМР 106 экспо 002743 42 нирован на наружной поверхности M.catarrhalis. Это открытие согласуется с тем, что полипептид ОМР 106 играет роль в гемагглютинации, и,кроме того, свидетельствует о том, что полипептид ОМР 106 мог бы быть применимым в качестве вакцины. 6.2.7. Свойства полипептида ОМР 106 Полипептид ОМР 106 существует в виде большого белкового комплекса в его нативном состоянии или в виде агрегатов, когда его экстрагируют октилглюкозидом. Этот вывод подтверждается обнаружением того, что экстракция клеток M.catarrhalis октилглюкозидом будет солюбилизировать полипептид ОМР 106, но экстрагированный полипептид ОМР 106 не входит в денатурирующие полиакриламидные гели,если этот экстракт не инкубируют сначала при 100 С (фиг. 6). Кроме того, полоса полипептида ОМР 106, по-видимому, не образуется из полипептидов более низкой молекулярной массы,которые полимеризуются или агрегируют при нагревании, так как полипептид ОМР 106 в не денатурированной нагреванием пробе удерживается в этой пробе хорошо и входит в разделяющий гель только в том случае, если пробу сначала инкубируют при 100 С. Это биохимическое свойство является очень полезным для идентификации полипептида ОМР 106 в различных гелях. Используя октилглюкозидные экстрактыM.catarrhalis, затем инкубируя эти экстракты с додецилсульфатом натрия при 100 С и разделяя белки на денатурирующем полиакриламидном геле, мы определили, что средняя молекулярная масса полипептида ОМР 106 из различных штаммов M.catarrhalis, в частности, штаммов АТС 25238, АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627 и АТСС 43628, находится в диапазоне от около 180 кДа до около 230 кДа(фиг. 9 А), тогда как полипептид ОМР 106 штамма АТСС 49143 имеет, по-видимому, среднюю молекулярную массу примерно 190 кДа (фиг. 6). Полипептид ОМР 106 штамма АТСС 49143 был экстрагирован из пластинки геля и его Nконец был секвенирован. Секвенирование показало, что N-конец полипептида ОМР 106 из наружной мембраны АТСС 49143 представляет собой IGISEADGGKGGANARGDKSIAIGDIAQALGSQSIAIGDNKIV (SEQ ID N 1). Кроме того, был выделен внутренний пептид ОМР 106,продуцируемый продуктом расщепления Lys-C(Fernandez et al., 1994, Anal. Biochem. 218:112117), и было определено, что его последовательность представляет собой GTVLGGKK(SEQ ID N 2). Мы получили три олигонуклеотидных зонда. Два зонда соответствуют внутреннему пептиду GTVLGGKK, один имеет следующую последовательность GGNACNGTNTTRGGNGGNAARAAR (SEQ ID N 7). Другой зонд, Мс-572, кодирующий внутренний фрагмент (SEQ IDTGACATTGCGCAA (SEQ ID N 4). Гибридизация зонда Мс-5-72 с полным продуктом гидролиза HindIII или DraI ДНК М.catarrhalis в каждом случае давала единственную полосу в блоттинге по Саузерну (фиг. 7). Гибридизующаяся полоса в продукте расщепления HindIII имеет приблизительный размер 8,0 т.п.н.; гибридизующаяся полоса в продукте расщепления DraI имеет приблизительный размер 4,2 т.п.н. (фиг. 7). 6.2.8. Консервативность полипептида ОМР 106 Вестерн-блот-анализ экстрактов белков наружной мембраны ряда штаммов М.catarrhalis и родственных видов бактерий показал, что антитела против ОМР 106 связываются с полипептидом от приблизительно 180 до 230 кДа во многих штаммах М.catarrhalis, как в НА, так и вNHA штаммах или культиварах (фиг. 9 А). Антитела против ОМР 106 не связывались с какимлибо полипептидом в белковых экстрактах родственных бактерий (фиг. 8 А). Эти результаты свидетельствуют о следующем: 1) Антитела против ОМР 106 могут быть использованы для специфической идентификации и отличения М.catarrhalis от родственных видов бактерий. 2) Полипептид ОМР 106 может быть использован для генерирования антител, которые имеют диагностическое применение для идентификации M.catarrhalis. 3) Антитела к полипептиду ОМР 106 одного штамма (например, ОМР 106 АТСС 49143) могут быть использованы для идентификации и выделения соответствующего полипептида ОМР 106 других штаммов M.catarrhalis. Интересно, что результаты Вестерн-блоттинга показывают, что многие NHA штаммы M.catarrhalis имеют полипептид ОМР 106 в OG-экстрактах их наружных мембран. Это обнаружение и факт,что окрашивание серебром ОМР из OGэкстрактов наружных мембран NHA штаммовM.catarrhalis после PAGE не выявляет полосы в диапазоне 180-230 кДа, свидетельствуют о том,что полипептид ОМР 106 экспрессируется большинством штаммов или культиваровM.catarrhalis, но для того, чтобы быть активным в гемагглютинации или окрашиваться серебром,полипептид ОМР 106 должен быть правильно модифицирован некоторым образом. Очевидно,только НА штаммы и культивары способны подходящим образом модифицировать полипептид ОМР 106, так чтобы он мог медиировать бактериальное связывание с рецептором агглютинина на поверхностях клеток млекопитающих. 44 7. Пример: эффективность вакцины ОМР 106: цитотоксическая активность антисыворотки против ОМР 106 Опосредованную комплементом цитотоксическую активность антител против ОМР 106 исследовали для определения вакцинного потенциала полипептида ОМР 106. Антисыворотку к полипептиду ОМР 106 НА культивара АТСС 49143 получали, как описано в Разделе 6.1.8.supra. Активности преиммунной сыворотки и антисыворотки против ОМР 106 в медиировании киллинга (цитолиза) комплементом M.catarrhalis исследовали при помощи сывороточного бактерицидного теста (Serum Bactericidal Test),описанного Zollinger et al. (Immune Responses toNeisseria meningitis, in Manual of Clinical Laboratory Immunology, 3rd ed, pp. 347-349), за исключением того, что вместо клеток Neisseriameningitis использовали клетки НА и NHA штаммов и культиваров M.catarrhalis. Результаты показывают, что антисыворотка против ОМР 106 медиировала комплементкиллинг (цитолиз) НА культивара гетерологичного штамма 43627 M.catarrhalis, но не NHA культивара M.catarrhalis АТСС 43627 или NHA культивара M.catarrhalis АТСС 8176. Табл. 3 обобщает опосредованные комплементом цитотоксические активности преиммунной сыворотки и антисыворотки против ОМР 106 в отношении (против) НА культивара АТСС 43627. Таблица 3. Опосредованные комплементом цитотоксические активности преиммунной сыворотки и антисыворотки против ОМР 106 Цитотоксический титр 1 Преиммунная Антисыворотсыворотка ка против ОМР 106 Эксперимент 1 16 128 Эксперимент 2 8 64 1 Этот титр является наивысшим разведением, при котором сыворотка может медиировать киллинг (цитолиз) комплементом НА культивара АТСС 43627 (например, 16 обозначает 16-кратное разведение сыворотки); чем больше число, тем выше цитотоксическая активность или титр. Как показано в табл. 3, антисыворотка против ОМР 106 имеет в 8 раз большую цитотоксическую активность, чем преиммунная сыворотка. Этот результат свидетельствует о том,что полипептид ОМР 106 применим в качестве вакцины против НА штаммов и культиваров М.catarrhalis. Хотя данное изобретение описано подробно со ссылкой на его характерные варианты должно быть понятно, что изменения, которые являются функционально равноценными, находятся в объеме данного изобретения. Действительно, различные модификации данного изобретения, в дополнение к показанным и описанным здесь, будут очевидными для специалистов 45 в данной области из предшествующего описания и сопутствующих рисунков. Такие модификации должны находиться в рамках прилагаемых пунктов формулы изобретения. Здесь цитируются многочисленные публикации, описания которых включены в качестве ссылок во всей их полноте. Список последовательностей(ii) ТИП МОЛЕКУЛЫ: другая нуклеиновая кислота (А) ОПИСАНИЕ: /desc = probe (зонд)YTTYTTNCCN CCYAANACNG TNCC ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный полипептид ОМP 106, который является полипептидом наружной мембраны Moraxella catarrhalis и имеет молекулярную массу приблизительно от 180 кДа до приблизительно 230 кДа, как определено электрофорезом в SDS-полиакриламидном геле с использованием миозина скелетных мышц кролика и 3-галактозидазы E.coli в качестве стандартов молекулярных масс 200 кДа и 116,25 кДа соответственно, и включает либо последовательность SEQ ID NO:1, либо последовательности SEQ ID NO:1 и SEQ ID NO:2. 2. Выделенный полипептид ОМР 106 по п.1, отличающийся тем, что включает последовательности SEQ ID NO:1 и SEQ ID NO:2. 3. Выделенный полипептид ОМР 106 по п.1 или 2, отличающийся тем, что он имеет молекулярную массу приблизительно 190 кДа. 4. Выделенный полипептид ОМР 106 по любому из пп.1-3, отличающийся тем, что он является полипептидом наружной мембраны штамма Moraxella catarrhalis, выбранного из группы, состоящей из АТСС 25238, АТСС 25240, АТСС 43617, АТСС 43618, АТСС 43627,АТСС 43628 и АТСС 49143. 5. Выделенный полипептид ОМР 106 по любому из пп.1-4, отличающийся тем, что штамм Moraxella catarrhalis представляет собой АТСС 49143. 6. Выделенный полипептид ОМР 106 по любому из пп.1-5, отличающийся тем, что штамм бактерий Moraxella catarrahalis является гемагглютинирующим культиваром. 48 7. Выделенный полипептид ОМР 106 по любому из пп.1-6, отличающийся тем, что он взаимодействует с содержащим серебро красителем. 8. Выделенное поликлональное антитело,отличающееся тем, что оно специфично связывает выделенный полипептид ОМР 106 по любому из пп.1-7 или его фрагмент. 9. Выделенное поликлональное антитело по п.8, отличающееся тем, что оно является цитотоксическим антителом,опосредующим уничтожение бактерий Moraxella catarrhalis с помощью комплемента. 10. Пептидный фрагмент полипептида ОМР 106 по любому из пп.1-7, характеризующийся тем, что он специфически связывает антитело по п.8 и включает аминокислотную последовательность SEQ ID NO: 5. 11. Вакцина, содержащая выделенный полипептид ОМР 106 по любому из пп.1-7. 12. Вакцина, содержащая пептидный фрагмент по п.10. 13. Антигенная композиция, содержащая выделенный полипептид ОМР 106 по любому из пп.1-7. 14. Антигенная композиция, содержащая пептидный фрагмент по п.10. 15. Выделенная молекула ДНК, кодирующая выделенный полипептид ОМР 106 по любому из пп.1-7, включающий последовательность SEQ ID NO:1 либо последовательностиSEQ ID NO:1 и SEQ ID NO:2, выведенная на основе принципа генетического кода. 16. Выделенная молекула ДНК, кодирующая полипептид ОМР 106 по любому из пп.1-7,включающий SЕQ ID N0:1, выведенная на основе принципа генетического кода. 17. Выделенная молекула ДНК, кодирующая пептидный фрагмент по п.10, включающая последовательность SEQ ID NO:4, а также варианты, полученные на основе вырожденности генетического кода. 18. Способ генерации иммунного ответа у животного, включающий иммунизацию животного эффективным количеством выделенного полипептида ОМР 106 по любому из пп.1-7. 19. Способ генерации иммунного ответа у животного, включающий иммунизацию животного эффективным количеством пептидного фрагмента по п.10. 20. Способ генерации иммунного ответа в животном по п.18 для лечения инфекции, вызываемой Moraxella catarrhalis, включающий введение животному, нуждающемуся в лечении,эффективного количества выделенного полипептида по любому из пп.1-7. 21. Способ генерации иммунного ответа в животном по п.18 для профилактики инфекции,вызываемой Moraxella Catarrhalis, включающий введение животному, нуждающемуся в профилактике, эффективного количества вакцины по п.11. 49 22. Способ генерации иммунного ответа по п.19 для лечения инфекции, вызываемой Moraxella catarrhalis, включающий введение животному, нуждающемуся в лечении, эффективного количества пептидного фрагмента по п.10. 23. Способ генерации иммунного ответа по п.19 для профилактики инфекции, вызываемойMoraxella Catarrhalis, включающий введение животному, нуждающемуся в профилактике,эффективного количества антигенной композиции по п.14. 24. Применение выделенного полипептида по любому из пп.1-7 для изготовления препара 002743 50 та для лечения или профилактики инфекции,вызываемой Moraxella catarrhalis. 25. Применение поликлонального антитела по любому из пп.8-9 для приготовления препарата для лечения или профилактики инфекции,вызываемой Moraxella catarrhalis. 26. Применение пептидного фрагмента по п.10 для приготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella catarrhalis. 27. Применение молекулы ДНК по п.17 для приготовления препарата для лечения или профилактики инфекции, вызываемой Moraxella
МПК / Метки
МПК: C07K 16/00, C07H 21/02, A61K 39/00, A01N 63/00
Метки: наружной, днк, полипептид, белка-106, применение, мембраны, кодирующие, catarrhalis, moraxella
Код ссылки
<a href="https://eas.patents.su/27-2743-polipeptid-belka-106-naruzhnojj-membrany-moraxella-catarrhalis-dnk-ego-kodiruyushhie-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Полипептид белка-106 наружной мембраны moraxella catarrhalis, днк, его кодирующие, и их применение</a>
Предыдущий патент: Антагонисты лейкотриена для лечения эпителиальной плоскоклеточной карциномы ротовой полости
Следующий патент: Корм для животных и птиц и способ его приготовления
Случайный патент: Тонкая крончатая крышка