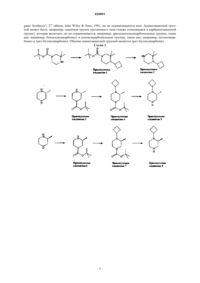
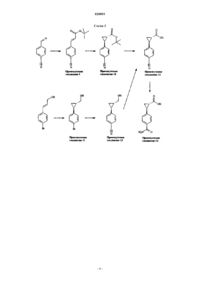
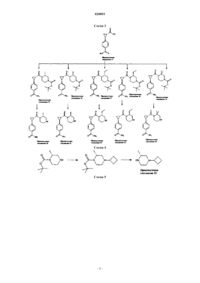
Производные циклопропиламида, направленно действующие на гистаминовый н3-рецептор
Формула / Реферат
1. Соединение или его фармацевтически приемлемая соль, выбранное из
диастереоизомерной смеси 4-(транс-2-((R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида;
изомера 1 4-(транс-2-((R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида и
изомера 2 4-(транс-2-((R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида.
2. Соединение или его фармацевтически приемлемая соль, представляющее собой изомер 1 4-(транс-2-((R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида.
3. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по п.1 или 2 и фармацевтически приемлемый носитель и/или разбавитель.
Текст
ПРОИЗВОДНЫЕ ЦИКЛОПРОПИЛАМИДА, НАПРАВЛЕННО ДЕЙСТВУЮЩИЕ НА ГИСТАМИНОВЫЙ Н 3-РЕЦЕПТОР В изобретении раскрыты производные циклопропиламида и фармацевтические композиции,содержащие раскрытые здесь производные циклопропиламида. Указанные производные циклопропиламида нацелены на гистаминовый H3-рецептор. В данном изобретении раскрыто по меньшей мере одно производное циклопропиламида, по меньшей мере одна фармацевтическая композиция, содержащая по меньшей мере одно раскрытое здесь производное циклопропиламида, и по меньшей мере один способ применения по меньшей мере одного раскрытого здесь производного циклопропиламида для лечения по меньшей мере одного состояния, ассоциированного с гистаминовым H3-рецептором. Гистаминовый H3-рецепттор является актуальным в разработке новых лекарственных средств.H3-рецептор представляет собой пресинаптический ауторецептор, локализованный как в центральной,так и периферической нервной системах, коже и в таких органах, как, например, легкое, кишечник, вероятно, в селезенке и желудочно-кишечном тракте. Недавно полученные данные показывают, чтоH3-рецептор обладает внутренней конститутивной активностью in vitro, а также in vivo (т.е. он активен в отсутствие агониста). Соединения, действующие как обратные агонисты, могут ингибировать эту активность. Показано, что гистаминовый H3-рецептор регулирует высвобождение гистамина и также других нейромедиаторов, таких как, например, серотонин и ацетилхолин. Некоторые H3-гистаминовые лиганды,такие как, например, антагонист или обратный агонист гистаминового H3-рецептора, могут усиливать высвобождение нейромедиаторов в головном мозге, в то время как другие H3-гистаминовые лиганды,такие как, например, агонисты гистаминового H3-рецептора, могут ингибировать биосинтез гистамина, а также ингибировать высвобождение нейромедиаторов. Это является подтверждением того, что агонисты,обратные агонисты и антагонисты гистаминового H3-рецептора могут опосредовать нейронную активность. В связи с этим были предприняты попытки разработки новых терапевтических средств, направленно воздействующих на гистаминовый H3-рецептор. Краткое изложение сущности изобретения Согласно данному изобретению предложено соединение или его фармацевтически приемлемая соль, где соединение выбрано из диастереоизомерной смеси 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида; изомера 1 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида и изомера 2 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопронил)бензамида. В конкретном воплощении изобретение представляет собой соединение или его фармацевтически приемлемую соль, где соединение представляет собой изомер 1 4-(транс-2-R)-4-циклобутил-2 метилпиперазин-1-карбонил)циклопропил)бензамида. Кроме того, в данном изобретении предложена фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль, где соединение выбрано из диастереоизомерной смеси 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида; изомера 1 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида; изомера 2 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида; и фармацевтически приемлемый носитель и/или разбавитель. Краткое описание графических материалов На фигуре продемонстрирована картина дифракции рентгеновских лучей на порошке (XRPD) для примера 35 (кристаллическая форма I). Подробное описание изобретения В данном изобретении описаны соединения по изобретению, или их диастереомеры или энантиомеры, или фармацевтически приемлемые соли соединений по изобретению или их диастереомеров или энантиомеров, или их смеси для применения в качестве лекарственного средства. В данном изобретении раскрыто применение соединений по изобретению, или их диастереомеров или энантиомеров, или их фармацевтически приемлемых солей или их диастереомеров или энантиомеров, или их смесей в изготовлении лекарственного средства для терапии по меньшей мере одного расстройства, выбранного из нарушения познавательной способности при шизофрении, нарколепсии, ожирения, синдрома дефицита внимания и гиперактивности, боли и болезни Альцгеймера. Кроме того, в данном изобретении описана фармацевтическая композиция, содержащая по меньшей мере одно соединение по изобретению, или его диастереомеры или энантиомеры, или фармацевтически приемлемые соли соединений по изобретению или их диастереомеры или энантиомеры, или их смеси и фармацевтически приемлемый носитель и/или разбавитель. Кроме того, в данном изобретении описан способ лечения по меньшей мере одного расстройства,выбранного из нарушения познавательной способности при шизофрении, нарколепсии, ожирения, синдрома дефицита внимания и гиперактивности, боли и болезни Альцгеймера, у теплокровного животного,включащий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению, или его диастереомеров или энантиомеров, или его фармацевтически приемлемых солей или их диастереомеров или энантиомеров,или их смесей. Кроме того, в данном изобретении описан способ лечения расстройства, при котором благоприятно модулирование гистаминового H3-рецепттора, включащий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению, или его диастереомеров или энантиомеров, или его фармацевтически приемлемых солей или их диастереомеров или энантиомеров, или их смесей. Признаки и преимущества изобретения могут быть более легко поняты специалистами в данной области техники после прочтения следующего далее подробного описания. Очевидно, что некоторые признаки изобретения, которые для ясности описаны выше и ниже в контексте отдельных воплощений, также могут быть скомбинированы с образованием одного воплощения. И наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного воплощения, также могут быть скомбинированы, чтобы образовать его подкомбинацию. Если в данном описании конкретно не указано иное, то ссылка, сделанная в отношении единственного числа, также может включать и множественное число. Например, "один", "одно" и "одна" могут относиться либо к одному/одной, либо к одному/одной или более. Предполагается, что воплощения, определенные в данном описании как типичные, являются иллюстративными и неограничивающими. Если не указано иное, то предполагают, что любой гетероатом с ненасыщенными валентностями имеет атомы водорода, достаточные для насыщения этих валентностей. Определения терминов, использованных при описании данного изобретения, приведены ниже. Если не указано иное, то первоначальное определение, приведенное для группы или термина, применяется каждый раз, когда такую группу или термин используют индивидуально или как часть другой группы. Группы и их заместители, приведенные по всему данному описанию, могут быть выбраны специалистом в данной области для получения стабильных группировок и соединений. Фраза "соединение по изобретению, или его энантиомеры или диастереомеры, или его фармацевтически приемлемые соли или их энантиомеры или диастереомеры, или их смеси" относится к свободному основанию, энантиомерам свободного основания, диастереомерам свободного основания, фармацевтически приемлемым солям соединения, фармацевтически приемлемым солям энантиомеров, фармацевтически приемлемым солям диастереомеров и/или смесям любого из перечисленного выше. Соединения по настоящему изобретению содержат хиральные центры, и соединения по изобретению могут существовать 1) в энантиомерных или диастереомерных формах (и быть выделены в таком виде) и/или 2) в виде рацемической смеси. Настоящее изобретение включает все возможные энантиомеры, диастереомеры, рацематы соединений по изобретению или их смеси. Оптически активные формы соединений по изобретению могут быть получены, например, в результате разделения рацемата посредством хиральной хроматографии, в результате синтеза из оптически активных исходных веществ или в результате асимметрического синтеза, основанного на описанных далее способах. Также следует понимать, что соединения по изобретению могут существовать в сольватированных,например гидратированных, а также несольватированных формах. Также следует понимать, что настоящее изобретение охватывает все такие сольватированные формы соединений по изобретению, которые обладают нижеупомянутой активностью. Соединения по изобретению также могут образовывать соли. Таким образом, когда в данном описании дается ссылка на соединение, тогда такая ссылка включает, если не указано иное, его соли. В одном из воплощений соединения по изобретению образуют фармацевтически приемлемые соли. В еще одном воплощении соединения по изобретению образуют соли, которые могут быть использованы, например, для выделения и/или очистки соединений по изобретению. В общем случае фармацевтически приемлемые соли соединений по изобретению могут быть получены с использованием стандартных способов, хорошо известных в данной области техники. Такие стандартные методики включают, например, взаимодействие достаточно основного соединения, такого как,например, алкиламин, с подходящей кислотой, такой как, например, HCl или уксусная кислота, с получением физиологически приемлемого аниона, но не ограничиваются ими. В одном воплощении соединения по изобретению могут быть превращены в их фармацевтически приемлемые соли или сольваты, в частности соли присоединения кислоты, такие как, например, гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат и паратолуолсульфонат. В общем случае соединения по изобретению могут быть получены в соответствии со следующими далее схемами и знаниями, известными специалисту в данной области техники, и/или в соответствии со способами, приведенными в примерах, которые следуют далее. Растворители, значения температуры,давления и другие реакционные условия легко могут быть выбраны специалистом обычнойквалификации в данной области техники. Исходные вещества имеются в продаже или могут быть легко получены специалистом в данной области. В получении данных соединений могут быть применены способы комбинаторного синтеза, например, когда промежуточные соединения обладают группами, подходящими для этих способов. Термин "аминозащитная группа" относится к принятым в данной области техники группировкам,способным присоединяться к аминогруппе с тем, чтобы предотвратить участие этой аминогруппы в реакциях, происходящих где-либо на молекуле, к которой присоединена аминогруппа. Приемлемые аминозащитные группы, включают, например, аминозащитные группы, описанные в "Protective Groups in Or-2 020093ganic Synthesis", 2nd edition, John WileySons, 1981, но не ограничиваются ими. Аминозащитной группой может быть, например, защитная группа уретанового типа (также относящаяся к карбаматзащитной группе), которая включает, но не ограничивается, например, арилалкилоксикарбонильные группы, такие как, например, бензилоксикарбонил; и алкоксикарбонильные группы, такие как, например, метоксикарбонил и трет-бутоксикарбонил. Обычно аминозащитной группой является трет-бутоксикарбонил. Схема 1 Еще один аспект изобретения относится к способу лечения расстройства, при котором благоприятно модулирование гистаминового H3-рецепттора, включающему введение теплокровному животному,нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению или его диастереомеров, или его энантиомеров, или фармацевтически приемлемых солей соединения по изобретению или их диастереомеров или энантиомеров, или их смесей. По меньшей мере одно соединение по изобретению может быть использовано для лечения целого ряда состояний или расстройств, при которых благоприятно взаимодействие с гистаминовым H3 рецептором. По меньшей мере одно соединение по изобретению может быть полезно, например, для лечения заболеваний центральной нервной системы, периферической нервной системы, сердечнососудистой системы, легочной системы, желудочно-кишечной системы или эндокринной системы. В одном воплощении по меньшей мере одно соединение по изобретению модулирует по меньшей мере один гистаминовый H3-рецептор. Термины "модулируют", "модулирует", "модулирование" или "модуляция", при использовании в данном описании, относятся, например, к активации (например, агонистической активности) или ингибированию (например, антагонистической активности и активности обратного агониста) по меньшей мере одного гистаминового H3-рецептора. В еще одном воплощении описан способ лечения расстройства, при котором благоприятно модулирование функции по меньшей мере одного гистаминового H3-рецептора, включающий введение теплокровному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном воплощении по меньшей мере одно соединение по изобретению может быть использовано в качестве лекарственного средства. По меньшей мере одно соединение по изобретению может быть полезно для лечения по меньшей мере одного аутоиммунного расстройства. Типичные аутоиммунные расстройства включают, например,артрит, кожные трансплантаты, органные трансплантаты и схожие хирургические потребности, коллагеновые заболевания, различные аллергии, опухоли и вирусы, но не ограничиваются ими. По меньшей мере одно соединение по изобретению может быть полезно для лечения по меньшей мере одного психиатрического расстройства. Типичные психиатрические расстройства включают, на-6 020093 пример, психотическое расстройство(а) и шизофреническое расстройство(а), такие как, например, шизоаффективное расстройство(а), бредовое расстройство(а), кратковременное психотическое расстройство(а), совместное (shared) психотическое расстройство(а) и психотическое расстройство(а) вследствие общего медицинского состояния; деменцию и другое расстройство(а) познавательной способности; тревожное расстройство(а), такое как, например, паническое расстройство(а) без агорафобии, паническое расстройство(а) с агорафобией, агорафобия без анамнеза панических(ого) расстройств(а), специфическая фобия, социальная фобия, обсессивно-компульсивное расстройство(а), стрессовое расстройство(а), посттравматическое стрессовое расстройство(а), острое стрессовое расстройство(а), генерализованное тревожное расстройство(а) и генерализованное тревожное расстройство(а) вследствие общего медицинского состояния; расстройство(а) настроения, такое как, например, а) депрессивное расстройство(а) (в том числе, например, большое депрессивное расстройство(а) и дистимическое расстройство(а), но не ограничивающееся ими), б) биполярная депрессия и/или биполярная мания, такие как, например, биполярное расстройство I (которое включает расстройства с маниакальными, депрессивными или смешанными эпизодами, но не ограничивается ими) и биполярное расстройство II, в) циклотимическое расстройство(а), и г) расстройство(а) настроения вследствие общего медицинского состояния; расстройство(а) сна, такое как,например, нарколепсия; расстройство(а), обычно первоначально диагностируемое в младенческом, детском или подростковом возрасте, в том числезадержка психического развития, синдром Дауна, расстройство(а) способности к обучению, расстройство(а) двигательных навыков, коммуникативное расстройство(а), распространяющееся расстройство(а) развития, расстройство(а) поведения с дефицитом внимания и распадом личности, расстройство(а) питания и приема пищи в младенческом или раннем детском возрасте, тиковое расстройство(а) и расстройство(а) экскреции, но не ограничиваясь ими; расстройство(а), связанное с употреблением психоактивных веществ, в том числе, например, синдром зависимости от веществ, пагубное употребление веществ, интоксикация, вызванная употреблением вещества,абстинентное состояние, расстройство(а), вызванное употреблением алкоголя, расстройство(а), связанное с употреблением амфетаминов (или амфетаминоподобных веществ), расстройство(а), связанное с употреблением кофеина, расстройство(а), связанное с употреблением каннабиоидов, расстройство(а),связанное с употреблением кокаина, расстройство(а), связанное с употреблением галлюциногенов, расстройство(а), связанное с употреблением летучих растворителей, расстройство(а), связанное с употреблением никотина, расстройство(а), связанное с употреблением опиоидов, расстройство(а), связанное с употреблением фенциклидина (или фенциклидиноподобных веществ), расстройство(а), связанное с употреблением седативных, снотворных или анксиолитических средств, но не ограничиваясь ими; расстройство(а) поведения с дефицитом внимания и распадом личности; расстройство(а) приема пищи, такое как,например, ожирение; расстройство(а) личности, в том числе обсессивно-компульсивное расстройство(а) личности, но не ограничиваясь ими; импульсивно контролируемое расстройство(а); тиковые расстройства, в том числе, например, расстройство Туретта, хроническое двигательное или голосовое тиковое расстройство, но не ограничиваясь ими; и транзиторное тиковое расстройство, но не ограничиваются ими. По меньшей мере одно из вышеупомянутых психиатрических расстройств определено, например, вRevision, Washington, DC, American Psychiatric Association, 2000. По меньшей мере одно соединение по изобретению может быть полезно 1) для лечения ожирения или склонности к полноте (например, для стимулирования уменьшения массы тела и поддержания уменьшения массы тела), расстройств приема пищи (например, постоянной потребности в еде, анорексии, булимии и компульсивного переедания) и/или пристрастий (к наркотикам, табаку, спирту, любым возбуждающим аппетит макронутриентам или несущественным пищевым продуктам); 2) для предупреждения прироста массы (например, индуцированного лекарственными средствами или после отказа от курения) и/или 3) для модулирования аппетита и/или чувства насыщения. По меньшей мере одно соединение по изобретению может подходить для лечения ожирения посредством снижения аппетита и массы тела и/или поддержания уменьшения массы тела и предупреждения возобновления симптомов. По меньшей мере одно соединение по изобретению может быть использовано для предупреждения или реверсирования индуцированного лекарственными средствами прироста массы, например увеличения массы, вызванного лечением антипсихотическими (нейролептическими) средствами; и/или увеличения массы, ассоциированного с отказом от курения. По меньшей мере одно соединение по изобретению может быть полезно для лечения по меньшей мере одного нейродегенеративного расстройства. Типичные нейродегенеративные расстройства включают, например, болезнь Альцгеймера (AD); деменцию, которая включает, например, болезнь Альцгеймера (AD), синдром Дауна, сосудистую деменцию, болезнь Паркинсона (PD), постэнцефалитический паркинсонизм, деменцию с тельцами Леви, ВИЧ-деменцию, болезнь Гентингтона, амиотрофический боковой склероз (ALS), поражения двигательных нейронов (MND), лобно-височную деменцию паркинсонического типа (FTDP), прогрессирующий супрануклеарный паралич (PSP), болень Пика, болень Ниманна-Пика, кортикобазальную дегенерацию, травматическое поражение головного мозга (TBI), демен-7 020093 цию боксеров, болезнь Крейтцфельдта-Якоба и прионные заболевания, но не ограничиваются ими; нарушение познавательной способности при шизофрении (CDS); умеренную когнитивную недостаточность (MCI); возрастное ослабление памяти (AAMI); возрастное снижение когнитивных функций(ARCD); когнитивную недостаточность без деменции (CIND); множественный склероз; болезнь Паркинсона (PD); постэнцефалитический паркинсонизм; болезнь Гентингтона; амиотрофический боковой склероз (ALS); поражения двигательных нейронов (MND); множественную системную атрофию (MSA); кортикобазальную дегенерацию; прогрессирующий супрануклеарный паралич; синдром Гийена-Барре(GBS) и хроническую воспалительную демиелинизирующую полиневропатию (CIDP), но не ограничиваются ими. По меньшей мере одно соединение по изобретению может быть полезно для лечения по меньшей мере одного нейровоспалительного расстройства, включая, например, рассеянный склероз (MS), который включает, например, ремиттирующий рассеянный склероз (RRMS), вторичный прогрессирующий рассеянный склероз (SPMS) и первичный прогрессирующий рассеянный склероз (PPMS), но не ограничивается ими; болезнь Паркинсона; множественную системную атрофию (MSA); кортикобазальную дегенерацию; прогрессирующий супрануклеарный паралич; синдром Гийена-Барре (GBS) и хроническую воспалительную демиелинизирующую полиневропатию (CIDP), но не ограничиваясь ими. По меньшей мере одно соединение по изобретению может быть полезно для лечения по меньшей мере одного расстройства поведения с дефицитом внимания и распадом личности. Типичные расстройства поведения с дефицитом внимания и распадом личности включают, например, синдром дефицита внимания (ADD), синдром дефицита внимания и гиперактивности (ADHD) и аффективные расстройства,но не ограничиваются ими. По меньшей мере одно соединение по изобретению может быть полезно для лечения боли; острых и хронических болевых расстройств, включая, например, распространенную боль, локализованную боль,ноцицептивную боль, воспалительную боль, центральную боль, центральную и периферическую невропатическую боль, центральную и периферическую нейрогенную боль, центральную и периферическую невралгию, боль в нижней части спины, послеоперационную боль, висцеральную боль и боль в области таза, но не ограничиваясь ими; аллодинии; болезненной анестезии; каузалгии; дизестезии; фибромиалгии; гипералгезии; гиперестезии; гиперпатии; ишемической боли; боли при ишиасе; боли, ассоциированной с циститом, включая интерстициальный цистит, но не ограничиваясь им; боли, ассоциированной с рассеянным склерозом; боли, ассоциированной с артритом; боли, ассоциированной с остеоартритом; боли, ассоциированной с ревматоидным артритом; и боли, ассоциированной с раком. По меньшей мере одно соединение по изобретению можно применять для изготовления лекарственного средства для лечения по меньшей мере одного аутоиммунного расстройства, психиатрического расстройства, ассоциированного с ожирением расстройства, расстройства приема пищи, расстройства,ассоциированного с навязчивым желанием, нейродегенеративного расстройства, нейровоспалительного расстройства, расстройства поведения с дефицитом внимания и распадом личности и/или болевого расстройства, описанного выше. По меньшей мере одно соединение по изобретению можно применять для изготовления лекарственного средства для лечения по меньшей мере одного расстройства, выбранного из нарушения познавательной способности при шизофрении, нарколепсии, синдрома дефицита внимания и гиперактивности,ожирения, боли и болезни Альцгеймера. По меньшей мере одно соединение по изобретению можно применять для лечения по меньшей мере одного расстройства, выбранного из нарушения познавательной способности при шизофрении, нарколепсии, ожирения, синдрома дефицита внимания и гиперактивности, боли и болезни Альцгеймера. По меньшей мере одно соединение по изобретению можно применять для лечения по меньшей мере одного расстройства, выбранного из нарушения познавательной способности при шизофрении и болезни Альцгеймера. В еще одном аспекте описан способ лечения по меньшей мере одного аутоиммунного расстройства,психиатрического расстройства, ассоциированного с ожирением расстройства, расстройства приема пищи, расстройства, ассоциированного с навязчивым желанием, нейродегенеративного расстройства, нейровоспалительного расстройства, расстройства поведения с дефицитом внимания и распадом личности и/или болевого расстройства у теплокровного животного, включающий введение указанному животному,нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения по меньшей мере одного расстройства, выбранного из нарушения познавательной способности при шизофрении, нарколепсии, ожирения, синдрома дефицита внимания и гиперактивности, боли и болезни Альцгеймера у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения нарушения познавательной способности при шизофрении у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения ожирения у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения нарколепсии у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения болезни Альцгеймера у теплокровного животного,включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения синдрома дефицита внимания и гиперактивности у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В еще одном аспекте описан способ лечения боли у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, терапевтически эффективного количества по меньшей мере одного соединения по изобретению. В одном из воплощений теплокровное животное представляет собой вид млекопитающих, включая,например, людей и домашних животных, таких как, например, собаки, кошки и лошади, но не ограничиваясь ими. В еще одном воплощении теплокровным животным является человек. В еще одном аспекте раскрыто применение по меньшей мере одного соединения по изобретению в терапии. В еще одном воплощении раскрыто применение по меньшей мере одного соединения по изобретению в изготовлении лекарственного средства для применения в терапии. Использованный здесь термин "терапия" также включает "профилактику", если не указано иначе. В еще одном воплощении соединения по изобретению или фармацевтическая композиция или препарат, содержащие по меньшей мере одно соединение по изобретению, могут быть введены одновременно, совместно, последовательно или по отдельности по меньшей мере с одним другим фармацевтически активным соединением, выбранным из следующих:(5) терапевтические средства против болезни Альцгеймера, такие как, например, донепезил, галантамин, мемантин, ривастигмин, такрин и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(6) терапевтические средства против болезни Паркинсона и агенты для лечения экстрапирамидальных симптомов, такие как, например, леводопа, карбидопа, амантадин, прамипексол, ропинирол, перголид, каберголин, апоморфин, бромкриптин, ингибиторы МАОВ (моноамин-оксидаза В) (т.е. селегин и разагилин), ингибиторы СОМТ (катехол-О-метилтрансфераза) (т.е. энтакапон и толкапон), альфа-2 ингибиторы, антихолинергические средства (т.е. бензтропин, бипериден, орфенадрин, проциклидин и тригексилфенидил), ингибиторы обратного захвата дофамина, NMDA-антагонисты (антагонистыN-метил-D-аспартатного рецептора), никотиновые агонисты, агонисты дофамина и ингибиторы нейрональной синтазы оксида азота и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метабо-9 020093(7) терапевтические средства против мигрени, такие как, например, алмотриптан, амантадин, бромокриптин, буталбитал, каберголин, дихлоралфеназон, элетриптан, фроватриптан, лизурид, наратриптан,перголид, прамипексол, ризатриптан, ропинирол, суматриптан, золмитриптан, зомитриптан и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(8) терапевтические средства против инсульта, такие как, например, абциксимаб, активаза (activase),NXY-059, цитиколин, кробенетин, дезмотеплаза (desmoteplase), репинотан, траксопродил и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(9) терапевтические средства против недержания мочи при сверхактивном мочевом пузыре, такие как, например, дарафенацин (darafenacin), дицикломин, флавоксат, имипрамин, дезипрамин, оксибутинин, пропиверин, пропантедин, робалзотан, солифенацин, альфазозин, доксазозин, теразозин, толтеродин и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(10) терапевтические средства против невропатической боли, такие как, например, габапентин, лидодерм, прегабалин и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(11) терапевтические средства против ноцицептивной боли, такие как, например, целекоксиб, кодеин, диклофенак, эторикоксиб, фентанил, гидрокодон, гидроморфон, лево-альфа-ацетилметадол, локсопрофен, люмиракоксиб, меперидин, метадон, морфин, напроксен, оксикодон, парацетамол, пропоксифен,рофекоксиб, суфентанил, валдекоксиб и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(12) терапевтические средства против бессонницы и седативные снотворные средства, такие как,например, агомелатин, аллобарбитал, алонимид (alonimid), амобарбитал, бензоктамин, бутабарбитал,капурид, клорал гидрат, клоназепам, хлоразепат, клоперидон, клоретат, декскламол, эстазолам, эсзопиклон, этхлорвинол, этомидат, флуразепам, глутетимид, галазепам, гидроксизин, меклоквалон, мелатонин,мефобарбитал, метаквалон, мидафлур, мидазолам, низобамат, пагоклон, пентобарбитал, перлапин, фенобарбитал, пропофол, квазепам, рамелтеон, ролетамид, супроклон, темазепам, триазолам, триклофос, секобарбитал, залеилон, золпидем, зопиклон и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы);(14) терапевтические средства против ожирения, такие как, например, лекарственные средства против ожирения, которые воздействуют на потребление энергии, гликолиз, глюконеогенез, глюкогенолиз,липолиз, липогенез, всасывание жира, накопление жира, выведение жира, механизмы голода и/или насыщения и/или навязчивых состояний, аппетит/мотивацию, всасывание пищи и ЖК (желудочнокишечную) перистальтику; очень низкокалорийные диеты (VLCD) и низкокалорийные диеты (LCD);(15) терапевтические агенты, полезные при лечении ассоциированных с ожирением расстройств,таких как, например, лекарственные средства на основе бигуанидов, инсулин (синтетические аналоги инсулина) и пероральные антигипергликемические средства (которые подразделяются на прандиальные регуляторы глюкозы и ингибиторы альфа-глюкозидазы), модулирующие PPAR (рецептор, активируемый пролифератором пероксисом) агенты, такие как, например, агонисты PPAR-альфа и/или -гамма; сульфонилмочевины; агенты, понижающие уровень холестерина, такие как, например, ингибиторы HMG-CoAредуктазы (3-гидрокси-3-метилглутарил-коэнзим-А-редуктаза); ингибитор транспорта желчных кислот подвздошной кишки (ингибитор IBAT); полимер, связывающий желчные кислоты; агент, усиливающий экскрецию желчных кислот, такой как, например, колестипол, холестирамин или холестагель(cholestagel); ингибитор СЕТР (белка-переносчика эфиров холестерина); антагонист всасывания холестерина; ингибитор МТР (микросомного белка-переносчика); производное никотиновой кислоты, в том числе продукты с медленным высвобождением и комбинированные продукты; соединение фитостерола; пробукол; антикоагулянт; омега-3-жирная кислота; терапевтические средства против ожирения, такие как, например, сибутрамин, фентермин, орлистат, бупропион, эфедрин и тироксин; антигипертензивное средство, такое как, например, ингибитор ангиотензин-превращающего фермента (АСЕ), антагонист рецептора ангиотензина II, адренергический блокатор, альфа-адренергический блокатор, бетаадренергический блокатор, смешанный альфа/бета-адренергический блокатор, адренергический стимулятор, блокатор кальциевых каналов, AT-1-блокатор, салуретик, диуретик и вазодилататор; модулятор меланин-концентрирующего гормона (МСН); модулятор рецептора NPY (нейропептида Y); модулятор орексинового рецептора; модулятор фосфоинозитид-зависимой протеинкиназы (PDK); модуляторы ядерных рецепторов, таких как, например, LXR (печеночный Х-рецептор), FXR (фарнезоидный Х-рецептор), RXR (ретиноидный X-рецептор), GR (глюкокортикоидный рецептор), ERR (эстрогенсвязанный рецептор)-, -, PPAR-, -, -и ROR-альфа (сиротский рецептор ретиноидов альфа); агент, модулирующий моноаминную передачу (сигнала), такой как, например, селективный ингибитор обратного захвата серотонина (SSRI), ингибитор обратного захвата норадреналина (NARI), ингибитор обратного захвата серотонина и норадреналина (SNRI), ингибитор моноамин-оксидазы (MAOI), трициклический антидепрессивный агент (ТСА), норадренергический и специфический серотонергический антидепрес- 10020093 сант (NaSSA); модулятор серотонинового рецептора; модулятор лептина/лептинового рецептора; модулятор грелина/грелинового рецептора; ингибитор DPP-IV (дипептидилпептидазы-IV) и их эквиваленты и фармацевтически активный(ые) изомер(ы), метаболит(ы) и их фармацевтически приемлемые соли, сольваты и пролекарства.(16) агенты для лечения ADHD, такие как, например, амфетамин, метамфетамин, декстроамфетамин, атомоксетин, метилфенидат, дексметилфенидат, модафинил и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы); и(17) агенты, используемые для лечения расстройств при злоупотреблении алкоголем и психоактивными веществами, для лечения зависимости и абстинентного синдрома, такие как, например, никотиновые заместительные терапии (т.е. жевательная резинка, пластыри и назальные спреи); агонисты, частичные агонисты и антагонисты никотинергических рецепторов (например, варениклин); акомпросат, бупропион, клонидин, дисульфирам, метадон, налоксон, налтрексон и их эквиваленты и фармацевтически активный(ые) изомер(ы) и метаболит(ы). Указанное выше другое фармацевтически активное соединение, когда его применяют в комбинации по меньшей мере с одним соединением по изобретению, может быть использовано, например, в количествах, указанных в настольном справочнике врача (PDR) или иным образом определенных специалистом обычной квалификации в данной области техники. Соединения по изобретению могут быть введены посредством любого способа, подходящего для состояния, которое лечат, и этот способ может зависеть от того количества соединения по изобретению,которое должно быть введено. Соединения по изобретению могут быть введены в форме традиционной фармацевтической композиции посредством любого пути, включая, например, пероральный, внутримышечный, подкожный, местный, интраназальный, эпидуральный, внутрибрюшинный, интраторакальный, внутривенный, интратекальный, интрацеребровентрикулярный путь и посредством инъекции в суставы, но не ограничиваясь ими. В одном из воплощений путь введения представляет собой пероральный, внутривенный или внутримышечный путь."Эффективное количество" соединений по изобретению может быть определено специалистом обычной квалификации в данной области техники и включает типичные дозировки для млекопитающего от примерно 0,05 до примерно 300 мг/кг/сутки, предпочтительно менее чем примерно 200 мг/кг/сутки, в разовой дозе или в форме отдельных дробных доз. Типичные дозировки для взрослого человека составляют приблизительно 1-100 мг (например, 15) активного соединения на 1 кг массы тела в сутки, которые могут быть введены в разовой дозе или в форме отдельных дробных доз, например, от 1 до 4 раз в сутки. Тем не менее, конкретный уровень дозы и частота введения для любого конкретного субъекта могут варьировать и в общем случае зависят от ряда факторов, включающих, например, биодоступность конкретных соединений по изобретению в предназначенной для введения форме; метаболическая стабильность и продолжительность действия конкретных соединений по изобретению; вид, возраст, массу тела, общее состояние здоровья, пол и диету субъекта; способ и продолжительность введения; скорость экскреции, лекарственную комбинацию и тяжесть конкретного состояния, но не ограничиваясь ими. В одном из аспектов предложена фармацевтическая композиция, содержащая по меньшей мере одно соединение по изобретению и по меньшей мере один фармацевтически приемлемый носитель и/или разбавитель. В еще одном воплощении описан способ лечения по меньшей мере одного расстройства, выбранного из когнитивного нарушения при шизофрении, нарколепсии, ожирения, синдрома дефицита внимания и гиперактивности и болезни Альцгеймера, у теплокровного животного, включающий введение указанному животному, нуждающемуся в таком лечении, фармацевтической композиции, содержащей терапевтически эффективное количество по меньшей мере одного соединения по изобретению и по меньшей мере один фармацевтически приемлемый носитель и/или разбавитель. Приемлемые твердые фармацевтические композиции включают, например, порошки, таблетки,диспергируемые гранулы, капсулы, облатки и суппозитории, но не ограничиваются ими. В твердой фармацевтической композиции фармацевтически приемлемые носители включают, например, по меньшей мере одно твердое вещество, по меньшей мере одно жидкое вещество и их смеси, но не ограничиваются ими. Твердый носитель также может быть разбавителем, корригентом, солюбилизатором, смазывающим веществом, суспендирующим агентом, связывающим, инкапсулирующим веществом и/или разрыхляющим таблетки агентом. Подходящие носители включают, например, карбонат магния; стеарат магния; тальк; лактозу; сахар; пектин; декстрин; крахмал; трагакант; метилцеллюлозу; натриевую соль карбоксиметилцеллюлозы; низкоплавкий воск; масло какао и их смеси, но не ограничиваются ими. Порошок может быть изготовлен, например, путем смешивания тонкоизмельченного твердого вещества по меньшей мере с одним тонкоизмельченным соединением по изобретению. Таблетка может быть изготовлена, например, путем смешивания по меньшей мере одного соединения по изобретению в подходящих пропорциях с фармацевтически приемлемым носителем, обладающим необходимыми связывающими свойствами, и компактизации до желаемой формы и размера. Суппозиторий может быть изготовлен, например, путем смешивания по меньшей мере одного соединения по изобретению по меньшей мере с одним подходящим нераздражающим эксципиентом, который является жидким при ректальной температуре, но твердым при температуре ниже ректальной температуры, при этом нераздражающий эксципиент сначала расплавляют и в нем диспергируют соединения по изобретению. Расплавленную гомогенную смесь затем выливают в формы удобного размера и оставляют охладиться и отвердеть. Типичные нераздражающие эксципиенты включают, например, масло какао; глицеринизированный желатин; гидрированные растительные масла; смеси полиэтиленгликолей различных молекулярных масс и сложные эфиры жирных кислот и полиэтиленгликоля, но не ограничиваются ими. Приемлемые жидкие фармацевтические композиции включают, например, растворы, суспензии и эмульсии, но не ограничиваются ими. Например, стерильная вода или водно-пропиленгликолевые растворы по меньшей мере одного соединения по изобретению представляют собой жидкие фармацевтические композиции, подходящие для парентерального введения. Жидкие композиции также могут быть изготовлены в виде раствора в водно-полиэтиленгликолевом растворе. Водные растворы для перорального введения могут быть приготовлены путем растворения по меньшей мере одного соединения по изобретению в воде и добавления подходящих красителей, корригентов, стабилизаторов и/или загустителей, как будет желательно. Водные суспензии для перорального введения могут быть приготовлены путем диспергирования по меньшей мере одного тонкоизмельченного соединения по изобретению в воде вместе с вязким веществом, таким как, например, природная синтетическая камедь, смола, метилцеллюлоза и натриевая соль карбоксиметилцеллюлозы. В одном из воплощений фармацевтическая композиция содержит от приблизительно 0,05 до приблизительно 99 мас.% (процент по массе) по меньшей мере одного соединения по изобретению. Все проценты берутся из расчета на массу всей композиции. В еще одном воплощении фармацевтическая композиция содержит от приблизительно 0,10 до приблизительно 50 мас.% (процент по массе) по меньшей мере одного соединения по изобретению. Все проценты берутся из расчета на массу всей композиции. В соответствии с еще одним воплощением предложена фармацевтическая композиция, содержащая по меньшей мере одно соединение по изобретению и фармацевтически приемлемый носитель/разбавитель, для терапии. Кроме того, описано применение фармацевтической композиции, содержащей по меньшей мере одно соединение по изобретению вместе с фармацевтически приемлемым носителем, для любого из состояний, обсуждающихся выше. В следующем аспекте настоящего изобретения раскрыт способ получения описанных здесь соединений. Биологическая оценка. Соединения по изобретению, приведенные в данном описании в примерах, при тестировании по меньшей мере в одном из описанных ниже анализов in vitro являются активными в отношенииH3-рецепторов. Данная активность in in vitro может быть связана с активностью in vivo, но может не коррелировать линейно с аффинностью связывания. Соединения протестированы в анализе in in vitro на предмет их активности в отношении H3-рецепторов и получены значения IC50 для определения активности описанных здесь соединений в отношении H3-рецептора. Анализ связывания с гуанозин 5'-О-(3-[35S]тио)трифосфатом [GTPS]. Анализ связывания с GTPS может быть использован для исследования свойств соединений в качестве антагонистов в СНО-клетках (клетках яичников китайского хомячка), трансфицированных человеческим гистаминовым H3-рецептором (hH3R). Мембраны из СНО-клеток, экспрессирующих hH3R(10 мкг/лунку), разбавляют в буфере для анализа с использованием GTPS (20 мМ Hepes(125 мкг/лунку) (Amersham) в течение 30 мин. Для определения антагонистической активности добавляют (R)метилгистамин (30 нМ) в 96-луночный SPA-планщет, содержащий [35S]GTPS (0,2 нМ) и антагонисты H3R в различных концентрациях. Анализ связывания с GTPS начинают с добавления смеси мембраны/сапонин/GDP и инкубируют в течение 90 мин при комнатной температуре. Количество связанного [35S]GTPS определяют, используя счетчик MicroBeta Trilux (PerkinElmer). Процент связанного[35S]GTPS в каждом образце рассчитывают как процент связанного [35S]GTPS в контрольном образце,инкубированном в отсутствие H3-антагониста. Определение для каждой концентрации проводят в двух повторах и данные анализируют, используя ExcelFit4 для получения IC50 (средней ингибирующей концентрации). Значения IC50. В табл. 1 для соединений по изобретению приведены величины IC50, которые получали в соответствии с анализом связывания GTPS, по существу, описанным выше. Таблица 1 Примеры Кроме того, данное изобретение определено следующими далее примерами. Следует понимать, что примеры приведены только для иллюстрации. На основании приведенного выше обсуждения и примеров специалист в данной области техники может установить существенные признаки изобретения и, без отклонения от его сущности и объема, может осуществить различные изменения и модификации, чтобы адаптировать изобретение к различным применениям и условиям. Таким образом, изобретение не ограничено приведенными ниже иллюстративными примерами, а скорее определено прилагаемой формулой изобретения. Все температуры приведены в градусах по Цельсию (С) и не являются скорректированными. Если не указано иное, то имеющиеся в продаже реагенты, использованные в получении соединений из примеров, применяли после получения без дополнительной очистки. Если не указано иное, то растворители, использованные в получении соединений из примеров,представляли собой имеющиеся в продаже растворители марки "безводный", и их использовали без дополнительной сушки или очистки. Все исходные вещества, если не указано иное, имеются в продаже. Наименования продуктов определяли с использованием программного обеспечения для присвоения названий, включенного в CambridgeSoft E-Notebook version 9.2 (Chemoffice 9.0.7). В данном описании использованы следующие сокращения: водн.: водный;Celite: торговое обозначение фильтрующего агента на основе диатомовых земель, зарегистрированное торговое обозначение Celite Corporation;dddd: дублет дублета дублета дублетов;HPLC: жидкостная хроматография высокого давления;MgSO4: безводный сульфат магния (осушитель); МГц: мегагерц; ммоль: миллимоль; моль: моль;MPLC: жидкостная хроматография среднего давления;THF: тетрагидрофуран. Колоночную хроматографию проводили с использованием стеклянной колонки с силикагелем 32-63 мкм, 60 и давлении воздуха. MPLC осуществляли на приборе ISCO Companion с использованием предварительно упакованной одноразовой неподвижной фазы RediSep SiO2 при 5-100 мл/мин, УФдетекция (диапазон 190-760 нм). Масс-спектры регистрировали с использованием способов ионизации путем распыления электроновWaters Micromass ZQ, при 120C. Масс-спектрометр оборудован источником распыления электронов(ESI), функционирующим в режиме положительных или отрицательных ионов. Масс-спектрометр сканировал при m/z 100-1000 с временем сканирования 0,3 с. Спектры 1 Н ЯМР регистрировали на спектрометре Varian NMR при 400 МГц или Varian Mercury 300 МГц. Спектры 1 Н ЯМР интерпретировали с использованием программного обеспеченияACD/SpecManager version 10.02. Альтернативно, их регистрировали на спектрометре Bruker UltraShieldAdvance 400 МГц/54 мм и обрабатывали при помощи программного обеспечения XWIN-NMR version 2.6. Химические сдвигипредставлены в миллионных долях относительно тетраметилсиланового внутреннего стандарта. Пример 7. Диастереоизомерная смесь 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1 карбонил)циклопропил)бензамида. Промежуточное соединение 20 растворяли в DCE (13,0 мл). Добавляли TEA (0,958 мл, 6,87 ммоль),а затем циклобутанон (193 мг, 2,75 ммоль) и триацетоксиборгидрид натрия (437 мг, 2,06 ммоль). Реакционную смесь перемешивали в течение ночи и промывали насыщ. NaHCO3. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали на препаративной HPLC MS с использованием способа с коротким плавным градиентом с высоким pH(подвижная фаза: 20-40% В; А: H2O с 10 мМ NH4CO3 и 0,375% NH4OH об./об., В: CH3CN, анализ в течение 10 мин) на XBridge Prep C18 OBD, 3050 мм, 5 мкм, обращенно-фазовой колонке Waters, с получением 159 мг указанного в заголовке соединения (33,9%) в виде твердого вещества (диастереоизомерная смесь). 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,27 (d, J=7,03 Гц, 2 Н), 1,39 (br. s., 2H), 1,59 (ddd, J=9,18, 5,27,4,30 Гц, 1H), 1,65-1,78 (m, 3H), 1,78-1,98 (m, 3H), 1,98-2,10 (m, 2 Н), 2,20-2,34 (m, 1 Н), 2,42 (br. s., 1H),2,62-2,77 (m, 2 Н), 2,78-2,90 (m, 1 Н), 2,90-3,05 (m, 1 Н), 3,94-4,10 (m, 1 Н), 4,23-4,35 (m, 1 Н), 7,25 (d,J=8,59 Гц, 2 Н), 7,80 (d, J=8,20 Гц, 2 Н); Указание:обозначен единичный изомер с неизвестной абсолютной стереохимией. Пример 7 (138 мг, 0,40 ммоль) (диастереоизомерная смесь) разделяли на приборе для сверхкритической жидкостной хроматографии MettlerToledo Minigram с использованием следующих условий:DMEA, сверхкритическое CO2, регулятор установлен на 100 бар (1107 Па), температура колонки установлена на 35C, УФ 215 нм, с получением 57,8 мг изомера 1 (41,9%) и 56,5 мг изомера 2 (41%) в виде твердых веществ. Продукт анализировали на хиральной SFC (УФ-детекция) с использованием изократического метода (подвижная фаза: 55% EtOH с 0,1% DMEA, сверхкритическое СО 2) на ChiralPak AD-H,10250 мм, размер частиц 5 мкм, с получением энантиомерной чистоты 99%, Rt=1,92 мин (изомер 1) и 3,46 мин (изомер 2). Изомер 1: 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,26 (br. s., 1H), 1,38 (br. s., 3H), 1,59 (ddd,J=9,57, 4,69, 4,49 Гц, 1H), 1,65-1,77 (m, 3H), 1,77-1,98 (m, 3H), 1,98-2,09 (m, 2H), 2,22-2,31 (m, 1H), 2,43 Указание:обозначен единичный изомер с неизвестной абсолютной стереохимией. Этот изомер выделяли в соответствии с хиральным разделением, описанным в примере 8, и обрабатывали, как здесь описано. Продукт анализировали на хиральной SFC (УФ-детекция) с использованием изократического метода (подвижная фаза: 55% EtOH с 0,1% DMEA, сверхкритическое CO2) на ChiralPakAD-H, 10250 мм, размер частиц 5 мкм, с получением энантиомерной чистоты 99%, Rt=1,92 мин (изомер 1) и 3,46 мин (изомер 2). Изомер 2: 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,27 (d, J=7,03 Гц, 3H), 1,33-1,42 (m, 1H), 1,53-1,65 Промежуточное соединение 37 (389 г, 1,90 моль) смешивали в 2-MeTHF (6,7 л) при t рубашки=25 оС. Одной порцией добавляли 1,1'-карбонилдиимидазол (412 г, 2,09 моль, 82,1% мас./мас.). Реакционную суспензию нагревали до t рубашки=55 оС. Выделение газа уменьшалось после приблизительно 1 ч. Реакционную суспензию нагревали до t рубашки=85 С в течение 3 ч и затем охлаждали до t рубашки=50C. Промежуточное соединение 32 (490 г, 2,08 моль, 96,3% мас./мас.) и TEA (290 мл, 2,09 моль) добавляли к реакционной суспензии. 2-MeTHF (2 л) использовали для промывания. Реакционную суспензию нагревали при t рубашки=70 С в течение 4 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту. Реакционную суспензию охлаждали до t рубашки=20 С. Добавляли 1 M Na2CO3 в рассоле(2 л) и температуру доводили до t рубашки=40 оС. Водную фазу отделяли и органическую фазу промывали рассолом (2 л). Органическую фазу экстрагировали 5% Н 3 РО 4 в Н 2 О (41,5 л) при t рубашки=20 С. Объединенные водн. фазы промывали DCM (1 л). Происходило очень медленное разделение фаз. Объединенные водн. фазы подщелачивали до pH11 при помощи 5 М NaOH и экстрагировали DCM (21,2 л). Объединенные органические фазы концентрировали в вакууме досуха. Оставшееся масло растворяли в ацетонитриле (1,2 л) при t рубашки=50 С. Добавляли затравку и раствор перемешивали в течение 30 мин при t рубашки=40C. Смесь охлаждали до t рубашки=5 С в течение 6 ч и продукт отфильтровывали. Сушка в вакууме при 40 С позволила получить 372 г примера 35 (1,04 моль, 100% мас./мас.) в виде первого выхода. Маточный раствор перекристаллизовывали из ацетонитрила и было возможно выделение второго выхода примера 35 (77 г, 0,21 моль, 98,7% мас./мас.). Пример 35 выделяли с общим выходом 66%. Пример 35 соответствует примеру 8 (изомер 1). 1 Н ЯМР (DMSO-d6):млн-1 7,91 (br. s., 1 Н), 7,78 (d, J=8,4 Гц, 2H), 7,30 (br. s., 1H), 7,25 (d, J=8,0 Гц,2H), 4,54 и 4,36 (br. s., 1H), 4,17 и 4,01 (d, J=12,2 Гц, 1 Н), 3,20 и 2,80 (t, J=11,9 Гц, 1H), 2,74 (d, J=11,4 Гц,1H), 2,67-2,55 (m, 2H), 2,33 (br. s., 2H), 1,99-1,88 (m, 2H), 1,88-1,53 (m, 6H), 1,48-1,37 (m, 1H), 1,27 (br. s.,3H), 1,12 (br. s., 1H);(30 мл). К нему добавляли гидридо(диметилфосфинистой кислоты-kP)[водород бис-(диметилфосфиноkP]платину(II) (0,050 г, 0,12 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 20 ч. Реакционную смесь нагревали в течение еще 24 ч, концентрировали досуха и распределяли между EtOAc и H2O. Водную фазу экстрагировали трижды EtOAc, объединенные органические слои промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали путем флэш-хроматографии на силикагеле, элюируя градиентом CH2Cl2 и МеОН,2-10% с плато при 4% до элюирования видимой темной полосы, а затем путем второй очистки с градиентом ацетон/гептан 30-100% с получением 3,65 г примера 35 (выход 56,8%) в виде твердого вещества. 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,24 (br. s., 1H), 1,36 (br. s., 3H), 1,52-1,60 (m, 1H), 1,63-1,74 (m,3H), 1,74-1,84 (m, 1H), 1,84-1,95 (m, 2H), 1,95-2,05 (m, 2 H), 2,24 (br. s., 1H), 2,40 (br. s., 1H), 2,60-2,72 (m,2H), 2,82 (d, J=12,50 Гц, 1 Н), 2,94 и 3,36 (t, J=12,11 Гц, 1H), 4,01 и 4,28 (d, J=13,28 Гц, 1H), 4,35 и 4,62 (br.s., 1H), 7,22 (d, J=8,20 Гц, 2 Н), 7,77 (d, J=8,59 Гц, 2 Н). Продукт анализировали на аналитической HPLC MS с использованием градиентного метода ZorbaxMS m/z 342,3 [М+Н]+ (ESI), Rt=0,584 мин. Продукт анализировали на хиральной SFC (УФ-детекция) с использованием изократического метода (подвижная фаза: 55% EtOH с 0,1% DMEA, сверхкритическое СО 2) на ChiralPak AD-H, 10250 мм,размер частиц 5 мкм, с получением энантиомерной чистоты 99%, Rt=1,98 мин. Пример 35 соответствует примеру 8 (изомер 1). В первом способе получения кристаллической формы I 20 мг аморфной формы 4-(1S,2S)-2-[R)-4 циклобутил-2-метилпиперазин-1-ил)карбонил]циклопропилбензамида добавляли в сосуд. В сосуд добавляли 100 мкл EtOAc с получением суспензии. Получающуюся в результате суспензию перемешивали при температуре окружающей среды в течение 3 суток. Твердое вещество затем выделяли и сушили на воздухе. Во втором способе получения кристаллической формы I 20 мг аморфной формы 4-(1S,2S)-2-[R)4-циклобутил-2-метилпиперазин-1-ил)карбонил]циклопропилбензамида добавляли в сосуд. В сосуд добавляли 100 мкл ацетонитрила с получением суспензии. Получающуюся в результате суспензию перемешивали при температуре окружающей среды в течение 3 суток. Твердое вещество затем выделяли и сушили на воздухе. Твердое вещество, полученное по меньшей мере при помощи одного из способов, изложенных выше, анализировали при помощи XRPD. Выбранные пики приведены в табл. 1. Типичная картина XRPD представлена на фигуре. Картина XRPD подтвердила, что твердое вещество представляет собой кристаллическую форму I. Таблица 2 Выбранные пики XRPD кристаллической формы I Промежуточные соединения Промежуточное соединение 3.(5,47 г, 25,1 ммоль) в DCM (50 мл) по каплям добавляли при 0 С. Реакционную смесь перемешивали при к.т. в течение 1 ч. Раствор фильтровали и концентрировали при пониженном давлении. Воду (100 мл) добавляли к остатку, который вновь фильтровали. Фильтрат насыщали K2CO3 и экстрагировали Et2O(3150 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 5,04 г указанного в заголовке соединения (50%) в виде твердого вещества. 1 Н ЯМР (300 МГц, CDCl3):млн-1 1,03 (d, J=6,3 Гц, 3H), 1,45 (s, 9 Н), 1,56 (s, 1 Н), 2,30-2,46 (m, 1 Н),2,65-2,72 (m, 1 Н), 2,74-2,76 (m, 2 Н), 2,93-2,95 (m, 1 Н), 3,93 (br. s., 2H). Промежуточное соединение 9. В высушенную над пламенем трехгорлую круглодонную колбу, оборудованную магнитной мешалкой, термометром, капельной воронкой и входом для азота, загружали NaH (3,96 г, 94,7 ммоль) и безводный THF (120 мл). трет-Бутилдиэтилфосфоноацетат (23,2 мл, 94,7 ммоль), растворенный в безводномTHF (20 мл), по каплям добавляли при помощи воронки для добавления в течение периода 30 мин. После завершения добавления реакционную смесь перемешивали при к.т. в течение еще 30 мин. Раствор 4-цианобензальдегида (11,3 г, 86,1 ммоль), растворенного в безводном THF (20 мл), по каплям добавляли к реакционной смеси при помощи воронки для добавления в течение периода 30 мин. После завершения добавления реакционную смесь перемешивали при к.т. в течение 1 ч, затем разбавляли МТВЕ (200 мл) и насыщ. NH4Cl (150 мл). Органический слой разделяли, промывали 25 мл воды и 25 мл насыщ. NH4Cl,сушили над MgSO4, фильтровали и выпаривали досуха с получением 20,0 г указанного в заголовке соединения в виде твердого вещества (100%). 1 Н ЯМР (400 МГц, CDCl3):млн-1 1,56 (s, 9 Н), 6,47 (d, J=16 Гц, 1 Н), 7,58 (d, J=16 Гц, 1 Н), 7,61 (d,J=8 Гц, 2 Н), 7,68 (d, J=8 Гц, 2 Н). Промежуточное соединение 10. Транс-трет-бутил-2-(4-цианофенил)циклопропанкарбоксилат Триметилсульфоксоний йодид (37,9 г, 172,4 ммоль) растворяли в DMSO (450 мл) в атмосфере азота. Добавляли трет-бутоксид натрия (16,5 г, 172,4 ммоль) и образующуюся в результате смесь перемешивали при к.т. в течение 2 ч. Добавляли промежуточное соединение 9 (20 г, 86,2 ммоль) и реакционную смесь перемешивали при к.т. в течение 16 ч. Реакционную смесь разбавляли путем последовательного добавления МТВЕ (500 мл) и рассола (300 мл). Органический слой разделяли, сушили над MgSO4, фильтровали и выпаривали досуха. Неочищенный продукт очищали путем флэш-хроматографии (диоксид кремния, гептан/EtOAc от 95:5 до 90:10) с получением 11,6 г указанного в заголовке соединения (54%) в виде твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):млн-1 1,29-1,23 (m, 1 Н), 1,49 (s, 9 Н), 1,57-1,69 (m, 1 Н), 1,83-1,96 (m,1 Н), 2,40-2,53 (m, 1 Н), 7,18 (d, J=8 Гц, 2 Н), 7,57 (d, J=8 Гц, 2 Н). Промежуточное соединение 11. Транс-2-4-бромфенил)циклопропил)метанол Раствор диэтилцинка (1,1 М, 695 мл, 765 ммоль) в гексанах добавляли в высушенную над пламенем трехгорлую круглодонную колбу, содержащую 450 мл DCM в атмосфере азота. Получающийся в результате раствор охлаждали до 0-5 С. TFA (59 мл, 765 ммоль) добавляли медленно к охлажденному раствору диэтилцинка. После завершения добавления получающуюся в результате смесь перемешивали в течение 20 мин. Раствор CH2I2 (62 мл, 765 ммоль) в 50 мл DCM добавляли к смеси. После еще 20 мин перемешивания добавляли раствор 3-(4-бромфенил)проп-2-ен-1-ола (81,6 г, 382,9 ммоль) в 450 мл DCM. После завершения добавления реакционную смесь нагревали до к.т. и перемешивали в течение 2 ч. Избыток реагента гасили путем медленного добавления 500 мл 1 М HCl. Верхний водн. слой отделяли и экстрагировали 200 мл DCM. Объединенные органические экстракты промывали 500 мл смеси насыщ. NH4Cl иNH4OH (9:1 об./об.), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали при помощи колоночной флэш-хроматографии (диоксид кремния, гептан/EtOAc 10:1) с получением 76,1 г указанного в заголовке соединения в виде твердого вещества В круглодонную колбу загружали промежуточное соединение 11 (10,0 г, 44 ммоль), диметилацетамид (125 мл), тригидрат гексацианоферрата калия(II) (24,2 г, 22 ммоль), ацетат палладия(II) (1,3 г,2,2 ммоль), DABCO (1,3 г, 4,4 ммоль) и карбонат натрия (12,2 г, 44 ммоль). Получающуюся в результате смесь нагревали до 150 С в атмосфере азота в течение 17 ч. Реакционную смесь охлаждали до к.т. и фильтровали через слой геля диоксида кремния. Слой промывали EtOAc (200 мл). Объединенный фильтрат и промывку разбавляли дополнительным количеством EtOAc (200 мл), промывали рассолом(3100 мл), сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали путем колоночной хроматографии (диоксид кремния, DCM/MeOH 99:1) с получением 10,5 г указанного в заголовке соединения (55%). 1 Н ЯМР (400 МГц, CDCl3):млн-1 1,00-1,15 (m, 2H), 1,47-1,58 (m, 1 Н), 1,88-1,94 (m, 1 Н), 3,56-3,76 Промежуточное соединение 12 (11,2 г, 64,7 ммоль) растворяли в ацетоне (100 мл). Раствор охлаждали до -10 С. Добавляли реагент Джонса (65 мл) в течение периода 30 мин. После завершения добавления реакционную смесь нагревали до к.т. и затем гасили путем добавления 2-пропанола (100 мл). Получающуюся в результате смесь разбавляли EtOAc (200 мл). Добавляли MgSO4 и перемешивание продолжали в течение еще 30 мин. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток повторно растворяли в EtOAc (200 мл), промывали 275 мл воды, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали путем растирания с EtOAc (20 мл) с получением 5,2 г указанного в заголовке соединения (43%) в виде твердого вещества. 1 Н ЯМР (400 МГц, DMSO-d6):млн-1 1,39-1,46 (m, 1 Н), 1,47-1,55 (m, 1 Н), 1,90-1,98 (m, 1 Н), 2,452,55 (m, 1 Н), 7,38 (d, J=8,2 Гц, 2 Н), 7,73 (d, J=8,2 Гц, 2 Н). Приготовление реагента Джонса: реагент Джонса готовили путем растворения 26,7 г CrO3 в 23 мл концентрированной H2SO4 и разведения смеси до 100 мл водой. Промежуточное соединение 13 (второй способ). Транс-2-(4-цианофенил)циклопропанкарбоновая кислотаNaOH (5,7 г, 143,1 ммоль) в воде (30 мл) и образующуюся в результате смесь нагревали при 70 С в течение 4 ч. После охлаждения до к.т. смесь концентрировали до одной трети от ее объема и разбавляли пу- 19020093 тем добавления 50 мл 0,5 М NaOH. Образующуюся в результате смесь промывали 225 мл МТВЕ. Водн. слой отделяли и подкисляли путем добавления концентрированной HCl до pH 1. Подкисленную водн. фазу экстрагировали 250 мл EtOAc. Объединенные органические экстракты сушили над MgSO4, фильтровали и выпаривали досуха. Неочищенное вещество очищали путем флэш-хроматографии (диоксид кремния, DCM:MeOH от 99:1 до 90:10) с получением 3,1 г указанного в заголовке соединения (36,4%) в виде твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):млн-1 1,37-1,46 (m, 1H), 1,47-1,55 (m, 1H), 1,87-1,98 (m, 1 Н), 2,43-2,49 Промежуточное соединение 13 (3,4 г, 18,16 ммоль) растворяли в tBuOH (90 мл). Добавляли измельченный KOH (5,10 г, 90,81 ммоль), реакционную смесь нагревали до 70 С в течение ночи, охлаждали до к.т. и концентрировали при пониженном давлении. Остаток перерастворяли в воде и промывали EtOAc. Водную фазу подкисляли до pH 4-5 при помощи 1 М HCl. Осадок фильтровали и сушили в вакууме с получением 3,06 г указанного в заголовке соединения (82%) в виде твердого вещества. Продукт использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,42 (ddd, J=8,50, 6,35, 4,69 Гц, 1H), 1,55-1,62 (m, 1H), 1,91 (ddd,J=8,50, 5,37, 4,10 Гц, 1H), 2,52 (ddd, J=9,18, 6,25, 4,10 Гц, 1H), 7,20-7,26 (m, 2H), 7,76-7,83 (m, 2H);(1,149 мл, 6,58 ммоль), а затем НОВТ (444 мг, 3,29 ммоль), EDC (631 мг, 3,29 ммоль) и промежуточное соединение 3 (527 мг, 2,63 ммоль). Реакционную смесь перемешивали при к.т. в течение 2 суток, концентрировали при пониженном давлении, перерастворяли в EtOAc, промывали 1 М HCl и насыщ. NaHCO3,сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.(5,00 мл) и реакционную смесь перемешивали при к.т. в течение 30 мин. Летучие вещества выпаривали при пониженном давлении с получением желтой смолы. Неочищенное вещество использовали на следующей стадии без очистки. 1 Н ЯМР (400 МГц, CD3OD):млн-1 1,33 (d, J=7,03 Гц, 3 Н), 1,37-1,52 (m, 3 Н), 1,65 (br. s., 1 Н), 2,262,39 (m, 1 Н), 2,51 (br. s., 1 Н), 3,11 (br. s., 1H), 3,21-3,45 (m, 4H), 7,27 (d, J=8,20 Гц, 2H), 7,81 (d, J=8,20 Гц,2 Н). Промежуточное соединение 32.Chemical Co., растворяли в EtOH (2,75 л) при t рубашки=20 С. Одной порцией добавляли уксусную кислоту(1,37 л), а затем добавляли циклобутанон (184 г, 2,57 моль). Загрузочный сосуд промывали EtOH(250 мл) и светло-желтый раствор оставляли перемешиваться при t рубашки=20 С в течение 1 ч.NaBH(OAc)3 (497 г, 2,48 моль, 95% мас./мас.) добавляли 20 порциями в течение 90 мин. EtOH (340 мл) использовали для промывания. Реакционную смесь оставляли перемешиваться в течение 2 ч. Образец анализировали на GC (газовом хроматографе) с использованием колонки HP-5MS (длина 25 м, ID 0,32 мм, Film 0,52 мкм) с градиентным методом (2 мин при 60 С, а затем 25 С/мин в течение 8 мин, затем 2 мин при 260 С). Температура ввода=200 С с использованием Не в качестве газа и температура детектора = 300 С. Добавляли дополнительное количество NaBH(OAc)3 (30 г, 0,14 моль) для завершения реакции в течение 1 ч. Реакционную смесь охлаждали до t рубашки=0 С, а затем гасили 5 М NaOH (5,5 л).EtOH отгоняли в вакууме при t рубашки=50 С. Фазу H2O экстрагировали толуолом (5,5 л) при t рубашки=20 С. Органическую фазу комбинировали со второй партией, начиная с (R)-Вос-2-метилпиперазина (300 г,1,47 моль, 98% мас./мас.). Объединенные органические фазы концентрировали в вакууме приt рубашки=50 С до приблизительно 2 л. Полученный толуольный раствор с промежуточным соединением можно хранить при 5 С в течение нескольких суток. Толуольный раствор разбавляли 2-пропанолом (2 л) при t рубашки=10 оС и HCl в 2-пропаноле (1,06 л, 6,36 моль, 6 М), разбавленную в 2-пропаноле (2 л), добавляли в течение 30 мин. Реакционный раствор нагревали до t рубашки=48C. HCl в 2-пропаноле (2,12 л,12,72 моль, 6 М), разбавленную в 2-пропаноле (2 л), добавляли в течение 2 ч при t рубашки=46C. Реакционный раствор поддерживали при t рубашки=48C в течение еще 3 ч, а затем охлаждали до t рубашки=0C в течение 1 ч. Добавляли затравочную смесь (0,4 л реакционного раствора с промежуточным соединением 32 (0,2 г, 0,89 ммоль. Реакционную смесь оставляли перемешиваться при t рубашки=0 С в течение ночи и продукт отфильтровывали. Сушка в вакууме при 40 С позволила получить промежуточное соединение 32 (620 г, 2,63 моль, 96,3% мас./мас.), выход 83%. 1t рубашки=20 С. Добавляли (R)-(+)-метил-CBS-оксазаборолидин (2,6 кг, 2,74 моль, 1 М) в виде толуольного раствора. Загрузочный сосуд промывали толуолом (0,5 л) и t рубашки устанавливали равной 45 С. 1-(4-Бромфенил)-2-хлорэтанон (7,84 кг, 33,6 моль), имеющийся в продаже от Jiangyan Keyan FineChemical Co. Ltd, растворяли в 2-MeTHF (75 л) в делительном сосуде, и, когда t внутр поднималась выше 40 С в первом сосуде, тогда добавляли раствор 2-MeTHF в течение 3 ч. Последний сосуд промывали 2-MeTHF (2 л) и добавляли к реакционной смеси, которую оставляли перемешиваться при t рубашки=45C в течение 1 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5% CH3CN в Н 2 О с 0,1% TFA,В: 95% CH3CN в Н 2 О с 0,085% TFA, анализ в течение 10 мин) на Chromolith Performance RP-18e,4,6100 мм. Реакционную смесь охлаждали до t рубашки=10C, а затем медленно гасили с использованием МеОН (36 л). Первый литр МеОН добавляли в течение 30 мин, а оставшийся - в течение дополнительных 30 мин. МеОН отгоняли в вакууме при t рубашки=50C. Органический раствор оставляли охлаждаться до t рубашки=20 С, промывали 1 М HCl в Н 2 О (7 л конц. HCl + 73 л Н 2 О) и концентрировали в вакууме при t рубашки=50C до приблизительно 40 л. Промежуточное соединение 33, полученное в растворе 2-MeTHF,можно хранить при 10 С в течение 20 ч или использовать непосредственно на следующей стадии синтеза. Промежуточное соединение 34.Aliquat 175 (метил трибутиламмоний хлорид) (1,12 кг, 4,75 моль) добавляли к промежуточному соединению 33 в виде раствора 2-MeTHF (33,6 моль, 40 л) при t рубашки=20C. NaOH (5,1 кг, 57,4 моль,45% мас./мас.), разбавленную в H2O (2 л), добавляли в течение 20 мин. Реакционную смесь оставляли перемешиваться при t рубашки=20C в течение 2 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5% CH3CN в Н 2 О с 0,1% TFA, В: 95% CH3CN в Н 2 О с 0,085% TFA, анализ в течение 10 мин) наChromolith Performance RP-18e, 4,6100 мм. Водную фазу отделяли и органическую фазу промывали H2O(225 л). Добавляли 2-MeTHF (25 л) и органическую фазу концентрировали в вакууме при t рубашки=50 С до приблизительно 30 л. Промежуточное соединение 34, полученное в растворе 2-MeTHF, можно хранить при 5 С в течение 140 ч или использовать непосредственно на следующей стадии синтеза. Промежуточное соединение 35 (первый способ).t рубашки=-20 С. Гексиллитий в гексане (21 л, 48,3 моль, 2,3 М) добавляли с такой скоростью, чтобы поддерживать t внутр ниже 0 С. Загрузочный сосуд промывали 2-MeTHF (3 л) и реакционный раствор оставляли перемешиваться при t рубашки=10C. Промежуточное соединение 34 в виде раствора в 2-MeTHF(33,6 моль, 30 л) добавляли в течение 20 мин. Загрузочный сосуд промывали 2-MeTHF (2 л) и реакционный раствор оставляли перемешиваться при t рубашки=65 С в течение по меньшей мере 16 ч с последними 3 ч при t рубашки=75 С. Анализ образца на HPLC с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5% CH3CN в Н 2 О с 0,1% TFA, В: 95% CH3CN в Н 2 О с 0,085% TFA, анализ в течение 10 мин) на Chromolith Performance RP-18e, 4,6100 мм указывал на полное превращение в промежуточное соединение этиловый эфир (1S,2S)-2-(4-бромфенил)циклопропанкарбоновой кислоты. Реакционный раствор охлаждали до t рубашки=20 С. NaOH (7,6 кг, 85,5 моль, 45% мас./мас.), разбавленную в Н 2 О (12 л), добавляли в течение 20 мин. Полученный реакционный раствор оставляли перемешиваться при t рубашки=60C в течение по меньшей мере 2 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5% CH3CN в Н 2 О с 0,1% TFA, В: 95% CH3CN в Н 2 О с 0,085% TFA, анализ в течение 10 мин) наChromolith Performance RP-18e, 4,6100 мм. Реакционный раствор охлаждали до t рубашки=20C, водную фазу отделяли и органическую фазу экстрагировали Н 2 О (37 л). Объединенные вода, фазы подкисляли доpH3,5 при помощи H3PO4 (9 л, 131 моль, 85% мас./мас.), разбавленной в Н 2 О (12,5 л). Только 17 л разбавленной Н 3 РО 4 (водн) использовали для достижения pH3,5. Кислотную водн. фазу экстрагировали 2-MeTHF (215 л). Объединенные органические фазы, включая промывку 2-MeTHF (2 л), концентрировали в вакууме при t рубашки=50C до приблизительно 11 л. Раствор 2-MeTHF разбавляли Et OH (14,5 л) при t рубашки=35C и Н 2 О (16 л) добавляли в течение 20 мин. Реакционный раствор охлаждали до t рубашки=28C. Добавляли затравку (16 г, 0,066 моль) и раствор перемешивали в течение 2 ч при t рубашки=28 С. Реакционную смесь охлаждали до t рубашки=0 С в течение 6 ч и оставляли перемешиваться в течение по меньшей мере 1 ч. Дополнительную Н 2 О (8 л) добавляли в течение 40 мин., и продукт отфильтровывали и промывали охлажденной Н 2 О (10 л). Сушка в вакууме при 40 С позволила получить 6,18 кг промежуточного соединения 35 (21,5 моль, 84% мас./мас.), выход 64% после четырех стадий из 7,84 кг 1-(4 бромфенил)-2-хлорэтанона (33,6 моль). Перекристаллизация промежуточного соединения 35: Две партии промежуточного соединения 35(6,18+7,04 кг) смешивали в EtOH (52 л) и нагревали при t рубашки=70 С. Добавляли Н 2 О (52 л). Реакционный раствор охлаждали до t рубашки=30C в течение 2,5 ч. Н 2 О (16 л) добавляли в течение 20 мин и кристаллизуемую смесь охлаждали до t рубашки=20 С в течение 3 ч. Продукт отфильтровывали и промывали смесью Н 2 О (8 л) и EtOH (2 л). Сушка в вакууме при 40 С позволила получить 10,0 кг промежуточного соединения 35 (41,5 моль, 88% мас./мас.), которое перерастворяли в толуоле (39 л) и изооктане (57 л) приt рубашки=60C. Получали прозрачный раствор. Реакционный раствор охлаждали до t рубашки=45C и оставляли перемешиваться в течение 1 ч, затем охлаждали до t рубашки=20C в течение 2 ч. Продукт отфильтровывали и промывали двумя порциями смесью толуола (4 л) и изооктана (36 л). Сушка в вакууме при 40 С позволила получить 7,4 кг промежуточного соединения 35 (29,8 моль, 97% мас./мас.), выход 44% после четырех стадий из 7,84+7,93 кг 1-(4-бромфенил)-2-хлорэтанона (67,5 моль). 1 Н-ЯМР (DMSO-d6):млн-1 12,36 (s, 1 Н), 7,44 (d, 2H, J=8 Гц), 7,13 (d, 2H, J=8 Гц), 2,39 (m, 1H), 1,81Rt=5,03 мин для аналитического метода (подвижная фаза: 5-90% В; А: Н 2 О с 0,1% муравьиной кислотой, В: CH3CN, время анализа 8,6 мин) на Xbridge C18, 3,050 мм, размер частиц 2,5 мкм. Промежуточное соединение 35 (второй способ). К перемешиваемому раствору (транс)-2-(4-бромфенил)циклопропанкарбоновой кислоты (6,52 г,27,04 ммоль), которая может быть получена в соответствии со способом, изложенным на стр. 82 вWO 2009/024823, в 400 мл EtOH добавляли раствор (R)-(+)-1-(1-нафтил)этиламина (4,63 г, 4,37 мл,27,04 ммоль) в 100 мл EtOH, а затем 25 мл H2O. Его перемешивали при к.т. в течение приблизительно 4 ч. Твердое вещество собирали путем фильтрования и промывали 40 мл охлажденного EtOH/Н 2 О (20/1) с получением 3,18 г соли в виде белого твердого вещества (выделение 58%), эквивалентного 1,86 г свободной кислоты. Его суспендировали в 2 н. NaOH и 5 раз экстрагировали EtOAc. Водную фазу помещали в ротационный испаритель для удаления оставшегося EtOAc. Получающийся в результате прозрачный раствор переносили в колбу Эрленмейера, охлаждаемую в ледяной бане, и по каплям при перемешивании добавляли конц. HCl до pH 4. Получающееся в результате твердое вещество собирали путем фильтрования с получением 1,63 г промежуточного соединения 35. Продукт анализировали путем хиральнойSFC (УФ-детекция) с использованием изократического метода (подвижная фаза: 25% МеОН с 0,1%DMEA, сверхкритическое СО 2) на ChiralPak AD-H, 10250 мм, размер частиц 5 мкм, с получением энантиомерной чистоты 95%, Rt=3,88 мин (изомер 1) и 4,79 мин (изомер 2). 1 Н ЯМР (400 МГц, CDCl3):млн-1 11,37 (ddd, J=8,20, 6,64, 4,69 Гц, 1 Н), 1,67 (ddd, J=9,28, 5,08, 4,79 Гц, 1 Н), 1,87 (ddd, J=8,50, 4,69, 4,39 Гц, 1 Н), 2,48-2,63 (m, 1H), 6.87-7,06 (m, 2 Н), 7,37-7,46 (m, 2 Н). Промежуточное соединение 36.t рубашки=20 С. Смесь поддерживали под давлением N2 0,1-0,2 бар (1-2104 Па). К суспензии добавляли бис-(три-трет-бутилфосфин)палладий(0) (27,5 г, 0,054 моль) и сосуд поддерживали под давлением N2 0,1-0,2 бар (1-2104 Па). Смесь нагревали до t рубашки=45 С, к суспензии одной порцией добавлялиZn(CN)2 (1,0 кг, 8,52 моль) и систему поддерживали под давлением N2 0,1-0,2 бар (1-2104 Па) (Внимание: цианиды высокотоксичны). Получающуюся в результате смесь нагревали до t рубашки=75 С и перемешивали в течение по меньшей мере 2 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5%CH3CN в Н 2 О с 0,05% муравьиной кислотой, В: 95% CH3CN в Н 2 О с 0,05% муравьиной кислотой, время анализа 8 мин) на Chromolith Performance RP-18e, 4,6100 мм. Реакционную смесь охлаждали до t рубашки=20 С. Добавляли диоксид кремния с тиольной функционализацией (Silicycle, SiliaBond Thiol) (1,07 кг,28% мас./мас.) и в сосуде поддерживали атмосферу инертного газа. Реакционную смесь перемешивали в течение по меньшей мере 36 ч при t рубашки=20 С. Акцептор отфильтровывали через фильтр с активированным углеродом или эквивалентом (pall-filter). Сосуд и систему фильтров промывали 2-MeTHF (53 л). Фильтрат и промывные жидкости объединяли и перемешивали при t рубашки=5 С. В результате получали бледно-желтую жидкость. NaCl (3,5 кг) в H2O (16,4 л) добавляли в течение 15 мин с такой скоростью, что внутренняя температура поддерживалась ниже 15 С. Получающуюся в результате реакционную смесь нагревали до t рубашки=45 С и водную фазу отделяли. Органическую фазу промывали NaHSO4 Н 2 О в Н 2 О(2(2,87 кг+16,4 л и NaCl в Н 2 О (3,5 кг+16,4 л). Органическую фазу охлаждали до t рубашки=10C и NaOH(1,54 кг, 19,3 моль, 50% мас./мас.), разбавленную в Н 2 О (41 л), добавляли в течение 45 мин. Получающуюся в результате реакционную смесь нагревали до t рубашки=30C и органическую фазу отделяли. Водную фазу перемешивали при t рубашки=20 С и pH доводили до 6,5 при помощи Н 3 РО 4 (0,90 кг, 7,81 моль,85% мас./мас.), разбавленной в Н 2 О (5,3 л), с такой скоростью, что внутренняя температура поддерживалась на уровне ниже 25 С. 2-MeTHF и Н 2 О отгоняли в вакууме до объема 85-90% относительно объема до перегонки, приблизительно 8 л. Реакционную смесь охлаждали до t рубашки=0C и продолжили добавление Н 3 РО 4 (1,17 кг, 10,1 моль, 85% мас./мас.), разбавленной в Н 2 О (8,2 л), до pH 4. Суспензию оставляли перемешиваться в течение ночи при t рубашки=10C. Продукт отфильтровывали, промывали Н 2 О (24 л). Сушка в вакууме при 40 С позволила получить промежуточное соединение 36 (2,24 кг, 11,2 моль,93,2% мас./мас.), выход 75%.t рубашки=30C. NaOH (2,25 кг, 28,1 моль, 50% мас./мас.), разбавленную в Н 2 О (6 л), добавляли с такой скоростью, что t внутр. поддерживалась ниже 35 С. Загрузочный сосуд промывали Н 2 О (1 л). Если значение pH не превышало 12, то загружали дополнительное количество NaOH с той же самой концентрацией,как раньше. Перекись водорода (4,89 кг, 50,3 моль, 35% мас./мас.) добавляли с такой скоростью, чтобы поддерживать t внутр. ниже 35 С. Загрузочный сосуд промывали Н 2 О (1 л) и реакционную суспензию оставляли перемешиваться в течение 0,5-1,0 ч. Анализ образца на HPLC указывал на полное превращение к этому моменту с использованием следующего градиентного метода (подвижная фаза 20-95% В; А: 5%CH3CN в H2O с 0,05% муравьиной кислотой, В: 95% CH3CN в H2O с 0,05% муравьиной кислотой, время анализа 8 мин) на Chromolith Performance RP-18e, 4,6100 мм. Реакционную смесь охлаждали доt рубашки=0 оС и перемешивание поддерживали в течение по меньшей мере 0,5 ч при достижении температуры. Натриевую соль промежуточного соединения 37 отфильтровывали и промывали охлажденной H2O(27 л). Суспензию твердого вещества промывали на фильтре с использованием NaHSO4 Н 2 О (2,76 кг,20,0 моль), разбавленной в H2O (35 л). Суспензию поддерживали при перемешивании с t рубашки=0C в течение 1 ч. Если значение pH составляло не ниже 3,7, то его доводили с использованием NaHSO4 Н 2 О вH2O. Продукт отфильтровывали, промывали охлажденной H2O (314 л). Сушка в вакууме при 40 С позволила получить промежуточное соединение 37 (4,0 кг, 18,2 моль, 93,4% мас./мас.), выход 83%. 1 Н ЯМР (DMSO-d6):млн-1 12,40 (s, 1 Н), 7,94 (s, 1H), 7,79 (d, 2H, J=8 Гц), 7,32 (s, 1H), 7,23 (d, 2H,J=8 Гц), 2,44 (m, 1H), 1,88 (m, 1H), 1,47 (m, 1H), 1,39 (m, 1H); 13 К раствору промежуточного соединения 35 (второй способ) (5,87 г, 24,34 ммоль) в DMF (120 мл) при 0 С добавляли N,N-диизопропилэтиламин (21,20 мл, 121,72 ммоль), 1-гидроксибензотриазол (4,93 г,36,52 ммоль), N-(3-диметиламинопропил)-N'-этилкарбодиимид хлоргидрат (7 г, 36,52 ммоль), а затем промежуточное соединение 32 (5,53 г, 24,34 ммоль). Реакционную смесь перемешивали в течение 15 ч,затем реакционную смесь концентрировали и остаток суспендировали в EtOAc и промывали насыщенным раствором NaHCO3. Водную фазу дважды экстрагировали EtOAc и объединенные органические вещества промывали рассолом, сушили над MgSO4, фильтровали и концентрировали. Получающееся в результате масло очищали при помощи хроматографии на нормальной фазе с использованием градиентаEtOAc/гептан от 20 до 100% на 120 г колонках Redisep с использованием прибора ISCO Companion instrument с получением промежуточного соединения 38 (8,50 г, 93%) в виде прозрачного стекла, которое медленно затвердевало при стоянии. 1 Продукт анализировали на аналитической HPLC MS с использованием градиентного метода с высоким pH (подвижная фаза: 5-95% В; А: Н 2 О с 10 мМ NH4CO3 и 0,375% NH4OH об./об., В: CH3CN, 2,анализ в течение 25 мин) на XBridge С 18, 2,130 мм, размер частиц 5 мкм. К раствору промежуточного соединения 38 (8,5 г, 22,53 ммоль) в NMP (100 мл) при барботировании Ar добавляли цинк (0,737 г, 11,26 ммоль), цианид цинка (1,984 г, 16,90 ммоль) и дихлор[1,1'-бис-(дитрет-бутилфосфино)ферроцен]палладий(II) (0,335 г, 0,45 ммоль). Раствор нагревали при 100 С в течение 20 ч. Все еще оставалось некоторое количество исходного вещества, поэтому нагревание продолжали в течение еще 24 ч. Реакционную смесь охлаждали и концентрировали в высоком вакууме. Вещество суспендировали в EtOAc и фильтровали через целит. Фильтрат концентрировали, разделяли на две порции равной массы, причем каждую порцию очищали на 120 г колонке силикагеля, элюируя градиентомEtOAc/гептан 50-100% с получением промежуточного соединения 39 (6,10 г, 84%). Продукт анализировали на аналитической HPLC MS с использованием градиентного метода с высоким pH (подвижная фаза: 5-95% В; А: Н 2 О с 10 мМ NH4CO3 и 0,375% NH4OH об./об., В: CH3CN, 2, анализ в течение 25 мин) наMS m/z 324,39 [М+Н]+ (ESI),Rt=1,76 мин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение или его фармацевтически приемлемая соль, выбранное из диастереоизомерной смеси 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1 карбонил)циклопропил)бензамида; изомера 1 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида и изомера 2 4-(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида. 2. Соединение или его фармацевтически приемлемая соль, представляющее собой изомер 1 4(транс-2-R)-4-циклобутил-2-метилпиперазин-1-карбонил)циклопропил)бензамида. 3. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по п.1 или 2 и фармацевтически приемлемый носитель и/или разбавитель.
МПК / Метки
МПК: A61P 25/18, C07D 241/04, A61K 31/495
Метки: циклопропиламида, действующие, направленно, н3-рецептор, производные, гистаминовый
Код ссылки
<a href="https://eas.patents.su/27-20093-proizvodnye-ciklopropilamida-napravlenno-dejjstvuyushhie-na-gistaminovyjj-n3-receptor.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклопропиламида, направленно действующие на гистаминовый н3-рецептор</a>
Предыдущий патент: Способ и система для промывки электродов
Следующий патент: Фармацевтические препараты, содержащие легколетучие силиконы
Случайный патент: Способ получения кристаллического (r)-толтеродина тартрата