Способ генерации противовирусного иммунного ответа у человека или животного
Формула / Реферат
1. Способ генерации противовирусного иммунного ответа у человека или животного, отличающийся тем, что осуществляют трансдукцию клеток лимфоидного органа или клеток, мигрирующих к лимфоидному органу, генетической конструкцией, кодирующей аттенуированный вирус, с обеспечением экспрессии указанного вируса в лимфоидном органе.
2. Способ по п.1, отличающийся тем, что клетки являются дендритными клетками.
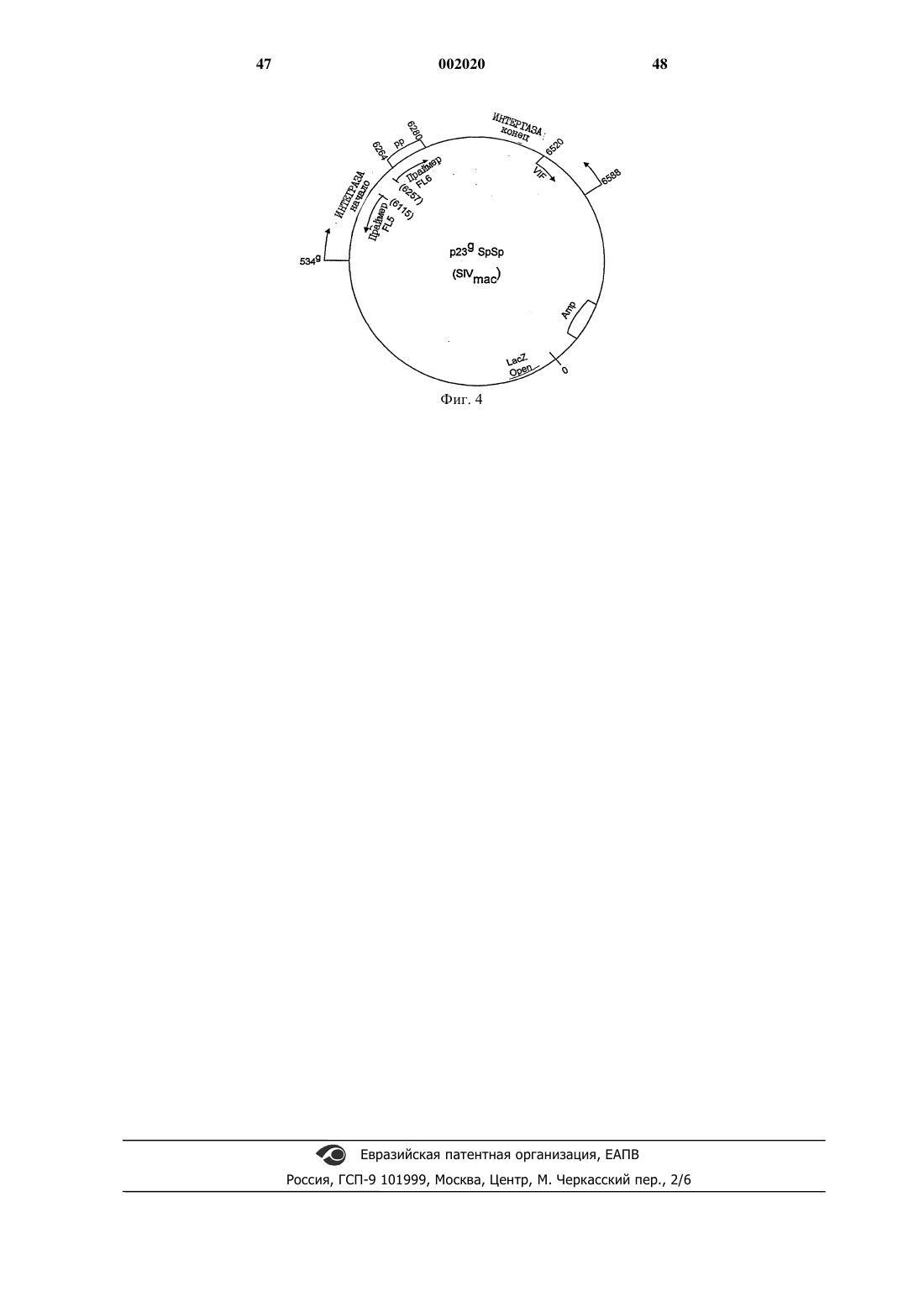
3. Способ по п.1, отличающийся тем, что указанный аттенуированный вирус является дефектным по интеграции или некомпетентным по репликации и не способен вызвать заболевание у хозяина с иммунодефицитом.
4. Способ по п.2, отличающийся тем, что указанный вирус содержит неполный ген интегразы, причем указанный ген интегразы имеет мутацию в активном сайте или в сайте связывания с ДНК.
5. Способ по п.3, отличающийся тем, что указанный аттенуированный вирус имеет мутацию в гене gag.
6. Способ по любому из предшествующих пунктов, отличающийся тем, что вирус представляет собой ретровирус или лентивирус.
7. Способ по п.6, отличающийся тем, что вирус выбран из группы, включающей ВИЧ-1, ВИЧ-2, SIV, HTLV-1 и FIV.
8. Способ по п.3, отличающийся тем, что указанным аттенуированным вирусом является вирус оспы канареек.
9. Способ по любому из предшествующих пунктов, отличающийся тем, что клетку дополнительно трансдуцируют генетической конструкцией, обеспечивающей экспрессию цитокина.
10. Способ по п.9, отличающийся тем, что цитокин выбран из группы, включающей IL-1, IL-2, IL-3, IL-4, IL-6, IL-7, IL-12, IL-15, IL-16, TNF, GM-CSF, IFN и хемокины RANTES, M1P1.
11. Способ по любому из пп.9 или 10, отличающийся тем, что экспрессия указанного цитокина стимулирует иммунный ответ Th1- или Тh2-типа, или осуществляемый природными клетками-киллерами, или цитотоксический Т-клеточный ответ, или В-клеточный ответ.
12. Способ по любому из предшествующих пунктов, отличающийся тем, что клетку дополнительно трансдуцируют генетической конструкцией, обеспечивающей экспрессию опухолевого антигена.
13. Способ по п.12, отличающийся тем, что опухолевый антиген выбран из группы, включающей антигены MAGE-1, p21ras, продукты генов Е6 и Е7 папилломавируса человека и их мутантные формы.
14. Способ по любому из предшествующих пунктов, отличающийся тем, что предназначен для облегчения или предупреждения ракового заболевания.
15. Способ по любому из предшествующих пунктов, отличающийся тем, что генерированный иммунный ответ является перекрестно-протективным.
Текст
1 Предпосылки создания изобретения Многие из смертельных и ослабляющих здоровье болезней, поражающих человека и животных, вызываются вирусами. Описанное в настоящей заявке изобретение направлено на предупреждение и лечение различных заболеваний, вызываемых вирусами, а в частности заболеваний, вызываемых ретровирусами. Так, например, настоящее изобретение может быть использовано для лечения раковых заболеваний,таких как Т-клеточный лейкоз/лимфома взрослых, вызываемых ретровирусом HTLV-1 (Тклеточным лимфотропным вирусом человека,типа 1). Это раковое заболевание создает большую угрозу для здоровья жителей Японии, а также для населения Карибского бассейна, Южной Америки и Соединенных Штатов Америки.Pombo de Olivera et al., (1990) Lancet 336: 987991; Shermata et al., (1992) Arch. Neurol. 49: 1113. HTLV-1 также связан с различными воспалительными расстройствами, такими как синдром Шегрена, характерный для жителей западной Японии, где HTLV-1 инфекция является эндемичной (Kaoru et al., [1994] Lancet 334:1116-1119), и дегенеративная энцефалопатия, вызывающая паралич нижних конечностей(Dixon et al., [1990] West J. Med., 152: 261-267). Другим ретровирусным заболеванием, рассматриваемым в настоящем описании, является СПИД, вызываемый ВИЧ (вирусом иммунодефицита человека), а в частности, конкретным типом ретровируса, называемым лентивирусом. Недавно было замечено, что гетеросексуальные женщины в возрасте 18-24 лет представляют собой группу населения, имеющую наиболее высокую сероположительную реакцию на ВИЧ. Поскольку ВИЧ-инфицированные женщины являются главным источником инфекции у детей, то, по мнению специалистов, смертность детей от СПИДа будет возрастать. В работеKimball et al., (1995) Annu. Rev. Public Health 16:253-282 дан обзор возможных разрушительных последствий эпидемии СПИДа. Примерами ретровирусов, вызывающих болезни у животных, является вирус иммунодефицита обезьян (SIV), вирус лейкоза кошек(FeLV), Т-лимфотропный лентивирус кошек (в настоящее время называемый вирусом иммунодефицита кошек (FIV), как было предложеноPedersen et al., [1987] Science 235:790-793), и вирус коровьего лейкоза. Другими заболеваниями, которые вызываются вирусами, не относящимися к ретровирусам, и которые также рассматриваются в настоящем изобретении, являются рак матки, вызываемый папилломавирусом человека (HPV), первичная гепатоцеллюлярная карцинома, называемая гепатитом В; лимфома Беркитта; и назофарингеальная карцинома, вызываемая вирусом Эпштейна-Барра 2 герпес, натуральная оспа, энцефалит, корь и грипп. Короче говоря, вирусы представляют собой облигатные внутриклеточные паразиты,которые реплицируются благодаря механизму стремительной атаки клеток хозяина. Вирусные частицы обычно включают геном, содержащий одну или несколько молекул ДНК или РНК, либо и то, и другое, и небольшой ряд белков, которые образуют капсид, либо присутствуют в качестве ферментов или регуляторных белков. Вирусы часто классифицируют (1) по типу нуклеиновой кислоты, составляющей геном; (2) по механизму репликации вирусов; и(3) морфологии вириона. Классификация и номенклатура вирусов описана Fenner et al., eds.Press, Inc., San Diego. Организм борется с вирусной инфекцией посредством комбинации клеточного и гуморального иммунных механизмов. Цитотоксические Т-лимфоциты (ЦТЛ) являются главным оружием в борьбе против интегрированной вирусной инфекции. В частности, CD8+-Tлимфоциты распознают антигены, ассоциированные с молекулами главного комплекса гистосовместимости (МНС) класса I, а CD4+-Tклeтки распознают антигены, ассоциированные с молекулами МНС класса II. В самом начале процесса инфицирования вирусом важным оружием в борьбе против вирусной атаки являются специфические антитела. Хотя точные механизмы нейтрализации вирусов антителами пока не известны, однако, сообщалось, что антителаIgG, IgA и IgM способны нейтрализовать вирусные частицы. В соответствии с этим успех профилактической вакцинации субъединичными,аттенуированными или убитыми вирусами в значительной степени связан со способностью вакцины стимулировать иммунный ответ путем образования антител. См., в основном, Abbas eted., W.B.Saunders Co., Philadelphia. Более конкретно, субъединичные вакцины,состоящие из вирусных белков, вводят в целях продуцирования иммунного ответа против вирусных белков для обеспечения эффективной защиты от вирусной инфекции. Такой способ вакцинации направлен на продуцирование гуморального или системного иммунного ответа,и обычно вызывает продуцирование антителIgG. Этот тип антител присутствует, главным образом, в кровотоке индивидуума и способствует предупреждению заболеваний, распространяемых по кровотоку. Например, в случае ВИЧ 1, многие вакцины, предназначенные для предупреждения ВИЧ-1-инфекций, являются такими субъединичными вакцинами, в которых используются рекомбинантные белки оболочки или сердцевины вируса ВИЧ-1 и которые вводят либо внутримышечно, либо подкожно. Однако эти вакцины не продуцируют эффективного 3 иммунного ответа в ВИЧ-моделях, отчасти из-за того, что селективно клонированные и экспрессированные белки не могут представлять вирусные эпитопы аутентичным образом. Letvin(1993) New Eng. J.Med. 329(19): 1400-1405. Кроме того, вирусные мутации облегчают уклонение вируса от иммунных ответов, сконцентрированных на нескольких специфических эпитопах. Nowak et al., (1995) Nature, 375: 606611. Что касается ВИЧ-модели, то помимо субъединичных вакцин, в качестве вакцин было предложено использовать живые аттенуированные вирусы. Однако те живые аттенуированные вирусы, которые не способны эффективно реплицироваться in vivo, не индуцируют протективного иммунного ответа (Letvin et al., [1995] J.Virol., 69: 4569-4571). С другой стороны, имеющиеся в настоящее время живые аттенуированные вирусы ВИЧ, которые способны эффективно реплицироваться in vivo, являются слишком опасными для их использования в качестве вакцин (Letvin (1993) Nev Eng. J.Med. 329(19): 1400-1405). Конкретными примерами вакцин на основе аттенуированных живых вирусов, которые являются слишком опасными для использования их в целях общей вакцинации, являются вакцины, разработанные против вирусов макакрезусов SIV (SIVmac). Ослабление этого вируса проводили путем делеции вирусного гена nef,т.е. 25-29 кД-белка, локализованного в цитоплазме и плазматической мембране инфицированных клеток (Allan, J.S., et al., [1985] Science 230:810-813). nef-Делетированный SIVmac сохранял свою способность к интеграции и репликации. Хотя вакцинация nef-делетированным вирусом SIVmac обеспечивает защиту взрослых макак-резусов от последующего инфицирования патогенным вирусом SIVmac (Daniel et al.,[1992] Science, 258: 1938-1941; Almond et al.,[1995] Lancet 345: 1342-1344), однако, у детенышей макак-резусов после вакцинации nefделетированным вирусом SIVmac иногда развивается тяжелое заболевание с летальным исходом. Baba et al., (1995) Science 270:1220-1221. Кроме того, недавно было показано (Heathet al., [1995] Nature, 377:740-744), что комплекс,образованный ВИЧ-1 с нейтрализующими антителами, является в высокой степени инфекционным в присутствии фолликулярных дендритных клеток. Это объясняет, почему методы с использованием традиционных вакцин, индуцирующих гуморальный ответ, могут оказаться неэффективными. Таким образом, возможность победить болезнь действительно связана, главным образом,с использованием компетентных по репликации аттенуированных вирусов. Кроме того, в случае ретровирусов (особенно лентивирусов), могут потребоваться годы, прежде чем будет выяснена потенциальная токсичность традиционных вак 002020 4 цин. Это значительно повысило бы безопасность и позволило бы установить пределы использования компетентных по репликации вирусных вакцин. Поэтому в настоящее время существует крайняя необходимость в разработке безопасных и эффективных способов борьбы с вирусными инфекциями. Эта проблема может быть решена с помощью способа генетической иммунизации настоящего изобретения, который обеспечивает защиту от ряда заболеваний. Краткое описание изобретения Настоящее изобретение относится к способам для продуцирования протективного и терапевтического иммунитета к вирусным инфекциям у человека и животных путем генетической иммунизации. Генетическая иммунизация предусматривает экспрессию генов, кодирующих чужеродные антигены в лимфоидных органах, для предупреждения и лечения болезней. Как будет более подробно описано ниже,при экспрессии генов не компетентных по репликации вирусов в лимфоидных органах, предпочтительно в дендритных клетках, будет генерироваться иммунитет посредством первичной и вторичной иммунных реакций, обусловленных продуцированном вирусной частицы и ограниченным повторным инфицированием. В предпочтительном варианте способы настоящего изобретения предусматривают трансдукцию клетки-хозяина человека или животного генетической конструкцией,сообщающей трансдуцированной клетке способность экспрессировать аттенуированный вирус. Аттенуированный вирус, продуцированный трансдуцированной клеткой, является предпочтительно инфекционным, но некомпетентным по репликации, так что этот вирус не является патогенным. Хотя вирус, продуцированный трансдуцированной клеткой, не является патогенным, однако, этот аттенуированный вирус индуцирует иммунный ответ, способный обеспечивать защиту клетки от инфицирования вирусом дикого типа. Этот уникальный результат был достигнут с использованием аттенуированных вирусов,селективно продуцированных клетками в лимфоидных органах животного или человекахозяина. Предпочтительно аттенуированный вирус имеет размер и другие характеристики природного вируса за тем лишь исключением,что аттенуированный вирус не является патогенным. Эффективность иммунного ответа максимизируется природными свойствами аттенуированного вируса, а также его экспрессией в лимфоидных органах. В соответствии с настоящим изобретением отсутствие патогенности аттенуированного вируса обеспечивается различными путями, но,как описано в настоящей заявке, в предпочтительных вариантах настоящего изобретения предусматривается генетическая модификация вирусного генома, например устранение или снижение способности вируса к продуктивной 5 репликации или интеграции. Путем клонирования ДНК этого не компетентного по репликации вируса можно создавать вирусную частицу, которая является лишь слабо инфекционной. При представлении хозяину с использованием стандартной методики такой слабо инфекционный вирус не должен стимулировать эффективный иммунный ответ, способный обеспечить защиту хозяина от последующего провокационного заражения. Для того чтобы решить проблему, связанную с таким отсутствием протективной или терапевтической иммуногенности вируса, настоящее изобретение предлагает уникальный способ эффективного усиления иммуногенности аттенуированной вирусной частицы путем более прямого представления этих вирусных частиц компонентам иммунной системы, которые ответственны за усиление антивирусного ответа. Более конкретно, клетки в лимфоидных органах подвергают трансдукции так, чтобы они обладали способностью продуцировать не компетентные по репликации вирусные частицы. По своим размерам, биохимическим свойствам и антигенному представлению вирусных белков,эти вирусные частицы почти идентичны вирусу дикого типа, за тем лишь исключением, что указанный аттенуированный вирус не способен продуцировать активную инфекцию. Хотя аттенуированный вирус, экспрессируемый вируспродуцирующими клетками настоящего изобретения, не способен к распространению инфекции, однако, он вполне способен продуцировать достаточно эффективный иммунный ответ. Способность вируса индуцировать нужный иммунный ответ обусловлена схожестью структуры и биохимических свойств этого вириона и вируса дикого типа, а также тем фактом, что аттенуированный вирус специфически продуцируется в непосредственной близости к соответствующим клеткам иммунной системы. Способы настоящего изобретения могут быть использованы для продуцирования иммунного ответа до экспонирования вирусом или, что преимущественно, эти способы могут быть использованы после экспонирования вирусом в целях генерирования усиленного иммунного ответа. Обработка после экспонирования вирусом является особенно преимущественной в случае инфицирования вирусом, который не снижает иммунный ответ хозяина или в случае неиммунизированных пациентов в иммунологически компетентных стадиях болезни. Как будет более подробно описано в настоящей заявке, трансдукция клеток-хозяев может иметь другие в высокой степени благоприятные последствия, включая, например, ингибирование репликации вируса дикого типа в трансдуцированных клетках. Может быть также достигнут перекрестный иммунитет против родственных вирусов вследствие представления наиболее широкого спектра иммунологических детерминант. Так, например, способы, описан 002020 6 ные в настоящей заявке, могут быть, кроме того,использованы для продуцирования иммунного ответа против гетерологичных вирусов, либо даже для продуцирования общего антивирусного иммунного ответа. Способы настоящего изобретения являются особенно предпочтительными потому, что они могут приводить к высокоэффективному антивирусному иммунному ответу при максимальной безопасности вакцинации или терапевтического лечения. В соответствии с настоящим изобретением, можно с достаточной безопасностью продуцировать иммунный ответ к полноразмерной вирусной частице без какойлибо опасности вызвать заболевание. Кроме того, поскольку известно, что вирусы опосредуют много типов канцерогенеза, способы настоящего изобретения могут быть использованы для лечения или предупреждения этих канцерогенных состояний путем элиминации или снижения вирусной инфекции, необходимой для инициации или прогрессирования канцерогенных состояний. Кроме того, способы настоящего изобретения могут быть использованы для лечения опухолей, обнаруживающих конкретно распознаваемые антигены, путем вырабатывания соответствующего иммунного ответа против указанных антигенов. В другом варианте настоящего изобретения иммунный ответ, вырабатываемый у животного-хозяина путем экспрессии аттенуированного вируса, может быть усилен, непосредственно или опосредованно, путем введения в трансдуцированные клетки второй генетической конструкции, которая регулирует экспрессию модулирующей иммунную систему молекулы,такой как цитокин. Способы настоящего изобретения могут быть также использованы, в основном, для повышения эффективности вакцин, изготовленных на основе рекомбинантного вируса. Так, например, были предприняты обширные исследования для разработки рекомбинантных вакцин с использованием различных поксвирусов в качестве вирусных векторов. Такими поксвирусами могут быть, например, вирус коровьей оспы,вирус оспы птиц, вирус оспы канареек или вирус оспы свиней. При использовании в альтернативных хозяевах или при экспрессии антигенов низкой иммуногенности эти вирусные вакцины часто оказываются неэффективными для продуцирования нужного иммунного ответа. Эта проблема может быть решена с помощью настоящего изобретения, предлагающего уникальные способы транспортировки, благодаря которым трансдуцированные клетки мигрируют в лимфоидные органы для экспрессии вирусных частиц. Трансдукция клеток, мигрирующих в лимфоидные органы, в значительной степени повышает эффективность иммунного ответа,вырабатываемого рекомбинантными вирусными конструкциями. Альтернативно, эти вирусы,инъецированные непосредственно в лимфоид 7 ные органы, могут инфицировать антигенпредставляющие клетки и продуцировать инфекционные вирусные частицы. Такая in vivoинъекция может решить проблему неэффективной индукции ЦТЛ после внутрикожного введения. Таким образом, способы настоящего изобретения могут быть использованы для (а) стимуляции эффективного иммунного ответа против вирусных антигенов; (b) ингибирования репликации вируса и вирус-опосредованного канцерогенеза; (с) генерирования продолжительной перекрестно-реактивной памяти; (d) активной иммунизации, направленной против опухолей; и(е) изготовления безопасных генетических вакцин. Настоящее изобретение обеспечивает как безопасность, так и эффективность указанных способов иммунизации благодаря использованию аттенуированных вирусов, которые не могут быть распространителями инфекции. Эффективность этих вирусов была обеспечена путем их внедрения в организм человека и животных иными способами, чем их собственная репликация. Однако если аттенуированный вирус способен совершать несколько циклов репликации, то этот вирус может быть непосредственно инъецирован в лимфоидные органы. Следовательно, эти вирусы являются безопасными и эффективными для продуцирования протективного и терапевтического иммунитета у человека и животных. Краткое описание рисунков Фиг. 1 иллюстрирует генетическую иммунизацию. Для трансдукции клеток, предпочтительно дендритных клеток (ДК), использовали ДНК, кодирующую вирус класса 4. Затем эти трансдуцированные клетки переносили в лимфоидный орган, где указанные трансдуцированные клетки экспрессируют ДНК в виде белка и вируса класса 4 и становятся первичными антиген-представляющими клетками (АРС). Вирус класса 4, высвобождаемый из трансдуцированных клеток, может действовать как растворимый антиген, а также инфицировать другие клетки, присутствующие в лимфоидном органе,такие как Т-клетки, макрофаги и дендритные клетки. Эти дендритные клетки становятся вторичными антиген-представляющими клетками. Как первичные, так и вторичные АРС представляют вирусные антигены аутентичным образом в контекстных последовательностях (контексте) главного комплекса гистосовместимости, сконцентрированных в лимфоидном органе,эффективно продуцируя иммунный ответ хозяина. Фиг. 2 А-2 В иллюстрируют ретровирусный геном дикого типа, некоторые части белка интегразы и пример аттенуированного гена интегразы, который генерирует ретровирус класса 4. Более конкретно, эта мутация приводит к образованию усеченного белка интегразы, который 8 начинается у 5'-конца как последовательность дикого типа и заканчивается у первого стопкодона после делеции, поэтому этот мутантный белок имеет примерно размер, составляющий половину интегразы дикого типа. Фиг. 3 А-3 В иллюстрирует патогенность четырех классов вирусов, классифицированных по их способности реплицироваться в данном хозяине. Фиг. 3 А-3 В рассматриваются вместе с табл. 1. Классы 1-3 были описаны Baba et al.,(1995) Science 270: 1220-1221, а класс 4 был описан в настоящей заявке. Вирус класса 1 представляет собой вирус дикого типа, который реплицируется на уровне, превышающем пороговый уровень, что обуславливает наличие персистентной виремии и вызывает заболевание у хозяина. Вирус класса 2 может быть вирусом дикого типа или аттенуированным вирусом,репликация которого превышает пороговый уровень, но при этом он может вызывать, а может и не вызывать заболевание у нормального хозяина. Вирусы класса 3 вызывают заболевание у хозяина, иммунная система которого ниже порогового уровня. Вирусы класса 4 являются аттенуированными вирусами с самоограничивающейся репликацией, и эти вирусы не могут вызывать заболевание даже у хозяев с ослабленной иммунной системой ниже порогового уровня. См. ниже пример 1, где обсуждаются фиг. 3 А-3 В. Фиг. 4 изображает плазмидную конструкцию p239SpSp, несущую дефектный ген, кодирующий усеченный белок интегразы. Краткое описание последовательностейFL6, используемый в соответствии с настоящим изобретением. Подробное описание изобретения Настоящее изобретение относится к материалам и способам стимуляции безопасного и эффективного иммунного ответа у человека и животного. Способы настоящего изобретения предусматривают трансдукцию клеток конструкцией, которая регулирует экспрессию аттенуированного вируса. Используемый в настоящем описании термин трансдукция клеток означает перенос в эти клетки ДНК, сообщающей этим клеткам способность продуцировать вирус, описанный в настоящей заявке, и в некоторых случаях экспрессировать цитокин и/или опухолевый антиген. В настоящем описании трансдуцированные клетки называют вируспродуцирующими клетками. Обычно трансдуцированными клетками являются клеткихозяева животного или человека. Для специфической экспрессии аттенуированного вируса,который не способен вызывать заболевание,создают конструкцию на основе аттенуированного вируса. Аттенуированный вирус может 9 быть, например, не компетентным по репликации. Если аттенуированный вирус является ретровирусом, то в качестве не компетентных по репликации вирусов используют дефектные по интеграции вирусы. Хотя аттенуированный вирус не является патогенным, его экспрессия вирус-продуцирующими клетками осуществляется в соответствии с механизмом, обуславливающим высокопродуктивный и эффективный иммунный ответ у хозяина. В предпочтительном варианте осуществления изобретения, получают такие вирус-продуцирующие клетки, которые экспрессируют дефектные вирусы в лимфоидных тканях, где индуцируется иммунный ответ против вирусных антигенов. Используемыми в настоящем изобретении лимфоидными органами являются, например, лимфатические узлы,селезенка и тимус. В своем важном аспекте,настоящее изобретение обеспечивает представление иммунной системе вирусных частиц, которые являются, в основном, идентичными природным вирусам, за тем лишь исключением, что вирусные частицы настоящего изобретения не являются патогенными. Преимущество заключается также в том, что эти вирусные частицы представляются иммунной системе в своей природной конформации, что облегчает продуцирование высокоэффективного иммунного ответа. В предпочтительном варианте осуществления изобретения вирусные частицы не являются патогенными вследствие того, что они никогда не присутствуют в количестве, достаточном для возникновения заболевания, и/или вследствие того, что они не могут обеспечивать спонтанно пролонгированное инфицирование(т.е. вирусы класса 4, описанные ниже в табл. 1 и в сопровождающем ее тексте). Хотя вирусные частицы, продуцированные способом настоящего изобретения, не способны вызывать заболевание, однако, их представление происходит таким образом, что это вызывает эффективный иммунный ответ. В частности, вирусные частицы высвобождаются из трансдуцированных клеток в непосредственной физической близости к клеткам иммунной системы, которые ответственны за генерирование антивирусного ответа. Путем создания вирусных частиц, которые точно имитируют природный вирион, и путем селективного концентрирования этих непатогенных частиц вириона и области, в которой происходит продуцирование иммунного ответа, можно индуцировать высоко продуктивный и эффективный иммунный ответ. Преимуществом является также то, что вирус и вируспродуцирующие клетки настоящего изобретения будут, в конечном счете, удаляться из организма иммунной системой, поскольку (а) этот вирус не может вызывать инфекцию, и (b) этот вирус индуцирует антивирусный иммунный ответ. Способы настоящего изобретения могут быть использованы до инфицирования хозяина 10 в целях продуцирования иммунного ответа, который будет обеспечивать защиту от инфекции. Альтернативно или помимо этого способы настоящего изобретения могут быть использованы для усиления иммунного ответа хозяина после инфицирования вирусом. Такая пост-обработка может иметь важное значение, в частности, в том случае, когда вирусная инфекция является одной из тех инфекций, которые могут вызывать снижение природного иммунного ответа у хозяина. Высокая эффективность способов настоящего изобретения, предназначенных для генерирования антивирусного иммунного ответа, обусловлена отчасти уникальным способом транспортировки аттенуированных вирусных частиц в организме-хозяине человека или животного. В частности, аттенуированные непатогенные вирусные частицы настоящего изобретения, которые продуцируют терапевтический или превентивный иммунный ответ, экспрессируются клетками в лимфоидных органах так,что высвобождение этих вирусных частиц происходит в той области организма человека или животного, где антивирусный ответ обычно генерируется клетками иммунной системы. Высвобождение вирусных частиц в лимфоидных органах достигается путем трансдукции клетокхозяев этих лимфоидных органов (или клеток,которые мигрируют преимущественно в лимфоидные органы) генной конструкцией, которая обеспечивает экспрессию аттенуированного вируса. Как подробно описано в настоящей заявке, особенно предпочтительной является трансдукция дендритных клеток. В другом своем аспекте настоящее изобретение относится к способу стимуляции или направления иммунного ответа хозяина путем совместного внедрения в вирус-продуцирующие клетки, по крайней мере, одного гена, экспрессирующего иммуномоделирующую молекулу, в комбинации с генетическим материалом, кодирующим аттенуированный вирус. Благодаря этому генерируются вирус/цитокин-продуцирующие клетки. В предпочтительном варианте осуществления изобретения получают вирус/цитокин-продуцирующие клетки, которые экспрессируют генные продукты предпочтительно в лимфоидных органах. Цитокин усиливает и/или влияет на тип иммунного ответа, индуцируемого аттенуированным вирусом. Примерами цитокинов, которые могут быть использованы для усиления иммунного ответа или направления конкретного иммунного ответа в соответствующие органы, являются, но не ограничиваются ими, IL-1, IL-2, IL-3, IL-4,IL-6, IL-7, IL-12, TNF, GM-CSF и IFN. См., например, Dranoff et al., (1993) Proc. Natl. Acad.Immunol. Today 16(5):220-223; и работы, цитируемые в этих статьях. Дополнительные аспекты настоящего изобретения включают способы ингибирования репликации вируса и вирусопосредованного канцерогенеза. В одном из вариантов осуществления настоящего изобретения ингибирование репликации вируса осуществляют с помощью цитотоксических Т-клеток,которые разрушают клетки, экспрессирующие любой вирусный антиген. Цитотоксические клетки продуцируются путем индуцирования либо необученных Т-клеток, либо Т-клеток памяти антигенами, экспрессируемыми в лимфоидных органах. Это является значительным преимуществом настоящего изобретения, поскольку хорошо известно, что вирусы, например папилломавирусы, вирус гепатита С, HTLV-1 и герпесвирус человека типа 8 (HHV-8) (называемый также герпесвирусом саркомы Капоши(KSHV и ВИЧ-1, могут опосредовать рак шейки матки, рак горла, рак печени, Т-клеточный лейкоз взрослых и саркому Капоши, соответственно. См., например, Bedi et al., (1995) NatureMedicine, 1:65-68. Поэтому ингибирование онкогенеза может быть достигнуто путем уничтожения клеток, экспрессирующих вирусные антигены, независимо от того, участвует ли непосредственно этот вирус в образовании опухоли или только опосредует его. В другом своем аспекте настоящее изобретение относится к способу получения безопасной генной вакцины против вирусных инфекций. Этот способ может быть осуществлен, как описано выше, путем продуцирования аттенуированного вируса, с использованием или без использования цитокинов, в лимфоидных органах индивидуума с необученными Тлимфоцитами. Эффективное представление антигена в лимфоидных органах приводит к клональной экспансии антигенспецифических Тклеток, которая необходима для оперирования с большим числом чужеродных генов. Некоторое потомство антигенреактивных клеток вырабатывает антигенспецифические Т-клетки памяти,которые быстро инициируют вторичный иммунный ответ после последующей стимуляции. Таким образом, способ генетической иммунизации, описанный в настоящей заявке, способствует генерированию из необученных Тклеток большего числа Т-клеток памяти, которые являются специфичными ко многим или,возможно, ко всем вирусным антигенам, что позволяет избежать ускользания антигенов от иммунологического надзора. Это может быть достигнуто путем профессиональной АРС (например, DC)-презентации всех эпитопов вирусных белков различным иммунным клеткам в лимфоидных органах, как описано выше. Кроме того, продуцируется вирус, который действует как растворимый антиген и инфицирует другие клетки в лимфоидных органах. Возрастание иммунного ответа достигается путем повторно 002020 12 го инфицирования аттенуированным вирусом других клеток в лимфоидных органах, что приводит к вторичному представлению антигена. Кроме того, для усиления специфического иммунного ответа могут быть использованы адъюванты (например, цитокины) или повторное введение вакцины. Такой продолжительный перекрестнореактивный иммунитет был описан Selin и др.([1994] J.Exp. Med., 179: 1993-1943). В этой работе показано, что клетки памяти могут быть, в основном, повторно стимулированы вирусами,которые не являются серологически перекрестнореактивными. Это утверждение справедливо как для Т-клеточного, так и для В-клеточного ответов. Известно, что Т-клетки узнают короткие пептиды, состоящие из 8-13 аминокислот, и что они могут перекрестно реагировать с вариантами исходного пептида, а также с комплексами неродственный МНС/пептид. Поэтому,перекрестная реактивность Т-клеток может не ограничиваться родственными патогенами. Другая важная особенность перекрестной реактивности заключается в том, что Т-клетки памяти присутствуют при той же самой частоте как в лимфоидных органах, так и в крови, что характерно для клетки, нуждающейся в иммунном надзоре (Lau et al., [1994] Nature 369:648-652). Поэтому, в отличие от необученных клеток,Т-клетки памяти экспонируются антигенами,которые не присутствуют в лимфоидных органах и быстро реагируют на инфекцию. Способ генетической иммунизации настоящего изобретения позволяет генерировать Т-клетки памяти,направленные против всех вирусных антигенов,представленных в правильной конформации, не только, главным образом, дендритными клетками, но также и вторично инфицированными клетками. При инфекциях, подобных ВИЧ или вирусу гриппа, небольшой процент клеток памяти, генерированных против консервативных или перекрестно-реагирующих антигенов, может обеспечить иммунитет против последующего заражения другим подтипом этого вируса. Перекрестный иммунитет против различных подтипов вирусов особенно важен в случае ВИЧ-инфекции или инфекции гриппа, при которых может быстро возникать большое число различных подтипов. Свидетельство в пользу перекрестного иммунитета против различных подтипов вируса было недавно продемонстрировано Marlink и др., из чего следует, что генетическая иммунизация с использованием ВИЧ-2 может обеспечить иммунитет против ВИЧ-1 инфекции (Marlink et al., [1995] Science 265:1587-1590). Кроме того, как было описано,этот тип генетической иммунизации с использованием целого вируса может обеспечить защиту от вариантов ВИЧ с большим успехом, чем это делает субъединичная вакцина, известная специалистам. 13 В соответствии с настоящим изобретением иммунный ответ, генерированный вирусом (или вирус/цитокин)-продуцирующими клетками в лимфоидных органах является полным антивирусным ответом. Так, например, в случае, если клетки-продуценты являются дендритными клетками, а аттенуированный вирус является негативным по интегразе вирусом ВИЧ-1, способным продуцировать белки в инфицированных клетках, то иммунный ответ может продуцироваться следующим образом:(а) антиген-представляющие дендритные клетки (первичные антиген-представляющие клетки) мигрируют с приобретенной ДНК в лимфоидные органы, где после продуцирования белка и вируса они стимулируют необученные Т-клетки и Т-клетки памяти и генерируют ко-стимулирующие сигналы. Thomson et al.,(1995) Transplantation 59:544-550;(b) иммунные клетки реагируют на вирусные антигены, и свободный вирус продуцируется in situ дендритными клетками. Так, например,дендритные клетки и макрофаги, присутствующие в лимфоидных органах, обладают способностью представлять вирусные антигены как(c) анатомическая совместная локализация антигена,антиген-представляющих клеток(АРС), и Т-клеток в лимфоидных органах стимулирует инициацию Т-клеточного ответа. У млекопитающих для удаления инфицированных и других ненужных клеток и тканей используются цитотоксические Т-клетки и природные клетки-киллеры. Цитотоксические Т-клетки распознают пептиды, представленные молекулами МНС класса 1, а природные клеткикиллеры, действуя в отсутствие МНС-1, осуществляют надзор за общей последовательностью инфицирования вирусом и злокачественного перерождения;(d) аттенуированный вирус, продуцируемый дендритной клеткой, может инфицировать другие иммунные клетки (например, СD4+лимфоциты, дендритные клетки, и макрофаги) в лимфоидных органах. В этом случае вирусный антиген также будет представлен эффекторным клеткам;(e) антиген в лимфоидных органах стимулирует продуцирование цитокинов. Эти цитокины играют роль эффекторов в Т-клеточно(см., например, Macatonia et al., [1995] J. Immunol., 154: 5071-5079) и в В-клеточноопосредованном иммунном ответе; опосредуют естественный иммунитет (например, интерферон, СD8-ингибирующий фактор) и регулируют активацию, рост и дифференцировку лимфоцитов и гемопоэза. Поэтому продуцирование цитокинов вместе с аттенуированным вирусом может способствовать усилению и регуляции иммунного ответа; и(f) аттенуированный вирус (в качестве внеклеточного антигена) и хелперные CD4+-Tлимфoциты могут активировать макрофаги для фагоцитоза антигена, и активировать В-клетки для секреции антитела. Таким образом, настоящее изобретение может быть использовано для предупреждения и лечения вирусных инфекций и других патологических состояний, включая рак, но не ограничиваясь им. В другом аспекте настоящего изобретения предусматривается использование ДНК, кодирующей аттенуированный вирус, в комбинации с опухолевыми антигенами. Поскольку генетическая иммунизация приводит к индуцированию сильного первичного и вторичного иммунного ответа против антигенов, экспрессированных в лимфоидных тканях, то этот иммунный ответ будет также направлен на чужеродные антигены (возможно, опухолевые антигены), встроенные в вирус класса 4. Материалы и способы, рассматриваемые в настоящем описании, могут быть использованы для лечения и предупреждения вирусных инфекций широкого спектра, включая инфекции ДНК- и РНК-вирусов. Конкретными примерами являются материалы и методы предупреждения или лечения патологических состояний человека,или животных, вызываемых ретровирусами,включая ВИЧ-1, SIV и HTLV-1. Если это не оговорено особо, то используемое в настоящем описании обозначение ВИЧ относится к ВИЧ-1 и ВИЧ-2. В нижеследующих примерах проиллюстрировано практическое применение способов настоящего изобретения. Эти примеры не должны рассматриваться как некое ограничение изобретения. Все проценты даны по массе, а все смеси растворителей даны по объему, если это не оговорено особо. Пример 1. Примеры инфекций, которые вызываются не компетентными по репликации вирусами (класса 4). Аттенуированный вирус, используемый в соответствии с настоящим изобретением, должен быть непатогенным. В предпочтительном варианте осуществления изобретения такое отсутствие патогенности обусловлено модификацией вирусного генома, которая нарушает его способность к неограниченной репликации. Такими дефектными по репликации вирусами являются предпочтительно вирусы, которые, во избежание их возврата к вирусу дикого типа,были получены путем внесения делеций. Такой делеционный метод хорошо известен специалистам. Используемый в настоящем описании термин аттенуированный вирус включает также мутантные вирусы. Сравнение и определение вирусов класса 4 представлены в табл. 1 и в нижеследующем описании. 1. Отсутствует 2. Потеря патогенности 3. Пониженная способность к репликации 4. Инфекционный, но не компетентный по репликации Таблица 1 Репликация выше порогового уровня Заболевание В ко-инфицированном В ко-инфицированном В нормальном В нормальном или иммунологически и иммунологически хозяине хозяине ослабленном хозяине ослабленном хозяине да да да да не компетентный по репликации Механизм аттенуации 1-3, описанный в табл. 1, исходя из данных Baba et al., (1995) Science 270:1220-1221, иллюстрирует различные классы ослабленных вирусов, известные специалистам, и влияние аттенуации вируса на его способность вызывать инфекцию выше порогового уровня. Настоящее изобретение вводит аттенуированные вирусы класса 4, подробно описанные ниже. В соответствии с этой пороговой гипотезой, предложенной Baba, патогенность ретровирусов выявляется только после того, как уровень репликации вируса перейдет пороговый уровень у данного хозяина: пороговый уровень определяется как уровень инфекции, выше которого наблюдается персистентная виремия и патогенность. На фиг. 3 А-3 В проиллюстрирован критерий порогового уровня, исходя из описания Baba. Как показано в табл. 1 и на фиг. 3 А-3 В,вирусы класса 1 являются неаттенуированными вирусами дикого типа, способными реплицироваться на уровне, превышающем пороговый уровень, и вызывать заболевание у инфицированного хозяина. У вирусов класса 2 отсутствует патогенность, поскольку, хотя эти вирусы являются компетентными по репликации, однако, они не являются вирулентными в организме хозяина. Поэтому в табл. 1, в столбце, озаглавленном Репликация, указано да. Вирусы класса 3 могут быть дефектными по репликации, что может быть достигнуто различными методами, но определенные факторы могут позитивно регулировать репликацию вируса и сохранять его вирулентность после того, как уровень репликации будет превышен. Обращаясь к фиг. 3 А-3 В, следует указать, что вирусы класса 3 вызывают заболевание у индивидуумов с низким порогом иммунитета. Более конкретно, инфицирование вирусами класса 1 или 2 (см. табл. 1) приводит к персистентной виремии (эти вирусы всегда способны реплицироваться на уровне, превышающем пороговый уровень), что представляет потенциальную опасность для индивидуума-хозяина,независимо от патогенности вируса (фиг. 3 А 3 В). Так, например, ретровирусы интегрируются в геном хозяина рандомизированным обра зом, а поэтому в случае высокого порога репликации вероятность активации онкогена посредством его интеграции в геном очень высока. И хотя нормальные хозяева способны контролировать репликацию вирусов класса 3 (фиг. 3 А),этот механизм не является специфическим, например, для ВИЧ, SIV или для мутантных вирусов. Так, например, инфекция цитомегаловируса человека (CMV) вызывает временную виремию у нормального хозяина; однако, у пациентов после пересадки костного мозга или у пациентов со СПИДом (где иммунная система является ослабленной), порог регуляции репликации вируса снижается (фиг. 3 В). Следовательно, CMV начнет реплицироваться на уровне выше порогового уровня и будет вызывать тяжелое заболевание. Хотя, как видно из табл. 1, может показаться, что аттенуированные вирусы классов 2-3 являются подходящими для генетической иммунизации, однако, возражением против этого может служить то, что эти вирусы способны неограниченно реплицироваться в оптимальных условиях (например, в тканевой культуре, у пациента с иммунодефицитом, у новорожденного). Так, например, мутантный вирус SIV класса 3 с делегированными генами nef и vpr вызывает СПИД у новорожденных макакрезусов, которые имеют более низкий порог,чем взрослые особи, см. фиг. 3 А-3 В. Таким образом, вирусы класса 3 являются относительно небезопасными для генетической иммунизации. Аналогичным образом, вирусы класса 2 являются относительно небезопасными для генетической иммунизации, поскольку их вирулентность может быть стимулирована путем вторичного инфицирования вирулентным вирусом. Например, авирулентный вирус мышиного лейкоза Раушера (RLV) обеспечивает защиту от низкой дозы RLV после инокуляции фармакологически аттенуированным RLV класса 4, тогда как у мышей, ко-инфицированных высокой дозой вирулентного вируса мышиного лейкоза, будет развиваться заболевание Раушера. Тем не менее, очевидно, что авирулентные вирусы класса 2 не защищают против провокационного заражения высокой дозой вируса и также являются 17 слишком опасными для использования в вакцинах, поскольку остаточная вирулентность этих вирусов может проявляться самопроизвольно. Эта остаточная вирулентность может быть запущена различными механизмами, включая коинфицирование, потерю иммунокомпетентности и старение. Таким образом, стандартные методы изготовления вакцин на основе живого аттенуированного вируса продолжают представлять серьезную опасность. Вирусы класса 4 не были описаны Baba и представляют собой часть изобретения, описанного в настоящей заявке. Один из аспектов заявленного изобретения включает продуцирование и представление вирусов класса 4, которые являются аттенуированными с остаточной инфекционностью, не превышающей порогового уровня, в результате чего они не компетентны по репликации. Репликация вирусов класса 4 является самоограниченной, а это означает, что число циклов репликации может составлять лишь от 0 до нескольких циклов, при этом указанная репликация не является неограниченной и остается ниже такого порогового уровня, который не вызывает заболевания у пациента. Вирусы класса 4 также обладают способностью инфицировать клетки, но такая инфекция не может распространяться до значительного уровня, вследствие того, что вызывавший ее вирус является не компетентным по репликации. Вирусы класса 4 являются генетически модифицированными так, что они не могут существовать в природе. Кроме того, инфицирование вирусами класса 4 никогда не приводит к персистентной виремии. Вирусы класса 4 не способны реплицироваться на уровне, превышающем пороговый уровень, даже если этот пороговый уровень является минимальным (например, оптимальным в in vitro-условиях). Из-за ограниченной природы своей инфекционности вирусы класса 4 должны быть представлены лимфоидным тканям для продуцирования протективного иммунного ответа. Важно отметить, что вирусы класса 4 сконструированы таким образом, что их ускользание от иммунного надзора и восстановление вирулентности является невозможным, в отличие от вирусов класса 2 и класса 3. Ниже приводится более подробное объяснение продуцирования и использования вирусов класса 4. Это может быть достигнуто с помощью собственного элемента промотора/энхансера вируса, либо эти элементы могут быть заменены более сильным энхансером (например, энхансерами CMV, SV40) в целях стимуляции экспрессии генов в трансдуцированных клетках. Это осуществляется для максимизации количества вирусных частиц, продуцированных в трансдуцированных клетках, что приводит к более сильному первичному и вторичному представлению антигена. 18 Пример 2. Дефектные по интегразе ретровирусы. В случае использования ретровирусов (например, HTLV, ВИЧ) для снижения патогенности и увеличения безопасности, аттенуированный вирус предпочтительно выбирают так, чтобы он был дефектным по интеграции. Использование такого мутантного вируса в настоящем изобретении имеет важное значение, поскольку,как сообщалось, в настоящее время, не существует такого ретровируса, который был бы патогенным, но при этом не способным к интеграции. Sakai et al., (1993) J.Virol. 67 (3):1169-1174. Однако дефектный по интегразе вирус может экспрессировать все вирусные белки в нативной форме, за исключением модифицированной интегразы (которая также может представлять эпитопы). Stevenson et al., (1990)J.Virol. 64(5):2421-2453. С использованием дефектных по интегразе вирусов, генетическая информация может быть со временем утеряна при клеточном делении, гибели клеток и при иммунном ответе пациента. Ослабление вируса должно быть вполне достаточным во избежание вирусной мутации или других модификаций. В частности, для достижения желаемой потери компетенции по репликации достаточно точковой мутации (Cara etal., [1995] Virology 208:242-248), однако, это не является предпочтительным из-за риска мутирования вируса с последующей регенерацией функционального пептида. Поэтому предпочтительной является такая мутация гена, которая включает инсерцию или делецию, по крайней мере, трех пар оснований, а более предпочтительно, по крайней мере, 100 пар оснований,при условии, что будет сохранен желаемый уровень репликации. Дефектные по репликации вирусы, имеющие частично или полностью разрушенную интегразу, могут быть сконструированы различными путями.(а) В предпочтительном варианте осуществления изобретения, ген интегразы является 3'делегированным или, по крайней мере, делетированным в области, близкой к 3'-концу, для помещения 3'-конца за пределы рамки считывания, для того, чтобы генерировался усеченный белок интегразы. Если для протективного иммунного ответа требуется также экспрессия в инфицированных клетках-мишенях, то предпочтительной является мутация вне рамки, которая разрушает 3'-конец интегразы. Эта мутация позволяет удалить активный центр интегразы, а также ДНК-связывающий сайт, а поэтому, белок интегразы не будет связываться с неинтегрированной ДНК, что будет обеспечивать экспрессию гена и продуцирование белка после инфицирования клеток-мишеней. См., Саrа et al.,[1995] Virology 208:242-248; Stevenson et al.,(1990) J.Virol. 64(5): 2421-2453. Полученный в результате этого вирус класса 4 не будет интег 19 рироваться после инфицирования, но будет способен экспрессировать ограниченное количество вирусных белков в инфицированных клетках. Следовательно, репликация этого вируса будет самоограничивающей, т.е. после нескольких циклов, даже в оптимальных условиях, репликация вируса класса 4 будет прекращена. Эта стратегия позволяет генерировать высокий уровень представления первичного антигена в трансдуцированных клетках, а также высокий уровень представления вторичного антигена инфицированных клеток благодаря экспрессии вирусного гена, которая является оптимальной для генетической иммунизации. Аналогичное ослабление вируса может быть использовано в случае других ретровирусов и онкоретровирусов.al., [1995] J.Virol. 66(12):7414-7419; Sakai et al.,(1993) J.Virol. 67(3):1169-1174; Wiskerchen,M.,M.A. Muesing (1995) J.Virol. 69:376-386),приводит к продуцированию вирусов, являющихся дефектными по репликации и интеграции. Эти вирусы класса 4 способны инфицировать клетки, но не способны к эффективной экспрессии белка после инфицирования клетокмишеней. Использование этих вирусов для генетической иммунизации приводит к эффективному представлению первичного антигена, а также представлению вторичного антигена,обусловленному инфекцией. Однако ожидается,что представление вторичного антигена инфицированными клетками будет менее эффективным, чем клетками, которые были инфицированы и которые экспрессируют вирусные белки(c) Для продуцирования негативных по интегразе ретровирусов также может быть использована 5'-делеция гена интегразы. Однако 5'делеции генерируют очень нестабильный белок. Поскольку ретровирусная интеграза продуцируется из полипротеина-предшественника вместе с обратной транскриптазой, то очевидно, что этот предшественник также будет нестабильным. Нестабильность этого белка может снижать эффективность продуцирования вируса трансдуцированными клетками, а, следовательно, она может влиять на эффективность генетической иммунизации.(d) Другим способом продуцирования ВИЧ-1 класса 4, который не способен к интеграции, является делеция гена vpr. Vprдефектные мутанты могут реплицироваться лишь в ограниченных пределах в первичных лимфоцитах человека, но не в макрофагах, поскольку продукт гена vpr является очень важным для интеграции. В литературе (см. работы, цитированные в Саrа et al., [1995] Virology 208:242-248) было описано несколько мутантов по интегразе, которые не способны интегрироваться, а поэтому 20 не способны реплицироваться. Поскольку эти вирусы способны инфицировать клетки, то они могут быть предпочтительно классифицированы как вирусы класса 4. Так, например, Саrа и др. описали негативный по интегразе ВИЧ-1,который имеет точковую мутацию и может реплицироваться в ограниченных пределах в первичных макрофагах человека, но не в Т-клетках. Однако как было описано выше, предпочтительный вариант настоящего изобретения включает делеционный мутант (но не точковый мутант, который является менее безопасным), способный к самоограничивающей репликации в иммунных клетках (макрофагах, дендритных клетках или Т-клетках). По сравнению с предыдущими методами, этот вариант является преимущественным, вследствие того, что аттенуированный вирус не может быть реверсирован с восстановлением дикого типа. Кроме того, в литературе ничего не сообщается о росте в дендритных клетках вируса, являющегося либо дефектным по репликации, либо дефектным по интегразе. Аналогично, самоограничивающая репликация нового вируса в дендритных клетках является новой отличительной характеристикой вирусов класса 4, используемых в настоящем изобретении. И, наконец, в литературе не описаны мутантные вирусы класса 4, которые при их экспрессии в лимфоидных органах способны генерировать иммунный ответ. Пример 3. Gag-дефектные ретровирусы. Примерами дефектных по репликации ретровирусов, которые могут стимулировать протективный иммунный ответ в соответствии с настоящим изобретением, являются gagдефектные вирусы. Gag процессируется вирусной протеазой с образованием нескольких структурных белков. При генерировании делеционных мутаций в капсидном домене гена gag прекращается образование зрелой частицы, но экспрессия гена сохраняется. Трансдоминантный gag-мутант ВИЧ-1 описан Тrоnоet al., (1989) Cell, 59:113-120. Однако ранее не было высказано каких-либо предположений относительно использования этого мутанта, как это было сделано в настоящем изобретении. Этот вирус может инфицировать клетки, но не способен к репликации в клетках-мишениях. Кроме того, при инфицировании клеток, содержащих мутантный вирус, вирусом дикого типа,мутантный вирус может блокировать репликацию вируса дикого типа. В случае ВИЧ-1 инфицированных индивидуумов, продуцирование таких дефектных по репликации мутантных вирусов в лимфоидных органах в соответствии с настоящим изобретением будет не только генерировать иммунный ответ, но и также блокировать репликацию вируса дикого типа. Следовательно, вирусная нагрузка в лимфоидных органах инфицированных индивидуумов будет снижаться, что приведет к стимуляции иммунной системы. 21 Пример 4. Другие аттенуированные ретровирусы класса 4. Другими аттенуированными вирусами ВИЧ класса 4, которые могут быть использованы в настоящем изобретении, являются, но не ограничиваются ими, env-дефектные, дефектные по протеазе, rev-дефектные, pol-дефектные,tat-дефектные (Beale (1995) Lancet 345:13181319), и gp41-мутантные вирусы. Т-клеточный лимфотропный вирус человека типа 1 (HTLV-1) присутствует в течение многих лет у инфицированных индивидуумов,но в отличие от ВИЧ-1, только очень незначительная часть из них вызывает развитие заболеваний (Т-клеточный лейкоз или тропический спастический парапарез). У HTLV-1 имеется высокая степень гетерогенности внутренне изолированной последовательности, хотя вариабельность последовательностей этого вируса у разных пациентов достаточно мала по сравнению с ВИЧ-1. Геномная организация HTLV-1 аналогична ВИЧ, поэтому дефектный по интегразе HTLV-1 может быть сконструирован любым специалистом по молекулярной вирусологии, в соответствии с описанием, приведенным выше для ВИЧ. Кроме того, для генерирования вируса класса 4; могут быть модифицированы другие гены, такие как gag, pol, env, rex и tax. Несмотря на некоторые различия, все интегразные белки ретровирусов имеют одинаковые структуры и домены. Поэтому для конструирования других ретровирусов, включая не только ВИЧ-2 иHTLV-1 S1, но также и вирус коровьего лейкоза,вирус лейкоза кошек, вирус иммунодефицита кошек и т.п. могут быть использованы те же методы, что и для ВИЧ-1. Пример 5. Другие аттенуированные вирусы класса 4. Вирусами, которые могут быть ослаблены с получением модели класса 4, но которые не относятся к ретровирусам, являются вирусы герпеса, вирусы гриппа и вирусы коровьей оспы(VV). Эти вирусы необходимы для получения вирусов класса 4 в целях использования их в иммунной терапии. Так, например, до настоящего времени, все усилия по созданию вакцины на основе аттенуированного респираторносинцитиального вируса оказались безуспешными. HSU et al., (1995) Vaccine 13 (5):509-515. Хотя HSU и др., очевидно, разработали термочувствительный аттенуированный вирус, однако, этот вирус остался генетически неохарактеризованным. Лучший метод конструирования вируса класса 4 обсуждался выше. Обычно РНК-вирусы класса 4 могут быть сконструированы путем модификации гена полимеразы. Biswas et al., (1995) J. Virol. 68:18191826 продемонстрировали, что вирусные полимеразы содержат четыре консервативных мотива, которые имеют важное значение для функции связывания с праймером. Генетическая мо 002020 22 дификация одного или нескольких из этих доменов приводит к разрушению полимераз в РНК-вирусах, включая вирусы гриппа, ретровирусы, вирусы дрожжей 1-А, и полиовирусы; а поэтому потомство этих вирусов является не компетентным по репликации. Герпесвирусами, которые могут быть аттенуированы для использования их в целях генетической иммунизации, являются вирусы простого герпеса (HSV), вирус псевдобешенства, и альфагерпесвирус. В частности, Cheung и сотрудники разработали не компетентный по репликации вирус, который является лишь слабоинфекционным у свиней. Ослабление этого вируса было осуществлено путем делеции ДНК,кодирующей части двух генных продуктов: ранний белок (ЕРО) и крупный латентный транскрипт (LLT). Cheung et al., (1995)Am.J.Vet.Res. 55 (12):1710-1717. Аналогичным образом, Farrell и сотрудники разработали аттенуированный живой вирус простого герпеса человека типа 1, способный лишь к одному циклу репликации, а поэтому, у этого вируса отсутствует патогенный потенциал. Этот аттенуированный вирус не содержит главного гликопротеина Н(gН), и не может размножаться в клеточной линии, которая обеспечивает прохождение gН через мембрану. Для осуществления иммунизации этот вирус должен быть размножен in vitro, а затем его инокулируют соответствующему животному. Farrell etal., (1994) J.Virol. 68:927-932. В соответствии с изобретением, изложенным в настоящем описании, ДНК, кодирующая либо вирус, не содержащий дН, либо предпочтительно gНдефектный вирус, может быть введена в клетки,мигрирующие в лимфоидные органы, где один цикл репликации приводит к тому, что почти целый вирус преимущественно представляется иммунной системе. Альтернативно, для получения вакцины,ученые проводили исследования по разработке других дефектных по репликации вирусов простого герпеса типа 1 человека. Так, например,Morrison et al., (1994) J.Virol. 68(2):689-696, использовали дефектный по репликации HSV(класса 4), несущий в основном, гены, кодирующие белок 8 инфицированной клетки (ICP8) или ICP27. Мыши были иммунизированы высокой дозой мутантного вируса путем инокуляции в хвостовую вену. Хотя эти вирусы продуцировали иммунитет у мышей, однако, такой тип иммунизации не дает защиту от высокого уровня репликации вируса в глазах и в ганглии тройничного нерва. В соответствии с настоящим изобретением, ДНК, кодирующую HSV класса 4, вводят в клетки, мигрирующие в лимфоидные органы, где репликация вируса и представление антигена должны индуцировать сильный антивирусный иммунитет. Аналогично этим примерам, исходя из схожести последовательностей и функциональ 23 ной схожести герпесвирусов, другие герпесвирусы могут быть также превращены в вирусы класса 4 и продуцированы в лимфоидных органах. Так, например, недавно было продемонстрировано продуктивное инфицирование вирусом HHV-8 (KSHV) в клетках саркомы Капоши(КS-клетках) (классические, пост-трансплантационные и СПИД-ассоциированные клетки), что подтверждало эпидемиологические данные инфекционной этиологии КS. В соответствии с настоящим изобретением генетическая иммунизация вирусом HHV-8 класса 4 может быть использована для продуцирования иммунитета против саркомы Капоши. Другими примерами герпесвирусов являются цитомегаловирус человека (HCMV), инфекция которого вызывает многочисленные клинические синдромы у индивидуумов с ослабленным иммунитетом, некоторые из которых представляют угрозу для жизни. Эти инфекции могут пересекать плаценту и инфицировать плод в матке, что приводит к врожденным дефектам новорожденных. Генетическая иммунизация вирусом HCMV класса 4(который может быть получен путем делеции генов, ответственных за репликацию ДНК, например, генов рибонуклеотид-редуктазы, тимидин-киназы, полимеразы), может быть использована для генерирования иммунитета против этих заболеваний. Папилломавирусы представляют собой мелкие опухолевые ДНК-вирусы, которые ассоциируются с эпителиомами, чешуйчатоклеточными папилломами, или фибропапилломами, в зависимости от хозяина и конкретного типа папилломавируса. Несмотря на кодированный онкоген с сильной трансформирующей активностью, папилломавирусы обычно индуцируют дискретную эпителиальную гиперплазию,которая продолжается в течение многих месяцев или лет. Лишь случайные изменения в доброкачественных поражениях, индуцированных папилломавирусами, могут приводить к прогрессивному росту этих доброкачественных опухолей или к их перерождению в злокачественные опухоли (Howel et al., [1988] Am.J.Med. 85:155158). Иногда, но редко, папилломы подвергаются спонтанной регрессии (Kreider et al., [1968]Cancer Res., 23:1593-1599), что свидетельствует о том, что иммунная система может распознавать инфицированные клетки. Так, например,инфицированные папилломавирусом эпителиальные клетки не могут индуцировать стерилизующий иммунный ответ. Рассматриваемое в данном описании изобретение позволяет решить эту проблему путем продуцирования мутантных папилломавирусов в лимфоидных органах, в которых может быть генерирован сильный иммунный ответ. Кроме того, недавние исследования продемонстрировали, что продукт, кодированный геном вируса Е 1, играет важную роль для синтеза ДНК в коровьем папилломавирусе 24 69:2341-2350). Таким образом, для генетической иммунизации, BPV класса 4 может быть сконструирован путем мутации гена Е 1 и делеции трансформирующих онкогенов. Другие вирусы, используемые в современных методах получения вакцин с ограниченным эффектом, могут дать больший эффект, если они будут направлены в лимфоидные органы,как описано выше. В частности, не компетентные по репликации поксвирусы, используемые в субъединичных вакцинах, продуцируют незначительный эффект или вообще не дают эффекта. Однако широкий круг хозяев и способность экспрессировать множество генов позволяет получить вектор на основе вируса коровьей оспы, подходящий для иммунизации. Прямая инокуляция таких вакцин в кожу не генерировала репродуцируемого протективного или эффективного иммунного ответа. Так, например, Gallimore и др. сообщали о иммунизации обезьян рекомбинантным вирусом коровьей оспы, несущим ген SIV ([1995] Nature Medicine 1:11671173). Несмотря на трехкратное введение высоких количеств вируса коровьей оспы путем скарификации, идентично иммунизированные животные обнаруживали различные уровни ЦТЛответа. Поэтому протективная иммунизация не может быть достигнута таким способом. Введение этих вирусов в клетки, мигрирующие в лимфоидные органы, и продуцирование этих вирусов будет способствовать усилению иммунного ответа. Этот рекомбинантный вирус может содержать ген, например, опухолевого антигена, который будет генерировать, например, противоопухолевый иммунный ответ. Этот механизм аналогичен механизму, описанному выше для ВИЧ, но является гораздо сильнее,поскольку вирус коровьей оспы инфицирует все типы клеток; а поэтому он может генерировать еще и вторичные АРС. Таким образом, в этом случае будет генерироваться иммунный ответ против коровьей оспы, а также против чужеродного антигена (или антигенов), клонированных в вектор, полученный на основе вируса коровьей оспы. Нереплицирующиеся векторы на основе поксвирусов были уже созданы, но они не могут быть использованы в настоящем изобретении. См., Radaelli et al., (1994) Vaccine 12:1110-1117; Tartaglia et al., (1992) Virology 188:217-232; Taylor et al., (1991) Vaccine 9:345358. Вирусы дикого типа, которые не способны продуктивно инфицировать клетки в лимфоидных органах также относятся к вирусам класса 4, в том случае, если их продуцирование ограничено в лимфоидных органах. Экспрессия гена из трансдуцированной ДНК этих вирусов также может приводить к продуцированию нужного иммунного ответа в отсутствии патогенности. Однако из соображений безопасности следует отдавать предпочтение вирусам, являющимся не 25 компетентными по репликации на молекулярном уровне. Пример 6. Комбинация аттенуированного вируса класса 4 и цитокинов. ДНК, кодирующая вирус класса 4, может быть сконструирована так, что помимо генетического материала, кодирующего аттенуированный вирус, будет экспрессироваться, по крайней мере, один ген, кодирующий иммуномоделирующую молекулу. Это позволит создать комплекс вирус/цитокин-продуцирующая клетка. Примерами цитокинов, которые могут быть использованы для усиления иммунного ответа или направления конкретного иммунного ответа в соответствующие ткани, являются, но не ограничиваются ими: IL-1, IL-2, IL-3, IL-4, IL-6, IL7, IL-12, IL-15, IL-16, TNF, GM-CSF, IFN и хемокины, такие как RANTES и МlРl. См., например, Dranoff et al., (1993) Proc.Natl.Acad.Immunol. Today 16 (5):220-223; Cocchi et al.,[1995], Science (Dec. 1995), и работы, цитируемые в этих статьях. В случае заболеваний, вызываемых ретровирусами (например, HTLV-1 и ВИЧ), особенно предпочтительно, чтобы дефектный по репликации вирус продуцировался вирус-продуцирующими клетками в лимфоидных органах. Так,например, ВИЧ-1, ВИЧ-2, FIV или SIV могут инфицировать в лимфоидных органах CD4+-Tклeтки, макрофаги и дендритные клетки. После интернализации и обратной транскрипции конструкции на основе вируса класса 4, лимфоидные клетки-мишени будут поддерживать лишь минимальную репликацию дефектного вируса. Таким образом интактные ретровирусы в цитокин-богатых лимфоидных органах будут индуцировать иммунный ответ против вирусных антигенов. Точная природа иммунного ответа может быть модулирована в соответствии с настоящим изобретением, исходя из природы вирус-продуцирующих клеток и характера цитокинов, присутствующих в лимфоидных органах. Поэтому на природу иммунного ответа может повлиять совместное введение гена цитокина в вирус-продуцирующие клетки. Следовательно,эти клетки продуцируют в лимфоидных органах аттенуированные вирусы вместе с цитокинами,стимулируя тем самым типоспецифический иммунный ответ против вируса. Так, например,был клонирован и экспрессирован in vitro ген,кодирующий IL-12. Было показано, что дендритные клетки, продуцирующие IL-12, усиливают генерирование IFN-продуцирующих Thlклеток из CD4+-T-клeтoк. Маса tonia et al.,(1995) J. Immunol., 154:5071-5079. Для клонирования гена IL-12 в ДНК, кодирующую вирус класса 4, описанный выше, так, чтобы клетки, 002020 26 трансдуцированные этой ДНК, также экспрессировали IL-12, может быть использована стандартная техника. Экспрессия IL-12 вместе с вирусом класса 4 в лимфоидных органах также приводит к усилению последующего иммунного ответа с участием Th-клеток. Эта техника может быть применена к любому клонированному гену цитокина, как указано выше. Кроме того, было предложено (Schmidt-Wolf (1995) Immunol. Today, 16(4):173-175), перенести гены, кодирующие цитокины, в лимфоциты и опухолевые клетки, и, с точки зрения настоящего изобретения, эта комбинация гена цитокина с вирусом класса 4 и его продуцирование в лимфоидных органах даст даже большее преимущество как способ усиления генетической иммунизации. Пример 7. Комбинация аттенуированного вируса класса 4 с опухолевыми антигенами. Как было описано выше, настоящее изобретение может быть использовано для продуцирования антивирусного иммунного ответа. В другом своем аспекте, настоящее изобретение относится к комбинации ДНК, кодирующей аттенуированный вирус, и опухолевый антиген. Поскольку генетическая иммунизация приводит к индуцированию сильного иммунного ответа против антигенов, экспрессированных в лимфоидных тканях, иммунный ответ может быть также направлен на чужеродные антигены,встроенные в вирус класса 4. Все опухолевые клетки экспрессируют гены, продукты которых необходимы для злокачественного перерождения. Даже после трансформации причиной образования опухолей часто является неэффективный иммунный ответ. Также хорошо известно, что эффективный противоопухолевый ответ может приводить к регрессии опухоли. Было продемонстрировано, что опухолевые клетки,экспрессирующие антигены, индуцируют иммунный ответ у хозяина, в моделях животных и у пациентов, страдающих раком. См., например,Abbas et al., см. выше, стр. 357-375. Поэтому вирусы класса 4 могут быть использованы для продуцирования антивирусного ответа, который, в свою очередь, будет обеспечивать противораковую иммунизацию. Примерами таких антигенов являются: MAGE-1, которые в 50% случаев вызывают меланому и в 25% случаев карциному молочной железы человека; р 21rasбелки с точковой мутацией в положении 12,которые в 10% случаев вызывают карциномы человека; р 21 продукт реаранжировки геновbcl/abl, который вызывает хронический миелоидный лейкоз; продукты гена папилломавирусов человека Е 6 и Е 7, вызывающие карциному матки; и продукт гена EBNA-1 EBV, вызывающий лимфому Беркитта и назофаренгиальную карциному. Два более подробно охарактеризованных ассоциированных с раком антигена представляют собой альфа-фетопротеин и карциноэмбриональный антиген. Недавно Grabbe и др. сообщили, что дифференцированное пред 27 ставление опухолевых антигенов антигенпредставляющими клетками может иметь важное значение для эффективности противоопухолевого иммунного ответа. (Grabbe et al., [1995]Immunol. Today, 16(3):117-121). В предпочтительном варианте осуществления изобретения дендритные клетки, трансдуцированные ДНК, кодирующей вирус класса 4, генерируют эффективный иммунный ответ. ДНК, кодирующая вирус класса 4, может быть также сконструирована так, чтобы она экспрессировала один или несколько опухолевых антигенов. В соответствии с этим, клетки, экспрессирующие и представляющие антигены в лимфоидных органах, помимо иммунного ответа против аттенуированного вируса, будут продуцировать у хозяина эффективный иммунный ответ против опухоли, несущей указанные антигены. Гены цитокинов, также клонированные в вирусы класса 4 вместе с опухолевым антигеном, могут воздействовать на иммунный ответ и усиливать его. Одним из примеров вирусов класса 4, которые могут содержать опухолевые антигены, является рекомбинантный вирус коровьей оспы. Этот вирус легко поддается модификациям, проводимым для эффективной экспрессии чужеродных генов, и, кроме того, благодаря своему широкому тропизму, этот вирус позволяет генерировать не только первичные антиген-представляющие клетки, но также и вторичные антиген-представляющие клетки. Другим примером может служить использование негативного по интегразе вируса ВИЧ. В этом вирусе белок гена nef является ранним высокоэкспрессируемым белком. Введение опухолевого антигена в открытую рамку считыванияnef и/или в делетированную интегразу может приводить не только к антивирусному, но и также к противоопухолевому иммунному ответу. Пример 8. Трансдуцированные клетки. Вирус-продуцирующие клетки настоящего изобретения являются предпочтительно трансдуцированными клетками. Трансдуцированные клетки несут ДНК, кодирующую аттенуированный вирус класса 4, и, помимо вирусной ДНК,необязательно генетический материал, кодирующий цитокин(ы) и/или опухолевый антиген(ы), и направляют в лимфоидные органы, где экспрессируется указанная ДНК, кодирующая аттенуированный вирус, цитокин, и/или опухолевый антиген. ДНК, кодирующую цитокин и опухолевый антиген, предпочтительно вводят в вирус для генерирования вторичных антигенпредставляющих или цитокин-продуцирующих клеток. Однако это не является необязательным. ДНК, кодирующая цитокин или опухолевый антиген, может быть также введена в вируспродуцирующие клетки на отдельной независимой плазмиде. Кроме того, вирус-продуцирующие клетки могут быть смешаны с цитокинпродуцирующими клетками в целях достижения 28 того же самого эффекта усиления иммунного ответа. В предпочтительном варианте осуществления изобретения клетками, трансдуцированными любым из вышеуказанных аттенуированных вирусов, включая, например, дефектные по интегразе или дефектные по репликации вирусы, являются клетки лимфоидных органов или клетки, которые предпочтительно мигрируют в лимфоидные органы. Трансдукция этих клеток является особенно предпочтительной, потому что лимфоидные органы представляют собой главный участок индуцирования природного иммунитета хозяина против вирусных инфекций. В особенно предпочтительном варианте осуществления изобретения трансдуцированными клетками являются дендритные клетки. Однако в качестве вирус-продуцирующих клеток в лимфоидной ткани могут быть использованы несколько других типов клеток. Клетки,которые могут быть использованы в качестве вирус-продуцирующих клеток, более подробно обсуждаются в нижеприведенных примерах. Пример 9. Аутологичные или сингенные дендритные клетки или клетки Лангерганса. Клетками-продуцентами вируса класса 4 являются предпочтительно дендритные клетки(в большинстве своем присутствующие в лимфатических узлах и селезенке), продуцированные путем введения ДНК, кодирующей аттенуированный вирус; или клетки Лангерганса(обнаруженные в эпидермисе), которые происходят от костного мозга и являются исключительно эффективными клетками, представляющими антигены хелперным CD4+-T-клеткам,цитотоксическим CD8+-T-клеткам и необученным Т-клеткам. Grabbe et al., (1995) Immunol.Today, 16 (3):117-121. Клетки Лангерганса способны мигрировать из кожи в лимфоидные органы. Abbas et al., см. выше, с. 124. Кроме того,Thomson и др. ([1995] Transplantation, 59:544551) показали, что культивированные in vitro дендритные клетки обнаруживают хомингэффект с миграцией в лимфоузлы и селезенку,где они находятся, по крайней мере, в течение двух месяцев. Дендритные клетки действительно являются профессиональными антигенпредставляющими клетками. Кроме того, чужеродный белок, представленный дендритными клетками, может генерировать ЦТЛ-ответ(Rouse et al., [1994] J.Virol. 68:5685-5689), который является преимущественным в отношении окончательной и полной элиминации инфицированных клеток, продуцирующих вирусный антиген. Дендритные клетки могут быть выделены из костного мозга, периферической крови, пуповинной крови, и из других органов с использованием хорошо известной техники. Недавно был описан простой способ продуцирования дендритных клеток с использованием колоние 29 стимулирующего фактора гранулоцитовмакрофагов (GM-CSF) + IL-4 (Romani et al.,[1994] J.Exp.Med., 180:83-93; Sallusto et al.,[1994] J.Exp. Med., 179:1109-1118). Таким образом, в предпочтительном варианте осуществления изобретения используются дендритные клетки, которые несут аттенуированные вирусы класса 4 в лимфоидные органы. Эти клетки могут быть выделены, трансдуцированы ДНК, кодирующей аттенуированный вирус, и снова введены хозяину. ДНК, кодирующая аттенуированный вирус, такой как, 3'делетированный дефектный по интегразе вирус,описанный выше, может быть введена в дендритные клетки способами, описанными в примерах 13 и 14. Пример 10. Аллогенные дендритные клетки. В соответствии с настоящим изобретением аллогенные дендритные клетки, выделенные,например, из пуповинной крови, могут быть также введены с целью создания вируспродуцирующих клеток. Это позволяет осуществлять трансплантацию антиген-продуцирующих клеток в отсутствие реакции трансплантант против хозяина. Аллогенные клетки могут быть легко получены с использованием стандартной техники, хорошо известной каждому специалисту. ДНК, кодирующую аттенуированный вирус, вводят в аллогенные клетки методами, описанными ниже в примерах 13 и 14. Пример 11. Фибробласты. Фибробласты могут быть также трансдуцированы аттенуированным вирусом класса 4 настоящего изобретения с целью создания вирус-продуцирующих клеток. Специалистам известно, что фибробласты могут быть использованы для индуцирования Т-клеточного ответа,поскольку они могут нести и эффективно представлять антиген в лимфоидных органах (Kundig et al., [1995] Science 268:1343-1347). Фибробласты могут быть легко получены способами, хорошо известными специалистам, и трансдуцированы методами, описанными ниже в примерах 13 и 14. Пример 12. Аллогенные или ксеногенные клетки. В соответствии с настоящим изобретением трансдуцированные клетки несут ДНК, кодирующую вирус класса 4 в лимфоидные органы,и продуцируют вирус. Этот свободный вирус в лимфоидных органах стимулирует представление антигена иммунными клетками и продуцирование иммунного ответа. Следовательно,трансдуцированные клетки распознаются иммунной системой как инфицированные клетки и элиминируются независимо от того, являются ли эти клетки аутологичными или аллогенными. Это различие может сказываться только на скорость элиминации. В случае эффективного продуцирования вируса и презентации антигена,трансдуцированные клетки могут стимулиро 002020 30 вать достаточный иммунный ответ в более короткий период времени. В случае, если трансдуцированная клетка сама не способна действовать как первичная АРС, то продуцированный вирус может действовать как свободный антиген, и инфицированные клетки могут функционировать как вторичные АРС. Могут быть продуцированы большие количества аллогенных или даже ксеногенных трансдуцированных клеток, и их аликвоты могут быть использованы для генетической иммунизации всех индивидуумов. При этом для каждого специалиста очевидно, что помимо клеток, обсуждаемых выше,для продуцирования вируса или вируса/цитокина(нов)/опухолевого(вых) антигена(нов) в лимфоидных органах в качестве вирус-продуцирующих клеток могут быть также использованы и другие клетки для введения аттенуированных вирусов класса 4 непосредственно в лимфоидные органы в целях достижения преимуществ настоящего изобретения, описанных в данной заявке. Пример 13. In vitro-трансдукция и введение трансдуцированных клеток. Генетический материал вводят в соответствующие клетки с целью их трансформации в вирус- или вирус/цитокин-продуцирующие клетки. Соответствующие клетки получают методами, хорошо известными каждому специалисту. Эти клетки могут быть получены от подвергаемого лечению пациента как аутологичного источника. Представление антигенов в ассоциации с МНС и ко-стимулирующими молекулами приводит к усилению клеточноопосредованного ответа. Клетки от разных индивидуумов или разных видов могут быть отобраны для трансдукции неродственному пациенту, поскольку вирус класса 4 продуцируется из трансдуцированных клеток, которые могут инфицировать клетки-хозяева пациента, которые затем представляют антиген в ассоциации с МНС хозяина и ко-стимулирующими молекулами. Поэтому эти ксеногенные инфицированные клетки могут также осуществлять перенос вирусной ДНК в лимфоидные ткани.In vitro-перенос ДНК, кодирующей вирусы класса 4, может быть осуществлен, например,путем инфицирования, электропорации, путем использования липосом, виросом, комплексов ДНК-полилизин-аденовирус или путем использования полиэтиленимина. Эти методы хорошо известны любому специалисту. Так, например,методы с использованием липосом для доставки генетического материала в специфические клетки были подробно описаны в WO 92/06677(Schreier et al., [1992]). Альтернативно, для эффективной трансдукции ДНК в клетки и для продуцирования вирусов класса 4 могут быть использованы вирусы (например, вирусы коровьей оспы или поксвирусы), способные к абортивной инфекции (более чем один цикл). 31 В соответствии с настоящим изобретением, вирус-продуцирующие клетки, такие как трансдуцированные клетки, могут быть введены человеку или животному путем:(a) Внутриселезеночной инъекции. Этот способ является предпочтительным, поскольку он приводит к наибольшей вероятности получения трансдуцированных клеток, достигающих лимфоидные органы.(c) Прямой инъекции в миндалины, что также является предпочтительным методом,поскольку миндалины являются доступным лимфоидным органом.(d) Внутривенной инъекции. Доза зависит от количества вируса, продуцируемого вируспродуцирующими клетками. Для усиления иммунного ответа может быть использовано повторное введение вирус-продуцирующих клеток.(g) Внутримышечной инъекции. На практике, оптимальное число клеток,которое должно быть инъецировано, и повторная инъекция должны быть определены в расчете на конкретного пациента, и исходя из генерируемого иммунного ответа. Такое определение может быть легко осуществлено любым специалистом в соответствии с настоящим описанием. Пример 14. In vivo-трансдукция. В соответствии с настоящим изобретением, ДНК, кодирующая аттенуированный вирус в ассоциации с опухолевым антигеном или генами цитокинов, или в их отсутствие, может быть введена в клетки для их трансдукции и миграции в лимфоидную систему путем:(a) Прямой инъекции ДНК. После внутримышечной, внутриселезеночной, интратонзиляторной или внутрикожной инъекции плазмидной конструкции, ДНК захватывается клетками, которые становятся вирус- или вирус/цитокин-продуцирующими клетками в лимфоидных органах. D.Weiner 1995) AidsResearchHuman Retroviruses 11(1):S136) продемонстрировали, что внутримышечно инъецированная ДНК экспрессирует и генерирует иммунный ответ. ДНК, введенная таким образом в дендритные клетки, находится возле участка инъекции, и может быть транспортирована и экспрессирована в лимфоидных органах. В соответствии с настоящим изобретением для достижения оптимального представления антигена,прямая инъекция ДНК может быть осуществлена предпочтительно в область, загруженную дендритными клетками, например, в миндалины или селезенку.(b) Инъецирования липосом или виросом,содержащих ДНК. Виросомы и липосомы могут быть использованы для доставки ДНК в дендритные клетки. При этом предпочтительной(c) Прямой внутриселезеночной инъекции поксвирусов класса 4, которая может способствовать абортивной инфекции клеток человека. ДНК может быть доставлена in vivo непосредственно в антиген-представляющие клетки путем инфицирования, и вирусные частицы будут продуцироваться в лимфоидных органах.(d) С использованием ректальных или вагинальных суппозиториев, несущих, например,ДНК, липосомы или виросомы, что может быть особенно предпочтительным методом доставки ДНК, кодирующей конструкции класса 4, в клетки, мигрирующие в лимфоидные органы. Кроме того, применение суппозиториев позволяет избежать необходимости использования стерильных игл или медицинской аппаратуры и проводить антивирусную терапию в отсутствие соответствующих условий, например, в развивающихся странах. См., Marlink et al., (1994)Science 265:1587-1590. Пример 15. Генетическая иммунизация для предупреждения и лечения болезней. Генетическая иммунизация, проводимая в соответствии с настоящим изобретением, приводит к индуцированию сильного иммунного ответа против антигенов, продуцируемых в лимфоидных органах; поэтому генетическая иммунизация настоящего изобретения может быть использована для предупреждения и лечения заболеваний, таких как вирусные инфекции и рак. Кроме того, аттенуированные, дефектные по репликации и/или дефектные по интеграции вирусы, используемые для генетической иммунизации, имеют существенные преимущества,поскольку они не могут распространять инфекцию, не могут индуцировать экспрессию онкогена или приводить к разрушению гена в результате интеграции, а также не влияют на клетки, ответственные за репродукцию. В случае эпидемии, подобной эпидемии гриппа или СПИДа, для индивидуумов с высоким риском заболевания раком (например, раком молочной железы) использование генетической иммунизации в качестве предупредительных мер является особенно предпочтительным. В случае вирусных инфекций генетическая иммунизация предпочтительно генерирует длительный и перекрестно-реактивный иммунитет. Этого невозможно было достичь с использованием существующих кандидатов на вакцину,поскольку субъединичные вакцины часто не представляют антигены в нужных участках ткани либо в нужной конформации, и вероятность индуцирования перекрестно-реактивных Тклеток памяти очень мала. Хотя вакцины, полученные на основе живых аттенуированных вирусов, обеспечивают перекрестный иммунитет,однако, этот иммунитет вырабатывается лишь через несколько месяцев после иммунизации. 33 Изобретение, описанное в настоящей заявке, позволяет решить многие проблемы, связанные с изготовлением вакцины, путем обеспечения представления антигена в нужной конформации и на том участке, где должен генерироваться иммунный ответ. Следовательно, достигаемый иммунный ответ является продолжительным и перекрестно-реактивным. Кроме того, поскольку аттенуированный вирус продуцируется на том участке, где сконцентрированы иммунные клетки, то инфицирование фоновых (не отвечающих) клеток приводит к представлению антигена, которое обеспечивает не только индуцирование гуморального и клеточного ответа, но также индуцирование природного иммунитета (например, продуцирование природных клеток-киллеров и макрофагов) и генерирование растворимых факторов (например,цитокинов, интерферона, хемокинов). Т-клетки памяти, другие иммунореактивные клетки и растворимые факторы постоянно циркулируют в кровотоке и достигают кожи и слизистых оболочек, где они генерируют быстрый иммунный ответ на вирусные или опухолевые антигены. Кроме того, генетическая иммунизация против ВИЧ-1 может приводить к продуцированию длительного перекрестно-протективного иммунитета. Аналогично, аттенуированные вирусы могут быть использованы для вакцинации против других заболеваний, вызываемых ретровирусами, поскольку ретровирусы не могут реплицироваться при отсутствии способности к интеграции. Так, например, дефектный по интегразе вирус HTLV-1 может быть использован для вакцинации индивидуумов, инфицированных вирусом HTLV-2, который вызывает лейкоз и неврологические заболевания. Дефектные по интегразе ретровирусы могут быть также использованы для иммунизации кошек против FIV или коров против BLV. Генетическая иммунизация способом настоящего изобретения может также индуцировать иммунный ответ в тех случаях, когда патоген или заболевание уже имеются, а особенно этот способ эффективен для лечения в случае,когда иммунный ответ, индуцируемый патогеном или онкогеном, является неадекватным для элиминации инфицированных или опухолевых клеток. В случае ВИЧ-инфекции, терапевтический эффект генетической иммунизации зависит от того, насколько быстро продуцируется ответ после инфицирования. У пациентов с длительно не прогрессирующим заболеванием с низкой загрузкой вируса и интактными лимфоидными органами может наблюдаться выведение вируса после генетической иммунизации. В противоположность этому у пациентов с высокой вирусной нагрузкой и поврежденными лимфоидными органами может не вырабатываться терапевтический иммунитет. Организм этих пациентов должен быть, прежде всего, снова заселен клетками, генетически резистентными к инфекции, 002020 34 что может быть достигнуто путем введения антивирусного гена в стволовые клетки и/или периферические клетки (Lisziewicz et al., [1995]J.Virol. 69:206-212). Если иммунная система также способна к регенерации, то она будет автоматически элиминировать остаточные вирусы. Генетическая иммунизация может быть также использована в качестве терапии приHTLV-1-инфекциях, при которых лишь у небольшой части пациентов развивается заболевание. Способы генетической иммунизации настоящего изобретения могут быть также использованы для иммунотерапии опухолевых заболеваний. Современные методы позволяют создавать цитокин-богатое окружение путем трансфекции опухолевых клеток цитокинами или путем трансформации опухолевых клеток в антиген-представляющие клетки посредством их трансфекции ко-стимулирующими молекулами. Kundig и др. ([1995] Science 268:13431346) высказали предположение, что опухолевые клетки могут быть доставлены в лимфоидные органы, которые по своей природе являются цитокин-богатыми, для индуцирования в них протективного иммунного ответа. Настоящее изобретение обеспечивает генетическую иммунизацию против опухолей. Одним из ее применений является лечение опухолей, образуемых в результате вирусной инфекции (прямой или опосредованной). В этих случаях, вирусы могут быть генетически модифицированы с образованием вируса класса 4, а путем использования этих вирусов может быть осуществлена генетическая иммунизация в соответствии с настоящим изобретением. Настоящее изобретение может быть использовано для предупреждения и/или лечения опухолей, которые не являются результатом вирусной инфекции. Все опухоли экспрессируют гены, продукты которых необходимы для злокачественного перерождения. Во многих случаях уже идентифицированы гены, которые вызывают опухоли. Так, например, экспрессияMAGE-1 (антигена меланомы-1) вплоть до 50% случаев приводит к образованию меланомы и вплоть до 25% случаев к образованию карциномы молочной железы, но этот антиген не обнаруживается в нормальных тканях. Этот ген может быть введен в вирус класса 4 (например, в вирус коровьей оспы или ВИЧ), и трансдуцирован (или инфицирован с использованием поксвекторов, которые способны к абортивной инфекции клеток человека) в клетки, находящиеся в той области, где генерируется иммунный ответ против опухолевого антигена и вируса класса 4. Другие способы, используемые для генерирования иммунного ответа против опухолевого антигена, предусматривают трансдукцию плазмиды, экспрессирующей только опухолевый антиген, в клетки, однако, в этом случае,вторичный иммунный ответ (в результате ин 35 фицирования фоновых клеток) не был генерирован против опухолевого антигена. Цитотоксический Т-клеточный ответ, генерируемый благодаря такой генетической иммунизации,будет приводить к элиминации опухолевых клеток и клеток памяти, которые ответственны за иммунный надзор, направленный против данной опухоли. Для генетической иммунизации, осуществляемой в соответствии с настоящим изобретением, может быть использован любой вирус класса 4. Предпочтительно, чтобы вирус класса 4 имел соответствующий круг хозяев (тропизм) для инфицирования иммунных клеток в лимфоидных органах и для генерирования вторичных антиген-представляющих клеток. Для клинического использования были уже разработаны векторы, сконструированные на основе дефектного по репликации вируса коровьей оспы. Вирусы коровьей оспы класса 4 отличаются широким кругом хозяев и способностью к высокой степени экспрессии множества генов. Поэтому,в один такой вирус может быть введено несколько опухолевых антигенов, и этот вирус может генерировать иммунный ответ против различных опухолевых антиген-экспрессирующих клеток. Генерирование иммунного ответа против нескольких опухолевых антигенов имеет большое преимущество в случае, когда один вид опухоли может экспрессировать различные опухолевые антигены (например, лишь 50% меланом экспрессирует MAGE-1). Пример 16. Генетическая иммунизация против ВИЧ. Ниже приводится постадийное описание одного из предпочтительных вариантов осуществления способов настоящего изобретения. 1. Получение ДНК, кодирующей дефектный по интеграции ВИЧ-1 и SIV.(а) Делеции в гене интегразы проводили путем неспецифического мутагенеза для получения усеченной интегразы рандомизированным образом. Для подтверждения того, что потомство вируса является вирусом класса 4, и того, что клетки после их инфицирования способны экспрессировать ген и представлять антиген, может быть использована in vitroхарактеризация мутантных вирусов. При этом предпочтительно, чтобы делеция была генерирована вне рамки считывания в центральной части гена интегразы. На фиг. 2 А-2 В показан геном ВИЧ дикого типа, а в частности, ген белка интегразы, и пример аттенуированного гена интегразы, который экспрессирует вирус класса 4. В частности, эта мутация приводит к образованию усеченного гена белка интегразы, который начинается у 5'-конца, как и ген дикого типа, и заканчивается у первого стоп-кордона после делеции. Этот мутантный белок может иметь, например, длину, вдвое меньшую, чем длина интегразы дикого типа.(б) Нужная делеция в гене интегразы может быть продуцирована с помощью PCR (в присутствии корректирующего фермента). В качестве матрицы может быть использована ДНК, кодирующая провирусы ВИЧ или SIV. Для отжига гена интегразы в области желаемой делеции конструировали праймеры. Делеция может начинаться у 5'-конца от активного центра интегразы и кончаться у 3'-конца интегразы. Генерированный PCR-продукт представляет собой двухцепочечную ДНК, которую затем лигируют для получения кольцевой плазмиды с делегированным геном интегразы. ДНК подвергают PCR-амплификации или трансформации в микроорганизм, такой как E.coli или дрожжи. При использовании этой стратегии 3'-конец гена интегразы может быть элиминирован. Эта стратегия является предпочтительной, поскольку (а) эпитопы от 5'-конца интегразы представлены от трансдуцированных или инфицированных клеток, (b) деструкция центральной части интегразы приводит к делеции активного центра белка(что максимизирует безопасность из-за отсутствия интеграции), и (с) элиминация 3'-конца молекулы способствует снижению связывания интегразы с неинтегрированной ДНК. Поскольку взаимодействие белок-ДНК ингибирует экспрессию гена, то максимальная эффективность экспрессии гена в инфицированных клетках достигается путем усечения белка интегразы у 3'-конца. Подобное усечение интегразы было уже продемонстрировано (Саrа et al., (1995) Virology 208:242-248), однако, мутация по Саrа была точковой мутацией, которая является менее безопасной для генетической иммунизации человека. Кроме того, в работе Саrа и в других работах с использованием негативных по интегразе вирусов было проанализировано только продуцирование вируса в лимфоцитах и макрофагах, но не были охарактеризованы антигенпредставляющие свойства инфицированных клеток, которые являются ключевым элементом для генетической иммунизации. 2. In vitro-характеризация дефектных по интеграции вирусов и отбор вирусов класса 4 для генетической иммунизации.(а) Характеризация дефектных по интегразе вирусов класса 4. В одном из вариантов негативные по интегразе вирусные частицы продуцируются после трансфекции (СаРO4-способом) клеточных линий HeLa 293 или HeLa-Tat. Количество вирусных частиц может быть определено с помощью иммуносорбентного анализа методом захвата антигена р 24 или, в случае SIV,антигена р 27 (Immunotech). Затем эти вирусы используют для инфицирования активированных (РНА+ IL-2) первичных мононуклеарных клеток периферической крови человека (РВМС),первичных CD4+-T-клeтoк, первичных макрофагов и/или дендритных клеток, культивированных в оптимальных условиях для ВИЧ/SIVинфекции. Продуцирование и распространение 37 вируса может быть прослежено с помощью анализа методом антигенной ловушки и с помощью PCR. Представление антигена может быть определено с помощью анализа на Т-клеточную пролиферацию. Эти эксперименты были разработаны в целях достижения оптимальных условий для репликации вируса. Вирусы класса 4 либо не распространяют инфекцию, либо их репликация заканчивается после нескольких циклов. Предпочтительно, чтобы мутантные вирусы, которые продуктивно инфицируют клетки при этих оптимальных условиях больше не использовались для генетической иммунизации. Было также установлено могут ли эти инфицированные клетки представлять антигеныCD8+- и CD4+- ВИЧ-1-специфическим Тклеткам и необученным Т-клеткам. Если этот вирус может экспрессировать гены в отсутствие интеграции в инфицированных клетках, то будут активироваться ВИЧ-1-специфические клетки памяти. Инфицированные дендритные клетки могут представлять антигены и активировать необученные СD8+-Т-клетки и СD8+T-клетки памяти, а также представлять вирусные антигены CD4+-T-клеткам. Оптимальный дефектный по интеграции вирус будет инфицировать CD4+-T-клeтки, макрофаги и дендритные клетки, и экспрессировать вирусные гены в клетках-мишенях для представления антигена.(b) Трансдукция дендритных клеток человека. Дендритные клетки человека могут быть выделены из периферической крови, костного мозга и пуповинной крови. Эти клетки могут быть культивированы с GM-CSF и IL-4. Затем, в эти клетки может быть перенесена ДНК, кодирующая негативные по интегразе ВИЧ и SIV. Этот перенос может быть осуществлен путем электропорации, инфицирования, а также с использованием липосом, виросом и/или полиэтиленимина, и оптимальных условий для трансдукции. После трансдукции, продуцирование вируса может быть прослежено с помощью анализа методом захвата антигена р 24, а число вирус-продуцирующих клеток может быть определено с помощью иммунофлуоресцентного анализа. Как описано выше, может быть проанализировано представление антигена Тклеткам памяти и необученным Т-клеткам. В результате происходит сильная активация необученных Т-клеток и Т-клеток памяти трансдуцированными дендритными клетками.(c) Трансдукция лимфоцитов. Первичные СD4+-лимфоциты выделяли от нормальных людей-доноров, активировали РНА и культивировали с IL-2. Затем, в клетки вводили негативную по интегразе ДНК ВИЧ (например, путем электропорации или другими методами), и продуцирование вируса прослеживали с помощью анализа методом захвата антигена р 24. Этот эксперимент был использован для обеспечения большей гарантии того, что дефектные по интегразе вирусы не смогут обеспечивать продук 002020 38 тивную инфекцию. Аналогичные эксперименты были проведены с использованием SIV от клеток обезьян.(d) Трансдукция мышиных фибробластов и дендритных клеток. Негативная по интегразе ДНК ВИЧ-1 может быть трансдуцирована в дендритные клетки и фибробласты мышиного происхождения. Продуцирование вируса прослеживали с помощью анализа методом захвата антигена р 24. Этот эксперимент был использован для того, чтобы определить, способны ли мышиные клетки экспрессировать конкретный вирус класса 4.(е) Оценка иммунного ответа в гистокультуре миндалин человека. Культуры клеток миндалин человека могут быть использованы в качестве модели для изучения иммунного ответа человека. В настоящем изобретении этот метод является полезным в том случае, когда модель животного не может полностью имитировать характерную патологию ВИЧ-инфекции. Недавно был разработан метод культивирования тканей. (Glushakova et al., [1995] Nature Medicine 1:1320-1322), который подтверждает репликацию ВИЧ-1 в соответствии с настоящим изобретением. Негативная по интегразе ДНК ВИЧ-1 может быть трансдуцирована в аутологичные дендритные клетки, выделенные из периферической крови, как описано выше. Затем различные количества этих клеток вводили путем микроинъекции в блоки тканей миндалин человека. После этого прослеживали индуцирование ЦТЛ- и гуморальный ответы. В последующих экспериментах культуры миндалин (с инъецированными дендритными клетками) могут быть подвергнуты провокационному заражению путем инфицирования различными типами ВИЧ, и ингибирование репликации вируса может быть измерено методом захвата антигена. Перекрестный иммунитет против различных подтипов вируса в этой модели может быть легко исследован вследствие генерирования сильного антивирусного иммунного ответа в этой системе. Аналогичные эксперименты осуществляли на культурах миндалин, выделенных от инфицированных индивидуумов, предпочтительно детей. 3. In vivo (мышиная модель)-тест на генетическую иммунизацию. Если эксперимент,описанный в 2(d), продемонстрировал продуцирование вируса мышиными дендритными клетками или фибробластами, то нижеследующие эксперименты могут быть осуществлены на мышах. (Альтернативно, вместо нормальных мышей могут быть использованы трансгенные мыши с человеческим CD4. В этой модели ВИЧ-1 не может обеспечивать продуктивной инфекции, однако, эта модель имеет то преимущество, что мутантный вирус способен внедряться в не отвечающие на данный антиген иммунные клетки). Мышиная модель. Опухолевые клетки,экспрессирующие белки ВИЧ-1 (например, 39gp120), могут быть генерированы путем трансфекции и in vitro-селекции. Затем эти клетки инокулировали мышам, продуцирующим опухоли. При генетической иммунизации осуществляется индукция иммунного надзора посредством МНС класса I и класса II, в результате чего будет обеспечиваться защита клеток животного после внедрения опухоли этому животному. Эту мышиную модель также тестировали на генетическую иммунизацию против опухолей, поскольку дефектный по интеграции ВИЧ-1 несет гликопротеин gр 120 как часть вирусного генома, который, в этой модели, является опухолевым антигеном. Эта модель отличается от ранее описанных моделей тем, что в ней трансдуцированные клетки продуцируют свободный вирус,который может быть захвачен другими клетками (например, путем фагоцитоза), в противоположность модели, которая только экспрессирует антиген. В комбинации с моделью, экспрессирующей соответствующий опухолевый антиген, могут быть также использованы и другие опухолевые модели.(a) Для оценки эффективности генетической иммунизации, различные дозы (10-107) мышиных дендритных клеток культивировали сGM-CSF и IL-4 и трансдуцировали дефектным по интегразе ВИЧ-1, который может быть инъецирован внутривенно, внутрикожно, внутримышечно, внутрибрюшинно и в селезенку сингенных мышей. Это позволяет определить, действительно ли генетическая иммунизация трансдуцированными дендритными клетками индуцирует СD8+-ЦТЛ-ответ против gр 120 invivo и in vitro. Мышей инокулировали gр 120 экспрессирующими опухолевыми клетками. Развитие опухолей у мышей прослеживали, например, вплоть до 60 дней. Специфическую цитотоксичность gр 120 также измеряли после повторной in vitro-стимуляции клеток селезенки,как описано Zinkernagel и др. ([1985] J.Exp.Med.,162:2125). Этот эксперимент был также использован для оценки роли участка инъекции в конкретной системе.(b) Эксперимент, описанный в (а) может быть повторен с использованием CD4 трансгенных мышей. СD4-клетки этих мышей могут быть инфицированы ВИЧ, а поэтому,сравнение генетической иммунизации нормальных мышей и СD4-трансгенных мышей может быть использовано для оценки роли вторичных антиген-представляющих клеток в генерировании иммунного ответа.(c) Мышиные фибробласты (например,клеточная линия фибробластомы), трансдуцированные дефектным по интегразе ВИЧ-1, могут быть инъецированы, как описано выше, в целях определения эффективности иммунного ответа после генетической иммунизации непрофессиональными антиген-представляющими клетками в конкретной системе.(d) Эксперимент (а) может быть повторен с использованием аллогенных клеток-реципиентов для того, чтобы определить которые из клеток, аллогенные или сингенные, являются лучшими для конкретной генетической иммунизации. Так как ВИЧ не инфицирует мышиные клетки, то вторичные антиген-представляющие клетки не будут продуцироваться в мышах. Поэтому для мышей, но не для обезьян или человека, может потребоваться перекрестное праймирование хозяйскими МНС. Альтернативно,продуцированный вирус может быть процессирован аллогенными профессиональными антиген-представляющими клетками-реципиентами (даже в отсутствии инфекции), что может также приводить к отторжению опухоли и ЦТЛответу на вирусные антигены.(e) В вышеописанных процедурах вместо инъекции трансдуцированных клеток может быть также использована прямая инъекция(внутривенная, внутриселезеночная, внутрикожная, внутримышечная, внутрибрюшинная) различных количеств (1-40 мкг) ДНК, кодирующей дефектный по интегразе ВИЧ, для того,чтобы оценить эффективность in vivo-введения ДНК и для того, чтобы определить, приводит ли этот метод к трансдукции антиген-представляющих клеток, к генерированию ЦТЛ-ответа и элиминации опухолевых клеток в конкретном варианте.(f) Различные количества (1-40 мкг) ДНК,кодирующей дефектный по интегразе ВИЧ-1,могут быть инкапсулированы в липосомы и виросомы для инъекций (внутривенной, внутриселезеночной, внутрикожной, внутримышечной,внутрибрюшинной) мыши или другому хозяину,как было описано выше. Эта процедура позволяет определить, можно ли с помощью такой системы доставки генов осуществлять эффективную трансдукцию иммунных клеток in vivo,а также позволяет определить, может ли in vivoтрансдукция приводить к эффективному ЦТЛответу, способному элиминировать gр 120 экспрессирующие опухолевые клетки.(g) Если один из вышеуказанных способов приводит к отторжению опухоли и генерированию ЦТЛ-ответа на продуцируемый вирус, то такая мышиная модель может быть затем легко использована для тестирования ректальных и вагинальных суппозиториев, несущих дефектную по интегразе ДНК ВИЧ, инкапсулированную в липосомы или виросомы.(h) Дефектные по репликации вирусы коровьей оспы способны инфицировать мышиные клетки благодаря своему широкому кругу хозяев. Дендритные клетки могут быть инфицированы gр 120-экспрессирующим вирусом коровьей оспы, который абортивно инфицирует клетки(вместо трансдукции ДНК). Поскольку инфицированные клетки могут продуцировать инфекционные вирусные частицы (что прослеживалось in vitro путем титрования на восприимчи 41 вой клеточной линии), то эти клетки были использованы для того, чтобы оценить эффективность генетической иммунизации с помощью процедур, описанных выше.(i) Было показано, что после in vitroинфицирования мышиных дендритных клеток дефектными по репликации вирусами коровьей оспы (или другим поксвирусом) и продуцирования инфекционных частиц, может быть осуществлено in vivo-инфицирование селезенки с использованием различных доз вируса. Селезенки умерщвленных животных прослеживали на продуцирование вируса коровьей оспы после invivo-инфекции. Животные были также подвергнуты провокационной инокуляции опухолевыми клетками. После этого оценивали развитие опухолей и противоопухолевую ЦТЛактивность. Вирус мышиного лейкоза Молони(MMLV) может эффективно инфицировать мышиные клетки и вызывать лейкоз в мышиной модели. Дефектный по интегразе MMLV может быть сконструирован, как было описано выше для ВИЧ-1, и использован для генетической иммунизации методами, описанными выше. Преимущество этой модели заключается в том,что мыши являются природными хозяевамиMMLV (как человек является природным хозяином для ВИЧ, а обезьяны для SIV), и вместо образования опухоли может быть оценено ингибирование репликации вируса. Кроме того,негативный по интегразе вирус иммунодефицита кошек может быть использован в кошках как в модели животного; однако, для оценки антивирусного эффекта генетической иммунизации,мы предпочитаем использовать приматы, не являющиеся человеком, поскольку полученные результаты могут быть легко применены к человеку. 4. In vivo-тест на генетическую иммунизацию (на модели приматов, не относящихся к человеку). У макак, инфицированных вирусомSIV, через два года развивался СПИД, и это заболевание развивалось по схеме, очень схожей с развитием ВИЧ-инфекции у человека. С использованием этой модели на животных, генетическая иммунизация может быть протестирована на возможность ее применения как для профилактики, так и для лечения. Дефектный по интеграции SIV эффективно экспрессировался в клетках макак (экспрессия гена надлежащим образом активировалась tat), и вирус, продуцированный в лимфоидных органах, мог инфицировать другие иммунные клетки, а поэтому генерировать вторичные антиген-представляющие клетки. Эта модель является прекрасной моделью для тестирования на эффективность генетической иммунизации.(a) Аутологичные дендритные клетки,культивированные с GM-CSF и IL-4, могут быть трансдуцированы дефектным по интеграции 42 количеств трансдуцированных дендритных клеток обезьян с необученными Т-клетками, этих обезьян подвергали провокационному заражению инфекционными дозами различных подтипов SIV. Затем оценивали гуморальный и клеточный иммунный ответ и продуцирование цитокинов до и после указанного провокационного заражения. После заражения образцы, взятые из периферической крови и лимфоузлов, могут быть проанализированы с помощью RT-PCR для определения вирусной нагрузки. Эта процедура позволяет определить оптимальное количество дендритных клеток, которое нужно инъецировать для продуцирования протективного и перекрестного иммунитета.(b) Уровень перекрестного иммунитета для различных лентивирусов может быть легко определен для конкретной системы. Для этого животные могут быть генетически иммунизированы дефектным по репликации и интегразе ВИЧ 1. Затем иммунизированных животных подвергают провокационному заражению патогенным(с) Эффективность конкретной генетической иммунизации у SIV-инфицированных обезьян может быть исследована следующим образом. Аутологичные дендритные клетки,культивированные с GM-CSF и IL-4, могут быть трансдуцированы дефектным по интеграцииSIV. SIV-инфицированным животным инъецировали в селезенку дендритные клетки вскоре после провокационного SIV-заражения (через 1 неделю - 6 месяцев). Затем гуморальный и клеточный иммунный ответ и продуцирование цитокинов оценивали до и после генетической иммунизации. После заражения, образцы, взятые из периферической крови и лимфатических узлов, анализировали с помощью RT-PCR для мониторинга вирусной нагрузки. Эта процедура позволяет определить эффективность конкретной генетической иммунизации как иммунотерапии против SIV-инфекции. Пример 17. Клонирование дефектного по интегразе SIV для оценки способа генетической иммунизации приматов, не являющихся человеком. С использованием двух праймеров:FL5:5'-СТА СТА TGG ТАС ССС ААА GGTFL6:5'-TGA АТТ ТТА ААА GAA GGG GAG-3'(SEQ ID No:2),продолжительная PCR может генерировать плазмиду, показанную на фиг. 4 и содержащую делецию в гене интегразы между нуклеотидами 6115 и 6257. Мы также включили два стопкодона в рамке считывания для гарантии генерирования усеченного белка интегразы (для обеспечения вдвойне гарантированной безопасности). Родительская плазмида p239SpSp5' может быть получена с помощью программного обеспечения по исследованию СПИДа и про 43 граммы эталонных реагентов (AIDS Researchand Reference Reagent Program, Division of AIDS,NIAID, NIH, от Dr. Donald Desrosiers). Эта плазмида может быть использована как описаноOgden Bioserviecs Corp., 685 Lofstrand Lane,Rockville, MD 20850, Special Characteristics,для генерирования лимфотропного и макрофаготопного SIV. Для генетической иммунизации предпочтительным является макрофаготропный вирус из-за его более широкого тропизма, поскольку он может инфицировать лимфоциты и макрофаги. Выше в качестве примера описана лишь одна из стратегий, которые могут быть использованы. Для получения фенотипа, который способен лишь к ограниченному числу циклов репликации в макрофагах, могут быть охарактеризованы и другие мутанты. При этом следует отметить, что примеры и варианты, описанные в настоящей заявке, приводятся лишь в иллюстративных целях, и для каждого специалиста очевидно, что в настоящее изобретение могут быть внесены различные модификации и изменения, которые, однако, не должны выходить за рамки сущности, области применения и объема настоящего изобретения,сформулированных в нижеследующей формуле изобретения. Список последовательностей(ii) Название изобретения: Способы и композиции для протективной и терапевтической генетической иммунизацииTGAATTTTAA AAGAAGGGGA G ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ генерации противовирусного иммунного ответа у человека или животного,отличающийся тем, что осуществляют трансдукцию клеток лимфоидного органа или клеток,мигрирующих к лимфоидному органу, генетической конструкцией, кодирующей аттенуированный вирус, с обеспечением экспрессии указанного вируса в лимфоидном органе. 2. Способ по п.1, отличающийся тем, что клетки являются дендритными клетками. 3. Способ по п.1, отличающийся тем, что указанный аттенуированный вирус является дефектным по интеграции или некомпетентным по репликации и не способен вызвать заболевание у хозяина с иммунодефицитом. 4. Способ по п.2, отличающийся тем, что указанный вирус содержит неполный ген интегразы, причем указанный ген интегразы имеет мутацию в активном сайте или в сайте связывания с ДНК. 5. Способ по п.3, отличающийся тем, что указанный аттенуированный вирус имеет мутацию в гене gag. 6. Способ по любому из предшествующих пунктов, отличающийся тем, что вирус представляет собой ретровирус или лентивирус. 7. Способ по п.6, отличающийся тем, что вирус выбран из группы, включающей ВИЧ-1,ВИЧ-2, SIV, HTLV-1 и FIV. 8. Способ по п.3, отличающийся тем, что указанным аттенуированным вирусом является вирус оспы канареек. 9. Способ по любому из предшествующих пунктов, отличающийся тем, что клетку дополнительно трансдуцируют генетической конст 45 рукцией, обеспечивающей экспрессию цитокина. 10. Способ по п.9, отличающийся тем, что цитокин выбран из группы, включающей IL-1,IL-2, IL-3, IL-4, IL-6, IL-7, IL-12, IL-15, IL-16,TNF, GM-CSF, IFN и хемокины RANTES, M1P1. 11. Способ по любому из пп.9 или 10, отличающийся тем, что экспрессия указанного цитокина стимулирует иммунный ответ Th1 или Тh2-типа, или осуществляемый природными клетками-киллерами, или цитотоксический Т-клеточный ответ, или В-клеточный ответ. 12. Способ по любому из предшествующих пунктов, отличающийся тем, что клетку дополнительно трансдуцируют генетической конст рукцией, обеспечивающей экспрессию опухолевого антигена. 13. Способ по п.12, отличающийся тем, что опухолевый антиген выбран из группы, включающей антигены MAGE-1, p21ras, продукты генов Е 6 и Е 7 папилломавируса человека и их мутантные формы. 14. Способ по любому из предшествующих пунктов, отличающийся тем, что предназначен для облегчения или предупреждения ракового заболевания. 15. Способ по любому из предшествующих пунктов, отличающийся тем, что генерированный иммунный ответ является перекрестнопротективным.
МПК / Метки
МПК: C12N 15/86, A61K 48/00, C07K 14/16
Метки: иммунного, человека, генерации, ответа, противовирусного, способ, животного
Код ссылки
<a href="https://eas.patents.su/25-2020-sposob-generacii-protivovirusnogo-immunnogo-otveta-u-cheloveka-ili-zhivotnogo.html" rel="bookmark" title="База патентов Евразийского Союза">Способ генерации противовирусного иммунного ответа у человека или животного</a>
Предыдущий патент: Альфа-замещенные арилсульфонамидогидроксамовые кислоты в качестве ингибиторов tnf-альфа и матричных металлопротеиназ
Следующий патент: Фукоидансодержащие пищевые продукты, в частности, вызывающие апоптоз
Случайный патент: Электрическая цепь электролизера и способ уменьшения электромагнитных полей поблизости от электролизера