Имидазопиридазины
Номер патента: 1734
Опубликовано: 27.08.2001
Авторы: Циммерманн Петер, Постиус Штефан, Опферкух Вольфганг, Зенн-Бильфингер Йорг, Ханаюр Гуидо, Коль Бернхард
Формула / Реферат
1. Соединение формулы I

в которой
R1 обозначает водород, С1-С4алкил, С1-С4алкил, замещенный радикалом R11, С1-С4алкилкарбонил, С1-С4алкоксикарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы, включающей пиррол, фуран, тиофен, пиразол, имидазол, имидазолин, оксазол, изоксазол, тиазол, тиазолин, изотиазол, триазол, оксадиазол, тиадиазол, тиадиазол-1-оксид, тетразол, гексопиранозы, бензол, пиридин, пиридин-N-оксид, пиридазин, пиримидин, пиразин, триазин, нафталин, хинолин, хиназолин, хиноксалин, бензимидазол, бензоксазол, бензотиазол, тиазолопиридин и имидазопиридин,
где R11 обозначает водород, С1-С4алкил, С3-С7циклоалкил, С1-С4алкокси, С1-С4алкоксиС1-С4алкокси, С1-С4алкилкарбонил, амино-, С1-С4алкилкарбониламиногруппу, галоген, трифторметил, трифторметокси, гидроксил, карбоксил, С1-С4алкоксикарбонил, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил, сульфогруппу (-SО3Н), нитрогруппу, гуанидин, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С1-С4алкил, замещенный радикалом R111, группу -N(R112)R113 или -CO-N(R112)R113, a
R12 обозначает водород, С1-С4алкил, С1-С4алкокси, галоген, аминогруппу, гидроксил, фенил или трифторметил,
где R111 обозначает гидроксил, С1-С4алкил, С1-С4алкокси, карбоксил, С1-С4алкоксикарбонил, галоген, аминосульфонил или группу -N(R112)R113,
R112 обозначает водород, С1-С4алкил, формил, С1-С4алкилкарбонил или С1-С4алкоксикарбонил, а
R113 обозначает водород или С1-С4алкил, или
где R112 и R113, совместно и включая азотный атом, с которым они оба связаны, обозначают пиперидиновый или морфолиновый радикал,
R2 обозначает водород, С1-С4алкил или галоген,
А обозначает С2-С7алкилен,
Х обозначает линию связи, О (кислород) или S (серу),
Y обозначает О (кислород), S (серу) или N-С1-С4алкил и
Z обозначает О (кислород) или S (серу),
или соли этого соединения и его N-оксиды, или соли N-оксидов.
2. Соединение по п.1 формулы I*
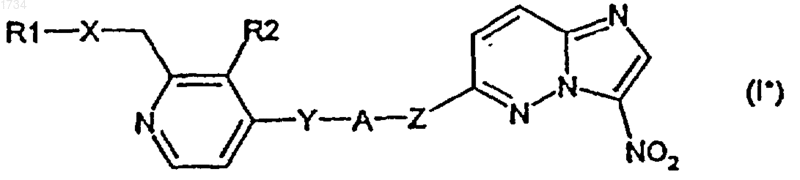
в которой R1, R2, А, X, Y и Z имеют значения, указанные в п.1, или соли этого соединения и его N-оксиды, или соли N-оксидов.
3. Соединение по п.1 формулы I, в которой
R1 обозначает водород, С1-С4алкил, С1-С4алкил, замещенный радикалом R11, С1-С4алкилкарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы, включающей пиррол, фуран, тиофен, пиразол, имидазол, имидазолин, оксазол, изоксазол, тиазол, тиазолин, изотиазол, триазол, оксадиазол, тиадиазол, тиадиазол-1-оксид, тетразол, гексопиранозы, бензол, пиридин, пиридин-N-оксид, пиридазин, пиримидин, пиразин, нафталин, хинолин, хиназолин, хиноксалин, бензимидазол, бензотиазол, тиазолопиридин и имидазопиридин,
где R11 обозначает водород, С1-С4алкил, С3-С7циклоалкил, С1-С4алкокси, С1-С4алкоксиС1-С4алкокси, С1-С4алкилкарбонил, амино-, С1-С4алкилкарбониламиногруппу, галоген, трифторметил, трифторметокси, гидроксил, карбоксил, С1-С4алкоксикарбонил, С1-С4алкилтио, С1-С4алкилсульфонил, нитрогруппу, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С1-С4алкил, замещенный радикалом R111, группу -N(R112)R113 или -CO-N(R112)R113, a
R12 обозначает водород, С1-С4алкил, С1-С4алкокси, галоген, аминогруппу, гидроксил или фенил,
где R111 обозначает гидроксил, С1-С4алкил, С1-С4алкокси, карбоксил, галоген, аминосульфонил или группу -N(R112)R113,
R112 обозначает водород, С1-С4алкил, С1-С4алкилкарбонил или С1-С4алкоксикарбонил, а
R113 обозначает водород или С1-С4алкил,
R2 обозначает водород, С1-С4алкил или галоген,
А обозначает С2-С7алкилен,
Х обозначает линию связи, О (кислород) или S (серу),
Y обозначает О (кислород), S (серу) или N-С1-С4алкил и
Z обозначает О (кислород) или S (серу),
или соли этого соединения и его N-оксиды, или соли N-оксидов.
4. Соединение по п.1 формулы I, в которой
R1 обозначает водород, С1-С4алкил, С1-С4алкил, замещенный радикалом R11, С1-С4алкилкарбонил, сульфогруппу (-SО3Н), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол, тетразол, гексопиранозы, пиридин, пиридин-N-оксид, пиримидин, бензимидазол и тиазолопиридин,
где R11 обозначает водород, С1-С4алкил, С3-С7циклоалкил, С1-С4алкокси, С1-С4алкоксиС1-С4алкокси, С1-С4aлкилкарбонил, аминогруппу, галоген, трифторметил, гидроксил, карбоксил, С1-С4алкоксикарбонил, С1-С4алкилтио, С1-С4алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С1-С4алкил, замещенный радикалом R111, или группу -N(R112)R113, a
R12 обозначает водород, С1-С4алкил, аминогруппу или гидроксил,
где R111 обозначает гидроксил, С1-С4алкил, С1-С4алкокси или группу -N(R112)R113,
R112 обозначает водород, С1-С4алкил или С1-С4алкилкарбонил, а
R113 обозначает водород или С1-С4алкил,
R2 обозначает водород, С1-С4алкил или галоген,
А обозначает С2-С5алкилен,
Х обозначает линию связи, О (кислород) или S (серу),
Y обозначает О (кислород), S (серу) или N-С1-С4aлкил и
Z обозначает О (кислород) или S (серу),
или соли этого соединения и его N-оксиды, или соли N-оксидов.
5. Соединение по п.1 формулы I*
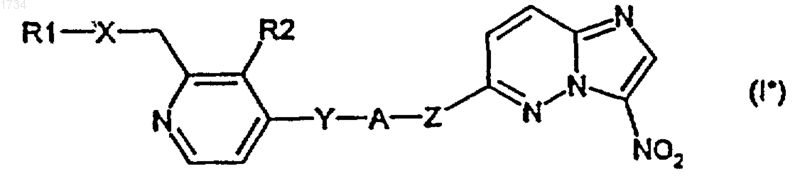
в которой
R1 обозначает водород, С1-С4алкил, С1-С4алкил, замещенный радикалом R11, С1-С4алкилкарбонил, сульфогруппу (-SO3Н), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол, тетразол, пиридин, пиримидин и бензимидазол,
где R11 обозначает водород, С1-С4алкил, С1-С4алкокси, С1-С4алкоксиС1-С4алкокси, С1-С4алкилтио, С1-С4алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, или тиазолил,
R12 обозначает водород,
где R111 обозначает гидроксил или С1-С4алкил,
R2 обозначает С1-С4алкил или галоген,
А обозначает С2-С4алкилен,
Х обозначает линию связи, О (кислород) или S (серу),
Y обозначает О (кислород), S (серу) или N-С1-С4алкил и
Z обозначает О (кислород) или S (серу),
или соли этого соединения и его N-оксиды, или соли N-оксидов.
6. Соединение по п.1 формулы I*
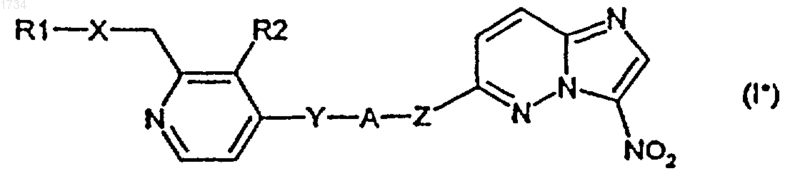
в которой
R1 обозначает бензимидазол-2-ил,
R2 обозначает С1-С4алкил или галоген,
А обозначает С2-С4алкилен,
Х обозначает линию связи, О (кислород) или S (серу),
Y обозначает О (кислород), S (серу) или N-С1-С4алкил и
Z обозначает О (кислород) или S (серу),
или соли этого соединения и его N-оксиды, или соли N-оксидов.
7. Соединение по п.1 формулы I, в которой Х обозначает S (серу), Y обозначает S (серу) и Z обозначает S (серу).
8. Соединение по п.1 формулы I, в которой А обозначает С2-С4алкилен, Х обозначает S (серу), Y обозначает N-С1-С4алкил, а Z обозначает О (кислород).
9. Лекарственное средство, включающее соединение по п.1 совместно с обычными фармацевтическими вспомогательными средствами или наполнителями.
10. Применение соединений по п.1 для борьбы против бактерий Helicobacter.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые предназначены для использования в фармацевтической промышленности при приготовлении лекарственных препаратов. Предпосылки создания изобретения В ЕР-А 632040 описаны имидазоловые производные, которые, как полагают, обладают антибактериальным действием. Описание изобретения Изобретение относится к соединениям формулыR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, С 1-С 4 алкоксикарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы,включающей пиррол, фуран, тиофен, пиразол,имидазол, имидазолин, оксазол, изоксазол, тиазол, тиазолин, изотиазол, триазол, оксадиазол,тиадиазол, тиадиазол-1-оксид, тетразол, гексопиранозы, бензол, пиридин, пиридин-N-оксид,пиридазин, пиримидин, пиразин, триазин, нафталин, хинолин, хиназолин, хиноксалин, бензимидазол, бензоксазол, бензотиазол, тиазолопиридин и имидазопиридин,где R11 обозначает водород, С 1-С 4 алкил, С 3 С 7 циклоалкил, С 1-С 4 алкокси, С 1-С 4 алкоксиС 1 С 4 алкокси, С 1-С 4 алкилкарбонил, амино-, C1 С 4 алкилкарбониламиногруппу, галоген, трифторметил, трифторметокси, гидроксил, карбоксил, С 1-С 4 алкоксикарбонил, С 1-С 4 алкилтио, С 1 С 4 алкилсульфинил,С 1-С 4 алкилсульфонил,сульфогруппу (-SO3H), нитрогруппу, гуанидин,фенил, фенил, замещенный радикалом R111,пиридил, пиридил, замещенный радикалом-N(R112)R113,R112 обозначает водород, С 1-С 4 алкил,формил,С 1-С 4 алкилкарбонил или С 1 С 4 алкоксикарбонил, а R113 обозначает водород или С 1-С 4 алкил, или где R112 и R113 совместно и включая азотный атом, с которым они оба связаны, обозначают пиперидиновый или морфолиновый радикал, 001734Z обозначает О (кислород) или S (серу),и к солям этих соединений и их Nоксидам, а также к солям N-оксидов. С 1-С 4 алкил обозначает прямоцепочечные или разветвленные алкиловые радикалы, содержащие 1-4 углеродных атома. Их примерами являются бутиловый, изобутиловый, вторбутиловый, трет-бутиловый, пропиловый, изопропиловый, этиловый и метиловый радикалы. С 1-С 4 алкилкарбонил представляет собой радикал, который, помимо карбониловой группы, содержит один из вышеупомянутых С 1 С 4 алкиловых радикалов. В качестве примера можно упомянуть ацетиловый радикал. С 1-С 4 алкокси представляет собой радикал,который, помимо кислородного атома, содержит один из вышеупомянутых С 1-С 4 алкиловых радикалов. В качестве примеров можно упомянуть метокси- и этоксирадикалы. С 1-С 4 алкоксикарбонил представляет собой радикал, который, помимо карбониловой группы, содержит один из вышеупомянутых С 1 С 4 алкиловых радикалов. В качестве примеров можно упомянуть метоксикарбониловый и этоксикарбониловый радикалы. В контексте описания настоящего изобретения гексoпиранозы представляют собой гексозы (такие как, например, галактоза, манноза или, в особенности, глюкоза), которые находятся в пиранозидной форме и которые связаны с остальной частью молекулы гликозидной связью. Особенно предпочтительна глюкопираноза. С 3-С 7 циклоалкил обозначает циклопропиловый, циклобутиловый, циклопентиловый,циклогексиловый и циклогептиловый радикал. С 1-С 4 алкоксиС 1-С 4 алкокси представляет собой С 1-С 4 алкокси, который замещен С 1 С 4 алкоксирадикалом. В качестве примеров можно упомянуть метоксиэтокси-, этоксиэтокси- и метоксипропоксирадикалы. С 1-С 4 алкилкарбониламиногруппа представляет собой аминогруппу, которая замещена одним из вышеуказанных С 1-С 4 алкоксикарбониловых радикалов. В качестве примера назвать ацетиламиногруппу (ацетамидную группу). С 1-С 4 алкилтио представляет собой радикал, который в дополнение к атому серы содержит один из вышеуказанных С 1-С 4 алкиловых радикалов. К примерам, которые могут быть упомянуты, относятся метилтио- и этилтиогруппы. С 1-С 4 алкилсульфинил представляет собой радикал, который, в дополнение к сульфиниловой группе (-SO-), содержит один из вышеуказанных С 1-С 4 алкиловых радикалов. В качестве 3 примеров можно упомянуть метилсульфиниловый и этилсульфиниловый радикалы. С 1-С 4 алкилсульфонил представляет собой радикал, который в дополнение к сульфониловой группе (-SO2-) содержит один из вышеуказанных С 1-С 4 алкиловых радикалов. К примерам,которые могут быть упомянуты, относятся метилсульфониловый и этилсульфониловый радикалы. Примерами С 1-С 4 алкиловых радикалов,замещенных группой R111, которые могут быть упомянуты, являются метоксикарбонилэтиловый, 2-этоксикарбонилэтиловый, метоксикарбонилметиловый, карбоксиметиловый, 2-гидроксиэтиловый, метоксиметиловый, 2-метоксиэтиловый, диметиламинометиловый и 2-диметиламиноэтиловый радикалы. С 2-С 7 алкилен обозначает прямоцепочечные или разветвленные алкиленовые радикалы,содержащие 2-7 углеродных атомов. В качестве примеров можно назвать гептиленовый, изогептиленовый (2-метилгексиленовый), гексиленовый, изогексиленовый (2-метилпентиленовый),неогексиленовый(2,2-диметилбутиленовый),пентиленовый, изопентиленовый (3-метилбутиленовый), неопентиленовый (2,2-диметилпропиленовый), бутиленовый, изобутиленовый, вторбутиленовый, трет-бутиленовый, пропиленовый, изопропиленовый и этиленовый радикалы. Предпочтительны этиленовый (-СН 2 СН 2-), бутиленовый (-СН 2 СН 2 СН 2 СН 2-) и, прежде всего,пропиленовый (-СН 2 СН 2 СН 2-) радикалы. Циклические системы или бициклические системы R1 могут быть связаны с Х в любом реакционноспособном положении. С другой стороны, заместители R11 и R12 в циклических системах или бициклических системах R1 также могут быть связанными в любом реакционноспособном положении. В качестве примеров радикалов R1 можно назвать 2-пирролил, 3 пирролил, 1-метил-3-пирролил, 2-фурил, 3 фурил, 2-метил-3-фурил, 2-диметиламинометил 5-метил-3-фурил,5-(2-диметиламиноэтил)-2 фурил, 5-метил-2-фурил, 2-тиенил, 3-тиенил, 5 хлор-2-тиенил, 3-пиразолил, 4-пиразолил, 1-метил-3-пиразолил,1-(2-диметиламиноэтил)-3 пиразолил, 2-имидазолил, 1-метил-2-имидазолил, 5-нитро-1-имидазолил, 2-метил-5-нитро-1 имидазолил, 4,5-дифенил-1-имидазолил, 2 имидазолинил, 2-оксазолил, 4-оксазолил, 4,5 диметил-2-оксазолил, 4-изоксазолил, 5-изоксазолил, 3,5-диметил-4-изоксазолил, 2-тиазолил,4,5-диметил-2-тиазолил,4-метил-5-карбоксиметил-2-тиазолил, 3,4-диметил-2-тиазолил, 2 тиазолинил, 3-изотиазолил, 1,2,3-триазол-4-ил,1,2,4-триазол-3-ил, 1-метил-1,2,3-триазол-4-ил,1-метил-1,2,4-триазол-3-ил,4-метил-1,2,4 триазол-3-ил,1-(2-диметиламиноэтил)-1,2,3 триазол-4-ил, 3-амино-1,2,4-триазол-5-ил, 4 метил-5-трифторметил-1,2,4-триазол-3-ил,5 метил-1,2,4-триазол-3-ил, 1,3,4-оксадиазол-2-ил,5-метил-1,3,4-оксадиазол-2-ил, 5-фенил-1,3,4 001734 4 оксадиазол-2-ил, 3-фенил-1,2,4-оксадиазол-5-ил,1,2,5-тиадиазол-4-ил,1,2,5-тиадиазол-4-ил-1 оксид, 1,3,4-тиадиазол-2-ил, 1,2,3-тиадиазол-2 ил, 5-метил-1,3,4-тиадиазол-2-ил, 2-амино-1,3,4 тиадиазол-5-ил, 5-амино-1,3,4-тиадиазол-2-ил,5-трифторметил-1,3,4-тиадиазол-2-ил, 5-тетразолил, 1-метил-5-тетразолил, 1-фенил-5-тетразолил, 1-(2-диметиламиноэтил)-5-тетразолил, 1(4-аминосульфонилфенил)-5-тетразолил, 1-карбоксиметил-5-тетразолил, 1-(2-гидроксиэтил)-5 тетразолил, фенил, 2-амино-4-хлорфенил, 2 амино-4-трифторметилфенил, 4-ацетамидофенил, 2-аминофенил, 3-аминофенил, 4-аминофенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил,2,5-дихлорфенил, 2,6-дихлорфенил, 3,4-дихлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 3,5 дихлорфенил, 2-хлор-6-метилфенил, 4-хлор-2 метилфенил, 2-хлор-4-фторфенил, 3-хлор-4 фторфенил, 2,4-диметилфенил, 2,5-диметилфенил, 2,6-диметилфенил, 3,4-диметилфенил,3,5-диметилфенил, 2-этилфенил, 4-этилфенил,2-фторфенил, 4-фторфенил, 3-фторфенил, 2 гидроксифенил, 4-гидроксифенил, 2-гидроксиметилфенил, 4-гидроксиметилфенил, 2-изопропилфенил, 4-изопропилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2,5 диметоксифенил, 3,4-диметоксифенил, 2-карбоксифенил, 4-карбоксифенил, 2-метоксикарбонилфенил, 4-нитрофенил, 2-нитро-4-фторметилфенил, 2-метилфенил, 3-метилфенил, 4 метилфенил, 4-третбутилфенил, 4-метилтиофенил, 3-диметиламинометилфенил, 3-пиперидинометилфенил,3-карбоксиметилфенил,4 карбоксиэтилфенил, 3-трифторметилфенил, 4 трифторметилфенил, 2-трифторметилфенил, 2 трифторметоксифенил,4-трифторметоксифенил, 2-пиридил, 4-пиридил, 3-гидрокси-2 пиридил, 3-карбокси-2-пиридил, 5-нитро-2 пиридил, 3-амино-6-метокси-2-пиридил,5 трифторметил-2-пиридил, 3-хлор-5-трифторметил-2-пиридил, 3-трифторметил-2-пиридил, 2 пиридил-1-оксид, 2-пиримидинил, 2-амино-4 пиримидинил, 4-амино-2-пиримидинил, 2,4 диамино-6-пиримидинил, 4-амино-6-гидрокси 2-пиримидинил,4,6-дигидрокси-2-пиримидинил, 2,4-дигидрокси-5-пиримидинил, 2-амино-4 этиламино-6-пиримидинил, 4-метил-2-пиримидинил, 4,6-диметил-2-пиримидинил, 2-этилтио 6-метил-4-пиримидинил, 2-гидрокси-4-пиримидинил, 5-метокси-4-пиримидинил, 4-трифторметил-2-пиримидинил, 1,3,4-триазин-2-ил, 5,6 дигидрокси-1,3,4-триазин-2-ил, 1-нафтил, 2 нафтил, 2-хинолил, 8-хинолил, 7-трифторметил 4-хинолил, 4-хиназолил, 4-гидрокси-2-хиназолил, 2-хиноксалил, 2-бензимидазолил, 5-метил 2-бензимидазолил, 5-нитро-2-бензимидазолил,5-сульфо-2-бензимидазолил, 5-метокси-2-бензимидазолил, 5-(2-тиазолил)-2-бензимидазолил, 5 метилтио-2-бензимидазолил,5-метилсульфонил-2-бензимидазолил, 2-бензоксазолил, 2 бензотиазолил,5-хлор-2-бензотиазолил,6 5 нитро-2-бензотиазолил, 6-амино-2-бензотиазолил, 6-метокси-2-бензотиазолил, 6-этокси-2 бензотиазолил и 2-имидазопиридил. Примерами заместителей R1 (если они представляют собой С 1-С 4 алкилы, замещенные радикалами R11), которые могут быть упомянуты дополнительно, являются 2-гидроксиэтил, 2 карбоксиэтил, 2-аминоэтил, 2-диметиламиноэтил, 2-диэтиламиноэтил, 2-ацетиламиноэтил,циклопропилметил, 2-оксопропил и 2,2,2 трифторэтил. Приемлемые соли соединений формулы I представляют собой как кислотно-аддитивные соли, так и соли с основаниями. Среди кислотно-аддитивных солей можно конкретно упомянуть фармакологически приемлемые соли минеральных и органических кислот, которые обычно применяют в фармации. Фармакологически неприемлемые соли, которые первоначально могут быть получены в качестве продуктов процесса, например, процесса получения соединений в соответствии с изобретением в промышленном масштабе, превращают в фармакологически приемлемые соли по способам,которые известны специалистам в данной области техники. Эти приемлемые соли представляют собой водорастворимые и не растворимые в воде кислотно-аддитивные соли с кислотами,такими как, например, хлористо-водородная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, Dглюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота,щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3 гидрокси-2-нафтойная кислота, причем при получении солей эти соли используют (в зависимости от того, является ли кислота одно- или многоосновной, и в зависимости от той соли,которую необходимо получить) в эквимолярном или отличном от него количественном соотношении. В случае соединений формулы I, содержащих (а) карбоксильную(ые) группу(ы) или содержащих (а) сульфогруппу(ы), приемлемыми солями являются также соли с основаниями. Примерами солей с основаниями, которые могут быть упомянуты, являются литиевые, натриевые, калиевые, кальциевые, алюминиевые,магниевые, титановые, аммониевые, меглуминовые и гуанидиниевые соли, причем в этом случае основания также используют в эквимолярном или отличном от него количественном соотношении. В одном из вариантов (вариант а) в изобретении предлагаются соединения формулы I,в которой Х обозначает связь, a R1 обозначает 6 водород, С 1-С 4 алкил или С 1-С 4 алкил, замещенный радикалом R11. В другом варианте (вариант б) в изобретении предлагаются соединения формулы I, в которой Х обозначает О (кислород), а R1 обозначает водород или С 1-С 4 алкил. В другом варианте (вариант в) в изобретении предлагаются соединения формулы I, в которой Х обозначает S (серу). В еще одном варианте (вариант г) в изобретении предлагаются соединения формулы I,в которой Y обозначает О (кислород) и Z обозначает О (кислород). В еще одном варианте (вариант д) в изобретении предлагаются соединения формулы I,в которой Y обозначает S (серу) и Z обозначаетS (серу). В еще одном варианте (вариант е) в изобретении предлагаются соединения формулы I,в которой Y обозначает N-С 1-С 4 алкил, а Z обозначает S (серу). В еще одном варианте (вариант ж) в изобретении предлагаются соединения формулы I,в которой Y обозначает О (кислород), а Z обозначает S (серу). Предпочтительными соединениями формулы I являются те, у которых заместитель R2 находится в 3 положении пиридинового кольца. Более того, предпочтительные соединения формулы I представляют собой такие, у которых мостиковый фрагмент -Y-A-Z-, связанный с пиридиновым кольцом, присоединен к 3-нитроимидазо[1,2-b]пиридазину в положении 6. Таким образом, предпочтительные соединения, предлагаемые в соответствии с изобретением, являются соединениями формулы IR1, R2, А, X, Y и Z имеют значения, указанные выше,и солями этих соединений, их N-оксидами, а также солями N-оксидов. Более того, предпочтительные соединения формулы I или формулы I являются соединения, у которых А обозначает этилен или пропилен. Соединениями, которые следует особо выделить, являются соединения формулы I, в которойR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей пиррол, фуран, тиофен, пиразол, имидазол, имидазолин,оксазол, изоксазол, тиазол, тиазолин, изотиазол,триазол, оксадиазол, тиадиазол, тиадиазол-1 оксид, тетразол, гексопиранозы, бензол, пири 7 дин, пиридин-N-оксид, пиридазин, пиримидин,пиразин, нафталин, хинолин, хиназолин, хиноксалин, бензимидазол, бензотиазол, тиазолопиридин и имидазопиридин,где R11 обозначает водород, С 1-С 4 алкил, С 3 С 7 циклоалкил, С 1-С 4 алкокси, С 1-С 4 алкоксиС 1 С 4 алкокси, С 1-С 4 алкилкарбонил, амино-, С 1 С 4 алкилкарбониламиногруппу, галоген, трифторметил, трифторметокси, гидроксил, карбоксил, С 1-С 4 алкоксикарбонил, С 1-С 4 алкилтио, С 1 С 4 алкилсульфонил, нитрогруппу, фенил, фенил,замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С 1-С 4 алкил, замещенный радикалом R111, группу -N(R112)R113 или -CON(R112)R113, aR12 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси, галоген, аминогруппу, гидроксил или фенил,где R111 обозначает гидроксил, С 1-С 4 алкил, С 1 С 4 алкокси, карбоксил, галоген, аминосульфонил или группу -N(R112)R113,R112 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкилкарбонил или С 1-С 4 алкоксикарбонил, аR113 обозначает водород или С 1-С 4 алкил,R2 обозначает водород, С 1-С 4 алкил или галоген,А обозначает С 2-С 7 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4 алкил, аZ обозначает О (кислород) или S (серу),и соли этих соединений и их N-оксиды, а также соли N-оксидов. Соединения, которые следует особо подчеркнуть, являются соединениями формулы I в которойR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол,тетразол, гексопиранозы, пиридин, пиридин-Nоксид, пиримидин, бензимидазол и тиазолопиридин,где R11 обозначает водород, С 1-С 4 алкил, С 3 С 7 циклоалкил, С 1-С 4 алкокси, С 1-С 4 алкоксиС 1 С 4 алкокси, С 1-С 4 алкилкарбонил, аминогруппу,галоген, трифторметил, гидроксил, карбоксил,С 1-С 4 алкоксикарбонил,С 1-С 4 алкилтио,С 1 С 4 алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С 1-С 4 алкил, замещенный радикалом R111,или группу -N(R112)R113, aR12 обозначает водород, С 1-С 4 алкил, аминогруппу или гидроксил,где R111 обозначает гидроксил, С 1-С 4 алкил, С 1 С 4 алкокси или группу -N(R112)R113, 001734R113 обозначает водород или С 1-С 4 алкил,R2 обозначает водород, С 1-С 4 алкил или галоген,А обозначает С 2-С 5 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4aлкил, аZ обозначает О (кислород) или S (серу),и солями этих соединений и их N-оксидами, а также солями N-оксидов. Предпочтительными соединениями являются соединения формулы I, в которойR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол,тетразол, пиридин, пиримидин и бензимидазол,где R11 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси,С 1-С 4 алкоксиС 1-С 4 алкокси,С 1 С 4 алкилтио, С 1-С 4 алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил,пиридил, замещенный радикалом R111 или тиазолил,R12 обозначает водород,где R111 обозначает гидроксил или С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или галоген,А обозначает С 2-С 4 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4 алкил иZ обозначает О (кислород) или S (серу),и соли этих соединений и их N-оксиды, а также соли N-оксидов. В приведенных ниже таблицах представлены конкретные примеры соединений по изобретению. Таблица 1 Соединения формулы I, в которых Х обозначает простую связь, а остальные заместители имеют следующие значения:R2 метил метил хлор хлор метил метил хлор хлор метил метил хлор хлор метил метил А этилен пропилен этилен пропилен этилен пропилен этилен пропилен этилен пропилен этилен пропилен этилен пропилен Таблица 2 Соединения формулы I, в которых Х означает О, Y означает О, Z означает О, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 3 Соединения формулы I, в которых Х означает О, Y означает О, Z означает О, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 4 Соединения формулы I, в которых Х означает S, Y означает О, Z означает О, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 5 Соединения формулы I, в которых Х означает S, Y означает О, Z означает О, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил 001734 метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 6 Соединения формулы I, в которых Х означает О, Y означает О, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 7 Соединения формулы I, в которых Х означает О, Y означает О, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 8 Соединения формулы I, в которых Х означает S, Y означает О, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 9 Соединения формулы I, в которых Х означает S, Y означает О, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 10 Соединения формулы I, в которых Х означает О, Y означает N-метил, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 11 Соединения формулы I, в которых Х означает О, Y означает N-метил, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 12 Соединения формулы I, в которых Х означает О, Y означает S, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил 001734 метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 13 Соединения формулы I, в которых Х означает О, Y означает S, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор 16 этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 15 Соединения формулы I, в которых Х означает S, Y означает S, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор 001734 хлор хлор хлор хлор хлор Таблица 16 Соединения формулы I, в которых Х означает О, Y означает О, Z означает О, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 17 Соединения формулы I, в которых Х означает О, Y означает О, Z означает О, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 18 Соединения формулы I, в которых Х означает S, Y означает О, Z означает О, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 19 Соединения формулы I, в которых Х означает S, Y означает О, Z означает О, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 20 Соединения формулы I, в которых Х означает О, Y означает О, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 21 Соединения формулы I, в которых Х означает О, Y означает О, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 22 Соединения формулы I, в которых Х означает S, Y означает О, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил 001734 метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 23 Соединения формулы I, в которых Х означает S, Y означает О, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор 22 означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 25 Соединения формулы I, в которых Х означает О, Y означает N-метил, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор 001734 хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 26 Соединения формулы I, в которых Х означает О, Y означает S, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 27 Соединения формулы I, в которых Х означает О, Y означает S, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 28 Соединения формулы I, в которых Х означает S, Y означает S, Z означает S, А означает этилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор Таблица 29 Соединения формулы I, в которых Х означает S, Y означает S, Z означает S, А означает пропилен, а остальные заместители имеют следующие значения:R2 метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил метил хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор хлор К приведенным выше примерам относятся также соли указанных в табл. 1-29 соединений,их N-оксиды и соли N-оксидов. Соединения в соответствии с изобретением могут быть получены аналогичным путем с применением способов, описанных в международных заявках WO 95/34554 и WO 95/15324,или с использованием исходных соединений,которые в них описаны или могут быть получены аналогичным образом. В частности, соединения в соответствии с изобретением могут быть получены так, как это более подробно описано в следующих примерах, или с применением аналогичных технологических стадий или реакцией с участием исходных соединений,которые могут быть получены аналогичным образом. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. В этих примерах tпл обозначает температуру плавления, мин обозначает минуту(минуты), ч обозначает час(часы), разл. обозначает "с разложением", ДБУ обозначает 1,8-диазабицикло[5.4.0]ундец-7-ен. 26 Примеры Исходные соединения А 1. [4-(3-Меркаптопропилсульфанил)-3 метилпиридин-2-ил]метанол. Раствор 691 г (5 молей) карбоната калия в 1,5 л воды в азотной атмосфере обрабатывают 432,8 г (4 моля) 1,3-пропандитиола и нагревают до 80 С. Далее при этой температуре с интенсивным перемешиванием в течение примерно 2 ч по каплям добавляют раствор 194,1 г (1 моль) гидрохлорида(4-хлор-3-метилпиридин-2-ил) метанола в 400 мл воды. Эту смесь при 80-85 С дополнительно перемешивают в течение 18 ч и затем охлаждают до комнатной температуры. После отделения водной фазы органическую фазу обрабатывают 1,5 л толуола и промывают 2 раза водой порциями по 1 л. Далее органическую фазу экстрагируют 2 л 2 М соляной кислоты. Солянокислотную фазу концентрируют и остаток перекристаллизовывают из изопропанола. Выделяют 159 г (60%-ный выход) указанного в заголовке соединения. Этот сырой продукт используют без дополнительной очистки в синтезе соединения из примера 1. А 2. 6-[3-(2-Хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазин. Раствор 3,6 мл (49,8 ммоля) тионилхлорида в 30 мл дихлорметана по каплям при комнатной температуре вводят в раствор 15,0 г (38,3 ммоля) 3-метил-4-[3-(3-нитроимидазо[1,2-b] пиридазин-6-илсульфанил)пропилсульфанил] пиридин-2-илметанола в 400 мл безводного дихлорметана и затем смесь перемешивают в течение последующих 18 ч. Далее ее охлаждают до 0 С и осторожно по каплям добавляют в нее 100 мл водного раствора карбоната натрия. Дихлорметан отгоняют. После этого суспензию обрабатывают 400 мл воды и при 0 С перемешивают в течение 30 мин. Осадок отфильтровывают, промывают водой, сушат при 40 С в вакууме и затем суспендируют в 300 мл ацетона. После фильтрования и сушки в виде бежевого порошка выделяют 15,3 г (97%-ный выход) указанного в заголовке соединения. tпл: 155156 С. Б 1. 3-(2,3-Диметил-1-оксипиридин-4-илокси)пропан-1-ол. Раствор 193 мл (2,66 моля) 1,3-пропандиола в 50 мл безводного диметилформамида при 0 С по каплям в течение 2 ч вводят в суспензию гидрида натрия (24 г суспензии 80%-ной концентрации, 0,8 моля) в 110 мл диметилформамида. Далее эту суспензию в течение 18 ч перемешивают при комнатной температуре с последующим нагреванием до 50 С. В течение 15 мин порциями добавляют 84 г (0,53 моля) 4 хлор-2,3-диметилпиридин-1-оксида. Далее смесь с перемешиванием выдерживают при 120 С в течение последующих 1,5 ч. После охлаждения до 50 С добавляют 500 мл метанола. 27 Затем соли отфильтровывают и промывают метанолом. Фильтрат концентрируют перегонкой в высоком вакууме и остаток очищают хроматографией на силикагеле. При этом используют элюент со следующим градиентом соотношений: 1) этилацетат/метанол/аммиак 19:1,0:0,6, 2) этилацетат/метанол/аммиак 18:3:0,6 и 3) этилацетат/метанол/аммиак 15:5:0,4. В дальнейшем фракции с Rf 0,25 (этилацетат/метанол/аммиак в соотношении 50:20:1) концентрируют и растворяют два раза с использованием в каждом случае 250 мл толуола и вновь концентрируют. В виде бледно-бежевого твердого вещества выделяют 76,2 г (72%-ный выход) указанного в заголовке соединения. tпл: 72-84 С. Этот сырой продукт используют для последующих реакций без дополнительной очистки. Б 2. 3-(2-Гидроксиметил-3-метилпиридин 4-илокси)пропан-1-ол. 47 г (0,24 моля) 3-(2,3-диметил-1-оксипиридин-4-илокси)пропан-1-ола и 176 мл (1,87 моля) уксусного ангидрида при 90 С выдерживают в течение 5 ч. Далее отгоняют избыток уксусного ангидрида. Остаток растворяют в 40 мл воды и 100 мл концентрированной соляной кислоты и при 80 С выдерживают в течение 16 ч. После этого при комнатной температуре раствор в общей сложности 3 раза обрабатывают с использованием каждый раз по 150 мл изопропанола и вновь концентрируют в вакууме с помощью водоструйного насоса. Затем осадок отфильтровывают, промывают изопропанолом и сушат. 32 г выделенного таким путем гидрохлорида суспендируют в 500 мл изопропанола, обрабатывают 38 г карбоната калия и при 80 С перемешивают в течение 1,5 ч. Горячий раствор фильтруют и фильтрат концентрируют досуха. В виде бледно-бежевого твердого вещества выделяют 26,5 г (56%-ный выход) указанного в заголовке соединения с tпл 65-70 С. Этот сырой продукт используют для последующих реакций без дополнительной очистки. Б 3. [4-(3-Хлорпропокси)-3-метилпиридин 2-ил]метанол. а) 2-Хлорметил-4-(3-хлорпропокси)-3 метилпиридин. Раствор 2,3 мл (31,7 ммоля) тионилхлорида в 5 мл дихлорметана при 0 С по каплям вводят в раствор 2,5 г (12,6 ммоля) 3-(2 гидроксиметил-3-метилпиридин-4-илокси)пропан-1-ола в 20 мл дихлорметана и в дальнейшем смесь перемешивают при комнатной температуре в течение последующих 16 ч. Затем добавляют 20 мл воды, с использованием раствора бикарбоната натрия значение рН смеси доводят до 8 и экстрагируют дихлорметаном 3 порциями по 20 мл. Органические экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток в виде масла (2,8 г) применяют на стадии б) без дополнительной очистки. б) 4-(3-Хлорпропокси)-3-метилпиридин-2 илметилацетат. 28 2,8 г (11,9 ммоля) продукта в виде масла со стадии а) в течение 6 ч выдерживают при 100 С совместно с 20 мл ледяной уксусной кислоты и 2,3 г (23,9 ммоля) ацетата калия. Далее смесь концентрируют и остаток растворяют в 30 мл этилацетата и 30 мл раствора бикарбоната натрия. С использованием 2 М соляной кислоты значение рН раствора доводят до 7 и экстрагируют 3 порциями по 30 мл этилацетата. Органические экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток в виде масла (2,8 г) применяют на стадии в) без дополнительной очистки. в) [4-(3-Хлорпропокси)-3-метилпиридин-2 ил]метанол. Раствор 2,7 г (10,4 ммоля) продукта в виде масла со стадии б) в 25 мл метанола обрабатывают 1,5 г (20,8 ммоля) карбоната калия и при комнатной температуре перемешивают в течение 4 ч. Далее соли отфильтровывают и фильтрат концентрируют. Остаток очищают хроматографией на силикагеле (элюент: этилацетат/метанол/аммиак в соотношении 19:1,0:0,4). 1,3 г (57%-ный выход) указанного в заголовке соединения выделяют в виде бесцветного масла,которое после стояния в течение относительно длительного времени частично кристаллизуется. Этот продукт используют непосредственно в ходе проведения последующей реакции (пример 15) без дополнительной очистки. Б 4. 3-Нитро-6-тритилсульфанилимидазо[1,2-b]пиридазин. 8,0 г (40,3 ммоля) 6-хлор-3-нитроимидазо[1,2-b]пиридазина, 16,7 г (60,4 ммоля) трифенилметантиола и 16,7 г (120 ммолей) карбоната калия в 150 мл диоксана выдерживают в аргоновой атмосфере при 90 С в течение 5 ч. После охлаждения до комнатной температуры смесь фильтруют и фильтрат концентрируют. Остаток растворяют в небольшом количестве этилацетата и обрабатывают 100 мл диизопропилового эфира. По прошествии 18 ч кристаллический осадок отфильтровывают и сушат. Выделяют 12,69 г (72%-ный выход) указанного в заголовке соединения, tпл: 168-170 С. Б 5. 3-Нитроимидазол[1,2-b]пиридазин-6 тиол. Раствор 1,0 г (2,28 моля) 3-нитро-6-тритилсульфанилимидазо[1,2-b]пиридазина в 10 мл безводного дихлорметана в аргоновой атмосфере обрабатывают 0,73 мл (4,56 ммоля) триэтилсилана и 1,0 мл (13 ммолей) трифторуксусной кислоты и при комнатной температуре перемешивают в течение 3 ч. Затем добавляют 10 мл 2 н. раствора гидроксида натрия и смесь экстрагируют 3 порциями по 20 мл этилацетата. Далее с использованием соляной кислоты значение рН водной фазы доводят до 2 с последующей экстракцией 3 порциями по 20 мл этилацетата. Органические экстракты промывают 20 мл воды,сушат над сульфатом магния и концентрируют. Остаток кристаллизуют добавлением небольшо 29 го количества диэтилового эфира. В виде бледно-желтого твердого вещества получают 0,34 г(76%-ный выход) указанного в заголовке соединения. tпл: 175-177 С. В 1. Ацетат 3-хлор-4-[(2-хлорэтил)метиламино]пиридин-2-илметила. 3,0 г (10,3 ммоля) гидрохлорида (3-хлор-2 хлорметилпиридин-4-ил)-(2-хлорэтил)метиламина и 3,0 г (31 ммоль) ацетата калия при 100 С выдерживают в течение 27 ч в 50 мл ледяной уксусной кислоты. Затем ледяную уксусную кислоту отгоняют и остаток растворяют в 60 мл этилацетата/воды (1:1). С использованием раствора бикарбоната натрия значение рН смеси доводят до 8 и экстрагируют 3 порциями по 30 мл этилацетата. Органические экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток очищают хроматографией на силикагеле (элюент: толуол/этилацетат в соотношении 1:1). Фракции с Rf 0,25 концентрируют (выход: 1,84 г, 64%) и используют непосредственно в синтезе соединения примера В 2. В 2. 3-Хлор-4-[(2-хлорэтил)метиламино] пиридин-2-илметанол. 1,83 г ацетата 3-хлор-4-[(2-хлорэтил) метиламино]пиридин-2-илметила и 250 мг карбоната калия в 20 мл метанола при комнатной температуре перемешивают в течение 8 ч. Затем смесь фильтруют и фильтрат концентрируют. Остаток растирают в диэтиловом эфире. В виде бежевого твердого вещества получают 1,43 г(92%-ный выход) указанного в заголовке соединения. tпл: 91-96 С. В 3. Гидрохлорид(2-хлорэтил)-[3-хлор-2(пиримидин-2-илсульфанилметил)пиридин-4 ил]метиламина. Раствор 5,05 г (19,9 ммоля) (3-хлор-2 хлорметилпиридин-4-ил)-(2-хлорэтил)метиламина и 2,23 г (19,9 ммоля) 2-меркаптопиримидина в 100 мл изопропанола кипятят с обратным холодильником в течение 1,5 ч. Затем его охлаждают до комнатной температуры и концентрируют, а остаток растворяют в небольшом количестве этилацетата/метанола (1:1). Далее добавляют эфирный раствор хлорида водорода и смесь охлаждают до 0 С. Осадок отфильтровывают, промывают диэтиловым эфиром и сушат. В виде бледно-бежевого твердого вещества получают 4,24 г (58%-ный выход) указанного в заголовке соединения с tпл 177-180 С. Для дальнейших реакций основание из гидрохлорида высвобождают экстракцией 2 н. раствором гидроксида натрия. В 4. Дигидрохлорид[2-(1 Н-бензимидазол-2 илсульфанилметил)-3-хлорпиридин-4-ил]-(2 хлорэтил)метиламина. С использованием в качестве исходных материалов 1,80 г (7,1 ммоля) (3-хлор-2-хлорметилпиридин-4-ил)-(2-хлорэтил)метиламин и 1,06 г (7,1 ммоля) 2-меркаптобензимидазола в 30 40 мл изопропанола после кристаллизации из диизопропилового эфира по методу, который описан в примере В 3, в виде бежевого твердого вещества получают 2,9 г (98%-ный выход) указанного в заголовке соединения. tпл: 202 С(разл.). Г 1. 2-[2-(1 Н-Бензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламино этанол. а) 2-[(3-Хлор-2-хлорметилпиридин-4-ил) метиламино]этанол 7,4 мл (101,5 ммоля) тионилхлорида, растворенного в 50 мл дихлрометана при 4 С по каплям вводят в раствор 10,0 г(46,1 ммоля) 2-[(3-хлор-2-гидроксиметилпиридин-4-ил)метиламино]этанола в 150 мл дихлорметана. При этой температуре раствор перемешивают в течение 1 ч, растирают в смеси воды со льдом и нейтрализуют насыщенным раствором бикарбоната натрия. После отделения органического слоя водную фазу экстрагируют дихлорметаном. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток без дополнительной очистки используют в синтезе на описанной ниже стадии б). б) 2-[2-(1H-Бензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламино этанол. Раствор 10,2 г 2-[(3-хлор-2-хлорметилпиридин-4-ил)метиламино]этанола, полученного на стадии а), и 5,8 г (39 ммолей) 2 меркаптобензимидазола в 250 мл 2-пропанола кипятят с обратным холодильником в течение 2 ч. После охлаждения до 4 С осадок отфильтровывают, промывают 2-пропанолом и сушат в вакууме. Остаток растворяют в воде, водным раствором бикарбоната натрия значение рН доводят до 8 и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток кристаллизуют из этилацетата с получением в виде беловатого твердого вещества 7,9 г (58%-ный выход) указанного в заголовке соединения. tпл: 132-135 С. Г 2. 3-[2-(1H-Бензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламино пропанол. а) 3-[(3-Хлор-2-хлорметилпиридин-4-ил) метиламино]пропанол 3,5 мл (47,6 ммоля) тионилхлорида, растворенного в 25 мл дихлрометана при 4 С по каплям вводят в раствор 5,0 г(21,6 ммоля) 3-[(3-хлор-2-гидроксиметилпиридин-4-ил)метиламино]пропанола в 75 мл дихлорметана. При этой температуре раствор перемешивают в течение 1 ч, растирают в смеси воды со льдом и нейтрализуют насыщенным раствором бикарбоната натрия. После отделения органического слоя водную фазу экстрагируют дихлорметаном. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Ос 31 таток без дополнительной очистки используют в синтезе на описанной ниже стадии б). б) 3-[2-(1 Н-Бензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламинопропанол. Раствор 5,3 г 3-[(3-хлор-2-хлорметилпиридин-4-ил)метиламино]пропанола, полученного на стадии а), и 2,2 г (14,6 ммоля) 2 меркаптобензимидазола в 150 мл 2-пропанола кипятят с обратным холодильником в течение 2 ч. После охлаждения до 4 С осадок отфильтровывают, промывают 2-пропанолом и сушат в вакууме. Остаток растворяют в воде, водным раствором бикарбоната натрия значение рН доводят до 8 и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток кристаллизуют из этилацетата с получением в виде не совсем белого твердого вещества 3,6 г (46%-ный выход) указанного в заголовке соединения. tпл: 127130 С. Г 3. 2-[(3-Хлор-2-гидроксиметилпиридин-4 ил)метиламино]этанол. а) 2-[(2-Гидроксиметилпиридин-4-ил)метиламино]этанол. Смесь 20,0 г (139 ммолей) (4 хлорпиридин-2-ил)метанола с 11,7 мл (146 ммолей) 2-метиламиноэтанола в течение 1 ч перемешивают при 140 С. После охлаждения до комнатной температуры продукт в виде вязкого масла используют без дополнительной очистки в синтезе на описанной ниже стадии б). б) 2-[(3-Хлор-2-гидроксиметилпиридин-4 ил)метиламино]этанол. 25 г (187 ммолей) N-хлорсукцинимида 5 порциями в течение 3 ч вводят в раствор 30 г 2[(2-гидроксиметилпиридин-4-ил)метиламино] этанола, сырого продукта, полученного на стадии а) (140 ммолей), в 170 мл уксусной кислоты. Перемешивание продолжают в течение 1 ч и в вакууме выпаривают растворитель. Остаток обрабатывают 6 н. раствором гидроксида натрия и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток хроматографируют (диоксид кремния, толуол/диоксан в соотношении 2:1), в виде коричневого твердого вещества получая указанное в заголовке соединение. tпл: 49-53 С. Г 4. 3-[(3-Хлор-2-гидроксиметилпиридин-4 ил)метиламино]пропанол. Указанное в заголовке соединение готовят по изложенному в примере Г 3 в две стадии с использованием в качестве исходных материалов 15,3 г (106 ммолей) (4-хлорпиридин-2 ил)метанола и 10,0 г (112 ммолей) 3 метиламинопропанола и последующим хлорированием сырого продукта 19 г (143 ммоля) Nхлорсукцинимида. Выход: 6,4 г (26%) в виде бесцветного масла. 32 Конечные продукты 1. 3-Метил-4-[3-(3-нитроимидазо[1,2-b] пиридазин-6-илсульфанил)пропилсульфанил] пиридин-2-илметанол. 10,9 г гидрида натрия (суспензия 80%-ной концентрации) в токе азота суспендируют в 350 мл тетрагидрофурана. Далее при интенсивном перемешивании при комнатной температуре по каплям в течение 2 ч добавляют раствор 73 г(0,31 моля) [4-(3-меркаптопропилсульфанил)-3 метилпиридин-2-ил]метанола в 350 мл тетрагидрофурана. Затем суспензию перемешивают при комнатной температуре в течение дальнейших 2,5 ч. После этого в течение 3,5 ч по каплям добавляют раствор 51,6 г (0,26 моля) 6-хлор-3 нитроимидазо[1,2-b]пиридазина в 1000 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение дальнейших 18 ч. Далее смесь охлаждают до 0 С и обрабатывают при интенсивном перемешивании осторожным добавлением 500 мл воды. Затем отгоняют органический растворитель. Водный остаток разбавляют дополнительной 500-миллилитровой порцией воды и охлаждают до 0 С. Бежевый осадок отфильтровывают, промывают водой и сушат в высоком вакууме при 40 С. После этого сырой продукт растворяют в 1,2 л горячего толуола и осветляют 25 г активированного угля и 15 г кизельгура. После фильтрования при температуре кипения раствор концентрируют до остаточного объема 750 мл и обрабатывают 1,2 л диизопропилового эфира. Для полноты осаждения суспензию с перемешиванием охлаждают до 0 С. Осадок отфильтровывают и затем сушат в вакууме при 40 С. С целью дальнейшей очистки продукт суспендируют в 1,2 л горячего метанола и после охлаждения до комнатной температуры вновь обрабатывают 500 мл диизопропилового эфира. После фильтрования и сушки в вакууме получают 82 г (80%-ный выход) указанного в заголовке соединения с tпл 127-129 С. 2. Гидрохлорид 6-3-[2-(1 Н-бензимидазол 2-илсульфанилметил)-3-метилпиридин-4-илсульфанил]пропилсульфанил-3-нитроимидазо[1,2-b]пиридазина. Суспензию 0,39 г (0,95 ммоля) 6-[3-(2 хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина и 160 мг (1,05 ммоля) 2-меркапто-1 Нбензимидазола в 50 мл изопропанола кипятят с обратным холодильником в течение 7 ч. После охлаждения до комнатной температуры осадок отфильтровывают, промывают изопропанолом и сушат в вакууме при 40 С. В виде бежевого твердого вещества получают 0,46 г (86%-ный выход) указанного в заголовке соединения. tпл: 200-207 С (разл.). 3. Гидрохлорид 6-3-[3-метил-2-(пиридин 4-илсульфанилметил)пиридин-4-илсульфанил] пропилсульфанил-3-нитроимидазо[1,2-b]пиридазина. 33 Аналогично примеру 2 в 30 мл изопропанола проводят реакцию между 0,53 г (1,3 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина и 0,15 г (1,3 ммоля) 4 меркаптопиридина. Получают 0,59 г (87%-ный выход) указанного в заголовке соединения. tпл: 174-178 С. 4. 6-3-[3-Метил-2-(пиримидин-2-илсульфанилметил)пиридин-4-илсульфанил]пропилсульфанил-3-нитроимидазо[1,2-b]пиридазин. Суспензию 1,23 г (3,0 ммоля) 6-[3-(2 хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанил]-3-нитроимидазо[1,2b]пиридазина, 330 мг (2,9 ммоля) 2-меркаптопиримидина и 335 мг (3,3 ммоля) триэтиламина в 100 мл изопропанола кипятят с обратным холодильником в течение 4,5 ч. После охлаждения суспензию перемешивают при комнатной температуре в течение последующих 18 ч, а затем при 0 С в течение 0,5 ч. Осадок отфильтровывают,промывают изопропанолом и при 40 С сушат в вакууме. Далее кристаллическое твердое вещество суспендируют в 50 мл воды и 10 мл раствора карбоната натрия. После фильтрования и сушки в вакууме при 40 С в виде бледнобежевого твердого вещества получают указанное в заголовке соединение. Выход: 1,40 г(93%), tпл: 143-147 С. 5. Гидрохлорид 6-3-[3-метил-2-(5-тиазол 2-ил-1 Н-бензимидазол-2-илсульфанилметил) пиридин-4-илсульфанил]пропилсульфанил-3 нитроимидазо[1,2-b]пиридазина. Аналогично примеру 2 в 25 мл изопропанола и 20 мл диметилформамида проводят реакцию между 0,77 г (1,87 ммоля) 6-[3-(2 хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина и 0,35 г (1,5 ммоля) 6-тиазол-2-ил-1 Нбензимидазол-2-тиола. Получают 0,60 г (62%ный выход) указанного в заголовке соединения с tпл: 232-234 С. 6. Гидрохлорид 6-3-[3-метил-2-(5-метилсульфанил-1 Н-бензимидазол-2-илсульфанилметил)пиридин-4-илсульфанил]пропилсульфанил-3-нитроимидазо[1,2-b]пиридазина. Аналогично примеру 2 в 35 мл изопропанола проводят реакцию между 0,79 г (1,93 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо 34 дазина, 0,4 г (1,75 ммоля) 6-метилсульфонил 1 Н-бензимидазол-2-тиола в 30 мл изопропанола и 10 мл диметилформамида выдерживают при 95 С в течение 6 ч. После охлаждения суспензию перемешивают при комнатной температуре в течение последующих 18 ч. Отгоняют растворитель. Остаток растворяют в 40 мл 0,2 М раствора гидроксида натрия и интенсивно перемешивают в течение 15 мин. Осадок отфильтровывают, промывают водой и сушат в вакууме над гидроксидом калия. Далее твердое вещество дважды суспендируют с использованием в каждом случае по 20 мл горячего метанола. После фильтрования и сушки в вакууме при 40 С в виде бледно-бежевого твердого вещества получают указанное в заголовке соединение. Выход: 0,91 г (86%), tпл: 155-156 С. 8. Фумарат 6-3-[2-(2-метоксиэтилсульфанилметил)-3-метилпиридин-4-илсульфанил] пропилсульфанил-3-нитроимидазо[1,2-b]пиридазина. Раствор 0,47 мл (5 ммолей) 1-бром-2 метоксиэтана к 0,57 г (5 ммолей) тиоацетата калия в 10 мл безводного этанола в азотной атмосфере перемешивают при 70 С в течение 2 ч. Далее добавляют 0,95 мл раствора метоксида натрия 30%-ной концентрации и смесь перемешивают при 70 С в течение последующих 30 мин. Затем эту реакционную смесь вводят непосредственно в суспензию 1,0 г (2,4 ммоля) 6-[3(2-хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина в 20 мл изопропанола и перемешивают при 70 С в течение последующих 30 мин. Ее охлаждают до комнатной температуры, обрабатывают 50 мл воды и экстрагируют 3 порциями по 50 мл этилацетата. Органические экстракты промывают 20 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают хроматографией на силикагеле (элюент: толуол/диоксан в соотношении 2:1). Фракции с Rf 0,17 собирают и концентрируют. Остаток растворяют в 10 мл ацетона и обрабатывают горячим раствором 165 мг фумаровой кислоты в 20 мл ацетона. После охлаждения до 0 С указанное в заголовке соединение получают в виде бежевого кристаллического вещества. Выход: 0,47 г[1,2-b]пиридазина. В соответствии с методом, который описан в примере 8, с использованием в качестве исходных материалов 0,8 мл (5,9 ммоля) 1-(2 бромэтокси)-2-метоксиэтана, 0,68 г (5,9 ммоля) тиоацетата калия, 1,12 мл раствора метоксида натрия 30%-ной концентрации, 12 мл этанола,1,2 г (2,9 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3 нитроимидазо[1,2-b]пиридазина, 25 мл изопро 35 панола, 150 мг фумаровой кислоты и 20 мл ацетона в виде фумарата получают указанное в заголовке соединение, tпл: 128-129 С. 10. Тиоацетат S-3-метил-4-[3-(3-нитроимидазо[1,2-b]пиридазин-6-илсульфанил)пропилсульфанил]пиридин-2-илметила. Суспензию 0,44 г (3,75 ммоля) тиоацетата калия и 0,87 г (6,25 ммоля) карбоната калия в 10 мл диметилформамида при комнатной температуре перемешивают в течение 30 мин, после чего обрабатывают раствором 1,03 г (2,5 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2b] пиридазина в 10 мл диметилформамида. Эту суспензию перемешивают при комнатной температуре в течение последующих 18 ч. Далее добавляют 100 мл воды, смесь охлаждают до 0 С и фильтруют. После сушки твердого вещества при 40 С в вакууме его дополнительно суспендируют в горячем диизопропиловом эфире. После охлаждения до комнатной температуры твердое вещество вновь отфильтровывают и сушат. В виде бледно-бежевого твердого вещества получают 1,02 г (98%-ный выход) указанного в заголовке соединения. tпл: 138-140 С. 11. 6-Амино-2-3-метил-4-[3-(3-нитроимидазо[1,2-b]пиридазин-6-илсульфанил)пропилсульфанил]пиридин-2-илметилсульфанил-3 Нпиримидин-4-он. Суспензию 0,7 г (1,7 ммоля) 6-[3-(2 хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина, 0,275 г (1,7 ммоля) моногидрата 6 амино-2-меркапто-3 Н-пиримидин-4-она и 0,18 г(1,7 ммоля) карбоната натрия в 20 мл изопропанола кипятят с обратным холодильником в течение 2,5 ч. Затем эту суспензию вводят в 250 мл воды и перемешивают при комнатной температуре в течение последующих 30 мин. Осадок отфильтровывают, промывают водой, сушат в высоком вакууме и суспендируют в горячем метаноле. После повторных отфильтровывания и сушки в виде бледно-бежевого твердого вещества получают 0,83 г (94%-ный выход) указанного в заголовке соединения. tпл: 244-246 С. 12. 3-Метил-4-[3-(3-нитроимидазо[1,2-b] пиридазин-6-илсульфанил)пропилсульфанил] пиридин-2-илметил-1-тиоD-гликопиранозид. Суспензию 0,42 г (2,3 ммоля) натриевой соли 1-тиоD-гликопиранозы и 1,0 г (2,5 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина в 20 мл изопропанола в азотной атмосфере кипятят с обратным холодильником в течение 5 ч. Затем эту суспензию перемешивают при 0 С в течение еще 1 ч с последующим фильтрованием. Твердое вещество растворяют в 10 мл воды и 3 раза экстрагируют, используя в каждом случае по 50 мл смеси дихлорметана с метанолом (10:1). Объединенные 36 органические экстракты сушат над сульфатом магния и концентрируют до остаточного объема 20 мл. Далее суспензию перемешивают при-15 С в течение 30 мин. Осадок отфильтровывают, промывают дихлорметаном и сушат в высоком вакууме. В виде бледно-бежевого твердого вещества получают 0,3 г (23%-ный выход) указанного в заголовке соединения. tпл: 110115 С. 13. 6-[3-(2,3-Диметил-1-оксипиридин-4 илокси)пропокси]-3-нитроимидазо[1,2-b]пиридазин. 0,54 г Гидрида натрия (суспензия 80%-ной концентрации, 18 ммолей) при комнатной температуре порциями вводят в суспензию 3,26 г(16,5 ммоля) 3-(2,3-диметил-1-оксипиридин-4 илокси)пропан-1-ола в 275 мл безводного диметилформамида, после чего смесь перемешивают в течение дальнейших 2,5 ч. Затем точно так же при комнатной температуре по каплям добавляют раствор 2,98 г (15 ммолей) 6-хлор-3 нитроимидазо[1,2-b]пиридазина в 75 мл диметилформамида и смесь перемешивают в течение последующих 16 ч. После этого по каплям добавляют 150 мл воды и отгоняют тетрагидрофуран. К остатку при интенсивном перемешивании вновь добавляют 500 мл воды. Осадок отфильтровывают, промывают водой и сушат в вакууме. Фильтрат экстрагируют 3 порциями по 200 мл этилацетата. Органические экстракты промывают 150 мл воды, сушат над сульфатом магния и концентрируют. Остаток совместно с высушенным осадком растворяют в 175 мл горячего метанола, раствор осветляют небольшим количеством активированного угля, фильтруют и охлаждают до 0 С. Осадок отфильтровывают и сушат. В виде бледно-бежевого твердого вещества получают 3,26 г (60%-ный выход) указанного в заголовке соединения. tпл: 213-215 С. 14. Ацетат 3-метил-4-[3-(3-нитроимидазо[1,2-b]пиридазин-6-илокси)пропокси]пиридин 2-илметила. 2,7 г (7,5 ммоля) 6-[3-(2,3-диметил-1 оксипиридин-4-илокси)пропокси]-3-нитроимидазо[1,2-b]пиридазина и 7,2 мл (75 ммолей) уксусного ангидрида при 90 С выдерживают в течение 5 ч. После охлаждения до комнатной температуры добавляют 80 мл воды со льдом и затем с использованием 6 н. раствора гидроксида натрия рН доводят до 9-10. Осадок отфильтровывают под вакуумом, промывают водой и сушат. Остаток растворяют в 35 мл горячего толуола, осветляют активированным углем, концентрируют до остаточного объема 30 мл и охлаждают до комнатной температуры. Далее добавляют 50 мл диизопропилового эфира и при 0 смесь перемешивают в течение 1 ч. Осадок отфильтровывают, промывают дииизопропиловым эфиром и сушат. В виде бледно-бежевого твердого вещества получают 2,29 г (76%-ный выход) указанного в заголовке соединения. tпл: 148-151 С. 15. 3-Метил-4-[3-(3-нитроимидазо[1,2-b] пиридазин-6-илсульфанил)пропокси]пиридин-2 илметанол. 570 мг (2,9 ммоля) 3-нитроимидазо[1,2-b] пиридазин-6-тиола, 500 мг (2,3 ммоля) [4-(3 хлорпропокси)-3-метилпиридин-2-ил]метанола и 0,4 мл (2,9 ммоля) триэтиламина в 10 мл диметилформамида в азотной атмосфере выдерживают при 100 С в течение 1 ч. После охлаждения до комнатной температуры добавляют 100 мл воды и смесь экстрагируют 3 порциями по 50 мл этилацетата. Остаточный продукт в виде масла кристаллизуют из метанола. В виде бледно-бежевого твердого вещества получают 600 мг (69%-ный выход) указанного в заголовке соединения. tпл: 135-136 С. 16. 3-Хлор-4-[метил[2-(3-нитроимидазо[1,2-b]пиридазин-6-илсульфанил)этил]амино пиридин-2-ил]метанол. 0,33 г (1,28 ммоля) 3-хлор-4-[(2-хлорэтил)метиламино]пиридин-2-илметанола и 0,33 г (1,68 ммоля) 3-нитроимидазо[1,2-b]пиридазин 6-тиола в аргоновой атмосфере растворяют в 10 мл безводного диметилформамида и раствор обрабатывают 0,25 мл (1,53 ммоля) ДБУ, а затем при 50 С перемешивают в течение 5 ч. Далее его охлаждают до комнатной температуры и разбавляют этилацетатом. Осадок отфильтровывают, промывают этилацетатом и диэтиловым эфиром и сушат. В виде бледно-бежевого твердого вещества получают 0,36 г (71%-ный выход) указанного в заголовке соединения. tпл: 189-191 С. 17. [2-(1H-Бензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метил-[2-(3-нитроимидазо[1,2-b]пиридазин-6-илсульфанил)этил] амин. В 10 мл диметилформамида в соответствии с методом, описанным в примере 16, проводят реакцию с участием 0,44 г (1,0 моля) [2-(1 Нбензимидазол-2-ил-сульфанилметил)-3-хлорпиридин-4-ил]-(2-хлорэтил)метиламина, 0,24 г(1,2 ммоля) 3-нитроимидазо[1,2-b]пиридазин-6 тиола и 0,52 мл (3,5 ммоля) ДБУ. После кристаллизации из диизопропилового эфира в виде бледно-бежевого твердого вещества получают 0,35 г (66%-ный выход) указанного в заголовке соединения. tпл: 184-185C. 18. [3-Хлор-2-(пиримидин-2-илсульфанилметил)пиридин-4-ил]метил-[2-(3-нитроимидазо(1,02 ммоля) 3-нитроимидазо[1,2-b]пиридазин 6-тиола и 0,15 мл (1,02 ммоля) ДБУ. После кристаллизации из диизопропилового эфира в виде бледно-бежевого твердого вещества получают 0,31 г (62%-ный выход) указанного в заголовке соединения. tпл: 174-175 С.(1,5 ммоля) 1-фенил-1 Н-тетразол-5-тиола в 30 мл изопропанола в течение 2 ч кипятят с обратным холодильником в азотной атмосфере. Далее смесь охлаждают до 0 С, перемешивают в течение еще 0,5 ч и затем фильтруют. Осадок промывают изопропанолом и сушат в вакууме. В виде бледно-бежевого твердого вещества получают 0,84 г (95%-ный выход) указанного в заголовке соединения. tпл: 204-207 С. 20. 4-5-3-Метил-4-[3-(3-нитроимидазо(1,5 ммоля) 4-(5-меркаптотетразол-1-ил)фенола в 30 мл изопропанола в течение 2 ч кипятят с обратным холодильником в азотной атмосфере. Далее смесь концентрируют. Остаток растворяют в 30 мл воды с использованием 2 н. раствора гидроксида натрия значение рН доводят до 9 и экстрагируют 4 порциями по 30 мл дихлорметана. Органические экстракты промывают водой,сушат над сульфатом магния и концентрируют. Остаток растворяют в 200 мл горячего ацетонитрила, раствор осветляют активированным углем, фильтруют, концентрируют до остаточного объема 50 мл и охлаждают до 0 С. Осадок отфильтровывают, промывают ацетонитрилом и сушат. В виде бледно-бежевого твердого вещества получают 0,64 г (75%-ный выход) указанного в заголовке соединения. tпл: 92 С (разл.). 21. Гидрохлорид 6-3-3-метил-2-[1-(3 метилпиридин-2-ил)-1 Н-имидазол-2-илсульфанилметил]пиридин-4-илсульфанилпропилсульфанил-3-нитроимидазо[1,2-b]пиридазина. 2,13 г (5,2 ммоля) 6-[3-(2-хлорметил-3 метилпиридин-4-ил-сульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина и 1,0 г(5,2 ммоля) 1-(3-метилпиридин-2-ил)-1 Нимидазол-2-тиола в 100 мл изопропанола в течение 3 ч кипятят с обратным холодильником в азотной атмосфере. Далее смесь охлаждают до 0 С, перемешивают в течение еще 0,5 ч и затем фильтруют. Осадок растворяют в 75 мл горячей воды, раствор осветляют активированным углем, фильтруют в горячем состоянии и концентрируют досуха. Остаток кристаллизуют из изопропанола, фильтруют и сушат в вакууме. В виде бледно-бежевого твердого вещества получают 1,44 г (45%-ный выход) указанного в заголовке соединения. tпл: 180-182 С.(5,6 ммоля) 1-пиридин-2-ил-1 Н-имидазол-2 тиола в 100 мл изопропанола в течение 2 ч кипятят с обратным холодильником в азотной атмосфере. Далее смесь охлаждают до комнатной температуры, обрабатывают 1 л воды и экстрагируют 4 порциями по 200 мл этилацетата. Органические экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток очищают хроматографией на силикагеле(элюент: этилацетат/метанол/аммиак в соотношении 19:1:0,6). Фракции с Rf 0,35 концентрируют и кристаллизуют из метанола. В виде бледно-бежевого твердого вещества получают 0,45 г указанного в заголовке соединения. tпл: 146-149 С. 23. 6-[3-(2-Метоксиметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазин. Раствор 0,69 мл метанолята натрия (30%ной концентрации) вводят в суспензию 1,23 (3 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b]пиридазина в 75 мл метанола. После кипячения с обратным холодильником в течение 16 ч и охлаждения до комнатной температуры растворитель выпаривают в вакууме. Остаток хроматографируют на диоксиде кремния(элюент: толуол/диоксан в соотношении 5:1) и кристаллизуют из диизопропилового эфира/этилацетата с получением в виде не совсем белых кристаллов 0,34 г (28%-ный выход) указанного в заголовке соединения. tпл: 107-110 С. 24. 6-3-[2-(4,6-Диметилпиримидин-2-илсульфанилметил)-3-метилпиридин-4-илсульфанил]пропилсульфанил-3-нитроимидазо[1,2-b] пиридазин. Суспензию 0,35 г (2,5 ммоля) 4,6 диметилпиримидин-2-тиола и 1,03 (2,5 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2-b] пиридазина в 50 мл 2-пропанола в течение 4 ч кипятят с обратным холодильником в азотной атмосфере. После охлаждения смесь обрабатывают 100 мл воды со льдом, раствором гидроксида натрия 40%-ной концентрации значение рН доводят до 10 и экстрагируют этилацетатом. Объeдиненные экстракты промывают раствором карбоната натрия, сушат над сульфатом магния и выпаривают в вакууме. Остаток кристаллизуют из ацетонитрила с получением в виде бесцветного твердого вещества 0,93 г (76%-ный выход) указанного в заголовке соединения. tпл: 145-147 С.[1,2-b]пиридазина в 50 мл 2-пропанола в течение 4 ч кипятят с обратным холодильником в азотной атмосфере. После охлаждения смесь обрабатывают 100 мл воды со льдом, раствором гидроксида натрия 40%-ной концентрации значение рН доводят до 10 и экстрагируют этилацетатом. Объединенные экстракты промывают раствором карбоната натрия, сушат над сульфатом магния и выпаривают в вакууме. Остаток хроматографируют на диоксиде кремния (толуол/диоксан в соотношении 2:1) и кристаллизуют из ацетонитрила с получением в виде бесцветного твердого вещества 0,49 г (39%-ный выход) указанного в заголовке соединения. tпл: 136138 С. 26. Гидрохлорид 2-3-метил-4-[3-(3 нитроимидазо[1,2-b]пиридазин-6-илсульфанил) пропилсульфанил]-пиридин-2-илметилсульфанилпиримидин-4,6-диамина. Суспензию 0,36 г (2,5 ммоля) 4,6 диаминопиримидин-2-тиола и 1,03 (2,5 ммоля) 6-[3-(2-хлорметил-3-метилпиридин-4-илсульфанил)пропилсульфанил]-3-нитроимидазо[1,2b]пиридазина в 50 мл 2-пропанола в течение 6 ч кипятят с обратным холодильником в азотной атмосфере. После охлаждения до 4 С осадок отфильтровывают, промывают холодным 2 пропанолом и сушат в вакууме. Сырой продукт растирают в 15 мл горячего ацетонитрила,фильтруют и вновь сушат в вакууме с получением в виде не совсем белого твердого вещества 1,25 г (90%-ный выход) указанного в заголовке соединения. tпл: 215-224 С. 27. Гидрохлорид [2-(1 Н-бензимидазол-2 илсульфанилметил)-3-хлорпиридин-4-ил]метил[2-(3-нитроимидазо[1,2-b]пиридазин-6-илокси) этил]амина. Раствор 7,5 г (21,5 ммоля) 2-[2-(1 Нбензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламиноэтанола в 75 мл диметилформамида обрабатывают 1,4 г гидрида натрия (суспензия 80%-ной концентрации) и в течение 1 ч перемешивают при комнатной температуре. Далее по каплям в течение 20 мин добавляют 4,3 г (21,5 ммоля) 6-хлор-3 нитроимидазо[1,2-b]пиридазина в 50 мл тетрагидрофурана и перемешивание продолжают в течение еще 2 ч. Раствор обрабатывают 750 мл воды и экстрагируют большим количеством этилацетата. Объединенные органические экстракты промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток хроматографируют на диоксиде кремния (толу 41 ол/диоксан/аммиак в соотношении 2:1:0,1) и кристаллизуют из этилацетата. Сырой продукт растворяют в 250 мл кипящего 2-пропанола и обрабатывают древесным углем. После фильтрования и охлаждения до 35 С добавляют 1,5 мл насыщенного раствора хлорида водорода в диэтиловом эфире и смесь охлаждают до 4 С. Осадок отфильтровывают, промывают 2 пропанолом и сушат в вакууме с получением в виде бледно-желтого твердого вещества 3,6 г(31%-ный выход) указанного в заголовке соединения. tпл: 211-212 С. 28. Гидрохлорид [2-(1 Н-бензимидазол-2 илсульфанилметил)-3-хлорпиридин-4-ил]метил[3-(3-нитроимидазо[1,2-b]пиридазин-6-илокси) пропил]амина. С использованием в качестве исходных материалов 3,0 г (8,7 ммоля) 3-[2-(1Hбензимидазол-2-илсульфанилметил)-3-хлорпиридин-4-ил]метиламинопропан-1-ола (см. пример Г 2), 1,72 г (8,7 ммоля) 6-хлор-3 нитроимидазо[1,2-b]пиридазина и 0,62 г гидрида натрия (суспензия 80%-ной концентрации) указанное в заголовке соединение получают и очищают в соответствии с методом, приведенным в примере 27. Выход: 1,95 г (42%). tпл: 202203 С. Промышленная применимость Исключительно высокая эффективность соединений формулы I и их солей против бактерий Helicobacter позволяет использовать их в терапии человека в качестве действующих веществ при лечении болезней, которые вызваны бактериями Helicobacter. Таким образом, объектом изобретения далее является способ лечения млекопитающих, в частности людей, которые страдают заболеваниями, вызванными бактериями Helicobacter. Этот способ включает введение в организм больного человека терапевтически эффективного и фармакологически допустимого количества одного или нескольких соединений формулы I и/или их фармацевтически приемлемых солей. Кроме того, объектом изобретения являются соединения формулы I и их фармацевтически приемлемые соли, предназначенные для использования при лечении заболеваний, вызванные бактериями Helicobacter. Объектом изобретения является также применение соединений формулы I и их фармацевтически приемлемых солей при приготовлении лекарственных средств, которые используют для лечения тех заболеваний, которые вызваны бактериями Helicobacter. Таким образом, объектом изобретения являются предназначенные для борьбы против бактерий Helicobacter лекарственные средства,которые включают одно или несколько соединений общей формулы I и/или их фармацевтически приемлемые соли. Из штаммов Helicobacter, против которых соединения формулы I признаны эффективны 001734pylori. Лекарственные средства готовят по методам, которые известны специалистам в данной области техники. В качестве лекарственных средств фармакологически действующие соединения формулы I и их соли (т.е. действующие соединения) используют либо индивидуально,либо, что предпочтительно, в сочетании с приемлемыми фармацевтическими вспомогательными средствами, например, в форме таблеток,таблеток с покрытиями, капсул, эмульсий, суспензий, гелей или растворов, причем предпочтительное содержание действующего соединения составляет 0,1-95%. Принимая во внимание знания специалиста в данной области техники, можно предположить, что ему известны вспомогательные средства, которые пригодны для приготовления целевых фармацевтических препаратов. Помимо растворителей, желатинизаторов, вспомогательных средств для таблетирования и других наполнителей для действующих соединений,можно использовать, например, антиоксиданты,диспергаторы, эмульгаторы, пеногасители, корригенты, консерванты, стабилизаторы, красители, агенты, содействующие проникновению, и комплексообразователи (например, циклодекстрины). Действующие соединения можно вводить,например, парентерально (в частности, внутривенно) или перорально. При терапии человека для достижения целевого результата действующие соединения обычно вводят в ежедневной дозе от примерно 0,2 до 50, предпочтительно 1-30 мг/кг массы тела, причем, если приемлемо, то в форме нескольких предпочтительно 2-6-разовых доз для достижения необходимого результата. Предлагаемые в соответствии с изобретением соединения можно также вводить в фиксированном или свободном сочетании совместно с веществом, нейтрализующим желудочный сок, и/или подавляющим секрецию желудочного сока, и/или с веществом, пригодными для обычной борьбы против микроорганизмов Helicobacter pylori. В качестве примеров веществ, которые нейтрализуют желудочный сок, можно упомянуть, в частности, бикарбонат натрия или другие антацидные средства (такие как гидроксид алюминия, алюминат магния или магалдрат(magaldrat). В качестве веществ, которые подавляют секрецию желудочного сока, можно упомянуть, например, Н 2-блокаторы (в частности,циметидин, ранитидин), ингибиторы Н+/К+АТФазы (в частности, лансопразол, омепразол или прежде всего пантопразол), равно как и так называемые периферические антихолинергические средства (в частности, пирензепин, телензепин). В качестве примеров веществ, приемлемых для обычной борьбы против микроорганизмовHelicobacter pylori, можно упомянуть, в частности, вещества с антимикробным действием, такие, как пенициллин G, гентамицин, эритромицин, кларитромицин, нитрофуразон, тинидазол,нитрофурантоин, фуразолидон, метронидазол и амоксициллин, или также соли висмута, такие как цитрат висмута. Биологические исследования Соединения формулы I исследовали в отношении их действия против микроорганизмовHelicobacter pylori в соответствии с методологией, описанной Tomoyuki Iwahi и др. (Antimicrobial Agents and Chemotherapy, 1991, 490-496), с использованием колумбийского агара (Oxoid) и периодом роста 4 дня. В приведенной ниже таблице А представлены значения минимальной ингибирующей концентрации (МИК 50), установленные для исследованных соединений (указанные номера соединений соответствуют номерам примеров в описании). Что касается их действия in vivo против микроорганизмов Helicobacter felis, то соединения формулы I были исследованы на мышах в соответствии с методологией, описанной Е.Dick-Hegedus и A. Lee (Scand. J. Gastroenterol. 1991, 26, 909-915). Вещества вводили перорально по 3 раза по 50 мг/г в течение 4 дней. В приведенной ниже таблице А представлены полученные данные степени элиминации исследованных соединений. Соединение 1 4 9 13 15 17 18 25 27R113 обозначает водород или С 1-С 4 алкил,или где R112 и R113, совместно и включая азотный атом, с которым они оба связаны, обозначают пиперидиновый или морфолиновый радикал,R2 обозначает водород, С 1-С 4 алкил или галоген,А обозначает С 2-С 7 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4 алкил иZ обозначает О (кислород) или S (серу),или соли этого соединения и его N-оксиды, или соли N-оксидов. 2. Соединение по п.1 формулы IR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, С 1-С 4 алкоксикарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему, замещенную радикалами R11 и R12, которую выбирают из группы,включающей пиррол, фуран, тиофен, пиразол,имидазол, имидазолин, оксазол, изоксазол, тиазол, тиазолин, изотиазол, триазол, оксадиазол,тиадиазол, тиадиазол-1-оксид, тетразол, гексо в которой R1, R2, А, X, Y и Z имеют значения,указанные в п.1, или соли этого соединения и его N-оксиды, или соли N-оксидов. 3. Соединение по п.1 формулы I, в которойR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SO3H), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей пиррол, фуран, тиофен, пиразол, имидазол, имидазолин,оксазол, изоксазол, тиазол, тиазолин, изотиазол,триазол, оксадиазол, тиадиазол, тиадиазол-1 оксид, тетразол, гексопиранозы, бензол, пири 45 дин, пиридин-N-оксид, пиридазин, пиримидин,пиразин, нафталин, хинолин, хиназолин, хиноксалин, бензимидазол, бензотиазол, тиазолопиридин и имидазопиридин,где R11 обозначает водород, С 1-С 4 алкил, С 3 С 7 циклоалкил, С 1-С 4 алкокси, С 1-С 4 алкоксиС 1 С 4 алкокси, С 1-С 4 алкилкарбонил, амино-, С 1 С 4 алкилкарбониламиногруппу, галоген, трифторметил, трифторметокси, гидроксил, карбоксил, С 1-С 4 алкоксикарбонил, С 1-С 4 алкилтио, С 1 С 4 алкилсульфонил, нитрогруппу, фенил, фенил,замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С 1-С 4 алкил, замещенный радикалом R111, группу -N(R112)R113 или -CON(R112)R113, aR12 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси, галоген, аминогруппу, гидроксил или фенил,где R111 обозначает гидроксил, С 1-С 4 алкил, С 1 С 4 алкокси, карбоксил, галоген, аминосульфонил или группу -N(R112)R113,R112 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкилкарбонил или С 1-С 4 алкоксикарбонил, аR113 обозначает водород или С 1-С 4 алкил,R2 обозначает водород, С 1-С 4 алкил или галоген,А обозначает С 2-С 7 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4 алкил иZ обозначает О (кислород) или S (серу),или соли этого соединения и его N-оксиды, или соли N-оксидов. 4. Соединение по п.1 формулы I, в которойR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SО 3 Н), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол,тетразол, гексопиранозы, пиридин, пиридин-Nоксид, пиримидин, бензимидазол и тиазолопиридин,где R11 обозначает водород, С 1-С 4 алкил, С 3 С 7 циклоалкил, С 1-С 4 алкокси, С 1-С 4 алкоксиС 1 С 4 алкокси, С 1-С 4aлкилкарбонил, аминогруппу,галоген, трифторметил, гидроксил, карбоксил,С 1-С 4 алкоксикарбонил,С 1-С 4 алкилтио,С 1 С 4 алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил, пиридил, замещенный радикалом R111, имидазолилдион, тиазолил, С 1-С 4 алкил, замещенный радикалом R111,или группу -N(R112)R113, aR12 обозначает водород, С 1-С 4 алкил, аминогруппу или гидроксил,где R111 обозначает гидроксил, С 1-С 4 алкил, С 1 С 4 алкокси или группу -N(R112)R113,R112 обозначает водород, С 1-С 4 алкил или С 1-С 4 алкилкарбонил, аR113 обозначает водород или С 1-С 4 алкил, 001734Z обозначает О (кислород) или S (серу),или соли этого соединения и его N-оксиды, или соли N-оксидов. 5. Соединение по п.1 формулы IR1 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкил, замещенный радикалом R11, С 1 С 4 алкилкарбонил, сульфогруппу (-SO3 Н), циклическую систему или бициклическую систему,замещенную радикалами R11 и R12, которую выбирают из группы, включающей имидазол,тетразол, пиридин, пиримидин и бензимидазол,где R11 обозначает водород, С 1-С 4 алкил, С 1 С 1-С 4 алкоксиС 1-С 4 алкокси,С 1 С 4 алкокси,С 4 алкилтио, С 1-С 4 алкилсульфонил, фенил, фенил, замещенный радикалом R111, пиридил,пиридил, замещенный радикалом R111, или тиазолил,R12 обозначает водород,где R111 обозначает гидроксил или С 1-С 4 алкил,R2 обозначает С 1-С 4 алкил или галоген,А обозначает С 2-С 4 алкилен,Х обозначает линию связи, О (кислород) или S (серу),Y обозначает О (кислород), S (серу) или NС 1-С 4 алкил иZ обозначает О (кислород) или S (серу),или соли этого соединения и его N-оксиды, или соли N-оксидов. 6. Соединение по п.1 формулы IZ обозначает О (кислород) или S (серу),или соли этого соединения и его N-оксиды, или соли N-оксидов. 7. Соединение по п.1 формулы I, в которой Х обозначает S (серу), Y обозначает S (серу) и Z обозначает S (серу). 8. Соединение по п.1 формулы I, в которой А обозначает С 2-С 4 алкилен, Х обозначает S (се 47 ру), Y обозначает N-С 1-С 4 алкил, а Z обозначает О (кислород). 9. Лекарственное средство, включающее соединение по п.1 совместно с обычными фар 48 мацевтическими вспомогательными средствами или наполнителями. 10. Применение соединений по п.1 для борьбы против бактерий Helicobacter.
МПК / Метки
МПК: C07D 487/04, A61P 31/04, A61K 31/5025
Метки: имидазопиридазины
Код ссылки
<a href="https://eas.patents.su/25-1734-imidazopiridaziny.html" rel="bookmark" title="База патентов Евразийского Союза">Имидазопиридазины</a>
Предыдущий патент: Производные эритромицина, способ их получения и применение
Следующий патент: Способ холодной переработки муниципальных отходов и/или жидких отбросов в инертные материалы, установка для осуществления способа и получаемый продукт
Случайный патент: Соединения и композиции в качестве ингибиторов протеинкиназы
























