Применение мутантного полипептида &beta-цепи рецептора интерферона типа i для приготовления лекарственного средства, модулирующего эффекты интерферона-&beta, и фармацевтическая композиция, содержащаяуказанный полипептид
Формула / Реферат
1. Применение мутантного полипептида b-цепи рецептора интерферона типа I (IFNAR2) (MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1, мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100, обладающего повышенной аффинностью к интерферону-b (IFN-b) по сравнению с полипептидом дикого типа, или аналога указанного мутантного полипептида, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100, или его соли, для производства лекарственного средства, модулирующего эффекты IFN-b.
2. Применение по п.1, где мутации представляют собой замены.
3. Применение по п.2, где замены являются неконсервативными.
4. Применение по любому из пп.1-3, где остаток гистидина в положении 78 заменен на аланин.
5. Применение по любому из пп.1-4, где остаток аспарагина в положении 100 заменен на аланин, аспарагиновую кислоту или гистидин.
6. Применение по п.4 или 5, где оба остатка в положениях 78 и 100 заменены на аланин.
7. Применение по п.1, где указанный мутантный полипептид включает последовательности SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4.
8. Применение по любому из пп.1-7, где аффинность мутантного полипептида к IFN-b составляет приблизительно 30 пМ.
9. Применение по любому из пп.1-7, где аффинность мутантного пептида к IFN-b приблизительно в 25, предпочтительно в 50 и более предпочтительно в 100 раз выше, чем аффинность полипептида IFNAR2 дикого типа.
10. Применение по любому из пп.1-7, где аналог MIFNAR 2 содержит экстрацеллюлярный домен.
11. Применение по любому из пп.1-10, где указанный мутантный полипептид ковалентно связан с IFN-b.
12. Применение по любому из пп.1-11, где указанный мутантный полипептид является ПЭГилированным.
13. Применение по любому из пп.1-12, где лекарственное средство дополнительно включает IFN-b.
14. Применение по п.13, где лекарственное средство дополнительно включает антагонист IFN-b.
15. Применение по любому из пп.1-12, где указанное лекарственное средство усиливает активность IFN-b.
16. Применение по п.15, где указанное лекарственное средство усиливает противоопухолевую активность IFN-b.
17. Применение по п.15, где указанное лекарственное средство усиливает иммуномодулирующую активность IFN-b.
18. Применение по п.17, где указанное лекарственное средство усиливает иммуномодулирующую активность IFN-b при аутоиммунных заболеваниях, выбранных из рассеянного склероза, ревматоидного артрита, миастении гравис, диабета, системной красной волчанки и язвенного колита.
19. Применение по любому из пп.1-12, где указанное лекарственное средство ингибирует активность IFN-b.
20. Применение по любому из пп.1-13, где лекарственное средство предназначено для лечения аутоиммунного заболевания, вирусного заболевания или рака.
21. Применение по п.20, где заболевание выбрано из рассеянного склероза, ревматоидного артрита, злокачественной миастении, диабета, язвенного колита, системной красной волчанки, хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза, гепатита А, хронической инфекции вирусами гепатита В и С, лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы и меланомы.
22. Применение по любому из пп.20 или 21, где лекарственное средство дополнительно содержит терапевтически активное количество IFN-b.
23. Применение по любому из пп.1-12, где лекарственное средство предназначено для лечения заболевания, вызванного или осложненного IFN-b.
24. Применение по п.23, где лекарственное средство дополнительно содержит антагонист IFN-b.
25. Применение по любому из пп.1-12, где лекарственное средство предотвращает олигомеризацию IFN-b.
26. Фармацевтическая композиция, включающая терапевтически эффективное количество мутантного полипептида b-цепи рецептора интерферона типа I (IFNAR2) (MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1, мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100, или его аналога, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100.
27. Фармацевтическая композиция по п.26, где указанное терапевтически эффективное количество MIFNAR2 по меньшей мере в 30 раз меньше терапевтически эффективного количество IFNAR2 дикого типа.
28. Фармацевтическая композиция по п.26 или 27, дополнительно включающая IFN-b.
29. Фармацевтическая композиция по п.26 или 27, дополнительно содержащая антагонист IFN-b.
30. Фармацевтическая композиция по п.28, где мутантный полипептид IFNAR2 ковалентно связан с IFN-b.
31. Фармацевтическая композиция по любому из пп.26 или 30, где указанный аналог IFNAR2 содержит экстрацеллюлярный домен.
32. Фармацевтическая композиция по любому из пп.26-31 для усиления противоопухолевых и противовирусных свойств, а также иммуномодулирующих свойств IFN-b.
33. Фармацевтическая композиция по п.32 для лечения хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза, гепатита А, хронической инфекции, вызванной вирусами гепатита В и С, лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы, меланомы, рассеянного склероза, ревматоидного артрита, злокачественной миастении, диабета, язвенного колита и системной красной волчанки.
34. Фармацевтическая композиция по п.29 для ингибирования иммуномодулирующих свойств IFN-b.
Текст
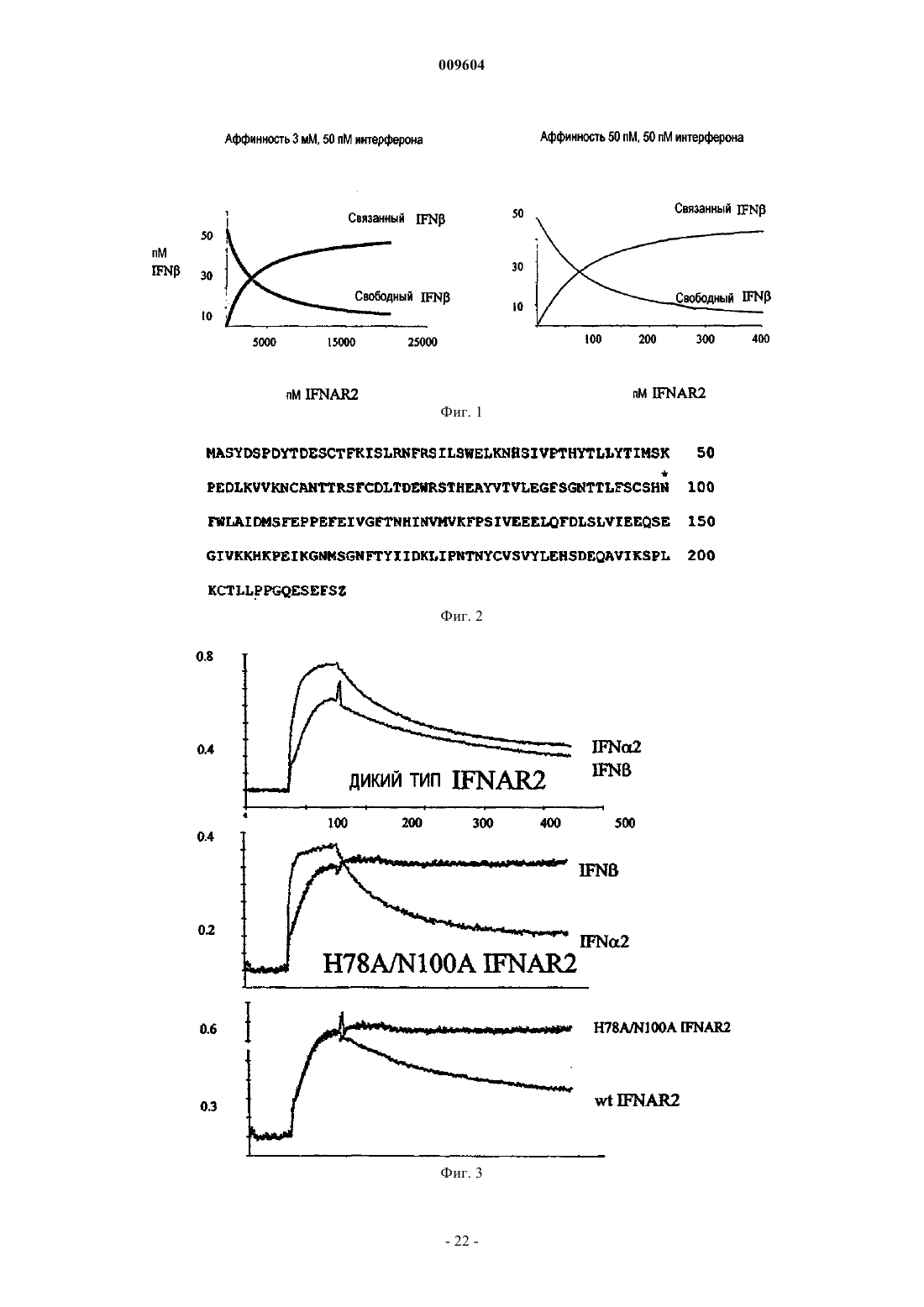
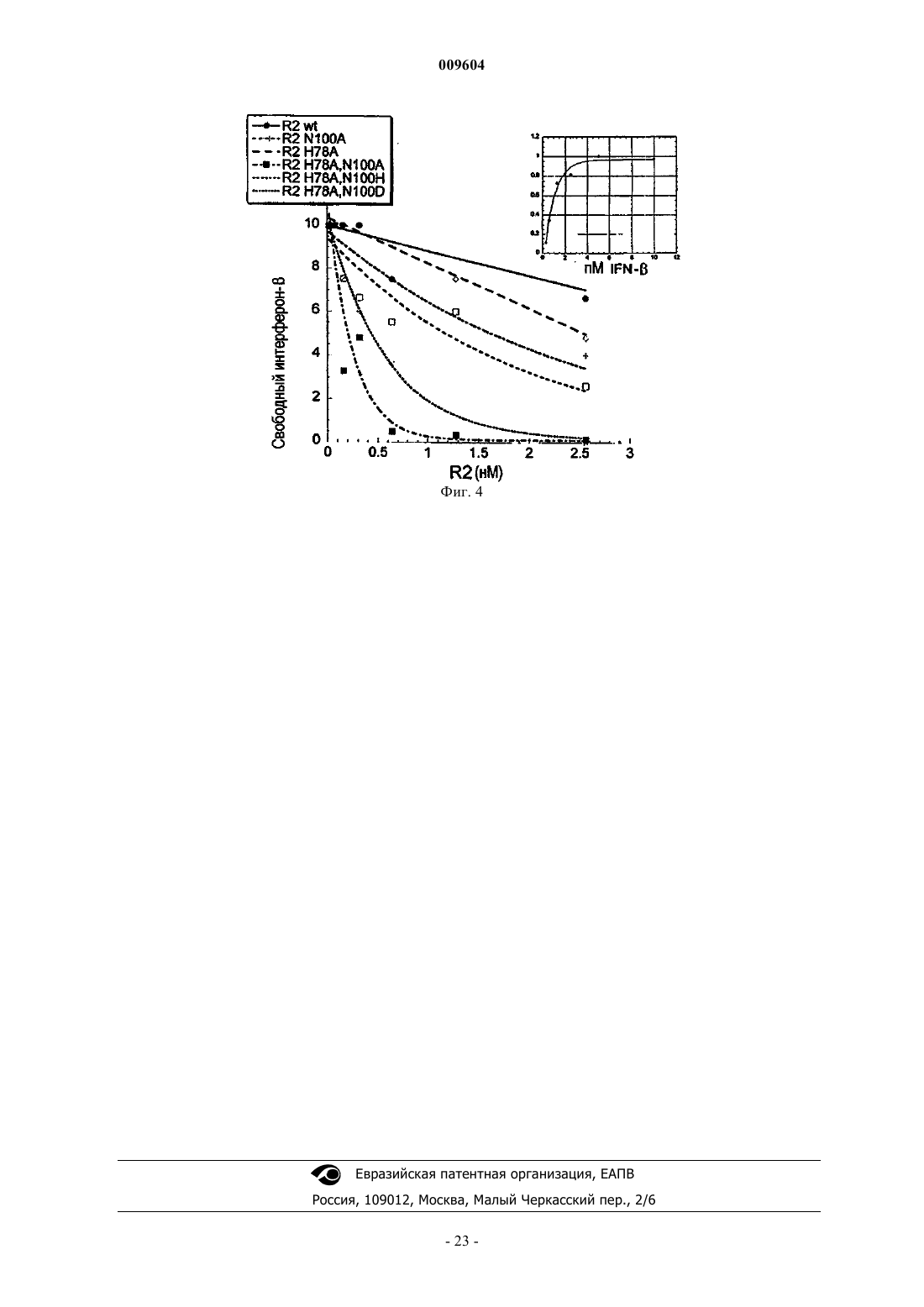
009604 Область изобретения Настоящее изобретение относится к мутантным полипептидам -цепи рецептора IFN типа I (MIFNAR2) с увеличенной аффинностью к интерферону- по сравнению с белком дикого типа для продления действия IFN- in vivo. Предпосылки изобретения Интерфероны классифицируют или как происходящие из лейкоцитов или фибробластов интерфероны типа I, или как индуцируемые митогеном или "иммунные" интерфероны типа II (Pestka et al., 1987). Посредством анализа идентичности последовательностей и общих видов биологической активности интерфероны типа I включают интерферон- (IFN-), интерферон- (IFN-) и интерферон- (IFN-), тогда как интерферон типа II включает интерферон- (IFN-). Гены IFN-, IFN- и IFN- расположены группой в 25 полосе на коротком плече хромосомы 9(Lengyl, 1982). Существует по меньшей мере 25 неаллельных генов IFN-, 6 неаллельных генов IFN- и единственный ген IFN-. Как полагают, все они произошли из единственного общего предкового гена. В пределах вида гены IFN- обладают по меньшей мере 80% идентичности последовательности друг с другом. Ген IFN- обладает приблизительно 50% идентичности последовательности с IFN-, а ген IFNобладает 70% гомологии с IFN- (Weissman et al., 1986; Dron et al., 1992). IFN- обладает молекулярной массой в диапазоне 17-23 кДа (165-166 аминокислот), IFN- - приблизительно 23 кДа (166 аминокислот),а IFN- - приблизительно 24 кДа (172 аминокислоты). Интерфероны типа I представляют собой плейотропные цитокины, обладающие активностью, такой как защита хозяина против вирусных и паразитарных инфекций, противоопухолевыми свойствами и активностью как иммуномодуляторы (Baron et al., 1994; Baron et al., 1991). Физиологические ответы на интерфероны типа I включают антипролиферативное действие на нормальные и трансформированные клетки, стимуляцию цитотоксической активности в лимфоцитах, природных киллерных клетках и фагоцитарных клетках, модуляцию клеточной дифференцировки, стимуляцию экспрессии антигенов МНС класса I, ингибирование МНС класса II и модуляцию разнообразия рецепторов на клеточной поверхности. В нормальных физиологических условиях IFN- и IFN- (IFN-/) в низких уровнях конститутивно секретируются большинством клеток человека, с экспрессией, стимулируемой добавлением ряда индукторов, включающих инфекционные агенты (вирусы, бактерии, микоплазму и простейшие одноклеточные), дцРНИ и цитокины (M-CSF, IL-1, IL-2, TNF). Действия интерферона типа I in vivo можно контролировать с применением суррогатных маркеров, неоптерина, 2',5'-олигоаденилатсинтетазы и 2 микроглобулина (Alam et al., 1997; Fierlbeck et al., 1996; Salmon et al., 1996). Интерфероны типа I (IFN-//) действуют через рецепторный комплекс на клеточной поверхности, индуцируя специфические биологические эффекты, такие как противовирусные, противоопухолевые и иммуномодуляторы. Рецептор IFN типа I (IFNAR) представляет собой гетеромультимерный рецепторный комплекс, состоящий по меньшей мере из двух различных полипептидных цепей (Colamonici et al.,1992; Colamonici et al., 1993; Platanias et al., 1993). Кодирующие данные цепи гены расположены на хромосоме 21, а кодируемые ими белки экспрессируются на поверхности большинства клеток (Tan et al.,1973). Цепи рецептора, первоначально обозначенные каки , затем переименовали в IFNAR1 для субъединицы и IFNAR2 для -субъединицы. В большинстве клеток IFNAR1 (-цепь, субъединица Uze)(Uze et al., 1990) обладает молекулярной массой 100-130 кДа, тогда как IFNAR2 (-цепь, L, IFN-/R) обладает молекулярной массой 100 кДа. В некоторых типах клеток (линии моноцитарных клеток и нормальные клетки костного мозга) идентифицирован альтернативный рецепторный комплекс, где субъединица IFNAR2 (S) экспрессируется как укороченный рецептор с молекулярной массой 51 кДа. Субъединицы IFNAR1 и IFNAR2 L и S клонированы (Novick et al., 1994; Domanski et al., 1995). СубъединицыIFNAR2 L и S обладают идентичными внеклеточными и трансмембранными доменами, однако в цитоплазматическом домене идентичными у них являются только первые 15 аминокислот. Субъединица IFNAR2 способна связывать IFN-/ самостоятельно, тогда как субъединица IFNAR1 не способна связывать IFN-/. Когда одну рецепторную субъединицу IFNAR1 человека трансфицируют в мышиные фибробласты L-929, человеческие IFN-, за исключением IFN-8/IFN-B, не способны связываться с клетками (Uze et al., 1990). Субъединица IFNAR2 человека, трансфицированная в L-клетки в отсутствие субъединицы IFNAR1 человека, связывает человеческий IFN-, связываясь с Kd, приблизительно равной 0,45 нМ. Когда субъединицы IFNAR2 человека трансфицируют в присутствии субъединицы человеческого IFNAR1, можно продемонстрировать связывание с высокой аффинностью с Kd, равной 0,026-0,114 нМ (Novick et al., 1994; Domanski et al., 1995). Рассчитано, что на большинстве клеток присутствуют от 500 до 20000 участков связывания IFN с высокой аффинностью и от 2000 до 100000 участков связывания IFN с низкой аффинностью. Хотя субъединицы комплекса IFNAR1/2 (/S или /L) связывают IFN- с высокой аффинностью, оказывается, что только пара /L представляет собой функциональный сигнальный рецептор. Трансфекция субъединиц IFNAR1 и IFNAR2 L в мышиные клетки L-929 с последующей инкубацией с IFN-2 индуцировала противовирусное состояние, инициировала фосфорилирование внутрикле-1 009604 точных белков и вызывала активацию внутриклеточных киназ (Jak1 и Tyk2) и транскрипционных факторов (STAT 1, 2 и 3) (Novick et al., 1994; Domanski et al., 1995). В соответствующем эксперименте трансфекция субъединицы IFNAR2 S являлась неспособной инициировать подобный ответ. Таким образом,субъединица L необходима для функциональной активности (противовирусный ответ) с максимальной индукцией, происходящей при ассоциации с субъединицей IFNAR1. В дополнение к связанным с мембраной формам IFNAR на клеточной поверхности, в моче и сыворотке человека идентифицировали растворимый IFNAR (Novick et al., 1994; Novick et al., 1995; Novick etal., 1992; Lutfalla et al., 1995). Растворимый IFNAR, выделенный из сыворотки, обладает средней молекулярной массой 55 кДа при SDS-PAGE, тогда как растворимый IFNAR из мочи обладает средней молекулярной массой 40-45 кДа (р 40). Транскрипты для растворимого р 40 IFNAR2 присутствуют на уровне мРНК и заключают в себе почти полный внеклеточный домен субъединицы IFNAR2 с двумя дополнительными аминокислотами на С-конце. На растворимом рецепторе IFNAR2 присутствуют пять потенциальных участков гликозилирования. Показано, что растворимый р 40 IFNAR2 связывает IFN-2 и IFN- и ингибирует in vitro противовирусную активность смеси разновидностей IFN- ("лейкоцитарный IFN") и индивидуальных IFN типа I (Novick et al., 1995). Показано, что рекомбинантный гибридный белок субъединицы IFNAR2 и Ig ингибирует связывание множества видов IFN типа 1 (IFN-A, IFN-B, IFN-D,IFN-, IFN- Con1 и IFN-) с клетками Дауди и дважды трансфицированными субъединицами /S клетками COS. Идентифицированы пути передачи сигнала с участием IFN типа I (Platanias et al., 1996; Yan et al.,1996; Qureshi et al., 1996; Duncan et al., 1996; Sharf et al., 1995; Yang et al., 1996). Полагают, что начальные события, ведущие к передаче сигнала, происходят при связывании IFN-// с субъединицей IFNAR2, с последующей ассоциацией с субъединицей IFNAR1 с формированием комплекса IFNAR1/2 (Platanias etand Tyk2), которые, как предполагают, фосфорилируют специфические остатки тирозина на субъединицах IFNAR1 и IFNAR2. Когда данные субъединицы фосфорилируются, фосфорилируются молекулыSTAT (STAT 1, 2 и 3), что приводит к димеризации транскрипционных комплексов STAT с последующим перемещением транскрипционного комплекса в ядро и активацией специфически индуцируемыхIFN генов. Рандомизированное, двойное слепое клиническое многоцентровое исследование с контролем плацебо на протяжении двух лет показало, что природный интерферон фибробластов человека (интерферон), введенный подоболочно (IT), эффективен для уменьшения обострений обостряющегосяремиттирующего рассеянного склероза (MS). В течение исследования среднее уменьшение уровня обострения 34 пациентов с MS, получавших интерферон-, вводимого IT, являлось значимо большим, чем уменьшение уровня обострения у 35 контрольных пациентов, получавших плацебо (Jacobs et al., 1987). У людей оценивали фармакокинетику и фармакодинамику IFN типа I (Alan et al., 1997; Fierlbeck etal., 1996; Salmon et al., 1996). Клиренс IFN- является достаточно быстрым с биодоступностью IFNниже, чем ожидаемая, для большинства цитокинов. Хотя у людей оценивали фармакодинамику IFNчеткой корреляции между биодоступностью IFN- и клинической эффективностью не установили. У нормальных здоровых добровольцев введение единичной внутривенной (iv) болюсной дозы (6 мМЕ) рекомбинантного IFN-, полученного из клеток СНО, приводило к быстрой фазе распределения в течение 5 мин и заключительному периоду полувыведения в течение приблизительно 5 ч (Alam et al., 1997). После подкожного (sc) или внутримышечного (im) введения IFN-, уровни в сыворотке являются ровными с системной доступностью приблизительно только 15% дозы. Фармакодинамика IFN- после iv, im илиsc введений (как измеряли посредством изменений активности 2',5'-олигоаденилатсинтетазы (2',5'-AS) в РВМС) увеличивалась в течение первых 24 ч и медленно уменьшалась до исходного уровня в течение следующих 4 суток. Величина и длительность биологического эффекта являлись одинаковыми вне зависимости от способа введения. Фармакодинамическое исследование множественных доз IFN- провели у пациентов с меланомой(Fierlbeck et al., 1996) с применением IFN-, вводимого способом sc три раза в неделю при 3 мМЕ/дозу в течение шестимесячного периода. Фармакодинамические маркеры, 2',5'-AS, 2-микроглобулин, неоптерин и активация клеток NK достигали максимума при второй инъекции (сутки 4) и уменьшалась через 28 суток, оставаясь только немного увеличенными к шести месяцам. Сообщалось об очистке и рефолдинге внеклеточной части IFNAR2 человека (IFNAR2-EC), экспрессированной в Escherichia coli, и ее характеристике, по отношению к ее взаимодействию с интерфероном 2 (IFN-2) (Piehler and Schreiber, 1999A). Показано, что негликозилированный ЕС IFNAR2 массой 25 кДа является стабильным, полностью активным белком, ингибирующим противовирусную активностьIFN-2. Стехиометрия связывания IFN-2 представляет собой 1:1, как определили посредством гельфильтрации, химического сшивания и детекции в твердой фазе. Найдено, что аффинность такого взаимодействия представляет собой приблизительно 3 нМ (Piehler and Schreiber, 2001). Скорость формирования комплекса по сравнению с другими взаимодействиями цитокин-рецептор является относительно вы-2 009604 сокой. Зависимость кинетики ассоциации от соли позволяет предположить ограниченный, но значимый вклад электростатических сил в скорость формирования комплекса. Константа диссоциации увеличивается с pH, снижающимся согласно протонированию основания с pKa, равным 6,7. Аффинность IFN- кIFNAR2 приблизительно в два раза выше, чем аффинность IFN-2 к IFNAR2 (Piehler and Schreiber,1999B). Единичные мутации в связывающем участке IFNAR2 позволили провести картирование отличий в связывании IFN-2 и IFN- (Piehler and Schreiber, 1999B). Например, обнаружено, что мутация Н 78 А делает комплекс с IFN- приблизительно в два раза более стабильным, тогда как комплекс с IFN-2 она делает менее стабильным более чем в два раза. Обнаружено, что мутация N100A почти не влияет на скорости связывания IFN-2, тогда как константу скорости диссоциации для IFN- она уменьшает почти в четыре раза. В ЕР 1037658 описано, что эффекты интерферона типа 1 (IFN) in vivo можно продлить посредством введения интерферона в форме комплекса со связывающей IFN цепью человеческого рецептора интерферона-/ (IFNAR), т.е. IFNAR служит в качестве белка-носителя для IFN. Такой комплекс также увеличивает стабильность IFN и повышает эффективность IFN. Комплекс может представлять собой нековалентный комплекс или комплекс, в котором IFN и IFNAR связаны ковалентной связью или пептидом. В ЕР 1037658 также описано, что хранение IFN в форме такого комплекса увеличивает время храненияIFN и позволяет хранение в более мягких условиях, чем те, которые могли бы являться возможными в противном случае. Существует необходимость в IFNAR2 с повышенной аффинностью к IFN-, но не к IFN-2, что делает IFNAR2 лучшим и специфическим носителем для IFN-. Сущность изобретения Настоящее изобретение относится к применению мутантного полипептида -цепи рецептора интерферона типа I (IFNAR2) (MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1,мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100,обладающего повышенной аффинностью к интерферону- (IFN-) по сравнению с полипептидом дикого типа, или аналога указанного мутантного полипептида, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100, или его соли, для производства лекарственного средства, модулирующего эффекты IFN-. В частности, к применению мутантного полипептида, где мутации представляют собой замены. Конкретно, где замены являются неконсервативными. В одном из вариантов осуществления остаток гистидина в положении 78 заменен на аланин. В еще одном варианте осуществления остаток аспарагина в положении 100 заменен на аланин, аспарагиновую кислоту или гистидин. В другом варианте осуществления оба остатка в положениях 78 и 100 заменены на аланин. Указанный мутантный полипептид также может включать последовательности SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4. В еще одном варианте осуществления аффинность мутантного полипептида к IFNсоставляет приблизительно 30 пМ. В другом варианте аффинность мутантного пептида к IFN- приблизительно в 25, предпочтительно в 50 и более предпочтительно в 100 раз выше, чем аффинность полипептида IFNAR2 дикого типа. В конкретном случае аналог MIFNAR 2 содержит экстрацеллюлярный домен. Также указанный мутантный полипептид может быть ковалентно связан с IFN-. В другом случае указанный мутантный полипептид является ПЭГилированным. В одном из вариантов осуществления лекарственное средство дополнительно включает IFN-. В другом варианте осуществления лекарственное средство дополнительно включает антагонист IFN-. В частном случае, указанное лекарственное средство усиливает активность IFN-. В другом частном случае указанное лекарственное средство усиливает противоопухолевую активность IFN-. Также указанное лекарственное средство может усиливать иммуномодулирующую активность IFN-, что необходимо, в частности, при аутоиммунных заболеваниях,выбранных из рассеянного склероза, ревматоидного артрита, миастении гравис, диабета, системной красной волчанки и язвенного колита. Также указанное лекарственное средство может ингибировать активность IFN-. Лекарственное средство может быть предназначено для лечения аутоиммунного заболевания, вирусного заболевания или рака, в частности, заболевание выбрано из рассеянного склероза,ревматоидного артрита, злокачественной миастении, диабета, язвенного колита, системной красной волчанки, хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза, гепатита А, хронической инфекции вирусами гепатита В и С, лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы и меланомы. Кроме того, лекарственное средство может дополнительно содержать терапевтически активное количество IFN-. Лекарственное средство может быть предназначено для лечения заболевания, вызванного или осложненного IFN-. Лекарственное средство также дополнительно может содержать антагонист IFN-. В одном из вариантов осуществления лекарственное средство предотвращает олигомеризацию IFN-.-3 009604 Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество мутантного полипептида -цепи рецептора интерферона типа I (IFNAR2)(MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1, мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100 или его аналога, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100. В частности, указанное терапевтически эффективное количество MIFNAR2 по меньшей мере в 30 раз меньше терапевтически эффективного количество IFNAR2 дикого типа. В другом случае фармацевтическая композиция дополнительно включает IFN- или антагонист IFN-. В одном из вариантов осуществления мутантный полипептид IFNAR2 ковалентно связан с IFN-. В еще одном варианте осуществления указанный аналог IFNAR2 содержит экстрацеллюлярный домен. В частности, фармацевтическая композиция по любому может использоваться для усиления противоопухолевых и противовирусных свойств, а также иммуномодулирующих свойств IFN-. Так, фармацевтическая композиция может использоваться для лечения хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза, гепатита А, хронической инфекции, вызванной вирусами гепатита В и С,лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы, меланомы, рассеянного склероза, ревматоидного артрита, злокачественной миастении, диабета, язвенного колита и системной красной волчанки. Также фармацевтическая композиция может использоваться для ингибирования иммуномодулирующих свойств IFN-. Краткое описание фигур На фиг. 1 (слева) изображена имитация концентрации связанного и свободного IFN-, с применением постоянной концентрации IFN (50 пМ) и увеличивающихся концентраций ЕС IFNAR2 дикого типа(слева) и мутантного ЕС IFNAR2 (справа) с Kd 3 нМ и 50 пМ, соответственно, рассчитанной в соответствии с законом действующих масс. На фиг. 2 представлена аминокислотная последовательность внеклеточного домена белка IFNAR2(за исключением лидирующей последовательности) и модифицированные аминокислотные остатки (отмечены звездочкой). На фиг. 3 представлено связывание IFN- и IFN-2 с мутантным H78A/N100A ЕС IFNAR2. Ассоциацию и диссоциацию IFN- и IFN-2 с ЕС IFNAR2 дикого типа (верхняя диаграмма), с мутантнымH78A/N100A с IFN- (нижняя диаграмма) измеряли с применением отражательной интерференционной спектроскопии (RIfS) с иммобилизованным на поверхности IFNAR2 (описано у Piehler and Schreiber,2001). Ось Y=сигнал (нанометры), а ось Х=время (секунды). На фиг. 4 изображено поглощение IFNпосредством IFNAR2 дикого типа и мутантами. Постоянное количество IFN- (10 пМ) смешивали с различными концентрациями IFNAR2 (R2) дикого типа и мутантами (одиночные мутанты R2 N100A и R2 Н 78 А, двойные мутанты R2 H78A/N100A, R2H78A/N100H и R2 H78A/N100D) и при равновесии в клетках WISH определяли остаточную противовирусную активность. В верхнем прямоугольнике показана диаграмма противовирусной активности IFNкак функция от концентрации в отсутствии IFNAR2 (ось Y=индекс выживаемости). Данную диаграмму применяют как стандарт для определения того, как много присутствует свободного (активного) IFNпри противовирусном анализе. Подробное описание изобретения Изобретение относится к мутанту -цепи рецептора IFN типа I (IFNAR2), измененному по аминокислотным остаткам Н 78 и N100 (см. последовательность ДНК IFNAR2 дикого типа на фиг. 2, SEQ IDNO:1), обладающему увеличенной аффинностью к IFN-, но не к IFN-2 (MIFNAR2). Также изобретение относится к системе носителя лекарственного средства для усиления активности IFN, включающей внеклеточный домен (ЕС) MIFNAR2. Изобретение относится к MIFNAR2 или его аналогу, функциональному производному, гибридному белку, его фрагменту или его солям. Носители обычно вводят для продления внутрисосудистого времени удержания белков с молекулярной массой ниже 50000 дальтон (например, интерферон). Особенно выгодными являются такие носители, которые связываются нековалентно и обеспечивают постоянное высвобождение лекарственного средства. Применение такого носителя является желательным для того, чтобы в любой момент времени иметь дозу свободного лекарственного средства, доступного для терапевтического действия (приблизительно 20%) и некоторое количество лекарственного средства, связанного с носителем и защищенного(приблизительно 80%). На фиг. 1 (левая диаграмма) изображена имитация концентрации связанного и свободного IFN-, в присутствии различных концентраций IFNAR2, основанная на законе действующих масс и Kd, составляющей 3 нМ (определяемой отражательной интерференционной спектроскопией [RIfS]). Данная имитация демонстрирует, что для того, чтобы достигнуть 20% свободного IFN- (10 пМ, что эквивалентно-4 009604 приблизительно 100 единицам) и 80% связанного IFN-, необходима очень высокая концентрация белкаIFNAR2, такая как 12,5 нМ (что эквивалентно 300 мкг/кг негликозилированного IFNAR2). Таким образом, применение в качестве носителя (см. имитацию на фиг. 1, правая диаграмма) мутантного IFNAR2 с аффинностью к IFN-, большей в 50 раз, может являться предпочтительным, так как с применением такого мутанта для получения 20% свободного IFN- теоретически потребуется, только приблизительно 0,24 нМ (что эквивалентно 6 мкг/кг). Получали мутантный IFNAR2 с увеличенной аффинностью к IFN (MIFNAR2). Для получения ЕСMIFNAR2 ЕС IFNAR2 дикого типа (фиг. 1, SEQ ID NO:1) модифицировали по двум аминокислотным остаткам, остатку гистидина в положении 78 и остатку аспарагина в положении 100 (см. фиг. 2, 3 и 4,SEQ ID NO:2, 3 и 4). Данный мутантный белок ЕС IFNAR2 оказался лучшим носителем конкретно дляIFN-, т.е. обладающим увеличенной аффинностью к IFN-, тогда как его активность к IFN-2 остается неизмененной. Обнаружено, что аффинность мутантов к IFN- в 26, 40 и приблизительно в 50 раз выше,чем аффинность белка дикого типа (табл. 4). Полученные результаты демонстрируют, что несмотря на увеличенную аффинность данного мутантного растворимого рецептора (Kd мутантного H78A/N100AIFNAR2 30 пМ против Kd белка WT=3 нМ), несвязанным и терапевтически активным остается достаточное количество IFN-, как доказано противовирусной защитной активностью клеток WISH, подвергнутых воздействию VSV (фиг. 4). Результаты также демонстрируют, что уровней поглощения IFN (связывание IFN при равновесных условиях), полученных с ЕС IFNAR2 дикого типа, можно достичь с применением меньших концентраций мутантных ЕС IFNAR. Наилучшие результаты получают с мутантами,модифицированными по обоим остаткам, особенно когда обе аминокислоты заменяют на аланин,H78A/N100A IFNAR2, например, для получения 80% связанного IFN- (8 пМ поглощенного и 2 пМ свободного IFN-) необходимо приблизительно в 30 раз меньше мутантного H78A/N100A IFNAR, чем белкаIFNAR2 дикого типа. Данные результаты демонстрируют, что дважды мутантный IFNAR2 поглощает IFN- более эффективно и для осуществления его действия в качестве носителя IFN- требуется введение значительно меньших количеств. Преимущества применения ЕС MIFNAR2 состоят в том, что:(I) в качестве носителя возможно введение меньших количеств (таким образом, технически выполнимо) рецептора,(II) по причине стабилизирующей активности мутанта возможно уменьшить количество вводимогоIFN- и, следовательно, уменьшить некоторые нежелательные побочные эффекты лечения интерфероном,(III) увеличение мутантом активности специфично для IFN- и(IV) при некоторых воспалительных заболеваниях, где может являться необходимым уменьшить концентрации IFN, при некоторых условиях возможно применение данного мутанта в качестве эффективного антагониста, специфичного для IFN-, но не для IFN-2. ЕС MIFNAR2 можно вводить самостоятельно для стабилизации и увеличения активности эндогенного IFN-, что особенно применимо для лечения пациентов с заболеванием или состоянием, которое по природе вызывает увеличение собственного IFN так, что IFN уже будет циркулировать в организме для присущего ему от природы действия по борьбе с таким заболеванием или состоянием. ЕС MIFNAR2 специфично действует на эндогенный IFN-, но менее - на IFN-2. Альтернативно, ЕС MIFNAR2 можно совместно вводить с IFN, предпочтительно IFN-, или можно вводить ковалентно связанным с IFN- для модуляции активности IFN-. Предпочтительно MIFNAR2 и IFN-, применяемые для получения комплекса, представляют собой рекомбинантные молекулы. Необходимая для получения гибридного белка мутантного ЕС IFNAR2 и IFN технология подобна технологии, описанной для получения комплекса IFNAR дикого типа/IFN, подробно описанной вWO 9932141, где вместо варианта дикого типа применяют мутантный по Н 78 и N100 IFNAR2 (MIFNAR2). Следствием применения нековалентно связанного комплекса по изобретению MIFNAR2/IFN- является то, что для множества терапевтических показаний, при которых IFN терапевтически активен сам по себе, необходимы и можно применять меньшие концентрации ЕС IFNAR2. Данные показания включают показания, при которых свободные IFN продемонстрировали какуюлибо терапевтическую активность, такую как противовирусную, противоопухолевую и иммуномодулирующую активность. Ожидается, что комплекс мутантный IFNAR2/IFN вследствие его большей эффективности, увеличенной активности и/или улучшенной фармакокинетики (т.е. периода полувыведения) будет более эффективен при лечении вирусных, онкологических и аутоиммунных расстройств. Когда комплекс рецептора интерферона вводят in vivo, он увеличивает биодоступность, улучшает фармакокинетику и/или фармакодинамику IFN, таким образом, усиливая противовирусные, противоопухолевые и иммуномодулирующие свойства IFN.-5 009604 Предпочтительные молекулы для применения в комплексах по настоящему изобретению включают аминокислотные последовательности природного IFN- и MIFNAR2 (SEQ ID NO:2, 3 и 4). Природная последовательность представляет собой последовательность встречающегося в природе IFN- человека. Такие последовательности известны и их можно легко найти в литературе. Природные аллельные варианты также считаются природными последовательностями. Настоящее изобретение также относится к аналогам указанного выше ЕС MIFNAR2. Такие аналоги могут представлять собой аналоги, в которых в белках приблизительно до 30, предпочтительно до 20 и наиболее предпочтительно 10 аминокислотных остатков могут являться удаленными, добавленными или замещенными другими аминокислотными остатками, за исключением мутаций по остаткам в положениях 78 и 100, что приводит к уменьшению аффинности MIFNAR2 к IFN- по сравнению с аффинностьюIFNAR2 дикого типа к IFN-. Данные аналоги получают посредством известных способов синтеза и/или сайт-специфического мутагенеза или любого другого известного подходящего способа. Любой такой аналог предпочтительно обладает последовательностью аминокислот в достаточной степени повторяющей последовательность основного MIFNAR2 так, чтобы обладать, по существу, сходной с ним активностью. Таким образом, посредством типового экспериментирования, включающего в себя применение к каждому такому аналогу тестирования связывания и биологической активности, можно определить, обладает ли любой данный аналог, по существу, одинаковой активностью и/или стабильностью с белком и комплексом по изобретению. Аналоги ЕС MIFNAR2 могут связывать IFN с аффинностью, которая по меньшей мере в 15 раз и приблизительно от 50 до 100 раз выше, чем аффинность белка дикого типа, тогда как аффинность к IFN-2 изменяется незначимо. Аналоги ЕС MIFNAR2 в отношении к IFN- могут демонстрировать Kd в размере приблизительно 30 пМ и ниже. Тесты связывания для взаимодействия MIFNAR2 и IFN могут включать аналитическую гель-фильтрацию, оптическую детекцию в гетерогенной фазе (такую как поверхностный плазменный резонанс [SPR] или отражательную интерференционную спектроскопию (RIfS), которая обладает сходством с широко применяемым способом BIACORE) и флуоресцентную спектроскопию (Piehler and Schreiber, 1999 А, Piehler and Schreiber,2001). Аналоги комплекса, которые можно применять по настоящему изобретению, или кодирующая их нуклеотидная последовательность, включают ограниченное множество, по существу, совпадающих последовательностей пептидов или полинуклеотидов с заменами, которые специалист в данной области может стандартным способом получить без чрезмерного экспериментирования, базируясь на указаниях и руководствах, представленных здесь. Для подробного описания химии и структуры белков см. Schulz etMolecular Properties, W. H. FreemanCo, San Francisco (1983), включенные сюда в качестве ссылки. Для представления о заменах нуклеотидной последовательности, таких как кодонные предпочтения, см. Ausubel et al. (1987, 1992), A.1. I-A. 1.24 и Sambrook et al. (1987, 1992), 6.3 и 6.4 в Приложениях С и D. Предпочтительные изменения для аналогов по настоящему изобретению представляют собой то,что известно как "консервативные" замены. Консервативные замены аминокислот в последовательностях белков по изобретению могут включать синонимические аминокислоты из группы, которые обладают достаточно сходными физико-химическими свойствами так, что замена представителей группы сохраняет биологическую функцию молекулы (Grantham, 1974). Ясно, что в определенных выше последовательностях также можно провести инсерции и делеции аминокислот без изменения их функции, особенно если инсерции или делеции включают только небольшое количество аминокислот, например, менее тридцати, а предпочтительно - менее десяти, и не приводят к удалению или перемещению аминокислот,важных для функциональной конформации, например, цистеиновых остатков (Anfinsen, 1973). Полученные посредством таких делеций или инсерций аналоги находятся в объеме настоящего изобретения. Предпочтительно синонимические группы аминокислот представляют собой группы, определенные в табл. 1. Более предпочтительно синонимические группы аминокислот представляют собой группы, определенные в табл. 2; и наиболее предпочтительно, синонимические группы аминокислот представляют собой группы, определенные в табл. 3.-6 009604 Таблица 1 Предпочтительные группы синонимических аминокислот Таблица 2 Более предпочтительные группы синонимических аминокислот-7 009604 Таблица 3 Наиболее предпочтительные группы синонимических аминокислот Примеры получения замен аминокислот в белках, которые можно применять для получения аналогов MIFNAR2 или ЕС MIFNAR2 для применения по настоящему изобретению, включают любые известные стадии способов, такие как представлены в патентах США RE 33653; 4959314; 4588585 и 4737462,выданных Mark et al.; 5116943, выданном Koths et al.; 4965195, выданном Namen et al.; и 5017691, выданном Lee et al., и замещенные лизином белки, представленные в патенте США 4904584 (Shaw et al.). Термин "по существу, соответствующий" предназначен для включения в него аналогов с незначительными изменениями последовательности основных MIFNAR2 или ЕС MIFNAR2, которые не влияют на их основные характеристики, например, их специфические улучшенные связывание и активность в отношении IFN-. Тип изменений, которые обычно рассматривают как относящиеся к языку "по существу, соответствующий", представляет собой изменения, которые являются результатом общепринятых способов мутагенеза ДНК, кодирующей комплекс по изобретению, приводящих к немногочисленным незначительным модификациям, и скрининга на предмет наличия желательной активности обсуждаемым выше способом. Предпочтительно часть комплекса, представляющая собой MIFNAR2, обладает основной последовательностью, одинаковой с основной последовательностью природной последовательности или ее биологически активного фрагмента, или ее вариантом, обладающим аминокислотной последовательностью,идентичной с природной аминокислотной последовательностью по меньшей мере на 70%, и сохраняющим ее биологическую активность. Более предпочтительно такая последовательность идентична с природной последовательностью по меньшей мере на 85%, по меньшей мере на 90% или наиболее предпочтительно по меньшей мере на 95%. Что касается части комплекса, представляющей собой IFN, то основная последовательность, которую можно применять, представляет собой природную последовательность, или ее биологически активный фрагмент, или их вариант, обладающий аминокислотной последовательностью, идентичной с ними,по меньшей мере на 70%, более предпочтительно по меньшей мере на 85% или по меньшей мере на 90%,и наиболее предпочтительно по меньшей мере на 95%. Такие аналоги должны сохранять биологическую активность природной последовательности IFN или его фрагмента или обладать антагонистической активностью, как обсуждалось здесь выше. Термин "идентичность последовательностей", применяемый здесь, означает, что последовательности сравнивали, как изложено ниже. Последовательности выравнивали с применением Genetic ComputingGroup's GAP (программа общего выравнивания) версии 9, применяя матрицу (значения от -4 до +11) по умолчанию (BLOSUM62) со штрафом в размере -12 за внесение промежутка (для первого пропуска промежутка) и штрафом в размере -4 за продолжение промежутка (для каждого дополнительного последова-8 009604 тельного пропуска в промежутке). После выравнивания рассчитывали процент идентичности, выражая количество совпадений как процент от количества аминокислот в заявленной последовательности. Аналоги по настоящему изобретению также можно определить в соответствии со следующей процедурой. В отношении части комплекса, представляющей собой MIFNAR2, или части комплекса, представляющей собой IFN, ДНК последовательностей IFNAR и IFN известна из предшествующих исследований в данной области и ее или можно найти в цитируемой в предпосылках настоящего описания литературе, или можно легко найти при помощи специалиста в данной области. Полипептиды, кодируемые любой нуклеиновой кислотой, такой как ДНК или РНК, которые гибридизуются с ДНК, комплементарной природной, в очень жестких или умеренно жестких условиях, пока полипептид сохраняет биологическую активность природной последовательности или, в случае IFN, или сохраняет биологическую активность MIFNAR2 или ЕС MIFNAR2, или обладает активностью в качестве антагониста, также рассматривают как находящиеся в объеме настоящего изобретения. "Жесткие условия" относятся к гибридизации и последующим условиям отмывки, которые специалисты в данной области условно обозначают как "жесткие". См. Ausubel et al., Current Protocols in Molecular Biology, supra, Interscience, N.Y., 6.3 и 6.4Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Без ограничений, примеры жестких условий включают условия отмывки при температуре на 1220 С ниже рассчитанной Tm исследуемого гибрида, например, в течение 5 мин в 2SSC и 0,5% SDS, 15 мин в 2SSC и 0,1% SDS; 30-60 мин при 37 С в 0,1SSC и 0,5% SDS, а затем 30-60 мин при 68 С в 0,1SSC и 0,5 SDS. Специалистам в данной области ясно, что жесткие условия также зависят от длины последовательностей ДНК, олигонуклеотидных зондов (например, 10-40 оснований) или смешанных олигонуклеотидных зондов. Если применяют смешанные зонды вместо SSC, предпочтительно применять хлорид тетраметиламмония (ТМАС). См. Ausubel вьше. Как применяют здесь, термин "функциональные производные" охватывает производные, которые можно получить из функциональных групп, находящихся в виде боковых цепей на остатках или на Nили С-концевых группах, посредством известных в данной области способов, и которые включены в данное изобретение до тех пор, пока они остаются фармацевтически приемлемыми, т.е. они не нарушают биологическую активность соответствующего белка комплекса, описанного здесь, и не придают токсических свойств содержащим их композициям или составленному с ними комплексу. Производные могут обладать химическими группами, такими как углеводные или фосфатные остатки, при условии, что такая фракция обладает такой же биологической активностью и остается фармацевтически приемлемой. Например, производные могут включать алифатические сложные эфиры карбоксила карбоксильных групп, амиды карбоксильных групп посредством реакции с аммиаком или с первичными или вторичными аминами, N-ацильные производные или свободные аминогруппы аминокислотных остатков, образуемые ацильными группами (например, алканоильные или карбоциклические ароильные группы) или Oацильные производные свободных гидроксильных групп (например, O-ацильные производные сериновых или треониновых остатков), образуемые ацильными группами. Такие производные могут также включать, например, боковые цепи из полиэтиленгликоля, которые могут маскировать антигенные участки и удлинять время присутствия комплекса или его частей в жидкостях организма. Термин "гибридный белок" относится к полипептиду, включающему MIFNAR2 или ЕС MIFNAR2 или их аналог или фрагмент, слитый с другим белком, который, например, обладает увеличенным временем присутствия в жидкостях организма. Таким образом, MIFNAR2 или ЕС MIFNAR2 можно сливать с другим белком, полипептидом или т.п., например, с иммуноглобулином или его фрагментом."Фрагмент" по настоящему изобретению может, например, представлять собой фрагмент MIFNAR2 или ЕС MIFNAR2. Термин фрагмент относится к любой части молекулы, т.е. более короткому пептиду,сохраняющему желательную биологическую активность. Фрагменты можно легко получить посредством удаления аминокислот с любого из двух концов молекулы MIFNAR2 и тестирования полученного фрагмента на способность связываться с IFN-. Известны протеазы, которые можно применять для удаления одной аминокислоты за один раз или с N-конца, или с С-конца полипептида, и такое определение фрагментов, сохраняющих желательную биологическую активность, включает в себя только типовое экспериментирование. В качестве активного фрагмента MIFNAR2, его аналогов и гибридных белков, настоящее изобретение дополнительно охватывает любой фрагмент или предшественники полипептидной цепи белковой молекулы, отдельно или вместе с ассоциированными молекулами или остатками, связанными с ними,например, остатками сахаров или фосфатными остатками, или агрегатами белковых молекул или самих остатков сахаров, при условии, что указанный фрагмент обладает в значительной степени сходной активностью. Термин "соли" здесь относится и к солям карбоксильных групп, и к кислотно-аддитивным солям аминогрупп комплекса по изобретению или его аналогов. Соли карбоксильной группы можно образовывать известными в данной области способами, и они включают неорганические соли, например, соли натрия, кальция, аммония, железа или цинка и т.п. и соли с органическими основаниями, такие как соли,-9 009604 образованные, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и т.п. Кислотно-аддитивные соли включают, например, соли неорганических кислот, таких как, например, соляная кислота или серная кислота, и соли органических кислот, таких как, например, уксусная кислота или щавелевая кислота. Конечно, любые такие соли должны обладать в значительной степени сходной биологической активностью с комплексом по изобретению или его аналогами. Как используют в данном описании термин "биологическая активность" понимают, как изложено ниже. В той мере, как это касается MIFNAR2, важной биологической активностью является его способность связываться с IFN- с увеличенной аффинностью. Таким образом, аналоги или варианты, соли и функциональные производные необходимо выбирать так, чтобы они сохраняли данную способность связывать интерферон. Это можно протестировать стандартными экспериментами анализа связывания. Кроме того, фрагменты MIFNAR2 или их аналоги также можно использовать до тех пор, пока они сохраняют повышенную активность в отношении связывания интерферона. Фрагменты можно легко получить посредством удаления аминокислот с любого из двух концов связывающего интерферон полипептида и тестирования продукта на наличие способности связывать интерферон. Кроме того, полипептид с такой интерферон-связывающей активностью, будь это MIFNAR2, ЕСMIFNAR2, аналог, функциональное производное, фрагмент, может также содержать дополнительные аминокислотные остатки, фланкирующие связывающий интерферон полипептид. Пока полученная в результате молекула сохраняет увеличенную интерферон-связывающую способность основного полипептида, можно определить, действуют ли любые такие фланкирующие остатки на основные и новые характеристики основного пептида, т.е. его характеристики в отношении связывания интерферона, посредством типового экспериментирования. Термин "по существу, состоящий из", когда относится к указанной последовательности, означает, что могут присутствовать дополнительные фланкирующие остатки, не влияющие на основные и новые характеристики указанной последовательности. Данный термин не включает замены, делеции или добавления в указанной последовательности. Хотя в данном описании в примерах применяли MIFNAR2 или ЕС MIFNAR2, должно быть понятно, что это представляет собой только предпочтительный пример, и что вместе с MIFNAR2 или ЕС MIFNAR2 можно применять субъединицу IFNAR1, и, в частности, ее внеклеточный домен. Относительно части комплекса по настоящему изобретению, представляющей собой интерферон,биологическая активность, которая должна быть сохранена в любом аналоге, функциональном производном, гибридном белке или фрагменте, представляет собой активность интерферона, зависящую от подразумеваемого применения. В большинстве случаев это должно представлять собой способность связываться с природным рецептором на клеточной поверхности и таким образом опосредовать образование сигнала рецептором. Таким образом, любой такой аналог, производное или фрагмент в отношении рецептора должны сохранять такую активность в качестве агониста, чтобы по настоящему изобретению являться пригодными для такого применения. С другой стороны, иногда полезно иметь молекулу с активностью в отношении рецептора в качестве антагониста для того, чтобы предотвратить биологическое действие природного интерферона. Такой антагонист также можно применять для продленного положительного действия с помощью комплекса по настоящему изобретению. Для таких применений, в которых желательно устранить нежелательные эффекты интерферона, аналоги, которые все еще связываются рецептором и частью комплекса, представляющей собой IFNAR, но которые не опосредуют сигнал и блокируют образование сигнала природным интерфероном на данном рецепторе (т.е. антагонист интерферона), можно также рассматривать как биологически активное средство для цели данного изобретения и как охватываемые термином интерферон, когда применяют по отношению к комплексам по настоящему изобретению. Прямыми анализами можно определить, сохраняет ли такой аналог в отношении рецептора такую активность в качестве агониста или обладает в отношении рецептора активностью в качестве антагониста и, таким образом, может являться пригодным для одного из применений по настоящему изобретению. Настоящее изобретение также относится к последовательностям ДНК, кодирующим ЕС MIFNAR2,например, ДНК, кодирующим аминокислотные последовательности SEQ ID NO:2, 3 и 4 или их аналоги и фрагменты, а также ДНК-векторам, несущим такие последовательности ДНК, для экспрессии в подходящих прокариотических или эукариотических клетках-хозяевах. Способность образовывать большие количества гетерологичных белков с применением системы экспрессии рекомбинантных белков привела к разработке различных терапевтических средств, например, t-PA и ЕРО (Edington, 1995). Различные экспрессирующие хозяева, из которых можно получить рекомбинантные белки, выстраиваются в ряд от прокариот в начале (например, бактерии) (Olins, 1993),через низших эукариот (например, дрожжи) (Ratner, 1989) до видов высших эукариот (например, клетки насекомых или млекопитающих) (Reuveny, 1993; Reff, 1993). Все данные системы основываются на одинаковом принципе, представляющем собой введение последовательности ДНК интересующего белка в выбранный тип клеток (временно или стабильно, как интегрированный или эписомный элемент) с применением систем транскрипции, трансляции и транспортировки хозяина для избыточной экспрессии введенной последовательности ДНК как гетерологичного белка (Keown, 1990).- 10009604 Для получения рекомбинантных гетерологичных белков описано множество протоколов (Ausubel etHarbor, NY, 1989). В дополнение к экспрессии природных генных последовательностей, возможность манипулировать ДНК на уровне нуклеотидов ускорила разработку новых сконструированных последовательностей, которые хотя и основаны на природных белках, обладают новыми видами активности как результат изменения первичной структуры белка (Grazia, 1997). Кроме того, выбранные последовательности ДНК можно физически соединить для получения транскриптов, которые преобразуются в новые гибридные белки, где изначально независимые белки теперь экспрессируются как одна полипептидная единица (Ibanez, 1991). Действие таких гибридных белков может являться различным, например, более эффективным, чем любой из двух отдельных белков (Curtis,1991). Для совместного введения ЕС MIFNAR2 с IFN, IFN человека можно получить посредством способа получения, в котором применяют клетку млекопитающего, представляющую собой клетку яичника китайского хомячка (СНО), как описано в ЕР 220574. Интерфероны типа I можно экспрессировать во множестве клеток-хозяев, включающих клетки бактерий (Utsumi, 1987), насекомых (Smith, 1983) и человека (Christofinis, 1981). Человеческий MIFNAR2 или его фрагмент также можно экспрессировать с применением клетки-хозяина СНО. Для выделения ЕС MIFNAR2 из клеток СНО последовательность ДНК ЕС MIFNAR2 можно лигировать с последовательностью сигнального пептида гормона роста человека,как описано в патентной заявке WO 0022146. Альтернативно, в бактериальных экспрессирующих системах можно успешно экспрессировать растворимые рецепторы, такие как ЕС MIFNAR2 (Terlizzese, 1996). Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента MIFNAR2, ЕС MIFNAR2, комплекс ЕС MIFNAR2/IFN или их аналоги, гибридные белки,функциональные производные, фрагменты, или их смеси, или их соли и фармацевтически приемлемый носитель, разбавитель или наполнитель. Осуществление фармацевтической композиции по данному изобретению включает фармацевтическую композицию для усиленного действия типа IFN при лечении вирусных заболеваний, в противоопухолевой терапии, в иммуномодулирующей терапии, например, при аутоиммунных заболеваниях и при других применениях интерферонов и связанных с ними цитокинов. Фармацевтические композиции по изобретению для введения получают посредством смешиванияMIFNAR2, ЕС MIFNAR2, комплекса ЕС MIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, фрагментов, или их смесей или их солей с физиологически приемлемыми стабилизаторами и/или наполнителями и получают в дозированной форме, например, путем лиофильной сушки в ампулах для дозирования. Способ введения может представлять собой любой из общепринятых способов введения для подобных средств и зависит от состояния подлежащего лечению, например, внутривенный, внутримышечный и подкожный, посредством местной инъекции или топического применения,или непрерывно, посредством инфузии, и т.п. Количество активного соединения для введения зависит от способа введения, подлежащего лечению заболевания и состояния пациента. Изобретение относится к способу лечения аутоиммунных заболеваний, таких как рассеянный склероз, ревматоидный артрит, злокачественная миастения, диабет, волчанка и язвенный колит, включающему введение терапевтически эффективного количества MIFNAR2, ЕС MIFNAR2, комплекса ЕСMIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, их фрагментов, или их смесей, или их солей. Изобретение относится к способу лечения вирусного заболевания, такого как гранулематозное заболевание, остроконечная кондилома, ювенильный ларингеальный папилломатоз, гепатит А или хроническая инфекция вирусами гепатита В и С, включающему введение терапевтически эффективного количества MIFNAR2, ЕС MIFNAR2, комплекса ЕС MIFNAR2/IFN или их аналогов, гибридных белков,функциональных производных, их фрагментов, или их смесей, или их солей. Изобретение относится к способу лечения различных типов злокачественной опухоли, например,таких как лейкоз ворсинчатых клеток, саркома Капоши, множественная миелома, хронический миелоидный лейкоз, неходжкинская лимфома или меланома, включающему введение терапевтически эффективного количества MIFNAR2, ЕС MIFNAR2, комплекса ЕС MIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, их фрагментов, или их смесей, или их солей. В указанных выше способах MIFNAR2, ЕС MIFNAR2, комплекс ЕС MIFNAR2/IFN или их аналоги,гибридные белки, функциональные производные, их фрагменты, или их смеси, или их соли можно вводить совместно с IFN, предпочтительно IFN-."Терапевтически эффективное количество" представляет собой такое количество, которое при введении MIFNAR2, ЕС MIFNAR2, комплекса ЕС MIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, их фрагментов, или их смесей, или их солей приводит к модуляции биологической активности IFN-. Вводимые индивидууму дозы, в качестве единичной или многократных доз,могут варьировать в зависимости от множества факторов, включающих способ введения, состояния и- 11009604 характеристики (пол, возраст, вес тела, состояние здоровья, размер) пациентов, степень симптомов, сопутствующих способов лечения, частоты лечения и желательного эффекта. Корректировка установленных диапазонов доз и манипулирование ими находятся полностью в компетенции специалистов в данной области, также как и способы определения активности MIFNAR2, ЕС MIFNAR2, комплекса ЕСMIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, их фрагментов, или их смесей, или их солей in vitro и in vivo. Например, местная инъекция требует меньшего количества белка на вес тела, чем внутривенная инфузия. Свободный IFN- обладает тенденцией к олигомеризации. Чтобы подавить данную тенденцию, современные препараты IFN- обладают кислым pH, который при введении может вызывать некоторое локальное раздражение. Поскольку MIFNAR2, ЕС MIFNAR2 или их аналоги, гибридные белки, функциональные производные, их фрагменты, или их смеси, или их соли могут служить в качестве превосходных стабилизаторов по сравнению с вариантом фактора дикого типа для IFN- и, таким образом,предотвращать олигомеризацию, их применение в препаратах IFN- может служить для стабилизацииIFN- и, таким образом, устранить необходимость кислых препаратов. Таким образом, некислая фармацевтическая композиция, содержащая MIFNAR2, ЕС MIFNAR2 или их аналоги, гибридные белки, функциональные производные, их фрагменты, или их смеси, или их соли, совместно с другими традиционными фармацевтически приемлемыми наполнителями также представляет собой часть настоящего изобретения. Настоящее изобретение также относится к применениям MIFNAR2, ЕС MIFNAR2, комплекса ЕСMIFNAR2/IFN или их аналогов, гибридных белков, функциональных производных, их фрагментов, или их смесей, или их солей в противовирусной, противоопухолевой и иммуномодулирующей терапии. Конкретно, мутантный рецептор интерферона и комплексы мутантного рецептора интерферона и интерферона по данному изобретению пригодны для противовирусной терапии при таких терапевтических показаниях, как хроническое гранулематозное заболевание, остроконечная кондилома, ювенильный ларингеальный папилломатоз, гепатит А или хроническая инфекция вирусами гепатита В и С. В частности, мутантный рецептор интерферона и комплексы мутантного рецептора интерферона и интерферона по данному изобретению пригодны для противоопухолевой терапии при таких терапевтических показаниях, как лейкоз ворсинчатых клеток, саркома Капоши, множественная миелома, хронический миелоидный лейкоз, неходжкинская лимфома или меланома. Мутантный рецептор интерферона и комплексы мутантного рецептора интерферона и интерферона по данному изобретению также пригодны для иммуномодулирующей терапии при аутоиммунных заболеваниях, например, рассеянном склерозе, ревматоидном артрите, злокачественной миастении, диабете,волчанке, язвенном колите и т.д."Аутоиммунное расстройство" представляет собой заболевание, в котором иммунная система индивидуума начинает поражать его или ее собственный организм. Иммунная система образует антитела против своих собственных тканей. К аутоиммунному расстройству чувствительна фактически каждая часть организма. Мутантный рецептор интерферона и комплексы мутантного рецептора интерферона и интерферона по данному изобретению также пригодны для лечения нейродегенеративных заболеваний, предпочтительно рассеянного склероза. Данное изобретение, кроме того, относится к фармацевтической композиции, содержащей MIFNAR2, ЕС MIFNAR2, комплекс ЕС MIFNAR2/IFN или их аналоги, гибридные белки, функциональные производные, фрагменты, или их смеси, или их соли, к фармацевтической композиции, содержащей экспрессирующий вектор, в частности лентивирусный вектор для генной терапии, экспрессирующий MIFNAR2, ЕС MIFNAR2, комплекс ЕС MIFNAR2/IFN или их аналоги, гибридные белки, функциональные производные, фрагменты. Как используют в данном описании термин "лечение" необходимо понимать как профилактику, подавление, ослабление, улучшение или обращение любых или всех симптомов или причин(ы) заболевания. Теперь, после описания данного изобретения, его можно будет легче понять посредством обращения к следующим примерам, которые предоставлены в целях иллюстрации и не предназначены для ограничения настоящего изобретения. Примеры Пример 1. Экспрессия и очистка белка. ЕС IFNAR2 (внеклеточный домен) и IFN- экспрессировали в Е. coli и очищали ионообменной и гель-проникающей хроматографией как описано (PiehlerSchreiber, 1999A). Уровни экспрессии мутантных ЕС IFNAR2 являлись такими же высокими, как и у дикого типа. Гликозилированный IFN- дикого типа получали в СНО (описано в ЕР 220574). Концентрации белка определяли на основании поглощения при 280 нм (PiehlerSchreiber, 1999A) с 1:280=18070 М-1 для IFN-2, 1:280=30050 М-1 для IFNи 1:280=26500 М-1 для ЕС IFNAR2 (скорректированным до 1:280=21100 М-1 для мутантных по триптофа- 12009604 ну ЕС IFNAR2 W102A и W74F). Чистоту белка анализировали посредством SDS-PAGE в невосстанавливающих условиях. Пример 2. Получение мутантных ЕС IFNAR. Проводили сайт-специфический мутагенез посредством ПЦР с матрицей pT72CR2 (Piehler andSchreiber, 1999) и праймерами длиной 18-21 нуклеотид, содержащими мутантный кодон, с применением высокоточных полимераз pwo (Boehringer Mannheim) и Pfu (Stratagene), как подробно описано (AlbeckSchreiber, 1999). После фосфорилирования и лигирования, мутантные плазмиды применяли для трансформации клеток TG1 Е. coli. Последовательность целого экспрессированного гена, содержащего мутацию, контролировали секвенированием ДНК (Ausubel et al., Current Protocols in Molecular Biology, GreenePublications and Wiley Interscience, New York, NY, 1987-1995; Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989). Получали мутантов, у которых два аминокислотных остатка, гистидин в положении 78 (Н 78) и аспарагин в положении 100 (N100) являлись замененными: А - оба на остаток аланина (мутантH78A/N100A), В - на остатки аланина и аспарагиновой кислоты, соответственно (H78A/N100D) и С - на остатки аланина и гистидина, соответственно (H78A/N100H). Пример 3. Термодинамический и кинетический анализ. Все термодинамические и кинетические данные получали посредством детекции в гетерогенной фазе без метки. Взаимодействия между IFN-2 и ЕС IFNAR2 контролировали посредством отражательной интерференционной спектроскопии (RIfS) в проточных условиях, как описано (PiehlerSchreiber,1999A). Данный способ сходен с Biacore и применим для точного измерения аффинности связывания двух белков. ЕС IFNAR2 (дикого типа или мутантный) иммобилизовали специфическими иммобилизующими антителами (как описано у Piehler и Schreiber, 2001). Все измерения с IFN-, IFN-2 и ЕС IFNAR2 проводили в 50 мМ Hepes с 500 мМ NaCl и 0,01% Triton X100 при pH 7,4. Взаимодействия измеряли с 500 мМ NaCl для исключения неспецифических взаимодействий с поверхностью, которые дляIFN- наблюдали при 150 мМ NaCl. Кинетику ассоциации и диссоциации измеряли посредством стандартных протоколов инъекций и корректировали посредством серий с контролем. Константы скорости диссоциации измеряли при концентрации IFN в диапазоне от 1 до 1000 нМ для насыщения поверхности. Для соответствия кинетической модели 1:1 использовали весь диапазон диссоциации (PiehlerSchreiber, 2001). Пример 4. Анализ противовирусной активности. Противовирусную активность IFN- оценивали как подавление цитопатического действия вируса везикулярного стоматита (VSV) на человеческие клетки WISH (Rubinstein et al., 1981). Пример 5. Измерение связывания IFN с мутантным IFNAR2. Измеряли связывание IFN- и IFN-2 с мутантом H78A/N100A (пример 2) и сравнивали посредством RIfS с ЕС рецептора дикого типа (пример 3). Хотя нашли, что скорость ассоциации IFN- с мутантом H78A/N100A являлась сходной со скоростью ассоциации дикого типа (фиг. 3), обнаружили, что скорость диссоциации являлась значительно меньшей. Рассчитанная аффинность IFN- к мутантуH78A/N100A является приблизительно 30 пМ против аффинности к белку WT величиной приблизительно 3 нМ. В отличие от IFN-, обнаружили, что и скорость ассоциации, и скорость диссоциации IFN-2 с мутантом H78A/N100A являлись сходными со скоростями, полученными для белка дикого типа (фиг. 3). Данные результаты демонстрируют, как обнаружено, что аффинность мутантного IFNAR2 к IFN- является приблизительно в 100 раз выше, чем аффинность IFNAR2 дикого типа и не изменена для IFN-2. Пример 6. Относительные аффинности интерферона к мутантному IFNAR2. Связывание и аффинности ЕС рецептора IFNAR и ЕС мутантного рецептора (пример 2) с IFN- иIFN-2 измеряли с применением RIfS и IFNAR2 дикого типа или мутантного IFNAR2, иммобилизованных на поверхности посредством специфических антител (пример 3). После измерения аффинностей получали относительные аффинности посредством сравнения Kd мутантного рецептора с Kd рецептора дикого типа (табл. 4).Kd связывания интерферона с внеклеточным доменом (ЕС) IFNAR2 измеряли посредством RIfS и нашли ее приблизительно равной 3 нМ (пример 5). Kd связывания IFN- с ЕС мутанта H78A/N100A составляла приблизительно 30 пМ. Точное измерение Kd для данного мутанта являлось невозможным, так как связывание происходило слишком быстро, чтобы получить хорошие данные посредством RIfS. Обнаружили, что Kd связывания для IFN-2 и ЕС мутанта H78A/N100A являлась сходной с рецептором дикого типа. Результаты в табл. 4 демонстрируют относительные аффинности мутантных ЕС IFNAR в сравнении с ЕС рецептора IFNAR2 дикого типа. Мутанты являлись следующими: мутантные по одному аминокислотному остатку, Н 78 А или N100A, и мутантные по двум аминокислотам H78A/N100A,H78A/N100D и H78A/N100H, где аминокислоту N100 заменяли на аланин, аспарагиновую кислоту и гистидин, соответственно (пример 2). Результаты демонстрируют, что одиночные мутации в IFNAR2 увеличивают аффинность комплекса от 4,6 до 7,3 раз, тогда как двойная мутация вызывает синергический эффект, увеличивая аффинность комплекса в размере от 26 до приблизительно 50 раз. Обнаружено, что лучшим мутантом в терминах с точки зрения аффинности является двойной мутант, с N100, замененной- 13009604 на аланин, демонстрирующий более чем в 50 раз увеличенную аффинность по сравнению с вариантом дикого типа. Таблица 4 Пример 7. Поглощение интерферона- мутантом IFNAR2. Сравнивали способность ЕС IFNAR2 дикого типа и мутантных ЕС служить в качестве носителейIFN-. Для данной цели контролировали противовирусную активность оставшегося (свободного) IFN- в образцах, содержащих постоянную концентрацию IFN- (10 пМ) смешанного с различными концентрациями рекомбинантных растворимых ЕС IFNAR2 или мутантных ЕС IFNAR2 (пример 6). При противовирусном анализе смесь (комплекс IFNAR2/IFN) добавляли к клеткам WISH (человеческие амниотические клетки). Данные клетки WISH затем подвергали обработке вирусом везикулярного стоматита (VSV) и контролировали противовирусную активность остаточного (свободного) IFN- как степень выживания клеток после 24 ч инкубации (пример 4). Свободный IFN-, присутствующий в образцах с различной концентрацией WT или мутантного ЕС IFNAR2 (R2), определяли на основании кривой "дозавыживание", соответствующей противовирусной активности, как функции от концентрации IFN-, полученной в отсутствие IFNAR2 (верхняя диаграмма фиг. 2). Тестируемые мутанты представляли собой следующее: ЕС IFNAR2, измененный по одному аминокислотному остатку, Н 78 А или N100A, и измененный по двум аминокислотам H78A/N100A,H78A/N100D и H78A/N100H, где аминокислоту N100 заменяли на аланин, аспарагиновую кислоту и гистидин, соответственно (пример 2). Двойной мутант IFNAR2 H78A/N100A (пример 2) продемонстрировал наивысшую аффинность из всех полученных мутантов (Kd составляла приблизительно 30 пМ и ниже,см. примеры 5 и 6). На фиг. 4 представлено то, что в присутствии 2,5 нМ ЕС IFNAR2 дикого типа приблизительно 20%IFN- связано с растворимым рецептором (поглощено), тогда как в присутствии только 0,2 нМ двойного мутанта ЕС H78A/N100A связанным является 50% IFN-, а с применением только 0,4 нМ мутанта ЕСH78A/N100A связанным является 80% IFN-. Биологический анализ также продемонстрировал, что таких же степеней поглощенного IFN- (связанный IFN- в условиях равновесия) и остаточной противовирусной активности (свободный IFN-), которые получают с IFNAR2 дикого типа, можно достичь с применением приблизительно в 30 раз меньшей концентрации мутантного H78A/N100A ЕС IFNAR2. Данные результаты также демонстрируют, что дважды измененный мутант дает лучшие результаты, особенно один, в котором обе аминокислоты заменены на аланин, H78A/N100A IFNAR2. Данные результаты демонстрируют, что дважды мутантный IFNAR2 поглощает IFN- более эффективно и, следовательно, необходимо введение значительно меньших количеств для достижения его активности в качестве носителя. Ссылки ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение мутантного полипептида -цепи рецептора интерферона типа I (IFNAR2)(MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1, мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100, обладающего повышенной аффинностью к интерферону- (IFN-) по сравнению с полипептидом дикого типа, или аналога указанного мутантного полипептида, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100, или его соли, для производства лекарственного средства, модулирующего эффекты IFN-. 2. Применение по п.1, где мутации представляют собой замены. 3. Применение по п.2, где замены являются неконсервативными. 4. Применение по любому из пп.1-3, где остаток гистидина в положении 78 заменен на аланин. 5. Применение по любому из пп.1-4, где остаток аспарагина в положении 100 заменен на аланин,аспарагиновую кислоту или гистидин. 6. Применение по п.4 или 5, где оба остатка в положениях 78 и 100 заменены на аланин. 7. Применение по п.1, где указанный мутантный полипептид включает последовательности SEQ IDNO:2, SEQ ID NO:3 или SEQ ID NO:4. 8. Применение по любому из пп.1-7, где аффинность мутантного полипептида к IFN- составляет приблизительно 30 пМ. 9. Применение по любому из пп.1-7, где аффинность мутантного пептида к IFN- приблизительно в 25, предпочтительно в 50 и более предпочтительно в 100 раз выше, чем аффинность полипептида IFNAR2 дикого типа. 10. Применение по любому из пп.1-7, где аналог MIFNAR 2 содержит экстрацеллюлярный домен. 11. Применение по любому из пп.1-10, где указанный мутантный полипептид ковалентно связан сIFN-. 12. Применение по любому из пп.1-11, где указанный мутантный полипептид является ПЭГилированным. 13. Применение по любому из пп.1-12, где лекарственное средство дополнительно включает IFN-. 14. Применение по п.13, где лекарственное средство дополнительно включает антагонист IFN-. 15. Применение по любому из пп.1-12, где указанное лекарственное средство усиливает активностьIFN-. 16. Применение по п.15, где указанное лекарственное средство усиливает противоопухолевую активность IFN-. 17. Применение по п.15, где указанное лекарственное средство усиливает иммуномодулирующую активность IFN-.- 20009604 18. Применение по п.17, где указанное лекарственное средство усиливает иммуномодулирующую активность IFN- при аутоиммунных заболеваниях, выбранных из рассеянного склероза, ревматоидного артрита, миастении гравис, диабета, системной красной волчанки и язвенного колита. 19. Применение по любому из пп.1-12, где указанное лекарственное средство ингибирует активность IFN-. 20. Применение по любому из пп.1-13, где лекарственное средство предназначено для лечения аутоиммунного заболевания, вирусного заболевания или рака. 21. Применение по п.20, где заболевание выбрано из рассеянного склероза, ревматоидного артрита,злокачественной миастении, диабета, язвенного колита, системной красной волчанки, хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза,гепатита А, хронической инфекции вирусами гепатита В и С, лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы и меланомы. 22. Применение по любому из пп.20 или 21, где лекарственное средство дополнительно содержит терапевтически активное количество IFN-. 23. Применение по любому из пп.1-12, где лекарственное средство предназначено для лечения заболевания, вызванного или осложненного IFN-. 24. Применение по п.23, где лекарственное средство дополнительно содержит антагонист IFN-. 25. Применение по любому из пп.1-12, где лекарственное средство предотвращает олигомеризациюIFN-. 26. Фармацевтическая композиция, включающая терапевтически эффективное количество мутантного полипептида -цепи рецептора интерферона типа I (IFNAR2) (MIFNAR2), имеющего аминокислотную последовательность SEQ ID NO:1, мутированного по аминокислотным остаткам гистидина в положении 78 и аспарагина в положении 100, или его аналога, обладающего, по существу, такой же активностью, у которого до 30 аминокислотных остатков может быть удалено, добавлено или замещено, при условии, что эти остатки не являются остатками 78 и 100. 27. Фармацевтическая композиция по п.26, где указанное терапевтически эффективное количествоMIFNAR2 по меньшей мере в 30 раз меньше терапевтически эффективного количество IFNAR2 дикого типа. 28. Фармацевтическая композиция по п.26 или 27, дополнительно включающая IFN-. 29. Фармацевтическая композиция по п.26 или 27, дополнительно содержащая антагонист IFN-. 30. Фармацевтическая композиция по п.28, где мутантный полипептид IFNAR2 ковалентно связан сIFN-. 31. Фармацевтическая композиция по любому из пп.26 или 30, где указанный аналог IFNAR2 содержит экстрацеллюлярный домен. 32. Фармацевтическая композиция по любому из пп.26-31 для усиления противоопухолевых и противовирусных свойств, а также иммуномодулирующих свойств IFN-. 33. Фармацевтическая композиция по п.32 для лечения хронического гранулематозного заболевания, остроконечной кондиломы, ювенильного ларингеального папилломатоза, гепатита А, хронической инфекции, вызванной вирусами гепатита В и С, лейкоза ворсистых клеток, саркомы Капоши, множественной миеломы, хронического миелоидного лейкоза, неходжкинской лимфомы, меланомы, рассеянного склероза, ревматоидного артрита, злокачественной миастении, диабета, язвенного колита и системной красной волчанки. 34. Фармацевтическая композиция по п.29 для ингибирования иммуномодулирующих свойств IFN-.
МПК / Метки
МПК: C07K 14/715, A61P 43/00
Метки: полипептида, типа, интерферона-&beta, средства, фармацевтическая, рецептора, композиция, содержащаяуказанный, beta-цепи, применение, лекарственного, интерферона, приготовления, мутантного, модулирующего, эффекты, полипептид
Код ссылки
<a href="https://eas.patents.su/24-9604-primenenie-mutantnogo-polipeptida-beta-cepi-receptora-interferona-tipa-i-dlya-prigotovleniya-lekarstvennogo-sredstva-moduliruyushhego-effekty-interferona-beta-i-farmacevticheskaya.html" rel="bookmark" title="База патентов Евразийского Союза">Применение мутантного полипептида &beta-цепи рецептора интерферона типа i для приготовления лекарственного средства, модулирующего эффекты интерферона-&beta, и фармацевтическая композиция, содержащаяуказанный полипептид</a>
Предыдущий патент: Кальцилитические соединения
Следующий патент: Способ характеристики полинуклеотидов
Случайный патент: Устройство, способ и установка для подъема железнодорожного рельса