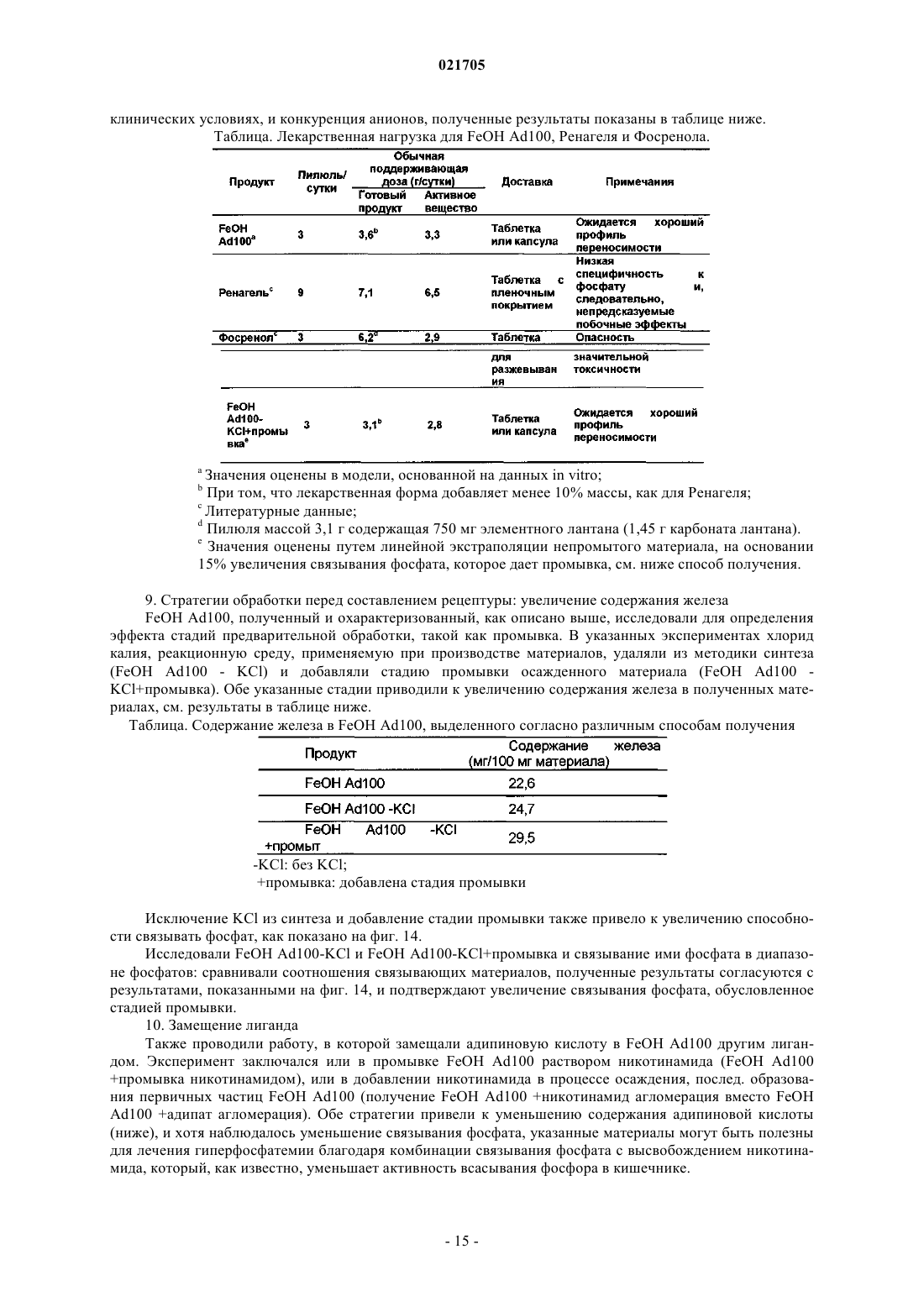
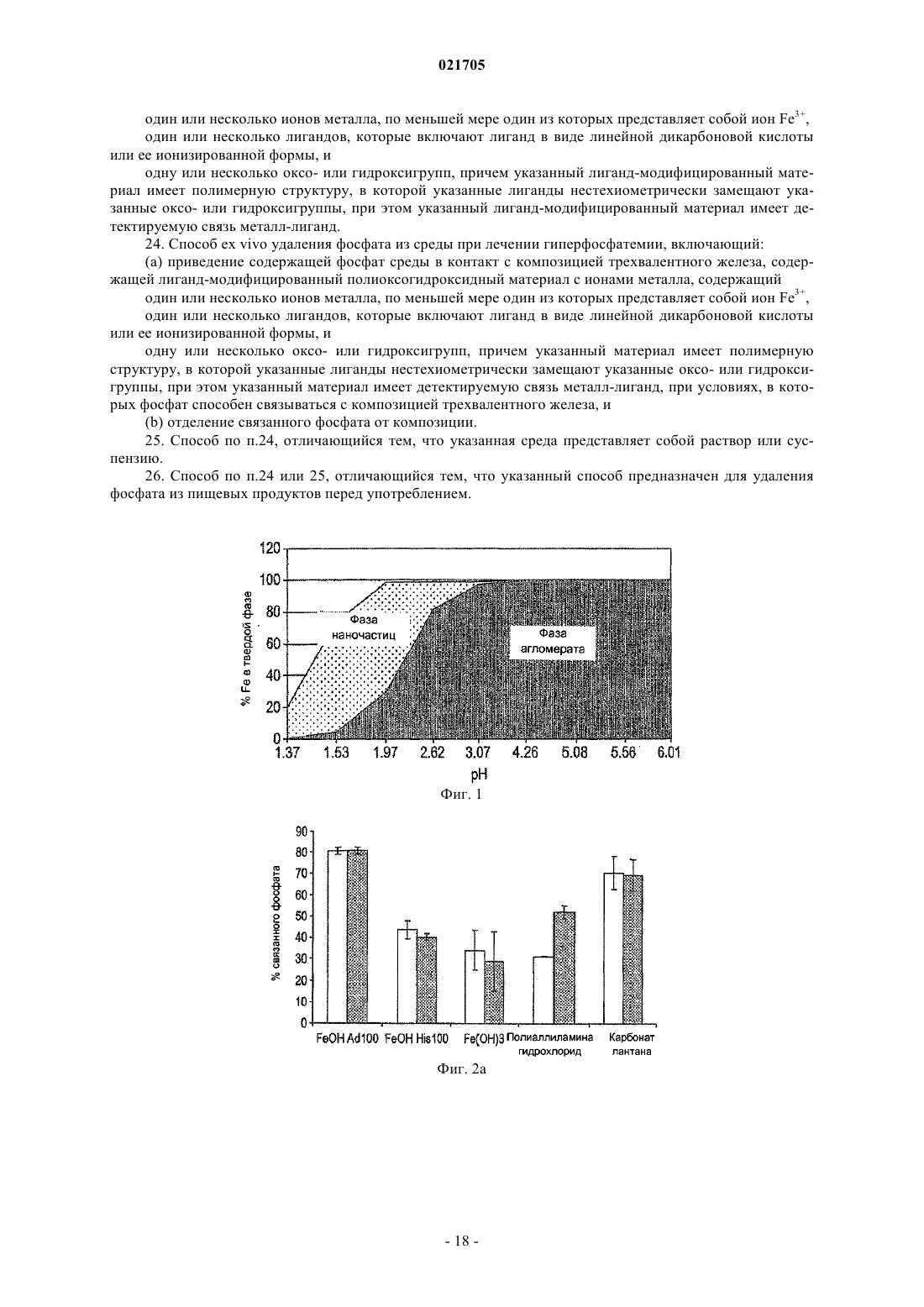
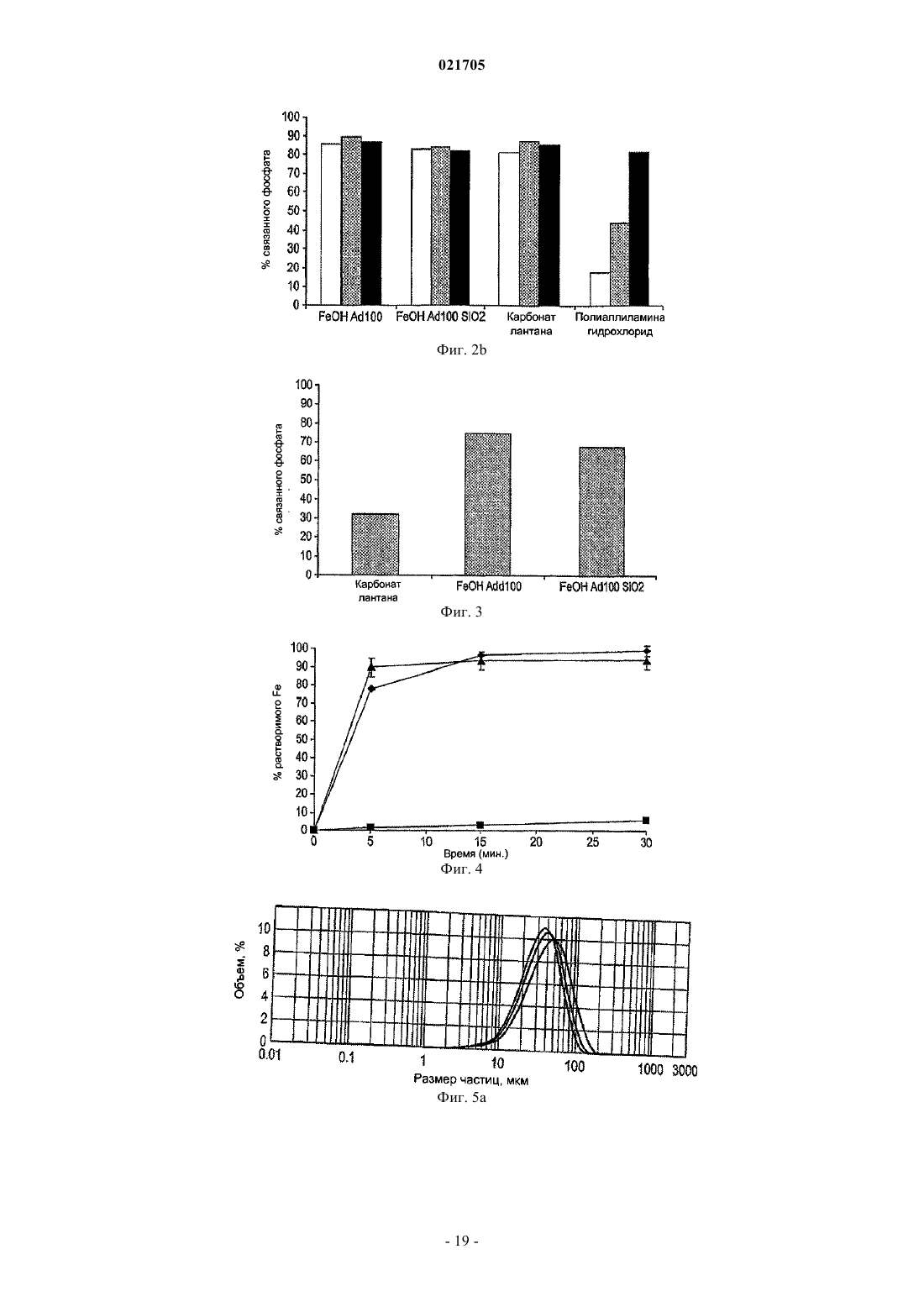
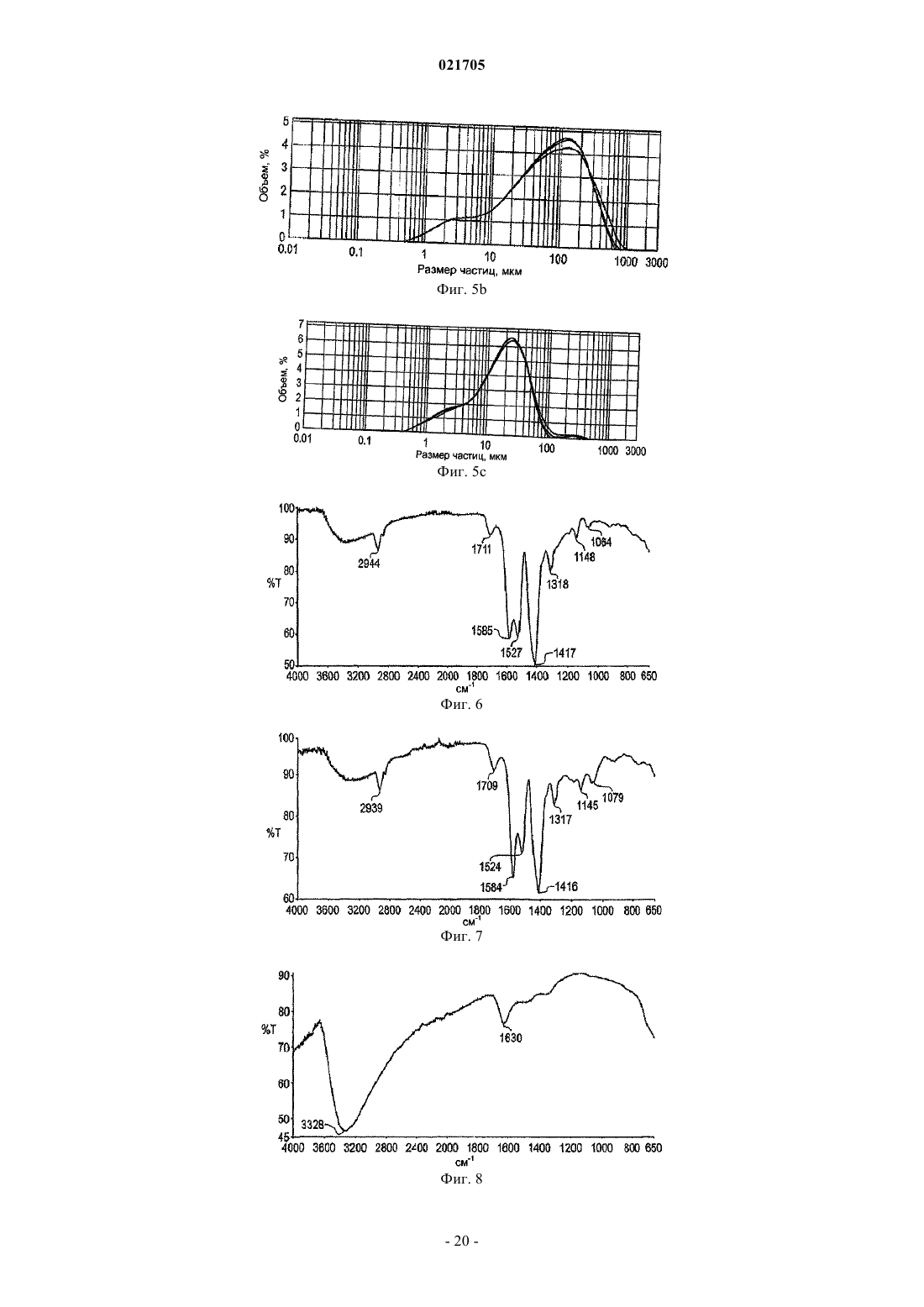
Фосфат-связывающие материалы и их применение
Номер патента: 21705
Опубликовано: 31.08.2015
Формула / Реферат
1. Применение композиции трехвалентного железа для лечения гиперфосфатемии, причем указанная композиция трехвалентного железа представляет собой твердый фосфат-связывающий материал, содержащий модифицированный лигандами полиоксогидроксидный материал с ионами металла, содержащий
один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,
один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и
одну или несколько оксо- или гидроксигрупп, а
указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд.
2. Применение по п.1, отличающееся тем, что указанный лиганд представляет собой карбоновую кислоту формулы HOOC-R1-COOH, где R1 представляет собой C1-10алкильную, C1-10алкенильную или C1-10алкинильную группу, или ее ионизированную форму, причем R1 возможно замещен одной или более гидроксильными группами.
3. Применение по любому из пп.1-2, отличающееся тем, что R1 представляет собой C1-10алкильную группу, при этом R1 возможно замещен одной или более гидроксильными группами.
4. Применение по любому из пп.1-3, отличающееся тем, что указанный лиганд в виде дикарбоновой кислоты представляет собой янтарную кислоту, яблочную кислоту, адипиновую кислоту, глутаровую кислоту или пимелиновую кислоту или ионизированные формы указанных кислот.
5. Применение по любому из пп.1-4, отличающееся тем, что указанный лиганд-модифицированный материал имеет структуру, соответствующую ферригидриту.
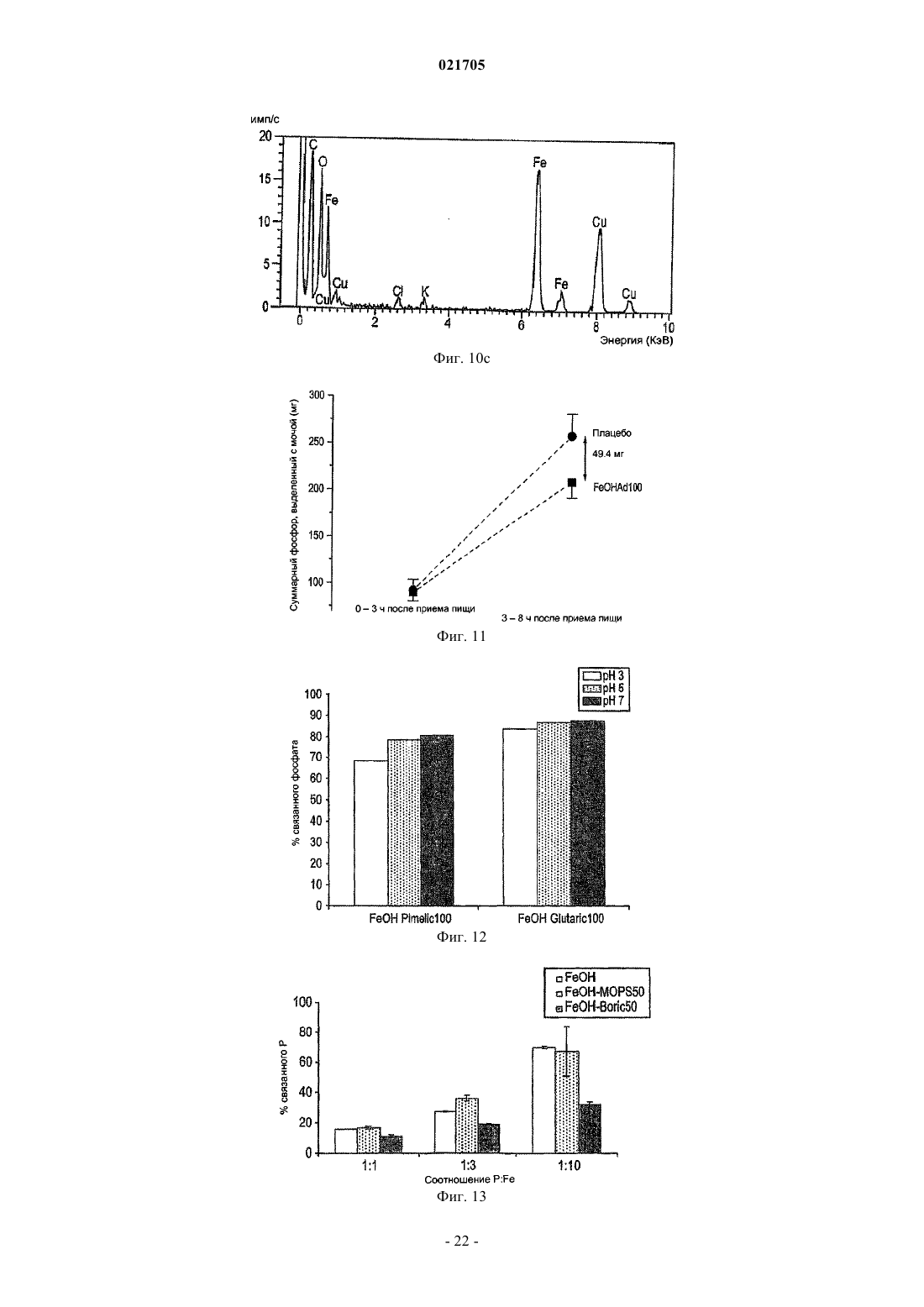
6. Применение по любому из пп.1-5, отличающееся тем, что емкость (K2) указанного твердого фосфат-связывающего материала составляет по меньшей мере 1,5 ммоль Р/г связывающего материала.
7. Применение по п.6, отличающееся тем, что емкость (K2) указанного твердого фосфат-связывающего материала составляет по меньшей мере 2,5 ммоль Р/г связывающего материала.
8. Применение по п.6, отличающееся тем, что емкость связывания фосфата указанной композицией массой 53,6 мг составляет по меньшей мере 50% 10 мМ фосфата в образце, при значениях pH между 3 и 7, в объеме 20 мл.
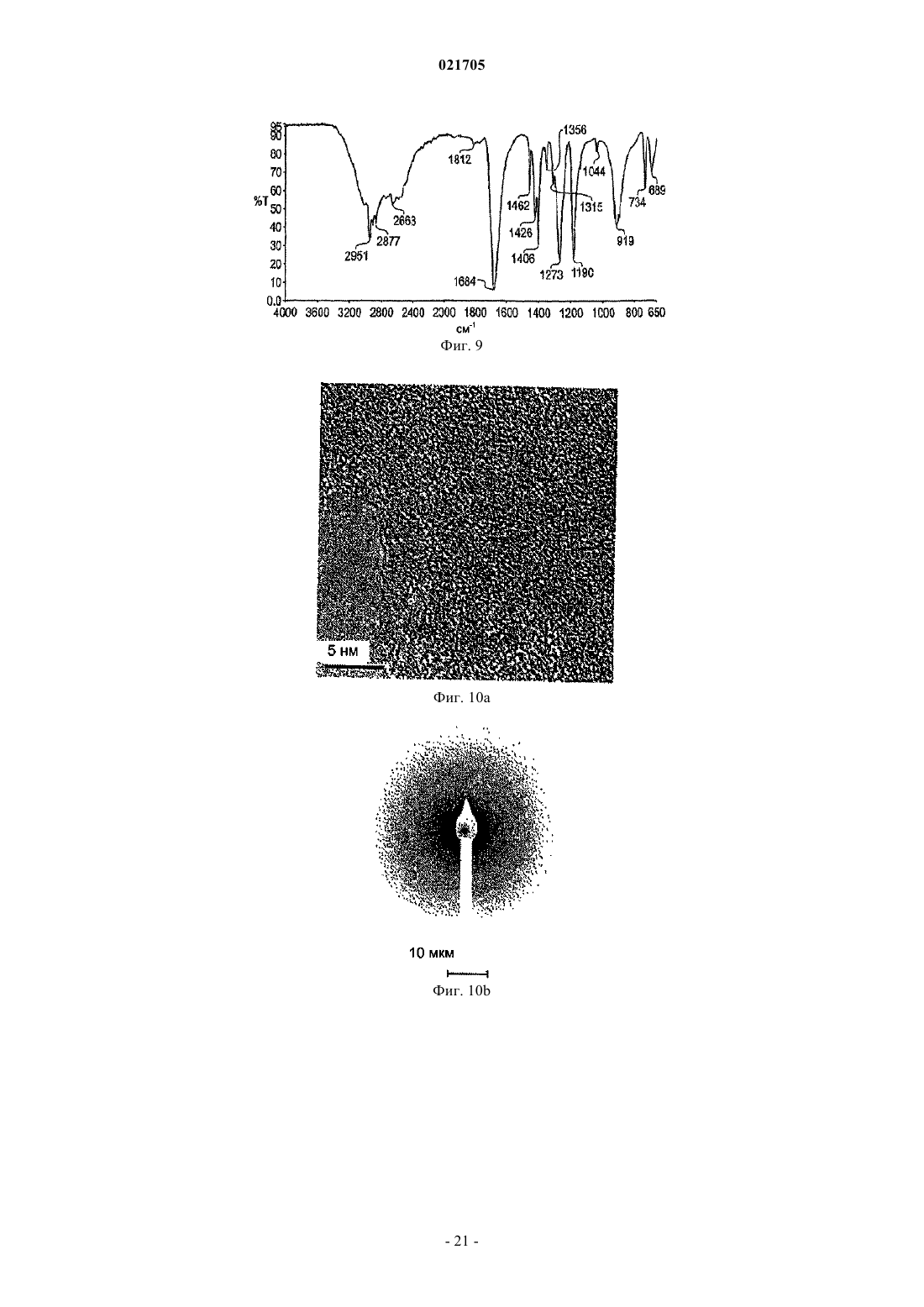
9. Применение по любому из пп.1-8, отличающееся тем, что указанную детектируемую связь "металл-лиганд" определяют при помощи инфракрасной спектроскопии.
10. Применение по любому из пп.1-9, отличающееся тем, что ионы металла представляют собой ионы Fe3+.
11. Применение по любому из пп.1-10, отличающееся тем, что указанная композиция дополнительно содержит ингибитор поглощения фосфата и/или вещество, способное облегчать побочные эффекты в желудке.
12. Применение по п.11, отличающееся тем, что указанный ингибитор поглощения фосфата и/или вещество, способное облегчать побочные эффекты в желудке, представляет собой дополнительный лиганд, включенный в твердый лиганд-модифицированный полиоксогидроксидный материал с ионами металла, или включен в состав композиции с твердым лиганд-модифицированным полиоксогидроксидным материалом с ионами металла.
13. Применение по любому из пп.1-12, отличающееся тем, что указанный лиганд-модифицированный материал представляет собой
оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором адипиновой кислоты (FeOH Ad100),
оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором адипиновой кислоты и силикатом натрия (FeOH Ad100 SiO2),
оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором глутаровой кислоты (FeOH Glutaric (Глутарат) 100), или
оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором пимелиновой кислоты (FeOH Pimelic (Пимелат) 100).
14. Способ лечения гиперфосфатемии, включающий введение пациенту композиции трехвалентного железа, которая представляет собой твердый фосфат-связывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий
один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,
один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и
одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металл-лиганд, и при этом указанный пациент страдает болезнью почек.
15. Способ лечения по п.14, отличающийся тем, что указанная болезнь почек представляет собой хроническую болезнь почек, конечную стадию болезни почек, гиперфосфатемию, вызванную на любой стадии почечной недостаточности, или острую почечную недостаточность.
16. Способ лечения по п.14, отличающийся тем, что указанного пациента подвергают гемодиализу.
17. Способ по любому из пп.14-16, отличающийся тем, что указанный пациент имеет высокие концентрации фосфора в плазме.
18. Способ по любому из пп.14-17, отличающийся тем, что введение указанной композиции осуществляют для лечения осложнения или вторичного состояния пациента, которое является результатом гиперфосфатемии.
19. Способ по п.18, отличающийся тем, что указанное осложнение или вторичное состояние представляет собой вторичный гипертиреоз, кальцификацию мягких тканей, остеодистрофию, гиперкальциемию, снижение гиперапратиреоидизма, сердечно-сосудистую заболеваемость или смертность, почечную остеодистрофию и/или кальцифилаксию.
20. Способ по любому из пп.14-19, отличающийся тем, что указанная композиция изготовлена в виде состава для перорального или назогастрального введения.
21. Способ по пп.14-19, отличающийся тем, что указанное лечение включает удаление фосфата из диализных жидкостей, плазмы и/или цельной крови.
22. Применение пищевого продукта при лечении гиперфосфатемии, причем пищевой продукт содержит твердый фосфат-связывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий
один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,
один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и
одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд.
23. Применение жидкости для диализа при лечении гиперфосфатемии, причем жидкость содержит твердый фосфат-связывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий
один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,
один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и
одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд.
24. Способ ex vivo удаления фосфата из среды при лечении гиперфосфатемии, включающий:
(а) приведение содержащей фосфат среды в контакт с композицией трехвалентного железа, содержащей лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий
один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,
один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и
одну или несколько оксо- или гидроксигрупп, причем указанный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металл-лиганд, при условиях, в которых фосфат способен связываться с композицией трехвалентного железа, и
(b) отделение связанного фосфата от композиции.
25. Способ по п.24, отличающийся тем, что указанная среда представляет собой раствор или суспензию.
26. Способ по п.24 или 25, отличающийся тем, что указанный способ предназначен для удаления фосфата из пищевых продуктов перед употреблением.
Текст
Настоящее изобретение относится к фосфатсвязывающим материалам и композициям,содержащим указанные материалы,представляющим собой твердые лигандмодифифицированные полиоксогидроксидные материалы с ионами металла, основанные на оксогидроксидах трехвалентного железа, модифицированных лигандами карбоновых кислот, или ионизированными формами указанных лигандов. Кроме того, изобретение относится к способам удаления фосфатов из фосфатсодержащей среды, в том числе к способам лечения гиперфосфатемии, а также к применению пищевого продукта и диализной жидкости,содержащей указанные композиции. Описанные материалы получены и исследованы в примерах,представленных в настоящей заявке для демонстрации того, что указанные материалы способны связывать фосфат в исследованиях in vitro и in vivo. Паувэл Джонатан Джозеф, Фариа Нано Хорхе Родригес (GB)(71)(73) Заявитель и патентовладелец: МЕДИКАЛ РЕСРЧ КАУНСИЛ (GB) Область техники Настоящее изобретение относится к фосфатсвязывающим материалам, и их применению для лечения гиперфосфатемии и для удаления фосфатов из материалов, при применении in vitro и in vivo. В частности, настоящее изобретение относится к фосфатсвязывающим материалам, представляющим собой лиганд-модифицированные полиоксогидроксидные материалы трехвалентного железа. Уровень техники Уровни фосфатов регулируются, главным образом, почками, и у здоровых людей гомеостаз фосфатов поддерживается благодаря выведению с мочой. Концентрации фосфатов в сыворотке могут значительно повышаться у пациентов с хронической почечной недостаточностью и приводить к вторичному гипертиреозу и кальцификации мягких тканей. Указанная кальцификация приводит к атеросклерозу коронарных артерий и ранней сердечной недостаточности, которая является основной причиной смерти на конечной стадии почечной недостаточности (ESRD, end stage renal disease). Диета с ограничением фосфатов, поступающих с пищей, обычно недостаточна для контроля гиперфосфатемии у пациентов, подвергаемых гемодиализу, и необходим прием фосфат-связывающих средств перорально, для уменьшения всасывания в кишечнике. Для связывания поступающих с пищей фосфатов широко применяли соединения алюминия и кальция, но они вызывают беспокойство в отношении их безопасности при длительном применении. Применение фосфат-связывающих средств на основе алюминия, приводит к накоплению указанного элемента в тканях и может привести к системной токсичности. Введение больших количеств средств, связывающих фосфаты, на основе кальция, может привести к гиперкальциемии и впоследствии осложниться кальцификацией тканей. Севеламер (полиаллиламина гидрохлорид), синтетический полимер, известный в продаже под названием Ренагель, представляет собой ионообменную смолу, применяемую для связывания фосфатов,поступающих с пищей. Однако связывающее действие указанной смолы не специфично к фосфатам, и необходимо вводить большие дозы для контроля фосфатов в сыворотке у пациентов с ESRD, что может ухудшить соблюдение пациентом схемы лечения. Карбонат лантана, одобренное к применению фосфатсвязывающее средство, известен в продаже как Фосренол. Однако существуют опасения по поводу долгосрочного накопления и токсичности лантана в тканях. В патенте США 6903235 описано применение цитрата железа (III), растворимого соединения железа, для связывания фосфатов, поступающих с пищей. Однако длительное применение растворимого соединения железа может привести к желудочно-кишечным побочным эффектам вследствие окислительной активности свободного железа в кишечном пространстве, которые могут впоследствии привести к ухудшению соблюдения терапевтических рекомендаций. В WO 2007/088343 описано фосфатсвязывающее средство, полученное по реакции водных растворов сульфата магния и сульфата трехвалентного железа, в присутствии гидроксида натрия и карбоната натрия, предположительно приводящей к образованию гидроксокарбоната железа и магния со структурой гидроталькита. Указанное фосфатсвязывающее средство известно как "Альфарен", но имеет тот недостаток, что связывает относительно малые количества фосфатов, и, кроме того, выделяет в желудкеMg2+, приводя к частым побочным эффектам. Способность оксогидроксидов железа связывать фосфаты известна в области техники. Например, в патенте США 6174442 описан адсорбент фосфата с использованием -гидроксида железа, стабилизированного углеводами и/или гуминовой кислотой. Однако его связывающая способность ограничена, а способ получения не подходит для получения больших количеств материала. В WO 2008/071747 описан адсорбент фосфата, содержащий -оксид-гидроксид железа, стабилизированный растворимыми и нерастворимыми углеводами. Однако активность описанного в указанной заявке материала в отношении связывания фосфата ограничена очень низким значением pH, что ограничивает его эффективность в качестве фосфатсвязывающего средства. Таким образом, не существует применяемого в настоящее время идеального фосфатсвязывающего средства, а существующие материалы имеют один или несколько недостатков, чаще всего токсичность или накопление, стоимость, эффективность удаления фосфатов, ацидоз и/или непереносимость пациентом. Следовательно, в данной области сохраняется постоянная потребность в разработке дополнительных фосфатсвязывающих средств, которые преодолевают или облегчают недостатки существующих вариантов лечения. Описание изобретения В общем, настоящее изобретение относится к фосфатсвязывающим материалам, и к композициям,содержащим указанные материалы, которые представляют собой твердые лиганд-модифицированные полиоксогидроксидные материалы с ионами металла. Композиции, описанные в настоящей заявке, основаны на оксогидроксидах трехвалентного железа, модифицированных лигандами в виде карбоновых кислот, или ионизированными формами указанных кислот, такими как адипат. Указанные материалы полу-1 021705 чены и исследованы в примерах, представленных в настоящей заявке, с целью продемонстрировать, что они способны связывать фосфаты in vitro и in vivo. Таким образом, согласно первому аспекту настоящего изобретения, предложено применение композиции трехвалентного железа для лечения гиперфосфатемии, причем указанная композиция представляет собой твердый фосфатсвязывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+, один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты, или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, а указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. Предпочтительно, чтобы твердый лиганд-модифицированный полиоксогидроксидный материал с ионами металла имел одно или несколько воспроизводимых физико-химических свойств, например, профиль растворения и/или характеристики связывания фосфатов. Как обсуждается ниже, материалы, содержащие трехвалентное железо, согласно настоящему изобретению, предпочтительно имеют структуры, соответствующие лиганд-модифицированному ферригидриту. Также предпочтительно, чтобы материалы, содержащие трехвалентное железо, согласно настоящему изобретению,имели детектируемую связь M-L, доступную для наблюдения при помощи физического анализа, например, такого как инфракрасная спектроскопия. Согласно другому аспекту настоящего изобретения предложено применение композиции трехвалентного железа согласно настоящему изобретению, для получения лекарственного средства для лечения гиперфосфатемии. Согласно другому аспекту настоящего изобретения предложен способ лечения гиперфосфатемии,включающий введение пациенту композиции трехвалентного железа, которая представляет собой твердый фосфатсвязывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты,или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металллиганд, и при этом указанный пациент страдает болезнью почек. Согласно другому аспекту настоящего изобретения предложен ex vivo способ удаления фосфата из среды, включающий:(a) приведение содержащей фосфат среды в контакт с композицией трехвалентного железа, содержащей лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты,или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп,причем указанный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металл-лиганд при условиях, в которых фосфат способен связываться с композицией трехвалентного железа, и(b) отделение связанного фосфата от композиции. Указанный способ можно применять in vitro или in vivo. Соответственно, материалы согласно настоящему описанию способны селективно удалять фосфат из растворов или суспензий, содержащих указанный анион. Указанное удаление может иметь место in vivo, например, в случае, когда материалы согласно настоящему изобретению способны удалять фосфат из жидкого или кашицеобразного содержимого желудочно-кишечного тракта после перорального введения. Однако материалы согласно настоящему изобретению могут найти другие применения, например, в случае, когда указанные материалы способны удалять фосфат из пищевых продуктов перед потреблением, или способны селективно удалять фосфат из диализных жидкостей, плазмы и/или цельной крови. Одним из конкретных применений материалов, связывающих фосфат, согласно настоящему изобретению, является диализ, в котором указанные материалы можно применять для экстракорпорального удаления фосфата из диализных жидкостей в процессе гемодиализа. Согласно указанному аспекту настоящего изобретения предложены композиции,такие как пищевой продукт или диализная жидкость, которые содержат фосфатсвязывающий материал,согласно настоящему изобретению. В частности, согласно одному аспекту изобретения предложено применение пищевого продукта при лечении гиперфосфатемии, причем пищевой продукт содержит твердый фосфатсвязывающий мате-2 021705 риал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты,или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. Согласно другому аспекту изобретения предложено применение жидкости для диализа при лечении гиперфосфатемии, причем жидкость содержит содержащие твердый фосфатсвязывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты,или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. Соответственно, согласно настоящему изобретению предложен способ лечения высоких концентраций фосфора в плазме, гиперфосфатемии, возникающей на разных стадиях почечной недостаточности, острой почечной недостаточности, хронической почечной недостаточности, и/или конечной стадии болезни почек, включая состояния, требующие гемодиализа. Клиническое управление указанными состояними с использованием настоящего изобретения может способствовать облегчению осложнений,связанных с указанными состояниями, таких как вторичный гипертиреоз, кальцификация мягких тканей,остеодистрофия, гиперкальциемия, снижение гиперпаратиреоза, сердечно-сосудистая заболеваемость или смертность, почечная остеодистрофия и/или кальцифилаксия. Согласно одному из аспектов настоящего изобретения, предложен способ, включающий стадии получения материала трехвалентного железа и его исследования, для определения, способен ли он, или до какой степени он способен связывать фосфат. В качестве примера, указанный способ может включать:(a) смешивание раствора, содержащего Fe3+ и лиганд в виде карбоновой кислоты (например, адипиновую кислоту), и любые дополнительные лиганды или другие компоненты, в реакционной среде при первом значении pH(А), при котором указанные компоненты растворимы;(b) изменение значения pH(А) до второго значения pH(В) с тем, чтобы вызвать образование твердого осадка или коллоидного раствора лиганд-модифицированного полиоксогидроксидного материала с ионами металла;(c) выделение и, возможно, высушивание и/или изготовление лекарственной формы из твердого лиганд-модифицированного полиоксогидроксидного материала с ионами металла, полученного на стадии(b). Ниже следует описание вариантов реализации настоящего изобретения в качестве примера, а не ограничения, со ссылками на прилагаемые фигуры и примеры. Краткое описание чертежей Фиг. 1: Динамика выпадения осадка FeOH Ad100 по мере увеличения значения pH, выраженная в процентах от общего содержания железа в исходном растворе. Полностью осажденная и агломерированная фаза получена при pH 4,5. Фиг. 2: (а) связывание фосфата in vitro. В случае лиганд-модифицированного гидроксида железа,как описано (например, FeOH Ad100), наблюдается связывание фосфата, явно превосходящее связывание в случаях с немодифицированным ферригидритом (Fe(OH)3) или Ренагелем (полиаллиламина гидрохлоридом), и, по меньшей мере, эквивалентное по эффективности, но с потенциально токсичным карбонатом лантана. Кроме того, выбранный лиганд имеет преимущество перед другими, например, гистидином, который в отличие от адипата, не дает заметного увеличения связывания фосфата (т.е., FeOH His100 по сравнению с Fe(OH)3). Белые столбики соответствуют значению pH 3, серые столбики соответствуют значению pH 5. (b) Второй пример связывания фосфата in vitro: при значениях pH 3 (белый), 5 (серый), а также 7 (черный). Также показана эффективность Fe ОН Ad100 SiO2 (т.е., модифицированного силикатомFeOH Ad100). На обеих фигурах (а и b) раствор представляет собой 10 мМ раствор фосфата и количество связывающего материала составляет 53,6 мг при суммарном объеме 20 мл. В указанных экспериментах связывающий материал в первую очередь выдерживали при самом низком значении pH в течение 60 мин, а затем последовательно при более высоких pH в течение 60 мин. Фиг. 3: Карбонат лантана оказался эффективным только при "предварительной обработке" при низком значении pH, в отличие от FeOHAd100 и FeOH Ad100 SiO2. Условия эксперимента в данном случае соответствовали представленным на фиг. 2 а/b, за исключением того, что фосфатсвязывающие материалы выдерживали с раствором фосфата только при значении pH 5, а не последовательно, таким образом, не происходила предварительная обработка кислотой (желудочным соком) связующего при более высоких значениях pH. Фиг. 4: Профиль растворения для FeOH Ad100 (ромбы), FeOHAd100 SiO2 (треугольники), и немодифицированного 2-линейного ферригидрита (квадраты) при значении pH 1,2. Для подробного описания методики смотрите материалы и способы. Фиг. 5: Размер частиц FeOHAd100 свежеприготовленного (а); после высушивания (b); после основного помола (с). Фиг. 6: Инфракрасный анализ FeOHAd100. Фиг. 7: Инфракрасный анализ FeOHAd100 SiO2. Фиг. 8: Инфракрасный анализ немодифицированного ферригидрита Fe(OH)3 для сравнения. Фиг. 9: Инфракрасный анализ немодифицированной адипиновой кислоты для сравнения. Фиг. 10: а) Первичные частицы (кристаллиты) FeOH Ad100, обнаруженные на изображении порошка, полученном методом ТЭМ высокого разрешения, в виде темных, пятнистых частиц размером 2-3 нм,и выглядят менее кристалличными, чем немодифицированный ферригидрит (не показано). b) Основная ферригидритоподобная структура наблюдается при электронной дифракции с расстоянием между плоскостями 2,5 и 1,5 , с) в спектр EDX (рентгеновский спектр рассеивания энергии) показывает, что основными элементами FeOH Ad100 являются С, О и Fe, с меньшим содержанием Cl (1,4 ат.%), К (1,2 ат.%) и, возможно, Na. Сигнал Cu обусловлен поддерживающей решеткой. Фиг. 11: Средняя (СОС) экскреция фосфора с мочой (мг за 8 ч) у 13 добровольцев, после приема пищи и FeOH Ad100 или плацебо. Фиг. 12: Связывание фосфата in vitro различными лиганд-модифицированными гидроксидами трехвалентного железа. В данном случае, применяли раствор фосфата с концентрацией 10 мМ и связывающий материал в количестве 214 мг при суммарном объеме 80 мл. Сначала связывающее вещество выдерживали при самом низком значении pH в течение 60 мин, а затем последовательно при более высоких значениях pH в течение 60 мин. Фиг. 13: Связывание фосфата in vitro различными лиганд-модифицированными оксогидроксидами трехвалентного железа. Различные количества связующего добавили к 10 мМ раствору фосфата, получив молярные соотношения фосфата к железу 1:1, 1:3 и 1:10. Связывание фосфата осуществляли в течение 120 мин при 37C. Фиг. 14: Связывание фосфата in vitro под действием FeOH Ad100, полученного различными способами. Применяли раствор фосфата 10 мМ и связующее в количестве 214 мг в суммарном объеме 80 мл. Связывающий материал в первую очередь выдерживали при самом низком значении pH в течение 60 мин, а затем последовательно при более высоких pH в течение 60 мин (НО = не определено). Подробное описание Ион металла (М). Получение и определение характеристик твердых лиганд-модифицированных полиоксогидроксидных материалов с ионами металла, описаны в нашей более ранней заявке, PCT/GB 2008/000408 (WO 2008/096130), поданной 6 февраля 2008 г. Указанные материалы, включая материалы, содержащие ион трехвалентного железа (Fe3+), применяемые для получения фосфат-связывающих материалов, согласно настоящему изобретению, могут быть представлены формулой (MxLy(OH)n), где М представляет один или несколько ионов металла. Обычно ион металла первоначально присутствует в форме соли, которую при получении материалов можно растворять и затем вводить для образования полиоксогидроксидных совместных комплексов с лигандом (L). Согласно некоторым вариантам реализации, ионы металлов, по существу, включают ионы трехвалентного железа (Fe3+), в противоположность комбинации ионов металлов, или ионов металлов, включая железо, в других состояниях окисления, таких как Fe2+. Предпочтительно некоторые из применяемых лигандов интегрированы в твердую фазу посредством формального связывания M-L, т.е., не все из лигандов (L) просто захвачены или адсорбированы объемом материала. Связывание иона металла в материале можно определить при помощи физических методик анализа, таких как инфракрасная спектроскопия, спектры которой будут включать сигналы, характеристичные для связей между ионом металла и лигандом (L), а также сигналы, характеристичные для других связей, присутствующих в материале, таких как М-О, О-Н и связи в разновидностях лигандов (L). В фосфатсвязывающих материалах согласно настоящему описанию применяют ион трехвалентного железа (Fe3+) для получения композиций, биологически совместимых с состояниями, при которых применяют указанные материалы, например, для смягчения некоторых недостатков прототипов фосфат-связывающих композиций, которые склонны к системной токсичности или обладают связывающими свойствами, неспецифическими к фосфату. Что касается существующего уровня техники, в данной области хорошо известно, что оксиды, гидроксиды и оксогидроксиды железа состоят из Fe совместно с О и/или ОН, и вместе упоминаются в настоящем патенте и известны в данной области как оксогидроксиды железа. Различные оксо-гидроксиды железа имеют различные структуры и элементный состав, что, в свою очередь, определяет их физикохимические свойства (см. CornellSchwertmann, The Iron Oxides Structure, Properties, Reactions, Occur-4 021705rence and Uses. 2nd ed, 1996, VCH Publishers, New York). Например, акаганеит (- или бетаоксогидроксид железа) содержит в своей внутренней структуре хлорид или фторид, и образует веретенообразные или палочковидные кристаллы. Маггемит (- или гамма-оксид железа) содержит катиондефицитные центры и обычно проявляет ферромагнитные свойства. Указанный материал склонен образовывать кубические кристаллы. Ферригидрит представляет собой еще один пример оксогидроксидного материала железа, который демонстрирует более низкий уровень структурной упорядоченности, чем акаганеит и маггемит, и образует сферические кристаллы. Эксперименты, описанные в настоящей заявке,показали, что фосфатсвязующие согласно настоящей заявке, такие как FeOH Ad100, предпочтительно имеют феррригидритоподобную структуру, и предпочтительно структуру, соответствующую 2 линейному ферригидриту. В качестве примера специалист в данной области техники может оценить,имеет ли материал структуру 2-линейного ферригидрита, при помощи дифракционной методики, предпочтительно, при помощи дифракции электронов, методики, в которой электроны, бомбардирующие образец в электронном микроскопе, рассеиваются так, что это отражает внутренний порядок первичных частиц материала, и дает спектр, похожий на спектр 2-линейного ферригидрита, в отличие от других форм оксо-гидроксидов железа. Как вариант или в дополнение, размер и морфология частиц материалов,связывающих фосфат, согласно настоящему изобретению, при рассмотрении в электронный микроскоп,похожи на аналогичные параметры частиц 2-линейного ферригидрита. Однако следует отметить, что хотя в электронных исследованиях размер, морфология и расположение атомов первичных частиц похоже на аналогичные параметры для 2-линейного ферригидрита, указанный материал является не 2 линейным ферригидритом, а его лиганд-модифицированной формой. Это очевидно в первую очередь из исследований связывания фосфата in vitro, в которых материалы, описанные в настоящей заявке, неизменно и значительно показывают улучшение способности связывать фосфат по сравнению с немодифицированным 2-линейным ферригидритом. Во-вторых, изучение растворения показывает, что при кислотных pH, обычно при или ниже pH 1,2, материалы согласно настоящему изобретению имеют быстрое растворение, физико-химический параметр, который не наблюдается для 2-линейного ферригидрита. Аналогично, предпочтительно, чтобы материалы согласно настоящему изобретению имели значительно более высокую способность связывать фосфаты, чем 2-линейный ферригидрит, в таком диапазонеpH, который может наблюдаться после приема пищи в желудочно-кишечном тракте, например, pH 3-7. Пример анализа для определения связывания фосфата приведен в примере 2.1, где равные массы ферригидрита (например, 53,6 мг) или любого другого фосфатсвязывающего материала, взятого в качестве сравнения, и фосфатсвязывающего материала, согласно настоящему изобретению, исследуют для определения процента фосфата, который они способны связывать в физиологических условиях. В целом,масса материалов, использованных в указанном исследовании, могла быть от 10 до 80 мг включительно в исследуемом объеме 20 мл. Полученные результаты показали, что ферригидрит связывает примерно 30% фосфата из 10 мМ раствора фосфата. Напротив, предпочтительно, чтобы фосфатсвязывающие материалы согласно настоящему изобретению связывали по меньшей мере 50% фосфата, более предпочтительно по меньшей мере 60% фосфата, более предпочтительно по меньшей мере 70% фосфата и наиболее предпочтительно от 80 до 85% или более фосфата, иллюстрируя значительное улучшение свойств фосфатсвязывающих материалов, согласно настоящему изобретению, по сравнению с немодифицированным ферригидритом. Инфракрасный анализ показывает, что в отличие от 2-линейного ферригидрита, материал, описанный в настоящей заявке, показывает связывание, соответствующее присутствию введенного лиганда, а именно адипата в данном конкретном примере. В общем, структуры фосфатсвязывающих материалов согласно настоящему изобретению предпочтительно основаны на структуре 2-линейного ферригидрита, которая была химически модифицирована таким образом, что придает значительно отличающиеся и новые свойства. Следовательно, материалы согласно настоящему изобретению можно описать как имеющие структуру, соответствующую 2 линейному ферригидриту, как определено при помощи изображения ТЭМ и/или дифракции электронов(см. примеры). Кроме того, для сравнения с композициями трехвалентного железа согласно настоящему описанию,присутствие формальной связи является одним из аспектов, позволяющих отличить материалы согласно настоящему изобретению от других продуктов, таких как "полимальтозат железа" (Мальтофер), в которой мелкодисперсный -оксогидроксид железа(акаганеит) окружен оболочкой сахара, образованной из мальтозы, и следовательно, представляет собой простую смесь оксо-гидроксида железа и сахара на наноуровне (Heinrich (1975); Geisser and Muller (1987); Nielsen et al. (1994; US Patent No: 3,076,798);US20060205691). Кроме того, материалы согласно настоящему изобретению представляют собой полимерные оксогидроксидные разновидности металлов, модифицированные путем нестехиометрического включения лигандов и, следовательно, их не следует путать с многочисленными комплексами металллиганд, хорошо известными в данной области (см., например, WO 2003/092674, WO 2006/037449). Хотя указанные комплексы, в общем, растворимы, их можно осадить из раствора в точке перенасыщения, например, тримальтатом трехвалентного железа, Harvey et al. (1998), WO 2003/097627; цитратом трехва-5 021705 лентного железа, WO 2004/074444 и тартратом трехвалентного железа, Bobtelsky and Jordan (1947), и в некоторых случаях, они могут даже участвовать в стехиометрическом связывании гидроксильных групп(например, сахарид гидроксида трехвалентного железа, Патент США 3821192). Применение гидроксильных групп для уравновешивания заряда и геометрии комплексов металл-лиганд, конечно же, хорошо известно в данной области (например, гидрокси-малат железа, WO 2004/050031) и не связано с твердыми лиганд-модифицированными полиоксогидроксидными материаламис ионами металла согласно настоящему описанию. Аналогично, в WO 2008/071747 описан адсорбент фосфата, содержащий гамма-оксид-гидроксид железа (маггемит), стабилизированный нерастворимыми и растворимыми углеводами. Получение материала, описанного в указанной заявке, требует присутствия нерастворимого углевода, такого как крахмал, который действует только как физический носитель материала и не взаимодействует значимо с оксогидроксидом железа. Получение материала, описанного в указанной заявке, может также включать возможное введение растворимого углевода, такого как сахароза, на конечных стадиях получения. Единственной целью введения растворимого углевода, описанного в указанной заявке, является предотвращение фазовых изменений из-за старения материала. Напротив, композиции трехвалентного железа настоящего изобретения предпочтительно имеют структуру, подобную структуре 2-линейного ферригидрита, и не используют нерастворимый углевод в качестве материала-носителя и/или не модифицируют свойства исходного материала при помощи растворимого углевода. Без модификации, первичные частицы материалов, применяемых в настоящем изобретении, имеют ядра оксида металла и поверхности гидроксида металла, и в различных областях знаний могут рассматриваться как оксиды металлов или гидроксиды металлов. Применение термина "оксогидрокси" или "оксогидроксид" предназначено указывать на данные факты без каких-либо указаний на соотношения оксои гидроксигрупп. Равным образом можно применять термин гидроксиоксиды. Как описано выше, материалы согласно настоящему изобретению модифицированы на уровне первичных частиц оксогидроксида металла при помощи, по меньшей мере, нескольких лигандов L, введенных в структуру первичной частицы, т.е. в результате введения добавки или загрязнения первичной частицы лигандом L. Указанную модификацию можно противопоставить образованию наносмесей оксогидроксидов металлов и органической молекулы, таких как сахаридные комплексы железа, в которых структура первичных частиц не изменена указанным образом. Первичные частицы лиганд-модифицированных полиоксогидроксидных материалов с ионами металла согласно настоящему описанию, получают при помощи процесса, называемого осаждением. Применение термина осаждение часто относится к образованию агрегатов материала, которые отделяются от раствора при помощи седиментации или центрифугирования. В настоящей заявке термин "осаждение" должен описывать образование всех твердофазных материалов, включая описанные выше агрегаты и твердые материалы, не образующие агрегатов, но остающиеся в качестве нерастворимой части суспензии, независимо от того, являются они мелкодисперсными или нанодисперсными (коллоидными или субколлоидными). Указанные последние твердые материалы могут также называться гидратированными мелкодисперсными твердыми веществами. Согласно настоящему изобретению можно упомянуть модифицированные оксогидроксиды металлов, имеющие полимерную структуру, которые обычно образуются при значении pH выше критического для образования осадка. В настоящем описании данный термин не следует понимать как указание на то,что структуры материалов являются полимерным в узком смысле, то есть содержат регулярно повторяющиеся мономерные единицы, поскольку, как было установлено, включение лигандов, за исключением случайных совпадений, является нестехиометрическим. Молекулы лигандов внедряются в структуру твердой фазы при помощи замещения оксо- или гидроксигрупп, приводящего к изменению в упорядоченности твердой фазы. В некоторых случаях, например, при получении материалов трехвалентного железа, приведенных в примерах в настоящей заявке, молекулы лигандов L можно вводить в структуру твердой фазы путем замещения оксо- или гидроксигрупп молекулами лигандов, таким образом, что это уменьшает общую упорядоченность твердофазного материала. Хотя это приводит к твердым лигандмодифицированным полиоксогидроксидным материалам с ионами металла, которые в макроскопической форме имеют одно или несколько воспроизводимых физико-химических свойств, указанные материалы имеют более аморфную природу по сравнению, например, со структурой соответствующего оксогидроксида металла. Присутствие более неупорядоченной или аморфной структуры специалист в данной области техники легко может определить при помощи хорошо известных в данной области методов. Одним из примеров указанных методов является трансмиссионная электронная микроскопия (ТЭМ). Трансмиссионная электронная микроскопия высокого разрешения позволяет визуально оценить кристаллическое строение материала. Этот метод показывает размер первичных частиц и структуру (такую как интервал между плоскостями), дает некоторую информацию о распределении между аморфным и кристаллическим материалом, и показывает, что материал обладает структурой, соответствующей структуре 2-линейного ферригидрита. С использованием указанного метода становится очевидным, что вышеописанная химия увеличивает аморфную фазу указанных материалов по сравнению с соответствующими материалами без включенных лигандов. Это может быть особенно ясно с использованием сканирующей трансмиссионной электронной микроскопии в кольцевом тмном поле при больших углах с исправленной аберрацией, благодаря высокому контрасту, достигаемому при сохранении разрешения, что позволяет визуализировать как объем, так и поверхность первичных частиц материала. Воспроизводимое физико-химическое свойство или характеристика материала согласно настоящему изобретению может зависеть от применения, для которого предназначен указанный материал. Примеры свойств, которые может быть полезно модулировать с использованием настоящего изобретения,включают: растворение (скорость, зависимость от pH и зависимость от рМ), распад, характеристики адсорбции и абсорбции, реактивность-инертность, температуру плавления, температурную устойчивость,размер частиц, магнетизм, электрические свойства, плотность, свойства поглощения/отражения света,твердость-мягкость, цвет и упаковочные свойства. Примерами свойств, особенно важных в области добавок, препаратов, восполняющих недостаток компонентов, и минеральных лекарственных средств, являются физико-химические свойства, выбираемые из одного или более: профиля растворения, профиля адсорбции или воспроизводимого элементного соотношения. В данном контексте, свойство или характеристика могут быть воспроизводимыми, если воспроизводимы повторные эксперименты, со стандартным отклонением предпочтительно 10%, более предпочтительно 5% и еще более предпочтительно в пределах 2 %. Согласно настоящему изобретению фосфат-связывающие материалы предпочтительно имеют воспроизводимые свойства связывания фосфата и/или профили растворения. Кроме теста на физиологическое связывание фосфата, обсуждаемого выше и приведенного как пример в разделе 2.1, можно также определить дополнительные свойства материалов согласно настоящему изобретению, такие как сродство или емкость связывания фосфата, или профили растворения, при помощи методик согласно настоящему описанию, см. например разделы 2.2 и 3. Согласно предпочтительным вариантам реализации, емкость (K2)фосфат-связывающих материалов, согласно настоящему изобретению, составляет по меньшей мере 1,5 ммоль Р/г связывающего материала, более предпочтительно по меньшей мере 2,0 ммоль Р/г связывающего материала, и наиболее предпочтительно по меньшей мере 2,5 ммоль Р/г связывающего материала. Профиль растворения твердых лиганд-модифицированных полиоксогидроксидных материалов с ионами металла, можно представить при помощи различных стадий процесса, а именно распада и растворения. Термин растворение применяют для описания перехода вещества из твердой фазы в растворимую. Конкретнее, распад должен описывать переход материалов из твердой агрегированной фазы в гидратированную фазу, которая представляет собой совокупность растворимой фазы и гидратированной мелкодисперсной фазы (т.е. фазы раствора плюс суспензии). Следовательно, термин растворение, в отличие от распада, более конкретно относится к переходу из любой твердой фазы (агрегированной или гидратированной) в растворимую фазу. Лиганд (L) В твердофазных лиганд-модифифицированных полиоксогидроксидных материалах с ионами металла, представленных формулой (MxLy(OH)n), L представляет один или несколько лигандов или анионов, изначально находящихся протонированной форме или в форме солей щелочных металлов, которые могут быть включены в твердофазный лиганд-модифицированный полиоксогидроксидный материал с ионами металла. В материалах согласно настоящему описанию по меньшей мере один из лигандов представляет собой лиганд в виде карбоновой кислоты, или ионизированной форме указанной кислоты (т.е.,карбоксилатный лиганд), такой как адипиновая кислота или адипат. Предпочтительно лиганд представляет собой лиганд в виде дикарбоновой кислоты и может быть представлен формулой HOOC-R1-COOH(или ионизированной формой указанной кислоты), где R1 представляет собой, возможно, замещеннуюC1-10 алкильную, C1-10 алкенильную или C1-10 алкинильную группу. В целом, предпочтительно применение лигандов, в которых R1 представляет собой C1-10 алкильную группу, и более предпочтительно, представляет собой C2-6 алкильную группу. Предпочтительные возможные заместители при группе R1 включают одну или несколько гидроксильных групп, например, таких, как имеются в яблочной кислоте. Согласно предпочтительным вариантам реализации группа R1 представляет собой линейную алкильную группу. Более предпочтительная группа лигандов карбоновых кислот включает адипиновую кислоту (или адипат), глутаровую кислоту (или глутарат), пимелиновую кислоту (или пимелат), янтарную кислоту (или сукцинат), и яблочную кислоту (или малат). То, находится ли лиганд в виде карбоновой кислоты в форме кислоты, или же полностью или частично ионизирован и находится в форме карбоксилат-аниона, будет зависеть от ряда факторов, таких как значение pH, при котором получают и/или выделяют материал,применение стадий обработки после получения или составления рецептуры, и того, как лиганды включают в полиоксогидроксидный материал с ионами металла. Согласно некоторым вариантам реализации по меньшей меречасть лиганда будет находиться в карбоксилатной форме, поскольку материал обычно выделяют при pH4 и поскольку взаимодействие между лигандом и положительно заряженным железом может быть сильно улучшено благодаря присутствию отрицательно заряженного карбоксилатного иона. Чтобы избежать сомнений, применение лигандов карбоновых кислот согласно настоящему изобретению охватывает все указанные возможности, т.е. лиганд находится в виде карбоновой кислоты, в неионизированной форме, в частично ионизированной форме (например, если лиганд представляет собой дикар-7 021705 боновую кислоту) или полностью ионизирован в виде карбоксилатного иона, и смеси указанных форм. Обычно лиганды включены в твердофазные лиганд-модифицированные полиоксогидроксидные материалы с ионами металла, чтобы способствовать модификации физико-химических свойств твердого материала, например, по сравнению с разновидностями полиоксогидроксидных материалов с ионами металла, в которых лиганд (лиганды) отсутствуют. Согласно некоторым из вариантов реализации настоящего изобретения, лиганд (лиганды) L могут также иметь некоторую буферную емкость. Примеры лигандов, которые можно применять согласно настоящему изобретению, включают без каких-либо ограничений карбоновые кислоты, такие как адипиновая кислота, глутаровая кислота, винная кислота, яблочная кислота, янтарная кислота, аспарагиновая кислота, пимелиновая кислота, лимонная кислота,глюконовая кислота, молочная кислота или бензойная кислота; пищевые добавки, такие как мальтол,этилмальтол или ванилин; "классические анионы" с лигандными свойствами, такие как бикарбонат,сульфат и фосфат; минеральные лиганды, такие как силикат, борат, молибдат и селенат; аминокислоты,такие как триптофан, глутамин, пролин, валин или гистидин; лиганды на основе питательных веществ,такие как фолат, аскорбат, пиридоксин или ниацин, или никотинамид. Обычно в данной области рассматривают лиганды с высоким сродством к определенному иону металла в растворе, или только с низким сродством, или вообще не рассматривают как лиганды для данного иона металла. Однако мы обнаружили, что в полиоксогидроксидных материалах с ионами металла лиганды могут иметь значение несмотря на явное отсутствие активности в растворе. Обычно при производстве указанных материалов применяют два лиганда с различным сродством к иону металла, хотя для некоторых применений можно применять один, два, три, четыре или более лигандов. Для многих применений лиганды должны быть биологически совместимыми в применяемых условиях и, в общем, иметь один или несколько атомов с неподеленной парой электронов в центре реакции. Лиганды включают анионы, слабые лиганды и сильные лиганды. Лиганды могут иметь некоторую внутреннюю буферную емкость в процессе реакции. Не ограничиваясь рамками конкретного объяснения,заявители полагают, что лиганды имеют два варианта взаимодействия:(b) неспецифическую адсорбцию (образование электронных пар). Эти два варианта, вероятно, относятся к различиям в сродстве металл-лиганд (т.е., сильные лиганды в первом случае и слабые лиганды/анионы в последнем). В настоящей работе есть некоторые данные о том, что указанные два типа лигандов обладают синергическим действием при модулировании характеристик растворения материалов, и, следовательно, возможно, в определении других характеристик материала. В данном случае применяли два типа лигандов и по меньшей мере один из них (тип (а, наглядно продемонстрировал связывание с металлом в материале. На эффективность лигандов, вероятно, особенно для лигандов типа (b), могут влиять другие компоненты системы, в частности, электролит. Отношение иона (ионов) металлов к лиганду (лигандам) (L) также представляет собой параметр твердофазного лиганд-модифицированного полиоксогидроксидного материала с ионами металла, который можно изменять в соответствии со способами, описанными в настоящей заявке, для изменения свойств материалов. В общем, подходящие соотношения М:L могут лежать между 10:1, 5:1, 4:1, 3:1, 2:1 и 1:1 и 1:2, 1:3, 1:4, 1:5 или 1:10. Получение и обработка фосфатсвязывающих материалов В общем, фосфатсвязывающие материлы согласно настоящему изобретению могут быть получены при помощи способа, включающего:(a) смешивание раствора, содержащего Fe3+ и лиганд карбоновой кислоты, и, возможно, любые дополнительные лиганды или другие компоненты, в реакционной среде при первом значении pH(А), при котором компоненты растворимы;(b) изменение значения pH(А) на второе значение pH(В) для образования твердого осадка или коллоидного раствора твердого лиганд-модифицированного полиоксогидроксидного материала с ионами металла;(с) разделение и, возможно, высушивание и/или изготовление лекарственной формы из твердого лиганд-модифицированного полиоксогидроксидного материала с ионами металла, полученного на стадии (b). Примеры условий, которые можно применять, включают следующие: использование первого pH(А) ниже 2,0 и второго pH(В) между 3,0 и 12,0, предпочтительно между 3,5 и 8,0, и более предпочтительно,между 4,0 и 6,0, и проведение реакции при комнатной температуре (20-25C). В целом, предпочтительно,чтобы на стадии (а) раствор содержал от 20 до 100 мМ Fe3+ и от 50 до 250 мМ подходящего лиганда в виде карбоновой кислоты, и более предпочтительно, примерно 40 мМ Fe3+ и примерно 100 мМ лиганда. Предпочтительным лигандом является адипиновая кислота. За разделением подходящего материала может затем следовать одна или более стадий, на которых материал характеризуют или испытывают. В качестве примера, можно проводить испытание материала,связывающего фосфат, in vitro или in vivo с целью определения одного или нескольких свойств материала, что особо касается профиля растворения и/или одного или нескольких свойств связывания фосфата. Как вариант или дополнительно, способ может включать химическое, например, при помощи титрования, или физическое, например, при помощи микронизации, изменение конечного размера частиц композиции трехвалентного железа, и/или воздействие на содержащий трехвалентное железо фосфатсвязывающий материал, одной или нескольких стадий обработки на пути к получению конечной композиции, например, для введения субъекту. Примеры дополнительных стадий включают, без ограничения: промывку, центрифугирование, фильтрование, высушивание распылением, высушивание замораживанием, высушивание в вакууме, диализ, помол, гранулирование, капсулирование, таблетирование, прессование, наноизмельчение и микронизирование. Согласно некоторым вариантам реализации, можно проводить дополнительные стадии между стадиями первоначального получения материала и любой последующей стадией, на которой материал вводят в рецептуру лекарственного средства. Указанные дополнительные стадии модификации после получения могут включать стадию промывки материала, например, водой или раствором, содержащим дополнительный лиганд, такой как никотинамид, который, как обнаружили заявители, удаляет загрязнения или замещает включенные лиганды дополнительными лигандами, таким образом, увеличивая содержание Fe3+ в материале и его емкость связывания фосфата, и/или придавая материалу одно или несколько дополнительных свойств благодаря присутствию дополнительного лиганда. Эффект указанного воздействия продемонстрирован в примерах и дополнительно обсуждается в нижеследующем разделе. Гидрокси- и оксогруппы В настоящем изобретении можно применять любой способ образования гидроксидных ионов в концентрациях, способствующих обеспечению гидроксильных групп на поверхности и оксидного мостикообразования при получении указанных полиоксогидроксидных материалов. Примеры включают, без ограничения, щелочные растворы, такие как гидроксид натрия, гидроксид калия и бикарбонат натрия, которые можно добавлять для увеличения содержания [ОН] в смеси ML, или кислые растворы, такие как минеральные кислоты или органические кислоты, которые можно добавлять для уменьшения содержания [ОН] в смеси ML. Условия, применяемые при получении фосфатсвязывающих композиций, согласно настоящему изобретению, можно регулировать для контроля физико-химической природы осадка, или чтобы иным образом содействовать его получению, выделению или приготовлению состава с одним или несколькими наполнителями. Указанное воздействие может включать преднамеренное ингибирование агломерации,или применение стадий высушивания или размола для последующего воздействия на свойства материала. Однако существуют общие параметры для любой из указанных систем для выделения твердого вещества из растворенной фазы. После отделения осажденного материала, его, возможно, высушивают перед применением или дальнейшей разработкой рецептуры. Высушенный продукт, однако, может содержать остаточную воду и может находиться в форме гидратированного твердофазного лигандмодифицированного полиоксогидроксидного материала с ионами металла. Специалисту в данной области техники будет понятно, что на любой из стадий, описанных в настоящей заявке для выделения твердой фазы, можно ввести наполнители, которые смешиваются с лиганд-модифицированным полиоксогидроксидным материалом с ионами металла, но не изменяют первичные частицы, и используются с целью оптимизации лекарственной формы для предусмотренной функции материала. Примерами таких добавок могут являться, без ограничения, гликолипиды, фосфолипиды (например, фосфатидилхолин),сахара и полисахариды, сахароспирты (например, глицерин), полимеры (например, полиэтиленгликоль(ПЭГ и таурохолевая кислота. Согласно другим вариантам реализации, в реакцию можно включить дополнительные лиганды для получения лиганд-модифицированных полиоксогидроксидных материалов с ионами металла, таким образом что указанные лиганды становятся включенными в материал. Примеры лигандов, которые можно включить указанным путем, включают ингибиторы всасывания фосфата и/или вещества, способные обеспечивать дополнительные терапевтические и/или физиологические свойства, такие как защита слизистой оболочки кишечника, например, для смягчения возможных желудочных побочных действий, которые могут наблюдаться при введении субъекту фосфатсвязывающего материала. Как вариант или дополнительно, ингибитор всасывания фосфата и/или вещество, способное смягчать желудочные побочные эффекты, можно вводить в состав композиции с твердым лиганд-модифицированным полиоксогидроксидным материалом с ионами металла, т.е., смешивать с указанным материалом, как описано в разделе ниже. В качестве иллюстрации ингибиторы всасывания фосфата хорошо известны в данной области и включают никотинамид, ниацин или ингибиторы, описанные в US 2004/0019113, US 2004/0019020 и WO 2004/085448. Примеры веществ, способных смягчать желудочные побочные эффекты, включают ретинол и/или рибофлавин, см. Ma et al., J. Nutr. Sci., 138(10): 1946-50, 2008. Лекарственные формы и применения Твердофазные материалы согласно настоящему изобретению можно включить в лекарственные формы для применения в качестве фосфатсвязывающих материалов и можно применять для лечения гиперфосфатемии, in vitro и/или in vivo. Следовательно, композиции согласно настоящему изобретению могут содержать кроме одного или нескольких твердофазных материалов согласно настоящему изобре-9 021705 тению фармацевтически приемлемый наполнитель, носитель, буферный агент, стабилизатор, или другие материалы, хорошо известные специалистам в данной области. Указанные материалы должны быть нетоксичными и не должны заметно влиять на эффективность твердофазных материалов для рассматриваемого применения. Точная природа носителя или другого компонента может зависеть от способа или пути введения композиции. Указанные композиции можно доставлять при помощи ряда путей доставки, включая, без ограничения: доставку через желудочно-кишечный тракт, в частности, пероральную и назогастральную доставку; парентеральную доставку, включая инъекцию; или при помощи имплантации в определенные участки, включая протезы, которые можно применять для указанной цели, или главным образом для другой цели, но с указанным преимуществом. Композиции согласно настоящему описанию также можно применять для удаления фосфата из пищевых продуктов перед употреблением, или для селективного удаления фосфата из диализных жидкостей, плазмы или цельной крови. В частности, указанные композиции можно применять в диализных жидкостях для улучшения удаления фосфата в процессе гемодиализа. Фармацевтические композиции для перорального введения могут находиться в форме таблетки,капсулы, порошка, геля, жидкости, спрея или подходящего пищевого продукта. Таблетка может содержать твердый носитель, такой как желатин, или вспомогательное вещество. Капсулы могут иметь специализированные свойства, такие как кишечнорастворимую оболоку. Жидкие фармацевтические композиции, в общем, содержат жидкий носитель, такой как вода, нефтепродукт, животные или растительные масла, минеральное масло или синтетическое масло. Можно включить физиологический солевой раствор, растворы декстрозы или другого сахарида, или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Если твердые лиганд-модифицированные полиоксогидроксидные материалы ионов железа(III), согласно настоящему изобретению, необходимо поддерживать в твердой форме, например, для контроля доставки компонента материала, может быть необходимо соответствующим образом выбирать компоненты лекарственной формы, например, при изготовлении жидкой лекарственной формы материала. Если материал вводят с пищевым продуктом, компоненты лекарственной формы следует выбирать так, чтобы они были совместимы с фосфатсвязывающим материалом и обеспечивали подходящие физико-химические и органолептические характеристики. Для внутривенных, внутрикожных и подкожных инъекций, или для инъекции в место заболевания,активный ингредиент должен находиться в форме парентерально приемлемого водного раствора или суспензии, апирогенного и имеющего подходящие pH, изотоничность и стабильность. Специалист в данной области техники способен приготовить подходящие растворы, с использованием, например, таких изотонических растворов, как хлорид натрия для инъекций, раствор Рингера для инъекций, раствор Рингера с лактатом для инъекций. При необходимости, можно включить консерванты, стабилизаторы, буферные агенты, антиокислители и/или другие добавки. Материалы и композиции, применяемые согласно настоящему изобретению, предназначенные для приема индивидуумом, предпочтительно вводят в "профилактически эффективном количестве" или в"терапевтически эффективном количестве" (в зависимости от обстоятельств, хотя профилактику можно рассматривать как терапию), которого достаточно для оказания благотворного действия в индивидуальном клиническом состоянии. Реальное вводимое количество, норма и периодичность введения будут зависеть от природы и тяжести состояния, лечение которого проводят. В качестве примера фосфатсвязывающие материалы согласно настоящему изобретению можно вводить в количествах примерно от 1 примерно до 20 г/сутки на пациента, более предпочтительно примерно от 2 примерно до 10 г/сутки на пациента и наиболее предпочтительно в количествах примерно от 3 примерно до 7 г/сутки на пациента. За назначение лечения, например определение дозировки, несут ответственность терапевты и другие врачи, и обычно принимают во внимание заболевание, подлежащее лечению, состояние отдельного пациента, место введения, способ введения и другие факторы, известные практикующим специалистам. Примеры методик и протоколов, упомянутых выше, можно найти в Remington's Pharmaceutical Sciences,20th Edition, 2000, Lippincott, WilliamsWilkins. Композицию можно вводить отдельно или в сочетании с другими видами лечения, одновременно или последовательно, в зависимости от состояния, подлежащего лечению. Фосфатсвязывающие материалы согласно настоящему описанию можно применять для лечения гиперфосфатемии. Указанное состояние часто возникает при болезни почек, особенно у пациентов, подвергающихся гемодиализу, и/или у пациентов с хронической болезнью почек или конечной стадией болезни почек. Как упомянуто во введении, современные способы лечения гиперфосфатемии имеют ряд серьезных недостатков, наиболее значительными из которых является то, что композиции, известные из уровня техники имеют либо неспецифическое действие, не ограниченное фосфатом, либо вызывают побочные эффекты, либо небезопасны при длительном применении. Состояния, которые можно лечить композициями согласно настоящему изобретению, включают высокие концентрации фосфата в плазме, гиперфосфатемию, вызванной на любой стадии почечной недостаточности, хроническую почечную недостаточность, острую почечную недостаточность и/или конечную стадию болезни почек, включая состояния, требующие гемодиализа. Клиническое управление указанными состояниями с использованием настоящего изобретения может способствовать облегчению осложнений, связанных с указанными состояниями, таких как вторичный гипертиреоз, кальцификация мягких тканей, остеодистрофия, гиперкальциемия, снижение гиперпаратиреоза, сердечно-сосудистая заболеваемость или смертность, почечная остеодистрофия и/или кальцифилаксия. Материалы и способы Тест на связывание фосфата in vitro а) Связывание фосфата в физиологической концентрации Раствор, содержащий 10 мМ фосфата, физиологически релевантную концентрацию, и 0,9 % NaCl,доводили до значения pH 3, pH 5 и, наконец, pH 7. Масса связующего была постоянной. Процент связывания фосфата рассчитывали в соответствии с формулой: Где [Р]t0 представляет собой концентрацию фосфора в исходном растворе, a [P]ti представляет собой концентрацию фосфора в фильтрате в различные моменты времени.b) Изотермы Ленгмюра Изотермы Ленгмюра получали с использованием такой же методики, как описано в Autissier et al.(2007), за исключением того, что растворы in vitro также содержали 0,9 % NaCl, чтобы приблизить тест к физиологическим условиям. Указанные изотермы Ленгмюра получали при значении pH 5 и таких же условиях эксперимента, как и условия, описанные в "Phosphate binding at physiological concentration" за исключением того, что массу связывающего материала варьировали от 13,4 до 80,4 мг. Тест in vitro на переваривание в желудочно-кишечном тракте Количество твердых лиганд-модифицированных полиоксогидроксидных материалов трехвалентного железа, или немодифицированного оксогидроксида трехвалентного железа, эквивалентное 60 мг элементного железа, добавляли к синтетическому желудочному (пищеварительному) соку (50 мл 2 г/л NaCl,0,15 М HCl и 3,0 мг/мл свиного пепсина) и выдерживали при 37C в течение 30 мин при радиальном встряхивании. Затем 5 мл полученной желудочной смеси добавляли к 30 мл синтетического дуоденального раствора (содержащего 10 г/л панкреатина и 2 г/л NaCl в 50 мМ бикарбонатном буферном растворе с pH 9,5). Конечный объем составлял 35 мл, а конечный pH составлял 7,0. Полученную смесь выдерживали при 37C в течение 60 мин при радиальном встряхивании. Отбирали гомогенные аликвоты (1 мл) в различные моменты времени в течение процесса, и центрифугировали при 13000 об/мин для разделения агрегата и водной неагрегированной фазы. Надосадочную жидкость анализировали на содержание железа при помощи ИСП-ОЭС. По окончании эксперимента оставшийся раствор центрифугировали при 4500 об./мин в течение 15 мин и анализировали надосадочную жидкость на содержание Fe при помощи ИСПОЭС. Регистрировали массу оставшегося материала (т.е., влажного осадка). Добавляли к указанному влажному осадку концентрированную HNO3 и регистрировали новую полученную массу. Оставляли пробирки при комнатной температуре до растворения осадка и отбирали аликвоту для анализа ИСП-ОЭС для определения, какое количество железа не распалось/растворилось. Исходное количество железа вычисляли как сумму железа во влажном осадке и железа в надосадочной жидкости. Для различения растворимого железа и гидратированного мелкодисперсного железа в надосадочной жидкости, в каждый момент времени, указанную фракцию также подвергали ультрафильтрации (полиэфирсульфоновая мембрана Vivaspin, порог пропускания молекулярной массы 3000 Да, Cat. VS0192,Sartorius Stedium Biotech GmbH, Goettingen, Germany) и снова анализировали при помощи ИСП-ОЭС. Анализ способом оптической эмиссионной спектрометрии с индуктивно-связанной плазмой(ИСП-ОЭС) Содержание железа и фосфора в растворах или твердых веществах (включая влажные твердые вещества) измеряли при помощи JY2000-2 ICPOES (Horiba Jobin Yvon Ltd., Stanmore, U.K.) на специфической для железа длине волны 259,940 нм, и длинах волн для фосфора 177,440 и/или 214,914 нм. Перед анализом растворы разбавляли 1-7,5% азотной кислотой, тогда как твердые вещества растворяли в концентрированной HNO3. Процентное содержание железа в растворе или в твердой фазе определяли по разности исходного содержания железа и либо железа в растворимой фазе, либо железа в твердой фазе, в зависимости от анализа. Определение размера частиц Распределение по размерам частиц микронного размера определяли при помощи Mastersizer 2000 с дисперсионным устройством Hydro-P (Malvern Instruments Ltd, Malvern, UK), а распределение по размерам наночастиц определяли при помощи Zetasizer Nano ZS (Malvern Instruments Ltd, Malvern, UK). Измерения при помощи Mastersizer не требовали предварительной обработки образцов, тогда как перед измерениями при помощи Zetasizer требовалось центрифугирование для удаления крупных частиц. Инфракрасный анализ (ИК) ИК-спектры записывали на спектрометре Nicolet Avatar 360 при помощи дополнительного устройства DurasampllR diamond ATR в диапазоне длин волн 4000-650 см-1, с разрешением 4 см-1. За анализы отвечал ITS Testing Services (UK) Ltd Sunbury on Thames, UK. Трансмиссионная электронная микроскопия и энергодисперсионный рентгеноспектральный микроанализ (ЭДС-РСМА). Порошкообразные образцы анализировали вначале при помощи диспергирования порошка в метаноле, а затем капельного нанесения на стандартные пленки-подложки для ТЭМ из перфорированного углерода. За анализы отвечал Institute for Materials Research, University of Leeds, UK. Поисковое исследование на людях для оценки связывания фосфата FeOH Ad100 Как часть указанного исследования, оценивали маркеры окислительного повреждения и антиоксидантный статус после перорального приема железа, исследование проводили для определения, будет ли наблюдаться связывание поступающего с пищей фосфата (РО 4) при введении материалов, связывающих фосфат, согласно настоящему изобретению (893 мг) с пищей (содержащей 781,5 мг фосфора (Р. Вкратце, каждый из 13 добровольцев получал богатый фосфором завтрак, в 3 вариантах - с плацебо, или с фосфат-связывающим материалом, или с сульфатом двухвалентного железа - указанные добавки давали в случайном порядке. Собирали мочу до приема пищи (пробная моча), через 0-3 ч после приема пищи(ожидали малое количество или отсутствие фосфата, полученного из пищи) и через 3-8 ч после приема пищи (ожидали экскреции 45% поглощенного фосфата, полученного с пищей). Результаты 1. Получение материала, связывающего фосфат В общем, материалы, связывающие фосфат, согласно настоящему описанию, получали путем полной или частичной нейтрализации кислого раствора, обычно при pH2,5, содержащего, по меньшей мере, растворимое трехвалентное железо и один или несколько лигандов. Впоследствии получали лиганд-модифицированный оксо-гидроксидный материал сразу по достижении подходящего pH, обычно при pH3,5, который можно было выделить посредством ряда методик (например, центрифугированием). Заметим, что получение фосфатсвязывающих материалов, описанное ниже, не включает каких-либо модификаций после получения, таких как промывание. 1.1 FeOHAd100 В стакан объемом 500 мл, содержащий 400 мл бидистиллированной (бд) H2O, помещали 4,5 г KCl и 7,3 г адипиновой кислоты. Полученную смесь перемешивали до полного растворения компонентов. Затем добавляли 100 мл раствора трехвалентного железа (200 мМ FeCl36H2O, 1,7 мл конц. HCl в 100 мл бд Н 2 О). Конечная концентрация железа в растворе составляла 40 мМ, KCl составлял 0,9% мас./об. pH конечного раствора, в который добавляли трехвалентное железо, в общем, составлял примерно 2, и обычно примерно 1,5. К полученной смеси по каплям добавляли NaOH (5 М раствор NaOH, приготовленный на бд Н 2 О) при постоянном перемешивании до достижения pH 4,50,2 (см. фиг. 1). Процесс проводили при комнатной температуре (20-25C). Затем раствор центрифугировали и агломерат высушивали на воздухе в печи при 45C. Высушенный материал размалывали вручную или микронизировали на шаровой мельнице. 1.2 FeOH Ad100 SiO2 Методика получения FeOH Ad100 SiO2 была такой же, как и для FeOH Ad100, за исключением того,что для повышения pH вместо NaOH применяли раствор силиката натрия (SiO2-NaOH). Указанный раствор содержал 27% Si. 1.3 FeOH Glutaric100 Методика получения FeOH Glutaric100 была такой же, как и для FeOH Ad100, за исключением того,что вместо адипиновой кислоты применяли 6,6 г глутаровой кислоты, a NaOH добавляли до достиженияpH 5,00,2. 1.3 FeOH Pimelic100 Методика получения FeOH Pimelic100 была такой же, как и для FeOH Ad100, за исключением того,что вместо адипиновой кислоты применяли 8,0 г пимелиновой кислоты, a NaOH добавляли до достижения pH 4,20,2. 2. Связывание фосфата in vitro 2.1 Связывание Р в физиологической концентрации Хорошо известно, что оксид железа ферригидрит связывает фосфат. Например, после выдержки при pH 3 в течение 60 мин, а затем при pH 5 в течение 60 мин, 54 мг ферригидрита может связать примерно 30% фосфата из 20 мл 10 мМ раствора фосфата (фиг. 2 а). Так можно в малом масштабе имитировать физиологические условия применения материалов, связывающих фосфат. Предпочтительное количество связывания составляет 50% в идентичных условиях, которое показал имеющийся в продаже связывающий фосфат материал Ренагель, полиаллиламина гидрохлорид (фиг. 2 а/b). Еще более предпочтительными количествами являются 70-85% в идентичных условиях, которые показал высокоаффинный агент, связывающий фосфат, карбонат лантана (фиг. 2a/b). FeOHAd100 и FeOHAd100 SiO2 достигли связывания фосфата 80-85% связывания в указанных условиях (фиг. 2 а/b), иллюстрируя значительно более выгодную модификацию по сравнению с одним ферригидритом. На фиг. 2 а и 2b, белые столбики показывают эксперименты, проведенные при значении pH 3, серые столбики - при pH 5, а черные столбики - 12021705 при pH 7 (только на фиг. 2b), и во всех случаях связывающий материал вначале выдерживали при более низком pH в течение 60 мин, а затем при более высоком (высоких) в течение 60 мин последовательно. Примечательно, что когда условия эксперимента изменяли таким образом, чтобы осуществлять указанное воздействие на связывающий материал непосредственно в растворе со значением pH 5 в течение 1 ч, без "предварительной обработки" при значении pH 3 в течение 1 ч, связывание фосфата карбонатом лантана значительно падало, от 70-85% (фиг. 2) до 30% (фиг. 3). Напротив, связывание фосфата FeOHAd100 и FeOHAd100 SiO2 падало только от 80-85% (фиг. 2) до 65-75% (фиг. 3), указывая на превосходное связывание последним связывающим материалом в условиях, которые могут наблюдаться физиологически (например, pH в желудке после приема пищи). С точки зрения преимущества также следует отметить, что карбонат лантана может быть токсичен, а Ренагель является неспецифическим связывающим материалом. 2.2 Графики Ленгмюра - определение сродства и емкости Мы дополнительно сравнили способности связывания фосфата для FeOH Ad100, FeOH Ad100 SiO2 и лантана с использованием изотерм Ленгмюра. Уравнение Ленгмюра относится к адсорбции молекул на твердой поверхности в зависимости от концентрации и было приспособлено для определения сродства и емкости вышеуказанных материалов,связывающих фосфатC = концентрация несвязанного адсорбируемого вещества в мМ;K2 = емкость. Невозможно было определить указанные величины для Ренагеля по причине его низкого сродства,требующего более высокой концентрации фосфата, чем физиологически релевантная концентрация (10 мМ), которую исследовали в указанном эксперименте. Изотермы Ленгмюра получали при pH 5, условия эксперимента были такими же, как условия на фиг. 2 а/b, за исключением того, что массу связывающего материала варьировали от 13,4 до 80,4 мг. Результаты приведены в таблице ниже и показывают, что сродство, близкое для всех трех соединений, тогда как емкость ниже для карбоната лантана. 3. Растворение в желудочно-кишечном тракте in vitro В то время как способность связывать фосфат дает один пример того, как был модифицирован ферригидрит согласно настоящей заявке для изменения его физико-химических свойств, вторым примером является его профиль растворения при очень кислом значении pH. При pH 1,2 железо в FeOHAd100 иFeOH Ad100SiO2 быстро растворяется, в то время как немодифицированный ферригидрит растворяется медленно. Преимущество применения FeOHAd100 и FeOH Ad100SiO2 заключается в том, что будучи приняты внутрь с пищей они, в основном, останутся в виде частиц при значениях pH после приема пищи(pH 2,5), при этом указанные лабораторные данные по растворению приведены просто в качестве иллюстрации того, насколько значительно отличаются агенты согласно настоящему изобретению от ферригидрита (фиг. 4). 4. Определение размера частиц На фиг. 5 показано, что агенты согласно настоящему изобретению имеют диаметр агрегированных частиц, охватывающий значения 10-100 мкм, со средним диаметром примерно 40 мкм (а); при высушивании диапазон увеличивается (b), особенно в направлении больших размеров (теперь среднее 100 мкм), но может быть возвращен к прежнему значению, например, путем размалывания (с) или даже дополнительно уменьшен при помощи микронизации или наноизмельчения (не показано). 5. Химическое исследование 5.1 ИК исследование Были получены инфракрасные спектры FeOH Ad100 (фиг. 6) и FeOH Ad100 SiO2 (фиг. 7)и показано присутствие двух полос при 1583-1585 см-1 и 1524-1527 см-1. Указанные полосы отсутствуют как в немодифицированном ферригидрите (фиг. 8), так и в адипиновой кислоте (фиг. 9), и указывают на присутствие некоторой связи между карбоксилатной группой адипиновой кислоты (при 1684 см-1) и катионом,который может представлять собой железо в материалах FeOH Ad100 и FeOH Ad100 SiO2. 5.2 ТЭМ FeOH Ad100 Дифракция электронов показала два диффузных кольца (расстояния между плоскостями 2,5 и 1,5 ангстрем соответственно); это является указанием на наличие ферригидритоподобной структуры (фиг. 10b). Все прочие формы оксида железа, такие как акаганеит (- или бета-оксогидроксид железа) или маггемит (- или гамма-оксид железа) дают полностью отличные межплоскостные расстояния (см. CornellSchwertmann, The Iron Oxides Structure, Properties, Reactions, Occurrence and Uses. 2nd ed, 1996, VCH Publishers, New York). Общий состав, определенный при помощи EDX, показал присутствие низких концентраций Na, Cl,и K, и значительных концентраций Fe, О и С (фиг. 10 с). Количество С выше, чем введено с углеродной пленкой-подложкой, и сделано заключение, что указанный дополнительный С поступает из адипиновой кислоты. Изображения при большом увеличении показывают пятнистую структуру, в которой более темные пятна размером 2-3 нм показывают размер первичных зерен (фиг. 10 а). Указанная структура все еще соответствует 2-линейному ферригидриту (Janney et al, 2000), хотя в целом менее упорядочена, чем немодифицированный 2-линейный ферригидрит. Следовательно, материалы, связывающие фосфат, согласно настоящему описанию, представляют собой агломерированные частицы с ферригидритоподобной стукрурой, с размерами первичных кристаллитов 2-3 нм, содержащие Fe, О и С, и низкие концентрацииCl, Na и K. Следовательно, они представляют собой лиганд-модифицированные структуры, дающие некоторые свойства, заметно отличающиеся от свойств самого ферригидрита, и, что касается связывания фосфата, выгодные. 6. Поисковое исследование на людях для оценки связывания фосфата FeOH Ad100 В качестве части исследования оценивали маркеры окислительного повреждения и антиокислительный статус после перорального приема железа, исследование проводили для определения, будет ли наблюдаться связывание поступающего с пищей фосфата (РО 4) при введении материалов, связывающих фосфат, согласно настоящему изобретению (893 мг) с пищей (содержащей 781,5 мг фосфора (Р. Указанный тест использовали для проверки гипотезы, что экскреция фосфата с мочой должна быть выше в период приема плацебо, чем в период приема фосфатсвязывающего материала и проверяли это при помощи одностороннего парного критерия Стьюдента. Во-первых, после приема внутрь только завтрака (т.е., лишь с плацебо), экскрецию фосфора с мочой, исправленную по концентрации креатинина, применяли для установления периода, в течение которого наблюдалось увеличение концентрации выделяемого фосфора. Это наблюдалось через 3-8 ч после приема пищи, как и ожидалось (данные не показаны). Затем, в интервале времени 3-8 ч, сравнивали экскрецию фосфора после приема завтрака плюс плацебо с завтраком плюс лечение связывающим материалом согласно настоящему изобретению, и наблюдали различие в экскреции фосфора в 49,4 мг (р = 0,01; фиг. 11). Для создания вокруг указанных фигур некоторого контекста, данные по связыванию фосфора in vivo для материала согласно настоящему изобретению сравнивали с данными известными из литературы. При расчетах предполагали, что связывающий материал согласно настоящему изобретению, при указанных диетических условиях, связывает 514 мг РО 4 на г связывающего материала, данные анализа мочи экстраполировали с 8 до 24 ч экскреции, и пересчитывали фосфор на фосфат. Указанная экстраполяция учитывала, что оставшийся адсорбированный фосфат должен выделиться в течение 16 ч, и предполагала 70% адсорбцию в кишечнике фосфата из пищи (Anderson, J.J.B, Watts M.L., Garner, S.A., Calvo, M.S., andPress, 2006). Это сравнивали с известными значениями in vivo для Севеламера гидрохлорида -262 мг фосфата на г связывающего материала (Sherman RA: Seminars in dialysis -Vol. 20(1), 2007, 16-18). Также следует отметить, что применяемая в указанном исследовании пища целенаправленно была очень богата Р (чтобы возможно было наблюдать изменение Р в моче), но, следовательно, не был представлен типичный прием Р с отдельным приемом пищи для почечных пациентов. Следовательно, в более типичных условиях, процент Р, связываемого фосфат-связывающим материалом, согласно настоящему изобретению (или фактически любым связывающим материалом), будет выше. 7. Дополнительные сравнительные эксперименты с различными лигандами Были получены дополнительные материалы, связывающие фосфат, согласно настоящему изобретению, включающие диапазон различных лигандов в виде карбоновых кислот (пимелиновую кислоту и глутаровую кислоту), и проведено сравнение с материалами, содержащими другие типы лигандов. Полученные результаты приведены на фиг. 12 и 13 и показывают, что лиганды в виде карбоновых кислот улучшали емкость связывания фосфата исходного материала, тогда как другие типы лигандов или не оказали никакого воздействия на емкость связывания фосфата FeOH, или даже уменьшали ее (см. FeOHMOPS 50 и FeOH Boric 50). 8. Моделирование лекарственной нагрузки Основным недостатком современных видов терапевтического лечения для удаления фосфатов является лекарственная нагрузка на пациентов, которые должны принимать внутрь большое количество пилюль, что неблагоприятно действует на побочные эффекты и выполнение пациентом режима лечения. Следовательно, лекарственная нагрузка для некоторых из взятых в качестве примера материалов сравнивалась с Ренагелем и Фосренолом с использованием математической модели, основанной на данных invitro и типичных желудочно-кишечных условиях, таких как pH, средняя концентрация фосфора в пище в клинических условиях, и конкуренция анионов, полученные результаты показаны в таблице ниже. Таблица. Лекарственная нагрузка для FeOH Ad100, Ренагеля и Фосренола. Значения оценены в модели, основанной на данных in vitro; При том, что лекарственная форма добавляет менее 10% массы, как для Ренагеля;d Пилюля массой 3,1 г содержащая 750 мг элементного лантана (1,45 г карбоната лантана).e Значения оценены путем линейной экстраполяции непромытого материала, на основании 15% увеличения связывания фосфата, которое дает промывка, см. ниже способ получения. 9. Стратегии обработки перед составлением рецептуры: увеличение содержания железаFeOH Ad100, полученный и охарактеризованный, как описано выше, исследовали для определения эффекта стадий предварительной обработки, такой как промывка. В указанных экспериментах хлорид калия, реакционную среду, применяемую при производстве материалов, удаляли из методики синтеза(FeOH Ad100 - KCl) и добавляли стадию промывки осажденного материала (FeOH Ad100 KCl+промывка). Обе указанные стадии приводили к увеличению содержания железа в полученных материалах, см. результаты в таблице ниже. Таблица. Содержание железа в FeOH Ad100, выделенного согласно различным способам получения+промывка: добавлена стадия промывки Исключение KCl из синтеза и добавление стадии промывки также привело к увеличению способности связывать фосфат, как показано на фиг. 14. Исследовали FeOH Ad100-KCl и FeOH Ad100-KCl+промывка и связывание ими фосфата в диапазоне фосфатов: сравнивали соотношения связывающих материалов, полученные результаты согласуются с результатами, показанными на фиг. 14, и подтверждают увеличение связывания фосфата, обусловленное стадией промывки. 10. Замещение лиганда Также проводили работу, в которой замещали адипиновую кислоту в FeOH Ad100 другим лигандом. Эксперимент заключался или в промывке FeOH Ad100 раствором никотинамида (FeOH Ad100+промывка никотинамидом), или в добавлении никотинамида в процессе осаждения, послед. образования первичных частиц FeOH Ad100 (получение FeOH Ad100 +никотинамид агломерация вместо FeOHAd100 +адипат агломерация). Обе стратегии привели к уменьшению содержания адипиновой кислоты(ниже), и хотя наблюдалось уменьшение связывания фосфата, указанные материалы могут быть полезны для лечения гиперфосфатемии благодаря комбинации связывания фосфата с высвобождением никотинамида, который, как известно, уменьшает активность всасывания фосфора в кишечнике. Таблица. Содержание адипиновой кислоты в FeOH Ad100, полученном различными способами замещения лиганда. Все материалы получены в отсутствие KCl. Ссылки Все публикации, патенты и заявки на патенты, процитированные в настоящей заявке или поданные с настоящей заявкой, включая ссылки, поданные как часть Заявления о раскрытии информации, полностью включены в настоящую заявку посредством ссылок.CornellSchwertmann, The Iron Oxides Structure, Properties, Reactions, Occurrence and Uses. 2nd ed,1996, VCH Publishers, New York. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение композиции трехвалентного железа для лечения гиперфосфатемии, причем указанная композиция трехвалентного железа представляет собой твердый фосфатсвязывающий материал, содержащий модифицированный лигандами полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, а указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. 2. Применение по п.1, отличающееся тем, что указанный лиганд представляет собой карбоновую кислоту формулы HOOC-R1-COOH, где R1 представляет собой C1-10 алкильную, C1-10 алкенильную или C1-10 алкинильную группу, или ее ионизированную форму, причем R1 возможно замещен одной или более гидроксильными группами. 3. Применение по любому из пп.1-2, отличающееся тем, что R1 представляет собой C1-10 алкильную группу, при этом R1 возможно замещен одной или более гидроксильными группами. 4. Применение по любому из пп.1-3, отличающееся тем, что указанный лиганд в виде дикарбоновой кислоты представляет собой янтарную кислоту, яблочную кислоту, адипиновую кислоту, глутаровую кислоту или пимелиновую кислоту или ионизированные формы указанных кислот. 5. Применение по любому из пп.1-4, отличающееся тем, что указанный лиганд-модифицированный материал имеет структуру, соответствующую ферригидриту. 6. Применение по любому из пп.1-5, отличающееся тем, что емкость (K2) указанного твердого фосфатсвязывающего материала составляет по меньшей мере 1,5 ммоль Р/г связывающего материала. 7. Применение по п.6, отличающееся тем, что емкость (K2) указанного твердого фосфатсвязывающего материала составляет по меньшей мере 2,5 ммоль Р/г связывающего материала. 8. Применение по п.6, отличающееся тем, что емкость связывания фосфата указанной композицией массой 53,6 мг составляет по меньшей мере 50% 10 мМ фосфата в образце, при значениях pH между 3 и 7, в объеме 20 мл. 9. Применение по любому из пп.1-8, отличающееся тем, что указанную детектируемую связь "металл-лиганд" определяют при помощи инфракрасной спектроскопии. 10. Применение по любому из пп.1-9, отличающееся тем, что ионы металла представляют собой ионы Fe3+. 11. Применение по любому из пп.1-10, отличающееся тем, что указанная композиция дополнительно содержит ингибитор поглощения фосфата и/или вещество, способное облегчать побочные эффекты в желудке. 12. Применение по п.11, отличающееся тем, что указанный ингибитор поглощения фосфата и/или вещество, способное облегчать побочные эффекты в желудке, представляет собой дополнительный лиганд, включенный в твердый лиганд-модифицированный полиоксогидроксидный материал с ионами металла, или включен в состав композиции с твердым лиганд-модифицированным полиоксогидроксидным материалом с ионами металла. 13. Применение по любому из пп.1-12, отличающееся тем, что указанный лигандмодифицированный материал представляет собой оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором адипиновой кислоты (FeOH Ad100),оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором адипиновой кислоты и силикатом натрия (FeOH Ad100 SiO2),оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором глутаровой кислоты (FeOH Glutaric (Глутарат) 100), или оксогидроксидный материал на основе железа(III), модифицированный 100 мМ раствором пимелиновой кислоты (FeOH Pimelic (Пимелат) 100). 14. Способ лечения гиперфосфатемии, включающий введение пациенту композиции трехвалентного железа, которая представляет собой твердый фосфат-связывающий материал, содержащий лигандмодифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металллиганд, и при этом указанный пациент страдает болезнью почек. 15. Способ лечения по п.14, отличающийся тем, что указанная болезнь почек представляет собой хроническую болезнь почек, конечную стадию болезни почек, гиперфосфатемию, вызванную на любой стадии почечной недостаточности, или острую почечную недостаточность. 16. Способ лечения по п.14, отличающийся тем, что указанного пациента подвергают гемодиализу. 17. Способ по любому из пп.14-16, отличающийся тем, что указанный пациент имеет высокие концентрации фосфора в плазме. 18. Способ по любому из пп.14-17, отличающийся тем, что введение указанной композиции осуществляют для лечения осложнения или вторичного состояния пациента, которое является результатом гиперфосфатемии. 19. Способ по п.18, отличающийся тем, что указанное осложнение или вторичное состояние представляет собой вторичный гипертиреоз, кальцификацию мягких тканей, остеодистрофию, гиперкальциемию, снижение гиперапратиреоидизма, сердечно-сосудистую заболеваемость или смертность, почечную остеодистрофию и/или кальцифилаксию. 20. Способ по любому из пп.14-19, отличающийся тем, что указанная композиция изготовлена в виде состава для перорального или назогастрального введения. 21. Способ по пп.14-19, отличающийся тем, что указанное лечение включает удаление фосфата из диализных жидкостей, плазмы и/или цельной крови. 22. Применение пищевого продукта при лечении гиперфосфатемии, причем пищевой продукт содержит твердый фосфат-связывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. 23. Применение жидкости для диализа при лечении гиперфосфатемии, причем жидкость содержит твердый фосфат-связывающий материал, содержащий лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий- 17021705 один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный лиганд-модифицированный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный лиганд-модифицированный материал имеет детектируемую связь металл-лиганд. 24. Способ ex vivo удаления фосфата из среды при лечении гиперфосфатемии, включающий:(а) приведение содержащей фосфат среды в контакт с композицией трехвалентного железа, содержащей лиганд-модифицированный полиоксогидроксидный материал с ионами металла, содержащий один или несколько ионов металла, по меньшей мере один из которых представляет собой ион Fe3+,один или несколько лигандов, которые включают лиганд в виде линейной дикарбоновой кислоты или ее ионизированной формы, и одну или несколько оксо- или гидроксигрупп, причем указанный материал имеет полимерную структуру, в которой указанные лиганды нестехиометрически замещают указанные оксо- или гидроксигруппы, при этом указанный материал имеет детектируемую связь металл-лиганд, при условиях, в которых фосфат способен связываться с композицией трехвалентного железа, и(b) отделение связанного фосфата от композиции. 25. Способ по п.24, отличающийся тем, что указанная среда представляет собой раствор или суспензию. 26. Способ по п.24 или 25, отличающийся тем, что указанный способ предназначен для удаления фосфата из пищевых продуктов перед употреблением.
МПК / Метки
МПК: A61K 45/06, A61K 31/295, A23L 1/059, A61K 31/80, A23L 1/015, A61P 39/04, C07F 15/02, A61K 31/26
Метки: материалы, фосфат-связывающие, применение
Код ссылки
<a href="https://eas.patents.su/24-21705-fosfat-svyazyvayushhie-materialy-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Фосфат-связывающие материалы и их применение</a>
Предыдущий патент: Горелочное устройство щелевого типа алюминиевого электролизера с самообжигающимся анодом
Следующий патент: Таблетка, содержащая твердую дисперсию n-[2,4-бис-(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида, и ее введение
Случайный патент: Способ получения водного раствора хлористого алюминия