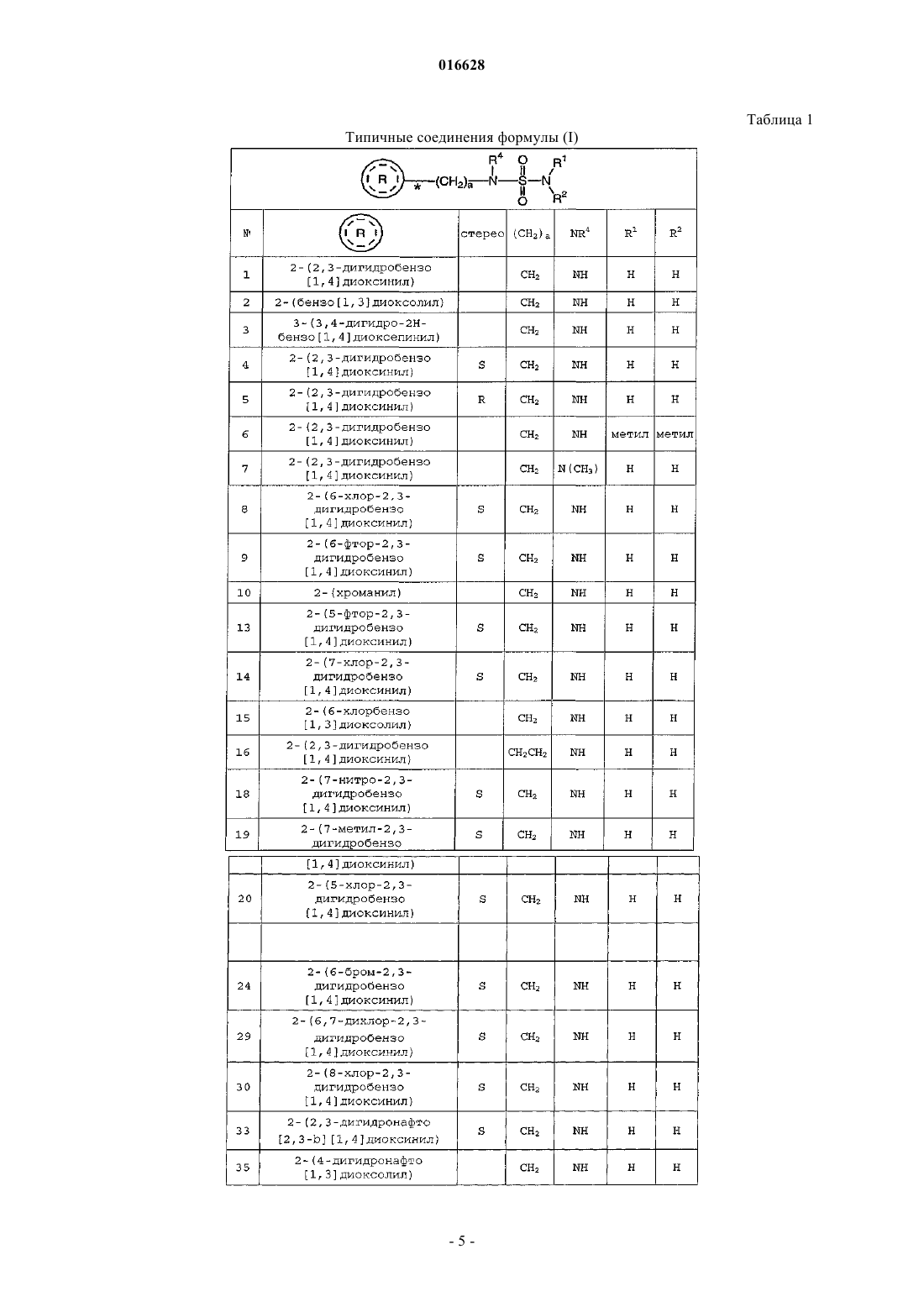
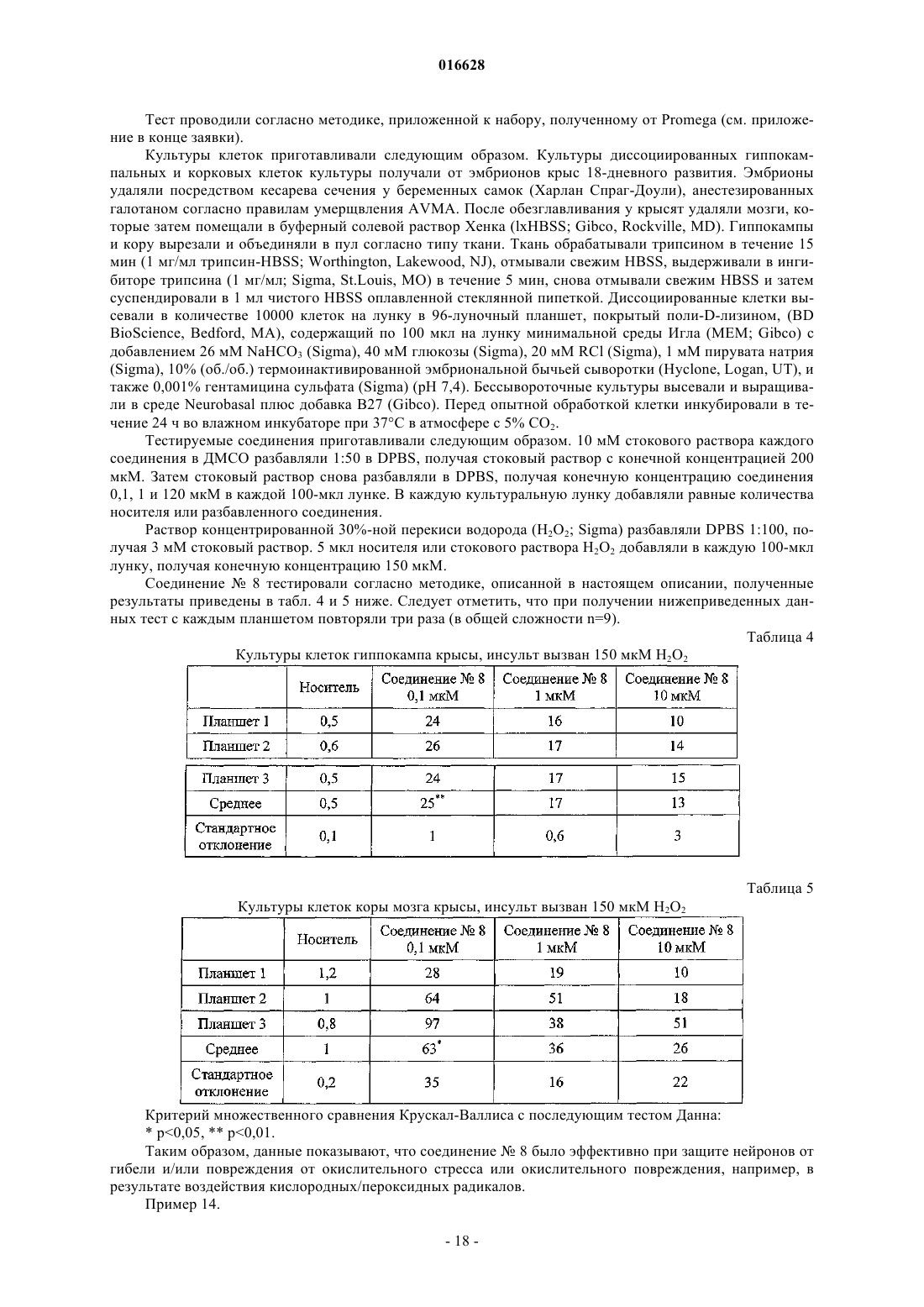
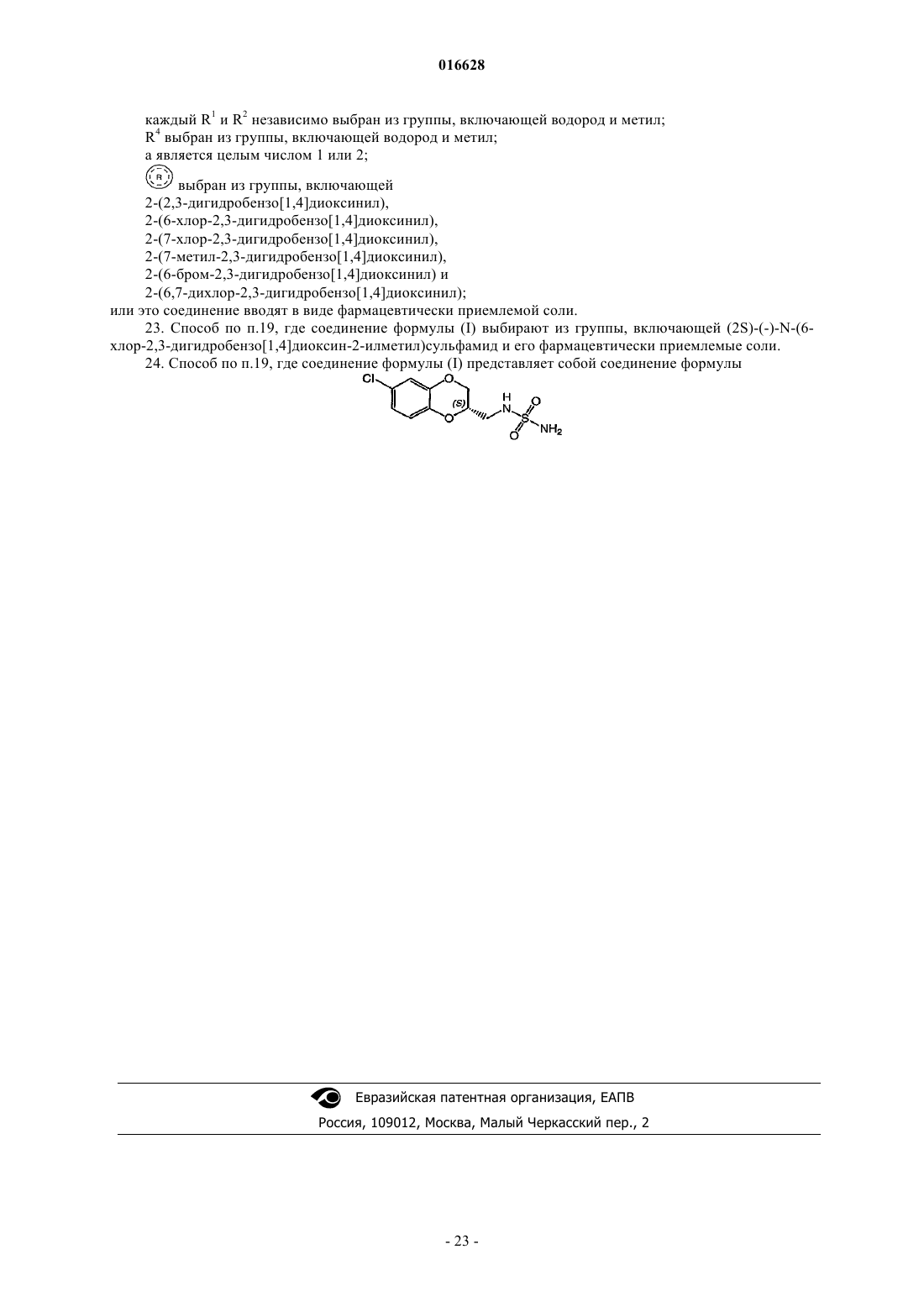
Применение бензоконденсированных гетероциклических сульфамидных производных в качестве нейропротективных агентов
Формула / Реферат
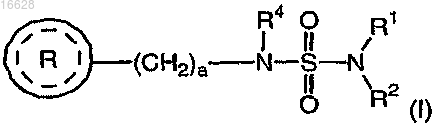
1. Способ нейропротекции при окислительном стрессе, включающий введение субъекту терапевтически эффективного количества соединения формулы (I)

где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
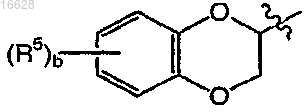
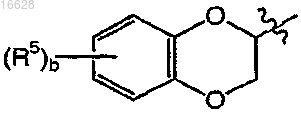
 представляет собой
представляет собой
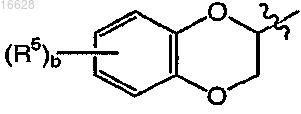
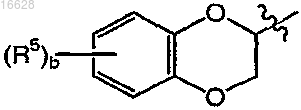
где b является целым числом от 0 до 4;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или его фармацевтически приемлемой соли.
2. Способ по п.1, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой
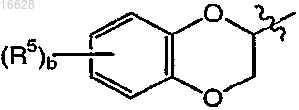
где b является целым числом 1 или 2;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или это соединение вводят в виде фармацевтически приемлемой соли.
3. Способ по п.1, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-хлорбензо[1,3]диоксолил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил),
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и
2-(8-хлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение формулы (I) вводят в виде фармацевтически приемлемой соли.
4. Способ по п.3, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и метил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
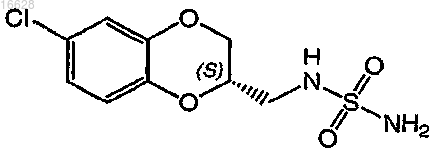
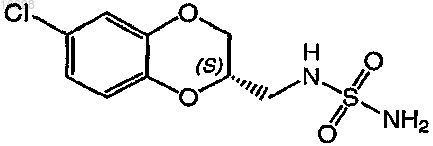
5. Способ по п.1, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли.
6. Способ по п.1, где соединение формулы (I) представляет собой соединение формулы
7. Способ лечения острого нейродегенеративного заболевания, включающий введение нуждающемуся субъекту терапевтически эффективного количества соединения формулы (I)
где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой
где b является целым числом от 0 до 4;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или его фармацевтически приемлемой соли.
8. Способ по п.7, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой
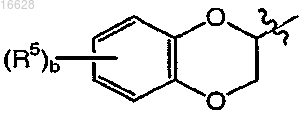
где b является целым числом от 0 до 2;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или это соединение вводят в виде фармацевтически приемлемой соли.
9. Способ по п.8, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил),
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и
2-(8-хлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
10. Способ по п.9, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и метил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
11. Способ по п.7, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли.
12. Способ по п.7, где соединение формулы (I) представляет собой соединение формулы

13. Способ лечения хронического нейродегенеративного заболевания, включающий введение нуждающемуся в нейропротекции при окислительном стрессе субъекту терапевтически эффективного количества соединения формулы (I)
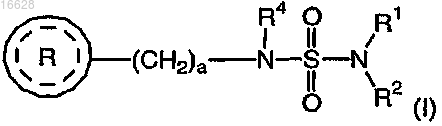
где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой

где b является целым числом от 0 до 4;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или это соединение вводят в виде фармацевтически приемлемой соли.
14. Способ по п.13, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой
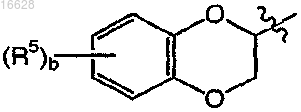
где b является целым числом от 0 до 2;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или это соединение вводят в виде фармацевтически приемлемой соли.
15. Способ по п.14, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(хроманил), 2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил),
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и
2-(8-хлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
16. Способ по п.15, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и метил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
17. Способ по п.13, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли.
18. Способ по п.13, где соединение формулы (I) представляет собой соединение формулы
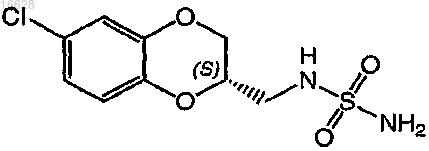
19. Способ предотвращения гибели или повреждения нейрона в результате травмы или повреждения мозга, головы или спинного мозга, включающий введение субъекту терапевтически эффективного количества соединения формулы (I)
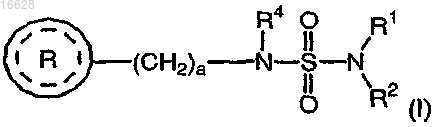
где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 представляет собой
представляет собой
где b является целым числом от 0 до 4;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или его фармацевтически приемлемой соли.
20. Способ по п.19, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и C1-4алкил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
где b является целым числом от 0 до 2;
каждый R5 независимо выбран из группы, включающей галоген и C1-4алкил;
или это соединение вводят в виде фармацевтически приемлемой соли.
21. Способ по п.20, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4алкил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил),
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и
2-(8-хлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
22. Способ по п.21, где в соединении формулы (I)
каждый R1 и R2 независимо выбран из группы, включающей водород и метил;
R4 выбран из группы, включающей водород и метил;
а является целым числом 1 или 2;
 выбран из группы, включающей
выбран из группы, включающей
2-(2,3-дигидробензо[1,4]диоксинил),
2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),
2-(7-метил-2,3-дигидробензо[1,4]диоксинил),
2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и
2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил);
или это соединение вводят в виде фармацевтически приемлемой соли.
23. Способ по п.19, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли.
24. Способ по п.19, где соединение формулы (I) представляет собой соединение формулы
Текст
ПРИМЕНЕНИЕ БЕНЗОКОНДЕНСИРОВАННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СУЛЬФАМИДНЫХ ПРОИЗВОДНЫХ В КАЧЕСТВЕ НЕЙРОПРОТЕКТИВНЫХ АГЕНТОВ Настоящее изобретение представляет собой способы нейропротекции для лечения острого нейродегенеративного заболевания, для лечения хронического нейродегенеративного заболевания и/или предотвращения гибели или повреждения нейрона в результате травмы или повреждения мозга, головы или спинного мозга, включающие введение нуждающемуся субъекту терапевтически эффективного количества одного или более новых бензоконденсированных гетероциклических сульфамидных производных формулы (I), описанных в настоящем описании. 016628 Настоящее изобретение направлено на применение бензоконденсированных гетероциклических сульфамидных производных в качестве нейропротективных агентов. Настоящее изобретение также направлено на применение бензоконденсированных гетероциклических сульфамидных производных в терапии острых и/или хронических нейродегенеративных заболеваний, более конкретно в терапии острых или хронических нейродегенеративных заболеваний, характеризующихся повреждением или гибелью нейрона. Уровень техники Нейродегенеративные заболевания поражают множество людей как в США, так и за их пределами. Например, много людей страдает от нейродегенеративных заболеваний. Указанные заболевания включают ряд тяжелых ослабляющих заболеваний, таких как болезнь Паркинсона, боковой амиотрофический склероз (БАС, "болезнь Лу Герига"), рассеянный склероз, болезнь Хантингтона, болезнь Альцгеймера,диабетическая ретинопатия, мультиинфарктная деменция, дегенерация желтого пятна и т.п. Увеличение продолжительности жизни людей привело к увеличению частоты случаев нейродегенеративных заболеваний. Относительно высокая частота возникновения - 2 - указанных заболеваний (в пределах 2-15% населения старше 70 лет) вызывает существенные медицинские, социальные и финансовые затруднения у пациентов, ухаживающих за ними лиц и также у общества в целом. После возникновения указанные заболевания могут привести очень быстро к смерти, или они могут медленно прогрессировать в течение многих лет, часто приводя к потребности пациента в специализированном уходе в условиях стационара. По мере старения населения частота, с которой у пациентов диагностируют нейродегенеративные заболевания, в особенности такие, которые затрагивают умственные способности, такие как болезнь Альцгеймера, быстро возрастает. Число людей с болезнью Альцгеймера растет по экспоненте, и, как оценивают, сегодня во всем мире число заболевших данным заболеванием может составлять не менее 24 млн человек. Болезнь Альцгеймера (БА) вызвана дегенеративным процессом, который характеризуется прогрессирующей потерей клеток базальных отделов переднего мозга, коры головного мозга и других областей мозга. В особенности затрагиваются нейроны, передающие ацетилхолин, и их целевые нервы. Присутствуют старческие бляшки и нейрофибриллярные клубки. Болезнь Пика имеет клиническую картину, подобную болезни Альцгеймера, но несколько более медленное течение и ограниченную атрофию, главным образом затрагивая лобные и височные доли. Одна из животных моделей болезни Альцгеймера и других деменций показывает наследственную тенденцию к формированию указанных бляшек. Полагают,что если препарат вызывает эффект в модели, то он также может применяться, по меньшей мере, при некоторых формах болезней Альцгеймера и Пика. В настоящее время существуют паллиативные терапии, временно облегчающие проявление заболевания, но при этом нет каких-либо средств восстановления функций пациентов с болезнью Альцгеймера. Болезнь Паркинсона (БП) является заболеванием среднего или пожилого возраста с очень медленным развитием и длительным течением. HARRISON'S PRINCIPLES OF INTERNAL MEDICINE, Vol. 2,23d ed., Ed by Isselbacher, Braunwald, Wilson, Martin, Fauci and Kasper, McGraw-Hill Inc., New York City,1994, стр. 2275. Наиболее регулярно наблюдаемые изменения у пациентов с болезнью Паркинсона присутствовали в агрегатах меланинсодержащих нервных клеток в стволе мозга (черное вещество, голубое пятно), где в различной степени наблюдается потеря нервных клеток с последующим глиозом (наиболее явным в черном веществе) наряду с характерными эозинофильными интрацитоплазматическими включениями. В своей полностью развившейся форме БП легко выявляется у пациентов, при этом основными симптомами являются наклоненная поза, малоподвижность и медлительность движения, неподвижность мимики лица, ритмичное дрожание конечностей, которое ослабевает при активном произвольном движении или полном расслаблении. В большинстве случаев другие признаки полностью развившегося заболевания сопровождает семенящая походка, при которой пациент двигается или идет быстрыми шагами с ускоряющимся темпом, как будто пытается догнать центр тяжести тела. Лечение болезни Паркинсона с применением таких фармакологических средств, как леводопа, в комбинации со стереотактической хирургией в лучшем случае дает лишь частичный эффект. Основная причина сложности лечения связана с тем, что ни одна из указанных терапевтических мер не обеспечивает воздействие на причину заболевания, которая заключается в нейронной дегенерации. В конечном счете, по-видимому, достигнута точка, когда фармакология больше не может компенсировать потерю допамина базальных ганглиев. Другие нейродегенеративные заболевания, поражающие людей, происходят в результате или вызваны иным образом, по меньшей мере частично, инсультом или другой травмой или повреждением. Согласно одному источнику ежегодно происходит не менее 700000 новых случаев инсульта. В США инсульт происходит каждую минуту. Большинство пострадавших от инсульта испытывают постоянную нетрудоспособность, при этом инсульт является основной причиной неврологической нетрудоспособности у взрослых лиц, затрагивая 3-4 млн граждан США. Таким образом, сохраняется потребность в эффективном лечении острых и хронических нейродегенеративных заболеваний. Кроме того, сохраняется потребность в агентах, которые являются нейропро-1 016628 тективными и, таким образом, могут применяться в целях предотвращения гибели и/или повреждения нейрона. Сущность изобретения Настоящее изобретение направлено на способ нейропротекции, включающий введение нуждающемуся в нейропротекции при окислительном стрессе терапевтически эффективного количества соединения формулы (I) где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;a является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 4; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или его фармацевтически приемлемой соли. В одном из примеров изобретение направлено на способ лечения острых нейродегенеративных заболеваний, включающий введение нуждающемуся субъекту терапевтически эффективной дозы любого из соединений, описанных выше. В другом примере изобретение направлено на способ лечения хронических нейродегенеративных заболеваний. Также примером изобретения является способ предотвращения гибели или повреждения нейронов после инсульта или повреждения мозга, центральной нервной системы или периферической нервной системы. Подробное описание изобретения Настоящее изобретение направлено на способ нейропротекции, включающий введение нуждающемуся в этом субъекту терапевтически эффективной дозы соединения формулы (I), а, R1, R2 и R4 определены выше. Настоящее изобреили его фармацевтически приемлемой соли, где тение также направлено на способ лечения острых или хронических нейродегенеративных заболеваний. Настоящее изобретение также направлено на способ предотвращения гибели или повреждения нейронов после повреждения. Используемое в настоящем описании понятие "нейропротекция" должно означать защиту нейронов в мозге, центральной нервной системе или периферической нервной системе (предпочтительно в мозге или спинном мозге) от гибели и/или повреждения. Предпочтительно нейроны защищены от гибели или повреждения, вызванного окислительным стрессом, например кислородными радикалами. Понятие "острые нейродегенеративные заболевания", включенное в способы настоящего изобретения, включает, помимо прочего, различные типы острых нейродегенеративных заболеваний, связанных с гибелью или повреждением нейронов, включая недостаточность мозгового кровообращения, локальную травму мозга, обширную травму мозга, а также повреждение спинного мозга, то есть мозговую ишемию или инфаркт, включая эмболическую и тромбозную закупорку, реперфузию после острой ишемии, перинатальное гипоксийно-ишемическое повреждение, остановку сердца, а также внутричерепное кровоизлияние любого типа (включая, помимо прочего, эпидуральное, субдуральное, субарахноидальное и внутрицеребральное), внутричерепные и внутрипозвоночные повреждения (включая, помимо прочего, ушиб,открытое ранение, смещение, сдавливание и разрыв), а также эписиндром у детей. Предпочтительно острое нейродегенеративное заболевание является последствием инсульта, острой ишемии, травмы головы или повреждения позвоночника. Понятие "хронические нейродегенеративные заболевания", включенное в способы настоящего изобретения, включает, помимо прочего, болезнь Альцгеймера, болезнь Пика, болезнь диффузных телец Леви, прогрессирующий супрануклеарный паралич (синдром Стила-Ричардсона-Ольшевского), мультисистемную дегенерацию (синдром Ши-Дрегера), хронические эпилептические заболевания, связанные с нейродегенерацией, заболевания моторного нейрона, включая боковой амиотрофический склероз, дегенеративную атаксию, кортико-базальную дегенерацию, гуамский комплекс БАС и деменции при паркин-2 016628 сонизме, подострый склерозирующий лейкоэнцефалит, болезнь Хантингтона, болезнь Паркинсона, синуклеинопатии (включая мультисистемную атрофию), первичную прогрессирующую афазию, стриатонигральную дегенерацию, болезнь Мачадо-Джозефа/спинально-церебеллярную атаксию 3 типа и оливопонтоцеребеллярные дегенерации, болезнь Жиля Де Ла Туретта, бульбарный и псевдобульбарный паралич, спинальную и спинально-бульбарную мышечную атрофию (болезнь Кеннеди), рассеянный склероз,первичный боковой склероз, наследственную спастическую параплегию, болезнь Верднига-Хоффмана,болезнь Кугельберга-Веландер, болезнь Тея-Сакса, болезнь Сандхоффа, наследственную спастическую болезнь, болезнь Вольфарта-Кугельберга-Веландера, спастический парапарез, прогрессирующую многоочаговую лейкоэнцефалопатию, наследственную вегетативную дистонию (синдром Райли-Дея), и также заболевания, вызванные прионами (включая, помимо прочего, болезнь Крейцфельдта-Якоба, болезнь Герстмана-Страуслера-Шейнкера, Куру и смертельную наследственную бессонницу). Предпочтительно хроническое нейродегенеративное заболевание выбрано из болезни Альцгеймера, болезни Паркинсона,рассеянного склероза или церебрального паралича. Как предполагается, другие заболевания, при которых происходит гибель или повреждение нейронов, также должны быть включены в способы настоящего изобретения и включают деменции независимо от основной этиологии, включая старческую деменцию и другие деменции и заболевания с потерей памяти, включая деменцию, связанную с болезнью Альцгеймера, сосудистую деменцию, субкортикальную артериосклеротическую энцефалопатию (болезнь Бинсвангера), деменцию эндокринного или метаболического происхождения, деменцию при травме головы и обширном повреждении головного мозга,деменцию боксеров и лобную деменцию. Также в настоящее изобретение включены способы нейропротекции (то есть способы предотвращения гибели и/или повреждения нейронов) после повреждения мозга, центральной нервной системы или периферической нервной системы, где повреждение происходит в результате химического, токсического, инфекционного, радиационного и/или травматического повреждения. Предпочтительно способы настоящего изобретения направлены на предотвращение гибели или повреждения нейронов после травмы или повреждения мозга, головы и/или спинного мозга независимо от причины. Используемое в настоящем описании понятие "субъект" относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который являлся объектом лечения, наблюдения или эксперимента. Используемое в настоящем описании понятие "терапевтически эффективная доза" обозначает то количество активного вещества или фармацевтического агента, которое проявляет биологический или лечебный ответ в системе тканей, животном или человеке, которое подбирается исследователем, ветеринаром, врачом или другим клиницистом и включает облегчение симптомов заболевания или нарушения,подвергнутых терапии. В варианте осуществления настоящего изобретения R1 выбран из группы, включающей водород и метил. В другом варианте осуществления настоящего изобретения R2 выбран из группы, включающей водород и метил. В еще одном варианте осуществления настоящего изобретения каждый R1 и R2 представляет собой водород или каждый R1 и R2 представляет собой метил. В варианте осуществления настоящего изобретения -(СН 2)а- выбран из группы, включающей -СН 2 и -СН 2-СН 2-. В другом варианте осуществления настоящего изобретения -(СН 2)а- представляет собой-СН 2-. В варианте осуществления настоящего изобретения R4 выбран из группы, включающей водород и метил, предпочтительно R4 представляет собой водород. В варианте осуществления настоящего изобретения а равно 1. В варианте осуществления настоящего изобретения b является целым числом от 0 до 2. В другом варианте осуществления настоящего изобретения с является целым числом от 0 до 2. В другом варианте осуществления настоящего изобретения b является целым числом от 0 до 1. В другом варианте осуществления настоящего изобретения с является целым числом от 0 до 1. В еще одном варианте осуществления настоящего изобретения сумма b и с равна целому числу от 0 до 2, предпочтительно целому числу от 0 до 1. В еще одном варианте осуществления настоящего изобретения b является целым числом от 0 до 2,и с равно 0. В варианте осуществления настоящего изобретения представляет собой где b является целым числом от 0 до 4. В одном из вариантов осуществления настоящего изобретенияR4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2;[1,4]диоксинил), 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и 2-(8-хлор-2,3-дигидробензо[1,4]диоксинил). В другом варианте осуществления настоящего изобретения выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил), 2-(6-хлор-2,3-дигидробензо[1,4]диоксинил), 2-(7-хлор-2,3-дигидробензо[1,4]диоксинил), 2-(7-метил-2,3-дигидробензо[1,4] диоксинил), 2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил. В другом варианте осуществления настоящего изобретения выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил), 2-(7-метил-2,3 дигидробензо[1,4]диоксинил) и 2-(6-бром-2,3-дигидробензо[1,4]диоксинил). В варианте осуществления настоящего изобретения R5 выбран из группы, включающей галоген и низший алкил. В другом варианте осуществления настоящего изобретения R5 выбран из хлора, фтора,брома и метила. В варианте осуществления настоящего изобретения стереоцентр соединения формулы (I) находится в S-конфигурации. В другом варианте осуществления настоящего изобретения стереоцентр соединения формулы (I) находится в R-конфигурации. В варианте осуществления настоящего изобретения соединение формулы (I) присутствует в виде энантиомерно обогащенной смеси, где % энантиомерного обогащения (% эо) выше приблизительно 75%,предпочтительно выше приблизительно 90%, более предпочтительно выше приблизительно 95%, наиболее предпочтительно выше приблизительно 98%. Дополнительные варианты осуществления настоящего изобретения включают варианты осуществления, в которых заместители, выбранные для одной или более переменных, определенных в настоящем описании (т.е. R1, R2, R3, R4, X-Y и А), независимо выбраны, чтобы быть любым индивидуальным заместителем или любой подгруппой заместителей, выбранных из полного списка, определенного в настоящем описании. Типичные соединения настоящего изобретения приведены в табл. 1 ниже. Дополнительные соединения настоящего изобретения приведены в табл. 3. В табл. 1 и 2 ниже колонка, озаглавленная "стерео",определяет стереоконфигурацию атома углерода в гетероцикле, присоединенного к связи, помеченной звездочкой. Когда какое-либо обозначение не приведено, соединение получали в виде смеси стереоконфигураций. Когда приведено обозначение "R" или "S", стереоконфигурация была основана на энантиомерно обогащенном стартовом материале.-4 016628 Таблица 1 Типичные соединения формулы (I)-5 016628 Используемый в настоящем описании "галоген", если не указано иное, должен означать хлор, бром,фтор и йод. Используемое в настоящем описании обозначение "алкил", если не указано иное, используемый либо отдельно, либо как часть замещающей группы, включает линейные и разветвленные цепи. Например,алкильные радикалы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил,пентил и т.п. Если не указано иное, обозначение "низший" при использовании с алкилом означает углеродную цепь с 1-4 атомами углерода. Используемый в настоящем описании "алкокси", если не указано иное, должен обозначать кислородсодержащий эфирный радикал из вышеописанных алкильных групп с линейными или разветвленными цепями. Например, метокси, этокси, н-пропокси, втор-бутокси, трет-бутокси, н-гексилокси и т.п. Используемый в настоящем описании символ должен обозначать присутствие стереогенного центра. Когда конкретная группа является "замещенной" (например, алкилом, арилом и т.д.), то данная группа может иметь один или несколько заместителей, предпочтительно от одного до пяти заместителей,более предпочтительно от одного до трех заместителей, наиболее предпочтительно от одного до двух заместителей, независимо выбранных из списка заместителей. В отношении заместителей понятие "независимо" означает, что когда может присутствовать больше одного из указанных заместителей, такие заместители могут быть одинаковыми или различными. Согласно стандартной номенклатуре, используемой по всему описанию настоящего изобретения,вначале описывается терминальная часть определяемой цепи и затем смежные функциональные группы по направлению к точке присоединения. Таким образом, например, "фенил-алкил-амино-карбонилалкильный" заместитель соответствует группе формулы Сокращения, используемые в описании, в особенности в схемах и примерах, следующие: ДЦК (DCC) - дициклогексилкарбодиимид,ДХЭ (DCE) - дихлорэтан,ДХМ (DCM) - дихлорметан,ДИПЭА (DIPEA) или ДИЭА (DIEA) - диизопропилэтиламин,ДМФА - N,N-диметилформамид,ДМСО - диметилсульфоксид,ЭДК (EDC) - этилкарбодиимид,Et3N или ТЭА (TEA) - триэтиламин,Et2O - диэтиловый эфир,ЭА (ЕА) или EtOAc - этилацетат,EtOH - этанол,ИПС (IPA) - 2-пропанол,Гепт - гептан,ГБТ (НОВТ) - 1-гидроксибензотриазол,ВЭЖХ - высокоэффективная жидкостная хроматография,ЛАГ (LAH) - алюмогидрид лития,М или МеОН - метанол,ЯМР - ядерный магнитный резонанс,Pd-C - палладиевый катализатор на угле,ОФ-ВЭЖХ - обращено-фазовая высокоэффективная жидкостная хроматография,КТ или кт - комнатная температура,ТЭА (TEA) - триэтиламин,ТФА (TFA) - трифторуксусная кислота,ТГФ - тетрагидрофуран,ТСХ - тонкослойная хроматография. Когда соединения согласно настоящему изобретению имеют по меньшей мере один хиральный центр, они соответственно могут существовать в виде энантиомеров. Когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в виде диастереомеров. Следует понимать, что все указанные изомеры и их смеси включены в объем настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений могут существовать в виде полиморфных модификаций и, как предполагается, должны быть включены в настоящее изобретение. Кроме того, некоторые из соединений могут образовывать сольваты с водой (то есть гидраты) или с обычными органическими растворителями, при этом указанные сольваты, как предполагается, также должны быть включены в объем настоящего изобретения. В целях применения в медицине соли соединений настоящего изобретения относятся к нетоксич-6 016628 ным "фармацевтически приемлемым солям". Однако другие соли могут использоваться при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений включают кислотно-аддитивные соли, которые могут быть получены, например, при смешивании раствора соединения с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, фумаровая кислота, малеиновая кислота,янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. Кроме того, когда соединения изобретения несут кислотную группу, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; а также соли, образованные с подходящими органическими лигандами, например соли четвертичного аммония. Таким образом, примеры фармацевтически приемлемых солей включают следующие: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат,глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид,гидроксинафтоат, йодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, аммониевая соль N-метилглюкамина,олеат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, сульфат, основной ацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтйодид и валерат. Примеры кислот и оснований, которые могут использоваться в получении фармацевтически приемлемых солей, включают следующее: кислоты, включая уксусную кислоту, 2,2-дихлоруксусную кислоту,ацетилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, Lаспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, (+)-(1S)-камфор-10-сульфоновую кислоту,каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту,цикламовую кислоту, додецилсерную кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, -оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромоводородную кислоту, хлороводородную кислоту, (+)-L-молочную кислоту, -DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту,-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин 1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтеновую кислоту, никотиновую кислоту, азотную кислоту,олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту,фосфорную кислоту, L-пироглутаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту,(+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту и ундециленовую кислоту; и основания, включая аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1 Н-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка. Соединения формулы (I) могут быть получены согласно способу, представленному на схеме 1. Схема 1 Таким образом, подходящим способом замещенное соединение формулы (X), известное соединение или соединение, полученное известными способами, взаимодействует с сульфамидом, известным соединением, где сульфамид предпочтительно присутствует в количестве в диапазоне от приблизительно 2 до приблизительно 5 экв. в органическом растворителе, таком как ТГФ, диоксан и т.п., предпочтительно при повышенной температуре в диапазоне от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре дефлегмации, что приводит к соответствующему соединению формулы (Ia). В качестве альтернативы замещенное подходящим образом соединение формулы (X), известное со-7 016628 единение или соединение, полученное известными способами, взаимодействует с замещенным соединением формулы (XI), известным соединением или соединением, полученным известными способами, в присутствии основания, такого как ТЭА, ДИПЭА, пиридин и т.п., в органическом растворителе, таком как ДМФА, ДМСО и т.п., что приводит к соответствующему соединению формулы (I). Соединения формулы (X), где и где а равно 2, могут быть получены согласно способу, представленному на схеме 4. Схема 4 Таким образом, подходящим способом замещенное соединение формулы (XVI), где J1 является подходящей уходящей группой, такой как Br, Cl, I, тозил, мезил, трифлил и т.п., известное соединение или соединение, полученное известными способами (например, активацией соответствующего соединения, где J1 представляет собой ОН), взаимодействует с цианидом, таким как цианид калия, цианид натрия и т.п., в органическом растворителе, таком как ДМСО, ДМФА, ТГФ и т.п., что приводит к соответствующему соединению формулы (XVII). Соединение формулы (XVII) восстанавливают согласно известным способам, например взаимодействием с подходящим восстанавливающим агентом, таким как ЛАГ, боран и т.п., что приводит к соответствующему соединению формулы (Хс). Соединения формулы (X), где и где а равно 1, могут быть получены согласно способу, представленному на схеме 5. Схема 5 Таким образом, подходящим способом замещенное соединение формулы (XVIII), известное соединение или соединение, полученное известными способами, активируют согласно известному способу,что приводит к соответствующему соединению формулы (XIX), где J2 представляет собой подходящую уходящую группу, такую как тозилат, Cl, Br, I, мезилат, трифлат и т.п. Соединение формулы (XIX) взаимодействует с фталимидной солью, такой как фталимид калия,фталимид натрия и т.п., в органическом растворителе, таком как ДМФА, ДМСО, ацетонитрил и т.п.,предпочтительно при повышенной температуре в диапазоне от 50 до приблизительно 200 С, более предпочтительно приблизительно при температуре дефлегмации, что приводит к соответствующему соединению формулы (XX). Соединение формулы (XX) взаимодействует с N2H4, известным соединением, в органическом растворителе, таком как этанол, метанол и т.п., предпочтительно при повышенной температуре в диапазоне-8 016628 от приблизительно 50 до приблизительно 100 С, более предпочтительно приблизительно при температуре дефлегмации и т.п., что приводит к соответствующему соединению формулы (Xd). Специалист, квалифицированный в данной области техники, также будет понимать, что когда необходим единственный энантиомер соединения формулы (X) (или смесь энантиомеров, где один энантиомер является обогащенным), вышеупомянутые способы, описанные в схемах 1-5, могут быть применены посредством замещения соответствующего единственного энантиомера (или смеси энантиомеров, где один энантиомер является обогащенным) для соответствующего исходного материала. Специалист, квалифицированный в данной области техники, будет понимать, что стадия реакции настоящего изобретения может быть проведена в различных растворителях или системах растворителей,указанная стадия реакции может также быть проведена в смеси подходящих растворителей или систем растворителей. Когда способы получения соединений согласно изобретению дают смеси стереоизомеров, то указанные изомеры могут быть разделены обычными способами, такими как препаративная хроматография. Соединения могут быть получены в рацемической форме, либо отдельные энантиомеры могут быть получены энантиоселективным синтезом или посредством выделения. Соединения могут, например, быть разделены на составляющие их энантиомеры стандартными способами, такими как образование диастереомерных пар путем образования соли с оптически активной кислотой, такой как (-)-ди-п-толуоил-Dвинная кислота и/или (+)-ди-п-толуоил-L-винная кислота, с последующей фракционной кристаллизацией и регенерацией свободного основания. Соединения могут также быть разделены посредством образования диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хирального вспомогательного соединения. В качестве альтернативы соединения могут быть разделены с использованием хиральной ВЭЖХ-колонки. При осуществлении любого из способов получения соединений настоящего изобретения может быть необходимым и/или желательным защитить чувствительные или реакционноспособные группы на любой из соответствующих молекул. Это может быть достигнуто посредством обычных защитных групп, таких как описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press,1973 и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. Защитные группы могут быть удалены на одной из удобных последующих стадий, используя способы, известные из уровня техники. Настоящее изобретение дополнительно включает фармацевтические композиции, содержащие одно или более соединений формулы (I) с фармацевтически приемлемым носителем. Фармацевтические композиции, содержащие в качестве активного компонента одно или более соединений изобретения, описанных в настоящем описании, могут быть получены тщательным смешиванием соединения или соединений с фармацевтическим носителем согласно стандартным методикам составления фармацевтических композиций. Носитель может иметь большой диапазон форм в зависимости от желаемого пути введения(например, орального, парентерального). Таким образом, в случае жидких препаратов для перорального применения, таких как суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизаторы, консерванты, стабилизаторы, красители и т.п.; в случае твердых препаратов для перорального применения, таких как порошки, капсулы и таблетки, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, скользящие вещества, связующие вещества, дезинтегрирующие добавки и т.п. Твердые препараты для перорального применения могут быть также покрыты такими веществами, как сахара, или покрыты энтеросолюбильным покрытием, чтобы изменить основной участок абсорбции. В случае парентерального введения носитель обычно будет состоять из стерильной воды, при этом в целях повышения растворимости или для консервации могут быть добавлены другие компоненты. Суспензии или растворы для инъекций могут быть также приготовлены с использованием водных носителей наряду с соответствующими добавками. Для приготовления фармацевтических композиций настоящего изобретения одно или более соединений настоящего изобретения в качестве активного компонента тщательно перемешивают с фармацевтическим носителем согласно обычным методикам составления фармацевтических композиций, где указанный носитель может иметь большой диапазон форм в зависимости от формы препарата, необходимой для введения, например, оральной или парентеральной, такой как внутримышечная. В ходе приготовления композиций в лекарственной форме для перорального применения может использоваться любой из стандартных фармацевтических носителей. Таким образом, в случае жидких препаратов для перорального применения, таких как, например, суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.п.; в случае твердых препаратов для перорального применения, таких как, например, порошки, капсулы, каплеты, желатиновые капсулы и таблетки, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, скользящие вещества, связующие вещества, дезинтегрирующие добавки и т.п. Благодаря легкости введения таблетки и капсулы представляют собой наиболее выгодную лекарственную форму для перорального применения, и в данном случае, очевидно, применяются твердые фармацевтические носители. Если необходимо, таблетки могут быть покрыты сахаром или энтеросолюбильным покрытием с помощью стандартных методик. В случае препаратов для парентерального применения носи-9 016628 тель обычно будет включать стерильную воду, хотя могут быть включены другие компоненты, предназначенные, например, для повышения растворимости или консервации. Также могут быть приготовлены суспензии для инъекций, при этом могут использоваться соответствующие жидкие носители, суспендирующие добавки и т.п. Фармацевтические композиции в настоящем описании будут содержать такое количество активного компонента в расчете на лекарственную форму, например таблетку, капсулу, порошок, инъекцию, чайную ложку и т.п., которое необходимо для доставки эффективной дозы, как описано выше. Фармацевтические композиции в настоящем описании будут содержать в расчете на лекарственную форму, например таблетку, капсулу, порошок, инъекцию, свечу, чайную ложку и т.п., приблизительно 0,1-1000 мг и смогут приниматься в дозировке приблизительно 0,01-200,0 мг/кг/день, предпочтительно приблизительно 0,1 до 100 мг/кг/день, более предпочтительно приблизительно 0,5-50 мг/кг/день,более предпочтительно приблизительно 1,0-25,0 мг/кг/день или в любом указанном диапазоне. Дозировки, однако, могут быть различны в зависимости от потребности пациентов, тяжести заболевания, которое лечат, и применяемого соединения. Может использоваться или ежедневное введение, или постпериодическое дозирование. Предпочтительно указанные композиции находятся в стандартных лекарственных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные растворы для парентерального введения или суспензии, дозированные аэрозоли или жидкие спреи, капли, ампулы, автоинжекторные устройства или свечи; для орального, парентерального, интраназального, сублингвального или ректального введения или для введения посредством ингаляции или вдувания. В качестве альтернативы композиция может присутствовать в форме, подходящей для еженедельного или ежемесячного введения; например, нерастворимая соль активного соединения, такая как деканоат, может быть подходящей для обеспечения препарата пролонгированного действия для внутримышечной инъекции. Для приготовления твердых композиций, таких как таблетки, основной активный компонент смешивают с фармацевтическим носителем,например с обычными компонентами таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, фосфат дикальция или камеди, и также с другими фармацевтическими разбавителями, например водой, что позволяет получить твердую предварительную композицию, содержащую гомогенную смесь соединения настоящего изобретения или его фармацевтически приемлемой соли. Когда указанные предварительные композиции упоминаются как гомогенные,это означает, что активный компонент равномерно диспергирован по всему объему композиции, и таким образом композиция может быть легко разделена на равноэффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Затем указанную твердую предварительную композицию разделяют на стандартные лекарственные формы вышеописанного типа, содержащие от 0,1 до приблизительно 1000 мг активного компонента настоящего изобретения. Таблетки или пилюли новой композиции могут быть покрыты или составлены другим способом, что обеспечивает лекарственную форму, обладающую преимуществом пролонгированного действия. Например, таблетка или пилюля может включать внутренний и внешний компоненты дозировки, причем последний присутствует в форме оболочки поверх основы. Указанные два компонента могут быть разделены энтеросолюбильным слоем, который служит для предотвращения распада в желудке и позволяет внутреннему компоненту проходить в исходном виде в двенадцатиперстную кишку или обеспечивает задержку высвобождения. Для указанных энтеросолюбильных слоев или покрытий могут использоваться различные материалы, которые включают ряд полимерных кислот и такие материалы, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы для перорального введения или инъекций, в которые могут быть включены новые соединения настоящего изобретения, включают водные растворы, ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, и также эликсиры и подобные фармацевтические носители. Подходящие диспергирующие или суспендирующие добавки для водных суспензий включают синтетические и натуральные камеди, такие как трагакантовая камедь, гуммиарабик, альгинат, декстран, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, поливинилпирролидон или желатин. Способ нейропротекции, описанный в настоящем изобретении, может также осуществляться с использованием фармацевтической композиции, включающей любое из соединений, определенных в настоящем описании, и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать от приблизительно 0,1 до 1000 мг, предпочтительно от приблизительно 50 до 500 мг соединения и может быть составлена в любой форме, подходящей для выбранного способа введения. Носители включают необходимые и инертные фармацевтические наполнители, включая, помимо прочих, связующие вещества, суспендирующие добавки, скользящие вещества, ароматизаторы, подсластители, консерванты, красители и покрытия. Композиции, подходящие для орального введения, включают твердые формы, такие как пилюли, таблетки, каплеты, капсулы (каждая форма включает композиции немедленного высвобождения, с регулирумым временнем высвобождения и замедленным высвобождением), гранулы и порошки, а также жидкие формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Формы, применяемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии.- 10016628 Предпочтительно соединения настоящего изобретения можно вводить в единственной ежедневной дозе, либо полная ежедневная доза может быть введена в раздельных дозах, два, три или четыре раза в день. Кроме того, соединения настоящего изобретения можно вводить в интраназальной форме посредством местного применения подходящих интраназальных носителей или посредством трансдермальных пластырей, известных средним специалистам в данной области техники. При введении в форме трансдермальной системы доставки, введение дозы, безусловно, будет осуществляться непрерывно, и не периодически, на протяжении всего режима дозировки. Например, для орального введения в форме таблетки или капсулы, активный компонент лекарственного средства может быть объединен с нетоксичным фармацевтически приемлемым инертным носителем для орального применения, таким как этанол, глицерин, вода и т.п. Кроме того, когда желательно или необходимо, в смесь могут быть также включены подходящие связующие вещества, скользящие вещества, дезинтегрирующие добавки и красители. Подходящие связующие вещества включают, помимо прочих, крахмал, желатин, натуральный сахар, такой как глюкоза или -лактоза, сахаристые вещества кукурузы, натуральные и синтетические камеди, такие как гуммиарабик, трагакант или олеат натрия,стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, помимо прочих, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. В жидкие формы обычно добавляют суспендирующие или диспергирующие добавки, такие как синтетические и натуральные камеди, например трагакант, гуммиарабик, метилцеллюлозу и т.п. Для парентерального введения предпочтительными являются стерильные суспензии и растворы. Изотонические препараты, которые обычно содержат подходящие консерванты, применяются в случаях, когда предпочтительно внутривенное введение. Соединения настоящего изобретения можно вводить в составе любой из предыдущих композиций и в соответствии с режимами дозировки, установленными в уровне техники, во всех случаях, когда требуется нейропротекция. Ежедневная доза продуктов может варьировать в широком диапазоне от 0,01 до 200 мг/кг для взрослого человека в день. В случае перорального введения соединения предпочтительно обеспечиваются в форме таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250,500 и 1000 мг активного компонента для симптоматического регулирования дозировки подвергнутого лечению пациента. Эффективная доза препарата обычно находится на уровне дозировки от приблизительно 0,01 до приблизительно 200 мг/кг массы тела в день. Предпочтительно диапазон дозировки составляет от приблизительно 0,1 до приблизительно 100,0 мг/кг массы тела в день, более предпочтительно от приблизительно 0,5 до приблизительно 50 мг/кг, более предпочтительно от приблизительно 1,0 до приблизительно 25,0 мг/кг массы тела в день. Соединения можно вводить в режиме 1-4 раза в день. Оптимальные вводимые дозы могут быть легко определены специалистами, квалифицированными в данной области техники, и варьируют в зависимости от конкретного используемого соединения, способа введения, концентрации препарата и улучшения в течение заболевания. Кроме того, факторы, связанные с конкретным пациентом, подвергнутым лечению, включающие возраст пациента, вес, режим питания и время введения, приводят к необходимости коррекции дозировок. Специалист, квалифицированный в данной области техники, будет понимать, что и испытания invivo, и in vitro с использованием подходящих, известных и общепринятых клеточных и/или животных моделей позволяют прогнозировать способность испытываемого соединения при лечении или профилактике данного нарушения. Специалист, квалифицированный в данной области техники, также будет понимать, что клинические испытания на людях, включая первичные испытания на человеке, испытания по подбору дозы и испытания на эффективность, у здоровых пациентов и/или страдающих от данного нарушения, могут быть проведены согласно способам, известным в клинической и медицинской областях. Следующие примеры изложены в целях помощи при понимании изобретения и не предназначены и не должны рассматриваться как ограничивающие каким-либо образом изобретение, изложенное в формуле, которая следует в дальнейшем. Пример 1. 3,4-Дигидро-2 Н-бензо[b][1,4]диоксепин-3-ил)метил)сульфамид (соединение 3). Катехин (5,09 г, 46,2 ммоль) и карбонат калия смешивали в ацетонитриле и нагревали до кипения с обратным холодильником в течение 1 ч. Затем добавляли 2-хлорметил-3-хлор-1-пропен (5,78 г, 46,2 ммоль) и взаимодействие продолжали при кипячении с обратным холодильником в течение 24 ч. Раствор охлаждали до комнатной температуры и отфильтровывали. Фильтрат выпаривали и остаток растворяли в воде и экстрагировали диэтиловым эфиром (3 раза). Объединенный органический раствор сушили надMgSO4 и концентрировали. Очищали с помощью хроматографии (2% диэтилового эфира в гексане), в результате чего получали 3-метилен-3,4-дигидро-2 Н-бензо[b][1,4]диоксепин в виде бесцветного масла.(100 мл). Боран-ТГФ (1,0 М в ТТФ, 10,3 мл) добавляли при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли аминосульфоновую кислоту (6,97 г, 61,6 ммоль). Реакционную смесь нагревали до кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и добавляли водный раствор гидроксида натрия (3,0 М, 100 мл). Раствор экстрагировали этилацетатом (3100 мл). Объединенный органический раствор сушили надMC (ESI): 180,1 (М+Н+). 1 Н-ЯМР (300 МГц, ДМСО), : 6,92 (м, 4 Н), 4,21 (м, 2 Н), 4,07 (м, 2 Н), 3,33 (широкий, 2 Н), 3,16 (д,J=4 Гц, 1 Н), 2,72 (д, J=4 Гц, 1 Н), 2,30 (м, 1 Н). 3,4-Дигидро-2 Н-бензо[b][1,4]диоксепин-3-ил)метил)амин (2,90 г, 16,2 ммоль) и сульфамид (3,11 г,32,4 ммоль) смешивали в сухом диоксане (60 мл) и нагревали до кипения с обратным холодильником в течение ночи. Добавляли хлороформ и осадок удаляли с помощью фильтрации. Фильтрат концентрировали в вакууме и очищали с помощью хроматографии (2-8% ацетона в дихлорметане), в результате чего получали указанное в заголовке соединение в виде не совсем белого твердого вещества. 258,8 (М+Н+). 1 Н-ЯМР (300 МГц, ДМСО), : 6,92 (м, 4 Н), 6,71 (широкий, 1 Н), 6,59 (широкий, 2 Н), 4,19 (м, 2 Н),4,04 (м, 2 Н), 3,00 (м, 2 Н), 2,39 (м, 1 Н). Пример 2. N-(2,3-Дигидробензо[1,4]диоксин-2-илметил)сульфамид (соединение 1). 1 Рацемический 2,3-дигидро-1,4-бензодиоксин-2-илметиламин (4,4 г, 26 ммоль) и сульфамид (5,1 г,53 ммоль) смешивали в 1,4-диоксане (100 мл) и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, после чего небольшое количество твердого вещества отфильтровывали и удаляли. Фильтрат выпаривали в вакууме и остаток очищали с помощью колоночной флеш-хроматографии (ДХМ:метанол - 10:1), получая белое твердое вещество. Твердое вещество перекристаллизовывали от ДХМ, в результате чего получали указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: 97,5-98,5 С. Элементный анализ: Расчетный состав: С, 44,25; Н, 4,95; N, 11,47; S, 13,13. Полученный состав: С, 44,28; Н, 4,66; N, 11,21; S, 13,15. 1 Н-ЯМР (ДМСО-d6) : 6,85 (м, 4 Н), 6,68 (шир.с, 3H, NH), 4,28 (м, 2 Н), 3,97 (дд, J=6,9, 11,4 Гц, 1 Н),3,20 (м, 1 Н), 3,10 (м, 1 Н). Пример 3. (Бензо[1,3]диоксол-2-илметил)сульфамид (соединение 2). Катехин (10,26 г, 93,2 ммоль), метоксид натрия (25 мас.% в метаноле, 40,3 г, 186 ммоль) и метил дихлорацетат (13,3 г, 93,2 ммоль) смешивали в сухом метаноле (100 мл). Раствор нагревали до кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры,подкисляли путем добавления концентрированной хлороводородной кислоты и затем концентрировали в вакууме до объема приблизительно 50 мл. Добавляли воду и смесь экстрагировали диэтиловым эфиром(3100 мл). Объединенный органический раствор сушили над MgSO4, концентрировали до получения коричневого твердого остатка и очищали с помощью хроматографии (2% этилацетата в гексане), в результате чего получали метиловый эфир бензо[1,3]диоксол-2-карбоновой кислоты в виде бесцветного масла.H-ЯМР (300 МГц, CDCl3), : 6,89 (широкий, 4 Н), 6,29 (с, 1 Н), 4,34 (кв., J=7 Гц, 2 Н), 1,33 (т, J=7 Гц,3H). К метиловому эфиру бензо[1,3]диоксол-2-карбоновой кислоты (7,21 г, 40,0 ммоль) добавляли гидроксид аммония (29% в воде, 10 мл) и достаточное количество ацетонитрила для получения гомогенной смеси (приблизительно 5 мл). Раствор перемешивали в течение 2 ч при комнатной температуре и затем добавляли дистиллированную воду. Амид бензо[1,3]диоксол-2-карбоновой кислоты, выпавший в виде- 12016628 белого осадка, собирали с помощью фильтрации и использовали без дальнейшей очистки. МС (ESI): 160,00 (М+Н+). 1 Н-ЯМР (300 МГц, ДМСО), : 7,99 (с, широкий, 1 Н), 7,72 (с, широкий, 1 Н), 6,94 (м, 2 Н) 6,86 (м, 2 Н),6,30 (с, 1 Н). Амид бензо[1,3]диоксол-2-карбоновой кислоты (5,44 г, 32,9 ммоль) растворяли в тетрагидрофуране(ТГФ, 100 мл). К раствору при комнатной температуре медленно добавляли алюмогидрид лития (ЛАГ,1M в ТГФ, 39,5 мл, 39,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем с целью гидролиза избытка ЛАГ добавляли дистиллированную воду. Добавляли водный раствор гидроксида натрия (3,0 М, 100 мл), после чего раствор экстрагировали этилацетатом (3100 мл). Объединенный органический раствор промывали водой и сушили над MgSO4. Растворитель выпаривали,в результате чего получали С-бензо[1,3]диоксол-2-илметиламин в виде бесцветного масла. МС (ESI): 152,1 (М+Н+). 1H-ЯМР (300 МГц, CDCl3), : 6,87 (м, 4 Н), 6,09 (т, J=4 Гц, 1 Н), 3,13 (д, J=4 Гц, 2 Н). С-бензо[1,3]диоксол-2-илметиламин (2,94 г, 19,4 ммоль) и сульфамид (3,74 г, 38,9 ммоль) смешивали в сухом диоксане (50 мл), и полученный раствор нагревали до кипения с обратным холодильником в течение ночи. Реакционную смесь концентрировали и остаток очищали с помощью хроматографии (210% ацетона в дихлорметане), в результате чего получали указанное в заголовке соединение в виде белого твердого вещества. Катехин (13,2 г, 0,12 моль) и карбонат калия (16,6 г, 0,12 моль) смешивали в ДМФА (250 мл), добавляли (2R)-глицидилтозилат (22,8 г, 0,10 моль) и реакционную смесь перемешивали при 60 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли ледяной водой (1 л) и экстрагировали диэтиловым эфиром (4 раза). Объединенный органический раствор промывали 3 раза 10%-м раствором карбоната калия, однократно водой, однократно насыщенным раствором соли и выпаривали в вакууме, в результате чего получали белое твердое вещество, которое очищали с помощью колоночной флеш-хроматографии (ДХМ:метанол - 50:1), получая 2S)-2,3-дигидробензо[1,4]диоксин-2 ил)метанол в виде твердого вещества. Полученное твердое вещество (13,3 г, 68 ммоль) растворяли в пиридине (85 мл), охлажденном до 0 С, добавляли п-толуолсульфонилхлорид (13,0 г, 68 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь разбавляли диэтиловым эфиром (1 л) и 1 н. HCl (1,2 л). Органический слой выделяли и промывали 2 раза 1 н. HCl (500 мл), 4 раза водой (150 мл), однократно насыщенным раствором соли, сушили (MgSO4) и выпаривали в вакууме, в результате чего получали белое твердое вещество, которое очищали с помощью колоночной флеш-хроматографии(гептан:ЭА - 2:1), получая (2S)-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир толуол-4-сульфоновой кислоты в виде белого твердого вещества. Белое твердое вещество смешивали с фталимидом калия (14,4 г, 78 ммоль) в ДМФА (250 мл) и нагревали до кипения с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и полученную смесь вливали в энергично перемешиваемую воду (1,5 л), после чего перемешивали 30 мин. Белый осадок отфильтровывали и полученное твердое вещество промывали несколько раз водой, 2%ным раствором NaOH и затем снова водой, затем сушили на воздухе, получая (2S)-2-(2,3 дигидробензо[1,4]диоксин-2-илметил)изоиндол-1,3-дион в виде белого порошкообразного вещества. Полученное белое порошкообразное вещество смешивали с гидразином (2,75 г, 86 ммоль) в EtOH(225 мл), после чего нагревали при кипячении с обратным холодильником в течение 2 ч и затем охлаждали до комнатной температуры, добавляли 1 н. HCl до рН 1,0 и перемешивали в течение 15 мин. Полученное белое твердое вещество отфильтровывали и промывали свежим EtOH (осадок удаляли), после чего фильтрат выпаривали в вакууме до получения твердого вещества, которое разделяли между диэтиловым эфиром и водным раствором NaOH. Раствор диэтилового эфира сушили (Na2SO4) и выпаривали в вакууме, получая светло-желтое масло. Полученное масло очищали с помощью колоночной флешхроматографии (ДХМ:МеОН - 10:1), получая масло. Часть полученного масла (4,82 г, 29 ммоль) в 2 пропаноле (250 мл) обрабатывали 1 н. HCl (30 мл) и нагревали на паровой бане до получения гомогенного раствора и затем охлаждали до комнатной температуры. Через 3 ч смесь охлаждали на льду в течение 2 ч. Белое хлопьевидное вещество (соответствующая соль HCl (2S)-С-(2,3-дигидробензо[1,4]диоксин-2 ил)метиламина) отфильтровывали и затем снова перекристаллизовывали из 2-пропанола, получая белое твердое вещество.[]D = -69,6 (c=1,06, EtOH). Полученное белое твердое вещество разделяли между ДХМ и разбавленным раствором NaOH, после чего ДХМ сушили (Na2SO4) и выпаривали в вакууме, получая (2S)-C-(2,3-дигидробензо[1,4]диоксин 2-ил)метиламин в виде масла.[]D = -57,8 (с=1,40, CHCl3). Полученное масло (2,1 г, 12,7 ммоль) и сульфамид (2,44 г, 25,4 ммоль) кипятили с обратным холодильником в диоксане (75 мл) в течение 2 ч, сырой продукт очищали с помощью колоночной флешхроматографии (ДХМ:МеОН - 10:1), в результате чего получали белое твердое вещество, которое перекристаллизовывали из ДХМ, получая указанное в заголовке соединение в виде белого кристаллического вещества. Т.пл. 102-103 С Рацемический 2,3-дигидро-1,4-бенздиоксин-2-илметиламин (8,25 г, 5,0 ммоль) и триэтиламин (1,52 г, 15 ммоль) смешивали в ДМФА (10 мл) и после добавления диметилсульфамоилхлорида (1,44 г, 10 ммоль) охлаждали на ледяной бане. Затем реакционную смесь перемешивали в течение 3 ч с постоянным охлаждением. Реакционную смесь разделяли между этилацетатом и водой, после чего этилацетатный раствор промывали насыщенным раствором соли, сушили (MgSO4) и выпаривали в вакууме, получая масло. Полученное масло очищали с помощью колоночной флеш-хроматографии (этилацетат:гептан 1:1), получая белое твердое вещество, которое перекристаллизовывали (этилацетат/гексан), в результате чего получали указанное в заголовке соединение в виде белого хлопьевидного вещества. Т.пл. 76-78 С; МС 273 (МН+); Элементный анализ: Расчетный состав: С, 48,52; Н, 5,92; N, 10,29; S, 11,78. Полученный состав: С, 48,63; Н, 5,62; N, 10,20; S, 11,90. 1 Н-ЯМР (CDCl3) : 6,87 (м, 4 Н), 4,59 (шир.м, 1 Н, NH), 4,35 (м, 1 Н), 4,27 (дд, J=2,3, 11,4 Гц, 1 Н), 4,04 Рацемический 2,3-дигидро-1,4-бенздиоксин-2-илметиламин (825 мг, 5 ммоль) растворяли в этилформиате (15 мл), кипятили с обратным холодильником в течение 30 мин, после чего выпаривали в вакууме, получая N-(2,3-дигидробензо[1,4]диоксин-2-илметил)формамид в виде масла. Полученное масло в диэтиловом эфире (25 мл) обрабатывали 1 М ЛАГ в ТГФ (9,0 мл, 9,0 ммоль) при 0 С и перемешивали в течение 5 ч при комнатной температуре. Реакционную смесь охлаждали на ледяной бане и разбавляли водой (0,50 мл), после чего добавляли 3 н. NaOH (0,50 мл) и воду (0,50 мл). Затем смесь перемешивали при комнатной температуре в течение 1 ч. Осадок отфильтровывали и фильтрат выпаривали в вакууме, получая остаток, который был разделен между 1 н. HCl и диэтиловым эфиром. Водную фазу нейтрализовали 1 н. NaOH и экстрагировали диэтиловым эфиром. Органическую фазу сушили (MgSO4) и выпаривали в вакууме, получая (2,3-дигидробензо[1,4]диоксин-2-илметил)метиламин в виде масла. МС 180 (МН+). 1H-ЯМР (CDCl3) : 6,85 (м, 4 Н), 4,30 (м, 2 Н), 4,02 (дд, J=7,9, 11,6 Гц, 1 Н), 2,85 (м, 2 Н), 2,50 (с, 3H). Полученное масло (380 мг, 2,1 ммоль) и сульфамид (820 мг, 8,5 ммоль) смешивали в диоксане (15 мл), кипятили с обратным холодильником в течение 1,5 ч и выпаривали в вакууме, получая неочищенный остаток. Остаток очищали с помощью колоночной хроматографии (этилацетат/гептан - 1:1), после чего полученное твердое вещество перекристаллизовывали из этилацетата/гексана, получая указанное в заголовке соединение в виде белого твердого вещества. В соответствии с методикой, представленной в примере 4 выше, в реакции участвовал 4 хлоркатехин, в результате чего была получена смесь (2S)-С-(7-хлор-2,3-дигидробензо[1,4]диоксин-2 ил)метиламина и (2S)-С-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламина (приблизительно с соотношением 3:1 6-хлор-:7-хлоризомеров, по данным ОФ-ВЭЖХ). Полученную смесь растворяли в 2-пропаноле (100 мл) и добавляли 1 н. HCl в диэтиловом эфире до получения рН 1,0. Выпавший в осадок гидрохлорид отфильтровывали (2,65 г) и перекристаллизовывали из метанола/ИПС, получая белые кристаллы. Полученные белые кристаллы разделяли между ДХМ и разбавленным раствором NaOH. ДХМ сушили и выпаривали в вакууме, получая очищенный (2S)-С-(6 хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламин в виде масла.[]D = -67,8 (с=1,51, CHCl3). Полученное масло (7,75 ммоль) и сульфамид (1,50 г, 15,5 ммоль) смешивали в диоксане (50 мл) и кипятили с обратным холодильником в течение 2,0 ч, после чего смесь охлаждали до комнатной температуры и выпаривали в вакууме, получая твердое вещество. Продукт очищали на флеш-колонке, используя ДХМ/метанол 20:1, получая указанное в заголовке соединение в виде белого твердого вещества. МС 277 (М-1)(дд, J=2,4, 11,5 Гц, 1 Н), 4,05 (дд, J=7,1, 11,5 Гц, 1 Н), 3,45 (м, 2 Н) Элементный анализ: Расчетный состав: С, 38,78; Н, 3,98; N, 10,05. Полученный состав: С, 38,80; Н, 3,67; N, 9,99. Фильтраты кристаллизованного гидрохлорида (2S)-С-(6-хлор-2,3-дигидробензо[1,4]диоксин-2 ил)метиламина, полученного ранее, выделяли (соотношение 6-хлор-:7-хлоризомеров приблизительно 1:1) и выпаривали в вакууме, в результате чего получали твердое вещество, которое разделяли между ДХМ (200 мл) и разбавленным раствором NaOH (0,5 М, 50 мл). Раствор ДХМ промывали один раз насыщенным раствором соли, сушили (Na2SO4) и выпаривали в вакууме, в результате чего получали масло,которое очищали с помощью обращенно-фазовой ВЭЖХ (10-50% ацетонитрила с 0,16% ТФА в воде и 0,20% ТФА), получая (2S)-С-(7-хлор-2,3-дигидробензо[1,4]диоксин-2-ил)метиламин в виде остатка. Полученный остаток смешивали с сульфамидом (0,90 г, 9,4 ммоль) в диоксане (25 мл) и кипятили с обратным холодильником в течение 2,5 ч, после чего охлаждали до комнатной температуры и выпаривали в вакууме, получая масло. Масло очищали с помощью колоночной флеш-хроматографии с использованием ДХМ/метанол 10:1, получая (2S)-(-)-N-(7-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид в виде белого твердого вещества. МС 277 (M-1). 1 Н-ЯМР (CDCl3/CD3OD) : 6,88 (д, J=0,7 Гц, 1 Н), 6,81 (м, 2 Н), 4,37 (м, 1 Н), 4,30 (дд, J=2,3, 11,6 Гц,1 Н), 4,04 (дд, J=7,0, 11,6 Гц, 1 Н), 3,38 (м, 2 Н). Пример 8. Хроман-2-илметилсульфамид (соединение 10). Хроман-2-карбоновую кислоту (4,5 г, 25 ммоль) и ГБТ (3,86 г, 25 ммоль) смешивали в ДХМ (40 мл) и ДМФА (10 мл). Диметиламинопропилэтилкарбодиимид (ЭДК, 4,84 г, 25 ммоль) добавляли при комнатной температуре, после чего реакционную смесь перемешивали в течение 30 мин. Добавляли гидроксид аммония (2,26 мл, 33,4 ммоль) и реакционную смесь перемешивали в течение 16 ч. Реакционную смесь разбавляли ДХМ (50 мл) и водой (50 мл), после чего рН смеси доводили 1 н. HCl до приблизительно рН 3,0. ДХМ отделяли, после чего водную фазу дважды экстрагировали ДХМ. Объединенную ДХМ фазу сушили (Na2SO4) и выпаривали в вакууме, в результате чего получали масло, которое очищали с- 15016628 помощью колоночной флеш-хроматографии (этилацетат), получая масло. Полученное масло (5,35 г, 30 ммоль) в ТГФ (90 мл) перемешивали с 1 М ЛАГ в ТГФ (36 мл, 36 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Затем реакционную смесь разбавляли водой, перемешивали в течение 2 ч, полученный раствор процеживали,сушили (Na2SO4) и выпаривали в вакууме, получая С-хроман-2-илметиламин в виде маслообразного амина. Маслообразный амин (1,63 г, 10 ммоль) и сульфамид (1,92 г, 20 ммоль) смешивали в диоксане (50 мл) и нагревали до кипения с обратным холодильником в течение 2 ч. Затем раствор охлаждали и выпаривали в вакууме, получая масло, которое очищали с помощью колоночной хроматографии(ДХМ:метанол 10:1), в результате чего получали белое твердое вещество. Полученное твердое вещество перекристаллизовывали из этилацетата/гексана, получая хроман-2-илметилсульфамид в виде белого твердого вещества. Т.пл. 100-101 С; МС 241 (М-1). Элементный анализ: Расчетный состав: С, 49,57; Н, 5,82; N, 11,56; S, 13,23. Полученный состав: С, 49,57; Н, 5,80; N, 11,75; S, 13,33. Пример 9. 2-(2,3-Дигидробензо[1,4]диоксин-2-ил)этилсульфамид (соединение 16). Цианид калия (2,05 г, 31,5 ммоль) добавляли к 2-бромметил-(2,3-дигидробензо[1,4]диоксину) (6,87 г, 30 ммоль) в ДМСО (90 мл) и перемешивали при температуре окружающей среды в течение 20 ч. Затем реакционную смесь разбавляли водой (250 мл) и дважды экстрагировали диэтиловым эфиром. Диэтиловый эфир промывали водой, затем дважды промывали насыщенным раствором соли, сушили (Na2SO4) и выпаривали в вакууме, получая 2-цианометил-(2,3-дигидробензо[1,4]диоксин) в виде белого твердого вещества. 1 Н-ЯМР (CDCl3) : 6,89 (м, 4 Н), 4,50 (м, 1 Н), 4,31 (дд, J=2,3, 11,5 Гц, 1 Н), 4,08 (дд, J=6,2, 11,6 Гц,1 Н), 2,78 (д, J=6,1 Гц, 2 Н). 2-Цианометил-(2,3-дигидробензо[1,4]диоксин) растворяли в ТГФ (50 мл), после чего добавляли 1 М ВН 3 в ТГФ (80 мл, 80 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 5 ч,затем перемешивали при температуре окружающей среды в течение 16 ч. При охлаждении на ледяной бане, рН доводили до 1,0 с помощью 2 н. HCl. Затем реакционную смесь перемешивали в течение 1 ч при комнатной температуре, после чего выпаривали в вакууме, получая масло. Масло разделяли между 3 н.NaOH и диэтиловым эфиром, раствор диэтилового эфира промывали насыщенным раствором соли, сушили (Na2SO4) и выпаривали в вакууме, получая неочищенный 2-(2,3-дигидробензо[1,4]диоксин-2 ил)этиламин. МС (М+Н)+ 180. Неочищенный 2-(2,3-дигидробензо[1,4]диоксин-2-ил)этиламин в диоксане (100 мл) смешивали с сульфамидом (3,0 г, 31 ммоль) и нагревали до кипения с обратным холодильником в течение 2 ч. Затем раствор охлаждали и выпаривали в вакууме, получая оранжевый остаток, который очищали с помощью колоночной хроматографии (ДХМ:МеОН - 10:1), получая белое твердое вещество. Твердое вещество перекристаллизовывали из ДХМ, получая указанное в заголовке соединение в виде твердого вещества. МС (М-1) 257; Т.пл. 101-103 С (разл.); 1(200 мл). Затем добавляли (2R)-глицидилтозилат (9,12 г, 40 ммоль), после чего реакционную смесь перемешивали при 60 С в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и затем разбавляли ледяной водой (600 мл) и экстрагировали диэтиловым эфиром (4 раза). Объединенный орга- 16016628 нический раствор промывали 3 раза 10%-ным раствором карбоната калия, дважды насыщенным раствором соли, сушили (MgSO4) и выпаривали в вакууме, получая вязкое масло, представляющее собой (2S)2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин)метанол. Маслообразный (2S)-2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин)метанол (6,4 г, 27 ммоль) растворяли в пиридине (50 мл), охлажденном до 0 С. Затем добавляли п-толуолсульфонилхлорид (5,2 г, 27 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь разбавляли диэтиловым эфиром и 1 н. HCl (750 мл), после чего органический слой отделяли и промывали 2 раза 1 н. HCl (250 мл), один раз водой (150 мл), дважды насыщенным раствором соли, сушили (MgSO4) и выпаривали в вакууме, в результате чего получали (2S)-6,7-дихлор-2,3 дигидробензо[1,4]диоксин-2-илметиловый эфир толуол-4-сульфоновой кислоты в виде светло-желтого твердого вещества. 1(2S)-6,7-Дихлор-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир толуол-4-сульфоновой кислоты (8,0 г, 20,5 ммоль) смешивали с фталимидом калия (6,1 г, 33 ммоль) в ДМФА (75 мл) и нагревали до кипения с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и вливали в энергично перемешиваемую воду (0,5 л) и затем перемешивали 30 мин. Белое твердое вещество отфильтровывали и промывали несколько раз водой, 2%-ным раствором NaOH и снова водой и затем сушили на воздухе, получая (2S)-2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксин-2-илметил)изоиндол-1,3 дион (6,0 г, 80%) в виде белого порошкообразного вещества. Белое порошкообразное вещество смешивали с гидразином (1,06 г, 33 ммоль) в EtOH (80 мл) и нагревали при кипячении с обратным холодильником в течение 2 ч и затем охлаждали до комнатной температуры. Затем добавляли 1 н. HCl, доводя рН реакционной смеси до 1,0, после чего реакционную смесь перемешивали в течение 15 мин. Белое твердое вещество отфильтровывали и промывали свежим EtOH(осадок удаляли), после чего фильтрат выпаривали в вакууме, получая твердое вещество, которое затем разделяли между диэтиловым эфиром и водным раствором NaOH. Раствор диэтилового эфира сушилиH-ЯМР (CDCl3) : 6,98 (с, 1 Н), 6,96 (с, 1 Н), 4,25 (дд, J=2,0, 11,2 Гц, 1 Н), 4,15 (м, 1 Н), 4,0 (м, 1 Н),2,97 (д, J=5,5 Гц, 2 Н). Часть полученного масла (3,8 г, 16 ммоль) и сульфамид (3,1 г, 32,4 ммоль) кипятили с обратным холодильником в диоксане (100 мл) в течение 2 ч и полученный в результате неочищенный продукт очищали с помощью колоночной флеш-хроматографии (ДХМ:МеОН - 20:1), получая указанное в заголовке соединение в виде белого твердого вещества, которое затем перекристаллизовывали из этилацетата/гексана, в результате чего указанное в заголовке соединение получали в виде белого кристаллического вещества. МС [М-Н]- 311,0. Т.пл. 119-121 С. Указанное в заголовке соединение, получали согласно методике, описанной в примере 4 выше, с использованием в качестве исходного соединения 4-метилкатехина, в результате чего получали белое твердое вещество, которое перекристаллизовывали из этилацетата/гексана, получая указанное в заголовке соединение в виде белого твердого вещества. МС [М-Н]- 257. 1- 17016628 Тест проводили согласно методике, приложенной к набору, полученному от Promega (см. приложение в конце заявки). Культуры клеток приготавливали следующим образом. Культуры диссоциированных гиппокампальных и корковых клеток культуры получали от эмбрионов крыс 18-дневного развития. Эмбрионы удаляли посредством кесарева сечения у беременных самок (Харлан Спраг-Доули), анестезированных галотаном согласно правилам умерщвления AVMA. После обезглавливания у крысят удаляли мозги, которые затем помещали в буферный солевой раствор Хенка (lxHBSS; Gibco, Rockville, MD). Гиппокампы и кору вырезали и объединяли в пул согласно типу ткани. Ткань обрабатывали трипсином в течение 15 мин (1 мг/мл трипсин-HBSS; Worthington, Lakewood, NJ), отмывали свежим HBSS, выдерживали в ингибиторе трипсина (1 мг/мл; Sigma, St.Louis, МО) в течение 5 мин, снова отмывали свежим HBSS и затем суспендировали в 1 мл чистого HBSS оплавленной стеклянной пипеткой. Диссоциированные клетки высевали в количестве 10000 клеток на лунку в 96-луночный планшет, покрытый поли-D-лизином, (BDBioScience, Bedford, MA), содержащий по 100 мкл на лунку минимальной среды Игла (MEM; Gibco) с добавлением 26 мМ NaHCO3 (Sigma), 40 мМ глюкозы (Sigma), 20 мМ RCl (Sigma), 1 мМ пирувата натрия(Sigma), 10% (об./об.) термоинактивированной эмбриональной бычьей сыворотки (Hyclone, Logan, UT), и также 0,001% гентамицина сульфата (Sigma) (pH 7,4). Бессывороточные культуры высевали и выращивали в среде Neurobasal плюс добавка В 27 (Gibco). Перед опытной обработкой клетки инкубировали в течение 24 ч во влажном инкубаторе при 37 С в атмосфере с 5% СО 2. Тестируемые соединения приготавливали следующим образом. 10 мМ стокового раствора каждого соединения в ДМСО разбавляли 1:50 в DPBS, получая стоковый раствор с конечной концентрацией 200 мкМ. Затем стоковый раствор снова разбавляли в DPBS, получая конечную концентрацию соединения 0,1, 1 и 120 мкМ в каждой 100-мкл лунке. В каждую культуральную лунку добавляли равные количества носителя или разбавленного соединения. Раствор концентрированной 30%-ной перекиси водорода (Н 2 О 2; Sigma) разбавляли DPBS 1:100, получая 3 мМ стоковый раствор. 5 мкл носителя или стокового раствора Н 2 О 2 добавляли в каждую 100-мкл лунку, получая конечную концентрацию 150 мкМ. Соединение 8 тестировали согласно методике, описанной в настоящем описании, полученные результаты приведены в табл. 4 и 5 ниже. Следует отметить, что при получении нижеприведенных данных тест с каждым планшетом повторяли три раза (в общей сложности n=9). Таблица 4 Культуры клеток гиппокампа крысы, инсульт вызван 150 мкМ Н 2 О 2 Таблица 5 Культуры клеток коры мозга крысы, инсульт вызван 150 мкМ Н 2 О 2 Критерий множественного сравнения Крускал-Валлиса с последующим тестом Данна:р 0,05,р 0,01. Таким образом, данные показывают, что соединение 8 было эффективно при защите нейронов от гибели и/или повреждения от окислительного стресса или окислительного повреждения, например, в результате воздействия кислородных/пероксидных радикалов. Пример 14.- 18016628 В качестве конкретного варианта осуществления композиции для перорального применения 100 мг соединения 8, полученного согласно примеру 7, вводили в композицию с достаточно тонко измельченной лактозой, получая общее количество от 580 до 590 мг, для заполнения твердых желатиновых капсул размера О. Несмотря на то, что предыдущее описание раскрывает принципы настоящего изобретения посредством примеров, приведенных в целях пояснения, следует понимать, что практическое осуществление изобретения охватывает все обычные варианты, изменения и/или модификации, находящиеся в объеме следующей формулы изобретения и ее эквивалентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ нейропротекции при окислительном стрессе, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 4; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или его фармацевтически приемлемой соли. 2. Способ по п.1, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом 1 или 2; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или это соединение вводят в виде фармацевтически приемлемой соли. 3. Способ по п.1, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-хлорбензо[1,3]диоксолил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и 2-(8-хлор-2,3-дигидробензо[1,4]диоксинил); или это соединение формулы (I) вводят в виде фармацевтически приемлемой соли. 4. Способ по п.3, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и метил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),- 19016628 2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 5. Способ по п.1, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6-хлор 2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли. 6. Способ по п.1, где соединение формулы (I) представляет собой соединение формулы 7. Способ лечения острого нейродегенеративного заболевания, включающий введение нуждающемуся субъекту терапевтически эффективного количества соединения формулы (I) где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 4; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или его фармацевтически приемлемой соли. 8. Способ по п.7, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 2; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или это соединение вводят в виде фармацевтически приемлемой соли. 9. Способ по п.8, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и 2-(8-хлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 10. Способ по п.9, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и метил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей- 20016628 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 11. Способ по п.7, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6 хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли. 12. Способ по п.7, где соединение формулы (I) представляет собой соединение формулы 13. Способ лечения хронического нейродегенеративного заболевания, включающий введение нуждающемуся в нейропротекции при окислительном стрессе субъекту терапевтически эффективного количества соединения формулы (I) где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 4; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или это соединение вводят в виде фармацевтически приемлемой соли. 14. Способ по п.13, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 2; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или это соединение вводят в виде фармацевтически приемлемой соли. 15. Способ по п.14, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),2-(хроманил),2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и 2-(8-хлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 16. Способ по п.15, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и метил;- 21016628 а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 17. Способ по п.13, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6 хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли. 18. Способ по п.13, где соединение формулы (I) представляет собой соединение формулы 19. Способ предотвращения гибели или повреждения нейрона в результате травмы или повреждения мозга, головы или спинного мозга, включающий введение субъекту терапевтически эффективного количества соединения формулы (I) где каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; представляет собой где b является целым числом от 0 до 4; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или его фармацевтически приемлемой соли. 20. Способ по п.19, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и C1-4 алкил; а является целым числом 1 или 2; выбран из группы, включающей где b является целым числом от 0 до 2; каждый R5 независимо выбран из группы, включающей галоген и C1-4 алкил; или это соединение вводят в виде фармацевтически приемлемой соли. 21. Способ по п.20, где в соединении формулы (I) каждый R1 и R2 независимо выбран из группы, включающей водород и C1-4 алкил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-фтор-2,3-дигидробензо[1,4]диоксинил),2-(5-фтор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(5-хлор-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил),2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил) и 2-(8-хлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 22. Способ по п.21, где в соединении формулы (I)- 22016628 каждый R1 и R2 независимо выбран из группы, включающей водород и метил;R4 выбран из группы, включающей водород и метил; а является целым числом 1 или 2; выбран из группы, включающей 2-(2,3-дигидробензо[1,4]диоксинил),2-(6-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-хлор-2,3-дигидробензо[1,4]диоксинил),2-(7-метил-2,3-дигидробензо[1,4]диоксинил),2-(6-бром-2,3-дигидробензо[1,4]диоксинил) и 2-(6,7-дихлор-2,3-дигидробензо[1,4]диоксинил); или это соединение вводят в виде фармацевтически приемлемой соли. 23. Способ по п.19, где соединение формулы (I) выбирают из группы, включающей (2S)-(-)-N-(6 хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид и его фармацевтически приемлемые соли. 24. Способ по п.19, где соединение формулы (I) представляет собой соединение формулы
МПК / Метки
МПК: A61P 25/14, A61P 25/16, A61K 31/357, A61P 25/02, A61P 25/08, A61K 31/353
Метки: применение, нейропротективных, производных, качестве, бензоконденсированных, сульфамидных, агентов, гетероциклических
Код ссылки
<a href="https://eas.patents.su/24-16628-primenenie-benzokondensirovannyh-geterociklicheskih-sulfamidnyh-proizvodnyh-v-kachestve-nejjroprotektivnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Применение бензоконденсированных гетероциклических сульфамидных производных в качестве нейропротективных агентов</a>
Предыдущий патент: Беспроводное передающее устройство
Следующий патент: 1,3-диоксанкарбоновые кислоты
Случайный патент: Конденсированные бициклические пиримидины