Антигенсвязывающие фрагменты антитела и их применение для лечения или диагностики глазных болезней
Номер патента: 22923
Опубликовано: 31.03.2016
Авторы: Абади Клэр, Комбетт Жан-Марк, Уилльямсон Роберт Энтони, Делош Катрин
Формула / Реферат
1. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, включающего последовательность, которая на 90% гомологична SEQ ID NO: 3 или SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении.
2. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, состоящего из SEQ ID NO: 3 или SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении.
3. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, включающего последовательность SEQ ID NO: 3 и SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении.
4. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, состоящего из SEQ ID NO: 3 и SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении.
5. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, включающего последовательность SEQ ID NO: 1 и SEQ ID NO: 2, для приготовления лекарственного средства, предназначенного для лечения глазной болезни при местном введении.
6. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV, состоящего из SEQ ID NO: 1 и SEQ ID NO: 2, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении.
7. Применение по любому из предшествующих пунктов, отличающееся тем, что указанное антитело нейтрализует HSV1 и HSV2.
8. Применение по любому из предшествующих пунктов, отличающееся тем, что поверхностный антиген вируса, с которым связывается указанное антитело, представляет собой gD.
9. Применение по любому из предшествующих пунктов, отличающееся тем, что лекарственное средство получено с использованием усилителя ретенции антигенсвязывающего фрагмента в глазу.
10. Применение по п.9, отличающееся тем, что усилитель ретенции выбран из группы, состоящей из гиалуроната натрия, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилового спирта, ксантановой камеди, геллановой камеди, хитозана, полимолочной кислоты и их производных.
11. Применение по любому из предшествующих пунктов, отличающееся тем, что лекарственное средство имеет форму глазных капель, мази, геля, глазного крема.
12. Применение по любому из предшествующих пунктов, отличающееся тем, что глазная болезнь, вызванная HSV, представляет собой глазной кератит, блефарит, конъюнктивит, блефароконъюнктивит, язвы.
13. Применение по любому из предшествующих пунктов, отличающееся тем, что полностью человеческий антигенсвязывающий фрагмент имеет связанную с ним детектируемую метку.
14. Фармацевтическая композиция для местного введения в глаз, предназначенная для лечения глазной болезни, вызванной HSV, которая включает эффективное количество полностью человеческого антигенсвязывающего фрагмента антитела, охарактеризованного в любом из предшествующих пунктов.
Текст
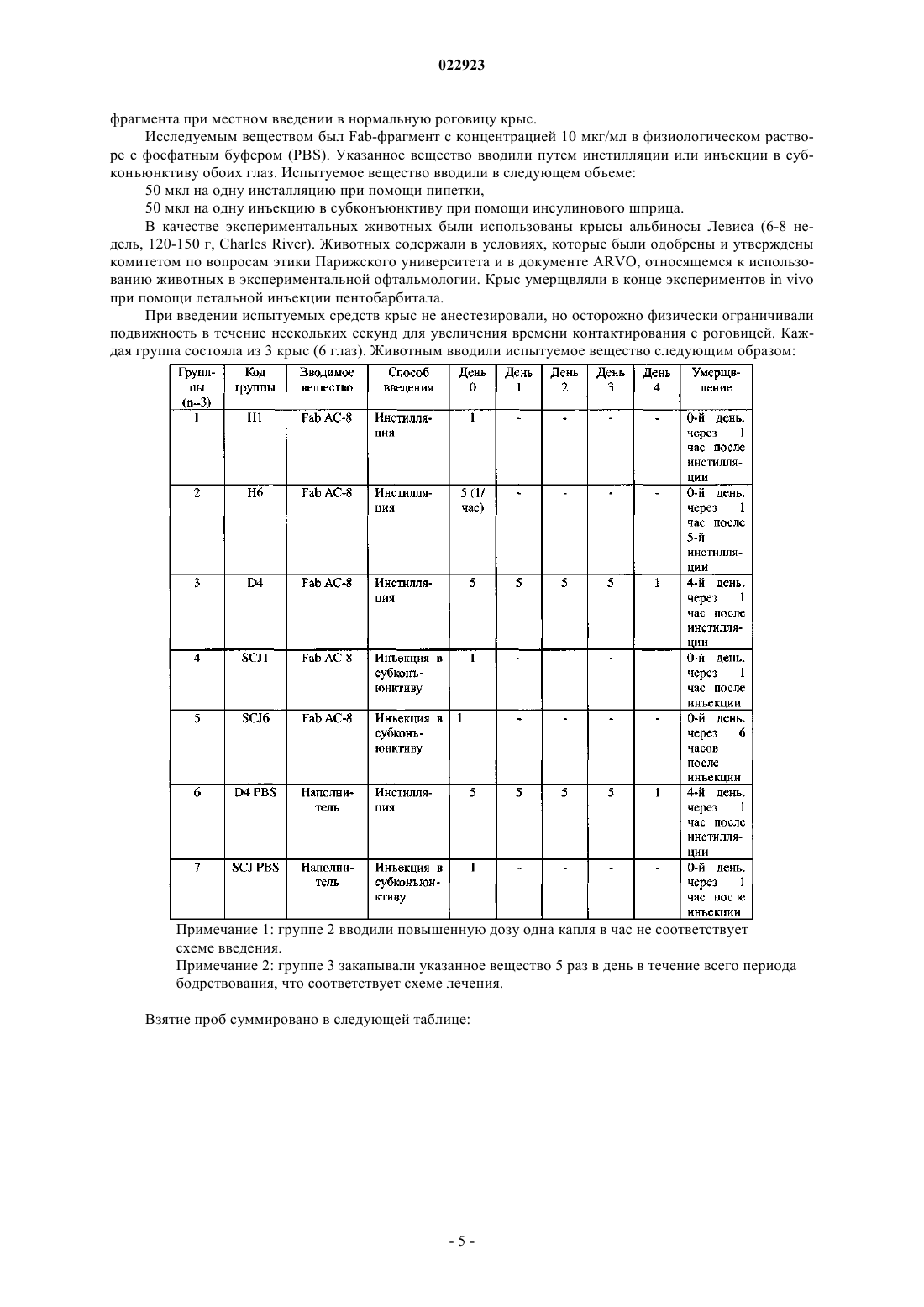
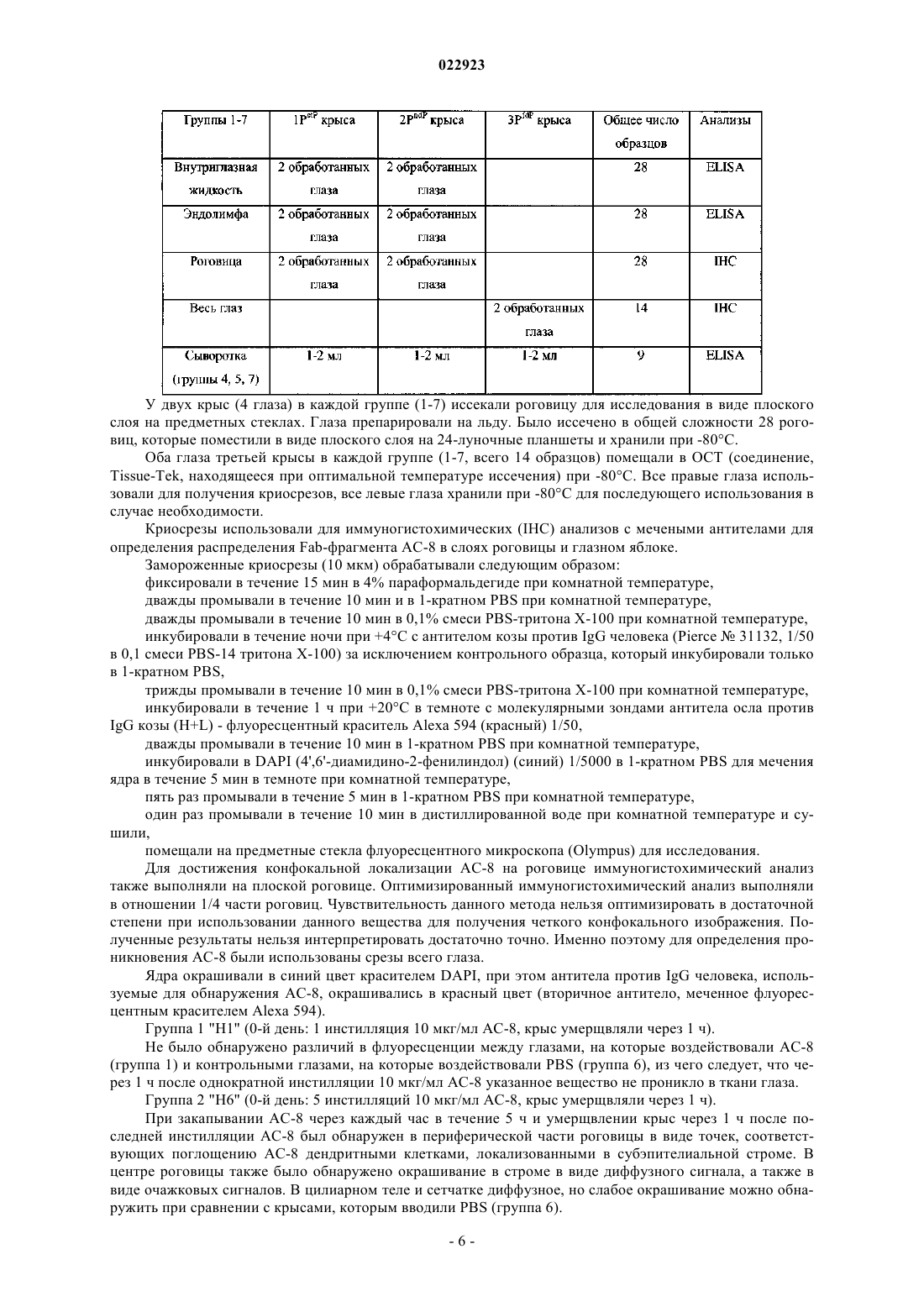
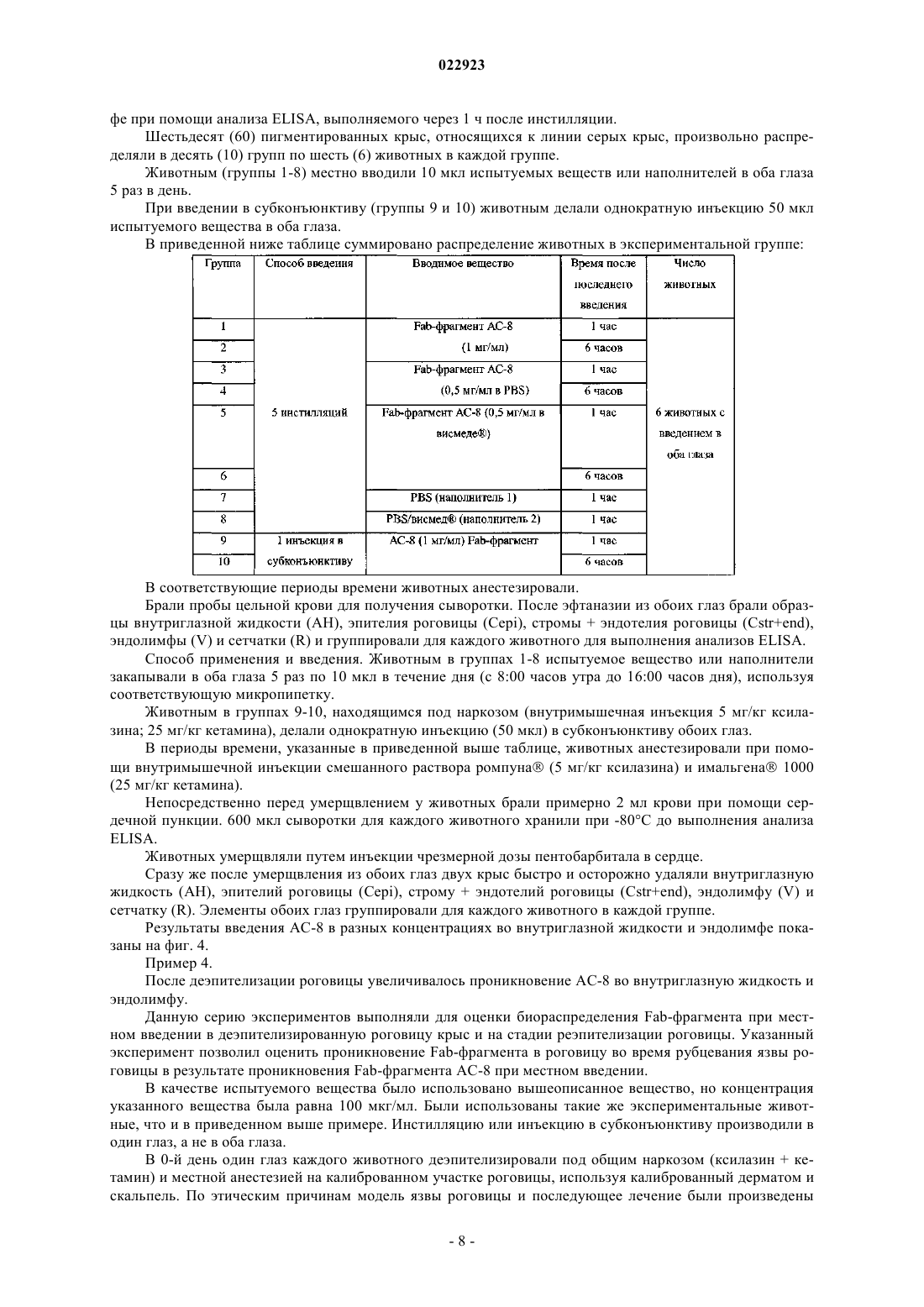
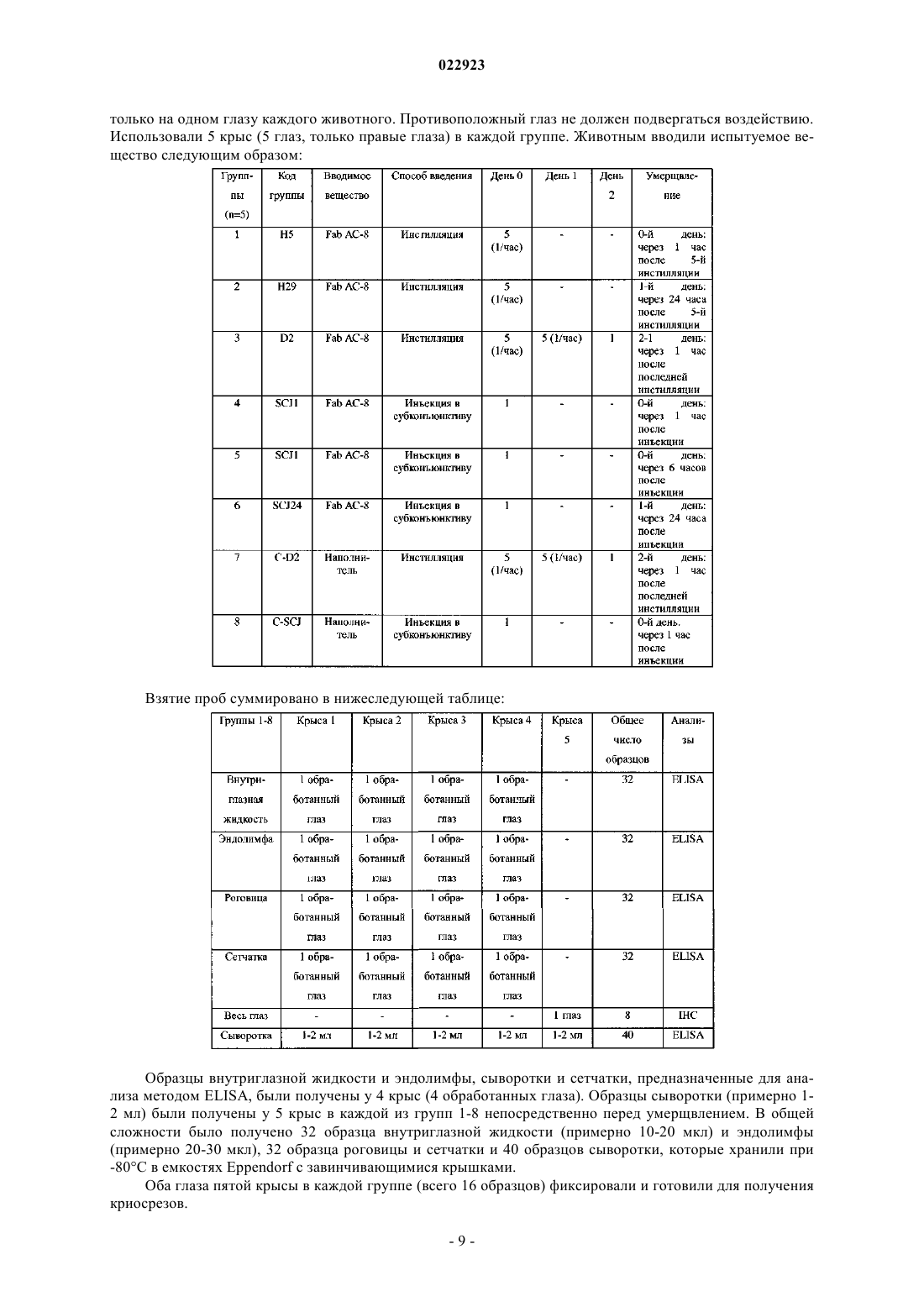
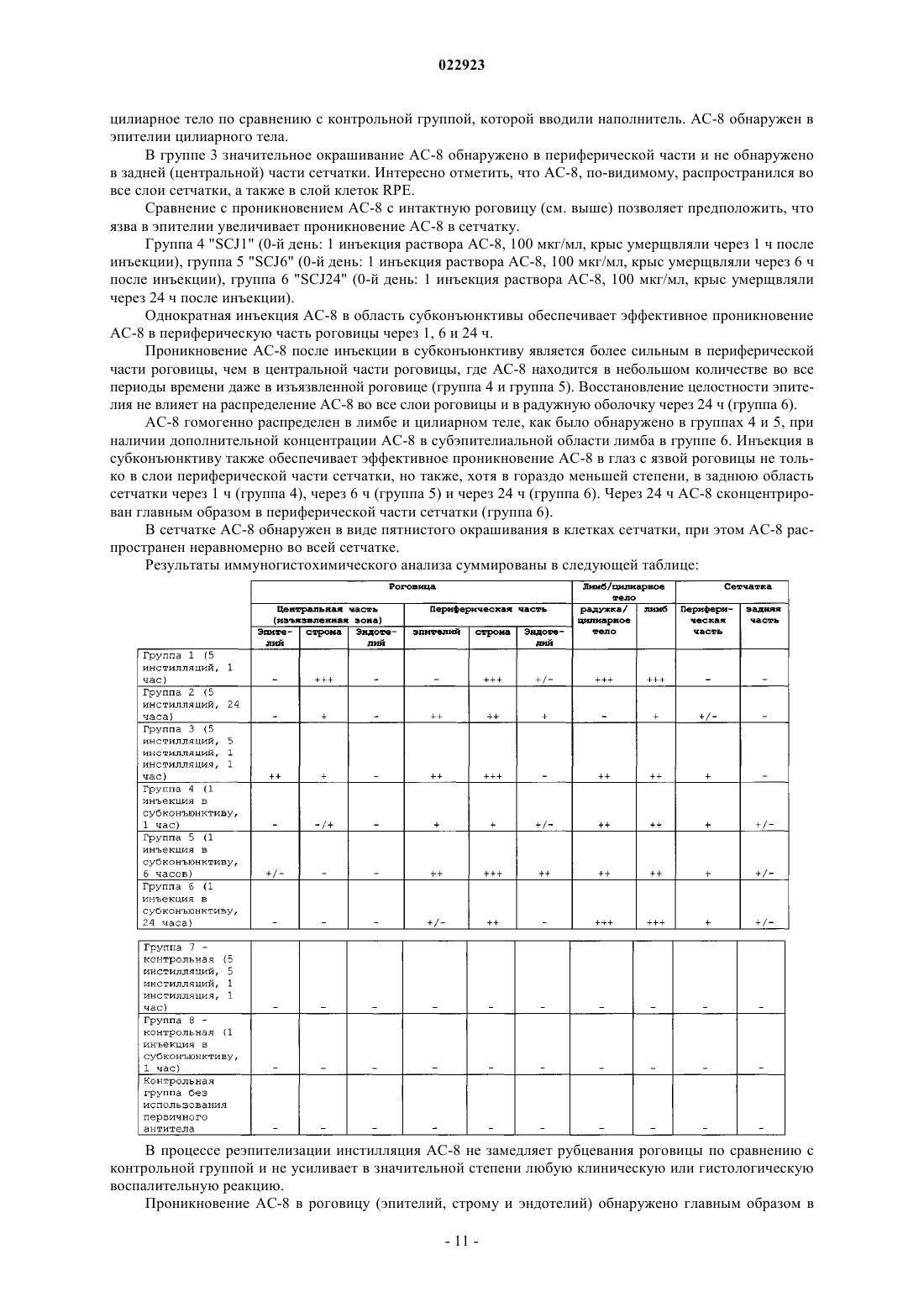
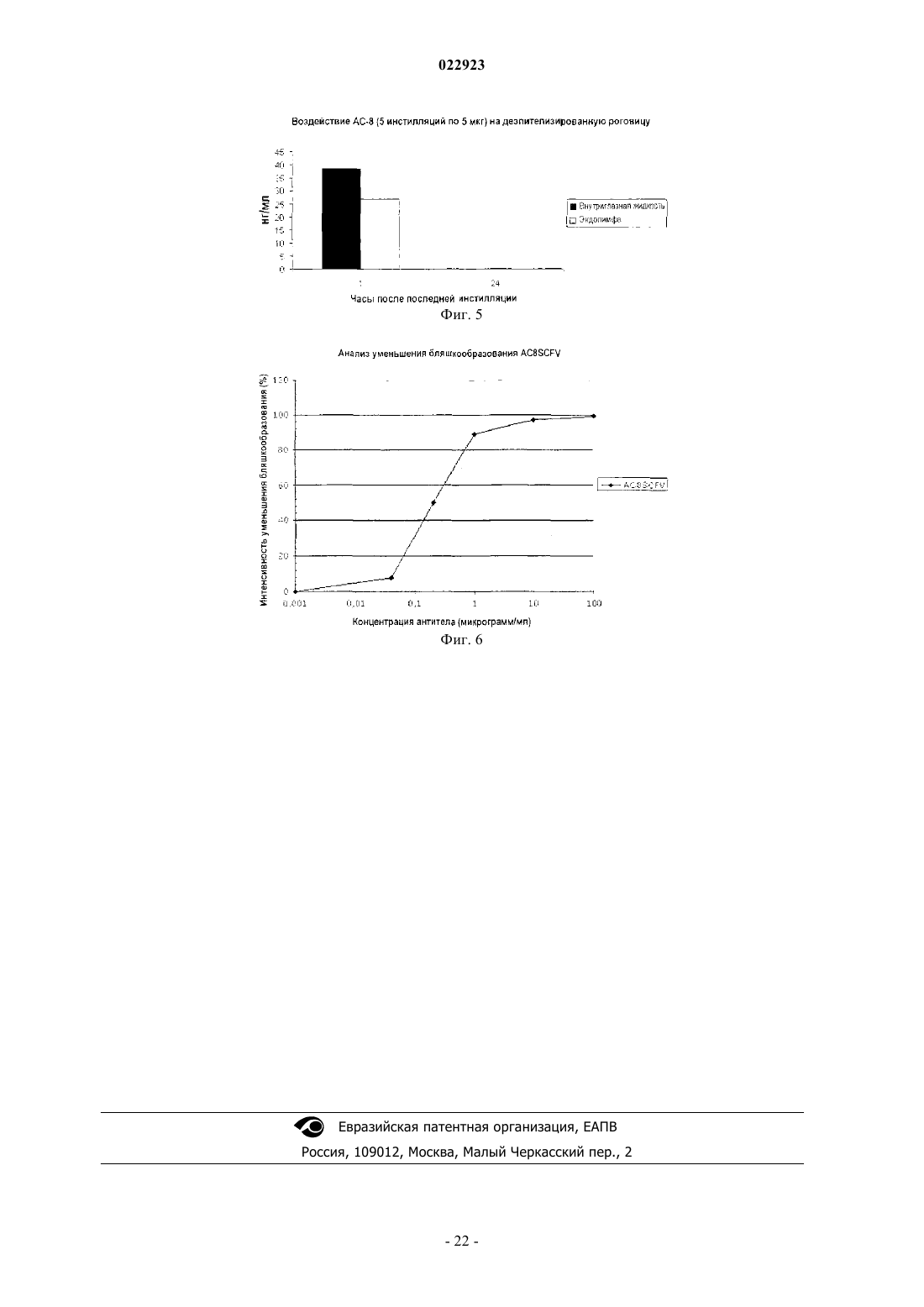
АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИЛИ ДИАГНОСТИКИ ГЛАЗНЫХ БОЛЕЗНЕЙ Настоящее изобретение относится к применению полностью человеческого антигенсвязывающего фрагмента антитела для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. Настоящее изобретение далее относится к фармацевтической композиции для местного введения в глаз, предназначенной для лечения или диагностики глазной болезни, которая включает полностью человеческий антигенсвязывающий фрагмент антитела. Указанное антитело, в частности, нейтрализует HSV1 и HSV2. Абади Клэр, Комбетт Жан-Марк (FR),Делош Катрин (CH), Уилльямсон Роберт Энтони (US) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: РИБОВАКС БАЙОТЕКНОЛОДЖИЗ СА (CH) Настоящее изобретение относится к применению антигенсвязывающих фрагментов антитела для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. Уровень техники Вирус простого герпеса (HSV) является ДНК-вирусом, обычно поражающим людей. Инфицирование происходит в результате прямого контактирования кожи или слизистой оболочки с содержащими вирус поражениями или выделениями. HSV 1-го типа (HSV-1) инфицирует главным образом рот, лицо и глаза, в то время как HSV 2-го типа (HSV-2) обычно передается половым путем и вызывает заболевания половых органов. HSV-2 может инфицировать глаз при контактировании рта и лица с поражениями в области половых органов и иногда передается новорожденным при прохождении по родовому каналу матери, у которой половые органы инфицированы HSV-2.HSV-1 инфицирует главным образом кожу и слизистую оболочку вдоль тройничного нерва. Данное заболевание часто является бессимптомным, но может проявляться в виде неспецифического инфекционного заболевания верхних дыхательных путей. После первичного инфицирования вирус проникает из пораженных эпителиальных клеток в ближайшие чувствительные нервные окончания и переносится по аксону в клеточное тело, расположенное в ганглии тройничного нерва. Там геном вируса проникает в ядро нейрона, где пребывает в латентном состоянии. Первичное инфицирование глазного, верхнечелюстного или нижнечелюстного ответвления черепного нерва V может вызвать латентное поражение нервных клеток в ганглии тройничного нерва. Распространение HSV по нейронам ганглия вызывает у субъектов последующую глазную болезнь даже без первичного инфицирования глаза вирусом простого герпеса. Традиционно считается, что рецидив глазной болезни, вызванной вирусом простого герпеса, представляет собой повторную активацию вируса в ганглии тройничного нерва, который перемещается по аксону, вызывая литическое инфицирование глазной ткани. Полученные данные позволяют предположить, что указанный вирус также может латентно находиться в ткани роговицы, являясь другим потенциальным источником рецидива болезни, возникающей в результате трансплантации роговицы донора,инфицированного вирусом простого герпеса. Инфицирование HSV является повсеместным, при этом одна треть населения во всем мире поражена рецидивирующими инфекционными болезнями. Только в США ежегодно регистрируется примерно 20000 новых случаев поражения глаз вирусом простого герпеса и более 28000 рецидивов болезней. Инфекционные болезни глаза, вызываемые вирусом простого герпеса, являются главной причиной слепоты в развивающихся странах. Инфекционные болезни глаза, вызываемые вирусом простого герпеса, можно, в частности, классифицировать в 4 категории: инфекционный эпителиальный кератит, нейротропная кератопатия, стромальный кератит и эндотелиит. Глазные болезни обычно диагностируют на основании характерных признаков поражения роговицы и путем исключения. Лабораторные исследования позволяют подтвердить диагноз в случае отсутствия типичных признаков, но выполнение таких исследований в большинстве клиник обычно связано с определенными трудностями. Соскоб эпителия с окрашиванием красителем Giemsa позволяет увидеть многоядерные гигантские клетки, образующиеся в результате слияния инфицированных эпителиальных клеток роговицы и внутриядерных вирусных включений. Однако отрицательные результаты цитологического анализа не исключают инфицирования HSV. Культуры вирусов характеризуются хорошей чувствительностью, но требуют нескольких дней для получения результата. Анализы по обнаружению антигена HSV, такие как система, индуцируемая вирусом, связанным с ферментом (ELVIS), являются специфическими, но их применение ограничено из-за более низкой чувствительности. Поэтому в любом случае рекомендуется использовать культуру клеток для подтверждения HSV, когда анализ ELVIS дает отрицательный результат, что снова требует дополнительной затраты времени. При помощи полимеразной цепной реакции с использованием образцов слезной жидкости, эпителия роговицы, жидкости из передней камеры глазного яблока или узелков роговицы можно обнаружить ДНК вируса в случае герпетического кератита или кератоувеита. Однако данный метод не позволяет выявить различия между латентными или активными инфекциями HSV. Диагностика особенно затруднена в случае дисковидного эндотелиита или стромального заболевания, так как вирусные частицы часто невозможно обнаружить в биопсийных образцах стромы и поэтому нельзя получить культуры. Что касается лечения, то несмотря на наличие антивирусной терапии данная болезнь по-прежнему остается значительной проблемой здравоохранения. В Европе для лечения глазных инфекций применяется мазь "зовиракс" (ацикловир) (хотя появление штаммов, устойчивых к данному лекарственному средству, вызывает озабоченность). Однако ацикловир не предотвращает поражения роговицы. В США единственным утвержденным средством для лечения указанных инфекций является "вироптик" (1% водный раствор трифтортимидина). Как ацикловир, так и трифтортимидин недостаточно эффективно воздействуют на рецидивирующую болезнь, которая является обычно причиной помутнения роговицы, вызывающего слепоту. При использовании обоих препаратов могут возникать значительные побочные эффекты, связанные с непереносимостью субъектом. Очевидно, что необходимы более совершенные мето-1 022923 ды лечения или диагностики глазных болезней, вызываемых вирусом простого герпеса (HSV). Антитела все шире используются при диагностике и лечении разных болезней. Использование антител является чрезвычайно эффективным при диагностике и лечении вышеописанных болезней в тех случаях, когда альтернативное лечение оказывается неудовлетворительным. Антитела можно вводить системно, хотя они могут вызывать серьезные системные побочные эффекты при достижении в терапевтических концентрациях места поражения инфекцией. Местное введение антител для модуляции иммунопатологических состояний роговицы или переднего отдела глазного яблока позволяет избежать указанных побочных эффектов, но такое введение является неэффективным, так как полные антитела являются слишком большими для быстрого проникновения в роговицу (Allansmith M., de Ramus A., Maurice D. The dynamics of IgG in the cornea. Invest Ophthalmol. Vis. Sci. 1979; 18:947-55). Объектом настоящего изобретения является использование полностью человеческого антигенсвязывающего фрагмента антитела, имеющего последовательность, которая по меньшей мере на 90% гомологична SEQ ID NO: 3 и/или SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. Другим объектом настоящего изобретения является использование полностью человеческого антигенсвязывающего фрагмента антитела, имеющего последовательность, которая по меньшей мере на 90% гомологична SEQ ID NO: 1 и SEQ ID NO: 2, для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. Другим объектом настоящего изобретения является фармацевтическая композиция, предназначенная для местного введения в глаз с целью лечения и/или диагностики глазной болезни, включающая полностью человеческий антигенсвязывающий фрагмент антитела, которая отличается тем, что указанный полностью человеческий антигенсвязывающий фрагмент имеет последовательность, которая по меньшей мере на 90% гомологична SEQ ID NO: 3 и/или SEQ ID NO: 4, или последовательность, которая по меньшей мере на 90% гомологична SEQ ID NO: 1 и SEQ ID NO: 2. Указанное антитело, в частности, нейтрализует HSV1 и HSV2. Определения терминов За исключением особо оговоренных случаев, все технические и научные термины, использованные в настоящем описании изобретения, имеют общепринятые значения, известные специалистам в данной области, к которой относится настоящее изобретение. Несмотря на то, что при осуществлении настоящего изобретения могут быть использованы многие методы и материалы, ниже описаны предпочтительные методы и материалы. За исключением особо оговоренных случаев, методы, рассмотренные в настоящем описании изобретения и предназначенные для использования с данным изобретением, представляют собой стандартные методы, хорошо известные специалистам в данной области. Термин "Fab-фрагмент" или "антигенсвязывающий фрагмент" означает любой фрагмент антитела,сохраняющий способность связываться с антигеном и включающий по меньшей мере одну вариабельную область легкой или тяжелой цепи. Термин "глазная болезнь" означает любую инфекционную болезнь (первичную или вторичную), такую как, например, глазной кератит (эпителиальный и стромальный), блефарит, конъюнктивит, блефароконъюнктивит, язвы. Термин "усилитель ретенции" означает любое вещество или композицию, продлевающие время пребывания продукта в больном глазу, такие как гиалуронат натрия, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксиэтилметилцеллюлоза, гидроксипропилметилцеллюлоза, поливиниловый спирт, ксантановая камедь, геллановая камедь, хитозан, полимолочная кислота и их производные. Термин "фармацевтическая композиция" означает любую терапевтически приемлемую смесь или комбинацию веществ. Краткое описание чертежей На фиг. 1 представлено несколько снимков иммуногистохимического анализа роговицы (a-h, l-n) и цилиарного тела (i-k, o-q), полученных через 1 ч после 5 инстилляций АС-8, выполняемых в течение 4 дней, и одной инстилляции АС-8, выполненной в последний день (а-k), или через 1 ч после 5 инстилляций PBS (наполнитель), выполненных в течение 4 дней, и одной инстилляции, выполненной в последний день (l-g). Символами d и h отмечены увеличенные изображения белых квадратов, в которых соответственно изображены (d) меченная флуоресцентным красителем Alexa дендритная субэпителиальная клетка и (h) меченый эпителий роговицы. Размер = 100 мкм. На фиг. 2 представлены снимки иммуногистохимического анализа центральной (a-d) и периферической части роговицы (e-j) через 24 ч после 5 инстилляций АС-8, на которых показано проникновениеFab-фрагмента через склеру. На фиг. 2 а в белом квадрате показана реэпителизированная область ранее имевшейся язвы. На фиг. 2d и 2i соответственно показаны увеличенные изображения белых квадратов на фиг. 2 с и 2h: субэпителиальные стромальные клетки, положительно меченные в отношении АС-8. На фиг. 2g и 2j показаны увеличенные изображения белых квадратов на фиг. 2l и 2h, на которых представлен эпителий, положительно меченный в отношении АС-8. На фиг. 2k-m показан иммуногистохимический анализ (IHC) контрольной роговицы, на которую воздействовали наполнителем. Epith = эпителий,-2 022923Endoth = эндотелий. Размер = 200 мкм. На фиг. 3 изображена диаграмма, показывающая воздействие АС-8 на титры слезной пленки после инфицирования вирусом глаза мыши, которая свидетельствует о нейтрализации вируса простого герпеса лекарственным средством АС-8 in vivo в зависимости от времени. На фиг. 4 изображена гистограмма, показывающая концентрацию АС-8 во внутриглазной жидкости и эндолимфе мышей с нормальной роговицей через 1 и 6 ч после 5 инстилляций 5 мкг АС-8. На фиг. 5 изображена гистограмма, показывающая концентрацию АС-8 во внутриглазной жидкости и эндолимфе мышей с деэпителизированной роговицей через 1 и 24 ч после 5 инстилляций 5 мкг АС-8. На фиг. 6 изображена диаграмма, показывающая нейтрализацию HSV-1 при выполнении анализа уменьшения бляшкообразования в зависимости от увеличения концентрации scFv-фрагмента АС-8. Подробное описание изобретения Настоящее изобретение относится к полностью человеческому антигенсвязывающему фрагменту антитела, имеющему последовательность SEQ ID NO: 1 и SEQ ID NO: 2, который использован для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. Следует отметить, что константные области тяжелой цепи (SEQ ID NO: 1) и легкой цепи (SEQ IDNO:2) могут быть заменены любой приемлемой константной областью иммуноглобулина человека при сохранении полученной молекулой способности связываться с антигеном. Таким образом, в альтернативном варианте осуществления настоящего изобретения scFv-фрагмент,имеющий SEQ ID NO: 3 или SEQ ID NO: 4, может быть использован для приготовления лекарственного средства, предназначенного для лечения или диагностики глазной болезни при местном введении. В частности, антитело по настоящему изобретению нейтрализует HSV1 и HSV2. Антиген вирусной поверхности представляет собой gD. Лекарственное средство по настоящему изобретению предпочтительно получают с использованием усилителя ретенции антигенсвязывающего фрагмента в глазу. Усилители ретенции, используемые в настоящем изобретении, могут быть выбраны из группы, состоящей из гиалуроната натрия, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилового спирта, ксантановой камеди, геллановой камеди, хитозана, полимолочной кислоты и их производных. Лекарственное средство по настоящему изобретению предпочтительно получают в форме глазных капель, мази, геля, глазного крема. Глазная болезнь представляет собой глазной кератит, блефарит, конъюнктивит, блефароконъюнктивит, язвы. Полностью человеческие антигенсвязывающие фрагменты по настоящему изобретению могут быть использованы в методах диагностики, включающих контактирование части глаза с антигенсвязывающими фрагментами, специфичными для данной болезни, и обнаружение наличия комплекса, включающего антигенсвязывающий фрагмент и антиген. Указанный комплекс может быть обнаружен любым методом,известным в данной области, таким как использование антигенсвязывающего фрагмента, связанного с детектируемой меткой, которая может быть обнаружена при выполнении иммуноанализов in vitro и invivo. Примерами анализов in vitro являются твердофазный иммуноферментный анализ (ELISA) (непрямой анализ, сэндвич-анализ, конкурентный анализ) и радиоиммуноанализ (RIA). Метка может быть прямо или опосредованно связана с антигенсвязывающим фрагментом или присоединена к последующему продукту реакции антигенсвязывающей молекулы. Метка может быть выбрана из группы, включающей хромоген, катализатор, фермент, фторохром, хемилюминесцентную молекулу, радиоактивный изотоп и краситель. Настоящее изобретение относится к фармацевтической композиции, предназначенной для местного введения в глаз с целью лечения или диагностики глазной болезни, которая включает полностью человеческий антигенсвязывающий фрагмент антитела, включающий SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4. Фармацевтическая композиция по настоящему изобретению, например, может состоять из 15% Н 2 О, 15% белого минерального масла, 70% аквафора (мазь) и 1 мг/мл Fab-фрагмента по настоящему изобретению. Антигенсвязывающие фрагменты по настоящему изобретению могут быть получены разными методами, известными в данной области, например, путем ферментативного расщепления папаином экстрагированных IgG или рекомбинантного продуцирования (временного или постоянного) в эукариотических или прокариотических экспрессирующих системах с последующей очисткой при помощи аффинной хроматографии. Основным преимуществом композиций по настоящему изобретению является то, что Fabфрагменты являются полностью человеческими, то есть кодированы полинуклеотидной последовательностью человека. Использование Fab-фрагментов in vivo для диагностики или лечения болезней, вызываемых вирусом простого герпеса, позволяет уменьшить вредные эффекты, возникающие вследствие иммунного ответа хозяина на пассивно введенные антитела, что является существенной проблемой при использовании моноклональных антител ксеногенного или химерного происхождения. Кроме того, Fab-фрагменты являются более предпочтительными по сравнению с полными IgG, так как они не подвержены воздействию Fc-рецепторов клеток и не осаждают антиген, благодаря чему Fabфрагменты характеризуются меньшей иммуногенностью и являются менее чувствительными к фагоцитозу. Fab-фрагменты быстрее выводятся из ткани, чем полные молекулы IgG.Fab-фрагменты также легче получить по сравнению с антителами IgG с точки зрения технологического процесса, затрат и времени, так как они могут быть продуцированы в экспрессирующих системах Е. coli.Fab-фрагменты являются устойчивыми и растворимыми (нерастворимость является признаком,способным усиливать иммуногенность). Указанные особенности позволяют достигать высоких уровней экспрессии и оптимальной устойчивости вещества, используемого для получения лекарственного средства, и самого лекарственного средства. Устойчивость Fab-фрагментов позволяет значительно увеличить время полужизни антитела в кровотоке. Альтернативный вариант осуществления настоящего изобретения также относится к одноцепочечным Fv-фрагментам (scFv). Как показано на фиг. 6, лекарственное средство АС-8, содержащее scFv-фрагмент, эффективно нейтрализует инфективность HSV при выполнении анализа уменьшения бляшкообразования. Вирусные титры, измеренные в образцах слезной пленки, полученных у мышей, которым вводили АС-8, свидетельствовали об эффективной нейтрализации HSV1 по сравнению с использованием неспецифического Fab-фрагмента. В результате местной инстилляции АС-8 проникает в интактный глаз и может быть обнаружен во внутриглазной жидкости и эндолимфе при помощи иммуногистохимического анализа и анализа ELISA,выполняемых через один час после инстилляции. После деэпителизации роговицы проникновение во внутриглазную жидкость и эндолимфу увеличивается. АС-8 можно визуализировать в клетках интактной роговицы, при этом можно предположить, что АС-8 проникает в глаза главным образом через склеру. После инъекции в субконъюнктиву АС-8 проникает в глаз так же, как после инстилляции в деэпителизированную роговицу. Однако инъекция в субконъюнктиву глаза после деэпителизации роговицы вызывает 5-кратное увеличение проникновения АС-8 в глаз. Иммуногистохимический анализ показывает, что АС-8, по-видимому, накапливается в дендритных субэпителиальных клетках, что указывает на его проникновение в роговицу. После местной инстилляции АС-8 был обнаружен в глазу в эффективной антивирусной концентрации. Примеры Пример 1. Вирусные титры, измеренные в образцах слезной пленки, полученных у мышей, которым вводили АС-8, свидетельствуют об эффективной нейтрализации HSV1 по сравнению с неспецифическим Fabфрагментом. В инфицированный глаз (правый) вводили 3 мкл каждого лекарственного средства в виде глазных капель. Введение (1 мг/мл АС-8 или неспецифического Fab-фрагмента) начинали в 8:00 часов, 10:00 часов, 12:00 часов, 14:00 часов, 16:00 часов, 18:00 часов, 20:00 часов, 22:00 часа на следующее утро после инфицирования (2-й день) и продолжали в течение 7 дней. Лечение в группах продолжали каждый день в указанном порядке и заканчивали в то же время, в которое было начато лечение. При каждой инстилляции мышей анестезировали изофлуораном (3-5%) или аналогичным средством. Вирусный штамм. Использовали глазной изолят CJ394, который вызывает кератит средней степени тяжести при незначительной смертности или отсутствии смертности. Животным инфицировали правый глаз, используя 1105 бляшкообразующих единиц (PFU). Процедура инфицирования. Инфицируемых мышей BALB/C анестезировали кетамином/ксилазином. Скарифицировали правую часть роговицы рядом с границей лимба, оставляя интактной центральную часть роговицы. На правую часть роговицы наносили 5 мкл каплю DMEM, содержащую инокулят, и дважды закрывали веко над роговицей, после чего животных возвращали в свои клетки. Вирусные титры. Образцы слезной пленки для титрования вируса в правом глазу брали в 1-й, 3-й,5-й, 7-й, 9-й, 11-й и 13-й день после инфицирования. Мышей кратковременно анестезировали для взятия образцов и возвращали в свои клетки. Образцы получали до начала лечения в указанные дни, для чего 10 мкл культуральной среды клеток наносили на роговицу, жидкость промывали 2-3 раза с помощью пипетки и переносили в 190 мкл среды для доставки в вирусологическую лабораторию. Затем образцы последовательно разводили и титровали на монослоях клеток Vero. Мышей анестезировали изофлуораном или аналогичным средством (3-5%) для взятия образцов слезной пленки. Результаты показаны на фиг. 3. Пример 2. АС-8 проникает в интактный глаз и может быть обнаружен во внутриглазной жидкости и эндолимфе при помощи иммуногистохимического анализа через один час после инстилляции. Данную серию экспериментов выполняли для оценки проникновения Fab-фрагмента АС-8 при местном введении. В частности, указанный эксперимент выполняли для оценки биораспределения Fab-4 022923 фрагмента при местном введении в нормальную роговицу крыс. Исследуемым веществом был Fab-фрагмент с концентрацией 10 мкг/мл в физиологическом растворе с фосфатным буфером (PBS). Указанное вещество вводили путем инстилляции или инъекции в субконъюнктиву обоих глаз. Испытуемое вещество вводили в следующем объеме: 50 мкл на одну инсталляцию при помощи пипетки,50 мкл на одну инъекцию в субконъюнктиву при помощи инсулинового шприца. В качестве экспериментальных животных были использованы крысы альбиносы Левиса (6-8 недель, 120-150 г, Charles River). Животных содержали в условиях, которые были одобрены и утверждены комитетом по вопросам этики Парижского университета и в документе ARVO, относящемся к использованию животных в экспериментальной офтальмологии. Крыс умерщвляли в конце экспериментов in vivo при помощи летальной инъекции пентобарбитала. При введении испытуемых средств крыс не анестезировали, но осторожно физически ограничивали подвижность в течение нескольких секунд для увеличения времени контактирования с роговицей. Каждая группа состояла из 3 крыс (6 глаз). Животным вводили испытуемое вещество следующим образом: Примечание 1: группе 2 вводили повышенную дозу одна капля в час не соответствует схеме введения. Примечание 2: группе 3 закапывали указанное вещество 5 раз в день в течение всего периода бодрствования, что соответствует схеме лечения. Взятие проб суммировано в следующей таблице: У двух крыс (4 глаза) в каждой группе (1-7) иссекали роговицу для исследования в виде плоского слоя на предметных стеклах. Глаза препарировали на льду. Было иссечено в общей сложности 28 роговиц, которые поместили в виде плоского слоя на 24-луночные планшеты и хранили при -80 С. Оба глаза третьей крысы в каждой группе (1-7, всего 14 образцов) помещали в ОСТ (соединение,Tissue-Tek, находящееся при оптимальной температуре иссечения) при -80 С. Все правые глаза использовали для получения криосрезов, все левые глаза хранили при -80 С для последующего использования в случае необходимости. Криосрезы использовали для иммуногистохимических (IHC) анализов с мечеными антителами для определения распределения Fab-фрагмента АС-8 в слоях роговицы и глазном яблоке. Замороженные криосрезы (10 мкм) обрабатывали следующим образом: фиксировали в течение 15 мин в 4% параформальдегиде при комнатной температуре,дважды промывали в течение 10 мин и в 1-кратном PBS при комнатной температуре,дважды промывали в течение 10 мин в 0,1% смеси PBS-тритона Х-100 при комнатной температуре,инкубировали в течение ночи при +4 С с антителом козы против IgG человека (Pierce31132, 1/50 в 0,1 смеси PBS-14 тритона Х-100) за исключением контрольного образца, который инкубировали только в 1-кратном PBS,трижды промывали в течение 10 мин в 0,1% смеси PBS-тритона Х-100 при комнатной температуре,инкубировали в течение 1 ч при +20 С в темноте с молекулярными зондами антитела осла противIgG козы (H+L) - флуоресцентный краситель Alexa 594 (красный) 1/50,дважды промывали в течение 10 мин в 1-кратном PBS при комнатной температуре,инкубировали в DAPI (4',6'-диамидино-2-фенилиндол) (синий) 1/5000 в 1-кратном PBS для мечения ядра в течение 5 мин в темноте при комнатной температуре,пять раз промывали в течение 5 мин в 1-кратном PBS при комнатной температуре,один раз промывали в течение 10 мин в дистиллированной воде при комнатной температуре и сушили,помещали на предметные стекла флуоресцентного микроскопа (Olympus) для исследования. Для достижения конфокальной локализации АС-8 на роговице иммуногистохимический анализ также выполняли на плоской роговице. Оптимизированный иммуногистохимический анализ выполняли в отношении 1/4 части роговиц. Чувствительность данного метода нельзя оптимизировать в достаточной степени при использовании данного вещества для получения четкого конфокального изображения. Полученные результаты нельзя интерпретировать достаточно точно. Именно поэтому для определения проникновения АС-8 были использованы срезы всего глаза. Ядра окрашивали в синий цвет красителем DAPI, при этом антитела против IgG человека, используемые для обнаружения АС-8, окрашивались в красный цвет (вторичное антитело, меченное флуоресцентным красителем Alexa 594). Группа 1 "H1" (0-й день: 1 инстилляция 10 мкг/мл АС-8, крыс умерщвляли через 1 ч). Не было обнаружено различий в флуоресценции между глазами, на которые воздействовали АС-8(группа 1) и контрольными глазами, на которые воздействовали PBS (группа 6), из чего следует, что через 1 ч после однократной инстилляции 10 мкг/мл АС-8 указанное вещество не проникло в ткани глаза. Группа 2 "Н 6" (0-й день: 5 инстилляций 10 мкг/мл АС-8, крыс умерщвляли через 1 ч). При закапывании АС-8 через каждый час в течение 5 ч и умерщвлении крыс через 1 ч после последней инстилляции АС-8 был обнаружен в периферической части роговицы в виде точек, соответствующих поглощению АС-8 дендритными клетками, локализованными в субэпителиальной строме. В центре роговицы также было обнаружено окрашивание в строме в виде диффузного сигнала, а также в виде очажковых сигналов. В цилиарном теле и сетчатке диффузное, но слабое окрашивание можно обнаружить при сравнении с крысами, которым вводили PBS (группа 6). Группа 3 "D4" (с 0-го дня до 3-го дня: 5 инстилляций АС-8 в день, 10 мкг/мл, 4-й день: 1 инстилляция, крыс умерщвляли через 1 ч). Иммуногистохимический анализ роговицы после введения АС-8 5 раз в день в течение 4 дней и одно введение на пятый день. Результаты данного анализа сравнивали с группой 6, которой вводили наполнитель. При закапывании АС-8 5 раз в день в течение 4 дней в концентрации 10 мкг/мл (фиг. 1 а-k) было обнаружено интенсивное проникновение АС-8 в периферическую часть роговицы (фиг. 1 е-h), а также в переднюю строму в центре роговицы (фиг. 1 а-d). Проникновение АС-8 было намного больше в периферической части роговицы, лимбе и цилиарном теле, чем в центре роговицы, из чего следует, что АС-8 проникает в глаз через склеру и затем распространяется в роговицу. Дендритные клетки здесь также, по-видимому, поглощают АС-8, так как дендритные клетки, положительно окрашенные АС-8, локализованы в субэпителиальной строме (фиг. 1d). В сетчатке АС-8 находится в астроцитах на внутренней границе сетчатки. Группа 4 "SCJ1" (0-й день: 1 инъекция АС-8 в субконъюнктиву, 10 мкг/мл, крыс умерщвляли через 1 ч). Одна инъекция АС-8 в субконъюнктиву вызывает очень сильное окрашивание АС-8 в переднем и заднем сегментах глаза. Полученные результаты сравнивали с группой 7, которой вводили наполнитель. В роговице АС-8 сконцентрирован в эпителии и строме в виде диффузного окрашивания, а также в клетках роговицы. В цилиарном теле АС-8, по-видимому, проникает и накапливается в эпителиальных клетках. В сетчатке АС-8 локализован в глиальных клетках (астроцитах и отростках глиальных клеток Мюллера). Сильный сигнал также обнаружен в пигментированных эпителиальных клетках сетчатки (клетки RPE). Группа 5 "SCJ6" (0-й день: 1 инъекция АС-8 в субконъюнктиву, 10 мкг/мл, крыс умерщвляли через 6 ч). В роговице АС-8, по-видимому, в основном частично остается в строме. В цилиарном теле флуоресцентный сигнал является более слабым по сравнению с группой 4, но лимб роговицы все еще остается окрашенным в данный период времени. В сетчатке сигнал АС-8 отсутствует в глиальных клетках и астроцитах. В пигментированных эпителиальных клетках сетчатки (клетки RPE) сигнал также является слабым. Полученные результаты сравнивали с группой 7, которой вводили наполнитель. В указанных экспериментах внутренние контрольные образцы, в которых отсутствовало первое антитело, были отрицательными и характеризовались очень ограниченным неспецифическим фоном в отличие от глаз, которые подвергали воздействию PBS, в которых наблюдался некоторый неспецифический фон. Результаты иммуногистохимического анализа образцов позволяют предположить, что АС-8 может быть обнаружен специфическими иммуногистохимическими методами. После инстилляции 10 мкг/мл АС-8 в нормальную роговицу антитело отсутствует в роговице или в любых тканях глаза через 1 ч после однократной инстилляции; присутствует в роговице после 5 инстилляций, при этом слабый сигнал обнаружен в цилиарном теле и сигнал не обнаружен в сетчатке; присутствует в большом количестве в роговице, цилиарном теле и сетчатке при закапывании 5 раз в день в течение 4 дней. При проникновении АС-8 в роговицу были обнаружены два типа окрашивания: одно диффузное окрашивание, локализованное в строме, и другое концентрированное окрашивание в субэпителиальных клетках роговицы (кератоциты или дендритные клетки). Так как АС-8 присутствует в клетках субэпителиальной стромы в нормальной роговице и в клетках всей стромы в деэпителизированной роговице (см. следующие примеры), то вполне вероятно, что АС-8 подвергается фагоцитозу в дендритных клетках. Через один час после однократной инъекции 10 мкг/мл АС-8 в субконъюнктиву антитело локализовано не только в роговице, но также присутствует в цилиарном теле, астроцитах и глиальных клетках сетчатки. При данном способе введения глубокие наружные слои сетчатки (пигментированные эпителиальные клетки сетчатки) также окрашиваются. Окрашивание является более сильным в периферической части роговицы, чем в центральной части, как это имеет место после инстилляции. Через 6 ч после однократной инъекции 10 мкг/мл АС-8 в субконъюнктиву антитело почти полностью отсутствует в глазу, оно остается в незначительном количестве в роговице и лимбе, но практически полностью отсутствует в цилиарном теле и сетчатке. В заключение следует отметить, что полученные результаты позволяют предположить, что АС-8 может проникать внутрь тканей глаза через интактную роговицу или смежный с ней лимб, и такое проникновение может быть обнаружено при концентрации АС-8, равной 10 мкг/мл. АС-8, по-видимому, проникает через склеру в лимб, что объясняет проникновение в сетчатку и сильное окрашивание периферической части роговицы. АС-8 поглощается клетками роговицы, которые соответствуют дендритным клеткам или кератоцитам. Способность АС-8 активировать дендритные клетки требует дальнейшего исследования. Пример 3. АС-8 проникает в интактный глаз и может быть обнаружен во внутриглазной жидкости и эндолим-7 022923 фе при помощи анализа ELISA, выполняемого через 1 ч после инстилляции. Шестьдесят (60) пигментированных крыс, относящихся к линии серых крыс, произвольно распределяли в десять (10) групп по шесть (6) животных в каждой группе. Животным (группы 1-8) местно вводили 10 мкл испытуемых веществ или наполнителей в оба глаза 5 раз в день. При введении в субконъюнктиву (группы 9 и 10) животным делали однократную инъекцию 50 мкл испытуемого вещества в оба глаза. В приведенной ниже таблице суммировано распределение животных в экспериментальной группе: В соответствующие периоды времени животных анестезировали. Брали пробы цельной крови для получения сыворотки. После эфтаназии из обоих глаз брали образцы внутриглазной жидкости (АН), эпителия роговицы (Cepi), стромы + эндотелия роговицы (Cstr+end),эндолимфы (V) и сетчатки (R) и группировали для каждого животного для выполнения анализов ELISA. Способ применения и введения. Животным в группах 1-8 испытуемое вещество или наполнители закапывали в оба глаза 5 раз по 10 мкл в течение дня (с 8:00 часов утра до 16:00 часов дня), используя соответствующую микропипетку. Животным в группах 9-10, находящимся под наркозом (внутримышечная инъекция 5 мг/кг ксилазина; 25 мг/кг кетамина), делали однократную инъекцию (50 мкл) в субконъюнктиву обоих глаз. В периоды времени, указанные в приведенной выше таблице, животных анестезировали при помощи внутримышечной инъекции смешанного раствора ромпуна (5 мг/кг ксилазина) и имальгена 1000(25 мг/кг кетамина). Непосредственно перед умерщвлением у животных брали примерно 2 мл крови при помощи сердечной пункции. 600 мкл сыворотки для каждого животного хранили при -80 С до выполнения анализаELISA. Животных умерщвляли путем инъекции чрезмерной дозы пентобарбитала в сердце. Сразу же после умерщвления из обоих глаз двух крыс быстро и осторожно удаляли внутриглазную жидкость (АН), эпителий роговицы (Cepi), строму + эндотелий роговицы (Cstr+end), эндолимфу (V) и сетчатку (R). Элементы обоих глаз группировали для каждого животного в каждой группе. Результаты введения АС-8 в разных концентрациях во внутриглазной жидкости и эндолимфе показаны на фиг. 4. Пример 4. После деэпителизации роговицы увеличивалось проникновение АС-8 во внутриглазную жидкость и эндолимфу. Данную серию экспериментов выполняли для оценки биораспределения Fab-фрагмента при местном введении в деэпителизированную роговицу крыс и на стадии реэпителизации роговицы. Указанный эксперимент позволил оценить проникновение Fab-фрагмента в роговицу во время рубцевания язвы роговицы в результате проникновения Fab-фрагмента АС-8 при местном введении. В качестве испытуемого вещества было использовано вышеописанное вещество, но концентрация указанного вещества была равна 100 мкг/мл. Были использованы такие же экспериментальные животные, что и в приведенном выше примере. Инстилляцию или инъекцию в субконъюнктиву производили в один глаз, а не в оба глаза. В 0-й день один глаз каждого животного деэпителизировали под общим наркозом (ксилазин + кетамин) и местной анестезией на калиброванном участке роговицы, используя калиброванный дерматом и скальпель. По этическим причинам модель язвы роговицы и последующее лечение были произведены только на одном глазу каждого животного. Противоположный глаз не должен подвергаться воздействию. Использовали 5 крыс (5 глаз, только правые глаза) в каждой группе. Животным вводили испытуемое вещество следующим образом: Взятие проб суммировано в нижеследующей таблице: Образцы внутриглазной жидкости и эндолимфы, сыворотки и сетчатки, предназначенные для анализа методом ELISA, были получены у 4 крыс (4 обработанных глаза). Образцы сыворотки (примерно 12 мл) были получены у 5 крыс в каждой из групп 1-8 непосредственно перед умерщвлением. В общей сложности было получено 32 образца внутриглазной жидкости (примерно 10-20 мкл) и эндолимфы-80 С в емкостях Eppendorf с завинчивающимися крышками. Оба глаза пятой крысы в каждой группе (всего 16 образцов) фиксировали и готовили для получения криосрезов. Криосрезы использовали для иммуногистохимических (IHC) анализов с мечеными антителами для определения распределения Fab-фрагментов АС-8 в слоях роговицы и глазном яблоке. Замороженные криосрезы (10 мкм) обрабатывали следующим образом: фиксировали в течение 15 мин в 4% параформальдегиде при комнатной температуре,дважды промывали в течение 10 мин в 1-кратном PBS при комнатной температуре,дважды промывали в течение 10 мин в 0,1% смеси PBS-тритона Х-100 при комнатной температуре,инкубировали в течение ночи при +4 С с антителом козы против IgG человека (Pierce31132, 1/50 в 0,1% смеси PBS-тритона Х-100) за исключением контрольного образца, который инкубировали только в 1-кратном PBS,трижды промывали в течение 10 мин в 0,1% смеси PBS-тритона Х-100 при комнатной температуре,инкубировали в течение 1 ч при +20 С в темноте с молекулярными зондами антитела осла противIgG козы (H+L) флуоресцентный краситель Alexa 594 (красный) 1/50,дважды промывали в течение 10 мин в 1-кратном PBS при комнатной температуре,инкубировали в DAPI (4',6'-диамидино-2-фенилиндол) (синий) 1/5000 в 1-кратном PBS для мечения ядра,выдерживали в течение 5 мин в темноте при комнатной температуре,промывали 5 раз в течение 5 мин в 1-кратном PBS при комнатной температуре,промывали один раз в течение 10 мин в дистиллированной воде при комнатной температуре и сушили,помещали на предметные стекла флуоресцентного микроскопа (Olympus) для исследования. Ядра окрашивали в синий цвет красителем DAPI, при этом антитела против IgG человека, используемые для обнаружения АС-8, окрашивались в красный цвет (вторичное антитело, меченное флуоресцентным красителем Alexa 594). Группа 1 "Н 5" (0-й день: 5 инстилляций 100 мкг/мл АС-8, крыс умерщвляли через 1 ч после последней инстилляции. АС-8 отчетливо обнаружен в центральной части (особенно на стыке между эпителизированными и деэпителизированными участками) и периферической части роговицы: АС-8 концентрируется в субэпителиальном пространстве на границе язвы. Интересно отметить, что проникновение АС-8 также обнаружено в субэпителиальном пространстве периферической части роговицы. В эндотелии роговицы АС-8 не обнаружен в центральной части и обнаружен в незначительном количестве в периферической части. Иммуногистохимический анализ контрольной роговицы, обработанной PBS, показал наличие очень слабого фона. В лимбе АС-8 локализован в цилиарном теле, а также в радужной оболочке. Следует отметить, что АС-8 также обнаружен в эндотелиальных клетках сосудов лимба. Такое распределение АС-8 на деэпителизированной роговице свидетельствует о том, что проникновение Fab-фрагментов происходит главным образом через лимб и склеру, а не прямо через роговицу. В группе 1 обнаружено очень слабое мечение АС-8 в сетчатке. Группа 2 "Н 29" (0-й день: 5 инстилляций 100 мкг/мл АС-8, крыс умерщвляли через 24 ч после последней инстилляции). В группе 2 эпителий центральной части роговицы почти полностью восстановлен во всех исследованных срезах (фиг. 2 а-j) при наличии некоторых аномалий на поверхности восстановленного эпителия(белый квадрат на фиг. 2 а). АС-8 сохраняется в клетках субэпителиального пространства. В периферической части роговицы (фиг. 2 е-j АС-8 сконцентрирован в эпителии, субэпителиальном пространстве(стрелки на фиг. 2i) и аккумулирован в эндотелии (стрелки на фиг. 2g и 2j). Через 24 ч после 5 инстилляций АС-8 проник с поверхности роговицы в более глубокий слой роговицы вплоть до эндотелия. АС-8 также отчетливо виден в радужной оболочке в указанный период времени (стрелки на фиг. 2f и 2h). Инфильтрующие клетки, содержащие АС-8, локализованы в субэпителиальном пространстве роговицы (стрелки на фиг. 2f и 2h, сильное увеличение на фиг. 2 с, стрелки на фиг. 2l). Указанные клетки могут соответствовать нейтрофильным клеткам, макрофагам или дендритным клеткам. В лимбе и цилиарном теле АС-8 проникает через эпителий и локализован в субэпителиальной области и цилиарном теле. В группе 2 АС-8 обнаружен в периферической части сетчатки и не обнаружен в центре задней части сетчатки. При сравнении с контрольной группой 7 установлено, что АС-8 локализован в нуклеарных слоях периферической части сетчатки. Группа 3 "D2" (с 0-го дня до 1-го дня: 5 инстилляций в день 100 мкг/мл АС-8, 2-й день: 1 инстилляция, крыс умерщвляли через 1 ч после инстилляций). В группе 3 эпителий полностью восстановлен, при этом инстилляцию продолжали в течение всего периода рубцевания. АС-8 обнаружен в большом количестве в эпителиальных клетках роговицы, в стромальных клетках и незначительно в эндотелии по сравнению с контрольной группой, которой вводили наполнитель. Исследование в группе 3 лимба и передней части сетчатки показывает, что АС-8 проник глубоко в цилиарное тело по сравнению с контрольной группой, которой вводили наполнитель. АС-8 обнаружен в эпителии цилиарного тела. В группе 3 значительное окрашивание АС-8 обнаружено в периферической части и не обнаружено в задней (центральной) части сетчатки. Интересно отметить, что АС-8, по-видимому, распространился во все слои сетчатки, а также в слой клеток RPE. Сравнение с проникновением АС-8 с интактную роговицу (см. выше) позволяет предположить, что язва в эпителии увеличивает проникновение АС-8 в сетчатку. Группа 4 "SCJ1" (0-й день: 1 инъекция раствора АС-8, 100 мкг/мл, крыс умерщвляли через 1 ч после инъекции), группа 5 "SCJ6" (0-й день: 1 инъекция раствора АС-8, 100 мкг/мл, крыс умерщвляли через 6 ч после инъекции), группа 6 "SCJ24" (0-й день: 1 инъекция раствора АС-8, 100 мкг/мл, крыс умерщвляли через 24 ч после инъекции). Однократная инъекция АС-8 в область субконъюнктивы обеспечивает эффективное проникновение АС-8 в периферическую часть роговицы через 1, 6 и 24 ч. Проникновение АС-8 после инъекции в субконъюнктиву является более сильным в периферической части роговицы, чем в центральной части роговицы, где АС-8 находится в небольшом количестве во все периоды времени даже в изъязвленной роговице (группа 4 и группа 5). Восстановление целостности эпителия не влияет на распределение АС-8 во все слои роговицы и в радужную оболочку через 24 ч (группа 6). АС-8 гомогенно распределен в лимбе и цилиарном теле, как было обнаружено в группах 4 и 5, при наличии дополнительной концентрации АС-8 в субэпителиальной области лимба в группе 6. Инъекция в субконъюнктиву также обеспечивает эффективное проникновение АС-8 в глаз с язвой роговицы не только в слои периферической части сетчатки, но также, хотя в гораздо меньшей степени, в заднюю область сетчатки через 1 ч (группа 4), через 6 ч (группа 5) и через 24 ч (группа 6). Через 24 ч АС-8 сконцентрирован главным образом в периферической части сетчатки (группа 6). В сетчатке АС-8 обнаружен в виде пятнистого окрашивания в клетках сетчатки, при этом АС-8 распространен неравномерно во всей сетчатке. Результаты иммуногистохимического анализа суммированы в следующей таблице: В процессе реэпителизации инстилляция АС-8 не замедляет рубцевания роговицы по сравнению с контрольной группой и не усиливает в значительной степени любую клиническую или гистологическую воспалительную реакцию. Проникновение АС-8 в роговицу (эпителий, строму и эндотелий) обнаружено главным образом в периферической части роговицы и лимбе. АС-8 обнаружен в клетках роговицы (эпителиальные, эндотелиальные и стромальные клетки), а также в субэпителиальных инфильтрующих клетках, что может быть связано с локальной иммунологической реакцией на инъекцию АС-8 (АС-8 распознается как чужеродный человеческий белок). АС-8 позже проникает также в радужную оболочку, цилиарное тело и периферическую часть сетчатки, что позволяет предположить наличие диффузии от наружных к внутренним тканям глаза. Интересно отметить, что АС-8 также обнаружен в эндотелиальных клетках сосудов, из чего следует, что потенциально может происходить системная диффузия АС-8. Локализация АС-8 в разных областях роговицы ясно показывает, что АС-8 проникает главным образом через склеру даже при наличии язвы в центральной части эпителия. При инстилляции АС-8 может проникать в роговицу на всех стадиях герпетического кератита, даже в процессе восстановления эпителия роговицы. Инъекция в субконъюнктиву характеризуется такой же эффективностью, что и повторные инстилляции АС-8 для направленного воздействия на роговицу. АС-8, по-видимому, проникает в роговицу через склеру как в случае инстилляции, так и в случае инъекции в субконъюнктиву. Инъекция в субконъюнктиву является более эффективным способом введения по сравнению с повторными инстилляциями для направленного воздействия на цилиарное тело и сетчатку. Результаты анализа ELISA, полученные при исследовании внутриглазной жидкости и эндолимфы деэпителизированной роговицы, суммированы на фиг. 5. Как показано на данной фигуре, количественное определение АС-8 во внутриглазной жидкости и эндолимфе свидетельствует об эффективном проникновении в глаз. В заключение следует отметить, что при исследовании распределения лекарственного средства по настоящему изобретению на изъязвленной роговице установлено, что 5 инстилляций в день не оказывают токсического воздействия на деэпителизированную роговицу. После 5 инстилляций в день АС-8 сохраняется в клетках роговицы в течение 24 ч и проникает в глубокие слои роговицы, а также в радужную оболочку и цилиарное тело. АС-8 проникает главным образом через лимб и склеру, из чего следует, что АС-8 может проникать в роговицу на всех стадиях герпетического кератита, даже в процессе восстановления эпителия. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,включающего последовательность, которая на 90% гомологична SEQ ID NO: 3 или SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызваннойHSV, при местном введении. 2. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,состоящего из SEQ ID NO: 3 или SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении. 3. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,включающего последовательность SEQ ID NO: 3 и SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении. 4. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,состоящего из SEQ ID NO: 3 и SEQ ID NO: 4, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении. 5. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,включающего последовательность SEQ ID NO: 1 и SEQ ID NO: 2, для приготовления лекарственного средства, предназначенного для лечения глазной болезни при местном введении. 6. Применение полностью человеческого антигенсвязывающего фрагмента антитела против HSV,состоящего из SEQ ID NO: 1 и SEQ ID NO: 2, для приготовления лекарственного средства, предназначенного для лечения глазной болезни, вызванной HSV, при местном введении. 7. Применение по любому из предшествующих пунктов, отличающееся тем, что указанное антитело нейтрализует HSV1 и HSV2. 8. Применение по любому из предшествующих пунктов, отличающееся тем, что поверхностный антиген вируса, с которым связывается указанное антитело, представляет собой gD. 9. Применение по любому из предшествующих пунктов, отличающееся тем, что лекарственное средство получено с использованием усилителя ретенции антигенсвязывающего фрагмента в глазу. 10. Применение по п.9, отличающееся тем, что усилитель ретенции выбран из группы, состоящей из гиалуроната натрия, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы,гидроксипропилметилцеллюлозы, поливинилового спирта, ксантановой камеди, геллановой камеди, хитозана, полимолочной кислоты и их производных. 11. Применение по любому из предшествующих пунктов, отличающееся тем, что лекарственное средство имеет форму глазных капель, мази, геля, глазного крема. 12. Применение по любому из предшествующих пунктов, отличающееся тем, что глазная болезнь,вызванная HSV, представляет собой глазной кератит, блефарит, конъюнктивит, блефароконъюнктивит,язвы. 13. Применение по любому из предшествующих пунктов, отличающееся тем, что полностью человеческий антигенсвязывающий фрагмент имеет связанную с ним детектируемую метку. 14. Фармацевтическая композиция для местного введения в глаз, предназначенная для лечения глазной болезни, вызванной HSV, которая включает эффективное количество полностью человеческого антигенсвязывающего фрагмента антитела, охарактеризованного в любом из предшествующих пунктов.
МПК / Метки
МПК: A61K 39/395, C07K 16/08, A61P 27/02
Метки: антитела, диагностики, глазных, лечения, применение, антигенсвязывающие, фрагменты, болезней
Код ссылки
<a href="https://eas.patents.su/23-22923-antigensvyazyvayushhie-fragmenty-antitela-i-ih-primenenie-dlya-lecheniya-ili-diagnostiki-glaznyh-boleznejj.html" rel="bookmark" title="База патентов Евразийского Союза">Антигенсвязывающие фрагменты антитела и их применение для лечения или диагностики глазных болезней</a>
Предыдущий патент: Способ для секвестирования двуокиси углерода из топлива на основе колошникового газа
Следующий патент: Твердая форма {3-[5-(4-хлорфенил)-1н-пирролo[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амида пропан-1-сульфоновой кислоты и ее применение
Случайный патент: Способ лечения устойчивой к медикаментам инфекции mycobacterium tuberculosis