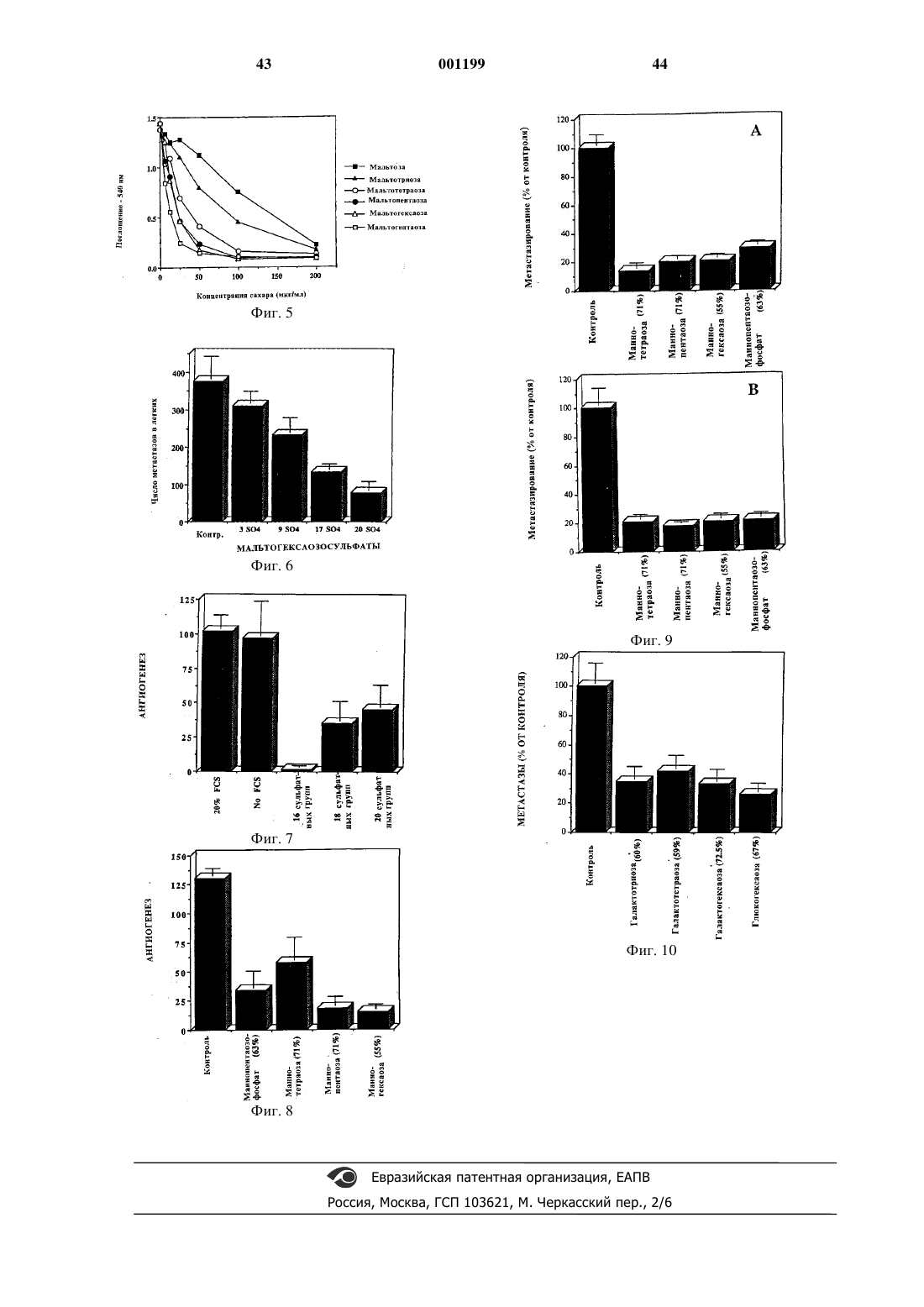
Сульфатированный олигосахарид, его применение для лечения теплокровных животных и фармацевтическая композиция на его основе
Формула / Реферат
1. Сульфатированный олигосахарид, имеющий общую формулу I
R1-(Rx)n-R2 (I)
где R1 и R2 и каждый Rx обозначают моносахаридную единицу и могут быть одинаковыми или различными, причем соседние моносахаридные единицы связаны гликозидными связями 1R 2, 1R 3, 1R 4 и/или 1R 6, и n является целым числом от 1 до 6; при условии, что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки.
2. Сульфатированный олигосахарид по п.1, отличающийся тем, что n является целым числом от 1 дo 4, предпочтительно 3 или 4.
3. Сульфатированный олигосахарид по п.1 или 2, отличающийся тем, что моносахаридная единица является гексозой, выбранной из группы, состоящей из фруктозы, маннозы, альтрозы, аллозы, талозы, галактозы, идозы и гулозы.
4. Сульфатированный олигосахарид по п.1, отличающийся тем, что олигосахарид имеет общую формулу II
Ry-(Ry)n-Ry (II)
где каждая группа Ry является одной и той же и каждая представляет собой моносахаридную единицу, причем соседние моносахаридные единицы связаны гликозидными связями 1R3, 1R4 и/или 1R6, и n является целым числом от 1 до 6;
при условии, что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки.
5. Сульфатированный олигосахарид по п.4, отличающийся тем, что n является целым числом от 1 до 4, предпочтительно 3 или 4.
6. Сульфатированный олигосахарид по п.4 или 5, отличающийся тем, что Ry представляет собой моносахаридную единицу, которая является гексозой, выбранной из группы, состоящей из маннозы, альтрозы, аллозы, талозы, галактозы, идозы и гулозы.
7. Сульфатированный олигосахарид по п.6, отличающийся тем, что Ry представляет собой маннозу или галактозу.
8. Сульфатированный олигосахарид по п.1 или 4, отличающийся тем, что олигосахарид представляет собой природно-встречающийся олигосахарид.
9. Сульфатированный олигосахарид по п.8, отличающийся тем, что олигосахарид выбран из раффинозы и стахиозы.
10. Сульфатированный олигосахарид по п.1 или 4, отличающийся тем, что олигосахарид получен ферментативной или химической деградацией природно-встречающегося полисахарида.
11. Сульфатированный олигосахарид по п.10, отличающийся тем, что олигосахарид представляет собой соединение, произведенное из хондроитина или эксoполисахарида, полученных из диплоидных дрожжей Pichia holstii.
12. Сульфатированный олигосахарид по п.11, отличающийся тем, что олигосахарид выбран из хондроитин-тетра-, гекса- и октасахаридов.
13. Сульфатированный олигосахарид по п.11, отличающийся тем, что олигосахарид является маннопентаозофосфатом из дрожжей Pichia holstii.
14. Способ антиангиогенного, антиметастатического и/или противовоспалительного лечения человека или другого теплокровного больного животного, нуждающегося в таком лечении, включающий в себя введение пациенту эффективного количества, по меньшей мере, одного сульфатированного олигосахарида согласно пп.1-13.
15. Способ по п.14, отличающийся тем, что включает в себя лечение ангиогенез-зависимого заболевания, в том числе ангиогенеза, связанного с ростом твердых опухолей, пролиферативными ретинопатиями и ревматоидным артритом.
16. Способ по п.14, отличающийся тем, что включает в себя лечение воспалительных заболеваний и состояний, в которых ингибирующая гепараназу активность ингибирует инфильтрацию лейкоцитов, в том числе хронических воспалительных заболеваний, таких как ревматоидный артрит, множественный склероз, инсулин-зависимый сахарный диабет, такие заболевания, как язвенные колиты и воспалительное заболевание пищеварительного тракта (болезнь Хрона), отторжение трансплантата и хроническая астма.
17. Применение сульфатированного олигосахарида по любому из пп.1-13 в качестве антиангиогенного, антиметастатического и/или противовоспалительного средства в лечении больного теплокровного животного, в том числе человека.
18. Применение по п.17, отличающееся тем, что включает в себя лечение ангиогенез-зависимого заболевания, в том числе ангиогенеза, связанного с ростом твердых опухолей, пролифе-ративными ретинопатиями и ревматоидным артритом.
19. Применение по п.17, отличающееся тем, что включает в себя лечение воспалительных заболеваний и состояний, в которых ингибирующая гепараназу активность ингибирует инфильтрацию лейкоцитов, в том числе хронических воспалительных заболеваний, таких как ревматоидный артрит, множественный склероз, инсулин-зависимый сахарный диабет, такие заболевания как язвенные колиты и воспалительное заболевание пищеварительного тракта (болезнь Хрона), отторжение трансплантата и хроническая астма.
20. Фармацевтическая или ветеринарная композиция для антиангиогенного, антиметастатического и/или противовоспалительного лечения, содержащая, по меньшей мере, один сульфатированный олигосахарид согласно любому из пп.1-13 вместе с его фармацевтически приемлемым и приемлемым в ветеринарии носителем или разбавителем.
21. Лекарственное средство для антиангиогенного, антиметастатического и/или противовоспалительного лечения человека или другого больного теплокровного животного, отличающееся тем, что содержит, по меньшей мере, один сульфатированный олигосахарид по любому из пп.1-13.
Текст
1 Область изобретения Данное изобретение относится к сульфатированным олигосахаридам, их получению и применению в качестве антиангиогенных, антиметастатических и/или противовоспалительных агентов. Предпосылки изобретения Гепарансульфаты относятся к глюкозаминогликановому классу полисахаридов. Они присутствуют в большинстве многоклеточных животных и имеют повсеместное распределение,будучи экспрессированными на поверхности клеток и во внеклеточных матриксах (ЕСМ) большинства тканей (1, 2). Гепарансульфаты обычно существуют в виде протеогликанов, и значительный прогресс был достигнут в секвенировании и клонировании полипептидного ядра молекулы. До сих пор, например, на клеточной поверхности были идентифицированы,по меньшей мере, восемь различных полипептидов ядра гепарансульфатпротеогликана(HSPG). Вначале считали, что HPSGs в большой степени играют структурную роль на поверхности клеток и в ЕСМ. Однако цепи гепарансульфата обнаруживают значительное структурное разнообразие (2, 4), которое предполагает, что они могут обеспечивать важную информацию передачи сигнала для многих биологических процессов. Таким образом, хотя цепи гепарансульфата исходно синтезируются в виде простого чередующегося повтора глюкуронозильных иN-ацетилглюкозаминильных остатков, соединенных связями 1-4 и 1-4, имеются многие дополнительные модификации. Этот полисахарид N-деацетилируется и N-сульфатируется и затем подвергается С 5-эпимеризации глюкуронозильных единиц до идуронозильных единиц и различным O-сульфатированиям уронозильных и глюкозаминильных остатков. Вариабельность этих модификаций допускает до тридцати различных дисахаридных последовательностей,которые, при размещении в различном порядке вдоль цепи гепарансульфата, могут теоретически приводить к огромному числу различных структур гепарансульфата. В этом отношении,антикоагулянтный полисахарид гепарин, присутствующий только в гранулах мастоцитов,представляет собой крайнюю форму гепарансульфата, в которой эпимеризация и сульфатирование были максимальными. Большинство гепарансульфатов содержат короткие отрезки высокосульфатированных остатков, соединенных относительно длинными отрезками несульфатированных единиц. В настоящее время имеется ясное доказательство того, что гепарансульфаты играют решающую роль в широком диапазоне биологических процессов (2-4). В частности, они могут функционировать в качестве лигандов для адгезионных молекул, участвующих в межклеточных взаимодействиях (5, 6), участвовать во 2 взаимодействиях клетка-ЕСМ (5, 6) и действовать в качестве рецепторов поверхности клеток для факторов роста, таких как основной фибробластный фактор роста (bFGF) (7, 8) и сосудистый эндотелиальный фактор роста (VEGF)(9). HPSG являются также ключевым компонентом базальной мембраны, которая представляет собой основной барьер для миграции клеток(10). Барьеры базальной мембраны могут быть разорваны только в том случае, когда клетки запускают диапазон расщепляющих ферментов(11), включающих в себя эндогликозидазу, называемую гепараназой, которая расщепляет цепи гепарансульфата (12, 13). Было показано, что многие биологические процессы, в которых участвуют гепарансульфаты, включают в себя узнавание уникальных гепарансульфатных структур, причем решающее значение имеет положение сульфатов в полисахаридной цепи (3). Например, было показано,что определенные гепарансульфатные последовательности узнаются кислым и щелочным FGF(14-16) и расщепляются гепараназами. На основании этих наблюдений, целью авторов данного изобретения был синтез сульфатированных олигосахаридов, которые блокируют узнавание гепарансульфатов факторами роста и ингибируют расщепление гепарансульфатов гепараназами. В случае блокирования факторов роста, имели в виду, что низкомолекулярные миметики гепарансульфата должны быть особенно эффективными, так как в настоящее время считают, что гепарансульфаты поверхности клеток медиируют сшивание факторов роста, связанных с их рецепторами (17). Кроме того, сульфатированные олигосахариды должны быть эффективными ингибиторами гепараназы, действуя в качестве нерасщепляемых субстратов этого фермента. Сульфатированные олигосахариды с ингибиторной активностью в отношении факторов роста находят ряд клинических применений. Факторы роста, связывающие гепарин/гепарансульфат, такие как bFGF и VEGF, являются сильными индукторами ангиогенеза (развития кровеносных сосудов) (18). У взрослых развитие кровеносных сосудов является относительно редким событием, за исключением ангиогенеза при заживлении ран. Однако имеется ряд "ангиогенез-зависимых заболеваний" у взрослых,при которых развитие кровеносных сосудов имеет решающее значение (18-20). Наиболее важным из них является развитие кровеносных сосудов, связанное с ростом твердых опухолей,пролиферативными ретинопатиями и ревматоидным артритом. сульфатированные олигосахариды, блокирующие действие ключевых ангиогенных факторов роста, таких как bFGF иVEGF, могли бы быть особенно ценными для лечения этих ангиогенез-зависимых заболеваний. 3 Подобным образом, сульфатированные олигосахариды, которые ингибируют действие гепараназы, находят ряд клинических приложений. Субэндотелиальная базальная мембрана представляет собой основной физический барьер для прохождения эндотелиальных клеток,опухолевых клеток и лейкоцитов через стенку кровеносного сосуда. Фермент гепараназы, в сочетании с рядом протеолитических ферментов(например, плазмином, металлопротеиназами матрикса), играет существенную роль в деградации базальной мембраны проникающими клетками (11-13, 21). Таким образом, путем предотвращения деградации базальной мембраны сульфатированные олигосахариды с ингибирующей гепараназу активностью должны проявлять антиметастатическую и противовоспалительную активность и, кроме того, могут ингибировать ранние стадии ангиогенеза. Использование сульфатированных олигосахаридов, которые одновременно ингибируют действие ангиогенного фактора роста и фермента гепараназы,были бы предпочтительными во многих клинических ситуациях, например, в лечении высокометастатических твердых опухолей и ревматоидного артрита. Предшествующая Международная патентная заявкаPCT/AU 88/00017 (PublicationWO 88/05301) описывает использование сульфатированных полисахаридов, таких как гепарин и модифицированный гепарин, фукоидин,пентозансульфат, декстрансульфат и каррагенин лямбда, которые блокируют или ингибируют гепараназную активность, в антиметастатическом и/или противовоспалительном лечении больного животного или человека. В исследовании, приведшем к данному изобретению, авторы изобретения получили сульфатированные олигосахариды с использованием либо встречающихся в природе олигосахаридов, либо полностью синтетических олигосахаридов, включающих в себя гексозосодержащие гомополимеры. Было показано, что некоторые из этих соединений являются сильными ингибиторами ангиогенеза человека, метастазирования опухолей и воспаления. Полученные данные согласуются с тем, что сульфатированные олигосахариды проявляют их биологическое действие путем ингибирования действия ангиогенного фактора роста и/или функции гепараназы, и были получены некоторые сульфатированные олигосахариды, которые являются сильными ингибиторами как ангиогенеза, так и активности гепараназы. Сущность изобретения Согласно одному аспекту, данное изобретение обеспечивает сульфатированные олигосахариды, имеющие общую формулу I:(I) где R1 и R2 и каждый Rx означают моносахаридную единицу, причем все они могут быть одинаковыми или различными, и смежные моноса 001199 4 харидные единицы соединены гликозидными связями 12, 13, 14 и/или 16; и n является целым числом от 1 до 6; при условии, что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки. Сульфатированные олигосахариды согласно данному изобретению имеют в основе полимеры моносахаридных единиц, которые могут быть соединены гликозидными связями 12,13, 14 и/или 16 и которые могут состоять из 3-8 моносахаридных единиц. Предпочтительно олигосахариды состоят из 3-6 моносахаридных единиц (т.е. n является 1-4), более предпочтительно из 5-6 моносахаридных единиц (n является 3-4). Эти полимеры могут быть гомополимерами, содержащими только один тип моносахаридной единицы, или гетерополимерами, содержащими два или более различных типов моносахаридных единиц. Моносахаридные единицы, которые соединены вместе с образованием олигосахаридов, предпочтительно являются гексозами и могут представлять собой либо фуранозы, такие как фруктоза, либо пиранозы, такие как манноза, альтроза, аллоза, талоза, галактоза, идоза или гулоза. Гексозы могут быть либо в D-, либо в Lконфигурации. В одном конкретном аспекте данного изобретения обеспечены новые синтетические олигосахариды общей формулы II:(II) где каждая группа Ry одна и та же и каждая означает моносахаридную единицу, причем соседние моносахаридные единицы соединены гликозидными связями 13, 14 и/или 16; иn является целым числом от 1 до 6; при условии,что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки. В этом конкретном аспекте данное изобретение обеспечивает также сульфатированные олигосахариды, в которых олигосахарид имеет общую формулу II, приведенную выше. Предпочтительно, в гомополимерных олигосахаридах формулы II моносахаридная единица является гексозой, такой как манноза,альтроза, аллоза, талоза, галактоза, идоза или гулоза. Также предпочтительно в этих олигосахаридах n является 1-4, более предпочтительно 3-4. Олигосахариды общих формул I и II включают в себя также соединения, в которых моносахаридные единицы являются производными, в частности, фосфатными производными, ацетилпроизводными или иными эфирными производными моносахаридов. В общем, сульфатированные олигосахариды данного изобретения могут быть получены сульфатированием олигосахаридов известнымиper se способами в данной области с образованием их соответствующих О-сульфатированных производных. Пригодные для этого способы 5 сульфатирования приведены в качестве примеров ниже. Олигосахариды, которые должны быть сульфатированы, могут быть природновстречающимися продуктами, в том числе природно-встречающимися олигосахаридами как таковыми (например, раффинозой и стахиозой),а также олигосахаридами, полученными ферментативной или химической деградацией природно-встречающихся полисахаридов (например, мальтотетраозой, мальтопентаозой и мальтогексаозой; глюкотриозой, глюкотетраозой и глюкопентаозой; хондроитин-тетра-, гекса- и октасахаридами; и маннопентаозофосфатом из дрожжей Pichia holstii). Как описано ранее, было показано, что сульфатированные олигосахариды, входящие в объем данного изобретения, проявляют ингибирующую гепараназу активность и/или ингибирующую фактор роста активность, и поэтому еще в одном аспекте данное изобретение относится к применению сульфатированного олигосахарида, описанного выше, в качестве антиангиогенного, антиметастатического и/или противовоспалительного агента в лечении теплокровного больного животного (в том числе человека). Таким образом, данное изобретение относится к способу антиангиогенного, антиметастатического и/или противовоспалительного лечения больного человека или иного теплокровного животного, нуждающегося в таком лечении,предусматривающем введение пациенту эффективного количества, по меньшей мере, одного сульфатированного олигосахарида, описанного выше. Активный компонент вводят в терапевтически эффективных количествах. Терапевтически эффективным количеством является количество, необходимое для достижения, по меньшей мере, частичного желаемого действия или для задержки наступления, ингибирования прогрессирования или полного прекращения наступления или прогрессирования конкретного подвергнутого лечению состояния. Такие количества будут зависеть, конечно, от конкретного подвергаемого лечению состояния, тяжести этого состояния и индивидуальных параметров пациента, в том числе, от возраста, физического состояния, размера, веса и сопутствующего лечения. Эти факторы хорошо известны специалистам с обычной квалификацией в этой области и могут быть определены обычным экспериментированием. Как правило, предпочтительно использовать максимальную дозу, т.е. самую высокую безопасную дозу по здравой медицинской оценке. Специалистам с обычной квалификацией в данной области, однако, понятно, что может вводиться более низкая или переносимая доза по медицинским показаниям, физиологическим причинам или фактически по любым иным причинам. 6 Данное изобретение распространяется также на применение в производстве медикамента для антиангиогенного, антиметастатического и/или противовоспалительного лечения больного человека или другого теплокровного животного, по меньшей мере, одного сульфатированного олигосахарида, описанного выше. Кроме того, данное изобретение обеспечивает фармацевтическую или ветеринарную композицию для антиангиогенного, антиметастатического и/или противовоспалительного лечения,которая содержит, по меньшей мере, один сульфатированный олигосахарид, описанный выше,вместе с его фармацевтически приемлемым или приемлемым в ветеринарии носителем или разбавителем. Приготовление таких терапевтических композиций хорошо известно специалистам в данной области. Пригодные фармацевтически приемлемые или приемлемые в ветеринарии носители и/или разбавители включают в себя все любые общепринятые растворители, дисперсионные среды, наполнители, твердые носители, водные растворы, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие всасывание агенты и т.п. Использование таких сред и агентов для фармацевтически активных и активных в области ветеринарии веществ хорошо известно в данной области и описано, например, в Remington'sPharmaceutical Sciences, 18th Edition, Mack Publishing Company, Pennsylvania, USA. За исключением случаев, когда какие-либо общепринятые среды или агент несовместимы с активньм ингредиентом, рассматривается использование их в фармацевтических и ветеринарных композициях данного изобретения. В композиции могут быть также включены дополнительные активные ингредиенты. Особенно выгодно готовить композиции в форме стандартных доз для облегчения введения и однородности дозы. Формой стандартной дозы здесь называют физически отдельные единицы, пригодные в качестве унифицированных доз для человека или животных, проходящих лечение; причем каждая стандартная единица содержит заданное количество активного ингредиента, рассчитанное для получения желаемого терапевтического действия, в соединении с требующимся фармацевтическим или ветеринарным носителем и/или разбавителем. Спецификации для новых форм стандартных доз данного изобретения диктуются (а) уникальными характеристиками активного ингредиента и конкретным терапевтическим эффектом, который должен быть достигнут, и (b) ограничениями, присущими способу компаундирования такого активного ингредиента для конкретного лечения, и зависят от них. Сульфатированные олигосахариды данного изобретения могут быть использованы в лечении ангиогенез-зависимых заболеваний, свя 7 занных с ростом твердых опухолей, пролиферативными ретинопатиями и ревматоидным артритом, а также в лечении противовоспалительных заболеваний и состояний, в которых ингибирующая гепараназу активность сульфатированных олигосахаридов была бы особенно полезной в ингибировании инфильтрации лейкоцитов, в том числе хронических воспалительных заболеваний, в которых инфильтрация лейкоцитов является ключевым элементом, таких как ревматоидный артрит, множественный склероз, инсулин-зависимый сахарный диабет,воспалительные заболевания пищеварительного тракта, такие как язвенный колит и болезнь Хрона, отторжение трансплантата и хроническая астма. Подробное описание изобретение Как описано в общем выше, данное изобретение относится к сульфатированным олигосахаридам и их использованию в качестве антиангиогенных, антиметастатических и/или противовоспалительных средств. Некоторые олигосахариды могут быть получены из природных источников для последующей сульфатации, однако, крайне желательным является простой способ синтеза олигосахаридов с определенной длиной цепи и определенной стереохимией. Данное изобретение обеспечивает усовершенствованный способ синтеза и выделения олигомеров гексозных сахаров из простых исходных материалов с высокими выходами, где сахарные мономеры этих олигомеров соединены связью 13, 14 и/или 16. Способ получения олигомеров гексозныхcахаров находится в резком противоречии со способом, которым такие сахарные олигомеры получали с хорошими выходами прежде, причем степень олигомеризации легко регулируется, и продукты, полученные этим способом, являются гомологичными линейными олигомерами, которые можно легко выделить и очистить при помощи простых хроматографических способов. В научной и патентной литературе можно найти много примеров получения сахарных полимеров и олигомеров. Например, в обычно используемом способе немодифицированный сахарный мономер, один или в присутствии растворителя, может быть нагрет в присутствии катализатора с получением разветвленных и линейных полимерных продуктов с различными и иногда трудно определяемыми химическими связями (22, 23). Другой способ, в котором сахар расплавляют в присутствии катионообменных смол (24), также дает высокомолекулярные,сильно разветвленные полимеры. В этих двух примерах полимеры образуются с сопутствующей потерей одной молекулы воды на каждую связь полимера. Другой пример известного способа ступенчатой полимеризации включает в себя использование реакции Кенигса-Кнорра, в 8 которой сахара, обладающие негидроксильными группами (такими как атом брома или хлора) в положении 1 и защитными группами (такими как ацетил) на других гидроксильных группах сахара, взаимодействуют в положении 1 с гидроксильной группой другого сахара (24). В этих способах во время образования полимерной связи происходит потеря молекулы, иной чем вода, например, НВr. Этот способ получения олигосахаридов требует получения сложных исходных материалов и дает низкие общие выходы. Также известно, что гексозный сахар, содержащий первичную спиртовую группу на углероде 6 и 0-защитные группы (такие как ацетил) в положениях 2, 3 и 4 и уходящую группу,такую как бром, в положении 1, будет самоконденсироваться, особенно в присутствии катализатора, такого как оксид серебра, с образованием 1,6-соединенных полимеров; ряд гентиодекстринов были получены таким образом из 1 бром-2,3,4-три-О-ацетилD-глюкозы; однако,выходы олигосахаридов были низкими вследствие образования 1,6-ангидроD-глюкозы, происходящей из внутримолекулярной конденсации; выходы димера (14%) и тримера (22%) не были хорошими, выходы тетрамера и пентамера были еще хуже (5%) и гексамер выделяли с выходом только 1% (26). Более недавние публикации описывают химические синтезы полимеров 1,6-соединенных -пиранозильных единиц (27) и Dдекстрана (28), выполненные реакцией полимеризации с открыванием кольца ангидросахарных производных. Этот способ затруднителен вследствие существенных усилий для приготовления ангидросахарного исходного материала и нет доказательства, что олигосахариды можно легко получать при помощи этого способа, даже при проведении реакций, например, при 60 С. В другом способе используют катализируемую кислотой полимеризацию с расплавлением 1,2,3,4-тетра-О-ацетилD-глюкозы для получения смеси 1,6'-соединенных олигосахаридацетатов, которые при деацетилировании и хроматографическом испытании показали в основном содержание моно- и дисахаридов, а именно,глюкозы (15%), левоглюкозана (4%) и гентиобиозы (16%), тогда как выход олигосахаридов был неприемлемо низким, в частности, гентиотриозы (4%) и гентиотетраозы (0,6%) (29). Этот способ был описан затем более детально(30) и, хотя выход полимеризованных продуктов был слегка улучшен, это приводило лишь к очень низким выходам ожидаемых олигомеров. Таким образом, из литературы очевидно,что, хотя уже существуют несколько способов получения ряда олигосахаридов, до настоящего времени не был описан способ синтеза гомоолигосахаридов с хорошим выходом из легко доступного и недорогого исходного материала. 9 В исследовании, ведущем к данному изобретению, авторы изобретения обнаружили процесс, при помощи которого можно синтезировать специфические гексопирано-олигосахариды с хорошими выходами из легко доступных и недорогих исходных материалов. В соответствии с этим аспектом данного изобретения обеспечен способ получения гексопирано-олигосахаридов, который предусматривает нагревание ацетилпроизводного или другого эфирного производного гексозы в инертном растворителе при пониженном давлении и в присутствии кислоты Льюиса или другого катализатора. В соответствии с этим способом олигомеризацию производных гексозных сахаров, в том числе (но не только) 1,2,3,4-О-ацетилпроизводных глюкозы, маннозы, галактозы, альтрозы, талозы, гулозы, идозы и аллозы, можно проводить регулируемым образом с получением Оацетилированных гексозных олигосахаридов. В этом способе степень олигомеризации (длину цепи) можно легко регулировать манипулированием температуры, при которой имеет место реакция олигомеризации, и варьированием времени, в течение которого дают протекать реакции. После реакции олигомеризации неочищенную смесь продукта можно подвергнуть дополнительной очистке для ацетилирования остальных свободных гидроксильных групп олигосахаридов. Затем ацетилированные олигосахариды могут быть легко отделены адсорбционной хроматографией. Ацетильные группы имеют поглощение в ультрафиолетовом свете, что облегчает применение спектрофотометрии для идентификации ацетилированных олигосахаридов по мере их последовательного элюирования из колонки. Ацетилзащитные группы могут быть затем удалены из смеси олигосахаридов, и полученные олигосахариды могут быть разделены по размеру гельфильтрационной (вытеснительной) хроматографией. В описанных здесь примерах сульфатированные олигосахариды выделяют и используют в виде их соответствующих солей натрия. Понятно, что другие фармацевтически приемлемые соли, такие как соли кальция или фармацевтически приемлемые соли аминов, могут быть выделены и использованы соответствующим образом. Поэтому, ссылки на "сульфатированный олигосахарид" в данном описании следует понимать как включающие такие соли натрия или другие фармацевтически приемлемые соли сульфатированного олигосахарида. Дополнительные признаки данного изобретения более полно описаны в нижеследующих примерах. Однако, должно быть понятно,что это подробное описание дано только для целей представления данного изобретения в виде примера, и не должно рассматриваться никаким образом в качестве ограничения широкого описания данного изобретения, представленного выше. 10 Примеры 1, 2 и 3 приводят примеры получения синтетических олигосахаридов при помощи нового способа, описанного в них. Примеры 4, 5 и 6 описывают способы сульфатирования олигосахаридов, и пример 7 описывает использование сульфатированных олигосахаридов в качестве антиангиогенных, антиметастатических и/или противовоспалительных агентов. (В примерах 1 и 2 "ND" обозначает "не определено"). В сопутствующих рисунках: Фиг. 1 показывает действие мальтогексаозосульфата на ангиогенез человека in vitro. Верхняя фигура является цифровым изображением контрольного ангиогенеза через 14 дней после инициирования культуры. Нижняя фигура изображает ангиогенез в присутствии 20 мкг/мл мальтогексаозосульфата. Фиг. 2 показывает действие различных концентраций мальтозосульфата , мальтотетраозосульфата (О) и мальтогексаозосульфатана ангиогенез человека in vitro. Данные получены из цифровых изображений ангиогенного ответа через 14 дней после инициирования культуры. Представлены средние величиныстандартная ошибка (n=4). Фиг. 3 показывает действие различных концентраций (мкг/мл) сульфатированного маннопентаозофосфата из Pichia holstii на ангиогенез человека in vitro. Данные получены из цифровых изображений ангиогенного ответа через 19 дней после инициирования культуры. Каждая величина представляет собой среднеестандартная ошибка (n=4). Фиг. 4 показывает действие сульфатированных мальтозных олигосахаридов с различной длиной цепи на метастазирование крысиной аденокарциномы молочной железы 13762 MAT. Контрольные животные получали клетки 13762MAT в отсутствие олигосахарида. В панели А,животные получали 2 мг, i.v., каждого соединения в момент инъекции опухолевых клеток. В панели В, животные получали 4 мг, подкожно,каждого соединения в момент инъекции опухолевых клеток. Вертикальные полоски обозначают стандартные ошибки среднего. Фиг. 5 - оценка способности сульфатированных мальтозных олигосахаридов с различной длиной цепи ингибировать связывание гепарансульфатов клеточной поверхности на клетках ВАLВ/с 3 Т 3 с иммобилизованнымaFGF. Связанные клетки 3 Т 3 определяли количественно окрашиванием Rose Bengal и измерением поглощения красителя при 540 нм. Степень сульфатирования различных мальтозных олигосахаридов представлена в таблице 2. Фиг. 6 показывает влияние степени сульфатирования мальтогексаозосульфата на его способность ингибировать метастазирование крысиной аденокарциномы молочной железы 13762 MAT. Числа вдоль оси х обозначают чис 11 ло сульфатных групп на молекулу мальтогексаозы. Контрольные животные получали опухолевые клетки в отсутствие соединений. Олигосахариды вводили в дозе 2 мг на крысу во время инъекции опухолевых клеток. Вертикальные полоски обозначают стандартные ошибки средних. Фиг. 7 показывает действие мальтогексаозы с различным количеством сульфатных групп на молекулу на ангиогенез человека in vitro. Олигосахариды добавляли в концентрации 200 мкг/мл и тест проводили в бессывороточной среде. Одинаковый ангиогенный ответ наблюдали в этом эксперименте, проводили ли тест в содержащей сыворотку (20% FCS) или в бессывороточной (без FCS) среде. Мальтогексаоза с 20 сульфатными группами на молекулу представляет собой максимально сульфатированную молекулу. Приведены средниестандартная ошибка (из четырех определений). Фиг. 8 показывает действие различных,содержащих маннозу, сульфатированных олигосахаридов на ангиогенез человека in vitro. Величины в скобках обозначают % сульфатирования олигосахаридов. Олигосахариды добавляли в концентрации 200 мкг/мл и тест проводили в содержащей сыворотку среде. Данные представлены как средниестандартная ошибка (из четырех определений). Фиг. 9 показывает действие сульфатированных маннозных олигосахаридов с различной длиной цепи на метастазирование крысиной аденокарциномы молочной железы 13762 MAT. Величины в скобках обозначают % сульфатирования олигосахаридов. Контрольные животные получали клетки 13762 MAT в отсутствие олигосахарида. Опытные животные получали либо 2 мг (А), либо 4 мг (В) (подкожно) каждого соединения непосредственно после внутривенной инъекции опухолевых клеток. Вертикальные полоски обозначают стандартные ошибки средних. Фиг. 10 показывает действие сульфатированных галактозных и глюкозных олигосахаридов с различной длиной цепи на метастазирование крысиной аденокарциномы молочной железы 13762 MAT. Величины в скобках обозначают% сульфатирования олигосахаридов. Контрольные животные получали клетки 13762 MAT в отсутствие олигосахарида. Опытные животные получали 2 мг подкожно каждого соединения сразу же после внутривенной инъекции опухолевых клеток. Вертикальные полоски обозначают стандартные ошибки средних. Пример 1. Олигосахариды из маннозы получали следующим образом: 1,2,3,4-тетра-О-ацетилманнозу (31) (15,0 г,43 ммоль) и хлорид цинка (1,5 г) тщательно смешивали в тетраметиленсульфоне (7 мл),смесь нагревали при пониженном давлении с перемешиванием при 110 С в течение 6 ч; в этот момент реакционная масса отверждалась и 12 прекращалось образование паров (уксусной кислоты). На протяжении всего времени реакции трубка с натронной известью была помещена между реакционным сосудом и источником вакуума. Реакционной смеси давали остыть и часть (11,0 г) смеси продукта растворяли в сухом пиридине (20 мл) и к этому раствору добавляли уксусный ангидрид (2 мл), эту смесь защищали от атмосферной влаги и нагревали при 50 С с перемешиванием в течение 2 ч. После охлаждения добавляли этанол (10 мл) и смеси давали стоять в течение 2 ч. Образовавшиеся пиридин, этанол и этилацетат выпаривали при пониженном давлении и остаток интенсивно промывали водой для удаления хлорида цинка,тетраметиленсульфона и пиридина. Остаток растворяли в дихлорметане, промывали водой и органический слой сушили над безводным сульфатом натрия. Производные олигосахаридов сначала разделяли на две фракции нанесением раствора в дихлорметане на короткую колонку (4 х 40 см) силикагеля 60 (130 г), которую сначала элюировали хлороформом и затем ацетоном. Элюирование хлороформом давало смесь полностью ацетилированного моносахарида и олигомеров, содержащих 3-5 единиц маннозы (Смесь А). Последующее элюирование ацетоном давало смесь полностью 0 ацетилированных олигомеров, содержащих в основном от 6 до 12 маннозных единиц на молекулу (Смесь В). Смесь А (4 г) наносили на колонку (3,3 х 135 см), упакованную силикагелем (Н) ТСХкачества. Колонку элюировали смесью ацетон/петролейный эфир (т.к. 60-80 С) с градиентом, начинающимся при 1:5, с увеличением процента ацетона до конечного отношения 1:1. Скорость тока была 0,5 мл/мин. Путем сбора и объединения соответствующих фракций (определяемых ТСХ-анализом на силикагеле) и удаления растворителя при пониженном давлении получали полностью О-ацетилированные маннозные олигосахариды 1a-1d: (n=число маннозных остатков; выход, молекулярное вращение(с=2, СНСl3: 1 а, (3; 0,7 г, 4,2%, []27D=+ND); 1b, (4; 4,1 г, 8,4%, []27D=+50); 1 с, (5; 1,2 г, 7,9%,[]27D=+47,3); 1d, (6; 0,8 г, 5,2%, []27D=+36,0). Смесь В (7,0 г) хроматографировали подобно процедуре, описанной для Смеси А, но градиент для элюирования начинали со смеси ацетон/петролейный эфир (т.к. 60-80 С) 4:5 и процент ацетона увеличивали до 100%. Таким путем получали также полностью О-ацетилированные маннозные олигосахариды 1d-1j: 13 Соединение 1 а (1,55 г) растворяли в сухом метаноле (40 мл) и добавляли 1 М метоксид натрия в 1 М метаноле (8,6 мл) с перемешиванием при комнатной температуре. Полученный осадок отфильтровывали, промывали интенсивно метанолом и сушили. Продукт (2 а; 0,61 г, 70%,[]27D=+72) идентифицировали как маннотриозу элементным анализом (величины CHN были 0,4 от ожидаемых), электрораспылительной и ЯМРмасс-спектрометрией(М+504) спектроскопией. Олигомеры 1b-1j обрабатывали подобным образом с получением следующих маннозных олигосахаридов: (n=число маннозных остатков; выход % от ацетилированных производных, молекулярное вращение (с=1,Н 2 О: 2b, (4; 75%, []27D=+78); 2 с, (5; 85%,[]27D=+80); 2d, (6; 98%, []27D=+84); 2 е, (7; 98%, []27D=+86,3); 2f, (8; 99%, []27D=+98,0); 2g, (9; 99%, []27D=+106); 2h, (10; 99%,[]27D=+100); 2i, (11; 98%, []27D=+ND); 2j, (12; 98%, []27D=ND). Альтернативно эти маннозные олигосахариды могут быть выделены гель-фильтрационной (вытеснительной) хроматографией. Так,смесь ацетилированных маннозных олигосахаридов получали нагреванием тщательно перемешиваемой смеси 1,2,3,4-тетра-О-ацетилманнозы (15,0 г, 43 ммоль) и хлорида цинка (1,5 г) в тетраметиленсульфоне (7 мл) при пониженном давлении при 110 С в течение 6 ч, как описано выше. Реакционной смеси давали остыть, добавляли воду (50 мл) и реакционную смесь перемешивали при комнатной температуре в течение 5 мин и водный слой удаляли. Эту процедуру промывания повторяли и затем полученную массу растворяли в хлороформе, промывали водой и сушили над безводным сульфатом натрия. После фильтрования хлороформ удаляли при пониженном давлении с получением неочищенной смеси ацетилированных олигосахаридов (11,3 г). Эту смесь растворяли в изопропаноле (20 мл) и метаноле (60 мл) и затем добавляли 1 М метоксид натрия в метаноле (8 мл) и смеси давали стоять при комнатной температуре в течение 1 ч. Полученный осадок отфильтровывали и промывали дважды метанолом (30 мл). После высушивания эту смесь продукта (6,5 г) наносили на гель-фильтрационную колонку (fine grade P2 gel, BioRad) (с рубашкой; 5 х 90 см), которая была стабилизирована пропусканием в течение двух дней воды (скорость тока 0,5 мл в мин.) при 60 С. Колонку элюировали водой при скорости тока 0,5 мл в мин. Продукты, элюированные из колонки, идентифицировали в виде пиков дифференциальной рефрактометрией и фракции собирали в соответствии с этим. Таким путем собирали фракции, соответствующие площадям под 11 отдельными пиками. Каждую из этих фракций повторно хроматографировали на идентичной колонке с гелем Р, поддерживаемой при 60 С, и 14 элюировали водой при скорости тока 0,5 мл/мин. Так, например, фракцию, идентифицированную как соответствующую маннопентаозе(0,9 г), из первой гель-фильтрационной колонки,повторно хроматографировали с получением основного центрального пика с одним плечом на каждой стороне. Продукт, элюированный в центральном пике, выделяли путем удаления воды при пониженном давлении с получением(0,5 г) материала, который опять повторно хроматографировали на идентичной колонке с гелем Р 2 при 60 С при скорости тока 0,3 мл/мин. Таким путем получали маннопентаозу (0,3 г),идентичную 2 с выше. Найдено: С 38,4; Н 6,7; С 30 Н 52 О 266 Н 2 О, необходимо С 38,5; Н 6,8%. Для азота обнаружено 0% и 0% ожидалось. Было обнаружено, что это соединение было по существу чистым согласно ВЭЖХ. Это было определено с системой Dionex HPLC, описанной ниже: Колонка: Электрораспылительная масс-спектроскопия показала, что это соединение имеет массуM+828, точную молекулярную массу маннопентаозы. Подобным образом были выделены маннотриоза, маннотетраоза, манногексаоза и манногептаоза, идентичные 2 а, 2b, 2d и 2 е, описанным выше. Пример 2. Этот пример показывает влияние проведения реакции полимеризации при более низкой температуре, чем в примере 1. Олигосахариды из глюкозы получали полимеризацией 1,2,3,4 тетра-О-ацетилглюкозы таким же образом, как это описано для маннозных олигосахаридов,полученных по способу, описанному в примере 1 выше, за исключением того, что в этом случае реакцию полимеризации проводили при 90 С в течение 8 ч. Реакционную смесь обрабатывали,как в примере 1, и продукты выделяли колоночной хроматографией, причем колонка (7 см х 155 см) была упакована силикагелем (Н) ТСХчистоты. При помощи способов элюирования,сходных с описанными в примере 1, получали полностью О-ацетилированные глюкозные олигосахариды 3 а-3 е: (n=число глюкозных остатков; выход, молекулярное вращение (с=2,СНСl3: 3 а, (3; 4,14 г, 24,9%, [] 27D=+37,5); 3b,(4; 2,92 г, 18,4%, [] 27D=+44); 3 с, (5; 2,99 г, 15 19,1%, [] 27D=+37,5); 3d, (6; 1,37 г, 8,9%,[]27D=+36); 3 е, (7; 0,18 г, 1,2%, [] 27D=+39). Соединение 3 а (1,0 г) растворяли в сухом метаноле (30 мл) и добавляли 1 М метоксид натрия в метаноле (5,5 мл) с перемешиванием при комнатной температуре. Полученный осадок отфильтровывали, промывали тщательно метанолом и сушили. Продукт (4 а; [] 27D=+68,5) идентифицировали как глюкотриозу при помощи элементного анализа, электрораспылительной масс-спектрометрии (М+=504) и ЯМРспектроскопии. Олигомеры 4b-4 е обрабатывали сходным образом с получением следующих глюкозных олигосахаридов (n=число глюкозных остатков; % выход, молекулярное вращение(с=2, Н 2 О; 4b, (4; 85%, []27D=+83); 4 с, (5; 90%, [] 27D=+84); 4d, (6; 90%, [] 27D=+86); 4 е,(7; 89%, [] 27D=+92,5). Альтернативно эти глюкозные олигосахариды могут быть изолированы гель-фильтрационной (вытеснительной) хроматографией. Так,смесь ацетилированных глюкозных олигосахаридов получали после нагревания интенсивно перемешиваемой смеси 1,2,3,4-тетра-О-ацетилглюкозы (15,0 г, 43 ммоль) и хлорида цинка (1,5 г) в тетраметиленсульфоне (7 мл) при пониженном давлении при 110 С в течение 6 ч, как описано выше. Реакционную смесь растворяли в дихлорметане, промывали водой и сушили над безводным сульфатом натрия. Дихлорметан удаляли при пониженном давлении и продукт взвешивали и растворяли в изопропаноле (20 мл) и метаноле (60 мл) и затем добавляли 1 М метоксид натрия в метаноле (9 мл) и смеси давали стоять при комнатной температуре в течение 1 ч. Полученный осадок отфильтровывали и промывали дважды метанолом (30 мл). Часть(7,6 г) этой смеси растворяли в воде (10 мл) и наносили на хроматографическую колонку с водной рубашкой 5 х 90 см, упакованную гелемfine grade P2 (BioRad) для гель-фильтрации. Колонку упаковывали, предварительно нагревали и обрабатывали при 60 С водой в течение 2 дней до использования. После добавления смеси глюкозных олигосахаридов колонку поддерживали при 60 С и элюировали водой (1 мл/мин.). Продукты, элюирующиеся из колонки, идентифицировали в виде пиков при помощи дифференциальной рефрактометрии и соответственно собирали фракции. Таким путем собирали фракции, соответствующие площадям под 10 отдельными пиками. Каждую из этих фракций повторно хроматографировали на идентичной колонке с гелем Р 2 при 60 С и элюировали водой при скорости тока 0,5 мл/мин. Так, например, фракцию, идентифицированную как соответствующую глюкопентаозе (0,59 г), повторно хроматографировали с получением основного центрального пика с одним плечом на каждой стороне. Продукт, элюирующийся в центральном пике, выделяли путем удаления воды при 16 пониженном давлении с получением (0,3 г) материала, который опять повторно хроматографировали на идентичной колонке с Р 2 при 60 С при скорости тока 0,3 мл/мин. Таким путем получали глюкопентаозу (0,2 г), идентичную 4 с. Подобным образом выделяли глюкотриозу,глюкотетраозу, глюкoгeксаозу и глюкогептаозу,идентичные 4a, 4b, 4d и 4 е. Пример 3. Олигосахариды других гексозных сахаров,в том числе, галактозы, альтрозы, талозы, гулозы, идозы и аллозы, могут быть получены согласно способам, описанным в примерах 1 и 2. Например, олигосахариды галактозы получали следующим образом: 1,2,3,4-тетра-Оацетилгалактозу (21,0 г) и хлорид цинка (2,1 г) тщательно смешивали в тетраметиленсульфоне(10 мл), смесь нагревали при пониженном давлении с перемешиванием при 90 С в течение 17 ч; в этот момент реакционная масса отверждалась и прекращалось образование паров (уксусной кислоты). На протяжении всего времени реакции трубка с натронной известью была помещена между реакционным сосудом и источником вакуума. Реакционной смеси давали остыть, затем реакционную массу растворяли в дихлорметане, промывали водой и сушили над безводным сульфатом натрия. Дихлорметан удаляли при пониженном давлении и продукт взвешивали и растворяли в изопропаноле (30 мл) и метаноле (70 мл) и затем добавляли 1 М метоксид натрия в метаноле (10 мл) и смеси давали стоять при комнатной температуре в течение 1 ч. Полученный осадок отфильтровывали и промывали дважды метанолом (30 мл). Эту смесь разделяли гель-фильтрационной хроматографией, как описано для полимеров маннозы и глюкозы в примерах 1 и 2 выше. Продукты,элюирующиеся из колонки, идентифицировали в виде пиков при помощи дифференциальной рефрактометрии и соответственно собирали фракции. Таким путем были собраны 8 фракций. Семь из этих фракций повторно хроматографировали дважды на идентичной колонке с гелем Р 2 при 60 С и элюировали водой при скорости тока 0,5 мл/мин, в первом случае и 0,3 мл/мин, при втором хроматографировании. Таким путем были получены следующие галактозные олигосахариды: галактотриоза, 1,03 г,5,3%; галактотетраоза, 1,15 г, 6,0%; галактопентаоза, 1,21 г, 6,3%; галктогексаоза, 4,26 г, 22,1%; галактогептаоза, 2,11 г, 11%; галактооктаоза,1,91 г, 9,9% и галактононаоза, 0,08 г, 0,4%. Пример 4. К раствору комплекса триоксид серыпиридин (0,8 г) (Aldrich) в свежеперегнанном ДМФ (1 мл) при 80 С добавляли по каплям раствор маннопентаозы (2 с) (0,1 г) в сухом пиридине (3 мл) и все это нагревали при 80 С еще в течение 90 мин. Супернатант декантировали,пока он был еще теплым, и липкий остаток промывали интенсивно метанолом (2 мл) три раза. 17 После декантирования оставшегося метанола продукт растворяли в воде (5 мл) и нейтрализовали (до рН 6) ацетатом бария (приблизительно 0,4 г в 2 мл воды) с интенсивным перемешиванием. После центрифугирования (3000 g) супернатант декантировали и сохраняли и осажденный осадок сульфата бария тщательно промывали водой (3 х 10 мл). Сохраненный супернатант и промывки объединяли и наносили на колонку (1,0 х 14 см) катионообменной смолы(Н+-формы) DOWEX 50W-X8-400. Колонку элюировали водой, пока элюат не становился нейтральным. Элюат (50 мл) перемешивали и нейтрализовали (до рН 7) ацетатом натрия (0,7 г). Раствор разбавляли ацетоном (200 мл) и центрифугировали (1750 g) для отделения продукта. Осадок тонко измельчали раздавливанием под метанолом и затем отфильтровывали. Твердое вещество промывали несколько раз метанолом с получением чистого (не содержащего неорганической соли) соединения (0,2 г; 66%). Продукт не был загрязнен ионом бария (согласно микроанализу и пламенной ионизации) и азотом (согласно микроанализу). Было обнаружено, что этот продукт, сульфатированная маннопентаоза, имеет 11 сульфатированных положений из 17. Найдено: С 14,2; Н 3,0; S 14,1; Nа 7,3. C30H60O59S11Na836H2O требует С 14,1; Н 5,2; S 13,8; Na 7,2%. Величины для азота и бария были найдены 0% и ожидались 0%. Пример 5. К смеси комплекса триоксид серыпиридин (Aldrich Chemical Company) (4 г) в сухом ДМФ (5 мл) добавляли сухой пиридин (10 мл) в атмосфере сухого азота. Эту смесь нагревали до 50 С и быстро перемешивали при добавлении в виде одной порции глюкогексаозы(4d) (0,5 г), выделенной согласно способу, описанному в примере 2 выше. Добавляли дополнительное количество (5 мл) пиридина и затем эту смесь нагревали при непрерывном перемешивании при 80 С в течение 90 мин. Затем реакционную смесь выдерживали при 4 С в течение ночи. Жидкость декантировали из реакционного сосуда, добавляли метанол (3 мл) и полутвердую массу разбивали и перемешивали тщательно с метанолом. После оседания метанол декантировали и эту процедуру повторяли. Добавляли воду (5 мл) к оставшемуся твердому веществу и полученный раствор помещали в тест-пробирку на 50 мл. Реакционный сосуд промывали дополнительным количеством воды(5 мл), которую объединяли с первым раствором. Полученный раствор доводили до рН 7-8 40% NaOH, после чего добавляли метанол (40 мл). Полученный мутный раствор центрифугировали (3000 g) в течение 25 мин и прозрачный раствор декантировали с осадка. Оставшийся твердый материал опять растворяли в воде (10 мл), добавляли метанол (40 мл) и пробирку центрифугировали, как описано выше. После де 001199 18 кантирования прозрачного супернатанта твердый материал растворяли в воде (10 мл) и пропускали через обессоливающую колонку с гелем Р 2 (2,5 см х 250 см; гель fine grade P2BioRad) с получением ожидаемой соли натрия сульфатированного производного 1,6-глюкогексаозы. Пример 6. Хотя синтез гексозных гомополимеров описан в примерах 1, 2 и 3, обычно очень трудно синтезировать большинство олигосахаридных структур. Таким образом, более простым подходом является сульфатирование олигосахаридов определенной структуры из природных источников. Олигосахариды природных продуктов, используемые в этом примере, относились к двум классам. Первый класс содержал олигосахариды, которые не требовали дальнейшей деградации и фракционирования. Примерами этого класса являются мальтоза, раффиноза и стахиоза. Второй класс состоял из олигосахаридов, получаемых из природно-вcтречающихся полисахаридов, которые были частично деградированы ферментативно или химически,и фракционированных по размеру. Примерами этого класса являются произведенные из амилозы, хондроитина и декстрана, олигосахариды и маннопентаозофосфат из дрожжей Pichia holstii. Мальтозу, раффинозу и стахиозу приобретали в Sigma Chemical, St. Louis, МО. Мальтотриозу, мальтотетраозу, мальтопентаозу, мальтогексаозу и мальтогептаозу получали из Seikagaku, Tokyo, Japan, и они представляют собой олигосахариды, очищенные из продукта ограниченного амилазного расщепления 1-4-соединенного глюкозного гомополимера, амилозы. Хондроитин-тетра-, гекса- и октасахариды были очищены гель-фильтрационным фракционированием продукта расщепления тестикулярной бычьей гиалуронидазой хондроитин-6-сульфата,как описано ранее (32). Циклогекса-, гепта- и окта-амилозы были поучены из Sigma. Эти олигосахариды могут быть сульфатированы, как описано в примере 5. Например, мальтогексаозосульфат получали следующим образом. К раствору комплекса триоксид серы-пиридин (4,0 г) (Aldrich) в свежеперегнанном ДМФ (5 мл) при 80 С добавляли по каплям раствор мальтогексаозы (0,5 г) в сухом пиридине (15 мл) и все это нагревали при 80 С еще в течение 90 мин. Супернатант декантировали, пока он был еще теплым, и липкий остаток промывали основательно метанолом (10 мл) три раза. После декантирования оставшегося метанола продукт растворяли в воде (15 мл) и нейтрализовали (до рН 6) ацетатом бария (2,0 г в 10 мл воды) при интенсивном перемешивании. После центрифугирования (3000 g) супернатант декантировали и сохраняли, а осажденный осадок сульфата бария промывали тщательно водой (3 х 10 мл). Сохраненный супернатант и промывки объединяли и наносили на ко 19 лонку (2,5 х 14 см) катионообменной смолы (Н+формы) DOVEX 50W-X8-400. Колонку элюировали водой, пока элюат не становился нейтральным. Элюат (250 мл) перемешивали и нейтрализовали (до рН 7) ацетатом натрия (3,5 г). Раствор разбавляли ацетоном (1 л) и центрифугировали (1750 g) для отделения продукта. Осадок тонко измельчали раздавливанием под метанолом и затем отфильтровывали. Фильтрат промывали несколько раз метанолом с получением чистого (не содержащего неорганической соли) соединения (0,88 г; 55%). Продукт не был загрязнен ионом бария (согласно микроанализу и пламенной ионизации) и азотом (согласно микроанализу). Было обнаружено, что этот продукт имеет 14 сульфатированных положений из 20. Найдено: С 13,9; Н 2,2; S 14,3; Na 6,7. С 36 Н 71O73S14Nа 9 45 Н 2O требует С 13,8; Н 5,1; S 14,3; Na, 6,6%. Величины для азота и бария были 0,32 и 0%,соответственно, ожидались 0% для каждого из них. Данные 1 Н-ЯМР (300 МГц - Gemini 300;TMS) для мальтогексаозосульфата показали, что 14 из возможных 20 положений были сульфатированы. Это было определено из химических смещений водородов, сосредоточенных около 4,15 м.д. (интегрирование для 20 Н), против водородов, сосредоточенных около 4,4 м.д. (интегрирование для 16 Н). Можно предположить,что все первичные группы ОН, т.е. группы в положении 6, будут сульфатированными, так как это наименее стерически затрудненное положение. Далее можно предположить, что во внутренних сахарных остатках только одно другое положение будет сульфатированным. Концевые сахарные остатки, в дополнение к одному положению 6, будут иметь два других сульфатированных положения. Маннопентаозофосфат получали из экзополисахарида, продуцируемого диплоидными дрожжами Pichia holstii (штаммом NRRL Y2448, прежде Hansenula holstii). Способ выращивания Р. holstii и выделения маннопентаозофосфата основан на способе, описанном ранее(33, 34). Вкратце, неочищенный экзосахарид выделяли из супернатанта культуры аэробно растущих дрожжей в виде соли калия осаждением этанолом. Затем использовали кислотный гидролиз для высвобождения маннопентаозофосфата из ядра экзополисахарида, являющегося сложным моноэфиром фосфоманнана(РРМЕ). Затем РРМЕ и маннопентаозофосфат отделяли друг от друга в виде солей бария дифференциальным осаждением этанолом и затем гель-фильтрацией. Олигосахарид имеет структуру(33, 34) выделяли из экзополисахарида дрожжей 20 следующим образом. Суспензию маннопентаозофосфата дрожжей (0,09 г) в ДМФ (2 мл) и пиридине (3 мл) добавляли к раствору комплекса триоксид серы-пиридин (0,8 г) (Aldrich) в ДМФ(1 мл). Эту смесь нагревали при 80 С в течение 2 ч. Супернатант декантировали, пока он был еще теплым, и липкий остаток промывали основательно метанолом (2 мл) три раза. После декантирования оставшегося метанола продукт растворяли в воде (5 мл) и нейтрализовали (до рН 6) ацетатом бария (приблизительно 0,7 г в 5 мл воды) при энергичном перемешивании. После центрифугирования (3000 g) надосадочную жидкость декантировали и осажденный осадок сульфата бария промывали интенсивно водой (3 х 10 мл). Надосадочную жидкость и промывки объединяли и наносили на колонку (2,5 х 14 см) катионообменной смолы (H+-формы) DOWEX 50W-X8-400. Колонку элюировали водой, пока элюат не становился нейтральным. Элюат (50 мл) перемешивали и нейтрализовали (до рН 7) ацетатом натрия (0,4 г). Раствор разбавляли ацетоном (150 мл) и центрифугировали (1750 g) для отделения продукта. Осадок тонко измельчали раздавливанием под метанолом и перемешивали под метанолом и затем отфильтровывали. Твердый материал промывали несколько раз метанолом с получением сульфатированного маннопентаозофосфата дрожжей (0,18 г). Продукт не был загрязнен ионом бария (согласно микроанализу и пламенной ионизации) и азотом (согласно микроанализу). Было обнаружено, что этот продукт имел 10 сульфатированных положений из возможных 16. Найдено: С 15,35; Н 2,7; Р 1,2; S 13,7; Na 8,5. С 32 Н 41 О 39 РS10Nа 925 Н 2O требует С 15,3; Н 3,5; Р 1,3; S 13,6; Na 8,8%. Величины для азота и бария были 0,16 и 0%, соответственно, и ожидаемые величины 0% для каждого из них. 1,6 Глюкозные олигосахариды получали кислотным гидролизом декстрана (средняя мол. масса 71000; Sigma Chemical Co.). Так, декстран(5 г) растворяли в дистиллированной воде (100 мл) и этот раствор доводили до рН 1,8 1 М соляной кислотой. Смесь нагревали с обратным холодильником (100 С) в течение 48 ч. Смесь сушили при пониженном давлении и доводили до 100 мл дистиллированной водой и сушили второй раз при пониженном давлении. К остатку добавляли абсолютный спирт (100 мл) и выпаривали при пониженном давлении. Остаток доводили до 4 мл дистиллированной водой и наносили на хроматографическую колонку 5 х 90 см с водной рубашкой, упакованную гелем finegrade P2 (BioRad) для гель-фильтрации. Колонку упаковывали, предварительно нагревали и обрабатывали водой при 60 С в течение двух дней до использования. После добавления смеси 1,6 глюкозных полисахаридов колонку поддерживали при 60 С и элюировали водой (1 мл/мин.). Продукты, элюирующиеся из колонки, 21 идентифицировали в виде пиков дифференциальной рефрактометрией и соответственно собирали фракции. Таким путем были собраны фракции, соответствующие площадям под отдельными пиками. Каждую из этих фракций повторно хроматографировали на идентичной колонке с гелем P2 при 60 С и элюировали водой при скорости тока 0,5 мл/мин. Так, например, фракцию, идентифицированную как соответствующую 1,6 глюкогексаозе (0,19 г), повторно хроматографировали с получением основного центрального пика с одним плечом на каждой стороне. Продукт, элюирующийся в центральном пике, выделяли удалением воды при пониженном давлении с получением (0,16 г) материала, который опять повторно хроматографировали на идентичной колонке с гелем P2 при 60 С при скорости тока 0,3 мл/мин. Таким путем получали глюкогексаозу (0,14 г) (электрораспылительная масс-спектрометрия: М+=990). Подобным путем выделяли 1,6-глюкотриозу, 1,6 глюкотетраозу (0,21 г) и 1,6-глюкопентаозу (0,17 г). Пример 7. А. Материалы и способы. Антикоагулянтная активность сульфатированных олигосахаридов. Антикоагулянтную активность каждого сульфатированного олигосахарида оценивали,как описано ранее (35), с использованием способов определения как тромбинового времени,так и парциального тромбопластинового времени. Активность каждого препарата сравнивали с гепариновым контролем и антикоагулянтную активность выражали как процент от активности гепарина. Тест ангиогенеза человека. Используемый тест-способ описан в Международной патентной заявкеPCT/AU 95/00105, описание которой включено здесь в качестве ссылки. Кровеносные сосуды, с диаметром приблизительно 1-2 мм и длиной 2-5 см,вырезали из поверхности плацент человека в пределах 6 ч после родов. Сосуды помещали в среду BSS Хенка, содержащую 2,5 мг/мл фунгизона, и разрезали на фрагменты длиной 1-2 мм при помощи рассекающих зажимов и ножниц для иридэктомии. Фрагменты сосудов освобождали от остаточных сгустков и вымачивали вBSS Хенка перед применением. Иссечение и разделение на фрагменты сосудов выполняли с применением увеличительной лампы (Maggylamp, Newbound, Balmain, NSW, Australia). Сходные ангиогенные ответные реакции получали с кровеносными сосудами венулярного и артериального происхождения, но для каждого теста использовали фрагменты только из одного кровеносного сосуда. Тесты ангиогенеза выполняли в 24- или 48 луночных культуральных планшетах (Costar,Cambridge, MA). В случае 24-луночного форма 001199 22 та 30 мкл бычьего тромбина (50 NIH единиц/мл в 0,15 М NaCl; Sigma Chemical Co., St. Louis,МО) добавляли в каждую лунку с последующим добавлением 1,0 мл/лунку бычьего фибриногена в концентрации 3 мг/мл (Sigma) в среде 199. Тромбин и фибриноген быстро смешивали и один фрагмент сосуда быстро помещали в центр лунки до образования сгустков. Обычно образование фибринового геля происходит в течение 30 с, и фрагмент сосуда оставляли суспендированным в геле. После образования геля добавляли 1,0 мл/лунку среды 199, дополненной 20% фетальной телячьей сывороткой (FCS), 0,2 мг аминокапроновой кислоты, L-глутамином и антибиотиками (гентамицином и фунгазоном). В случае 48-луночного формата объемы всех реагентов были уменьшены наполовину. Кровеносные сосуды культивировали при 37 С в увлажненном окружении в течение 14-21 дней со сменой среды два раза в неделю. Количественное определение ангиогенеза выполняли с помощью компьютерного анализа изображения, с использованием программного обеспеченияNIH Image, цифровых изображений культур,полученных в цифровой камере Dycam, смонтированной на инвертированном микроскопе(Olympus, Tokyo, Japan). Тест для определения гепараназы. Гепараназный тест основан на наблюдении, что сывороточный белок, богатый гистидином гликопротеин (HRG), связывается с цепями гепарансульфата и маскирует сайт расщепления гепараназы. На основании открытия, что расщепленный гепараназой гепарансульфат не способен связываться с HRG, был разработан гепараназный тест, который включает в себя расщепление 3H-меченых цепей гепарансульфата гепараназой, связывание расщепленного гепарансульфата со связанными с HRG гранулами и измерение несвязавшейся 3H-метки. С увеличением расщепления субстрата увеличивающееся количество 3H-метки перестает связываться с гранулами, связанными с HRG. Таким образом,этот способ предоставляет простую и быструю процедуру для измерения активности гепараназы в экстрактах тканей и оценки ингибирования гепараназы различными соединениями. Сначала бычий кишечный гепарансульфат(32 кДа) частично де-N-ацетилировали нагреванием в гидразингидрате (36) и повторно ацетилировали в 3H-уксусном ангидриде. HRG цыпленка, очищенный по способу Rylatt et al (1981)(37), связывали с CNBr-активированной Сефарозой 4 В (Pharmacia) согласно инструкциям изготовителя. Гепараназную активность тромбоцитов человека определяли инкубированием (37 С, 30 мин.) очищенной гепараназы тромбоцитов человека (которая, как было показано, имеет такую же активность в отношении гепарансульфата, что и гепараназная активность, присутствующая в высокометастатических культивируе 23 мых клеточных линиях карциномы HCN 116 человека, крысиной аденокарциномы 13762MAT и мышиной меланомы В 16) с 60 пмоль 3Hрадиоактивно меченого бычьего кишечного гепарансульфата. Активность определяли по скорости образования более малых (приблизительно 5 кДа) фрагментов гепарансульфата, которые не были связанными после прохождения инкубационной смеси (100 мкл) через миниколонкиHRG-Сефарозы (200 мкл упакованных гранул),которые удерживали больший нерасщепленный и частично расщепленный субстрат. В тестах ингибирования гепараназы различные концентрации ингибитора добавляли к ферменту перед добавлением радиоактивно меченого субстрата, причем ингибитор сохраняли в реакционной смеси на протяжении всего периода инкубирования.Tecт метастазирования. Антиметастатическую активность различных сульфатированных олигосахаридов оценивали с использованием высокометастатической крысиной аденокарциномы молочной железы 13762 MAT (35). Опухолевые клетки поддерживали in vitro, как описано ранее (35). Самок крысMAT в 0,6 мл среды RPMI 1640, содержащей 10% FCS. В момент инъекции опухолевых клеток животным инъецировали также 2 мг сульфатированного олигосахарида, причем одинаковые результаты получали при инъекции олигосахарида i.v., i.p. или s.c. (подкожно). Через 13 дней после инъекции опухолевых клеток у крыс удаляли легкие, помещали их в раствор Bouin и выдерживали в нем, по меньшей мере, в течение 24 ч и затем оценивали легочные метастазы под препаровальной лупой. Число легочных метастазов в получивших сульфатированный олигосахарид крысах сравнивали с числом, наблюдаемым в контрольных животных, причем в каждой группе было минимально 4 животных. Действие сульфатированных олигосахаридов на взаимодействие FGF-гепарина/гепарансульфата. Тест связывания, который подробно описан в другом месте (38), использовали для измерения связывания aFGF и bFGF с гепарином и оценки способности различных сульфатированных олигосахаридов ингибировать это взаимодействие. Вкратце, FGF иммобилизовали в лунках 96-луночных PVC-планшетов и оценивали связывание радиоактивно меченого гепарина с иммобилизованными FGF. В тестах ингибирования серийные разведения сульфатированных олигосахаридов испытывали на их способность ингибировать взаимодействие FGF-гепарина. Результаты ингибирования выражали в виде концентрации сульфатированного олигосахарида, требующейся для ингибирования связывания гепарина с иммобилизованными FGF на 20% или 50%. Немеченый гепарин использовали как 24 контроль во всех экспериментах по ингибированию связывания. ВзаимодействиеFGF-гепарансульфата оценивали, как сообщалось ранее (39), путем измерения связывания фибробластов ВАLВ/ с 3 Т 3 с PVC-иммобилизованными FGF, причем связывание клеток детектировали по RoseBengal-окрашиванию прикрепленных клеток. Сульфатированные олигосахариды испытывали на их способность ингибирования этого процесса адгезии клеток, который полностью зависим от гепарансульфатных структур на поверхности клеток BALB/с 3 Т 3 (39). Данные выражали в виде концентрации сульфатированного олигосахарида, которая ингибировала адгезию клеток на 50% (IC50). Модель воспаления с использованием воздушных карманов. Тест основан на сообщенном ранее способе (40). Подкожные воздушные карманы образовывали на спинках мышей инъекцией 5 мл стерильного воздуха под кожу выбритой зоны между лопатками анестезированной мыши в первый день (день 1). На третий день (день 3) карман повторно наполняли воздухом инъекцией 2,5 мл воздуха. Воспаление индуцировали на шестой день (день 6) инъекцией непосредственно в карман 1,0 мл тиогликоллата (56 мг/мл) или 1,0 мл физиологического раствора в качестве контроля. Приблизительно через 17-20 ч после инъекции тиогликоллата животных убивали шейным смещением и клеточное содержимое кармана извлекали инъекцией 2,5 мл охлажденного льдом PBS/5% FCS. Сульфатированные олигосахариды испытывали на их способность ингибировать воспалительную реакцию путем подкожной инъекции (50 мкл в PBS) в отдельный сайт непосредственно после введения тиогликоллата. В качестве контрольного противовоспалительного лекарственного средства использовали преднизолон, инъецируемый подкожно в масле при дозе 25 мг/кг. Общее клеточное содержимое каждого кармана определяли в счетчике Коултера и различные популяции лейкоцитов оценивали иммунофлуоресцентной проточной цитометрией. Мышиная модель астмы. Ранее сообщенную мышиную модель астмы (41) использовали для испытания способности сульфатированных олигосахаридов ингибировать индуцированную аэроаллергеном(овальбумином, OVA) инфильтрацию эозинофилов в легкие. Мышей (C57BL/6, 6-10 недельного возраста) сенсибилизировали i.v. инъекцией 50 мг OVA/1 мг Alhydrogel (CSL Ltd,Parkwille, Australia) в 0,9% стерильном физиологическом растворе в день 0 и день 12. В день 24 мышей обрабатывали аэрозолем OVA (10 мг/мл) в 0,9% физиологическом растворе в течение 30 мин три раза (с интервалами 1 ч) и затем обрабатывали таким же образом в дни 26 и 28. Аэрозоль получали при 6 л/мин, при помощи распы 25 лителя, который давал средний диаметр частиц 39 мкм, в закрытой камере 800 куб. см. В день 29 мышей убивали шейным смещением. Трахеи канюлировали и просветы дыхательных путей промывали 4 х 1 мл 0,9% физиологическим раствором, содержащим БСА (0,1% масса/объем) при 37 С. Приблизительно 0,8 мл инстиллированной жидкости извлекали на одну промывку. Жидкость бронхоальвеолярного лаважа (BALF),полученную из одного животного, объединяли и числа клеток определяли с применением стандартного гемоцитометра. Клетки BALF также цитоцентрифугировали и дифференциально окрашивали раствором May-Grunwald-Giemsa,причем эозинофилы идентифицировали при помощи морфологических критериев. Данные рассчитывали как число эозинофилов/мл BALF. Сульфатированные олигосахариды вводили животным либо системно при помощи вставленных i.p. миниосмотических насосов (Alzet), или через легкие в виде аэрозоля. Миниосмотические насосы вставляли в день 23 за 24 ч перед стимуляцией OVA и непрерывно подавали лекарственное средство до убивания животных в день 29. В случае подачи при помощи аэрозоля,мышей обрабатывали аэрозолем сульфатированных олигосахаридов в 0,9% физиологическом растворе в течение 30 мин три раза (с интервалами 1 ч) в дни 23, 25 и 27. Экспериментальная модель аутоиммунного энцефаломиелита (ЕАЕ). Клетки селезенки получали для воспринимаемого переноса ЕАЕ, как описано ранее (43). Вкратце, крыс Lewis сенсибилизировали миелиновым основным белком, иммунные клетки селезенки, активированные конканавалином А(СоnA) in vitro, и активированные СоnA ЕАЕэффекторные клетки (30 х 106 клеток) переносили i.v. каждому реципиенту. Миниосмотические насосы (Alzet), содержащие сульфатированные олигосахариды, имплантировали подкожно во время переноса клеток и поставляли дозу 70 мг/кг/день в течение 14 дней. Клинический ЕАЕ классифицировали по следующей схеме: 0, бессимптомный; 1, вялая дистальная половина хвоста; 2, вялое состояние всего хвоста; 3, атаксия, трудность в выпрямлении; 4,слабость задних конечностей; 5, паралич задних конечностей. Модель воспалительного заболевания пищеварительного тракта. Воспалительное заболевание пищеварительного тракта индуцировали в мышах добавлением в воду для питья 5% (м/об.) декстрансульфата натрия (DSS), поставляемого TdB Consultancy, Uppsala, Sweden. Раствор доводили до рН 8,0 и фильтровали через мембрану 0,45 . Растворы DSS собирали ежедневно, повторно фильтровали и объемы доводили свежим исходным раствором DSS. Самцов мышей BALB/c 67-недельного возраста подвергали скринингу на вес тела и мышей с весом тела между 20-23 г 26 объединяли по группам в клетки с 5 мышами на клетку. Мышей инъецировали сульфатированным маннопентаозофосфатом (20 мг/кг/день) или носителем (стерильной водой) при интервалах 8 ч со дня 0 до дня 10. Инъецируемый объем стандартизировали до 100 мкл и инъецировали подкожно в заднюю часть шеи. Скорость потребления DSS, вес тела и симптомы оценивали в баллах ежедневно для всех мышей. Симптомы диареи и ректального кровотечения оценивали (каждый) как незначительные или массивные и выражали величинами 1 и 4, соответственно. Присутствие слизи также отмечали и включали в балл незначительной диареи. Затем сумму баллов диареи и ректального кровотечения делили на число выживших животных в данной группе на данный день. Общий балл является суммой баллов диареи и ректального кровотечения. Результаты Антиангиогенная и антиметастатическая активность сульфатированных природно-встречающихся олигосахаридов Как только был синтезирован набор природно-встречающихся олигосахаридов, их испытывали в ряде биологических тестов. Таблица 1 суммирует результаты, полученные с сульфатированными формами 12 природно-вcтречающихся олигосахаридов. Биологические активности сурамина (соединения, имеющего умеренную антиангиогенную и ингибирующую гепараназу активность) (42) и гепарина также включены в таблицу 1 для сравнения. Сначала было показано, что все испытанные сульфатированные олигосахариды обладают незначительной антикоагулянтной активностью, т.е. 2% активности гепарина (таблица 1). Это было важным свойством гепарина, сильного антиметастатического соединения, клиническая применимость которого ограничивалась для этого показания вследствие его сильной антикоагулянтной активности. Три сульфатированных природно-вcтречающихся олигосахарида были вполне сильными ингибиторами ангиогенеза человека, а именно, сульфатированный маннопентаозофосфат(полученный из Pichia holstii), мальтотетраозосульфат и мальтогексаозосульфат. Маннопентаозофосфат и мальтогексаоза были наиболее сильными из этих соединений с 50% ингибирующей концентрацией 2 мкг/мл, тогда как мальтотетраоза давала 50% ингибирование при 20 мкг/мл. Пример явного ингибирования ангиогенеза, индуцируемого 20 мкг/мл мальтогексаозосульфатом, представлен в фиг. 1. Интересно отметить, что гепарин имел небольшую антиангиогенную активность. Таким образом, кажется вероятным, что сульфатированные олигосахариды с относительно короткой цепью необходимы для этого типа активности. Более полное титрование ингибирования ангиогенеза 27 мальтозным рядом олигосахаридов представлено в фиг. 2, а сульфатированным маннопентаозофосфатом в фиг. 3. Можно видеть, что мальтозный ряд обладает небольшой ингибиторной активностью, тогда как мальтотетраозо- и мальтогексаозосульфат были сильными ингибиторами (фиг. 2). Все эксперименты по ангиогенезу, представленные в таблице 1, включали добавление олигосахарида к культуральной среде при начале теста ангиогенеза. Однако, предварительные исследования (данные не представлены) показывают, что добавление мальтогексаозосульфата после начала ответной реакции ангиогенеза может также ингибировать дальнейшее разрастание сосудов, хотя наиболее эффективное ингибирование имеет место, когда соединение добавляют в начале культивирования. Сульфатированные олигосахариды также заметно отличаются по их ингибирующей гепараназу активности, причем наиболее сильными ингибиторами являются сульфатированный маннопентаозофосфат и мальтогексаозосульфат,и активность этих двух соединений подобна активности гепарина (таблица 1). Интересно,что эти два соединения являются также эффективными антиангиогенными соединениями. Однако, ингибирование ангиогенеза не коррелирует с ингибирующей гепараназу активностью многих соединений. Например, сульфатированные циклоамилозы были очень сильными ингибиторами гепараназы, но слабыми ингибиторами ангиогенеза. Мальтозный ряд был также очень информативен в отношении длины цепи и ингибирования гепараназы. Таблица 3 представляет ингибирующую гепараназу активность для всего мальтозного ряда в диапазоне от дисахарида (мальтозы) до гептасахарида (мальтогептаозы). Мальтоза не была ингибирующей, мальтотриоза была слабо ингибирующей, мальтотетраоза обнаружила умеренную ингибирующую активность, тогда как пента-, гекса- и гептасахариды проявляли высокую ингибирующую активность. Таким образом, сульфатированный пентасахарид или сахарид с более длинной цепью необходим для оптимального ингибирования гепараназы. Многие сульфатированные сахара испытывали также in vivo на антиметастатическую активность (таблица 1). В общем, существует умеренно хорошая корреляция между ингибированием гепараназы и антиметастатической активностью. Так, сульфатированный маннопентаозофосфат и мальтогексаозосульфат, два соединения с наивысшей ингибирующей гепараназу активностью, проявляют наибольшую антиметастатическую активность, фактически,они не отличаются значительно от гепарина по их способности предотвращать метастазирование (таблица 1). Два других соединения, циклооктаамилозосульфат и стахиозосульфат также были умеренно эффективными антиметастати 001199 28 ками, и это свойство соответствовало их умеренной ингибирующей гепараназу активности. В целом эти данные предполагают, что сульфатированный маннопентаозофосфат и мальтогексаозосульфат одновременно обладают значительной антиангиогенной, антиметастатической и ингибирующей гепараназу активностями. Антиметастатическая активность мальтозного ряда сульфатированных олигосахаридов представлена более детально в фиг. 4. С увеличением длины цепи наблюдали постоянное увеличение антиметастатической активности олигосахаридов, причем пента-, гекса- и гептасахариды были наиболее активны. При введении внутривенно в дозе 2 мг/мл мальтозосульфат не влиял на метастазирование (фиг. 4 А), но при подкожном введении в дозе 4 мг/мл наблюдали значительное ингибирование метастазирования(фиг. 4 В). Последующие эксперименты обнаружили, что независимо от способа введения (i.v.,s.c. или i.p.) сульфатированные олигосахариды проявляли антиметастатическую активность(данные не представлены). Фактически, антиметастатическую активность мальтозосульфата наблюдали только при введении животным высоких доз. Поскольку мальтозосульфат является очень слабым ингибитором гепараназы, этот результат предполагает, что ингибирование гепараназы может быть не единственным путем,при помощи которого сульфатированные олигосахариды ингибируют метастазирование опухолей, в частности, при использовании высоких доз олигосахаридов. Циклоамилозы сульфатировали и включали в это исследование, так как они представляют собой нелинейные олигосахариды. Интересно отметить, что эти соединения были лишь умеренно активными (таблица 1), что позволяет предполагать, что линейные олигосахариды могут быть необходимыми для оптимальной активности. Кроме того, наиболее активные сульфатированные олигосахариды были гораздо более эффективными ингибиторами ангиогенеза метастазирования и гепараназной активности, чем сурамин (таблица 1), лекарственное средство, подвергнутое клиническим испытаниям в качестве антиангиогенного соединения(42). Поскольку антиангиогенная активность этих соединений не всегда прямо коррелирует с их ингибирующей гепараназу активностью, кажется вероятным, что сульфатированные олигосахариды могли бы ингибировать ангиогенез по какому-то другому механизму. Как упоминалось выше, очень вероятно, что некоторые сульфатированные олигосахариды могут влиять на действие ангиогенных факторов роста нарушением взаимодействий фактора роста и гепарансульфата. Прежние анализы (см. Международную патентную заявкуPCT/AU 95/00105) показали, что тест ангиогенеза человека, используемый в этом примере, сильно зависит от 29 действия эндогенного bFGF и в меньшей степени от действия aFGF и VEGF. Поэтому различные сульфатированные олигосахариды исследовали в отношении их способности действовать в качестве конкурентов взаимодействия bFGF,aFGF и VEGF с гепарином или гепарансульфатом. Было обнаружено, что с увеличением длины цепи сульфатированные олигосахариды мальтозного ряда становятся более эффективными ингибиторами взаимодействия bFGF иaFGF с гепарансульфатами клеточной поверхности (таблица 2), т.е. мальтоза была слабо ингибирующей, тогда как пента-, гекса- и гептасахариды были наиболее активными. Сульфатированный маннопентаозофосфат также обнаруживал значительную ингибиторную активность в этой системе (таблица 2). Полные кривые ингибирования взаимодействияaFGFгепарансульфат мальтозным рядом сульфатированных олигосахаридов представлены в фиг. 5. Дополнительные исследования показали, что мальтогексаозосульфат был также сильным ингибитором связывания радиоактивно меченого гепарина с bFGF и aFGF (данные не показаны). Поскольку мальтогексаозосульфат был одним из наиболее активных антиангиогенных и антиметастатических соединений, влияние степени сульфатирования на его биологическую активность исследовали более детально. Сначала было замечено, что даже хотя некоторая антикоагулянтная активность детектировалась с наиболее высокосульфатированной мальтогексаозой, эта активность все еще была крайне мала по сравнению с активностью гепарина (таблица 2). Однако, с увеличением сульфатирования, имело место непрерывное увеличение способности мальтогексаозы ингибировать активность гепараназы и связывания FGF с гепарансульфатом (таблица 2). Однако, ингибирующая активность выходила на плато в обеих системах при сульфатировании 85% или более. Исследования ингибирования метастазирования (фиг. 6) также показали, что с увеличением степени сульфатирования мальтогексаозосульфат становится более эффективным антиметастатическим лекарственным средством. В противоположность этому, было предположение, что очень высоко сульфатированная мальтогексаоза (90-100% сульфатирования) была менее эффективным ингибитором ангиогенеза(фиг. 7). Эти данные предполагают, что существуют тонкие различия в оптимально сульфатированной олигосахаридной структуре, требующейся для ингибирования ангиогенеза и метастазирования. Тем не менее, был идентифицирован ряд сульфатированных олигосахаридов,полученных из природно-встречающихся олигосахаридов, которые одновременно проявляли сильную антиметастатическую и антиангиогенную активности. Такими соединениями являются сульфатированный маннопентаозофосфат изPichiа holstii и мальтопентаозо-, гексаозо- и гептаозосульфат. Антиангиогенная и антиметастатическая активность сульфатированных синтетических олигосахаридов Сульфатированные синтетические олигосахариды, описанные в примерах 1-5, также испытывали на их биологическую активность. Таблица 3 суммирует способность сульфатированных синтетических олигосахаридов, содержащих маннозу, галактозу или глюкозу, ингибировать свертывание, действие гепараназы и связывание фактора роста с гепарансульфатом. Все испытанные синтетические сульфатированные олигосахариды обнаружили незначительную антикоагулянтную активность. Однако, за исключением трисахаридов маннозы и глюкозы,все другие сульфатированные олигосахариды были умеренно эффективными ингибиторами гепараназной активности и связывания ростовой фактор - гепаран-сульфат. Фактически, общим выводом является, что сульфатированные синтетические олигосахариды, содержащие 4-6 гексозных единиц (т.е. D-маннозу, D-галактозу илиD-глюкозу), являются высокоактивными в этих тестах. Исключением является галактотриозосульфат, который был по существу таким же активным, как и другие члены галактозного ряда. При испытании в тесте ангиогенеза человека сульфатированные маннозные олигосахариды были ингибиторными, хотя пента- и гексасахариды были более активны, чем тетрасахариды (фиг. 8), и были подобны сульфатированному маннопентаозофосфату по их эффективности. Подобным образом, сульфатированные маннозные тетра-, пента- и гексасахариды были так же эффективны, как сульфатированный маннопентаозофосфат, в качестве антиметастатических лекарственных средств (фиг. 9). Галактозусодержащие сульфатированные олигосахариды и глюкогексаозосульфат также ингибировали метастазирование (фиг. 10), хотя они обнаруживают тенденцию к слегка меньшей активности, чем активность содержащих маннозу соединений. Противовоспалительная активность сульфатированных олигосахаридов Как упоминалось выше, ключевым барьером для вхождения лейкоцитов в места воспаления является субэндотелиальная базальная мембрана. Для пересечения этой мембраны лейкоциты должны использовать батарею деградационных ферментов (11). Особенно важна здесь эндоглюкозидаза, гепараназа, которая расщепляет связанные с базальной мембраной сульфатные цепи гепарана и является важной для экстравазации лейкоцитов (12, 13). В самом деле, как и в исследованиях с ингибированием метастазирования (35), сульфатированные полисахариды, ингибирующие гепараназную активность, являются сильными ингибиторами вос 31 паления (43, 44). На основании этих наблюдений специалистам в данной области будет понятно, что сульфатированные олигосахариды,которые являются антиангиогенными и антиметастатическими агентами, должны быть очень эффективными противовоспалительными соединениями. Особенное значение в этом отношении имеют мальтогексаозосульфат и маннопентаозосульфат. Кроме того, поскольку ангиогенез связан с хроническими воспалительными заболеваниями, таким как ревматоидный артрит(18), антиангиогенная активность этих соединений имела бы дополнительную ценность в лечении воспаления. Доказательство в пользу такого предсказания было получено в некоторых моделях воспаления на животных. Во-первых, мальтогексаозосульфат, маннопентаозосульфат и сульфатированный маннопентаозофосфат были способны значительно ингибировать индуцированное тиогликоллатом воспаление в воздушных карманах (таблица 4). В самом деле, в одном эксперименте единственная инъекция маннопентаозосульфата была так же эффективна, как преднизолон, в ингибировании инфильтрации лейкоцитов, которая была преимущественно инфильтрацией нейтрофилов по природе, тогда как мальтогексаозосульфат был несколько менее эффективным. Даже еще большее ингибирование воспалительной реакции наблюдали при инъекции сульфатированных олигосахаридов в виде двух равных доз с интервалом 6 ч. Во-вторых, сульфатированные олигосахариды испытывали на их способность ингибировать мышиную модель хронической астмы. Эта модель характеризуется массивным притоком эозинофилов в легкие мышей индуцированным 32 введением аэроаллергена (41). Такая воспалительная реакция является характеристикой хронической астмы у человека. При введении через миниосмотические насосы мальтогексаозосульфат и маннопентаозосульфат значительно ингибировали накопление эозинофилов в легких мышей (таблица 5). Мальтогексаозосульфат также проявлял некоторую противовоспалительную активность при введении в виде аэрозоля (раствор 40 мг/мл). В-третьих, как маннопентаозосульфат, так и сульфатированный маннопентаозофосфат,значительно ингибировали ЕАЕ в крысиной модели заболевания (таблица 6). В самом деле,некоторые животные, получавшие сульфатированные олигосахариды, не развивали симптомы заболевания. Эти данные согласуются с более ранними исследованиями, показывающими, что сульфатированные полисахариды, ингибирующие активность гепараназы, могут уменьшать тяжесть ЕАЕ (43). Наконец, маннопентаозофосфат испытывали на его способность ингибировать модель воспалительного заболевания пищеварительного тракта в мышах. Эта модель, индуцируемая декстрансульфатом в питьевой воде, вызывает колит, подобный язвенному колиту, и, в меньшей степени, болезнь Хрона. Было обнаружено,что при дозе 20 мг/кг/день сульфатированный маннопентаозофосфат вызывал заметное ослабление острого колита и также предотвращал потерю веса тела, вызываемую этим заболеванием (таблица 7). Контроли в этом эксперименте получали инъекции сульфатированного олигосахарида, но не получали декстрансульфат в воде для питья. Таблица 1 Ингибирование ангиогенеза человека, активности гепараназы и метастазирования сульфатированными формами различных природно-встречающихся олигосахаридов Антикоагу- Концентрация 50% ингиби- МетастазироСоединение Число салянтная аквание (% от харидных рования (мкг/мл) тивностьа (%) Ангиогенез Гепараназа контроля)b единиц Гепарин 60 100 2000 1 203 Маннопентаозофосфат SО 4 с 5 0,2 2 2 313 Раффиноза SО 4 3 1,6 200 50 489 Стахиоза SО 4 4 3,2 2000 12 364 Мальтоза SО 4 2 0 2000 1000 999 Мальтотетраоза SO4 4 0,8 20 10 729 Мальтогексаоза SO4 6 1,6 2 1,5 247 Циклогексаамилоза SO4 6 0,4 200 8 1077 Циклогептаамилоза SO4 7 0,8 200 7 8114 Циклооктаамилоза SO4 8 1,6 200 5 366 Хондроитин-тетра- SO4 4 0 2000 30a Антикоагулянтная активность в процентах от активности гепарина (100%).% По отношению к контролю метастазированиястандартная ошибка среднего (n=4) в легких крыс, получавших клетки 13762 MAT i.v. и 2 мг/мл каждого олигосахарида в момент инъекции опухолевых клеток. Подчеркнутые величины обозначают соединения с наибольшим антиметастатическим действием. с Маннопентаозофосфат, выделенный из дрожжей Pichia holstii ND не определено. Таблица 2 Ингибирование активности гепараназы и связывания факторов роста с гепарансульфатами сульфатированным маннопентаозофосфатом и мальтозным рядом сульфатированных олигосахаридов Сульфатированный оли- Сульфати- % Сульфа- АнтикоагулянтнаяaFGF Мальтоза 6/8 75 0,2 100 200 134 Мальтотриоза 10/11 91 0,8 100 145 58,7 Мальтотетраоза 11/14 79 1,6 25 65 31,5 Мальтопентаоза 15/17 88 3,2 4 37,5 27 Мальтогексаоза 18/20 90 2 5 31,3 27 Мальтогептаоза 18/23 78 3,9 3 10 27 Маннопентаозофосфатd 10/16 63 0,2 5 25 22 Мальтогексаоза 3/20 15 0 100 187 200 Мальтогексаоза 9/20 45 0,8 50 45,6 79 Мальтогексаоза 14/20 70 0,4 20 12,5 12,5 Мальтогексаоза 17/20 85 1,7 6 5,4 10,4 Мальтогексаоза 18/20 90 2 6 5,4 18,8 Мальтогексаоза 20/20 100 3,3 5 5,4 19,7 а Истинное число присоединенных сульфатных групп/теоретическое максимальное число сульфатных групп, которое может быть связано с каждой молекулой.b Антикоагулянтная активность в процентах от активности гепарина (100%).c Концентрация соединения, требующаяся для ингибирования на 50% активности тромбоцитов человека или связывания мышиных клеток 3 Т 3 с иммобилизованными aFGF/bFGF. В случае гепараназного теста IC50 для гепарина была 2 мкг/мл.d Маннопентаозофосфат, выделенный из дрожжей Pichia holstii. ND = не определено. Таблица 3 Ингибирование активности гепараназы, связывания факторов роста с гепарансульфатами сульфатированными формами различных синтетических олигосахаридов Сульфатированный Сульфати- % Сульфа- Антикоагулянтнаяb олигосахарид рование тирования активность (%) ГепараназаND а Истинное число присоединенных сульфатных групп/теоретическое максимальное число сульфатных групп, которое может быть связано с каждой молекулой.b Антикоагулянтная активность в процентах от активности гeпарина (100%). с Концентрация соединения, требующаяся для ингибирования на 50% активности тромбоцитов человека или связывания мышиных клеток 3 Т 3 с иммобилизованными aFGF/bFGF. В случае гепараназного теста IC50 для гепарина была 2 мкг/мл. ND = не определено. Таблица 4 Действие сульфатированных олигосахаридов на воспаление в воздушных карманахa Инфильтрат лейкоцитов в воздушном карманеba Воспаление в воздушном кармане индуцировали инъекцией тиогликоллата и приток лейкоцитов оценивали спустя 17 ч. Лекарственные средства инъецировали подкожно одновременно с тиогликоллатом для эксп. 1. В эксп. 2 сульфатированные олигосахариды инъецировали подкожно при 0 ч. и 7 ч. после инъекции тиогликоллата.b Данные, представленные в виде процента от контрольного числа лейкоцитов в инфильтратах воздушных кармановстандартная ошибка среднего. Контроли инъецировали тиогликоллатом, но они не получали лекарственного средства, только инъекцию физиологического раствора. Инфильтрат лейкоцитов в воздушных карманах, которые получили только инъекцию физиологического раствора, (фон), был 92% от наблюдаемого после инъекции тиогликоллата.ND = не определено. Таблица 5 Действие сульфатированных олигосахаридов на индуцированное овальбумином (OVA) накопление эозинофилов в легких мышейa Эозинофилы/мл BALF Сульфатированный олигосахарид Способ введения Дозаa Мышей сенсибилизировали к OVA и затем приток эозинофилов в легкие индуцировали аэрозольным введением OVA. Сульфатированные олигосахариды вводили либо i.p. миниосмотическими насосами, либо через легкие в виде аэрозоля.b Данные, выраженные в виде процента от контрольного числа эозинофилов в жидкости бронхоальвеолярного лаважа (BALF)стандартная ошибка, причем контролями были животные, которые были сенсибилизированы OVA и получали физиологический раствор либо через миниосмотические насосы,либо через легкие в виде аэрозоля.c Концентрация сульфатированного олигосахарида в аэрозольном растворе. Таблица 6 Действие сульфатированных олигосахаридов на воспринимаемо переносимый экспериментальный аутоиммунный энцефаломиелит (EAE)а Число с ЕАЕ/ общее Средний день появ- Тяжесть заболевания Сульфатированный олигосахаридb число ления ЕАЕcb Сульфатированные олигосахариды, вводимые через подкожные миниосмотические насосы, вставляемые во время перенесения клеток, подающие дозу 70 мг/кг/день.c Средний день появления ЕАЕ в животных с развившимся заболеванием.d Тяжесть заболевания обозначает кумулятивную клиническую оценку в баллах животных. Таблица 7 Действие сульфатированного маннопентаозофосфата на воспалительное заболевание пищеварительного тракта в мышаха Не получавшие обработкиc Получавшие обработкуcb День Средняя оценка заболеваСредняя оценка заболеваВес тела (г) Вес тела (г) нияd ния 0 0 23,1 0 22,1 1 0 23,2 0 22,1 2 0 23,6 0 22,6 3 0 23,5 0 22,5 4 0 23,3 0 21,9 5 0 23,4 0 21,9 6 0,47 23,3 0,07 22,4 7 1,40 22,7 0,40 22,4 8 2,47 22,1 0,40 22,3 9 2,87 21,4 0,67 22,2 10 2,00 20,7 0,93 22,1 а Воспалительное заболевание пищеварительного тракта, индуцированное введением декстрансульфата в воде для питья.b Дни после начала введения декстрансульфата.c Не получавшие обработки животные получали три раза в день инъекции носителя, тогда как получавшие обработку животные получали три раза в день инъекции сульфатированного маннопентаозофосфата в дозе 20 мг/кг/день.d Средняя оценка заболевания представляет собой сумму баллов как диареи, так и ректального кровотечения для животных в каждой временной точке. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Сульфатированный олигосахарид,имеющий общую формулу I(I) где R1 и R2 и каждый Rx обозначают моносахаридную единицу и могут быть одинаковыми или различными, причем соседние моносахаридные единицы связаны гликозидными связями 12,13, 14 и/или 16, и n является целым числом от 1 до 6; при условии, что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки. 2. Сульфатированный олигосахарид по п.1,отличающийся тем, что n является целым числом от 1 дo 4, предпочтительно 3 или 4. 3. Сульфатированный олигосахарид по п.1 или 2, отличающийся тем, что моносахаридная единица является гексозой, выбранной из груп пы, состоящей из фруктозы, маннозы, альтрозы,аллозы, талозы, галактозы, идозы и гулозы. 4. Сульфатированный олигосахарид по п.1,отличающийся тем, что олигосахарид имеет общую формулу II(II) где каждая группа Ry является одной и той же и каждая представляет собой моносахаридную единицу, причем соседние моносахаридные единицы связаны гликозидными связями 13,14 и/или 16, и n является целым числом от 1 до 6; при условии, что полисахарид не является соединением, содержащим 1-4 связанные глюкозные остатки. 5. Сульфатированный олигосахарид по п.4,отличающийся тем, что n является целым числом от 1 до 4, предпочтительно 3 или 4. 6. Сульфатированный олигосахарид по п.4 или 5, отличающийся тем, что Ry представляет собой моносахаридную единицу, которая явля 39 ется гексозой, выбранной из группы, состоящей из маннозы, альтрозы, аллозы, талозы, галактозы, идозы и гулозы. 7. Сульфатированный олигосахарид по п.6,отличающийся тем, что Ry представляет собой маннозу или галактозу. 8. Сульфатированный олигосахарид по п.1 или 4, отличающийся тем, что олигосахарид представляет собой природно-встречающийся олигосахарид. 9. Сульфатированный олигосахарид по п.8,отличающийся тем, что олигосахарид выбран из раффинозы и стахиозы. 10. Сульфатированный олигосахарид по п.1 или 4, отличающийся тем, что олигосахарид получен ферментативной или химической деградацией природно-встречающегося полисахарида. 11. Сульфатированный олигосахарид по п.10, отличающийся тем, что олигосахарид представляет собой соединение, произведенное из хондроитина или эксoполисахарида, полученных из диплоидных дрожжей Pichia holstii. 12. Сульфатированный олигосахарид по п.11, отличающийся тем, что олигосахарид выбран из хондроитин-тетра-, гекса- и октасахаридов. 13. Сульфатированный олигосахарид по п.11, отличающийся тем, что олигосахарид является маннопентаозофосфатом из дрожжейPichia holstii. 14. Способ антиангиогенного, антиметастатического и/или противовоспалительного лечения человека или другого теплокровного больного животного, нуждающегося в таком лечении, включающий в себя введение пациенту эффективного количества, по меньшей мере,одного сульфатированного олигосахарида согласно пп.1-13. 15. Способ по п.14, отличающийся тем, что включает в себя лечение ангиогенез-зависимого заболевания, в том числе ангиогенеза, связанного с ростом твердых опухолей, пролиферативными ретинопатиями и ревматоидным артритом. 16. Способ по п.14, отличающийся тем, что включает в себя лечение воспалительных заболеваний и состояний, в которых ингибирующая 40 гепараназу активность ингибирует инфильтрацию лейкоцитов, в том числе хронических воспалительных заболеваний, таких как ревматоидный артрит, множественный склероз, инсулин-зависимый сахарный диабет, такие заболевания, как язвенные колиты и воспалительное заболевание пищеварительного тракта (болезнь Хрона), отторжение трансплантата и хроническая астма. 17. Применение сульфатированного олигосахарида по любому из пп.1-13 в качестве антиангиогенного, антиметастатического и/или противовоспалительного средства в лечении больного теплокровного животного, в том числе человека. 18. Применение по п.17, отличающееся тем, что включает в себя лечение ангиогенеззависимого заболевания, в том числе ангиогенеза, связанного с ростом твердых опухолей, пролиферативными ретинопатиями и ревматоидным артритом. 19. Применение по п.17, отличающееся тем, что включает в себя лечение воспалительных заболеваний и состояний, в которых ингибирующая гепараназу активность ингибирует инфильтрацию лейкоцитов, в том числе хронических воспалительных заболеваний, таких как ревматоидный артрит, множественный склероз,инсулин-зависимый сахарный диабет, такие заболевания как язвенные колиты и воспалительное заболевание пищеварительного тракта(болезнь Хрона), отторжение трансплантата и хроническая астма. 20. Фармацевтическая или ветеринарная композиция для антиангиогенного, антиметастатического и/или противовоспалительного лечения, содержащая, по меньшей мере, один сульфатированный олигосахарид согласно любому из пп.1-13 вместе с его фармацевтически приемлемым и приемлемым в ветеринарии носителем или разбавителем. 21. Лекарственное средство для антиангиогенного, антиметастатического и/или противовоспалительного лечения человека или другого больного теплокровного животного, отличающееся тем, что содержит, по меньшей мере,один сульфатированный олигосахарид по любому из пп.1-13.
МПК / Метки
МПК: C08B 37/00, A61K 31/739, C07H 11/00
Метки: лечения, животных, композиция, теплокровных, фармацевтическая, основе, применение, олигосахарид, сульфатированный
Код ссылки
<a href="https://eas.patents.su/23-1199-sulfatirovannyjj-oligosaharid-ego-primenenie-dlya-lecheniya-teplokrovnyh-zhivotnyh-i-farmacevticheskaya-kompoziciya-na-ego-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфатированный олигосахарид, его применение для лечения теплокровных животных и фармацевтическая композиция на его основе</a>
Предыдущий патент: Мультиматричное мультиспецифическое электрохемилюминесцентное испытание
Следующий патент: Фармацевтическая композиция, способ лечения, способ ингибирования иммунного ответа
Случайный патент: Прибор для измерения метеорологической дальности видимости