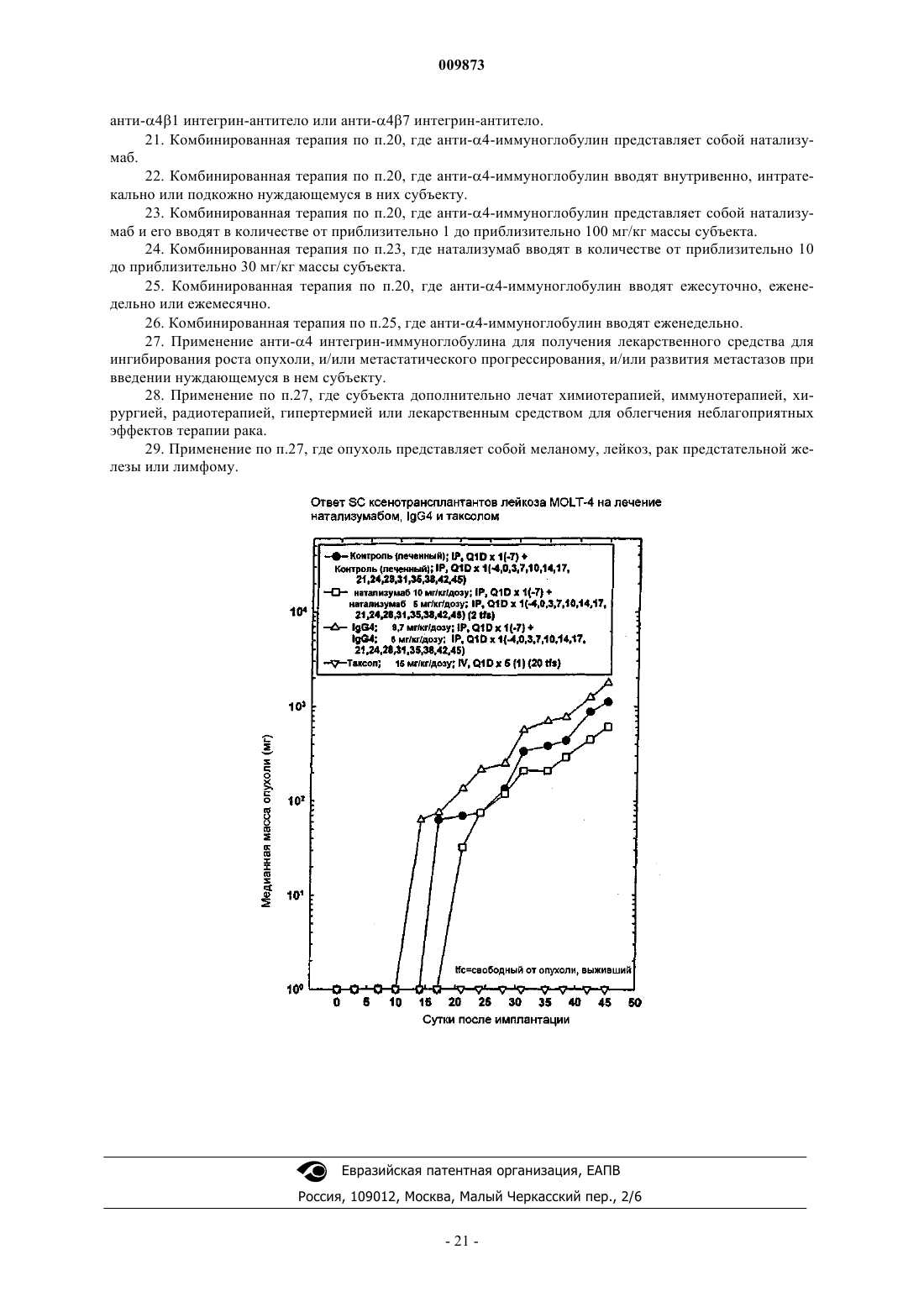
Способ ингибирования роста опухоли и/или метастатического прогрессирования
Формула / Реферат
1. Способ ингибирования роста опухоли, и/или метастатического прогрессирования, и/или развития метастазов, предусматривающий введение анти-a4-иммуноглобулина нуждающемуся в этом субъекту в количестве, достаточном для ингибирования роста опухоли и/или метастазирования.
2. Способ по п.1, где анти-a4-антитело связывает a4b1 интегрин и/или a4b7 интегрин.
3. Способ по п.1, где анти-a4-иммуноглобулин представляет собой натализумаб.
4. Способ по п.1, где опухоль представляет собой меланому, рак предстательной железы, лейкоз или лимфому.
5. Способ по п.4, где меланома представляет собой кожную меланому, метастатическую меланому или внутриглазную меланому.
6. Способ по п.4, где лимфома представляет собой неходжкинскую лимфому, кожную Т-клеточную лимфому или лимфому Ходжкина.
7. Способ по п.4, где лейкоз представляет собой хронический миелолейкоз, острый миелолейкоз, острый лимфобластный лейкоз взрослых, острый миелолейкоз, острый лимфобластный лейкоз зрелых В-клеток, хронический лимфолейкоз, пролимфоцитарный лейкоз или лейкоз ворсистых клеток.
8. Способ по п.3, где субъекту вводят натализумаб в количестве от приблизительно 1 до приблизительно 100 мг/кг массы субъекта.
9. Способ по п.8, где субъекту вводят натализумаб в количестве от приблизительно 1 до приблизительно 10 мг/кг массы субъекта.
10. Способ по п.8, где натализумаб вводят в количестве от приблизительно 1 до приблизительно 20 мг/кг массы субъекта.
11. Способ по п.4, где опухоль представляет собой меланому и субъекту вводят натализумаб после хирургического удаления меланомы.
12. Способ по п.4, где опухоль представляет собой меланому и субъекта дополнительно подвергают хирургическому лечению, перфузии отдельной конечности, местной инфузионной химиотерапии, системной химиотерапии или иммунотерапии вторым антителом или антисывороткой для лечения меланомы.
13. Способ по п.12, где второе антитело представляет собой анти-GM2 ганглиозид-антитело, анти-GD2 ганглиозид-антитело или анти-GD3 ганглиозид-антитело.
14. Способ по п.12, где местная инфузионная химиотерапия или системная химиотерапия предусматривает по меньшей мере одно химиотерапевтическое средство, выбранное из группы, состоящей из дакарбазина, кармустина, ломустина, тауромустина, фотемустина, семустина, цисплатина, карбоплатина, винкристина, винбластина, виндезина, таксола, дибромдулыдитола, деторубицина, пиритрексима и интерферона.
15. Способ по п.14, где интерферон представляет собой интерферон-a2.
16. Способ по п.1, где метастаз представляет собой метастаз в мозге, легком, печени или кости.
17. Способ по п.16, где метастаз представляет собой метастаз легкого и опухоль представляет собой меланому.
18. Способ по п.1, где опухоль представляет собой лимфому и субъекта дополнительно лечат одним или несколькими химиотерапевтическими средствами и/или радиотерапией.
19. Комбинированная терапия для ингибирования роста опухоли и/или метастатического прогрессирования, и/или развития метастазов, предусматривающая введение анти-a4 интегрин-иммуноглобулина или иммуноглобулина против лиганда a4 интегрина и химиотерапевтического средства, иммунотерапевтического средства и/или радиотерапию.
20. Комбинированная терапия по п.19, где анти-a4 интегрин-иммуноглобулин представляет собой анти-a4b1 интегрин-антитело или анти-a4b7 интегрин-антитело.
21. Комбинированная терапия по п.20, где анти-a4-иммуноглобулин представляет собой натализумаб.
22. Комбинированная терапия по п.20, где анти-a4-иммуноглобулин вводят внутривенно, интратекально или подкожно нуждающемуся в них субъекту.
23. Комбинированная терапия по п.20, где анти-a4-иммуноглобулин представляет собой натализумаб и его вводят в количестве от приблизительно 1 до приблизительно 100 мг/кг массы субъекта.
24. Комбинированная терапия по п.23, где натализумаб вводят в количестве от приблизительно 10 до приблизительно 30 мг/кг массы субъекта.
25. Комбинированная терапия по п.20, где анти-a4-иммуноглобулин вводят ежесуточно, еженедельно или ежемесячно.
26. Комбинированная терапия по п.25, где анти-a4-иммуноглобулин вводят еженедельно.
27. Применение анти-a4 интегрин-иммуноглобулина для получения лекарственного средства для ингибирования роста опухоли, и/или метастатического прогрессирования, и/или развития метастазов при введении нуждающемуся в нем субъекту.
28. Применение по п.27, где субъекта дополнительно лечат химиотерапией, иммунотерапией, хирургией, радиотерапией, гипертермией или лекарственным средством для облегчения неблагоприятных эффектов терапии рака.
29. Применение по п.27, где опухоль представляет собой меланому, лейкоз, рак предстательной железы или лимфому.
Текст
009873 Перекрестная ссылка на родственные заявки Заявка на данное изобретение имеет приоритет предварительной заявки США 60/541946, поданной 6 февраля 2004 г. Область изобретения Изобретение относится к способу применения иммуноглобулина против 4 интегрина или иммуноглобулина против лиганда 4 интегрина (например, MadCAM-1 и VCAM-1) для лечения субъектов,страдающих злокачественным и/или метастазирующим заболеванием, включающим экспрессию 4 интегрина. Предоставлено также применение лекарственного средства для ингибирования роста опухоли,и/или прогрессирования метастазирования, и/или развития метастазов. Предпосылки изобретения Известно, что и доброкачественные, и злокачественные опухоли экспрессируют белки в наборах, не обнаруживаемых в нормальных клетках. Набор белков, демонстрируемый опухолевыми или злокачественными клетками, может отражать стадию заболевания (т.е. ранняя стадия или метастазирование). Когда злокачественность прогрессирует, клетки имеют тенденцию отличаться все больше от ткани, из которой они произошли. Поскольку рак прогрессирует, становясь менее дифференцированным, независимо от схемы разделения на стадии, применяемой для определения прогрессирования рака, клетки становятся метастазирующими с большей вероятностью и/или устойчивыми к общепринятой терапии. Терапия рака может включать в себя один или несколько из следующих способов лечения: химиотерапию, хирургию,радиотерапию, гипертермию, иммунотерапию, трансплантацию костного мозга, гормонотерапию и биотерапию. Интегрины представляют собой семейство гликопротеинов клеточной поверхности, вовлеченных в клеточную адгезию, миграцию и активацию иммунной клетки. Альфа-4 интегрин экспрессирует все циркулирующие лейкоциты, за исключением нейтрофилов, и он формирует гетеродимерные рецепторы в соединении с бета-1 (1) или бета-7 (7) субъединицами интегринов. И альфа-4 бета-1- (41) интегрин,и альфа-4 бета-7 (47) интегрин играют роль в миграции лейкоцитов через эндотелий сосудов (Springeret al., Cell, 1994, 76: 301-14; Butcher et al., Science, 1996, 272: 60-6) и вносят вклад в активацию и выживание клеток внутри паренхимы (Damle et al., J. Immunol., 1993; 151: 2368-79; Koopman et al., J. Immunol.,1994, 152: 3760-7; Leussink et al., Acta Neuropathol., 2002, 103: 131-136). 41 интегрин конститутивно экспрессирует лимфоциты, моноциты, макрофаги, тучные клетки, базофилы и эозинофилы. Альфа-4 бета-1 (известный также как очень поздний антиген-4, VLA-4), связывает молекулу адгезии сосудов-1 (VCAM-1) (Lobb et al., J. Clin. Invest. 1994, 94: 1722-8), которую экспрессирует эндотелий сосудов во многих участках хронического воспаления (Bevilacqua et al., 1993, Annu. Rev. Immunol., 11: 767-804; Postigo et al., 1993, Res. Immunol., 144: 723-35). У 41 интегрина есть другие лиганды, включая фибронектин и другие компоненты внеклеточного матрикса (ЕСМ). Альфа-4 бета-7 интегрин взаимодействует с молекулой клеточной адгезии мукозным адрессином(MAdCAM-1) и опосредует хоминг лимфоцитов в кишечнике (Farstad et al., 1997, Am. J. Pathol., 150: 18799; Issekutz, 1991, J. Immunol. 147: 4178-84). Таким образом, существует необходимость в новых средствах, композициях и способах, ингибирующих рост и метастазирование раковой опухоли, которые можно применять самостоятельно или во взаимодействии с другими средствами для лечения рака, особенно опухолей поздней стадии, как правило, приводящих к метастазам. Сущность изобретения Изобретение относится к новым способам, композициям и комбинированной терапии для лечения опухолей, и/или метастазирования, и/или ингибирования роста опухолей. Способы, композиции и комбинированная терапия предпочтительно направлены на лечение раков с экспрессией 4, таких как лимфомы, лейкозы, меланомы, опухоль предстательной железы и метастазирования любой первичной опухоли, экспрессирующей 4. Соответственно, в одном из аспектов изобретение относится к способу ингибирования роста опухоли, и/или метастазирования, или метастатического распространения, предусматривающему введение анти-4-иммуноглобулина (иммуноглобулина против 4) или иммуноглобулина против лиганда 4 интегрина (например, MadCAM-1 и VCAM-1) нуждающемуся в этом субъекту в количестве, достаточном для ингибирования роста опухоли, и/или метастазирования, и/или метастатического распространения. Анти 4-антитело предпочтительно связывает 41 интегрин и/или 47 интегрин, и более предпочтительно иммуноглобулин представляет собой моноклональное антитело (например, натализумаб). В дополнительном аспекте изобретения подлежащая лечению опухоль представляет собой солидную опухоль или опухоль мягкой ткани. Опухоли солидной ткани, рассматриваемые для лечения с применением данных способов, комбинированной терапии и анти-4 интегрин-иммуноглобулинов или иммуноглобулинов против лигандов анти-4 интегрина, включают в себя в качестве неограничивающих примеров меланомы (например, кожную меланому, метастатическую меланому или внутриглазную меланому), раки предстательной железы и метастатические очаги других первичных опухолей. В другом аспекте изобретения подлежащая лечению опухоль представляет собой опухоль мягкой ткани, такую как опухоль кости, лейкоз (например, хронический миелолейкоз, острый миелолейкоз, ост-1 009873 рый лимфобластный лейкоз взрослых, острый миелолейкоз, острый лимфобластный лейкоз зрелых Вклеток, хронический лимфолейкоз, пролимфоцитарный лейкоз или лейкоз ворсистых клеток), или лимфому (например, неходжкинскую лимфому, кожную Т-клеточную лимфому или лимфому Ходжкина). В дополнительном аспекте изобретение относится к введению субъекту анти-4 интегриниммуноглобулина в количестве от приблизительно 1 мг/кг массы субъекта до приблизительно 100 мг/кг массы субъекта (и любого целого значения, попадающего в данный диапазон). Более предпочтительно,анти-4 интегрин-иммуноглобулин вводят субъекту в количестве от приблизительно 1 мг/кг массы субъекта до приблизительно 10 мг/кг массы субъекта. Предпочтительно иммуноглобулин представляет собой натализумаб. В дополнительном аспекте изобретения иммуноглобулины можно вводить самостоятельно или в сочетании с другими воздействиями в формате множественных воздействий. Например, если опухоль представляет собой меланому, субъекту можно вводить натализумаб после хирургического удаления меланомы. Если опухоль представляет собой меланому, вышеописанный способ можно дополнительно объединять с такими воздействиями на рак, как перфузия отдельной конечности, местная инфузионная химиотерапия, системная химиотерапия или иммунотерапия вторым антителом (например, анти-GM2 ганглиозид-антителом, анти-GD2 ганглиозид-антителом, анти-GD3 ганглиозид-антителом), или антисывороткой. Химиотерапевтическое средство может представлять собой одно или несколько из следующих: дакарбазин, кармустин, ломустин, тауромустин, фотемустин, семустин, цисплатин, карбоплатин,винкристин, винбластин, виндезин, таксол, дибромдульцитол, деторубицин, пиритрексим и интерферон(например, интерферон-2). В другом аспекте изобретение относится к способу лечения метастазов в мозге, легком, печени или кости. В еще одном аспекте изобретение относится к способу лечения лимфом с применением иммуноглобулинов против 4 интегринов или их лигандов (например, MadCAM-1 и VCAM-1) в сочетании с другими терапевтическими воздействиями на лимфомы. В другом аспекте изобретение относится к комбинированной терапии, где иммуноглобулины против 4 интегрина или его лигандов (например, MadCAM-1 и VCAM-1) применяют в сочетании с другими терапевтическими воздействиями на опухоль, как известно в данной области. В дополнительном аспекте изобретение относится к применению для получения лекарственного средства для ингибирования роста опухоли, и/или ингибирования метастазирования, и/или для ингибирования или замедления прогрессирования заболевания при введении нуждающемуся субъекту, содержащего анти-4 интегриниммуноглобулин или иммуноглобулин против лиганда 4 интегрина (например, MadCAM-1 и VCAM-1). В дополнительном аспекте изобретение относится к применению анти-4 интегриниммуноглобулина для получения лекарственного средства для ингибирования роста опухоли, и/или прогрессирования метастазирования, и/или развития метастазов при введении нуждающемуся субъекту. Предпочтительно субъекта дополнительно подвергают лечению химиотерапией, иммунотерапией, хирургией, радиотерапией, гипертермией или лекарственным средством для облегчения неблагоприятных эффектов лечения рака. Предпочтительно опухоль представляет собой меланому, лейкоз, рак предстательной железы или лимфому. Краткое описание чертежа Чертеж представляет собой график, показывающий первичный рост опухоли ксенотрансплантантовMOLT-4 при введении контроля, таксола, IgG4 или натализумаба после установления наличия опухоли. Мышей SCID подвергали лечению солевым раствором (N=20), натализумабом (N=20), IgG4 (N=20) или таксолом (N=20). Солевой раствор, натализумаб и IgG4 вводили на -7, -4, 0, 3, 7, 10, 14, 17, 21, 24, 28, 31,35, 38, 42 и 45 сутки. Ксенотрансплантанты лейкоза MOLT-4 имплантировали подкожно на 0 сутки. Таксол вводили внутривенно на сутки 1-5. Опухоли измеряли дважды в неделю. Подробное описание изобретения 1. Определения и акронимы. В соответствии с подробным описанием применяют следующие аббревиатуры и определения. Следует отметить, что, как применяют здесь, формы единственного числа и и включают в себя формы множественного числа объектов ссылки, если контекст ясно не требует другого. Так, например, ссылка на антитело включает в себя множество данных антител, и ссылка на дозу включает в себя ссылку на одну или несколько доз или их эквивалентов, известных специалистам в данной области, и так далее. Обсуждаемые здесь публикации приведены исключительно для раскрытия их сущности до даты подачи заявки на данное изобретение. В заявке ничего нельзя толковать как допущение, что настоящее изобретение не правомочно использовать такую публикацию на основании предшествующего уровня техники настоящего изобретения. Кроме того, приведенные даты публикации могут отличаться от фактических дат публикации, которые могут нуждаться в независимом подтверждении. 1.1 Определения. Термин субъект или пациент, как применяют здесь, предназначен для обозначения млекопитающего. Млекопитающее может относиться к псовым, кошачьим, приматам, бычьим, овечьим, свиным,-2 009873 верблюдовым, козьим, грызунам или лошадиным. Предпочтительно млекопитающее представляет собой человека. Под натализумабом или Tysabri понимают гуманизированное антитело против VLA-4, как описано в патентах США 5840299 и 6033665, которые приведены здесь в качестве ссылки в полном объеме. Здесь рассматривают также другие специфические к VLA-4 антитела. Такие анти-VLA-4 антитела и иммуноглобулины включают в себя в качестве неограничивающих примеров иммуноглобулины,описанные в патентах США 6602503 и 6551593, опубликованной патентной заявке США 20020197233 (Relton et al.). Антитело можно получить посредством способов, описанных в данных патентах и патентных заявках, посредством экспрессии в клетках млекопитающих или посредством экспрессии в экспрессионных системах трансгенных животных (например, козы). Термин эффективность, как применяют здесь, относится к эффективности конкретного режима лечения. Эффективность можно измерять на основании таких характеристик (но не ограничиваясь ими),как ингибирование роста опухоли, уменьшение массы опухоли, уменьшение метастатических очагов, как оценивают, например, рентгенографией, замедление роста опухоли, отсутствие детектируемых ассоциированных с опухолью антигенов, и подобных. Дополнительные способы оценки прогрессии опухоли обсуждаются здесь, и они известны лечащим и диагностирующим врачам. Фразы фармацевтически пригодный носитель и фармацевтически пригодный эксципиент предназначены для обозначения любого соединения (соединений), применяемых для формирования части состава, предназначенной, чтобы действовать просто как носитель, т.е. не предназначенной, чтобы обладать биологической активностью самостоятельно. Фармацевтически пригодный носитель или эксципиент, как правило, является безопасным, не токсичным и не является биологически или иным образом неприемлемым. Фармацевтически пригодный носитель или эксципиент, как применяют здесь, включает в себя один и несколько таких носителей или эксципиентов. Термины обработка, лечение и подобные применяют здесь, как правило, для обозначения получения желательного фармакологического и физиологического эффекта. Более конкретно, описанные здесь реагенты, которые применяют для лечения субъекта с опухолью и метастазированием, как правило,предоставляют в терапевтически эффективном количестве для достижения одного или нескольких из следующего: ингибирования роста опухоли, уменьшения массы опухоли, исчезновения метастатических очагов, ингибирования развития новых метастатических очагов после начала лечения или уменьшения опухоли, так что заболевание становится необнаруживаемым (как оценивают, например, рентгенографией, анализом биологических жидкостей, цитогенетически, флуоресцентной гибридизацией in situ, иммуноцитохимически, анализами колоний, многопараметрической проточной цитометрией или полимеразной цепной реакцией). Термин лечение, как применяют здесь, охватывает любое лечение заболевания у млекопитающего, особенно у человека. Под терапевтически эффективным количеством понимают количество средства, реагента, соединения, композиции или сочетания реагентов, описанных здесь, которое при введении млекопитающему является достаточным, чтобы быть эффективным против опухоли. Термин опухоль предназначен, чтобы включать в себя и доброкачественные, и злокачественные новообразования, или рак. Таким образом, термин рак, если не указано иначе, может включать в себя и доброкачественные, и злокачественные новообразования. Предпочтительно опухоль является злокачественной. Опухоль может представлять собой опухоль солидной ткани, такую как меланома, или опухоль мягкой ткани, такую как лимфома, лейкоз или рак кости. Термин первичная опухоль означает первоначальную неоплазию без метастатического очага, локализованного в другой ткани или органе тела пациента. Термины метастазирование, метастазы и метастатический очаг означают группу клеток, мигрировавших в участок, отдаленный относительно первичной опухоли. 1.2 Акронимы. Следующие акронимы являются общеупотребительными для связанных терминов и известны в данной области. 2. Заболевания. В одном аспекте изобретения способы и композиции, описанные здесь, можно применять для ингибирования или замедления прогрессирования злокачественных новообразований. Данные злокачественные новообразования могут представлять собой опухоли солидных или мягких тканей. Опухоли мягких тканей включают в себя раки кости, лимфомы и лейкозы. Другой аспект по изобретению представляет собой применение способов и композиций для ингибирования или предупреждения метастазов или прогрессирования метастазирования. Таким образом, в одном аспекте изобретение относится к лечению опухолей или метастазирования иммуноглобулином. Данный иммуноглобулин может быть направлен против 4 и, предпочтительно,-5 009873 41 интегрина и/или 47 интегрина. Альтернативно, иммуноглобулин может быть направлен против лигандов 4 (например, VCAM-1, MadCAM-1). Данные иммуноглобулины можно применять по отдельности, в сочетании друг с другом или в сочетании с другими терапевтическими воздействиями, включающими в себя в качестве неограничивающих примеров химиотерапию, хирургию, радиотерапию, гипертермию, иммунотерапию, гормонотерапию, биологическую терапию (например, иммунные эффекторные механизмы, приводящие к уничтожению клеток, цитокины, иммунотерапию, интерфероны, интерлейкин-2, терапию противораковой вакциной и адоптивную терапию), и средства для облегчения неблагоприятных побочных эффектов данных воздействий на рак. 2.1 Лечение рака. Термин рак охватывает совокупность злокачественных новообразований, где каждый рак каждого органа состоит из множества подтипов. Как правило, на время диагностирования рака рак фактически состоит из множественных субпопуляций клеток с разнообразными генетическими, биохимическими, иммунологическими и биологическими характеристиками. Типы раков, подлежащих лечению композициями и способами по настоящему изобретению, представляют собой такие, которые демонстрируют наличие 41 интегринов (т.е. 41 и/или 47) или их лиганды (например, VCAM-1 и/или MadCAM-1). Предпочтительные раки включают в себя в качестве неограничивающих примеров меланомы (например, кожную меланому, метастатические меланомы, и внутриглазные меланомы), рак предстательной железы, лимфомы (например, кожную Т-клеточную лимфому, грибовидный микоз, лимфомы Ходжкина и неходжкинские лимфомы, и первичные лимфомы центральной нервной системы), лейкозы (например, острый лимфобластный лейкоз пре-В-клеток, хронический и острый лимфоцитарный лейкоз, хронический и острый миелолейкоз, острый лимфобластный лейкоз взрослых, острый лимфобластный лейкоз зрелых В-клеток, пролимфоцитарный лейкоз, лейкоз ворсистых клеток и хронический лимфоцитарный лейкоз Т-клеток), и метастатические опухоли, несущие данные белки на поверхности клеток. Следует отметить, что хотя грибовидный микоз (MF), синдром Сезари, ретикулоклеточную саркому кожи и некоторые другие кожные лимфоцитарные дискразии считали различными состояниями, в настоящее время их распознают как различные клинические проявления кожной Т-клеточной лимфомы (CTCL), и, таким образом, включают в данный термин. См. Lynn D.Wilson et al., "Cutaneous T-Cell Lymphomas", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY 2220-2232 (Vincent T. DeVita, Jr. et al., editors, 5th ed. 1997); Bank et al., 1999, J. Cutan. Pathol., 26(2): 65-71. 2.2 Метастазирование. После диагностирования опухоли у пациента первым вопросом является, прогрессирует ли опухоль и распространяется ли в регионарные лимфоузлы и в отдаленные органы. В конечном счете, большинство смертей от рака происходят от метастазов, устойчивых к общепринятому лечению рака. Метастазы могут быть локализованы в различных органах и в различных участках того же органа, что делает их полное уничтожение посредством хирургии, облучения, лекарственных средств и/или биотерапии почти невозможным. С применением описанных здесь способов, комбинированной терапии и композиций предполагают также лечение метастатического рака. Как правило, рост опухолей начинается только в одном местоположении ткани-источника. При прогрессировании рака, рак может мигрировать в отдаленное местоположение у пациента. Например, рак, начинающийся в предстательной железе, может мигрировать в легкое. Другие местоположения, общие для метастазирования, предполагаемые здесь, включают в себя метастазирование рака в мозг, легкое, печень и кость. Обнаружили повышенную экспрессию некоторых субъединиц интегринов (т.е. 2, 4 и 3) в метастазах по сравнению с нормальной тканью предстательной железы и нормальными меланоцитами. Hartstein et al., 1997, Ophthal. Plast. Reconstr. Surg., 13(4): 22738. Существуют необходимые стадии формирования метастазов всех опухолей. Данные стадии включают в себя следующие.(1) После неопластической трансформации развивающуюся пролиферацию неопластических клеток поддерживает окружающая среда органа/ткани, в которой локализовано неопластическое образование.(2) Образование новых сосудов или ангиогенез опухоли для дальнейшего роста более 1-2 мм в диаметре.(3) Понижающая регуляция экспрессии прикрепляющих молекул, отчего клетки обладают увеличенной подвижностью или способностью отделяться от первичного очага.(4) Отделение и эмболизация отдельных опухолевых клеток или клеточных агрегатов с быстрым уничтожением огромного большинства данных клеток.(5) После выживания опухолевых клеток после стадий отделения и эмболизации, они должны продолжать пролиферацию внутри просвета кровяного сосуда. Затем клетки продолжают проникать из сосудов в паренхиму органа посредством механизма, сходного с механизмом, действующим при инвазии.(6) Опухолевые клетки с подходящими рецепторами клеточной поверхности могут отвечать на паракринные факторы роста и, следовательно, пролиферировать в паренхиме органа.(7) Уклонение опухолевой клетки от защиты хозяина (специфического и неспецифического иммун-6 009873 ного ответа).(8) Для пролиферации метастаза более 1-2 мм в диаметре, в метастазе должна развиваться сосудистая сеть. Таким образом, если дать первичной опухоли достаточно времени для прохождения данных стадий,она будет формировать метастатические очаги в участке или участках, отдаленных от первичной опухоли. Описанные здесь реагенты, способы и комбинированная терапия ингибируют или предотвращают одну или несколько стадий метастатического процесса. Дополнительные детали механизма и патологии метастазирования опухоли см. в Isaiah J. Fidler, "Molecular Biology of Cancer: Invasion and Metastasis", inCANCER: PRINCIPLESPRACTICE OF ONCOLOGY 135-152 (Vincent T. DeVita et al., editors, 5th ed.,1997). Соответственно, в одном аспекте изобретение относится к способам с использованием и к композициям, содержащим анти-4 интегрин-иммуноглобулины или иммуноглобулины, направленные против лигандов 4 интегринов (например, VCAM-1 и MadCAM-1). Предпочтительный анти-4 интегриниммуноглобулин представляет собой анти-VLA-4-антитело, такое как натализумаб. Данные иммуноглобулины можно применять по отдельности или в сочетании с другими средствами или терапевтическими воздействиями на опухоль, предотвращающими метастазирование или ингибирующими прогрессию метастатических очагов. Таким образом, данные композиции и способы можно применять для лечения любых метастазов любой первичной опухоли, экспонирующей 4 интегрин или лиганды 4 интегринов. 3. Лечение иммуноглобулинами. Иммуноглобулины, предполагаемые для применения в лечении вышеуказанных раков, включают в себя анти-4 интегрин-антитела, ингибирующие связывание 41 и/или 47 с узнающими их лигандами, например, VCAM-1 или MAdCAM-1. Также предполагают применение иммуноглобулинов против лигандов. Данные иммуноглобулины могут представлять собой антитела (т.е. моноклональные, приматизированные, гуманизированные или человеческие антитела, также как химерные антитела и биспецифические антитела). Данные иммуноглобулины могут представлять собой также иммуногенные фрагменты антител (например, Fab, scFv, Fab', F(ab')2, Fab, Fabc или рекомбинантно синтезированный фрагмент),или рекомбинантно полученные иммуноглобулины. Предпочтительное анти-4-антитело представляет собой натализумаб. Однако предполагают также другие анти-4 интегрин-иммуноглобулины, включая иммуноглобулины, способные различать между 41 и 47. Предпочтительные иммуноглобулины представляют собой моноклональные антитела, и наиболее предпочтительные иммуноглобулины представляют собой гуманизированные или приматизированные антитела, если подлежащий лечению пациент является человеком. Данные антитела можно применять по отдельности или в сочетании с другими анти-4 интегриниммуноглобулинами или иммуноглобулинами против лигандов 4-интегрина. В другом аспекте изобретение относится к применению анти-4-антител в сочетании с другими общеупотребительными терапевтическими воздействиями на опухоль, в форме комбинированной терапии. 4. Комбинированная терапия. Существует множество способов лечения раков. Конкретное лечение рака или сочетание терапевтических воздействий, применяемых для лечения рака, сильно зависит от типа рака, его стадии, пациента(например, веса, пола, возраста, состояния здоровья, предшествующих опухолей и подобного), и состояния лечения пациента (например, первое лечение, бластный криз, устойчивость к начальному лечению,рецидив рака, или второй рак, возможно, индуцированный лечением первого рака за месяцы или годы перед этим). Следовательно, врачи часто вынуждены комбинировать множество терапевтических воздействий, которые будут лучше всего подходить нуждам пациента в борьбе с заболеванием и в самоопределении качества жизни пациента. Терапевтические воздействия включают в себя в качестве неограничивающих примеров хирургию, радиотерапию, химиотерапию, биологическую терапию (например,цитокины, иммунотерапию и интерфероны), гормонотерапию и гипертермию. Общеупотребительную химиотерапию можно дополнительно прерывать гормонотерапией (например, антиэстрогенами, ингибиторами ароматазы, аналогами высвобождающего гонадотропин гормона и антиандрогенами), противоопухолевыми алкилирующими средствами (например, горчицами, нитрозомочевинами, тетразинами и азиридинами), цисплатином и его аналогами, антиметаболитами (например,метотрексатом, антифолатами, 5-фторпиримидинами, цитарабином, азацитидином, гемцитабином, 6 тиопуринами и гидроксимочевиной), взаимодействующими с топоизомеразой средствами, антимикротрубочковыми соединениями (например, алкалоидами барвинка, таксанами и эстрамустином), дифференцирующими средствами (например, ретиноидами, витамином D3, полярными-аполярными соединениями, бутиратом и фенилактетатом, цитотоксическими средствами, цитокинами и их сочетаниями), и другими химиотерапевтическими средствами, такими как флударабин, 2-хлордезоксиаденозин, 2'дезоксиформицин, гомогаррингтонин (ННТ), сурамин, блеомицин и L-аспарагиназа. 4.1 Комбинированная терапия для лечения лимфом. В одном из аспектов изобретение относится к применению анти-4 интегрин-иммуноглобулинов или иммуноглобулинов, связывающих лиганды 4 интегрина (например, MadCAM-1 и VCAM-1), для-7 009873 лечения лимфом. Любую клетку лимфомы, экспрессирующую 4 интегрин или лиганд 4 интегрина,предполагают лечить описанной здесь комбинированной терапией. Лимфомы, рассматриваемые для лечения данной комбинированной терапией, включают в себя в качестве неограничивающих примеров Т-клеточные лимфомы, такие как кожная Т-клеточная лимфома(CTCL), Т-клеточная неходжкинская лимфома, лимфомы периферических Т-клеток, анапластическая крупноклеточная лимфома, антииммунобластная лимфома, LBL предшественников Т. Лечение лимфом снова зависит от подлежащего лечению субъекта, типа заболевания и его стадии. Существующие терапевтические воздействия для лейкозов и лимфом в основном описаны в CANCER: PRINCIPLESPRACTICE OF ONCOLOGY (Vincent T. DeVita et al., editors, 5th ed., 1997). Также предполагаемыми для лечения являются В-клеточные лимфомы (например, фолликулярная лимфома, диффузная крупноклеточная В-клеточная лимфома, лимфома из клеток зоны мантии, B-CLL/SLL, иммуноцитома/Вальденстрома, и MALT-типа/моноцитоидная В-клеточная лимфома). Также предполагают лечение педиатрических лимфом, таких как лимфома Беркитта, диффузная крупноклеточная В-клеточная лимфома, фолликулярная лимфома, LBL предшественников В, LBL предшественников Т, анапластическая крупноклеточная лимфома и лимфома периферических Т-клеток. Общеупотребительные сочетания лекарственных средств для применения в лечении лимфом включают в себя в качестве неограничивающих примеров CHOP (т.е. циклофосфамид, доксорубицин, винкристин и преднизон), GAP-ВОР (т.е. циклофосфамид, доксорубицин, прокарбазин, блеомицин, винкристин и преднизон), m-BACOD (т.е. метотрексат, блеомицин, доксорубицин, циклофосфамид, винкристин, дексаметазон и лейковорин), ProMACE-МОРР (т.е. преднизон, метотрексат, доксорубицин, циклофосфамид,этопозид, лейковорин со стандартным МОРР), ProMACE-CytaBOM (преднизон, доксорубицин, циклофосфамид, этопозид, цитарабин, блеомицин, винкристин, метотрексат и лейковорин) и МАСОР-В (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин и лейковорин). Для рецидивирующей агрессивной неходжкинской лимфомы с описанными здесь антителами и сочетаниями лекарственных средств можно применять следующие сочетания химиотерапевтических лекарственных средств: IMVP-16 (т.е. ифосфамид, метотрексат и этопозид), MIME (т.е. метил-gag, ифосфамид, метотрексат и этопозид), DHAP (т.е. дексаметазон, высокая доза цитарабина и цисплатин), ESHAP (т.е. этопозид, метилпреднизон, высокая доза цитарабина и цисплатин), CEFF(B) (т.е. циклофосфамид, этопозид,прокарбазин, преднизон и блеомицин) и CAMP (т.е. ломустин, митоксантрон, цитарабин и преднизон). См. Margaret A. Shipp et al., "Non-Hodgkin's Lymphomas", in CANCER: PRINCIPLESPRACTICE OFONCOLOGY 2165-2220 (Vincent T. DeVita et al., editors, 5th ed., 1997). Лечение химиотерапией по жизненным показаниям, применяемое для конкретных лимфом, таких как рецидивирующее устойчивое заболевание Ходжкина, включает в себя в качестве неограничивающих примеров VABCD (т.е. винбластин, доксорубицин, дакарбазин, ломустин и блеомицин), ABDIC (т.е. доксорубицин, блеомицин, дакарбазин, ломустин и преднизон), CBVD (т.е. ломустин, блеомицин, винбластин, дексаметазон), PCVP (т.е. винбластин, прокарбазин, циклофосфамид и преднизон), СЕР (т.е. ломустин, этопозид и преднимустин), EVA (т.е. этопозид, винбластин и доксорубицин), MOPLACE (т.е. циклофосфамид, этопозид, преднизон, метотрексат, цитарабин и винкристин), MIME (т.е. метил-gag,ифосфамид, метотрексат и этопозид), MINE (т.е. митогуазон, ифосфамид, винорелбин и этопозид), МТХСНОР (т.е. метотрексат и CHOP), СЕМ (т.е. ломустин, этопозид и метотрексат), CEVD (т.е. ломустин,этопозид, виндезин и дексаметазон), CAVP (т.е. ломустин, мелфалан, этопозид и преднизон), EVAP (т.е. этопозид, винбластин, цитарабин и цисплатин), и EPOCH (т.е. этопозид, винкристин, доксорубицин,циклофосфамид и преднизон). См., например, Vincent T. DeVita et al., "Hodgkin's Disease", in CANCER:PRINCIPLESPRACTICE OF ONCOLOGY 2242-2283 (Vincent T. DeVita et al., editors, 5th ed., 1997). Для CTCL общепринятая терапия зависит от обследования пациента. Так, на основании определения стадии заболевания по TNM, пациента можно лечить местной химиотерапией, терапией псораленом и ультрафиолетом, дистанционной радиотерапией, экстракорпоральной фотохимиотерапией, интерфероном (IFN), системной химиотерапией с производными нуклеотидов или облучением фотонами в сочетании со способами и композициями, описанными здесь. Дополнительные терапевтические воздействия известны в данной области. В общих чертах см. CANCER: PRINCIPLESPRACTICE OF ONCOLOGY(Vincent T. DeVita et al., editors, 5th ed., 1997). Таким образом, в одном из аспектов изобретение относится к применению анти-4 иммуноглобулинов или иммуноглобулинов против лигандов 4, 41 и 47 для ингибирования прогрессирования лимфомы у субъекта и/или метастазирования лимфомы. Реагенты можно применять по отдельности или в сочетании с другим лечением лимфомы, как обсуждают здесь. 4.2 Комбинированная терапия меланом. В другом аспекте изобретение относится к ингибированию роста меланомы и/или ингибированию роста или распространения метастазов меланомы. Анти-4 интегрин- (т.е. 41- и 47-) иммуноглобулины или иммуноглобулины, узнающие лиганд 4-интегрина, можно применять самостоятельно или в сочетании с другими воздействиями на опухоль для лечения меланомы. Способы и композиции относятся в качестве неограничивающих примеров к лечению кожных меланом, метастатических меланом и-8 009873 внутриглазных меланом. Общеупотребительная терапия для лечения данных меланом известна в данной области. См., например, Anthony P. Albino et al., "Molecular Biology of Cutaneous Malignant Melanoma", inCANCER: PRINCIPLESPRACTICE OF ONCOLOGY 1935-1947 (Vincent T. DeVita et al., editors, 5th ed.,1997); Charles M. Balch et al., "Cutaneous Melanoma", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY, 1947-1994; и Jose A. Sahel et al., "Intraocular Melanoma", IN CANCER: PRINCIPLESPRACTICE OF ONCOLOGY, 1995-2012. Например, для лечения метастатических меланом применение хирургии, перфузии отдельной конечности, местной инфузионной химиотерапии (например, с дакарбазином или цисплатином), радиотерапии, иммунотерапии (например, лечения антителами против GD2 и GD3 ганглиозидов), внутриочаговой иммунотерапии, системной химиотерапии, гипертермии, системной химиотерапии, противоопухолевых вакцин или их сочетания можно дополнительно объединять с анти-4 иммуноглобулинами или иммуноглобулинами против лигандов 4, 41 и 47. 4.3 Комбинированная терапия для лечения лейкоза. В другом аспекте изобретение относится к лечению конкретных лейкозов с применением анти-4 иммуноглобулинов или иммуноглобулинов против лигандов 4 (например, VCAM-1 и MadCAM-1) в сочетании с традиционными терапевтическими воздействиями на подлежащий лечению лейкоз. Традиционное лечение острого миелоидного лейкоза (AML) включает в себя в качестве неограничивающих примеров режимы введения, основанные на антрациклине/цитарабине, интенсивную терапию после ремиссии, такую как трансплантант костного мозга (ВМТ) или высокая доза (HD) цитарабина. Традиционное лечение острого промиелоцитарного лейкоза включает в себя в качестве неограничивающих примеров лечение, основанное на ретиноевой кислоте и антрациклине/цитарабине. Пациентам можно вводить также криопреципитат или свежезамороженную плазму для поднятия уровня фибриногена до более чем 100 мг/дл. Переливания тромбоцитов также могут являться необходимыми для поддержания ежедневного числа тромбоцитов у человека 50000/мкл. Общеупотребительные терапевтические воздействия на острый лимфобластный лейкоз (ALL) включают в себя четыре или пять режимов введения лекарственного средства с применением антрациклинов, циклофосфамида, аспарагиназы или сочетания в дополнение к винкристину и преднизону. В качестве альтернативы, врач может предпочесть применение интенсивной объединенной терапии, основанной на цитарабине, объединенном с антрациклинами, эпидофиллотоксинами или антиметаболитами в сочетании с описанными здесь композициями иммуноглобулинов. Еще одним аспектом может являться применение длительной поддерживающей терапии с применением метотрексата перорально в сочетании с меркаптопурином и указанными иммуноглобулинами. Другая альтернатива предусматривает применение профилактической интратекальной химиотерапии (с черепной радиотерапией или без нее) для профилактики CNS в сочетании с указанными иммуноглобулинами. Дополнительную информацию по терапевтическим воздействиям для лечения лейкоза, которые можно применять в сочетании с настоящим изобретением, см. в Issa Khouri et al., "Molecular Biology of Leukemias", in CANCER: PRINCIPLESB. Deisseroth et al., "Chronic Leukemias", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY 23212343. 4.4 Комбинированная терапия для лечения метастазирования. Лечение метастазов можно осуществлять описанными здесь композициями, комбинированной терапией и способами самостоятельно или в сочетании с другими терапевтическими воздействиями на опухоль, в зависимости от участка метастазирования и первичной опухоли, из которой произошли метастазы. Наиболее распространенными участками метастазирования опухолей являются мозг, легкое, печень, кость, злокачественные плевральные и перикардиальные излияния и злокачественный асцит. 4.4.1 Метастазы в мозге. Метастазы в мозге развиваются, когда опухолевые клетки, происходящие из центральной нервной системы (CNS), распространяются вторично, непосредственно поражая мозг. Внутричерепные метастазы могут поражать паренхиму мозга, черепные нервы, кровеносные сосуды (включая дуральные пазухи),твердую мозговую оболочку, мягкую и паутинную оболочки мозга и внутреннюю поверхность кости черепа. Наиболее распространенными из внутричерепных метастазов являются внутрипаренхимальные метастазы. Частота метастазирования в мозг для первичных опухолей составляет: легкое (48%), молочная железа (15%), меланома (9%), толстая кишка (5%), другие известные первичные (13%) и другие неизвестные первичные опухоли (11%). См. Jay S. Loeffler et al., "Metastatic Brain Cancer", in CANCER:PRINCIPLESPRACTICE OF ONCOLOGY 2523-2536 (Vincent T. DeVita et al., editors, 5th ed., 1997). Симптомы, связанные с метастазированием в мозг, включают в себя измененный ментальный статус,гемипарез, гемианестезию, отек соска зрительного нерва и атаксию походки. Таким образом, пациентов с недавним диагнозом метастазы мозга часто подвергают противосудорожной профилактике и воздействию кортикостероидов на длительный период времени. Данные лекарственные средства включают в себя фенилоин натрия и фенобарбитал.-9 009873 Метастазы в мозге можно лечить хирургически с иссечением метастазов, если их легко достичь. С развитием технологий томографии и локализации, смертность, связанная с хирургическим удалением метастазов мозга, уменьшилась. Однако риск еще остается. Поэтому радиотерапия является основой лечения пациентов с метастазами в мозге. Радиотерапию можно сочетать с хирургией в качестве вспомогательной терапии для хирургии. В качестве альтернативы можно применять радиохирургию. Радиохирургия представляет собой способ экстракорпорального облучения, предусматривающий применение множественных источников для конвергентного облучения для доставки высокой однократной дозы радиации в малом объеме. Можно вводить сочетание радиотерапии с другими химиотерапевтическими средствами, такими как метил-CCNU или ACNU, или сочетание радиотерапии, метил-CCNU, ACNU, и тегафур (вводимый орально 5'-фторурацил). Химиотерапию можно также применять для метастазов в мозге. В зависимости от первичной опухоли, пациенту можно вводить любое из следующих лекарственных средств или их сочетание: циклофосфамид, 5-фторурацил, винкристин, метотрексат, доксорубицин, преднизон и адриамицин (например,в сочетании CAF или CMF). Композиции с антителом и способы применения антител, как описано здесь, можно сочетать с любым из общеупотребительных терапевтических воздействий, описанных здесь, или известных в данной области (см., например, метастазы в мозге в Jay S. Loeffler et al., 1997). 4.4.2 Метастазы в легком. Легкие являются вторым по частоте участком метастазирования. Анатомически, легкие представляют собой богатые сосудами участки, и капиллярное ложе первым сталкивается с циркулирующими опухолевыми клетками по мере их выхода из венозного оттока их первичной опухоли. Таким образом,легкие действуют как начальный участок фильтрации, где диссеминированные опухолевые клетки становятся задержанными механически. Однако какие клетки задерживаются здесь и продолжают пролиферировать и формировать метастатические очаги, в значительной степени зависит от первоначальной первичной опухоли, из которой они происходят. Гематогенный процесс метастазирования в легкое имеет наиболее общее значение, но легочные метастазы могут возникать также через лимфатическую систему. См. Harvey I. Pass et al., "Metastatic Cancer to the Lung", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY 2536-2551 (Vincent T. DeVita et al., editors, 5th ed., 1997). Наиболее распространенные первичные опухоли, развивающиеся с метастазами в легкое, включают в себя саркому мягких тканей, карциному кишечника, эмбриональные опухоли, остеосаркому, конкретные педиатрические опухоли (например, рабдомиосаркому, саркому Юинга, опухоль Вильма, липосаркому, лейомиосаркому, альвеолярные саркомы, синовиальные саркомы, фибросаркому, нейрогенные саркомы и эпителиальные саркомы), меланому, почечно-клеточную карциному и карциному молочной железы. Большинство метастазов из данных первичных опухолей лечат хирургически. Однако некоторые рекомендуют хирургию в сочетании с химиотерапией. Например, эмбриональные опухоли, метастазирующие в легкое, лечат хирургической резекцией с последующей лечебной комбинированной химиотерапией на основе цисплатина. Лечение метастазов часто предусматривает метастазоэктомию (т.е. хирургическое удаление метастатического очага в легком). Таким образом, в одном аспекте изобретение относится к применению описанных антител в сочетании с общеупотребительной терапией, как обсуждают здесь, или, как известно в данной области, для лечения метастазов в легких. Дополнительные терапевтические воздействия,см., например, в Harvey I. Pass et al., 1997. Таким образом, в одном аспекте изобретение относится к сочетанию анти-4 интегриниммуноглобулинов или иммуноглобулинов, узнающих и связывающих 4 лиганды (например, VCAM-1 и MadCAM-1), и к способам применения любого доступного терапевтического воздействия для лечения метастазов легких. 4.4.3 Метастазы в печени. Метастазирование в печень может происходить из многих участков первичной опухоли. Из-за анатомического венозного оттока желудочно-кишечные опухоли распространяются предпочтительно в печень, так что у многих пациентов первоначально диагностируют рак печени. Для большинства желудочно-кишечных опухолей, метастазирующих в печень, диагноз страшен относительно коротким выживанием. Однако метастазы в печень при раке ободочной и прямой кишки могут поддаваться лечению после резекционной терапии. Системная химиотерапия представляет собой воздействие, наиболее часто применяемое в лечении печеночных метастазов. Ответ на системную химиотерапию варьирует в зависимости от первичной опухоли. Другой терапевтической возможностью является химиотерапия печеночной артерии. Метастазы снабжает кровью почти исключительно печеночная артерия, в то время как нормальные гепатоциты получают кровь и из воротной вены, и из печеночной артерии. Таким образом, химиотерапия печеночной артерии, где 3 Н-флоксуридин (3H-FUDR) (или другое химиотерапевтическое средство или средства) вводят в печеночную артерию, приводит к значительно увеличенным концентрациям лекарственного средства (15-кратным) в метастазах по сравнению с нормальной печеночной тканью. Дополнительные- 10009873 лекарственные средства, вводимые через печеночную артерию, включают в себя в качестве неограничивающих примеров фторурацил, 5-фторурацил-2-дезоксиуридин, бихлорэтилнитрозомочевину, митомицин С, цисплатин и доксорубицин. Терапевтические воздействия на метастазы в печени могут включать в себя системную химиотерапию (например, с применением 3 Н-флоксуридина), внутрипеченочную терапию, перевязку или эмболизацию печеночной артерии, химиоэмболизацию, радиотерапию, инъекцию спирта и криохирургию. Для химиоэмболизации можно применять следующие режимы лекарственных средств: (1) DSM и митомицин С; (2) коллаген, цисплатин, доксорубицин и митомицин С; (3) фторурацил, митомицин С, этиодол и желатин; (4) ангиостатин (или другое лекарственное средство, ингибирующее образование новых сосудов или ангиогенез), цисплатин, доксорубицин и митомицин С; (5) липиодол и доксорубицин; (6) гелевая пена, доксорубицин, митомицин С и цисплатин; (7) доксорубицин, митомицин С и липиодол; и (8) поливинил, спирт, фторурацил и интерферон. Дополнительные способы лечения и детали см. в John M. Dalyet al., "Metastatic Cancer to the Liver", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY, 25512569 (Vincent T. DeVita et al., editors, 5th ed., 1997). Для метастазов в печени можно применять любые доступные терапевтические воздействия в сочетании со способами и композициями, содержащими иммуноглобулины рассматриваемого изобретения. 4.4.4 Метастазы в кости. Наилучшего лечения метастаза в кости достигают с применением комбинированного способа. Одной из проблем с костью является степень разрушения кости и заживления кости. Удаление опухолевого образования для опухолей кости можно проводить хирургически, и оно может предусматривать ампутацию конечности. В дополнение к хирургическому лечению для скелетных метастазов можно применять облучение. Локализованное дистанционное облучение, облучение половины тела или системную терапию радиоактивным изотопом можно рассматривать для широко рассредоточенного заболевания костей. Рекомендуют проникающие в кость изотопы, такие как 89Sr, так как их лучше переносят, чем 32 Рортофосфат, являющийся изотопом с высокой энергией. Дополнительные воздействия и детали лечения метастаз кости, см., например, в John H. Healy, "Metastatic Cancer to the Bone", in CANCER: PRINCIPLESPRACTICE OF ONCOLOGY 2570-2586 (Vincent T. DeVita et al., editors, 5th ed., 1997). Для метастазов в кости можно применять любые доступные терапевтические воздействия в сочетании со способами и композициями с применением анти-4 интегрин-иммуноглобулинов или антител против лигандов, связывающих 4 интегрин (например, VCAM-1 и MadCAM-1). 4.5 Комбинированная терапия для улучшения состояний, связанных с лечением опухоли. В общем смысле, идеей начальных терапевтических воздействий на опухоль с применением облучения или химиотерапии является отравить раковые клетки, которые пролиферируют быстрее, чем нормальные клетки, делая их более чувствительными к химиотерапии и облучению. Однако лечение пациента облучением и химиотерапией или даже некоторыми из новых терапевтических воздействий на рак обладает неблагоприятными побочными эффектами для пациента, подлежащего лечению. Таким образом, в одном из аспектов изобретение относится к применению соединений и композиций, облегчающих отрицательные эффекты, производимые сочетанием терапевтических воздействий, применяемых для лечения пациентов. Например, пациенту одновременно с противораковой терапией можно вводить лекарственные средства, которые будут лечить неблагоприятные эффекты, включающие в себя в качестве неограничивающих примеров тошноту, рвоту, мукозит и другие осложнения ротовой полости, цистит,легочную токсичность, кардиотоксичность, потерю волос и гонадную дисфункцию. Хотя некоторые из данных реагентов могут казаться только косметическими (например, для ингибирования потери волос),исследования показали, что поддержание положительного отношения к лечению рака и предупреждение депрессии может способствовать общему ответу на лечение у подлежащего лечению пациента. Соответственно, реагенты и комбинированную терапию, обсуждаемые здесь, можно дополнительно сочетать с лечением лекарственными средствами, облегчающим данные неблагоприятные эффекты, также как сочетать с любыми общеупотребительными терапевтическими воздействиями на рак. Подробности относительно способов, облегчающих данные неблагоприятные эффекты лечения рака, в основном см. в CANCER: PRINCIPLESPRACTICE OF ONCOLOGY (Vincent T. DeVita et al., editors, 5th ed., 1997). 5. Составы с иммуноглобулином и способы введения. В одном из аспектов изобретение относится к применению анти-4-иммуноглобулинов или иммуноглобулинов, связывающих 4 лиганд (например, VCAM-1 и MadCAM-1). Данные иммуноглобулины могут представлять собой полноразмерные антитела, фрагменты антитела или рекомбинантно полученные иммуноглобулины, узнающие и связывающие данные полипептиды. Представляющие интерес антитела или иммуноглобулины, обсуждаемые выше, предпочтительно вводят субъекту в физиологически приемлемом носителе. Антитела можно вводить множеством способов, включающих в себя в качестве неограничивающих примеров парентеральное введение, включая подкожный (s.c.), субдуральный, внутривенный (i.v.), внутримышечный (i.m.), интратекальный, внутрибрюшинный (i.p.), внутримозговой, внутриартериальный или внутриочаговый способы введения; локализованное (например, хирургическое применение или хирургический суппозиторий); легочное (напри- 11009873 мер, аэрозоли, ингаляция или порошок), и как описано далее ниже. Предпочтительно анти-4 иммуноглобулины или иммуноглобулины против лигандов 4 вводят внутривенно или подкожно. В зависимости от способа введения, иммуноглобулины можно готовить в виде композиции множеством способов. Концентрация терапевтически активного иммуноглобулина в композиции (т.е. композиции, терапевтически эффективной для субъекта, которому ее вводят) может меняться приблизительно от 0,01 мг/мл до 1 г/мл. Предпочтительно, композиция с иммуноглобулином при введении нуждающемуся субъекту достигает концентрации в крови субъекта, которому ее вводят, приблизительно 10 мкг/мл или более. Предпочтительно, иммуноглобулин готовят в виде композиции для парентерального введения в подходящем инертном носителе, таком как стерильный физиологический солевой раствор. Например,концентрация иммуноглобулина в растворе носителя обычно составляет приблизительно между 1-150 мг/мл. Вводимую дозу определяют по способу введения. Предпочтительные способы введения включают в себя парентеральное, подкожное или внутривенное введение. При парентеральном введении иммуноглобулины по изобретению можно вводить в инъецируемых дозах раствора или суспензии вещества в физиологически приемлемом растворителе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода или масла с добавлением сурфактанта или без него. Другие приемлемые растворители включают в себя масла животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло и минеральное масло. Как правило, гликоли, такие как пропиленгликоль или полиэтиленгликоль (PEG),являются предпочтительными жидкими носителями, особенно для инъецируемых растворов. Антитела и иммуноглобулины по настоящему изобретению можно вводить в форме инъекции замедленного всасывания или имплантируемого препарата, который можно готовить в виде композиции таким способом,чтобы позволять пролонгированное действие активного ингредиента (ингредиентов). Предпочтительная композиция содержит моноклональное антитело при 20 мг/мл, составленное в водном буфере, содержащем 50 мМ L-гистидина, 150 мМ NaCl, с рН, доведенным HCl до 6,0. По одному аспекту изобретения иммуноглобулин, узнающий и связывающий 4, димер 4, или лиганд, связывающий 4 (или его димер), можно вводить самостоятельно или в сочетании с другими средствами, как обсуждали выше, для лечения и/или облегчения опухоли. Данные реагенты можно применять также для получения лекарственного средства для применения в лечении пациента. Введение других лекарственных средств против опухоли можно проводить до, одновременно с, или после введения иммуноглобулина. Введение указанных иммуноглобулинов можно проводить до, в ходе или после хирургического лечения, радиотерапии, гормонотерапии, иммунотерапии, гипертермии или других терапевтических воздействий на опухоль. Введение указанных иммуноглобулинов можно проводить ежесуточно, еженедельно или ежемесячно по необходимости. Предпочтительно, иммуноглобулины вводят еженедельно в течение одной или нескольких недель. Терапевтические композиции с иммуноглобулином получают для хранения посредством смешивания иммуноглобулина, обладающего желательной степенью чистоты, с не обязательными физиологически приемлемыми носителями, экспоциентами, консервантами или стабилизаторами (REMINGTON'SPHARMACEUTICAL SCIENCES, 16th ed., A. Osol, Ed., 1980 и более новые издания), в форме лиофилизированного осадка или водного раствора. Приемлемые носители, экспоциенты или стабилизаторы для иммуноглобулина являются нетоксичными, нетерапевтическими и/или неиммуногенными для реципиентов в применяемых дозах или концентрациях и включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводороды,включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как этилендиаминтетраацетат(EDTA); сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как Tween, плюроники или полиэтиленгликоль (PEG). Конкретные молекулы носителя включают в себя в качестве неограничивающих примеров гликозаминогликаны (например, гепаринсульфат), гиалуроновую кислоту, кератансульфат, хондроитин-4-сульфат, хондроитин-6-сульфат, гепарансульфат, дерматинсульфат, перлекан и пентополисульфат. Фармацевтические композиции, содержащие иммуноглобулины, могут содержать также, если желательно, фармацевтически приемлемые, нетоксичные носители или растворители, представляющие собой носители, общеупотребительные для получения фармацевтических композиций для введения животному или человеку. Растворитель выбирают так, чтобы не влиять на биологическую активность сочетания. Неограничивающие примеры включают в себя дистиллированную воду, физиологический фосфатно-солевой раствор, растворы Рингера, раствор глюкозы и раствор Хенкса. Средства по изобретению можно готовить в форме препаратов для инъекций посредством их растворения, суспендирования или эмульгирования в водном или не водном растворителе, таком как расти- 12009873 тельные или другие подобные масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль. Композиции могут содержать также общеупотребительные добавки, такие как солюбилизаторы, изотонические средства, суспендирующие средства,эмульгирующие средства, стабилизаторы и консерванты. Иммуноглобулины можно применять также в форме аэрозольных препаратов, вводимых ингаляцией или доставкой в легкие. Препараты по настоящему изобретению можно готовить в приемлемых пропеллентах под давлением, таких как дихлордифторметан, пропан, азот и подобные. Иммуноглобулин можно также заключать в микрокапсулы, полученные, например, способом коацервации или посредством полимеризации на границе фаз (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметил-метакрилатные микрокапсулы), в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы), или в макроэмульсии. Такие способы описаны в REMINGTON'S PHARMACEUTICAL SCIENCES, выше. Иммуноглобулин, применяемый для введения in vivo, должен являться стерильным. Этого легко достичь фильтрованием через стерильные фильтрационные мембраны до или после лиофилизации и разведения. Обычно иммуноглобулин хранят в лиофилизированной форме или в растворе. Терапевтические композиции иммуноглобулина, как правило, помещают в контейнер, обладающий отверстием для стерильного доступа, например пакет или флакон с внутривенным раствором, с пробкой,поддающейся прокалыванию иглой для подкожной инъекции или подобным острым инструментом. Подходящие примеры препаратов с пролонгированным действием включают в себя полупроницаемые матрицы твердых гидрофобных полимеров, содержащие белок, где матрицы присутствуют в форме профилированных изделий, например пленок или микрокапсул. Примеры матриц с пролонгированным действием включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт, как описано у Langer et al., J. Biomed. Mater. Res. 15: 167-277 (1981) и Langer,Chem. Tech. 12: 98-105 (1982), полилактиды (U.S. Pat.3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers 22: 547-556, 1983), неразлагаемый этиленвинилацетат (Langer et al., выше), разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие какLUPRON DEPOT (т.е. пригодные для инъекции микросферы, состоящие из сополимера молочной кислоты гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту(ЕР 133988). В то время как полимеры, такие как этиленвинилацетат и молочная кислота - гликолевая кислота,способны высвобождать молекулы более 100 суток, конкретные гидрогели высвобождают белки за более короткие периоды времени. Когда инкапсулированные антитела остаются в организме на долгое время,они могут денатурировать или агрегировать в результате воздействия влажности при 37 С, что приводит к потере биологической активности и возможным изменениям иммуногенности. Можно разрабатывать разумные стратегии стабилизации в зависимости от вовлеченного механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S связи посредством тиолдисульфидного обмена, можно достичь стабилизации модификацией сульфгидрильных остатков, лиофилизацией из кислых растворов, контролированием содержания влаги, применением соответствующих добавок, разработкой специальных композиций полимерной матрицы и подобными. Композиции иммуноглобулина с пролонгированным действием включают в себя также заключенный в липосомах иммуноглобулин. Липосомы, содержащие иммуноглобулин, получают способами, известными по существу. См., например, Epstein et al., Proc. Natl. Acad. Sci. USA 82: 3688-92 (1985); Hwanget al., Proc. Natl. Acad. Sci. USA 77: 4030-4 (1980); U.S. Pat.4485045; 4544545; 6139869 и 6027726. Обычно присутствуют небольшие (от приблизительно 200 до приблизительно 800 ) липосомы, однослойного типа, содержание липидов в которых составляет более чем приблизительно 30 мол.% холестерина; выбранную пропорцию корректируют для оптимальной терапии иммуноглобулином. Иммуноглобулины по настоящему изобретению можно вводить в пролонгированной форме, например, инъекции замедленного всасывания, имплантации препарата или осмотического насоса, которые можно составлять таким способом, чтобы позволять пролонгированное действие активного ингредиента. Имплантанты для препаратов пролонгированного действия хорошо известны в данной области. Имплантанты составляют в виде микросфер, пластинок и т.д. с биологически разлагаемыми или биологически неразлагаемыми полимерами. Например, полимеры молочной кислоты и/или гликолевой кислоты формируют поддающиеся эрозии полимеры, хорошо переносимые хозяином. Имплантант помещают вблизи солидной опухоли, например, так, что локальная концентрация активного средства увеличена в данном участке по сравнению с остальным телом. Обычное ежесуточное дозирование для иммуноглобулинов может лежать в диапазоне от приблизительно 1 мкг/кг вплоть до приблизительно 200 мг/кг массы субъекта или более, предпочтительнее от приблизительно 0,01 мг/кг до приблизительно 150 мг/кг массы субъекта, предпочтительнее от приблизительно 0,1 мг/кг до приблизительно 100 мг/кг массы субъекта, предпочтительнее от приблизительно 1 мг/кг до приблизительно 75 мг/кг массы пациента (и любое целое значение между данными значения- 13009873 ми), в зависимости от упомянутых здесь факторов. Обычно клиницист вводит иммуноглобулин до достижения дозы, обеспечивающей желательный эффект. Прогресс данной терапии можно легко контролировать общеупотребительными анализами. Стабильный препарат с иммуноглобулином, антителом или фрагментом антитела представляет собой такой, в котором белок в основном сохраняет свою физическую стабильность, и/или химическую стабильность, и/или биологическую активность при хранении. Различные аналитические способы для измерения стабильности белка известны в данной области, и их обзор дан, например, в Peptide and Protein Drug Delivery, 247-301 (Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. 1991) и А. Jones,Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерять при выбранной температуре в течение выбранного периода времени. Предпочтительно, препарат является стабильным при комнатной температуре (приблизительно 30 С) или при 40 С по меньшей мере в течение 1 месяца и/или стабильным при приблизительно 2-8 С по меньшей мере в течение 2 лет. Кроме того, препарат может быть стабильным после замораживания (например, до -70 С) и оттаивания состава. Иммуноглобулин сохраняет свою биологическую активность в фармацевтическом препарате, если биологическая активность иммуноглобулина в заданное время находится в пределах приблизительно 10% (в пределах ошибок анализа) биологической активности, показанной во время получения фармацевтического состава, как определено, например, анализом связывания антигена. Хотя настоящее изобретение подробно описано в отношении следующих примеров, понятно, что можно осуществлять различные модификации без отклонения от сущности изобретения, полностью известные специалисту в данной области. Примеры Пример 1. Эффекты натализумаба на пролиферацию опухолевой клетки in vitro. Для оценки способности натализумаба индуцировать или ингибировать пролиферацию трансформированных клеток и размножение клона, возможно, приводящие к неоплазии, проводили эксперименты для определения способности натализумаба стимулировать рост злокачественных клеток, экспрессирующих рецептор in vitro, и исследования проводили на моделях опухоли на животных. Оценку положительных или отрицательных эффектов на пролиферацию линий опухолевых клеток проводили с применением анализов включения 3 Н-тимидина. Оценку ингибирования или усиления роста клеток опухоли человека и/или метастазирования определяли с применением модели ксенотрансплантата мышам nude/SCID. Проводили скрининг тридцати двух линий опухолевых клеток. Из тридцати двух линий опухолевых клеток двенадцать представляли собой линии клеток карциномы кишечника, аденокарциномы кишечника, аденокарциномы толстой кишки или карциномы толстой кишки; семь представляли собой меланомы или амеланотические меланомы; шесть представляли собой переходно-клеточные карциномы мочевого пузыря или карциномы мочевого пузыря; три представляли собой лейкозы; две представляли собой лимфомы; и две представляли собой карциномы предстательной железы. Для тестирования экспрессии 4 применяли иммуногистохимию (IHC) и сортировку клеток с активацией флуоресценции (FACS). Пять из двадцати шести оцениваемых линий клеток являлись положительными по IHC. Четыре из двадцати одной линии клеток, считаемых отрицательными или неопределенными по иммуногистохимии (IHC), являлись сильно положительными (85%) по анализу FACS. Две линии клеток, отрицательные или неопределенные по IHC, являлись от слабо до умеренно положительными (22,5 и 77,6%) по анализу FACS. Шесть линий клеток не оценивали IHC. Только одна линия клеток являлась умеренно положительной по анализу FACS (68,4%). Проводили также анализ адгезии для связывания VCAM-1. Семь из одиннадцати оцениваемых линий клеток являлись положительными. В предварительном анализе пролиферации клеток все девять из девяти оцениваемых линий клеток не обладали цитотоксическим или пролиферативным эффектом. Линии клеток AS283, НТ-29, MOLT-4 и UM-UC-3 обрабатывали Tysabri (натализумабом). Измеряли поглощение меченого тритием тимидина. На 1, 2, 3, 4 и 5 сутки воздействия восемью разными концентрациями (0,001-100 мг/мл) не обнаружили доказательств цитотоксического или пролиферативного эффекта. Пример 2. Эффекты натализумаба на рост подкожно имплантированных ксенотрансплантантов MOLT-4 человека у мышей SCID. Целью данного исследования являлось определение эффекта лечения натализумабом на рост подкожно имплантированных ксенотрансплантатов острого лимфобластного лейкоза человека MOLT-4 у самок мышей SCID. Материалы и методы. Прижизненную экспериментальную работу начинали на сутки 0 и прекращали на сутки 80. Самок мышей SCID в возрасте от пяти до шести недель приобретали в Taconic Farms, Inc. (Germantown, N.Y.) и акклиматизировали в лабораториях одну неделю до эксперимента. Животных содержали в свободных от патогенов огражденных отделениях в клетках-микроизоляторах, по пять животных на клетку с- 14009873 12-часовым циклом свет/темнота. Животные получали фильтрованную водопроводную воду Бирмингема и стерильный корм для грызунов без ограничений. Мышей кормили стерилизуемым кормом для грызунов (Harlan-Teklad TD8656). Клетки заменяли дважды в неделю. Животных обследовали ежедневно и записывали клинические симптомы. Фрагменты лейкоза человека MOLT-4 от тридцати до сорока миллиграмм имплантировали мышам около правой подмышечной области с применением иглы-троакара 12 размера и позволяли расти. Сутки имплантации фрагмента опухоли являлись 0 сутками эксперимента. Опухолям позволяли достигать 75-144 мг по массе (75-144 мм 3 по размеру) перед началом обработок. Имплантацию проводили достаточному числу мышей, так что опухоли в диапазоне массы, настолько узком, насколько возможно, отбирали для испытания на сутки начала лечения (14 сутки после имплантации опухоли). Отобранных животных с опухолями в подходящем диапазоне размера распределяли случайным образом по группам лечения. Средние массы опухолей на первые сутки лечения лежали в диапазоне от 84 или 96 мг; медианные массы опухолей на 14 сутки составляли 75 или 88 мг. Одну донорную опухоль собирали в сутки имплантации фрагментов и разрезали пополам. Одну половину опухоли замораживали в соединении О.С.Т., и вторую половину опухоли фиксировали в 10% забуференном формалине. И замороженные, и фиксированные в формалине половины опухоли отправляли в Biogen Idec Inc. для анализа. Один фрагмент из каждой донорной опухоли, применяемый для имплантации мыши, помещали в пробирку с тиогликолевой средой и инкубировали при +37 С в течение 24 ч. Натализумаб (20-мг/мл раствор, Gensia Sicor Pharmaceuticals Inc., лотыF23014 и G23004) и растворитель (плацебо для Tysabri, Gensia Sicor Pharmaceuticals Inc., лотF85002) получали из BiogenIdec Inc. и по получении хранили при +2-8 С. Ампулы с 0,97-мг/мл раствором иммуноглобулина человека (IgG4) получали из Sigma-Aldrich (St. Louis, Mo., лот 122K9159) и по получении хранили при -84 С. Клинический препарат Taxol (плаклитаксел) (6,0 мг/мл в 50% кремофоре-EL/50% этаноле, BristolMyers Squibb Company, Princeton, N.J.; лот 2L57296) приобретали и по получении замораживали. Солевой раствор (0,9% солевой раствор, только для применения для животных) приобретали из PhoenixPharmaceutical, Inc. (St. Joseph, Mo., лоты 262053F, 206205F, 208281F) и хранили при комнатной температуре. Для каждых суток работы применяли новый флакон солевого раствора. На 14 сутки, 20-мг/мл раствор натализумаба разводили плацебо для Tysabri до 1,0 мг/мл. В последующие дни инъекций 0,5-мг/мл раствор натализумаба составляли разведением 20-мг/мл маточного раствора плацебо для Tysabri. Следили, чтобы не встряхивать флаконы с натализумабом; для смешивания флаконы переворачивали. Для каждых суток работы применяли новый флакон плацебо для Tysabri. На 14 сутки поставляемый 0,97-мг/мл маточный раствор IgG4 оттаивали и инъецировали мыши. В последующие сутки инъекций 0,5-мг/мл раствор IgG4 получали разбавлением 0,97-мг/мл маточного раствора 0,9% солевым раствором. Для каждых суток работы применяли новый флакон IgG4. Аликвоту коммерчески приготовленного 6-мг/мл раствора Taxol в 50% кремофоре-EL/50% этаноле разбавляли на каждые сутки инъекции 0,9% солевым раствором для получения 1,5-мг/мл раствора в 12,5% кремофоре-EL/12,5% этаноле/75% солевом растворе. Все дозируемые растворы инъецировали в течение 2-3 ч после составления. На 14, 17, 24, 31, 38 и 45 сутки две 1-мл аликвоты дозируемого раствора для группы 1 (солевой раствор) и группы 2 (натализумаб) отбирали из флакона для дозирования немедленно после завершения приготовления препарата. Каждую 1-мл аликвоту натализумаба и солевого раствора переносили во флакон, меченный названием исследования, номером группы, названием соединения, дозой, способом введения, объемом инъекции, сутками исследования и словами Prep. Lab., и флаконы немедленно замораживали. Две дополнительные 1-мл аликвоты того же самого дозируемого солевого раствора и раствора натализумаба набирали в два шприца на группу (1 мл/шприц) перед началом инъекций в каждой группе,и позволяли шприцам находиться при комнатной температуре во время дозирования всех двадцати животных в группе. После завершения обработки содержимое каждого шприца перекачивали во флакон, меченый номером исследования, номером группы, названием соединения, дозой, способом введения, объемом инъекции, сутками исследования и словами Animal Lab., и флаконы немедленно замораживали. После завершения эксперимента данные аликвоты отправляли в Covance Laboratories, Inc. для анализа. Лечение лекарственным средством. Животных случайным образом разделяли на шесть групп по 20 животных каждая, и одну группу из 30 животных. Две группы (группы 1 и 5) лечили 0,9% солевым раствором. Животных в группах 2, 6 и 7 лечили натализумабом. Животных в группе 3 лечили IgG4 (изотипический контроль). Животных в группе 4 лечили Taxol (положительный контроль). Для лечения солевой раствор, натализумаб и IgG4 (группы 1, 2, 3, 5 и 6) вводили IP на 14, 17, 21, 24, 28, 31, 35, 38, 42 и 45 сутки (Q3D2 в течение пяти недель,расписание пятница-понедельник). Для лечения натализумаб в группе 7 (группа из 30 мышей) вводили на 14, 17, 21, 24, 28, 31, 35 и 38 сутки (Q3D2 в течение четырех недель). На 14 сутки натализумаб вводили в дозе 10 мг/кг, с последующими дополнительными обработками с дозированием 5 мг/кг/дозу. На 14 сутки IgG4 вводили в дозе 9,7 мг/кг с последующими дополнительными обработками с дозированием 5 мг/кг/дозу. Taxol вводили внутривенно (IV) один раз в сутки в течение пяти последовательных суток(Q1D5) с дозированием 15 мг/кг/дозу, начиная на 14 сутки. Все тестовые соединения вводили по точной массе тела отдельного животного на каждые сутки лечения в объеме носителя 0,1 мл/10 г массы тела. Животных взвешивали, и подкожные (SC) опухоли измеряли в сутки введения обработок, начиная с 14 суток, за исключением двух измерений, сделанных за одни сутки до инъекции (на 24 и 41 сутки). После завершения лечения, данные массы опухоли и тела собирали дважды в неделю. Объем опухоли определяли посредством измерения штангенциркулем (мм) и применения формулы для эллипсоидальной сферы: LW2/2=мм 3, где L и W относятся к наибольшему и наименьшему перпендикулярным измерениям, полученным при каждом измерении. Данную формулу применяли также для расчета массы опухоли,принимая единицу плотности (1 мм 3=1 мг). Кровь животных в группе 7 собирали в течение всего курса лечения. Животным 1-5 спускали кровь через 8 ч после инъекции на 14 сутки. По пяти животным спускали кровь перед инъекцией на 21 сутки (животные 6-10), на 28 сутки (животные 11-15), на 35 сутки (животные 16-20) и на 38 сутки (животные 21-25). Животным 26-30 спускали кровь через 8 ч после инъекции на 38 сутки. Кровь собирали ретроорбитальной пункцией под анестезией CO2/O2. Животным спускали кровь до максимального количества крови (терминальное кровопускание) с применением непокрытой капиллярной трубки, и позволяли крови свертываться при комнатной температуре в течение 30 мин со времени спускания крови у последнего животного в каждой временной точке. Образцы крови центрифугировали при 10000 об./мин в течение 10 мин при +4 С; сыворотку отделяли и замораживали в сухом льду. Все образцы сыворотки хранили при -84 С до отправки в Biogen Idec для анализа. Первичные опухоли животных в группах 5 и 6 хирургически иссекали на 28 сутки, через сутки после достижения медианной массы опухолей в группе 5-466 мг. Введение анестезии и хирургические/послеоперационные восстановительные процедуры проводили, следуя утвержденным стандартным лабораторным способам. Кратко, каждого животного анестезировали, и участок разреза предварительно обрабатывали антисептическим раствором. Осуществляли разрез вдоль границы одной стороны опухоли(не более чем на 3-4 мм длиннее, чем диаметр опухоли), отгибали кожу и выворачивали опухоль в ходе разреза. Опухоль отрезали от кожи и мышцы. Разрез закрывали 4,0-мм раневым зажимом. Каждую иссеченную опухоль разрезали пополам, одну половину опухоли замораживали в соединении О.С.Т., и вторую половину опухоли фиксировали в 10% забуференном формалине. Участок резекции контролировали на повторный рост опухоли дважды в неделю, и когда возникала новая солидная опухоль, записывали ее измерения. Животных 1-10 в группах 1-4 подвергали эвтаназии на 47 сутки после имплантации опухоли(16 мая 2003); животных 11-20 в группах 1-4 подвергали эвтаназии на 48 сутки (17 мая 2003). Всех выживших животных в группах 5 и 6 (за исключением животного 12 в группе 5 и животного 8 в группе 6, объяснения см. ниже) подвергали эвтаназии на 80 сутки после имплантации опухоли (19 мая 2003). Животное 12 в группе 5 умертвили на 73 сутки из-за избыточного веса опухоли (4000 мг). Животное 8 в группе 6 умертвили на 73 сутки из-за изъязвления опухоли. По пять животных в группе 7 подвергали эвтаназии на 14, 21, 28, 35 сутки, и десять животных подвергли эвтаназии на 38 сутки. Тушки всех животных, живых на 47, 48 и 80 сутки, приняты отделом обеспечения безопасности Southern Research Institute для вскрытия с последующим полным гистопатологическим анализом. Животных в группе 7 исключали из вскрытия и полного гистопатологического анализа. Для животных в группах 1-6 имплантация опухоли (подкожная) имела место на 0 сутки. Лечение начинали на 14 сутки, и лечение прекращали на 45 сутки. Иссечение первичной опухоли осуществляли на 28 сутки после имплантации в группах 5 и 6. Животных умерщвляли на 80 сутки. Животных в группе без иссечения умерщвляли на 4748 сутки. Таблица 1- 16009873 Для животных в группах 7-10 имплантация опухоли (подкожная) имела место на 0 сутки. Лечение начинали на -7 сутки, и лечение прекращали на 45 сутки. Животных умерщвляли на 46-47 сутки. Таблица 2 Для животных в группе 11 имплантация опухоли (подкожная) имела место на 0 сутки. Лечение начинали на 14 сутки, и лечение прекращали на 45 сутки. По пять животных на группу умерщвляли на 1, 7,14, 21, 24, 24 сутки. Данную группу применяли для контроля уровней натализумаба в сыворотке. Таблица 3 Введение натализумаба начинали в указанный день исследования с ударной дозы 10 мг/кг. Последующие дозы вводили дважды в неделю (т.е. каждые 3-4 дней). Уровни дозирования выбирали на основе моделирования фармакокинетики после однократной дозы и концентраций в сыворотке в повторно подтвержденном фармакокинетическом исследовании. Выбирали уровень дозирования для предоставления минимальной концентрации в сыворотке 20 ml/mL после введения повторной дозы. Лечение натализумабом после развития опухоли MOLT-4 приводило к более медленному росту опухоли в группе иссечения, и некоторые животные в группе иссечения являлись свободными от опухоли после лечения. Лечение натализумабом, начинаемое перед имплантацией опухоли MOLT-4, приводило к значительному уменьшению роста опухоли. Лечение натализумабом не оказывало неблагоприятного влияния на здоровье животного, как очевидно из увеличения массы тел в ходе всего периода лечения. Определяли число неспецифических смертей, число частичных и полных регрессий опухоли, число свободных от опухоли выживших, и время до достижения оцениваемого размера (время до достижения четырех удвоений массы опухоли) для отдельного животного. Время до достижения четырех удвоений массы опухоли для отдельного животного применяли в вычислении общей задержки роста медианы опухоли (Т-С). Группу 1 (животные, леченные солевым раствором) применяли в качестве контрольной группы (С) во всех вычислениях. Медианные массы опухоли, средние массы опухоли, стандартные отклонения и сравнение медианного и среднего веса опухоли в группах лечения (Т) с медианным и средним весом опухоли в контрольной группе (С) (медианное Т/С=медианное Т/медианное С 100% и среднее Т/С=среднее Т/среднее С 100%, соответственно) вычисляли для каждой группы на каждые сутки сбора данных (значения представлены в таблицах с 8-2 по 8-8). Средние массы тела и стандартные отклонения вычисляли для каждой группы на каждые сутки сбора данных (значения представлены в табл. с 8-9 по 8-15). Опухоли животных 1-10 в группах 1, 2, 3 и 4 собирали на 47 сутки. Опухоли животных 11-20 в группах 1, 2, 3 и 4 собирали на 48 сутки. Первичные опухоли животных 1-20 в группах 5 и 6 хирургически иссекали на 28 сутки. Вторичные опухоли (повторно выросшие в участке первичной опухоли) всех выживших животных в группах 5 и 6 собирали на 80 сутки. Животные 1 и 15 в группе 6 не обладали вторичной опухолью по вскрытию на 80 сутки. (Животное 4 в группе 5 и животное 3 в группе 6 умерли в ходе послеоперационного восстановления на 28 сутки, и таким образом, не обладали вторичной опухолью. Животное 19 в группе 5, которое было найдено мертвым на 47 сутки, вскрыли посмертно. Животное 12 в группе 5 удалили из эксперимента на 73 сутки из-за избыточного веса опухоли (4224 мг). Животное 8 в группе 6 удалили из эксперимента на 73 сутки из-за изъязвления опухоли. Животных 10, 17 и 20 в группе 5 нашли мертвыми на 73 сутки и не подвергали вскрытию из-за значительного саморазложения.) Каждую опухоль с массой более 100 мг разрезали пополам, одну половину каждой опухоли замораживали в соединении О.С.Т. с применением кашицы сухой лед/этанол и хранили при -84 С. Опухоли с массой менее 100 мг (опухоли животных 1, 3, 7, 9, 11, 12, 14-18 и 20 в группе 4) целиком замораживали в соединении О.С.Т. Опухоли животных 2, 4, 5, 6, 8, 13 и 19 в группе 4 с массой менее 100 мг целиком фиксировали в 10% забуференном формалине. После завершения эксперимента все образцы опухо- 17009873 лей, замороженные в соединении О.С.Т. (всего 145 образцов опухолей), отправили в Sierra Biomedical,Division of Charles River Laboratories для иммуногистохимического анализа для подтверждения, чтоMOLT-4 экспрессировала VLA-4 in vivo и таким образом являлась адекватной моделью опухоли для данного исследования. Иммуногистохимический анализ проводили с коммерческим анти-CD49dантителом и замороженными срезами опухолей MOLT-4 из подгруппы животных в каждой группе лечения. Вторую половину каждой опухоли, если присутствовала, фиксировали в 10% забуференном формалине и принимали в Safety Assessment Department of Southern Research Institute для гистопатологической оценки. Анализ данных. Измерения индивидуальных опухолей и масс тела собирали и обрабатывали с применением программного обеспечения ADAS (автоматизированная система сбора данных), разработанного в SouthernResearch Institute. Затем данные экспортировали в MS Excel для целей представления. Для графического представления исходных данных применяли SigmaPlot. Массу опухоли индивидуального животного на сутки последнего измерения перед завершением (сутки 47 для групп 1-4 и сутки 80 для групп 5 и 6) применяли в качестве конечной точки для статистического сравнения данных роста между группами. Для проведения t-теста Стьюдента применяли программное обеспечение SigmaStat. Когда набор данных не проходил теста на нормальность или равенство дисперсий, применяли критерий суммы рангов МаннаУитни. Копия результатов статистического анализа приложена к данному сообщению. Анализ разведения дозы. Два разведения дозы (МР-21520 и МР-21522) немного превышали заданную концентрацию 15% с разницей +16% и +19%, соответственно. Данные разницы относили к 0,01-0,04 единицам оптической плотности при 280 нм, присутствующим в растворах для дозирования в солевом растворителе и в растворителе. Данную оптическую плотность относили к отложениям соли на пробке контейнера с образцом. Рост SC ксенотрансплантантов лейкоза MOLT-4. Не обнаружили роста ни в одной из пробирок с тиогликолевой средой, в которые помещали фрагменты опухоли в сутки имплантации фрагмента опухоли и инкубировали при +37 С 24 ч. В контрольной,леченной солевым раствором группе (группа 1) доля приживаемости ксенотрансплантанта составляла 95%, с отсутствием роста у одного ксенотрансплантанта из двадцати (отторжение). Животное 20 в группе 1 с отторжением опухоли исключали из всех вычислений. Рост опухоли и введение солевого раствора являлись переносимыми без потери массы. Медианная масса опухоли достигала 1764 мг на 47 сутки и достигала четырех удвоений массы опухоли на 30,2 сутки. Опухоли у всех двадцати леченных солевым раствором животных в группе 5 постепенно росли после имплантации. Опухоли хирургически иссекали на 28 сутки. Одно животное умерло в ходе периода послеоперационного восстановления (животное 4). Животные теряли массу немедленно после хирургии (максимум средней потери массы тела 2 г [10%]), но позже вновь набирали массу и продолжали расти. Наблюдаемую потерю массы тела можно отнести к введению анестезии, так же как к потере массы нетто иссеченной опухоли. Четыре животных умерли в ходе эксперимента: животное 19 найдено мертвым на 47 сутки; животные 10, 17 и 20 найдены мертвыми на 73 сутки. У всех животных на участке первичной опухоли после иссечения опухоли выросли повторно. Медианная масса опухоли достигала 2363 мг на 80 сутки, и медианная опухоль достигала четырех удвоений массы на 60,9 сутки. Эффект натализумаба. Введение натализумаба (группа 2) являлось хорошо переносимым без смертей и связанным со средними колебаниями массы тела 1 г (5%) в течение первой недели лечения. Все двадцать опухолей выросли на протяжении курса эксперимента. Медианная масса опухоли достигала 1240 мг на 47 сутки, и медианная опухоль достигала четырех удвоений массы опухоли на 33,5 сутки. Сравнением масс отдельных опухолей в контрольной, леченной солевым раствором группе (группа 1) и в леченной натализумабом группе (группа 2) на 47 сутки показали, что массы опухолей в леченной натализумабом группе статистически не отличались по сравнению с массами опухолей в леченной солевым раствором группе(р=0,1032, критерий суммы рангов Манна-Уитни), показывая, что опухоли в обеих группах росли с одинаковой скоростью. Опухоли у всех двадцати леченных натализумабом животных в группе 6 постепенно росли после имплантации. Опухоли хирургически иссекали на 28 сутки. Одно животное умерло в ходе периода послеоперационного восстановления (животное 3). Животные испытывали минимальную потерю массы немедленно после хирургического иссечения опухоли (максимум средней потери массы тела 1 г [5%]),но впоследствии продолжали набирать массу. У семнадцати из девятнадцати животных на участке первичной опухоли после иссечения повторно выросли опухоли, с двумя животными, остающимися свободными от опухоли на сутки завершения исследования, 80 сутки. Медианная масса опухоли достигала 1006 мг на 80 сутки, и медианная опухоль не достигала четырех удвоений массы опухоли (66,0 суток). Сравнением массы индивидуальных животных в леченной солевым раствором группе (группа 5) и в леченной натализумабом группе (группа 6) показали, что рост опухолей в леченной натализумабом группе- 18009873 статистически отличался от роста опухолей в леченной солевым раствором группе (Р=0,0189, t-тест),показывая, что леченные натализумабом опухоли росли повторно с более медленной скоростью, чем опухоли в леченной солевым раствором группе. Опухоли всех тридцати леченных натализумабом животных в группе 7 росли. Рост опухолей не оценивали, так как животных периодически удаляли из исследования для терминального сбора крови. Эффект IgG4. Введение IgG4 (группа 3) являлось хорошо переносимым без смертей или потери массы тела. Все двадцать животных обладали опухолью при завершении эксперимента. Медианная масса опухоли достигала 1731 мг на 47 сутки, и медианная опухоль достигала четырех удвоений массы опухоли на 31,7 сутки. Сравнением масс отдельных опухолей в контрольной, леченной солевым раствором группе, и в леченной IgG4 группе на 47 сутки показали, что массы опухолей в леченной IgG4 группе статистически не отличались по сравнению с массами опухолей в контрольной группе (р=0,8004, критерий суммы рангов Манна-Уитни), показывая, что опухоли в обеих группах росли с одинаковой скоростью. Эффект Taxol. Введение Taxol (группа 4) являлось хорошо переносимым без смертей или длительной потери массы тела. Максимум средней потери массы тела 5% (1 г) наблюдали после окончания лечения (на сутки 17 и 21), что являлось ожидаемым, поскольку Taxol, цитотоксическое средство, вводили в приблизительно максимальной переносимой дозе. Животные восстанавливали массу в ходе периода после лечения. Лечение Taxol являлось очень эффективным для ингибирования роста ксенотрансплантанта опухоли MOLT-4. Двенадцать из двадцати животных не обладали измеряемой опухолью при завершении эксперимента, и только три из восьми измеряемых опухолей удвоили свою массу один раз в ходе эксперимента. Рост опухолей, леченных Taxol, статистически отличался от роста опухоли в леченной носителем, контрольной группе (р 0,0001, критерий суммы рангов Манна-Уитни), показывая, что лечениеTaxol ингибирует рост опухоли. Краткое изложение гистопатологической оценки. В заключение, среди различных групп лечения наблюдали распределенные случайным образом макроскопические поражения, вовлекающие матку, яичники, лимфатические узлы, легкое, печень, и увеличение селезенки, но ни одно из обнаруженного не считали связанным с лечением. Микроскопические очаги, встречающиеся случайным образом у мышей из различных групп лечения, включали в себя экстрамедуллярный гемопоэз в селезенке и печени, фокальный некроз и воспаление в печени, воспаление в брыжейке и минерализацию эпикарда сердца. Все данные изменения считали случайными или спонтанными и не связанными с введением всех тестируемых веществ. Увеличение роста ксенотрансплантанта не являлось очевидным ни в одной группе лечения. Расширение роста ксенотрансплантанта отметили в вентральной абдоминальной (паховой) коже четырех мышей, каждая из групп 5 и 6. Метастазирование или расширение ксенотрансплантанта наблюдали в региональных лимфатических узлах (подмышечном,паховом, подвздошном, нижнечелюстном и медиастинальном) у мышей в группе 5 и в паховом лимфатическом узле мышей в группе 6. Метастазы в тимусе наблюдали у одной мыши из каждой из групп 5 и 6. Не было доказательств усиления роста или метастазирования вторичного острого лимфобластного лейкоза в результате лечения натализумабом. Краткое изложение иммуногистологического анализа опухолей. Срезы опухолей анализировали посредством иммуногистохимии, чтобы подтвердить, что MOLT-4 экспрессировала VLA-4 in vivo и таким образом являлась адекватной моделью опухоли для данного исследования. Иммуногистохимический анализ проводили с коммерческим анти-CD49d-антителом и замороженными срезами опухолей MOLT-4 из подгруппы животных в каждой группе лечения. Иммуноположительные CD49d-специфические клетки MOLT-4 характеризовались явным, от гранулярного до дымчатого, диффузным окрашиванием цитоплазмы и поверхности клеток. Диффузное цитоплазматическое окрашивание позволяет предполагать, что CD49d внутри цитоплазмы, так же как на поверхности клеток,связывает анти-CD49d-антитело. Срезы опухолей от животных из контрольной группы солевого раствора и из контрольной группы IgG4 обладали явным окрашиванием, и им присваивали баллы иммуногистохимического окрашивания от 3 до 4 (от кластеризованные клетки, тесно расположенные до плотно упакованные клетки, соответственно). Срезы опухолей от животных из леченной натализумабом группы с пролонгированным периодом без лечения перед вскрытием (группа 6) также обладали явным окрашиванием, и им присваивали баллы иммуногистохимического окрашивания от 3 до 4. У животных, леченных натализумабом и умерщвленных при завершении лечения, иммуногистохимическое окрашивание для CD49d являлось сильно уменьшенным, до отсутствующего, и срезам опухоли присваивали баллы иммуногистохимического окрашивания от 0 до 2 (от нет меченых клеток до редкие отдельные клетки, тесно расположенные, соответственно). У мышей, леченных лизирующим опухоль средством таксолом, после лечения часто не оставалось опухолевого образования, позволяющего оценку иммуногистохимическим окрашиванием. Данные результаты подтверждают, что линия клеток лейкоза человекаMOLT-4 экспрессирует CD49d in vivo в экспериментальных условиях данного исследования.- 19009873 Заключение. Рост SC-имплантированных ксенотрансплантантов острого лимфобластного лейкоза человекаMOLT-4 не ингибировали введением натализумаба. Однако повторный рост солидной опухоли в участке иссечения первичной опухоли ингибировали введением натализумаба. Введение IgG4 не оказывало эффекта на рост ксенотрансплантантов. Лечением Taxol ингибировали первичный рост опухоли, приводя к отсутствию измеряемой опухоли у двенадцати из двадцати животных при окончании эксперимента. Гистопатологический анализ животных не выявил доказательств усиления роста или метастазирования ксенотрансплантантов острого лимфобластного лейкоза человека в результате лечения натализумабом или IgG4. Во всех группах лечения присутствовало множество макроскопических и микроскопических очагов со случайным характером распределения. Однако по всем данным об очагах, их считали спонтанными или случайными и не связанными с лечением солевым раствором, натализумабом, IgG4 илиTaxol. Все процитированные выше ссылки приведены здесь в полном объеме для любых целей. Данная патентная заявка является родственной предварительной патентной заявке США 60/541946, поданной 6 февраля 2004, которая приведена здесь в качестве ссылки в полном объеме для любых целей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ ингибирования роста опухоли, и/или метастатического прогрессирования, и/или развития метастазов, предусматривающий введение анти-4-иммуноглобулина нуждающемуся в этом субъекту в количестве, достаточном для ингибирования роста опухоли и/или метастазирования. 2. Способ по п.1, где анти-4-антитело связывает 41 интегрин и/или 47 интегрин. 3. Способ по п.1, где анти-4-иммуноглобулин представляет собой натализумаб. 4. Способ по п.1, где опухоль представляет собой меланому, рак предстательной железы, лейкоз или лимфому. 5. Способ по п.4, где меланома представляет собой кожную меланому, метастатическую меланому или внутриглазную меланому. 6. Способ по п.4, где лимфома представляет собой неходжкинскую лимфому, кожную Т-клеточную лимфому или лимфому Ходжкина. 7. Способ по п.4, где лейкоз представляет собой хронический миелолейкоз, острый миелолейкоз,острый лимфобластный лейкоз взрослых, острый миелолейкоз, острый лимфобластный лейкоз зрелых Вклеток, хронический лимфолейкоз, пролимфоцитарный лейкоз или лейкоз ворсистых клеток. 8. Способ по п.3, где субъекту вводят натализумаб в количестве от приблизительно 1 до приблизительно 100 мг/кг массы субъекта. 9. Способ по п.8, где субъекту вводят натализумаб в количестве от приблизительно 1 до приблизительно 10 мг/кг массы субъекта. 10. Способ по п.8, где натализумаб вводят в количестве от приблизительно 1 до приблизительно 20 мг/кг массы субъекта. 11. Способ по п.4, где опухоль представляет собой меланому и субъекту вводят натализумаб после хирургического удаления меланомы. 12. Способ по п.4, где опухоль представляет собой меланому и субъекта дополнительно подвергают хирургическому лечению, перфузии отдельной конечности, местной инфузионной химиотерапии, системной химиотерапии или иммунотерапии вторым антителом или антисывороткой для лечения меланомы. 13. Способ по п.12, где второе антитело представляет собой анти-GM2 ганглиозид-антитело, антиGD2 ганглиозид-антитело или анти-GD3 ганглиозид-антитело. 14. Способ по п.12, где местная инфузионная химиотерапия или системная химиотерапия предусматривает по меньшей мере одно химиотерапевтическое средство, выбранное из группы, состоящей из дакарбазина, кармустина, ломустина, тауромустина, фотемустина, семустина, цисплатина, карбоплатина,винкристина, винбластина, виндезина, таксола, дибромдулыдитола, деторубицина, пиритрексима и интерферона. 15. Способ по п.14, где интерферон представляет собой интерферон-2. 16. Способ по п.1, где метастаз представляет собой метастаз в мозге, легком, печени или кости. 17. Способ по п.16, где метастаз представляет собой метастаз легкого и опухоль представляет собой меланому. 18. Способ по п.1, где опухоль представляет собой лимфому и субъекта дополнительно лечат одним или несколькими химиотерапевтическими средствами и/или радиотерапией. 19. Комбинированная терапия для ингибирования роста опухоли и/или метастатического прогрессирования, и/или развития метастазов, предусматривающая введение анти-4 интегриниммуноглобулина или иммуноглобулина против лиганда 4 интегрина и химиотерапевтического средства, иммунотерапевтического средства и/или радиотерапию. 20. Комбинированная терапия по п.19, где анти-4 интегрин-иммуноглобулин представляет собой- 20009873 анти-41 интегрин-антитело или анти-47 интегрин-антитело. 21. Комбинированная терапия по п.20, где анти-4-иммуноглобулин представляет собой натализумаб. 22. Комбинированная терапия по п.20, где анти-4-иммуноглобулин вводят внутривенно, интратекально или подкожно нуждающемуся в них субъекту. 23. Комбинированная терапия по п.20, где анти-4-иммуноглобулин представляет собой натализумаб и его вводят в количестве от приблизительно 1 до приблизительно 100 мг/кг массы субъекта. 24. Комбинированная терапия по п.23, где натализумаб вводят в количестве от приблизительно 10 до приблизительно 30 мг/кг массы субъекта. 25. Комбинированная терапия по п.20, где анти-4-иммуноглобулин вводят ежесуточно, еженедельно или ежемесячно. 26. Комбинированная терапия по п.25, где анти-4-иммуноглобулин вводят еженедельно. 27. Применение анти-4 интегрин-иммуноглобулина для получения лекарственного средства для ингибирования роста опухоли, и/или метастатического прогрессирования, и/или развития метастазов при введении нуждающемуся в нем субъекту. 28. Применение по п.27, где субъекта дополнительно лечат химиотерапией, иммунотерапией, хирургией, радиотерапией, гипертермией или лекарственным средством для облегчения неблагоприятных эффектов терапии рака. 29. Применение по п.27, где опухоль представляет собой меланому, лейкоз, рак предстательной железы или лимфому.
МПК / Метки
МПК: A61K 31/541, A61K 39/395, C12N 5/12, A61K 31/381, C12N 15/13, C07K 16/28
Метки: роста, способ, метастатического, прогрессирования, опухоли, ингибирования
Код ссылки
<a href="https://eas.patents.su/22-9873-sposob-ingibirovaniya-rosta-opuholi-i-ili-metastaticheskogo-progressirovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ ингибирования роста опухоли и/или метастатического прогрессирования</a>