Нуклеиновые кислоты, специфично связывающие биоактивный грелин
Номер патента: 9376
Опубликовано: 28.12.2007
Авторы: Бухнер Клаус, Маш Кристиан, Клуссманн Свен, Эульберг Дирк, Хельмлинг Штеффен
Формула / Реферат
1. Нуклеиновая кислота, которая связывается с биоактивным грелином.
2. Нуклеиновая кислота по п.1, где эта нуклеиновая кислота специфично связывается с биоактивным грелином, и специфичное связывание выражено в виде величины Kd, где Kd нуклеиновой кислоты составляет от 10 пМ до 1 мкМ, более предпочтительно от 100 пМ до 500 нМ и наиболее предпочтительно от 1 до 100 нМ.
3. Нуклеиновая кислота по п.1 или 2, где биоактивный грелин представляет собой н-октаноил-грелин.
4. Нуклеиновая кислота по любому из пп.1-3, где нуклеиновая кислота представляет собой L-нуклеиновую кислоту, предпочтительно шпигельмер (spiegelmer).
5. Нуклеиновая кислота по любому из пп.1-4, где эта нуклеиновая кислота имеет вторичную структуру, представленную на фиг. 1B.
6. Нуклеиновая кислота по любому из пп.1-5, где эта нуклеиновая кислота содержит последовательность, соответствующую SEQ. ID. No 1, предпочтительно состоит из нее.
7. Нуклеиновая кислота по любому из пп.1-6, где эта нуклеиновая кислота содержит последовательность, соответствующую от SEQ. ID. No. 2 до SEQ. ID. No. 15, предпочтительно состоит из нее.
8. Применение нуклеиновой кислоты по любому из пп.1-7 для связывания биоактивного грелина.
9. Применение нуклеиновой кислоты по любому из пп.1-7 для обнаружения биоактивного грелина.
10. Применение нуклеиновой кислоты по любому из пп.1-7 для ингибирования биоактивного грелина.
11. Применение нуклеиновой кислоты по любому из пп.1-7 для производства лекарства.
12. Применение по п.11, где лекарство предназначено для лечения и/или для предупреждения заболевания и/или расстройства, где заболевание и/или расстройство выбрано из группы, включающей ожирение, регуляцию энергетического баланса, аппетита, массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечно-сосудистое заболевание.
13. Способ обнаружения биоактивного грелина, включающий следующие стадии:
а) получение образца, который подлежит тестированию на присутствие биоактивного грелина,
б) получение нуклеиновой кислоты по любому из пп.1-7,
в) взаимодействие образца с нуклеиновой кислотой, где стадию (а) можно проводить перед стадией (б), либо стадию (б) можно проводить перед стадией (а).
14. Способ по п.13, включающий дополнительную стадию (г):
г) обнаружение взаимодействия образца с нуклеиновой кислотой.
15. Способ по п.14, при котором нуклеиновую кислоту стадии (б) иммобилизуют на поверхности.
16. Способ по п.14, где нуклеиновая кислота по любому из пп.1-7 содержит флуоресцентную группировку и где флуоресценция этой флуоресцентной группировки отличается при образовании комплекса между нуклеиновой кислотой и биоактивным грелином от свободного биоактивного грелина.
17. Способ по любому из пп.14-16, где нуклеиновая кислота представляет собой производное нуклеиновой кислоты по любому из пп.1-7, где это производное нуклеиновой кислоты включает по меньшей мере одно флуоресцентное производное аденозина, замещающее аденозин.
18. Способ по п.17, где флуоресцентное производное аденозина представляет собой этеноаденозин.
19. Способ по любому из пп.16-18, при котором комплекс, состоящий из производного нуклеиновой кислоты по любому из пп.1-7 и биоактивного грелина, обнаруживают с использованием флуоресценции.
20. Способ по любому из пп.13-19, где биоактивный грелин представляет собой н-октаноил-грелин.
21. Способ по любому из пп.13-20, где сигнал создается на стадии (в) или на стадии (г) и предпочтительно этот сигнал коррелирует с концентрацией биореактивного грелина в образце.
22. Способ по любому из пп.13-21, где образец выбран из группы, включающей кровь, плазму, сыворотку, жидкость и ткани.
23. Способ по любому из пп.13-22, где способ представляет собой диагностический способ или прогностический способ.
24. Способ по п.23, где способ предназначен для диагностики, определения стадии и/или прогнозирования заболевания и/или расстройства, где предпочтительно указанное заболевание и/или расстройство выбрано из группы, включающей ожирение, регуляцию энергетического баланса, аппетита, массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечно-сосудистое заболевание.
Текст
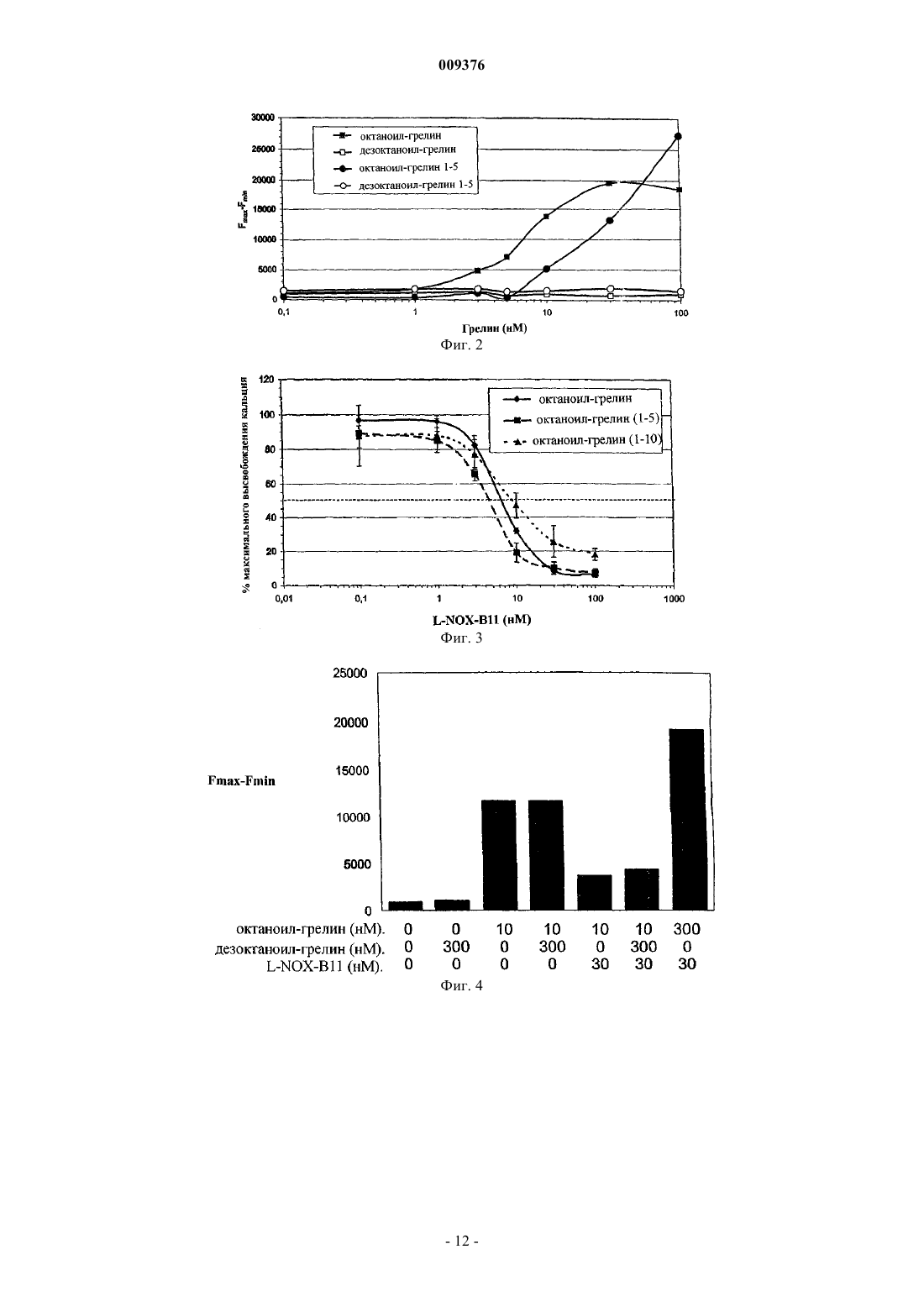
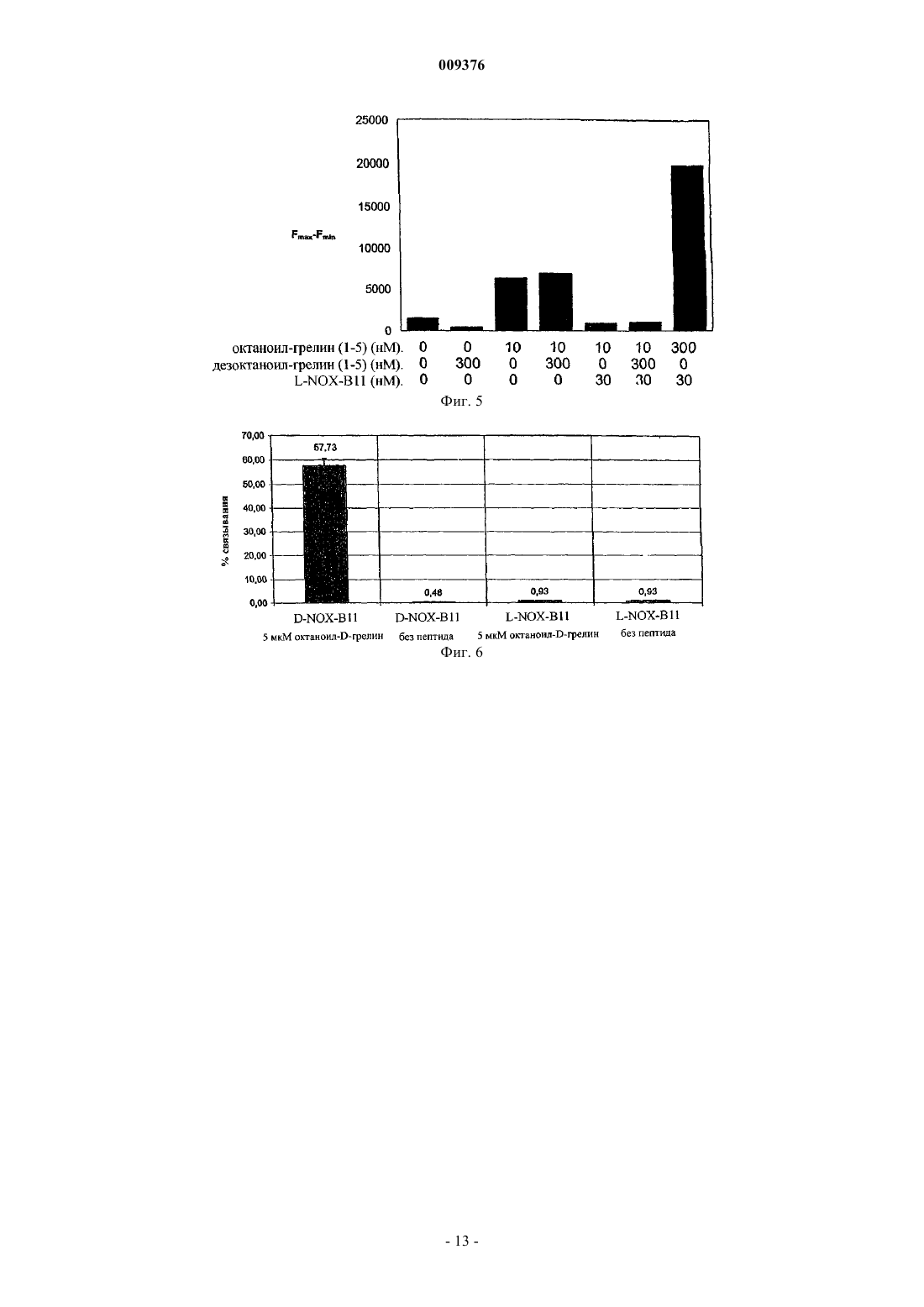
009376 Настоящее изобретение относится к нуклеиновым кислотам, которые связывают биоактивный грелин, и к применению такой нуклеиновой кислоты для связывания и обнаружения биоактивного грелина. Грелин был идентифицирован как природный лиганд рецептора стимулятора секреции гормона роста 1a (GHSR1a). Этот рецептор наиболее распространен в гипофизе и в гипоталамических участках головного мозга, но также может быть обнаружен в других тканях в низких концентрациях. Начиная с конца 70-х годов, было показано, что синтетические пептиды и другие соединения, названные стимуляторами секреции, стимулируют высвобождение гормона роста. Однако природный лиганд, ответственный за высвобождение гормона роста, оставался неизвестным вплоть до открытия грелина в 1999 году. Грелин представляет собой высокоосновный пептидный гормон из 28 аминокислот с октаноильной кислотной боковой цепью по третьей аминокислоте его N-конца (серии 3). Эта необычная модификация требуется для взаимодействия при GHS-рецепторе и для его активности. Однако в биологических образцах присутствует смесь обеих форм, как октаноил-грелина, который представляет собой биологически активную форму грелина, так и немодифицированного или дезоктаноил-грелина. Аминокислотная последовательность очищенного грелина крысы была определена с помощью белкового секвенатора какGSSFLSPEHQKAQQRKESKKPPAKLQPR (SEQ. ID. No. 19). Соответствующая последовательность человека отличается только по двум положениям, несущим такую же н-октаноил-боковую цепь по положению аминокислоты серии 3 (GSSFLSPEHQRVQQRKESKKPPAKLQPR (SEQ. ID. No. 16). Кроме встречающегося в природе н-октаноильного остатка ненасыщенные или разветвленные октаноильные группы и более длинные алифатические цепи, включенные по положению 3 грелина, также опосредуют распознавание рецептора. Домен взаимодействия с рецептором расположен на самом Nконце грелина; исследования делеций указывают на то, что грелин (1-10) [GSSFLSPEHQ, SEQ. ID. No. 17] и даже минимальный мотив из аминокислот 1-5 (грелин (1-5) [GSSFL, SEQ. ID. No. 18]) являются достаточными для стимуляции GHSR1a, но в обоих случаях наблюдается строгое требование в отношении модификации пептида н-октаноильным остатком. Показано, что грелин опосредует физиологические функции, имеющие отношение к анаболическому состоянию. Хотя он непосредственно стимулирует высвобождение гормона роста (GH) из гипофиза,эксперименты на грызунах также показали, что грелин индуцирует питание независимым от GH образом путем воздействия на нейроны гипоталамуса. Интересно, что первичным сайтом продуцирования грелина являются собственные железы желудка, подтверждая, что он служит в качестве гормональной связи между желудком, гипофизом и гипоталамусом. Наблюдение того факта, что введение грелина крысам приводило в результате к увеличению массы тела вследствие изменений в поглощении энергии и/или утилизации энергии, подтверждает такую роль. Кроме того, системное введение грелина людям вызывает ощущения голода у испытуемых субъектов и вызывает переедание. На основании этих открытий считают, что грелин играет решающую роль в регуляции аппетита и массы тела, являясь как острым, так и хроническим сигналом состояния недостаточного питания. Дополнительное подтверждение этой гипотезы следует из наблюдений того факта, что и уровни грелина, и аппетит снижены у индивидуумов после желудочного шунтирования, что вносит, по меньшей мере, частичный вклад в эффективность этой методики при осуществлении похудания. Клинические данные у пациентов с синдромом Прадера-Вилли также позволяют предположить, что гиперфагия и ожирение, ассоциированные с заболеванием, являются следствием огромной гипергрелинемии. Кроме того, обнаружено, что грелин индуцирует гипергликемию и ингибирование высвобождения инсулина, указывая на вовлечение в метаболизм глюкозы. В дополнение к этим функциям в энергетическом метаболизме грелин также вовлечен в ряд других процессов. Было обнаружено, что он экспрессируется в ряде нейроэндокринных опухолей и стимулирует, кроме высвобождения GH из гипофиза, высвобождение адренокортикотропного гормона (АСТН), пролактина(PRL) и кортизола. Было обнаружено, что однократные инъекции грелина здоровым индивидуумам повышают минутный сердечный выброс и снижают кровяное давление. Таким образом, действие грелина по-видимому вовлечено в ряд различных задач. Информация о предшествующем уровне техники может быть получена из М. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsu, K. Kangawa, "Ghrelin is a growthhormone-releasing acylated peptide from stomach", Nature 402: 656-60, 1999; M. Tschp, D.L. Smiley, M.L.-1 009376 Задача, лежащая в основе настоящего изобретения, заключается в том, чтобы предложить средства для связывания биоактивного грелина, и более конкретно, предложить способ лечения заболеваний и расстройств, опосредованных биоактивным грелином, а также способы специфичного обнаружения биоактивного грелина. Согласно настоящему изобретению эта задача решена посредством объектов, заявленных в независимых пунктах формулы изобретения, которая прилагается здесь. Предпочтительные воплощения следуют из зависимых пунктов. Грелин человека представляет собой основный пептид, имеющий аминокислотную последовательность в соответствии с SEQ. ID. No. 16, и модифицирован боковой цепью жирной кислоты. С учетом высокой степени гомологии пептидной последовательности между различными видами термин грелин,используемый здесь, относится к любому грелину, включая грелин млекопитающих, но не ограничен им. Предпочтительно грелин млекопитающих выбран из группы, включающей грелин мышей, крыс, кроликов, хомяков и человека. Наиболее предпочтительно грелин представляет собой грелин человека. Рассчитанная изоэлектрическая точка (pI) грелина равна 11,09. Несмотря на эту высокоосновную общую pI грелина, мотив связывания рецептора GSSFL [грелин (1-5)] представляет собой достаточно кислый домен, имеющий рассчитанную pI, равную 5,5. Настоящее изобретение основано на неожиданном открытии того, что посредством полноразмерного грелина может быть отобрана нуклеиновая кислота, которая специфично распознает кислый домен связывания рецептора, но не распознает основные центральный и карбоксиконцевой домены этого пептида. Это является неожиданным в отношении электростатических эффектов как зарядов молекулы-мишени, то есть грелина, так и зарядов нуклеиновой кислоты. Связывание отрицательно заряженных нуклеиновых кислот с основным доменом молекулы-мишени должно обладать значительными преимуществами по сравнению со связыванием нуклеиновой кислоты с кислым доменом молекулы-мишени. Следовательно нужно подчеркнуть, что специалисты в данной области техники не ожидают обоснованного успеха в выборе нуклеиново-кислотного лиганда, который не связывается с основной частью грелина, но связывается с кислым доменом молекулы-мишени. Кроме аминоконцевого мотива связывания рецептора биологически активный грелин, который также называют здесь биоактивным грелином, характеризуется его ацилированием группой н-октаноил при аминокислоте серии 3. Нуклеиново-кислотный лиганд аминоконцевого мотива GSSFL, раскрытый здесь, дает возможность отличения биологически активной формы от биологически неактивной или не биоактивной формы грелина. Это является неожиданным, поскольку связывание строго зависит от присутствия двух группировок, октаноильной группы и пептида: связывание нуклеиновой кислоты с октаноил-грелином является специфичным в присутствии 1000-кратного избытка дезоктаноил-грелина, более предпочтительно в присутствии 100-кратного избытка дезоктаноил-грелина и наиболее предпочтительно в присутствии 10-кратного избытка дезоктаноил-грелина. Кроме того, характеристики связывания также специфичны для пептидной группировки с учетом того факта, что энантиомерный октаноил-грелин не распознается нуклеиновой кислотой; октаноильная группа не является достаточной для связывания. Как используют здесь в предпочтительных воплощениях, биоактивный грелин представляет собой грелин, который проявляет в предпочтительном воплощении по существу все характеристики встречающегося в природе грелина. В частности, биоактивный грелин, как используют здесь в предпочтительных воплощениях, представляет собой любой грелин и производное грелина, который является ответственным за высвобождение или который может запускать высвобождение гормона роста, более предпочтительно посредством взаимодействия с рецептором GHS. В противоположность этому в предпочтительных воплощениях биологически неактивный грелин представляет собой грелин, который отличается от биоактивного грелина, более предпочтительно не запускает высвобождение гормона роста, более предпочтительно посредством взаимодействия с рецептором GHS. Признаки нуклеиновой кислоты по настоящему изобретению, как описано здесь, могут быть реализованы в любом аспекте настоящего изобретения, где используют нуклеиновую кислоту, либо в отдельности, либо в комбинации. Нуклеиновая кислота по настоящему изобретению также включает нуклеиновые кислоты, которые являются по существу гомологичными конкретным последовательностям, раскрытым здесь. Термин по существу гомологичный следует понимать так, что гомология составляет по меньшей мере 75%, предпочтительно 85%, более предпочтительно 90% и наиболее предпочтительно более чем 95, 96, 97, 98 или 99%. Нуклеиновая кислота по настоящему изобретению также включает в одном из воплощений нуклеиновую кислоту, которая является производной от конкретных последовательностей, раскрытых здесь. Термин производное следует понимать так, что на основе SEQ. ID No. 1 локусы инсерции Ins1-Ins4,показанные на фиг. 1 А, могут быть представлены любой последовательностью длиной максимум 30 нуклеотидов, предпочтительно любой последовательностью максимум 20 нуклеотидов, более предпочтительно любой последовательностью максимум 10 нуклеотидов и наиболее предпочтительно любой последовательностью 0-3 нуклеотида для Ins1, 0-14 нуклеотидов для Ins2, 1-3 нуклеотида для Ins3 и 0-2 нуклеотида для Ins4. Внутреннюю петлю IL 1 а, представленную Ins2, считают наиболее важным сайтом модификации.-2 009376 Нуклеиновая кислота по настоящему изобретению может быть также представлена в предпочтительном воплощении следующей общей формулой: CGUGYGN(0-3)AGGYAN(0-14)AAAACN(1-3)UAARWCCGAAGGUAACCAWUCCUACN(0-2)ACG (SEQ. ID. No. 1), где Y означает U или С, R означает А или G, W означает U или А. В связи с этим следует отметить, что любой из индексов представляет собой любое целое число, начиная с первой указанной цифры до последней указанной цифры, и любое целое число между ними. Соответственно, например, 0-3 представляет собой 0, 1, 2 и 3. Таким образом, консенсусная последовательность SEQ. ID. No. 1 содержит четыре области, где инсерции вариабельной длины наблюдают в различных воплощениях. Эти области называют локусами инсерции и отмечают как Ins1-Ins4. В соответствии с L-NOX-B11, обозначенной как SEQ. ID. No. 2 на фиг. 1 А, Ins1 локализован между нуклеотидами 6 и 7, Ins2 локализован между нуклеотидами 13 и 14, Ins3 локализован между нуклеотидами 18 и 20 и Ins4 локализован между нуклеотидами 44 и 45. Длина соответствующих локусов инсерции, наблюдаемая в изображенных клонах, дана в SEQ. ID. No. 1 и в указанной выше общей формуле. Нуклеиновая кислота по настоящему изобретению также включает в одном из воплощений нуклеиновую кислоту, которая представляет собой структурный гомолог конкретных последовательностей,раскрытых здесь, предпочтительно до такой степени, что указанные участки вовлечены в связывание с октаноил-грелином и исключение дез-октаноил-грелина. Структурную гомологию, как она использована в отношении предпочтительных воплощений настоящего изобретения, следует понимать так, что эти последовательности укладываются в характеристическую модель вторичной структуры, содержащую основной стебель и внутреннюю петлю, а также концевую петлю на конце стебля, как изображено на фиг. 1 В, предпочтительно укладываются в указанную структуру, где в областях стебля встречаются компенсаторные замены оснований, и предпочтительно укладываются в указанную структуру, где в однонитевых протяженных участках встречаются замены, делеции и/или инсерции, и наиболее предпочтительно укладываются в указанную структуру, соответствующую фиг. 1 В по размеру и последовательности SEQ.ID. 1 по последовательности. В термин нуклеиновая кислота по изобретению или нуклеиновая кислота по настоящему изобретению следует также включать те нуклеиновые кислоты, которые содержат участки последовательностей нуклеиновых кислот, раскрытых здесь, предпочтительно до такой степени, чтобы указанные участки были вовлечены в связывание с грелином и отличение биоактивного грелина от биологически неактивного грелина, то есть, в частности, октаноил-грелина от дезоктаноил-грелина. Такая нуклеиновая кислота может быть образована от раскрытых здесь, например, путем усечения. Усечение может относиться к любому концу или к обоим концам нуклеиновых кислот, как раскрыто здесь. Усечение может также относиться к внутренней последовательности нуклеотидов, то есть оно может относиться к нуклеотиду(ам) между 5'- и 3'-концевым нуклеотидом, соответственно. Кроме того, усечение должно включать насколько возможно малую делецию, такую как делеция единственного нуклеотида из последовательности нуклеиновых кислот, раскрытых здесь. Усечение может также относиться к более чем одному участку нуклеиновой(ых) кислот(ы) по изобретению, где этот участок может иметь насколько возможно малую длину, такую как один нуклеотид. Нуклеиновые кислоты по настоящему изобретению могут представлять собой либо D-нуклеиновые кислоты, либо L-нуклеиновые кислоты. Предпочтительно нуклеиновые кислоты по изобретению представляют собой L-нуклеиновые кислоты. Кроме того, возможно, чтобы один или несколько участков нуклеиновой кислоты присутствовали в виде D-нуклеиновых кислот, либо по меньшей мере один или несколько участков нуклеиновых кислот представляли собой L-нуклеиновые кислоты. Термином "участок" нуклеиновых кислот следует обозначать насколько возможно малый участок, такой как один нуклеотид. Такие нуклеиновые кислоты в целом называют здесь D- и L-нуклеиновые кислоты, соответственно. В термин нуклеиновая кислота по изобретению или нуклеиновая кислота по настоящему изобретению следует также включать те нуклеиновые кислоты, которые содержат последовательности нуклеиновых кислот, раскрытые здесь, и другие последовательности, присоединенные к ним, предпочтительно до той степени, чтобы указанные участки или нуклеиновые кислоты были вовлечены в связывание с октаноил-грелином и отличение дезоктаноил-грелина. Удлинения, то есть дополнительные последовательности, присоединенные к специфичным последовательностям нуклеиновых кислот, раскрытым здесь, могут быть такими, чтобы последовательность удлинялась либо с 5'-конца, либо с 3'-конца, либо с обоих концов, и она может содержать такое количество, как 100 нуклеотидов с каждой стороны, предпочтительно такое количество, как 50 нуклеотидов с каждой стороны, более предпочтительно такое количество, как 20 нуклеотидов с каждой стороны, и наиболее предпочтительно полноразмерную или частичную 5'-фланкирующую последовательность, которая раскрыта здесь как SEQ. ID. No. 20, и/или полноразмерную или частичную 3'-фланкирующую последовательность, которая раскрыта здесь как SEQ.ID. No. 21. Термин частично, как он использован здесь, означает в предпочтительном воплощении настоящего изобретения единственный нуклеотид соответствующей последовательности или последовательность из двух или более чем двух нуклеотидов такой последовательности, которые являются соседними друг с другом в последовательности, к которой они относятся, более предпочтительно к фланки-3 009376 рующим последовательностям в соответствии с любой из SEQ. ID. No. 20 и 21. В объем настоящего изобретения также входит то, что нуклеиновые кислоты по настоящему изобретению представляют собой участок более длинной нуклеиновой кислоты, где эта более длинная нуклеиновая кислота содержит несколько участков, где по меньшей мере один участок представляет собой нуклеиновую кислоту, либо ее участок, в соответствии с настоящим изобретением. Другой участок этих более длинных нуклеиновых кислот может представлять собой либо D-нуклеиновую кислоту, либо Lнуклеиновую кислоту. Любую комбинацию можно использовать согласно настоящему изобретению. Этот другой участок (участки) этой более длинной нуклеиновой кислоты может проявлять функцию,которая отлична от связывания. Одной из возможных функций является обеспечение возможности взаимодействия с другими молекулами, такими как, например, молекулы для иммобилизации, перекрестного связывания, обнаружения или амплификации.L-нуклеиновые кислоты, как они использованы здесь, представляют собой нуклеиновые кислоты,состоящие из L-нуклеотидов, предпочтительно состоящие полностью из L-нуклеотидов.D-нуклеиновые кислоты, как они использованы здесь, представляют собой нуклеиновые кислоты,состоящие из D-нуклеотидов, предпочтительно состоящие полностью из D-нуклеотидов. Независимо от того, состоит ли нуклеиновая кислота по изобретению из D-нуклеотидов, Lнуклеотидов или комбинации обоих, где эта комбинация представляет собой, например, случайную комбинацию или определенную последовательность участков, состоящих по меньшей мере из одного Lнуклеотида и по меньшей мере одной D-нуклеиновой кислоты, эта нуклеиновая кислота может состоять из дезоксирибонуклеотида(ов), рибонуклеотида(ов) или их комбинаций. Конструирование нуклеиновых кислот по изобретению в виде L-нуклеиновой кислоты является предпочтительным по нескольким причинам. L-нуклеиновые кислоты представляют собой энантиомеры встречающихся в природе нуклеиновых кислот. D-нуклеиновые кислоты, однако, не очень стабильны в водных растворах и, в частности, в биологических системах или в биологических образцах из-за широкого распространения нуклеаз. Встречающиеся в природе нуклеазы, в частности нуклеазы из животных клеток, неспособны к разрушению L-нуклеиновых кислот. В связи с этим биологический период полувыведения L-нуклеиновой кислоты значительно увеличен в такой системе, включая организм животного и человека. Благодаря отсутствию разрушаемости L-нуклеиновой кислоты не образуются продукты нуклеазного распада и, следовательно, не наблюдается побочных эффектов, возникающих из-за них. Этот аспект разграничивает L-нуклеиновую кислоту и фактически все другие соединения, которые применяют в терапии заболеваний и/или расстройств, в которые вовлечено присутствие грелина. В объем настоящего изобретения также входит то, что нуклеиновые кислоты по изобретению, независимо от того, присутствуют ли они в виде D-нуклеиновых кислот, L-нуклеиновых кислот или D,Lнуклеиновых кислот, и от того, представляют ли они собой ДНК или РНК, могут быть представлены однонитевыми или двунитевыми нуклеиновыми кислотами. Типично нуклеиновые кислоты по изобретению представляют собой однонитевые нуклеиновые кислоты, которые проявляют определенные вторичные структуры благодаря первичной последовательности и могут, следовательно, также образовать третичные структуры. Нуклеиновые кислоты по изобретению, однако, могут быть также двунитевыми в том значении, что две нити, которые комплементарны друг другу, гибридизуются друг с другом. Это придает стабильность нуклеиновой кислоте, которая будет предпочтительна, если нуклеиновая кислота присутствует в природной D-форме, а не в L-форме. Нуклеиновые кислоты по изобретению могут быть модифицированы. Такие модификации могут относиться к единственному нуклеотиду нуклеиновой кислоты и хорошо известны в данной области техники. Примеры такой модификации описаны среди прочего в Kusser, W. (2000) J Biotechnol, 74: 27-38;al., (1993) J Physiol, 469, 213-43. Нуклеиновые кислоты по настоящему изобретению могут представлять собой многокомпонентную нуклеиновую кислоту. Многокомпонентная нуклеиновая кислота, как она использована здесь, представляет собой нуклеиновую кислоту, которая состоит из по меньшей мере двух нитей нуклеиновой кислоты. Эти по меньшей мере две нити нуклеиновой кислоты образуют функциональную единицу, где эта функциональная единица является лигандом для молекулы-мишени. Эти по меньшей мере две нити нуклеиновой кислоты могут быть образованы из любой из нуклеиновых кислот по изобретению либо путем расщепления нуклеиновой кислоты с образованием двух нитей, либо путем синтеза одной нуклеиновой кислоты, соответствующей первой части нуклеиновой кислоты по изобретению, то есть всей нуклеиновой кислоты, и другой нуклеиновой кислоты, соответствующей второй части всей нуклеиновой кислоты. Следует признать, что как расщепление, так и синтез могут быть использованы для образования многокомпонентной нуклеиновой кислоты, где имеется более двух нитей, как проиллюстрировано выше. Иными словами, по меньшей мере две нити нуклеиновой кислоты обычно отличаются от двух нитей,являющихся комплементарными и гибридизующихся друг с другом, хотя некоторая степень комплементарности между различными участками нуклеиновой кислоты может существовать.-4 009376 Возможность определения константы связывания представляет собой использование так называемого устройства Biacore, которое также известно специалистам в данной области техники. Аффинность,как используют здесь, также измеряли с использованием анализов с помощью гранул, как описано в примере 5. Соответствующей мерой для выражения интенсивности связывания между нуклеиновой кислотой в соответствии с мишенью, которая в настоящем случае представляет собой грелин, является так называемая величина Kd, которая, как и способ ее определения, известна специалистам в данной области техники. Нуклеиновые кислоты по настоящему изобретению характеризуются определенной величиной Kd. Предпочтительно величина Kd, проявляемая нуклеиновыми кислотами по настоящему изобретению, находится ниже 1 мкМ. Величину Kd примерно 1 мкМ считают характеристической для неспецифичного связывания нуклеиновой кислоты с мишенью. Как должно быть понятно специалистам в данной области техники, величина Kd группы соединений, таких как нуклеиновые кислоты по настоящему изобретению,находится в пределах определенного интервала. Вышеупомянутая Kd примерно 1 мкМ является предпочтительным верхним пределом для величины Kd. Предпочтительный нижний предел для Kd связывания нуклеиновых кислот с мишенью может составлять примерно 10 пикомоль или выше. В пределах настоящего изобретения величины Kd индивидуальных нуклеиновых кислот, отличающие биоактивный грелин от биологически неактивного грелина, то есть предпочтительно октаноил-грелин от дезоктаноилгрелина, находятся в пределах данного интервала от 10 пМ до 1 мкМ, более предпочтительно в пределах интервала от 100 пМ до 500 нМ и наиболее предпочтительно в пределах интервала от 1 нМ до 100 нМ. Молекулы нуклеиновой кислоты по настоящему изобретению могут иметь любую длину, при условии, что они все еще способны связываться с молекулой-мишенью и отличать биоактивный грелин от биологически неактивного грелина, то есть предпочтительно октаноил-грелин от дезоктаноил-грелина. Специалистам в данной области техники должно быть понятно, что существуют предпочтительные длины нуклеиновых кислот по настоящему изобретению. Типично эта длина находится между 15 и 120 нуклеотидами. Специалистам в данной области техники должно быть понятно, что любое целое число между 15 и 120 составляет возможную длину нуклеиновых кислот по настоящему изобретению. Более предпочтительными интервалами для длины нуклеиновых кислот по настоящему изобретению являются длины примерно от 20 до 100 нуклеотидов, примерно от 20 до 80 нуклеотидов, примерно от 20 до 60 нуклеотидов, примерно от 20 до 50 нуклеотидов и примерно от 30 до 50 нуклеотидов. Анализы по отличению биоактивного и биологически неактивного грелина согласно настоящему изобретению можно проводить, используя стандартные методики, как известно специалистам в данной области техники. В предпочтительном аспекте эти анализы можно проводить в 96-луночных планшетах,где компоненты иммобилизованы в реакционных сосудах, как раскрыто согласно формуле изобретения. Возможно, комплексы можно удалить из реакционных сосудов после образования комплексов. В одном аспекте молекулу нуклеиновой кислоты по изобретению анализируют с помощью вторичных средств обнаружения, где указанные средства обнаружения представляют собой молекулярный зонд. Методология молекулярного зонда известна специалистам в данной области техники. Кратко, нуклеиново-кислотные зонды, которые также называют молекулярными зондами, представляют собой обратный комплемент образца нуклеиновой кислоты, подлежащего обнаружению, и в связи с этим гибридизуются с участком образца нуклеиновой кислоты, подлежащего обнаружению. При связывании с образцом нуклеиновой кислоты отделяются флуорофорные группы молекулярного зонда, что приводит в результате к изменению сигнала флуоресценции, предпочтительно к изменению интенсивности. Это изменение коррелирует с количеством присутствующих нуклеиновых кислот в образце. Нуклеиновые кислоты по изобретению, которые также называют здесь нуклеиновые кислоты по настоящему изобретению и/или антагонисты по настоящему изобретению, могут быть использованы для изготовления или производства лекарства. Такое лекарство содержит по меньшей мере одну из нуклеиновых кислот по изобретению, возможно вместе с дополнительными фармацевтически активными соединениями, где сама нуклеиновая кислота по изобретению предпочтительно действует в качестве фармацевтически активного соединения. Такие лекарства содержат в предпочтительных воплощениях по меньшей мере фармацевтически приемлемый носитель. Такой носитель может представлять собой, например, воду, буфер, крахмал, сахар, желатин или любое другое приемлемое вещество-носитель. Такие носители в целом известны специалистам в данной области техники. Заболевания, и/или расстройства,и/или болезненные состояния, для лечения и/или предупреждения которых можно применять такое лекарство, включают, но не ограничены ими, ожирение, регуляцию энергетического баланса, аппетита и массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечнососудистые заболевания. Как должно быть понятно специалистам в данной области техники, нуклеиновые кислоты по изобретению могут применяться фактически при любом заболевании, где антагонист грелина можно вводить пациенту, нуждающемуся в таком антагонисте, и такой антагонист подходит для элиминации случая заболевания или расстройства или по меньшей мере уменьшения воздействий в результате этого заболевания или расстройства. Такое воздействие включает, но не ограничено им, ожирение, регуляцию энергетического баланса, аппетита и массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечно-сосудистые заболевания. Для. целей настоящего-5 009376 изобретения регуляцию энергетического баланса рассматривают как заболевание. Более конкретно, применение предназначено для лечения любого заболевания, где на регуляцию энергетического баланса оказывает влияние грелин, либо непосредственно, либо опосредованно, и где желательно уменьшение биодоступности грелина. То же самое применимо к обмену сахаров, кровяному давлению, а также аппетиту и массе тела. Дополнительными заболеваниями, которые можно лечить с использованием нуклеиновых кислот по настоящему изобретению, возможно путем системного или местного введения, являются заболевания, которые могут быть выбраны из группы, включающей опухоли гипофиза, акромегалию, центральный синдром Кушинга, надпочечниковый синдром Кушинга, паранеопластический синдром Кушинга, эктопический синдром Кушинга, опухоль надпочечника, стресс, гиперкортицизм, сердечную недостаточность, инфаркт сердца, удар, адренокортикальную недостаточность, гипотонию, стеноз аорты,легочную гипертонию, констриктивный перикардит, инфекционные заболевания, инфекционную токсическую гипотонию, гиповолемию и гипонатриемию. Следует понимать, что нуклеиновую кислоту, а также антагонисты по настоящему изобретению можно применять не только в качестве лекарства или для производства лекарства, но также в косметических целях, в частности, в отношении вовлечения грелина в ожирение. С той же целью нуклеиновую кислоту, а также антагонисты по настоящему изобретению можно применять в качестве пищевой добавки,средств для регуляции массы тела и/или средств для регуляции аппетита. Композицию, содержащую нуклеиновую кислоту, а также антагонисты по настоящему изобретению можно применять для любой из вышеупомянутых целей. Нуклеиновую кислоту по изобретению можно, кроме того, использовать в качестве исходного вещества для разработки лекарств. В основном, существует два возможных подхода. Один подход представляет собой скрининг библиотек соединений, где такие библиотеки соединений предпочтительно представляют собой библиотеки низкомолекулярных соединений. Такие библиотеки известны специалистам в данной области техники. Альтернативно, нуклеиновую кислоту по настоящему изобретению можно использовать для рациональной разработки лекарств. Рациональная разработка лекарств может начинаться с любой из нуклеиновых кислот по настоящему изобретению и включает структуру, предпочтительно трехмерную структуру, которая подобна структуре нуклеиновых кислот по изобретению или идентична участкам, опосредующим связывание этой структуры нуклеиновыми кислотами по изобретению. В любом случае такая структура все еще проявляет такие же или подобные характеристики связывания, что и нуклеиновые кислоты по изобретению. Либо в качестве дополнительной стадии, либо в качестве альтернативной стадии в рациональной разработке лекарств предпочтительную трехмерную структуру этих участков нуклеиновых кислот, связывающихся с нейротрансмиттером, имитируют химическими группами, которые отличны от нуклеотидов и нуклеиновых кислот. С помощью этой имитации можно разработать соединение, отличное от нуклеиновых кислот. Такое соединение предпочтительно представляет собой малую молекулу или пептид. В случае скрининга библиотек соединений, как, например, путем использования конкурентного анализа, который известен специалистам в данной области техники, могут быть обнаружены соответствующие аналоги грелина, агонисты грелина или антагонисты грелина. Такие конкурентные анализы могут быть поставлены следующим образом. Нуклеиновую кислоту по изобретению, предпочтительно шпигельмер (spiegelmer), которая представляет собой связывающую мишень L-нуклеиновую кислоту,пришивают к твердой фазе. Чтобы идентифицировать аналоги грелина, в этот анализ может быть добавлен меченный грелин. Потенциальный аналог будет конкурировать со связыванием молекул грелина со шпигельмером, и параллельно с этим будет происходить снижение сигнала, получаемого с помощью соответствующей метки. Скрининг на агонисты или антагонисты может включать использование анализа клеточной культуры, как известно специалистам в данной области техники. Набор по настоящему изобретению может содержать по меньшей мере одну или несколько нуклеиновых кислот по изобретению. Дополнительно этот набор может содержать по меньшей мере один или несколько положительных или отрицательных контролей. Положительный контроль может, например,представлять собой грелин, в частности грелин, против которогоотобрана нуклеиновая кислота по изобретению, либо с которым она связывается, предпочтительно в жидкой форме. Отрицательный контроль может, например, представлять собой пептид, который определен в отношении биофизических свойств как подобный грелину, но который не распознается нуклеиновыми кислотами по изобретению. Кроме того, указанный набор может содержать один или несколько буферов. Различные ингредиенты могут содержаться в наборе в высушенной или лиофилизированной форме или быть растворены в жидкости. Этот набор может содержать один или несколько контейнеров, которые, в свою очередь, могут содержать один или несколько ингредиентов набора. Следует понимать, что любая из последовательностей, раскрытая в примерах и графических материалах, соответственно, раскрыта как таковая, и любую такую последовательность можно применять в любом аспекте и воплощении настоящего изобретения. Настоящее изобретение дополнительно проиллюстрировано графическими материалами, примерами и перечнем последовательностей, на основании которых могут быть получены дополнительные признаки, воплощения и преимущества, где на фиг. 1 А показаны члены группы L-NOX-B11, их название,-6 009376 частота, с которой они были отобраны, и их усеченная последовательность, которую альтернативно можно удлинить 5'-фланкирующей последовательностью 5'-GGAGCUCAGACUUCACU-3' (SEQ. ID. No. 20) и 3'-фланкирующей последовательностью 5'-UACCACUGUCGGUUCCAC-3' (SEQ. ID. No. 21), и указаны локусы инсерции Ins1-Ins4; на фиг. 1B показана модель вторичной структуры усеченного клона L-NOX-B11 и указаны области основного стебля, 5'- и 3'-участок внутренней петли (IL Ia, IL Ib) и концевой стебель-петля; на фиг. 2 показано зависимое от дозы высвобождение кальция, опосредованное октаноил- или дезоктаноил-грелином в полноразмерной или усеченной форме, в клеточном анализе с использованием клеток СНО, экспрессирующих человеческий рецептор грелина (титрование доза-ответ); на фиг. 3 показано ингибирование высвобождения кальция, опосредованного полноразмерным и усеченным октаноил-грелином, шпигельмером L-NOX-B11 (кривая ингибирования); на фиг. 4 показаны результаты клеточного конкурентного анализа с октаноил-грелином, дезоктаноил-грелином и L-NOX-B11, где комбинации и концентрации компонентов суммированы ниже под полосами; на фиг. 5 показаны результаты клеточного конкурентного анализа с октаноил-грелином (1-5), дезоктаноил-грелином (1-5) и L-NOX-B11, где комбинации и концентрации компонентов суммированы ниже под полосами; на фиг. 6 показаны результаты анализа связывания in vitro, анализирующего связывание радиоактивно меченого D-NOX-B11 и L-NOX-B11 с биотинилированным D-октаноил-грелином. В приведенной ниже таблице объединены SEQ. ID. Номера различных клонов и идентификаторов,соответственно, описаны здесь. Последовательности нуклеиновых кислот, если не указаны иным путем,представлены в виде (+) нитей и построены из 2'ОН-рибонуклеотидов. Пример 1. Связывающие грелин нуклеиново-кислотные лиганды. В Европейской патентной заявке ЕР 02023627.8 и в Международной патентной заявке РСТ/ЕР 03/08542 описано получение связывающих грелин нуклеиново-кислотных лигандов. Одна группа таких нуклеиново-кислотных лигандов, полученных в процессе отбора, показана на фиг. 1 А. Клон LNOX-B11 является наиболее распространенной последовательностью в этой группе и подобно всем другим членам этой группы является функциональным в длинном и усеченном варианте (L-NOX-B11 [86] иL-NOX-B11 [47]). Для удлинения усеченных клонов 5'-фланкирующая и 3'-фланкирующая последовательности могут быть добавлены к показанной коровой последовательности. 5'-фланкирующая последовательность 5'-GGAGCUCAGACUUCACU-3' SEQ. ID. No. 20, 3'-фланкирующая последовательность 5'-UACCACUGUCGGUUCCAC-3' SEQ. ID. No. 21.-7 009376 На фиг. 1 А суммированы только усеченные варианты, и в данной патентной заявке представлены только результаты, касающиеся этих усеченных клонов. Однако характеристики L-NOX-B11 [47], раскрытого здесь, также касаются всех удлиненных вариантов этих усеченных последовательностей. Индивидуальные клоны в группе L-NOX-B11 являются высоко консервативными и проявляют идентичность длинных отрезков последовательности. Приведенная ниже консенсусная последовательность может быть получена на основе клонов, показанных на фиг. 1 А: CGUGYGN(0-3)AGGYAN(0-4)AAAACN(1-3)UAARWCCGAAGGUAACCAWUCCUACN(0-2)ACG(SEQ. ID. No. 1), где Y означает U или С, R означает А или G, W означает U или А. Как можно наблюдать, нуклеотидные замены обнаруживаются только в нескольких положениях. Кроме того, существует 4 определенные области, где встречается инсерция последовательности; эти локусы инсерции обозначены Ins1-Ins4 и соответствуют буквам 'N(x-y)' в SEQ. ID. No.1. В этих положениях может быть вставлен любой нуклеотид в любом количестве, предпочтительно в количестве, указанном в скобках в SEQ. ID. No.1. В локусе инсерции 2 предпочтительным нуклеотидом вставки является аденозин. Последовательность L-NOX-B11 укладывается в характеристическую вторичную структуру, показанную на фиг. 1 В, включающую структуру основного стебля, внутренней петли и концевого стебляпетли. Подробный анализ всех последовательностей внутри этой группы показывает, что локусы инсерции последовательности главным образом попадают в область внутренней петли (Ins2). Концевой стебель-петля, а также основной стебель всегда идентичны и представляются высоко характеристическими для данного семейства молекул, связывающих грелин, и их специфичных признаков. Необходимо упомянуть, что некоторые замены последовательности, очевидные для специалиста в данной области техники, которые не нарушают или только слегка нарушают вторичную структуру, данную на фиг. 1 В, могут быть сделаны без потери специфичной функции нуклеиновой кислоты, а именно в отличении биоактивного грелина от биологически неактивного грелина. В нескольких отборах, описанных в Европейской патентной заявке ЕР 02023627.8 и в Международной патентной заявке РСТ/ЕР 03/08542, был найден этот вид модифицированных последовательностей. Признаки, описанные для L-NOX-B11, могут быть перенесены на те последовательности, которые являются достаточно консервативными в отношении последовательности и структуры. Пример 2. Способ анализа индуцированного грелином высвобождения кальция. Функциональную характеристику связывающего грелин шпигельмера проводят в системе клеточного анализа мониторинга взаимодействия грелина и рецептора стимулятора секреции гормона роста человека (GHS-R). Внутриклеточное высвобождение кальция, являющееся результатом взаимодействия рецептор-лиганд, визуализируют посредством флуоресцентного индикатора кальция. Стабильно трансфицированные клетки СНО, экспрессирующие рецептор грелина человека (GHSR1a) (получен от Euroscreen, Gosselies, Belgium), высевают при концентрации 5-7104 клеток на лунку в черный 96-луночный планшет с прозрачным дном (Greiner) и культивируют в течение ночи при 37 С и 5% CO2 в среде UltraCHO (Cambrex), которая содержит дополнительно 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина, 400 мкг/мл генетицина и 2,5 мкг/мл фунгизона. Перед нанесением индикатора кальция красителя fluo-4 клетки промывают один раз 200 мклCHO-U+ (5 мМ пробенецид, 20 мМ HEPES в среде UltraCHO). Затем добавляют 50 мкл раствора индикаторного красителя (10 мкМ fluo-4 (Molecular Probes), 0,08% pluronic 127 (Molecular Probes) в CHO-U+) и клетки инкубируют в течение 60 мин при 37 С. Затем клетки промывают три раза 180 мкл CHO-U+. Наконец добавляют 90 мкл CHO-U+ на лунку. В анализе стимуляции полноразмерные или усеченные варианты человеческого или крысиного Lгрелина либо в октаноил-, либо в дезоктаноил-форме используют, как указано [L-грелин и дезоктаноилL-грелин были получены от Bachem (Basel, Switzerland), a L-грелин (1-5), L-грелин (1-10) и дезоктаноилL-грелин (1-5) были предоставлены Phoenix Pharmaceuticals (Belmont, CA)]. Соответствующие пептиды инкубируют в CHO-U+ в течение 15-60 мин при комнатной температуре в 0,2 мл низкопрофильном 96-луночном планшете. В этих растворах стимуляции пептид находится в 10 кратной концентрации по сравнению с анализом. Для обнаружения высвобождения кальция раствор стимуляции добавляют к клеткам (10 мкл/лунка) и проводят мониторинг изменения сигнала флуоресценции. Измерение сигналов флуоресценции проводят при длине волны возбуждения 485 нм и длине волны эмиссии 520 нм в многоканальном считывающем устройстве для планшетов Fluostar Optima(BMG). Для параллельного измерения нескольких образцов лунки одного (перпендикулярного) ряда 96 луночного планшета считывают вместе. Первые три считывания с промежутком времени 4 с проводят для определения исходных данных. Затем считывание прерывают и планшет вынимают из аппарата. Используя многоканальную пипетку, в лунки добавляют 10 мкл раствора стимуляции, затем планшет снова помещают в аппарат и измерение продолжают. Всего проводят 20 считываний с интервалом времени 4 с. Для каждой лунки определяют разность максимальной флуоресценции и исходного значения (FmaxFmin) и наносят на график против концентраций грелина. На фиг. 2 показаны кривые доза-ответ человече-8 009376 ского октаноил- и дезоктаноил-грелина (полноразмерного и усеченного пептида). Оказывается, что как полноразмерный, так и усеченный октаноил-грелин индуцируют высвобождение кальция, однако в различной степени: полноразмерный октаноил-грелин показывает максимальную активность при концентрации 30 нМ, тогда как октаноил-грелин 1-5 стимулирует только при более высоких концентрациях пептида и не достигает максимальной интенсивности сигнала в наблюдаемом интервале концентраций. Дезоктаноил-формы обоих пептидов не стимулируют человеческий рецептор грелина ни при какой концентрации, анализируемой в данном анализе. Эти эксперименты подтверждают, что пяти N-концевых аминокислот грелина достаточно для стимуляции человеческого рецептора грелина и что октаноилгруппа является существенной для биологической активности грелина. Пример 3. Ингибирование индуцированного грелином высвобождения кальция связывающим грелин шпигельмером. Ингибирование индуцированного грелином высвобождения кальция измеряли, используя клеточный анализ, описанный в примере 2. В качестве модификации этого способа в растворы стимуляции в анализе ингибирования добавляли варьирующие количества шпигельмера L-NOX-B11. В качестве контроля анализировали образцы только с пептидом (максимальное высвобождение кальция) и образцы без пептида (минимальное высвобождение кальция). После инкубации в течение 15-60 мин при комнатной температуре к клеткам добавляли 10 мкл растворов стимуляции, получая в результате конечную концентрацию пептида 5 нМ. Обычно выбирали конечные концентрации шпигельмера 0,1, 1, 3, 10, 30 и 100 нМ. Для каждой лунки определяют разность между максимальной флуоресценцией и исходным значением (Fmax-Fmin). Значения для 100% активности (отсутствие ингибирования) и 0% активности (полное ингибирование) могут быть определены на основании контрольных образцов (образцы только пептид и без пептида). Для всех других образцов соответствующую активность вычисляют в процентах и наносят на график против концентрации шпигельмера (кривая ингибирования), дающий возможность определить константу ингибирования, равную половине от максимума (IC50). На фиг. 3 показаны кривые ингибирования, полученные на основании эксперимента, в котором анализируют ингибиторную активность L-NOX-B11 с полноразмерными и усеченными формами октаноил-грелина. Оказывается, что шпигельмер ингибирует активность всех протестированных форм октаноил-грелина: полноразмерного пептида, грелина 1-10 и грелина 1-5. Значения IC50 не проявляют значительного отклонения для всех трех пептидов (полноразмерный грелин: 7 нМ, грелин 1-10: 9 нМ, грелин 1-5: 5 нМ). Можно сделать вывод, что область связывания шпигельмера локализована на N-конце грелина, включающем аминокислоты 1-5. Результатом связывания L-NOX-B11 с этим минимальным мотивом является эффективное ингибирование биологической активности грелина в клеточном анализе. Пример 4. Отличение октаноил-грелина и дезоктаноил-грелина связывающими грелин шпигельмерами. Характеристики связывания шпигельмера L-NOX-B11 с грелином далее анализировали в конкурентном анализе, основанном на способе, описанном в примере 3. В этих анализах шпигельмер инкубировали с различными комбинациями пептидов грелина в растворах стимуляции перед стимуляцией клеток. Схема комбинаций пептидов и результаты эксперимента с полноразмерным грелином суммированы на фиг. 4 (полосы пронумерованы слева направо): без какого-либо грелина или с дезоктаноил-грелином в конечной концентрации 300 нМ никакой стимуляции клеток не обнаружили (полосы 1 и 2), тогда как октаноил-грелина уже в концентрации 10 нМ достаточно для опосредования высвобождения кальция(полоса 3); дополнительное добавление 300 нМ дезоктаноил-грелина (полоса 4) не препятствует стимуляции клеток, что указывает на то, что биологически неактивный дезоктаноил-грелин не является антагонистом рецептора. Высвобождение кальция, опосредованное 10 нМ октаноил-грелина, может быть ингибировано 3-кратным избытком L-NOX-B11 (полоса 5), и даже присутствие дезоктаноил-грелина в 30-кратном избытке (300 нМ) по отношению к октаноил-грелину недостаточно для ингибирования (полоса 6). Напротив, аналитическая концентрация 300 нМ октаноил-грелина и 30 нМ шпигельмера проявляет повышенное высвобождение кальция (полоса 7), свидетельствуя о том, что в условиях анализа может быть достигнуто усиление стимуляции октаноил-грелином. Данный эксперимент демонстрирует, чтоL-NOX-B11 специфично различает грелин в октаноил-форме и дезоктаноил-форме. Эксперимент повторяли с грелином 1-5 вместо полноразмерного пептида, показав идентичные результаты (фиг. 5). Однако в зависимости от более слабой стимулирующей активности грелина 1-5 сигналы сравнительно ниже. Пример 5. Требования к связыванию L-NOX-B11 с октаноил-грелином. Сайт связывания для L-NOX-B11 на октаноил-грелине локализован на N-конце пептида (сравнительный пример 3) и включает октаноил-группу (сравнительный пример 4). Значимость и вовлечение обоих компонентов для акта связывания, пептида и группы жирной кислоты, показаны в приведенном ниже эксперименте. Обоснованием данного эксперимента является то, что шпигельмеры связывают свои пептидные мишени с энантиомерной специфичностью, а сама по себе октаноил-группа является ахиральной группой. Если бы одного участка жирной кислоты грелина было достаточно для связывания шпигельмера,-9 009376 акт связывания не был бы энантиомерно-специфичным в отношении пептидного участка; тогда D-NOXB11 и L-NOX-B11 должны одинаковым образом связывать D-октаноил-грелин.NOX-B11 синтезировали химическим путем в виде L- и D-РНК и вводили радиоактивную метку,используя Т 4-полинуклеотидкиназу (Invitrogen, Karlsruhe) с -32[Р]-АТР (Hartmann Analytic, Braunschweig). РНК очищали на 10% денатурирующем полиакриламидном геле и 0,5-5 пмоль РНК инкубировали с 5 мкМ биотинилированного D-грелина в связывающем буфере [20 мМ Трис/HCl, рН 7,4; 150 мМNaCl; 5 мМ KCl; 1 мМ MgCl2; 1 мМ CaCl2; 0,1% Твин-20] в течение 2 ч при 37 С. Сравнительно высокая концентрация пептида была выбрана, чтобы обеспечить возможность мониторинга даже слабых взаимодействий шпигельмера. Затем добавляли фиксированное количество конъюгированного со стрептавидином матрикса UltraLink. Связанные с матриксом комплексы грелин-РНК отмывали связывающим буфером, считывали в сцинтилляционном счетчике (Beckman LS6500) и наносили на график в виде процента суммарного связывания с D-грелином. Каждую экспериментальную группу анализировали в трех повторностях. Результаты этого эксперимента представлены на фиг. 6. Оказалось, что D-NOX-B11 специфично связывается с D-октаноил-грелином (полосы 1 и 2), тогда как соответствующий L-энантиомер не связывается (полосы 3 и 4). Этот результат указывает на то, что октаноильный остаток главным образом служит в качестве гидрофобной группы, представляя Nконцевой мотив GSSFL L-октаноил-грелина в конформации, где шпигельмер L-NOX-B11 эффективно связывается. Оба участка, пептидный и октаноил-участок L-октаноил-грелина, необходимы для связывания L-NOX-B11. Признаки настоящего изобретения, раскрытые в описании, формуле изобретения и/или графических материалах, могут как по отдельности, так и в любой их комбинации представлять материал для реализации изобретения в различных его формах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Нуклеиновая кислота, которая связывается с биоактивным грелином. 2. Нуклеиновая кислота по п.1, где эта нуклеиновая кислота специфично связывается с биоактивным грелином, и специфичное связывание выражено в виде величины Kd, где Kd нуклеиновой кислоты составляет от 10 пМ до 1 мкМ, более предпочтительно от 100 пМ до 500 нМ и наиболее предпочтительно от 1 до 100 нМ. 3. Нуклеиновая кислота по п.1 или 2, где биоактивный грелин представляет собой н-октаноилгрелин. 4. Нуклеиновая кислота по любому из пп.1-3, где нуклеиновая кислота представляет собой Lнуклеиновую кислоту, предпочтительно шпигельмер (spiegelmer). 5. Нуклеиновая кислота по любому из пп.1-4, где эта нуклеиновая кислота имеет вторичную структуру, представленную на фиг. 1B. 6. Нуклеиновая кислота по любому из пп.1-5, где эта нуклеиновая кислота содержит последовательность, соответствующую SEQ. ID. No 1, предпочтительно состоит из нее. 7. Нуклеиновая кислота по любому из пп.1-6, где эта нуклеиновая кислота содержит последовательность, соответствующую от SEQ. ID. No. 2 до SEQ. ID. No. 15, предпочтительно состоит из нее. 8. Применение нуклеиновой кислоты по любому из пп.1-7 для связывания биоактивного грелина. 9. Применение нуклеиновой кислоты по любому из пп.1-7 для обнаружения биоактивного грелина. 10. Применение нуклеиновой кислоты по любому из пп.1-7 для ингибирования биоактивного грелина. 11. Применение нуклеиновой кислоты по любому из пп.1-7 для производства лекарства. 12. Применение по п.11, где лекарство предназначено для лечения и/или для предупреждения заболевания и/или расстройства, где заболевание и/или расстройство выбрано из группы, включающей ожирение, регуляцию энергетического баланса, аппетита, массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечно-сосудистое заболевание. 13. Способ обнаружения биоактивного грелина, включающий следующие стадии: а) получение образца, который подлежит тестированию на присутствие биоактивного грелина,б) получение нуклеиновой кислоты по любому из пп.1-7,в) взаимодействие образца с нуклеиновой кислотой, где стадию (а) можно проводить перед стадией(б), либо стадию (б) можно проводить перед стадией (а). 14. Способ по п.13, включающий дополнительную стадию (г): г) обнаружение взаимодействия образца с нуклеиновой кислотой. 15. Способ по п.14, при котором нуклеиновую кислоту стадии (б) иммобилизуют на поверхности. 16. Способ по п.14, где нуклеиновая кислота по любому из пп.1-7 содержит флуоресцентную группировку и где флуоресценция этой флуоресцентной группировки отличается при образовании комплекса между нуклеиновой кислотой и биоактивным грелином от свободного биоактивного грелина. 17. Способ по любому из пп.14-16, где нуклеиновая кислота представляет собой производное нуклеиновой кислоты по любому из пп.1-7, где это производное нуклеиновой кислоты включает по меньшей- 10009376 мере одно флуоресцентное производное аденозина, замещающее аденозин. 18. Способ по п.17, где флуоресцентное производное аденозина представляет собой этеноаденозин. 19. Способ по любому из пп.16-18, при котором комплекс, состоящий из производного нуклеиновой кислоты по любому из пп.1-7 и биоактивного грелина, обнаруживают с использованием флуоресценции. 20. Способ по любому из пп.13-19, где биоактивный грелин представляет собой н-октаноил-грелин. 21. Способ по любому из пп.13-20, где сигнал создается на стадии (в) или на стадии (г) и предпочтительно этот сигнал коррелирует с концентрацией биореактивного грелина в образце. 22. Способ по любому из пп.13-21, где образец выбран из группы, включающей кровь, плазму, сыворотку, жидкость и ткани. 23. Способ по любому из пп.13-22, где способ представляет собой диагностический способ или прогностический способ. 24. Способ по п.23, где способ предназначен для диагностики, определения стадии и/или прогнозирования заболевания и/или расстройства, где предпочтительно указанное заболевание и/или расстройство выбрано из группы, включающей ожирение, регуляцию энергетического баланса, аппетита, массы тела, расстройства питания, диабет, метаболизм глюкозы, опухоль, кровяное давление и сердечнососудистое заболевание.
МПК / Метки
МПК: C12Q 1/68, C12N 15/11
Метки: связывающие, специфично, грелин, кислоты, биоактивный, нуклеиновые
Код ссылки
<a href="https://eas.patents.su/22-9376-nukleinovye-kisloty-specifichno-svyazyvayushhie-bioaktivnyjj-grelin.html" rel="bookmark" title="База патентов Евразийского Союза">Нуклеиновые кислоты, специфично связывающие биоактивный грелин</a>
Предыдущий патент: Исходные композиции для керамических продуктов
Следующий патент: Еро-имитирующие миметические антитела человека с центральной шарнирной областью, композиции, способы и применения
Случайный патент: Профильная рельсовая система