Нуклеиновые кислоты-лиганды тенасцина-с
Номер патента: 4795
Опубликовано: 26.08.2004
Авторы: Хике Брайан, Парма Дейвид, Голд Ларри, Уоррен Стивен
Формула / Реферат
1. Нуклеиновая кислота-лиганд к тенасцину-C, выявленная с помощью способа, предусматривающего:
а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-C, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-C по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси;
б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;
в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-C, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-C.
2. Нуклеиновая кислота-лиганд по п.1, где перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот.
3. Нуклеиновая кислота-лиганд по п.2, где одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты.
4. Нуклеиновая кислота-лиганд по п.3, где перспективная смесь нуклеиновых кислот состоит из 2'-F-(2'-фтор)-модифицированных рибонуклеиновых кислот.
5. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд к тенасцину-C.
6. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд к тенасцину-C по п.5, где эта нуклеиновая кислота-лиганд является одноцепочечной.
7. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд по п.6, где эта нуклеиновая кислота-лиганд представляет собой РНК.
8. Очищенная и выделенная не встречающаяся в естественных условиях РНК-лиганд по п.7, где этот лиганд представляет собой 2'-фтор- (2'-F)-модифицированные нуклеотиды.
9. Очищенная и не встречающаяся в естественных условиях РНК-лиганд по п.8, где этот лиганд выбирают из группы, включающей последовательности, представленные в табл. 3 и 4 и на фиг. 2.
10. Способ идентификации нуклеиновых кислот-лигандов к тенасцину-C, предусматривающий:
а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-C, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-C по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси;
б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;
в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, обладающих относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-C, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-C.
11. Способ по п.10, дополнительно предусматривающий:
г) повторение стадий а), б) и в).
12. Способ по п.10, где перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот.
13. Способ п.12, где одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты.
14. Способ по п.13, где нуклеиновые кислоты представляют собой 2'-F-(2'-фтор)-модифицированные рибонуклеиновые кислоты.
15. Комплекс, применяемый для диагностики in vivo болезней, ассоциированных с экспрессией тенасцина-C, который включает нуклеиновую кислоту-лиганд тенасцина-C по пп.1-4 или пп.5-9 и маркер.
16. Комплекс по п.15, в котором нуклеиновую кислоту-лиганд к тенасцину-C идентифицируют с помощью способа, предусматривающего
а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-C, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-C по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси;
б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;
в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, которая имеет высокое содержание нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-C, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-C.
17. Комплекс по п.16, в котором перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот.
18. Комплекс по п.17, в котором одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты.
19. Комплекс по п.18, в котором перспективная смесь нуклеиновых кислот включает 2'-F-(2'-фтор)-модифицированные рибонуклеиновые кислоты.
20. Комплекс по п.15, в котором маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин.
21. Комплекс по п.20, в котором радионуклид выбирают из группы, включающей технеций-99m (Tc-99m), Re-188, Cu-64, Cu-67, F-18, 125I, 131I, 111In, 32P, 186Re.
22. Комплекс по п.21, в котором маркер представляет собой технеций-99m.
23. Комплекс по п.22, дополнительно включающий линкер.
24. Комплекс по п.23, в котором линкер имеет структуру.
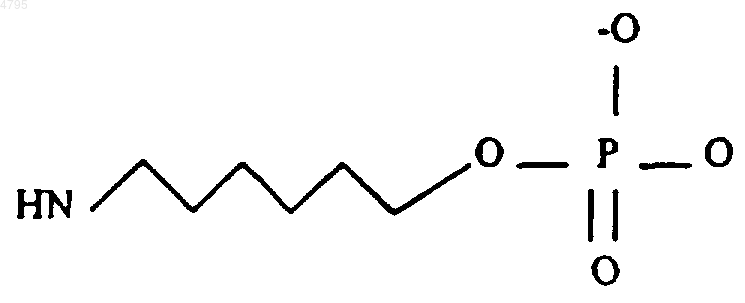
25. Комплекс по п.24, где комплекс представляет собой (CH2CH2O)6-линкер
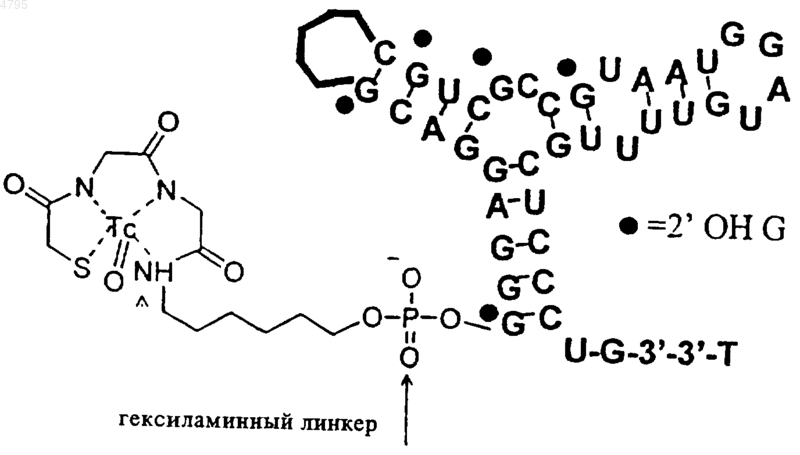
все A обозначают 2'-OMe,
все G, за исключением указанных, являются 2'-OMe-модифицированными,
все C являются 2'-F-модифицированными,
все U являются 2'-F-модифицированными.
26. Способ получения комплекса, включающего нуклеиновую кислоту-лиганд тенасцина-C и маркер, который предусматривает:
а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-C, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-C по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси;
б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;
в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, которая имеет высокое содержание нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-C; и
г) ковалентное связывание выявленной нуклеиновой кислоты-лиганда тенасцина-C с маркером.
27. Способ по п.26, где маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин.
28. Способ по п.27, где радионуклид выбирают из группы, включающей Tc-99m, Re-188, Cu-64, Cu-67, F-18, 125I, 13lI, 111In, 32P, 186Re.
29. Способ по п.28, где маркер представляет собой Tc-99m.
30. Способ по п.29, дополнительно включающий линкер.
31. Способ по п.30, в котором линкер имеет структуру
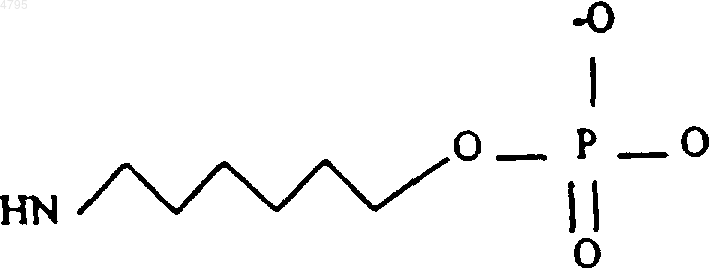
32. Способ по п.31, где комплекс представляет собой (CH2CH2O)6-линкер

все A обозначают 2'-OMe,
все G, за исключением указанных, являются 2'-OMe-модифицированными,
все C являются 2'-F-модифицированными,
все U являются 2'-F-модифицированными.
33. Способ обнаружения присутствия болезни, при которой происходит экспрессия тенасцина-C в биологической ткани, которая может быть поражена болезнью, предусматривающий
а) идентификацию нуклеиновой кислоты-лиганда в перспективной смеси нуклеиновых кислот, при этом нуклеиновая кислоты-лиганд является лигандом к тенасцину-C, что включает
(I) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-C, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-C по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представитеыхщ перспективной смеси;
(II) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;
(III) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-C, посредством чего выявляют нуклеиновые кислоты-лиганды тенасцина-C;
(б) присоединения маркера, который может использоваться для диагностики in vivo с помощью нуклеиновой кислоты-лиганда, выявленной на стадии (III), с получением комплекса маркер-нуклеиновая кислота-лиганд;
(в) обработку ткани, которая может быть поражена болезнью, комплексом маркер-нуклеиновая кислота-лиганд; и
г) обнаружение присутствия комплекса маркер-нуклеиновая кислота-лиганд в ткани, посредством чего выявляют болезнь, при которой происходит экспрессия тенасцина-C.
34. Способ по п.33, где нуклеиновая кислота-лиганд дополнительно включает линкер.
35. Способ по п.34, где маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин.
36. Способ по п.35, где радионуклид выбирают из группы, включающей Tc-99m, Re-188, Cu-64, Cu-67, F-18, 125I, 131I, 111In, 32P, 186Re.
37. Способ по п.36, где маркер представляет собой технеций-99m.
38. Способ по п.37, где линкер имеет структуру
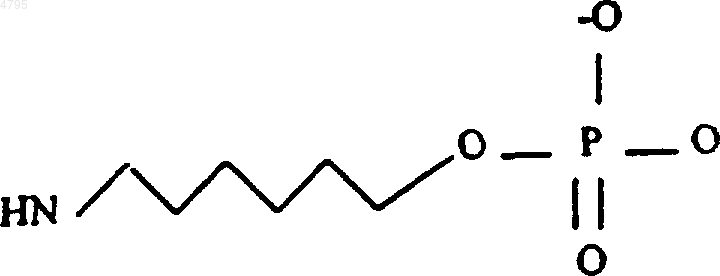
39. Способ по п.38, где комплекс маркер-нуклеиновая кислота-лиганд представляет собой
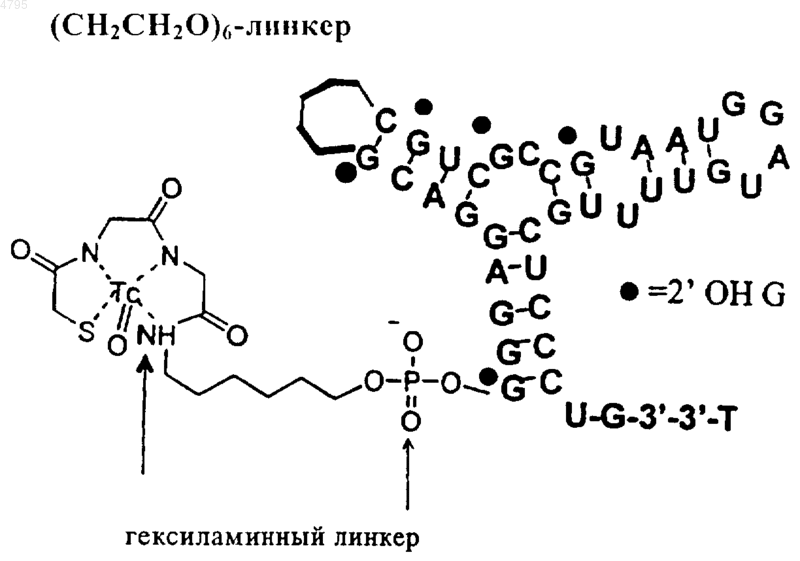
все A обозначают 2'-OMe,
все G, за исключением указанных, являются 2'-OMe-модифицированными,
все C являются 2'-F-модифицированными,
все U являются 2'-F-модифицированными.
40. Способ по п.33, дополнительно предусматривающий присоединение к комплексу терапевтического или диагностического агента.
41. Способ по п.33, где болезнь выбирают из группы, включающей рак, псориаз и атеросклероз.
42. Способ по п.41, где болезнь представляет собой рак.
43. Способ введения терапевтического агента к месту, пораженному болезнью, при которой происходит экспрессия тенасцина-C, предусматривающий ковалентное связывание нуклеиновой кислоты-лиганда тенасцина-C с терапевтическим агентом с получением комплекса и введение комплекса пациенту.
Текст
1 Область техники изобретения В изобретении описаны нуклеиновые кислоты-лиганды, обладающие высокой аффинностью в отношении тенасцина-С. Также описаны способы идентификации и получения нуклеиновых кислоты-лигандов, обладающих высокой аффинностью в отношении тенасцина-С. Способ, который применяют согласно изобретению для идентификации таких нуклеиновых кислотлигандов, обозначен SALEX, что является сокращением Systematic Evolution of Ligands byExponential enrichment (систематическое выделение лигандов путем экспоненциального обогащения). Кроме того, описаны нуклеиновые кислоты-лиганды, обладающие высокой аффинностью к тенасцину-С. Кроме того, описаны РНК-лиганды тенасцина-С. Также описаны олигонуклеотиды, содержащие нуклеотидные производные, химически модифицированные в 2'положении пуринов и пиримидинов. Дополнительно описаны РНК-лиганды тенасцина-С, содержащие 2'-F- и 2'-ОМе-модификации. Олигонуклеотиды по изобретению можно применять в качестве диагностических и/или терапевтических агентов. Предпосылки создания изобретения Тенасцин-С представляет собой гексамерный гликопротеин с молекулярной массой 1,11,5 миллиона Да, который локализован в основном во внеклеточном матриксе. Тенасцин-С экспрессирутся в процессе эмбриогенеза, при заживлении ран и неоплазии, что позволяет предположить, что этот протеин принимает участие в ремоделировании ткани (Erickson и Bourdon, Ann. Rev. Cell Biol., 5: 71-92 (1989. Неопластические процессы также включают ремоделирование ткани, и тенасцин-С сверхэкспрессируется во многих типах опухолей, включая карциномы легкого, молочной железы, предстательной железы и ободочной кишки, астроцитомы, глиобластомы, меланомы и саркомыPathol. Lab. Med. 17(2): 259-266 (1997); Hasegawa и др., Hum. Pathol. 26(8): 838-845 (1995. Кроме того, сверхэкспрессия тенасцина-С происходит при гиперпролиферативных кожных болезнях, например, псориазе (Schalkwijk и др.,Br. J. Dermatol. 124(1): 13-20 (1991 и атеросклеротических повреждениях (Fukumoto и др.,J. Atheroscler. Tromb. 5(1): 29-35 (1998); Wallner и др., Circulation 99(10): 1284-1289 (1999. Ме 004795 2 ченные с помощью радиоактивных изотопов антитела, которые связываются с тенасцином-С,применяют для визуализации и терапии опухолей в клинических условиях (Paganelli и др.,Eur. J. Nucl. Med. 26(4): 348-357 (1999); Paganelli и др., Eur. J. Nucl. Med. 21(4): 314-321 (1994);(1997. Аптамеры к тенасцину-С потенциально могут найти применение в диагностике и терапии рака, а также в диагностике и терапии атеросклероза и терапии псориаза. По сравнению с антителами аптамеры являются небольшими (720 кДа), для них характерен очень быстрый клиренс из крови и их получают с помощью химического синтеза. Быстрый клиренс из крови является важным для диагностической визуализации in vivo, когда уровни в крови являются основными фоновыми факторами, которые мешают визуализации. Быстрый клиренс из крови также может быть важен для терапии,когда уровни в крови могут обусловливать токсичность. SELEX-метод позволяет быстро выделять аптамеры, а химический синтез позволяет осуществлять быструю и сайтспецифическую конъюгацию аптамеров с различными инертными и биологически активными молекулами. Таким образом, аптамер к тенасцину-С можно применять для терапии опухолей или для in vivo или ex vivo диагностической визуализации и/или для введения различных терапевтических агентов в комплексе с нуклеиновыми кислотами-лигандами тенасцина-С для лечения болезненных состояний, при которых происходит экспрессия тенасцина-С. В течение многих лет считалось, что нуклеиновые кислоты играют главным образом информационную роль. С помощью метода,известного как Systematic Evolution of LigandsSELEX-метод, стало очевидно, что нуклеиновые кислоты имеют разнообразную трехмерную структуру, отличную от протеинов. SELEX представляет собой метод, предназначенный для выявления in vitro молекул нуклеиновых кислот, обладающих способностью к высокоспецифичному связыванию с молекуламимишенями, и он описан в заявке на патент США сер.07/536428, зарегистрированной 11 июня 1990 г. под названием "Systematic Evolution ofNucleic Acid Ligands", каждый из документов специально полностью включен в настоящее описание в качестве ссылки. В каждой из этих заявок, которые в совокупности обозначены в данном описании как заявки на патент, касающиеся SELEX, представлен совершенно новый 3 метод получения нуклеиновых кислот-лигандов к любой требуемой молекуле-мишени. С помощью SELEX-метода получают класс продуктов,обозначенных как нуклеиновые кислотылиганды или аптамеры, каждый из которых имеет уникальную последовательность, и которые обладают способностью к специфичному связыванию с требуемыми соединением- или молекулой-мишенью. Каждая выявленная с помощью SELEX-метода нуклеиновая кислоталиганд представляет собой специфичный лиганд данного соединения- или молекулы-мишени.SELEX-метод основан на очень важном открытии того факта, что нуклеиновые кислоты обладают способностью, необходимой для образования различных двух- и трехмерных структур,и достаточной химической изменчивостью их мономеров, позволяющей действовать им в качестве лигандов (образуя специфично связанные пары) практически с любым химическим соединением, как мономерным, так и полимерным. Согласно SELEX-методу в качестве мишеней могут служить молекулы любого размера или состава. SELEX-метод, применяемый для высокоаффинного связывания, включает отбор из смеси олигонуклеотидов-кандидатов (перспективная смесь олигонуклеотидов) и постадийное повторение связывания, разделения и амплификации с помощью одной и той же общей схемы отбора до достижения соответствия любому требуемому критерию аффинности и избирательности связывания. Начиная процесс со смеси нуклеиновых кислот, которые предпочтительно включают сегмент рандомизированной последовательности,SELEX-метод включает стадии приведения смеси в контакт с мишенью в условиях, наиболее предпочтительных для связывания, отделения несвязанных нуклеиновых кислот от тех нуклеиновых кислот, которые специфично связались с молекулами-мишенями, диссоциации комплексов нуклеиновая кислота-мишень, амплификации нуклеиновых кислот, диссоциированных из комплексов нуклеиновая кислота-мишень, с получением богатой лигандами смеси нуклеиновых кислот, с последующим повторением стадий связывания, разделения, диссоциации и амплификации в течение такого количества циклов,которое необходимо для получения нуклеиновых кислот-лигандов, обладающих высокой аффинностью в отношении молекулы-мишени. При создании изобретения было установлено, что с помощью SELEX-метода можно продемонстрировать, что нуклеиновые кислоты,как химические соединения, могут иметь широкое разнообразие форм, размеров и конфигураций, и они обладают более широким спектром связывания и другими функциями по сравнению с теми, которые нуклеиновые кислоты проявляют в биологических системах. Основной SELEX-метод был модифицирован с целью решения разнообразных конкрет 004795 4 ных задач. Например, в заявке на патент US сер.07/960093, зарегистрированной 14 октября 1992 г., в настоящее время абандированной, и в патенте US5707796, оба документа озаглавлены "Method for Selecting Nucleic Acids on theBasis of Structure", описано применение SELEXметода в сочетании с гель-электрофорезом для отбора молекул нуклеиновых кислот со специфичными структурными характеристиками, таких как изогнутая ДНК. В заявке на патентAcids Ligands and Solution SELEX" и в заявке на патент US сер.09/093293, зарегистрированной 8 июня 1998 г., озаглавленной "SystematicPhotoselection of Nucleic Acids Ligands and Solution SELEX", описан метод, основной которого является SELEX, для отбора нуклеиновых кислот-лигандов, содержащих фотореактивные группы, которые обладают способностью к связыванию, и/или фотосвязыванию, и/или к фотоинактивации молекулы-мишени. В патенте US5580737, озаглавленном "High-Affinity Nucleic Acids Ligands That Discriminate BetweenTheophylline and Caffeine", описан метод, обозначенный как Counter-SELEX, идентификации высокоспецифичных нуклеиновых кислотлигандов, которые обладают способностью различать близкородственные молекулы, которые могут не относиться к пептидам. В патенте US5567588, озаглавленном "Systematic EvolutionSELEX", описан метод, основой которого является SELEX, с помощью которого достигается высокоэффективное разделение олигонуклеотидов, обладающих высокой и низкой аффинностью по отношению к молекуле-мишени. SELEX-метод предусматривает идентификацию обладающих высокой аффинностью нуклеиновых кислот-лигандов, которые содержат модифицированные нуклеотиды, придающие улучшенные характеристики лиганду, такие как повышенная стабильность in vivo, или улучшенные характеристики при введении. Примеры таких модификаций включают химические замены в положениях рибозы, и/или фосфата,и/или основания. Идентифицированные с помощью SELEX-метода нуклеиновые кислотылиганды описаны в патенте US5660985, озаглавленном "High Affinity Nucleic Acids LigandsContaining Modified Nucleotides", в котором описаны олигонуклеоиды, содержащие нуклеотидные производные, химически модифицированные в положениях 5- и 2'-пиримидинов. В патенте US5580737, выше, описаны высокоспецифичные нуклеиновые кислоты-лиганды,содержащие один или несколько нуклеотидов, 5 модифицированных с помощью 2'-аминогруппы(2'-NH2), 2'-фтора (2'-F) и/или 2'-О-метила (2'ОМе). В заявке на патент US сер.08/264029,зарегистрированной 22 июня 1994 г., в настоящее время абандированной, озаглавленнойSELEX-метод предусматривает объединение отобранных олигонуклеотидов с другими отобранными олигонуклеотидами и неолигонуклеотидными функциональными звеньями,как это описано в патенте US5637459, озаглавленном "Systematic Evolution of Ligands byExponential Enrichment: Chimeric SELEX", и в патенте US5683867, озаглавленном "Systematic Evolution of Ligands by Exponential Enrichment: Blended SELEX" соответственно. Согласно представленным в этих заявках методах можно объединять широкое разнообразие форм и других свойств олигонуклеотидов и их способности к эффективной амплификации и репликации с требуемыми свойствами других молекул.SELEX-метод также предусматривает объединение отобранных нуклеиновых кислотлигандов с липофильными соединениями или неиммуногенными высокомолекулярными соединениями в комплексы, предназначенные для диагностики или терапии, как это описано в заявке на патент US сер.08/434465, зарегистрированной 4 мая 1995 г., озаглавленной "Nucleic Acid Ligand Complexes". Все вышеуказанные патенты и заявки, в которых описаны модификации основного SELEX-метода, специально полностью включены в настоящее описание в качестве ссылки. Краткое изложение сущности изобретения В настоящем изобретении описан способ выделения нуклеиновых кислот-лигандов, которые с высокой специфичностью связываются с тенасцином-С. Кроме того, описаны нуклеиновые кислоты-лиганды к тенасцину-С. Также описаны высокоаффинные РНК-лиганды к тенасцину-С. Также описаны РНК-лиганды к тенасцину-С, с модифицированным 2'-фтором пиримидином и с модифицированным 2'-ОМе пурином. Применяемый согласно изобретению способ идентификации таких нуклеиновых кислот-лигандов назван SALEX, что является сокращением Systematic Evolution of Ligands byExponential enrichment. Под объем изобретения также подпадают лиганды, приведенные в табл. 3 и 4 и на фиг. 10 Изобретение также относится к способу обнаружения присутствия болезни, при которой происходит экспрессия тенасцина-С, в биологической ткани, которая может быть поражена болезнью. Кроме того, изобретение относится к способу обнаружения присутствия опухоли, 004795 6 экспрессирующей тенасцин-С в биологической ткани, которая может включать опухоль. Также изобретение относится к комплексу, предназначенному для диагностики in vivo или ex vivo,Изобретение также относится к способу введения терапевтических агентов, предназначенных для лечения или профилактики пораженных заболеванием тканей, экспрессирующих тенасцин-С. И наконец, изобретение относится к комплексу, предназначенному для введения терапевтических агентов для лечения или профилактики пораженных заболеванием тканей, экспрессирующих тенасцин-С. Краткое описание чертежей На фиг. 1 представлены данные о связывании РНК-пулов, полученных с помощью клеточного SELEX, с клетками линии U251. На фиг. 2 представлена предполагаемая вторичная структура аптамеров ТТА 1 и ТТА 1NB. На чертеже показана конъюгация аптамеров с хелатором Тс-99m. Все А являются 2'ОМемодифицированными. Все G, если не указано иное, являются 2'ОМе-модифицированными. Все С и U являются 2'F-модифицированными. На фиг. 3 приведены изображения ксенотрансплантатов опухолевых клеток линииU251, полученные с использованием меченных с помощью Tc-99m TTA1 и ТТА 1 NB через 3 ч после инъекции. На фиг. 4 представлены данные, полученные с помощью флуоресцентной микроскопии,среза глиобластомы U251 через 3 ч после внутривенной инъекции (i.v.) меченного с помощью красителя Rhodamine-Red-X TTA1. На фиг. 5 показано, каким образом Тс-99m и линкер связываются через 5'G с ТТА 1. На фиг. 6 представлены данные о поглощении TTA1/GS7641 через 3 ч различными ксенотрансплантами опухолей человека в мышах в сравнении с поглощением не связывающегося контрольного аптамера. ID/г обозначает инъецируемую дозу/г. На фиг. 7 представлены данные о биораспределении меченного с помощью 111InTTA1/GS7641 с использованием в качестве хелатора либо DOTA, либо DTPA, меченного с помощью радиоактивного металла, через 3 ч после инъекциями. ID/г обозначает инъецируемую дозу/г. На фиг. 8 представлена конъюгация аптамера с DTPА. 111In представлен в виде хелатного комплекса с DTPA. На фиг. 9 представлена конъюгация аптамера с DOTA. 111In представлен в виде хелатного комплекса с DOTA. На фиг. 10 представлена предполагаемая вторичная структура аптамера ТТА 1. На чертеже показана конъюгация аптамеров с хелатором Тс-99m. Аптамер приведен в меченной с помощью TC-99m форме. Все А являются 2'ОМемодифицированными. Все G, если не указано 7 иное, являются 2'ОМе-модифицированными. Все С и U являются 2'F-модифицированными. Подробное описание предпочтительных вариантов осуществления Основной метод, который применялся для идентификации нуклеиновых кислот-лигандов к тенасцину-С, обозначен как SELEX-метод, что является сокращением названия SystematicEvolution of Ligands by Exponential enrichment, и он включает (а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, (б) разделение представителей перспективной смеси (смеси кандидатов) на основе аффинности к тенасцину-С и (в) амплификацию отобранных молекул с получением смеси нуклеиновых кислот с высоким содержанием нуклеотидных последовательностей, обладающих относительно высокой аффинностью к связыванию с тенасцином-С. Изобретение включает РНК-лиганды к тенасцину-С. Изобретение также включает специфичные РНК-лиганды к тенасцину-С, приведенные в табл. 3 и 4 и на фиг. 10. Более конкретно изобретение относится к нуклеотидным последовательностям, которые практически гомологичны нуклеиновым кислотам-лигандам, приведенным в табл. 3 и 4 и на фиг. 10, и которые обладают практически такой же способностью связываться с тенасцином-С. Под практической гомологией понимают уровень гомологии первичной последовательности,превышающий 70%, наиболее предпочтительно превышающий 80% и еще более предпочтительно превышающий 90, 95 или 99%. Процент гомологии, как он указан выше, рассчитывают как процент нуклеотидов, обнаруженных в меньшей из двух последовательностей, для которых проводится сравнительный анализ, с идентичными нуклеотидными остатками в последовательности, с которой производится сравнение, при этом для облегчения этого сравнительного анализа может быть встроена 1 брешь длиной 10 нуклеотидов. Понятие "практически такая же способность связываться с тенасцином-С" обозначает,что уровень аффинности находится в пределах 1 или 2 порядков по сравнению с уровнем аффинности лигандов по изобретению. Определение того, является ли данная последовательность практически гомологичной конкретно представленной в настоящем описании последовательностям, имеет ли она практически такую же способность связываться с тенасцином-С, находится в компетенции специалиста в данной области. Обобщение данных о гомологиях последовательностей нуклеиновых кислот-лигандов тенасцина-С, приведенных в табл. 3 и 4 и на фиг. 10, свидетельствует о том, что последовательности, имеющие низкий уровень гомологии или вообще не имеющие первичной гомологии,могут обладать практически одинаковой способностью связываться с тенасцином-С. По 8 этим причинам под объем настоящего изобретения также подпадают нуклеиновые кислотылиганды, которые имеют практически такую же установленную структуру или структурные мотивы и способность связываться с тенасциномС, что и нуклеиновые кислоты-лиганды, приведенные в табл. 3 и 4 и на фиг. 10. Практически одинаковая структура или структурные мотивы могут быть установлены с помощью программыZukerfold (см. Zuker, Science 244: 48-52 (1989. Как известно в данной области для предсказания вторичной структуры и структурных мотивов могут также применяться другие компьютерные программы. Практическая такая же структура или структурный мотив нуклеиновых кислот-лигандов, находящихся в растворе или в виде связанной структуры, также могут быть установлены с помощью ЯМР или других методов, известных в данной области. Настоящее изобретение также относится к способу обнаружения присутствия болезни, при которой происходит экспрессия тенасцина-С, в биологической ткани, которая может быть поражена болезнью, способ предусматривает (а) идентификацию нуклеиновой кислоты-лиганда в перспективной смеси нуклеиновых кислот, при этом нуклеиновая кислота-лиганд является лигандом к тенасцину-С, что включает (I) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси; (II) отделение нуклеиновых кислот, обладающих повышенной аффинностью, от остальных представителей перспективной смеси; (III) амплификацию нуклеиновых кислот, обладающих повышенной аффинностью, с получением смеси нуклеиновых кислот, обладающих относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С, посредством чего выявляют нуклеиновые кислотылиганды тенасцина-С; (б) присоединение маркера, который может использоваться для диагностики in vivo или ex vivo с помощью нуклеиновой кислоты-лиганда, выявленной на стадии (III),с получением комплекса маркер-нуклеиновая кислота-лиганд; (в) обработку ткани, которая может быть поражена болезнью, комплексом маркер-нуклеиновая кислота-лиганд; и (г) обнаружение присутствия комплекса маркернуклеиновая кислота-лиганд в ткани, посредством чего выявляют болезнь, при которой происходит экспрессия тенасцина-С. Еще одним объектом изобретения является комплекс, который может применяться для диагностики in vivo или ex vivo, включающий одну или несколько нуклеиновых кислот-лигандов тенасцина-С и один или несколько маркеров. Объектом изобретения также является способ введения терапевтических агентов для лечения 9 или профилактики болезненных состояний, при которых происходит экспрессия тенасцина-С. И еще одним объектом изобретения является комплекс, применяемый для введения терапевтических агентов для лечения или профилактики болезненных состояний, при которых происходит экспрессия тенасцина-С. Определения Для описания изобретения используют различные понятия. С целью облегчения понимания описания компонентов изобретения применяют следующие определения. В контексте настоящего описания понятие"нуклеиновая кислота-лиганд" относится к не встречающейся в естественных условиях нуклеиновой кислоте, которая оказывает требуемое воздействие на мишень. Нуклеиновые кислотылиганды часто обозначаю как "аптамеры". Мишенью по настоящему изобретению является тенасцин-С, поэтому понятие подразумевает нуклеиновую кислоту-лиганд тенасцина-С. Требуемое воздействие включает (но не ограничиваясь им) связывание с мишенью, каталитическое изменение мишени, взаимодействие с мишенью таким образом, что это модифицирует/изменяет мишень или функциональную активность мишени, ковалентное присоединение к мишени в качестве ингибитора-"самоубийцы",облегчение взаимодействия между мишенью и другой молекулой. Согласно предпочтительному варианту воздействие подразумевает специфичную аффинность к связыванию с молекулой-мишенью, при этом такая молекула-мишень имеет трехмерную химическую структуру, отличную от полипептида, который связывается с нуклеиновой кислотой-лигандом посредством механизма, который в основном зависит от спаривания оснований Уотсона/Крика или триплетного спирального связывания, причем нуклеиновая кислота-лиганд не является нуклеиновой кислотой, имеющей известную физиологическую функцию, проявляющуюся в связывании с молекулой-мишенью. Из перспективной смеси нуклеиновых кислот выделяют нуклеиновые кислоты-лиганды, отличающиеся тем, что эти нуклеиновые кислоты-лиганды являются лигандами к тенасцину-С, с помощью метода, который предусматривает а) приведение перспективной смеси в контакт с тенасцином-С, при этом нуклеиновые кислоты, обладающие повышенной аффинностью к тенасцину-С, могут быть отделены от остальных представителей перспективной смеси, б) отделение нуклеиновых кислот, обладающих повышенной аффинностью, от остальных представителей перспективной смеси, и в) амплификацию нуклеиновых кислот, обладающих повышенной аффинностью, с получением смеси нуклеиновых кислот с повышенным содержанием лигандов (см. заявку на патент США 08/434425, зарегистрированную 3 мая 1995 г , в настоящее время па 004795 10 тент US5789157, включенный в настоящее описание в качестве ссылки). В контексте настоящего описания понятие"смесь кандидатов (перспективная смесь)" обозначает смесь нуклеиновых кислот, имеющих различные последовательности, из которой выбирают требуемый лиганд. Источником перспективной смеси могут быть встречающиеся в естественных условиях нуклеиновые кислоты или их фрагменты, синтезированные химическим путем нуклеиновые кислоты, синтезированные ферментативным путем нуклеиновые кислоты или нуклеиновые кислоты, полученные с помощью комбинации этих методов. Согласно предпочтительному варианту для облегчения процесса амплификации каждая нуклеиновая кислота имеет фиксированную последовательность, окружающую рандомизированную область. В контексте настоящего описания понятие"нуклеиновая кислота" обозначает одноцепочечные или двухцепочечные ДНК, РНК и любые их химические модификации. Модификации включают (но не ограничиваясь ими) модификации, приводящие к получению других химических групп, которые придают основаниям нуклеиновой кислоты-лиганда или нуклеиновой кислоте-лиганду в целом дополнительный заряд, измененную способность к поляризации,образованию водородных связей, электростатическому взаимодействию и текучести. Такие модификации включают (но не ограничиваясь ими) модификации сахара в 2'-положении, модификации пиримида в 5-положении, модификации пурина в 8-положении, модификации экзоциклических аминов, замену 4-тиоуридина,замену 5-бром- или 5-йодурацила; модификации каркаса, метилирования, необычные комбинации спаривания оснований, таких как изооснования изоцитидин и изогуанидин, и т.п. Модификации также могут включать 3'-и 5'модификации, такие как кэппинг."SELEX-метод включает сочетание отбора нуклеиновых кислот-лигандов, которые взаимодействуют с мишенью требуемым образом, например, связываются с протеином, и амплификации отобранных нуклеиновых кислот. Необязательное циклическое повторение стадий отбора/амплификации позволяет отобрать одну или небольшое количество нуклеиновых кислот,которые наиболее сильно взаимодействуют с мишенью, из группы, включающей очень большое количество нуклеиновых кислот. Циклическое повторение процесса отбора/амплификации продолжают до решения поставленной задачи. Согласно настоящему изобретению SELEX-метод применяют для получения нуклеиновых кислот-лигандов к тенасцину-С.SELEX-метод описан в заявках на патент,касающихся SELEX. Понятие "SELEX-мишень" или "мишень" обозначает любое представляющее интерес со 11 единение или молекулу, для которых требуется лиганд. Мишень может представлять собой (но не ограничиваясь ими) протеин, пептид, углевод, полисахарид, гликопротеин, гормон, рецептор, антиген, антитело, вирус, субстрат, метаболит, аналог переходного состояния, кофактор,ингибитор, лекарственное средство, краситель,питательное вещество, фактор роста и т.д. В настоящем описании SELEX-мишень представляет собой тенасцин-С. Понятие "комплекс" в контексте настоящего описания обозначает молекулу, образованную посредством ковалентного связывания одной или нескольких нуклеиновых кислотлигандов тенасцина-С с одним или несколькими маркерами. В некоторых вариантах осуществления настоящего изобретения комплекс обозначают как A-B-Y, где А обозначает маркер; В является необязательным компонентом и обозначает линкер; и Y обозначает нуклеиновую кислоту-лиганд тенасцина-С. Понятие "маркер" в контексте настоящего описания обозначает молекулу или молекулы,которые образуют комплексы с нуклеиновой кислотой-лигандом тенасцина-С, либо непосредственно, либо через линкер(ы) или спейсер(ы), которая(ые) позволяют обнаруживать комплекс in vivo или ex vivo визуально или с помощью химических методов. Примеры маркеров включают (но не ограничиваясь ими) радионуклеотиды, Tc-99m, Re-188, Cu-64, Cu-67,F-18, 125I, 131I, 111In, 32P, 186Re; все флуорофоры,включая флуоресцин, родамин, техаский красный (Texas Red); производные вышеуказанных флуорофоров, включая Rhodamine-Red-X; магнитные соединения; и биотин. В контексте настоящего описания понятие"линкер" обозначает молекулу, которая соединяет две или большее количество молекул через ковалентную связь или нековалентные взаимодействия и осуществляет пространственное разделение молекул таким образом, при котором сохраняются функциональные свойства одной или нескольких молекул. Линкер также обозначают как спейсер. Примеры линкеров включают (но не ограничиваясь ими) (СН 2 СН 2O)6 и гексиламины, строение которых приведено на фиг. 2. Понятие "терапевтический" в контексте настоящего описания включает лечение и/или профилактику. Понятие терапевтический, если оно используется, относится к людям и другим животным. Понятие "ковалентная связь" обозначает химическую связь, образованную обобществлением электронов. Понятие "нековалентные взаимодействия" относится к отличным от ковалентных связей взаимодействиям, с помощью которых молекулы удерживаются вместе, включая ионные взаимодействия и водородные связи. Согласно предпочтительному варианту нуклеиновые кислоты-лиганды по настоящемуNucleic Acid Ligands". Эти документы, каждый из которых специально включен в настоящее описание в качестве ссылки, вместе обозначены как заявки на патент, в которых описан SELEX.SELEX-метод позволяет получить класс продуктов, представленных молекулами нуклеиновых кислот, каждая из которых имеет уникальную последовательность и каждая из которых обладает способностью специфично связываться с требуемыми соединением- или молекулой-мишенью. Молекулы-мишени предпочтительно представляют собой протеины, но они также включают среди прочего углеводы,пептидогликаны и различные небольшие молекулы. SELEX-метод также можно применять для биологических структур-мишеней, таких как клеточные поверхности или вирусы, с использованием специфического взаимодействия с молекулой, которая является составной частью биологической структуры. В наиболее общей форме SELEX-метод можно охарактеризовать следующей последовательностью стадий: 1) Получают перспективную смесь нуклеиновых кислот с различными последовательностями. Перспективная смесь обычно включает области фиксированных последовательностей(т.е. каждый представитель перспективной смеси содержит одинаковые последовательности в одном и том же положении) и области рандомизированных последовательностей. Области фиксированных последовательностей выбирают либо: (а) для облегчения описанных ниже стадий амплификации; (б) для имитации последовательности, для которой известна способность связываться с мишенью, либо (в) для повышения уровня данной структурной аранжировки нуклеиновых кислот в перспективной смеси. Рандомизированные последовательности могут быть полностью рандомизированными (т.е. вероятность нахождения основания в любом положении составляет один к четырем) или частично рандомизированными (например, вероятность нахождения основания в любом положении может быть выбрана из любого уровня от 0 до 100%). 2) Перспективную смесь приводят в контакт с выбранной мишенью в условиях, наиболее предпочтительных для связывания мишени с представителями перспективной смеси. В этих условиях взаимодействие между мишенью и нуклеиновыми кислотами перспективной смеси можно рассматривать, как образование пар нук 13 леиновая кислота-мишень между мишенью и теми нуклеиновыми кислотами, которые обладают наиболее высокой аффинностью к мишени. 3) Нуклеиновые кислоты, которые обладают наиболее высокой аффинностью к мишени, отделяют от нуклеиновых кислот, которые обладают более низкой аффинностью к мишени. Поскольку только очень небольшое количество последовательностей (и возможно только одна молекула нуклеиновой кислоты) соответствует нуклеиновым кислотам с наиболее высокой аффинностью, присутствующим в перспективной смеси, как правило, требуется таким образом подбирать критерии разделения, чтобы значительное количество нуклеиновых кислот в перспективной смеси (примерно 5-50%) сохранялось в процессе разделения. 4) Затем те нуклеиновые кислоты, которые отобраны в результате разделения, как имеющие относительно высокую аффинность по отношению к мишени, амплифицируют, создавая новую перспективную смесь, с более высоким содержанием нуклеиновых кислот, имеющих относительно высокую аффинность по отношению к мишени. 5) В результате повторения описанных выше стадий разделения и амплификации вновь полученная перспективная смесь содержит все меньше и меньше уникальных последовательностей, при этом средний уровень аффинности нуклеиновых кислот к мишени в целом должен возрастать. В своей наиболее высокой степени реализации SELEX-метод должен обеспечить получение перспективной смеси, содержащей одну или лишь небольшое количество уникальных нуклеиновых кислот, соответствующих тем нуклеиновым кислотам из исходной перспективой смеси, для которых характерна наиболее высокая аффинность по отношению к молекулемишени. Основной SELEX-метод был модифицирован с целью решения большого количества конкретных задач. Например, в заявке на патент US сер.07/960093, зарегистрированной 14 октября 1992 г., в настоящее время абандированной, и в патенте US5707796, оба документа озаглавлены "Method for Selecting Nucleic AcidsSELEX-метода в сочетании с гель-электрофорезом для отбора молекул нуклеиновых кислот со специфичными структурными характеристиками, таких как изогнутая ДНК. В заявке на патент US сер.08/123935, зарегистрированной 17 сентября 1993 г., в настоящее время абандированной, озаглавленной "Photoselection of Nucleic Acids Ligands", в патенте US No. 5763177, озаглавленном "Systematic Evolution ofof Nucleic Acids Ligands and Solution SELEX", и в заявке на патент США сер. No. 09/093293, зарегистрированной 8 июня 1998 г., озаглавлен 004795 14 ной "Systematic Evolution of Ligands by Exponential Enrichment: Photoselection of Nucleic Acids Ligands and Solution SELEX", описан метод,основной которого является SELEX, для отбора нуклеиновых кислот-лигандов, содержащих фотореактивные группы, которые обладают способностью к связыванию, и/или фотосвязыванию, и/или к фотоинактивации молекулымишени. В патенте США No. 5580737, озаглавленном "High-Affinity Nucleic Acids Ligands ThatDiscriminate Between Theophylline and Caffeine",описан метод, обозначенный как CounterSALEX, идентификации высокоспецифичных нуклеиновых кислот-лигандов, которые обладают способностью различать близкородственные молекулы. В патенте US5567588, озаглавленном "Systematic Evolution of Ligands byExponential Enrichment: Solution SELEX", описан метод, основой которого является SELEX, с помощью которого достигается высокоэффективное разделение олигонуклеотидов, обладающих высокой и низкой аффинностью по отношению к молекуле-мишени. В патенте US5496938, озаглавленном "Nucleic Acids Ligandsto HIV-RT and HIV-1 Rev", описаны основанные на использовании SELEX методы получения нуклеиновых кислот-лигандов с улучшенными характеристками. В патенте US5705337, озаглавленном "Systematic Evolution of Ligands byExponential Enrichment: Chemi-SELEX", описаны методы ковалентного связывания лиганда с его мишенью.SELEX-метод предусматривает идентификацию обладающих высокой аффинностью нуклеиновых кислот-лигандов, которые содержат модифицированные нуклеотиды, придающие улучшенные характеристики лиганду, такие как повышенная стабильность in vivo, или улучшенные характеристики при введении. Примеры таких модификаций включают химические замены в положениях рибозы, и/или фосфата,и/или основания. Идентифицированные с помощью SELEX-метода нуклеиновые кислотылиганды описаны в патенте US5660985, озаглавленном "High Affinity Nucleic Acids LigandsContaining Modified Nucleotides", в котором описаны олигонуклеотиды, содержащие нуклеотидные производные, химически модифицированные в положениях 5- и 2'-пиримидинов. В патенте US5580737, выше, описаны высокоспецифичные нуклеиновые кислоты-лиганды,содержащие один или несколько нуклеотидов,модифицированных с помощью 2'-аминогруппы(2'-NH2), 2'-фтора (2'-F) и/или 2'-О-метила (2'ОМе). В заявке на патент US сер.08/264029,зарегистрированной 22 июня 1994 г., в настоящее время абандированной, озаглавленнойSELEX-метод предусматривает объединение отобранных олигонуклеотидов с другими отобранными олигонуклеотидами и не олигонуклеотидными функциональными звеньями,как это описано в патенте US5637459, озаглавленном "Systematic Evolution of Ligands byExponential Enrichment: Chimeric SELEX" и в патенте US5683867 озаглавленном "Systematic Evolution of Ligands by Exponential Enrichment: Blended SELEX" соответственно. Согласно представленным в этих заявках методах можно объединять широкое разнообразие форм и других свойств олигонуклеотидов и их способности к эффективной амплификации и репликации с требуемыми свойствами других молекул. В патенте US5496938 описаны методы получения с помощью SELEX нуклеиновых кислот-лигандов с улучшенными характеристиками. Этот патент, озаглавленный "NucleicAcids Ligands to HIV-RT and HIV-1 Rev", специально включен в настоящее описание в качестве ссылки. В заявке на патент US08/434425, зарегистрированной 3 мая 1995 г., озаглавленнойEnrichment: Tissue SELEX", в настоящее время патент US 5789157, описаны методы идентификации нуклеиновых кислот-лигандов к макромолекулярным компонентам ткани, включая раковые клетки, и нуклеиновые кислотылиганды, выявленные с помощью этих методов. Этот патент специально включен в настоящее описание в качестве ссылки. Одна из потенциальных проблем, связанная с применением нуклеиновых кислот в диагностических или терапевтических целях, состоит в том, что олигонуклеотиды в виде фосфодиэфиров еще до проявления их требуемого воздействия могут быстро расщепляться в общей воде организма под действием внутриклеточных и внеклеточных ферментов, таких как эндонуклеазы и экзонуклеазы. Для повышения стабильности in vivo нуклеиновых кислот-лигандов или для повышения или изменения характеристик при введении нуклеиновых кислот-лигандов можно использовать определенные химические модификации нуклеиновых кислот-лигандов(см., например, заявку на патент US сер.08/117991, зарегистрированную 8 сентября 1993 г., в настоящее время абандированную, и патентModified Nucleotides", которые специально включены в настоящее описание в качестве ссылки). Модификации нуклеиновых кислотлигандов согласно изобретению включают (но не ограничиваясь ими) модификации, приводящие к получению других химических групп,которые придают основаниям нуклеиновой кислоты-лиганда или нуклеиновой кислотелиганду в целом дополнительный заряд, изме 004795 16 ненную способность к поляризации, образованию водородных связей, электростатическому взаимодействию и текучести. Такие модификации включают (но не ограничиваясь ими) модификации сахара в 2'-положении, модификации пиримидина в 5-положении, модификации пурина в 8-положении, модификации экзоциклических аминов, замену 4-тиоуридина, замену 5 бром- или 5-йодурацила; модификации каркаса,метилирования, необычные комбинации спаривания оснований, таких как изооснования изоцитидин и изогуанидин и т.п. Модификации также могут включать 3'- и 5'-модификации,такие как кэппинг. В предпочтительных вариантах осуществления изобретения нуклеиновые кислоты-лиганды представляют собой молекулы РНК, 2'-фтор-(2'-F)-модифицированные на остатке сахара пиримидиновых фрагментов. Модификации могут представлять собой модификации, которые осуществляют до или после SELEX-метода. Модификации, которые осуществляют до SELEX-метода, позволяют получить нуклеиновые кислоты-лиганды, которые обладают как специфичностью по отношению к SELEX-мишени, так и улучшенной стабильностью in vivo. Модификации 2'-ОНнуклеиновых кислот-лигандов, которые осуществляют после SELEX-метода, позволяют достичь улучшенной стабильности in vivo без необходимости воздействия на способность к связыванию нуклеиновых кислот-лигандов. Специалистам в данной области известны и другие модификации. Такие модификации могут быть осуществлены после SELEX-метода(модификации ранее выявленных немодифицированных лигандов) или включены в процесс осуществления SELEX-метода. Нуклеиновые кислоты-лиганды по изобретению получают с помощью описанного вышеSELEX-метода и в основном с использованием заявок на патент, касающихся SELEX, которые полностью включены в настоящее описание в качестве ссылок. Аптамеры тенасцина-С по изобретению связываются с гепаринсвязывающим сайтом СООН-конца тенасцина-С. Согласно некоторым вариантам осуществления настоящего изобретения описанные нуклеиновые кислоты-лиганды тенасцина-С применяют для диагностических целей, и они могут применяться для визуализации патологических состояний (таких как визуализация опухолей человека). Помимо диагностики нуклеиновые кислоты-лиганды тенасцина-С применяют для прогноза и мониторинга болезненных состояний, при которых происходит экспрессия тенасцина-С. Для диагностических агентов требуется лишь то, чтобы они позволяли выявлять наличие данной мишени в конкретном локусе или в определенной концентрации. Для инициации положительного сигнала для целей диагностики 17 может быть достаточным только наличие способности образовывать связывающие пары с мишенью. Специалистам в данной области должно быть очевидно, как адаптировать любую нуклеиновую кислоту-лиганд тенасцина-С с помощью известных в данной области методов для включения маркера, для того чтобы выявить присутствие нуклеиновой кислотылиганда. Такой маркер можно применять в различных диагностических процедурах, таких как обнаружение первичных и метастатических опухолей и атеросклеротических повреждений. Примерами маркеров-меток по изобретению является технеций-99m и 111In; однако другие маркеры, такие как другие радионуклиды, магнитные соединения, флуорофоры, биотин и т.п.,могут быть включены в конъюгаты с нуклеиновой кислотой-лигандом тенасцина-С для визуализации in vivo или ex vivo болезненных состояний, при которых происходит экспрессия тенасцина-С (например, рака, атеросклероза и псориаза). Маркер может быть ковалентно связан с различными положениями в нуклеиновой кислоте-лиганде тенасцина-С, такими как экзоциклическая аминогруппа основания, 5 положение пиримидинового нуклеотида, 8 положение пуринового нуклеотида, гидроксильная группа фосфата или гидроксильная группа или другие группы на 5'- или 3'-концах нуклеиновой кислоты-лиганда тенасцина-С. В вариантах осуществления, в которых маркер представляет собой технеций-99m или 111In, его предпочтительно связывают с 5'- или 3'гидроксилом фосфатной группы или с 5 положением модифицированного пиримидина. Согласно наиболее предпочтительному варианту осуществления маркер связывают с 5'гидроксилом фосфатной группы нуклеиновой кислоты-лиганда с помощью линкера или без него. Согласно другому варианту осуществления маркер конъюгируют с нуклеиновой кислотой-лигандом путем включения пиримидина,содержащего первичный амин в 5-положении, и применения амина для конъюгации с маркером. Присоединение маркера можно осуществлять непосредственно или с помощью линкера. В одном из вариантов, когда в качестве маркера применяют технеций-99m или 111In, предпочтительным линкером является гексиламинный линкер, приведенный на фиг. 10. Согласно другим вариантам нуклеиновую кислоту-лиганд тенасцина-С применяют для введения терапевтических соединений (включая(но не ограничиваясь ими) цитотоксическое соединение, вещества, повышающие иммунитет, и терапевтические радионуклиды) для тканей или органов, в которых происходит экспрессия тенасцина-С. Болезненные состояния, при которых может происходить экспрессия тенасцинаС, включают (но не ограничиваясь ими) рак,атеросклероз и псориаз. Специалисту в данной области ясно, как можно адаптировать любую 18 нуклеиновую кислоту-лиганд тенасцина-С с помощью известных в данной области методов включения терапевтического соединения в комплекс. Терапевтическое соединение может быть ковалентно связано с различными положениями нуклеиновой кислоты-лиганда тенасцина С, такими как экзоциклическая аминогруппа основания, 5-положение пиримидинового нуклеотида,8-положение пуринового нуклеотида, гидроксильная группа фосфата или гидроксильная группа или другие группы на 5'- или 3'-концах нуклеиновой кислоты-лиганда тенасцина-С. Согласно предпочтительному варианту осуществления терапевтический агент связывают с 5'амином нуклеиновой кислоты-лиганда. Присоединение терапевтического агента можно осуществлять непосредственно или с помощью линкера. В вариантах, в которых болезнь-мишень представляет собой рак, 5-флуородезоксиурацил или другие нуклеотидные аналоги, для которых выявлена активность в отношении опухолей,могут быть включены внутрь в урацилы (U),существующие в нуклеиновых кислотахлигандах тенасцина-С, или добавлены внутрь или конъюгированы с любым концом либо непосредственно, либо через линкер. Кроме того,можно включать как пиримидиновые аналоги 2',2'-дифлоуроцитидина, так и пуриновые аналоги (дезоксикоформицин). В заявке на патент США сер. No. 08/993765, зарегистрированной 18 декабря 1997 г., которая полностью включена в настоящее описание в качестве ссылки, среди прочего также описаны пролекарства, основой которых являются нуклеотиды, включающие нуклеиновые кислоты-лиганды, мишенью которых является опухоль, например тенасцин-С,предназначенные для точной локализации хеморадиосенсибилизаторов и радиосенсибилизаторов и других радиотерапевтических агентов для опухоли. Также подразумевается, что как маркер,так и терапевтический агент могут быть связаны с нуклеиновой кислотой-лигандом тенасцина-С так, чтобы обнаружение болезненного состояния и введение терапевтического агента осуществлять одновременно с использованием одного аптамера или смеси двух или большего количества различных модифицированных версий одного аптамера. Также подразумевается, что либо маркер и/или терапевтический агент, либо они оба могут быть связаны с неиммуногенным высокомолекулярным соединением или липофильным соединением, таким как липосома. Методы получения конъюгатов нуклеиновых кислот-лигандов с липофильными соединениями или неиммуногенными соединениями в комплексах, предназначенных для диагностики или терапии, описаны в заявке на патент US сер.08/434465, зарегистрированной 4 мая 1995 г.,озаглавленной "Nucleic Acid Ligand Complexes",которая полностью включена в настоящее описание в качестве ссылки. 19 Представленные в настоящем описании диагностические или терапевтические композиции можно вводить парентерально с помощью инъекции (например, внутривенно, подкожно,внутридермально, внутрь повреждения), хотя также можно применять другие эффективные формы введения, такие как внутрисуставная инъекция, аэрозоли для ингаляции, активные при пероральном введении композиции, трансдермальные ионофоретические композиции или суппозитории. Их также можно наносить местно путем непосредственной инъекции, они могут высвобождаться из устройств, таких как имплантированные стенты или катетеры, или их можно вводить непосредственно в мишень с помощью инфузионного насоса. Одним из предпочтительных носителей является физиологический раствор, но подразумевается, что также можно применять другие фармацевтически приемлемые носители. Согласно одному из вариантов носитель и комплекс, включающий нуклеиновую кислоту-лиганд тенасцина-С и терапевтический агент, представляют собой физиологически совместимую композицию с медленным высвобождением. Первичный растворитель в таком носителе по свой природе может быть либо водным, либо неводным. Кроме того, носитель может включать другие фармакологически приемлемые эксципиенты для изменения или поддержания значения рН, осмотического давления, вязкости, прозрачности,цвета, стерильности, стабильности, скорости растворения или запаха композиции. Аналогично этому носитель может также включать еще и другие фармакологически приемлемые эксципиенты для изменения или поддержания стабильности, скорости растворения, высвобождения или абсорбции нуклеиновой кислотылиганда тенасцина-С. Такие эксципиенты представляют собой субстанции, которые обычно применяют для изготовления дозируемых форм для парентерального введения либо в виде стандартных доз, либо в виде форм, включающих несколько доз. После приготовления терапевтической или диагностической композиции ее можно хранить в стерильных пузырьках в виде раствора, суспензии, геля, эмульсии, твердого или дегидратированного или лиофилизированного порошка. Такие композиции можно хранить либо в виде формы, готовой к применению, либо в виде формы, которую необходимо подвергать восстановлению непосредственно перед введением. Путь введения композиций, содержащих нуклеиновые кислоты-лиганды тенасцина-С, которые предназначены для системного введения,может быть подкожным, внутримышечным,внутривенным, интрадермальным, интраназальным или с помощью вагинальных или ректальных суппозиториев. Ниже изобретение пояснено на примерах,которые не ограничивают его объем. В примере 20 1 описаны материалы и экспериментальные процедуры, применение которых описано в примере 2, для получения РНК-лигандов к тенасцину-С. В примеры 2 описаны РНК-лиганды к тенасцину-С и предсказанная вторичная структура выбранной нуклеиновой кислотылиганда. В примере 3 описано определение минимального размера, необходимого для высокоаффинного связывания выбранной нуклеиновой кислоты-лиганда, и замена 2-ОН-пуринов на 2'ОМе-пурины. В примере 4 описано биораспределение меченных с помощью Тс-99m нуклеиновых кислот-лигандов тенасцина-С у несущих опухоли мышей. В примере 5 описано применение флуоресцентномеченной нуклеиновой кислоты-лиганда тенасцина-С для локализации тенасцина-С внутри пораженной опухолью ткани. В примере 6 описано обнаружение опухолейin vivo с помощью аптамера ТТА 1 (также известного как GS7641). В примере 7 описан альтернативный вариант мечения с помощью 111In. Примеры Пример 1. Применение SELEX для получения нуклеиновых кислот-лигандов к тенасцину-С и к клеткам глиобластомы линии 251. Материалы и методы Тенасцин-С получали от фирмы Chemicon(Темекула, штат Калифорния). Одноцепочечные ДНК-праймеры и матрицы были синтезированы на фирме Operon Technologies Inc. (Аламеда,штат Калифорния).SELEX-метод подробно описан в заявках на патент, касающихся SELEX. Двухцепочечные матрицы для транскрипции получали в целом путем удлинения с помощью фрагмента Кленова оцДНК 40N7a: 5-TCGCGCGAGTCGTCTG[40N]CCGCATCGTCTGCGG-3' (SEQ ID NO:2), который содержит промотор полимеразы фага Т 7 (подчеркнут). РНК получали с помощью РНК-полимеразы фага Т 7 согласно методу, описанному ранее уFitzwater и Polisky, Method Enzymol., 267: 275301 (1996), публикация полностью включена в настоящее описание в качестве ссылки. Все реакции транскрипции осуществляли в присутствии пиримидиновых нуклеотидов, 2'-фтор(2'-F)модифицированных на сахарном фрагменте. Эта замена способствует повышенной устойчивости к рибонуклеазам, которые используют 2'гидроксильную группу для расщепления фосфодиэфирной связи. В частности, каждая смесь для транскрипции содержала 3,3 мМ 2'-F-УТФ и 3,3 мМ 2'-F-ЦТФ наряду с 1 мМ ЦТФ и АТФ. Начальная случайная библиотека РНК, полученная таким образом, включала 3 х 1014 молекул. Аффинность отдельных лигандов к тенасцину-С определяли стандартными методами с помощью распределения на нитроцеллюлозном 21 фильтре (Tuerk и Gold, Science, 249(4968) 505510 (1990. Для каждого SELEX-цикла планшеты Лумино (фирма Labsystems, Нидхэм Хеитс, штат Миннесота) сенсибилизировали в течение 2 ч с использованием 200 мкл ЗФР Дульбекко, содержащего концентрации тенасцина-С, которые приведены в табл. 1. После сенсибилизации лунки блокировали с использованием HBSMC+буфер [20 мМ Hepes,pH 7,4, 137 мМ NaCl, 1 мМ СаСl2, 1 мМ MgCl2 и 1 г/л человеческого сывороточного альбумина(фирма Sigma, фракция V)] в течение 1-6 цикла, а в 7 и 8 цикле лунки блокировали с использованием смеси HBSMC+буфер, содержащий 1 г/л казеина (I-блок, фирма Tropix). Буфер для связывания и промывки содержал HBSMC+буфер, включающий 0,05% твин 20. Для каждого цикла SELEX РНК разбавляли в 100 мкл буфера для связывания и инкубировали в течение 2 ч при 37 С в сенсибилизированных протеином лунках, которые предварительно промывали буфером для связывания. После связывания осуществляли шестикратную промывку, используя каждый раз по 200 мкл. После стадии промывки сухую лунку помещали на 5 мин на верхнюю часть нагревательного блока с температурой 95 С. Стандартные реакции с использованием обратной транскриптазы AMV (вирус миелобластоза птиц) (50 мкл) осуществляли при 48 С непосредственно в лунке, и продукты реакции использовали для стандартной ПЦР и реакций транскрипции. Два синтетических праймера 5N7(см. выше) и 3N7a: 5'TCGCGCGAGTCGTCTTG-3' (SEQ ID NO 3) использовали для стадий амплификации и обратной транскрипции этих матриц. Для осуществления клеточного SELEX клетки человеческой глиобластомы линии U251(Hum Hered , 21 238 (1971 выращивали до конфлюэнтности в модифицированной по методу Дульбекко среде Игла, дополненной 10% фетальной телячьей сыворотки (фирма GIBCOBRL, Геттисберг, Мэриленд), в 6-луночных планшетах для культуры ткани (Becton Dickinson Labware, Линкольн-Парк, штат НьюДжерси) и трижды промывали буфером, содержащим ЗФР Дульбекко, дополненным СаСl2(ДЗФР, фирма GIBCO BRL). РНК, в которую путем транскрипции вводили внутреннюю метку (Fitzwater (1996), выше), инкубировали с клетками при 37 С в течение 1 ч. Затем меченую РНК удаляли и клетки промывали ДЗФР 6 раз по 10 мин при 37 С. Затем добавляли ДЗФР,содержащий 5 мМ ЭДТК, и инкубировали с клетками в течение 30 мин с целью элюирования связанных РНК, которые сохранялись после стадий промывки. Эту РНК оценивали количественно с помощью стандартного протокола с использованием жидкостного сцинтилляционного счетчика и амплифицировали с помощью ОТ-ПЦР. Анализ связывания с клетками U251. РНК с внутренней меткой инкубировали с повы 004795 22 шающими концентрациями конфлюэнтных клеток U251 в 6-луночных планшетах для культуры ткани (фирма Becton Dickinson Labware, Линкольн-Парк, штат Нью-Джерси) при 37 С в течение 60 мин. Несвязанную РНК отмывали с помощью трех 10-минутных промывок ДЗФР+СаСl2 при 37 С и связанную РНК собирали путем разрушения клеток с помощью тризола (фирма GIBCO BRL, Геттисберг, Мэриленд). Связанную РНК количественно оценивали с помощью жидкостного сцинтилляционного счетчика. Клонирование и секвенирование. Амплифицированные пулы олигонуклеотидов с повышенной аффинностью очищали на 8%-ном полиакриламидном геле, осуществляли обратное транскрибирование с получением оцДНК и ДНК амплифицировали с помощью полимеразной цепной реакции (ПЦР) с помощью праймеров,содержащих сайты, распознаваемые рестриктазами BamHI и HindIII. ПЦР-фрагменты клонировали, получали плазмиды и анализ последовательности осуществляли с помощью стандартных методов (Sambrook и др. (1989) MolecularU251 получали с помощью SELEX-метода, описанного в заявке на патент США No. 08/434425,зарегистрированной 3 мая 1995 г., озаглавленнойEnrichment: Tissue SELEX", в настоящее время патент US5789157. Далее подтверждали, что полученные лиганды представляли собой нуклеиновые кислоты-лиганды тенасцина-С. Для получения олигонуклеотидных лигандов к человеческому тенасцину-С осуществляли 8 циклов SELEX с использованием рандомизированной библиотеки нуклеотидов, как описано в разделе "Материал и методы". РНК и протеин,которые использовали в каждом цикле, приведены в табл. 1. После 8 циклов SELEX аффинность пула олигонуклеотидов к тенасцину-С составляла 10 нМ, и эта аффинность не увеличивалась при использовании дополнительных циклов SELEX. Для получения лигандов к клеткам глиобластомы U251 осуществляли 9 циклов SELEX с использованием рандомизированной библиотеки нуклеотидов. После 9 циклов связывания с клетками линии U251 и элюирования с помощью ЭДТК продукты циклов 3, 5 и 9 тестировали в отношении способности связываться с клетками линии U251. На фиг. 1 показано, что с увеличением количества циклов SELEX количество связанной РНК, взятой в определенной концентрации, также возрастает. Из-за сложности ткани-мишени невозможно оценить аффинность олигонуклеотидных пулов в отношении неизвестных молекул-мишеней на этих клетках. 23 Затем пул Е 9 (9 циклов связывания и элюирование ЭДТК из клеток линии U251) использовали в качестве исходной точки для осуществления SELEX с использованием очищенного тенасцина-С. Осуществляли 2 цикла SELEX с использованием очищенного тенасцинаС согласно описанному ранее методу. Применяемые для двух циклов SELEX концентрации протеина и РНК (Е 9 Р 1 и Е 9 Р 2) представлены в табл. 2. В целом осуществляли три различных SELEX-эксперимента: эксперимент с использованием в качестве мишени очищенного тенасцина-С,эксперимент с использованием в качестве мишени клеток глиобластомы линии U251 и эксперимент,в котором SELEX-пул из клеток глиобластомы линии U251 применяли для инициации SELEXэксперимента, котором в качестве мишени использовали очищенный тенасцин-С. Продукты всех трех SELEX-экспериментов анализировали путем клонирования и секвенирования лигандов, полученных после 8-ого цикла SELEX-эксперимента с использованием очищенного тенасцина-С ("TN"-последовательности), после 9 ого цикла SELEX-эксперимента с использованием клеток линии U251 ("Е 9"-последовательности) и после 2-ого цикла гибридного("Е 9 Р 2"-последовательности). Последовательности 34 уникальных клонов приведены в табл. 3, и их можно разделить на 2 основные группы: лиганды тенасцина-С ("TN"- и "Е 9 Р 2"- последовательности) и лиганды клеток линии U251 ("Е 9"-лиганды). Среди лигандов тенасцина-С большинство клонов (всего 65) представлено одним из двух различных классов последовательностей, обозначенных как семейство I и семейство II (фиг. 1). Оценка вариабельной области 12 клонов семейства I позволила выявить наличие 7 уникальных последовательностей, родственных консенсусной последовательности GACNYUUCCNGCYAC (SEQ ID NO:12). Оценка вариабельной области 18 клонов семейства II позволила выявить последовательности, содержащие консенсусную последовательность CGUCGCC(табл. 3). Е 9-последовательности можно сгруппировать в родственный набор по признаку наличия консервативных последовательностейGAY и CAU внутри вариабельных областей. Для оставшихся последовательностей не выявлено родства с другими последовательностями,и они были классифицированы как "сиротские". Доминируют три последовательности: Е 9 Р 2-1,Е 9 Р 2-2 и TN9, частота встречаемости которых составляет 14, 16 и 10 раз соответственно. В категории "сиротских последовательностей" одна последовательность, TN18, представлена дважды. В целом эти данные свидетельствуют об обогащенном в значительной степени пуле последовательностей. Для большинства образцов установлены наномолярные значения констант диссоциации, 004795 24 при этом три наиболее превалирующие последовательности TN9, Е 9 Р 2-1 и Е 9 Р 2-2 имеют наиболее высокие уровни аффинности при 5 нМ,2 нМ и 8 нМ (табл. 3). Эти результаты свидетельствуют о том, что SELEX с использованием клеток U251 позволяет создать пул аптамеров к тенасцину-С, и что только два цикла SELEX требуется для выделения специфичных для тенасцина лигандов из SELEX-пула, полученного с использованием клеток. Олигонуклеотидные лиганды к другим протеинам аналогичным образом могут быть выделены из Е 9-пула с использованием в качестве мишеней очищенных протеинов. Пример 3. Определение минимального размера TN9 и замена 2'-ОН-пуринов на 2'-ОМепурины синтез аптамера ТТА 1. Методы синтеза олигонуклеотидов являются стандартными для специалистов в данной области (Green и др , Chem Biol 2(10) 685-695(1995. Мономеры 2'-фторпиримидинфосфорамидита получали от фирмы JBL Scientific(Сент-Луис Обиспо, штат Калифорния), 2'-ОМепурин, 2'-ОН-пурин , гексиламин и (СН 2 СН 2 О)6 мономеры, а также твердую подложку из dTполистирола получали от фирмы Glen Research(Стерлинг, штата Виргиния). Аффинность аптамеров оценивали на основе распределения на нитроцеллюлозном фильтре (Green и др., выше).TN9 выбран для дополнительного анализа на основе его высокой аффинности к тенасцинуС. Сначала определяли минимальный размер последовательности, необходимый для высокоаффинного связывания, с помощью стандартных методов (Green и др., выше) установлено,что нуклеотиды, расположенные от 3'-конца до нуклеотида 55, необходимы для связывания с тенасцином-С, при этом ни один нуклеотид не может быть удален с 5'-конца без потери аффинности. Для дополнительного уменьшения длины TN9 до менее чем 55 нуклеотидов с сохранением высокоаффинного связывания была предпринята попытка определить внутренние делеции TN9. Данные о первых 55 нуклеотидахTN9 наряду с данными о первых 55 нуклеотидах лигандов TN7, TN21 и TN41 из родственного семейства II вводили в компьютерную программу для определения возможной двухмерной укладки РНК (mfold 3.0, можно получить по адресу http://www.ibc.wustl.edu/zuker/.M.Zuker,D.H.Mathews и D.H.Turner. Algorithms andPublishers (1999. Среди многих возможных укладок РНК, предсказанных с помощью алгоритма, была обнаружена структура, общая для всех олигонуклеотидов. Эта структура, представленная олигонуклеотидом ТТА 1 на фиг. 2,содержит три стебля, которые сходятся в одном стыке, так называемом трехстеблевом стыке. 25 Эта укладка приводит к тому, что наиболее консервативные нуклеотиды из семейства II олигонуклеотидов находятся в зоне стыка. При сравнении TN9, TN7, TN21 и TN41 оказалось, что второй стебель является вариабельным по длине и последовательности, что позволяет предположить, что удлинение второго стебля не требуется для связывания с тенасцином-С. При апробации этой гипотезы на TN9, было установлено,что нуклеотиды 10-26 можно заменять на этиленгликольный линкер (СН 2 СН 2 О)6. Линкер служит в качестве заменителя петли и снижает размер аптамера. Кроме того, состоящие из 4 нуклеотидов петли (CACU или GAGA), которые заменяют нуклеотиды 10-26, позволяют получить последовательности, обладающие высокой аффинностью по отношению к тенасцину-С. Специалисту в данной области должно быть очевидно, как определить другие нуклеотидные петли или другие спейсеры, которые могут заменять нуклеотиды 10-26, с получением последовательностей, обладающих высокой аффинностью по отношению к тенасцину-С. С целью повышения защиты от нуклеазной активности была выявлена локализация пуринов, которые можно заменять соответствующими 2'-ОМе-пуринами. Олигонуклеотиды произвольно разделяли на 5 секторов и все пурины в каждом секторе заменяли соответствующим 2'ОМе-пуриновым нуклеотидом, всего использовали 5 олигонуклеотидов (табл. 4, стадия I синтеза). Определяли аффинность каждого олигонуклеотида по отношению к тенасцину-С, при этом было установлено, что все пурины в секторах 1, 3 и 5 можно заменять без заметной потери аффинности. Затем индивидуальные пурины в секторах 2 и 4 заменяли 2'-ОМе-пуринами и оценивали воздействие на аффинность (табл. 4,стадия III синтеза). Из этих экспериментов установлено, что замена нуклеотидов G9, G28,G31 и G34 на 2'-OMe-G приводит к потере аффинности по отношению к тенасцину-С. Следовательно, эти пурины должны быть сохранены в виде 2'-ОН-пуринов в аптамере ТТА 1. Затем синтезировали аптамер ТТА 1 (табл. 4) с добавлением линкера (СН 2 СН 2 О)6 (спейсер 18), 3'-3'-дТ-кэпа для защиты от экзонуклеазы,5'-гексиламина (табл. 4) и всех пуринов в виде 2'-ОМе-пуринов за исключением 5G, указанных в табл. 4. Не обладающий способностью к связыванию контрольный аптамер TTA1.NB получали путем делеции 5 нуклеотидов на 3'-конце,получая тем самым TTA1.NB. ТТА 1 связывается с тенасцином-С, при этом константа равновесия диссоциации (Kd) составляет 5 нМ, в то время как для ТТА 1. NB Kd для тенасцин-С 5 мкМ. Нуклеотиды 1-26 можно заменять ненуклеотидным этиленгликольным линкером. Отсюда можно предположить, что ТТА 1 можно синтезировать в виде двух отдельных фрагментов,для этого интродуцируют разрыв в положении этиленгликольного линкера и интродуцируют 26 новые 5'- и 3'-концы. После синтеза две молекулы инкубируют вместе, позволяя образоваться гибриду. Этот метод позволяет интродуцировать дополнительные аминогруппы, а также нуклеотиды на новые 5'- и 3'-концы. Эти новые функционально активные молекулы можно использовать для биоконъюгации. Кроме того,синтез с использованием двух фрагментов позволяет повысить выход химического синтеза из-за укорочения длины молекул. Пример 4. Биораспределение меченных с помощью TC-99m аптамеров в организме несущих опухоль мышей. Биораспределение аптамеров оценивали путем конъюгации хелатора Тс-99m (Hi15, Hilger и др., Tet. Lett. 39:9403-9406 (1998 с 5'-концом олигонуклеотида, как показано на фиг. 2, и радиоактивного мечения аптамера с помощью Tс 99m. Аптамер в виде меченного с помощью Tс 99m аптамера приведен на фиг. 10. ТТА 1 и ТТА 1 NB конъюгировали с Hi15 в концентрации аптамера 50 мг/мл в 30%-ном диметилформамиде с 5 молярными эквивалентами Нi15-Nгидроксисукцинимида, забуференного в 100 мМ натрий-борате, рН 9,3, в течение 30 мин при комнатной температуре. Аптамер в виде меченного с помощью Tс-99m аптамера приведен на фиг. 10. После очистки с помощью ЖХВР с обращенной фазой получали Hi15-TTA1 и Hi15TTA1.NB. Затем олигонуклеотиды метили с помощью Тс-99m следующим образом к 1 нмолю Нi15-аптамера добавляли 200 мкл 100 мМ натрий-фосфатного буфера, рН 8,5, 23 мг/мл тартрата натрия и 50 мкл пертехнетата Тс-99m(5,0 мКи), элюированного из колонки Мо-99(фирма Syncor, Денвер) за 12 ч до применения. Реакцию мечения инициировали, добавляя 10 мкл раствора SnCl2 с концентрацией 5 мг/мл. Реакционную смесь инкубировали в течение 15 мин при 90 С. Реакционную смесь отделяли от непрореагировавшего Тс-99m путем спиндиализа через мембрану с предельным размером пропускаемой молекулярной массы 30000 Да(тип Centrex, фирма SchleicherScheull) с двумя 300-микролитровыми промывками. Этот протокол мечения обеспечивает введение 3050% Тс-99m, что позволяет получить удельную активность 2-3 мКи/нмоль РНК Тс-99m связывается через 5'G, что видно на фиг. 5. Для экспериментов по биораспределению получали ксентрансплантаты опухолей линииU251 следующим образом: клетки линии U251 культивировали в модифицированной по методу Дульбекко среде Игла, дополненной 10 об.% фетальной телячьей сыворотки (фирма GibcoBRL, Геттисберг, Мэриленд). Бестимусным мышам (фирма Harlan Sprague Dawley, Индианаполис, штат Иллинойс) инъецировали подкожно 1x106 клеток линии U251. Когда опухоли достигали размера, соответствующего 200-300 мг (1-2 недели), вводили путем внутривенной инъекции меченный с помощью TC-99m апта 27 мер из расчета 3,25 мг/кг. В указанное время животных анестезировали с помощью изофлурана (фирма Fort Dodge Animal Health, ФортДодж, штат Айова), брали образцы крови с помощью сердечной пункции и животных умерщвляли и брали образцы ткани. Уровни Тс-99m оценивали с помощью счетчика гамма-лучей(фирма Wallac Oy, Турку, Финляндия). Поглощение аптамера тканями оценивали в виде процента от инъецируемой дозы на г ткани (% ИД/г). Изображения мышей получали с помощью рентгеновской камеры. Мышей помещали в камеру (фирма Siemens, LEM+) под анестезиейMAC, версия 3.22.2 (фирма Scientific Imaging,штат Калифорния) с использованием компьютера типа Power MAC G3 (фирма Apple Computer,штат Калифорния). Приведенные в табл. 5 данные экспериментов по биораспределению свидетельствуют о быстром и специфическом поглощении аптамера тканью опухоли, несвязанный аптамер не сохранялся в опухоли. Уровни Tc-99m в крови также быстро снижались. При использованииHi15-TTA1 через 3 ч время полужизни Тс-99m в опухоли оказалось очень продолжительным(18 ч). Это свидетельствует о том, что после проникновения аптамера в опухоль радиоактивная метка сохраняется в опухоли в течение продолжительных периодов времени. Эти данные свидетельствует о том, что цитотоксические агенты, включая радионуклиды и нерадиоактивные агенты, конъюгированные с аптамером,также должны сохраняться в опухоли и иметь длинные периоды полужизни. Радиоактивность Тс-99m также присутствует в других тканях, особенно в тонкой и толстой кишке. Специалисты в данной области могут легко изменить установленную схему гепатобилиарного клиренса, например, изменяя гидрофильность хелатора Тс-99m, изменяя хелатор или изменяя всю пару радиоактивный металл/хелатор. Изображение всего животного получали через 3 ч после инъекции меченного с помощьюTc-99m Hi15-TTA1. На изображениях мышей,которым инъецировали Hi15-TTA1, в отличие от мышей, которым инъецировали Hi15-TTA1.NB,были ясно видны опухоли (фиг. 3). Дополнительная радиоактивность выявлена в желудочно-кишечном тракте, как это и было предсказано с помощью экспериментов по биораспределению. Пример 5. Применение флуоресцентномеченного ТТА 1 для локализации тенасцина-С в ткани опухоли. Материалы и методы. ТТА 1 и TTA1.NB синтезировали согласно описанному выше методу. СукцинимидилRhodamine-Red-X (фирма Molecular Probes, 004795Eugene, штат Орегон) конъюгировали с 5'амином аптамеров согласно методу, описанному для конъюгации Hi15-NHS. Конъюгированные сTTA1.NB-Red, очищали с помощью ЖХВР с обращенной фазой. Культивирование клеток линии U251 и выращивание опухоли в бестимусных мышах осуществляли согласно описанному выше методу. Бестимусным мышам вводили с помощью внутривенной инъекции 5 нМTTA1-Red или TTA1.NB-Red и через требуемый промежуток времени мышей подвергали анестезии, осуществляли перфузию 0,9%-ным NaCl и умерщвляли. Опухоль вырезали и помещали в формалин. После выдерживания в течение 24 ч в формалине делали среды толщиной 10 мкм иRhodamine-Red-X выявляли с помощью флуоресцентного микроскопа (типа Eclipse T800,фирма Nikon, Япония). Результаты: Аффинность к тенасцину-СTTA1-Red оказалась идентичной с аффинностью неконъюгированного родительского аптамера ТТА 1 и составляла 5 нМ. Было проведено сравнение уровней флуоресценции TTA1-Red или TTA1.NB-Red в опухолях через 10 мин после инъекции. Обладающий способностью к связыванию аптамер TTA1-Red вызывал выраженное окрашивание опухоли, но не прилежащей ткани (фиг. 4). В противоположность этому при использовании TTA1.NB-Red обнаружена лишь самофлуоресценция ткани. Эти результаты демонстрируют возможность применения аптамера для обнаружения тенасцина-С in vivo,аналогичным образом аптамер можно использовать для окрашивания срезов тканей ex vivo. Пример 6. Обнаружение опухолей in vivo с помощью аптамера ТТА 1 (в настоящее время также обозначаемого как GS7641): дополнительные типы опухолей. Мечение аптамера, биораспределение и получение ксенотрансплантатов бестимусных мышей осуществляли согласно примеру 4. Известно, что многие типы человеческих опухолей экспрессируют тенасцин-С. Для оценки возможности TTA1/GS7641 выявлять типы опухолей помимо глиобластом выращивали линии клеток опухолей человека в виде опухолей в бестимусных мышах. Тестировали ткани опухолей в отношении человеческого тенасцина-С и те опухоли, в которых происходила экспрессия человеческого тенасцина-С, тестировали в отношении поглощения аптамера. На фиг. 6 показано поглощение аптамера некоторыми опухолями, включая глиобластому, рак молочной железы, колоректальный рак и рабдомиосаркому. Специфическое поглощение опухолью продемонстрировано путем сравнения обладающего способностью к связыванию аптамера(TTA1/GS7641) и необладающего способностью к связыванию аптамера (TTA1.NB). Следует отметить, что для KB, т.е. ксенотрансплантата,который экспрессирует мышиный, а не челове 29 ческий TN-C, не выявлено поглощение аптамера опухолью. Этот эксперимент позволяет распространить данные, полученные для глиобластомы, на другие карциномы и саркомы, а также свидетельствует о том, что все опухоли, экспрессирующие человеческий тенасцин-С, поглощают TTA1/GS7641. Пример 7. Другой вариант мечения с использованием In111. Опыты по получению ксенотрансплантатов опухолей и по биораспределению осуществляли согласно примеру 4. Для конъюгацииDTPA и DOTA с TTA1/GS7641 циклический ангидрид каждого из указанных соединений инкубировали с аминсодержащим TTA1/GS7641 при нейтральном значении рН с помощью стандартных методов. Структуры DTPA и DOTA и конъюгатов приведены на фиг. 8 и фиг. 9 соответственно, каждый из них был помечен с помощью In111. DOTA-конъюгаты имели линкеры,идентичные линкерам для DTPA. DOTA- иDTPA-конъюгаты метили с помощью In111 путем инкубации при 95 С в 0,5 М NaOAc, рН 5,5 в течение 30 мин. После удаления невключенной радиоактивной метки с помощью спин-диализа через мембрану с предельным размером пропускаемой молекулярной массы 30 кДа, радиоактивно меченный аптамер переносили в забуференный фосфатом физиологический раствор для введения путем инъекции несущим опухоль мышам. Биораспределение меченного с помощьюIn111 аптамера в значительной степени отличалось от меченной с помощью Тс композиции,описанной в примере 4. Из фиг. 7 видно, что по сравнению с меченным с помощью Тс-99mTTA1/GS7641 в кишечнике оказалась существенно ниже, при этом обнаружено увеличение поглощения печенью и почкой. Этот эксперимент свидетельствует о том, что химические свойства хелатора оказывают значительное воздействие на распределение радиоактивно меченного TTA1/GS7641 в живом организме. Схемы биораспределения, отличные от Hi15TTA1/GS7641, можно применять для введения в опухоли при определенных клинических состояниях, при котором нежелателен гепатобилиарный клиренс. Такие условия включают (но не ограничиваясь ими) радиотерапевтические применения, а также получение изображения кишечника, предстательной железы и других брюшных органов. Таблица 1. Концентрации РНК и протеина, используемые для получения лигандов к тенасцину-С с помощью SELEX. Тенасцин-С РНК Цикл(пмолей/лунку) 1 12 200 2 12 200 3 12 200 4 12 200 5 2 33 6 2 33 7 2 33 8 0,2 3,3 Таблица 2. Концентрации РНК и протеина, используемые для получения лигандов к клеткам/тенасцину-С с помощью SELEX. Тенасцин-С РНК Цикл Таблица 3. Последовательности тенасцина-С: последовательности, полученные в результате SELEXэксперимента с использованием очищенного протеина (последовательности тенасцина) и гибридного SELEX-эксперимента с использованием клеток U25 Почищенного протеина (последовательности Е 9 Р 2). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Нуклеиновая кислота-лиганд к тенасцину-С, выявленная с помощью способа, предусматривающего: а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси; б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси; в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-С. 43 2. Нуклеиновая кислота-лиганд по п.1, где перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот. 3. Нуклеиновая кислота-лиганд по п.2, где одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты. 4. Нуклеиновая кислота-лиганд по п.3, где перспективная смесь нуклеиновых кислот состоит из 2'-F-(2'-фтор)-модифицированных рибонуклеиновых кислот. 5. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд к тенасцину-С. 6. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд к тенасцину-С по п.5, где эта нуклеиновая кислота-лиганд является одноцепочечной. 7. Очищенная и выделенная не встречающаяся в естественных условиях нуклеиновая кислота-лиганд по п.6, где эта нуклеиновая кислота-лиганд представляет собой РНК. 8. Очищенная и выделенная не встречающаяся в естественных условиях РНК-лиганд по п.7, где этот лиганд представляет собой 2'-фтор(2'-F)-модифицированные нуклеотиды. 9. Очищенная и не встречающаяся в естественных условиях РНК-лиганд по п.8, где этот лиганд выбирают из группы, включающей последовательности, представленные в табл. 3 и 4 и на фиг. 2. 10. Способ идентификации нуклеиновых кислот-лигандов к тенасцину-С, предусматривающий: а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси; б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси; в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, обладающих относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-С. 11. Способ по п.10, дополнительно предусматривающий: г) повторение стадий а), б) и в). 12. Способ по п.10, где перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот. 13. Способ п.12, где одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты. 44 14. Способ по п.13, где нуклеиновые кислоты представляют собой 2'-F-(2'-фтор)модифицированные рибонуклеиновые кислоты. 15. Комплекс, применяемый для диагностики in vivo болезней, ассоциированных с экспрессией тенасцина-С, который включает нуклеиновую кислоту-лиганд тенасцина-С по пп.14 или пп.5-9 и маркер. 16. Комплекс по п.15, в котором нуклеиновую кислоту-лиганд к тенасцину-С идентифицируют с помощью способа, предусматривающего а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси; б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси; в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, которая имеет высокое содержание нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С, посредством чего можно выявлять нуклеиновые кислоты-лиганды тенасцина-С. 17. Комплекс по п.16, в котором перспективная смесь нуклеиновых кислот состоит из одноцепочечных нуклеиновых кислот. 18. Комплекс по п.17, в котором одноцепочечные нуклеиновые кислоты представляют собой рибонуклеиновые кислоты. 19. Комплекс по п.18, в котором перспективная смесь нуклеиновых кислот включает 2'F-(2'-фтор)-модифицированные рибонуклеиновые кислоты. 20. Комплекс по п.15, в котором маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин. 21. Комплекс по п.20, в котором радионуклид выбирают из группы, включающей технеций-99m (Тс-99m), Re-188, Cu-64, Cu-67, F-18,125 131 111I, I, In, 32P, 186Re. 22. Комплекс по п.21, в котором маркер представляет собой технеций-99m. 23. Комплекс по п.22, дополнительно включающий линкер. 24. Комплекс по п.23, в котором линкер имеет структуру. 25. Комплекс по п.24, где комплекс представляет собой (СН 2 СН 2 О)6-линкер все А обозначают 2'-ОМе,все G, за исключением указанных, являются 2'-ОМе-модифицированными,все С являются 2'-F-модифицированными,все U являются 2'-F-модифицированными. 26. Способ получения комплекса, включающего нуклеиновую кислоту-лиганд тенасцина-С и маркер, который предусматривает: а) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси; б) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси; в) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот, которая имеет высокое содержание нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С; и г) ковалентное связывание выявленной нуклеиновой кислоты-лиганда тенасцина-С с маркером. 27. Способ по п.26, где маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин. 28. Способ по п.27, где радионуклид выбирают из группы, включающей Tс-99m, Re-188,Cu-64, Cu-67, F-18, 125I, 13lI, 111In, 32P, 186Re. 29. Способ по п.28, где маркер представляет собой Tc-99m. 30. Способ по п.29, дополнительно включающий линкер. 31. Способ по п.30, в котором линкер имеет структуру 32. Способ по п.31, где комплекс представляет собой (СН 2 СН 2 О)6-линкер 46 33. Способ обнаружения присутствия болезни, при которой происходит экспрессия тенасцина-С в биологической ткани, которая может быть поражена болезнью, предусматривающий а) идентификацию нуклеиновой кислотылиганда в перспективной смеси нуклеиновых кислот, при этом нуклеиновая кислоты-лиганд является лигандом к тенасцину-С, что включает(I) приведение в контакт перспективной смеси нуклеиновых кислот с тенасцином-С, при этом нуклеиновые кислоты, имеющие повышенную аффинность к тенасцину-С по сравнению с другими перспективными кислотами в смеси, могут быть отделены от остальных представителей перспективной смеси;(II) отделение нуклеиновых кислот с повышенной аффинностью от остальных представителей перспективной смеси;(III) амплификацию нуклеиновых кислот с повышенной аффинностью с получением смеси нуклеиновых кислот с относительно высокой аффинностью и специфичностью в отношении связывания с тенасцином-С, посредством чего выявляют нуклеиновые кислоты-лиганды тенасцина-С;(б) присоединения маркера, который может использоваться для диагностики in vivo с помощью нуклеиновой кислоты-лиганда, выявленной на стадии (III), с получением комплекса маркер-нуклеиновая кислота-лиганд;(в) обработку ткани, которая может быть поражена болезнью, комплексом маркернуклеиновая кислота-лиганд; и г) обнаружение присутствия комплекса маркер-нуклеиновая кислота-лиганд в ткани,посредством чего выявляют болезнь, при которой происходит экспрессия тенасцина-С. 34. Способ по п.33, где нуклеиновая кислота-лиганд дополнительно включает линкер. 35. Способ по п.34, где маркер выбирают из группы, включающей радионуклиды, флуорофоры, магнитные соединения и биотин. 36. Способ по п.35, где радионуклид выбирают из группы, включающей Tс-99m, Re-188,Cu-64, Cu-67, F-18, 125I, 131I, 111In, 32P, 186Re. 37. Способ по п.36, где маркер представляет собой технеций-99m. 38. Способ по п.37, где линкер имеет структуру 39. Способ по п.38, где комплекс маркернуклеиновая кислота-лиганд представляет собой все А обозначают 2'-ОМе,все G, за исключением указанных, являются 2'-ОМе-модифицированными,все С являются 2'-F-модифицированными,все U являются 2'-F-модифицированными. 40. Способ по п.33, дополнительно предусматривающий присоединение к комплексу терапевтического или диагностического агента. 41. Способ по п.33, где болезнь выбирают из группы, включающей рак, псориаз и атеросклероз. 48 42. Способ по п.41, где болезнь представляет собой рак. 43. Способ введения терапевтического агента к месту, пораженному болезнью, при которой происходит экспрессия тенасцина-С,предусматривающий ковалентное связывание нуклеиновой кислоты-лиганда тенасцина-С с терапевтическим агентом с получением комплекса и введение комплекса пациенту.
МПК / Метки
МПК: C12P 19/34, C12Q 1/68, C07H 21/02, A61P 9/00
Метки: нуклеиновые, кислоты-лиганды, тенасцина-с
Код ссылки
<a href="https://eas.patents.su/25-4795-nukleinovye-kisloty-ligandy-tenascina-s.html" rel="bookmark" title="База патентов Евразийского Союза">Нуклеиновые кислоты-лиганды тенасцина-с</a>
Предыдущий патент: Вакцина
Следующий патент: Инфекционные клоны вируса ньюкаслской болезни, вакцины и диагностические анализы
Случайный патент: Способ изготовления трубчатого теплообменного элемента и трубчатый теплообменный элемент












