Оральная дозированная форма пропиверина
Номер патента: 8862
Опубликовано: 31.08.2007
Авторы: Плоен Ян, Гюльднер Петер, Шайтхауэр Стеффен, Памперин Дирк, Граматте Томас, Грубер Петер, Хешель Михель, Вехнер Вольфганг
Формула / Реферат
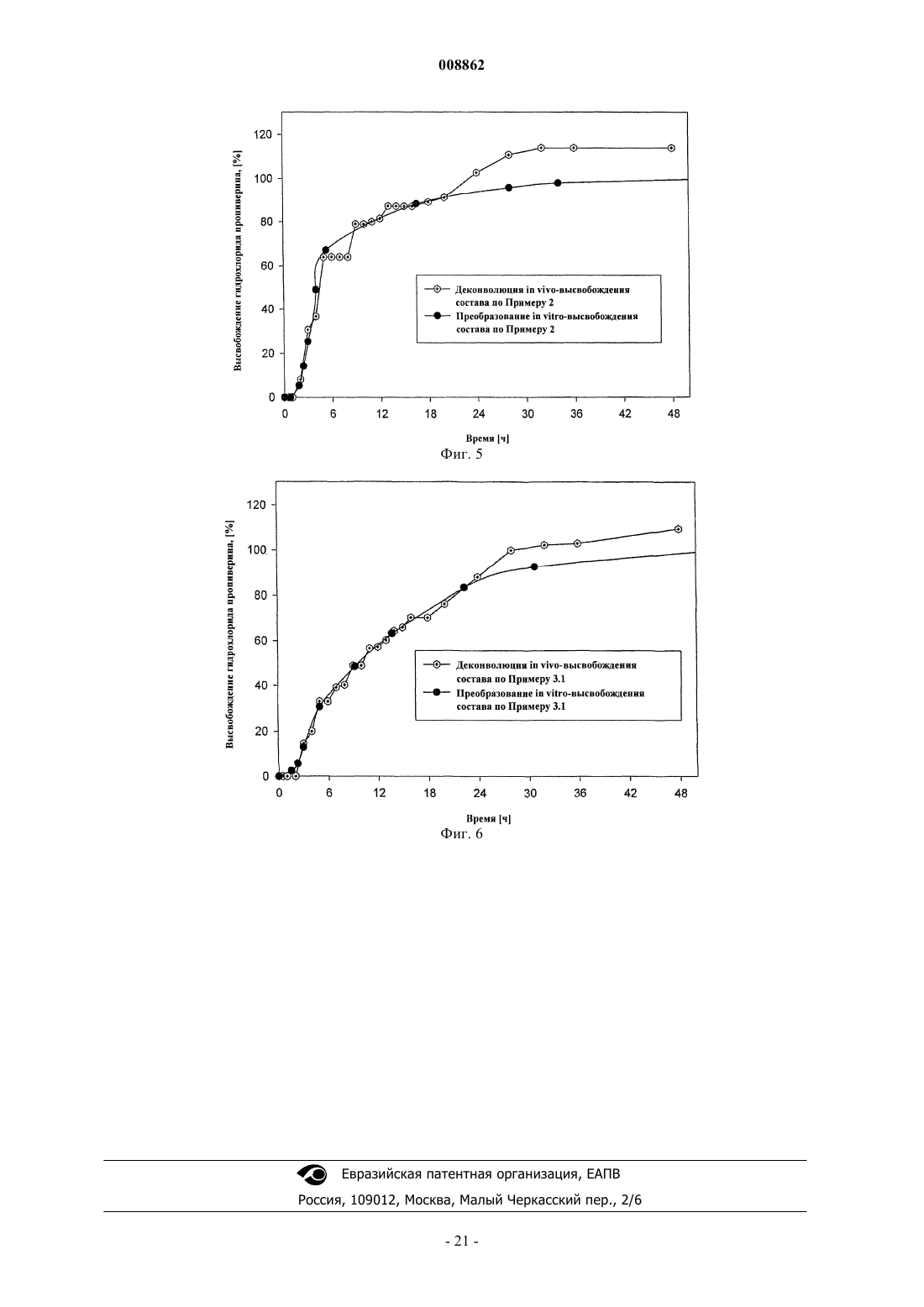
1. Фармацевтический состав для орального введения с пролонгированным высвобождением активного вещества, содержащий пропиверин в количестве от 4 до 60 мг или соответствующее эквивалентное количество соли пропиверина или их смеси, покрытые по меньшей мере одним слоем, контролирующим высвобождение, содержащим материал, задерживающий высвобождение, нерастворимый в желудочном и кишечном соке или нерастворимый в желудочном, но растворимый в кишечном соке, и/или введенные в контролирующую высвобождение матрицу, включающую способный к набуханию или нерастворимый материал, причём состав характеризуется следующим in vitro-высвобождением, определённым в 750 мл 0,1 N соляной кислоты в течение первого часа и затем определённым в 750 мл USP-буфера с рН 5,8 с применением метода Eur. Drehkцrbchen при 100 об./мин и температуре, равной 37шС:
0-20% пропиверина высвобождается через 1 ч,
10-45% пропиверина высвобождается через 3 ч,
30-60% пропиверина высвобождается через 5 ч,
40-75% пропиверина высвобождается через 7 ч,
50-80% пропиверина высвобождается через 9 ч,
60-90% пропиверина высвобождается через 12 ч.
2. Состав по п.1, отличающийся тем, что вещество, замедляющее высвобождение, и/или материал матрицы выбраны из полимеров и сополимеров, производных акриловой и/или метакриловой кислоты, EudragitТ L, EudragitТ S, EudragitТ RL, EudragitТ RS, EudragitТ E или EudragitТ NE 30D, поливинилпирролидонов, поливинилацетатов, простых эфиров целлюлозы, сложных эфиров целлюлозы, полисахаридов, альгинатов, ксантанов, поливиниловых спиртов, ацетатфталатов целлюлозы, жиров, восков, белков или шеллака.
3. Состав по одному из пп.1 или 2, отличающийся тем, что он дополнительно содержит по меньшей мере одно или более кислых веществ с величиной рKа менее 6,65, предпочтительно от 1,8 до 6,5.
4. Состав по п.3, отличающийся тем, что эквивалентное соотношение веществ между общим количеством одноосновной кислоты и пропиверина или соли пропиверина или их смеси составляет от 2:1 до 20:1, предпочтительно от 3:1 до 10:1.
5. Состав по одному из пп.3 или 4, отличающийся тем, что в качестве кислого вещества он содержит органические пищевые кислоты, такие как лимонная кислота, винная кислота, яблочная кислота, малеиновая кислота, янтарная кислота, аскорбиновая кислота, фумаровая кислота, адипиновая кислота, или фармацевтически приемлемые соли многоосновных кислот, такие как гидроцитрат натрия или калия, динатрий- или дикалий гидроцитрат, гидротартрат натрия или калия или смесь этих кислот и/или солей.
6. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде множественной дозированной формы, содержащей гранулы, зернистые или плотные частицы, причём эти частицы состоят из содержащего кислоту ядра с замедленным высвобождением, которое, в случае необходимости, содержит слой пропиверина или соли пропиверина, и, в случае необходимости, дополнительных частиц кислоты и вспомогательных веществ, и это ядро, включающее активное вещество, заключено в слой, способствующий замедлению, выполненный вообще из нерастворимых в желудочном соке и нерастворимых в кишечном соке полимеров или из комбинации нерастворимых в желудочном соке и нерастворимых в кишечном соке полимеров с нерастворимыми в желудочном соке, но растворимых в кишечном соке полимеров, и этот состав затем заключён в капсулы или саше или применяется как составная часть питьевой суспензии.
7. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде множественных доз, включающих сферические таблетки, которые получены прессованием гранул, содержащих покрытие из нерастворимого в желудочном соке, однако, нерастворимого в кишечном соке и/или растворимого в кишечном соке материала, которые состоят из сжатой смеси пропиверина или соли пропиверина, кислого вещества, сфероидизирующих средств, таких как лактоза, микрокристаллическая целлюлоза, оксипропилцеллюлоза, веществ, обеспечивающих скольжение, и средств, используемых при таблетировании, таких как поливинилпирролидон, кросповидон, причём таблетки могут дополнительно содержать покрытие из материала, способствующего замедлению.
8. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде единичных доз, включающих матричные таблетки, которые получены прессованием смеси пропиверина или соли пропиверина, в случае необходимости, одного или более кислых веществ, вспомогательных веществ, образующих матрицу и придающих замедление, таких как простые эфиры целлюлозы или сложные эфиры целлюлозы, альгинаты, ксантаны, жиры и воски, или поливиниловый спирт, и возможно снабжены покрытием из полимеров производных акриловой и/или метакриловой кислоты или простых эфиров целлюлозы, сложных эфиров целлюлозы, поливинилацетата, поливинилового спирта или шеллака.
Текст
008862 Данное изобретение касается новых оральных форм пропиверина или его фармацевтически приемлемых солей с пролонгированным высвобождением активного вещества. Пропиверин, его химическое название 1-метилпиперид-4-иловый эфир 2,2-дифенил-2-(1-пропокси)уксусной кислоты, или его фармацевтически приемлемая соль хорошо известны и применяются для лечения мочевого пузыря по гипертоническому типу (сверхактивного пузыря) (DE 2937589). Спазмолитик для мочевого пузыря - пропиверин - действует как антихолинергический агент, он расслабляет холинергически/мускаринергически раздражнную гладкую мускулатуру мочевого пузыря за счт блокады соответствующих рецепторов. Кроме того, он оказывает влияние на содержание кальция в клетках. В продаже уже давно имеется пропиверин в форме его гидрохлорида в виде быстро выделяющихся оральных форм, например Mictonorm. Используемое до сих пор введение драже Mictonorm, содержащего 15 мг пропиверингидрохлорида, например три раза в день, обеспечивает сравнительно большие флуктуирующие количества лекарства в крови с множественными пиками в течение дня. Вследствие антихолинергического действия пропиверина при быстром увеличении его уровня в крови, возникают побочные явления, такие как сухость во рту и нарушение аккомодации. Эти побочные эффекты ограничивают количество единичной дозы быстро выделяющего лекарство препарата 10-20 мг. Для достижения терапевтически эффективного количества пропиверина в крови требуется точное соблюдение интервалов прима лекарства, что вызывает проблемы, особенно, у пожилых пациентов с гипертоническими расстройствами мочевого пузыря. На основании изложенного желательно уменьшить многократную однодневную дозу до одноразовой дозы при достижении равного или улучшенного терапевтического эффекта. Для того чтобы создать подходящие оральные формы со значительно замедленным высвобождением активного вещества, обеспечивающие терапевтически эффективное количество лекарства в крови,нужно иметь в виду, что такие формы естественно должны выделять значительные количества активного вещества в дальних отделах кишечника. С точки зрения фармакокинетики общеизвестно, что скорость всасывания в значительной степени определяет количество лекарства в крови во времени и что количественная характеристика всасывания, а также период полураспада вещества в организме определяют достижение эффективного количества лекарства в крови в конце интервала дозирования, т.е. перед введением следующей дозы. Поэтому необходимыми являются достаточная скорость всасывания и достаточное количество активного вещества во всей области желудочно-кишечного тракта с е различными величинами рН. Слабоосновной пропиверин с величиной рKа 7,350,1 (вода, 25 С) должен, как известно, сравнительно плохо всасываться в желудке в протонированном виде и сравнительно хорошо всасываться в кишечнике как основание, т.е. в слабоосновной нейтральной форме. Но когда внутренняя поверхность кишечника покрыта микроскопическим тонким слоем воды, кроме кислотно-основных свойств вещества решающее значение имеют растворимость и липофильность поглощнного основания. Коэффициент распределения и растворимость гидрохлорида пропиверина, как известно, зависят от величины рН (определение содержания пропиверина в водной фазе методом ЖХВР). Коэффициент распределения гидрохлорида пропиверина (1-октанол/вода, 25 С)-1 008862 Растворимость гидрохлорида пропиверина в воде Эти физико-химические свойства гидрохлорида пропиверина оказываются, таким образом, неподходящими для получения состава замедленного действия, так как в водной среде только в кислом диапазоне, который из-за протонирования является неблагоприятным для всасывания пропиверина, достигается достаточная растворимость. Зато при рН, превышающем 6,65, в области, благоприятной для всасывания, наблюдается практически нерастворимость и липофильное основание пропиверина выпадает в осадок. Далее, из практики известно, что в случае начавшегося осаждения основания уже небольшое количество гидрохлорида пропиверина покрывается нерастворимым основанием пропиверина и дальнейший переход в соответствующее основание не происходит. Эти свойства гидрохлорида пропиверина делают получение 12- или 24-часового депо менее перспективным. По этой причине потерпели также неудачу опыты по созданию трансдермальных систем (Biol. Pharm. Bull. 1995, 18(7), 968-975). Далее, известно, что чрезвычайно сильный эффект первого прохождения пропиверина под действием монооксигеназ приводит к превращению пропиверина в нежелательную, вредную для организма Nокись пропиверина. N-окись пропиверина, содержащая четвертичный, постоянно заряженный положительный атом азота, в противоположность пропиверину очень хорошо растворяется в воде во всм интервале рН (растворимость от 127 до 99 г/л при рН 4,0-8,0) и, следовательно, хуже всасывается. Содержащиеся в кишечнике монооксигеназы окисляют содержащееся в равновесном состоянии основание пропиверина в N-окись. При этом возможно осаждение пропиверина на поверхность его водорастворимой N-окиси. Кроме того, это фармакокинетическое свойство пропиверина делает получение 24-часового депо с терапевтически эффективным количествам активного вещества в крови в дальних отделах кишечника или биоэквивалента для формы с быстрым высвобождением менее перспективным. Кроме пропиверина для лечения мочевого пузыря по гипертоническому типу обычно используют третичные амины: оксибутинин и толтеродин. Период полураспада - существенная фармакокинетическая характеристика для быстро распадающихся форм оксибутинина и толтеродина - составляет только примерно 2-3 ч, в то время как в случае пропиверина он равен примерно 15 ч. Поэтому при помощи различных методов, используемых в фармацевтике, получали оральные формы с замедленным высвобождением оксибутинина (патент США 5912268, заявки WO 9523593, WO 9612477, WO 9637202) и толтеродина (заявки WO 0012069, WO 0027369). В случае пропиверина получение такой формы кажется менее оправданным, соответственно, большой период полураспада может даже препятствовать успешному получению терапевтически приемлемого препарата. Для слабоосновных лекарственных веществ оральные формы с замедленным высвобождением активного вещества в виде единичных дозированных форм, а также множественных дозированных форм являются общеизвестными. В единичных дозированных формах с регулируемым высвобождением, например в матричных таблетках, многослойных таблетках, диффузионных таблетках, достигается дополнительный контроль диффузии, например, при помощи винной кислоты (Int. J. Pharm. 1997, 157, 181-184) или при помощи янтарной кислоты (Pharm. bid. 1991, 53, 686-690). При разжвывании такой монолитной формы, несмотря на замедление будет сразу же высвобождаться большое количество активного вещества, что в случае высокоактивного антихолинергетика может сделать безопасность лекарства довольно проблематичной. Формы с множественными дозами не имеют этих недостатков и также известны для слабоосновных лекарственных веществ (Pharm. Ind. 1989, 51, 98-101, 540-543; там же 1991, 53, 69-73, 595-600, 778-785;Arzneim.-Forsch./Drug Res. 1998, 48, 540-604). Далее технические растворы зависящих от величины рН,плохо растворимых в основной среде соединений существуют, например, в случае дипиридамола(ЕР 32562; ЕР 68191) и бромгексина (ЕР 69259). Задача данного изобретения, несмотря на недостаточно хорошие физико-химические и фармакокинетические свойства пропиверина и его солей, заключается в получении, в первую очередь, оральных форм этих активных веществ с пролонгированным высвобождением, которые независимо от величины рН всего желудочно-кишечного тракта, независимо от возможных нарушений перистальтики желудка и-2 008862 кишечника, а также сравнительно независимо от индивидуальных внутренних и внешних особенностей пациентов характеризуются в течение по меньшей мере 24 ч постоянным содержанием лекарства в крови, пригодным для клинического лечения гиперактивного мочевого пузыря при одновременном уменьшении возникновения побочных эффектов. Согласно предпочтительному варианту изобретения решение поставленной задачи состоит в том,что получают оральные формы, которые содержат пропиверин и/или его фармацевтически приемлемую соль в терапевтически эффективном количестве и которые характеризуются следующими in vitro скоростями высвобождения, измеренными в 750 мл 0,1 N НСl в течение первого часа и затем измеренными в 750 мл USP-буфера, рН 5,8, при применении метода Ph. Eur. Drehkrbchen при 100 об./мин и 37 С: 0-20% пропиверина высвобождается через 1 ч,10-45% пропиверина высвобождается через 3 ч,30-60% пропиверина высвобождается через 5 ч,40-75% пропиверина высвобождается через 7 ч,50-80% пропиверина высвобождается через 9 ч,60% пропиверина высвобождается через 12 ч,особенно предпочтительно, когда 60-90% пропиверина высвобождается через 12 ч,причм эти формы обеспечивают клинически релевантное содержание лекарства в крови в течение длительного времени, биоэквивалент препарата с быстрым высвобождением, уменьшенные побочные эффекты и, наконец, благодаря возможности введения одноразовой дозы, улучшенную переносимость пациентами. Впервые преодолены недостатки, обусловленные физико-химическими и фармакокинетическими свойствами пропиверина, и предрассудки, вытекающие из продолжительного периода полураспада, и одновременно достигнут терапевтический прогресс. Предпочтительные формы выполнения, как правило, в общем содержат 4-60 мг пропиверина, предпочтительно 9-45 мг пропиверина или эквивалентное количество его фармацевтически приемлемой соли,в данном случае кислой, с величиной рKа менее 6,65, предпочтительно равной 1,8-6,5, и оба эти компонента покрыты одним или несколькими слоями, замедляющими высвобождение, содержащими нерастворимый в желудочном соке и нерастворимый в кишечном соке и/или нерастворимый в желудочном соке и растворимый в кишечном соке материал, и/или заключены в замедляющую матрицу, которая содержит набухающий или нерастворимый материал и может содержать покрытие из нерастворимого в желудочном соке и растворимого или нерастворимого в кишечном соке материала. Оральные формы по изобретению могут быть также получены без добавления кислого вещества. Предпочтительные составы согласно данному изобретению кроме активного вещества содержат по меньшей мере одну фармацевтически приемлемую органическую или неорганическую кислоту с величиной рKа менее 6,65, особенно органические пищевые кислоты и фармацевтически приемлемые соли многоосновных кислот, например лимонной кислоты, винной кислоты, янтарной кислоты, адипиновой кислоты, аскорбиновой кислоты, фумаровой кислоты, гидротартрат натрия или калия, дигидроцитрат натрия или калия, динатрий- или дикалийгидроцитрат и т.д. или смеси этих кислот и солей в соотношении от 2:1 до 20:1, предпочтительно от 3:1 до 10:1, исходя из соотношения эквивалентных количеств одноосновной кислоты к пропиверину или соли пропиверина. Добавка кислоты при этом служит не для регулируемого при помощи рН высвобождения, а способствует независимой от величины рН растворимости пропиверина и его солей путм образования квазиионных пар пропиверина и кислоты, и тем самым обеспечивает достаточное высвобождение лекарства во всм кишечном тракте независимо от вида используемой соли пропиверина, например солей сильных кислот, таких как гидрохлорид, добавление кислоты препятствует образованию пересыщенного или концентрированного водного раствора пропиверина, который приводит к немедленному осаждению нерастворимого основания пропиверина при величине рН, превышающей 7. Кроме того, образовавшаяся ионная пара обеспечивает за счт диффузионного давления оптимальное высвобождение лекарства из частиц с замедленным высвобождением при протонировании дополнительной защиты пропиверина перед сильным N-окислением и возможно лучшей всасываемостью при физиологически установившемся равновесии между способным к всасыванию свободным основанием пропиверина и хуже всасывающейся протонированной формой, что очевидно из незначительных отклонений фармакокинетических характеристик препаративных форм по изобретению по сравнению с имеющимся в продаже препаратом быстрого действия. Материалы, свойства которых зависят или не зависят от величины рН, способствующие замедлению высвобождения, образующие плнку, образующие матрицу или используемые в системах с модифицированным высвобождением, хорошо известны специалистам и имеются в продаже, например полимеры и сополимеры эфиров акриловых и/или метакриловых кислот, такие как Eudragit, полимеры и сополимеры винилацетата и винилпирролидона, такие как Kollidon VA 64; простые и сложные эфиры целлюлозы, такие как Methocel, Aquacoat и Tylose;-3 008862 альгинаты, такие как Kelacid, Texamid; ксантаны, такие как Keltrol, Rhodigel, полисахариды или модифицированные полисахариды, такие как хитозан, гуаровая смола и гуммиарабик; поливиниловые спирты, такие как Mowiol; ацетофталат целлюлозы, такой как Aquateric; моно-, ди- и триглицериды, такие как Cutina; воски, такие как монтан-воск - НОЕСНТ, или смолы, такие как шеллак; белки и модифицированные белки. Согласно данному изобретению применение кислых вспомогательных веществ в сочетании с покрытиями, замедляющими высвобождение, и/или замедляющей высвобождение матрицей позволяют получить так называемые множественные дозированные формы, а также единичные дозированные формы. Особенно предпочтительная форма представляет собой множественную дозированную форму в виде гранул. Эти частицы согласно изобретению могут иметь диаметр ядра от 0,1 до 2,5 мм, предпочтительно от 0,6 до 1,5 мм, и могут быть непосредственно заключены в капсулы или саше или же из них вместе с вспомогательными веществами могут быть получены прессованием таблетки, причм в препарате могут содержаться эти сферические частицы одного размера или разного размера. При комбинации различных технологических стадий сначала в псевдоожиженном слое перемешивают известным способом сферические частицы кислых веществ диаметром от 0,1 до 2,0 мм, предпочтительно от 0,5 до 1,2 мм, например кристаллические частицы лимонной кислоты, винной кислоты и т.д., с суспензиями, содержащими вспомогательные вещества, такие как лактоза, растворнные кислоты, такие как лимонная кислота, связующие, такие, например, как поливинилпирролидон, и вещества, препятствующие слипанию, например тальк. Для того чтобы регулировать растворение хорошо растворимых в воде пищевых кислот или других кислых веществ, согласно данному изобретению предусмотрено нанесение покрытия, например, в псевдоожиженном слое на перемешиваемые затравки кислот. Широко используются материалы для нерастворимых в желудочном соке и зависящих от величины рН растворимых в кишечном соке мембран, такие как Eudragit S и Eudragit L. Можно также добавлять связующие или пластификаторы. Нельзя было предсказать, что в случае пропиверина или его солей такой слой покрытия для форм по изобретению будет предпочтительным. При его отсутствии обусловленная более высоким добавлением беспрепятственная диффузия лекарства, несмотря на замедление его высвобождения частицами, содержащими активное вещество, и последующее замедление этих частиц, стойких к желудочному соку, может привести к нежелательному быстрому высвобождению пропиверина и, вследствие преждевременного израсходования запаса кислоты в процессе высвобождения, к заметно снизившемуся количеству высвобожденного пропиверина(пример 7). На следующей технологической стадии известным из уровня техники методом, например в псевдоожиженном слое, на пропиверин или его соль наносят смесь из вспомогательных клеящих, связующих веществ и других компонентов из уже упомянутых кислот или кислых веществ в виде водно-спиртовой суспензии. Далее существует также возможность нанести на микронизированный активный компонент с добавкой микрокристаллических вспомогательных веществ или без не и вышеупомянутых кислот или кислых веществ порошкообразный клей после напыления замедляющих высвобождение материалов на зародыше кислоты. Добавление одинаковых или разных кислот в сравнении с кислотой, содержащейся в нанеснном покрытии, является предпочтительным для того, чтобы достичь высвобождения лекарства из первоначального раствора при буферировании проникающего через следующий замедляющий слой кишечного сока. Согласно данному изобретению для составов с замедленным и регулируемым до конца высвобождением лекарства является предпочтительным наносить на следующей технологической стадии на кислые частицы, содержащие активное вещество, один или несколько слоев, замедляющих выделение, по отдельности или в виде общей смеси с добавкой связующих и вспомогательных веществ или без этой добавки. Используемые согласно изобретению нерастворимые в желудочном соке, не зависящие от величины рН нерастворимые в кишечном соке материалы, обладающие высокой проницаемостью, и нерастворимые в желудочном соке, зависящие от величины рН растворимые в кишечном соке материалы имеются в продаже, например Eudragit RS, Eudragit RL и Eudragit S или Eudragit L. Оптимальные количества отдельных ингредиентов, т.е. состав соответствующих компонентов, зависит от различных факторов, например от желательного эффекта замедления, вида отдельных компонентов, вызывающих замедление, с их конкретной растворимостью и проницаемостью и соотношения между кислым веществом и активным веществом - пропиверином. Эти количества при этом могут меняться совершенно независимо друг от друга и имеют большое значение для достижения регулируемого-4 008862 и пролонгированного высвобождения пропиверина. При помощи осуществлнных in vitro и in vivo испытаний на основе полученных данных эти трудности можно преодолеть. При помощи найденного отношения in vitro/in vivo можно без проведения клинических и in vivo испытаний определить состав препаративной формы согласно изобретению путм простого определения in vitro скорости высвобождения. Если средние скорости высвобождения соответствуют найденным областям высвобождения, эта препаративная форма может применяться в клинике. Неожиданно было установлено, что благоприятным является, если нанесенный распылением на частицы кислоты, содержащие активное вещество, замедляющий слой не растворяется в способной к резорбции части желудочно-кишечного тракта до тех пор, пока не закончится диффузия всего активного вещества в форме его ионной пары с кислотой. Более предпочтительно, чтобы этот слой, который удерживает кислоту, находящуюся в ядре, полностью исчез до образования ионной пары пропиверина и кислоты. Если этот слой покрытия преждевременно растворится или если он не является плотным, содержащийся всегда в большом избытке кишечный сок проникает внутрь частицы и нейтрализует находящуюся там кислоту. При этом из-за незначительной растворимости пропиверина при значениях рН, характерных для кишечного сока, пропиверин практически не переходит в раствор и не диффундирует из частиц. Кислота, содержащаяся внутри частиц, снижает величину рН проникающей кишечной жидкости и затем образует соответствующую ионную пару. Затем образующийся внутри раствор ионной пары пропиверин-кислота диффундирует через мембрану в кишечнике. Поскольку здесь имеются неблагоприятные величины рН, наступает очевидное явление пересыщения, которое обеспечивает хорошую резорбцию плохо растворяющегося активного вещества. Само собой разумеется, что количество кислоты, содержащейся в частицах, в процессе высвобождения вс больше уменьшается, так что должно начаться сильное снижение количества диффундирующего вещества или высвобождающегося пропиверина. Для того чтобы помешать последнему, слой, обеспечивающий замедление, который регулирует скорость высвобождения, должен быть, предпочтительно, частично растворимым в кишечном соке. Выражение частично растворимый означает определнную проницаемость или сопротивление диффузии. Этот слой, способствующий замедлению, должен в дальнейшем дополнительно гарантировать, чтобы внутри частиц всегда был кислый рН и чтобы возможное снижение величины рН, вызванное воздействием пищевых жидкостей или других факторов, компенсировалось. Уже небольшие отклонения от величины соотношения Eudragit RS/Eudragit RL/Eudragit S приводят к сильным изменениям профиля высвобождения. Когда найденное соотношениеEudragit RS/Eudragit RL/Eudragit S изменяется от 2:1:2 до 1,5:1:2,5 (пример 9), это уменьшение количества нерастворимого в кишечном соке компонента с незначительной проницаемостью(Eudragit RS) и увеличение количества растворимого в кишечном соке компонента (Eudragit S) приводит к слишком быстрому высвобождению активного вещества или слишком быстрой диффузии кислого компонента. Этот эффект, как следует, можно объяснить следующим образом: поскольку нерастворимый в желудочном соке и растворимый в кишечном соке материал этого слоя после некоторой выдержки частиц в кишечном соке растворяется, то при соотношении Eudragit RS/Eudragit L/Eudragit S, равном 2:1:2,слишком быстрое высвобождение активного вещества в верхнем отделе кишечника подавляется, и это высвобождение происходит в среднем и дальнем отделах кишечника. Указанный слой, обеспечивающий замедление, таким образом, приводит к уменьшению особенно быстрой резорбции в верхнем отделе кишечника без уменьшения общего выделения активного вещества из частиц. Это однозначно приводит к пролонгированию высвобождения активного вещества. Общеизвестно, что для придания стойкости к желудочному соку и для достижения не слишком высокой начальной скорости высвобождения или для дальнейшей модификации характеристик высвобождения следует наносить дополнительные слои, способствующие замедлению, из нерастворимых в желудочном соке и растворимых в кишечном соке материалов, например Eudragit L или Eudragit S. Кроме того, применяемые по изобретению замедляющие слои могут содержать целевые добавки,как например пластификаторы, сшивающие агенты и средства, предотвращающие склеивание. Примерами подходящих фармакологически приемлемых мягчителей являются глицеринацетат, полиэтиленгликоль и сложный эфир лимонной кислоты, такой как триэтиловый эфир лимонной кислоты. Нанесение замедляющих слов на частицы, содержащие активное вещество, можно осуществлять известным методом, например, в быстро вращающемся резервуаре или в псевдоожиженном слое при распылении лака. Последующую сушку гранул с целью удаления содержащихся в суспензии растворителей проводят общеизвестными методами. Полученные частицы с замедленным выделением, которые могут быть в виде гранул или плотных частиц, если это желательно, заключают в капсулы или саше, предпочтительно в тврдые желатиновые капсулы. При этом можно смешать частицы с различным уровнем высвобождения и, в случае необходимости, можно добавить частицы, содержащие активное вещество, с немедленным высвобождением в качестве так называемых стартовых доз. Частицы с замедленным высвобождением можно также вместе с добавками, используемыми для получения таблеток, такими как целлюлоза, лактоза, стеарат магния и-5 008862 т.п., использовать для изготовления методом прессования таблеток. Это особенно целесообразно в случае частиц с замедленным высвобождением, имеющих диаметр до 1 мм, чтобы избежать вышеупомянутого повреждения слов, обеспечивающих замедление. Такая таблетка распадается менее чем за 1 мин, и при этом из тврдой желатиновой капсулы выделяются частицы с замедленным высвобождением пропиверина согласно изобретению. Другой предпочтительной формой осуществления изобретения в виде так называемых множественных дозированных форм являются гранулы и плотные частицы, которые кроме пропиверина или его соли содержат одно или несколько кислых веществ, которые не содержатся в замедляющей матрице, а включают только эту смесь с одним или несколькими слоями покрытия с замедленным высвобождением и затем могут быть подвергнуты прессованию с получением таблеток. Эти так называемые сферические таблетки получают путм прессования при высоком давлении пропиверина или его фармацевтически приемлемой соли в мольном соотношении, предусмотренном данным изобретением, с одним или несколькими кислыми веществами, сфероидизирующими средствами, такими как, например, лактоза, микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, смазками, такими как, например, стеарат магния, и другими вспомогательными добавками, такими как, например, поливинилпирролидон, в микрокристаллическом виде, например, с величиной частиц менее 0,25 мм, последующего повторного измельчения и, например, отбора частиц размером 0,5-1,5 мм, и повторного сжатия мелкодисперсной части, причм эти технологические стадии повторяют до тех пор, пока не получают смесь гранул нужного размера. Такие гранулы помимо вышеуказанного способа прессования могут быть получены также другими способами, например, методом экструзии/сфероидизации. В последующем на эти гранулы могут быть нанесены покрытия на основе общеизвестных нерастворимых в желудочном соке и растворимых в кишечном соке и/или нерастворимых в желудочном соке и нерастворимых в кишечном соке средств, замедляющих высвобождение, таких как, например,Eudragit NE, Eudragit L и т.п. При этом добавляются общеизвестные добавки, используемые при изготовлении таблеток, такие как микрокристаллическая целлюлоза, кросповидон, поливинилпирролидон,стеарат магния и т.п., полученная смесь тщательно перемешивается и подвергается прессованию для получения таблеток. В последующем на полученные таким образом таблетки могут быть нанесены покрытия с модифицированным высвобождением. В этом случае замедляющие высвобождение слои обеспечивают образование ионной пары пропиверин-кислота и е регулируемую диффузию. Поскольку препараты согласно данному изобретению распадаются менее чем за 5 мин, и при этом выделяются сотни частиц пропиверин-кислота с замедленным высвобождением, время распада не оказывает никакого влияния на процесс высвобождения лекарства. Помимо так называемых множественных дозированных форм на основе гранул или сферических частиц препараты пропиверина с замедленным высвобождением могут быть также получены в виде единичных дозированных форм. В частности, подходящие параметры высвобождения могут быть достигнуты с использованием замедляющих матриц, например, матричных таблеток. В случае такой формы осуществления изобретения предпочтительно также использовать вышеупомянутые кислые вещества, при этом кислое вещество, как и активное вещество, помещают в замедляющую матрицу. При этом применяются, в основном, общеупотребительные вышеупомянутые кислые вещества, полимеры, дозы и мольные соотношения кислого вещества к пропиверину. Например, при получении матричных таблеток согласно изобретению тщательно перемешивают пропиверин или его фармацевтически приемлемую соль, в данном случае, с одним или несколькими кислыми веществами в мольном соотношении по изобретению с образующими матрицу, замедляющими высвобождение добавками,такими как, например, простые эфиры целлюлозы, альгинаты, ксантаны, поливиниловые спирты, жиры,воски, и другими используемыми при изготовлении таблеток вспомогательными веществами, такими как, например, стеарат магния в микрокристаллической форме с частицами размером предпочтительно менее 0,25 мм и из полученной смеси прессуют таблетки. В случае применения пропиверина и его солей было установлено, что при этом выбор кислых веществ может быть сделан независимо от их водорастворимости. Так, например, плохо растворимая в воде адипиновая кислота и более растворимая в воде винная кислота при их применении согласно изобретению приводят к одинаковым профилям высвобождения. При контакте таких таблеток с водой в случае, например, матрицы из алкилцеллюлозы, сразу же образуется высоковязкий слой, который снижает диффузию образовавшейся ионной пары пропиверинкислота, соответствующую желательной скорости высвобождения. Кроме уже описанных препаративных форм, содержащих пропиверин, одно или несколько кислых веществ и материалы, замедляющие высвобождение, существует возможность изготовить известным способом комбинации пропиверина или его одной или нескольких фармацевтически приемлемых солей с одним или несколькими другими активными веществами, характеризующиеся замедленным высвобождением, независимо от того, содержат применяемые комбинации активных веществ кислые вещества,как в случае уже упомянутой аскорбиновой кислоты, или нет.-6 008862 Нижеследующие примеры сделают данное изобретение более понятным, не ограничивая его объм. Примеры выполнения Все величины приведены в весовых процентах (вес.%), если иное не оговаривается. Пример 1. Гранулы с гидрохлоридом пропиверина - 100%-ное высвобождение через 15 мин. Для получения сферических ядер лимонной кислоты на 3,5 кг частиц лимонной кислоты величиной 0,7-1,0 мм (Roche) при температуре окружающей среды, равной 45 С, при помощи двухкомпонентного сопла в псевдоожиженном слое наносят водно-изопропанольную суспензию, содержащую 105 г поливинилпирролидона (Kollidon K25), 35 г лимонной кислоты, 275 г лактозы (Microtose), 210 г талька, 1500 г 2-пропанола и 300 г воды, получают 4,060 кг (98,4% от теории в расчте на продукт, не содержащий растворителя) сферических гранул лимонной кислоты. На эти сферические гранулы лимонной кислоты (3,75 кг) на следующей технологической стадии аналогичным методом наносят обеспечивающую замедление водно-изопропанольную суспензию на основе 600 г Eudragit S 12,5 (соответствующего 75 г Eudragit S), 600 г Eudragit L 12,5 (соответствующего 75 г Eudragit L), 20 г триэтилцитрата, 100 г талька, 1500 г 2-пропанола и 300 г воды. Выход равен 4,013 кг (99,8% от теории в расчте на продукт, не содержащий растворителя). Для нанесения активного вещества на 3,95 г частиц лимонной кислоты, характеризующихся замедлением высвобождения, аналогичным способом распыляют при помощи двухкомпонентного сопла в псевдоожиженном слое при температуре 45 С водно-изопропанольную суспензию, содержащую 1300 г микронизированного гидрохлорида пропиверина, 280 г поливинилпирролидона (Kollidon K25), 50 г лимонной кислоты, 200 г талька, 50 г стеарата магния, 2100 г 2-пропанола и 400 г воды. Получают 5,772 кг гранул лимонной кислоты, включающих активное вещество, характеризующихся замедленным высвобождением кг (90% в расчте на не содержащий растворителей продукт). Содержание гидрохлорида пропиверина в гранулах, определнное описанным в примере 6 методом,составляет 20,9%, содержание лимонной кислоты равно 59,8%. Отсюда следует, что мольное отношение гидрохлорида пропиверина к лимонной кислоте равно 1:6,0. Из расчта на количества добавленных веществ получается мольное отношение гидрохлорида пропиверина к лимонной кислоте, равное 1:5,2. Эту разницу можно объяснить потерями при распылении и истирании. Перед наполнением капсул 2000 г полученных гранул опыляют 10 г мелкодисперсного талька и перемешивают в течение 15 мин. Параметры высвобождения определяют описанным в примере 5 методом,они приведены там же в таблице. Затем гранулы сортируют и отбирают фракцию с диаметром частиц 0,7-1,25 мм (98%). 215 мг гранул, содержащих 45 мг гидрохлорида пропиверина, заключают в тврдые желатиновые капсулы и применяют для определения биодоступности (пример 13). Пример 2. Гранулы с гидрохлоридом пропиверина - примерно 50%-ное высвобождение через 3 ч. Для получения исходных сферических ядер лимонной кислоты на 3500 г гранул лимонной кислоты(Microse) и 60 г талька в среде 340 г 2-пропанола и 75 г воды. Получают 3665 г сферических гранул лимонной кислоты (99,7% от теории, в расчте на сухое вещество). На 3660 г вышеописанных гранул лимонной кислоты на следующей стадии наносят суспензию,содержащую 600 г Eudragit S 12,5 (75 г сухого Eudragit S), 600 г Eudragit L 12,5 (75 г сухогоEudragit L), 20 г триэтилцитрата и 100 г мелкодисперсного талька в 1500 г 2-пропанола и 300 г воды. Выход равен 3930 г (соответствует 100% в расчте на не содержащий растворителей продукт). На 3650 г этих гранул известным методом наносят распылением суспензию, содержащую 1000 г микронизированного гидрохлорида пропиверина, 215 г поливинилпирролидона (Kollidon K25), 40 г лимонной кислоты, 155 г тонкодисперсного талька и 40 г стеарата магния в 2100 г 2-пропанола и 310 г деминерализованной воды. Получают 5030 г гранул, содержащих активное вещество. Это соответствует выходу, равному 98,6% в расчте на сухой продукт. На 3500 г этих гранул на следующей технологической стадии наносят двухкомпонентным соплом в псевдоожиженном слое при температуре 40-45 С водно-изопропанольную суспензию 420 гEudragit RS 12,5 (соответствует 52,5 г Eudragit RS, сухого продукта), 420 г Eudragit RL 12,5 (соответствует 48,4 г Eudragit RL, сухого продукта), 560 г Eudragit S 12,5 (соответствует 75 г Eudragit S,сухого продукта), 20 г триэтилцитрата, 120 г талька, 1400 г 2-пропанола и 210 г воды, способствующую замедлению высвобождения, сушат в псевдоожиженном слое. Получают 3815 г гранул (100% от теории,в расчте на не содержащий растворителей продукт). На 2900 г гранул с замедленным высвобождением активного вещества на следующей технологической стадии при уже описанных выше условиях наносят суспензию 1392 г Eudragit L 12,5, 16 г триэтилцитрата и 105 г тонкодисперсного талька в 1135 г 2-пропанола и 380 г воды. Получают 3190 г гранул(99,8% от теории, в расчте на сухой продукт).-7 008862 Затем для придания ещ большего замедления на 2500 г гранул, уже обладающих замедленным высвобождением наносят суспензию 300 г Eudragit RL 12,5 (37,5 г сухого вещества), 4 г триэтилцитрата, 35 г тонкодисперсного талька и 96,5 г стеарата магния в 1370 г 2-пропанола и 340 г воды. Получают 2583 г гранул, т.е. выход равен 99,5% от теории, в расчте на сухое вещество. Перед наполнением капсул смешивают в течение 15 мин 2500 г гранул с 12,5 г мелкодисперсного талька и затем просеивают через сито. 2425 г (96,5%) этих гранул имеют диаметр частиц, равный 0,7-1,25 мм. Содержание гидрохлорида пропиверина, определнное описанным в примере 6 методом, составляет 13,7%. Содержание лимонной кислоты в этих гранулах, определнное описанным в примере 6 методом,составляет в данном случае 53,0%. Отсюда следует, что мольное отношение гидрохлорида пропиверина к лимонной кислоте равно 1:8,1. Исходя из количеств добавленных веществ, мольное отношение гидрохлорида пропиверина к лимонной кислоте равно 1:6,9. Эту разницу также можно объяснить потерями при распылении и истирании. Для определения биодоступности по примеру 13 328 мг гранул, что соответствует 45 мг гидрохлорида пропиверина, заключают в тврдые желатиновые капсулы. Параметры высвобождения определяют описанным в примере 5 методом, полученные данные приведены в таблице, приведнной в этом примере. Пример 3. Гранулы с гидрохлоридом пропиверина - примерно 20%-ное высвобождение через 3 ч и примерно 80% высвобождение через 10 ч. Пример 3.1. Получение в полупромышленном масштабе. Способом, описанным в примере 1, из тех же компонентов и в том же соотношении снова получают 5638 г (96,7% от теории, в расчте на продукт, не содержащий растворителей) гранул лимонной кислоты,содержащих гидрохлорид пропиверина, уже характеризующихся замедленным высвобождением. На 2900 г вышеописанных гранул с активным веществом наносят распылением суспензию 600 гEudragit S 12,5 (75 г сухого Eudragit S), 20 г триэтилцитрата и 120 г тонкодисперсного талька в 1415 г 2-пропанола и 220 г деминерализованной воды. Получают 3227 г гранул, содержащих активное вещество, с замедлением (соответствует 100% от теории, в расчте на не содержащий растворителей продукт). На 3100 г этих гранул затем наносят суспензию, включающую 868 г Eudragit S 12,5 (108,5 г сухого Eudragit S), 11 г триэтилцитрата, 65 г тонкодисперсного талька, 840 г 2-пропанола и 100 г воды. Получают 3285 г гранул, что соответствует 100% от теории, в расчте на гранулы, не содержащие растворителей. Перед наполнением капсул 3200 г полученных таким образом гранул перемешивают с 16 г мелкодисперсного талька в течение 15 мин и затем просеивают через сито. Фракция частиц величиной 0,7-1,25 мм (3120 г, что соответствует 97% от теории) характеризуется определнным экспериментально содержанием гидрохлорида пропиверина, равным 18,8%. Содержание лимонной кислоты в гранулах, определнное описанным в примере 6 методом потенциометрического титрования, составляет 50,7%. Из этого экспериментально определнного содержания следует, что мольное отношение активное вещество/лимонная кислота равно 1:5,7. Теоретическая величина этого отношения, рассчитанная, исходя из количеств добавленных компонентов, равна 1:5,2. И в данном случае эта разница объясняется потерями при распылении и истирании. 240 мг вышеописанных гранул, что соответствует 45 мг гидрохлорида пропиверина, заключают в тврдые желатиновые капсулы и применяют для определения биодоступности по примеру 13. Параметры высвобождения определяются описанным в примере 6 методом и приведены в таблице в этом примере. Пример 3.2. Получение в производственном масштабе. Для получения сферических исходных гранул лимонной кислоты на 250,0 кг гранулята лимонной кислоты (Roche) размером 0,7-1,0 мм при помощи двухкомпонентного сопла в псевдоожиженном слое наносят суспензию, содержащую 7,5 кг поливинилпирролидона (Kollidon K25), 2,5 кг лимонной кислоты, 19,6 кг лактозы и 15,0 кг тонкодисперсного талька в 89,3 кг 2-пропанола и 19,6 кг деминерализованной воды. Таким образом получают 282 кг исходных сферических гранул лимонной кислоты (95,7% от теории, в расчте на не содержащий растворителей продукт). Затем известным методом распыляют на 200 кг исходных частиц кислоты суспензию 4,0 кгEudragit S 100, 4,0 кг Eudragit L 100, 1,1 кг триэтилцитрата и 5,3 кг тонкодисперсного талька в 94,0 кг 2-пропанола и 11,0 кг деминерализованной воды. Выход равен 214 кг, что соответствует 99,8% от теории, в расчте на сухой продукт.-8 008862 Путм последующего просеивания отбирают все гранулы диаметром менее 1,25 мм. На полученные таким образом исходные частицы с замедленным высвобождением на следующей технологической стадии в два этапа наносят суспензию, содержащую всего 85,3 кг гидрохлорида пропиверина, 22,7 кг поливинилпирролидона (Kollidon K25), 8,5 кг лимонной кислоты, 11,1 кг тонкодисперсного талька, 0,802 кг стеарата магния, 165,5 кг 2-пропанола и 48,2 кг деминерализованной воды. После двух стадий выход составляет 94,8% в расчте на сухой продукт. На полученные таким образом гранулы, содержащие активное вещество, в количестве 243,0 кг наносят в псевдоожиженном слое для замедления высвобождения покрытие из суспензии, которая содержит 54,7 кг Eudragit RS 12,5 (6,7 кг Eudragit RS, сухого вещества), 27,8 кг Eudragit RL (3,4 кг сухогоEudragit RL), 6,7 кг Eudragit S 100, 1,8 кг триэтилцитрата и 10,8 кг тонкодисперсного талька в 207,3 кг 2-пропанола и 23,8 кг деминерализованной воды. Выход в расчте на не содержащие растворителей частицы с замедленным высвобождением составляет 99,2% от теории. На эти гранулы, содержащие активное вещество, в количестве 237,4 кг наносят покрытие из суспензии, содержащей 5,7 кг Eudragit S 100, 0,582 кг триэтилцитрата и 3,5 кг тонкодисперсного талька в 44,6 кг 2-пропанола и 5,4 кг деминерализованной воды. Полученные гранулы перед наполнением сушат в течение 60 ч при 70 С. Затем 13,0 кг гранул смешивают с 65 г талька в течение 10 мин и просеивают через сито с ячейками 1,25 мм. 12,8 кг полученной фракции гранул с частицами размером менее 1,25 мм характеризуются содержанием гидрохлорида пропиверина, равным 18,8% и содержанием лимонной кислоты, равным 49,8%, определение проводили методом, описанным в примере 6. Мольное отношение активного вещества к лимонной кислоте составляет 1:5,6. В тврдую желатиновую капсулу заключают 240 мг полученных гранул, что соответствует 45 мг гидрохлорида пропиверина, и используют такие капсулы для определения биодоступности по примеру 14. Высвобождение пропиверина из гранул изучают при описанных в примере 5 условиях. Результаты приведены в таблице. Пример 4. Гранулы с пропиверином. Как описано в примере 3.2, получают 2400 г сферических частиц лимонной кислоты, на которые в псевдоожиженном слое при температуре 40-75 С наносят суспензию, включающую 48 г Eudragit S 100,48 г Eudragit L 100, 13 г триэтилцитрата, 65 г тонкодисперсного талька, 1860 г изопропанола и 200 г воды. На полученные таким образом замедленные исходные частицы при тех же условиях наносят суспензию, содержащую 828 г основания пропиверина, 177 г поливинилпирролидона (Kollidon K25), 63 г лимонной кислоты, 200 г тонкодисперсного талька и 32 г стеарата магния в 3100 г 2-пропанола и 400 г воды. Получают 3740 г гранул, включающих активное вещество, что соответствует 98,4% от теории в расчте на сухой продукт. На эти гранулы, содержащие активное вещество (3250 г) известным способом наносят суспензию,включающую 720 г Eudragit RS 12,5 (90 г сухого Eudragit RS), 368 г Eudragit RL 12,5 (46 г сухогоEudragit RL), 90 г Eudragit S 100, 24 г триэтилцитрата и 146 г тонкодисперсного талька в 1930 г 2 пропанола и 300 г деминерализованной воды. На полученные таким образом гранулы (3500 г) с замедленным высвобождением, содержащие активное вещество, распыляют в тех же условиях в псевдоожиженном слое суспензию, содержащую 86 г Eudragit S 100, 9 г триэтилцитрата, 52 г тонкодисперсного талька, 129,9 г 2-пропанола и 80 г воды. Содержание гидрохлорида пропиверина в полученных таким образом гранулах, определнное описанным в примере 6 методом, равно 19,4%, содержание лимонной кислоты - 40,4%. Из этого следует, что мольное отношение активного вещества к лимонной кислоте равно 1:4,0. Параметры высвобождения пропиверина из гранул определяют методом, описанным в примере 5,эти параметры приведены в таблице в этом примере. Пример 5. Определение скорости высвобождения - сравнение этих величин для гранул по примерам 1-4, 7-13. Определение высвобождения гидрохлорида пропиверина или пропиверина из всех описанных оральных препаративных форм осуществляют при помощи описанного в Ph. Eur. 3, 2.93 прибораDrechkrbchen при 100 об./мин в течение 17 ч. Для этого определнное количество гранул, соответствующее 45 мг гидрохлорида пропиверина,помещают в шесть ротационных перфорированных сосудов. Высвобождение начинается через 1 ч выдержки в 750 мл желудочного сока (0,1 М раствор соляной кислоты) при 37 С. После измерения параметра через 1 ч эту среду удаляют и продолжают исследование высвобождения 750 мл буфера - дигирофосфата калия с рН 5,8 при 37 С ещ в течение 16 ч. Количественное определение гидрохлорида пропиверина или пропиверина в среде, где происходит высвобождение, осуществляют с помощью одного из размещнных on-line УФ-видимый свет спектрофотометров. Для определения среду, в которой происходило высвобождение, закачивают в определнный-9 008862 момент времени из каждого сосуда, где происходило высвобождение, через полипропиленовый фильтр при помощи шестиканального насоса в проточные кюветы вышеуказанного спектрофотометра. Измерение экстинкции осуществляют при 239 нм, при этом в качестве фона дополнительно определяют экстинкцию при 277 нм. Для расчта содержания гидрохлорида пропиверина/пропиверина величину экстинкции при фоновой длине волны вычитают из величины экстинкции при длине волны измерения. Определение величины высвободившегося лекарства проводят по отношению к пробе эталонного вещества, которое в тех же условиях помещают в УФ-видимый свет спектрофотометр. Количество гидрохлорида пропиверина или пропиверина, которое высвободилось в течение первого часа в 0,1 М растворе соляной кислоты, прибавляется к последующим величинам высвобождения. Полученные величины высвобождения (среднее значение шести определений) приведены в табл. 1 и 2. Таблица 1 Высвобождение гидрохлорида пропиверина/пропиверина в процентах - примеры 1-4- 10008862 Пример 6. Определение количества пропиверина/гидрохлорида пропиверина методом ЖХВР, количества лимонной кислоты методом потенциометрического титрования и количества 2-пропанола методом газовой хроматографии. 1. Для количественного определения содержания пропиверина/гидрохлорида пропиверина в различных препаративных формах используют метод жидкостной хроматографии высокого разрешения(ЖХВР), который позволяет отделить составные части матрицы от аналитов. Используемый метод позволяет получить хорошие результаты, так как обеспечивает селективность в отношении аналитов, линейность в данной области определения, точность результатов, что может быть показано при помощи обычных опытов. Для количественного определения содержания пропиверина/гидрохлорида пропиверина в препаративных формах, содержащих активное вещество, точно взвешенное количество мелкодисперсной препаративной формы, соответствующее 15,0 мг гидрохлорида пропиверина, помещают в мерную колбу объмом 100 мл, добавляют 50 мл метанола и одну каплю 0,1 М соляной кислоты и в течение примерно 10 мин обрабатывают ультразвуком. Затем добавляют 40 мл воды и снова обрабатывают полученную суспензию ультразвуком в течение примерно 10 мин. После охлаждения до комнатной температуры добавляют до градуировочной метки воду. Для приготовления раствора сравнения помещают точно взвешенное количество гидрохлорида пропиверина (60,0 мг) в мерную колбу объмом 100 мл, добавляют 50 мл метанола и одну каплю 0,1 М соляной кислоты и в течение примерно 10 мин обрабатывают ультразвуком. Затем добавляют 40 мл воды и снова обрабатывают полученную суспензию ультразвуком в течение примерно 10 мин. После охлаждения до комнатной температуры добавляют до градуировочной метки воду. Хроматографию проводят на промышленной установке, включающей насос, автозаборник проб,колонку и детектор с УФ и видимым светом, со скоростью истечения 1,0 мл/мин, температуре в колонке 40 С и длине волны 220 нм, при этом время прохождения составляет 5 мин, а количество отобранной пробы или раствора для сравнения - 20 мкл. В качестве неподвижной фазы применяют материал с обращнной фазой (LiCrospher 60 Select В, 5 мкм, 1254 мм, Fa. Merck), а в качестве подвижной фазы - смесь 56 об.ч. 10 мМ калийдигидрофосфатного буфера, рН 1,0 (с 85%-ной фосфорной кислотой) и 44 об.ч. ацетонитрила. Количественное определение содержания пропиверина/гидрохлорида пропиверина в пробе осуществляют дважды, используя соответствующий пик на хроматограмме раствора сравнения при той же длине волны. Результат выражают в мас.% для данной препаративной формы. 2. Количественное определение лимонной кислоты в различных препаративных формах проводят путм потенциометрического титрования первых точек эквивалентности лимонной кислоты. Применяемый метод обеспечивает специфичность, достоверность и точность, при этом было показано, что вспомогательные добавки или гидрохлорид пропиверина не искажают результаты определения. Для осуществления определения к точно взвешенным 50,0 мг мелкодисперсного образца препаративной формы добавляют 50 мл деминерализованной воды и обрабатывают в течение около 5 мин ультразвуком. Затем до появления первой точки эквивалентности титруют 0,1 М раствором едкого натра. Расход 1 мм едкого натра соответствует 6,403 мг лимонной кислоты. 3. Количественное определение 2-пропанола в гранулах проводят методом газовой хроматографии. Этот метод приводит к достоверным результатам, обеспечивая селективность к аналитам, линейность в области определения, достоверность и точность, что можно показать при помощи обычных экспериментов. Для определения содержания 2-пропанола в гранулах 100 мг каждой формы помещают в различные центрифужные пробирки и добавляют 1,0 мл диметилформамида. Затем осуществляют в течение 2 мин экстракцию под действием ультразвука, центрифугируют в течение 3 мин при скорости 10000 об./мин и сливают жидкость в пробирки. Раствор для сравнения приготавливают путм помещения 100 мг 2-пропанола в мерную колбу объмом 100 мл и заполнения е диметилформамидом до отметки 100 мл. 2,5 мл этого раствора разводят до 50 мл диметилформамидом (500 ч./млн в расчте на вес гранул в растворе образца). Хроматографию проводят с использованием промышленной установки, которая снабжена устройством для инъекции, термостатированной колонкой, а также детектором пламенной ионизации, газомносителем служит гелий. В качестве неподвижной фазы применяют, например, колонку BTR-CW длиной 10 м, внутренним диаметром 0,53 мм и толщиной плнки 1,0 мкм. Элюирование 2-пропанола проводят при скорости истечения 6 мл/мин, объме образца 1 мкл и температуре колонки, равной 60 С, в течение примерно 0,6 мин. Количественное определение содержания 2-пропанола в пробе проводят дважды в сравнении с соответствующим пиком на хроматограмме раствора сравнения. Результат выражают в мас.% для данной формы.- 11008862 Пример 7. Придание замедления сферическим частицам лимонной кислоты. Как описано в примере 1, получают 3990 г (соответствует 96,7% от теории, в расчте на материал,не содержащий растворитель) сферических частиц лимонной кислоты. Для введения активного вещества на сферические частицы лимонной кислоты (3650 г) без замедляющего эффекта при температуре 45 С при помощи двухкомпонентного сопла в псевдоожиженном слое наносят водно-изопропанольную суспензию, содержащую 1200 г гидрохлорида пропиверина, 260 г поливинилпирролидона (Kollidon K25), 45 г лимонной кислоты, 185 г талька, 45 г стеарата магния,1940 г 2-пропанола и 370 г деминерализованной воды. Получают 5250 г гранул лимонной кислоты, содержащих активное вещество, но не обладающих эффектом замедления (97,5% в расчте на материал, не содержащий растворителей). На следующей технологической стадии на содержащие активное вещество гранулы (3500 г) в псевдоожиженном слое при температуре 40-45 С при помощи двухкомпонентного сопла наносят водноизопропанольную суспензию, содержащую 720 г Eudragit RS 12,5 (90 г сухого Eudragit RS), 365 гEudragit S), 24 г триэтилцитрата и 144 г тонкодисперсного талька в 1700 г 2-пропанола и 264 г воды. Получают 3700 г гранул с замедлением. Это соответствует 95,0% от теории в расчте на сухой материал. В тех же условиях на полученные таким образом гранулы (2800 г) наносят суспензию, содержащую 781 г Eudragit S 12,5 (соответствует 98 г сухого Eudragit S), 100 г триэтилцитрата и 58,5 г тонкодисперсного талька в 760 г 2-пропанола и 90 г воды. Выход полученных гранул равен 2960 г. Это соответствует 100% от теории в расчте на гранулы, не содержащие растворителей. Перед наполнением капсул 2900 г полученных таким образом гранул смешивают с 15 г талька и затем просеивают через сито. Для фракции с частицами размером 0,7-1,25 мм (2650 г, 91% от теории) методом, описанным в примере 6, определяют содержание гидрохлорида пропиверина, оно составляет 19,0%. Содержание лимонной кислоты, определнное методом титрования, описанным в примере 6, равно 53%. Экспериментальные данные свидетельствуют, что мольное отношение активное вещество/лимонная кислота составляет 1:5,8. Высвобождение гидрохлорида пропиверина из описанных выше гранул изучают с помощью метода, описанного в примере 5. Результаты представлены в таблице в этом примере. Пример 8. Гранулы с гидрохлоридом пропиверина - мольное отношение активное вещество/лимонная кислота 1:12. Как описано в примере 1, получают 4019 г сферических частиц лимонной кислоты (что соответствует 97,4% от теории в расчте на сухое вещество). На полученные таким образом частицы (3750 г) наносят, как описано в примере 1,водно-изопропанольную суспензию, содержащую 600 г Eudragit S 12,5 (соответствует 75 г сухогоEudragit S), 600 г Eudragit L 12,5 (соответствует 75 г сухого Eudragit L), 20 г триэтилцитрата, 100 г талька, 1500 г 2-пропанола и 300 г воды, получая замедляющее высвобождение покрытие. Выход равен 4000 г, что соответствует 99,5% от теории в расчте на продукт, не содержащий растворителей. На полученные таким образом сферические частицы лимонной кислоты (3500 г) с замедленным высвобождением при помощи двухкомпонентного сопла в псевдоожиженном слое при температуре 45 С наносят водно-изопропанольную суспензию, содержащую 575 г гидрохлорида пропиверина, 250 г поливинилпирролидона (Kollidon K25), 45 г лимонной кислоты, 175 г талька, 45 г стеарата магния, 1860 г 2 пропанола и 350 г воды. Получают 4490 г гранул, включающих активное вещество (соответствует 97,8% в расчте на материал, не содержащий растворителей). В тех же условиях на полученные гранулы (3500 г), содержащие активное вещество, наносят водноизопропанольную суспензию, содержащую 720 г Eudragit RS 12,5 (соответствует 90 г сухого EudragitRS), 365 г Eudragit RL 12,5 (соответствует 45 г сухого Eudragit RL), 720 г Eudragit S 12,5 (соответствует 90 г сухого Eudragit S), 24 г триэтилцитрата и 144 г тонкодисперсного талька в 1700 г 2-пропанола и 264 г воды (деминерализованной). Получают 3894 г гранул с замедленным высвобождением, содержащие активное вещество. Это соответствует 100% от теории в расчте на сухое вещество. Затем на полученные таким образом гранулы (3100 г), характеризующиеся замедленным высвобождением, известным методом наносят суспензию, содержащую 865 г Eudragit S 12,5 (соответствует 108 г сухого Eudragit S), 110 г триэтилцитрата, 65 г талька в 840 г 2-пропанола и 100 г воды. Получают 3380 г гранул, включающих активное вещество, с двумя слоями покрытия (99,9% от теории в расчте на материал, не содержащий растворителей). Перед заполнением желатиновых капсул 3000 г полученных гранул смешивают с 15 г талька и затем просеивают. Для фракции частиц размером 0,7-1,25 мм (2750 г, что соответствует 91,7% от теории) определяют, как описано в примере 6, содержание гидрохлорида пропиверина, оно составляет 9,8%. Содержание лимонной кислоты, определнное методом титрования, как описано в примере 6, составляет 55,2%. Из этого следует, что отношение активное вещество/лимонная кислота составляет 1:11,8.- 12008862 Высвобождение гидрохлорида пропиверина из вышеописанных гранул изучают способом, описанным в примере 5. Результаты приведены в таблице в этом примере, они показывают, что высвобождение активного вещества, как в примере 3.1, сильно замедляется в первый и второй час. В дальнейшем, однако, имеется увеличенное количество лимонной кислоты, которое приводит к более высокому осмотическому давлению и тем самым к более быстрому высвобождению активного вещества. Пример 9. Гранулы с гидрохлоридом пропиверина - соотношение Eudragit SL/RL/S составляет 1,5:1:2,5. Известным способом, как описано в примере 1, получают 4000 г (что соответствует 97,0% от теории в расчте на не содержащий растворителей материал) сферических частиц лимонной кислоты. Для придания замедления на 3750 г полученных исходных частиц наносят известным методом суспензию, которая имеет тот же количественный состав, что и в примере 1. Выход частиц лимонной кислоты составляет 3980 г, что соответствует 99% в расчте на материал, не содержащий растворителей. На полученные таким образом сферические частицы лимонной кислоты при помощи двухкомпонентного сопла в псевдоожиженном слое при температуре 45 С наносят суспензию, содержащую 1100 г гидрохлорида пропиверина, 250 г поливинилпирролидона (Kollidon K25), 45 г лимонной кислоты, 175 г талька, 45 г стеарата магния, 1860 г 2-пропанола и 350 г воды. Получают 4490 г гранул, содержащих активное вещество (соответствует 97,5% в расчте на материал, не содержащий растворителей). На полученные гранулы (4000 г), включающие активное вещество, при тех же условиях наносят водно-изопропанольную суспензию, содержащую 615 г Eudragit RS 12,5 (соответствует 77 г сухого(соответствует 128 г сухого Eudragit S), 27 г триэтилцитрата и 165 г тонкодисперсного талька в 1950 г 2-пропанола и 300 г воды. Получают 4440 г гранул, содержащих активное вещество, с замедленным высвобождением. Это соответствует 99,8% от теории в расчте на сухой остаток. 3100 г полученных таким способом гранул, содержащих активное вещество, с замедленным высвобождением обрабатывают известным методом суспензией, описанной в примере 8. Таким образом, получают 3100 г гранул с покрытием (91,6% от теории в расчте на материал, не содержащий растворителей). Перед заполнением тврдых желатиновых капсул полученные гранулы, содержащих активное вещество, с покрытием смешивают с 15 г тонкодисперсного талька и просеивают. Для фракции с частицами размером 0,7-1,25 мм (2450 г, 98% от теории) определяют методом, описанным в примере 6, содержание гидрохлорида пропиверина, оно равно 18,5%. Содержание лимонной кислоты, определнное также описанным в примере 6 методом титрования, составляет 49%. Таким образом, из этого следует, что мольное отношение пропиверина к лимонной кислоте равно 1:5,6. Высвобождение гидрохлорида пропиверина из вышеописанных гранул с покрытием определяют методом, описанным в примере 5. Результаты приведены в этом примере. Пример 10. Сферические таблетки с гидрохлоридом пропиверина. Для получения таблетки из стойких к желудочному соку сферических частиц в смесителе в течение 5 мин перемешивают 1,25 кг гидрохлорида пропиверина (величина зрен меньше 0,2 мм), 2,97 кг лимонной кислоты (величина частиц меньше 0,25 мм), 0,80 кг поливинилпирролидона (Kollidon K25), 1,44 кг лактозы (Tablettose). Для разделения агломератов смесь пропускают через сито с размером отверстий 0,81 мм и снова перемешивают в течение 5 мин. Затем к этой смеси добавляют над ситом с размером ячеек 0,5 мм стеарат магния в количестве 0,05 кг и снова перемешивают всю смесь в течение 2 мин. Мольное отношение гидрохлорида пропиверина к лимонной кислоте составляет 1:5. Полученную таким образом смесь подвергают уплотнению и затем полученные частицы измельчают. Отбирают на сите фракцию с частицами размером 0,6-1,2 мм. Эту фракцию снова уплотняют, измельчают и просеивают до получения смеси частиц заданного размера. Выход равен 5,28 кг, что соответствует 81,1% от теории. На полученные гранулы (3,5 кг) при помощи двухкомпонентного сопла наносят при температуре 50 С в псевдоожиженном слое водную суспензию, содержащую 967 г Eudragit NE 30D (что соответствует 290 г сухого вещества), 467 г Eudragit L 30D (что соответствует 140 г сухого вещества), 100 г талька и 3300 г воды и затем при температуре 40 С и пониженном количестве воздуха сушат. Выход составляет 3,985 кг, что соответствует 93,8% от теории в расчте на продукт, не содержащий растворителей. 3,0 кг полученных частиц с замедленным высвобождением смешивают в смесителе в течение 20 мин с 5,0 кг микрокристаллической целлюлозы (тип 101), 0,52 кг поливинилпирролидона(Kollidon K25) и 1,0 кг кросповидона XL. Затем к этой смеси добавляют стеарат магния, просеянный через сито с отверстиями величиной 0,50 мм, и перемешивают ещ в течение 5 мин. Полученную таким образом прессовочную массу прессуют при помощи вращающегося пресса- 13008862 При помощи метода, описанного в примере 6, определяют содержание гидрохлорида пропиверина,оно равно 5,2%, содержание лимонной кислоты равно 11,8%. Отсюда следует, что мольное отношение активного вещества к лимонной кислоте равно 1:4,8. И в этом случае разницу можно объяснить потерями при истирании и нанесении покрытия на различных технологических стадиях. Высвобождение гидрохлорида пропиверина из таблеток изучают описанным в примере 5 методом. Полученные данные приведены в этом примере в таблице. Пример 11. Гельматричные таблетки гидрохлорида пропиверина и винной кислоты. Для получения стойкой к желудочному соку гельматричной таблетки с гидрохлоридом пропиверина и винной кислотой смешивают в смесителе в течение 10 мин 132,5 г винной кислоты с частицами,размер которых менее 250 мкм, 112,5 г гидрохлорида пропиверина, 187,5 г гипромеллозы (MethocelK100) и 62,5 г микрокристаллической целлюлозы. Часть смеси перетирают с 5,0 г стеарата магния и полученную смесь пропускают через сито с отверстиями размером 500 мкм. Затем перемешивают смесь ещ в течение 2 мин. Полученную таким образом прессовочную массу прессуют с применением вращающегося пресса с плунжером размером 8 мм (радиус кривизны 9 мм) в таблетки с сопротивлением разрушению, равным 50-70 Н, и отходами менее 0,5%. На полученные таблетки в псевдоожиженном слое при помощи двухкомпонентного сопла наносят суспензию, содержащую 48 г Eudragit L 12,5 (6,0 г Eudragit L в сухом состоянии), 60 мг стеарата магния, 600 мг талька и 600 мг триэтилцитрата в 40 г 2-пропанола. Получают 355 г стойких к желудочному соку гельматричных таблеток, т.е. выход равен 99,4%. Содержание гидрохлорида пропиверина, определнное описанным в примере 6 методом, равно 22,3%. Из этого следует, что мольное отношение активное вещество/винная кислота равно 1:3,2. Высвобождение гидрохлорида пропиверина из полученных гельматричных таблеток определяют методом,описанным в примере 5. Оно приведено в этом примере в таблице. Пример 12. Гельматричные таблетки с гидрохлоридом пропиверина и адипиновой кислотой. Для получения стойких к желудочному соку гельматричных таблеток с гидрохлоридом пропиверина и адипиновой кислотой в смесителе в течение 10 мин смешивают 132,5 г адипиновой кислоты с частицами, величина которых у 100% менее 250 мкм, 112,5 г гидрохлорида пропиверина, 187,5 г гипромеллозы (Methocel K100) и 62,5 г микрокристаллической целлюлозы, просеивают смесь через сито с диаметром отверстий размером 0,81 мм и снова перемешивают в течение 10 мин. Часть смеси перетирают с 5,0 г стеарата магния и полученную пасту пропускают через сито с ячейками размером 500 мкм и добавляют к оставшейся части первой смеси. Затем перемешивают снова в течение 2 мин. Полученную прессовочную массу прессуют при помощи вращающегося пресса с плунжером размером 8 мм (радиус кривизны 9 мм) с получением таблеток с сопротивлением разрушению 50-70 Н и отходов, составляющих менее 0,5%. Полученные таким образом ядра таблеток (350 г) обрабатывают с помощью двухкомпонентного сопла в псевдоожиженном слое суспензией, содержащей 48 г Eudragit L 12,5 (6,0 г сухого Eudragit L),60 мг стеарата магния, 600 мг талька и 600 мг триэтилцитрата в 40 г 2-пропанола. Получают 356 г стойких к желудочному соку гельматричных таблеток, что соответствует выходу,равному 99,6%. Содержание гидрохлорида пропиверина, определнное методом, описанным в примере 6, составляет 22,7%. Мольное отношение активное вещество/адипиновая кислота равно 1:3,2. Высвобождение гидрохлорида пропиверина из вышеописанных матричных таблеток определяли методом, описанным в примере 5, и оно приведено в имеющейся в указанном примере таблице. Пример 13. Гельматричные таблетки с гидрохлоридом пропиверина без добавки кислоты. Для получения модифицированных гельматричных таблеток без кислых веществ, содержащих гидрохлорид пропиверина, в течение 10 мин в смесителе смешивают 45 г гидрохлорида пропиверина, частицы которого имеют размер менее 0,25 мм, 247 г микрокристаллической целлюлозы (Тип 101) и 67 г гипромеллозы (Methocel K100), просеивают смесь через сито с отверстиями диаметром 0,25 мм и снова перемешивают в течение 10 мин. Часть этой смеси перетирают с 3,6 г стеарата магния и полученную пасту продавливают через сито с отверстиями размером 0,25 мм и добавляют к оставшейся части первой смеси. Затем перемешивают снова в течение 2 мин. Полученную таким образом смесь прессуют при помощи вращающегося пресса с выпускной головкой длиной 8 мм (радиус кривизны 9 мм) и выемкой на верхнем плунжере с получением ядер таблеток с сопротивлением разрушению 100-150 Н, со средней массой 244 мг и отходов, составляющих менее 0,5%. На полученные ядра таблеток (300 г) в псевдоожиженном слое при помощи двухкомпонентного сопла наносят суспензию, содержащую 40 г Eudragit L 12,5 (соответствует 5,0 г сухого Eudragit L),0,05 г стеарата магния, 0,5 г талька и 0,5 г триэтилцитрата в 60 г 2-пропанола. Получают 304 г гельматричных таблеток с покрытием, что соответствует выходу, равному 99%. Содержание гидрохлорида пропиверина, определнного методом, описанным в примере 6, равно 12,2%. Из этого следует, что одна таблетка содержит 30,3 мг гидрохлорида пропиверина. Поэтому- 14008862 в качестве эталона сравнения при определении высвобождения методом, описанным в примере 5, вместо 45 мг гидрохлорида пропиверина применяют только 30 мг. Корректировка этого содержания предусмотрена при расчте величин высвобождения. Все другие параметры высвобождения остаются без изменений. Найденные величины высвобождения в виде усредннных величин шести опытов приведены в таблице в примере 5. Пример 14. Сравнительное изучение биодоступности гранул по примерам 1, 2 и 3.1. В процессе клинического исследования сравнивались биодоступность и фармакокинетика гранул,полученных в примерах 1, 2 и 3.1. Для этого шести испытуемым давали каждому 45 мг гидрохлорида пропиверина в виде единичной дозы по схеме Cross-over-Design (перекрстного исследования). Содержание лекарства в крови определяют 25 раз с промежутками 20 мин - 12 ч, всего в течение 48 ч. Уровень пропиверина и его основного метаболита в сыворотке определяют при помощи достоверного метода ЖХВР. Для этого к 0,5 мл сильно замороженных образцов сыворотки или контрольного образца добавляют 0,5 мл фосфорной кислоты (4%) и затем экстрагируют методом адсорбционной хроматографии(картриджи Nexus, 1 мл, 30 мг). Элюат упаривают досуха и добавляют 100 мкл подвижной фазы. Хроматографию осуществляют на промышленной установке, включающей насос, автозаборник проб, колонку и диодный детектор, при скорости истечения 1,2 мл/мин, температуре колонки 40 С и длине волны детектирования 202 нм, причм время пробега составляет примерно 5 мин и количество раствора образца или раствора эталона (не содержащего сыворотки с добавкой гидрохлорида пропиверина или N-оксида пропиверина) составляло 20 мкл. Стационарной фазой служит материал с обращенной фазой (предварительная колонка: LiChocart 10x2 мм, LiChrospher 60, RP-select В, 5 мкм (Merck); разделительная колонка: LiChrospher 60-5, select В, 1252 мм (Macherey-Nagel, мобильной фазой является смесь 70 об.ч. ацетонитрила и 30 об.ч. фосфатного буфера, рН 7,3 (2 мМ дигидрофосфата калия и гидрофосфата натрия). Регистрацию и обработку данных осуществляли при помощи системы ChromeleonChromatography Data. Определнное при этих условиях содержание пропиверина составляет 99%, а содержание N-оксида пропиверина равно 95%. При повторном определении (n=5) пиковых значений в образце сыворотки (10 нг/мл пропиверина или 20 нг/мл N-оксида) установлено, что коэффициент стандартного склонения измеренных концентраций равен 6%. С учтом измеренных концентраций были построены кривые изменения концентрации вещества(содержания в крови) во времени в течение 48 ч и определена площадь под этими кривыми (площадь под кривой=AUC). Этот параметр является мерой количества пропиверина или N-оксида пропиверина, поступившего в кровь (биодоступность). Полученные при определении биодоступности величины площади под кривыми (см. таблицу) доказывают, что замедление высвобождения лекарственного вещества (примеры 2 и 3.1) не приводит к снижению биодоступности по сравнению с гранулами с немедленным высвобождением (пример 1). Следовательно, установлено, что при введении пропиверина в виде составов с замедленным высвобождением по изобретению биодоступность пропиверина в дальних отделах кишечника сохраняется. Это означает,что при высвобождении пропиверина в дальних отделах кишечника наблюдаемое в случае основных лекарственных веществ и обусловленное физико-химическими свойствами пропиверина ожидаемого снижения биодоступности не происходит. Вопреки предположению, что причиной этого могла быть не изменившаяся резорбция пропиверина в дальних отделах кишечника, неожиданно было установлено, что эта причина заключается в уменьшении превращения в N-оксид пропиверина (метаболит). Количество (AUC) образовавшегося N-оксида пропиверина или отношение метаболит/материнское вещество уменьшается с увеличением замедления(см. таблицу). Таким образом, при введении замедленных оральных препаративных форм пропиверина или его фармацевтически приемлемой соли при той же биодоступности активного пропиверина нежелательный продукт метаболизма - N-оксид пропиверина, причиняет меньший системный вред организму. Клинически предпочтительным для индивидуального безопасного дозирования можно считать неожиданно обнаруженный факт, что индивидуальное отклонение доступного количества пропиверина(AUC), выраженное в виде коэффициента отклонения (VK), очень заметно уменьшается с замедлением высвобождения (см. таблицу). Оно уменьшается с 62% для гранул с немедленным высвобождением по примеру 1 до 27% для состава с самым большим замедлением высвобождения по примеру 3.1. На фиг. 1 и 2 показаны кривые изменения концентрации пропиверина или N-оксида пропиверина во времени (содержание в крови) при введении гранул по примерам 1, 2 и 3.1, при этом показаны средние результаты, полученные у шести испытуемых. Для сравнения показано также содержание в крови при введении 3 драже (по 15 мг гидрохлорида пропиверина) промышленного препарата Mictonorm (средние величины, полученные у 34 испытуемых). Затем состав гранул по примеру 1 может служить эталоном сравнения для промышленного препарата. Содержание в крови, показанное на фиг. 1 и 2, показывает, что придание замедленного высвобождения приводит к резкому снижению скорости повышения концентрации пропиверина и N-оксида пропиверина.- 15008862 Кроме того, высота пиков концентрации уменьшается (пример 1 по сравнению с примером 2). При более сильном замедлении, как в случае состава по примеру 3.1, не наблюдаются более дискретные пики концентрации, что означает, что имеется сниженное содержание в крови наряду со сравнительно постоянными концентрациями в течение продолжительного промежутка времени без снижения биодоступности вследствие замедления. Кроме того, видно, что благодаря препаративным формам по изобретению, например форме по примеру 3.1, а также наблюдаемому соотношению in vitro/in vivo в течение 24 ч, реализуется клинически эффективное содержание в крови. Дополнительно, благодаря исчезновению пиков концентрации следует ожидать уменьшения частоты и/или тяжести антихолинергических побочных эффектов. Результаты определения биодоступности при введении гранул по примерам 1, 2 и 3.1 и в виде усредннных величин приведены в нижеследующей таблице. Биодоступность (AUC) пропиверина и N-оксида пропиверина. Пример 15. Изучение биоэквивалентности гранул по примеру 3.2 по сравнению с промышленным препаратом Mictonorm. В этом опыте сравнивали биодоступность пропиверина в промышленном препарате (Mictonorm) и в гранулах по примеру 3.2. С этой целью 12 здоровых мужчин и 12 здоровых женщин, рандомизированных по перекрстной схеме, получали в течение 7 дней 3 раза в день по драже Mictonorm (по 15 мг гидрохлорида пропиверина) или 1 раз в день гранулы по примеру 3.2 (45 мг гидрохлорида пропиверина). Смена вида препарата следовала после стадии промывки в течение 14 дней. На каждый седьмой день измеряли содержание в крови в Steady-State (стабильном состоянии) 28 раз с промежутками 30 мин - 2 ч всего в течение 24 ч. Содержание пропиверина и его основного метаболита - N-оксида пропиверина - в сыворотке определяли при помощи метода ЖХВР, описанного в примере 13. На основе определнных концентраций в условиях повторного введения (содержание в крови вSteady-State) в течение 24 ч строят кривые зависимости концентрации от времени и измеряют площадь под этими кривыми (Площадь под кривой = AUC0-24 ч, ss). Этот параметр является мерой количества пропиверина или N-оксида пропиверина, доступного в крови в течение 24 ч. Результаты (см. данные по биоэквивалентности в таблице) подтверждают также условия Steady-State (устойчивое состояние), что уже наблюдалось в примере 13, когда биодоступность пропиверина не изменяется, если он вводится в виде гранул с замедленным высвобождением. Существует биоэквивалентность между промышленным препаратом (315 мг) и составом гранул по примеру 3.2 (145 мг). Концентрации в сыворотке являются одинаковыми в течение 24 ч (см. Сср в таблице). Кроме того, при введении гранул пропиверина подтверждается ожидаемое по данным примера 13 преимущество меньшего отклонения биодоступности пропиверина в сравнении с промышленным препаратом. Коэффициент отклонения в случае AUC пропиверина для гранул равен только 15% (для промышленного препарата - 31%). Поэтому возможно индивидуальное дозирование в клинических условиях. У всех 24 испытуемых при сравнении результатов наблюдалось уменьшение AUC N-оксида пропиверина при приме гранул вместо промышленного препарата. При этом при сравнении с промышленным препаратом получается значительно меньшая средняя величина AUC после введения гранул. Кроме того, усредннная величина концентрации в сыворотке, полученная в течение 24 ч, значительно меньше (см. Сср в таблице) при введении гранул. При этом подтверждается снижение вредного действия клинически неблагоприятного продукта превращения N-оксида пропиверина при повторном введении (Steady-State). Не изменившиеся величины AUC для пропиверина и Сср при введении гранул служат доказательством того, что при замедленном высвобождении не происходит аккумуляция пропиверина со временем в смысле увеличения содержания в крови. значительно меньшая величина, чем при введении промышленного препарата Mictonorm Помимо изучения биодоступности и фармакокинетики эти исследования включали также определение побочного действия. В нижеследующей таблице приведены результаты по частоте возникновения побочных эффектов при введении пропиверина, которые распределяются по видам как достоверный,вероятный или, по меньшей мере, возможный. При применении гранул частота возникновения типичных для пропиверина антихолинергических побочных эффектов уменьшается почти на половину(нарушение аккомодации и повышенная чувствительность к свету) или на четверть (сухость во рту). Часть возникновения всех побочных эффектов уменьшается в целом примерно на одну треть. Побочное действие Пример 16. Корреляция соотношения in vitro/in vivo. Для имитирования процесса высвобождения активного вещества из различных препаративных форм осуществляют корреляцию данных, полученных при высвобождении in vitro, и данных, полученных in vivo. Если эта корреляция соотношения in vivo/in vitro может быть выявлена, тогда становится возможным прогноз процесса in vivo-высвобождения других препаративных форм на основе их in vitro поведения. Первой предпосылкой для выявления корреляции соотношения in vivo/in vitro должно быть определение того, что механизм in vitro-высвобождения для рассматриваемых препаративных форм является идентичным. Это может быть показано при помощи гомоморфных (одинаковая форма) соответствующих профилей высвобождения. Для этого определнные по примеру 5 данные in vitro-высвобождения для описанных в примере 2 и примере 3.1 гранул, содержащих гидрохлорид пропиверина, выражают по Вайбулю где M(t) - количество высвободившегося гидрохлорида пропиверина в момент времени t, с; М 0 - общее количество высвободившегося гидрохлорида пропиверина, %;- константа высвобождения, 1/ч;- фактор увеличения;- фактор сдвига функции на временной оси (время задержки), ч. Обработка кривых производилась для всех препаративных форм в отдельности и осуществлялась при помощи подходящего программного обеспечения, например, HOEGIP-PC-Software, по методу незна- 17008862 чительных квадратичных ошибок. Для математического сравнения обоих профилей in vitroвысвобождения кривые при 100% выделившегося гидрохлорида пропиверина при окончании эксперимента нормализуются. Затем временные величины согласовываются при помощи следующих линейных преобразований: или где ti,Bsp2,trans - преобразованная временная величина для количества препарата по примеру 2 в момент времени ti;ti,Bsp2 - не преобразованная временная точка для количества in vivo высвобожденного лекарства по примеру 2;Bsp2 - задержка высвобождения по примеру 2;P2 - мера высвобождения для количества препаративной формы по примеру 2. Аналогичные данные имеют место для препарата по примеру 3.1. Результаты приведены на фиг. 3 (преобразование примера 2 в пример 3.1) и 4 (преобразование примера 3.1 в пример 2). Коэффициенты корреляции для преобразования составляют 0,9997 для примера 2 в пример 3.1 и 0,99969 для преобразования примера 3.1 в пример 2. Эта величина свидетельствует о почти одинаковой форме профилей in vitro-высвобождения. Следовательно, существует предпосылка для сравнения in vivo данных с in vitro данными. На следующей стадии определнную в примере 13 среднюю величину содержания пропиверина в крови у 6-ти испытуемых после одноразового введения препаративных форм по примеру 2 или примеру 3.1 прибавляли методом деконволюции к кумулятивному профилю in vivo-высвобождения. Для этого учитывали, по мере необходимости, количество активного вещества в сыворотке в единицу времени, принимая во внимание метаболический распад активного вещества во времени. Затем полученный таким образом профиль in vitro-высвобождения пробовали превратить с помощью вышеописанных преобразований временной оси в профиль in vivo-высвобождения. На фиг. 5 и 6 представлены результаты, полученные для профилей или in vivo-, или in vitroвысвобождения для препаративных форм, соответствующих примеру 2 и примеру 3.1. Следует отметить, что кривые, полученные для обеих рассматриваемых форм, хорошо согласуются друг с другом. При этом можно указать, что профили in vivo-высвобождения для форм по примеру 2 и примеру 3.1 могут быть определены при помощи подходящих экспериментов по определению in vitroвысвобождения. При этом можно сделать выводы о характере in vivo-высвобождения на основе полученных профилей in vitro-высвобождения и предсказать их пригодность для получения клинически релевантного содержания в крови и тем самым для практического применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический состав для орального введения с пролонгированным высвобождением активного вещества, содержащий пропиверин в количестве от 4 до 60 мг или соответствующее эквивалентное количество соли пропиверина или их смеси, покрытые по меньшей мере одним слоем, контролирующим высвобождение, содержащим материал, задерживающий высвобождение, нерастворимый в желудочном и кишечном соке или нерастворимый в желудочном, но растворимый в кишечном соке, и/или введенные в контролирующую высвобождение матрицу, включающую способный к набуханию или нерастворимый материал, причм состав характеризуется следующим in vitro-высвобождением, определнным в 750 мл 0,1 N соляной кислоты в течение первого часа и затем определнным в 750 мл USP-буфера с рН 5,8 с применением метода Eur. Drehkrbchen при 100 об./мин и температуре, равной 37 С: 0-20% пропиверина высвобождается через 1 ч,10-45% пропиверина высвобождается через 3 ч,30-60% пропиверина высвобождается через 5 ч,40-75% пропиверина высвобождается через 7 ч,50-80% пропиверина высвобождается через 9 ч,60-90% пропиверина высвобождается через 12 ч. 2. Состав по п.1, отличающийся тем, что вещество, замедляющее высвобождение, и/или материал матрицы выбраны из полимеров и сополимеров, производных акриловой и/или метакриловой кислоты,Eudragit L, Eudragit S, Eudragit RL, Eudragit RS, Eudragit E или Eudragit NE 30D, поливинилпирролидонов, поливинилацетатов, простых эфиров целлюлозы, сложных эфиров целлюлозы, полисахаридов, альгинатов, ксантанов, поливиниловых спиртов, ацетатфталатов целлюлозы, жиров, восков, белков или шеллака. 3. Состав по одному из пп.1 или 2, отличающийся тем, что он дополнительно содержит по меньшей мере одно или более кислых веществ с величиной рKа менее 6,65, предпочтительно от 1,8 до 6,5. 4. Состав по п.3, отличающийся тем, что эквивалентное соотношение веществ между общим коли- 18008862 чеством одноосновной кислоты и пропиверина или соли пропиверина или их смеси составляет от 2:1 до 20:1, предпочтительно от 3:1 до 10:1. 5. Состав по одному из пп.3 или 4, отличающийся тем, что в качестве кислого вещества он содержит органические пищевые кислоты, такие как лимонная кислота, винная кислота, яблочная кислота,малеиновая кислота, янтарная кислота, аскорбиновая кислота, фумаровая кислота, адипиновая кислота,или фармацевтически приемлемые соли многоосновных кислот, такие как гидроцитрат натрия или калия,динатрий- или дикалий гидроцитрат, гидротартрат натрия или калия или смесь этих кислот и/или солей. 6. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде множественной дозированной формы, содержащей гранулы, зернистые или плотные частицы, причм эти частицы состоят из содержащего кислоту ядра с замедленным высвобождением, которое, в случае необходимости, содержит слой пропиверина или соли пропиверина, и, в случае необходимости, дополнительных частиц кислоты и вспомогательных веществ, и это ядро, включающее активное вещество, заключено в слой, способствующий замедлению, выполненный вообще из нерастворимых в желудочном соке и нерастворимых в кишечном соке полимеров или из комбинации нерастворимых в желудочном соке и нерастворимых в кишечном соке полимеров с нерастворимыми в желудочном соке, но растворимых в кишечном соке полимеров, и этот состав затем заключн в капсулы или саше или применяется как составная часть питьевой суспензии. 7. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде множественных доз,включающих сферические таблетки, которые получены прессованием гранул, содержащих покрытие из нерастворимого в желудочном соке, однако, нерастворимого в кишечном соке и/или растворимого в кишечном соке материала, которые состоят из сжатой смеси пропиверина или соли пропиверина, кислого вещества, сфероидизирующих средств, таких как лактоза, микрокристаллическая целлюлоза, оксипропилцеллюлоза, веществ, обеспечивающих скольжение, и средств, используемых при таблетировании,таких как поливинилпирролидон, кросповидон, причм таблетки могут дополнительно содержать покрытие из материала, способствующего замедлению. 8. Состав по одному из пп.1-5, отличающийся тем, что он выполнен в виде единичных доз, включающих матричные таблетки, которые получены прессованием смеси пропиверина или соли пропиверина, в случае необходимости, одного или более кислых веществ, вспомогательных веществ, образующих матрицу и придающих замедление, таких как простые эфиры целлюлозы или сложные эфиры целлюлозы, альгинаты, ксантаны, жиры и воски, или поливиниловый спирт, и возможно снабжены покрытием из полимеров производных акриловой и/или метакриловой кислоты или простых эфиров целлюлозы, сложных эфиров целлюлозы, поливинилацетата, поливинилового спирта или шеллака.
МПК / Метки
МПК: A61K 9/52, A61K 31/445, A61K 9/20, A61K 9/16, A61K 9/28, A61K 9/32, A61K 9/22, A61P 13/06
Метки: форма, дозированная, оральная, пропиверина
Код ссылки
<a href="https://eas.patents.su/22-8862-oralnaya-dozirovannaya-forma-propiverina.html" rel="bookmark" title="База патентов Евразийского Союза">Оральная дозированная форма пропиверина</a>
Предыдущий патент: Диариловые эфиры в качестве антагониста опиоидного рецептора
Следующий патент: Комбинированная терапия с использованием производных 1- аминоциклогексана и ингибиторов ацетилхолинэстеразы
Случайный патент: Способ оценки шума цифровых рентгенограмм