Замещенные производные тетрациклина, фармацевтическая композиция и способ лечения субъекта с их использованием
Номер патента: 12203
Опубликовано: 28.08.2009
Авторы: Ренни Глен, Нельсон Марк Л., Коуза Дэррелл Дж.
Формула / Реферат
1. Производное тетрациклина, замещенное в положении 9 замещенной С1-С4-алкильной группой.
2. Производное тетрациклина по п.1, представляющее собой миноциклин.
3. Производное тетрациклина по п.1, представляющее собой санциклин.
4. Производное тетрациклина по п.1, представляющее собой доксициклин.
5. Производное тетрациклина по п.1, представляющее собой тетрациклин.
6. Производное тетрациклина по п.1, представляющее собой окситетрациклин, хлортетрациклин или демеклоциклин.
7. Производное тетрациклина по п.1, представляющее собой хелокардин, ролитетрациклин или лимециклин.
8. Производное тетрациклина по п.1, представляющее собой метациклин, апициклин или кломоциклин.
9. Производное тетрациклина по п.1, представляющее собой гуамециклин, меглуциклин или мепилциклин.
10. Производное тетрациклина по п.1, представляющее собой мепилциклин, пенимепициклин или пипациклин.
11. Производное тетрациклина по п.1, представляющее собой этамоциклин или пенимоциклин.
12. Производное тетрациклина по любому из пп.1-11, в котором C1-С4-алкильная группа замещена С2-С4-алкенилом, С1-С4-алкилкарбонилом, C1-С4-алкоксикарбонилом или карбоксилом.
13. Производное миноциклина, замещенное в положении 9 С1-С4-алкильной группой, в котором указанная C1-С4-алкильная группа замещена аминогруппой.
14. Фармацевтическая композиция, содержащая производное тетрациклина, замещенное в положении 9 замещенной С1-С4-алкильной группой, и фармацевтически приемлемый носитель.
15. Фармацевтическая композиция по п.14, в которой указанное производное тетрациклина представляет собой окситетрациклин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин, хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин, кломоциклин, гуамециклин, меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин.
16. Фармацевтическая композиция по п.14, в которой указанная C1-С4-алкильная группа замещена С2-С4-алкенилом, С1-С4-алкилкарбонилом, C1-С4-алкоксикарбонилом или карбоксилом.
17. Фармацевтическая композиция по п.14, в которой указанное замещенное производное тетрациклина представляет собой миноциклин, замещенный в положении 9 аминозамещенной С1-С4-алкильной группой.
18. Способ лечения субъекта, отличающийся тем, что применяют терапевтически эффективное количество производного тетрациклина, замещенного в положении 9 замещенной С1-С4-алкильной группой.
19. Способ по п.18, отличающийся тем, что указанное производное тетрациклина представляет собой окситетрациклин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин, хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин, кломоциклин, гуамециклин, меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин.
20. Способ по п.18, отличающийся тем, что указанная С1-С4-алкильная группа замещена С2-С4-алкенилом, С1-С4-алкилкарбонилом, С1-С4-алкоксикарбонилом или карбоксилом.
21. Способ по п.18, отличающийся тем, что указанное замещенное производное тетрациклина представляет собой миноциклин, замещенный в положении 9 аминозамещенной С1-С4-алкильной группой.
22. Способ по п.18, отличающийся тем, что указанное терапевтически эффективное количество является эффективным для лечения инфекций, вызванных микроорганизмами, или сопутствующих заболеваний.
23. Способ по п.20, отличающийся тем, что указанные микроорганизмы выбраны из группы, включающей бактерии, грибы, риккетсии или паразитов.
24. Способ по п.23, отличающийся тем, что указанные бактерии являются грамположительными.
25. Способ по п.23, отличающийся тем, что указанные бактерии являются грамотрицательными.
26. Способ по п.18, отличающийся тем, что указанный субъект является млекопитающим.
27. Способ по п.26, отличающийся тем, что указанное млекопитающее является человеком.
Текст
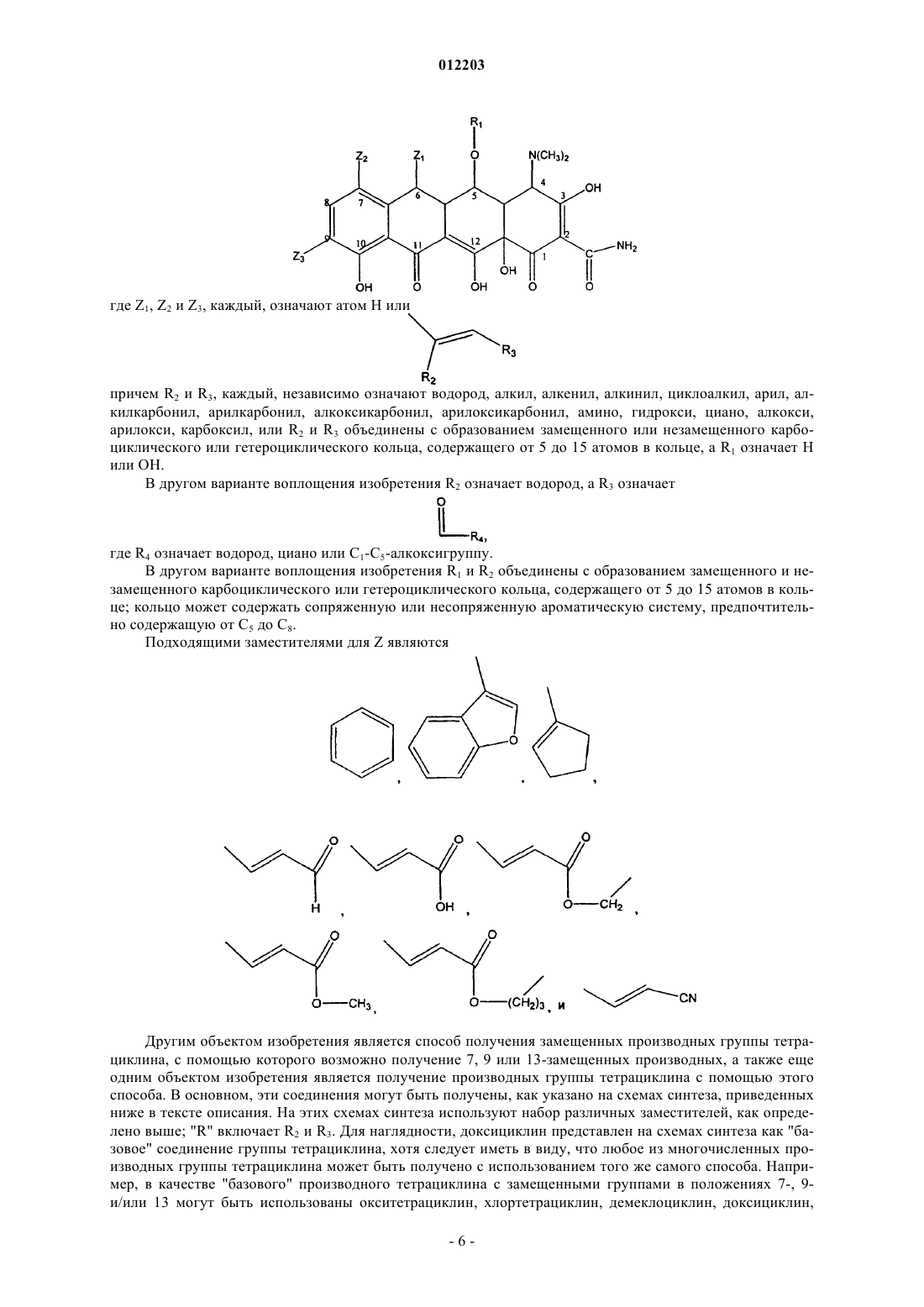
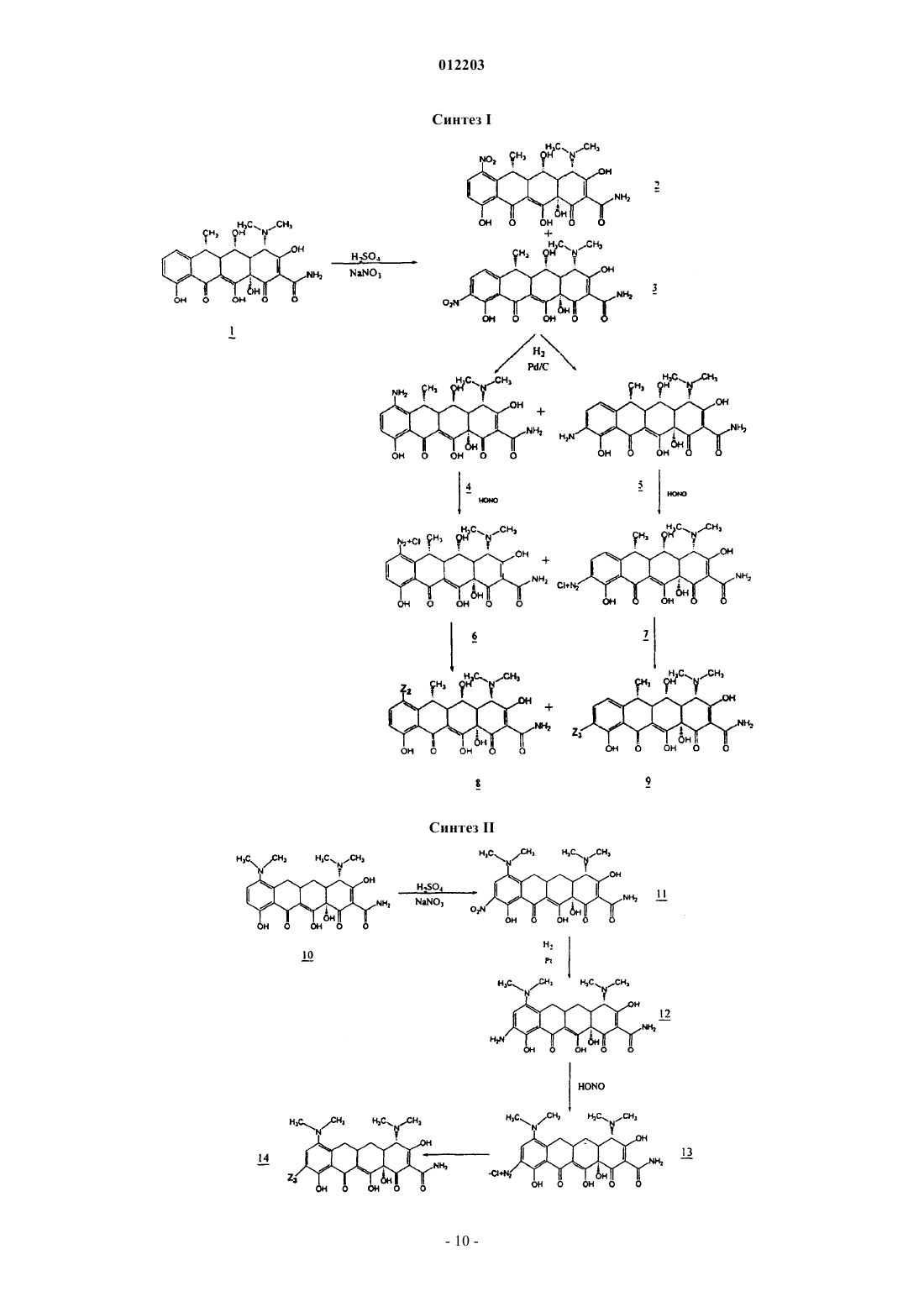
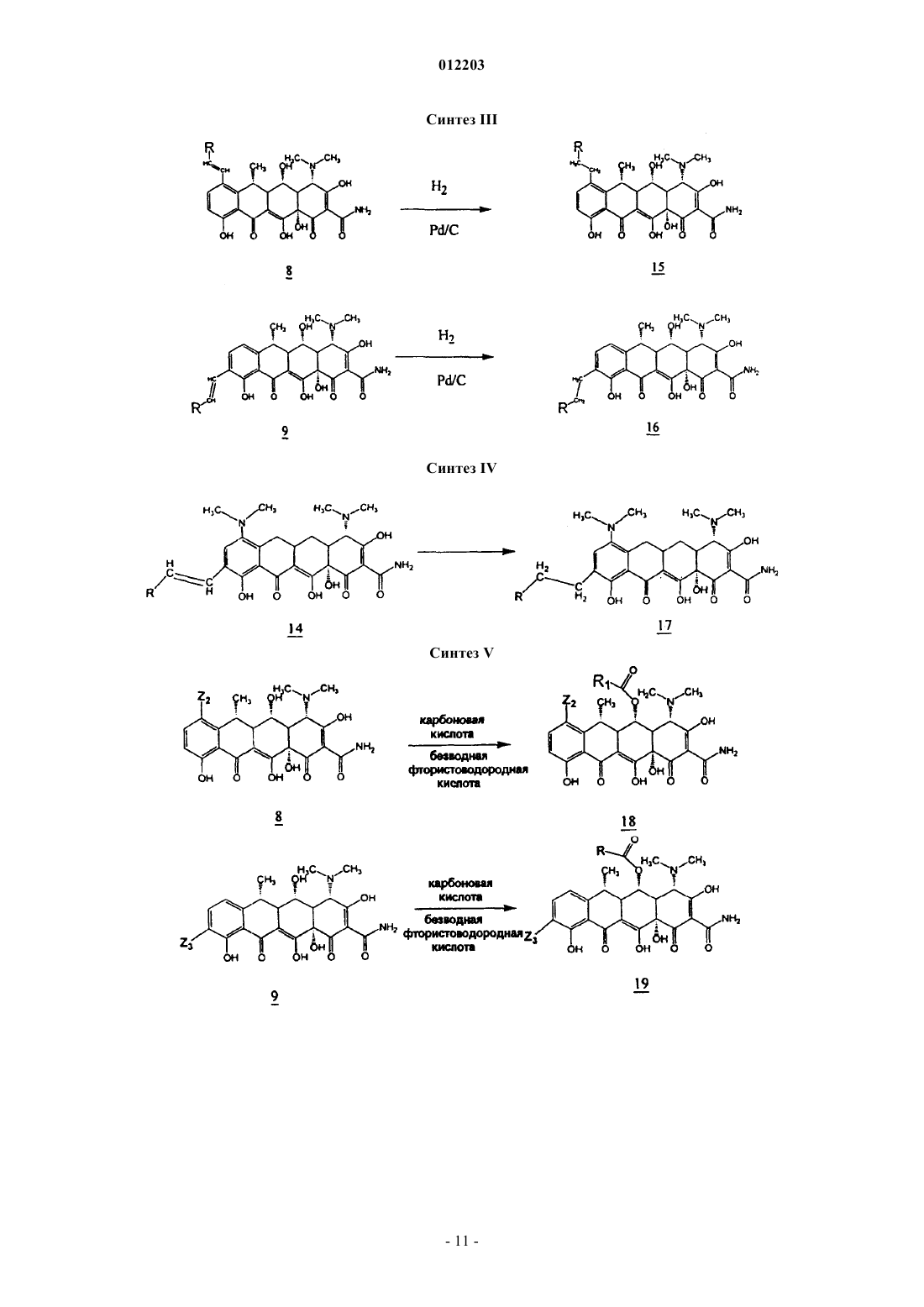
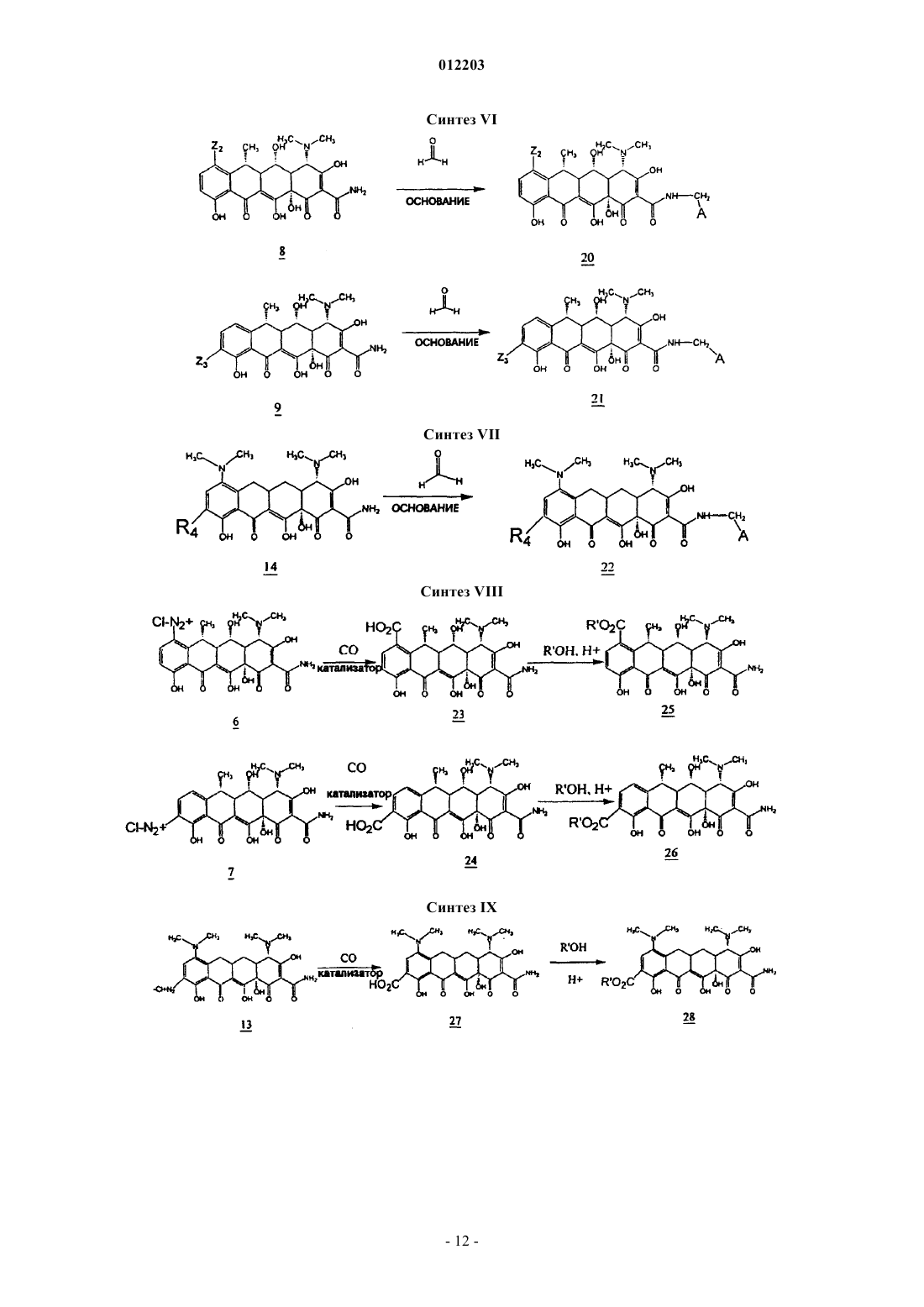
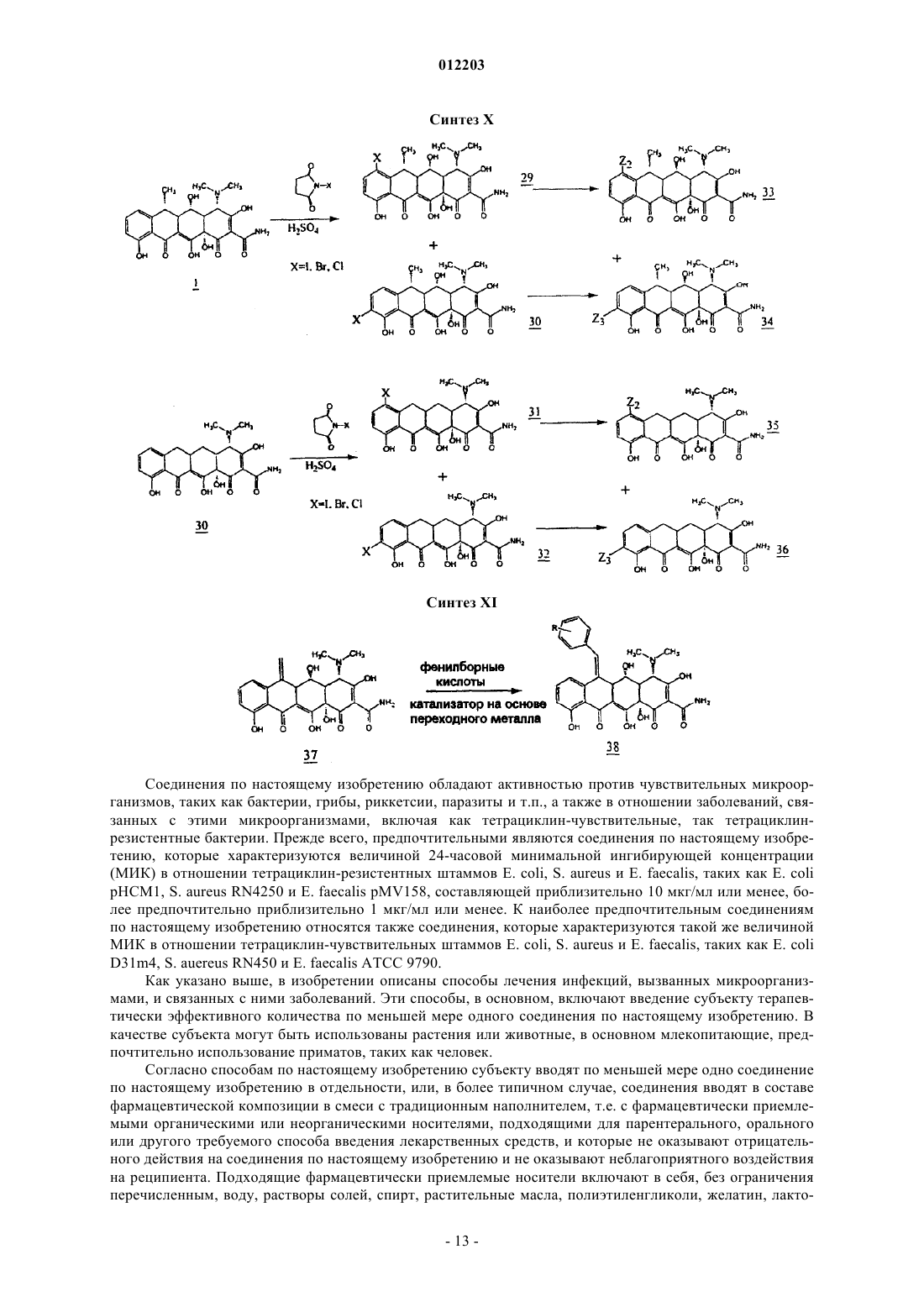
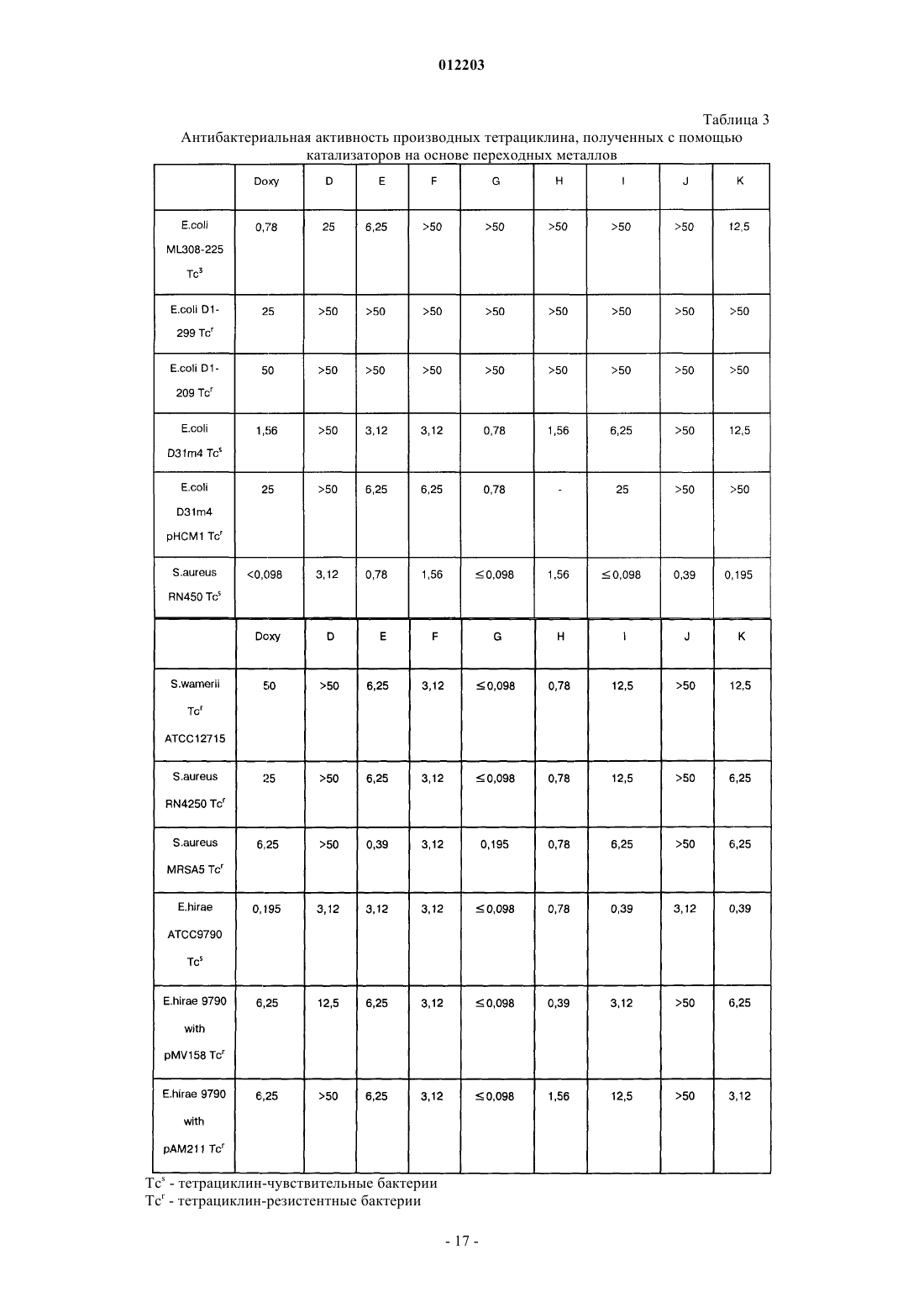
012203 Область техники, к которой относится изобретение Изобретение относится к химии антибиотиков, в частности, к производным тетрациклина, замещенным в положении 9, к фармацевтическим композициям, содержащим такие производные тетрациклина, и к способам лечения заболеваний с их использованием. Уровень техники Развитие химии антибиотиков тетрациклинового ряда является прямым результатом систематического исследования образцов почвы, собранных в разных частях света, для поиска микроорганизмов,способных производить бактерицидные и/или бактериостатические композиции. Первое из этих новых соединений под названием хлортетрациклин было введено в практику в 1948 г. Двумя годами позже был получен окситетрациклин. Подробное исследование химической структуры этих веществ подтвердило их подобие и стало аналитической основой для получения третьего представителя этой группы, тетрациклина. К 1957 г. было получено новое семейство тетрациклиновых композиций, которые отличались отсутствием ОН-группы при циклическом атоме углерода в положении 6, присутствовавшей в первых соединениях; эти данные были опубликованы в 1967 г., а миноциклины стали использоваться с 1972 г. Структурное сравнение индивидуальных веществ тетрациклинового ряда представлено в табл. 1, приведенной ниже, со ссылкой на следующую структурную формулу: Более поздние исследования были сконцентрированы как на разработке новых композиций тетрациклиновых антибиотиков, эффективных при различных условиях терапии и способах введения, так и на разработке новых аналогов тетрациклина, с аналогичной или более высокой эффективностью по сравнению с первыми соединениями тетрациклинового ряда, полученными в 1948 г. Примеры таких исследований описаны в патентах США 3957980, 3674859, 2980584, 2990331, 3062717, 3557280, 4018889,4024272, 4126680, 3454697 и 3165531. Необходимо отметить, что перечисленные патенты относятся лишь к небольшой части разносторонних исследований по поиску композиций тетрациклина и его аналогов, которые имеют фармакологическую активность. Позднее, сразу после открытия тетрациклинов и их введения в практику, было обнаружено, что независимо от их специфического состава или химической структуры, они характеризуются высокой фармакологической эффективностью по отношению к риккетсиям, ряду грамположительных и грамотрицательных бактерий, а также к агентам, вызывающим лимфогранулемные венерические заболевания,конъюнктивиты включения и орнитоз. В связи с этим, тетрациклины известны как антибиотики широкого спектра действия. После установления их антимикробной активности in vitro, эффективности действия при экспериментальных инфекционных заболеваниях и фармакологических свойств тетрациклины, как класс, стали широко использоваться для терапевтических целей. Однако широкое использование тетрациклинов для лечения как серьезных, так и легких заболеваний и расстройств привело к возникновению устойчивости к действию данных антибиотиков даже среди высокочувствительных как симбиотических,так и патогенных бактерий, например, Pneumococci и Salmonella. Увеличение числа организмов с резистентностью к тетрациклинам привело к всеобщему отказу от использования композиций тетрациклина и тетрациклиновых аналогов в качестве антибиотиков.-1 012203 Сущность изобретения Настоящее изобретение относится к замещенным производным тетрациклина, включая замещенные аналоги тетрациклина, которые обладают высокой антибактериальной активностью. В частности, изобретение касается производных тетрациклина, замещенных в положении 9 замещенной алкильной группой. Предпочтительно, если представленное производное тетрациклина выбрано из группы, включающей миноциклин, санциклин, доксициклин, тетрациклин, окситетрациклин, хлортетрациклин, демеклоциклин, хелокардин, ролитетрациклин, лимециклин, метациклин, апициклин, кломоциклин, гуамециклин, меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин. Согласно изобретению алкильная группа может быть замещена алкенилом, алкинилом, циклоалкилом, арилом, алкилкарбонилом, алкоксикарбонилом, гидрокси, циано, арилокси, карбоксилом, арилоксикарбонилом или аминогруппой. В одном из вариантов осуществления изобретения производное миноциклина замещено в положении 9 алкильной группой, которая, в свою очередь, замещена аминогруппой. Способы получения производных тетрациклина, представленные в данном описании, включают использование реакционноспособных соединений-предшественников тетрациклина, реакционноспособных органических предшественников заместителей и переходных металлов или катализаторов на основе переходных металлов в условиях, при которых образуется замещенное производное тетрациклина с требуемым органическим заместителем. Производные тетрациклина могут быть получены путем взаимодействия реакционноспособных предшественников тетрациклина, таких как арендиазониевая соль тетрациклина, и реакционноспособного органического предшественника заместителя, например, алкенов, замещенных алкенов, виниловых мономеров, ароматических и гетероароматических соединений, в присутствии катализаторов на основе переходных металлов, таких как хлорид палладия, в условиях, при которых образуется замещенное производное тетрациклина, содержащее органический заместитель. В другом варианте замещенное производное тетрациклина может быть получено путем контактирования реакционноспособного химического комплекса тетрациклина, содержащего реакционноспособный предшественник тетрациклина, с переходным металлом или катализатором на основе переходного металла, с образованием реакционноспособного промежуточного соединения, содержащего реакционноспособный предшественник органического заместителя, в условиях, в которых происходит образование производного тетрациклина, содержащего органический заместитель. Также в данном описании представлены реакционноспособные химические комплексы тетрациклина, содержащие реакционноспособный предшественник тетрациклина и катализатор на основе переходного металла, из которых образуется промежуточное соединение. Использование этих промежуточных соединений в способах получения производных тетрациклина, заявленных в настоящем изобретении,характеризуется большими преимуществами. Кроме этого, описаны замещенные аналоги тетрациклина, в которых заместитель (в тексте описания обозначен как "Z") в определенном положении, например 7, 9, 13, присоединен посредством -C-Cсвязи и может содержать ароматический и гетероароматический остаток. Заместитель может также содержать -C=C- связь, примыкающую к -C-C- связям тетрациклина, например где R2 и R3, каждый, независимо означают водород, алкил, алкенил, алкинил, циклоалкил, арил, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, амино, гидрокси, циано, алкокси, арилокси, карбоксил, или R2 и R3 могут быть объединены с образованием замещенного или незамещенного карбоциклического или гетероциклического кольца, содержащего от 5 до 15 атомов. Способы и промежуточные соединения, охарактеризованные в данном изобретении, позволяют получить новые замещенные производные тетрациклинового ряда, которые могут быть использованы для терапии и для получения фармацевтических композиций, содержащих такие соединения. Способ их получения включает введение упомянутых заместителей Z в основную структуру тетрациклинового кольца в требуемое положение при добавлении реакционноспособного соединения, например, введение в требуемое положение соединения, содержащего п-связь, в присутствии катализатора на основе переходного металла. Процесс проводят через выделение образующегося в ходе реакции реакционноспособного промежуточного соединения (содержит арендиазониевую соль тетрациклина, полученную наиболее подходящим способом). Реакционноспособное промежуточное соединение может быть получено in situ. Наибольшие преимущества имеет способ, согласно которому заместители вводят в D кольцо основной структуры тетрациклина, например, в положение 7 и/или 9. Возможно также введение заместителей в положение 13. Такие схемы синтеза впервые используют в этой области химии, и их преимущество состоит в том, что они позволяют напрямую вводить различные заместители и/или предвари-2 012203 тельно полученные комплексные соединения заместителей в требуемое положение. Соединения данного изобретения активны по отношению к восприимчивым микроорганизмам,включая как тетрациклин-чувствительные бактерии, так и тетрациклин-резистентные бактерии. Прежде всего, предпочтительны соединения, у которых величина 24-часовой минимальной ингибирующей концентрации (МИК) тетрациклин-резистентных штаммов E coli, S. aureus и E. faecalis, таких как E. colipHCM1, S. aureus RN4250 и E. faecalis pMV158 составляет 10 мкг/мл или меньше, более предпочтительны соединения с МИК 1 мкг/мл или меньше. К наиболее предпочтительным соединениям изобретения также относятся те, для которых определена величина МИК в отношении тетрациклин-чувствительных штаммов E. coli, S. aureus и E. faecalis, таких как E. coli D31m4, S. auereus RN450 и E. faecalis ATCC 9790. В изобретении представлены способы лечения субъекта, страдающего заболеванием, вызванным микроорганизмами, такими как бактерии, грибы, риккетсии, паразиты и тому подобное, а также сопутствующими заболеваниями. Эти терапевтические способы, в основном, включают введение терапевтически эффективного количества одного или более соединений, представленных в данном изобретении, в живой организм, который заражен или восприимчив к инфекциям, вызываемым такими микроорганизмами, как бактерии, грибы, риккетсии и тому подобное. Подходящими объектами для лечения являются животные, прежде всего млекопитающие, такие как человек, или растения. В изобретении также представлены фармацевтические композиции, содержащие по меньшей мере одно производное тетрациклина, замещенное в положении 9 замещенной алкильной группой, и фармацевтически приемлемый носитель. Предпочтительно, если данная фармацевтическая композиция содержит производное тетрациклина,представляющее собой окситетрациклин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин,хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин, кломоциклин, гуамециклин, меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин. В производном тетрациклина, содержащемся в фармацевтической композиции, указанная алкильная группа может быть замещена алкенилом, алкинилом, циклоалкилом, арилом, амино, алкилкарбонилом, алкоксикарбонилом, гидрокси, циано, арилокси, карбоксилом или арилоксикарбонилом. Предпочтительным замещенным производным тетрациклина, содержащимся в данной фармацевтической композиции, является миноциклин, замещенный в положении 9 аминозамещенной алкильной группой. Сведения, подтверждающие возможность осуществления изобретения В описании настоящего изобретения использованы следующие термины. Термин "тетрациклин" или "тетрациклиновый ряд" означает тетрациклин, а также другие представители семейства тетрациклинов, такие как окситетрациклин, хлортетрациклин, демеклоциклин, доксициклин, хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин,кломоциклин, гуамециклин, меглуциклин, мепициклин, пенимепициклин, пипациклин, этамоциклин,пенимоцикпин и т.д., и другие производные тетрациклина, содержащие характерные нафтаценовые кольца A-B-C-D в структурной формуле, представленной в разделе "Уровень техники". Кроме того, использованы те же номера положений в тетрациклиновом кольце, на которые ссылаются в описании патента, как указано в приведенной выше структурной формуле. Термин "реакционноспособный предшественник тетрациклина" означает тетрациклины, которые содержат реакционноспособную группу в тетрациклиновой структуре, например, в положении 7, 9 или 13, причем реакция замещения с участием реакционноспособного предшественника тетрациклина может приводить, как указано в патенте, к образованию замещенного тетрациклина. К предшественникам тетрациклина относятся общеизвестные производные семейства тетрациклина. Такие семейства тетрациклина, без ограничения перечисленным, включают миноциклин, доксициклин и санциклин. Термин "предшественник миноциклина" означает соединения, содержащие в основе структуру миноциклина, которая отличается от структуры тетрациклина наличием диметиламиногруппы в положении 7 и отсутствием метильной и гидроксильной групп в положении 6, а также отсутствием гидроксильной группы в положении 5. Для иллюстрации ядро структуры предшественника миноциклина приведено ниже Следует понимать, что предшественники миноциклина могут быть замещенными, незамещенными или производными миноциклина, содержащими заместители в других атомах, за исключением положе-3 012203 ния 5 и 6. Например, другие положения атомов в основной структуре, например, положение 8, могут быть замещены или незамещены, а в других могут быть замещены или могут быть получены производные по группам в этих положениях, например, по амидогруппе в положении 2. Подходящими заместителями являются водород, алкил, алкенил, алкинил, циклоалкил, арил, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, амино, гидрокси, циано, алкокси,арилокси, карбоксил, карбоксамидо, сложный эфир карбоновой кислоты, карбоциклические или гетероциклические группы, а также их различные комбинации. Однако специалисты в данной области техники могут в качестве заместителей использовать и другие группы. Кроме того, R в приведенной выше формуле может означать не только метильную группу, но и, например, низкомолекулярный алкил, такой как этил, пропил и т.д. Реакционноспособные предшественники миноциклина включают, без ограничения перечисленным, производные 9-диазоний миноциклина, 9-йодминоциклина, 9-бромминоциклина и 9-хлорминоциклина. Термин "предшественник доксициклина" означает соединения, содержащие в основе структуру доксициклина, которая отличается от ядра структуры тетрациклина замещением атома водорода в положении 6 на гидроксильную группу и замещением гидроксильной группы в положении 5 на водород. Для иллюстрации ядро структуры предшественника доксициклина приведено ниже Следует понимать, что предшественники доксициклина могут быть замещенными, незамещенными или производными доксициклина, например, содержащими заместители в положениях 7, 8 и/или 9. Например, другие положения атомов в основной структуре, например, положение 8, могут быть замещены или незамещены, а в других могут быть замещены или могут быть получены производные по группам в этих положениях, например, по гидроксильной группе в положении 5 или по амидогруппе в положении 2. Подходящими заместителями являются водород, алкил, алкенил, алкинил, циклоалкил, арил, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, амино, гидрокси, циано, алкокси, арилокси, карбоксил, карбоксамидо, сложный эфир карбоновой кислоты, карбоциклические или гетероциклические группы, а также их различные комбинации. Специалисты в данной области техники в качестве заместителей могут использовать и другие группы. Кроме того, R в приведенной выше формуле может означать не только метильную группу, но и, например, низкомолекулярный алкил, такой как этил, пропил и т.д. Соединения реакционноспособного предшественника доксициклина включают, без ограничения перечисленным, производные 7- и/или 9-диазоний доксициклина, 7- и/или 9-йоддоксициклина, 7 и/или 9-бромдоксициклина и 7- и/или 9-хлордоксициклина. Термин "предшественник санциклина" означает соединения, содержащие структуру санциклина,которая отличается от структуры тетрациклина замещением атома водорода на метильную и атома водорода на гидроксильную группу в положении 6. Для иллюстрации ядро структуры предшественника санциклина приведено ниже Следует понимать, что предшественники санциклина могут быть замещенными, незамещенными или производными санциклина, например, в положениях 7, 8 и/или 9. Например, другие положения атомов в основной структуре, например, положение 8, могут быть замещены или незамещены, а в других могут быть замещены или могут быть получены производные по группам в этих положениях, например,по амидогруппе в положении 2. Подходящими заместителями являются водород, алкил, алкенил, алкинил, циклоалкил, арил, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, амино, гидрокси, циано, алкокси, арилокси, карбоксил, карбоксамидо, сложный эфир карбоновой кислоты, алкоксикарбонил, арилоксикарбонил, карбоциклические или гетероциклические группы, а также их различные комбинации. Специалистами в данной области техники в качестве заместителей могут быть использованы и другие группы. Реакционноспособные предшественники доксициклина включают в себя, без огра-4 012203 ничения перечисленным, производные 7- и/или 9-диазоний санциклина, 7- и/или 9-йодсанциклина, 7 и/или 9-бромсанциклина и 7- и/или 9-хлорсанциклина. Предпочтительными реакционноспособными предшественниками тетрациклина являются арендиазонивая соль тетрациклина, а также йодпроизводные тетрациклина, или производные тетрациклина, которые содержат двойную связь и реакционноспособны по отношению к производным борной кислоты,например, в положении 13. В одном из вариантов воплощения изобретения получают реакционноспособное промежуточное соединение путем взаимодействия реакционноспособного предшественника тетрациклина и катализатора на основе переходного металла. Данное промежуточное соединение используют для получения новых тетрациклинов с помощью способов, известных в данной области техники(например, см. в книге Hegedus, Transition Metals in the Synthesis of Complex Organic Molecules (Использование переходных металлов в синтезе сложных органических молекул) University Science Books. MillValley, CA, 1994, которая включена в качестве ссылки в текст описания). Реакционноспособное промежуточное соединение предпочтительно получают in situ при взаимодействии с реакционноспособным предшественником заместителя. Термин "катализатор на основе переходного металла" является общеизвестным термином, который означает как переходные металлы, так и катализаторы, содержащие переходные металлы, представленные элементами с 21 по 29, с 39 по 47, с 57 по 79, и 89. В состав типичных катализаторов на основе переходных металлов обычно входят CuCl2, трифлат меди (I), тиофенхлорид меди, хлорид палладия (II), органопалладиевые катализаторы, такие как ацетат палладия, Pd(PPh3)4,Pd(AsPh3)4, PdCl2(PhCN)2, PdCl2(Ph3P)2, Pd2(dba)3-CHCl3 ("dba" - дибензилацетон) и их различные комбинации. Другие катализаторы на основе переходных металлов включают те же соединения, но с такими металлами, как родий (например, ацетат родия (II) и Rh6(CO)16), железо, иридий, хром, цирконий и никель. Специалист в данной области техники может выбрать в литературе соответствующий катализатор на основе переходного металла для проведения требуемой реакции (например, см. в статье Lipshutz B.H.,Org. React., 1992, 41:135, которая включена в качестве ссылки в текст изобретения). Термин "реакционноспособный предшественник органического заместителя" означает органические заместители, имеющие реакционноспособные группы, необходимые для проведения реакции присоединения к реакционноспособному предшественнику тетрациклина, как указано в тексте изобретения. Реакционноспособный предшественник органического заместителя предпочтительно содержит по крайней мере одну реакционноспособную группу. В варианте воплощения изобретения реакционноспособный предшественник органического заместителя может содержать фрагменты с п-связями, такие как метилен, арилборная кислота, активные ароматические кольца, замещенные и незамещенные олефины и алкины, нитрилы, ацетилены, замещенные ацетилены, арилэтилены, стиролы, сопряженные диены, изопрены, виниловые эфиры, ,-ненасыщенные альдегиды и кетоны, арилвинил и арилизопренилкетоны,йодалкены и йодарены, хиноны, ,-ненасыщенные кислоты и их производные."Реакционноспособный предшественник органического заместителя" также включает в себя соединения (они могут быть получены in situ), которые взаимодействуют с реакционноспособным промежуточным соединением с образованием требуемого аналога тетрациклина. Например, реакционноспособное промежуточное соединение может быть переметаллировано, при этом получают широкий спектр разнообразных аналогов. Переметаллирование осуществляют путем взаимодействия с другими металлоорганическими комплексами, такими как соединения трибутилолова и диорганокупраты лития (например, см. в статьях Kalanin, Synthesis, 1992, 413; Sawamuru, Chem. Rev., 1992, 92:857; Negeishi, Acct. Chem.Res., 1982, 15:340, которые включены в качестве ссылок в текст изобретения). Другие предшественники включают в себя соединения, подходящие для проведения реакции, катализируемой переходными металлами, но которые содержат реакционноспособные связи для взаимодействия с промежуточными соединениями, содержащими переходные металлы. Такими предшественниками являются, например, соединения, содержащие галоген, гидроксильные группы, трифлат группы, тиолгруппы и аминогруппы. К внутримолекулярным реакциям относятся также реакции, в которых реакционноспособный предшественник органического заместителя образует связь или комплекс с реакционноспособным промежуточным соединением (см. книгу Hegedus, упомянутую выше). Соединения по настоящему изобретению включают в себя аналоги тетрациклина, замещенные в положении 7, замещенные в положении 9 и замещенные в положении 13. Эти соединения могут быть представлены общей формулой причем R2 и R3, каждый, независимо означают водород, алкил, алкенил, алкинил, циклоалкил, арил, алкилкарбонил, арилкарбонил, алкоксикарбонил, арилоксикарбонил, амино, гидрокси, циано, алкокси,арилокси, карбоксил, или R2 и R3 объединены с образованием замещенного или незамещенного карбоциклического или гетероциклического кольца, содержащего от 5 до 15 атомов в кольце, a R1 означает H или ОН. В другом варианте воплощения изобретения R2 означает водород, a R3 означает где R4 означает водород, циано или C1-C5-алкоксигруппу. В другом варианте воплощения изобретения R1 и R2 объединены с образованием замещенного и незамещенного карбоциклического или гетероциклического кольца, содержащего от 5 до 15 атомов в кольце; кольцо может содержать сопряженную или несопряженную ароматическую систему, предпочтительно содержащую от C5 до C8. Подходящими заместителями для Z являются Другим объектом изобретения является способ получения замещенных производных группы тетрациклина, с помощью которого возможно получение 7, 9 или 13-замещенных производных, а также еще одним объектом изобретения является получение производных группы тетрациклина с помощью этого способа. В основном, эти соединения могут быть получены, как указано на схемах синтеза, приведенных ниже в тексте описания. На этих схемах синтеза используют набор различных заместителей, как определено выше; "R" включает R2 и R3. Для наглядности, доксициклин представлен на схемах синтеза как "базовое" соединение группы тетрациклина, хотя следует иметь в виду, что любое из многочисленных производных группы тетрациклина может быть получено с использованием того же самого способа. Например, в качестве "базового" производного тетрациклина с замещенными группами в положениях 7-, 9 и/или 13 могут быть использованы окситетрациклин, хлортетрациклин, демеклоциклин, доксициклин,-6 012203 хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин,апициклин, кломоциклин, гуамециклин, меглюциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин, пенимоциклин, их полусинтетические промежуточные производные и т.п. Производные группы тетрациклина по настоящему изобретению могут быть легко получены с помощью описанных способов в соответствии с приведенными схемами синтеза. Синтез I относится к получению производных группы тетрациклина из исходного соединения формулы 1 - доксициклина, являющегося антибиотиком группы тетрациклина, применяемым в клинической практике. Было найдено,что 6-замещенные 5-гидрокси-6-дезокситетрациклины (1, R2=CH3, доксициклин) или их соли с неорганическими кислотами растворяются в концентрированных кислотах, например, H2SO4 является подходящим растворителем, а также взаимодействуют с нитрирующими реагентами, такими как нитрат натрия или калия, с образованием 7- и 9-нитропроизводных тетрациклина (2, 3). Эти производные могут быть разделены различными способами. Предпочтительным является метод препаративной ВЭЖХ с обращенной фазой (колонка C18) на силикагеле с использованием бинарной системы градиента, которая может включать в себя как градиент метанола в присутствии натриевой соли этилендиаминтетрауксусной кислоты (ЭДТА) в фосфатном буфере, так и градиент ацетонитрила в присутствии трифторуксусной кислоты, более 0,1%. Эти выделенные соединения могут быть легко восстановлены до функциональной аминогруппы, в присутствии типичных восстанавливающих реагентов, таких как водород в присутствии катализаторов на основе переходных металлов, оксид платины, углерод-палладиевый катализатор и им подобные, при этом с высоким выходом получают 7-NH2 и 9-NH2 тетрациклины (4, 5). Альтернативно, 7NH2 тетрациклины (доксициклин) может быть получен посредством восстановительного алкилирования 7-(N,N-дикарбоксибензилоксигидразино)тетрациклинов (подробнее см. патент США 3483251, включенный в описание изобретения в качестве ссылки). Соединения, содержащие функциональные анилиновые группы, легко вступают в реакцию диазотирования с азотистой кислотой (HONO) или органическими веществами, такими как бутилнитрит, с образованием солей диазония (таких как, гидрохлорид или тетрафторборат) (6, 7 ) с практически количественным выходом. Так как это производное реакционноспособного предшественника тетрациклина (6,7) является подходящей формой соли диазония, то оно может образовывать комплексы с органопалладиевыми катализаторами и их производными, что приводит к образованию связи углерод-углерод между промежуточным производным тетрациклина и соответствующим реакционноспособным предшественником органического заместителя по выбору. Катализаторы на основе переходных металлов, такие какCuCl2 (реакция Мирвина), также как и палладиевые катализаторы, такие как хлорид палладия, ацетат палладия и другие упомянутые выше катализаторы, предпочтительно ацетат палладия, применяют для получения замещенных в положении 7 и 9 производных тетрациклина. Реакции обычно проводят в полярных растворителях, таких как ДМСО, вода и спирты со следовыми количествами неорганических кислот (HCl, 0,1%), при этом реакция с замещенными и незамещенными ароматическими и гетероароматическими, алкильными, алкенильными или алкинильными субструктурами проходит с образованием требуемых замещенных соединений. Для проведения этих реакций могут быть также использованы неполярные растворители. Известно, что галогениды переходных металлов, такие как галогениды палладия и меди, взаимодействуют с солями арендиазония с образованием комплексов, которые могут участвовать в дальнейших реакциях. Галогениды переходных металлов в качестве катализаторов ускоряют образование связи углерод-углерод за счет протекания радикальной окислительно-восстановительной реакции присоединения субструктур углерода (двойные связи и другие структуры, содержащие п-связи) к электронноненасыщенному атому азота в реакционноспособной группе диазония. Например, образование связи углерод-углерод, катализируемой палладием, происходит легче, если соответствующий алкен в реакционной системе образует реакционноспособные координационные комплексы. За этим следует присоединение к сигма-связи углерода с образованием тройного комплекса. Катализаторы, такие как катализаторы палладия, циклизуются и при этом регенерируются, например, за счет отщепления -гидрида, что приводит к образованию ковалентной углерод-углеродной связи. В этих условиях молекулярные субструктуры, имеющие систему п-связи, такие как алкены, эфиры акриловой кислоты или любое из многочисленных соединений, содержащих двойную связь, легко арилируются производными реакционноспособного предшественника тетрациклина, например, арендиазониевой солью тетрациклина. Могут быть также использованы другие реакции, катализируемые переходными металлами, такие как переметаллирование и присоединение, например, монооксида углерода (см. книгу Hegedus, приведенную выше, пример реакций, катализируемых переходными металлами). Образование углерод-углеродной связи может проходить и при гомогенном катализе с использованием комплексов палладия или других подходящих реакционноспособных соединений. Тетрациклины,например, доксициклин или миноциклин применяют для получения реакционноспособной функциональной группы диазония в кольце D, причем реакционноспособный аддукт выбирают из ряда различных в структурном отношении семейств химических реагентов. Следовательно, производные реакционноспособных предшественников тетрациклина, такие как арендиазониевая соль тетрациклина, т.е. содержащая реакционноспособные функциональные группы в-7 012203 положении 7- и 9-тетрациклина, аналогичным образом может взаимодействовать с алкенами, замещенными алкенами, винильными мономерами, ароматическими и гетероароматическими реакционными группами (незамещенными и замещенными) в присутствии подходящего катализатора на основе переходного металла с образованием 7-(замещенного) и 9-(замещенного) тетрациклинов (8, 9, синтез I) с высоким выходом. Например, 9-диазониевую соль замещенного в положении 7 тетрациклина (синтез II) получают последовательными реакциями: нитрования миноциклина (10) с образованием 9-NO2 производного (11), с последующими каталитическим восстановлением до 9-NH2-производного (12) и диазотированием (13), причем указанная соль может также взаимодействовать с двойной связью соединений,таких как олефины и реакционноспособные продукты и реагенты, с образованием производных миноциклина, имеющих формулу II (14, синтез II). В другом варианте воплощения изобретения из продуктов реакции, имеющих формулы I и II, могут быть получены производные, которые вступают в реакции с реагентами, как показано на схемах синтезаIII-VII. Таким образом, эти продукты выполняют функцию промежуточных соединений для получения веществ, которые не могут быть получены другими способами. 9-алкенилзамещенные доксициклины (8,9), имеющие формулу I, могут быть гидрированы по 9-алкенильной группе в присутствии платинового или палладиевого катализатора на угле при низком давлении водорода с образованием 9 алкилпроизводных доксициклина (15, 16, синтез III). Аналогичным образом, 9-алкенилпроизводные миноциклина (14) могут быть восстановлены до алкилпроизводных путем каталитического гидрирования,способом, показанным на схеме синтеза IV (17). 7- или 9-производные доксициклина, имеющие формулу I (синтез I и III), могут взаимодействовать также с карбоновыми кислотами, при этом соединения растворяют в сильных кислотах, таких как безводная фтористо-водородная кислота, метансульфокислота или трифторметансульфокислота, и получают производные 7- и 9-замещенных доксициклинов в виде сложных эфиров в положении 5 (18, 19, синтез V). 7- или 9-производные доксициклина, имеющие формулу I (синтез I, III и V), могут образовывать также производные оснований Манниха при взаимодействии 7- или 9-производных с формальдегидом и соответствующим основанием (пирролидином), при этом получают продукты присоединения оснований Манниха (22, синтез VI). 9-производные миноциклина, имеющие формулу II (14, синтез II), могут образовывать производные оснований Манниха при взаимодействии 9-производных с формальдегидом и соответствующим основанием (пирролидином), при этом получают продукты присоединения оснований Манниха (22, синтез VII). Реакционноспособные функциональные группы тетрациклиндиазония, полученные по схеме (синтез I), могут также взаимодействовать с монооксидом углерода в спиртах в присутствии катализаторов на основе переходных металлов, таких как ацетат палладия, при этом получают производное 7- и 9 карбоновой кислоты с высоким выходом (23, 24), которое легко этерифицируется с образованием сложных эфиров тетрациклина в положении 9 (25, 26, синтез VIII). Реакционноспособные функциональные группы миноциклиндиазония, полученные по схеме (синтез II), могут также взаимодействовать с монооксидом углерода в спиртах в присутствии катализаторов на основе переходных металлов, таких как ацетат палладия, при этом получают производное 9 карбоновой кислоты с высоким выходом (2), которое легко этерифицируется с образованием сложных эфиров карбоновой кислоты миноциклина в положении 9 (28, синтез IX). Могут быть использованы и другие реакции 7- и 9-аминотетрациклинов с участием функциональной группы диазония. Арендиазониевые соли тетрациклина также взаимодействуют с активными метиленовыми соединениями, такими как сложные эфиры ацетоацетата, и их производными, реакционноспособными ароматическими кольцами, замещенными и незамещенными олефинами, ацетиленами, замещенными ацетиленами, арилэтиленами, стиролами, сопряженными диенами, изопренами, простыми виниловыми эфирами, ,-ненасыщенными альдегидами и кетонами, арилвинил- и арилизопренилкетонами, хинонами, ,-ненасыщенными кислотами и их производными. Все соединения с кратными связями,а также нуклеофилы, легко взаимодействуют с солями арендиазония. Производные реакционноспособных предшественников тетрациклина с заместителями в положении 7- и положениях 7- и 9- (галогенизированные производные тетрациклина, как показано на схеме синтеза X) также образуют 7- и 9-производные тетрациклина. Реакции замещения в ароматическом кольце,проводимые с помощью йодирования, бромирования или хлорирования, позволяют получить 7- и 9 галогенпроизводные доксициклина (29, 30) или санциклина (31, 32) с высоким выходом. Такая реакция описана, например, в статье Hlavka J.J., и соавт., J. Am. Chem. Soc, (1961), т. 84, с. 1426-1430. Реакция с иодалкенами и иодаренами производных тетрациклинов, галогенизированных в положениях 7- и 9-, может проходить в N-метилпирролидоне в присутствии катализаторов на основе переходных металлов,таких как тиофенхлорид меди или других, при этом с высоким выходом получают 7- или 9-производные доксициклина (33, 34) или 7- или 9-производные доксициклина (35, 36). Производные тетрациклина с заместителями в положении 13 получают при взаимодействии фенилборной кислоты с экзоциклической двойной связью метациклина (37) (синтез XI) в спиртах, таких как-8 012203 метанол, в присутствии хлорида палладия или других катализаторов на основе переходных металлов,при этом получают 13-фенилпроизводные метациклина (38) с высоким выходом. Настоящее изобретение проиллюстрировано на следующих схемах синтеза: Соединения по настоящему изобретению обладают активностью против чувствительных микроорганизмов, таких как бактерии, грибы, риккетсии, паразиты и т.п., а также в отношении заболеваний, связанных с этими микроорганизмами, включая как тетрациклин-чувствительные, так тетрациклинрезистентные бактерии. Прежде всего, предпочтительными являются соединения по настоящему изобретению, которые характеризуются величиной 24-часовой минимальной ингибирующей концентрации(МИК) в отношении тетрациклин-резистентных штаммов E. coli, S. aureus и E. faecalis, таких как E. coli рНСМ 1, S. aureus RN4250 и E. faecalis pMV158, составляющей приблизительно 10 мкг/мл или менее, более предпочтительно приблизительно 1 мкг/мл или менее. К наиболее предпочтительным соединениям по настоящему изобретению относятся также соединения, которые характеризуются такой же величиной МИК в отношении тетрациклин-чувствительных штаммов E. coli, S. aureus и E. faecalis, таких как E. coliD31m4, S. auereus RN450 и E. faecalis ATCC 9790. Как указано выше, в изобретении описаны способы лечения инфекций, вызванных микроорганизмами, и связанных с ними заболеваний. Эти способы, в основном, включают введение субъекту терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению. В качестве субъекта могут быть использованы растения или животные, в основном млекопитающие, предпочтительно использование приматов, таких как человек. Согласно способам по настоящему изобретению субъекту вводят по меньшей мере одно соединение по настоящему изобретению в отдельности, или, в более типичном случае, соединения вводят в составе фармацевтической композиции в смеси с традиционным наполнителем, т.е. с фармацевтически приемлемыми органическими или неорганическими носителями, подходящими для парентерального, орального или другого требуемого способа введения лекарственных средств, и которые не оказывают отрицательного действия на соединения по настоящему изобретению и не оказывают неблагоприятного воздействия на реципиента. Подходящие фармацевтически приемлемые носители включают в себя, без ограничения перечисленным, воду, растворы солей, спирт, растительные масла, полиэтиленгликоли, желатин, лакто- 13012203 зу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, парфюмерные масла, моно- и диглицериды жирных кислот, сложные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидон и т.д. Фармацевтические препараты могут быть стерилизованы и при необходимости смешаны со вспомогательными веществами, например, с замасливателями, консервантами, стабилизаторами, смачивающими агентами, эмульгаторами, солями для поддержания осмотического давления, буферными солями, красителями, ароматизаторами и/или ароматическими веществами и т.п., которые не оказывают отрицательного влияния на активные соединения. Большинство соединений по настоящему изобретению могут быть введены субъекту в протонированной и водорастворимой форме, например, в форме соли фармацевтически приемлемой органической или неорганической кислоты, например, в форме гидрохлорида, сульфата, гемисульфата, фосфата, нитрата, ацетата, оксалата, цитрата, малеата, мезилата и т.д. В случае соединений по настоящему изобретению, содержащих соответствующую кислотную группу, могут быть использованы фармацевтически приемлемые соли с органическими и неорганическими основаниями, такие как соли аммония, органических аминов, или соли щелочных металлов или щелочноземельных металлов, таких как калий, кальций или натрий. Терапевтические композиции могут быть введены субъекту согласно изобретению с использованием ряда способов. В основном, предпочтительными являются местный способ введения (включая чрескожный, оральный или подъязычный способы) и парентеральный способ (включая внутрибрюшинную,подкожную, внутривенную и внутримышечную инъекции). В случае парентерального способа, прежде всего, подходящими являются растворы, предпочтительно масляные или водные растворы, а также суспензии, эмульсии или имплантанты, включая суппозитории. Терапевтические композиции могут быть изготовлены в стерильной форме в виде одной или нескольких доз, например, диспергированных в жидком носителе, таком как стерильный физиологический солевой раствор или 5%-ный раствор декстрозы, которые обычно используют для инъекций. Для энтерального введения, прежде всего, подходят таблетки, драже или капсулы, содержащие тальк и/или углеводный носитель в качестве связующего агента и т.п., причем предпочтительными носителями являются лактоза и/или кукурузный крахмал и/или картофельный крахмал. Могут быть также использованы сироп, эликсир и т.п., если используют наполнитель в качестве подсластителя. Могут быть также получены композиции пролонгированного действия, включая композиции, в которых активный компонент защищен дифференциально разрушающимся покрытием, например, полученным с помощью микрокапсулирования, многослойного покрытия и т.д. В случае местного способа введения терапевтические соединения могут быть смешаны с фармакологически инертными носителями, которые обычно используются для наружного применения, такими как гель, мазь, лосьон или крем. Такие носители для наружного применения содержат воду, глицерин,спирт, пропиленгликоль, жирные спирты, триглицериды, сложные эфиры жирных кислот или минеральные масла. Другими возможными носителями для наружного применения являются жидкий вазелин,изопропилпальмитат, полиэтиленгликоль, 95%-ный этанол, 5%-ный монолаурат полиоксиэтилена в воде,5%-ный лаурилсульфат натрия в воде и т.п. Кроме того, при необходимости могут быть добавлены материалы, такие как антиоксиданты, увлажнители, стабилизаторы вязкости и т.п. Кроме использования для лечения человека, терапевтические способы по настоящему изобретению могут быть использованы в ветеринарной практике, например, для лечения домашнего скота, такого как крупный рогатый скот, овцы, козы, свиньи и т.д.; домашней птицы, такой как цыплята, утки, гуси, индюки и т.д.; лошадей; домашних животных, например кошек и собак. Следует учитывать, что реальное предпочтительное количество активного соединения, применяемого для определенных способов терапии, изменяется в зависимости от конкретного используемого соединения, прежде всего, от состава композиции, способа введения, определенного участка введения и т.д. Оптимальная частота введения в данном конкретном случае лечения может быть легко определена специалистом в данной области техники с использованием обычных способов определения дозы с учетом вышеупомянутых рекомендаций. В основном, соединения по настоящему изобретению могут быть введены субъекту в дозах, используемых на практике в случае тетрациклиновой терапии. См., например, в книге "Phisicians' Desk Reference" (Настольный справочник для терапевтов). Например, подходящая эффективная доза одного или нескольких соединений по настоящему изобретению находится в диапазоне от 0,01 до 100 мг на кг веса тела реципиента в сутки, предпочтительно в диапазоне от 0,1 до 50 мг на кг веса тела реципиента в сутки, наиболее предпочтительно от 1 до 20 мг на кг веса тела реципиента в сутки. Требуемую дозу вводят один раз в сутки, или в виде нескольких субдоз, например, от 2 до 5 субдоз, которые вводят через определенные промежутки времени в течение суток, или по другой подходящей схеме. Следует также понимать, что должны быть предприняты традиционно известные меры предосторожности по введению тетрациклинов, в основном для обеспечения их эффективности в нормальных условиях лечения. Прежде всего, при лечении людей и животных in vivo, практикующий специалист в данной области техники должен предпринять все разумные меры предосторожности, чтобы исключить обычные в таких случаях осложнения и токсические эффекты. Таким образом, следует надлежащим об- 14012203 разом учитывать обычно выявляемые отрицательные реакции, такие как желудочно-кишечные нарушения и воспалительные процессы, почечная интоксикация, реакции гиперчувствительности, изменения состава крови, недостаточность всасывания ионов алюминия, кальция и магния, с использованием традиционных методов. Биологическая активность Метод определения in vitro. Оценку антибактериальной активности различных соединений по настоящему изобретению in vitro проводят следующим образом. Минимальную ингибирующую концентрацию, т.е. наименьшую концентрацию лекарственного средства, которая ингибирует рост бактерий в течение 18 ч при определенной температуре, определяют с помощью метода разбавления питательной среды, используя L-бульон или бульон Мюллера-Хинтона (Mueller-Hinton). Концентрацию ионов в бульоне Мюллера-Хинтона доводят до определенной величины, и все бактериологические методы проводят, как описано в Документе стандартов Национальной комиссии для клинической лаборатории (Waitz J.A., National Commission for Clinical Laboratory Standards Document M7-A2, т.10, No.8, стр.13-20, 2-е изд., Villanova, PA (1990). Тестируемые организмы представляют грамположительные и грамотрицательные типы бактерий, которые являются чувствительными к тетрациклинам или резистентными к ним из-за их способности вызывать отток тетрациклинов или за счет механизмов рибосомальной защиты. Используют клинические штаммы, либо чувствительные к тетрациклинам, либо резистентные к ним, причем резистентные свойства обусловлены как оттоком лекарственного средства, так и рибосомальной защитой. Таблица 2 Список соединений- 16012203 Таблица 3 Антибактериальная активность производных тетрациклина, полученных с помощью катализаторов на основе переходных металлов- 17012203 Экспериментальная часть Соединения по настоящему изобретению могут быть получены, как представлено выше на схемах(синтез I-IX) и/или как описано ниже. Согласно схеме синтеза I доксициклин растворяют в охлажденной концентрированной серной кислоте и добавляют эквивалентное количество нитрата калия. Температуру реакции поддерживают в диапазоне от 0 до 5 С в течение 1-3 ч, при этом получают 7- и 9-нитро-6-замещенные 5 гидрокситетрациклины формулы IV. Эти промежуточные соединения с соответствующей реакционноспособной функциональностью могут взаимодействовать с большим числом восстанавливающих агентов, таких как PtO2 или водород и катализаторы на основе палладия или платины, при этом получают соединения общей формулы IV. Соли диазония 7- и 9-аминопроизводных получают при использовании нитритов (нитрита натрия, бутилнитрита или их эквивалентов) и промежуточное соединение получают без дополнительной очистки. Пример 1. [4S-(4,12 а)]-9-(Нитро)-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 а-октагидро-3,5,10,12,12 апентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид. К охлажденному во льду раствору 1,0 г гидрохлорида доксициклина в 10 мл концентрированной серной кислоты добавляют 0,231 г нитрата калия. Реакцию проводят при перемешивании в течение 1 ч при атмосферном давлении. Затем смесь выливают в 150 г льда, полученное твердое вещество экстрагируют н-бутанолом и высушивают, при этом получают 0,9 г требуемого продукта в виде твердого вещества желто-зеленого цвета.(dd, 1 Н, J=11,42, 8,35 Гц, Н-5), 2,95 (bs, 6H, NMe2), 2,81 (d, 1 Н, J=11,45 Гц, Н-4 а), 2,71 (dq, 1H, J=12,41,6,5 Гц, Н-6), 2,53 (dd, 1H, J=12,23, 8,20 Гц, Н-5 а), 1,51 (d, 3 Н, J=6,78 Гц, CH3). Пример 2. [4S-(4,12 а)]-9-(Амино)-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 а-октагидро-3,5,10,12,12 апентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид. В колбу для гидрирования объемом 200 мл добавляют 1,0 г продукта, полученного, как указано в примере 1, 40 мл метанола, 1 мл концентрированной HCl и 100 мг 10% палладия на угле. Используя аппарат для гидрирования, смесь выдерживают в течение 3 ч в атмосфере водорода при давлении 206,8 кПа(30 фунт/кв.дюйм). Катализатор отфильтровывают и фильтрат высушивают, при этом получают 0,9 г дигидрохлорида в виде твердого вещества желтого цвета.H ЯМР (CD3OD):7,54 (d, 1 Н, J=8,08 Гц, Н-8), 6,88 (d, 1H, J=8,08 Гц, Н-7), 5,16 (dd, J=10,44, 7,94 Гц, Н-5), 4,44 (bs, 1 Н, Н-4), 3,74 (d, 1H, J=2,07 Гц, Н-4), 3,04 (bs, 6H, NMe2), 2,90 (dd, 1H, J=7,94, 2,07 Гц,Н-4 а), 2,72 (dq, 1H, J=12,31, 6,56 Гц, Н-6), 2,61 (dd, 1H, J=12,31, 10,44 Гц, Н-5 а), 2,54 (q, 2H, J=7,48 Гц,CH2-C), 1,44 (bs, 9 Н, CMe3), 1,29 (d, 3 Н, J=6,56 Гц, CH3), 1,20 (t, 3H, J=7,48 Гц, C-CH3). Пример 3. [4S-(4,12 а)]-9-(Диазоний)-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 а-октагидро-3,5,10,12,12 апентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид. В круглодонную колбу объемом 10 мл помещают 100 мг продукта, полученного, как указано в примере 2, и растворяют в 4 мл 0,1 н. раствора соляной кислоты в метаноле. Раствор охлаждают до 0C и при перемешивании добавляют 35 мкл бутилнитрита. Через 1 ч реакционную смесь ярко-красного цвета по каплям добавляют к 100 мл безводного ангидрида диэтилового эфира. Полученный продукт собирают с помощью фильтрации, промывают эфиром и сушат в вакуумном эксикаторе, при этом получают 73 мг соли диазония в виде твердого вещества оранжевого цвета.H ЯМР (CD3OD):7,55 (d, 1H, J=8,08 Гц, Н-8), 6,86 (d, 1H, J=8,08 Гц, Н-7), 5,13 (dd, J=10,44, 7,94 Гц, Н-5), 4,41 (bs, 1 Н, Н-4), 3,72 (d, 1H, J=2,07 Гц, Н-4), 3,04 (bs, 6H, NCH3), 2,90 (dd, 1H, J=7,94, 2,07 Гц,Н-4 а), 2,70 (dq, 1H, J=12,31, 6,56 Гц, Н-6), 2,61 (dd, 1H, J=12,31, 10,44 Гц, Н-5 а), 2,2 (m, 6H, J=7,48 Гц,ацетил), 1,44 (bs, 9 Н, C(CH3)3), 1,29 (d, 3 Н, J=6,56 Гц, CH3), 1,20 (t, 3 Н, J=7,48 Гц, C-CH3). Общая методика олефинирования. К раствору 0,1 г производного 9-диазония (влажного или сухого) в метаноле добавляют 0,05 экв. ацетата палладия. Реакционную смесь перемешивают при комнатной температуре в течение 5 мин, затем добавляют 2 экв. соответствующего олефина, перемешивают в течение 18 ч при атмосферном давлении,или проводят ВЭЖХ. Перемешивание может быть также продолжено в атмосфере азота. По окончании процесса катализатор отфильтровывают и фильтрат высушивают, при этом получают неочищенный продукт. Для очистки продукта проводят препаративную ВЭЖХ с обращенной фазой с использованием градиента метанола в фосфатном буфере. Пример 4. [4S-(4,12 а)]-9-[3'-(Е)-Пропеновая кислота]-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 аоктагидро-3,5,10,12,12 а-пентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид.[4S-(4,12 а)]-7-[3'-(Е)-Бутилпропеноат]-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 аоктагидро-3,5,10,12,12 а-пентагидрокси-6-метил-1,11-ди-оксо-2-нафтаценкарбоксамид. Общая методика арилирования. К раствору производного 9-диазония в метаноле добавляют 0,10 экв. ацетата палладия. Смесь перемешивают при комнатной температуре в течение 5 мин, затем добавляют 2 экв. арилборной кислоты. Через 6 ч отфильтровывают катализатор и фильтрат высушивают. Полученный неочищенный продукт очищают методом препаративной ВЭЖХ с обращенной фазой с использованием градиента метанола в фосфатном буфере. Общая методика карбоксилирования. В трехгорлую круглодонную колбу, снабженную двумя резиновыми перегородками, краном для соединения с вакуумным насосом, мешалкой, добавляют 100 мг производного диазония, 6,0 мг ацетата палладия и 10 мл безводного диметилформамида. Реакционный сосуд вакуумируют и через смесь с помощью шприца пропускают СО в течение 1 ч. Затем смесь перемешивают еще в течение 2 ч, после чего удаляют растворитель в вакууме, при этом получают неочищенный продукт. Полученное соединение выделяют методом препаративной ВЭЖХ с обращенной фазой (на колонке C18) с использованием бинарной системы градиента растворителей. Пример 7. [4S-(4,12 а)]-9-(Карбокси)-4-(диметиламино)-1,4,4 а,5,5 а,6,11,12 а-октагидро-3,5,10,12,12 апентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид.MC (FAB): m/z 489 (М+Н). Общая методика гидрирования. Соединение получают при добавлении к 0,100 г соединения, полученного, как указано в примере 4,растворенного в 10 мл метанола, 0,1%-ной концентрированной HCl и 10 мг 10% палладия на угле. Смесь гидрируют при давлении 275,8 кПа (40 фунт/кв.дюйм) в аппарате Парра в течение 6 ч при комнатной температуре, полноту реакции контролируют с помощью метода ВЭЖХ. Полученный неочищенный продукт хроматографируют на колонке C18 с обращенной фазой с использованием полупрепаративной бинарной системы градиента растворителей, при этом получают необходимый продукт. Общая методика олефинирования в положении 7. К раствору 0,1 г производного 7-диазония, полученному аналогичным способом, как указано в примерах 1 и 2, во влажном метаноле добавляют 0,05 экв. ацетата палладия. Реакционную смесь перемешивают в течение 5 мин при комнатной температуре, затем добавляют 2 экв. требуемого олефина. Смесь перемешивают в течение 18 ч при атмосферном давлении, затем проводят ВЭЖХ. По окончании процесса катализатор отфильтровывают через целит, и фильтрат высушивают, при этом получают неочищенный продукт. Для очистки продукта проводят препаративную ВЭЖХ с обращенной фазой с использованием градиента метанола в фосфатном буфере. Пример 8. 9-Фенилминоциклин [4S-(4,12 а)]-9-(фенил)-4,7-бис-(диметиламино)-1,4,4 а,5,5 а,6,11,12 аоктагидро-3,5,10,12,12 а-тетрагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид. Данное соединение получают из 0,100 г 9-аминоминоциклина с использованием реагентов и аналогичных условий, как описано в примере 5. Реакцию проводят при перемешивании в течение ночи в атмосфере азота, затем удаляют растворитель в вакууме, при этом получают 0,063 г неочищенного продукта. Обращено-фазовая хроматография на C18 с использованием препаративных методов и бинарной системы градиента растворителей, с последующей экстракцией продукта в бутаноле и упариванием в вакууме,позволяют получить 0,027 г требуемого продукта в виде твердого вещества желтого цвета.MC (FAB): m/z 571 (М+Н). Пример 9. 7-Иоддоксициклин. 30 мл концентрированной серной кислоты добавляют при перемешивании к 1,00 г полугидрата гидрохлорида доксициклина и раствор охлаждают до 0C. К нему небольшими порциями добавляют 0,973 гN-иодсукцинимида в течение 1 ч, полноту протекания реакции контролируют с помощью методов ВЭЖХ и TCX. Полученный раствор выливают в 250 мл ледяной воды, трижды экстрагируют бутанолом и удаляют растворитель при пониженном давлении. Остаток очищают с помощью метода препаративной ВЭЖХ, при этом получают 1,13 г (89%) требуемого соединения в виде кристаллов темно-желтого цвета.(m, 3H), 2,85 (s, 7H), 2,66 (m, 4H), 2,41 (s, 1H), 1,49 (d, J=6,52 Гц, 3H), 0,95 (t, J=7,27 Гц, 2H). Примеры 10 и 11. 7-Иодсанциклин и 7,9-дииодсанциклин. 30,0 мл концентрированной серной кислоты при перемешивании приливают к 1,00 г полугидрата гидрохлорида санциклина и охлаждают до 0C. 1,09 г N-иодсукцинимида порциями добавляют в указанный выше раствор в течение 1 ч, состав реакционной смеси контролируют при помощи ВЭЖХ и TCX. Затем реакционную смесь выливают в 250 мл ледяной воды, трижды экстрагируют н-бутанолом и растворитель отгоняют при пониженном давлении. Полученный неочищенный остаток очищают при помощи препаративной ВЭЖХ, при этом получают 787 мг (61%) 7-иодсанциклина и 291 мг (22%) 7,9- 19012203 дииодсанциклина в виде кристаллов желтого и темно-желтого цвета, соответственно.H ЯМР (Метанол d-4, 300 МГц)8,35 (s, 1H), 3,78 (s, 1H), 3,33 (s, 2H), 2,88 (s, 7H), 2,41 (m, 2H),1,41 (m, 5H). Пример 12. Описание общего метода конденсации. 7-4'-Cl-фенилсанциклин. 100 мг 7-иодсанциклина или 7-иоддоксициклина (0,18 мМ) и 4 мг Pd(OAc)2 добавляют к метанолу,дегазированному аргоном, с последующим добавлением 200 мкл 2 M раствора Na2CO3. Полученный раствор перемешивают в течение 10 мин при комнатной температуре. 4'-Cl-фенилборную кислоту (58 мг,0,37 мМ) растворяют в 1 мл метанола, после чего добавляют к иодтетрациклину и проводят 3-кратную дегазацию реакционной смеси аргоном. Смесь перемешивают в течение 15 минут при комнатной температуре, а затем нагревают с обратным холодильником в течение 18 ч. Раствор охлаждают, фильтруют и отгоняют растворитель при пониженном давлении. Неочищенный продукт очищают при помощи обращенно-фазовой хроматографии на колонке C18, при этом получают 23 мг продукта в виде кристаллов темно-желтого цвета.H ЯМР (Метанол d-4, 300 МГц)7,65 (d, J=8,79 Гц, 1H), 6,80 (d, J=8,76 Гц, 1H), 5,56 (d, J=18,42 Гц,1H), 5,25 (d, J=12,15 Гц, 1H), 3,84 (s, 1H), 3,19 (m, 2H), 2,98 (s, 6H), 2,82 (m, 1H), 2,32 (m, 2H), 0,92 (m,1H). Эквивалентные решения Специалист в данной области техники может легко выявить многочисленные варианты описанных выше способов с использованием обычных экспериментов. Все эти варианты находятся в пределах объема притязаний настоящего изобретения и заявлены в следующей формуле изобретения. Содержание всех цитируемых ссылок, опубликованных патентов и заявок на выдачу патента включены в текст описания в качестве ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное тетрациклина, замещенное в положении 9 замещенной С 1-С 4-алкильной группой. 2. Производное тетрациклина по п.1, представляющее собой миноциклин. 3. Производное тетрациклина по п.1, представляющее собой санциклин. 4. Производное тетрациклина по п.1, представляющее собой доксициклин. 5. Производное тетрациклина по п.1, представляющее собой тетрациклин. 6. Производное тетрациклина по п.1, представляющее собой окситетрациклин, хлортетрациклин или демеклоциклин. 7. Производное тетрациклина по п.1, представляющее собой хелокардин, ролитетрациклин или лимециклин. 8. Производное тетрациклина по п.1, представляющее собой метациклин, апициклин или кломоциклин.- 20012203 9. Производное тетрациклина по п.1, представляющее собой гуамециклин, меглуциклин или мепилциклин. 10. Производное тетрациклина по п.1, представляющее собой мепилциклин, пенимепициклин или пипациклин. 11. Производное тетрациклина по п.1, представляющее собой этамоциклин или пенимоциклин. 12. Производное тетрациклина по любому из пп.1-11, в котором C1-С 4-алкильная группа замещена С 2-С 4-алкенилом, С 1-С 4-алкилкарбонилом, C1-С 4-алкоксикарбонилом или карбоксилом. 13. Производное миноциклина, замещенное в положении 9 С 1-С 4-алкильной группой, в котором указанная C1-С 4-алкильная группа замещена аминогруппой. 14. Фармацевтическая композиция, содержащая производное тетрациклина, замещенное в положении 9 замещенной С 1-С 4-алкильной группой, и фармацевтически приемлемый носитель. 15. Фармацевтическая композиция по п.14, в которой указанное производное тетрациклина представляет собой окситетрациклин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин, хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин, кломоциклин,гуамециклин, меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин. 16. Фармацевтическая композиция по п.14, в которой указанная C1-С 4-алкильная группа замещена С 2-С 4-алкенилом, С 1-С 4-алкилкарбонилом, C1-С 4-алкоксикарбонилом или карбоксилом. 17. Фармацевтическая композиция по п.14, в которой указанное замещенное производное тетрациклина представляет собой миноциклин, замещенный в положении 9 аминозамещенной С 1-С 4-алкильной группой. 18. Способ лечения субъекта, отличающийся тем, что применяют терапевтически эффективное количество производного тетрациклина, замещенного в положении 9 замещенной С 1-С 4-алкильной группой. 19. Способ по п.18, отличающийся тем, что указанное производное тетрациклина представляет собой окситетрациклин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин, хелокардин, миноциклин, ролитетрациклин, лимециклин, санциклин, метациклин, апициклин, кломоциклин, гуамециклин,меглуциклин, мепилциклин, пенимепициклин, пипациклин, этамоциклин или пенимоциклин. 20. Способ по п.18, отличающийся тем, что указанная С 1-С 4-алкильная группа замещена С 2-С 4 алкенилом, С 1-С 4-алкилкарбонилом, С 1-С 4-алкоксикарбонилом или карбоксилом. 21. Способ по п.18, отличающийся тем, что указанное замещенное производное тетрациклина представляет собой миноциклин, замещенный в положении 9 аминозамещенной С 1-С 4-алкильной группой. 22. Способ по п.18, отличающийся тем, что указанное терапевтически эффективное количество является эффективным для лечения инфекций, вызванных микроорганизмами, или сопутствующих заболеваний. 23. Способ по п.20, отличающийся тем, что указанные микроорганизмы выбраны из группы, включающей бактерии, грибы, риккетсии или паразитов. 24. Способ по п.23, отличающийся тем, что указанные бактерии являются грамположительными. 25. Способ по п.23, отличающийся тем, что указанные бактерии являются грамотрицательными. 26. Способ по п.18, отличающийся тем, что указанный субъект является млекопитающим. 27. Способ по п.26, отличающийся тем, что указанное млекопитающее является человеком.
МПК / Метки
МПК: A61K 31/65, C07C 237/26, A61P 31/04
Метки: использованием, субъекта, тетрациклина, производные, способ, лечения, композиция, фармацевтическая, замещенные
Код ссылки
<a href="https://eas.patents.su/22-12203-zameshhennye-proizvodnye-tetraciklina-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-subekta-s-ih-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные тетрациклина, фармацевтическая композиция и способ лечения субъекта с их использованием</a>
Предыдущий патент: Способы и системы надёжного и точного определения глубины каротажного кабеля в стволе скважины
Следующий патент: Три(цикло)замещённые амидные соединения
Случайный патент: Восстановление для повторного использования текучей среды для обслуживания скважин