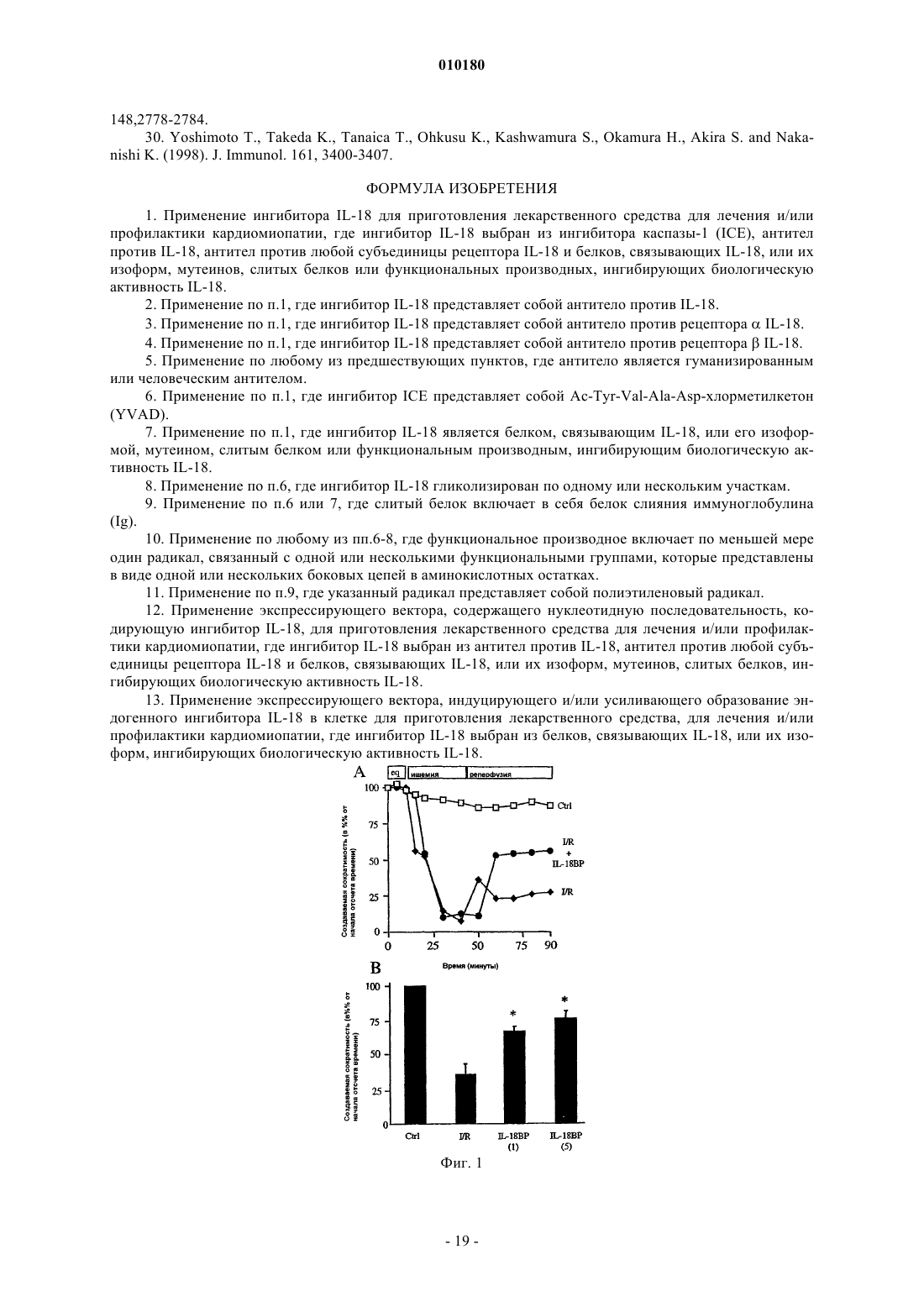
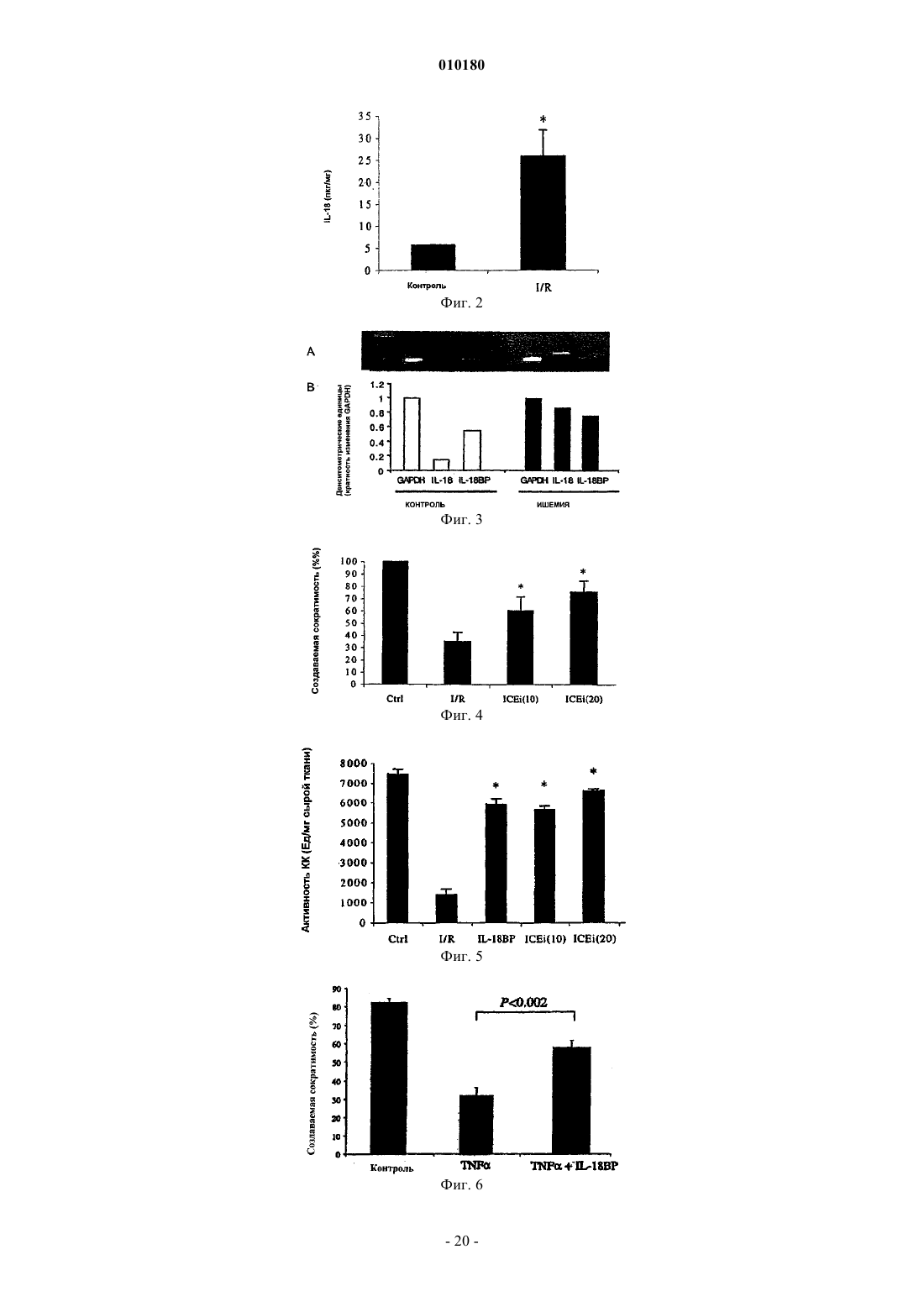
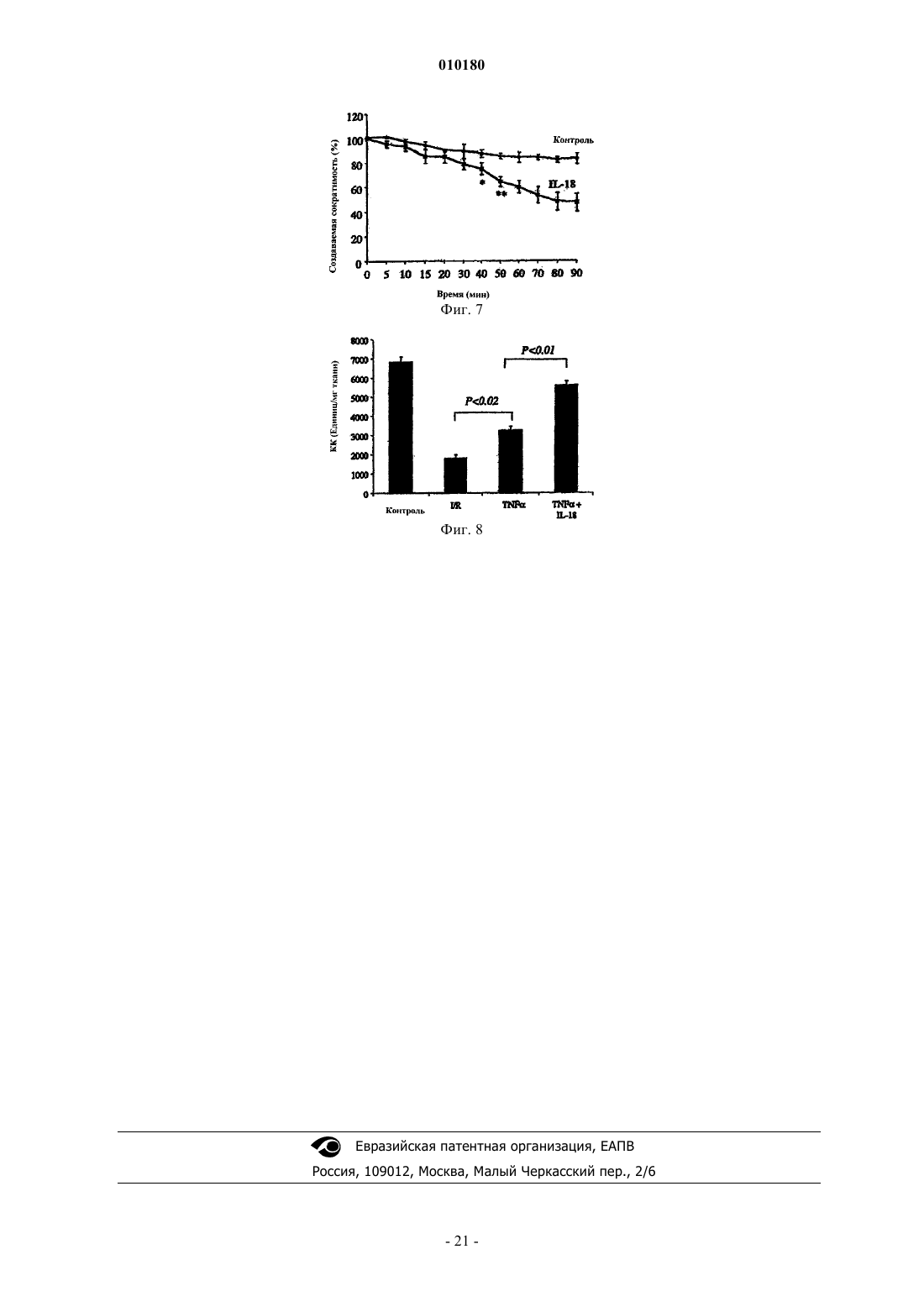
Применение ингибитора il-18 для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии
Номер патента: 10180
Опубликовано: 30.06.2008
Авторы: Резников Леонид, Динарелло Чарльз, Шватшко Йоланд, Померантц Бенджамин, Харкен Альден
Формула / Реферат
1. Применение ингибитора IL-18 для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из ингибитора каспазы-1 (ICE), антител против IL-18, антител против любой субъединицы рецептора IL-18 и белков, связывающих IL-18, или их изоформ, мутеинов, слитых белков или функциональных производных, ингибирующих биологическую активность IL-18.
2. Применение по п.1, где ингибитор IL-18 представляет собой антитело против IL-18.
3. Применение по п.1, где ингибитор IL-18 представляет собой антитело против рецептора a IL-18.
4. Применение по п.1, где ингибитор IL-18 представляет собой антитело против рецептора b IL-18.
5. Применение по любому из предшествующих пунктов, где антитело является гуманизированным или человеческим антителом.
6. Применение по п.1, где ингибитор ICE представляет собой Ac-Tyr-Val-Ala-Asp-хлорметилкетон (YVAD).
7. Применение по п.1, где ингибитор IL-18 является белком, связывающим IL-18, или его изоформой, мутеином, слитым белком или функциональным производным, ингибирующим биологическую активность IL-18.
8. Применение по п.6, где ингибитор IL-18 гликолизирован по одному или нескольким участкам.
9. Применение по п.6 или 7, где слитый белок включает в себя белок слияния иммуноглобулина (Ig).
10. Применение по любому из пп.6-8, где функциональное производное включает по меньшей мере один радикал, связанный с одной или несколькими функциональными группами, которые представлены в виде одной или нескольких боковых цепей в аминокислотных остатках.
11. Применение по п.9, где указанный радикал представляет собой полиэтиленовый радикал.
12. Применение экспрессирующего вектора, содержащего нуклеотидную последовательность, кодирующую ингибитор IL-18, для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из антител против IL-18, антител против любой субъединицы рецептора IL-18 и белков, связывающих IL-18, или их изоформ, мутеинов, слитых белков, ингибирующих биологическую активность IL-18.
13. Применение экспрессирующего вектора, индуцирующего и/или усиливающего образование эндогенного ингибитора IL-18 в клетке для приготовления лекарственного средства, для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из белков, связывающих IL-18, или их изоформ, ингибирующих биологическую активность IL-18.
Текст
010180 Область техники, к которой относится изобретение Настоящее изобретение относится к области сердечно-сосудистых заболеваний. Более конкретно,оно относится к применению ингибитора IL-18, для приготовления лекарственного средства для лечения и/или профилактики заболевания сердца, в частности ишемической болезни сердца. Рассматривается также способ лечения заболевания сердца, предусматривающий введение нуждающемуся хозяину эффективного ингибирующего количества ингибитора IL-18. Предпосылки изобретения Цитокин интерлейкин-18 (IL-18) был первоначально описан в качестве фактора, индуцирующего интерферон (IFN-) (Nakamura и соавт., 1989). Он является ранним сигналом развития ответов Тхелперных лимфоцитов типа 1 (ТН 1). IL-18 действует вместе с IL-12, IL-2, антигенами, митогенами и,возможно, с другими дополнительными факторами, которые индуцируют продукцию IFN-. IL-18 усиливает также продукцию GM-CSF и IL-2, потенциирует Т-клеточную пролиферацию, индуцируемую антиCD3, и повышает опосредованный Fas киллинг природных киллерных клеток. Зрелый IL-18 продуцируется из своего предшественника с помощью IL-1-превращающего фермента (ICE, каспаза-1). Рецептор IL-18 состоит по меньшей мере из двух компонентов, взаимодействующих при связывании лиганда. Сайты связывания IL-18 с высоким и низким сродством были обнаружены в мышиных Тклетках, стимулированных IL-12 (Yoshimoto и соавт., 1998), что позволяет предположить наличие многоцепочечного рецепторного комплекса. Пока идентифицированы две рецепторные субъединицы, обе относящиеся к семейству рецепторов IL-1 (Parnet и соавт., 1996; Kim и соавт., 2001). Передача сигналаIL-18 включает в себя активацию NF-В (DiDonato и соавт., 1997). Комплекс рецептора IL-18 состоит из двух рецепторных цепей: цепь IL-18Ra называют лигандсвязывающей цепью, а цепь IL-18R называют цепью, передающей сигнал. Цепь IL-18R выделили вначале в виде белка клеточной поверхности, связывающего радиоактивно меченный IL-18; данный белок выделили и выявили идентичность его аминокислотной последовательности с ранее описанным орфановым рецептором, названным IL-1R-связанным белком (IL-1Rrp), (Torigoe и соавт., 1997). Недавно из человеческой мочи был выделен растворимый белок, обладающий высоким сродством против IL-18, и клонированы кДНК человека и мыши, а также человеческий ген (Novick и соавт., 1999;WO 99/09063). Данный белок был назван IL-18-связывающий белок (IL-18BP).IL-18BP не является внеклеточным доменом ни одного из известных рецепторов IL-18, а представляет собой естественно циркулирующий белок. Он относится к новому семейству секретируемых белков,кроме того, включающему в себя несколько белков, кодируемых поксвирусом (Novick и соавт., 1999). IL18BP из мочи, как и рекомбинантный IL-18BP, с высоким сродством специфически связывают IL-18 и регулируют биологическое сродство IL-18. Ген IP-18BP локализован в хромосоме 11q13 человека, и в геномной последовательности длиной 8.3 т.п.н. не обнаруживается экзон, кодирующий трансмембранный домен. На сегодняшний день у человека найдены четыре варианта или изоформы сплайсинга IL-18 ВР, образуемые в результате альтернативного сплайсинга мРНК. Они обозначены IL-18BP а, b, с и d, причем все обладают одним и тем же N-концом и отличаются по С-концу (Novick и соавт., 1999). Эти изоформы варьируют по способности связывать IL18. Известно, что из указанных четырех изоформ, изоформы а и с hIL-18 ВР обладают способностью нейтрализовать IL-18. Изоформа IL-18 ВР человека перекрестно реагирует с мышиным IL-18. Заболевания сердца определяются как нарушения, которые влияют на сердечную мышцу или на кровеносные сосуды сердца (The Merck Manual Home Edition, www.merck.com). Сосудистое нарушение представляет собой нарушение деятельности кровеносного сосуда, например ослабление циркуляции крови вследствие закупорки. Заболевания сердца называют также сердечно-сосудистыми нарушениями. Ишемическая болезнь сердца зачастую вызывает сердечную недостаточность и в западном сообществе является самой частой причиной смерти. Она, как правило, обусловлена атеросклеротической бляшкой в коронарной артерии. Повреждения миокарда включают ишемический фиброз и острый инфаркт. В нормальных условиях кровоток в коронарных артериях сильно зависит от метаболических потребностей сердечной мышцы. Ишемическая болезнь сердца развивается при недостаточном кровоснабжении вследствие ухудшения самого кровоснабжения либо при гипертрофированном миокарде, который требует повышенного кровоснабжения. Коронарный кровоток в норме не зависит от аортального давления. Существует эффективный саморегулирующийся механизм, контролирующий кровоток через коронарное сосудистое ложе. Если происходит закупорка большой коронарной артерии, обычно вследствие атеросклероза или артериосклероза, то поначалу коронарный кровоток сохраняется, поскольку периферическое сопротивление непроходимости уменьшено. Если просвет сосуда закупорен более чем на 75%, развивается ишемия, особенно в случае, если коронарное коллатеральное кровообращение выражено слабо. Сердечная мышца чрезвычайно метаболически активна, в отдельных ее волокнах содержится свыше 30% митохондрий по объему. Кислородный обмен существен, так как резервы высокоэнергетических фосфатов крайне скудны. При очень низком уровне тканевого аденозинтрифосфата (АТФ) и при факти-1 010180 ческой остановке анаэробного гликолиза сердечная мышца погибает. Как и в случае с другими тканями точная причина гибели неясна, но летальное поражение сердечной мышцы ассоциируется с мембранным повреждением и внезапным вбросом кальция в цитоплазму клетки. После короткого промежутка времени ишемии кардиальный кровоток может восстановиться (реперфузия). Однако после большого интервала времени реперфузия невозможна, по-видимому, вследствие набухания эндотелиальных клеток капилляров. Атеросклероз ответственен за огромное большинство случаев ишемической болезни сердца. Ишемическая болезнь сердца может также возникать из-за скудной перфузии коронарных артерий. Инсульт,особенно геморрагический, часто является причиной ее возникновения. Как указано выше, ишемическая болезнь сердца является результатом дисбаланса между кровоснабжением миокарда и метаболическими потребностями миокарда. Кроме того, кровоток может уменьшиться из-за наложения таких событий как, спазм сосудов, тромбоз или циркуляторные изменения,приводящие к скудной перфузии. Перфузия коронарных артерий зависит от разницы давления между коронарным отверстием (аортальное диастолическое давление) и коронарным синусом (давление в правом предсердии). Коронарный кровоток уменьшается в течение систолы вследствие эффектов Вентури в коронарных отверстиях и сдавления внутримышечных артерий во время сокращения желудочков. Факторы уменьшения коронарного кровотока включают в себя пониженное артериальное диастолическое давление, повышенное внутрижелудочковое давление и сокращение миокарда, стеноз коронарной артерии, стеноз и регургитацию аортального клапана и повышенное давление в правом предсердии. Тромболитическую терапию с помощью таких средств, как стрептокиназа или тканевый активатор плазминогена (ТРА), часто используют для растворения недавно образованного тромба. Такая терапия по растворению тромба может в большинстве случаев восстановить кровоток. Это помогает предупредить существенное повреждение миокарда, если достаточно рано вмешаться (менее чем в течение одного часа или около этого) в данное развитие событий, и может, по меньшей мере, помочь уменьшить дальнейшее повреждение. Стенокардия является симптомокомплексом ишемической болезни сердца, характеризующимся пароксизмальным приступом боли в груди, обычно загрудинной или прекордиальной. Это обусловлено ишемией миокарда, не приведшей к инфаркту. Может произойти внезапная сердечная смерть, которая представляет собой скоропостижную смерть сердечной этиологии, обычно в течение одного часа возникновения сердечного этиологического фактора или без возникновения симптомов. От нее ежегодно умирает 300000-400000 человек. Другие формы заболевания сердца включают в себя алкогольную кардиомиопатию, пролабирование створок аортального клапана, стеноз аортального клапана, аритмии, кардиогенный шок, врожденный порок сердца, дилатационную кардиомиопатию, сердечный приступ, сердечную недостаточность, опухоль сердца, стеноз легочного клапана сердца, гипертрофическую кардиомиопатию, идиопатическую кардиомиопатию, ишемическую болезнь сердца, ишемическую кардиомиопатию, регургитацию крови при недостаточности митрального клапана, пролабирование створок митрального клапана, связанную с родами кардиомиопатию, стабильную стенокардию. Инфаркт миокарда представляет собой еще одну форму ишемической болезни сердца. Его патогенез может включать в себя обтурирующий внутрикоронарный тромбоз, т.е. возникновение тромба, покрывающего изъязвленную или разрушенную стенорирующую бляшку. Обтурирующий внутрикоронарный тромб вызывает 90% трансмуральных инфарктов миокарда. Спазм сосудов может иметь место при коронарном атеросклерозе или в его отсутствие и вероятно ассоциируется с агрегацией тромбоцитов. Эмболы могут также играть роль в развитии инфаркта миокарда. Общая морфологическая картина инфаркта миокарда может варьировать. Трансмуральный инфаркт миокарда вовлекает всю толщину стенки левого желудочка от эндокарда до эпикарда. При субэндокардиальном инфаркте миокарда возникают многоочаговые области некроза, ограниченные 1/3-1/2 внутренней стенки левого желудочка. Осложнения инфаркта миокарда могут включать в себя аритмию и дефекты проводимости с возможной "внезапной смертью", расширением зоны инфаркта или повторным инфарктом, застойную сердечную недостаточность (отек легких), кардиогенный шок, перикардит, пристеночный тромбоз с возможной эмболизацией, разрыв стенки миокарда с возможной тампонадой, отрыв папиллярных мышц с возможной клапанной недостаточностью, образование аневризмы желудочка. Инфаркт миокарда (ИМ) определяют как ишемический некроз миокарда, обычно развивающийся в результате внезапного уменьшения коронарного кровотока на участке миокарда. У более чем 90% больных острым ИМ острый тромб, часто связанный с разрушением бляшки, закупоривает данную артерию (ранее частично перекрытую атеросклеротической бляшкой), которая снабжает поврежденную область. Измененная функция тромбоцитов, индуцируемая изменением эндотелия в атеросклеротической бляшке, вносит основной вклад в тромбогенез. Примерно у 2/3 пациентов происходит спонтанный тромболиз, так что через 24 ч тромботическая окклюзия наблюдается лишь примерно у 30%. Иногда инфаркт миокарда вызван артериальной эмболизацией (например, при стенозе митрального-2 010180 клапана или стенозе устья аорты, инфекционном эндокардите и токсическом эндокардите). Сообщалось об инфаркте миокарда у пациентов при коронарном спазме и при нормальных по другим показателям коронарных артериях. Кокаин вызывает сильный спазм коронарных артерий и у его потребителей может развиться вызванная кокаином стенокардия или инфаркт миокарда. Изучение секционного материала и коронарная ангиография показали, что вызванный кокаином коронарный тромбоз может произойти в нормальных коронарных артериях или в результате сложения с предсуществующей бляшкой. Инфаркт миокарда преимущественно является заболеванием левого желудочка, но повреждение может распространиться и на правый желудочек (RV) или на правое предсердие. Инфаркт правого желудочка обычно происходит из-за окклюзии правой коронарной или основной левой огибающей артерии и характеризуется высоким давлением при заполнении правого желудочка, часто с тяжелой регургитацией трехстворчатого клапана и пониженным сердечным выбросом. Некоторая дисфункция правого желудочка встречается примерно у половины больных нижне-задним инфарктами, приводит к нарушению гемодинамики у 10-15%. Способность сердца продолжить функционировать в качестве насоса непосредственно связана со степенью повреждения миокарда. Трансмуральные инфаркты затрагивают миокард по всей его толщине от эпикарда до эндокарда и,как правило, характеризуются на ЭКГ аномальными зубцами Q. Нетрансмуральные, или субэндокардиальные, инфаркты не распространяются на всю стенку желудочка и вызывают аномалии лишь сегментаST и зубца Т. Субэндокардиальные инфаркты затрагивают внутреннюю 1/3 миокарда, где натяжение стенки наибольшее, а кровоток в миокарде наиболее чувствителен к изменениям циркуляции. Они могут также следовать за продолжительной гипотензией. Поскольку трансмуральную глубину некроза невозможно точно определить клинически, инфаркты лучше всего классифицировать с помощью ЭКГ по наличию и отсутствию зубца Q. Объем пораженного миокарда можно оценить по величине и продолжительности повышения содержания СК. Другим заболеванием в рамках ишемической болезни сердца является ишемическая кардиомиопатия. Этому состоянию может предшествовать инфаркт миокарда, но данное заболевание является следствием тяжелого коронарного атеросклероза, поражающего все основные сосудистые ветви. Результатом является недостаточное кровоснабжение, что приводит к гибели миоцитов. Потеря миоцитов, сопряженная с фиброзом в виде интерстициального отложения коллагена, приводит к уменьшению эластичности,что наряду с расширением сердца приводит к перегрузке оставшихся миоцитов. Данный процесс продолжается, компенсируясь непрерывной гипертрофией миоцитов. Возможна даже компенсация посредством гиперплазии, а также гипертрофии, что может объяснить огромный размер (в 2-3-раза больше нормального) сердца. В конце концов, такое сердце уже не может компенсировать, и в результате наступает сердечная недостаточность с аритмиями и/или ишемическими приступами. Таким образом, клинически отмечается медленно прогрессирующая сердечная недостаточность, с инфарктом миокарда или стенокардической болью или без таковых в анамнезе. Ишемическая кардиомиопатия ответственна не менее чем за 40% летальных исходов при ишемической болезни сердца. Во время ишемии, а также реперфузии сердца, секретируются многочисленные эндогенные медиаторы, например, такие как низкомолекулярные вторичные мессенджеры, которые влияют на функцию миокарда. В минуты ишемического приступа сократительная способность миокарда снижается, а полное восстановление силы сокращений по большей части сильно зависит от продолжительности ишемического периода (Daemen и соавт., 1999). Например, во время ишемического приступа нарушается гомеостаз Са 2+, генерируются активные формы кислорода и происходит синтез и высвобождение оксида азота(NO). Кроме того, происходит также местное продукцию цитокинов, в частности TNF и IL-1 (Bolli,1990). В неповрежденном сердце эти цитокины вносят свой вклад в дисфункцию миокарда, вызванную ишемией, индуцируя экспрессию генов индуцируемой NO-синтазы (iNOS) (Daemen и соавт., 1999), циклооксигеназы-2 (СОХ-2) и фосфолипазы А 2, а также сосудистых молекул адгезии и некоторых хемокинов. В итоге отмечается немедленное угнетение сократительной способности миокарда, опосредованное низкомолекулярными мессенджерами с последующей цитокин-опосредованной нейтрофильной инфильтрацией, что еще более повреждает сердечную мышцу. Сердца животных, исследованные в отсутствие крови или продуктов крови, вырабатывают в течение индуцированной ишемии TNF (Herskowitz и соавт., 1995) и IL-1 . Кардиомиоциты также утрачивают сократительную способность в результате действия этих эндогенных цитокинов (Meldrum и соавт., 1998). Большинство экспериментальных данных, касающихся TNF и IL-1, опосредствующих дисфункцию миокарда, получены в исследованиях на животных. Вместе с тем, ткани человеческого миокарда,полученные от пациентов, подвергшихся некоторой операции в условиях искусственного кровообращения, изучают в контролируемых ex vivo условиях (Gurevitch и соавт., 1996; Cleveland и соавт.,1997). В этой экспериментальной модели трабекулы предсердия человека суспендируют в бескровном физиологически оксигенированном буфере и затем моделируют приступ ишемии. В течение этого времени резко уменьшается сократительная способность; когда к данной ткани восстанавливают доступ кислорода, ее сократительная способность возвращается, хотя и не полностью (60-70% снижение), и существует свиде-3 010180 тельство повреждения миокарда, наблюдаемого по высвобождению креатинкиназы (СК) (Gurevitch и соавт., 1996; Cleveland и соавт., 1997). Если биологическая активность TNF специфично нейтрализовать во время ишемии/реперфузии (I/R), то наблюдается лучшее восстановление сократительной способности,что позволяет предположить, что активность эндогенного TNF миокарда способствует сократительной дисфункции, обусловленной ишемическим приступом (Cain и соавт., 1999).Daemen и соавт. (1999) исследовали тканевое повреждение вследствие ишемии с последующей реперфузией, используя мышиную модель ишемии почки. Они показали, что положительная регуляция мРНК IL-18 почки совпадает на первые сутки после ишемии с активацией каспазы-1. Впоследствии мРНК IFN- и IL-12 подвергались положительной регуляции на 6 сутки после ишемии. Объединенная, а не раздельная, нейтрализация in vivo индуцирующих-IFN цитокинов IL-12 и IL-18 уменьшает зависимую от гамма-IFN положительную регуляцию МНС классов I и II, до степени, соответствующей таковой при нейтрализации IFN-. Однако до сих пор не сообщалось о роли IL-18 в развитии заболеваний сердца. Сущность изобретения В основу настоящего изобретения положен тот факт, что ингибитор IL-18 существенно улучшает сократительную функцию сердца в ишемической/реперфузионной модели с усиленной перфузией предсердия миокарда человека. Ингибирование каспазы-1 (ICE) также ослабляет снижение сократительной способности после ишемии и реперфузии. Кроме того, введение ингибитора IL-18 в мышиной модели инфаркта миокарда приводило к повышению выживаемости и существенному улучшению функции желудочка. Данные исследования свидетельствуют, что ингибиторы IL-18 пригодны для лечения или профилактики дисфункции миокарда. Поэтому настоящее изобретение относится к применению ингибитора IL-18 или экспрессирующего вектора, содержащего нуклеотидную последовательность, кодирующую ингибитор IL-18, для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии, с тем, чтобы применить генно-терапевтический подход для доставки ингибитора IL-18 в больную ткань или клетку. Используемый ингибитор IL-18 выбирают из ингибитора каспазы-1 (ICE), антител против IL-18, антител против любой субъединицы рецептора IL-18 и белков, связывающих IL-18, или их изоформ, мутеинов, слитых белков или функциональных производных, ингибирующих биологическую активностьIL-18. Краткое описание чертежей На фиг. 1 показано действие IL-18BP на вызванную ишемией дисфункцию сократимости миокарда.(A) Кинетическая реакция на ишемическое повреждение. После уравновешивания (eq) в течение данного эксперимента контрольные трабекулы подвергают усиленной перфузии в условиях нормальной оксигенации. Трабекулы подвергаются ишемии/ реперфузии в отсутствие или в присутствии IL-18BP (5 мкг/мл). На вертикальной оси указано выраженное в процентах развиваемое усилие в сравнении с началом данного эксперимента (начало отсчета времени). Эти данные получены для трабекул отдельного пациента и показательны для способов, используемых для вычисления среднего изменения развиваемого усилия за 90 мин.(B) Развиваемое постишемическое усилие после нейтрализации IL-18 с помощью 1-5 мкг/мл IL18BP. Результаты представлены в виде среднего процентного изменения развиваемого усилия относительно Ctrl (контроля) после завершения реперфузии (90 мин). Числа в скобках соответствуют IL-18BP в мкг/мл. N=6. р 0,01 в сравнении с I/R (ишемия/реперфузия). Фиг. 2 показывает содержание в миокарде белка IL-18. Трабекулы гомогенизируют после 90 мин усиленной перфузии в условиях нормальной оксигенации (контроль) или через 45 минут после 30 мин ишемии (I/R). От одних и тех же субъектов собраны равноценные трабекулы. Уровни IL-18 указаны на вертикальной оси в пкг/мл. N=4. р 0,01. Фиг. 3 показывает стационарные уровни мРНК IL-18 и IL-18BP в контроле и в ишемической ткани предсердий. Уровни IL-18 и IL-18 ВР определяют с помощью RT-PCR. Данные характеризуют одного субъекта (из двух). На А показан окрашенный бромидом этидия агарозный гель, в котором были разделены продукты ПЦР, а на В представлены результаты количественного анализа РСТ-продукта в виде кратного изменения к контролю (GAPDH). Фиг. 4 показывает влияние ICE-ингибирования на создаваемую постишемическую сократимость. Результаты выражены в виде среднего процентного изменения развиваемого усилия по отношению к контролю (Ctrl) после ишемии/реперфузии (I/R). Числа в скобках указывают концентрацию ICEi в мкг/мл. N=7. р 0,01 в сравнении с I/R. Фиг. 5 показывает активность тканевой креатинкиназы (CK) после I/R. CK выражена в единицах активности на миллиграмм массы сырой ткани. Данные экспериментальные условия указаны под горизонтальной осью. Ctrl и I/R, N=6; IL-18BP (5 мкг/мл), N=5; ICEi (10 и 20 мкг/мл), N=5 каждый; р 0,05 в сравнении с I/R. Фиг. 6 показывает среднее изменение развиваемого усилия трабекул, инкубированных по 10 мкг/мл-4 010180 в течение 15 мин перед добавлением TNF (1 нг/мл), относительно, взятой за 100% (n=5), развиваемого усилия после периода уравновешивания. TNF и IL-18 ВР добавляют в каждую сменяемую ванну. Фиг. 7 представляет реакцию трабекул предсердий человека во времени в условиях нормальной оксигенации. Зрелый IL-18 (100 нг/мл) добавляют к трабекулам предсердий на протяжении 90 мин экспериментального времени. На вертикальной оси указано среднее процентное изменение от исходной линии развиваемого усилия. Исходную линию определяют в конце периода уравновешивания (не показано).(n=6). Р 0,05, Р 0,001 по сравнению с контролем в одном и том же интервале и в течение оставшегося экспериментального периода. Фиг. 8 показывает сохранение креатинкиназной активности мышечной ткани после воздействия I/R,TNF (1 нг/мл) и TNF (10 мг/мл) + IL-18BP. Активность CK выражают в единицах CK-активности на миллиграмм массы сырой ткани. (n=6). Подробное описание изобретения В основу настоящего изобретения положен тот факт, что ингибиторы IL-18 оказывают благоприятный эффект при заболеваниях сердца, в частности при ишемической болезни сердца. Как показано ниже в примерах, несколько разных ингибиторов IL-18 оказывают существенный благоприятный эффект на создаваемую постишемическую сократимость сердечной мышцы. Помимо этого, ингибитор IL-18, испытанный на модели in vivo инфаркта миокарда, повышает выживаемость и существенно улучшает функции желудочка. Поэтому настоящее изобретение относится к применению ингибитора IL-18 для приготовления лекарственного средства для лечения и/или профилактики заболевания сердца. В соответствии с настоящим изобретением термин "заболевание сердца" охватывает заболевания,включающие дисфункцию данного сердца. Обычно их называют также сердечно-сосудистыми заболеваниями. В предпочтительном варианте осуществления настоящего изобретения заболевание сердца представляет собой ишемическую болезнь сердца. Используемый здесь термин "ишемическая болезнь сердца" включает все возможные виды ишемической болезни сердца, включая без ограничения, заболевания, подробно описанные в разделе "Предпосылки изобретения", а также сердечно-сосудистые заболевания, связанные с ишемической болезнью сердца. Применение по настоящему изобретению весьма подходит для длительного лечения и, таким образом, особенно применимо для использования при хронических заболеваниях сердца. Таким образом, в предпочтительном варианте осуществления настоящего изобретения ишемическая болезнь сердца является хронической. Стенокардия, или angina pectoris, является одним из наиболее обычных клинических симптомов у пациентов с длительной историей ишемической болезни сердца. Ослабление функции левого желудочка после одного или нескольких инфарктов миокарда может привести к левожелудочковой и,в конечном итоге, к застойной сердечной недостаточности. Поэтому настоящее изобретение относится к применению ингибитора IL-18 для лечения и/или профилактики стенокардии. В следующем предпочтительном варианте осуществления настоящего изобретения ишемическая болезнь сердца протекает остро и, более предпочтительно, представляет собой инфаркт миокарда. Острый инфаркт миокарда обычно включает в себя некроз сердечной мышцы, обычно левого желудочка. Он часто вызван атеромой коронарной артерии с наложением тромба или кровоизлиянием в бляшку. За некрозом следует воспалительная инфильтрация, высвобождение в кровь репаративных ферментов соединительной ткани из некротической мышцы и лейкоцитоз, которые могут использоваться для диагностики. Осложнения острого инфаркта миокарда включают в себя аритмии, сердечную недостаточность, разрыв миокарда, приводящий к гемоперикарду, пристеночный тромбоз, ведущий к эмболии,и аневризму сердца. Другие осложнения включают в себя внезапную смерть, аритмии, персистирующую боль, стенокардию, сердечную недостаточность, недостаточность митрального клапана, перикардит, разрыв миокарда (желудочковая боль, отрыв межжелудочковой трабекулы или папиллярной мышцы), пристеночный тромбоз, аневризму желудочка, синдром Дресслера (боль в груди, лихорадка, выпоты), эмболию легочной артерии. Лекарственное средство в соответствии с настоящим изобретением можно также использовать для лечения и/или профилактики этих осложнений инфаркта миокарда. В другом предпочтительном варианте осуществления настоящего изобретения заболевание сердца представляет собой сердечную недостаточность. Сердечная недостаточность представляет собой болезненное состояние, при котором сердце неспособно перекачивать кровь со скоростью, необходимой для нормального метаболизма. Почти при всех формах сердечной недостаточности минутный сердечный выброс снижен, это связано с меньшим кровотоком, который называют артериальным незаполнением. Организм компенсирует, удерживая жидкость в увеличенном объеме крови. Сердечная недостаточность может быть острой или хронической. На ранних стадиях клинические симптомы сердечной недостаточности могут казаться односторонними, но поскольку межжелудочковая трабекула (перегородка) является общей для правого и левого желудочка, то неминуемо, что недостаточность одного желудочка ведет к недостаточности другого. Сердечная недостаточность может быть связана с ишемической болезнью-5 010180 сердца. Она может быть обусловлена и другими причинами, такими как системная гипертензия, порок клапана сердца или легочное заболевание, ведущее к застойной сердечной недостаточности. Сердечная недостаточность может быть застойной сердечной недостаточностью, которая является симптоматичной дисфункцией миокарда, приводящей к развитию характерного профиля гемодинамических, почечных, и нейрогормональных реакций. Клинические проявления сердечной недостаточности могут быть недостаточностью левого желудочка или недостаточностью правого желудочка. Сердечная недостаточность проявляется как систолическая или диастолическая дисфункция или как та и другая. Сочетание систолической и диастолической аномалий является обычным. Еще в одном предпочтительном варианте осуществления настоящего изобретения болезнь сердца представляет собой кардиомиопатию. Кардиомиопатия представляет собой любую структурную или функциональную аномалию желудочка сердечной мышцы. Термин "профилактика" в контексте настоящего изобретения относится не только к общей профилактике определенного эффекта, но также и к любой ограниченной или значительной профилактике, к ослаблению, смягчению, снижению или уменьшению эффекта до его возникновения или на ранних стадиях. Термин "лечение" в контексте настоящего изобретения относится к любому благоприятному влиянию на течение заболевания, включая ослабление, смягчение, снижение или уменьшение развития патологического состояния после возникновения заболевания. Термин "ингибитор IL-18" в контексте настоящего изобретения относится к любому типу молекул,модулирующих продукцию IL-18 и/или действующих таким образом, что продукцию IL-18 и/или его действие ослабляется, смягчается, либо частично, практически, либо полностью предупреждается или блокируется. Ингибитор продукции может представлять собой любую молекулу, отрицательно влияющую на синтез, процессинг или созревание IL-18. Ингибиторы, рассматриваемые в соответствии с настоящим изобретением, могут представлять собой, например, супрессоры генной экспрессии интерлейкина IL-18,антисмысловые мРНК, уменьшающие или предотвращающие транскрипцию мРНК IL-18 или приводящие к деградации мРНК, белки, ухудшающие правильную укладку или частично или существенно предотвращающие секрецию IL-18, протеазы расщепляющие IL-18, после того как он был синтезирован,ингибиторы протеаз, расщепляющих про-IL-18 с получением зрелого IL-18, таких, например, как ингибиторы каспазы-1 и т.п. Ингибитор IL-18 может, например, выступать антагонистом IL-18. Антагонисты могут либо связывать, либо секвестрировать саму молекулу IL-18 при достаточном сродстве и специфичности, чтобы частично или существенно нейтрализовать IL-18 или участок(ки) связывания IL-18, ответственный за связывание IL-18 с его лигандами (как, например, с его рецепторами). Антагонист может также ингибировать сигнальный путь IL-18, который активируется в клетках при связывании рецептора IL-18. Ингибиторы IL-18 могут также быть растворимыми рецепторами IL-18 или молекулами, имитирующими такие рецепторы, или агентами, блокирующими данные рецепторы IL-18, или антителами против IL-18, такими как поликлональные или моноклональные антитела, или любым иным агентом или молекулой, предотвращающей связывание IL-18 с его мишенями, уменьшая или предупреждая тем самым запуск внутри- или внеклеточных реакций, опосредуемых IL-18. В предпочтительном варианте осуществления настоящего изобретения ингибитор IL-18 выбран из ингибиторов каспаза-1 (ICE), антител против IL-18, антител к любой субъединице рецептора IL-18, ингибиторов сигнального пути IL-18, антагонистов IL-18-, которые конкурируют с IL-18 и блокируют рецептор IL-18, и белков, связывающих IL-18, изоформ, мутеина, слитых белков, функциональных производных, активных фракций или их круговых перестановочных производных, ингибирующих биологическую активность IL-18. Используемый здесь термин "белки, связывающие IL-18" синонимичен "белку, связывающему IL18" или "IL-18BP". Он подразумевает белки, связывающие IL-18, которые охарактеризованы в WO 99/09063 или у Novick и соавт., 1999, включающие сплайсинговые варианты и/или изоформы белков,связывающих IL-18, как указано у Kim и соавт., 2000, которые связываются с IL-18. В частности, применимыми в соответствии с настоящим изобретением являются изоформы а и с XL-18BP человека. Эти белки, применимые в соответствии с настоящим изобретением, могут быть гликозилированными или негликозилированными, они могут быть получены из естественных источников, таких как моча, или они могут быть предпочтительно получены рекомбинантно. Рекомбинантную экспрессию можно осуществить в прокариотической экспрессирующей системе, аналогичной E.coli, или в эукариотической, и предпочтительно - в экспрессирующих системах млекопитающих. Используемый здесь термин "мутеин" относится к аналогам IL-18BP или к аналогам вирусного IL18BP, в которых один или несколько аминокислотных остатков естественного или вирусного IL-18BP заменяются различными аминокислотными остатками или делетируются или же один или несколько аминокислотных остатков встраиваются в последовательность нативного IL-18BP или вирусного IL18BP без существенного изменения активности получаемых продуктов по сравнению с IL-18BP дикого типа или вирусного IL-18BP. Данные мутанты получают с помощью известных методик синтеза и/или-6 010180 сайт-направленного мутагенеза или с помощью любой иной известной методики, подходящей для этого. В соответствии с настоящим изобретением мутеины включают в себя белки, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которые гибридизуются с ДНК или РНК, которые кодируют IL18 ВР или кодируют вирусный IL-18BP, в соответствии с настоящим изобретением, в жестких условиях. Термин "жесткие условия" относится к гибридизации и к последующим условиям отмывки, которые рядовые специалисты в данной области техники обычно называют "жесткими". Смотрите Ausubel и соавт.,Current Protocols in Molecular Biology (Современные протоколы в молекулярной биологии), выше, Interscience, N.Y., 6.3 и 6.4 (1987, 1992) и Sambrook и соавт., выше. Без ограничения, примеры жестких условий включают в себя условия отмывки 12-20 С ниже расчетной Tm данного гибрида при исследовании, например, в 2SSC и 0,5% SDS в течение 5 мин, 2 SSC и 0,1% SDS в течение 15 мин; 0,1 SSC и 0,5% SDS при 37 С в течение 30-60 мин, а затем - 0,1 SSC и 0,5% SDS при 68 С в течение 30-60 мин. Рядовым специалистам в данной области техники очевидно, что жесткие условия зависят также от длины ДНК-последовательностей, олигонуклеотидных зондов (таких как 10-40 оснований) или смешанных: олигонуклеотидных зондов. При использовании смешанных зондов вместо SSC предпочтительно использовать хлорид тетраметиламмония (ТМАС). Смотрите Ausubel, выше. Любой такой мутеин предпочтительно обладает аминокислотной последовательностью, в достаточной мере повторяющей последовательность IL-18BP, или последовательностью, в достаточной мере повторяющей последовательность вирусного IL-18 ВР, такой, которая обладает активностью, сравнимой с таковой IL-18BP. Одна активность немого IL-18BP заключается в его способности связывать IL-18. Поскольку данный мутеин обладает существенной связывающей IL-18 активностью, он может использоваться для очистки IL-18, как, например, при помощи аффинной хроматографии и, следовательно, может рассматриваться как обладающий существенно сходной активностью с таковой IL-18 ВР. Таким образом,его можно определить как любой данный немой белок, обладающий по существу такой же активностью,что и IL-18BP, с помощью обычного экспериментирования, включающего обработку такого немого белка, например, в простом конкурентном сэндвич-анализе, как, например, в радиоиммуноанализе илиELISA-анализе, чтобы выяснить, связывается ли он с соответствующим образом помеченным IL-18 или нет. В предпочтительном варианте осуществления настоящего изобретения любой такой мутеин обладает по меньшей мере 40%-й идентичностью или гомологией с последовательностью IL-18BP или с гомологом IL-18BP, кодируемым вирусом, как указано в WO 99/09063. Более предпочтительно, он обладает по меньшей мере 50%-й, по меньшей мере 60%-й, по меньшей мере 70%-й, по меньшей мере 80%-й или наиболее предпочтительно по меньшей мере 90%-й идентичностью или гомологией с ним. Мутеины полипептидов IL-18BP или мутеины вирусных IL-18BP, которые можно использовать в соответствии с настоящим изобретением, или нуклеиновая кислота, кодирующая их, включает конечное множество, существенно соответствующих последовательностей, в виде замещенных пептидов или полинуклеотидов, которые может получить обычным способом любой рядовой специалист в данной области техники без чрезмерного экспериментирования, основываясь на представленных здесь указаниях и под их руководством. Предпочтительными изменениями мутеинов в соответствии с настоящим изобретением являются те, которые известны в качестве "консервативных" замен. Консервативные аминокислотные замены в полипептидах IL-18BP или белках или вирусных IL-18BP могут включать синонимичные аминокислоты,в рамках группы, члены которой обладают достаточно сходными физико-химическими свойствами, чтобы обмен членов группы сохранял биологическую функцию данной молекулы (Grantham, 1974). Ясно,что вставки и делеции аминокислот можно также осуществить в вышеуказанных последовательностях без изменения их функции, особенно, если во вставках или делециях участвуют лишь несколько аминокислот, например до тридцати, но предпочтительно до десяти, и не удаляются или не заменяются аминокислоты, которые являются ключевыми для функциональной конформации, например цистеиновые остатки. Белки и мутеины, полученные с помощью таких делеций и/или вставок, подпадают под объем настоящего изобретения. Предпочтительно синонимичные аминокислотные группы представлены группами, указанными в табл. 1. Более предпочтительно синонимичные аминокислотные группы представлены группами, указанными в табл. 2; и наиболее предпочтительно синонимичные аминокислотные группы представлены группами, указанными в табл. 3.-7 010180 Таблица 1. Предпочтительные группы синонимичных аминокислот Таблица 2. Более предпочтительные группы синонимичных аминокислот-8 010180 Таблица 3. Наиболее предпочтительные группы синонимичных аминокислот Примеры произведения аминокислотных замен в белках, которые могут использоваться для получения мутеинов полипептидов IL-18BP или мутеинов вирусных IL-18BP, для использования в настоящем изобретении, включают стадии любых известных способов, которые представлены в патентах США 4959314, 4588585 и 4737462 у Mark и соавт.; 5116943 у Koths и соавт., 4965195 у Namen и соавт.; 4879111 у Chong и соавт. и 5017 691 у Lee и соавт; а замены лизина в белках представлены в патенте США 4904584 (Shaw и соавт.). Термин "слитый белок" относится к полипептиду, содержащему IL-18BP или вирусный IL-18BP или мутеин или его фрагмент, слитый с другим белком, который, например, обладает длительным временем циркуляции в жидкостях организма. Поэтому IL-18BP или вирусный IL-18BP можно слить с другим белком, полипептидом и т.п., например иммуноглобулином или его фрагментом. Используемые здесь "функциональные производные" включают производные IL-18BP или вирусного IL-18BP и их мутеины или слитые белки, которые можно получить из функциональных групп, находящиеся в виде боковых цепей в остатках, или с использованием известных в данной области техникиN- или С-концевых групп, включенных в настоящее изобретение, поскольку они остаются фармацевтически приемлемыми, т.е. они не устраняют активность белка, которая практически сходна с активностьюIL-18 ВР, или вирусных IL-18BP, и не придают токсических свойств композициям, содержащих их. Эти производные могут, например, включать полиэтиленгликолевые боковые цепи, которые могут маскировать антигенные участки и пролонгировать циркуляцию IL-18BP или вирусного IL-18BP в жидкостях организма. Другие производные включают сложные алифатические эфиры карбоксильных групп,амиды карбоксильных групп в результате взаимодействия с аммиаком или же с первичными или вторичными аминами, N-ацильными производными свободных аминогрупп аминокислотных остатков, образуемых с ацильными составляющими (например, алканоильные или карбоциклические ароильные группы) или О-ацильными производными свободных гидроксильных групп (например, остатками серила и треонина), образуемых с ацильными составляющими. В качестве "активных фракций" IL-18BP, или вирусного IL-18 ВР, мутеинов или слитых белков настоящее изобретение включает любые фрагменты или предшественники полипептидной цепи данной белковой молекулы, отдельно или вместе с ассоциированными молекулами или остатками, присоединенными к ним, например, сахарозными или фосфатными остатками, или с совокупностями белковых молекул или с одними сахарозными остатками, при условии, что указанная фракция обладает практически сходной активностью с IL-18BP. Еще в одном предпочтительном варианте осуществления настоящего изобретения ингибитор IL-18-9 010180 представляет собой антитело против IL-18 или его рецептора, IL-18R. В соответствии с настоящим изобретением можно использовать антитела к любой из субъединиц IL-18R, именуемых IL-18R и . В соответствии с настоящим изобретением антитела могут быть поликлональными или моноклональными, химерными, гуманизированными или даже полностью человеческими. Рекомбинантные антитела и их фрагменты характеризуются высоким сродством к связыванию с IL-18 или IL-18R in vivo и низкой токсичностью. Антитела, которые могут использоваться в настоящем изобретении, характеризуют по их способности лечить пациентов в течение времени, достаточном для достижения хорошей или полной регрессии или облегчения болезненного состояния или симптома или группы симптомов, связанных с болезненным состоянием, или по их низкой токсичности. Нейтрализующие антитела легко получить у животных, таких как кролики, овцы или мыши путем иммунизации препаратами: IL-18 или IL-18R или . Иммунизированные мыши особенно пригодны для создания источника В-клеток при получении гибридом, которые, в свою очередь, культивируют для получения больших количеств моноклональных антител против IL-18. Химерные антитела представляют собой иммуноглобулиновые молекулы, характеризующиеся двумя или несколькими сегментами или частямм, полученными от разных видов животных. Как правило,вариабельную область данного химерного антитела получают из антитела отличного от человека млекопитающего, такого, например, как мышиное моноклональное антитело, а константную область данного иммуноглобулина получают из молекулы иммуноглобулина человека. Предпочтительно обе области и их сочетание обладают низкой иммуногенностью, что определено обычным способом (Elliot и соавт.,1994). Гуманизированные антитела представляют собой иммуноглобулиновые молекулы, создаваемые генноинженерными методами, в которых мышиные константные области заменены человеческими аналогами константных областей, при сохранении мышиных антиген-связывающих областей. Полученное химерное мышиное-человеческое антитело предпочтительно обладает пониженной иммуногенностью и улучшает фармакокинетику у людей (Knight и соавт., 1993). Поэтому в очередном предпочтительном варианте осуществления настоящего изобретения антитело против IL-18 или против IL-18R является гуманизированным антителом. Предпочтительные примеры гуманизированных антител против IL-18 изложены, например, в европейской патентной заявке ЕР 0974600. Еще в одном предпочтительном варианте осуществления настоящего изобретения данное антитело является полностью антителом человека. Техника получения человеческих антител подробно описана,например, в WO 00/76310, WO 99/53049, патенте США 6162963 или AU 5336100. Первый способ получения полностью человеческих антител состоит из "гуманизации" мышиной гуморальной иммунной системы, т.е. создания линий мышей, способных продуцировать человеческий Ig(ксеногенные мыши), путем введения локусов человеческого иммуноглобулина (Ig) мышам, у которых данные эндогенные Ig-гены были инактивированы. Эти Ig-локусы являются комплексными с точки зрения их физической структуры и генной перестройки, и процессы экспрессии необходимы для одновременного получения широкого иммунного ответа. Первоначально разнообразие антител создается в результате комбинаторной перестройки между различными генами, V, D и J, присутствующими в этих Igлокусах. Эти локусы содержат также разбросанные регуляторные элементы, которые контролируют экспрессию антител, аллельное исключение, тип переключения и филогенетическое сходство созревания. Введение мышам неперестроенных человеческих Ig-трансгенов показывает, что мышиный механизм рекомбинации сопоставим с генами человека. К тому же гибридомы, секретирующие специфичный антиген человеческих моноклональных антител разных изотипов, можно получить путем иммунизации антигеном ксеногенных мышей. Полностью человеческие антитела и способы их создания известны в данной области техники(Mendez и соавт. (1997); Buggemann и соавт. (1991); Tomizuka и соавт. (2000) Патент W0 98/24893). В наиболее предпочтительном варианте осуществления настоящего изобретения ингибитор IL-18 представляет собой IL-18 ВР, или изоформу, немой белок, слитый белок, функциональное производное,активную фракцию или ее измененное кольцевое производное. Эти изоформы, мутеины, слитые белки или функциональные производные сохраняют биологическую активность IL-18BP, в частности способность к связыванию с IL-18, и предпочтительно обладают, по меньшей мере, активностью, сходной с IL18BP. Теоретически, такие белки обладают повышенной биологической активностью в сравнении с немодифицированным IL-18 ВР. Предпочтительные активные фракции обладают активностью, которая превышает активность IL18BP, или которые обладают дополнительными преимуществами, такими как повышенная стабильность или же сниженная токсичность или иммуногенность, или их легче получить в больших количествах, или легче выделить. Последовательности IL-18BP и их сплайсированные варианты/ изоформы можно позаимствовать изWO 99/09063 или от Novick и соавт., 1999, а также у Kim и соавт., 2000. Функциональные производные IL-18BP могут быть соединены с полимерами в целях улучшения свойств белка, таких как стабильность, время полужизни, биологическая активность, переносимость в- 10010180 организме человека, или иммуногенность. Для достижения этой цели IL-18BP можно конъюгировать,например, с полиэтиленгликолем (PEG). Полиэтиленгликолизирование можно осуществить с помощью известных способов, например, описанных в WO 92/13095. Поэтому в предпочтительном варианте осуществления настоящего изобретения ингибиторы IL-18 и, особенно, ингибиторы IL-18BP, полиэтиленгликолизируют. Еще в одном предпочтительном варианте осуществления настоящего изобретения ингибитор IL-18 включает в себя белок слияния иммуноглобулина, т.е. ингибитор IL-18 представляет собой слитый белок, включающий весь или часть белка, связывающего IL-18, который сливается со всем или с частью иммуноглобулина. Способы создания белков, слитых с иммуноглобулином, хорошо известны в данной области техники, один из них, к примеру, изложен в WO 01/03737. Специалистам в данной области техники очевидно, что получение слитого белка настоящего изобретения сохраняет биологическую активность IL-18 ВР, в частности, способность связывания с IL-18. Слияние может происходить непосредственно или с помощью короткого линкерного пептида, длина которого может очень короткой в виде 1-3 аминокислотных остатков или больше, например 13-20 аминокислотных остатков в длину. Указанный линкер может представлять собой, например, трипептидную последовательность E-F-M (Glu-Phe-Met),или 13-аминокислотную линкерную последовательность, включающую Glu-Phe-Gly-Ala-Gly-Leu-ValLeu-Gly-Gly-Gln-Phe-Met, вводимую между последовательностью IL-18BP и иммуноглобулиновой последовательностью. Итоговый слитый белок обладает улучшенными свойствами, такими как пролонгированным временем циркуляции в жидкостях организма (время полужизни), повышенной специфической активностью, повышенным уровнем экспрессии, или более легким выделением очисткой данного слитого белка. В предпочтительном варианте осуществления настоящего изобретения IL-18BP слит с константной областью молекулы Ig. Предпочтительно он слит с участками тяжелой цепи, такими, например, как домены СН 2 и СН 3 IgGl человека. Создание специфичных слитых белков, включающих IL-18BP и часть иммуноглобулина, описано, в частности, в примере 11 WO 99/09063. Другие изоформы молекул Ig также пригодны для создания слитых белков в соответствии с настоящим изобретением, такие как IgG2 илиIgG4, или другие классы Ig, такие, в частности, как IgM или IgA. Слитые белки могут быть мономерными или мультимерными, гетеро- или гомомультимерными. Еще в одном варианте осуществления настоящего изобретения ингибитор IL-18 используют в сочетании с антагонистом TNF. Антагонист TNF проявляет свою активность несколькими способами. Вопервых, антагонисты могут связывать или блокировать собственно молекулу TNF с достаточным сродством и специфичностью, чтобы частично или практически полностью нейтрализовать эпитоп TNF или эпитопы, ответственные за связывание рецептора TNF (именуемые в дальнейшем "блокирующие антагонисты"). Блокирующий антагонист может, например, представлять собой антитело против TNF. Альтернативно, антагонисты TNF могут ингибировать сигнальный путь TNF, активируемый рецептором клеточной поверхности после связывания TNF (именуемые в дальнейшем "сигнальные антагонисты"). Для терапии или профилактики заболеваний сердца пригодными являются обе группы антагонистов, каждая в отдельности или вкупе, в сочетании с ингибитором IL-18. Антагонисты TNF легко идентифицировать и охарактеризовать с помощью стандартного скрининга кандидатов по их воздействию на активность нативного TNF в чувствительных к нему in vitro линиях клеток, например в линиях В-клеток человека, в которых TNF вызывает пролиферацию и секрецию иммуноглобулина. Данный анализ включает композицию TNF с разным разведением антагонистакандидата, например в 0,1-100 раз от молярного количества TNF, используемого в данном анализе, и контроль без TNF или только с антагонистом (Tucci и соавт., 1992). Блокирующие антагонисты являются предпочтительными антагонистами TNF, которые используют в соответствии с настоящим изобретением. Среди блокирующих антагонистов предпочтительными являются полипептиды, которые связывают TNF с высоким сродством и обладают низкой иммуногенностью. Молекулы растворимого рецептора TNF и нейтрализующие антитела к TNF являются особенно предпочтительными. Например, в настоящем изобретении используют растворимые TNF-RI и TNF-RII. Неполные формы этих рецепторов, включающие внеклеточные домены рецепторов или их функциональные части, являются особенно предпочтительными антагонистами в соответствии с настоящим изобретением. Неполные растворимые рецепторы TNF тип I и тип II, описаны, например, в ЕР 914431. Неполные формы рецепторов TNF растворимы и детектируются в моче и сыворотке в виде 30 кДа и 40 кДа, ингибирующих TNF, связывающих белков, которые называют, соответственно, TNFI и TNFII(Engelmann и соавт., 1990). Совместное, последовательное, или раздельное использование ингибитора IL18 и антагониста TNF является предпочтительным в соответствии с настоящим изобретением. Еще в одном предпочтительном варианте осуществления настоящего изобретения растворимыйTNF-RI (TBPI) человека представляет собой антагонист TNF, который используют в соответствии с настоящим изобретением. Нативные и рекомбинантные растворимые молекулы рецептора TNF и способы их получения были описаны в Европейских Патентах ЕР 308378, ЕР 398327 и ЕР 433900. Производные, фрагменты, участки и биологически активные части рецепторных молекул функционально сходны с определенными рецепторными молекулами, которые можно также использозать в на- 11010180 стоящем изобретении. Такой биологически активный эквивалент или производное рецепторной молекулы относится к части полипептида, или к последовательности, кодирующей рецепторную молекулу, которая обладает достаточным размером и способностью связывать TNF с таким сродством, что взаимодействие рецептора TNF, связанного с мембраной, ингибируется или блокируется. Ингибитор IL-18 можно использовать одновременно, последовательно, или раздельно с ингибитором TNF. В соответствии с настоящим изобретением данное лекарственное средство может дополнительно включать известные агенты, используемые при лечении заболеваний сердца, такие как нитраты, например нитроглицерин, диуретики, ингибиторы FCT, дигиталис, бета-блокаторы, или блокаторы кальциевых каналов, в сочетании с ингибитором IL-18. Эти активные компоненты могут использоваться одновременно, последовательно, или раздельно. Еще в одном предпочтительном варианте осуществления настоящего изобретения ингибитор IL-18 используют в количестве около 0,001-100 мкг/кг или около 1-10 мг/кг или 2-5 мг/кг. В соответствии с настоящим изобретением ингибитор IL-18 предпочтительно вводят системно и предпочтительно подкожно или внутримышечно. Кроме того, настоящее изобретение относится к использованию экспрессирующего вектора, включающего кодирующую последовательность ингибитора IL-18, для получения лекарственного средства,применимого для профилактики и лечения заболевания сердца. Таким образом, рассматривается генотерапевтический метод по доставке ингибитора IL-18 в участок, где он необходим. Для того чтобы лечить и/или предупреждать заболевание сердца, генотерапевтический вектор, включающий последовательность ингибитора IL-18 можно, например, инъецировать непосредственно в данную больную ткань, избегая тем самым трудностей, связанных с системным введением генотерапевтических векторов, вроде разведения этих векторов, достигающих и мишенирующих клетки-мишени или ткани-мишени, и побочных эффектов. Использование вектора для стимуляции и/или усиления эндогенного образования ингибитора IL-18 в клетке, обычно не экспрессирующей ингибитор IL-18, или которая экспрессирует недостаточное количество данного ингибитора, также находится в соответствии с целью настоящего изобретения. Вектор может включать регуляторные последовательности, функционирующие в данной клетке, предполагающей экспрессировать ингибитор или IL-18. Такие регуляторные последовательности могут, например,представлять собой промоторы или энхансеры. Затем данную регуляторную последовательность можно интродуцировать в надлежащий локус данного генома с помощью гомологичной рекомбинации, присоединяя таким образом данную регуляторную последовательность к указанному гену путем сшивки, экспрессию которого необходимо индуцировать и усилить. Обычно данную технологию называют "Активация эндогенного гена" (EGA), и она описана, например, в WO 91/09955. Специалистам в данной области техники следует иметь ввиду, что экспрессию IL-18 можно полностью остановить, без использования ингибитора IL-18, с помощью одного и того же метода. Чтобы сделать это, в генный локус IL-18 можно ввести, например, отрицательный регуляторный элемент, например, сайленсер, снижая таким образом регуляцию или предотвращая экспрессию IL-18. Специалистам в данной области техники следует иметь ввиду, что такая пониженная регуляция или глушение экспрессииIL-18 обладает тем же эффектом, что и использование ингибитора IL-18 с целью профилактики и/или лечения заболевания. Кроме того, настоящее изобретение относится к использованию клеток, которые были генетически модифицированы, для получения ингибитора IL-18 при изготовлении лекарственного средства, применимого для лечения и/или профилактики заболевания сердца. Ингибитор IL-18, используемый в соответствии с настоящим изобретением, можно предпочтительно вводить в виде фармацевтической композиции, необязательно в сочетании с терапевтически эффективным количество ингибитора TNF.IL-18BP и его вышеописанные изоформы, мутеины, слитые белки, функциональные производные,активные фракции или круговые перестановочные производные являются предпочтительными ингредиентами фармацевтических композиций. Определение "фармацевтически приемлемый" подразумевает включение любого носителя, который не препятствует эффективной биологической деятельности активного компонента и который не токсичен для хозяина, которому он вводится. Например, для парентерального введения можно приготовить активный(е) белок(и) в виде дозированной единицы для инъекции на основе, например, физиологического раствора, сывороточного альбумина или раствора Рингера. Активные ингредиенты данной фармацевтической композиции, в соответствии с настоящим изобретением, можно ввести индивидуально разными способами. Пути введения включают внутрикожный,чрескожный (например, для медленного высвобождения композиций), внутримышечный, внутрибрюшинный, внутривенный, подкожный, пероральный, внутричерепной, эпидуральный, местный и интраназальный пути. Можно использовать любой другой эффективный путь введения, например поглощение через эпителиальную или эндотелиальную ткань или генотерапевтическим путем, при котором пациенту вводят ДНК-молекулу (например, с помощью вектора), кодирующую данный активный агент, что за- 12010180 ставляет введенный активный агент экспрессироваться и секретироваться in vivo. Кроме того, в соответствии с настоящим изобретением белок(и) можно вводить вместе с другими компонентами биологически активных агентов, таких, например, как фармацевтически приемлемые поверхностно-активные вещества,наполнители, носители, разбавители и средства доставки. Для парентерального введения (например, внутривенного, подкожного, внутримышечного) активный белок(и) можно составить в виде раствора, суспензии, эмульсии или лиофилизированного порошка с фармацевтически приемлемым парентеральным средством доставки (например, воды, физиологического раствора, декстрозного раствора) и с добавками, которые поддерживают изотоничность (например, маннит) или химическую стабильность (например, консерванты и буферы). Составленную композицию стерилизуют с помощью обычно используемых методов. В соответствии с настоящим изобретением биодоступность активного белка(ов) можно также улучшить путем использования методов присоединения, с помощью которых повышают время полужизни его молекул в организме человека, присоединяя, например, данную молекулу к полиэтиленгликолю,как описано в патентной заявке РСТ WO 92/13095. Терапевтически активные количества активного белка(ов) зависят от многих переменных, включая вид антагониста, сродство антагониста против IL-18 и остаточную цитотоксическую активность, проявляемую данными антагонистами, путь введения, клиническое состояние пациента (в том числе желательно поддержание нетоксичного уровня эндогенной активности IL-18)."Терапевтически эффективное количество" составляет такое вводимое количество, что при его введении ингибитор IL-18 подавляет биологическую активность IL-18. Вводимая доза для однократного или многократного приема индивидом варьирует в зависимости от разных факторов, включая фармакокинетические свойства ингибитора IL-18, путь введения, состояние пациента и его данные (пол, возраст, масса тела, жизнеспособность, объем), длительность симптомов, сопутствующее лечение, частота лечения и ожидаемый эффект. Согласование и процедура выбора диапазона доз находится в пределах возможностей специалистов в данной области техники, а также способов in vitro и in vivo, определяющих степень ингибирования IL-18 для индивида. В соответствии с настоящим изобретением ингибитор IL-18 используют в количестве около 0,001100 мг/кг или около 0,1-10 мг/кг массы тела, или около 0,1-5 мг/кг массы тела, или около 1-3 мг/кг массы тела, или около 2 мг/кг массы тела. Путь введения, который предпочтителен в соответствии с настоящим изобретением, представляет собой подкожный путь введения. В соответствии с настоящим изобретением предпочтительным является также внутримышечное введение. Для того чтобы ввести ингибитор IL-18 непосредственно в определенное место его действия, его можно также ввести местно. В других дополнительных предпочтительных вариантах осуществления настоящего изобретения ингибитор IL-18 вводят ежедневно или через день. Ежедневные дозы обычно указывают в виде расчлененных доз, для замедленного высвобождения,что эффективно для получения желаемых результатов. Второе или последующее введение можно осуществить в той же дозе, меньшей или большей от начального или предыдущего введения данному индивиду. Второе или последующее введение можно осуществить во время данного заболевания или перед его началом. В соответствии с настоящим изобретением ингибитор IL-18 можно вводить индивиду с профилактической или терапевтической целью в терапевтически эффективном количестве до, одновременно или после других терапевтических схем или агентов (например, множественных лекарственных схем), в частности, вместе с ингибитором TNF и/или другим кардиозащитным агентом. Активные агенты, которые вводят одновременно с другими терапевтическими агентами, можно вводить в составе одних и тех же или разных композиций. Настоящее изобретение относится также к способу получения фармацевтической композиции,включающей смешивание эффективного количества ингибитора IL-18 и/или антагониста TNF с фармацевтическим приемлемым носителем. Настоящее изобретение относится также к способу лечения заболевания сердца, включающему введение пациенту, нуждающемуся в них, фармацевтически эффективного количества ингибитора IL-18,необязательно в сочетании с фармацевтически эффективным количеством антагониста TNF. Теперь, обладая полным описанием настоящего изобретения, специалистам в данной области техники следует принять во внимание, что его можно осуществлять в широком диапазоне эквивалентных параметров, содержания и условий, не выходя за рамки существа и объема настоящего изобретения и без чрезмерного экспериментирования. Хотя настоящее изобретение описано в связи со специфическими вариантами его осуществления,следует иметь ввиду, что оно может быть подвергнуто дополнительным модификациям. Данная заявка подразумевает включение любых изменений, назначений или переделок настоящего изобретения и в том числе таких отклонений от настоящего существа изобретения, которые находятся в пределах известной или обычной практики, к которой относится настоящее изобретение и которые могут быть применены к существенным признакам, сформулированным выше, так же как и в рамках нижеследующей формулы- 13010180 изобретения. Все приведенные здесь ссылки, включая журнальные статьи и рефераты, опубликованные или неопубликованные в патентных заявках США или в иностранных патентных заявках, изданных в США,или в иностранных патентах, или любые другие ссылки, полностью включены здесь путем ссылки,включая все данные, таблицы, рисунки и текст, представленные в цитируемых ссылках. Кроме того,полное содержание ссылок в рамках цитируемых здесь ссылок также полностью включено путем ссылки. Ссылка на известные стадии способа, стадии традиционных способов, на известные способы или на традиционные способы не является каким-либо признанием факта раскрытия любого аспекта, описания или варианта осуществления настоящего изобретения, сообщенного или подтвержденного в данной области техники. Вышеизложенное описание специфических вариантов осуществления настоящего изобретения настолько полно обнаруживает общую природу настоящего изобретения, что другие, применяя знания специалиста в данной области техники (в том числе и содержание процитированных здесь ссылок), могут легко модифицировать и/или адаптировать различное применение таких специфических вариантов осуществления настоящего изобретения без чрезмерного экспериментирования, не выходя за рамки основной концепции настоящего изобретения. Поэтому подразумевается, что такие адаптации и модификации являются эквивалентами изложенных вариантов осуществления настоящего изобретения, основанными на представленных здесь указаниях и общей ориентации. Следует иметь ввиду, что используемые здесь формулировки или терминология предназначена для целей описания и не ограничивается, так что терминология или формулировки настоящего описания могут интерпретироваться специалистами в данной области техники в свете представленных здесь указаний и общей ориентации и в соответствии со знаниями рядовых специалистов в данной области техники. Примеры Пример 1. Ингибирование IL-18 уменьшает ишемическую дисфункцию миокарда in vitro. Материал и методы Реагенты. Изоформу IL-18BP экспрессируют с N-концевой меткой (His)6 в овариальных клетках китайского хомячка и выделяют очисткой до гомогенности. Способность IL-18BP-(His)6 нейтрализовать IL18 была описана (Kim и соавт., 2000). Ингибитор ICE (ICEi) Ac-Try-Val-Ala-Asp-хлорметилкетон(YVAD) получают от Alexis Biochemicals (San Diego) и растворяют в DMSO до 10 мг/мл. Перед использованием ICEi разбавляют раствором Tyrode's. В моноядерных клетках периферической крови человекаICEi уменьшает индуцированную эндотоксином секрецию зрелого IL-1 на 92%, что измерено в ELISA(Cistron Biotechnology, Pine Brook, NJ). Выделение трабекул предсердий. Пациенты, подвергающиеся операции избирательного шунтирования коронарной артерии, с использованием насоса-оксигенатора, нуждаются в введении канюли в правое предсердие. В этот момент обычным способом вырезают и откладывают небольшой сегмент ушка правого предсердия. Из этой отложенной ткани получают трабекулы. Ткань предсердий человека помещают в огксигенированный буферный раствор Tyrode's при 4 С. Модифицированный раствор Tyrode's готовят ежедневно на деионизованной дистиллированной воде, который содержит 5 ммоль/литр Dглюкозы, 2,0 ммоль/литр CaCl2, 118,0 ммоль/л NaCl, 4,0 ммоль/л KCl, 1,2 ммоль/л MgSO47H2O, 25 ммоль/л NaHCO3 и 1,2 ммоль/л NaH2PO4. Свободный от субстрата раствор Tyrode's содержит 7 ммоль/л холинхлорида для поддержания осмотического давления. Если не указано иначе, химикалии и реагенты получают от Sigma. Две-четыре трабекулы (4-7 мм длиной и 1,0 мм в диаметре) подсоединяют к динамометрическому датчику и погружают в нагретую (37 С) 30 мл термостатированную ванну с модифицированным раствором Tyrode's; во время normoxia пропускают в виде пузырьков смесь из 92,5%О 2/7,5%CO2. Данная газовая смесь создает парциальное давление О 2 350 мм рт.ст. (1 мм рт.ст.=133 Па), парциальное давление СО 2 36-40 мм рт.ст. и рН 7,35-7,45. Каждый параметр контролируют обычным способом с помощью автоматического газового анализатора крови. В эксперименте температуру органа в термостатированной ванне поддерживают на уровне 37 С. Во время моделирования ишемии указанную газовую смесь переключают на смесь, содержащую 92,5% N2/7,5% СО 2. Данная смесь создает парциальное давление О 2 50 мм рт.ст. Указанный буферный раствор меняют каждые 20 мин, за исключением 30 мин периода моделирования ишемии. План эксперимента. Трабекулы уравновешивают в течение 90 мин для увеличения базовой сократимости до 1000 мг и полученную сократимость стабилизируют. Трабекулы, сократимость которых составляет несколько более 250 мг, исключают из исследования. Во время 90 мин уравновешивания кардиостимуляцию осуществляют с помощью платиновых электродов (Radnoti Glass, Monrovia, CA) в области стимуляции. Платиновые электроды помещают на любую сторону трабекул, стимулируют (GrassSD9 stimulator, Warwick, RI) 6 мс импульсами при напряжении на 20% выше порога и в течение normoxia задают шаг в 1 Гц, а в течение ишемии - в 3 Гц. Сокращения отслеживают при помощи динамометрических датчиков (Grass FT03) и регистрируют с помощью компьютеризованного предусилителя и цифрового датчика (MacLab Quad Bridge, MacLab/8e, AD Instruments, Milford, MA) и непрерывно отслеживают- 14010180 с помощью компьютера фирмы Макинтош. После уравновешивания трабекулы отдельного пациента исследуют в трех экспериментальных условиях: контрольные условия включают 90 мин нормальной оксигенации при усиленной перфузии; I/R включает 30 мин моделированную ишемию с последующей 45 мин реперфузией; и третье условие включает антицитокиновое воздействие. В последнем случае антицитокин добавляют в термостатированную ванну с усиленной перфузией как раз перед началом ишемии, и он присутствует на протяжении 45 мин реперфузии. Сохранение активности КК трабекул. По окончании тканевой реперфузии определяют ККактивность, как описано (Kaplan и соавт., 1993). Ткани гомогенизируют в 100 объемах ледяного изотонического буфера для экстракции (Cleveland и соавт., 1997, Kaplan и соавт., 1993). Данный анализ осуществляют с помощью набора для КК (Sigma) с использованием автоматического спектрофотометра. Результаты представлены в виде единиц активности КК на мг (массы сырой ткани). Выделение РНК и сопряженная ревертазная ПЦР. Свежевыделенные трабекулы гомогенизируют в Tri-Reagent (Molecular Research Center, Cincinnati),а тотальную РНК выделяют с помощью экстрагирования хлороформом и осаждения изопропанолом. Выделенную РНК растворяют в водном диэтилпирокарбонате, обрабатывают ДНКазой и определяют количественно с использованием GeneQuant (Amersham Pharmacia Biotech). кДНК-овые способы описаны (Reznikov и соавт., 2000). В каждой ПЦР используют следующую последовательность операций: предварительное нагревание при 95 С в течение 15 мин, с последующими циклами 94 С в течение 40 с,55 С в течение 45 с и 72 С в течение 1 мин, с фазой завершающего удлинения при 72 С в течение 10 мин Оптимальное число циклов определено в количестве 35. Приведены праймеры для глицеральдегид-3 фосфатдегидрогеназы (GAPDH) и IL-18 человека (Reznikov и соавт., 2000), а также для IL-18BP человека(Kim и соавт., 2000). Полученные продукты ПЦР разделяют в 1,5%-ном агарозном геле, содержащем 0,5 ТВЕ (50 мМ Трис/45 мМ борная кислота/0,5 мМ ЭДТА, рН 8,3) и этидийбромид в количестве 0,5 мг/мл, визуализируют путем облучения УФ и фотографируют. Денситометрию осуществляют по негативному изображению (IMAGEQUANT software, Molecular Dynamics), а относительную поглощающую способность ПЦР-продуктов IL-18 и IL-18BP уточняют против поглощения, полученного для GAPHD. Определение IL-18. Свежеполученные трабекулы гомогенизируют, как указано выше для измерения КК. IL-18 анализируют с помощью жидкофазной хемилюминисценции (ECL, Igen. Gaithersburg,MD). Мышиные антитела против IL-18 человера (RD Systems) метят с помощью рутения (Igen). Кроме того, выделенные очисткой по сродству козьи антитела против IL-18 человека (RD) метят биотином(Igen). Полученные биотинилированные антитела разбавляют до конечной концентрации 1 мкг/мл в PBS(рН 7,4), содержащем 0,25% BSA, 0,5% Твин-20 и 0,01% азида (ECL-буфер). В аналитической пробирке при комнатной температуре преинкубируют 25 мкл биотинилированных антител с 25 мкл покрытых стрептавидином парамагнитных бусинок (Dynal, Great Neck, NY) в концентрации 1 мкг/мкл в течение 30 мин при энергичном встряхивании. Тестируемые образцы (25 мкл) или стандарты вносят в пробирки вслед за 25 мкл меченных рутением антител (конечная концентрация 1 мкг/мкл, разбавленная ECLбуфером). Затем эти пробирки встряхивают в течение 24 ч. Данную реакцию заглушают добавлением 200 мкл PBS на пробирку и в анализаторе Origen Analyzer (Igen) количественно определяют хемилюминисценцию. Предел обнаружения для IL-18 составляет 16 пкг/мл. Софокальная микроскопия. Ткань предсердия человека, полученную во время введения канюли насоса-оксигенатора, помещают в пластиковый 1 сантиметровый держатель (Meldrum и соавт., 1998) и замораживают в среду для замораживания тканей (Triangle. Biomedical Sciences, Durham, NC) в изопентане,охлаждаемом сухим льдом. Замороженные срезы нарезают в криостате Leica CM 1850 (Leica, Deerfield,IL). Срезы на предметных стеклах фиксируют в течение 10 мин в 4%-м параформальдегиде, высушивают на воздухе и инкубируют в течение 20 мин в PBS с добавлением 10% нормальной козьей сыворотки крови. Срезы инкубируют в разбавленных 1:100 антителах против IL-18 человека (Peprotech, Rocky Hill, NJ) или неиммунных IgG кролика при концентрации 1 мкг/мл в качестве негативного контроля. Эти антитела разбавляют в PBS, содержащем 1% BSA. После инкубации в течение ночи при 4 С инкубированные срезы трижды промывают с помощью 0,5 BSA в PBS. Затем промытые срезы инкубируют в темноте при комнатной температуре в течение 60 мин с конъюгированными с Alexa488 (Molecular Probes) вторичными козьими антителами против кроличьих антител. Ядра окрашиваются бисбензимидом (Sigma) при 1 мкг/100 мл в голубой цвет. После окраски срезы промывают и просматривают в софокусной лазерной сканирующей системе с последующим анализом в компьютере с использованием программы SLIDEBOOK для компьютера Макинтош (Intelligent Imaging Innovations, Denver). Статистический анализ. Данные представлены в виде среднихSEM. Среднее изменение для развиваемого усилия рассчитывают относительно контрольного значения в течение 90 мин для каждой ткани пациента. Статистическую значимость различий между группами определяют с помощью факторного дисперсионного анализа ANOVA с последующим Bonferroni-Dunn-анализом. Статистические вычисления осуществляют с помощью программы STAT-VIEW 4,51 (Abacus Concepts, Calabasas, CA).- 15010180 Результаты Эффект нейтрализации эндогенного IL-18 и IL-18BP на создание постишемической сократимости. На фиг. 1 А представлен кинетический ответ трабекул на I/R-повреждение. Показано завершающее 15 мин уравновешивание и 100%-я нормализация к началу экспериментального периода. Во время эксперимента в условиях нормальной оксигенации контрольные трабекулы подвергаются усиленной перфузии. Для контрольных трабекул показано снижение (10%) в сократимости. Трабекулы, подвергающиеся ишемии, быстро ухудшают сократительную функцию; при реперфузии сила сокращения восстанавливается приблизительно, на 25% от создаваемой в контроле сократимости. Напротив, трабекула подвергнутая ишемии, но в присутствии IL-18 ВР, восстанавливается на 55% от создаваемой в контроле сократимости. Чтобы определить I/R-ответ тканей сердца от нескольких пациентов, уровень создания сократимости для контрольных трабекул в течение 90 мин берут за 100% для каждого образца пациента и рассчитывают относительное процентное изменение для создания сократимости в экспериментальных группах. Как показано на фиг. 1 В, создаваемая постишемическая сократимость для необработанных трабекул (I/R) снижается в среднем на 35% от контроля. Однако в присутствии IL-18BP это снижение уменьшается, соответственно, в среднем на 66,2% от контроля, при 1 мкг/мл и на 76% при 5 мкг/мл. Данные результаты подтверждают, что I/R приводит к высвобождению биологически активного IL-18 после процессинга эндогенного предшественника IL-18 с помощью ICE. Поэтому, IL-18 измеряют в свежеполученной ткани предсердия. Как показано на фиг. 2, в трабекулах, полученных перед введением канюли насоса-оксигенатора в правое предсердие, представлен базисный IL-18. Через 90 мин уравновешивания,30 мин ишемии и 45 мин реоксигенации трабекулы гомогенизируют и определяют уровень IL-18. Отмечено 4,5-кратное увеличение IL-18 в данной ткани после I/R (фиг. 2). В этих тканях определяют также постоянные уровни мРНК для IL-18 и IL-18BP. В свежеполученных гомогенатах предишемического предсердия наблюдается основная генная экспрессия IL-18 и IL18 ВР (фиг. 3 А, В). Наряду с повышением уровня IL-18-белка I/R индуцирует также устойчивое увеличение уровней мРНК IL-18 (4,7-кратное увеличение). Генная экспрессия IL-18BP наблюдается также в свежеполученной ткани предсердия и увеличивается лишь ограниченно после I/R (в 1,3 раза). Обнаружение IL-18 в миокарде человека. Поскольку и белок IL-18, что измерено с помощью TCL, и мРНК IL-18 присутствуют в свежеполученных гомогенатах миокарда, для определения нахождения IL18 используют гистохимическое окрашивание. Ткани предсердия получают непосредственно перед введением канюли насоса-оксигенатора и сразу мгновенно замораживают (не показано). IL-18 наблюдают в оседлых макрофагах миокарда и в сосудистых эндотелиальных клетках. IL-18 в макрофагах и в эндотелиальных клетках присутствует перед любым связанным с ишемией процессом в отсутствие контакта с любой инородной поверхностью. Данные о локализации IL-18 в оседлых макрофагах и в эндотелиальных клетках согласуются с предшествующими исследованиями конститутивного заранее созданного предшественника IL-18 в свежеполученных периферических человеческих моноцитах от здоровых пациентов(Puren и соавт., 1999). Поэтому можно заключить, что заранее созданный предшественник IL-18 существует в миокарде пациента, с ишемической болезнью сердца, которого запланировали на коронарное шунтирование. Влияние ICE-ингибирования на создаваемую постишемическую сократимость. Поскольку IL-18BP эффективно ослабляет вызванную ишемией дисфункцию миокарда, авторы предполагают, что ингибирование превращения заранее сформированного предшественника IL-18 в зрелый IL-18 будет также ослаблять вызванную ишемией дисфункцию миокарда. Поэтому специфический ингибитор ICE YVAD добавляют в термостатированную ванну с усиленной перфузией до возникновения ишемии. Ингибитор ICE осуществляют путем непрерывного добавления YVAD в период ишемии и на протяжении восстановления кровотока. YVAD-опосредованное ингибирование ICE приводит к ослаблению вызванной ишемией дисфункции миокарда, что показано в результате улучшения сократительной функции с 35% в контроле для I/R до 60% при 10 мкг/мл и 75,8% при 20 мкг/мл (фиг. 4). Эти результаты подтверждают, что биологически активный IL-18 в человеческом миокарде является результатом расщепления заранее созданного предшественника IL-18 с помощью ICE. Кроме того, данные результаты подтверждают, что ишемия миокарда может активировать латентный ICE. Сохранение клеточной жизнеспособности. Внутриклеточные уровни КК используют для оценки степени клеточной жизнеспособности послеI/R. В данном анализе наибольшему значению КК соответствует большее количество жизнеспособных клеток. Каждое воздействие антицитокина сохраняет клеточную жизнеспособность. Как показано на фиг. 5, ингибирование IL-18BP- и ICE- (10 и 20 мкг/мл) повышает внутриклеточные уровни КК после I/R с 1,399 до, соответственно, 5,921, 5,675, 6,624, и 4,662 единиц активности КК на мг (сырой ткани). Эти наблюдения подтверждают, что ингибирование индуцированной I/R активации IL-18 сохраняет жизнеспособность клеток миокарда в данной ex vivo-модели. Влияние нейтрализации TNF-индуцированной функции миокарда. Как показано на фиг. 6, развиваемое усилие (DF) трабекул было снижено на 18% после 90 мин воздействия экзогенного TNF . Нейтрализация действия эндогенного IL-13 на сократительную функцию- 16010180 человеческого миокарда, экспонируемого с экзогенным TNF , путем инкубации с IL-18BP в течение десяти минут перед добавлением TNF, снижает величину ослабления развиваемого усилия (DF), смотрите фиг. 6. Через 90 мин развиваемое усилие в контрольной группе было уменьшено на 18%, тогда как для трабекул, экспонированных с TNF, оно уменьшилось на 58% по сравнению с контролем. Однако,для трабекул, экспонированных с TNF и с IL-18BP сократимость ослабла лишь на 30% по сравнению с контролем. Эти данные подтверждают, что прямое угнетающее действие TNF на сократительную способность миокарда опосредуется, по меньшей мере частично, биологически активным эндогенным IL-18. Влияние экзогенного IL-18 на создаваемую сократимость Далее определено прямое действие экзогенного IL-18 на сократительную функцию миокарда. IL-18 добавляют к трабекулам при усиленной перфузии после 90 мин уравновешивания и при каждой смене термостатированной ванны. Как показано на фиг. 7, действие IL-18 в течение экспериментального периода ведет к медленному, но постепенному снижению развиваемого усилия. После 90 мин непрерывного выдерживания с IL-18 развиваемое усилие снижается на 42%. Эти данные свидетельствуют, что экзогенный IL-18, подобно TNF, действует на миокард в качестве депрессанта. Интересно, что IL-18 не является сильным депрессантом миокарда как это присуще TNF. Сохранение клеточной жизнеспособности. Каспазы часто ассоциируются с апоптозом. Чтобы оценить жизнеспособность клеток трабекул, экспонированных в TNF , измеряют внутриклеточную КК их ткани. В данном анализе высокие уровни КК служат признаком жизнеспособности клеток. Как изображено на фиг. 8, контрольные трабекулы, которые в течение 90 мин претерпевают усиленную перфузию в условиях нормальной оксигенации, содержат 6801 276 единиц активности КК на миллиграмм массы сырой ткани. В противоположность этому, трабекулы, подвергнутые 30/45-минутному I/R повреждению или 90-минутному воздействию TNF проявляют сниженные уровни сохраненной КК, соответственно, 3246 217 единиц/мг. Трабекулы, выдержанные с TNF в присутствии IL-18BP, содержат 5605 212 единиц/мг ткани. Интересно отметить, что трабекулы, обработанные TNF, сохраняют более высокие уровни КК по сравнению с I/R-трабекулами. Это явилось неожиданной находкой, так как величина развиваемого усилия в конце экспериментального периода оказалась аналогичной для I/R и TNF. Пример 3. IL-18BP защищает от инфаркта миокарда IL-18BP in vivo. Внутримышечный in vivo-электроперенос мышиной плазмиды, экспрессирующей IL-18. МышейC57BL/6 получают с 3-недельным интервалом, инъецируют 3 раза экспрессирующей плазмидой, содержащей кДНК IL-18BP (названной рсДНК-IL-18 ВР и описанной в WO 01/85201). Контрольных мышей инъецируют контрольной пустой плазмидой. Мышиную изоформу IL-18BP кДНК, выделенную как описано (вспомогательный номерQ9ZOM9) (Kim и соавт., 2000), субклонируют в EcoRl/Notl-сайт экспрессирующего вектора рсДНК 3 клетки млекопитающего под контролем цитомегаловирусного промотора(Invitrogen). Контрольная плазмида была аналогичной конструкции за исключением терапевтической кДНК. Контрольная группа содержала 31 мышь, а экспериментальная группа, получающая IL-18BP,включала 27 мышей. Контрольную экспрессионную плазмиду, или экспрессионную плазмиду с IL-18BP, (60 мкг) инъецируют и в большеберцовую, и в черепную мышцу анестезированных мышей, как описано раньше (Mallat и соавт., 1999). Вкратце, чрескожные электрические импульсы (8 прямоугольных импульсов 200 В/см,продолжительностью 20 мс при 2 Гц) выдаются с помощью мультивибратора PS-15 (Genetronic, France) и с использованием двух электродов в виде пластин из нержавеющей стали на расстоянии друг от друга 4,2-5,3 мм с каждой стороны лапки. Индукция инфаркта в левом желудочке. Через двадцать четыре часа после введения плазмиды IL-18BP или пустой плазмиды, мышей анестезируют с помощью IP-инъекции ксилазина или кетамина, подключают к внешнему дыханию и подвергают торакотомии. Используя 8-0 пролен (длинный) шовный материал, надолго перевязывают левую магистральную коронарную артерию с тем, чтобы вызвать инфаркт миокарда, после чего закрывают грудную клетку и животных оставляют пробудиться от анестезии. Гибель во время операции составляет менее 20%. Послеоперационная гибель достигает 48% в контрольной группе и 26% - в экспериментальной группе, которая случается почти исключительно через 4-5 дней после перевязки сосуда. Через семь дней после лигирования мышей повторно анестезируют и с помощью электрокардиографии определяют объем левого желудочка (LV) в закрытой грудной клетке, используя для этого электрокардиограф ATL HDI 5000, Дробное укорочение LV рассчитывают по измерению поперечника в конце диастолы и в конце систолы. По окончании электрокардиографического измерения сердце извлекают,фиксируют, после чего делают срезы. Затем гистологические срезы окрашивают с помощью сириуса красного для определения размера инфаркта. Результаты У выживших мышей диастолический поперечник левого желудочка после семи дней наложения лигатуры оказался следующим: 0,53+0,01 мм (n=20) у мышей, обработанных с помощью IL-18 ВР против 0,59+0,01 у контрольных- 17010180 мышей (n+16), р 0,01. У выживших мышей систолический поперечник левого желудочка после семи дней наложения лигатуры оказался следующим: 0,45+0,02 у мышей, обработанных с помощью IL-18BP против 0,52+0,02 у контрольных мышей,р 0,01. Дробное укорочение левого желудочка: 15+1% у мышей, обработанных с помощью IL-18BP против 11+1% у контрольных мышей, р 0,01. Заключение: IL-18BP снижает смертность среди мышей после инфаркта миокарда, вызванного полным коронарным лигированием левого желудочка, на 50%. Помимо этого, функция левого желудочка существенно улучшается, как показано по уменьшенному систолическому и диастолическому поперечнику данного левого желудочка. Ссылки 1. Bolli.R. (1990) Circulation 82,723-38. 2. Buggemann et al.,EurJ.lmmunol.21:1323-1326(1991) 3. Cain B.S., Meldrum D.R., Dinarello C.A., Meng X., Banerjee A.Harken A. H.(1998)J Surg Res 76,117-23. 4. Cleveland J. C. J., Meldrum, D. R. Cain B. S., Banerjee A.Harken A. H. (1997) Circulation 96, 2932. 5. Daemen M. A., van't Veer C., Wolfs G., et al.: Ischemia/reperfusion-induced IFN-gamma up-regulation:- 18010180 148,2778-2784. 30. Yoshimoto T., Takeda K., Tanaica T., Ohkusu K., Kashwamura S., Okamura Н., Akira S. and Nakanishi K. (1998). J. Immunol. 161, 3400-3407. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибитора IL-18 для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из ингибитора каспазы-1 (ICE), антител против IL-18, антител против любой субъединицы рецептора IL-18 и белков, связывающих IL-18, или их изоформ, мутеинов, слитых белков или функциональных производных, ингибирующих биологическую активность IL-18. 2. Применение по п.1, где ингибитор IL-18 представляет собой антитело против IL-18. 3. Применение по п.1, где ингибитор IL-18 представляет собой антитело против рецептораIL-18. 4. Применение по п.1, где ингибитор IL-18 представляет собой антитело против рецептораIL-18. 5. Применение по любому из предшествующих пунктов, где антитело является гуманизированным или человеческим антителом. 6. Применение по п.1, где ингибитор ICE представляет собой Ac-Tyr-Val-Ala-Asp-хлорметилкетон(YVAD). 7. Применение по п.1, где ингибитор IL-18 является белком, связывающим IL-18, или его изоформой, мутеином, слитым белком или функциональным производным, ингибирующим биологическую активность IL-18. 8. Применение по п.6, где ингибитор IL-18 гликолизирован по одному или нескольким участкам. 9. Применение по п.6 или 7, где слитый белок включает в себя белок слияния иммуноглобулина(Ig). 10. Применение по любому из пп.6-8, где функциональное производное включает по меньшей мере один радикал, связанный с одной или несколькими функциональными группами, которые представлены в виде одной или нескольких боковых цепей в аминокислотных остатках. 11. Применение по п.9, где указанный радикал представляет собой полиэтиленовый радикал. 12. Применение экспрессирующего вектора, содержащего нуклеотидную последовательность, кодирующую ингибитор IL-18, для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из антител против IL-18, антител против любой субъединицы рецептора IL-18 и белков, связывающих IL-18, или их изоформ, мутеинов, слитых белков, ингибирующих биологическую активность IL-18. 13. Применение экспрессирующего вектора, индуцирующего и/или усиливающего образование эндогенного ингибитора IL-18 в клетке для приготовления лекарственного средства, для лечения и/или профилактики кардиомиопатии, где ингибитор IL-18 выбран из белков, связывающих IL-18, или их изоформ, ингибирующих биологическую активность IL-18.
МПК / Метки
МПК: A61K 39/395, A61P 9/10, A61K 48/00, A61K 38/17
Метки: профилактики, приготовления, применение, лекарственного, лечения, кардиомиопатии, ингибитора, il-18, средства
Код ссылки
<a href="https://eas.patents.su/22-10180-primenenie-ingibitora-il-18-dlya-prigotovleniya-lekarstvennogo-sredstva-dlya-lecheniya-i-ili-profilaktiki-kardiomiopatii.html" rel="bookmark" title="База патентов Евразийского Союза">Применение ингибитора il-18 для приготовления лекарственного средства для лечения и/или профилактики кардиомиопатии</a>
Предыдущий патент: Биохимический синтез 1,4-бутандиамина
Следующий патент: Фосфолипидные смазывающие вещества в жидкостях для бурения на водной основе
Случайный патент: 4-[5-метил-3-фенилизоксазол-4-ил] бензолсульфонамид