Полиморфные модификации дофетилида
Номер патента: 2656
Опубликовано: 29.08.2002
Авторы: Ньюбери Тревор Джек, Николз Гари, Эпплби Айан Колин
Формула / Реферат
1. Способ получения кристаллической полиморфной формы дофетилида, заключающийся в получении полиморфной модификации этого вещества либо путем кристаллизации любой из его форм или их смеси из водного ацетонитрила, либо путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта, либо путем растворения любой из его форм или их смеси в метаноле, нанесения полученного раствора на силикагелевую колонку, элюирования этой колонки метанолом и концентрирования элюированного раствора до сухого состояния с получением продукта.
2. Способ по п.1, отличающийся тем, что, при получении полиморфной модификации дофетилида путем кристаллизации любой из его форм или их смеси из водного ацетонитрила используют смесь ацетонитрил:вода в соотношении от 98,5:1,5 до 99,5:0,5 по объему.
3. Способ по п.2, отличающийся тем, что используют смесь ацетонитрил:вода в соотношении приблизительно 99:1 по объему.
4. Способ по п.1, отличающийся тем, что при получении полиморфной модификации дофетилида путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта основание представляет собой гидроксид натрия.
5. Способ по п.1 или 4, отличающийся тем, что при получении полиморфной модификации дофетилида путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта кислота представляет собой минеральную кислоту, такую как соляная кислота.
6. По существу чистая, кристаллическая полиморфная модификация дофетилида Р162, которая характеризуется эндотермическим пиком при приблизительно 162шС.
7. Полиморфная модификация дофетилида Р162 по п.6, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuK-альфа1: dÅ 21,303, 10,597, 7,053, 5,288, 5,088, 4,856, 4,793, 4,569, 4,504, 4,430, 4,256, 4,230, 4,133, 3,956, 3,911, 3,866, 3,674, 3,606, 3,524, 3,424, 3,384, 3,309, 3,255, 3,171, 3,083, 3,038, 3,021, 2,893, 2,842, 2,776, 2,679, 2,598, 2,557, 2,503, 2,482, 2,436, 2,419, 2,399, 2,345 и 2,323.
8. Полиморфная модификация дофетилида Р162 по п.6 или 7, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3246, 3013, 2807, 2776, 1907, 1611, 1593, 1510, 1398, 1366, 1357, 1321, 1300, 1277, 1251, 1220, 1171, 1146, 1106, 1091, 1051, 1031, 1023, 994, 966, 934, 925, 903, 851, 825, 808, 774, 723, 657, 603, 586, 559, 538, 528, 509, 499, 461 и 431 см-1.
9. Фармацевтическая композиция, содержащая полиморфную модификацию дофетилида Р162 по пп.6, 7 или 8 вместе с фармацевтически приемлемым разбавителем или носителем.
10. Композиция по п.9, которая пригодна для введения в капсульной лекарственной форме.
11. Полиморфная модификация дофетилида Р162 по пп.6, 7 или 8 или ее фармацевтически приемлемая композиция по п.9 или 10 для применения в качестве лекарства.
12. Применение полиморфной модификации дофетилида Р162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10 для производства антиаритмического агента.
13. Применение полиморфной модификации дофетилида Р162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10 для производства лекарства для лечения сердечной недостаточности, в частности застойной сердечной недостаточности.
14. Способ лечения сердечной аритмии, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10.
15. Способ лечения сердечной недостаточности, в частности застойной сердечной недостаточности, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10.
16. По существу чистая, кристаллическая полиморфная модификация дофетилида Р162а, которая характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 160шС.
17. Полиморфная модификация дофетилида Р162а по п. 16, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuK-альфа1: dÅ 21,306, 10,603, 7,054, 5,289, 5,114, 5,094, 4,860, 4,572, 4,431, 4,260, 4,247, 4,228, 4,153, 4,136, 3,955, 3,870, 3,676, 3,607, 3,524, 3,435, 3,421, 3,384, 3,176, 3,038, 2,895, 2,778, 2,684, 2,559, 2,501, 2,486, 2,433, 2,326, 2,283, 2,248, 2,216, 2,171, 2,119, 2,051, 1,989 и 1,948.
18. Полиморфная модификация дофетилида Р162а по п.16 или 17, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3246, 3013, 2807, 2776, 1907, 1611, 1593, 1510, 1397, 1366, 1357, 1321, 1300, 1277, 1251, 1220, 1171, 1146, 1106, 1091, 1051, 1031, 1023, 994, 966, 934, 926, 903, 851, 825, 807, 774, 726, 657, 602, 586, 559, 538, 528, 509, 499, 461 и 430 см-1.
19. По существу чистая, кристаллическая полиморфная модификация дофетилида Р143, которая характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 144шС.
20. Полиморфная модификация дофетилида Р143 по п.19, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuK-альфа1: dÅ 10,993, 9,006, 8,243, 6,769, 5,807, 5,530, 5,375, 5,104, 4,998, 4,735, 4,575, 4,539, 4,237, 4,179, 4,159, 4,019, 3,854, 3,705, 3,682, 3,601, 3,562, 3,482, 3,392, 3,343, 3,331, 3,263, 3,227, 3,173, 3,135, 3,082, 3,009, 2,946, 2,905, 2,859, 2,830, 2,803, 2,769, 2,672, 2,608 и 2,567.
21. Полиморфная модификация дофетилида Р143 по п.19 или 20, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3266, 3123, 3107, 3041, 3027, 3013, 2766, 2723, 2610, 1895, 1614, 1607, 1587, 1511, 1414, 1395, 1337, 1319, 1301, 1287, 1248, 1230, 1215, 1202, 1187, 1157, 1148, 1130, 1110, 1060, 1042, 1018, 1005, 980, 975, 959, 940, 917, 853, 844, 831, 803, 785, 766, 752, 743, 718, 640, 613, 553, 536, 526, 509, 499, 455 и 429 см-1.
22. Фармацевтическая композиция, содержащая полиморфную модификацию дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, вместе с фармацевтически приемлемым разбавителем или носителем.
23. Полиморфная модификация дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемая композиция по п.22 для применения в качестве лекарства.
24. Применение полиморфной модификации дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22 для производства антиаритмического агента.
25. Применение полиморфной модификации дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22 для производства лекарства для лечения сердечной недостаточности, в частности застойной сердечной недостаточности.
26. Способ лечения сердечной аритмии, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22.
27. Способ лечения сердечной недостаточности, в частности застойной сердечной недостаточности, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р162а или Р143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22.
28. Полиморфэря модификация по пп.6, 7, 8, 16, 17, 18, 19, 20 или 21, где "по существу чистая" означает чистоту, по меньшей мере, 95 мас.%.
29. Полиморфная модификация по п.28, где "по существу чистая" означает чистоту, по меньшей мере, 98 мас.%.
30. Полиморфная модификация по п.29, где "по существу чистая" означает чистоту, по меньшей мере, 99 мас.%.
Текст
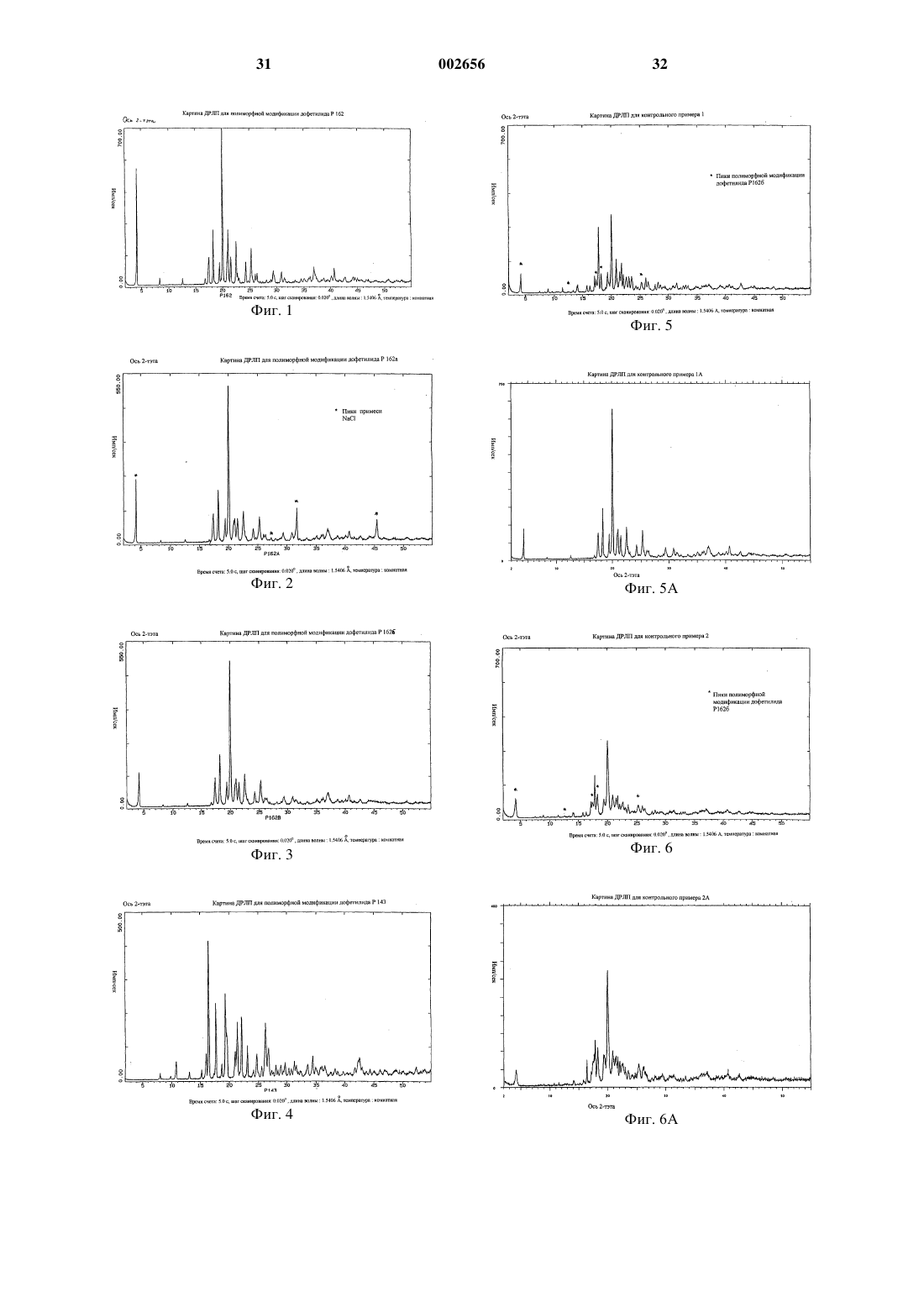
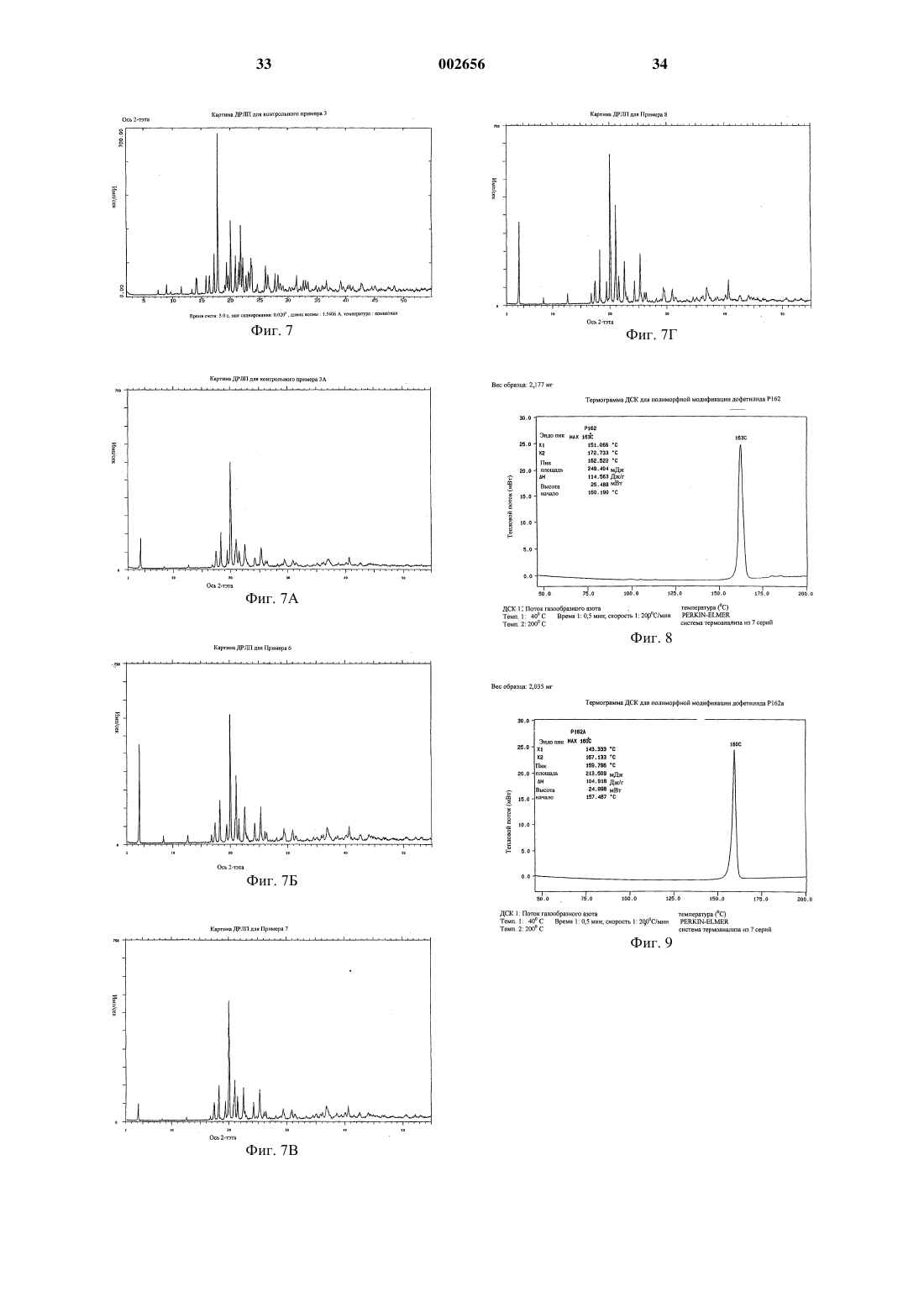
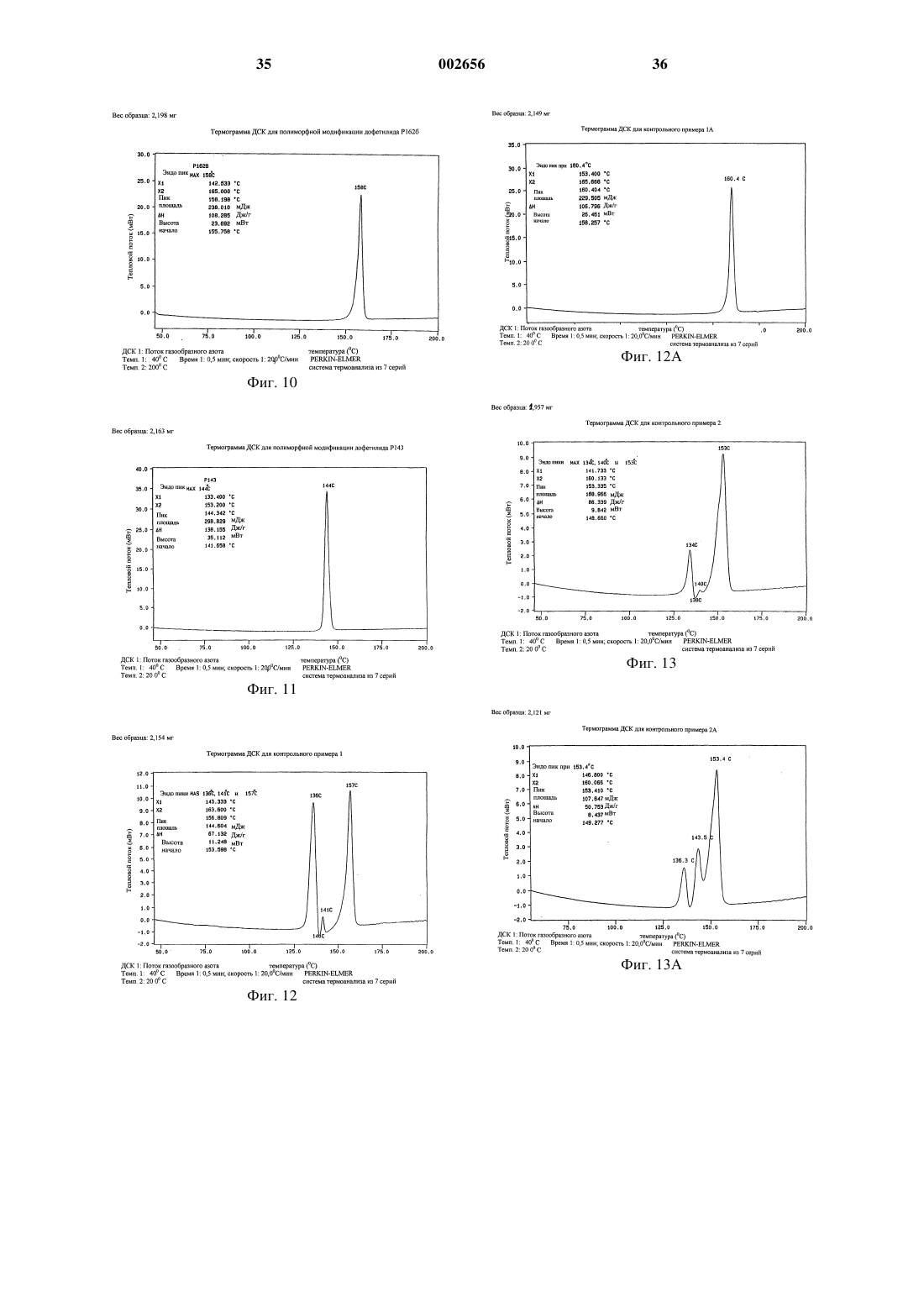
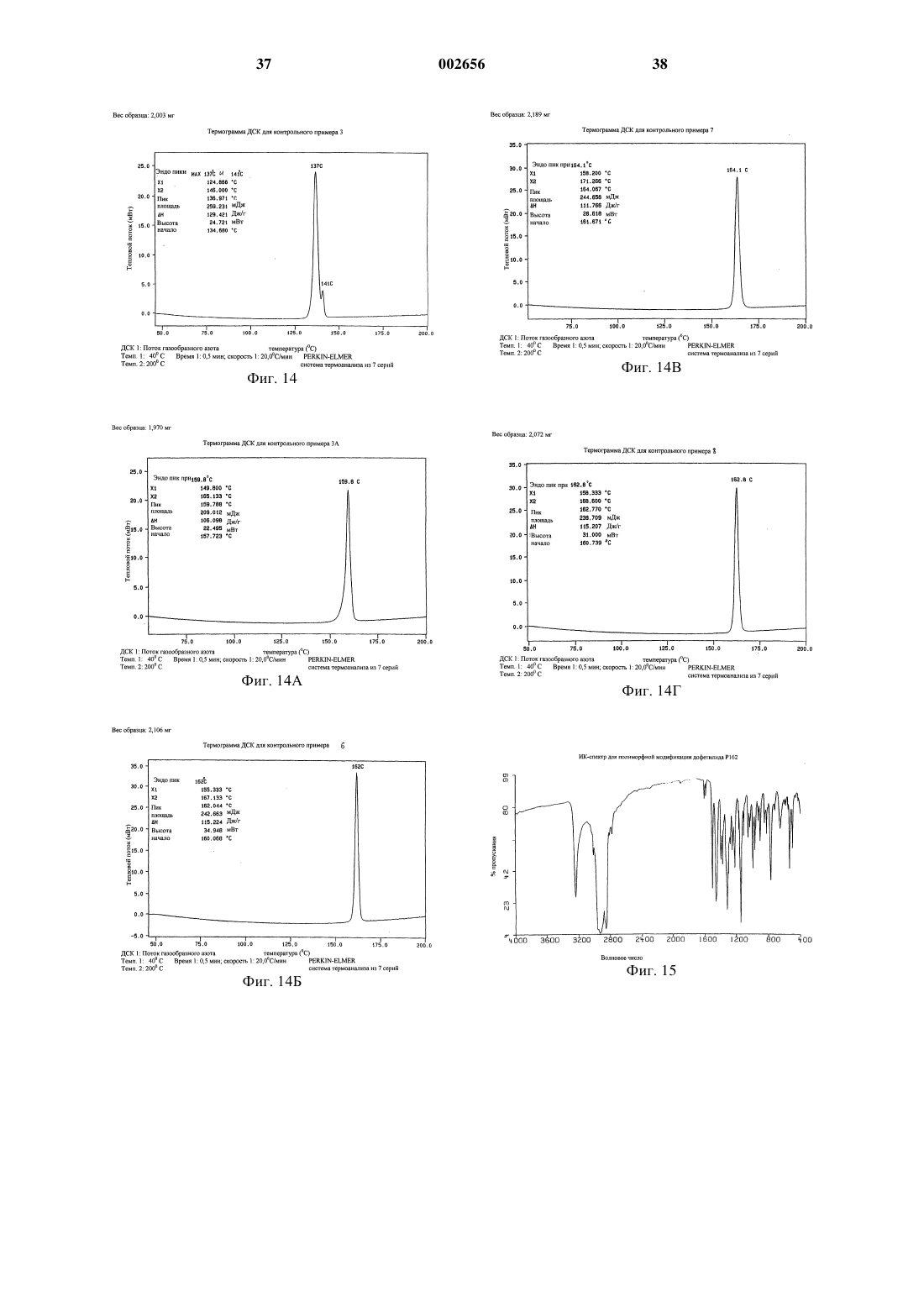
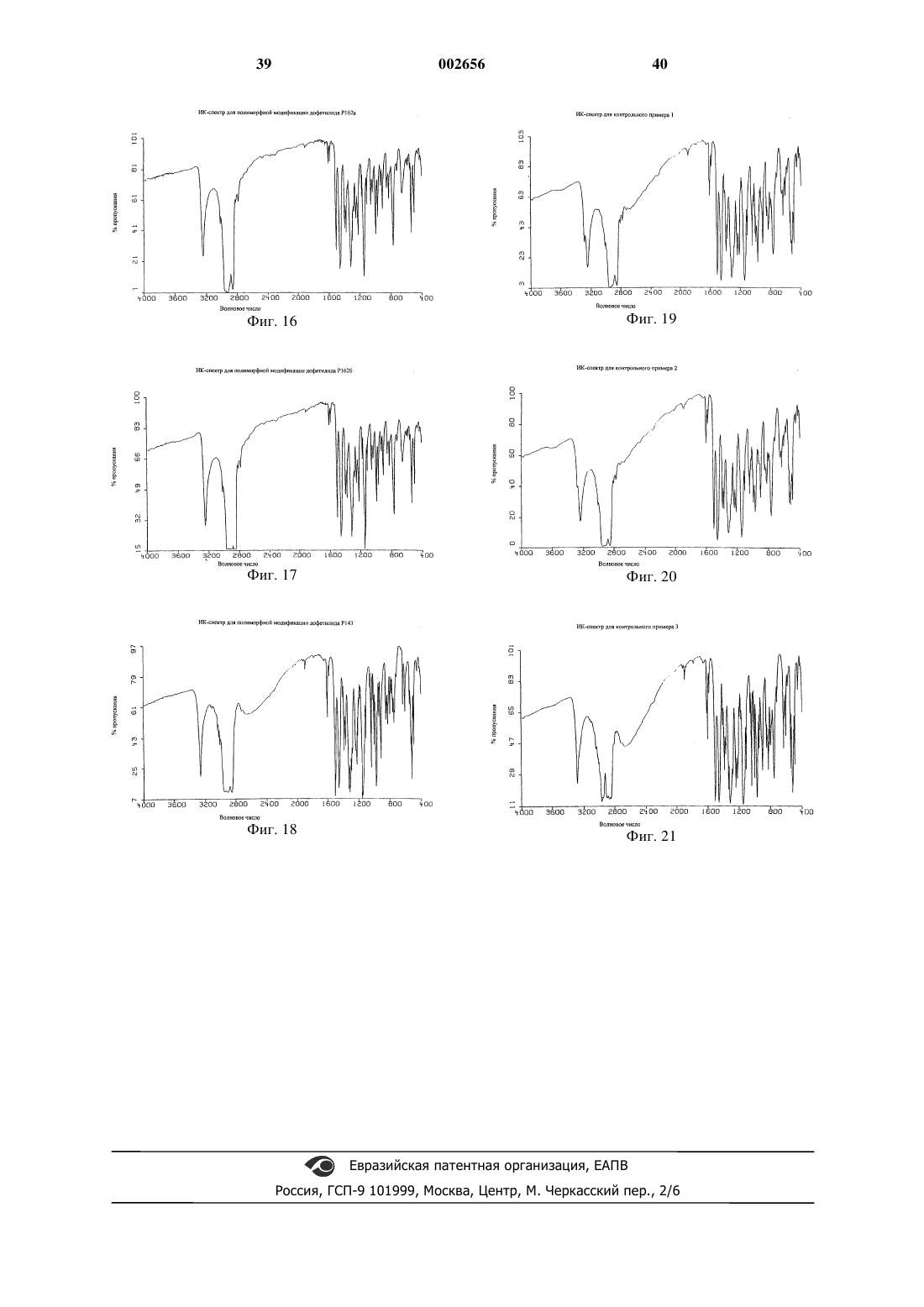
1 Настоящее изобретение относится к полиморфным модификациям соединения, известного как дофетилид. Более конкретно изобретение относится к новым полиморфным модификациям дофетилида, известным как Р 162, Р 162 а и Р 143, и к способам получения таких полиморфных модификаций, к композициям, содержащим такие полиморфные модификации, и к применению таких полиморфных модификаций. Дофетилид N-[4-(2-[2-[4-(метансульфонамидо)фенокси]-N1-метилэтиламино]этил)фенил]метансульфонамид имеет следующую структуру: Дофетилид описан в ЕР-А-0245997 как антиаритмический агент, который пролонгирует продолжительность потенциала действия в сердечной мышце и проводящей ткани, тем самым увеличивая рефрактерность к преждевременным стимулам. Поэтому он является антиаритмическим агентом Класса III согласно классификации Vaughan Willams (Anti-Arrythmic Action,E.M.Vaughan Willams, Academic press, 1980). Он эффективен для предсердия, желудочков и проводящей ткани как in vitro, так и in vivo и, следовательно, может быть полезен для предупреждения и лечения широкого ряда желудочковых и суправентрикулярных аритмий, включая предсердную и желудочковую фибрилляцию. Так как он не меняет скорость, с которой проводятся импульсы, он имеет меньше склонности,чем другие антиаритмические лекарственные препараты (главным образом Класса I), ускорять или усиливать аритмию, а также вызывает меньше неврологических побочных эффектов. Он также не имеет отрицательной инотропной активности и поэтому имеет преимущества перед другими антиаритмическими агентами у пациентов с нарушенной функцией сердечного насоса. Применение дофетилида при лечении сердечной недостаточности, в частности застойной сердечной недостаточности, описано в Европейской патентной заявке 98306188.8, предмет которой включен сюда ссылкой. В настоящее время предпочтительным является капсульный препарат дофетилида. Дофетилид является очень сильным лекарственным средством и поэтому его используют в очень низкой дозе. Так как для капсульного препарата требуется очень низкая загрузка лекарственного средства, существенным является, чтобы активный ингредиент имел малый размер частиц для обеспечения получения гомогенной смеси. Ранее известные способы получения дофетилида, описанные в ЕР-А-0245997, трудны для воспроизводства, и согласно им получают либо смесь полиморфных модификаций дофетилида Р 162/Р 162 а, Р 162b/Р 136 или Р 162b/Р 136/Р 143,либо главным образом полиморфную модифи 002656 2 кацию дофетилида Р 136 или Р 162b, причем все они имеют тенденцию кристаллизоваться в агломерированной форме, которую нужно деагломерировать (например, измельчением или микронизацией), чтобы добиться получения требуемого малого размера частиц. Следовательно, ни один из этих продуктов непосредственно не может быть пригоден для использования в капсульном препарате. Задача настоящего изобретения заключается в том, чтобы предоставить подходящую, по существу чистую, кристаллическую полиморфную форму дофетилида, которую можно легко,экономично и воспроизводимо получать с требуемым малым размером частиц для использования в капсульном препарате, предпочтительно без необходимости какого-либо измельчения лекарственного средства в процессе производства. Теперь неожиданно обнаружено, что настоящее изобретение решает эту задачу, обеспечивая, по существу, чистую, кристаллическую полиморфную форму дофетилида, известную как Р 162, и способ ее получения на уровне изобретения. Полиморфная модификация дофетилида Р 162 кристаллизуется из водного ацетонитрила в виде хлопьев/чешуек с постоянным распределением малого размера частиц, 90% частиц размером менее 45 мкм. Поэтому эта форма не требует измельчения перед использованием в капсульном препарате. Она также является негигроскопичной в широком диапазоне значений относительной влажности, химически и физически стабильной, быстро всасывается invivo, и ее можно в плановом порядке и воспроизводимо получать в промышленных количествах описанным здесь способом кристаллизации. Соответственно, настоящее изобретение обеспечивает, по существу, чистую, кристаллическую полиморфную модификацию дофетилида Р 162, которая характеризуется дифференциальной сканирующей калориметрией (ДСК),при которой она проявляет эндотермический тепловой эффект при приблизительно 162 С. Полиморфная модификация дофетилида Р 162 дополнительно характеризуется картиной дифракции рентгеновских лучей на порошке(ДРЛП), полученной при облучении рентгеновским излучением СuК-альфа 1 (длина волны = 1,5406 Ангстрем), которая показывает основные пики, соответствующие межплоскостным расстояниям d 21,303, 10,597, 7,053, 5,288, 5,088,4,856, 4,793, 4,569, 4,504, 4,430, 4,256, 4,230,4,133, 3,956, 3,911, 3,866, 3,674, 3,606, 3,524,3,424, 3,384, 3,309, 3,255, 3,171, 3,083, 3.038,3,021, 2,893, 2,842, 2,776, 2,679, 2,598, 2,557,2,503, 2,482, 2,436, 2,419, 2,399, 2,345 и 2,323. Полиморфная модификация дофетилида Р 162 дополнительно характеризуется, в виде порошка в нуйоле, инфракрасным (ИК) спектром, который показывает полосы поглощения при 3246, 3013, 2807, 2776, 1907, 1611, 1593, 3 1510, 1398, 1366, 1357, 1321, 1300, 1277, 1251,1220, 1171, 1146, 1106, 1091, 1051, 1031, 1023,994, 966, 934, 925, 903, 851, 825, 808, 774, 723,657, 603, 586, 559, 538, 528, 509, 499, 461 и 431 см-1. Полиморфная модификация дофетилида Р 162 стала доступной благодаря неожиданному открытию того, что кристаллизация любой другой формы дофетилида из водного ацетонитрила приводит к получению этой полиморфной модификации в виде продукта. Согласно настоящему изобретению, кроме того, предложены по существу чистые, кристаллические полиморфные модификации дофетилида Р 162 а и Р 143. Должно быть понято, что эти полиморфные модификации не должны рассматриваться только как синтетические промежуточные продукты, которые далее могут быть преобразованы в полиморфную модификацию дофетилида Р 162 кристаллизацией из водного ацетонитрила; они также имеют такие же терапевтические свойства, как и Р 162. Однако полиморфные модификации дофетилида Р 162 а и Р 143, и Р 162b и Р 136 не пригодны настолько,насколько пригодна полиморфная модификация дофетилида Р 162, для использования в приготовлении капсульных препаратов лекарственного средства, главным образом потому, что для получения требуемого размера частиц часто требуется измельчение. Полиморфные модификации дофетилида Р 162 а и Р 612b имеют, по сравнению с полиморфной модификацией дофетилида Р 162, сходные картины ДРЛП и ИКспектры, но иные характеристики ДСК. Различия в точках плавления этих полиморфных модификаций обусловлены различной степенью разупорядочения внутри кристаллических структур этих полиморфных модификаций. По существу чистая, кристаллическая полиморфная модификация дофетилида Р 162 а характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 160 С. Полиморфная модификация дофетилида Р 162 а дополнительно характеризуется картиной дифракции рентгеновских лучей на порошке(ДРЛП), полученной при облучении рентгеновским излучением СuК-альфа 1 (длина волны = 1,5406 Ангстрем), которая показывает основные пики, соответствующие межплоскостным расстояниям d 21,306, 10,603, 7,054, 5,289, 5,114,5,094, 4,860, 4,572, 4,431, 4,260, 4,247, 4,228,4,153, 4,136, 3,955, 3,870, 3,676, 3,607, 3,524,3,435, 3,421, 3,384, 3,176, 3,038, 2,895, 2,778,2,684, 2,559, 2,501, 2,486, 2,433, 2,326, 2,283,2,248, 2,216, 2,171, 2,119, 2,051, 1,989 и 1,948. Полиморфная модификация дофетилида Р 162 а дополнительно характеризуется, в виде порошка в нуйоле, ИК-спектром, который показывает полосы поглощения при 3246, 3013,2807, 2776, 1907, 1611, 1593, 1510, 1397, 1366,1357, 1321, 1300, 1277, 1251, 1220, 1171, 1146, 002656 1106, 1091, 1051, 1031, 1023, 994, 966. 934, 926,903, 851, 825, 807, 774, 726, 657, 602, 586, 559,538, 528, 509, 499, 461 и 430 см-1. По существу чистая, кристаллическая полиморфная модификация дофетилида Р 143 характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 144 С. Полиморфная модификация дофетилида Р 143 дополнительно характеризуется картиной дифракции рентгеновских лучей на порошке(ДРЛП), полученной при облучении рентгеновским излучением СuК-альфа 1 (длина волны = 1,5406 Ангстрем), которая показывает основные пики, соответствующие межплоскостным расстояниям d 10,993, 9,006, 8,243, 6,769, 5,807,5,530, 5,375, 5,104, 4,998, 4,735, 4,575, 4,539,4,237, 4,179, 4,159, 4,019, 3,854, 3,705, 3,682,3,601. 3,562, 3,482, 3,392, 3,343, 3,331, 3,263,3,227, 3,173, 3,135, 3,082, 3,009, 2,946, 2,905,2,859, 2,830, 2,803, 2,769, 2,672, 2,608 и 2,567. Полиморфная модификация дофетилида Р 143 дополнительно характеризуется, в виде порошка в нуйоле, ИК-спектром, который показывает полосы поглощения при 3266, 3123,3107, 3041, 3027, 3013, 2766, 2723, 2610, 1895,1614, 1607, 1587, 1511. 1414, 1395, 1337, 1319,1301, 1287, 1248, 1230, 1215,1202,1187, 1157,1148, 1130, 1110,1060, 1042, 1018, 1005, 980,975, 959, 940, 917, 853, 844, 831, 803, 785, 766,752, 743, 718, 640, 613, 553, 536, 526, 509, 499,455 и 429 см-1. Выражение по существу чистая, когда его используют в связи с полиморфными модификациями дофетилида Р 162, Р 162 а и Р 143, означает чистоту, по меньшей мере, 95 мас.%. Более предпочтительно по существу чистая означает чистоту, по меньшей мере, 98 мас.% и наиболее предпочтительно означает чистоту, по меньшей мере, 99 мас.%. Полиморфная модификация дофетилида Р 162 может быть получена кристаллизацией любой другой формы дофетилида, в том числе его полиморфных смесей, из водного ацетонитрила. Предпочтительно в качестве растворителя для кристаллизации используют смесь ацетонитрил:вода в соотношении от 98,5:1,5 до 99,5:0,5 по объему. Полиморфная модификация дофетилида Р 162 а может быть получена растворением любой другой формы дофетилида в водном растворе подходящего основания, такого как гидроксид натрия, доведением раствора до рН приблизительно 8,5, используя подходящую минеральную кислоту, например соляную кислоту, и собиранием продукта. При этом способе, когда используют гидроксид натрия и соляную кислоту, в качестве примеси может соосаждаться хлорид натрия. Полиморфная модификация дофетилида Р 143 может быть получена растворением любой другой формы дофетилида в метаноле, нанесе 5 нием полученного раствора на силикагелевую колонку, элюированием колонки метанолом и концентрированием элюированного раствора до сухого состояния при пониженном давлении с получением кристаллического продукта. Пути синтеза для получения дофетилида описаны в ЕР-А-0245997 и в разделе настоящего описания изобретения "Контрольные примеры". Для оценки антиаритмических фармакологических эффектов полиморфных модификаций дофетилида используют выделенную сердечную ткань собаки. Правые желудочковые трабекулы,папиллярную мышцу или волокна Пуркинье выделяют из того или другого желудочка, укрепляют в сосуде для органов, содержащем физиологический солевой раствор, и стимулируют электричеством. Полученные потенциалы действия регистрируют, используя внутриклеточные микроэлектроды. Оценивают влияние увеличения концентрации полиморфной модификации в растворе на продолжительность потенциала действия и на эффективный рефракторный период (ЭРП). ЭРП измеряют, стимулируя ткань добавочными стимулами при прогрессивно более коротких интервалах между стимулами до тех пор, пока эти добавочные стимулы не перестанут продуцировать потенциал действия. В сущности, используемые способы являются такими же, как способы, описанные в Gwlit М.,Arrowsmith J.E., Blackburn K.J. et al., UK-68798.(1991). Способы оценки активности полиморфных модификаций дофетилида при лечении сердечной недостаточности описаны в Европейской патентной заявке 98306188.8. Полиморфные модификации дофетилида можно вводить сами по себе, но в общем случае их будут вводить в смеси с фармацевтически приемлемым разбавителем или носителем, выбранным с учетом назначенного пути введения и стандартной фармацевтической практики. Например, их можно вводить перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах либо одни,либо в смеси с эксципиентами, или в форме эликсиров или суспензий, содержащих корригенты или красители. Их можно вводить, например, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего использовать в форме стерильного водного раствора, который может содержать другие растворенные вещества, например достаточное количество солей или глюкозы для того, чтобы сделать раствор изотоническим с кровью. Полиморфные модификации дофетилида предпочтительно вводят в виде капсульных препаратов. Такие препараты могут быть получены путем смешивания полиморфной модификации дофетилида с подходящими носителями 6 или эксципиентами, такими как микрокристаллическая целлюлоза, сухой кукурузный крахмал, коллоидный диоксид кремния и стеарат магния. Для введения человеку при лечении сердечного состояния, такого как желудочковая и суправентрикулярная аритмия, включая предсердную и желудочковую фибрилляцию, предполагаемые пероральные дозировки соединений формулы (I) будут находиться в интервале от 0,125 до 1 мг, предпочтительно от 0,25 до 1 мг в сутки для приема в до двух разделенных дозах в сутки для среднего взрослого пациента (70 кг). Таким образом для типичного взрослого пациента индивидуальные таблетки или капсулы могут содержать например от 0,125 до 0,5 мг активного соединения вместе с подходящим фармацевтически приемлемым разбавителем,эксципиентом или носителем. Как известно из медицинской практики, колебания могут иметь место в зависимости от веса и состояния субъекта, подлежащего лечению. Подходящие дозировки полиморфных модификаций дофетилида для лечения сердечной недостаточности описаны в Европейской патентной заявке 98306188.8. Должно быть понято, что ссылка на медицинское лечение означает излечивающее (куративное), паллиативное или профилактическое лечение. Таким образом, согласно настоящему изобретению, предложены:(1) по существу чистая, кристаллическая полиморфная модификация дофетилида Р 162,Р 162 а или Р 143;(2) способ получения по существу чистой,кристаллической полиморфной модификации дофетилида Р 162, Р 162 а или Р 143;(3) фармацевтическая композиция, содержащая по существу чистую полиморфную модификацию дофетилида Р 162, Р 162 а или Р 143 вместе с фармацевтически приемлемым разбавителем или носителем;(4) фармацевтическая капсульная композиция, содержащая по существу чистую, кристаллическую полиморфную модификацию дофетилида Р 162, Р 162 а или Р 143 вместе с фармацевтически приемлемым разбавителем или носителем;(5) по существу чистая, кристаллическая полиморфная модификация дофетилида Р 162,Р 162 а или Р 143 для использования в качестве лекарства;(6) применение по существу чистой, кристаллической полиморфной модификации дофетилида Р 162, Р 162 а или Р 143 для производства антиаритмического агента;(7) способ лечения сердечной аритмии, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество по существу чистой, кристаллической полиморфной модификации дофетилида 7 Р 162, Р 162 а или Р 143 или ее фармацевтически приемлемой композиции;(8) применение по существу чистой, кристаллической полиморфной модификации дофетилида Р 162, Р 162 а или Р 143 для производства лекарства для лечения сердечной недостаточности, в частности застойной сердечной недостаточности; и(9) способ лечения сердечной недостаточности, в частности застойной сердечной недостаточности, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество по существу чистой, кристаллической полиморфной модификации дофетилида Р 162, Р 162 а или Р 143 или ее фармацевтически приемлемой композиции. Примеры 1-8 Следующие примеры иллюстрируют получение новых полиморфных модификаций дофетилида Р 162, Р 162 а и Р 143 и известной полиморфной модификации дофетилида P162b. Аналитические данные по ДРЛП, ИК, ДСК и размеру частиц для типичных образцов этих полиморфных модификаций приведены в табл. 1-5. Пример 1. Полиморфная модификация дофетилида Р 162. К перемешиваемому раствору ацетонитрила (18 л) и воды (180 мл) добавляют дофетилид(перед использованием, чтобы удалить примеси,исходное вещество может быть предварительно обработано древесным углем с использованием следующего способа) (3,62 кг) и смесь нагревают по полного растворения твердого вещества. Горячий раствор фильтруют через фильтровальную подушку ускорителя фильтрованияCLARCEL-FLO (торговая марка) (подготовленную как описано в примечании 1 ниже), и эту подушку промывают ацетонитрилом. Фильтрат перемешивают и охлаждают до температуры окружающей среды. Суспензию гранулируют в течение 18 ч при температуре окружающей среды, твердое вещество собирают фильтрацией,промывают ацетонитрилом (2400 мл) и продукт сушат при пониженном давлении при 70 С с получением указанного в заголовке соединения (3,043 кг). К перемешиваемому раствору ацетонитрила (10,145 мл) и воды (101 мл) добавляют дофетилид (2028,9 г), и смесь нагревают до полного растворения твердого вещества. Добавляют обесцвечивающий уголь (BDH [торговая марка],202,9 г), и смесь нагревают с обратным холодильником в течение 15 мин. Грунтованную фильтровальную подушку подготавливают путем суспендирования ускорителя фильтрования CLARCEL-FLO (торговая марка) (200 г) в ацетонитриле (1000 мл) и фильтрования этой смеси с отсосом под разряжением на бумажную мембрану. Фильтрат отбрасывают, а подушку промывают ацетонитрилом (1000 мл) до тех пор, пока фильтрат не станет прозрачным. Подушку отсасывают, пока она 8 не станет плотной, но влажной, и промывные воды отбрасывают. Горячий раствор дофетилида фильтруют через эту подушку с отсосом под разряжением,и фильтрат охлаждают до температуры окружающей среды при перемешивании. Суспензию гранулируют в течение 18 ч при температуре окружающей среды. Твердое вещество собирают фильтрацией, промывают ацетонитрилом (2200 мл), и продукт сушат при пониженном давлении при 70 С с получением 1525,6 г вещества. Пример 2. Полиморфная модификация дофетилида Р 162 а. Дофетилид (100 г) растворяют при перемешивании в растворе гидроксида натрия (25 г) в воде (1000 мл). Этот раствор обрабатывают обесцвечивающим углем (5 г) в течение 30 мин при температуре окружающей среды и уголь отфильтровывают. Фильтрат доводят до рН 8,5 концентрированной соляной кислотой и смесь гранулируют в течение 90 мин. Твердое вещество собирают фильтрацией и промывают водой(2 х 100 мл). Твердое вещество растворяют в растворе гидроксида натрия (25 г) в воде (1000 мл), и обработку обесцвечивающим углем повторяют как ранее. Фильтрат доводят до рН 8,5,как ранее, и смесь гранулируют в течение 90 мин. Твердое вещество отфильтровывают, промывают водой и сушат при пониженном давлении при 70 С с получением указанного в заголовке соединения (93,3 г). Пример 3 (для контроля). Полиморфная модификация дофетилида Р 162b. Дофетилид (37,0 г) растворяют при перемешивании в ацетоне (750 мл) при температуре окружающей среды и раствор осветляют фильтрованием через фильтровальную подушку ускорителя фильтрования CLACEL-FLO (торговая марка). Фильтрат выпаривают при пониженном давлении, при этом поддерживают температуру не выше 20 С. Полученный сироп кристаллизуется, после чего добавляют ацетон (100 мл). Твердое вещество собирают фильтрацией и сушат при пониженном давлении при 70 С в течение ночи с получением указанного в заголовке соединения (29,1 г). Пример 4 (для контроля). Полиморфная модификация дофетилида Р 162b. Дофетилид нагревают до температуры приблизительно на 5 С выше температуры плавления, а затем охлаждают до температуры окружающей среды с получением некристаллического стеклообразного вещества. Это стеклообразное вещество затем нагревают до 70-125 С с получением указанного в заголовке соединения в виде кристаллического твердого вещества. Пример 5. Полиморфная модификация дофетилида Р 143. Дофетилид (60 г) растворяют при перемешивании в метаноле (6000 мл), и полученный раствор вносят в колонку из диоксида кремния(WOELM Type TSC [торговая марка]) (1000 г). Колонку элюируют метанолом и первые 12 л элюированного раствора концентрируют до сухого состояния при пониженном давлении с получением указанного в заголовке соединения в виде порошка, который сушат при пониженном давлении при 60 С (54,9 г). Пример 6. Полиморфная модификация дофетилида Р 162. Полиморфную модификацию дофетилида Р 162 а кристаллизуют из водного ацетонитрила способом, аналогичным способу, использованному в примере 1, с получением полиморфной модификации дофетилида Р 162. Пример 7. Полиморфная модификация дофетилида Р 162. Полиморфную модификацию дофетилида Р 162b кристаллизуют из водного ацетонитрила способом, аналогичным способу, использованному в примере 1, с получением полиморфной модификации дофетилида Р 162. Пример 8. Полиморфная модификация дофетилида Р 162. Полиморфную модификацию дофетилида Р 143 кристаллизуют из водного ацетонитрила способом, аналогичным способу, использованному в примере 1, с получением полиморфной модификации дофетилида Р 162. Контрольные примеры 1, 1 А, 2, 2 А, 3, 3 А и 4 В следующих контрольных примерах 1,1 А, 2, 2 А, 3 и 3 А повторяют условия кристаллизации примеров 7, 19, 20, 21 и 22 из ЕР-А 0245997. Специалисту будет ясно, что пути синтеза, используемые для получения дофетилида в каждом из примеров,описанных в ЕР-А-0245997, не будут влиять на полученные полиморфную модификацию/смесь полиморфных модификаций. Это будут определять только условия кристаллизации. Точки плавления определяют, используя прибор ElectrothermalIA9100 в сочетании с бензанилидным стандартным образцом. Аналитические данные по ДРЛП, ИК, ДСК и размеру частиц для продуктов этих контрольных примеров приведены в табл. 1-5. Ни один из контрольных примеров 1, 1 А,2, 2 А, 3 и 3 А не обеспечивает получение по существу чистой полиморфной модификации Р 162, Р 162 а или Р 143. В контрольном примере 4 описано получение дофетилида, использованного в качестве исходного вещества в примерах 1-5 и контрольных примерах 1, 1 А, 2, 2 А, 3 и 3 А. Контрольный пример 1 (см. примеры 21 и 22 из ЕР-А-0245997). Смесь полиморфных модификаций дофетилида Р 136/Р 162b. Дофетилид (5,0 г) суспендируют в этилацетате (100 мл) и эту смесь при перемешивании нагревают до температуры дефлегмации. После 15 мин нагревания с обратным холодильником еще добавляют этилацетат (100 мл), а через дополнительные 15 мин еще добавляют 10 этилацетат (100 мл). Горячий раствор фильтруют и охлаждают, но кристаллизации не достигают. Раствор нагревают при температуре дефлегмации,выпариванием растворителя уменьшают объем до приблизительно 100 мл,охлаждают и оставляют стоять при комнатной температуре в течение ночи. Продукт после кристаллизации собирают фильтрованием, промывают холодным этилацетатом и сушат (1,7 г). Т.пл. 160-1 С (бензанилидный стандарт (литературные данные: т.пл. 163 С) т.пл. 164-5 С). Контрольный пример 1 А (см. примеры 21 и 22 из ЕР-А-0245997). Смесь полиморфных модификаций дофетилида Р 162/Р 162 а. Невоспроизводимость примеров 21 и 22 из ЕР-А-0245997 продемонстрирована тем, что при повторении условий кристаллизации контрольного примера 1 с использованием дофетилида(20,0 г) была получена смесь полиморфных модификаций дофетилида Р 162/Р 162 а. Контрольный пример 2 (см. примеры 19 и 20 из ЕР-А-0245997). Смесь полиморфных модификаций дофетилида Р 136/Р 162b. Дофетилид (5,0 г) добавляют к этилацетату(300 мл) и эту смесь перемешивают и нагревают при температуре дефлегмации до полного растворения. Горячий раствор фильтруют и фильтрат обрабатывают н-гексаном (100 мл). Образуется белый осадок, и эту суспензию гранулируют при комнатной температуре в течение ночи. Твердое вещество собирают фильтрацией, промывают н-гексаном и сушат (3,7 г). Т.пл. 15860 С (бензанилидный стандарт (литературные данные: т.пл. 163 С) т.пл. 164-5 С). Контрольный пример 2 А (см. примеры 19 и 20 из ЕР-А-0245997). Смесь полиморфных модификаций дофетилида Р 136/Р 162b/Р 143. Невоспроизводимость примеров 19 и 20 из ЕР-А-0245997 продемонстрирована тем, что при повторении условий кристаллизации контрольного примера 2 с использованием дофетилида(20,0 г) была получена смесь полиморфных модификаций дофетилида Р 136/Р 162b/Р 143. Контрольный пример 3 (см. пример 7 из ЕР-А-0245997). Полиморфная модификация дофетилида Р 136. Дофетилид (10,0 г) добавляют к этилацетату (200 мл) и эту смесь перемешивают и нагревают при температуре дефлегмации. Полученную суспензию обрабатывают метанолом по каплям до полного растворения. Горячий раствор фильтруют и охлаждают, но кристаллизация не происходит. Раствор нагревают при температуре дефлегмации для испарения растворителя до тех пор, пока не начнется кристаллизация. Смесь охлаждают, гранулируют в течение 4 ч, фильтруют и сушат (2,6 г). Т.пл. 147-8 С(бензанилидный стандарт (литературные данные: т.пл. 163 С) т.пл. 164-5 С). Контрольный пример 3 А (см. пример 7 из ЕР-А-0245997). Полиморфная модификация дофетилида Р 162b. 11 Невоспроизводимость примера 7 из ЕР-А 0245997 продемонстрирована тем, что при повторении условий кристаллизации контрольного примера 3 с использованием дофетилида (20,0 г) была получена полиморфная модификация дофетилида Р 162b. Контрольный пример 4. N-[4-(2-[2-[4(метансульфонамидо)фенокси]-N1-метилэтиламино]этил)фенил]метансульфонамид (дофетилид).[J.Org.Chem., 49, 3114-21 (1984)] (18,61 г), безводный карбонат калия (14,04 г), иодид калия(3,06 г) и тетра-н-бутиламмония иодид (1,70 г). Смесь нагревают при температуре дефлегмации в течение 3 ч, охлаждают до приблизительно 40 С, добавляют этилацетат (100 мл) и перемешивают в течение 10 мин. Органическую фазу отделяют, а водную фазу промывают этилацетатом (2100 мл). Объединенные органические фазы промывают водой (можно использовать рассол) (50 мл), концентрируют при пониженном давлении до объема, содержащего 2 мл на грамм указанного в заголовке соединения (в расчете на теоретический выход), а затем добавляют два объема этанола. Смесь перемешивают и гранулируют при температуре окружающей среды в течение ночи, твердое вещество собирают фильтрацией, промывают этанолом(2100 мл) и сушат при пониженном давлении при 40 С с получением указанного в заголовке соединения (21,34 г, 67%). 12 К метанолу (2000 мл) добавляют соединение из части (1) (200 г) и 5 мас.%/мас. палладияна-угле (содержащего 50% воды) (20 г). Эту смесь перемешивают и гидрируют при 60 фунт./кв.дюйм (414 кПа) до прекращения потребления водорода. Катализатор отфильтровывают и промывают метанолом (2100 мл), объединенный фильтрат и промывные воды выпаривают до малого объема при пониженном давлении. Остаточные растворители вытесняют толуолом путем азеотропной дистилляции и по завершении этого процесса объем раствора доводят до приблизительно 400 мл толуолом (всего используют толуола приблизительно 800 мл). Раствор охлаждают до температуры окружающей среды и гранулируют в течение приблизительно 90 мин. Твердое вещество собирают фильтрацией, промывают толуолом (100 мл) и сушат при пониженном давлении при 40 С с получением указанного в заголовке соединенияN-[4-(2-[2-[4-(мeтaнcульфoнaмидo) фeнoкcи]-N1-мeтилэтилaминo]этил)фенил] метансульфонамид (дофетилид). К перемешиваемому ацетонитрилу (235 мл) добавляют соединение из части (2) (57,0 г) с последующим добавлением триэтиламина (50,5 г). К этой смеси медленно добавляют раствор метансульфонилхлорида (57,2 г) в ацетонитриле(50 мл) в течение 30 мин (температуре реакционной смеси во время добавления не дают возможности подниматься выше 50 С). Смесь перемешивают в течение 90 мин и гасят водой(200 мл). Добавляют карбонат натрия (26,7 г) и эту смесь перемешивают в течение 20 мин. Реакционную смесь уменьшают до половины объема дистилляцией (этого можно достичь также выпариванием при пониженном давлении), добавляют воду (200 мл) и снова дистиллируют до половины объема. Смесь охлаждают, добавляют гранулы гидроксида натрия (16,0 г) и эту смесь перемешивают в течение 3 ч при температуре окружающей среды (следует убедиться, что смесь имеет рН 13 после этого периода. Если это не так, следует еще добавить основание до достижения этого рН). В течение 30 мин по каплям добавляют концентрированную соляную кислоту (35 мл) и эту смесь гранулируют в течение 90 мин. Твердое вещество собирают фильтрацией, промывают водой (270 мл) и сушат при пониженном давлении при 60 С с получением указанного в заголовке соединения(ЖХВД (жидкостная хроматография высокого давления) показывает, что это вещество имеет чистоту 99%. Оно может быть дополнительно очищено путем обработки углем (см. пример 1,примечание 1) (87,4 г, 99%). Аналитические данные а) ДРЛП. Картины дифракции рентгеновских лучей на порошке определяли, используя порошковый рентгеновский дифрактометр Siemens D5000,снабженный механизмом для смены образцов,тэта-тэта гониометром, механизмом автоматического изменения щелерасходимости, вторичным монохроматором и сцинтилляционным счетчиком. Образцы подготавливали для анализа, набивая порошок в углубления диаметром 12 мм и глубиной 0,25 мм, вырезанные в кремниевых пластинах держателей образцов. Каждый образец вращали во время облучения рентгеновским излучением СuК-альфа 1 (длина волны = 1,5406 Ангстрем) при помощи рентгеновской трубки,работающей при 40 кV/40 мА. Анализы проводили с использованием гониометра, работающего в режиме дискретного сканирования с 5 секундным счетом на каждый шаг 0,02 в диапазоне измерения угла 2 от 2 до 55. На фиг. 1 показана картина ДРЛП полиморфной модификации дофетилида Р 162; на фиг. 2 - картина ДРЛП полиморфной модификации дофетилида Р 162 а; на фиг. 3 - картина ДРЛП полиморфной модификации дофетилида Р 162b; на фиг. 4 - картина ДРЛП полиморфной модификации дофетилида Р 143; на фиг. 5 - картина ДРЛП продукта контрольного примера 1; на фиг. 5 А - картина ДРЛП продукта контрольного примера 1 А; на фиг. 6 - картина ДРЛП продукта контрольного примера 2; на фиг. 6 А - картина ДРЛП продукта контрольного примера 2 А; на фиг. 7 - картина ДРЛП продукта контрольного примера 3; на фиг. 7 А - картина ДРЛП продукта контрольного примера 3 А; на фиг. 7 Б - картина ДРЛП продукта примера 6; на фиг. 7 В - картина ДРЛП продукта примера 7; на фиг. 7 Г - картина ДРЛП продукта примера 8. В табл. 1 для вышеуказанных фигур приведен перечень пиков, где d - межплоскостное расстояние, a I/Ii - относительная интенсивность. Таблица 1 Примечания 1. Пики, принадлежащие любой примеси хлорида натрия, опущены 2. Смесь полиморфных модификаций дофетилида P136/P162b 3. Смесь полиморфных модификаций дофетилида P136/P162b 4. Полиморфная модификация дофетилида Р 136. Таблица 1 (продолжение) Контрольный пример 1 А(5) Примечания 5. Смесь полиморфных модификаций дофетилида Р 162/Р 162 а 6. Смесь полиморфных модификаций дофетилида Р 136/Р 162b/Р 143 7. Полиморфная модификация дофетилида б) ДСК. Дифференциальную сканирующую калориметрию (ДСК) осуществляли, используя прибор Perkin Elmer DSC-7, снабженный автоматическим механизмом для смены образцов. Приблизительно 2 мг каждого образца точно отвешивают в 50-микролитровую алюминиевую кювету и закрывают ее, обжимая перфорированной крышкой. Образцы нагревают со скоростью 20 С/минуту в диапазоне от 40 до 200 С, продувая газообразным азотом. На фиг. 8 показана термограмма ДСК для полиморфной модификации дофетилида Р 162; на фиг. 9 показана термограмма ДСК для полиморфной модификации дофетилида Р 162 а; на фиг. 10 показана термограмма ДСК для полиморфной модификации дофетилида Р 162b; на фиг. 11 показана термограмма ДСК для полиморфной модификации дофетилида Р 143; на фиг. 12 показана термограмма ДСК для контрольного примера 1; на фиг. 12 А показана термограмма ДСК для контрольного примера 1 А; на фиг. 13 показана термограмма ДСК для контрольного примера 2; на фиг. 13 А показана термограмма ДСК для контрольного примера 2 А; на фиг. 14 показана термограмма ДСК для контрольного примера 3; на фиг. 14 А показана термограмма ДСК для контрольного примера 3 А; на фиг. 14 Б показана термограмма ДСК для примера 6; на фиг. 14 В показана термограмма ДСК для примера 7; 18 на фиг.14 Г показана термограмма ДСК для примера 8. Тепловые эффекты для вышеуказанных фигур приведены в табл. 2. Тепловой эффект Пик = 162,5 С (эндотерм) Начало = 160,2 С Энтальпия = 114,6 Дж/г Пик = 159,8 С (эндотерм) Начало = 157,5 С Энтальпия = 104,9 Дж/г Пик = 158,2 С (эндотерм) Начало = 155,8 С Энтальпия = 108,3 Дж/г Пик = 144,3 С (эндотерм) Начало = 141,6 С Энтальпия = 138,2 Дж/г Пик = 136,3 С (эндотерм) Начало = 132,0 С Энтальпия = 56,3 Дж/г Пик = 134,4 С (эндотерм) Начало = 131,3 С Энтальпия = 17,7 Дж/г Пик = 137,0 С (эндотерм) Начало = 134,7 С Энтальпия = 129,4 Дж/г Таблица 2 (продолжение) Образец Контрольный пример 1 А Контрольный пример 2 А Контрольный пример 3 А Контрольный пример 6 Контрольный пример 7 Контрольный пример 8 Тепловой эффект Пик = 160,4 С (эндотерм) Начало = 158,3 С Энтальпия = 106,8 Дж/г Пик = 136,3 С (эндотерм) Начало = 132,8 С Энтальпия = 13,2 Дж/г Пик = 159,8 С (эндотерм) Начало = 157,7 С Энтальпия = 106,1 Дж/г Пик = 162,0 С (эндотерм) Начало = 160,1 С Энтальпия = 115,2 Дж/г Пик = 164,1 С (эндотерм) Начало = 161,7 С Энтальпия = 111,8 Дж/г Пик = 162,8 С (эндотерм) Начало = 160,7 С Энтальпия = 115,2 Дж/гв) ИК. Инфракрасную (ИК) спектроскопию проводили на спектрометре Nicolet 800 FT-IR,снабженном детектором МСТ-В. Все спектры получали с разрешением 2 см-1. Перед получением спектра образцы подготавливали в виде порошка в нуйоле и устанавливали между двумя КВr пластинами. На фиг. 15 показан ИК спектр для полиморфной модификации дофетилида Р 162; на фиг. 16 показан ИК спектр для полиморфной модификации дофетилида Р 162 а; на фиг. 17 показан ИК спектр для полиморфной модификации дофетилида Р 162b; на фиг. 18 показан ИК спектр для полиморфной модификации дофетилида Р 143; на фиг. 19 показан ИК спектр для контрольного примера 1; на фиг. 20 показан ИК спектр для контрольного примера 2; на фиг. 21 показан ИК спектр для контрольного примера 3. Перечень пиков для фиг. 15-21 приведен в табл. 3, в которой записано волновое число Перечень пиков для фиг. 15-18 приведен в табл. 4, в которой записано как волновое число 3246.2 3246.0 3123.5 3106.7 3041.3 3026.7 3012.6 3012.8 3011.5 3011.8 2950 - 2850 полосы нуйола. См. также полосы, отмеченные 2807.0 2806.8 2807.0 2776.2 2776.4 2776.6 2766.5 2722.6 2721.0 2721.9 са.2610 са.2670 са.2670 широкая широкая широкая 1906.7 1894.6 1894.8 1894.8 1614.0 1613.6 1610.5 1606.6 1606.0 1606.4 1592.8 1592.7 1592.8 1587.1 1587.2 1587.6 1509.7 1511.2 1510.4 1510.4 1463.5 4464.4 1462.6 1462.7 1414.3 1415.6 1415.3 1397.1 1395.4 1395.4 1395.9 1377.7 1376.9 1377.8 1377.7 1366.2 1356,8 1356.5 1356.8 1337.3 1338.5 1338.1 1321.2 1319.0 1316,3 1316.6 1301.5 1301.8 1301.0 1300.0 1287.4 1287.1 1288.0 1276.6 1251.1 1248.0 Примечания 1. Смесь полиморфных модификаций дофетилида Р 136/Р 162b 2. Смесь полиморфных модификаций дофетилида Р 136 Р 162b 3. Полиморфная модификация дофетилида Р 136. г) Размер частиц. Анализы размера частиц проводили путем дифракции лазерного луча, используя приборMalvern Mastersizer S. Приблизительно 0,5 г каждого образца добавляли к 100 мл пропан-2 ола. Полученный насыщенный раствор фильтровали, дополнительно добавляли образец и диспергировали путем обработки ультразвуком с последующим перемешиванием. Средние значения для размера частиц, установленные по D(v, 0,9), вычисляли по трем определениям. Результаты анализа размера частиц, полученные для полиморфной модификации дофетилида Р 162 и для каждого из продуктов кон трольных примеров 1 А, 2 А и 3 А приведены в табл. 5. Таблица 5 Образец Полиморфная модификация дофетилида Р 162 Контрольный пример 1 А 1 Контрольный пример 2 А 2 Контрольный пример 3 А Примечания 1,2. В отличие от полиморфной модификации дофетилида Р 162, каждый из продуктов контрольных примеров 1 А, 2 А и 3 А содержит смесь тонкодисперсного вещества и больших 27 комков, которые достигают 6-8 мм в поперечнике. После обработки ультразвуком каждого из продуктов контрольных примеров 1 А, 2 А и 3 А в насыщенном растворе много больших комков остается в продуктах контрольных примеров 1 А и 2 А, и они не включены в производимый анализ размера частиц. В результате данные по размеру частиц, полученные для продуктов контрольных примеров 1 А и 2 А, не точны, так как анализировали только тонкодисперсные фракции. Результаты, представленные в табл. 5, показывают, что кроме полиморфной модификации дофетилида Р 162 только продукт контрольного примера 3 А имел 90% частиц размером менее 45 мкм. Однако продукт контрольного примера 3 А имел 90% частиц размером менее 14 мкм, который считается слишком малым для того, чтобы быть пригодным для использования в капсульном препарате. Следует отметить, что для удаления больших комков вещества из продуктов контрольных примеров 1 А, 2 А и 3 А в процессе производства требуется стадия измельчения, что не является необходимым для полиморфной модификации дофетилида Р 162. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кристаллической полиморфной формы дофетилида, заключающийся в получении полиморфной модификации этого вещества либо путем кристаллизации любой из его форм или их смеси из водного ацетонитрила, либо путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта, либо путем растворения любой из его форм или их смеси в метаноле, нанесения полученного раствора на силикагелевую колонку, элюирования этой колонки метанолом и концентрирования элюированного раствора до сухого состояния с получением продукта. 2. Способ по п.1, отличающийся тем, что при получении полиморфной модификации дофетилида путем кристаллизации любой из его форм или их смеси из водного ацетонитрила используют смесь ацетонитрил:вода в соотношении от 98,5:1,5 до 99,5:0,5 по объему. 3. Способ по п.2, отличающийся тем, что используют смесь ацетонитрил:вода в соотношении приблизительно 99:1 по объему. 4. Способ по п.1, отличающийся тем, что при получении полиморфной модификации дофетилида путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта основание представляет собой гидроксид натрия. 5. Способ по п.1 или 4, отличающийся тем,что при получении полиморфной модификации 28 дофетилида путем растворения любой из его форм или их смеси в водном растворе основания, доведения рН приблизительно до 8,5, используя кислоту, и собирания продукта кислота представляет собой минеральную кислоту, такую как соляная кислота. 6. По существу чистая, кристаллическая полиморфная модификация дофетилида Р 162,которая характеризуется эндотермическим пиком при приблизительно 162 С. 7. Полиморфная модификация дофетилида Р 162 по п.6, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuКальфа 1: d 21,303, 10,597, 7,053, 5,288, 5,088,4,856, 4,793, 4,569, 4,504, 4,430, 4,256, 4,230,4,133, 3,956, 3,911, 3,866, 3,674, 3,606, 3,524,3,424, 3,384, 3,309, 3,255, 3,171, 3,083, 3,038,3,021, 2,893, 2,842, 2,776, 2,679, 2,598, 2,557,2,503, 2,482, 2,436, 2,419, 2,399, 2,345 и 2,323. 8. Полиморфная модификация дофетилида Р 162 по п.6 или 7, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3246, 3013, 2807, 2776, 1907, 1611, 1593,1510, 1398, 1366, 1357, 1321, 1300, 1277, 1251,1220, 1171, 1146, 1106, 1091, 1051, 1031, 1023,994, 966, 934, 925, 903, 851, 825, 808, 774, 723,657, 603, 586, 559, 538, 528, 509, 499, 461 и 431 см-1. 9. Фармацевтическая композиция, содержащая полиморфную модификацию дофетилида Р 162 по пп.6, 7 или 8 вместе с фармацевтически приемлемым разбавителем или носителем. 10. Композиция по п.9, которая пригодна для введения в капсульной лекарственной форме. 11. Полиморфная модификация дофетилида Р 162 по пп.6, 7 или 8 или ее фармацевтически приемлемая композиция по п.9 или 10 для применения в качестве лекарства. 12. Применение полиморфной модификации дофетилида Р 162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10 для производства антиаритмического агента. 13. Применение полиморфной модификации дофетилида Р 162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10 для производства лекарства для лечения сердечной недостаточности, в частности застойной сердечной недостаточности. 14. Способ лечения сердечной аритмии,при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р 162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10. 15. Способ лечения сердечной недостаточности, в частности застойной сердечной недос 29 таточности, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р 162 по пп.6, 7 или 8 или ее фармацевтически приемлемой композиции по п.9 или 10. 16. По существу чистая, кристаллическая полиморфная модификация дофетилида Р 162 а,которая характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 160 С. 17. Полиморфная модификация дофетилида Р 162 а по п. 16, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuКальфа 1: d 21,306, 10,603, 7,054, 5,289, 5,114,5,094, 4,860, 4,572, 4,431, 4,260, 4,247, 4,228,4,153, 4,136, 3,955, 3,870, 3,676, 3,607, 3,524,3,435, 3,421, 3,384, 3,176, 3,038, 2,895, 2,778,2,684, 2,559, 2,501, 2,486, 2,433, 2,326, 2,283,2,248, 2,216, 2,171, 2,119, 2,051, 1,989 и 1,948. 18. Полиморфная модификация дофетилида Р 162 а по п.16 или 17, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3246, 3013, 2807, 2776, 1907, 1611,1593, 1510, 1397, 1366, 1357, 1321, 1300, 1277,1251, 1220, 1171, 1146, 1106, 1091, 1051, 1031,1023, 994, 966, 934, 926, 903, 851, 825, 807, 774,726, 657, 602, 586, 559, 538, 528, 509, 499, 461 и 430 см-1. 19. По существу чистая, кристаллическая полиморфная модификация дофетилида Р 143,которая характеризуется ДСК, при которой она проявляет эндотермический тепловой эффект при приблизительно 144 С. 20. Полиморфная модификация дофетилида Р 143 по п.19, которая дополнительно характеризуется следующей рентгенограммой, полученной при дифракции рентгеновских лучей при облучении рентгеновским излучением СuКальфа 1: d 10,993, 9,006, 8,243, 6,769, 5,807,5,530, 5,375, 5,104, 4,998, 4,735, 4,575, 4,539,4,237, 4,179, 4,159, 4,019, 3,854, 3,705, 3,682,3,601, 3,562, 3,482, 3,392, 3,343, 3,331, 3,263,3,227, 3,173, 3,135, 3,082, 3,009, 2,946, 2,905,2,859, 2,830, 2,803, 2,769, 2,672, 2,608 и 2,567. 21. Полиморфная модификация дофетилида Р 143 по п.19 или 20, которая дополнительно характеризуется следующими полосами в инфракрасном спектре поглощения порошка в нуйоле при 3266, 3123, 3107, 3041, 3027, 3013,2766, 2723, 2610, 1895, 1614, 1607, 1587, 1511, 002656 1414, 1395, 1337, 1319, 1301, 1287, 1248, 1230,1215, 1202, 1187, 1157, 1148, 1130, 1110, 1060,1042, 1018, 1005, 980, 975, 959, 940, 917, 853,844, 831, 803, 785, 766, 752, 743, 718, 640, 613,553, 536, 526, 509, 499, 455 и 429 см-1. 22. Фармацевтическая композиция, содержащая полиморфную модификацию дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 19-21,соответственно, вместе с фармацевтически приемлемым разбавителем или носителем. 23. Полиморфная модификация дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 1921, соответственно, или ее фармацевтически приемлемая композиция по п.22 для применения в качестве лекарства. 24. Применение полиморфной модификации дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22 для производства антиаритмического агента. 25. Применение полиморфной модификации дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22 для производства лекарства для лечения сердечной недостаточности, в частности застойной сердечной недостаточности. 26. Способ лечения сердечной аритмии,при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22. 27. Способ лечения сердечной недостаточности, в частности застойной сердечной недостаточности, при котором животному, включая человека, нуждающемуся в таком лечении, вводят эффективное количество полиморфной модификации дофетилида Р 162 а или Р 143 по любому из пп.16-18 и 19-21, соответственно, или ее фармацевтически приемлемой композиции по п.22. 28. Полиморфная модификация по пп.6, 7,8, 16, 17, 18, 19, 20 или 21, где "по существу чистая" означает чистоту, по меньшей мере, 95 мас.%. 29. Полиморфная модификация по п.28,где "по существу чистая" означает чистоту, по меньшей мере, 98 мас.%. 30. Полиморфная модификация по п.29,где "по существу чистая" означает чистоту, по меньшей мере, 99 мас.%.
МПК / Метки
МПК: C07C 311/08
Метки: полиморфные, модификации, дофетилида
Код ссылки
<a href="https://eas.patents.su/21-2656-polimorfnye-modifikacii-dofetilida.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфные модификации дофетилида</a>