Способ получения бензоксаборолов
Номер патента: 21532
Опубликовано: 30.07.2015
Авторы: Конде Хосе Х., Заджак Мэттью Аллен, Ковальски Энтони Джон
Формула / Реферат
1. Способ получения соединения формулы А, включающий приведение соединения формулы 6
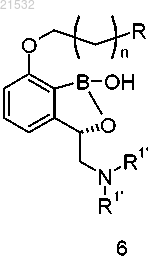
или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А

или его фармацевтически приемлемой соли,
где R представляет собой Н или OR1;
каждый R1 и каждый R1' независимо представляют собой защитные группы;
R1'' представляет собой Н или ОН;
n равен 0, 1, 2, 3, 4 или 5,
где соединение формулы 6 получают приведением соединения формулы 5
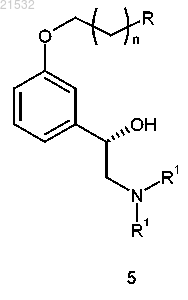
или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой:
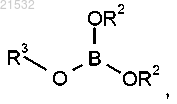
в присутствии алкиллитиевого реагента,
где каждый R2 независимо представляет собой С1-С6-алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо и
R3 представляет собой C1-алкил, С2-алкил, С3-алкил, С4-алкил, C5-алкил, С6-алкил.
2. Способ по п.1, где
R представляет собой OR1;
R1 представляет собой группы -СН(Ra)фенил-(Rb)х, триалкилсилил, тетрагидропиранил, -СН2ОСН3 или -СН2ОСН2СН2ОСН3, где Ra представляет собой Н или метил; Rb представляет собой метокси или C1-алкил, С2-алкил или С3-алкил и х равен 0, 1 или 2;
каждый R1' независимо представляет собой -CH(Rc)фенил-(Rd)y, где Rc представляет собой Н или метил, каждый Rd независимо представляет собой метокси или C1-алкил, С2-алкил или С3-алкил; n равен 0, 1, 2 или 3 и у равен 0, 1 или 2.
3. Способ по п.1, где
R представляет собой OR1;
R1 и каждый R1' представляют собой бензильные группы;
реагент для снятия защиты представляет собой восстановитель;
n равен 1;
соединение формулы 6 восстанавливают в присутствии HCl с получением гидрохлоридной соли соединения формулы А.
4. Способ по п.3, где реагент для снятия защиты представляет собой Pd/C или Pt/C в присутствии Н2 или их смесь, Н2 над гидроксидом палладия или реагент для гидрогенизации в условиях каталитического переноса.
5. Способ по п.1, где борилирующий реагент представляет собой изопропилпинаколборат или три-С1-борат, три-С2-борат или три-С3-борат; n представляет собой число от 0 до 3 и алкиллитиевый реагент представляет собой н-BuLi, н-гексиллитий или втор-BuLi.
6. Способ по п.1 или 5, где борилирующий реагент представляет собой изопропилпинаколборат или триметилборат; n равен 2 и алкиллитиевый реагент представляет собой н-BuLi.
7. Способ по п.1, где соединение формулы 5 или его соль получают
либо энантиоселективным восстановлением соединения формулы 10

или его соли,
либо приведением R1'X в основных условиях в контакт с соединением формулы 4
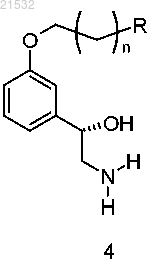
или его солью,
где X представляет собой уходящую группу.
8. Способ по п.7, где соединение формулы 5 или его соль получают с использованием Н2 и комплекса трифенилфосфина (S)-2-[(SP)-2-(дифенилфосфино)ферроценил]-4-изопропил-2-оксазолина и дихлорида рутения(II) или Н2 и (R)-BINAP-Ru-(R,R)-(+)-DPEN Cl ([(R)-2,2'-бис-(дифенилфосфино)-1,1'-бинафтил]-Ru-(R,R)-(+)-[1,2-дифенилэтилендиамин] Cl); n равен 2.
9. Способ по п.7, где соединение формулы 5 или его соль получают приведением соединения формулы 4 или его соли в контакт с бензилбромидом в присутствии карбоната или гидроксида.
10. Способ по п.9, где соединение формулы 4 или его соль получают приведением соединения формулы 2
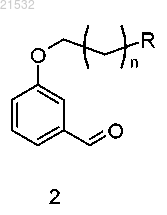
в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3
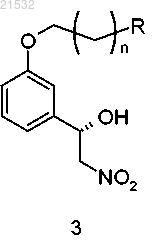
с последующим восстановлением нитрогруппы до аминогруппы.
11. Способ по п.10, где хиральный реагент представляет собой дигидрохлорид 1,7,7-триметил-N-(пиридин-2-илметил)бицикло[2.2.1]гептан-2-амина; (4S)-4-этил-2-{1-этил-1-[(4S)-4-(1-метилэтил)-4,5-дигидро-1,3-оксазол-2-ил]пропил}-4,5-дигидро-1,3-оксазол; (S)-4-(трет-бутил)-2-(2-((S)-4-метил-4,5-дигидрооксазол-2-ил)пропан-2-ил)-4,5-дигидрооксазол или N1,N2-бис-[(1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]-1,2-этандиамин в присутствии Cu(OAc)2; n равен 2.
12. Способ по п.7, где соединение формулы 10 или его соль получают приведением HN(R1')2 в контакт с основанием и соединением формулы 9

13. Способ по п.12, где соединение формулы 9 получают бромированием соединения формулы 8
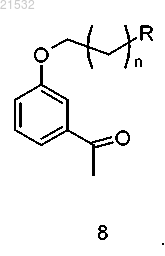
14. Способ получения соединения формулы А, включающий стадии:
а) приведения соединения формулы 2
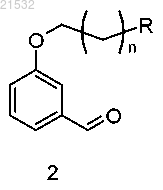
в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3
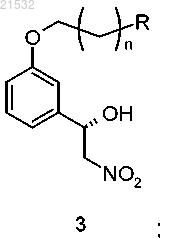
где R представляет собой Н или OR1; R1 представляет собой защитную группу и n равен 0, 1, 2, 3, 4 или 5;
б) восстановления соединения формулы 3 с получением соединения формулы 4
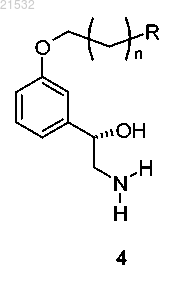
или его соли;
в) приведения соединения формулы 4 или его соли в контакт с R1'X и основанием с получением соединения формулы 5
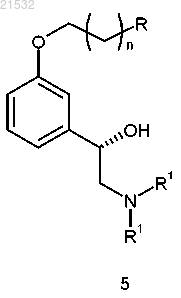
или его соли,
где R1' представляет собой защитную группу и X представляет собой уходящую группу;
г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой:
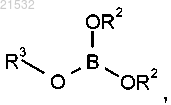
в присутствии н-BuLi с получением соединения формулы 6
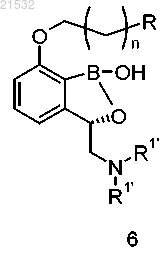
или его фармацевтически приемлемой соли,
где каждый R2 независимо представляет собой C1-алкил, С2-алкил, С3-алкил, С4-алкил, C5-алкил, С6-алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо;
R3 представляет собой C1-алкил, С2-алкил, С3-алкил, С4-алкил, C5-алкил, С6-алкил; и
д) приведения соединения формулы 6 или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли
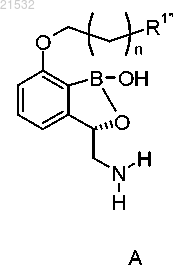
где R1'' представляет собой Н или ОН.
15. Способ по п.14, где
R1 и каждый R1' представляют собой бензильные группы;
n равен 2;
хиральный реагент представляет собой дигидрохлорид 1,7,7-триметил-N-(пиридин-2-илметил)бицикло[2.2.1]гептан-2-амина, (4S)-4-этил-2-{1-этил-1-[(4S)-4-(1-метилэтил)-4,5-дигидро-1,3-оксазол-2-ил]пропил}-4,5-дигидро-1,3-оксазол, (S)-4-(трет-бутил)-2-(2-((S)-4-метил-4,5-дигидрооксазол-2-ил)пропан-2-ил)-4,5-дигидрооксазол или N1,N2-бис-[(1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]-1,2-этандиамин в присутствии Cu(OAc)2;
X представляет собой уходящую группу, выбранную из Br, Cl, I, тозила или трифлила;
борилирующий реагент представляет собой изопропилпинаколборат или триметилборат;
агент для снятия защиты представляет собой гидрогенизацию в присутствии катализатора Pd/C, катализатора Pt/C или смеси катализаторов Pd/C и Pt/C.
16. Способ получения соединения формулы А, включающий стадии:
а) бромирования соединения формулы 8
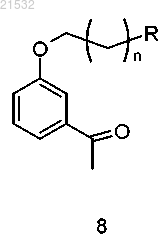
с получением соединения формулы 9
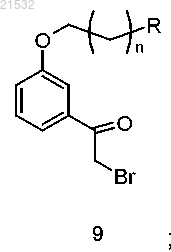
где R представляет собой Н или OR1;
R1 представляет собой защитную группу;
n равен 0, 1, 2, 3, 4 или 5;
б) приведения соединения формулы 9 в контакт с HN(R1')2 с получением соединения формулы 10
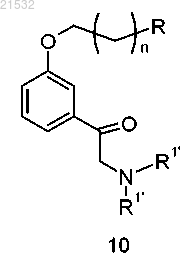
или его соли,
где каждый R1' представляет собой защитную группу;
в) энантиоселективного восстановления соединения формулы 10 или его соли с получением соединения формулы 5
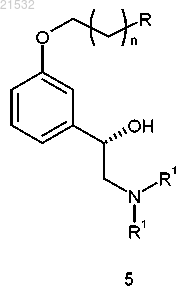
или его соли;
г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой:
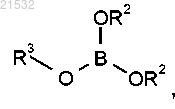
в присутствии н-BuLi с получением соединения формулы 6
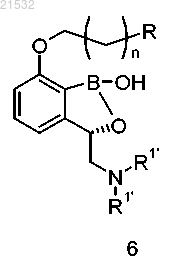
или его фармацевтически приемлемой соли,
где каждый R2 независимо представляет собой C1-алкил, С2-алкил, С3-алкил, С4-алкил, С5-алкил, С6-алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо;
R3 представляет собой C1-алкил, С2-алкил, С3-алкил, С4-алкил, C5-алкил, С6-алкил; и
д) приведения соединения формулы 6 или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли
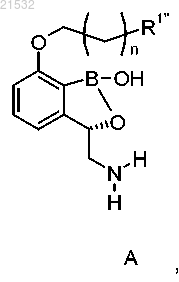
где R1'' представляет собой Н или ОН.
Текст
Согласно настоящему изобретению предложен способ, включающий приведение соединения формулы 6 Конде Хосе Х., Ковальски Энтони Джон, Заджак Мэттью Аллен (US) или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли; где R представляет собой Н или OR1; R1 и каждый R1' представляют собой защитные группы; R1" представляет собой Н или ОН; n равен 0, 1, 2, 3, 4 или 5. Предшествующий уровень техники Настоящее изобретение относится к бензоксаборолам и способам их получения. Гидрохлоридная соль (3S)-3-(аминометил)-7-[(3-гидроксипропил)окси]-2,1-бензоксаборол-1(3H)-ола, раскрытая в заявке на патент США 12/142692 (в настоящее время патенте США 7816344) вместе с другими фармацевтически приемлемыми солями, характеризуется следующей формулой: Было показано, что эти соли, также как и соответствующее им конъюгатное свободное основание,являются перспективными антибактериальными агентами, особенно против грамотрицательных патогенов. По этой причине полезно найти альтернативные способы получения этого агента и его солей. Краткое изложение сущности изобретения В одном аспекте согласно настоящему изобретению предложен способ, включающий снятие защиты с соединения формулы 6 или его фармацевтически приемлемой соли в условиях снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли,где R представляет собой Н или OR1; каждый R1 и каждый R1' представляют собой защитные группы;n равен 0, 1, 2, 3, 4 или 5. Во втором аспекте согласно настоящему изобретению предложен способ, включающий стадии: а) приведения соединения формулы 2 в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3R1 представляет собой защитную группу;n равен 0, 1, 2, 3, 4 или 5; б) восстановления соединения формулы 3 с получением соединения формулы 4 в) приведения соединения формулы 4 или его соли в контакт с R1'X и основанием с получением соединения формулы 5 или его соли,где R1' представляет собой защитную группу иX представляет собой уходящую группу; г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой: в присутствии н-BuLi с получением соединения формулы 6 или его фармацевтически приемлемой соли,где каждый R2 независимо представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6 алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо;R3 представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6-алкил; и д) снятия защиты с соединения формулы 6 или его фармацевтически приемлемой соли с получением соединения формулы А или его фармацевтически приемлемой соли В другом аспекте согласно настоящему изобретению предложен способ, включающий стадии: а) бромирования соединения формулы 8 с получением соединения формулы 9R1 представляет собой защитную группу;n равен 0, 1, 2, 3, 4 или 5; б) приведения соединения формулы 9 в контакт с HN(R1')2 с получением соединения формулы 10 или его соли,где каждый R1' представляет собой защитную группу; в) энантиоселективного восстановления соединения формулы 10 с получением соединения формулы 5 г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой: в присутствии н-BuLi с получением соединения формулы 6 или его фармацевтически приемлемой соли,где каждый R2 независимо представляет собой C1-С 6-алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют (как указано выше) 5- или 6-членное кольцо;R3 представляет собой C1-С 6-алкил; и д) снятия защиты с соединения формулы 6 или его фармацевтически приемлемой соли с получением соединения формулы А или его фармацевтически приемлемой соли где R1 представляет собой Н или ОН. В другом аспекте согласно настоящему изобретению предложено соединение, характеризующееся следующей формулой 6 а или его фармацевтически приемлемая соль,где R1 представляет собой Н или ОН иR1' представляет собой защитную группу. Подробное описание изобретения В первом аспекте согласно настоящему изобретению предложен способ, включающий снятие защиты с соединения формулы 6 или его фармацевтически приемлемой соли в условиях снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли,где R представляет собой Н или OR1;R1 и каждый R1' представляют собой защитные группы;n равен 0, 1, 2, 3, 4 или 5. Примеры подходящих защитных групп R1 включают группы -CH(Ra)фенил-(Rb)x, триалкилсилил,тетрагидропиранил, -СН 2 ОСН 3 или -СН 2 ОСН 2 СН 2 ОСН 3, где Ra представляет собой Н, C1-алкил, С 2 алкил, С 3-алкил, С 4-алкил или фенил; каждый Rb независимо представляет собой C1-алкилокси, С 2 алкилокси, С 3-алкилокси, С 4-алкилокси или C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил; х равен 0, 1 или 2. В-4 021532 другом аспекте R1 представляет собой бензил. С 1-С 4-алкил относится к C1-алкилу, С 2-алкилу, С 3-алкилу, С 4-алкилу, например метилу, этилу, нпропилу, изопропилу, н-бутилу, втор-бутилу и трет-бутилу. Аналогично, С 1-С 4-алкокси относится к C1 алкилокси, С 2-алкилокси, С 3-алкилокси, С 4-алкилокси, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси и трет-бутокси. C1-С 6-алкил относится к C1-алкилу, С 2-алкилу, С 3-алкилу,С 4-алкилу, C5-алкилу, С 6-алкилу. Примеры подходящих защитных групп R1' включают -СН(Rb)фенил-(Rc)у; примеры таких групп включают группы бензил, 1-фенилэтил, 2-метоксибензил, 3-метоксибензил, 4-метоксибензил, 2,4 диметоксибензил и дифенилметил; в другом аспекте каждый R1' представляет собой бензил. Подходящие способы снятия защиты включают гидрогенизацию, катализируемую металлами, гидрогенизацию с каталитическим переносом или кислотное расщепление. В случаях, когда R1' представляет собой бензил, предпочтительные реагенты для снятия защиты включают Н 2 над Pd/C, H2 над Pt/C, H2 над гидроксидом палладия или формиат аммония и Pd/C. В другом аспекте n равен 0, 1, 2 или 3; предпочтительно n равен 2. При использовании здесь "фармацевтически приемлемая соль" относится к соли присоединения кислоты. Примерами подходящих солей присоединения кислоты являются соли неорганических кислот и органические соли. Примеры подходящих неорганических солей включают соли соляной, бромистоводородной, фосфорной, метафосфорной, азотной и серной кислот; примеры подходящих солей органических кислот включают соли винной, уксусной, трифторуксусной, лимонной, яблочной, молочной, фумаровой, бензойной, муравьиной, пропионовой, гликолевой, глюконовой, малеиновой, янтарной, метансульфоновой, этансульфоновой, стеариновой, бензолсульфоновой, бромбензолсульфоновой и птолуолсульфоновой кислот. Фармацевтически приемлемой солью соединения А предпочтительно является соль HCl. В другом аспекте соединение формулы 6 восстанавливают в присутствии HCl с получением гидрохлоридной соли соединения формулы А. В другом аспекте настоящего изобретения соединение формулы 6 получают приведением соединения формулы 5 или его соли в контакт с борилирующим реагентом в присутствии алкиллития, такого как н-BuLi, нгексиллитий или втор-BuLi. Борилирующий реагент характеризуется следующей формулой: Каждый R2 независимо представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, С 5-алкил, С 6 алкил, и каждый R3 представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6-алкил. Предпочтительно каждый R2 представляет собой одну и ту же алкильную группу; альтернативно, группыR2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо, которое возможно может быть конденсировано с арильным кольцом. Примеры подходящих борилирующих реагентов включают изопропилпинаколборат, 2-(метокси)-1,3,2-бензодиоксаборол и три-С 1-бораты, триС 2-бораты и три-С 3-бораты, такие как триизопропилборат и триметилборат. В другом аспекте борилирующий реагент представляет собой изопропилпинаколборат или триметилборат. Соединение формулы 5 или его соль могут быть получены приведением R1'X в основных условиях в контакт с соединением формулы 4 или его солью,где X представляет собой подходящую уходящую группу, такую как Br, Cl, I, тозильная или трифлильная группа. Подходящие основания включают карбонаты, такие как карбонаты натрия, калия и цезия, или гидроксиды, такие как гидроксид тетрабутиламмония. Соединение формулы 4 или его соль могут быть получены приведением соединения формулы 2 в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3 с последующим восстановлением нитрогруппы до аминогруппы. Примеры подходящих хиральных реагентов включают дигидрохлорид 1,7,7-триметил-N-(пиридин 2-илметил)бицикло[2.2.1]гептан-2-амина; (4S)-4-этил-2-1-этил-1-[(4S)-4-(1-метилэтил)-4,5-дигидро-1,3 оксазол-2-ил]пропил-4,5-дигидро-1,3-оксазол; (S)-4-(трет-бутил)-2-(2-S)-4-метил-4,5-дигидрооксазол 2-ил)пропан-2-ил)-4,5-дигидрооксазол или N1,N2-бис-[(1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2 ил]-1,2-этандиамин в присутствии подходящего катализатора, такого как Со(ОАс)2, Cu(OAc)2, CuCl2,Zn(OTf)2 или Zn(Et)2. Примеры подходящих агентов для восстановления нитрогруппы включают Pd/C, Pt/C или их смесь в присутствии водорода. Соединение формулы 2 легко получают путем взаимодействия R1(CH2)3-X с 3 гидроксибензальдегидом в присутствии подходящего основания, примеры которого включают гидроксидное и карбонатное основания. Альтернативно, соединение формулы 5 или его соль могут быть получены энантиоселективным восстановлением соединения формулы 10 или его соли. Примеры реагентов для энантиоселективного восстановления включают Н 2 и катализатор на основе рутения,родия или иридия,такой как комплекс трифенилфосфина(S)-2-[(Sp)-2(дифенилфосфино)ферроценил]-4-изопропил-2-оксазолина и дихлорида рутения(II) (также известный как катализатор Naud); (R)-BINAP-Ru-(R,R)-(+)-DPEN Cl (также известный как катализатор Noyori), или катализируемое оксазаборолидином восстановление бораном. Соединение формулы 10 или его соль могут быть получены приведением HN(R1')2 в контакт с соединением формулы 9 Соединение формулы 9 может быть получено бромированием соединения формулы 8 Подходящие бромирующие реагенты включают Br2 в дихлорметане, NBS (N-бромсукцинимид) и трибромид тетра-н-бутиламмония. Соединение формулы 8 получают приведением 3-гидроксиацетофенона в контакт с X(CH2)3-R1 и подходящим основанием, примеры которого включают гидроксидное и карбонатное основания. Схемы Следующие схемы в целом иллюстрируют способы по настоящему изобретению. R1, R1' и X не ограничены конкретными раскрытыми группами, и способы не ограничены раскрытыми катализаторами,основаниями, восстановителями и энантиоселективными реагентами. Схема 1 В соответствии со схемой 1 3-гидроксибензальдегид (соединение 1) приводят в контакт сXCH2(CH2)nCH2R в присутствии подходящего основания в условиях, достаточных для получения соединения 2. Соединение 2 превращают в соответствующий (1S)-2-нитро-1-фенилэтанол (соединение 3), используя нитрометан и подходящий хиральный реагент, такой как дигидрохлорид 1,7,7-триметил-N-(пиридин 2-илметил)бицикло[2.2.1]гептан-2-амина, (4S)-4-этил-2-1-этил-1-[(4S)-4-(1-метилэтил)-4,5-дигидро-1,3 оксазол-2-ил]пропил-4,5-дигидро-1,3-оксазол, (S)-4-(трет-бутил)-2-(2-S)-4-метил-4,5-дигидрооксазол 2-ил)пропан-2-ил)-4,5-дигидрооксазол или N1,N2-бис-[(1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2 ил]-1,2-этандиамин в присутствии подходящего катализатора, такого как Cu(OAc)2. Затем соединение 3 превращают в соответствующий первичный амин (соединение 4), после чего защищают, используя R1'X,-7 021532 с получением соединения 5; это промежуточное соединение может быть выделено в виде свободного основания или в виде соли, предпочтительно гидрохлоридной соли. Соединение 5 или его соль борилируют подходящим борилирующим реагентом в присутствии сильного основания, такого как н-BuLi, нгексиллитий или втор-BuLi, с получением соединения 6. С этого промежуточного соединения снимают защиту с получением аминометилбензоксаборола, предпочтительно (3S)-3-(аминометил)-7-[(3 гидроксипропил)окси]-2,1-бензоксаборол-1(3H)-ола. Этот продукт предпочтительно выделяют в виде гидрохлоридной соли, и он далее может быть очищен путем перекристаллизации. Схема 2 В соответствии со схемой 2 3-гидроксиацетофенон (соединение 7) приводят в контакт сXCH2(CH2)nCH2-R в присутствии подходящего основания в условиях, достаточных для получения соединения 8. Бромирование подходящим бромирующим реагентом приводит к получению бромкетона (соединения 9), который в свою очередь приводят в контакт с HN(R1')2 в условиях, достаточных для получения защищенного амина (соединения 10). Соединение 10 или его соль подвергают энантиоселективному восстановлению до соответствующего (1S)-2-амино-1-фенилэтанола (соединения 5) в условиях энантиоселективного восстановления. Затем соединение 5 или его соль борилируют и снимают с него защиту, как изображено на схеме 1,с получением аминометилбензоксаборола,предпочтительно(3S)-3-(аминометил)-7-[(3 гидроксипропил)окси]-2,1-бензоксаборол-1(3H)-ола, предпочтительно в виде гидрохлоридной соли. Следующие примеры являются иллюстративными для способа по настоящему изобретению и не предназначены ограничивать объем изобретения. Пример 1. Получение гидрохлорида (3S)-3-(аминометил)-7-[(3-гидроксипропил)окси]-2,1 бензоксаборол-1(3 Н)-она. 1 А. Получение 3-(3-[(фенилметил)окси]пропилокси)бензальдегида В реакционный сосуд объемом 3 л загружали карбонат цезия (209,6 г), 3-гидроксибензальдегид(67,6 г), диметилформамид (DMF, 250 мл) и 3-бромпропилфенилметиловый эфир (113,4 г) и перемешивали их при температуре окружающей среды в течение приблизительно 18 ч. Добавляли воду (567 мл), а затем трет-бутилметиловый эфир (907 мл). Нижний водный слой отделяли и органический слой промывали 1 н. гидроксидом натрия (2567 мл) и водой (1567 мл). Органический раствор концентрировали до минимального объема, после чего добавляли этанол (крепость "200 proof" (абсолют), 907 мл) и раствор концентрировали до минимального объема и фильтровали через 1-мкм фильтр. Ацетат меди(II) и бис-HCl соль камфораминометилпиридина (504 мг) загружали в реактор с последующей загрузкой этанола (60 мл) и диизопропилэтиламина (изо-Pr2NEt) (1,16 мл). Содержимое перемешивали в течение 1 ч при комнатной температуре, после чего загружали раствор 3-(3[(фенилметил)окси]пропилокси)бензальдегида в этаноле (15 г в 15 мл). Реакционную смесь охлаждали до температуры от -30 до -40 С; потом к реакционной смеси медленно добавляли нитрометан (33,9 г),поддерживая температуру ниже -30 С, а затем диизопропилэтиламин (359 мг). Температуру реакционной смеси поддерживали при -30 С в течение 24-48 ч. По завершении реакции в реакционную смесь загружали трифторуксусную кислоту (952 мг) и содержимое переносили в отдельный реактор, содержащий раствор 1 н. HCl (75 мл) и трет-бутилметилового эфира (ТВМЕ, 150 мл) при комнатной температуре. После окончания добавления слои оставляли разделяться и водную фазу удаляли. Затем органическую фазу промывали водой (75 мл) и водную фазу удаляли. Потом раствор продукта в ТВМЕ фильтровали через слой силикагеля (15 г), который ополаскивали ТВМЕ. Продукт хранили холодным в виде раствора в ТВМЕ, который перед последующей стадией гидрогенизации следует заменить этанолом. 1 В 1. Получение (1S)-2-амино-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола(1S)-2-Нитро-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанол в этанольном растворе (8 г в 160 мл) подвергали гидрогенизации с использованием Pd(4%)/Pt(1%)/С катализатора (1,6 г). После израсходования исходного вещества и гидроксиламинного промежуточного соединения фильтровали продукт реакции в этаноле. 1 В 2. Получение гидрохлорида Порошкообразный карбонат калия (12,8 г) загружали в реактор объемом 250 мл с последующей загрузкой этанольного раствора (1S)-2-амино-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола(12,7 г в 100 мл). В суспензию загружали дополнительное количество этанола (40 мл). В реактор загружали бензилбромид (15,9 г) и суспензию перемешивали при 20-25 С в течение 18-24 ч, после чего твердую фазу отфильтровывали и промывали этанолом (50 мл). Фильтрат разбавляли водой (50 мл), затем нагревали до 50 С. В реактор загружали концентрированную HCl (3,52 мл), что приводило к осаждениюHCl соли продукта. В начале осаждения суспензию выдерживали при 50 С в течение 30 мин, затем суспензию охлаждали до 0 С и выдерживали при 0 С в течение еще 30 мин. Продукт фильтровали и промывали 20%-ным водным раствором этанола (приблизительно 60 мл) при 0 С. В реактор объемом 250 мл загружали гидрохлорид (1S)-2-[бис-(фенилметил)амино]-1-[3-(3[(фенилметил)окси]пропилокси)фенил]этанола (20 г) и толуол (160 мл). Содержимое тщательно перемешивали в течение приблизительно 5 мин, после чего смесь дегазировали путем помещения реактора под вакуум и заполнения его азотом с повторением операций два раза. Суспензию нагревали до 50-55 С,после чего в течение приблизительно 1 ч при интенсивном перемешивании добавляли н-BuLi (16,3 мл,2,6 М). Затем смесь перемешивали в течение приблизительно 1 ч при 50-55 С, после чего наблюдали израсходование исходного вещества. Затем смесь охлаждали до температуры от -20 до -40 С, потом добавляли 1,0 экв. н-BuLi (14,8 мл) с такой скоростью, чтобы поддерживать температуру ниже -20 С. После окончания добавления температуру доводили до -(30-40)С, и настолько быстро, насколько это было возможно (меньше 10 мин), добавляли н-BuLi (43 мл), сохраняя в процессе добавления температуру ниже -20 С. Температуру доводили до -(20-25)С и смесь перемешивали в течение 1 ч. Смесь охлаждали до температуры от -75 до -80 С и непосредственно в CD3OD гасили аликвоту. После полного включения дейтерия, подтвержденного LCMS (жидкостная хроматография - масс-спектрометрия), добавляли THF(тетрагидрофуран) (18 мл), сразу после чего быстро добавляли борат (36 мл). Смесь нагревали до 1525 С в течение от 30 мин до 1 ч, затем добавляли 5%-ный водн. NaHCO3 (200 мл) и смесь интенсивно перемешивали в течение приблизительно 15 мин. Полученную суспензию фильтровали и осадок на фильтре промывали по меньшей мере 30 мл ТВМЕ. Фильтрат оставляли разделяться и затем органический слой промывали три или четыре раза водой (100 мл), оставляя последнюю промывку отстаиваться по меньшей мере на 1 ч. Органический слой концентрировали до приблизительно 40 мл. 1 Д. Получение гидрохлорида (3S)-3-(аминометил)-7-[(3-гидроксипропил)окси]-2,1-бензоксаборол 1(3 Н)-ола К раствору гидрохлорида (3S)-3-(аминометил)-7-[(3-гидроксипропил)окси]-2,1-бензоксаборол 1(3 Н)-она в толуоле (приблизительно 46 мл) добавляли метанол (200 мл), 1 н. HCl в воде (42,5 мл) и катализатор 5% Pd/C (2 г, 11 мас.%). Полученную смесь обрабатывали газообразным водородом при 100 фунт/кв.дюйм (изб.) (примерно 689,4 кПа (изб. и 50 С. После израсходования моно-N-бензиламинного промежуточного соединения реакционный раствор фильтровали через наполнитель для фильтраочистителя с последующим 1-мкм фильтрованием. Затем отфильтрованный раствор неочищенного продукта подвергали дистилляции, добавляли 2-пропанол (200 мл), после чего снова дистиллировали до минимального объема, позволяющего осуществлять перемешивание. Этот концентрированный раствор оставляли кристаллизоваться при комнатной температуре, затем фильтровали и промывали 2-пропанолом. Н ЯМР: (d4-метанол, 400,13 МГц) d (млн-1) 7,48 (t, J=7,81 Гц, 1 Н), 7,01 (d, J=7,58 Гц, 1 Н), 6,93 (d,J=8,21 Гц, 1 Н), 5,37 (dd, J=2,76, 8,77 Гц, 1 Н), 4,18 (t, J=6,11 Гц, 2 Н), 3,78 (t, J=5,47 Гц, 2 Н), 3,59 (dd,J=2,87, 13,29 Гц, 1H), 2,92 (dd, J=8,86, 13,29 Гц, 1H), 2,00 (m, J=6,13 Гц, 2H). Точную массу протонированной молекулы [М + Н]+ измеряли при m/z 238,1247, используя ионизацию электрораспылением с регистрацией положительных ионов. Массу этого иона вычисляли при m/z 238,1251. Используя хиральную HPLC (высокоэффективная жидкостная хроматография), обнаружили,что хиральная чистота составила 99,9%. Пример 2. Получение гидрохлорида (3S)-3-(аминометил)-7-[(3-гидроксипропил)окси]-2,1 бензоксаборол-1(3 Н)-ола. 2 А. Получение 3-(3-[(фенилметил)окси]пропилокси)бензальдегида В реакционный сосуд объемом 3 л загружали карбонат калия (152 г), 3-гидроксибензальдегид (67,6 г), диметилформамид (DMF, 250 мл) и 3-хлорпропилфенилметиловый эфир (96,4 г) и перемешивали их при 90 С в течение приблизительно 18 ч. Добавляли воду (567 мл), а затем трет-бутилметиловый эфир(907 мл). Нижний водный слой отделяли и органический слой промывали 1 н. гидроксидом натрия (2567 мл) и водой (1567 мл). Органический раствор концентрировали до минимального объема, после чего добавляли этанол (крепость "200 proof", 907 мл), и раствор концентрировали до минимального объема и фильтровали через 1-мкм фильтр. 2 Б. Получение (1S)-2-нитро-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола Моногидрат ацетата меди(II) (3,70 г, 0,05 экв.) и бис-камфорэтилендиамин (N1,N2-бис-[(1R,2R,4R)1,7,7-триметилбицикло[2.2.1]гепт-2-ил]-1,2-этандиамин) (7,38 г, 0,06 экв.) загружали в реактор с последующей загрузкой этанола (200 мл, 2 объема). Содержимое нагревали до 50-60 С в течение приблизительно 1 ч или до растворения всей твердой фазы, затем охлаждали до комнатной температуры и перемешивали, после чего загружали раствор 3-(3-[(фенилметил)окси]пропилокси)бензальдегида в этаноле(100 г, 1 экв. в 50 мл, 0,5 об.). Реакционную смесь охлаждали до температуры от -10 до -20 С; потом к реакционной смеси медленно добавляли нитрометан (112,7 г, 5 экв.), поддерживая температуру ниже-10 С, а затем диизопропилэтиламин (1,94 мл, 1,44 г, 0,03 экв.). Температуру реакционной смеси поддерживали при -10 С в течение приблизительно 22-30 ч. По завершении реакции в реакционный сосуд загружали раствор 1 н. HCl (250 мл, 2,5 об.) и трет-бутилметилового эфира (ТВМЕ, 500 мл, 5 об.) при комнатной температуре. После добавления содержимое перемешивали в течение приблизительно 5 мин и доводили температуру до 20 С (приблизительно до комнатной температуры), затем слои оставляли разделяться и водную фазу удаляли. Потом органическую фазу промывали водой (250 мл, 2,5 об.) два раза, причем водную фазу каждый раз удаляли. Затем отгоняли ТМВЕ и заменяли его абсолютным этанолом. 2 В 1. Получение (1S)-2-амино-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола(1S)-2-Нитро-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанол в этанольном растворе (8 г в 160 мл) подвергали гидрогенизации с использованием Pd(4%)/Pt(1%)/С катализатора (1,6 г). После израсходования исходного вещества и гидроксиламинного промежуточного соединения фильтровали продукт реакции в этаноле.(1S)-2-[бис-(фенилметил)амино]-1-[3-(3 Порошкообразный карбонат калия (12,8 г) загружали в реактор объемом 250 мл с последующей загрузкой этанольного раствора (1S)-2-амино-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола(12,7 г в 100 мл). В суспензию загружали дополнительное количество этанола (40 мл). В реактор загружали бензилбромид (15,9 г) и суспензию перемешивали при 20-25 С в течение 18-24 ч, после чего твердую фазу отфильтровывали и промывали этанолом (50 мл). Фильтрат разбавляли водой (50 мл), затем нагревали до 50 С. В реактор загружали концентрированную HCl (3,52 мл), что приводило к осаждениюHCl соли продукта. В начале осаждения суспензию выдерживали при 50 С в течение 30 мин, затем суспензию охлаждали до 0 С и выдерживали при 0 С в течение еще 30 мин. Продукт фильтровали и промывали 20%-ным водным раствором этанола (приблизительно 60 мл) при 0 С. 2 Г. Получение (3S)-3-[бис-(фенилметил)амино]метил-7-(3-[(фенилметил)окси]пропилокси)-2,1 бензоксаборол-1(3 Н)-ола В реактор объемом 250 мл загружали гидрохлорид (1S)-2-[бис-(фенилметил)амино]-1-[3-(3[(фенилметил)окси]пропилокси)фенил]этанола (20 г) и толуол (160 мл). Содержимое тщательно перемешивали в течение приблизительно 5 мин, после чего смесь дегазировали путем помещения реактора под вакуум и заполнения его азотом с повторением операций два раза. Суспензию нагревали до 50-55 С,после чего в течение приблизительно 1 ч при интенсивном перемешивании добавляли н-BuLi (16,3 мл,2,6 М). Затем смесь перемешивали в течение приблизительно 1 ч при 50-55 С, после чего наблюдали израсходование исходного вещества. Затем смесь охлаждали до температуры от -20 до -40 С, потом добавляли 1,0 экв. н-BuLi (14,8 мл) с такой скоростью, чтобы поддерживать температуру ниже -20 С. После окончания добавления температуру доводили до -(30-40)С и, настолько быстро, насколько это было возможно (меньше 10 мин), добавляли н-BuLi (43 мл), сохраняя в процессе добавления температуру ниже -20 С. Температуру доводили до -(20-25)С и смесь перемешивали в течение 1 ч. Смесь охлаждали до температуры от -75 до -80 С, и непосредственно в CD3OD гасили аликвоту. После полного включения дейтерия, подтвержденного LCMS, добавляли THF (18 мл), сразу после чего быстро добавляли борат (36 мл). Смесь нагревали до 15-25 С в течение от 30 мин до 1 ч, затем добавляли 5%-ный водн. NaHCO3 (200 мл) и смесь интенсивно перемешивали в течение приблизительно 15 мин. Полученную суспензию фильтровали и осадок на фильтре промывали по меньшей мере 30 мл ТВМЕ. Фильтрат оставляли разделяться и затем органический слой промывали три или четыре раза водой (100 мл), оставляя последнюю промывку отстаиваться по меньшей мере на 1 ч. Органический слой концентрировали до приблизительно 40 мл.(42,5 мл) и катализатор 5% Pd/C (2 г, 11 мас.%). Полученную смесь обрабатывали газообразным водородом при 100 фунт/кв.дюйм (изб.) (примерно 689,4 кПа (изб. и 50 С. После израсходования моно-Nбензиламинного промежуточного соединения реакционный раствор фильтровали через наполнитель для фильтра-очистителя с последующим 1-мкм фильтрованием. Затем отфильтрованный раствор неочищенного продукта подвергали дистилляции, добавляли 2-пропанол (200 мл), после чего снова дистиллировали до минимального объема, позволяющего осуществлять перемешивание. Этот концентрированный раствор оставляли кристаллизоваться при комнатной температуре, затем фильтровали и промывали 2 пропанолом. 1 Н ЯМР: (d4-метанол, 400,13 МГц) d (млн-1) 7,48 (t, J=7,81 Гц, 1 Н), 7,01 (d, J=7,58 Гц, 1 Н), 6,93 (d,J=8,21 Гц, 1 Н), 5,37 (dd, J=2,76, 8,77 Гц, 1 Н), 4,18 (t, J=6,11 Гц, 2 Н), 3,78 (t, J=5,47 Гц, 2 Н), 3,59 (dd,J=2,87, 13,29 Гц, 1 Н), 2,92 (dd, J=8,86, 13,29 Гц, 1 Н), 2,00 (m, J=6,13 Гц, 2 Н). Точную массу протонированной молекулы [М + Н]+ измеряли при m/z 238,1247, используя ионизацию электрораспылением с регистрацией положительных ионов. Массу этого иона вычисляли при m/z 238,1251. Используя хиральную HPLC, обнаружили, что хиральная чистота составила 99,9%. Пример 3. Альтернативное получение гидрохлорида К раствору 3-гидроксиацетофенона (5,5 г) в диметилформамиде (18 мл) добавляли 3 бромпропилфенилметиловый эфир (9,25 г) при температуре окружающей среды с последующим добавлением карбоната цезия (17 г). Суспензию перемешивали в течение 24 ч и добавляли воду, а затем этилацетат. Органический слой отделяли и водный слой экстрагировали этилацетатом. Органические слои объединяли и промывали два раза 2 н. гидроксидом натрия, четыре раза рассолом и концентрировали в вакууме до масла с получением указанного в заголовке соединения. 3 Б. Получение 2-бром-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанона(50 мл) добавляли метанол (50 мл) и раствор трибромида тетрабутиламмония (16 г) в тетрагидрофуране(50 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 45 мин, после чего добавляли трибромид тетрабутиламмония (0,89 г) с последующим дополнительным добавлением 0,6 г. В реакционную смесь добавляли 10%-ный водный тиосульфат натрия и смесь концентрировали в вакууме до минимального объема. Добавляли этилацетат, полученный органический раствор промывали водным тиосульфатом натрия, насыщенным бикарбонатом натрия и рассолом и концентрировали до масла с получением указанного в заголовке соединения. 3 В. Получение 2-[бис-(фенилметил)амино]-1-[3-(3[(фенилметил)окси]пропилокси)фенил]этанона(6,4 г) и дихлорметана (25 мл) добавляли раствор карбоната натрия (7,6 г) в воде (50 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Органический слой отделяли и концентрировали до минимального объема и добавляли трет-бутилметиловый эфир. Органический слой промывали разбавленной уксусной кислотой (4 раза), 0,1 н. гидроксидом натрия (1 раз) и рассолом(1 раз). Органический раствор концентрировали досуха. Масло промывали метанолом и очищали хроматографией с получением указанного в заголовке соединения. 3 Г. Получение Смесь 2-[бис-(фенилметил)амино]-1-[3-(3[(фенилметил)окси]пропилокси)фенил]этанона, катализатора SK-N003-2z (катализатор Naud, 47 мг) и 1 М гидроксида натрия (2,085 мл) в тетрагидрофуране (10 мл) обрабатывали водородом при 150 фунт/кв.дюйм (примерно 1034,1 кПа) в течение 4 ч. Затем реакционную смесь фильтровали через силикагель. Неочищенный фильтрат очищали хроматографией, элюируя трет-бутилметиловым эфиром-гексаном (0-60%) с получением желаемого продукта в виде желтого масла. 3 Д. Получение (3S)-3-[бис-(фенилметил)амино]метил-7-(3-[(фенилметил)окси]пропилокси)2,1-бензоксаборол-1(3 Н)-ола К раствору (1S)-2-[бис-(фенилметил)амино]-1-[3-(3-[(фенилметил)окси]пропилокси)фенил]этанола (240 мг, 0,50 ммоль) в 5 мл толуола при -20 С добавляли 1,75 ммоль н-BuLi в гексане (2,59 М,0,67 мл) в течение приблизительно 5 мин. Затем смесь перемешивали в течение 2 ч, после чего гасили свежеперегнанным триметилборатом (0,28 мл, 259 мг, 2,5 ммоль). Холодную баню удаляли и смесь нагревали до комнатной температуры. Затем реакционную смесь разбавляли 10 мл ТВМЕ, после чего до- 14021532 бавляли 5 мл насыщенного раствора NaHCO3. После интенсивного перемешивания в течение приблизительно 30 мин органический слой промывали 5 мл 0,1 М NaH2PO4, затем 5 мл насыщенного NaHCO3. Потом органический слой сушили над Na2SO4 и концентрировали. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы А, включающий приведение соединения формулы 6 или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли,где R представляет собой Н или OR1; каждый R1 и каждый R1' независимо представляют собой защитные группы;n равен 0, 1, 2, 3, 4 или 5,где соединение формулы 6 получают приведением соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой: в присутствии алкиллитиевого реагента,где каждый R2 независимо представляет собой С 1-С 6-алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо иR1 представляет собой группы -СН(Ra)фенил-(Rb)х, триалкилсилил, тетрагидропиранил, -СН 2 ОСН 3 или -СН 2 ОСН 2 СН 2 ОСН 3, где Ra представляет собой Н или метил; Rb представляет собой метокси или C1 алкил, С 2-алкил или С 3-алкил и х равен 0, 1 или 2; каждый R1' независимо представляет собой -CH(Rc)фенил-(Rd)y, где Rc представляет собой Н или метил, каждый Rd независимо представляет собой метокси или C1-алкил, С 2-алкил или С 3-алкил; n равенR1 и каждый R1' представляют собой бензильные группы; реагент для снятия защиты представляет собой восстановитель;n равен 1; соединение формулы 6 восстанавливают в присутствии HCl с получением гидрохлоридной соли соединения формулы А. 4. Способ по п.3, где реагент для снятия защиты представляет собой Pd/C или Pt/C в присутствии Н 2 или их смесь, Н 2 над гидроксидом палладия или реагент для гидрогенизации в условиях каталитического переноса. 5. Способ по п.1, где борилирующий реагент представляет собой изопропилпинаколборат или триС 1-борат, три-С 2-борат или три-С 3-борат; n представляет собой число от 0 до 3 и алкиллитиевый реагент представляет собой н-BuLi, н-гексиллитий или втор-BuLi. 6. Способ по п.1 или 5, где борилирующий реагент представляет собой изопропилпинаколборат или триметилборат; n равен 2 и алкиллитиевый реагент представляет собой н-BuLi. 7. Способ по п.1, где соединение формулы 5 или его соль получают либо энантиоселективным восстановлением соединения формулы 10 или его солью,где X представляет собой уходящую группу. 8. Способ по п.7, где соединение формулы 5 или его соль получают с использованием Н 2 и комплекса трифенилфосфина (S)-2-[(SP)-2-(дифенилфосфино)ферроценил]-4-изопропил-2-оксазолина и дихлорида рутения(II) или Н 2 и (R)-BINAP-Ru-(R,R)-(+)-DPEN Cl ([(R)-2,2'-бис-(дифенилфосфино)-1,1'бинафтил]-Ru-(R,R)-(+)-[1,2-дифенилэтилендиамин] Cl); n равен 2. 9. Способ по п.7, где соединение формулы 5 или его соль получают приведением соединения формулы 4 или его соли в контакт с бензилбромидом в присутствии карбоната или гидроксида. 10. Способ по п.9, где соединение формулы 4 или его соль получают приведением соединения формулы 2 в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3 с последующим восстановлением нитрогруппы до аминогруппы. 11. Способ по п.10, где хиральный реагент представляет собой дигидрохлорид 1,7,7-триметил-N(пиридин-2-илметил)бицикло[2.2.1]гептан-2-амина;N1,N2-бис-[(1R,2R,4R)-1,7,7 триметилбицикло[2.2.1]гепт-2-ил]-1,2-этандиамин в присутствии Cu(OAc)2; n равен 2. 12. Способ по п.7, где соединение формулы 10 или его соль получают приведением HN(R1')2 в контакт с основанием и соединением формулы 9 13. Способ по п.12, где соединение формулы 9 получают бромированием соединения формулы 8 14. Способ получения соединения формулы А, включающий стадии: а) приведения соединения формулы 2 в контакт с нитрометаном в присутствии хирального реагента с получением соединения формулы 3 где R представляет собой Н или OR1; R1 представляет собой защитную группу и n равен 0, 1, 2, 3, 4 или 5; б) восстановления соединения формулы 3 с получением соединения формулы 4 или его соли; в) приведения соединения формулы 4 или его соли в контакт с R1'X и основанием с получением соединения формулы 5 или его соли,где R1' представляет собой защитную группу и X представляет собой уходящую группу; г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой: в присутствии н-BuLi с получением соединения формулы 6 или его фармацевтически приемлемой соли,где каждый R2 независимо представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6 алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо;R3 представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6-алкил; и д) приведения соединения формулы 6 или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой солиR1 и каждый R1' представляют собой бензильные группы;n равен 2; хиральный реагент представляет собой дигидрохлоридX представляет собой уходящую группу, выбранную из Br, Cl, I, тозила или трифлила; борилирующий реагент представляет собой изопропилпинаколборат или триметилборат; агент для снятия защиты представляет собой гидрогенизацию в присутствии катализатора Pd/C, катализатора Pt/C или смеси катализаторов Pd/C и Pt/C. 16. Способ получения соединения формулы А, включающий стадии: а) бромирования соединения формулы 8 с получением соединения формулы 9R1 представляет собой защитную группу;n равен 0, 1, 2, 3, 4 или 5; б) приведения соединения формулы 9 в контакт с HN(R1')2 с получением соединения формулы 10 или его соли,где каждый R1' представляет собой защитную группу; в) энантиоселективного восстановления соединения формулы 10 или его соли с получением соединения формулы 5 или его соли; г) приведения соединения формулы 5 или его соли в контакт с борилирующим реагентом, характеризующимся следующей формулой: в присутствии н-BuLi с получением соединения формулы 6 или его фармацевтически приемлемой соли,где каждый R2 независимо представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, С 5-алкил, С 6 алкил или R2 вместе с атомами кислорода, к которым они присоединены, образуют 5- или 6-членное кольцо;R3 представляет собой C1-алкил, С 2-алкил, С 3-алкил, С 4-алкил, C5-алкил, С 6-алкил; и д) приведения соединения формулы 6 или его фармацевтически приемлемой соли в контакт с реагентом для снятия защиты с получением соединения формулы А или его фармацевтически приемлемой соли
МПК / Метки
МПК: A61K 31/69, A01N 55/08
Метки: способ, получения, бензоксаборолов
Код ссылки
<a href="https://eas.patents.su/21-21532-sposob-polucheniya-benzoksaborolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензоксаборолов</a>
Предыдущий патент: Аппликатор бирок для животных
Следующий патент: Ударная дробилка с горизонтальным валом
Случайный патент: Пиридазиноновые соединения и их применение в качестве ингибиторов daao