Способ улучшения выживаемости после размораживания криоконсервированного биологического материала посредством стимуляции гидростатическим сжатием
Формула / Реферат
1. Способ повышения выживаемости после размораживания криоконсервированного жизнеспособного биологического материала, включающий в себя стадии:
(а) приложения гидростатического давления к жизнеспособному биологическому материалу;
(б) выдерживания жизнеспособного биологического материала под гидростатическим давлением;
(в) сброса гидростатического давления;
(г) замораживания жизнеспособного биологического материала.
2. Способ по п.1, отличающийся тем, что гидростатическое давление находится в диапазоне от 1 до 200 МПа, предпочтительно от 10 до 100 МПа, более предпочтительно от 20 до 75 МПа и наиболее предпочтительно от 30 до 60 МПа.
3. Способ по п.1 или 2, отличающийся тем, что гидростатическое давление прикладывают на период времени от 1 с до 300 мин, предпочтительно от 1 с до 150 мин, более предпочтительно от 1 с до 90 мин и наиболее предпочтительно от 1 с до 60 мин.
4. Способ по любому из пп.1-3, отличающийся тем, что давление сбрасывают постепенно в течение периода времени от 1 с до 4 ч или мгновенно.
5. Способ по любому из пп.1-4, отличающийся тем, что жизнеспособный биологический материал выбран из группы, состоящей из ооцитов, сперматозоидов, зигот, морул, бластоцист, стволовых клеток, других клеток или тканей позвоночного животного.
6. Способ по любому из пп.1-5, отличающийся тем, что позвоночное животное является рыбой, птицей или млекопитающим, предпочтительно коровой, лошадью, козой, овцой, свиньей, другим сельскохозяйственным животным, домашним животным, приматом, включая человека.
Текст
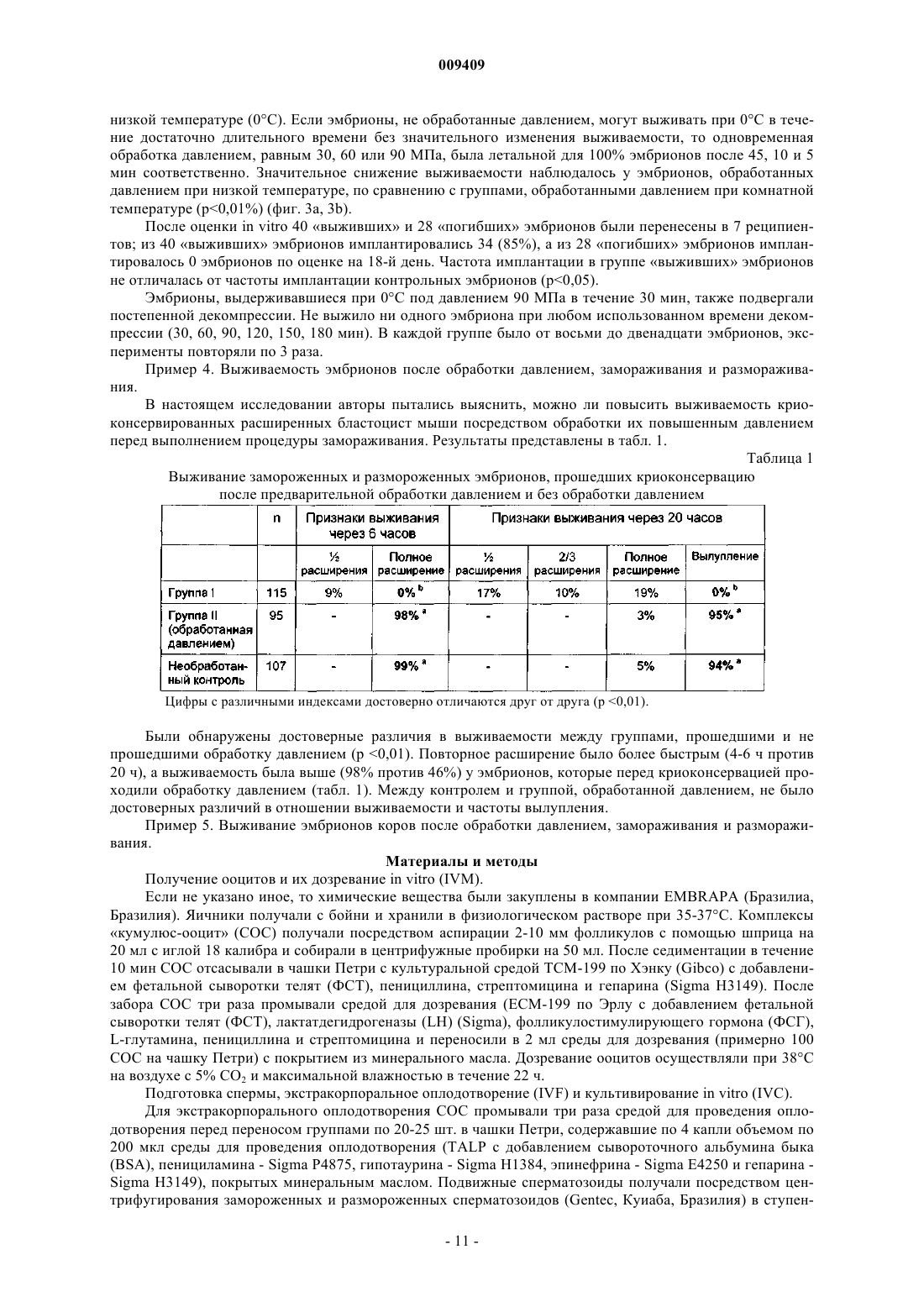
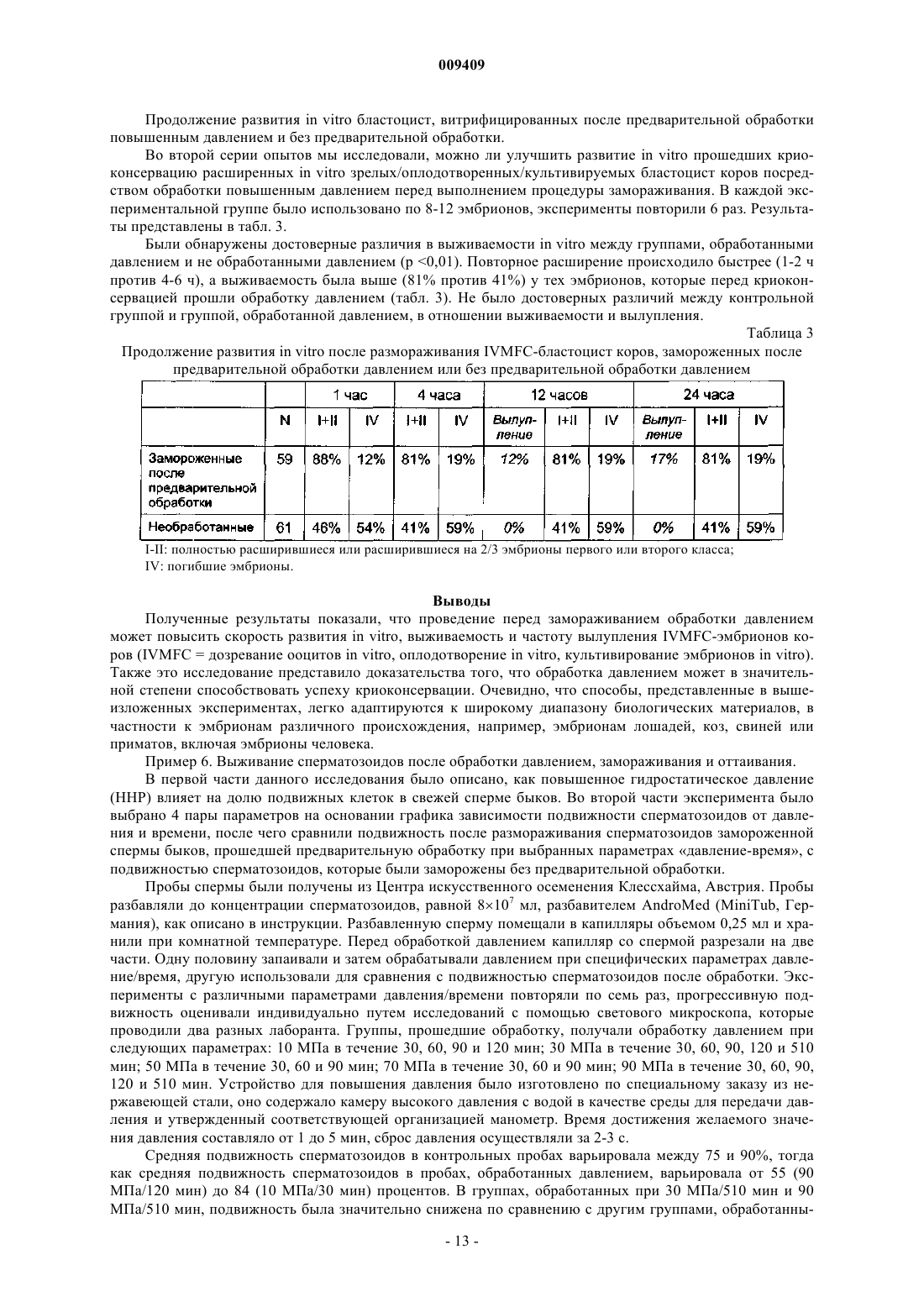
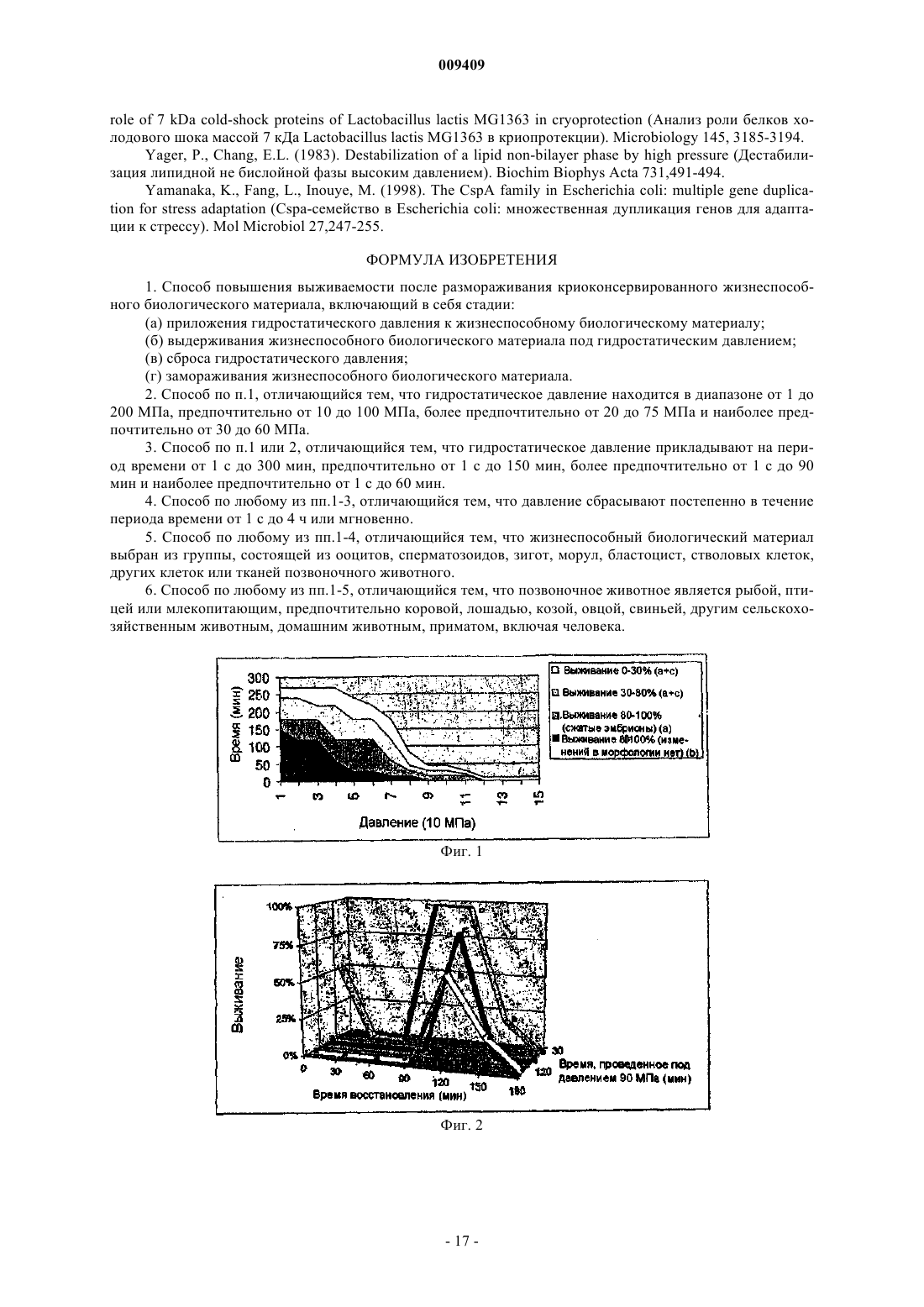
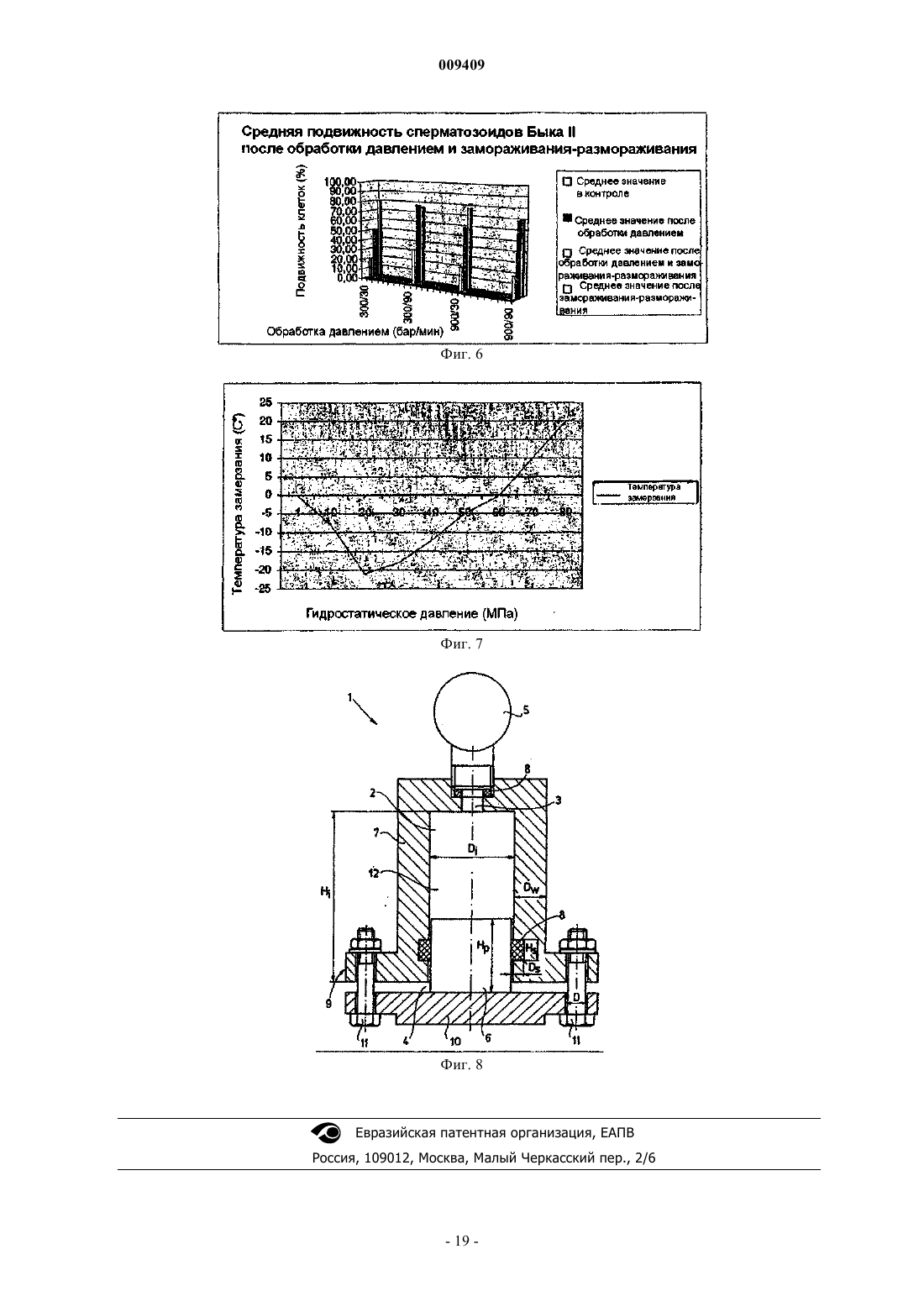
009409 Область техники Настоящее изобретение относится к способу повышения выживаемости после размораживания криоконсервированного биологического материала, который включает в себя приложение гидростатического давления (гидростатического сжатия) к указанному биологическому материалу, выдерживание биологического материала под гидростатическим давлением в течение предварительно определенного периода времени, сброс гидростатического давления и замораживание биологического материала с использованием любого применимого протокола. Изобретение также относится к применению устройства,повышающего давление, для предварительной обработки биологического материала, подлежащего криоконсервации, а также к устройству для повышения давления, предназначенному для предварительной обработки биологического материала, подлежащего криоконсервации, причем указанное устройство содержит камеру высокого давления, в которую помещают биологический материал, средства для создания давления и средства для поддержания давления в камере. Предшествующий уровень техники Способ криоконсервации широко используется в различных областях современной биологии и биотехнологии для хранения биологического материала для разнообразных целей. Эти способы включают в себя очень похожие основные этапы. 1. Биологический материал обрабатывают раствором, содержащим криопротектор(ы). 2. Следующая стадия представляет собой охлаждение (замораживание) биологического материала до температуры ниже нуля. 3. Обработанный таким образом биологический материал хранят, в том числе и в течение очень длительных периодов времени, при низкой температуре, например, в жидком азоте. 4. Перед использованием биологический материал снова подогревают. 5. Удаляют криопротектор(ы) из биологического материала. Кроме того, могут потребоваться дополнительные стадии для восстановления исходной жизнеспособности биологического материала. Было испытано несколько подходов, имевших целью усовершенствование описанного протокола,поскольку процесс криоконсервации повреждает биологический материал. Подходы, направленные на предотвращение образования льда за счет использования очень высоких скоростей охлаждения и нагревания или за счет постепенного снижения равновесной точки замерзания во время охлаждения до -80 С,не дали решения, подходящего для всех областей криобиологии. Предпринимались попытки повысить выживаемость после размораживания за счет витрификации (превращения в стекловидное вещество) высококонцентрированных водных растворов криопротекторов, переохлажденных до очень низких температур, что обеспечивает внутриклеточную витрификацию (Rall and Fahy, 1985). Несмотря на то, чтоFahy et al. (1984) указали на возможность применения весьма значительного гидростатического давления в качестве дополнительного фактора, который может способствовать витрификации, они считали, что это имеет малое практическое значение для репродуктивной биологии. В других исследованиях описано применение белков, предохраняющих от замерзания (AFP), которые неколлигативно снижают температуру замерзания водных растворов, блокируют ионные каналы в мембранах и за счет этого повышают уровень защиты во время охлаждения (Baguisi et al., 1997). В любом из описанных способов не являются пренебрежимо малыми токсические эффекты криопротекторов и вредные последствия изменений осмотического давления. В настоящее время эти процедуры имеют различный уровень эффективности в различных прикладных задачах. Например, в случае консервации эмбрионов эффективность криоконсервации колеблется от 0 до 80% в зависимости от вида, способа замораживания, стадии развития эмбриона (Ischwar, 1996; VanWagtendonk-De Leeuw, 1995, 1997; Medeiro, 2002; Reubinoff, 2001; Hammita, 2003; Archer, 2003; Stachecki,2002; Leibo and Songassen, 2002). Степень успешности криоконсервации яйцеклеток человека, которая в настоящее время является очень популярной проблемой, также далека от удовлетворительной. С 1912 г. известно, что вода проходит различные фазы, если прикладывать к ней гидростатическое давление при разных температурах (Brigman, 1911) (фиг. 7). Если прикладывать к растворам определенные давления, то их можно сохранять в незамороженном состоянии даже при температурах значительно ниже нуля (Bridgeman, 1970). Высокое гидростатическое давление (ГСД) было использовано Takahashi etal. (2000, 2001) для консервирования печени крысы при температурах ниже нуля для последующей трансплантации с целью снижения криоповреждений. В этом подходе ГСД было использовано для значительного снижения температуры замерзания культуральной среды, за счет чего биологический материал сохраняется при температурах ниже нуля без негативного воздействия криоконсервации. Авторами настоящего изобретения этот подход был признан ненадежным при консервации эмбрионов мышей, что показано ниже в примерах 2 и 3. Гидростатическое давление в диапазоне 30-50 МПа обычно ингибирует рост различных организмов: инициация репликации ДНК является одним из наиболее чувствительных к давлению внутриклеточных процессов (Abe et al., 1999). Воздействие давления имеет различную степень выраженности в зависимости от амплитуды и длительности сжатия (Murakami and Zimmerman, 1973). Указывалось, что основным местом возникновения повреждений, вызванных повышенным давлением, является мембрана клетки (Palou et al., 1997). Обработка высоким гидростатическим давлением может нарушить функцио-1 009409 нальные свойства мембраны, такие как активный транспорт и пассивная проницаемость, и за счет этого может нарушить физико-химическое равновесие в клетке (Yager and Chang, 1983; Aldridge and Bruner,1985; Macdonald, 1987; Schuster and Sleytr, 2002). Недавно проведенное исследование Routray et al. (2002) показало, что гидростатическое давление (5 МПа) ускоряло захват ДМСО в эксперименте, проведенном на яйцеклетках и эмбрионах оризии (Oryzias latipes), хотя при этом происходило быстрое снижение жизнеспособности. Физические или биохимические процессы в условиях измененного гидростатического давления подчиняются принципу Ле Шателье: все реакции, которые сопровождаются уменьшением объема, заметно ускоряются (Murakami and Zimmerman, 1973; Welch et al., 1993; Palou et al., 1997). Повышенное давление может привести к изменению конформации белков, включая частично или полностью развернутые конформации. Давление может вызвать денатурацию белков за счет сочетанных эффектов разрыва внутрибелковых взаимодействий и открытия полостей, следствием чего является связывание воды (Schmid et al., 1975; Weber and Drickamer, 1983; Jaenicke, 1991; Gross and Jaenicke, 1994; Silva et al.,2001). В недавно выпущенных статьях указано, что гидростатическое давление повышает продуцирование белков шока (Welch et al., 1993; Wemekamp-Kamphius et al., 2002). Исследования показали, что нестабильность нормального синтеза белков у бактерий, которую вызывает сублетальный холодовой шок,можно преодолеть за счет синтеза так называемых белков холодового шока (CSP - белки холодового шока, HSP - белки теплового шока) (Phadatare et al., 1999). Предполагается, что CSP и HSP имеют много функций, например, являются шаперонами РНК (Graumann and Marahiel, 1999) или активаторами транскрипции (LaTena et al., 1991); допускается также, что они играют роль в защите от замораживания(Wouters et al., 1999). В дополнительных исследованиях было установлено, что продуцирование CSP иHSP индуцируется не только холодовым шоком, но и другими внешними стрессами. Например, у Е. coli определенный тип CSP продуцируется при пищевом стрессе (Yamanaka et al., 1998). В другом исследовании было показано, что воздействие высокого гидростатического давления провоцирует продуцирование некоторых белков, индуцируемых холодом, и белков теплового шока (Welch et al., 1993). В других недавно появившихся статьях указано, что гидростатическое давление повышает продуцирование белков шока (Wemekamp-Kamphius, et al., 2002). Поскольку и холодовой шок, и высокое гидростатическое давление повышают уровни CSP и HSP, были проведены исследования относительно возможности перекрестной защиты. Wemekamp-Kamphius et al. (2002) обнаружили, что после повышения давления уровень выживания Lysteria monocytogenes, подвергнутой холодовому шоку, был в 100 раз выше, чем у клеток,которые росли при 37 С. В то время как микробиологи пищевых продуктов изучают указанные процессы с целью убить вредные микроорганизмы (Butz and Ludwig, 1986; Wemekamp-Kamphius et al., 2002; Spilimbergo et al.,2002), задачей настоящего изобретения является повышение выживаемости криоконсервированного биологического материала. В последние годы большое внимание было уделено изучению роли белков шока в криоконсервации. Huang et al. (1999) опубликовали данные о том, что значительное снижение концентрации одного из белков шока, HSP90, может сопровождаться снижением подвижности сперматозоидов во время охлаждения спермы морских свинок. Wen-Lei et al. (2003) сообщили, что содержание HSP 90 в сперматозоидах человека значительно снижалось после криоконсервации, что может быть результатом деградации белков. Обобщая вышесказанное, можно сказать, что HSP 90, синтез которого индуцируется высоким гидростатическим давлением, является белком цитозоля,молекулярным шапероном, играющим важную роль в устойчивости к стрессам, фолдинге белков,сигнальной трансдукции и т.п. Было показано, что он связан со специфической АТФазой, которая важна для активации аутентичных белков организма in vivo (Pearland Prodromou, 2000). Связан с подвижностью сперматозоидов. Активирует синтетазу окиси азота (NOS) (Garcia-Gardenia et al., 1998). Защищает клетки от активных видов кислорода (ROS) (Fukuda et al., 1996), содержание которых достоверно увеличивается в процессе охлаждения и сильно нарушает подвижность сперматозоидов. Участвует в метаболизме АТФ (Prodromou et al., 1997). Уровень АТФ снижается после холодового шока, и после этого не восстанавливается. После охлаждения спермы свиней содержание HSP 90 значительно снижается, совместно со снижением подвижности сперматозоидов. Был сделан вывод о том, что HSP 90 может играть ключевую роль в регуляции подвижности сперматозоидов свиней (Huang et al., 1999). Гелданамицин, специфический ингибитор HSP 90, достоверно снижает подвижность сперматозоидов свиней, причем эффект зависит от дозы и от времени (Huang et al., 2000). Уровень HSP 90 в сперматозоидах человека значительно снижается после криоконсервации совместно с подвижностью сперматозоидов; снижение не обусловлено утечкой белка, а является результатом его деградации (Wen-Lei CAO et al., 2003).-2 009409 При превышении определенного уровня сумма эффектов давления является летальной: хотя необратимые изменения некоторых биомолекул происходят при более высоких давлениях, большинство бактерий и многоклеточных организмов погибают при 300 МПа. Однако тихоходки, которые в активном состоянии погибают между 100 и 200 МПа, могут выдерживать давление до 600 МПа, если они находятся в дегидратированном измененном состоянии (Seki and Toyoshima, 1998). Авторы настоящего изобретения неожиданно обнаружили, что можно достоверно повысить выживаемость биологического материала посредством приложения к нему повышенного гидростатического давления с последующим выполнением протоколов криоконсервации, соответствующих современному уровню техники. В контексте настоящего изобретения термин выживаемость означает, среди прочего,продолжение развития in vitro и in vivo, более высокую частоту продолжения развития или имплантации и родов (в случае эмбрионов); большую подвижность и/или повышенную способность к оплодотворению после размораживания (в случае сперматозоидов); повышенную способность к оплодотворению, большую частоту развития эмбрионов или их имплантации и большую частоту родов (в случае ооцитов). Следует учесть, что термин выживаемость может охватывать другие разнообразные функциональные характеристики в зависимости от типа обработанного биологического материала. С этой целью была определена переносимость давления некоторыми типами биологических материалов (см. примеры 1, 5 и 6) с последующим исследованием нескольких соответствующих современному уровню техники концепций повышения выживаемости биологического материала, подвергнутого воздействию повышенного давления (см. примеры 2 и 3). Затем авторы настоящего изобретения исследовали эффекты обработки повышенным давлением на различные типы биологических материалов и неожиданно обнаружили являющийся предметом настоящего изобретения способ воздействия повышенным давлением, позволяющий достичь решить задачи настоящего изобретения. В этой связи следует подчеркнуть, что концепция настоящего изобретения одинаково применима ко многим различным протоколам криоконсервации и что выбор протокола не ограничивает настоящее изобретение. Единственной стадией, которую необходимо включить в усовершенствованные протоколы,является стадия воздействия повышенным гидростатическим давлением, параметры которого могут быть легко оптимизированы специалистом в данной области техники, если он будет следовать указаниям,данным в настоящей заявке. Сущность изобретения Настоящее изобретение относится к способу повышения выживаемости после размораживания криоконсервированного биологического материала, включающему в себя:(а) приложение гидростатического давления к биологическому материалу, по выбору, согласно заранее определенному профилю давление-время;(б) выдерживание биологического материала под гидростатическим давлением в течение заранее определенного периода времени;(г) замораживание биологического материала согласно любому применимому протоколу. В одной из форм осуществления изобретения давление, используемое в способе согласно настоящему изобретению, лежит в диапазоне от 1 до 250 МПа. В предпочтительных формах осуществления настоящего изобретения давление предпочтительно лежит в диапазоне от 10 до 100 МПа, более предпочтительно от 20 до 75 МПа и еще более предпочтительно от 30 до 60 МПа. В другой форме осуществления настоящего изобретения гидростатическое давление, используемое в способе согласно настоящему изобретению, прикладывается к объекту в течение периода времени, лежащего в диапазоне от 1 с до 300 мин. В предпочтительных формах осуществления настоящего изобретения давление прикладывается предпочтительно на период времени, лежащий в диапазоне от 1 с до 150 мин, более предпочтительно от 1 с до 90 мин и еще предпочтительнее от 1 с до 60 мин. В других формах осуществления настоящего изобретения способ согласно настоящему изобретению включает в себя постепенное снижение давления в течение периода времени, лежащего в диапазоне от 1 с до 4 ч. В других формах осуществления период времени, в течение которого снижается давление,находится в диапазоне от 10 с до 2 ч, или от 1 мин до 1 ч, или в других случаях от 10 до 30 мин. Снижение давления также может быть мгновенным. В предпочтительной форме осуществления настоящего изобретения способ согласно настоящему изобретению используется для обработки биологического материала, выбранного из группы, состоящей из ооцитов, сперматозоидов, зигот, морул, бластоцист, эмбрионов, стволовых клеток, других клеток или тканей позвоночного животного. Другие предпочтительные формы осуществления настоящего изобретения относятся к способу, в котором указанным позвоночным животным является рыба, птица или млекопитающее, предпочтительно корова, лошадь, коза, овца, свинья, другое сельскохозяйственное животное, домашнее животное, примат,в том числе человек. Настоящее изобретение также относится к устройству для получения повышенного давления для обработки биологического материала давлением, которое включает в себя камеру высокого давления для помещения в нее биологического материала;-3 009409 средства для создания давления в диапазоне от 1 до 250 МПа, предпочтительно от 10 до 100 МПа,более предпочтительно от 20 до 75 МПа и еще предпочтительнее от 30 до 60 МПа и средства для подержания давления в камере в течение периода времени от 1 с до 300 мин, предпочтительно от 1 с до 150 мин, более предпочтительно от 1 с до 90 мин и еще предпочтительнее от 1 с до 60 мин. В предпочтительной форме осуществления настоящее изобретение относится к устройству, в котором средства для создания давления представляют собой поршень, а камера высокого давления является цилиндрической камерой, в которой находится этот поршень; между камерой и поршнем предусмотрены уплотнители, позволяющие развить высокое давление; и для приложения силы к поршню предусмотрены средства, которыми управляют вручную и/или с помощью автоматики. В другой предпочтительной форме осуществления настоящее изобретение относится к устройству,в котором средством для приложения силы к поршню является пластинчатый элемент с поверхностью,упирающейся в поршень, и предусмотрены средства для регулирования положения поршня внутри камеры. В других предпочтительных формах осуществления настоящего изобретения устройство включает в себя систему для регулирования снижения давления в напорной камере в течение периода времени,лежащего в диапазоне от 1 с до 4 ч. В других предпочтительных формах осуществления настоящего изобретения устройство также содержит манометр, который показывает давление в камере. В другой предпочтительной форме осуществления настоящего изобретения напорная камера содержит жидкую среду. В специфических примерах осуществления настоящего изобретения напорная камера имеет стенку толщиной примерно от 10 до 25 мм, предпочтительно толщиной менее 20 мм; камера имеет внутренний диаметр, который предпочтительно меньше 100 мм, более предпочтительно меньше 50 мм, более конкретно примерно равен 20 мм, а высота внутренней полости предпочтительно меньше 250 мм, более предпочтительно меньше 100 мм, в частности примерно равна 200 мм. В другой предпочтительной форме осуществления настоящее изобретение относится к устройству,которое используется для обработки биологического материала, выбранного из группы, состоящей из ооцитов, сперматозоидов, зигот, морул, бластоцист, эмбрионов, стволовых клеток, других клеток или тканей позвоночного животного. Настоящее изобретение также относится к применению устройства высокого давления для компрессии биологического материала. В предпочтительной форме осуществления настоящее изобретение относится к применению устройства высокого давления, в котором повышенное давление используется для предварительной обработки биологического материала перед криоконсервацией. В предпочтительных формах осуществления настоящего изобретения применение устройства высокого давления может включать в себя любую из процедур криоконсервации согласно настоящему изобретению. В предпочтительных формах осуществления настоящего изобретения применение согласно настоящему изобретению предусматривает устройство высокого давления, которое включает в себя камеру высокого давления, подходящую для размещения в ней биологического материала, и средства, обеспечивающие регулируемое давление в диапазоне от 1 до 250 МПа, предпочтительно от 10 до 100 МПа, более предпочтительно от 20 до 75 МПа и еще предпочтительнее от 30 до 60 МПа. В других предпочтительных формах осуществления настоящего изобретения применение согласно настоящему изобретению предусматривает применение устройства высокого давления, которое включает в себя средства для поддержания давления в течение периода времени в диапазоне от 1 с до 300 мин,предпочтительно от 1 с до 150 мин, более предпочтительно от 1 с до 90 мин и еще предпочтительнее от 1 с до 60 мин. В предпочтительной форме осуществления настоящего изобретения применение согласно настоящему изобретению включает в себя использование вместе с устройством высокого давления системы управления, регулирующей снижение давления в камере в течение периода времени от 1 с до 4 ч. В специфических примерах осуществления изобретение также относится к применению устройства высокого давления, при котором в устройстве высокого давления может быть развито высокое гидростатическое давление. В другой предпочтительной форме осуществления настоящее изобретение относится к применению устройства высокого давления для обработки биологического материала, который выбран из группы,состоящей из ооцитов, сперматозоидов, зигот, морул, бластоцист, эмбрионов, стволовых клеток, других клеток или тканей позвоночного животного. Изобретение также относится к применению устройства высокого давления согласно настоящему изобретению для компрессии биологического материала.-4 009409 Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение более подробно описано на примере использования эмбрионов мыши для демонстрации концепции, являющейся предметом изобретения. Тем не менее, очевидно, что описанные процедуры одинаково применимы к любым биологическим материалам, которые обычно криоконсервируют в данной области техники. Эмбрионы мыши были выбраны в качестве объекта детального исследования исключительно по причине легкости их получения и обращения с ними. Кроме того, криоконсервация эмбрионов находится на переднем фронте исследований в области криоконсервации из-за возможности ее применения в промышленности и медицине. Однако в способе согласно настоящему изобретению и, аналогично, в данном описании изобретения термин эмбрион мыши может быть использован взаимозаменяемо с термином биологический материал. В настоящей заявке также представлены экспериментальные данные для IVF-эмбрионов (эмбрионов, полученных путем экстракорпорального оплодотворения) коров и сперматозоидов быков, у которых неожиданно была обнаружена повышенная выживаемость после размораживания. Показательным биологическим материалом могут быть, например,эмбрионы различных видов млекопитающих на пред- и постимплантационных стадиях развития, ооциты, сперматозоиды, стволовые клетки, ткани, органы позвоночных животных и человека, или даже весь организм. Позвоночное животное может принадлежать к любому виду, например, быть рыбой, птицей или млекопитающим, предпочтительно коровой, лошадью, козой, овцой, свиньей, другим сельскохозяйственным животным, мелким домашним животным, приматом, в том числе человеком. Эмбрионы мышей, относящихся к высокоразвитым эукариотическим организмам, более восприимчивы к эффектам гидростатического давления, чем тихоходки и бактерии. Поэтому первая цель состояла в том, чтобы определить основные особенности эмбрионов мыши, обработанных давлением, относящиеся к их морфологии и выживаемости. Для тщательного исследования способа согласно настоящему изобретению было изготовлено устройство-прототип. Для проведения экспериментов, обсуждающихся в примерах, приведенных ниже, было использовано устройство для создания высокого давления 1, изображенное на фиг. 8. Устройство для создания высокого давления 1 содержит цилиндрическую камеру высокого давления 2, имеющую два отверстия 3, 4, одно из которых находится наверху, а второе - в дне камеры, манометр 5, который подсоединен к верхнему отверстию 3, и поршень 6, который вставлен через нижнее отверстие 4. Манометром 5 может быть любой подходящий манометр, при условии, что он может измерять давление в диапазоне, представляющем интерес, а именно в диапазоне от 1 до 250 МПа, предпочтительно от 10 до 100 МПа, более предпочтительно от 20 до 75 МПа и еще предпочтительнее от 30 до 60 МПа. Камера высокого давления 2 имеет внутреннюю высоту, примерно равную 60 мм, и ширину, примерно равную 20 мм. Стенка 7 камеры 2 адаптирована к тому, чтобы выдерживать давления до 250 МПа, предпочтительно не мене 75 МПа и еще предпочтительнее до 60 МПа. Стенка 7 камеры 2 предпочтительно изготовлена из материала, устойчивого к коррозии, которым предпочтительно является пластмасса или нержавеющая сталь. Чтобы увеличить плотность соединения между внутренней стороной стенки 7 у нижнего отверстия 4 и поршнем 6, последний снабжен круговым герметичным уплотнителем 8, например, кольцевым уплотнителем из тефлона. Такой же или иного рода герметизирующий уплотнитель предпочтительно используется также у верхнего отверстия 3, где установлен манометр 5. Часть стенки 7, окружающей нижнее отверстие, имеет периферический выступ, образующий фланец 9. Камера высокого давления 2 дополнительно оборудована толстой крышкой 10 для удержания и перемещения поршня 6 в камере 2. Крышку 10 можно прикрепить к фланцу 9 с помощью фиксирующих средств, таких как винты 11. Предел прочности на растяжение каждого винта должен иметь достаточно высокое значение, чтобы выдерживать растягивающие силы, обусловленные высоким давлением в камере 2. Камера высокого давления 2 заполнена средой 12, подходящей для создания высокого давления при относительно небольшом сжатии, которое происходит при продвижении поршня внутрь камеры высокого давления 2. Такой средой может быть любой известный тип нетвердой среды 12 (предпочтительно жидкая или гелеобразная среда 12), используемой в области технологии высоких давлений, однако, в контексте настоящего изобретения была использована обычная вода. Чтобы предотвратить нагревание среды 12 при сжатии, стенку 7 камеры высокого давления 2 предпочтительно изготавливают из теплопроводящего материала. Следует учесть, что описанное устройство для создания высокого давления 1 может быть изготовлено с такими диаметрами, чтобы оно представляло собой портативное устройство для использования усовершенствованного способа криоконсервации согласно настоящему изобретению. Указанные ниже размеры приведены только в качестве примера, и очевидно, что специалист в данной области техники,может легко представить себе примеры осуществления с большими или меньшими размерами. В данном примере камера высокого давления 2 имеет внутреннюю высоту Hi, равную 60 мм, и внутренний диаметрDi, равный 20 мм, который также соответствует диаметру поршня 6. Высоту Нр поршня 6 можно выбрать пропорционально Hi, например, в коротком испытательном устройстве она была равна 20 мм. Стенка 7 камеры 2 имеет толщину Dw, примерно равную 10 мм. Герметичный уплотнитель 8 вокруг поршня 6 имеет высоту Hs, равную 5 мм, и толщину Ds, равную 2 мм. Винты 11, использованные для крепления крышки 10 к фланцу 9, могут иметь диаметр D, равный 8 мм. Коммерчески доступные винты 11 такого-5 009409 размера могут иметь предел прочности на растяжение, равный 800 МПа, который является достаточным для того, чтобы выдержать давление до 200 МПа. Фактический размер устройства можно выбрать в зависимости от биологического материала, подлежащего обработке, и доступных средств, используемых для помещения биологического материала в устройство. Во время предварительной обработки эмбрионов мыши перед криоконсервацией эти эмбрионы(помещенные в пластмассовый капилляр с соответствующим раствором для хранения эмбрионов) размещали внутри камеры высокого давления 2 в жидкой среде 12 (последней была обычная вода); поршень 6 вставляли в нижнее отверстие 4, не прикладывая к нему чрезмерных усилий, и прикрепляли крышку 10 к фланцу 9 камеры 2 при помощи винтов 11 так, чтобы она примыкала к поршню 6, который, при несжатом состоянии среды 12, частично выступал из камеры 2. После этого крышку перемещали ближе к нижнему отверстию 4, чтобы сдвинуть поршень 6 внутрь камеры высокого давления 2, закручивая винты(либо вручную, либо с помощью завинчивающего автоматического устройства) с такой скоростью и настолько, чтобы получить необходимые для конкретного проводимого эксперимента параметры давления. Результирующее давление внутри камеры 2 контролировали с помощью манометра 5. По истечении желаемого периода времени производили сброс давления в камере, либо посредством постепенного отвинчивания винтов 11, либо посредством удаления манометра 5 из верхнего отверстия, обеспечивая тем самым квазимгновенное расширение жидкой среды 12. Средства для помещения эмбрионов в камеру не ограничиваются пластмассовыми капиллярами. В зависимости от конкретной прикладной задачи и биологического материала пробу, подлежащую обработке, можно поместить в различные опорные структуры. Например, эмбрионы или клетки можно поместить на криостатические петли или сетки для электронной микроскопии. В другой форме осуществления изобретения каплю раствора для хранения, в которой находится биологический материал, можно просто покрыть минеральным маслом, выполняющим роль жидкой среды 12. В этом случае можно миниатюризировать все устройство для создания высокого давления, что даст возможность закрепить его под стереомикроскопом для обеспечения легкого выделения биологического материала. В случае макроскопического биологического материала нет необходимости в специальных средствах для размещения,образец можно поместить в камеру, а жидкой средой 12 может быть раствор для хранения. Любые средства для размещения и/или удержания биологического материала в камере, которые обеспечивают воздействие высокого гидростатического давления на биологический материал, входят в объем изобретения. Устройство для создания высокого давления 1 может быть полностью автоматизировано посредством использования программируемой системы управления. Такая система управления может регулировать следующие входные параметры: скорость увеличения давления, желаемое время пребывания биологического материала под максимальным давлением и скорость сброса давления. Также могут быть использованы средства для регулирования температуры, хотя использования материала с высокой теплопроводностью для изготовления стенки 7 камеры высокого давления 2 может быть достаточно для предотвращения вредных колебаний температуры. Средства для регулирования температуры могут представлять собой единое устройство для повышения давления-замораживания, обеспечивающее одностадийное решение для процесса криоконсервации. В этом случае оба компонента - устройство для создания высокого давления и устройство для замораживания - могут быть автоматизированы и оборудованы средствами для программирования обработки высоким давлением и замораживания согласно требованиям различных биологических материалов. Также может быть предусмотрено портативное устройство, которое может быть очень сходным с описанной испытательной установкой и которое может обеспечить легкий и простой способ обработки биологического материала; после этой стадии можно использовать легкодоступные технологии консервации биологического материала. Такой подход может помочь практикам в удаленных местах, или его можно использовать в различных проектах, например, для консервации в полевых условиях. Были проведены тщательно спланированные эксперименты по исследованию переносимости высокого давления различными биологическими материалами. Использованные давления и периоды времени были выбраны так, чтобы перекрыть самый широкий диапазон, который может в дальнейшем быть использован в практических применениях. Например, как показано на фиг. 7, температура фазового перехода воды при повышении давления снижается от 0 С при 0,1 МПа до -21 С при 210 МПа, а при превышении этого уровня давления наблюдается противоположный эффект. Поэтому для использования в способе согласно настоящему изобретению было выбрано давление в диапазоне от 1 до 250 МПа или даже до уровня, при котором среда замерзает при рабочей температуре устройства. Более конкретно,гидростатическое давление, которое может быть приложено к эмбрионам на стадии бластоцисты, равно 1, 5, 10, 15, 20 25, 30, 40, 50, 60, 70, 80, 90, 100, 110 120, 130, 140, 150, 200 или 250 МПа или любому значению между этими промежуточными диапазонами. Гидростатическое давление может быть приложено к биологическому материалу согласно предварительно заданному профилю давление-время. Этот профиль может быть определен специалистом в данной области техники в зависимости от материала, подлежащего обработке, при этом давление, прикладываемое к материалу, может постепенно возрастать с течением времени. Профиль, подходящий для данного биологического материала, можно определить эмпирически, и он может быть линейным, сту-6 009409 пенчатым или другим стандартным временным профилем. Сходным образом, для биологических материалов можно выбрать очень разнообразные периоды времени, в течение которых они будут находиться под высоким гидростатическим давлением. Более конкретно, эмбрионы мышей выдерживают под выбранным давлением в течение периода времени в диапазоне от 1 с до 6 ч, более конкретно в течение 1, 5, 10, 20, 30, 40, 50 с, 1, 2, 3, 4, 5, 6, 8, 10, 15, 20, 30, 40,50, 60, 70, 70, 80, 90, 120, 150, 180, 210, 240, 300 или 360 мин. Время, в течение которого эмбрионы могут выжить под давлением, укорачивается при повышении давления. Специалисту в данной области техники должно быть понятно, что время между окончанием предварительной обработки повышенным давлением и началом криоконсервации в специфических формах осуществления изобретения может быть весьма различным. В зависимости от выбранного протокола,состояние биологического материала в этот промежуток времени может изменяться. Этот период может обеспечить физическое восстановление клеток, если он достаточно продолжителен, или, напротив, в клетках могут начаться новые процессы, например, могут происходить синтез и накопление белков шока. В различных условиях эти эффекты могут быть полезными или вредными, поэтому может потребоваться оптимизация протокола посредством проведения дополнительных экспериментов. Фиг. 1 демонстрирует, что эмбрионы могут переносить значительное давление без видимых изменений морфологии (например, 90 МПа в течение 1 с или 30 МПа в течение 2 ч). Происходило сжатие(уплотнение) эмбрионов в зависимости от величины и длительности приложенного давления. Не ограничивая объем изобретения теорией, авторы изобретения считают, что давление не может быть прямой причиной выдавливания воды из бластоцист. Судя по процитированным источникам, уменьшение размеров эмбрионов было следствием индуцированного давлением синтеза различных белков (белков холодового шока, CSP), обратимых нарушений структуры белков и метаболических процессов. Сжатые (уплотненные) эмбрионы могут восстановить свою нормальную морфологию через 4-5 ч их культивирования in vitro и продолжить развитие аналогично контрольным эмбрионам (например, эмбрионы, на которых действовало давление, равное 90 МПа, в течение 30 мин или давление, равное 30 МПа, в течение 3 ч). Не ограничивая объем изобретения теорией, на основании исследований, проведенных на IVFэмбрионах коров, можно постулировать, что сжатие (уплотнение) не является критерием оптимальной предварительной обработки повышенным давлением. Сжатие (уплотнение) может быть результатом нарушения проницаемости мембран при повышенном давлении, нарушения диффузии и активного транспорта через клеточные мембраны. Это обратимое изменение морфологии можно считать морфологическим признаком, который указывает на то, что эмбрионы были обработаны сублетальным давлением. Согласно литературе, сублетальный шок является воздействием, которое стимулирует продуцирование так называемых белков шока, которые, предположительно, играют роль в повышении успешности криоконсервации. Однако в некоторых прикладных задачах для криоконсервации предпочтительно могут быть выбраны сжатые эмбрионы. После повышения давления расширенные бластоцисты сжимаются и остаются в таком виде в течение 3-4 ч, после чего снова расширяются. На основании этого феномена перед процедурой замораживания можно отобрать эмбрионы, обработанные повышенным давлением. Так как морфологические изменения эмбрионов и положительные эффекты предварительной обработки повышенным давлением могут быть результатом нарушения структуры белков, и/или их характеристик, и/или стимуляции продуцирования различных индуцированных давлением белков, обнаружение этих белков может быть признаком того, что к биологическому материалу перед процессом криоконсервации было приложено высокое гидростатическое давление. Предварительная обработка давлением также в некоторой степени коррелирует с тем временем, в течение которого эмбрионы возвращаются к нормальному развитию после криоконсервации. Наблюдение за этим процессом может выявить природу предварительной обработки, так как приложение высокого гидростатического давления может значительно сократить время, необходимое для регенерации. Чем больше величина давления, тем меньше время выживания эмбрионов. Воздействие давления,превышающего определенную величину и длительность, вызывает необратимые изменения: эмбрионы распадаются через 2 ч культивирования in vitro или оказываются уже разрушенными после декомпрессии(например, эмбрионы, обработанные давлением, равным 90 МПа, в течение 2 ч или давлением, равным 30 МПа, в течение 5 ч). Специалист в данной области техники должен уметь определять эти предельные значения давления или предельные длительности воздействия для конкретного используемого биологического материала посредством обычного экспериментирования. Предполагается, что время выживания эмбрионов, обработанных давлением, можно увеличить путем постепенного снижения давления. Исследования показали, что коэффициент выживаемости эмбрионов, обработанных давлением, резко возрастает, если возвращать их в исходное состояние постепенно. Хотя пребывание в течение 60 мин под давлением, равным 90 МПа, было летальным для всех эмбрионов,80% эмбрионов выживали при использовании постепенной декомпрессии в течение 120 мин. Время декомпрессии также является признаком настоящего изобретения, и специалист в данной области техники должен определить его для конкретного применения. Более конкретно, декомпрессию эмбрионов мыши,выдержанных под повышенным давлением, производили в течение периода времени в диапазоне от 1 с-7 009409 до 4 ч, более конкретно в течение 1, 5, 10, 20, 30, 40, 50 с, 1, 2, 3, 4, 5, 6, 8, 10, 15, 20, 30, 40, 50, 60, 70, 80,90, 120, 150, 180, 210 или 240 мин. Аналогично повышению давления, декомпрессию также можно выполнить согласно заранее определенному профилю давление-время. Опять-таки не ограничиваясь теорией, можно отметить, что возможным объяснением этой особенности может быть то, что под давлением генерируется значительное количество СО 2 (Abe and Horikoshi,1995). Гидратация и ионизация СО 2 (образование НСО 3- и Н+) ускоряются при повышении давления, поскольку реакция сопровождается уменьшением объема (0,26 мл/моль), которое зависит от величины приложенного давления (Palou et al., 1997; Welch et al., 1993). Образующийся внутри клеток диоксид углерода мгновенно растворяется, а затем диссоциирует с образованием НСО 3- и Н+, за счет чего также снижается внутриклеточный рН (Abe and Horikoshi, 1995, 1997, 1998, Abe et al., 1999). Можно предположить, что равновесие, устанавливающееся при повышенном давлении, является летальным для эмбрионов при атмосферном давлении. Можно также выдвинуть гипотезу о том, что мгновенное снижение давления приводит к повышению выделения СО 2 в цитоплазме из его гидратированной и ионизированной формы, что приводит к мгновенной гибели эмбрионов. Если декомпрессия происходит в течение определенного времени, то белки плазматической мембраны (Н+-АТФаза) (Schmid et al., 1975; Pequeux andGilles, 1978), обратимо инактивированные повышенным гидростатическим давлением, снова начинают функционировать и (совместно с пассивной диффузией) постепенно сдвигают равновесие к физиологическому состоянию. Высокое гидростатическое давление (ВГД) ранее было использовано для снижения криоповреждений Nakahashi et al. (2000, 2001) при консервации печени крысы при температурах ниже нуля с целью последующей трансплантации. В этом подходе ВГД было использовано для значительного снижения температуры замерзания культуральной среды, за счет чего биологический материал консервировался при температурах ниже нуля без негативных эффектов криоконсервации. Чтобы исследовать этот способ криоконсервации на эмбрионах мышей, были проведены опыты с повышением давления на эмбрионы при 0 С. Выживаемость эмбрионов достоверно снижалась. Если при комнатной температуре (КТ) у эмбрионов, подвергнутых действию давления, равного 30 МПа в течение 45 мин, средняя выживаемость составила 90%, то при 0 С ни один из эмбрионов не выдержал такого воздействия. После 10 или 5 мин пребывания под давлением 60 МПа и 90 МПа соответственно, при 0 С выжило 0% эмбрионов. В противоположность этому, при комнатной температуре выживаемость в обоих случаях была равна примерно 90%. Также на эмбрионы воздействовали повышенным давлением при 0 С, после чего производили постепенную декомпрессию. Применение постепенной декомпрессии при низкой температуре не оказало положительного эффекта на выживаемость эмбрионов. На основании полученных результатов можно сделать вывод, что этот феномен нельзя использовать, поскольку доказано, что совместное действие давления и низкой температуры является летальным для эмбрионов. Настоящее изобретение относится к повышению выживаемости после размораживания криоконсервированных бластоцист мыши посредством приложения повышенного гидростатического давления. Выживаемость можно оценить по результатам переноса обработанных давлением эмбрионов после их обработки по любому протоколу криоконсервации и размораживания в культуральную среду и/или их подсадки псевдобеременным реципиентам. Развитие эмбрионов in vitro, их имплантация, дальнейшее развитие в матке и рождение здоровых детенышей являются явными доказательствами их биологического и генетического потенциала. Как подробно описано выше, выживаемость криоконсервированных расширенных бластоцист мыши можно повысить посредством обработки их определенным давлением перед процедурой замораживания. К бластоцистам прикладывали давление, равное 60 МПа, на 30 мин, при этом примерно 80-90% эмбрионов оказывались сжатыми, а их выживание не отличалось от выживания необработанных контрольных эмбрионов. Согласно результатам оценки in vitro, обработка посредством приложения давления резко улучшает развитие эмбрионов in vitro после замораживания. Исследования in vitro показали,что воздействие повышенным гидростатическим давлением не только повышает выживаемость обработанных бластоцист, но и сокращает время восстановления, необходимое для возвращения эмбрионов в нативное состояние. В наших иллюстративных исследованиях через 6 ч 98% бластоцист, обработанных давлением, были морфологически (диаметр, структурная целостность и общая морфология) абсолютно идентичными контрольным эмбрионам, и 95% бластоцист продолжали свое развитие через 20 ч, так же,как и в контроле. Эмбрионы, замороженные без обработки давлением, расширялись до первоначальных размеров лишь через 20 ч после размораживания. Доля бластоцист, расширившихся до исходного размера, была значительно меньше по сравнению с бластоцистами, прошедшими обработку давлением (46% против 98%). Кроме того, в этой группе эмбрионы не продолжили свое развитие. Поэтому очевидно, что способ согласно настоящему изобретению пригоден для получения высоко жизнеспособных эмбрионов мыши. Краткое описание графических материалов На фиг. 1 показана выживаемость эмбрионов при различных давлениях в диапазоне от 10 до 150 МПа (и при 10 МПа) в течение различного времени (1 с, 5, 15 и 30 мин и далее до 300 мин с 30 минутными интервалами) при комнатной температуре. В каждой группе было использовано 14-16 эм-8 009409 брионов; каждый эксперимент повторили 3 раза. Выживаемость эмбрионов в полях, обозначенных буквами "а" и "b", не отличается от необработанных контрольных эмбрионов (р 0,05). На фиг. 2 показана выживаемость эмбрионов, которые находились под давлением 90 МПа в течение 30, 60, 120 мин с последующей декомпрессией в течение 30-180 мин. (При мгновенной декомпрессии выживаемость через 30, 60 и 120 мин составляла 50%, 0%, 0% соответственно). Значения выживаемости,отмеченные на чертеже различными надстрочными индексами, достоверно отличаются друг от друга(р 0,05). На фиг. 3 а показана выживаемость эмбрионов, находившихся под давлением, равным 30, 60 или 90 МПа, в течение периода от 1 с до 45 мин при комнатной температуре. На фиг. 3b показана выживаемость эмбрионов, находившихся под давлением, равным 30, 60 или 90 МПа, в течение периода от 1 с до 45 мин при 0 С. В каждой группе было использовано 12-15 эмбрионов; каждый эксперимент повторили 3 раза. Были обнаружены достоверные различия между группами, обработанными давлением при комнатной температуре и при 0 С (р 0,01). На фиг. 4 показаны средние значения подвижности сперматозоидов (обработанных давлением и контрольных). На фиг. 5 показана средняя подвижность сперматозоидов быка I после обработки давлением и замораживания-размораживания. На фиг. 6 показана средняя подвижность сперматозоидов быка II после обработки давлением и замораживания-размораживания. На фиг. 7 показана температура замерзания воды при различных давлениях. Фиг. 8 представляет собой схему поперечного сечения возможного устройства для обработки повышенным давлением согласно настоящему изобретению. Описание примеров осуществления изобретения Материалы и методы для примеров 1-4 Экспериментальные животные и получение эмбрионов. Мышей CB6F1 (Charles River, Германия) содержали в стандартных условиях (222 С; 12 ч темноты/12 ч света; вода и корм по потребности). У самок вызывали суперовуляцию посредством внутрибрюшинной инъекции 10 ME сывороточного гонадотропина (PMSG) (Sigma, США) с последующей инъекцией 10 ME хорионического гонадотропина человека (hCG) (Sigma, США) через 46 ч. Через 6 ч после введения hCG самок спаривали с фертильными самцами с образованием моногамных пар. Эмбрионы на стадии одной-двух клеток (день 0 и день 1) получали посредством промывания фаллопиевых труб промывочной средой FertiCult (FertiPro N.V., Бельгия). Эмбрионы культивировали при 37 С в термостате с 5% СО 2 при максимальной влажности воздуха. В период между стадиями одной клетки и компактной морулы эмбрионы культивировали в среде G 1.2(Vitrilife, Швеция) под минеральным маслом Ovoil (Vitrolife, Швеция). Затем эмбрионы переносили и культивировали в среде G 1.2 (Vitrilife, Швеция) под минеральным маслом Ovoil до стадии расширенной бластоцисты. Обработка повышенным давлением. Бластоцисты помещали в пластиковые капилляры со средой М 2 (Sigma, США) так, чтобы капилляры не содержали пузырьков воздуха (7-9 эмбрионов/капилляр), после чего капилляры запаивали. Капилляры помещали в камеру высокого давления, заполненную водой в качестве среды, передающей давление. Изготовленное по специальному заказу устройство для создания высокого давления, способное обеспечивать точно регулируемое давление в диапазоне от 1 до 150 МПа, было изготовлено из нержавеющей стали с внутренним диаметром, равным 2 см, и соединено с манометром. Гидростатическое давление создавали посредством продвижения поршня в камеру высокого давления при завинчивании винтов вручную. Желаемое давление достигалось за время от 20 с до 5 мин (от 10 МПа до 150 МПа соответственно); длительность сброса давления была равна 3 секундам. В тех экспериментах, где исследовались эффекты постепенной декомпрессии, время снижения давления лежало в интервале от 30 до 210 мин. Эксперименты проводили при 0 С, камеру высокого давления погружали в холодильную ванну, заполненную средой Biocool (FTS-Sysems, Нью-Йорк, США). Криоконсервация после предварительной обработки повышенным давлением. Эмбрионы случайным образом делили на три группы. Бластоцисты группы I криоконсервировали так, как описано ниже, в растворе для витрификации, содержавшем 7 М этиленгликоля (ЭГ), по Nowshariand Brem (1998). Эмбрионы группы II обрабатывали давлением, равным 60 МПа, в течение 30 мин, затем замораживали таким же способом. Эмбрионы группы III служили необработанным контролем. После размораживания эмбрионы культивировали in vitro в течение 24 ч. Криоконсервация. Эмбрионы в течение 5 мин уравновешивали в растворе, содержавшем 1,5 М этиленгликоля (ЭГ)(ФСТ) (Sigma, США), затем переносили в раствор для витрификации (7 М ЭГ, 0,5 М сахарозы в М 2 с 10% ПСТ), предварительно помещенный в пластиковые капилляры объемом 0,25 мл (7-9 эмбрионов/капилляр). Затем капилляры запаивали. После воздействия раствора для витрификации в течение 1-9 009409 мин капилляр медленно погружали в жидкий азот. Капилляры оттаивали посредством погружения в воду при температуре 30 С на 30 с, после чего эмбрионы извлекали и помещали в регидратирующую среду(0,5 М сахарозы в М 2 с добавкой 10% ФСТ) на 5 мин. Затем эмбрионы культивировали в среде G 2.2, как описано выше (Nowshari and Brem, 1998). Перенос эмбрионов. Эмбрионы культивировали в среде G 2.2 в течение 2 ч, как описано выше. Затем их в каждой экспериментальной группе разделяли на погибших и выживших и по отдельности переносили (по 7-12 эмбрионов на животное) в псевдобеременных реципиентов в день 3. В качестве контроля переносили необработанные бластоцисты. Оценка и статистический анализ. Качество эмбрионов оценивали сразу же после сброса давления или после оттаивания, а также через 2, 3, 4, 6, 12, 20 и 24 ч. Выживание эмбрионов оценивали по морфологическим признакам: интактность бластомеров, повторное расширение бластоцеля и вылупление из прозрачной зоны были признаками выживания. В качестве контроля были использованы необработанные бластоцисты. Для оценки in vivo обработанные давлением эмбрионы культивировали в G 2.2 в течение 2 ч, как описано выше. Затем по 7-12 эмбрионов на животное переносили в псевдобеременных реципиентов в день 3. В качестве контролей переносили необработанные бластоцисты. Рождение здоровых детенышей было признаком выживания эмбрионов in vivo. Выживаемость сравнивали с выживаемостью необработанных контролей с использованием критерия хи-квадрат. Пример 1. Выживаемость эмбрионов мыши при различных давлениях при комнатной температуре. В этих экспериментах эмбрионы подвергали воздействию различных гидростатических давлений в диапазоне от 10 до 150 МПа (с шагом по 10 МПа) в течение различных периодов времени в диапазоне от 1 с до 300 мин при комнатной температуре. При превышении определенных значений давления и времени (фиг. 1) обработка вызывала обратимые морфологические изменения. Расширенные бластоцисты сжимались внутри прозрачной зоны: бластоцель исчезал, размеры бластомеров уменьшались, но их нарушений структурной целостности не обнаруживалось. Через 4-5 ч культивирования in vitro эти бластоцисты снова расширялись, и в течение 24 ч они вылуплялись из прозрачной зоны (а). Эмбрионы, получившие меньшее воздействие, не обнаруживали морфологических изменений и вылуплялись через 24 ч культивирования in vitro (b), тогда как эмбрионы, получившие большую нагрузку, не расширялись из сжатого состояния и разрушались в пределах 2 ч, или уже были разрушенными после декомпрессии (с) (фиг. 1). Для оценки in vivo обработанные эмбрионы оценивались как выжившие (а и b) и погибшие (с) через 2 ч культивирования in vitro после декомпрессии, и их раздельно переносили в реципиентов. После переноса 170 эмбрионов а и b родилось 145 здоровых детенышей (85%), тогда как после переноса 49 эмбрионов с не было получено ни одного детеныша (0%). Не было достоверных различий между частотой вылупления (in vitro) и рождаемостью (in vivo) в случае контролей, не проходивших обработки давлением, и сжатых и не сжатых эмбрионов а и b,обработанных давлением (р 0,05). Эти результаты показывают, что эмбрионы могут выдерживать значительное давление без изменения выживаемости, хотя чем выше амплитуда давления, тем меньше время выживания эмбрионов (фиг. 1). Эмбрионы, которые не разрушались в течение 2 ч культивирования in vitro, имели такие же значения выживаемости in vitro и in vivo, что и необработанные контроли. Пример 2. Выживаемость эмбрионов мыши при использовании различных профилей декомпрессии. В этом эксперименте исследовали, можно ли повысить выживаемость эмбрионов, обработанных давлением, посредством постепенной декомпрессии. Расширенные бластоцисты выдерживали под давлением 90 МПа в течение 30, 60 и 120 мин (при этом выживаемость при комнатной температуре после мгновенной декомпрессии была равна 50, 0 и 0%),после чего давление постепенно снижали (9 ступеней) в течение 30, 60, 90, 120 и 150 мин. Результаты показывают, что можно значительно повысить выживаемость при проведении постепенной декомпрессии, которая имеет оптимальные параметры, зависящие от времени, в течение которого эмбрионы находились под давлением. С увеличением времени, в течение которого эмбрионы находятся под давлением,оптимальное время декомпрессии увеличивается. Максимальная выживаемость, которую можно получить с помощью декомпрессии, снижается с увеличением времени пребывания под давлением (фиг. 2). После оценки in vitro 54 выживших и 35 погибших эмбрионов были перенесены в 9 реципиентов. Из 54 выживших эмбрионов 47 имплантировались (87%), а из 35 погибших эмбрионов имплантировалось 0 эмбрионов по оценке на 18-й день. Частота имплантации в группе выживших эмбрионов не отличалась от частоты имплантации контрольных эмбрионов (р 0,05). Пример 3. Выживаемостьэмбрионов мыши при различных давлениях при низкой температуре. В этом эксперименте было исследовано влияние температуры на выживаемость эмбрионов, обработанных давлением. Давление, равное 30, 60 или 90 МПа, прикладывали к эмбрионам на 1 с, 5, 10, 15, 30 и 60 мин при- 10009409 низкой температуре (0 С). Если эмбрионы, не обработанные давлением, могут выживать при 0 С в течение достаточно длительного времени без значительного изменения выживаемости, то одновременная обработка давлением, равным 30, 60 или 90 МПа, была летальной для 100% эмбрионов после 45, 10 и 5 мин соответственно. Значительное снижение выживаемости наблюдалось у эмбрионов, обработанных давлением при низкой температуре, по сравнению с группами, обработанными давлением при комнатной температуре (p0,01%) (фиг. 3a, 3b). После оценки in vitro 40 выживших и 28 погибших эмбрионов были перенесены в 7 реципиентов; из 40 выживших эмбрионов имплантировались 34 (85%), а из 28 погибших эмбрионов имплантировалось 0 эмбрионов по оценке на 18-й день. Частота имплантации в группе выживших эмбрионов не отличалась от частоты имплантации контрольных эмбрионов (р 0,05). Эмбрионы, выдерживавшиеся при 0 С под давлением 90 МПа в течение 30 мин, также подвергали постепенной декомпрессии. Не выжило ни одного эмбриона при любом использованном времени декомпрессии (30, 60, 90, 120, 150, 180 мин). В каждой группе было от восьми до двенадцати эмбрионов, эксперименты повторяли по 3 раза. Пример 4. Выживаемость эмбрионов после обработки давлением, замораживания и размораживания. В настоящем исследовании авторы пытались выяснить, можно ли повысить выживаемость криоконсервированных расширенных бластоцист мыши посредством обработки их повышенным давлением перед выполнением процедуры замораживания. Результаты представлены в табл. 1. Таблица 1 Выживание замороженных и размороженных эмбрионов, прошедших криоконсервацию после предварительной обработки давлением и без обработки давлением Цифры с различными индексами достоверно отличаются друг от друга (р 0,01). Были обнаружены достоверные различия в выживаемости между группами, прошедшими и не прошедшими обработку давлением (р 0,01). Повторное расширение было более быстрым (4-6 ч против 20 ч), а выживаемость была выше (98% против 46%) у эмбрионов, которые перед криоконсервацией проходили обработку давлением (табл. 1). Между контролем и группой, обработанной давлением, не было достоверных различий в отношении выживаемости и частоты вылупления. Пример 5. Выживание эмбрионов коров после обработки давлением, замораживания и размораживания. Материалы и методы Получение ооцитов и их дозревание in vitro (IVM). Если не указано иное, то химические вещества были закуплены в компании EMBRAPA (Бразилиа,Бразилия). Яичники получали с бойни и хранили в физиологическом растворе при 35-37 С. Комплексы кумулюс-ооцит (СОС) получали посредством аспирации 2-10 мм фолликулов с помощью шприца на 20 мл с иглой 18 калибра и собирали в центрифужные пробирки на 50 мл. После седиментации в течение 10 мин СОС отсасывали в чашки Петри с культуральной средой ТСМ-199 по Хэнку (Gibco) с добавлением фетальной сыворотки телят (ФСТ), пенициллина, стрептомицина и гепарина (Sigma H3149). После забора СОС три раза промывали средой для дозревания (ЕСМ-199 по Эрлу с добавлением фетальной сыворотки телят (ФСТ), лактатдегидрогеназы (LH) (Sigma), фолликулостимулирующего гормона (ФСГ),L-глутамина, пенициллина и стрептомицина и переносили в 2 мл среды для дозревания (примерно 100 СОС на чашку Петри) с покрытием из минерального масла. Дозревание ооцитов осуществляли при 38 С на воздухе с 5% СО 2 и максимальной влажностью в течение 22 ч. Подготовка спермы, экстракорпоральное оплодотворение (IVF) и культивирование in vitro (IVC). Для экстракорпорального оплодотворения СОС промывали три раза средой для проведения оплодотворения перед переносом группами по 20-25 шт. в чашки Петри, содержавшие по 4 капли объемом по 200 мкл среды для проведения оплодотворения (TALP с добавлением сывороточного альбумина быка(BSA), пенициламина - Sigma P4875, гипотаурина - Sigma H1384, эпинефрина - Sigma Е 4250 и гепарина Sigma H3149), покрытых минеральным маслом. Подвижные сперматозоиды получали посредством центрифугирования замороженных и размороженных сперматозоидов (Gentec, Куиаба, Бразилия) в ступен- 11009409 чатом градиенте плотности перколла (2 мл 45% перколла поверх 2 мл 90% перколла) в течение 20 мин при 700 г при комнатной температуре. Осадок сперматозоидов, собранный со дна 90%-й фракции, промывали в растворе Тироде, забуференном HEPES, и осаждали посредством центрифугирования при 700 г в течение 5 мин. Сперматозоиды подсчитывали на гемоцитометре и разводили в соответствующем объеме TALP с получением концентрации 2106 сперматозоидов/мл; к каждой капле для оплодотворения добавляли аликвоту этой суспензии объемом 200 мкл. Чашки Петри инкубировали в течение 19 ч в увлажненном воздухе, содержавшем 5% СО 2, при 39 С. Предположительные зиготы затем культивировали invitro в каплях SOF под минеральным маслом в увлажненной атмосфере, содержавшей 5% СО 2, при 39 С. Обработка давлением. Расширенные бластоцисты помещали в пластиковые капилляры (7-9 эмбрионов/капилляр), содержавшие среду для хранения эмбрионов (Emcare Holding, Emcare, Новая Зеландия) без пузырьков воздуха,затем капилляры герметизировали ПВХ. Капилляры помещали в камеру высокого давления, заполненную водой в качестве среды для передачи давления. Эмбрионы подвергали воздействию различных гидростатических давлений в диапазоне от 60 до 90 МПа (с шагом 10 МПа) в течение различного времени(15, 30, 45, 50, 60, 90, 100 мин) при комнатной температуре, как описано выше. Криоконсервация с предварительной обработкой давлением. Эмбрионы случайным образом делили на три группы. Бластоцисты группы I криоконсервировали так, как указано ниже, в растворе для замораживания, содержащем 1,5 М этиленгликоля (ЭГ). Эмбрионы группы II обрабатывали давлением, равным 80 МПа, в течение 50 мин, затем замораживали таким же способом. Промежуток времени между обработкой давлением и началом замораживания составлял 4-5 мин. Группа III служила в качестве необработанного контроля. После размораживания эмбрионы культивировали in vitro в течение 24 ч. Криоконсервация. Бластоцисты уравновешивали в течение 8 мин в растворе для замораживания, содержавшем 1,5 М этиленгликоля (Emcare, Новая Зеландия), предварительно поместив их в пластиковые капилляры объемом 0,25 мл (7-9 эмбрионов на капилляр). Капилляры герметизировали ПВХ. Капилляры помещали в программируемый морозильный аппарат (Bio-cool, FTS-Systems, США, Нью-Йорк), предварительно охлажденный до -5,2 С. Через 3 мин начиналась кристаллизация. Еще через 10 мин капилляры начинали охлаждать со скоростью -0,5 С/мин до -32 С, после чего их погружали в жидкий азот. Капилляры размораживали посредством осторожного встряхивания на воздухе в течение 10 с, после чего их помещали в воду при 35 С до тех пор, пока лед в капиллярах не таял. Бластоцисты извлекали из капилляров, три раза промывали в SOF, помещали в SOF под минеральное масло и возвращали в инкубатор на 24 ч. Оценка и статистический анализ. Качество эмбрионов оценивали сразу же после сброса давления или после размораживания, а также через 2, 3, 4, 6, 12 и 24 ч. Выживание эмбрионов оценивали по морфологическим признакам и продолжению развития in vitro: интактность бластомеров, повторное расширение бластоцеля и вылупление из прозрачной зоны были признаками выживания. В качестве контроля были использованы необработанные бластоцисты. Выживаемость сравнивали с выживаемостью контролей с использованием критерия хи-квадрат. Значение вероятности р 0,05 было принято за статистически достоверное. Результаты Выживание и продолжение развития эмбрионов после обработки различными давлениями. В первой серии экспериментов на эмбрионы воздействовали различными значениями гидростатического давления в течение различного времени. Результаты суммированы в табл. 2, приведенной ниже: Таблица 2 Выживание замороженных и размороженных эмбрионов коров, прошедших криоконсервацию после предварительной обработки давлением или без предварительной обработки давлениемI-II: полностью расширившиеся или расширившиеся на 2/3 от первоначального размера эмбрионы первого или второго класса;III-IV: эмбрионы третьего класса или мертвые эмбрионы.- 12009409 Продолжение развития in vitro бластоцист, витрифицированных после предварительной обработки повышенным давлением и без предварительной обработки. Во второй серии опытов мы исследовали, можно ли улучшить развитие in vitro прошедших криоконсервацию расширенных in vitro зрелых/оплодотворенных/культивируемых бластоцист коров посредством обработки повышенным давлением перед выполнением процедуры замораживания. В каждой экспериментальной группе было использовано по 8-12 эмбрионов, эксперименты повторили 6 раз. Результаты представлены в табл. 3. Были обнаружены достоверные различия в выживаемости in vitro между группами, обработанными давлением и не обработанными давлением (р 0,01). Повторное расширение происходило быстрее (1-2 ч против 4-6 ч), а выживаемость была выше (81% против 41%) у тех эмбрионов, которые перед криоконсервацией прошли обработку давлением (табл. 3). Не было достоверных различий между контрольной группой и группой, обработанной давлением, в отношении выживаемости и вылупления. Таблица 3 Продолжение развития in vitro после размораживания IVMFC-бластоцист коров, замороженных после предварительной обработки давлением или без предварительной обработки давлениемI-II: полностью расширившиеся или расширившиеся на 2/3 эмбрионы первого или второго класса; Выводы Полученные результаты показали, что проведение перед замораживанием обработки давлением может повысить скорость развития in vitro, выживаемость и частоту вылупления IVMFC-эмбрионов коров (IVMFC = дозревание ооцитов in vitro, оплодотворение in vitro, культивирование эмбрионов in vitro). Также это исследование представило доказательства того, что обработка давлением может в значительной степени способствовать успеху криоконсервации. Очевидно, что способы, представленные в вышеизложенных экспериментах, легко адаптируются к широкому диапазону биологических материалов, в частности к эмбрионам различного происхождения, например, эмбрионам лошадей, коз, свиней или приматов, включая эмбрионы человека. Пример 6. Выживание сперматозоидов после обработки давлением, замораживания и оттаивания. В первой части данного исследования было описано, как повышенное гидростатическое давление(ННР) влияет на долю подвижных клеток в свежей сперме быков. Во второй части эксперимента было выбрано 4 пары параметров на основании графика зависимости подвижности сперматозоидов от давления и времени, после чего сравнили подвижность после размораживания сперматозоидов замороженной спермы быков, прошедшей предварительную обработку при выбранных параметрах давление-время, с подвижностью сперматозоидов, которые были заморожены без предварительной обработки. Пробы спермы были получены из Центра искусственного осеменения Клессхайма, Австрия. Пробы разбавляли до концентрации сперматозоидов, равной 8107 мл, разбавителем AndroMed (MiniTub, Германия), как описано в инструкции. Разбавленную сперму помещали в капилляры объемом 0,25 мл и хранили при комнатной температуре. Перед обработкой давлением капилляр со спермой разрезали на две части. Одну половину запаивали и затем обрабатывали давлением при специфических параметрах давление/время, другую использовали для сравнения с подвижностью сперматозоидов после обработки. Эксперименты с различными параметрами давления/времени повторяли по семь раз, прогрессивную подвижность оценивали индивидуально путем исследований с помощью светового микроскопа, которые проводили два разных лаборанта. Группы, прошедшие обработку, получали обработку давлением при следующих параметрах: 10 МПа в течение 30, 60, 90 и 120 мин; 30 МПа в течение 30, 60, 90, 120 и 510 мин; 50 МПа в течение 30, 60 и 90 мин; 70 МПа в течение 30, 60 и 90 мин; 90 МПа в течение 30, 60, 90,120 и 510 мин. Устройство для повышения давления было изготовлено по специальному заказу из нержавеющей стали, оно содержало камеру высокого давления с водой в качестве среды для передачи давления и утвержденный соответствующей организацией манометр. Время достижения желаемого значения давления составляло от 1 до 5 мин, сброс давления осуществляли за 2-3 с. Средняя подвижность сперматозоидов в контрольных пробах варьировала между 75 и 90%, тогда как средняя подвижность сперматозоидов в пробах, обработанных давлением, варьировала от 55 (90 МПа/120 мин) до 84 (10 МПа/30 мин) процентов. В группах, обработанных при 30 МПа/510 мин и 90 МПа/510 мин, подвижность была значительно снижена по сравнению с другим группами, обработанны- 13009409 ми давлением (27 и 33% соответственно; р 0,05). См. фиг. 4. Во второй части исследования пробы спермы были получены от двух быков (одна проба - от быка с известной плохой замораживаемостью спермы). Пробы разбавили, как описано выше, затем разделили на четыре группы для обработки. Группы, подлежащие обработке, разделили на две части: одну половину запаивали в капилляре и перед замораживанием подвергали воздействию повышенного давления с параметрами: I - 90 МПа/30 мин; II - 90 МПа/90 мин; III - 30 МПа/30 мин; IV -30 МПа/90 мин, вторую половину замораживали без предварительной обработки по такому же протоколу замораживания (уравновешивание при 5 С в течение 60 мин, затем 10 мин при -110 С перед погружением в жидкий азот). Размораживание производили в водяной бане с температурой 35 С в течение 30 с. Каждую группу также исследовали на начальную подвижность сперматозоидов после обработки давлением и без обработки. Каждый эксперимент повторили восемь раз. Средняя начальная подвижность сперматозоидов у обоих быков находилась в интервале от 65 до 80%, тогда как после обработки давлением она снижалась до 45-75%. Средняя подвижность сперматозоидов после размораживания у обоих быков была значительно выше после предварительной обработки давлением (р 0,001) (бык I: 2-3% без обработки давлением против 17-33% после обработки - фиг. 5; быкII: 0% без обработки давлением против 21-35% после предварительной обработки давлением - фиг. 6). Среди исследованных параметров сочетание 30 МПа/90 мин оказалось значительно лучшим (33 и 35%; р 0,05). Настоящее исследование явно подтверждает положительный эффект предварительной обработки давлением на подвижность сперматозоидов быков, прошедших криоконсервацию в нашем эксперименте,после их размораживания. Исследование обеспечило дополнительные доказательства того, что обработка давлением может в значительной степени способствовать успеху криоконсервации. Очевидно, что способы, представленные в вышеизложенных экспериментах, легко адаптируются к широкому диапазону биологических материалов, в частности к сперме различного происхождения, например, к сперме лошадей, коз, свиней или приматов, включая сперму человека. Промышленная применимость. Результаты, представленные в приведенных выше примерах, показывают, что обработка давлением,проведенная перед криоконсервацией, заметно повышает скорость развития эмбрионов in vitro, выживаемость и частоту вылупления эмбрионов. Соответственно, может быть достигнута основная цель этих усилий: получение большего количества потомков. Кроме того, представленные данные по эмбрионам быков и сперме быков показывают широкую применимость концепции криоконсервации биологических материалов согласно настоящему изобретению. Применение способов согласно настоящему изобретению может быть полезным для повышения успешности криоконсервации эмбрионов и манипуляций с эмбрионами, включая другие виды млекопитающих и не исключая человека, а также для работы с ооцитами, эмбриональными стволовыми клетками, тканями и т.п. Представленный способ также открывает широкие возможности для других областей техники, где может найти применение криоконсервация биологического материала. СсылкиAbe, F., and Horikoshi, K. (1995). Hydrostatic pressure promotes the acidification of vacuoles in Saccharomyces cerevisiae (Гидростатическое давление способствует закислению вакуолей Saccharomyces cerevisiae). FEMS Microbiol Lett 130, 307-312.cerevisiae, вызванное повышенным гидростатическим давлением, является временным и опосредованным вакуолярной Н+-АТФазой). Extremophiles 1, 89-93.Abe, F., and Horikoshi, K. (1998). Analysis of intracellular pH in the yeast Saccharomyces cerevisiae under elevated hydrostatic pressure: a study in baro-(piezo-) physiology (Анализ внутриклеточного pH в дрожжах Saccharomyces cerevisiae при повышенном гидростатическом давлении: баро-(пьезо-)физиологическое исследование). Extremophiles 2, 223-228.membranes (Воздействие давления на механизм переноса зарядов через двухслойные мембраны). BiochimArcher, J., Gook, D.A., Edgar, D.H. (2003). Blastocyst formation and cell numbers in human frozenthawed embryos following extended culture (Образование бластоцист и количество клеток в замороженныхразмороженных эмбрионах после длительного культивирования). Human Reproduction (Oxford, England) 18, 1669-1673.embryos with antifreeze proteins: development in vitro and in vivo (Гипотермическое хранение эмбрионов овец с белками, предохраняющими от замерзания). Theriogenology 48, 1017-1024.Butz P., Ludwig H. (1986). Pressure inactivation of microorganisms at moderate temperatures (Инактивация микроорганизмов давлением при умеренных температурах). Physica B+C 139-140, 875-877.induced acute nephrotoxicity: enhanced expression of heat shock protein 90 (Реакция на оксидативный стресс при индуцированной железом острой нефротоксичности: повышенная экспрессия белка теплового шока 90). Biochem Biophys Res Commun 1996; 219:76-81.endothelial nitric oxide synthase by HSP90 (Динамическая активация эндотелиальной синтазы окиси азота белком теплового шока 90). Nature 1998; 392: 821-4.Graumann, P.L., Marahiel M.A. (1999). Cold shock proteins CspB and CspC are major stationary-phaseinduced proteins in Bacillus subtilis (Белки холодового шока CspB и CspC являются основными индуцируемыми белками стационарной фазы у Bacillus subtilis). Arch Microbiol 171, 135-138.structure, function and assembly of proteins and protein complexes (Белки под давлением. Влияние высокого гидростатического давления на структуру, функцию и сборку белков и белковых комплексов). Eur J Biochem 221, 617-630.Huang, S.Y., Kuo, Y.H., Lee, W.C., Tsou, H.L., Lee, Y.P., Chang, H.L. et al. Substantial decrease of heatshock protein 90 precedes the decline of sperm motility during cooling of boar spermatozoa (Значительное снижение содержания белка теплового шока 90 предшествуют снижению подвижности сперматозоидов во время охлаждения сперматозоидов хряков). Theriogenology 1999; 51:1007-16.sperm motility by geldanamycin, a specific inhibitor of heat shock protein 90 (HSP 90) (Снижение подвижности сперматозоидов свиней гелданамицином, специфическим ингибитором белка теплового шока 90).(Идентификация стимулятора транскрипции основного гена холодового шока Escherichia coli, кодирующего нуклеотидный белок H-NS). Proc Natl Acad Sci USA 88, 10907-10911.Macdonald, A.G. (1987). The role of membrane fluidity in complex processes under high pressure (Роль текучести мембраны в комплексных процессах под высоким давлением). In: Jonnasch, H.W., Marquis,R.E., Zimmerman, A.M., editors. Current Perspectives in High Pressure Biology. London: Academic Press pp. 207-223.and development of expanded mouse blastocysts frozen by a simple rapid-freezing procedure (Влияние криопротекторов и их концентрации на выживание и развитие после размораживания расширенных бластоцист мыши, замороженных посредством простой процедуры быстрого замораживания). Theriogenology 50, 1001-1013.ATPases of some organs implicated in hydromineral regulation (Воздействие высокого гидростатического давления на активность мембранных АТФаз некоторых органов, участвующих в регуляции гидроминерального обмена). Comp Biochem Physiol В Biochem Mol Biol 59, 207-212.Prodromou, С, Roe, S.M., O'Brian, R., Ladbury, J.E., Piper, P.W.amd Pearl, LH. Identification and structural characterization of the ATP/ADP-binding site in the HSP90 molecular chaperone (Идентификация и определение структуры АТФ/АДФ-связывающего сайта молекулярного шаперона HSP90). Cell 1997; 90:6575.(Криоконсервация эмбрионов мыши без образования льда при -196 С посредством витрификации). Nature 313, 573-575.embryonic stem cells by the open pulled straw vitrification method (Эффективная криоконсервация эмбриональных стволовых клеток человека по методу витрификации в открытом капилляре). Human Reproduction 16,2187-2194.the eggs and embryos of medaka, Oryzias latipes (Факторы, влияющие на захват ДМСО яйцеклетками и эмбрионами оризии, Oryzias latipes). Theriogenology 58.1483-1496.enzymes (Влияние высокого давления на активность гликолитических ферментов). Biophys Chem 3,90-98.(Влияние гидростатического давления на липидные мембраны с опорным S-слоем). Biochim Biophys Acta 1563, 29-34.and structure (Давление обеспечивает новые представления о фолдинге белка, его динамике и структуре).zygotes cryopreserved in a nonconventional freezing medium (Развитие плодов из ооцитов и зигот мыши,криоконсервированных в нестандартной среде для замораживания). Cryobiology 44, 5-13.high pressure (Функциональная целостность печени крысы после консервации при температурах ниже нуля при высоком давлении). Transplantation Proceedings 32, 1634-1636.of rat livers by supercooling under high pressure (Консервация печени крысы посредством суперохлаждения под высоким давлением). Transplatation Proceedings 3,916-919.Van Wagtendonk-De Leeuw, A.M., Den Daas, J.H., Kruip, T.A., Rall, W.F. (1995). Comparison of the efficacy of conventional slow freezing and rapid cryopreservation methods for bovine embryos (Сравнение эффективности методов стандартного медленного замораживания и быстрой криоконсервации эмбрионов коров). Cryobiology 32, 157-167.and three-step dilution (Полевые эксперименты по сравнению частот наступления беременностей при различных методах криоконсервации эмбрионов коров: витрификация и одностадийное разведение против медленного замораживания и трехстадийного разведения). Theriogenology 48, 1071-1084.Watson, P.F. The effect of cold shock on sperm cell membranes (Воздействие холодового шока на мембраны клеток спермы). In: Morris, G.J. and Clarke, A. eds. Effects of low temperature on biological membranes. London: Academic Press; 1981, p. 189-218.(Влияние высокого давления на белки и другие биомолекулы). Q Rev Biophys 16, 89-112.Welch, T.J., Farewell, A., Neidhardt, F.C., Bartlett, D.H. (1993). Stress response of Escherichia coli to elevated hydrostatic pressure (Стрессорная реакция Escherichia coli на повышенное гидростатическое давление). J Bacteriol 175,7170-7177.(Повышенные уровни белков холодового шока в Listeria monocytogenes LO28 под действием низкой температуры и высокого гидростатического давления). Appl Environ Microbiol 68,456-63.Wen-Lei, С, Yi-Xin, W., Zu-Qiong, X. and Zheng, L. (2003). Cryopreservation-induced decrease in heatshock protein 90 in human spermatozoa and its mechanism (Вызванное криоконсервацией снижение белка теплового шока 90 в сперматозоидах человека и его механизм). Asian Journal Of Andrology 5. 43-46.role of 7 kDa cold-shock proteins of Lactobacillus lactis MG1363 in cryoprotection (Анализ роли белков холодового шока массой 7 кДа Lactobacillus lactis MG1363 в криопротекции). Microbiology 145, 3185-3194.Yager, P., Chang, E.L. (1983). Destabilization of a lipid non-bilayer phase by high pressure (Дестабилизация липидной не бислойной фазы высоким давлением). Biochim Biophys Acta 731,491-494.Yamanaka, K., Fang, L., Inouye, M. (1998). The CspA family in Escherichia coli: multiple gene duplication for stress adaptation (Cspa-семейство в Escherichia coli: множественная дупликация генов для адаптации к стрессу). Mol Microbiol 27,247-255. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ повышения выживаемости после размораживания криоконсервированного жизнеспособного биологического материала, включающий в себя стадии:(а) приложения гидростатического давления к жизнеспособному биологическому материалу;(б) выдерживания жизнеспособного биологического материала под гидростатическим давлением;(г) замораживания жизнеспособного биологического материала. 2. Способ по п.1, отличающийся тем, что гидростатическое давление находится в диапазоне от 1 до 200 МПа, предпочтительно от 10 до 100 МПа, более предпочтительно от 20 до 75 МПа и наиболее предпочтительно от 30 до 60 МПа. 3. Способ по п.1 или 2, отличающийся тем, что гидростатическое давление прикладывают на период времени от 1 с до 300 мин, предпочтительно от 1 с до 150 мин, более предпочтительно от 1 с до 90 мин и наиболее предпочтительно от 1 с до 60 мин. 4. Способ по любому из пп.1-3, отличающийся тем, что давление сбрасывают постепенно в течение периода времени от 1 с до 4 ч или мгновенно. 5. Способ по любому из пп.1-4, отличающийся тем, что жизнеспособный биологический материал выбран из группы, состоящей из ооцитов, сперматозоидов, зигот, морул, бластоцист, стволовых клеток,других клеток или тканей позвоночного животного. 6. Способ по любому из пп.1-5, отличающийся тем, что позвоночное животное является рыбой, птицей или млекопитающим, предпочтительно коровой, лошадью, козой, овцой, свиньей, другим сельскохозяйственным животным, домашним животным, приматом, включая человека.
МПК / Метки
МПК: A01N 1/02
Метки: стимуляции, выживаемости, гидростатическим, способ, биологического, после, криоконсервированного, улучшения, размораживания, сжатием, посредством, материала
Код ссылки
<a href="https://eas.patents.su/20-9409-sposob-uluchsheniya-vyzhivaemosti-posle-razmorazhivaniya-kriokonservirovannogo-biologicheskogo-materiala-posredstvom-stimulyacii-gidrostaticheskim-szhatiem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ улучшения выживаемости после размораживания криоконсервированного биологического материала посредством стимуляции гидростатическим сжатием</a>
Предыдущий патент: Магнитотерапевтическая установка
Следующий патент: Автоэмиссионный холодный катод
Случайный патент: Устройство для охраны объектов