Анти-epcam антитело и его применение
Номер патента: 23679
Опубликовано: 30.06.2016
Авторы: Де Сантис Рита, Петронцелли Фиорелла, Альберти Саверио, Анастаси Анна Мария
Формула / Реферат
1. Анти-ЕрСАМ антитело или его функционально активный фрагмент, отличающееся тем, что вариабельная область тяжелой цепи антитела содержит все три гипервариабельных участка (CDR) с последовательностью SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6, а вариабельная область легкой цепи антитела содержит по меньшей мере один гипервариабельный участок (CDR) с последовательностью SEQ ID NO:8, SEQ ID NO:10 или SEQ ID NO:12.
2. Анти-ЕрСАМ антитело или его функционально активный фрагмент по п.1, которое способно полностью и постоянно ингибировать рост опухолей, экспрессирующих ЕрСАМ.
3. Анти-ЕрСАМ антитело по любому из пп.1, 2, которое представляет собой моноклональное антитело.
4. Анти-ЕрСАМ антитело по п.3, продуцируемое гибридомной клеточной линией, депонированной в Центре биотехнологии (Advanced Biotechnology Center, Генуя, Италия) с номером доступа PD06004.
5. Анти-ЕрСАМ антитело или его фрагмент по п.2, представляющее собой scFv, Fv фрагмент, Fab фрагмент, F(ab)2 фрагмент, мультимерное антитело, пептид или протеолитический фрагмент, содержащий эпитоп-связывающий участок.
6. Анти-ЕрСАМ антитело по п.5, отличающееся тем, что химерный белок представляет собой химерный белок, состоящий из участков антитела человека и мыши.
7. Анти-ЕрСАМ антитело по п.2, отличающееся тем, что антитело представляет собой химерный белок, слитый с цитокином, белком из семейства авидинов, биотином, меченым биотином или другими эффекторными белками, или соединен с маркером для визуализации.
8. Анти-ЕрСАМ антитело по п.2, где антитело представляет собой антитело человека или гуманизированное антитело.
9. Нуклеиновая кислота, содержащая последовательность, кодирующую антитело или его функционально активный фрагмент по любому из предшествующих пунктов, или последовательность нуклеиновой кислоты, которая гибридизируется с указанной выше последовательностью нуклеиновой кислотой в жестких условиях, или последовательность нуклеиновой кислоты, полученная на основе указанной в соответствии с принципом вырожденности генетического кода.
10. Нуклеиновая кислота по п.9, содержащая по меньшей мере одну из следующих последовательностей: SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 и SEQ ID NO:11.
11. Вектор экспрессии, содержащий нуклеиновую кислоту по любому из пп.9 или 10.
12. Клетка-хозяин, трансформированная вектором экспрессии по п.11.
13. Гибридомная клеточная линия, продуцирующая анти-ЕрСАМ антитело по пп.1-3.
14. Гибридомная клеточная линия по п.13, представляющая собой гибридому, депонированную в Центре биотехнологии в Генуе (Advanced Biotechnology Center, Генуя, Италия) с номером доступа PD06004, продуцирующая моноклональное антитело по п.8.
15. Применение анти-ЕрСАМ антитела по пп.1-8 в качестве лекарственного средства для лечения опухоли.
16. Применение анти-ЕрСАМ антитела по п.15, где опухоль выбрана из группы, состоящей из карциномы толстой кишки, карциномы молочной железы, карциномы желудка, карциномы яичника, карциномы мочевого пузыря или карциномы легкого.
17. Фармацевтическая композиция для лечения опухоли, содержащая эффективное количество антитела или его фрагментов по любому из пп.1-8 и фармацевтически приемлемый носитель или разбавитель.
18. Фармацевтическая композиция по п.17, используемая при радиоиммунотерапии.
19. Фармацевтическая композиция по п.17 или 18, содержащая по крайней мере еще одно опухолеспецифическое антитело в той же или в стандартной дозе.
20. Фармацевтическая композиция по п.19, отличающаяся тем, что опухолеспецифическое антитело представляет собой ЕрСАМ антитело, отличное от антитела по пп.1-8.
21. Применение анти-ЕрСАМ антитела по пп.1-8 в качестве средства для диагностики опухолей.
22. Применение анти-ЕрСАМ антитела по п.21 в качестве средства для диагностики опухолей in vivo.
23. Растворимая композиция для инъекции для проведения опухолевой диагностики in vivo, содержащая анти-ЕрСАМ антитело по п.22.
24. Способ иммунодетекции в образце антигена, способного связываться с антителом или его фрагментом по любому из пп.1-7, включающий стадию инкубации в соответствующих условиях данного образца с антителом или его фрагментом по пп.1-8 и последующую детекцию комплекса антиген-антитело.
25. Диагностический набор для использования в способе по п.24, включающий антитело или его фрагмент по любому из пп.1-8 и средство детекции комплекса антиген-антитело.
Текст
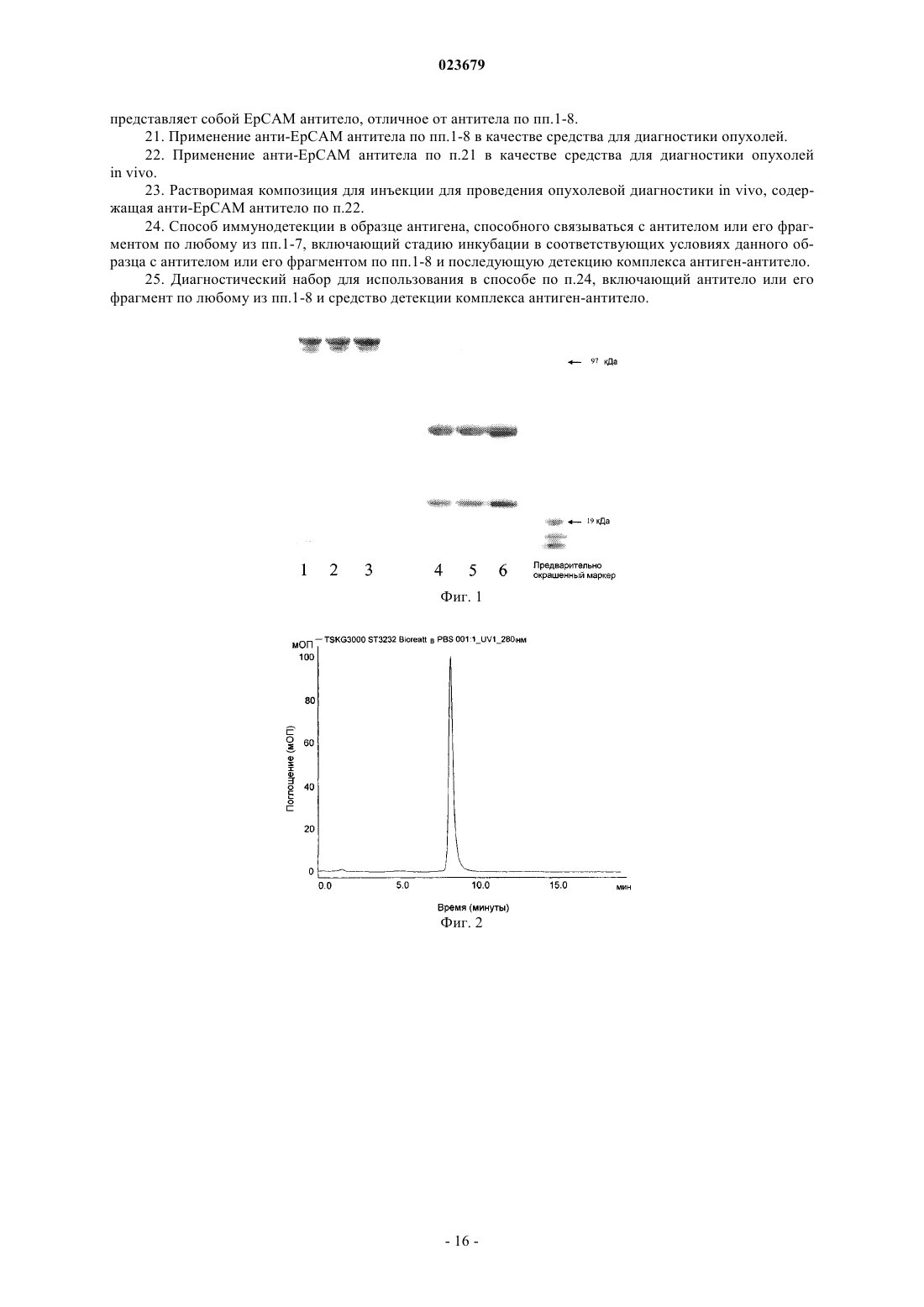
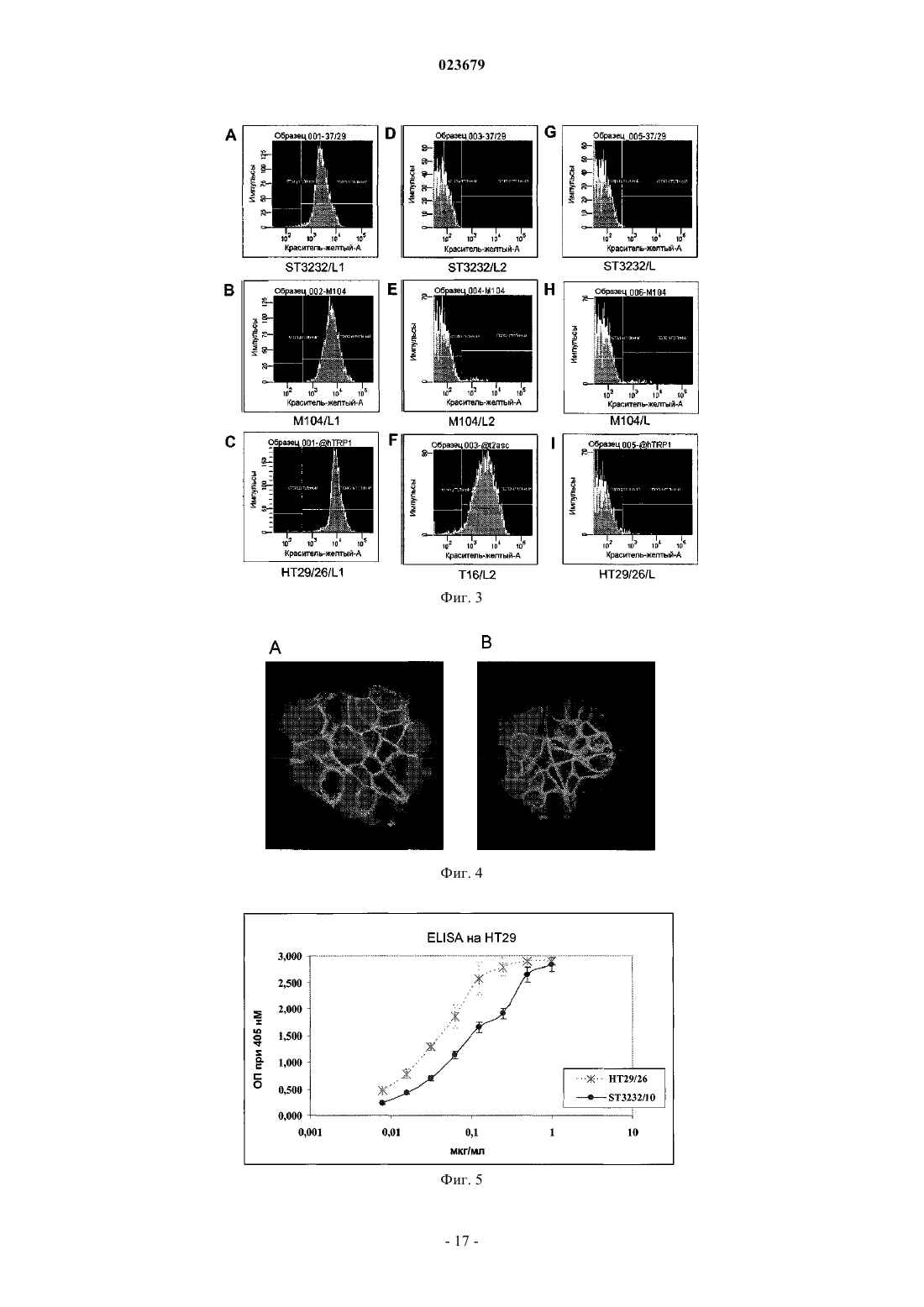
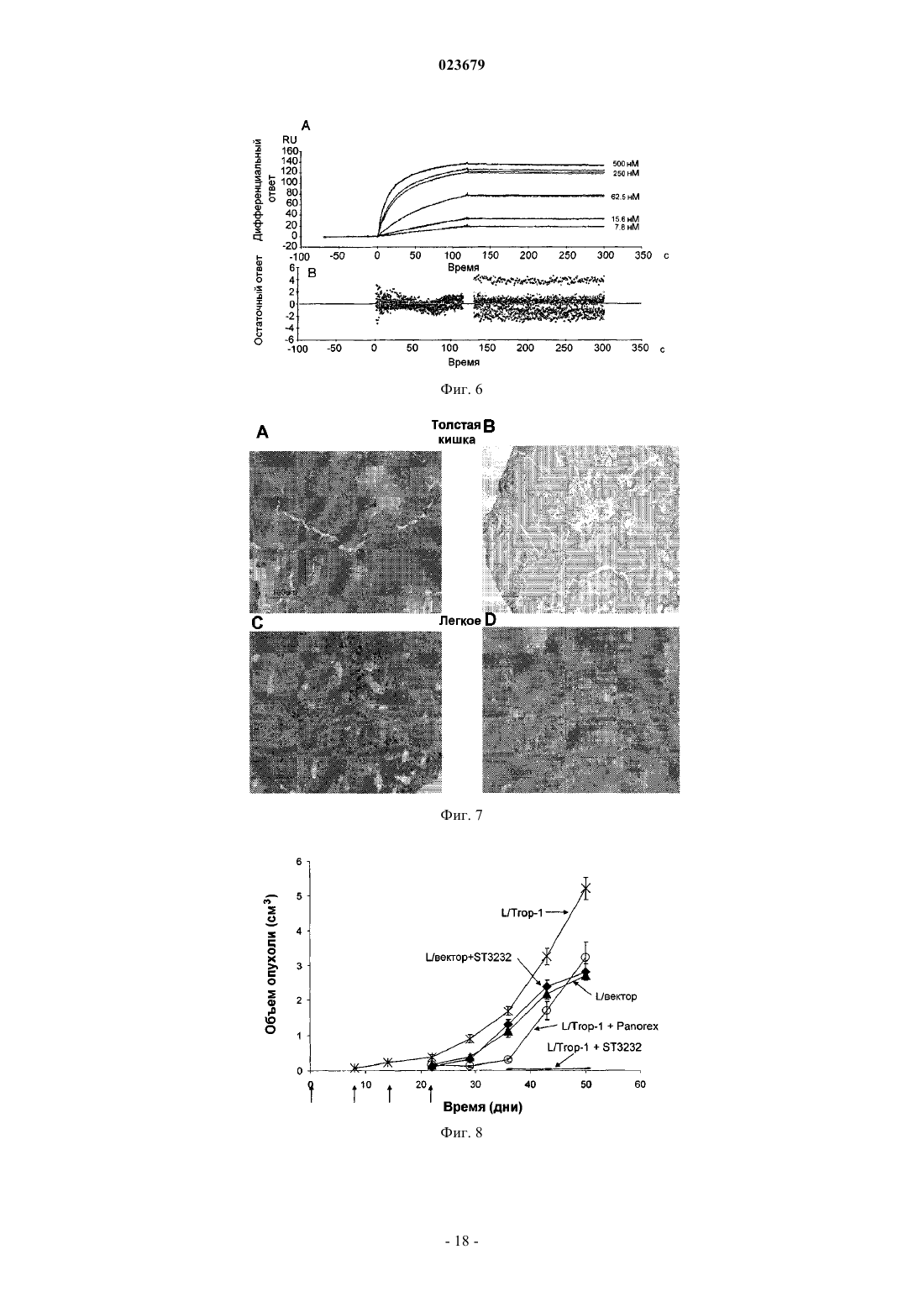
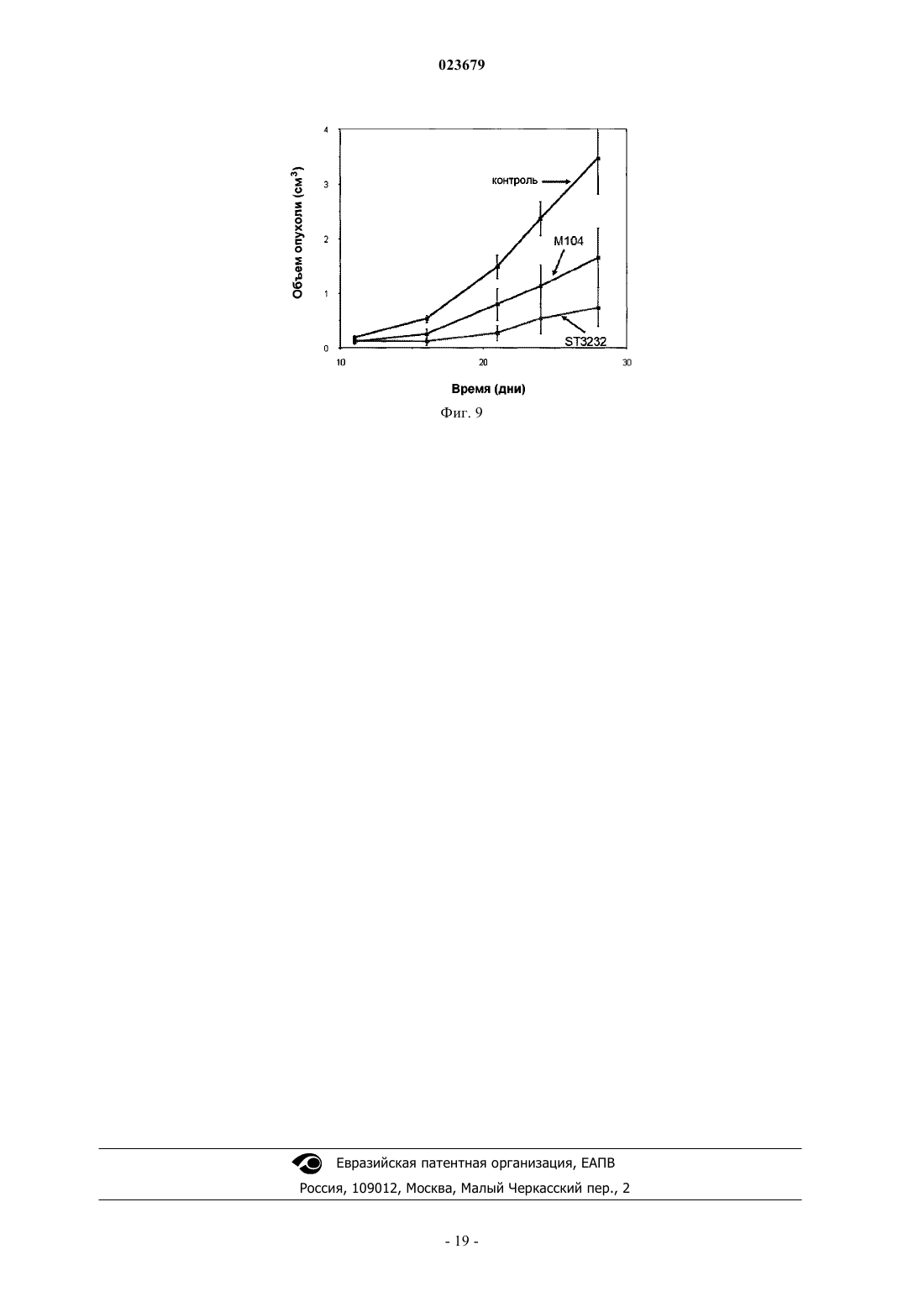
Описывается анти-ЕрСАМ антитело, которое демонстрирует высокую аффинность в отношении нативного антигена и хорошую опухолевую специфичность. Также описаны варианты применения антитела, фармацевтическая композиция, содержащая антитело, способ применения и набор.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. Область техники, к которой относится изобретение Настоящее изобретение относится к моноклональным антителам против ЕрСАМ человека и к его функциональным производным, к способам и материалам, используемым для их получения, к применению указанных антител для диагностики и лечения опухолей, экспрессирующих ЕрСАМ, и к материалам, подходящим для использования в медицине, которые содержат указанные антитела. Предпосылки создания изобретения Нацеливание антител на опухолевые ткани позволяет селективно распознавать антигены, сверхэкспрессирующиеся в сайте опухоли, которые являются мишенью противоопухолевой иммунотерапии. Молекула адгезии эпителиальных клеток (ЕрСАМ, swiss prod.no. Р 16422), также известная как опухолеассоциированный кальциевый сигнальный трансдуктор 1, TROP-1, GA733-2 и т.п., представляет собой трансмембранный гликопротеин типа 1, экспрессирующийся на базолатеральной мембране простого эпителия, где он вовлечен в кальций-независимую гомофильную клеточную адгезию. Внеклеточный домен состоит одного повтора, аналогичного повтору эпидермального фактора роста, за которым следует тиреоглобулиновый повтор и обедненный цистеином участок, а внутриклеточный домен состоит из 26 аминокислот и включает два сайта связывания -актинина, для присоединения к актиновому цитоскелету (Winter MJ et al. 2003). Клетки основных злокачественных опухолей человека устойчиво сверхэкспрессируют ЕрСАМ, как было недавно продемонстрировано Went и коллегами (2006), на основании результатов иммуногистохимического анализа большого числа образцов опухолевых тканей толстой кишки, желудка, предстательной железы и легкого. Клетки, сверхэкспрессирующие ЕрСАМ, стремятся отделиться от нормальных клеток, что коррелирует с развитием пролиферативного и злокачественного фенотипа (Winter et al. 2003). На основании этих данных, была исследована возможность нацеливания на ЕрСАМ для иммунотерапии. Антитело IgG2a мыши, Эдреколомаб, имеющее некоторую антитело-зависимую клеточную цитотоксичность (ADCC) в отношении ЕрСАМ-положительных клеток, было разрешено в Германии для клинического применения и используется для лечения пациентов с колоректальной или панкреатической карциномой, после оперативного хирургического вмешательства. Семилетнее наблюдение показало минимальные остаточные проявления заболевания у пациентов с колоректальным раком Дукса после лечения эдреколомабом и снижение смертности на 32%, а также снижение числа рецидивов на 23% (Riethmuller G et al., 1998; Weiner LM et al., 1993). Однако, общие результаты клинического испытания привели к отказу от этого лекарственного средства в качестве препарата для монотерапии, в связи с его ограниченной противоопухолевой эффективностью (Punt CJ et al., 2002) и ввиду подготовки к новым клиническим испытаниям, в которых планировалось использовать антитело в качестве дополнительного средства в сочетании с другими активными химиотерапевтическим соединениями (Frodin JE ey al., 2002). Другие антитела, направленные на эту мишень, использовали в доклинических или клинических экспериментах. МТ-201 (Адекатумумаб) представляет собой полностью моноклональное антитело IgGl человека со средней степенью аффинности к ЕрСАМ (Naundorf S et al., 2002). Его эффективность была продемонстрирована на модели "голых" мышей с ксенотрансплантатом, используя линии клеток рака толстой кишки НТ-29 (Naundorf S et al., 2002). В исследованиях in vitro на различных линиях опухолевых клеток было показано, что МТ 201 опосредует лизис мишеневых клеток по механизму ADCC и комплемент-зависимой цитотоксичности (CDC) (Prang N et al., 2005). Это антитело в настоящее время проходит фазу клинической разработки для применения его при лечении гормоно-резистентного рака предстательной железы (Oberneder R et al., 2006).ING-1 представляет собой сконструированное высокоаффинное моноклональное антитело человека, нацеленное на ЕрСАМ-положительные клетки. Указанное антитело использовалось на I фазе клинического испытания на пациентах с прогрессировавшей аденокарциномой, устойчивой к стандартной терапии, и полученные в результате этого испытания данные показали, что антитела с высокой аффинностью к ЕрСАМ, являющиеся цитотоксичными для опухолевых клеток, также могут индуцировать острое токсическое поражение поджелудочной железы, что ограничивает терапевтический диапазон их системного применения (De Bono JS et al., 2004). Имеются различные мнения по поводу важности аффинности антител для достижения эффективной иммунотерапии. Так, Velders et al. (1998) представили in vitro данные о влиянии аффинности антитела и антигенной плотности на ADCC, которые были получены при сравнении двух антител с разной аффинностью в отношении ЕрСАМ. Результаты данного исследования показывают, что высокоаффинное антитело может опосредовать гибель клетки при низких уровнях антигенной экспрессии или, при сравнимых уровнях связывания, с более высокой эффективностью. Поскольку гетерогенность экспрессии антигена-мишени является обычной характеристикой всех опухолей, то использование высокоаффинных антител может привести к улучшению клинических результатов. Возможные системные токсические эффекты, связанные с терапевтическим применением анти-ЕрСАМ антител, могут быть снижены при использовании стратегий предварительного мишеневого воздействия,которые включают стадию распознавания для удаления на определенной временной стадии циркулирующего антитела. Альтернативно, использование высокоаффинных аффинных антител может быть ограничено локально-региональным лечением. Был разработан одноцепочечный фрагмент Fv гуманизированного антитела NR-LU-10, специфичный для антигена ЕрСАМ, сконструированный по рекомбинантной технологии в виде слитого белка со стрептавидином, предназначенный для проведения предварительного нацеливания в рамках радиоиммунотерапии или при проведении хирургической операции на молочной железе с визуализацией опухоли с помощью радиоактивных веществ. Результаты доклинического испытания показали, что однократная доза 800 мкКю 90Y-DOTA-биотина, введенная после NR-LU-10, излечивала мышей с приживленными ксенотрансплантатами мелкоклеточного рака легкого или рака толстой кишки человека (Goshorn S et al.,2001). Во втором отчете Burak WE Jr et al. (2001) было показано, по данным анализа отобранных в ходе операции проб для оценки локализации опухоли у 7 из 10 пациентов, что использованный при этом Fab,меченный NR-LU-10, демонстрирует способность в качестве направленно воздействующего агента. Несмотря на успехи клинического использования моноклональных антител при ряде патологий,иммунотерапия солидных опухолей все еще остается неудовлетворительной. Радиоиммунотерапия с предварительным направленным воздействием антител (PAGRIt) представляет собой многофакторную лечебную стратегию, позволяющую ограничить область накопления радиоактивных изотопов в опухоли,тем самым усиливая их действие. Специфичность и аффинность противоопухолевых моноклональных антител, используемых на первой стадии, представляет собой фундаментальный фактор, определяющий эффективность лечения. Заявитель сообщил о достижении исключительно высокого и специфичного накопления антитенасциновых моноклональных антител ST214 6 в ксенотрансплантатах опухолей человека, экспрессирующих антиген как на низком, так и на высоком уровне (De Santis et al., Clinical Cancer Research, p 2191,1 April 2006). На основании результатов, описанных в ЕР 0496074, G. Paganelli et al разработали трехстадийную процедуру проведения предварительного воздействия с целью системного и локально-регионального лечения опухолей (Cremonesi M. et al., Eur. J. Nucl. Med.26 (2).-110- 120, 1999; Paganelli G. et al., Eur. J.Nucl. Med. 26 (4): 348-357, 1999; Paganelli G., et al. Cancer Biother.Radiopharm. 16 (3): 227-235, 2001). Другими ссылками на указанный трехстадийный метод предварительного мишеневого воздействия являются WO 94/04702 и US 5578287. Указанное трехстадийное лечение с предварительным нацеливанием основано на внутривенном последовательном введении биотинилированных анти-тенасциновых моноклональных антител, стрептавидина и 90Y-меченого биотина с двумя введениями авидина и биотинилированного альбумина, перед введением стрептавидина и 90Y-меченого биотина, соответственно, для снижения уровня неспецифического связывания. Таким образом, в настоящее время в медицине имеется потребность в других улучшенных анти-ЕрСАМ антителах, которые могли бы использовать для диагностики и лечения рака, например в рамках стратегии PAGRIT. Краткое описание сущности изобретения Настоящее изобретение относится к анти-ЕрСАМ антителу, или его функционально активному фрагменту, которое содержит вариабельную область тяжелой цепи антитела с тремя гипервариабельными участками (CDR) с последовательностью SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6, и вариабельную область легкой цепи антитела по меньшей мере с одним гипервариабельным участком (CDR) с последовательностью SEQ ID NO:8, SEQ ID NO:10 или SEQ ID NO:12, Также изобретение относится к варианту указанного антитела, который способен полностью и постоянно ингибировать рост опухолей,экспрессирующих ЕрСАМ. Изобретение также относится к варианту указанного антитела, который представляет собой моноклональное антитело. Другим вариантом указанного антитела является антитело, продуцируемое гибридомной клеточной линией, депонированной в Центре биотехнологии (AdvancedBiotechnology Center, Генуя, Италия) с номером доступа No. PD06004. Еще одним вариантом указанного антитела или его фрагмента является scFv, Fv фрагмент, Fab фрагмент, F(ab)2 фрагмент, мультимерное антитело, пептид или протеолитический фрагмент, содержащий эпитоп-связывающий участок. Кроме того, изобретение относится к варианту, когда антитело представляет собой химерный белок, состоящий из участков антитела человека и мыши. Согласно еще одному варианту антитело связано с белком, который представляет собой цитокин, белок из семейства авидинов, биотин, меченый биотин или другие эффекторные белки. Согласно еще одному варианту антитело представляет собой антитело человека или гуманизированное антитело. Также изобретение относится к нуклеиновой кислоте, содержащей последовательность, кодирующую любой указанный вариант антитела или его функционально активного фрагмента, или последовательность нуклеиновой кислоты, которая гибридизируется с указанной выше последовательностью нуклеиновой кислотой в жестких условиях, или последовательность нуклеиновой кислоты, полученная на основе указанной в соответствии с принципом вырожденности генетического кода. В качестве варианта указанная нуклеиновая кислота содержит по меньшей мере одну из следующих последовательностей: Еще в одном из вариантов осуществления изобретение относится к вектору экспрессии, содержащему указанную нуклеиновую кислоту. Также изобретение относится к клетке-хозяину, трансформированной указанным вектором экспрессии. Заявлены гибридомные клеточные линии, продуцирующие указанные анти-ЕрСАМ антитела. В частности, заявлена гибридома, депонированная в Центре биотехнологии в Генуе (Advanced Biotechnology Center, Генуя, Италия) с номером доступа No. PD06004. В другом варианте осуществления изобретение относится к применению анти-ЕрСАМ антитела в качестве лекарственного средства для лечения опухоли. В частности, опухоль может быть выбрана из группы, состоящей из карциномы толстой кишки, карциномы молочной железы, карциномы желудка,карциномы яичника, карциномы мочевого пузыря или карциномы легкого. Изобретение относится к фармацевтической композиция для лечения опухоли, содержащая эффективное количество указанного антитела или его фрагментов и фармацевтически приемлемый носитель или разбавитель. В частности, композиция может быть использована для радиоиммунотерапии. Также композиция может содержать по крайней мере еще одно опухолеспецифическое антитело в той же или в стандартной дозе. В еще одном варианте указанная композиция отличается тем, что опухолеспецифическое антитело представляет собой ЕрСАМ антитело, отличное от указанных антител. Анти-ЕрСАМ антитела можно использовать в качестве средства для диагностики опухолей. Анти-ЕрСАМ антитела можно использовать в качестве средства для диагностики опухолей in vivo. Также изобретение относится к растворимой композиции для инъекции для проведения опухолевой диагностики in vivo. Также заявлен способ иммунодетекции в образце антигена, способного связываться с указанным антителом или его фрагментом, где способ включает стадию инкубации в соответствующих условиях данного образца с указанным антителом или его фрагментом и последующую детекцию комплекса антиген-антитело. Изобретение также относится к диагностическому набору для использования в вышеуказанном способе. Набор включает указанное антитело или его фрагмент и средство детекции комплекса антигенантитело. Ниже приведено подробное описание настоящего изобретения, в сочетании с неограничивающими примерами и со ссылкой на следующие чертежи. Фиг. 1: профиль CST3232/10, полученного после очистки на колонке с белком A (MabSelect SuRe,GE Healthcare) в 4-12% BisTris SCS-PAGE (Precast, Invitrogen, США). Линии 1-3: очищенное моноклональное антитело ST3232/10 в невосстанавливающих условиях; линии 4-6: очищенное моноклональное антитело ST3232/10 в восстанавливающих условиях. Для разделения используется буфер 1x MES. Для окрашивания геля используется краситель Кумасси (Simplie Blu, Invitrogen, США). Фиг. 2: гель-фильтрация на колонке с TSGK3000 очищенного ST3232/10, при использовании для разделения PBS, рН 7. Показатели времени (минуты) приводятся на оси абсцисс, а на оси ординат показано поглощение в милли- единицах поглощения (мЕП). Фиг. 3: тест на специфичность флуоресцентной сортировки анти-ЕрСАМ антител. ST3232/10 или другие контрольные антитела (М 104, НТ 29/26 и Т 16) инкубируют (1 мкг/106 клеток, 1 час, при 4 С) с клетками фибросаркомы L мыши, которые в естественном состоянии не экспрессирует ЕрСАМ и которые были трансфицированы молекулой TROP-1 человека (панели A-С), молекулой TROP2 человека (панели D-F) или пустым вектором, в который не были введены экзогенные белки (G-I). Вторичное РЕ-конъюгированное антитело (BD, США) было использовано согласно инструкциям производителя и гибель клеток определяли при окрашивании красителем 7-AAD (FACSCalibur, BD Biosciences, США).ST3232/10 демонстрирует положительную реакцию с TROP-1-положительными клетками (панель А) и отрицательную реакцию с L клетками дикого типа или с клетками, трансфицированными молекуламиTROP2 (панели G и D соответственно). Аналогичный результат наблюдался с другими ЕрСАМ-специфичными антителами (панели В, Е, Н: М 104; С, I: HT29/26). Т 16 антитело было использовано в качестве положительного контроля для TROP2-L клеток (панель F). Фиг. 4: конфокальная микроскопия ST3232/10, конъюгированного с А 1 еха 488 на линии опухоли клеток молочной железы MCF7. MCF7 клетки помещают на планшеты размером 1515 мм с покровным стеклами и фиксируют через 48 ч при инкубации в смеси PBS/4% параформальдегид в течение 30 мин при комнатной температуре. Затем клетки подвергают пермеабилизации и окрашивают антителом, после чего анализируют несколько полей в конфокальном микроскопе. Конъюгат Alexa488-ST3232 демонстрирует ожидаемую картину окрашивания и наибольшая интенсивность отмечается на границах клеткаклетка, а также выявляется окрашивание отдельных пятен. Два примера такого окрашивания отдельных пятен показаны на панелях А и В. Фиг. 5: иммунореактивность ST3232/10 и анти-ЕрСАМ моноклонального антитела НТ 29/26 в отношении антигена, экспрессированного на линии клеток карциномы толстой кишки НТ 29. Данные представлены как изменение оптической плотности (ОП, измеренной при лине волны 405 нм) (линейная шкала, ось Y) с возрастающими концентрациями двух антител (мкг/мл, логарифмическая шкала, ось X) при инкубации с клетками карциномы толстой кишки НТ 29. Фиг. 6: кинетический анализ и определение параметров связывания ST3232/10 с внеклеточным доменом молекулы ЕрСАМ, иммобилизованной на сенсорном чипе СМ 5. Панель А: сенсограммы инъецированного моноклонального антитела в разных концентрациях (500, 250, 62,5, 15,6 и 7,8 нМ) в виде функции времени (мин, ось X) и резонансных единиц (RU, ось Y). Панель В: бивалентная модель при оценке в рамках программы BiaEvaluation была использована для построения кривых на основе полученных данных; остаточные значения, отражающие различия в значениях RU между полученными и ожидаемыми кривыми представлены в виде графика (ось Y) для каждой временной точки (ось X). Кинетические константы имеют следующие значения: kaI=7,75 Е+04297, kdI=7,20E-058,48 Е-06, KD=9,3E-10,2=1,97. Фиг. 7: реактивность ST3232/10 на тканях опухоли человека и на нормальных тканях. В качестве примера, приведены результаты иммуногистохимического анализа клеток карциномы толстой кишки и легкого (панели А и С соответственно), в сравнении с нормальными для них вариантами (панели В и D соответственно.) Ткани опухоли человека сильно окрашиваются коричневым цветом. Фиг. 8: аллогенный трансплантат у "голых" мышей и результаты лечения с использованиемST3232/10, в сравнении с Эдреколомабом (Edrecolomab (Panorex. Линия клеток фибросаркомы L мыши, трансфицированная (L/Trop-1) или не трансфицированная (L/вектор) человеческим Trop-1, была инъецирована подкожно "голым" мышам. В день инокуляции животным ввели 200 мкг ST3232/10(L/вектор и L/Trop-1). Три других введения были выполнены в дни 7, 15 и 22, как указано стрелками. Прогрессирование опухоли оценивают до 50 дня. Фиг. 9: ксеногенные трансплантаты у "голых" мышей и результаты лечения с использованиемST3232/10, в сравнении с использованием антитела М 104. Линия клеток карциномы толстой кишки человека KM12-SM, которая в нативном состоянии экспрессирует Trop-1, была подкожно трансплантирована"голым" мышам. Было проведено четыре варианта лечения, один раз в неделю с использованием 200 мкг ST3232/10 (группа введения ST3232), М 104 (группа введения М 104) или носителя (контрольная группа), начиная с дня инокуляции. Прогрессирование опухоли оценивают до 30 дня. Методы Гибридомные клетки. Для получения нового клона гибридомных клеток против ЕрСАМ, мышей Balb/c иммунизируют линией клеток фибросаркомы мышей L (Alberti S et al., 1988), стабильно трансфицированных молекулой человеческого ЕрСАМ (NCBI RefSeq NM002354). Спленоциты иммунизированных мышей сливают с миеломными клетками Sp2/0Ag14 по стандартному методу (Cianfriglia M. et al., 1986), и гибридомную популяцию скринируют цитофлуориметрией на наличие линии опухолевых клеток, экспрессирующих ЕрСАМ, такой как НТ 29. ЕрСАМ-специфичные гибридомы клонируют при проведении ограниченного двукратного разведения в FCS-содержащей среде и четырехкратного разведения в безбелковой среде(Animal Derived Component Free Medium HyClone, HyQRPerbio). Один из положительных клонов, полученных на стадии четвертого ограниченного разведения, с последующим клонированием, был обозначен как CST3232, и далее этот клон был подвергнут ферментации в минибиореакторе. Стабильность клеточной линии CST3232 составляет 98,65%. В этой связи, положительный клон CST3232/10 был выбран для амплификации с целью дальнейшей работы с ним. Антитело.ST3232/10 представляет собой мышиный иммуноглобулин IgGl/k изотипа, по данным определения с использованием коммерческого набора (Roche, Germany). Вариабельный участок легкой каппа-цепи был амплифицирован на основе кольцевой кДНК с использованием пары праймеровNO:14, который был подвергнут отжигу с получением константного участка антитела, по методу М. Sassano et al (1994). Вариабельный участок тяжелой гамма-цепи был амплифицирован на основе кольцевой кДНК с использованием олигонуклеотидных праймеров мыши 1CH1 5'-ATGGAGTTAGTTTGGGCAGCAG-3'NO:16), который был подвергнут отжигу до получения константного участка антитела по методу М. Sassano et al. (1994). ПЦР проводят с использованием следующих условий: 40 с при температуре 94 С, 40 с при температуре 62 С, 1 мин при температуре 72 С, в течение 30 циклов. Амплифицированные фрагменты клонируют непосредственно в векторе клонирования ПЦР с использованием набора для клонирования ТА с двойным праймером ПЦР (Invitrogen, К 2050-01). Девять клонов, содержащих вариабельные участки легкой каппа-цепи, и семь клонов, содержащих вариабельные участки тяжелой гамма-цепи, секвенировали. Секвенирование проводили на оборудовании MWGBiotech, Германия. Секвенируют обе цепи. Были получены ожидаемые результаты.SDS-PAGE анализ. Антитело анализируют в 4-12% градиенте с использованием BisTris NuPAGE с помощью 1 MES в качестве буфера для анализа и окрашивают раствором кумасси-красителя (все реактивы получены от компании Invitrogen, США) как в невосстановительных условиях, так и в восстановительных условиях. Хроматографический профиль.ST3232/10 прогоняли на колонке с TSGK3000 (Tosoh Bioscience GmbH, Stuttgart, Германия) со скоростью потока 1 мл/мин при использовании в качестве буфера для элюции PBS + NaN3 0,05%. Трансфекция клеток. Трансфекцию с использованием Trop-1 или Trop-2 проводят по методу Alberti S et al., 1988.FAC5 анализ. Связывание антитела ST3232/10 с нативными молекулами Trop-1 на поверхности клеток анализируют методом проточной цитометрии на наборе линий клеток человека. Указанную реакцию проводят в 96-луночных планшетах с V-дном в виде двух стадий с использованием 3105 клеток на лунку. Клеточную суспензию вначале инкубируют с 1 мкг/лунку антитела ST3232/10, затем с 2 мкл вторичного РЕ-конъюгированного противомышиного антитела (550589, BD Pharmingen, Erembodegem, Бельгия). На каждой стадии клетки инкубируют в течение 30 мин при температуре 4 С и промывают PBS, содержащим 1% FCS. После окончательной промывки, клетки ресуспендируют в PBS для подготовки их к анализу с использованием прибора FACSArray с использованием соответствующего программного обеспечения (BD Biosciences, Erembodegem, Бельгия). Другие Trop1, Trop2 или нерелевантные антитела используют в качестве контролей и к образцам добавляют 7-AAD (BD Biosciences, Erembodegem, Бельгия)(5 мкл/106 клеток) для окрашивания с целью определения жизнеспособности. Конфокальная микроскопия. Линию клеток опухоли молочной железы MCF7 окрашивают с использованиемMCF7 наносят на пластину размером 1515 мм с покровными стеклами и фиксируют через 48 ч при инкубации в смеси PBS/4% параформальдегид в течение 30 мин при комнатной температуре. После пермеабилизации в течение 30 мин при комнатной температуре в SM (10% сыворотка в PBS) с содержанием 0,05% сапонина, проводят инкубацию первичного антитела (1 мкг ST3232-Alexa488 в расчете на пластинку) в течение 30 мин при комнатной температуре в среде SM+Сапонин. После 3 промывок в SM,препарат закрывают покровными стеклами и проводят обследование под конфокальным микроскопом.ELISA клеток. 96-луночный планшет вначале блокируют с использованием 200 мкл/лунку 1PBS с 10% FCS в течение 30 мин при температуре 37 С и затем высевают с плотностью 250000 клеток/лунку, плюс первичное антитело с достижением общего объема 100 мкл. Планшет инкубируют в течение 1 ч при температуре 37 С и затем промывают три раза 1PBS с 1% FCS и центрифугируют со скоростью 2000 об/мин в течение нескольких секунд. Противомышиный IgG, конъюгированный с щелочной фосфатазой (Sigma А 2429, разведение 1/1000), добавляют к комплексу первичное антитело-клетка и инкубируют в течение 1 ч при комнатной температуре и затем, после пяти промывок, к каждой лунке добавляют по 200 мкл субстрата pNpp (Sigma A3496) и проводят инкубацию при температуре 37 С в течение 30 мин. Проводят окончательное центрифугирование планшетов и переносят 170 мкл супернатанта на новый планшет и подсчитывают поглощение при длине волны 405 нм в спектрофотометре для ELISA (SEAC Sirio S). Поверхностный плазмонный резонанс. Аффинность ST3232/10 для ЕрСАМ оценивают по процедуре поверхностного плазмонного резонанса (SPR, Biacore X, Biacore, Uppsala, Швеция) при проведении иммобилизации на чипе СМ 5 внеклеточного домена коммерчески доступного химерного слитого белка Fc-EpCAM (RD, США). Оценивают в рамках бивалентной модели кривые, полученные при инъекции ST3232/10 в диапазоне концентраций 500-7,8 нМ (программное обеспечение Biaevaluation software, версия 3.1, Biacore, Uppsala, Швеция). Иммуногистохимия. Для определения степени селективности используют замороженные срезы из технологической лаборатории TRISTAR (TRISTAR Technology laboratories (США, выполненные на основе 35 образцов из ткани рака легкого и 10 образцов ткани нормального легкого (cod.49561006), 35 образцов из ткани рака толстой кишки-прямой кишки и 10 образцов из ткани нормальной толстой кишки (cod.49561004),35 образцов из ткани с раком яичника и 10 образцов из нормальной ткани (cod.49561006) и слайдов,содержащих нормальную ткань (cod.49561001). ST3232/10 разбавляют до концентрации 5 мкг/мл с использованием блокирующего раствора (PBS+2,5% нормальной лошадиной сыворотки). Изотип сравнивают с отрицательным контролем, используя одинаковые копии микроскопических препаратов при такой же концентрации тестируемых элементов. Препараты обрабатывают в соответствии с инструкцией производителя и выявляют связывание антитела при использовании набора Vectastain ABC Elite Kit cod. PK6102 (Vector Laboratories). После гидратации ткани гасят активность эндогенной пероксидазы путем погружения препаратов в 0,3% раствор гидрогенпероксидазы на 5 мин. После промывки в PBS в течение 5 мин в трехкратном повторе и блоки-5 023679 рования среза образца путем обработки смесью PBS+2,5% лошадиной нормальной сыворотки, добавляют первичное антитело, разбавленное блокирующим раствором до концентрации 5 мкг/мл, на 2 ч при комнатной температуре. После 3 промывок PBS, препараты инкубируют со вторичным козьим противомышиным антителом, конъюгированным с биотином, в течение 30 мин и затем с комплексом авидинбиотин-пероксидаза в течение 30 мин. После дополнительной промывки, препараты инкубируют со свежим раствором DAB, входящим в субстратный набор Vector DAB/Ni (Cat. SK-4100), в течение 2 мин и реакцию останавливают в водопроводной воде. Противоточное окрашивание проводят при погружении в гематоксилин Мейера на 10 с. В итоге, препараты подвергают дегидратации в 75%, 80%, 95% и 100% этаноле, каждый раз по 1 мин, осветляют ксилолом, наслаивают синтетический агент и исследуют под микроскопом. Модель in vivo: аллотрансплантат бестимусных "голых" мышей. Линию клеток фибросаркомы L мыши, трансфицированную с использованием Trop-1 (L/Trop-1) или нетрансфицированную (L/вектор) человеческим Trop-1, инъецируют подкожно мышам в трех группах, где указанные мыши представляют собой бестимусных "голых" мышей (10 животных/группа). В день инокуляции животным вводят 200 мкг ST3232/10 (L/вектор+ST3232 и L/Trop-1+ST3232), эдреколомаб (L/Trop-1+Panorex) или неродственный IgG мыши (L/вектор и L/Trop-1). Три других введения осуществляют в дни 7, 15 и 22, как показано на чертеже стрелками. Во всех группах, рост опухоли оценивают при измерении циркулем на 50 день. Модель in vivo: ксенотрансплантат линии колоректальных клеток человека. Линию клеток карциномы толстой кишки человека KM12-SM, которая в нативном состоянии экспрессирует Trop-1, трансплантируют подкожно "голым" мышам. Проводят четыре обработки, один раз в неделю, с использованием 200 мкг ST3232/10 (группа введения ST3232), М 104 (группа введения М 104) или носителя (контрольная группа введения), начиная со дня введения инокулята. Прогрессирование опухоли оценивают до 30 дня. Результаты. Последовательности ST3232/10 участков, определяющих комплементарность гипервариабельного домена тяжелой цепи (VH) и участков, определяющих комплементарность вариабельного домена легкой цепи (VL), показаны в табл. I. Таблица I Последовательности гипервариабельных участков VH и VL антитела ST3232/10 Как было показано по результатам анализа в SDS-PAGE и по картине хроматографического профиля (фиг. 1 и 2), ST3232/10 является гомогенным по составу легкой и тяжелой цепи. Фактически, антитело подвергают аналитическому разделению в электрофорезе в тройном повторе в градиенте 4-12% Bis-TrisNuPAGE с использованием 1MES, в качестве буфера для разделения, и окрашивания раствором кумасси-красителя (все реактивы от компании Invitrogen, США), при этом, анализ в невосстановительных условиях (линии 1-3) выявил полосу с ожидаемой молекулярной массой (150 кДа) . В восстановительных условиях (линии 4-6) выявлялись лишь две полосы, соответствующие тяжелой (50 кДа) и легкой (25 кДа) цепям, и, таким образом было продемонстрировано отсутствие других контаминирующих продуктов. Этот результат был подтвержден хроматографическим профилем, где был элюирован единственный гомогенный пик при анализе ST3232/10 на колонке TSGK3000 (фиг. 2). Специфичность ST3232/10 для представителей семейства ЕрСАМ оценивали при проведении анализа FACS с использованием на линии клеток мыши, не экспрессирующих данный антиген, которые были трансфицированы ЕрСАМ (TROP-1) или высоко гомологичной молекулой TROP2. Как видно из фиг. 3, ST3232/10 обладает специфичностью в отношении ЕрСАМ, поскольку реагирует только сTrop-1-положительными клетками (панель А) и не реагирует с Trop-1-отрицательными клетками, такими как L-клетки (панель G) или L-Trop2 клетки (панель D). Аналогичный результат наблюдался с другими ЕрСАМ-специфичными антителами (панели В, Е, Н: М 104; С, I: HT29/26). В случае TROP2-L клеток в качестве положительного контроля было использовано антитело Т 16 (панель F). Дополнительно, ST3232/10 обладал сравнимой связывающей активностью для других ЕрСАМ антител, таких как М 104 (Klein СЕ. et al., 1990). Было продемонстрировано эффективное распознавание нативного антигена при проведении цитофлуорометрического анализа на панели линий раковых клеток,где наблюдались разные уровни ЕрСАМ молекул (табл. II). Таблица II Результаты анализа FACS, проведенного на панели линий опухолевых клеток различного происхождения с использованием ST3232/10 или М 104 антиTROP-1 антитела Линию клеток опухоли молочной железы MCF7 окрашивают Alexafluor-488-меченым ST3232/10 и анализируют под конфокальным микроскопом (фиг. 4). Конъюгат Alexa488-ST3232/10 демонстрирует ожидаемую картину окрашивания, при этом наибольшая интенсивность отмечается на границах клеткаклетка, а также выявляется окрашивание изолированных пятен (два примера показаны на фиг. 4 А и В). Иммунореактивность ST3232/10 оценивают по процедуре клетка-ELISA, в сравнении с другими доступными анти-ЕрСАМ антителами, на линиях опухолевых клеток, которые в естественном состоянии экспрессируют ЕрСАМ или которые трансфицированы человеческим транскриптом. В качестве репрезентативного примера, на фиг. 5 показаны результаты оценки ST3232/10 по процедуре клетка-ELISA на линии клеток карциномы толстой кишки человека НТ 29/26 (Klein CE et al., 1990), при использовании анти-ЕрСАМ антител. Показано, что ST3232/10 способен связываться с экспрессируемым клетками НТ 29, в природном состоянии, ЕрСАМ зависимым от дозы образом. В рамках данного теста, НТ 29/26, по всей видимости, связывается с ЕрСАМ с более высокой аффинностью, чем ST3232/10, как и другие антитела (данные не показаны). Аффинность ST3232/10 для ЕрСАМ оценивали по процедуре поверхностного плазмонного резонанса (SPR). Кривые, полученные при инъекции ST3232/10 в диапазоне концентраций 500-7,8 нМ, оценивают в рамках бивалентной модели (фиг. 6 А), при этом была продемонстрирована хорошая сочетаемость с данными анализа chi2 (1,97) и остаточными значениями 10% от наивысшего значения RU (140),зарегистрированного в данном эксперименте (фиг. 6 В). Значение KD для ST3232/10 составило 9,3 Е-10 (kon,= 7,75 Е 04297; koff=7,2E-058,48E-06). Аффинность ST3232/10 для ЕрСАМ была в 274 раза выше, чем выявленная при использовании SPR аффинность эдреколомаба (KD 2,55E-07, Naundorf et al,2002), тогда как для других анти-Trop-1 антител в литературе отсутствовала какая-либо информация относительно их аффинности. Что касается интернализации ST3232/10, был проведен тест с использованием FACS при инкубации антитела с ЕрСАМ-экспрессирующей клеточной линией при температуре 4 С и затем полученный комплекс был перенесен в условия температуры 37 С, где выдерживался в течение 30-120 мин. Не было выявлено различий по проценту положительных клеток или по среднему значению интенсивности флуоресценции инкубированных при температуре 37 С образцов относительно контрольного образца при температуре 4 С (табл. III), что указывало на отсутствие интернализации комплекса ЕрСАМ/антитело. Таблица III Оценка интернализации ST3232/10 в клеточной линии LoVo Селективность ST3232/10 также была исследована по процедуре иммуногистохимического анализа на микрочипах со срезами тканей, репрезентативных для нескольких твердых опухолей и нормальных тканей. Результаты обобщены в табл. IV и V, и соответствующие примеры проиллюстрированы на фиг. 7. Таблица IV Реактивность ST3232/10 на опухолях Криостатические препараты тканей солидного рака часто встречаемого типа (табл. IV) оценивают в сравнении с препаратами тканей соответствующего гистотипа нормальных органов (табл. V). Показано,что ST3232/10 способно связываться практически со всеми тестируемыми образцами тканей рака толстой кишки (94,1%) и карциномы яичника (88,6 %) и с большей частью препаратов ткани карциномы легкого (59,3%). Селективность ST3232/10 в отношении раковых клеток крайне высока для образцов тканей яичников, где ни один из образцов нормальной ткани не прореагировал с антителом, тогда как 88,6% опухолевых образцов были положительны в отношении ST3232/10. Кроме того, ST3232/10 прореагировал с более высокой частотой с достижением более сильного окрашивания с раковыми клетками относительно нормальных клеток в опухолях другого типа. Селективность для опухолей толстой кишки и легкого, в сравнении с нормальными тканями, продемонстрирована на фиг. 7, где показана явно положительная реакция на образцах опухолевой ткани, для которой характерна сверхэкспрессия ЕрСАМ, и отсутствие окрашивания нормальных тканей. Были использованы две разных модели животных для исследования активности антител in vivo в отношении опухолевого роста. В первом эксперименте, в трех группах бестимусных "голых" мышей(10 животных на группу) проводили подкожную (п/к) трансплантацию линии клеток мышиной фибросаркомы L-hTrop-1 и далее им вводили ST3232/10, эдреколомаб или не родственный мышиному IgG,один раз в неделю (200 мкг на мышь) в течение 4 недель, начиная с дня инокуляции. L клетки, не трансфицированные ЕрСАМ, были трансплантированы мышам в двух дополнительных группах и затем животным вводили ST3232/10 или контрольное антитело. Как показано на фиг. 8,ЕрСАМ-экспрессирующая опухоль (L/Trop) характеризуется более быстрым развитием, в сравнении с нетрансфицированными опухолями (L/вектор или L/вектор + ST3232). Дополнительно, ST3232/10 полностью и постоянно ингибировало рост ЕрСАМ-экспрессирующей опухоли и не препятствовало росту ЕрСАМ-отрицательных опухолей. С другой стороны, эдреколомаб (Panorex) также влиял на рост ЕрСАМ-экспрессирующей опухоли. Однако, опухоль продолжала быстро расти при прерывании лечения эдреколомабом. Вторая модель животных включала "голых" мышей, которым вводили ксенотрансплантат линии колоректальных клеток человека KM12SM и которые были использованы для подтверждения и дальнейшего развития полученных результатов. Указанным мышам вводили ST3232/10, мышиный IgG и другие анти-ЕрСАМ антитела, М 104, с использованием доз и режимов, идентичных таковым, описанным в предыдущем эксперименте (табл. VI, фиг. 9). Как показано в табл. VI, уровень образования опухоли у животных в группе введения ST3232/10 была ниже (56%), чем у животных в двух других группах Дополнительно, как видно из фиг. 9, ST3232/10 снижало рост опухоли и повышало латентность в развитии опухоли в сравнении с животными в других группах. Приведенные результаты поддерживают предположение относительно непосредственного терапевтического эффекта ST3232/10, который отличается от простого связывания с целевой молекулой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Анти-ЕрСАМ антитело или его функционально активный фрагмент, отличающееся тем, что вариабельная область тяжелой цепи антитела содержит все три гипервариабельных участка (CDR) с последовательностью SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6, а вариабельная область легкой цепи антитела содержит по меньшей мере один гипервариабельный участок (CDR) с последовательностью SEQ IDNO:8, SEQ ID NO:10 или SEQ ID NO:12. 2. Анти-ЕрСАМ антитело или его функционально активный фрагмент по п.1, которое способно полностью и постоянно ингибировать рост опухолей, экспрессирующих ЕрСАМ. 3. Анти-ЕрСАМ антитело по любому из пп.1, 2, которое представляет собой моноклональное антитело. 4. Анти-ЕрСАМ антитело по п.3, продуцируемое гибридомной клеточной линией, депонированной в Центре биотехнологии (Advanced Biotechnology Center, Генуя, Италия) с номером доступа PD06004. 5. Анти-ЕрСАМ антитело или его фрагмент по п.2, представляющее собой scFv, Fv фрагмент, Fab фрагмент, F(ab)2 фрагмент, мультимерное антитело, пептид или протеолитический фрагмент, содержащий эпитоп-связывающий участок. 6. Анти-ЕрСАМ антитело по п.5, отличающееся тем, что химерный белок представляет собой химерный белок, состоящий из участков антитела человека и мыши. 7. Анти-ЕрСАМ антитело по п.2, отличающееся тем, что антитело представляет собой химерный белок, слитый с цитокином, белком из семейства авидинов, биотином, меченым биотином или другими эффекторными белками, или соединен с маркером для визуализации. 8. Анти-ЕрСАМ антитело по п.2, где антитело представляет собой антитело человека или гуманизированное антитело. 9. Нуклеиновая кислота, содержащая последовательность, кодирующую антитело или его функционально активный фрагмент по любому из предшествующих пунктов, или последовательность нуклеиновой кислоты, которая гибридизируется с указанной выше последовательностью нуклеиновой кислотой в жестких условиях, или последовательность нуклеиновой кислоты, полученная на основе указанной в соответствии с принципом вырожденности генетического кода. 10. Нуклеиновая кислота по п.9, содержащая по меньшей мере одну из следующих последовательностей: SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 и SEQ ID NO:11. 11. Вектор экспрессии, содержащий нуклеиновую кислоту по любому из пп.9 или 10. 12. Клетка-хозяин, трансформированная вектором экспрессии по п.11. 13. Гибридомная клеточная линия, продуцирующая анти-ЕрСАМ антитело по пп.1-3. 14. Гибридомная клеточная линия по п.13, представляющая собой гибридому, депонированную в Центре биотехнологии в Генуе (Advanced Biotechnology Center, Генуя, Италия) с номером доступаPD06004, продуцирующая моноклональное антитело по п.8. 15. Применение анти-ЕрСАМ антитела по пп.1-8 в качестве лекарственного средства для лечения опухоли. 16. Применение анти-ЕрСАМ антитела по п.15, где опухоль выбрана из группы, состоящей из карциномы толстой кишки, карциномы молочной железы, карциномы желудка, карциномы яичника, карциномы мочевого пузыря или карциномы легкого. 17. Фармацевтическая композиция для лечения опухоли, содержащая эффективное количество антитела или его фрагментов по любому из пп.1-8 и фармацевтически приемлемый носитель или разбавитель. 18. Фармацевтическая композиция по п.17, используемая при радиоиммунотерапии. 19. Фармацевтическая композиция по п.17 или 18, содержащая по крайней мере еще одно опухолеспецифическое антитело в той же или в стандартной дозе. 20. Фармацевтическая композиция по п.19, отличающаяся тем, что опухолеспецифическое антитело представляет собой ЕрСАМ антитело, отличное от антитела по пп.1-8. 21. Применение анти-ЕрСАМ антитела по пп.1-8 в качестве средства для диагностики опухолей. 22. Применение анти-ЕрСАМ антитела по п.21 в качестве средства для диагностики опухолейin vivo. 23. Растворимая композиция для инъекции для проведения опухолевой диагностики in vivo, содержащая анти-ЕрСАМ антитело по п.22. 24. Способ иммунодетекции в образце антигена, способного связываться с антителом или его фрагментом по любому из пп.1-7, включающий стадию инкубации в соответствующих условиях данного образца с антителом или его фрагментом по пп.1-8 и последующую детекцию комплекса антиген-антитело. 25. Диагностический набор для использования в способе по п.24, включающий антитело или его фрагмент по любому из пп.1-8 и средство детекции комплекса антиген-антитело.
МПК / Метки
МПК: A61K 39/395, C07K 16/30
Метки: применение, анти-epcam, антитело
Код ссылки
<a href="https://eas.patents.su/20-23679-anti-epcam-antitelo-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Анти-epcam антитело и его применение</a>
Предыдущий патент: Агонисты mglu 2/3
Следующий патент: Интерлейкин-1 бета в косметических композициях и способы его использования
Случайный патент: Способ определения объема напитка и соответствующая система