Улучшение клеточного роста
Формула / Реферат
1. Способ улучшения клеточного роста клеточной линии яичников китайских хомячков, где рост клеточной линии повышают путем встраивания гетерологичного гена DHFR, минигена DHFR, мутанта DHFR или кодирующей последовательности DHFR из вида, отличного от вида, из которого получена клеточная линия, отличающийся тем, что повышают активность дегидрофолатредуктазы (DHFR) в клеточной линии, в которой DHFR не служит селективным маркером и/или маркером амплификации для гена-мишени, а клеточная линия представляет собой клеточную линию, дефектную по DHFR или со сниженным уровнем DHFR, причем клеточная линия, дефектная по DHFR, является клеточной линией, которая функционально не экспрессирует DHFR фермент, а клеточная линия со сниженным уровнем DHFR является клеточной линией с низкими уровнями эндогенного DHFR.
2. Способ по п.1, в котором ген, кодирующий DHFR, и ген-мишень (GOI), кодирующий целевой продукт, последовательно встраивают в клеточную линию, и кассета экспрессии DHFR, включающая DHFR ген, предпочтительно представляет собой предпочтительно экспрессионную единицу только млекопитающего, которую встраивают в клеточную линию во время последующей стадии встраивания DHFR, и/или селекцию гена-мишени, который кодирует целевой продукт, осуществляют в отсутствии метотрексата (MTX).
3. Способ по пп.1, 2, в котором клетки клеточной линии содержат по меньшей мере 1, предпочтительно по меньшей мере 3 копии гена DHFR.
4. Способ по пп.1-3, в котором клеточная линия уже трансфицирована геном-мишени (GOI).
5. Способ по пп.1-4, в котором клеточная линия представляет собой клеточную линию млекопитающего, такую как клеточная линия CHO, предпочтительно клеточная линия представляет собой CHO-DG44 или CHO-DUKX-B11, предпочтительно CHO-DG44.
6. Способ по пп.3-5, в котором селекцию гена-мишени, который кодирует целевой продукт, осуществляют в присутствии гипоксантина и тимидина (HT) и в отсутствие MTX.
7. Способ по пп.1-6, в котором DHFR встраивают в клеточную линию с помощью плазмид, отличной от плазмиды с геном-мишенью, кодирующим целевой продукт.
8. Способ по п.7, в котором трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно или параллельно с плазмидой, содержащей ген-мишень.
9. Способ по п.8, в котором трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно с плазмидой, содержащей ген-мишень, причем клеточную линию предварительно трансфицируют первой плазмидой, которая содержит ген-мишень, функционально связанный с селективным маркером, отличным от DHFR.
10. Способ по пп.1-9, в котором клеточная линия содержит по меньшей мере один другой маркер амплификации, такой как глутаминсинтетаза (GS), аденозиндеаминаза (ADA) или цитозиндеаминаза (CDA) и/или по меньшей мере один другой селективным маркер, такой как ген, обусловливающий устойчивость к пуромицину, неомицину или блеомицину.
11. Способ создания продуктивной линии клеток-хозяев, отличающийся тем, что (а) трансфицируют клетку-хозяина, дефектную по DHFR или с пониженным уровнем DHFR, по меньшей мере одним геном-мишени, кодирующим целевой продукт, который находится по меньшей мере на одной первой плазмиде и функционально связан с селективным маркером/амплификации, отличным от DHFR, (б) встраивают кассету экспрессии DHFR, локализованную на плазмиде, отличной от плазмиды, указанной на стадии (а), (в) отбирают стабильно трансфицированные клетки с помощью селективного маркера, указанного на стадии (а), где характеристики роста и клеточной плотности, полученные у указанной клетки, лучше и выше, чем у соответствующей нетрансфицированной клеточной линии, причем клеточная линия, дефектная по DHFR, является клеточной линией, которая функционально не экспрессирует DHFR фермент, а клеточная линия со сниженным уровнем DHFR является клеточной линией с низкими уровнями эндогенного DHFR.
12. Способ по п.11, в котором порядок стадий (а) и (б) изменяют и/или DHFR представляет собой единицу, которая экспрессируется только в клетках млекопитающего, которую встраивают в клеточную линию на стадии (б).
Текст
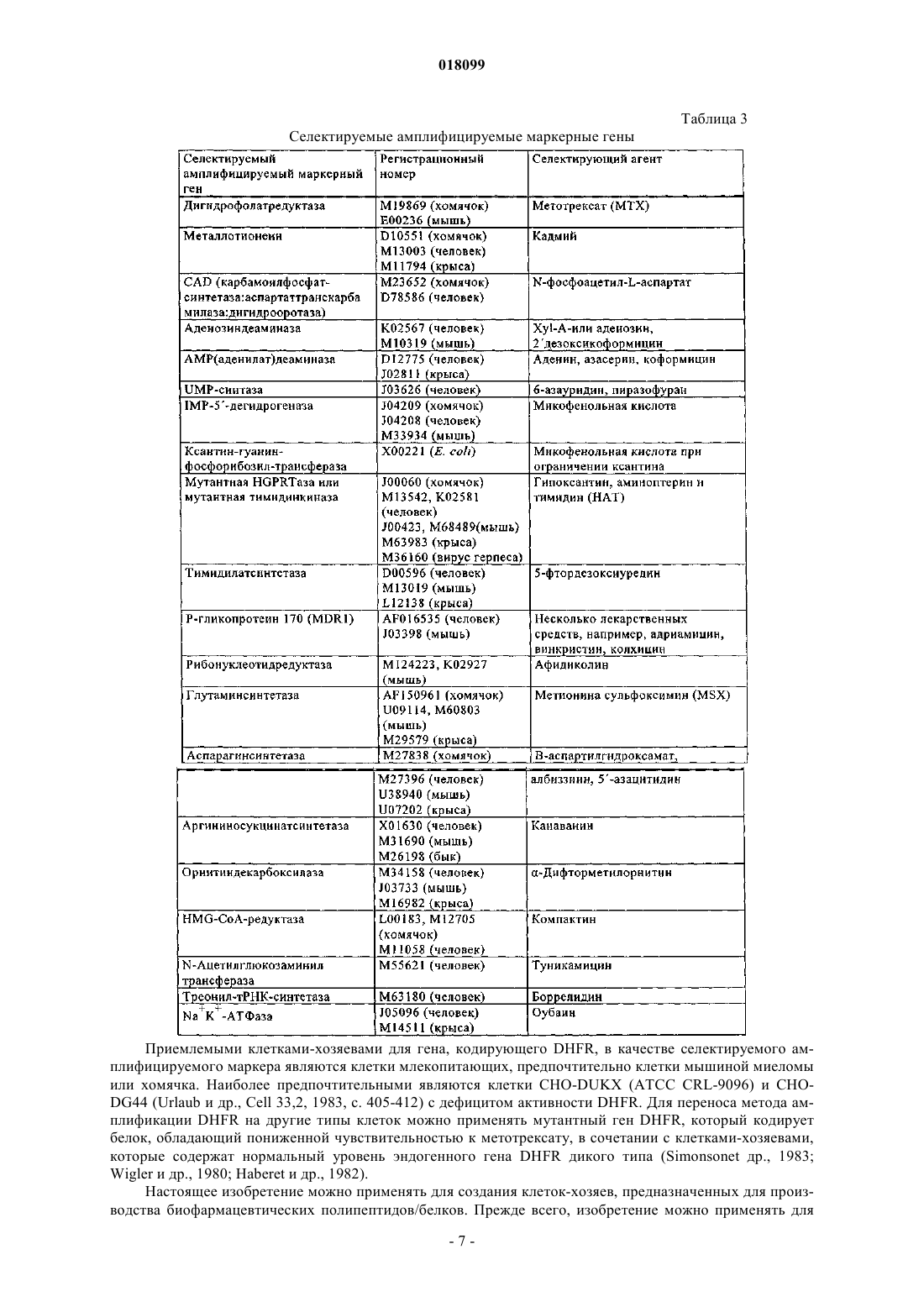
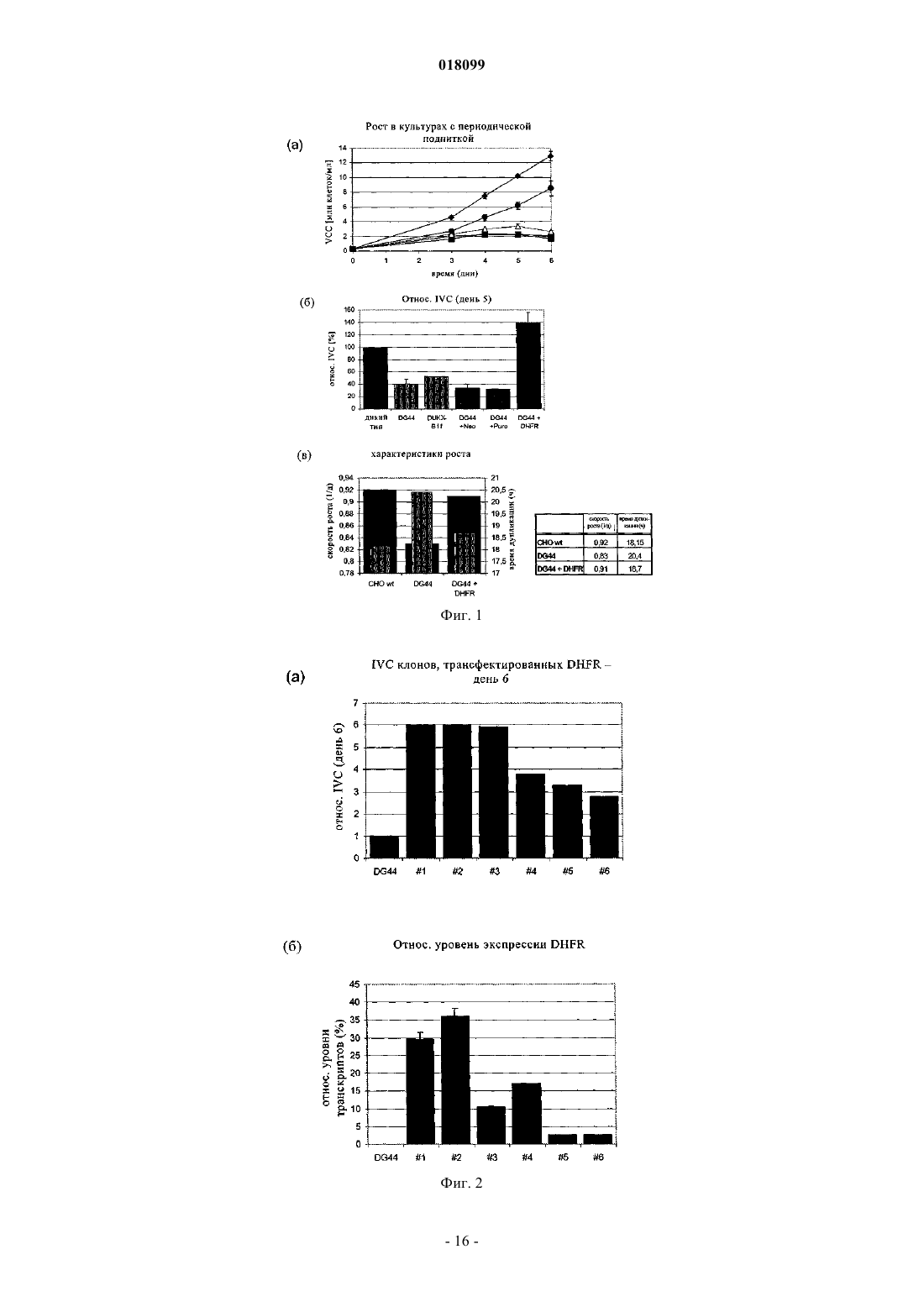
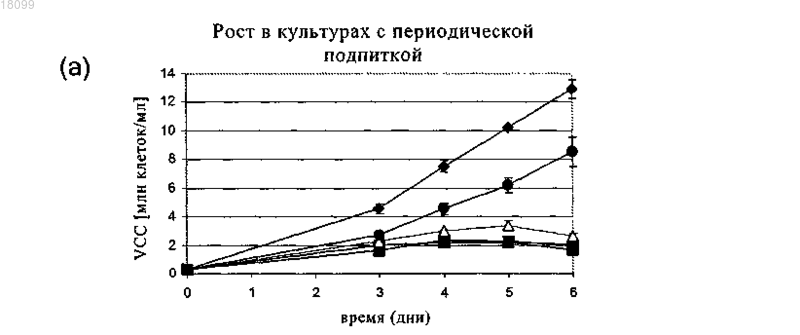
Изобретение относится к области технологии культивирования клеток. В изобретении описан способ улучшения клеточного роста, прежде всего роста клеток-хозяев, которые продуцируют биофармацевтический продукт. В изобретении описан также способ получения белков с помощью клеток, созданных посредством описанного способа.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ФАРМА ГМБХ УНД КО. КГ (DE) Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к области технологии культивирования клеток. Оно относится к способу улучшения клеточного роста, а также к способу создания продуктивной линии клеток-хозяев. Изобретение относится также к способу получения белков с помощью клеток, созданных посредством описанного способа. Известный уровень техники Рынок биофармацевтических средств, предназначенных для применения в терапии человека, продолжает увеличиваться с высокой скоростью, при этом в 2003 г. в клинических условия прошли оценку 270 новых биофармацевтических средств, и их примерная стоимость составила 30 млрд (Werner, 2004). В настоящее время все возрастающее количество биофармацевтических средств получают в клетках млекопитающих благодаря их способности осуществлять правильный процессинг и модификацию человеческих белков. Таким образом, успешное производство биофармацевтических средств в клетках млекопитающих с высоким выходом имеет решающее значение и зависит от характеристик рекомбинантной моноклональной клеточной линии, применяемой в этом процессе. В процессах получения биофармацевтических продуктов выход определяется двумя факторами: удельная продуктивность (Pspec) клетки-хозяина и IVC, общее количество жизнеспособных клеток в различные моменты времени, которые продуцируют требуемый белок. Эту корреляцию выражают следующей формулой: Y = PspecIVC. Таким образом, стандартные подходы повышения выхода продукта могут быть основаны на повышении как производительной способности (продуктивности) клетки-хозяина, так и плотности жизнеспособных клеток в биореакторе. Один из путей повышения IVC состоит в улучшении характеристик клеточного роста, что предусматривает создание клеток, которые растут быстрее, и повышение максимальной клеточной плотности. Усиленный клеточный рост оказывает заметное воздействие на несколько аспектов процесса получения биофармацевтических продуктов: укорачивает период размножения, что приводит к пролонгированному времени развития клеточной линии; повышает эффективность после одноклеточного клонирования и замедляет последующий рост; укорачивает временные рамки в процессе масштабного производства, прежде всего в случае инокулята для биоректора, предназначенного для крупномасштабного производства; повышает выход продукта в течение времени ферментации в результате пропорциональной корреляции между IVC и выходом продукта. И, наоборот, низкие уровни IVC снижают выход и/или удлиняют время ферментации. Фермент дигидрофолатредуктаза (DHFR) является одним из основных ферментов нуклеотидного синтеза. Он катализирует восстановление дигидрофолата с образованием тетрагидрофолата, универсального медиатора C1-единиц при синтезе конструктивных элементов пурина и других метаболических путях. В производстве биофармацевтических продуктов и в академических исследованиях DHFR широко применяют в качестве маркера селекции и амплификации для выращивания в условиях селекции стабильно трансфектированных клеточных линий. При этом экспрессия DHFR функционально связана с экспрессией представляющего интерес гена (GOI), например, в экспрессионной кассете для продукта гена. Таким образом, путем придания устойчивости к селективным условиям с помощью DHFR опосредованно увеличивают количество GOI-экспрессирующих клеток. Эту функцию, как правило, опосредуют/создают с помощью бицистронной экспрессии обоих генов или, по меньшей мере, их совместной локализации на одной и той же плазмиде. Поскольку DHFR является не доминантным маркером, то эту систему в основном применяют в клетках, лишенных эндогенной DHFR-активности. С тех пор как в 1980 г. стали доступны dhfrнегативные клетка яичника китайского хомячка (CHO), такие как CHO-DG44 и CHO-DUKX (B11), они быстро превратились в наиболее предпочтительную систему клеток-хозяев и в настоящее время их наиболее часто применяют во всем мире в биофармацевтической индустрии в качестве производственной базы, основанной на клетках млекопитающих. Фермент DHFR является одним из имеющих решающее значение ферментов в пути биосинтеза пуринов. Таким образом, клетки, в которых отсутствует DHFR, являются нежизнеспособными, если дефицит DHFR не компенсируют путем добавления нуклеотидных предшественников гипоксантина и тимидина (HT) в культуральную среду. При создании изобретения неожиданно было установлено, что даже в дополненной HT среде CHOклетки, дефектные по dhfr, растут существенно медленнее и имеют значительно меньшую плотность по сравнению с родительскими CHO-клетками дикого типа (фиг. 1). Указанная пониженная способность к росту, что продемонстрировано в настоящем изобретении дляdhfr-негативных клеток (таких как клетки CHO-DG44) или клеток с очень низким уровнем эндогенногоdhfr, оказывает отрицательное воздействие на некоторые аспекты получения биофармацевтических продуктов: удлиняет период размножения, что приводит к пролонгированному времени развития клеточной линии; снижает эффективность после одноклеточного клонирования и замедляет последующий рост; удлиняет временные рамки в процессе масштабного производства, прежде всего в случае инокулята для производственного ферментера, предназначенного для крупномасштабного производства; снижает выход продукта в одном цикле ферментера. Эти недостатки непосредственно связаны с характеристиками роста клеток-продуцентов (например,CHO-DG44 или DUKX (B11. Они имеют место, например, когда эти клетки применяют в сочетании со следующими системами селекции и амплификации: система на основе глутаминсинтетазы (GS), неомицина, пуромицина, блеомицина и других. Для компенсации дефицита роста в этих клетках, прежде всего применяемых для получения биофармацевтических средств клеточных линий, наибольшие усилия были направлены на улучшение культуральной среды путем введения способствующих росту добавок, таких как углеводы, нуклеозиды, микроэлементы, белковые гидролизаты, растительные экстракты и т.д. Можно, например, несколько повышать рост dhfr-негативных клеток путем добавления белковых гидролизатов в культуральную среду, но при этом не достигается уровень роста, характерный для клеток дикого типа. Таким образом, существует большая необходимость в улучшении ростовых характеристик клетокхозяев, которые являются продуцентами, прежде всего клеток с низким уровнем экспрессии DHFR или клеток, у которых отсутствует эндогенная экспрессия DHFR, таких как клетки линии CHO-DG44. Кроме того, очевидно, что повышенный клеточный рост и в результате более высокий уровень IVC в процессе ферментации имеет преимущество, когда требуется большая биомасса, например, для получения высокого выхода продукта при кратковременной ферментации, для сбора большего количества клеток для выделения, очистки или характеризации внутриклеточных или связанных с клеткой компонентов или для укорочения продолжительности периода размножения, одноклеточного клонирования и масштабного культивирования. Краткое изложение сущности изобретения Основной задачей, положенной в основу настоящего изобретения, является улучшения клеточного роста в процессе получения биофармацевтического продукта с целью увеличения клеточной плотности и в результате выхода продукта. Эта задача согласно настоящему изобретению решается путем интродукции кассеты экспрессииDHFR в клетки-продуценты. Таким образом, при создании изобретения неожиданно было установлено,что усиленный клеточный рост получают в результате гетерологичной экспрессии фермента дигидрофолатредуктазы (DHFR). В настоящем изобретении ген DHFR не служит общепринятой цели в качестве маркера селекции для другого гена, т.е. представляющего интерес гена (GOI), а обладает независимой функцией повышения клеточного роста. В этом системе ген DHFR не требуется функционально связывать/сшивать с одной или несколькими другими кассетами экспрессии. Он может находиться на той же плазмиде, что и GOI,или его можно экспрессировать из другого вектора. Если оба гена находятся в различных векторных конструкциях, плазмидами можно котрансфектировать клетку или их можно последовательно вносить в клетку. При создании настоящего изобретения неожиданно впервые было установлено, что дефект dhfr приводит к пониженному клеточному росту. Таким образом, можно продемонстрировать, что реинтродукция DHFR может решать указанную проблему. Реинтродукия DHFR-трансгена не только приводит к снижению времени дупликации, но также к увеличению IVC до уровня дикого типа или даже сверх него (фиг. 1). Это усиливающее рост действие можно обнаруживать не только для двух различных клеточных линий DG44, но также для клеток линииCHO DUKX B11, трансфектированных функциональным геном DHFR. Однако трансфекция экспрессионными конструкциями, несущими кассеты, обусловливающие устойчивость к пуромицину или неомицину, не приводит к изменениям характеристик клеточного роста. Это свидетельствует о том, что повышение роста не является следствием селекции и/или культивирования стабильных трансфектантов, а вызывается воссозданием функциональной экспрессии DHFR в dhfr-негативных CHO-клетках. Кроме того, для гетерологичной экспрессии DHFR характерна зависимость от дозы гена, что свидетельствует о том, что характеристики роста стабильных клеточных субклонов возрастают пропорционально экспрессии активного белка DHFR (фиг. 2(а), (б. Важно отметить, что это действие, вероятно, не относится к клеточным линиям, у которых происходит амплификация гена DHFR в результате обработки метотрексатом (МТХ) (Gu и др., 1992, Pendse и др., 1992). Это может быть результатом либо достижения пороговых уровней, выше которых активныйDHFR более не вызывает усиление роста, либо компенсирующим действием ингибитора МТХ, который в высоких концентрациях, превышающих молекулярную концентрацию фермента DHFR, должен "перевешивать" амплификацию гена dhfr, что приводит к снижению чистой активности DHFR и, как следствие, пониженному клеточному росту. Настоящее изобретение относится к общей проблеме усиления роста клеточных линий, прежде все-2 018099 го продуцирующих клеточных линий, которые имеют низкий уровень экспрессии DHFR или у которых отсутствует эндогенная экспрессия DHFR. В этих клетках характеристики роста могут существенно улучшаться с помощью гетерологичной экспрессии DHFR. Гетерологичная экспрессия DHFR в клетках-хозяевах, дефектных по dhfr, имеет дополнительные преимущества, которые проявляются в снижении временных рамок, требуемых для процесса размножения и инокуляции при ферментации, и в повышении уровня IVC, например, в производственных процессах, и в результате к большему выходу продукта. Клетки-хозяева и способы, предлагаемые в изобретении, можно применять также при получении биофармацевтических средств, прежде всего, в которых используют системы клеток-хозяев, основанные на CHO-DG44 или CHO-DUKX-B11. Кроме того, их можно применять в том случае, когда не требуются высокие выходы рекомбинантного белка, например, для очистки/структурного анализа при исследованиях, или когда требуется большая клеточная биомасса, например, для выделения/изучения клеточных компонентов, таких как нуклеиновые кислоты или белки. В предпочтительном варианте осуществления настоящего изобретения клетки-хозяева и способы,предлагаемые в настоящем изобретении, можно объединять с системой(ами) селекции, таким как система на основе глутаминсинтетазы (GS), аденозиндеаминазы (ADA), цитозиндеаминазы (CDA), пуромицина, неомицина, блеомицина и т.д. Это может приводить к повышению скоростей роста и более высокой клеточной плотности в процессе ферментации. Настоящее изобретение не является очевидным из существующего уровня техники.CHO-клетки были приняты для изучения генетики соматических клеток в 1957 г. (PUCK, 1957). Путем мутагенеза исходной клеточной линии K1 Urlaub и Chasin создали клетки, дефектные по DHFR линии "CHO DG44" (Urlaub и Chasin, 1980), у которых имелась гомозиготная делеция хромосомного dhfrлокуса (Urlaub и др., 1983). Указанными авторами не были изучены особенности роста этой вновь созданной клеточной линии. Клетки линии CHO DG44 вскоре стали применять в качестве предпочтительных клеток в методе трансфекции, для осуществления которого использовали экспрессионные векторы, несущие функциональный ген dhfr в сочетании с кассетой экспрессии для представляющего интерес гена (GOI). DHFR представляет собой не доминантный селектирующий маркер и поэтому наиболее пригоден для применения в клетках, в которых отсутствует DHFR. Однако было установлено, что его можно применять также в клетках-хозяевах, которые обладают эндогенной DHFR-активностью, например, путем селекции с помощью второго доминантного маркера (Kaufman и др., 1986), или мутантных или бактериальных геновdhfr (Simonsen и Levinson, 1983; Asselbergs и Widmer, 1995). В условиях селекции гетерологичная экспрессия DHFR позволяет трансфектированным клеткам выживать и размножаться. Однако не было установлено, что DHFR придает преимущество с позиций роста вне зависимости от его функции в качестве маркера селекции и в неселективных условиях. Ген dhfr принадлежит к маркерам амплификации, позволяющим осуществлять совместную амплификацию чужеродных генов после обработки фолатным аналогом метотрексатом (МТХ) (Schimke и др.,1978; Alt и др., 1978; Pallavicini и др., 1990). Из этого следует, что совместная амплификация GOI и dhfr не зависит от того находятся ли оба гена на одной и той же плазмиде (Kaufman и Sharp, 1982). После этого были опубликованы стратегии осуществления экспрессии для производства рекомбинантных антител,в которых либо обе цепи антитела локализованы на одной и той же плазмидной ДНК вместе с геном dhfr(Page и Sydenham, 1991), при этом только одна цепь функционально связана с кассетой экспрессии dhfr(Fouser и др., 1992), либо dhfr кодируется отдельной применяемой для совместной интеграции плазмидой(Wurm и Jordan, 2003). Известны публикации, свидетельствующие о том, что наличие структурной связи гена dhfr и GOI на одной и той же плазмидной ДНК не является предпосылкой для коамплификации, поскольку различные ДНК-конструкции, применяемые для котрансфекции, имеют тенденцию к совместной интеграции в соседние хромосомные локусы (Wurm F.M. и Jordan M., Gene Transfer and Gene Amplification in MammalianCells в Gene Transfer and Expression in Mammalian Cells, изд-во S.C. Makrides Elsevier Science B.V., 2003,с. 309-335). В этом плане важно отметить также, что DHFR служит в качестве маркера селекции и/или амплификации для чужеродного GOI, с которым он имеет функциональную связь, несмотря на структурное разобщение. В противоположность этому настоящее изобретение основывается на том факте, что гетерологичный DHFR, помимо его хорошо известной функции в качестве маркера селекции/амплификации для GOI,обладает совершенно независимой функцией улучшения клеточного роста. Важно отметить, что известны многочисленные публикации о связи высокого уровня экспрессииDHFR с пониженным клеточным ростом, что является противоположным требуемому действию амплификации гетерологичного гена. В проведенных ранее исследованиях на Escherichia coli и Saccharomycescerevisiae продемонстрировано, что увеличение количества копий гена dhfr сопровождалось снижением удельной скорости роста (Bailey и др., 1986). Gu с соавторами обнаружили понижение скорости роста экспрессирующих бета-галактозидазу клеток линии CHO-DG44 после амплификации гена dhfr в результате обработки МТХ (Gu и др., 1992). Аналогичные данные получены Pendse с соавторами при использо-3 018099 вании вирусного трансгена, сшитого с DHFR (Pendse и др., 1992). Важно отметить, что в обоих этих исследованиях не использовали клетки, экспрессирующие только DHFR, что не позволяет сделать заключение об индивидуальном вкладе применяемых нескольких трансгенов. Следует учитывать, что в этих исследованиях только сравнивали характеристики роста экспрессирующих dhfr амплифицированных и неамплифицированных клеток. Нетрансфектированные клетки CHO-DG44 не были включены в исследования. Snapka с соавторами выявили снижение клеточного роста по мере увеличения количества копий гена dhfr в клетках, выведенных из линии NIH3T3 (Snapka и др., 1997). Важно отметить, что в отличие от предполагаемого в указанной публикации механизма, эти исследователи обнаружили также другую прикрепленную линию клеток, которые росли до достижения более высокой клеточной плотности после опосредуемой MTX амплификации dhfr. Эти исследователи предположили, что это явление связано с пониженным ингибированием контакта, однако такое предположение является неуместным для клеток,растущих в суспензии. В целом, в настоящем изобретении впервые продемонстрировано, что гетерологичная экспрессияDHFR приводит к улучшению характеристик роста CHO-клеток, прежде всего клеток линии CHO DG44 и CHO DUXX-(B11). Эту функцию DHFR можно применять также для усиления скорости клеточного рост в других dhfr-негативных или имеющих пониженный уровень dhfr клеточных линиях. Описание чертежей На чертежах показано: на фиг. 1 - улучшенный рост под воздействием гетерологичного фермента DHFR; на фиг. 1(а) - кривые клеточного роста при использовании периодических процессов с подпиткой. Клетки выращивали во встряхиваемых колбах в течение 5 дней и подпитывали каждые 24 ч, начиная со дня 3. Количество жизнеспособных клеток (VCC) определяли ежедневно с помощью системы CEDEX. Сравнивали следующие клетки: CHO-клетки дикого типа (WT) ( ; n=4); dhfr-негативные клетки линииDUX-B11 (; n=2) и две линии клеток DG44 из различных источников ( ; n=4); пулы DG44-клеток,стабильно трансфектированных векторами, которые несут гены, обусловливающие устойчивость к неомицину (n=6, данные не представлены) или пуромицину (n=6, данные не представлены), или ген dhfr; n=9). Представлена репрезентативная кривая, построенная по пяти независимым экспериментам; на фиг. 1(б) - относительные уровни IVC клеток, указанных в (а). Рассчитывали общую занятую клетками площадь в день 5 и строили график зависимости от уровней WT-клеток, который принимали за 100%. "Усы" представляют собой стандартные отклонения, полученные по меньшей мере по трем независимым экспериментам; на фиг. 1(в) - характеристики роста в процессе продолжительного культивирования. Клетки поддерживали при клеточной плотности от 0,3 до 2,510 клеток/мл и расщепляли каждые 2-3 дня, осуществляя 8 пассажей. Рассчитывали скорость роста (черные прямоугольники) и время дупликации (затемненные прямоугольники) и строили график зависимости от уровня этих показателей в CHO-клетках дикого типа, DG44 и трансфектированных dhfr DG44-клетках; на фиг. 2 - зависимость усиления роста от дозы; на фиг. 2(а) - усиленный клеточный рост трансфектированных DHFR субклонов. Шесть стабильных трансфектированных DHFR клеточных пулов создавали путем гетерологичной интродукции кассеты экспрессии DHFR в клетки линии CHO DG44. Из них получали клональные клеточные популяции с помощью основанного на FACS одноклеточного клонирования и подвергали ферментации с периодической подпиткой. Рассчитывали IVC DHFR-клонов в день 6 и строили график зависимости от уровня IVC родительской клеточной линии DG44, который принимали за 1; на фиг. 2(б) - относительные уровни экспрессии DHFR. Общую РНК выделяли из вышеуказанных клеток и осуществляли количественную оценку с помощью ПЦР в реальном времени для определенияDHFR-специфических транскриптов мРНК. Для стандартизации применяли бета-тубулин. Подробное описание изобретения Определения. В целом, в вариантах осуществления изобретения понятие "содержит" или "содержащий" включает более конкретное понятие "состоящий из". Кроме того, формы в единственном и множественном числе не следует рассматривать как ограничивающие. Понятия, которые применяют при описании настоящего изобретения, имеют указанные ниже значения. Понятие "дефектные по DHFR" имеет такое же значение, что и "DHFR-негативный". Оно относится к клеткам, в которых отсутствует функциональная экспрессия фермента DHFR. Это может быть обусловлено либо гомозиготной делецией, либо мутацией гена DHFR. Понятие "с пониженным уровнем DHFR" относится к клеткам с низкими уровнями эндогенногоDHFR, например к клеткам, гетерозиготным по гену DHFR. Понятие "общая концентрация жизнеспособных клеток в течение времени" (IVC) означает площадь под кривой роста клеток в зависимости от времени и, как правило, понятие применяют для описания характеристики роста клеток, например, в производственных процессах, которые проходят в течение от нескольких дней до недель. Понятие "клеточная культура" означает множество клеток, культивируемых в одном контейнере в условиях, пригодных для роста клеток. Понятие "клетка-хозяин" согласно настоящему изобретению относится к клеткам, таким как клетки хомячка, предпочтительно клетки BHK21, BHK TK-, CHO, CHO-K1, CHO-DUKX, CHO-DUKX B1 иCHO-DG44, или производным/потомству любой из указанных клеточных линий. Наиболее предпочтительными являются клетки CHO-DG44, CHO-DUKX, CHO-K1 и BHK21 и еще более предпочтительно клетки CHO-DG44 и CHO-DUKX. В другом варианте осуществления настоящего изобретения понятие"клетки-хозяева" относится также к клеткам мышиной миеломы, предпочтительно клеткам NS0 и Sp2/0,или производным/потомству любой из указанных клеточных линий. Примеры мышиных клеток и клеток хомячка, которые можно применять согласно изобретению, обобщены также в табл. 1. Однако согласно настоящему изобретению, прежде всего для получения биофармацевтических белков, можно применять также производные/потомство этих клеток, других клеток млекопитающих, включая, но не ограничиваясь только ими, клеточные линии человека, мышей, крыс, обезьян и грызунов, или эукариотические клетки, включая, но не ограничиваясь только ими, клетки дрожжей, насекомых и растений. Таблица 1 Линии клеток хомячка и мыши, применяемые в качестве клеток-продуцентов Наиболее предпочтительными являются клетки-хозяева, которые созданы так, что они адаптированы и их можно полностью культивировать в бессывороточных условиях и необязательно в средах, которые не содержат каких-либо белков/пептидов животного происхождения. В продажу поступают такие среды, как среда Хэма F12 (фирма Sigma, Дейзенхофен, Германия), RPMI-1640 (фирма Sigma), модифицированная по методу Дульбекко среда Игла (DMEM; фирма Sigma), минимальная поддерживающая среда (MEM; фирма Sigma), среда Дульбекко, модифицированная по методу Исков (IMDM; Sigma), CDCHO (фирма Invitrogen, Карлсбад, шт. Калифорния), CHO-S-Invtirogen, бессыворотчная CHO-среда(фирма Sigma) и не содержащая белки CHO-среда (фирма Sigma), которые являются примерами питательных растворов. Любую из сред можно дополнять при необходимости различными соединениями,примерами которых являются гормоны и/или другие факторы роста (такие как инсулин, трансферрин,эпидермальный фактор роста, инсулиноподобный фактор роста), соли (такие как хлорид натрия, фосфат кальция, магния), буферы (такие как HEPES), нуклеозиды (такие как аденозин, тимидин), глутамин, глюкоза или другие эквивалентные источники энергии, антибиотики, микроэлементы. Можно включать также любые другие необходимые добавки в соответствующих концентрациях, которые известны специалистам в данной области. В настоящем изобретении предпочтительно применяют бессывороточную среду,но для культивирования клеток-хозяев можно применять также среды, дополненные приемлемым количеством сыворотки. Для выращивания и селекции генетически модифицированных клеток, экспрессирующих селектируемый ген, в культуральную среду добавляют приемлемый селектирующий агент. Понятие "белок" применяют взаимозаменяемо с понятием аминокислотные последовательности или полипептид, и оно относится к полимерам аминокислот любой длины. Эти понятия включают также белки, которые подвергнуты посттрансляционным модификациям с помощью реакций, которые включают, но не ограничиваясь только ими, гликозилирование, ацетилирование, фосфорилирование или процессинг белков. Модификации и изменения, например, слияния с другими белками, замены, делеции или инсерции в аминокислотной последовательности можно осуществлять в структуре полипептида так, чтобы молекула сохраняла при этом ее биологическую функциональную активность. Например, можно осуществлять определенные замены в аминокислотной последовательности в полипептиде или в кодирующей его нуклеотидной последовательности и получать белок с аналогичными свойствами. Экспрессионный вектор, который несет представляющий интерес ген, кодирующий представляющий интерес белок, может содержать также селектируемый амплифицируемый маркерный ген. Понятие "селективные условия" относится к условиям, в которых не могут расти или выживать клетки, не содержащие соответствующий селектирующий маркер. Селективные условия можно создавать, используя среду, содержащую добавки, такие как антибиотики, или лишенную компонентов,имеющих решающее значение для роста. Понятие "селектируемый маркер" или "селектирующий маркер (маркер для селекции)" относится к маркерам, которые позволяют расти/выживать клеткам в селективных условиях. Например, в случае применения в качестве селектируемого маркера пуромицин-N-ацетилтрансферазы (PAC) только клетки,которые содержат ген PAC, могут выживать в селективных средах, содержащих антибиотик пуромицин. Понятие "амплифицируемый маркер" или "маркер для амплификации" относится к генам, которые амплифицируются (например, удваиваются, утраиваются, многократно увеличиваются) в присутствии агента для селекции или после обработки агентом для селекции (например, метотрексатом (MTX, что приводит к увеличению количества копий маркера (например, DHFR) и окружающих областей ДНК."Селектируемый амплифицируемый маркерный ген", как правило, кодирует фермент, который необходим для роста эукариотических клеток в указанных условиях. Например, селектируемый амплифицируемый маркерный ген может кодировать DHFR, ген которой амплифицируется, когда клеткухозяина, трансфектированную им, выращивают в присутствии селектирующего агента, т.е. метотрексата(MTX). Приведенные в табл. 3 в качестве примеров, не ограничивающих объем изобретения, селектируемые агенты представляют собой также амплифицируемые маркерные гены, которые можно использовать при осуществлении настоящего изобретения. Обзор селектируемых амплифицируемых маркерных генов, представленных в табл. 3, см. у Kaufman, Methods in Enzymology, 185, 1990, c. 537-566, публикация включена в настоящее описание в качестве ссылки. Таким образом, настоящее изобретение относится к клеткам-хозяевам, генетически модифицированным согласно любому представленному в настоящем описании методу, где селектируемый амплифицируемый маркерный ген кодирует полипептид, который обладает функцией дигидрофолатредуктазы (DHFR), глутаминсинтетазы, CAD, аденозиндеаминазы,аденилатдеаминазы,UMP-синтетазы,IMP-5'-дегидрогеназы,ксантин-гуанин-фосфорибозилтрансферазы, HGPR-тазы, тимидинкиназы, тимидилатсинтетазы, P-гликопротеина 170, рибонуклеотидредуктазы, аспарагинсинтетазы, аргининосукцинатсинтетазы, орнитиндекарбоксилазы, HMG-CoAредуктазы, ацетилглюкозаминилтрансферазы, треонил-тРНК-синтетазы или Na+K+-АТФазы. Предпочтительным селектируемым амплифицируемым маркерным геном является ген, кодирующий дигидрофолатредуктазу (DHFR), которая необходима для биосинтеза пуринов. Клетки, в которых отсутствует ген DHFR, не могут расти на среде, лишенной пуринов. Таким образом, ген DHFR можно применять в качестве доминантного селектируемого маркера для селекции и амплификации генов в таких клетках, выращиваемых в среде, лишенной пуринов. Селектирующий агент, который применяют в сочетании с геном DHFR, представляет собой метотрексат (MTX). Понятие "ген DHFR" или "dhfr" относится к любой нуклеиновой кислоте, кодирующей активный белок дигидрофолатредуктазу. Под понятие подпадают геномные последовательности DHFR, которые содержат один или несколько интронов, последовательности кДНК или так называемые "минигены",содержащие регуляторные последовательности и кодирующие последовательности DHFR в сочетании с интронами или без них. Таблица 3 Селектируемые амплифицируемые маркерные гены Приемлемыми клетками-хозяевами для гена, кодирующего DHFR, в качестве селектируемого амплифицируемого маркера являются клетки млекопитающих, предпочтительно клетки мышиной миеломы или хомячка. Наиболее предпочтительными являются клетки CHO-DUKX (ATCC CRL-9096) и CHODG44 (Urlaub и др., Cell 33,2, 1983, с. 405-412) с дефицитом активности DHFR. Для переноса метода амплификации DHFR на другие типы клеток можно применять мутантный ген DHFR, который кодирует белок, обладающий пониженной чувствительностью к метотрексату, в сочетании с клетками-хозяевами,которые содержат нормальный уровень эндогенного гена DHFR дикого типа (Simonsonet др., 1983;Wigler и др., 1980; Haberet и др., 1982). Настоящее изобретение можно применять для создания клеток-хозяев, предназначенных для производства биофармацевтических полипептидов/белков. Прежде всего, изобретение можно применять для экспрессии высоких уровней многочисленных различных представляющих интерес генов клетками, для которых выявлена повышенная клеточная продуктивность."Представляющий интерес ген" (GOI), "выбранная последовательность" или "генный продукт" имеют одинаковое значение в контексте настоящего описания и относятся к полинуклеотидной последовательности любой длины, которая кодирует представляющий интерес продукт или "представляющий интерес белок", под это понятие подпадает также "требуемый продукт". Выбранная последовательность может представлять собой полноразмерный или укороченный ген,слитый или меченый ген и может представлять собой кДНК, геномную ДНК или фрагмент ДНК, предпочтительно представляет собой кДНК. Она может иметь нативную последовательность, т.е. встречающуюся/встречающиеся в естественных условиях форму/формы, или может быть при необходимости мутантной или иным образом модифицированной. Эти мутации представляют собой усовершенствование кодонов с целью оптимизации наиболее часто встречающихся кодонов в отобранной клетке-хозяине,гуманизацию или мечение. Выбранная последовательность может кодировать секретируемый, цитоплазматический, ядерный, связанный с мембраной или находящийся на клеточной поверхности полипептид."Представляющий интерес белок" включает белки, полипептиды, их фрагменты, пептиды, которые все могут экспрессироваться в отобранной клетке-хозяине. Требуемые белки могут представлять собой,например, антитела, ферменты, цитокины, лимфокины, адгезионные молекулы, рецепторы и их производные или фрагменты и любые другие полипептиды, которые могут служить агонистами или антагонистами и/или которые можно применять в терапевтических или диагностических целях. Примеры требуемого белка/полипептида представлены также ниже. В случае более сложных молекул, таких как моноклональные антитела, GOI кодирует одну или обе цепи антитела."Представляющий интерес продукт" может являться также антисмысловой РНК. Представляющие интерес белки или требуемые белковые продукты указаны выше. Прежде всего,требуемые белки/представляющие интерес полипептиды или белки, включают, но не ограничиваясь только ими, инсулин, инсулиноподобный фактор роста, hGH, tPA, цитокины, такие как интерлейкины(IL), например IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL16, IL-17, IL-18, интерферон (IFN) альфа, IFN-бета, IFN-гамма, IFN-омега или IFN-тау, фактор некроза опухоли (TNF), такой как TNF-альфа и TNF-бета, TNF-гамма, TRAIL; G-CSF, GM-CSF, M-CSF, МСР-1 иVEGF. Под объем изобретения подпадает также производство эритропоэтина или любых других гормональных ростовых факторов. Способ, предлагаемый в изобретении, целесообразно применять также для производства антител или их фрагментов. Такие фрагменты представляют собой, например, Fabфрагменты (Fragment antigen-binding (антигенсвязывающий фрагмент) = Fab). Fab-фрагменты состоят из вариабельных областей обеих цепей, которые удерживаются вместе примыкающей константной областью. Их можно получать путем расщепления протеазами, например папаином, из обычных антител, но,кроме того, Fab-фрагменты можно получать также с помощью генетической инженерии. К фрагментам антител относятся также F(ab')2-фрагменты, которые можно получать протеолитическим расщеплением пепсином. Представляющий интерес белок предпочтительно выделяют из культуральной среды в виде секретируемого полипептида или его можно выделять из лизатов клеток-хозяев, если его экспрессия происходит без секреторного сигнала. Необходимо очищать представляющий интерес белок от других рекомбинантных белков и белков клетки-хозяина так, чтобы получать практически гомогенные препараты представляющего интерес белка. На первой стадии клетки и/или состоящий из частиц клеточный дебрис удаляют из культуральной среды или лизата. Затем представляющий интерес продукт очищают от загрязнителей в виде растворимых белков, полипептидов и нуклеиновых кислот, например, путем фракционирования или иммуноаффинности или с помощью ионообменных колонок, путем осаждения этанолом,ЖХВР с обращенной фазой, хроматографии на сефадексе, хроматографии на силикагеле или на катионообменной смоле, такой как ДЭАЭ диацетиламино)этилцеллюлоза). В целом, в данной области хорошо известны методы очистки гетерологично экспрессируемых в клетке-хозяине белков. Такие методы описаны, например, у Harris и Angal, Protein Purification Methods, в: The Practical Approach Series под ред.Rickwood и Hames, изд-во IRL Press, 1995 или Robert Scopes, Protein Purification, изд-во Springer-Verlag,1988, обе публикации включены в настоящее описание в качестве ссылки. С помощью методов генной инженерии можно получать укороченные фрагменты антител, которые состоят только из вариабельных областей тяжелой (VH) и легкой (VL) цепи. Их обозначают как Fvфрагменты (Fragment variable, т.е. фрагмент вариабельных областей). Поскольку у этих Fv-фрагментов отсутствует ковалентное связывание двух цепей остатками цистеина константных областей цепей, то Fvфрагменты часто стабилизируют. Целесообразно связывать вариабельные области тяжелой и легкой цепи коротким пептидным фрагментом, например, состоящим из 10-30 аминокислот, предпочтительно 15 аминокислот. Таким образом, получают одну пептидную цепь, состоящую VH и VL, которые связаны пептидным линкером. Белок антитела такого типа обозначают как одноцепочечный Fv (scFv). Примеры белков scFv антител такого типа известны в данной области, см., например, Huston и др., PNAS 16:, 1988,с. 5879-5883). В последние годы разработаны различные стратегии получения scFv в виде мультимерного производного. Это должно приводить, в частности, к получению рекомбинантных антител с улучшенными фармакокинетическими свойствами и особенностями биораспределения, а также обладающих повышенной авидностью к связыванию. Для достижения мультимеризации scFv получали scFv в виде слитых белков с мультимеризованными доменами. Мультимеризованные домены могут представлять собой, например, CH3-участок IgG или структуру типа свернутой спирали (coiled coil) (спиралевидная структура),такие как домены в виде лейциновой "молнии". Однако известны также стратегии, при использовании которых для мультимеризации применяют взаимодействие между VH/VL-областями scFv (например,двойные, тройные антитела и пентаантитела). Под двойными антителом специалист в данной области подразумевает двухвалентное гомодимерное производное scFv. Укорочение линкера в молекуле scFv до 5-10 аминокислот приводит к образованию гомодимеров, в которых имеет место межцепочечное VH/VLналожение. Двойные антитела можно дополнительно стабилизировать путем введения дисульфидных мостиков. Примеры белков двойных антител, известных из существующего уровня техники, представлены у Perisic и др., Structure 2, 1994, с. 1217-1226. Под миниантителом специалист в данной области подразумевает двухвалентное гомодимерное производное scFv. Оно состоит из слитого белка, который содержит CH3-участок иммуноглобулина,предпочтительно IgG, наиболее предпочтительно IgG1, в качестве области димеризации, которая соединена с scFv через шарнирную область (например, также из IgG1) и линкерную область. Примеры белков антител в виде миниантител можно найти у Hu и др., Cancer Res. 56, 1996, с. 3055-3061. Под тройными антителом специалист в данной области подразумевает трехвалентное гомотримерное производное scFv (Kortt и др., Protein Engineering 10, 1997, с. 423-433). Производные scFv, в которыхVH-VL слиты непосредственно без линкерной последовательности, позволяют получать тримеры. Специалисту в данной области известны также так называемые миниантитела, которые имеют двух-, трех- или четырехвалентную структуру и которые выведены из scFv. Мультимеризацию осуществляют с помощью двух-, трех- или четырехмерных структур типа свернутой спирали (Pack и др., Biotechnology 11, 1993, с. 1271-1277; Lovejoy и др., Science 259, 1993, с. 1288-1293; Pack и др., J. Mol. Biol. 246, 1995, с. 28-34). Любые последовательности или гены, интродуцированные в клетку-хозяина, обозначают как "гетерологичные последовательности" или "гетерологичные гены" или "трансгены" относительно клеткихозяина, даже, если интродуцированная последовательность или ген идентичны эндогенной последовательности или гену клетки-хозяина. Гетерологичные генные последовательности можно интродуцировать в клетку-мишень с помощью"экспрессионного вектора", предпочтительно эукариотического и еще более предпочтительно экспрессионного вектора млекопитающих. Методы, применяемые для конструирования векторов, хорошо известны специалистам в данной области и описаны в различных публикациях. Конкретные методики создания приемлемых векторов, включая описание функциональных компонентов, таких как промоторы, энхансеры, сайты терминации и сигналы полиаденилирования, маркеры для селекции, сайты инициации репликации и сигналы сплайсинга, обобщены более конкретно у Sambrook и др., 1989 и в приведенных в этом руководстве ссылках. Векторы могут представлять собой, но не ограничиваясь только ими, плазмидные векторы, фагмиды, космиды, искусственные/минихромосомы или вирусные векторы, такие как векторы на основе бакуловируса, ретровируса, аденовируса, аденоассоциированного вируса, вируса герпеса простого, ретровируса, бактериофагов. Эукариотические экспрессионные векторы должны, как правило,содержать также прокариотические последовательности, которые облегчают размножение вектора в бактерии, такие как сайт инициации репликации и гены, обусловливающие устойчивость к антибиотикам для селекции в бактериях. Различные эукариотические экспрессионные векторы, содержащие сайт клонирования, в котором можно функционально связывать полинуклеотид, хорошо известны в данной области и некоторые из них поступают в продажу от таких компаний, как фирма Stratagene, Ла-Джолла, шт. Калифорния; фирма Invitrogen, Карлсбад, шт. Калифорния; фирма Promega, Мэдисон, шт. Висконсин или фирма BD Biosciences Clontech, Пало-Альто, шт. Калифорния. В предпочтительном варианте осуществления изобретения экспрессионный вектор содержит по меньшей мере одну нуклеотидную последовательность, которая представляет собой регуляторную последовательность, необходимую для транскрипции и трансляции нуклеотидных последовательностей,которые кодируют представляющий интерес пептид/полипептид/белок. Понятие "экспрессия" в контексте настоящего описания относится к транскрипции и/или трансляции гетерологичной нуклеотидной последовательности внутри клетки-хозяина. Уровень экспрессии требуемого продукта/представляющего интерес белка в клетке-хозяине можно определять на основе либо количества соответствующей мРНК, присутствующей в клетке, либо количества требуемого полипептида, представляющего интерес белка, кодируемого выбранной последовательностью, как описано в примерах, представленных в настоящем описании. Например, мРНК, транскрибируемую с выбранной последовательности, можно оценивать количественно гибридизацией нозерн-блоттингом, защитой РНК от рибонуклеазы, гибридизацией in situ с клеточной РНК или ПЦР (см. Sambrook и др., 1989; Ausubel и др.,1987, пересмотренное и дополненное издание). Белок, кодируемый выбранной последовательностью,-9 018099 можно количественно оценивать различными методами, например с помощью ELISA, вестернблоттинга, радиоиммуноанализов, иммунопреципитации, путем оценки биологической активности белка,с помощью иммуноокрашивания белка после FACS-анализа (см. Sambrook и др., 1989; Ausubel и др.,1987, пересмотренное и дополненное издание) или путем анализов гомогенной флуоресценции с временным разрешением (HTRF)."Трансфекцию" эукариотических клеток-хозяев полинуклеотидом или экспрессионным вектором,которая приводит к получению генетически модифицированных клеток или трансгенных клеток, можно осуществлять любым методом, хорошо известным в данной области и описанным, например, у Sambrook и др., 1989 или Ausubel и др., 1987 (пересмотренное и дополненное издание). Методы трансфекции включают, но не ограничиваясь только ими, опосредуемую липосомой трансфекцию, совместное осаждение с фосфатом кальция, электропорацию, опосредуемую поликатионом (таким как ДЭАЭ-декстран) трансфекцию, слияние протопластов, вирусные заражения и микроинъекцию. Предпочтительно трансфекция представляет собой стабильную трансфекцию. Предпочтительным является такой метод трансфекции, который обеспечивает оптимальную частоту трансфекции и экспрессию гетерологичных генов в конкретной линии клеток-хозяев. Приемлемые методы можно определять общепринятыми путями. Для получения стабильных трансфектантов конструкции либо интегрируют в геном клетки-хозяина, либо в искусственную хромосому/минихромосому, либо локализуют эписомально, так чтобы они стабильно поддерживались в клетке-хозяине. Для воплощения настоящего изобретения на практике можно применять, если не указано иное, общепринятые методики клеточной биологии, молекулярной биологии, клеточного культивирования, иммунологии и т.п., известные в данной области. Эти методики полностью описаны в современной литературе (см., например, Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-е изд., изд-во Cold SpringManual, под ред. Harlow и др., 1987). Изобретение относится к способу улучшения клеточного роста линии клеток, отличающемуся тем,что повышают активность DHFR в указанной линии клеток. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия представляет собой клеточную линию, дефектную по DHFR или с пониженным уровнем DHFR. В другом варианте осуществления настоящего изобретения способ отличается тем, что ген, кодирующий DHFR, и представляющий интерес ген (GOI), кодирующий требуемый продукт, последовательно интродуцируют в указанную клеточную линии. В другом варианте осуществления настоящего изобретения способ отличается тем, что кассета экспрессии DHFR представляет собой экспрессионную единицу только млекопитающего, которую интродуцируют в клеточную линию во время последующей стадии интродукции. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что селекцию представляющего интерес гена, кодирующего требуемый продукт, осуществляют в отсутствии метотрексата (MTX). В следующем варианте осуществления настоящего изобретения способ отличается тем, что увеличивают количество гена DHFR. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что клетки указанной клеточной линии содержат по меньшей мере 1, предпочтительно по меньшей мере 3 копии гена DHFR. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что клетки указанной клеточной линии содержат по меньшей мере 5, по меньшей мере 10 или по меньшей мере 25 копий гена DHFR. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что уровень экспрессии DHFR повышают. В следующем варианте осуществления настоящего изобретения способ отличается тем, что уровень экспрессии DHFR повышают по меньшей мере в 2 раза. В следующем варианте осуществления настоящего изобретения способ отличается тем, что уровень экспрессии DHFR повышают по меньшей мере в 3-10, 15 или 20 раз. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что активность DHFR повышают путем интродукции гетерологичного гена DHFR, минигена DHFR, мутантаDHFR или кодирующей последовательности DHFR из видов, отличных от рассматриваемой клеточной линии. В следующем варианте осуществления настоящего изобретения способ отличается тем, что указанная клеточная линия уже трансфектирована представляющим интерес геном (GOI). В следующем варианте осуществления настоящего изобретения способ отличается тем, что указанная клеточная линия представляет собой линию клеток млекопитающего, такую как клеточная линияCHO. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия представляет собой CHO-DG44 или CHO-DUKX-B11, предпочтительно CHO-DG44. В другом варианте осуществления настоящего изобретения способ отличается тем, что селекцию представляющего интерес гена, кодирующего требуемый продукт, осуществляют в присутствии гипоксантина и тимидина (HT) и в отсутствии MTX. В следующем конкретном варианте осуществления настоящего изобретения способ отличается тем,что клеточную линию трансфектируют DHFR, который находится на плазмиде, отличной от плазмиды,которая содержит кодирующий требуемый продукт представляющий интерес ген, и поэтому DHFR не служит в качестве маркера селекции и/или амплификации для представляющего интерес гена. В следующем варианте осуществления настоящего изобретения способ отличается тем, что трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно или одновременно с трансфекцией плазмидой, которая содержит представляющий интерес ген. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно с трансфекцией плазмидой, которая содержит представляющий интерес ген. В другом предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия была предварительно трансфектирована первой плазмидой, которая содержит представляющий интерес ген, функционально связанный с маркером селекции, отличным от DHFR. В другом варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия содержит гетерологичный DHFR и по меньшей мере один другой маркер амплификации, такой как глутаминсинтетаза (GS), аденозиндеаминаза (ADA) или цитозиндеаминаза (CDA). В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия содержит гетерологичный DHFR и GS. В другом конкретном варианте осуществления настоящего изобретения способ отличается тем, что клеточная линия содержит гетерологичный DHFR и по меньшей мере один другой маркер селекции, такой как ген, обусловливающий устойчивость к пуромицину, неомицину или блеомицину. В следующем варианте осуществления настоящего изобретения способ отличается тем, что стабильно трансфектированные клетки отбирают с помощью селектирующего маркера, функционально связанного с представляющим интерес геном. В следующем варианте осуществления настоящего изобретения способ отличается тем, что стабильно трансфектированные клетки отбирают с помощью селектирующего маркера, функционально связанного с представляющим интерес геном, который не представляет собой DHFR. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что клеточная плотность, достигаемая при использовании указанной стабильно трансфектированной клеточной линии, по меньшей мере в 2 раза выше по сравнению с соответствующей нетрансфектированной клеточной линией. Кроме того, настоящее изобретение относится к способу получения линии клеток-хозяев, отличающемуся тем, что: а) трансфектируют клетку-хозяина по меньшей мере одним представляющим интерес геном, кодирующим требуемый продукт, который находится по меньшей мере на одной первой плазмиде и функционально связан с маркером селекции/амплификации, отличным от DHFR; б) интродуцируют кассету экспрессии DHFR, локализованную на плазмиде, которая отлична от плазмиды, указанной на стадии а); в) отбирают стабильно трансфектированные клетки с помощью селектирующего маркера, указанного на стадии а), где характеристики роста и клеточной плотности, полученные у указанной клетки,лучше и выше, чем у соответствующей нетрансфектированной клеточной линии. Предпочтительно настоящее изобретение относится к способу получения линии клеток-хозяев, отличающемуся тем, что: а) трансфектируют клетку-хозяина, дефектную по DHFR или с пониженным уровнем DHFR, по меньшей мере одним представляющим интерес геном, кодирующим требуемый продукт, который нахо- 11018099 дится по меньшей мере на одной первой плазмиде и функционально связан с маркером селекции/амплификации, отличным от DHFR; б) интродуцируют кассету экспрессии DHFR, локализованную на плазмиде, которая отлична от плазмиды, указанной на стадии а); в) отбирают стабильно трансфектированные клетки с помощью селектирующего маркера, указанного на стадии а), где характеристики роста и клеточной плотности, полученные у указанной клетки,лучше и выше, чем у соответствующей нетрансфектированной клеточной линии. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что порядок осуществления стадий а) и б) меняют. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что порядок осуществления стадий а) и б) является обратным. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, чтоDHFR представляет собой экспрессионную единицу только млекопитающего, которую интродуцируют в указанную клеточную линию на стадии б). Кроме того, настоящее изобретение относится к клетке-хозяину, которую можно получать любым из указанных способов. В конкретном варианте осуществления настоящего изобретения способ отличается тем, что клетка представляет собой клетку-хозяина млекопитающих, такую как CHO-клетка. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что клетка представляет собой CHO-DG44 или CHO-DUKX-B11. Кроме того, настоящее изобретение относится к способу получения белка в клеточной линии, например клеточной линии млекопитающего, отличающемуся тем, что:(а) создают клетку-хозяина с помощью одного из описанных выше способов, которая содержит представляющий интерес ген, кодирующий представляющий интерес белок;(б) культивируют клетку в условиях, пригодных для пролиферации клетки;(в) собирают представляющий интерес белок, например, путем отделения клеток от супернатанта и(г) очищают представляющий интерес белок. Предпочтительно настоящее изобретение относится к способу получения белка с использованием линии клеток, дефектной по DHFR или с пониженным уровнем DHFR, например линии клеток млекопитающих, отличающемуся тем, что:(а) создают клетку-хозяина с помощью одного из описанных выше способов, которая содержит представляющий интерес ген, кодирующий представляющий интерес белок;(б) культивируют клетку в условиях, пригодных для пролиферации клетки;(в) собирают представляющий интерес белок, например, путем отделения клеток от супернатанта и(г) очищают представляющий интерес белок. В конкретном варианте осуществления настоящего изобретения способ отличается тем, что представляющий интерес белок является секретируемым белком. В другом варианте осуществления настоящего изобретения способ отличается тем, что клетка дополнительно содержит трансген, который кодирует внутриклеточный или расположенный в мембране белок. В предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что трансген локализуют на той же плазмиде, что и кассету экспрессии DHFR. В другом предпочтительном варианте осуществления настоящего изобретения способ отличается тем, что трансген кодирует антиапоптозный ген или фактор транскрипции. В конкретном предпочтительном варианте осуществления изобретения способы/клетки-хозяева отличаются тем, что их осуществляют/выращивают в суспензионной культуре. В конкретном предпочтительном варианте осуществления настоящего изобретения способы/клетки-хозяева отличаются тем, что их осуществляют/выращивают в бессывороточной культуральной среде. С целью лучшего понимания изобретения, описанного в целом выше, ниже представлены ссылки на конкретные примеры, которые включены в настоящее описание только для иллюстрации определенных вариантов осуществления настоящего изобретения и никоим образом не направлены на ограничение его объема. Примеры Материалы и методы. Клеточные культуры. Все клеточные линии, применяемые на этапах производства и разработки, поддерживали в виде серийных маточных культур для посева в T-колбах с поверхностной аэрацией (фирма Nunc, Дания) в термостатах (фирма Thermo, Германия) или встряхиваемых колбах (фирма Nunc, Дания) при температуре 37C и в атмосфере, содержащей 5% CO2. Маточные культуры для посева пересевали каждые 2-3 дня с плотностью посева 2-3E5 клеток/мл. Концентрацию клеток определяли во всех культурах с помощью гемоцитометра. Жизнеспособность оце- 12018099 нивали методом исключения трипанового синего. Все продуктивные CHO-клетки культивировали в являющихся собственностью фирмы-заявителя (BI) средах и их состав не имел решающего значения. Культивирование методом периодической подпитки. Клетки высевали из расчета 310 клеток/мл в 125-миллилитровые встряхиваемые колбы в 30 мл являющейся собственностью BI среды для получения без антибиотиков или с MTX (фирма Sigma-Aldrich,Германия). Культуры перемешивали при 120 об/мин при 37C и 5% CO2, содержание которого снижали до 2% через 3 дня. Параметры культивирования, такие как pH, pO2, pCO2, концентрации глюкозы, лактата и глутамина определяли ежедневно и при необходимости доводили значение рН до 7,0 с помощьюNaCO3. Являющийся собственностью BI подпитывающий раствор добавляли каждые 24 ч из расчета 30 мл/л/день. Плотность и жизнеспособность клеток определяли методом исключения трипанового синего с помощью автоматической системы для подсчета клеток CEDEX (фирма Innovatis). Сортировка индивидуальных клеток. Для анализа и сортировки клеток использовали проточный цитометр типа FACS Vantage (фирмаBecton Dickinson), снабженный устройством для импульсной обработки, модулем для ускорения сортировки и автоматическим устройством для внесения клеток. С использованием точечного графика рассеяния в прямом и боковом направлении (FSC/SSC) устанавливали дискриминационное окно вокруг индивидуальных живых клеток. Отсортированные клетки по одной клетку на лунку помещали в 96-луночный титрационный микропланшет, содержащий 200 мкл среды для роста, с помощью автоматического устройства для внесения клеток. Для обеспечения стерильности сортировки систему труб клеточного сортера очищали и стерилизовали, пропуская в качестве защитой жидкости в течение 1 ч каждый из следующих растворов: 0,1 н. NaOH; 0,1% Triton-X-100; 70% этанола. Затем стерильный защитный резервуар с ЗФР соединяли с клеточным сортером. Выделение РНК и ОТ-ПЦР. РНК из растущих клеток выделяли с помощью реагента TRIzol (фирма Invitrogen, Германия) согласно инструкциям производителя с последующей обработкой ДНКазой I в течение 30 мин при 37C. Синтез первой цепи кДНК осуществляли с помощью набора Cloned AMV First-Strand cDNA Synthesis(фирма Invitrogen, Германия), используя для начала процесса 3 мкг общей РНК и олиго(dT) олигонуклеотиды. Различия в количестве транскриптов dhfr определяли с помощью ПЦР в реальном времени, используя смесь Absolute QPCR SYBR Green Fluorescein Mix (фирма ABgene, Суррей, Великобритания) и термоячейку, контролируемую с помощью программного обеспечения MyIQ Real Time Detection (фирма BioRad, Германия). Все эксперименты проводили в трех повторностях. Создавали DHFRспецифические амплификаты (ампликоны) и оценивали количественно относительно уровней экспрессии тубулина с помощью следующих олигонуклеотидов: dhfr (смысловой) SEQ ID NO: 1 5ATGGTTCGACCGCTGAACTGC-3';DUKX-B11 (АТСС CRL-9010), стабильно трансфектировали конструкциями ДНК, несущими селектирующие маркеры, обусловливающие устойчивость к пуромицину и неомицину соответственно, и/или экспрессионную плазмиду для гена DHFR. Клетки селектировали в среде, содержащей соответствующий антибиотик (пуромицин или генетицин), или в селективной среде без HT. Затем характеристики роста образовавшихся пулов стабильных клеток сравнивали в маточных культурах для посева и в культурах в процессе культивирования с периодической подпиткой во встряхиваемых колбах, что является принятой моделью для маломасштабных процессов ферментации/производства (Liu С. и Hong L., Biochem. Eng. J. 7, 2001, с. 121-125). При создании изобретения неожиданно было установлено, что CHO-клетки, дефектные по DHFR линии DG44, обладали в значительной степени ухудшенными характеристиками роста по сравнению с родительскими CHO-клетками дикого типа (wt) (фиг. 1). В культурах с периодической подпиткой они росли медленнее и достигали более низкой максимальной клеточной плотности (фиг. 1(а), (б, что согласуется с пониженной скоростью роста, оцененной при культивировании маточных культур для посева(фиг. 1(в. Важно отметить, что восполнение дефекта у клеток DG44 dhfr-/- с помощью гетерологичной экспрессии DHFR (SEQ ID NO: 5-6) полностью восстанавливало (приводило в норму) этот фенотип. Реинтродукция DHFR-трансгена не только приводила к снижению времени дупликации, но повышала также уровень IVC до уровней дикого типа или даже превышающих их уровней. Это усиливающее рост действие можно наблюдать не только при использовании двух различных клеточных линий DG44, но это имеет место также в случае CHO-клеток линии DUKX В 11, трансфектированных функциональным геномDHFR. Однако трансфекция экспрессионными конструкциями, несущими кассеты, обусловливающие устойчивость к пуромицину или неомицину, не приводила к изменению характеристики клеточного роста. Это свидетельствует о том, что усиление роста не является результатом селекции и/или культивирования стабильных трансфектантов, а вызывается восстановлением функциональной экспрессии DHFR вDHFR повышает клеточный рост в зависимости от дозы. Для оценки зависимости опосредуемого реинтродукцией DHFR воздействия на рост создавали стабильно экспрессирующие DHFR (SEQ ID NO: 5-6) субклоны и подвергали их основанному на применении FACS клонированию индивидуальных клеток для получения клональных популяций с гомогенной экспрессией DHFR. Затем анализировали особенности роста этих DHFR-клонов с использованием циклов ферментации с периодической подпиткой. Как видно из фиг. 2(а), трансфектированные DHFR субклоны достигали существенно более высоких уровней IVC по сравнению с клетками линии CHO-DG44,при этом различия составляли 2,5-6 раз в течение 6 дней. Для решения вопроса о том, коррелируют ли увеличенные уровни IVC с повышенным количеством транскриптов DHFR, общую РНК выделяли из DHFR-субклонов, а также из родительской клеточной линии CHO-DG44 и осуществляли количественную ПЦР для анализа уровня экспрессии DHFR (фиг. 2(б. Примерно у 80% проанализированных клонов оцененные уровни IVC точно коррелировали с уровнем экспрессии DHFR, это означает, что клоны с наибольшим количеством транскриптов DHFR имели наиболее высокие уровни IVC в процессе ферментации. Эти данные позволяют предположить, что экспрессия гетерологичного гена DHFR в клетках линии CHO-DG44 повышает клеточный рост в зависимости от дозы. Перечень ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ улучшения клеточного роста клеточной линии яичников китайских хомячков, где рост клеточной линии повышают путем встраивания гетерологичного гена DHFR, минигена DHFR, мутантаDHFR или кодирующей последовательности DHFR из вида, отличного от вида, из которого получена клеточная линия, отличающийся тем, что повышают активность дегидрофолатредуктазы (DHFR) в клеточной линии, в которой DHFR не служит селективным маркером и/или маркером амплификации для гена-мишени, а клеточная линия представляет собой клеточную линию, дефектную по DHFR или со сниженным уровнем DHFR, причем клеточная линия, дефектная по DHFR, является клеточной линией, которая функционально не экспрессирует DHFR фермент, а клеточная линия со сниженным уровнем DHFR является клеточной линией с низкими уровнями эндогенного DHFR. 2. Способ по п.1, в котором ген, кодирующий DHFR, и ген-мишень (GOI), кодирующий целевой продукт, последовательно встраивают в клеточную линию, и кассета экспрессии DHFR, включающаяDHFR ген, предпочтительно представляет собой предпочтительно экспрессионную единицу только млекопитающего, которую встраивают в клеточную линию во время последующей стадии встраиванияDHFR, и/или селекцию гена-мишени, который кодирует целевой продукт, осуществляют в отсутствии метотрексата (MTX). 3. Способ по пп.1, 2, в котором клетки клеточной линии содержат по меньшей мере 1, предпочтительно по меньшей мере 3 копии гена DHFR. 4. Способ по пп.1-3, в котором клеточная линия уже трансфицирована геном-мишени (GOI). 5. Способ по пп.1-4, в котором клеточная линия представляет собой клеточную линию млекопитающего, такую как клеточная линия CHO, предпочтительно клеточная линия представляет собой CHODG44 или CHO-DUKX-B11, предпочтительно CHO-DG44. 6. Способ по пп.3-5, в котором селекцию гена-мишени, который кодирует целевой продукт, осуществляют в присутствии гипоксантина и тимидина (HT) и в отсутствие MTX. 7. Способ по пп.1-6, в котором DHFR встраивают в клеточную линию с помощью плазмид, отличной от плазмиды с геном-мишенью, кодирующим целевой продукт. 8. Способ по п.7, в котором трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно или параллельно с плазмидой, содержащей ген-мишень. 9. Способ по п.8, в котором трансфекцию плазмидой, содержащей DHFR, осуществляют последовательно с плазмидой, содержащей ген-мишень, причем клеточную линию предварительно трансфицируют первой плазмидой, которая содержит ген-мишень, функционально связанный с селективным маркером,отличным от DHFR. 10. Способ по пп.1-9, в котором клеточная линия содержит по меньшей мере один другой маркер амплификации, такой как глутаминсинтетаза (GS), аденозиндеаминаза (ADA) или цитозиндеаминаза(CDA) и/или по меньшей мере один другой селективным маркер, такой как ген, обусловливающий устойчивость к пуромицину, неомицину или блеомицину. 11. Способ создания продуктивной линии клеток-хозяев, отличающийся тем, что (а) трансфицируют клетку-хозяина, дефектную по DHFR или с пониженным уровнем DHFR, по меньшей мере одним геном-мишени, кодирующим целевой продукт, который находится по меньшей мере на одной первой плазмиде и функционально связан с селективным маркером/амплификации, отличным от DHFR, (б) встраивают кассету экспрессии DHFR, локализованную на плазмиде, отличной от плазмиды, указанной на стадии (а), (в) отбирают стабильно трансфицированные клетки с помощью селективного маркера, указанного на стадии (а), где характеристики роста и клеточной плотности, полученные у указанной клетки,лучше и выше, чем у соответствующей нетрансфицированной клеточной линии, причем клеточная линия, дефектная по DHFR, является клеточной линией, которая функционально не экспрессирует DHFR фермент, а клеточная линия со сниженным уровнем DHFR является клеточной линией с низкими уровнями эндогенного DHFR. 12. Способ по п.11, в котором порядок стадий (а) и (б) изменяют и/или DHFR представляет собой единицу, которая экспрессируется только в клетках млекопитающего, которую встраивают в клеточную линию на стадии (б).
МПК / Метки
МПК: C12N 5/10, C12N 9/06, C12N 15/66
Метки: клеточного, роста, улучшение
Код ссылки
<a href="https://eas.patents.su/20-18099-uluchshenie-kletochnogo-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшение клеточного роста</a>
Предыдущий патент: Фосфинатные соединения (варианты)
Следующий патент: Способ и устройство для производства минеральных волокон
Случайный патент: Способ сжигания твердого топлива в высокотемпературном циркулирующем кипящем слое и устройство для его осуществления