Модифицированные микроорганизмы geobacillus thermoglucosidasius с инактивированным геном лактатдегидрогеназы и их применение для производства этанола
Номер патента: 14228
Опубликовано: 29.10.2010
Авторы: Элей Кирстин, Томпсон Энн, Тейлор Марк, Бэйкер Саймон, Аткинсон Энтони, Рудд Брайан, Лик Дэвид, Криппс Роджер
Формула / Реферат
1. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41277, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы.
2. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41278, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы.
3. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41279, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы.
4. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41280, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы.
5. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41281, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы.
6. Микроорганизм по любому из пп.1-5, где ген лактатдегидрогеназы делетирован.
7. Применение микроорганизма по любому из пп.1-6 в производстве этанола.
8. Способ модификации микроорганизма для повышения продуцирования этанола, при котором получают любой из термофильных микроорганизмов дикого типа Geobacillus thermoglucosidasius NCIMB 41277, 41278, 41279, 41280 и 41281 и инактивируют ген лактатдегидрогеназы.
9. Способ производства этанола, при котором культивируют микроорганизм по любому из пп.1-6 в подходящих условиях в присутствии С5- или С6-сахара.
Текст
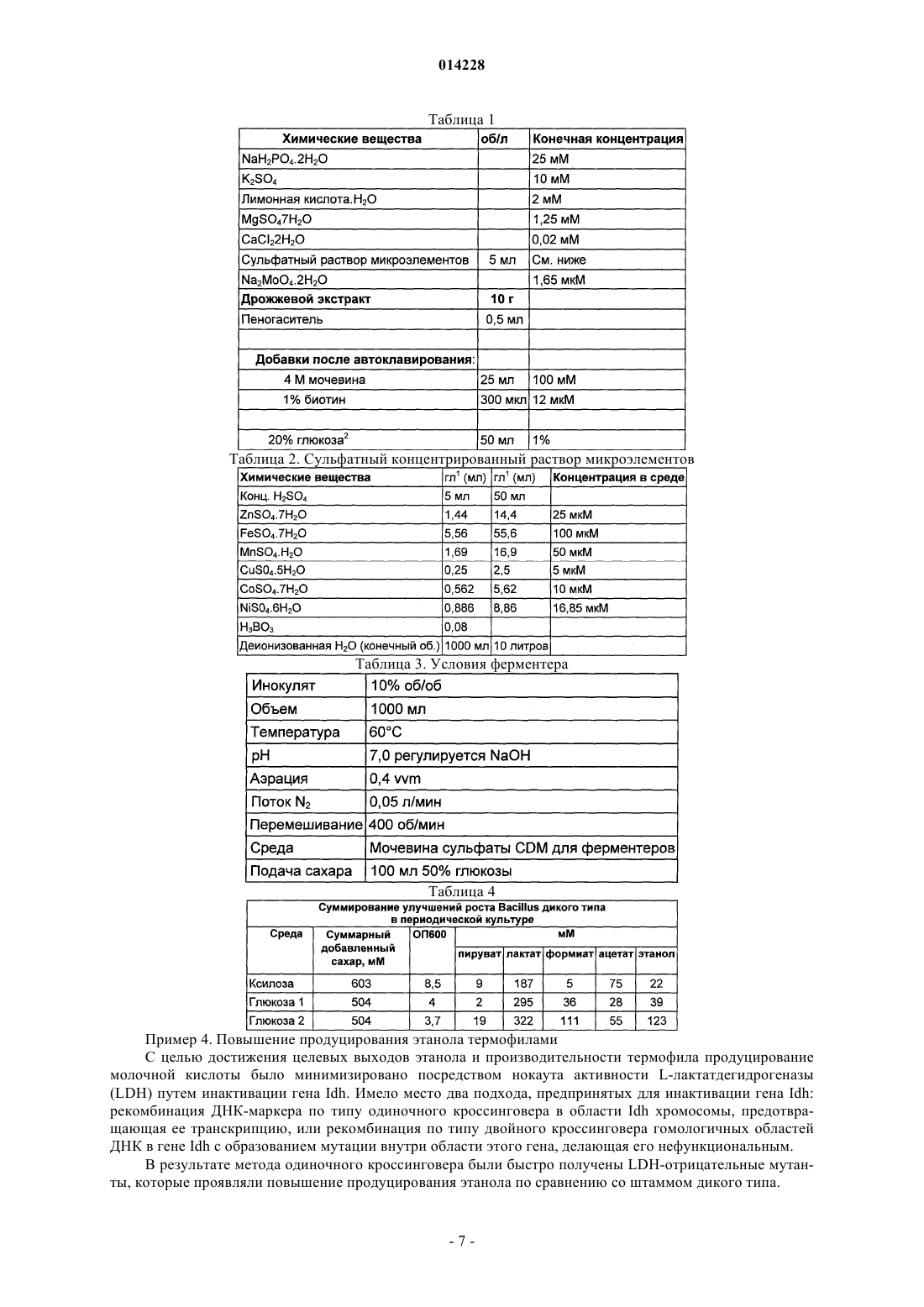
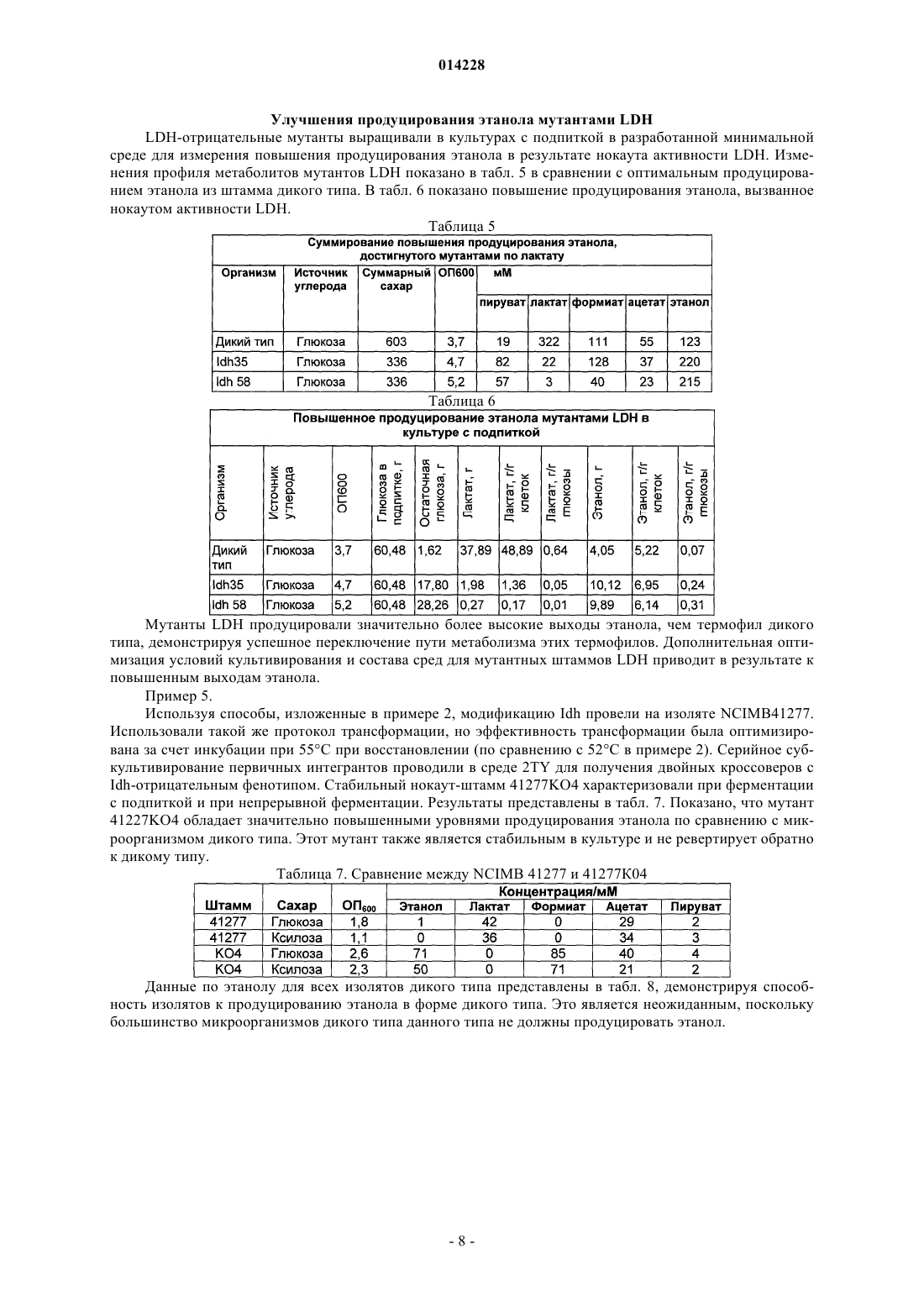
THERMOGLUCOSIDASIUS С ИНАКТИВИРОВАННЫМ ГЕНОМ ЛАКТАТДЕГИДРОГЕНАЗЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОИЗВОДСТВА ЭТАНОЛА Изобретение относится к модифицированным микроорганизмам, полученным посредством инактивации эндогенного гена лактатдегидрогеназы в штаммах Geobacillus thermoglucosidasiusNCIMB 41277, 41278, 41279, 41280 и 41281. Указанные микроорганизмы могут использоваться для производства этанола.(71)(73) Заявитель и патентовладелец: ТМО РЕНЬЮАБЛЗ ЛИМИТЕД (GB) 014228 Область изобретения Данное изобретение относится к идентификации микроорганизмов, которые могут быть приспособлены к продуцированию этанола как продукта бактериальной ферментации. В частности, изобретение относится к продуцированию этанола термофильными бактериями. Предшествующий уровень техники Бактериальный метаболизм может осуществляться посредством ряда различных механизмов в зависимости от вида бактерий и условий окружающей среды. Гетеротрофные бактерии, которые включают все патогены, получают энергию от окисления органических соединений, причем наиболее распространенными окисляемыми соединениями являются углеводы (в частности, глюкоза), липиды и белок. Результатом биологического окисления этих органических соединений бактериями является синтез АТФ как химического источника энергии. Этот процесс также дает возможность образования более простых органических соединений (молекул-предшественников), которые требуются бактериальной клетке для реакций биосинтеза. Общим процессом, посредством которого бактерии метаболизируют подходящие субстраты, является гликолиз, который представляет собой последовательность реакций, превращающих глюкозу в пируват с образованием АТФ. Судьба пирувата при генерировании метаболической энергии зависит от микроорганизма и условий окружающей среды. Существует три основных реакции пирувата. Во-первых, в аэробных условиях многие микроорганизмы будут генерировать энергию, используя цикл лимонной кислоты и превращение пирувата в ацетилкоэнзим А, катализируемое пируватдегидрогеназой (PDH). Во-вторых, в анаэробных условиях некоторые образующие этанол организмы могут осуществлять спиртовую ферментацию путем декарбоксилирования пирувата до ацетальдегида, катализируемого пируватдекарбоксилазой (PDC), и последующего восстановления ацетальдегида до этанола посредством НАДФ (никотинамиддинуклеотидфосфата), катализируемого алкогольдегидрогеназой (ADH). Третьим процессом является превращение пирувата в лактат, которое происходит посредством катализа лактатдегидрогеназой (LDH). Существует большой интерес в использовании микроорганизмов для продуцирования этанола, либо с использованием микроорганизмов, которые претерпевают анаэробную ферментацию естественным путем, либо посредством использования рекомбинантных микроорганизмов, которые включают гены пируватдекарбоксилазы и алкогольдегидрогеназы. Хотя достигнут некоторый успех в продуцировании этанола путем использования этих микроорганизмов, ферментация часто подвергается риску за счет повышенной концентрации этанола, в частности, когда микроорганизм обладает низким уровнем толерантности к этанолу. Для продуцирования этанола предложены термофильные бактерии, и их применение обладает тем преимуществом, что ферментацию можно проводить при повышенных температурах, которые дают возможность удаления продуцированного этанола в виде пара при температурах выше 50 С; это также дает возможность проведения ферментации с использованием высоких концентраций сахара. Однако поиск подходящих термофильных бактерий, которые могут эффективно продуцировать этанол, проблематичен. В WO 01/49865 раскрыта грамположительная бактерия, которая трансформирована гетерологичным геном, кодирующим пируватдекарбоксилазу, и которая обладает нативной функцией алкогольдегидрогеназы, для продуцирования этанола. Эта бактерия представляет собой термофильную Bacillus, и эта бактерия может быть модифицирована инактивацией гена лактатдегидрогеназы с использованием вставки транспозона. Все бактерии, раскрытые в WO 01/49865, имеют происхождение от штамма Bacillus LLD-R,штамма с дефицитом споруляции, который возник спонтанно из культуры, и в котором ген Idh инактивирован спонтанной мутацией или химическим мутагенезом. Штаммы LN и TN раскрыты в качестве улучшенных производных штамма LLD-R. Однако все штаммы содержат рестрикционные системы типа Нае III, что затрудняет плазмидную трансформацию и, следовательно, предотвращает трансформацию неметилированной ДНК. В WO 01/85966 раскрыты микроорганизмы, которые получают путем метилирования in vivo, чтобы преодолеть проблемы рестрикции. Это требует трансформации метилтрансферазы Нае III из Haemophilusaegyptius в штаммы LLD-R, LN и TN. Однако штаммы LLD-R, LN и TN являются нестабильными мутантами и спонтанно ревертируют к продуцирующим лактат штаммам дикого типа, в частности, при низком рН и при высоких концентрациях сахара. Результатом этого являются изменения продукта ферментации с этанола на лактат, что делает эти штаммы непригодными для продуцирования этанола. В WO 02/29030 раскрыто, что штамм LLD-R и его производные включают встречающийся в природе инсерционный элемент (IE) в кодирующей области гена Idh. Транспозиция этого элемента в ген Idh (и из него) и последующая инактивация гена является нестабильной, приводя к реверсии. В качестве решения была предложена интеграция плазмидной ДНК в последовательность IE. Таким образом, в уровне техники получение микроорганизмов для продуцирования этанола основано на модификации полученных в лаборатории мутированных химическим путем микроорганизмовBacillus, их обработке in vivo с помощью методик метилирования и последующей модификации этих микроорганизмов интеграцией плазмидной ДНК в последовательность IE. Эта процедура сложна, нена-1 014228 дежна, а также существуют спорные предписания по использованию этих штаммов. Таким образом, существует необходимость в усовершенствованных микроорганизмах для продуцирования этанола. Краткое изложение сущности изобретения Согласно первому аспекту настоящего изобретения термофильный микроорганизм, обозначенный здесь любым из номеров по каталогу NCIMB 41277, 41278, 41279, 41280 и 41281, модифицирован таким образом, чтобы дать возможность повышенного продуцирования этанола, где эта модификация представляет собой инактивацию гена лактатдегидрогеназы термофильного микроорганизма дикого типа. Согласно второму аспекту настоящего изобретения способ продуцирования этанола включает культивирование микроорганизма в соответствии с приведенным выше определением в пригодных условиях в присутствии С 5 или С 6 сахара. Согласно третьему аспекту настоящего изобретения способ модификации микроорганизма для повышения продуцирования этанола включает получение термофильного микроорганизма, определенного как любой из номеров по каталогу NCIMB 41277, 41278, 41279, 41280 и 41281, и делецию гена лактатдегидрогеназы из этого микроорганизма. Описание графических материалов Настоящее изобретение описано со ссылкой на сопроводительные графические материалы, где чертеж представляет собой графическую иллюстрацию карт плазмид для puВ 190 и puB190-Idh. Описание изобретения Настоящее изобретение основано на идентификации микроорганизмов дикого типа с желательными свойствами продуцирования этанола и модификации этого термофильного микроорганизма дикого типа,прерывающей экспрессию гена лактатдегидрогеназы. Инактивация гена лактатдегидрогеназы способствует предотвращению расщепления пирувата до лактата и, следовательно, стимулирует (в подходящих условиях) расщепление пирувата до этанола с использованием пируватдекарбоксилазы и алкогольдегидрогеназы или эквивалентные ферментативные пути. Микроорганизм дикого типа может представлять собой любой из термофильных микроорганизмов,депонированных под номерами по каталогу NCIMB 41277, 41278, 41279, 41280 и 41281. Микроорганизм, выбранный для модификации, указан как микроорганизм "дикого типа", то есть он не является мутантом, полученным в лаборатории. Этот микроорганизм выделен из образцов окружающей среды, которые содержали термофилы. Изолированный микроорганизм дикого типа был выбран благодаря его удивительной способности к продуцированию этанола. Однако, если он не модифицирован, лактат, вероятно, является основным продуктом ферментации. Изолят был также отобран на его способность к росту на сахарах, гексозе и/или пентозе, при термофильных температурах. Микроорганизм по изобретению обладает некоторыми желательными характеристиками, которые дают возможность использования этого микроорганизма в процессе ферментации. Этот микроорганизм не имеет системы рестрикции, посредством чего избегают необходимости в метилировании in vivo. Кроме того, этот микроорганизм стабилен по меньшей мере к 3% этанолу и обладает способностью к утилизации С 5 и С 6 сахаров в качестве субстрата, включая целлобиозу и крахмал. Этот микроорганизм также является трансформируемым при высокой частоте. Кроме того, этот микроорганизм имеет скорость роста в непрерывной культуре выше 0,3 ч-1. Микроорганизм является термофилом и растет в температурном диапазоне 40-85 С. Предпочтительно этот микроорганизм растет в температурном диапазоне 50-70 С. Кроме того, этот микроорганизм растет в условиях рН 6,5 или ниже, в частности рН 6,5-4,5. Последовательность нуклеиновой кислоты для лактатдегидрогеназы сейчас известна. Используя эту последовательность, специалист в данной области техники имеет возможность использовать ген лактатдегидрогеназы в качестве мишени для достижения инактивации этого гена посредством различных механизмов. Предпочтительно, если ген лактатдегидрогеназы инактивируют либо путем инсерции транспозона, либо предпочтительно путем делеции последовательности этого гена или участка последовательности этого гена. Делеция является предпочтительной, поскольку позволяет избежать трудностей повторной активации последовательности гена, которая часто происходит при использовании транспозонной инактивации. В предпочтительном воплощении ген лактатдегидрогеназы инактивируют путем интеграции термочувствительной плазмиды (плазмиды pUB190-ldh;депонирована под номером по каталогуNCIMB 41276), которая достигается естественной гомологичной рекомбинацией или интеграцией между плазмидой и хромосомой микроорганизма. Хромосомные интегранты можно отобрать на основании их устойчивости к антибактериальному агенту (например, к канамицину). Интеграция в ген лактатдегидрогеназы может происходить посредством события рекомбинации по типу одиночного кроссинговера или посредством события рекомбинации по типу двойного (или более чем двойного) кроссинговера. Событие двойного кроссинговера является предпочтительным. Полученный в результате мутант является стабильным без отбора антибиотиком. Микроорганизмы для применения по изобретению депонированы под номерами по каталогуAberdeen, AB21 9YA, Scotland. Микроорганизмы по изобретению можно культивировать в общепринятых условиях культивирования в зависимости от выбранного термофильного микроорганизма. Выбор субстратов, температуры, рН и других условий роста можно произвести на основании известных требований к культивированию, например, см. WO 01/49865 и WO 01/85966. Настоящее изобретение теперь будет описано только путем примера со ссылкой на сопровождающие графические материалы в приведенных ниже примерах. Микроорганизм, используемый для демонстрации модификаций в гене Idh, представляет собой Geobacillus 11955, хотя способы, раскрытые здесь, пригодны для использования с любым из микроорганизмов, определенных здесь, как показано в примере 5. Инактивация гена LDH Пример 1. Мутация в результате одиночного кроссинговера Разработка нокаут-вектора LDH Частичный фрагмент гена Idh примерно 800 п.о. субклонировали в термочувствительном векторе доставки pUB190 (SEQ ID NO. 1), используя Hindlll и Xbal, с получением в результате плазмиды 7,7 т.п.о. pUB190-ldh (фиг. 1 и SEQ ID NO. 1). Десять предполагаемых трансформантов Е. coli JM109(pUB190-ldh) проверяли с помощью рестрикционного анализа, и две культуры использовали для получения плазмидной ДНК для целей трансформации. В результате переваривания pUB190-ldh рестриктазамиHindlll и Xbal высвобождается ожидаемый фрагмент Idh. Трансформация Geobacillus thermoglucosidasius 11955 плазмидой pUB190-ldh Трансформанты были получены со всеми тремя плазмидами, протестированы после 24-48 ч при 54 С селекцией канамицином. Трансформанты Idh очищали из Geobacillus thermoglucosidasius (Gt) 11955 и проверяли с помощью рестрикционного анализа, используя Hindlll и Xbal. Нокаут гена LDH Нокаут гена осуществляли посредством интеграции термочувствительной плазмиды в ген Idh на хромосоме. Плазмида pUB190-ldh реплицируется при 54 С в Gt11955, но не реплицируется при 65 С. Селекцию поддерживали канамицином(12 мкг/мл). Затем температуру роста повышали до 65 С (плазмида больше не является репликативной). Естественная рекомбинация или интеграция происходит между плазмидой и хромосомой. Хромосомные интегранты отбирали по их устойчивости к канамицину. Интеграция была направлена в сторону гена Idh, поскольку на плазмиде находится гомологичная последовательность. Направленная интеграция в ген Idh происходила посредством процесса, известного как рекомбинация по типу одиночного кроссинговера. Плазмида становится встроенной в ген Idh, результатом чего является неактивный ген Idh. Тандемные повторы могут встречаться, если интегрирует несколько копий плазмиды. Методология и результаты Для интеграции предпринимали два различных метода: Метод 1: 4 х 50 мл культур TGPвыращивали при 54 С в течение 12-18 ч. Клетки осаждали центрифугированием и ресуспендировали в 1 мл TGP. Эту суспензию высевали на чашки (5 х 200 мл) TGP(кап) и инкубировали в течение ночи при 68 С. Интегранты собирали и высевали на 50-квадратную решетку на свежих чашках TGPи инкубировали в течение ночи при 68 С. Метод 2: 1 х 50 мл культур TGPвыращивали при 54 С в течение 12-18 ч. 1 мл этой культуры использовали для инокуляции 50 мл свежих культур TGP , которые выращивали при 68 С в течение 12-18 ч. Эту культуру субкультивировали на следующие сутки в 50 мл свежих культур TGPи выращивали при 68 С еще в течение 12-18 ч. Эту культуру высевали на чашки TGPи инкубировали при 68 С в течение ночи. На чашках был получен конфлюентный рост. Отдельные колонии высевали на 50 квадратную решетку на чашки TGPи инкубировали в течение ночи при 68 С. Скрининг Предполагаемые интегранты подвергали скринингу на нокаут гена Idh, используя приведенное ниже: 1) Скрининг на чашках Несколько сотен интегрантов перепечатывали на чашки SAM2 при 68 С. Отрицательные по лактату клетки продуцируют меньше кислоты и могут обладать ростовым преимуществом по сравнению с диким типом на ферментационных средах без буферов. 2) Скрининг с помощью ПЦР ПЦР колоний использовали для определения того, интегрировала ли плазмида в ген Idh. Путем подбора праймеров, которые фланкируют сайт интеграции, возможно определить, произошла ли интеграция гена Idh (для вставок фрагмент ПЦР не амплифицируется). 3) Анализ на лактат Данный анализ определяет, продуцируют ли интегранты лактат при росте в течение ночи на SAM2 при 68 С. Надосадочную жидкость культуры тестировали на концентрацию лактата реагентом на лактат фирмы Sigma для определения лактата. Отрицательные по лактату интегранты дополнительно-3 014228 характеризовали с помощью ПЦР и оценивали в ферментере на стабильность. Протокол электропорации для Geobacillus thermoglucosidasius NCIMB 11955 Замороженную исходную культуру NCIMB 11955 получали путем выращивания ночной культуры в среде TGP (250 об./мин при 55 С, объем 50 мл в конической колбе на 250 мл, ОП 600), добавления равного объема 20% глицерина и деления на аликвоты по 1 мл и хранения в пробирках для криоконсервации при-80 С. 1 мл этой исходной культуры использовали для инокуляции 50 мл TGP в конической колбе на 250 мл, инкубируя при 55 С, 250 об./мин до достижения культурой ОП 600 1,4. Колбу охлаждали на льду в течение 10 мин, затем культуру центрифугировали в течение 20 мин при 4000 об./мин при 4 С. Осадок ресуспендировали в 50 мл охлажденной во льду среды для электропорации и центрифугировали при 4000 об./мин в течение 20 мин. Проводили три дополнительных отмывки,125 мл и 210 мл, а затем осадок ресуспендировали в 1,5 мл охлажденной во льду среды для электропорации и делили на аликвоты по 60 мкл. Для электропорации 1-2 мкл ДНК добавляли к 60 мкл электрокомпетентных клеток в пробирке типа Эппендорф, которую держали на льду, и мягко перемешивали. Эту суспензию переносили в предварительно охлажденную кювету для электропорации (щель 1 мм) и проводили электропорацию при 2500 В,емкости 10 мФ и сопротивлении 600 Ом. Сразу после импульса добавляли 1 мл TGP, перемешивали, и суспензию переносили в пробирку с завинчивающейся крышкой и инкубировали при 52 С в течение 1 ч в водяной бане с качалкой. После инкубации суспензию либо высевали непосредственно (например, 20,5 мл), либо центрифугировали при 4000 об./мин в течение 20 мин, ресуспендировали в 200 мкл - 500 мкл TGP и высевали на агар TGP,содержащий соответствующий антибиотик. Инактивация гена LDH Мутация в результате двойного кроссинговера Праймеры разрабатывали на основе доступной последовательности 11955 LDH. Нокаут-стратегия была основана на создании внутренних делеций внутри гена LDH путем двух подходов. При стратегии 1 два существующих уникальных сайта рестрикции вблизи середины кодирующей последовательности LDH использовали для образования делеций. Из геномной ДНК получали один большой продукт ПЦР, покрывающий большую часть доступной последовательности LDH, и клонировали в сайте Smal в сайте поликлонирования в pUC19. Затем клон pUC19 последовательно переваривалиBstEII и BsrGI и повторно лигировали после переваривания фрагментом Кленова с образованием внутренней делеции в гене LDH между BstEII и BsrGI. При стратегии 2 (см. пример 2) ген LDH клонировали в виде 2 продуктов ПЦР, вводя сайты Notl на олигопраймерах, чтобы образовать 2 продукта ПЦР для совместного лигирования в pUC19 с образованием делеции в середине последовательности LDH. Два гена LDH с внутренними делециями субклонировали в трех потенциальных системах доставки для Geobacillus. Векторы доставки трансформировали в 11955 путем электропорации. Информация по генетической стратегии: Разработка систем доставки для гомологичной рекомбинации Для создания нокаутов необходима эффективная система для доставки мутированного гена в организм-мишень и отбора на интеграцию в геноме в результате гомологичной рекомбинации с геноммишенью "дикого типа". В принципе, это может быть достигнуто путем введения ДНК на векторе Е. coli без грамположительного репликона, но который несет грамотрицательный селективный маркер. Для этого необходима высокая эффективность трансформации. Метод электропорации, разработанный для Geobacillus 11955, создает 3104 трансформантов на мкг ДНК с pNW33N. Грамположительный репликон выделен из рВС 1 по каталогу BGSC и из рТНТ 15 по базе данных последовательностей.-4 014228 Ген cat на pNW33N используют для селекции как в Е. coli, так и в Geobacillus. Термочувствительные мутанты pNW33N были получены с помощью пассажей плазмиды через штамм-мутатор StatageneXL1r ed. Пример 2. Получение мутанта LDH путем замещения гена Для получения стабильной мутации гена LDH в Geobacillus thermoglucosidasius NCIMB 11955 была разработана дополнительная стратегия путем замещения гена. В эту стратегию вовлечено создание делеции 42 п.о. вблизи середины кодирующей последовательности и инсерции 7 п.о. в данном положении,вводящей новый сайт рестрикции Notl. Эта последовательность вставки была предназначена для того,чтобы вызвать ниже мутацию сдвига считывания. В данную стратегию вовлечено создание делеции с использованием 2 фрагментов ПЦР, используя олигопраймеры, вводящие сайт рестрикции Notl. Праймеры были разработаны на основании частичной последовательности кодирующей области LDH из 11955. Последовательность использованных праймеров показана ниже. Фрагмент 1: Праймер 1 (прямой): GGAATTCCCTTATGAACCAAGGAATAGCA (подчеркнутая последовательность указывает основания, введенные для создания нового сайта EcoRI; SEQ ID NO. 3). Праймер 2 (обратный): GCGGCCGCACCCGCTCTTTCGGTAACCCGCT (подчеркнутая последовательность указывает основания, введенные для создания нового сайта Notl; SEQ ID NO. 4). Фрагмент 2: Праймер 3 (прямой): GCGGCCGCTTGCTAAGTGAATATTTTCAAGT (подчеркнутая последовательность указывает основания, введенные для создания нового сайта Notl; SEQ ID NO. 5). Праймер 4 (обратный): CTGCAGCGTCAATTCCATCACTTCACGA (подчеркнутая последовательность указывает основания, введенные для создания нового сайта Pstl; SEQ ID NO. 6). Получение препарата геномной ДНК Препарат геномной ДНК, который служит матрицей для ПЦР, получали из 11955. Клетки из 20 мл ночной культуры 11955, выращенной в среде TGP при 52 С, собирали центрифугированием при 4000 об./мин в течение 20 мин. Клеточный осадок ресуспендировали в 5 мл буфера STE 0,3 М сахароза, 25 мМ Трис HCI и 25 мМ ЭДТА, доведенного до рН 8,0, содержащего 2,5 мг лизоцима и 50 мкл 1 мг/мл рибонуклеазы А. Эту смесь инкубировали в течение 1 ч при 30 С, затем добавляли 5 мг протеиназы К и 50 мкл 10% ДСН с последующей инкубацией при 37 С в течение 1 ч. Затем лизированную культуру последовательно экстрагировали равными объемами фенола/хлороформа, а затем хлороформом, после чего осаждали изопропанолом. После отмывки дважды охлажденным во льду 70% этанолом осадок ДНК снова растворяли в 0,5 мл буфера ТЭ. Создание конструкции с делецией LDH ПЦР проводили, используя Robocycler Gradient 96 (Stratagene), и условия реакции были следующими: Цикл 1: денатурация при 95 С в течение 5 мин, отжиг при 47 С в течение 1 мин, элонгация при 72 С в течение 2 мин. Цикл 2-30: денатурация при 95 С в течение 1 мин, отжиг при 47 С в течение 1 мин, элонгация при 72 С в течение 2 мин, и последующая инкубация при 72 С в течение 5 мин. Используемые ферменты представляли собой равную смесь полимеразы Pfu (Promega) и полимеразы Taq(New England Biolabs,NEB). Используемые буфер, состав и концентрация dNTP были такими, как рекомендовано для Pfu поставщиками. Продукты ПЦР, полученные с использованием геномной ДНК из NCIMB 11955 в качестве матрицы, очищали путем электрофореза в агарозном геле и элюировали из агарозного геля с использованием набора QIAquick Gel Extraction Kit (Qiagen). Очищенные продукты ПЦР лигировали с pUC19 (NewEngland Biolabs), предварительно переваренной Smal, и лигазную смесь использовали для трансформации Escherichia coli DH10 В (Invitrogen). Отбирали колонии, устойчивые к ампициллину, и содержащиеся плазмиды выделяли и характеризовали рестрикционным анализом и устанавливали ориентацию вставок. Плазмиду (рТМ 002) с фрагментом 2, встроенным в pUC19 (с новым сайтом Pstl, введенным на праймере 4 ближе всего к сайту Pstl в сайте поликлонирования (mcs) pUC19), переваривали Notl и Pstl. Полученный в результате фрагмент (примерно 0,4 т.п.о.) лигировали в плазмиду pUC19 (pTM001), несущую фрагмент 1 (с новым сайтом EcoRI, введенным на праймере 1 ближе всего к сайту EcoRI в mcspUC19), переваренную Notl и Pstl для линеаризации плазмиды. Лигазную смесь использовали для трансформации E.coli DH10B. Отбирали колонии, устойчивые к ампициллину, и содержащиеся плазмиды выделяли и характеризовали рестрикционным анализом. Плазмиду (рТМ 003) с ожидаемым паттерном рестрикции для желаемой конструкции (кодирующая область LDH, несущая делецию и введенный сайт Notl) идентифицировали и проверяли секвенированием, используя прямой и обратный праймеры М 13mp18. Мутированный ген LDH вырезали из рТМ 003 путем переваривания Hindlll и EcoRI и очищали путем электрофореза в агарозном геле с последующей элюцией из агарозного геля с использованием набора QIAquick Gel Extraction Kit (в виде фрагмента примерно 0,8 т.п.о.). Этот фрагмент обрабатывали полимеразой Кленова (NEB, согласно инструкциям изготовителей) с образованием тупых концов и вводили в вектор pUB190. Это было достигнуто путем лигирования по тупым концам с pUB190, линеаризованной перевариванием Xbal, а затем обработанной фрагментом Кленова, с последующей очисткой из геля, как-5 014228 описано выше. Лигазную смесь использовали для трансформации Е. coli SCS110 (Stratagene). Отбирали колонии, устойчивые к ампициллину, и содержащиеся плазмиды выделяли и характеризовали рестрикционным анализом. Плазмиду (рТМ 014) с ожидаемым паттерном рестрикции для желаемой конструкции идентифицировали и использовали для трансформации NCIMB 11955 путем электропорации, используя протокол электропорации, как описано в примере 1. Получение и характеристика мутанта LDH с замещением гена посредством двойного кроссинговера Предполагаемый первичный интегрант рТМ 014, полученный таким способом (штамм ТМ 15), использовали для получения двойных рекомбинантов (замещения гена). Это было достигнуто с помощью серийной субкультуры ТМ 15 в среде TGP без канамицина. Использовали пять последовательных культур при качании, чередуя 8 ч при 54 С и 16 ч при 52 С, используя 5 мл TGP в пробирках на 50 мл(Falcon) при 250 об/мин, 1 % пересев на каждой стадии. После этих 5 пассажей полученную в результате культуру серийно разводили в TGP и высевали пробы по 100 мкл на чашки с агаром TGP для инкубации при 54 С. Перепечатку полученных в результате колоний на агар TGP, содержащий 12 мкг/мл канамицина, использовали для идентификации колоний, чувствительных к канамицину. После рассева истощающим штрихом на агаре до отдельных колоний для очистки эти производные, чувствительные к канамицину, тестировали на продуцирование лактата, и, как ожидали, оказалось, что они представляют собой смесь LDH+ и LDH-. Одно производное LDH-, TM89, было дополнительно охарактеризовано с помощью ПЦР и Саузерн-блоттингов. Геномную ДНК получали из ТМ 15 (первичный интегрант) и ТМ 89 (предполагаемый двойной рекомбинант LDH-) и использовали в качестве матрицы для ПЦР с использованием праймеров 1 и 4 и условий, описанных выше. Геномную ДНК из 11955 использовали в качестве контроля. Продукты ПЦР(полосы примерно 0,8 т.п.о. получены для всех 3 матриц) очищали электрофорезом в агарозном геле и элюировали из агарозного геля, используя набор QIAquick Gel Extraction Kit. Образцы переваривали Notl и разгоняли на 0,7% агарозном геле для визуализации продуктов. Продукт ПЦР 11955 не показал данных рестрикции Notl, как ожидали, тогда как продукт ПЦР ТМ 89 дал 2 полосы примерно по 0,4 т.п.о., что указывает на замещение гена дикого типа мутированным аллелем. Переваривание Notl продукта ПЦР ТМ 15, первичного интегранта, дало преимущественно 2 полосы, наблюдаемые для ТМ 89, со следом нерестрицированной (0,8 т.п.о.) полосы. Это можно объяснить результатом, полученным Саузернблоттингом геномной ДНК ТМ 15. Геномную ДНК 11955, ТМ 15 и ТМ 89 переваривали Notl, Pstl и Notl и HindIII и Notl и подвергали электрофорезу в агарозном геле. ДНК переносили на положительно заряженную нейлоновую мембрану(Roche) и гибридизовали с меченым DIG зондом, полученным с помощью ПЦР гена LDH 11955, используя праймеры 1 и 4, с мечеными DIG dNTP, следуя инструкциям поставщиков (Roche Molecular Biochemicals DIG application manual). Гибридизовавшиеся полосы визуализировали, используя поставляемый набор для обнаружения (Roche). Данные Саузерн-блоттинга показали наличие множественно амплифицированной полосы примерно 7,5 т.п.о. в переваре Notl TM15 с так же амплифицированными полосами примерно 7 и 0,4 т.п.о. в переварах HindIII/Notl и PstI/NotI TM15, что указывает на интеграцию множественных тандемных копий рТМ 014, интегрированных при локусе LDH в данном первичном интегранте. Со всеми 3 рестрикционными переварами ТМ 89 показала наличие другого паттерна рестрикции,показывающего дополнительную полосу гибридизации по сравнению с 11955, соответствующую замещению гена. Пример 3. Продуцирование этанола термофилом дикого типа Воспроизводимый рост и образование продукта было достигнуто в культурах с подпиткой и непрерывных культурах для термофила дикого типа. В табл. 1, 2 и 3 показаны условия, используемые для процесса ферментации. Таблица 2. Сульфатный концентрированный раствор микроэлементов Пример 4. Повышение продуцирования этанола термофилами С целью достижения целевых выходов этанола и производительности термофила продуцирование молочной кислоты было минимизировано посредством нокаута активности L-лактатдегидрогеназы(LDH) путем инактивации гена Idh. Имело место два подхода, предпринятых для инактивации гена Idh: рекомбинация ДНК-маркера по типу одиночного кроссинговера в области Idh хромосомы, предотвращающая ее транскрипцию, или рекомбинация по типу двойного кроссинговера гомологичных областей ДНК в гене Idh с образованием мутации внутри области этого гена, делающая его нефункциональным. В результате метода одиночного кроссинговера были быстро получены LDH-отрицательные мутанты, которые проявляли повышение продуцирования этанола по сравнению со штаммом дикого типа.-7 014228 Улучшения продуцирования этанола мутантами LDHLDH-отрицательные мутанты выращивали в культурах с подпиткой в разработанной минимальной среде для измерения повышения продуцирования этанола в результате нокаута активности LDH. Изменения профиля метаболитов мутантов LDH показано в табл. 5 в сравнении с оптимальным продуцированием этанола из штамма дикого типа. В табл. 6 показано повышение продуцирования этанола, вызванное нокаутом активности LDH. Таблица 5 Мутанты LDH продуцировали значительно более высокие выходы этанола, чем термофил дикого типа, демонстрируя успешное переключение пути метаболизма этих термофилов. Дополнительная оптимизация условий культивирования и состава сред для мутантных штаммов LDH приводит в результате к повышенным выходам этанола. Пример 5. Используя способы, изложенные в примере 2, модификацию Idh провели на изоляте NCIMB41277. Использовали такой же протокол трансформации, но эффективность трансформации была оптимизирована за счет инкубации при 55 С при восстановлении (по сравнению с 52 С в примере 2). Серийное субкультивирование первичных интегрантов проводили в среде 2TY для получения двойных кроссоверов сIdh-отрицательным фенотипом. Стабильный нокаут-штамм 41277KO4 характеризовали при ферментации с подпиткой и при непрерывной ферментации. Результаты представлены в табл. 7. Показано, что мутант 41227KO4 обладает значительно повышенными уровнями продуцирования этанола по сравнению с микроорганизмом дикого типа. Этот мутант также является стабильным в культуре и не ревертирует обратно к дикому типу. Таблица 7. Сравнение между NCIMB 41277 и 41277 К 04 Данные по этанолу для всех изолятов дикого типа представлены в табл. 8, демонстрируя способность изолятов к продуцированию этанола в форме дикого типа. Это является неожиданным, поскольку большинство микроорганизмов дикого типа данного типа не должны продуцировать этанол.-8 014228 Таблица 8. Данные по этанолу для изолятов ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41277, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы. 2. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41278, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы. 3. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41279, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы. 4. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41280, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы. 5. Микроорганизм Geobacillus thermoglucosidasius NCIMB 41281, модифицированный с инактивацией эндогенного гена лактатдегидрогеназы. 6. Микроорганизм по любому из пп.1-5, где ген лактатдегидрогеназы делетирован. 7. Применение микроорганизма по любому из пп.1-6 в производстве этанола. 8. Способ модификации микроорганизма для повышения продуцирования этанола, при котором получают любой из термофильных микроорганизмов дикого типа Geobacillus thermoglucosidasius NCIMB 41277, 41278, 41279, 41280 и 41281 и инактивируют ген лактатдегидрогеназы. 9. Способ производства этанола, при котором культивируют микроорганизм по любому из пп.1-6 в подходящих условиях в присутствии С 5- или С 6-сахара.
МПК / Метки
Метки: thermoglucosidasius, микроорганизмы, применение, инактивированным, лактатдегидрогеназы, геном, geobacillus, этанола, производства, модифицированные
Код ссылки
<a href="https://eas.patents.su/19-14228-modificirovannye-mikroorganizmy-geobacillus-thermoglucosidasius-s-inaktivirovannym-genom-laktatdegidrogenazy-i-ih-primenenie-dlya-proizvodstva-etanola.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированные микроорганизмы geobacillus thermoglucosidasius с инактивированным геном лактатдегидрогеназы и их применение для производства этанола</a>
Предыдущий патент: Способ получения кисломолочного продукта “максилин” и способ коррекции микрофлоры в организме человека и животных
Следующий патент: Антитело против мср-1, содержащие его композиции и способы применения антитела и композиций
Случайный патент: Комбинированные композиции для лечения болезни альцгеймера и родственных заболеваний зонизамидом и акампросатом