Дозированная форма биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением, способ ее получения и способ лечения депрессии с ее использованием
Формула / Реферат
1. Дозированная форма, содержащая:
(a) примерно от 14 до 25 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;
(b) примерно от 70 до 85 мас.% фармацевтически приемлемой целлюлозной полимерной матрицы и
(c) подходящее количество одного или более фармацевтически приемлемых наполнителей, где скорость высвобождения биоактивного метаболита гепирона из дозированной формы такова, что для достижения примерно 90-95% абсорбции биоактивного метаболита гепирона требуется примерно от 18 до 24 ч.
2. Дозированная форма по п.1, где (с) дополнительно содержит по меньшей мере один фармацевтически приемлемый наполнитель, выбранный из группы, включающей краситель, микрокристаллическую целлюлозу, коллоидный диоксид кремния и стеарат магния.
3. Дозированная форма по п.1, где (b) представляет собой гидроксипропилметилцеллюлозу, имеющую вязкость примерно от 15000 до 100000 сП.
4. Дозированная форма по п.1, где концентрация (а) составляет примерно от 15,5 до 18,7 мас.%.
5. Дозированная форма по п.1, где указанный биоактивный метаболит гепирона выбран из группы, включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон.
6. Дозированная форма по п.1, где указанная дозированная форма представлена в виде таблетки.
7. Дозированная форма по п.6, где общая масса указанной таблетки составляет от 350 до 450 мг.
8. Дозированная форма по п.7, где масса (а) в указанной таблетке составляет от 60 до 80 мг.
9. Дозированная форма по п.6, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
10. Дозированная форма по п.9, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
11. Дозированная форма по п.6, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
12. Дозированная форма по п.11, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
13. Дозированная форма, содержащая:
(a) примерно от 14,0 до 24,4 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;
(b) от 70,5 до 82,1 мас.% гидроксипропилметилцеллюлозы, имеющей вязкость примерно от 15000 до 100000 сП;
(c) от 0 примерно до 1 мас.% красителя;
(d) примерно от 8,0 до 16,7 мас.% микрокристаллической целлюлозы;
(e) примерно от 0,39 до 0,47 мас.% коллоидного диоксида кремния и
(f) примерно от 0,29 до 1,0 мас.% стеарата магния.
14. Дозированная форма по п.13, где (а) составляет примерно от 15,5 до 18,7 мас.%.
15. Дозированная форма по п.13, где фармацевтически приемлемая соль биоактивного метаболита гепирона является гидрохлоридом.
16. Дозированная форма по п.13, где указанный биоактивный метаболит гепирона выбран из группы, включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон.
17. Дозированная форма по п.13, где (с) составляет от 0 примерно до 0,3 мас.%.
18. Дозированная форма по п.13, где (с) представляет собой один или более оксид железа.
19. Дозированная форма по п.13, где (е) составляет примерно от 0,42 до 0,47 мас.%.
20. Дозированная форма по п.13, где указанная дозированная форма представлена в виде таблетки.
21. Дозированная форма по п.20, где общая масса указанной таблетки составляет от 350 до 450 мг.
22. Дозированная форма по п.21, где масса (а) в указанной таблетке составляет от 60 до 80 мг.
23. Дозированная форма по п.20, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
24. Дозированная форма по п.23, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
25. Дозированная форма по п.20, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
26. Дозированная форма по п.25, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
27. Способ получения таблетки по п.20, включающий:
(i) смешивание всех или части компонентов от (а) до (f);
(ii) перемешивание смеси, полученной на стадии (i);
(iii) добавление части или оставшихся компонентов от (а) до (f);
(iv) перемешивание смеси, полученной на стадии (iii), если какие-либо компоненты добавляют на стадии (iii);
(v) получение заготовки из смеси со стадии (iv);
(vi) измельчение заготовки, полученной на стадии (v);
(vii) добавление оставшегося компонента (f), если часть сохранена на стадиях (i) и (iv);
(viii) перемешивание смеси со стадии (vii);
(ix) прессование смеси со стадии (viii) с получением таблетки.
28. Способ получения таблетки по п.20, включающий:
i) смешивание всех компонентов (а), всех компонентов (с), всех компонентов (е) и 20% от общей концентрации компонента (b);
ii) перемешивание смеси со стадии (i);
iii) добавление к смеси со стадии (ii) всех компонентов (d), половины от общей концентрации компонента (f) и оставшихся 80% от общей концентрации компонента (b);
iv) перемешивание смеси со стадии (iii);
v) получение заготовки смеси со стадии (iv);
vi) измельчение заготовки со стадии (v);
vii) добавление оставшихся 50% компонента (f) к измельченной заготовке со стадии (vi);
viii) перемешивание смеси со стадии (vii);
ix) прессование смеси со стадии (viii) в конечную желательную форму.
29. Дозированная форма по п.20, содержащая:
(a) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;
(b) примерно 75,3 мас.% гидроксипропилметилцеллюлозы;
(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;
(d) примерно 8,0 мас.% микрокристаллической целлюлозы;
(e) примерно 0,42 мас.% коллоидного диоксида кремния и
(f) примерно 0,31 мас.% стеарата магния.
30. Дозированная форма по п.29, где общая масса указанной таблетки составляет 385 мг.
31. Дозированная форма по п.30, где масса (а) в указанной таблетке составляет 60 мг.
32. Дозированная форма по п.29, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
33. Дозированная форма по п.32, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
34. Дозированная форма по п.29, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
35. Дозированная форма по п.34, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
36. Дозированная форма по п.20, состоящая, по существу, из:
(а) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;
(b) примерно 75,3 мас.% гидроксипропилметилцеллюлозы;
(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;
(d) примерно 8,0 мас.% микрокристаллической целлюлозы;
(e) примерно 0,42 мас.% коллоидного диоксида кремния и
(f) примерно 0,31 мас.% стеарата магния.
37. Дозированная форма по п.36, где общая масса указанной таблетки составляет 385 мг.
38. Дозированная форма по п.37, где масса (а) в указанной таблетке составляет 60 мг.
39. Дозированная форма по п.36, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
40. Дозированная форма по п.39, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
41. Дозированная форма по п.36, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
42. Дозированная форма по п.41, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
43. Дозированная форма по п.20, содержащая:
(a) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;
(b) примерно 70,7 мас.% гидроксипропилметилцеллюлозы;
(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;
(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;
(d) примерно 8,2 мас.% микрокристаллической целлюлозы;
(e) примерно 0,39 мас.% коллоидного диоксида кремния и
(f) примерно 0,29 мас.% стеарата магния.
44. Дозированная форма по п.43, где общая масса указанной таблетки составляет 410 мг.
45. Дозированная форма по п.44, где масса (а) в указанной таблетке составляет 80 мг.
46. Дозированная форма по п.43, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
47. Дозированная форма по п.46, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
48. Дозированная форма по п.43, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
49. Дозированная форма по п.48, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
50. Дозированная форма по п.20, состоящая, по существу, из:
(a) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;
(b) примерно 70,7 мас.% гидроксипропилметилцеллюлозы;
(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;
(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;
(d) примерно 8,2 мас.% микрокристаллической целлюлозы;
(e) примерно 0,39 мас.% коллоидного диоксида кремния и
(f) примерно 0,29 мас.% стеарата магния.
51. Дозированная форма по п.50, где общая масса указанной таблетки составляет 410 мг.
52. Дозированная форма по п.51, где масса (а) указанной таблетки составляет 80 мг.
53. Дозированная форма по п.50, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.
54. Дозированная форма по п.53, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,240±0,025 дюйма.
55. Дозированная форма по п.50, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.
56. Дозированная форма по п.55, где указанная таблетка имеет итоговый размер 0,400±0,05 дюйма на 0,325±0,05 дюйма с толщиной 0,195±0,025 дюйма.
57. Способ лечения депрессии у нуждающегося в этом пациента, включающий введение указанному пациенту эффективного количества дозированной формы по любому из пп.1, 6, 13, 20, 29, 36 и 43.
58. Способ по п.57, где указанный пациент является человеком.
59. Способ по п.57, где указанный пациент, кроме того, страдает от генерализованной тревоги.
60. Способ по п.57, где указанное эффективное количество составляет от 0,01 до 40 мг/кг массы тела в день.
Текст
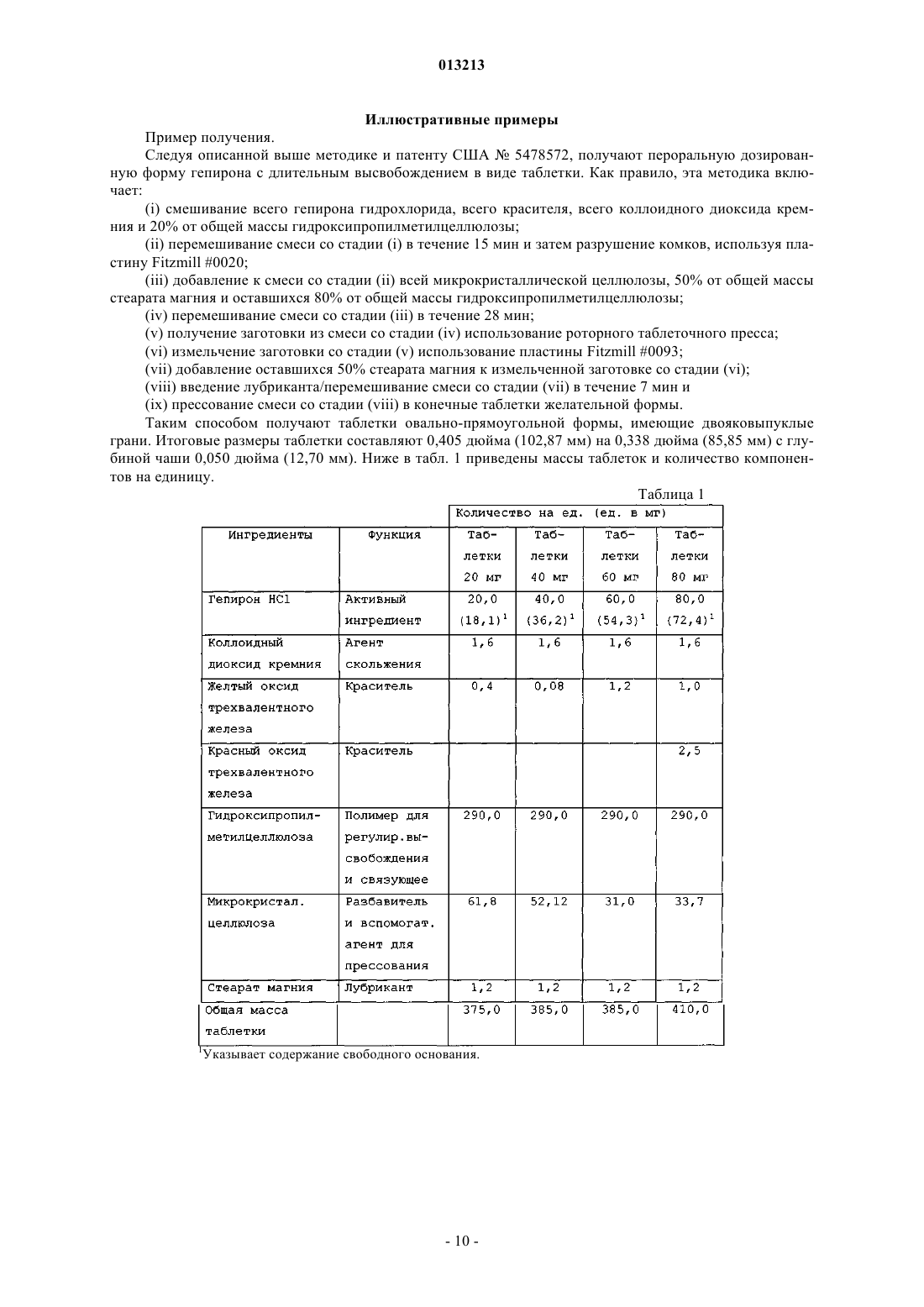
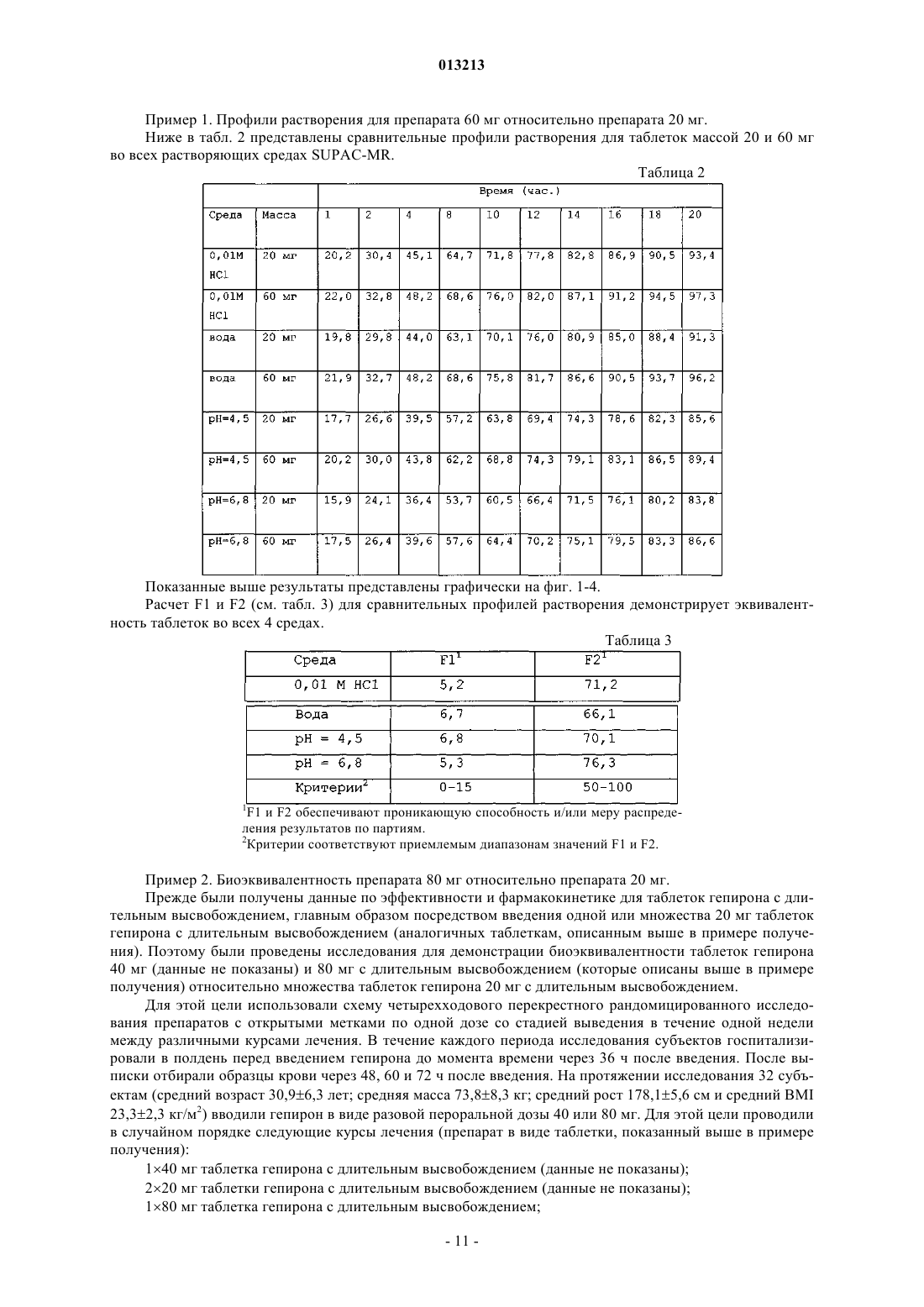
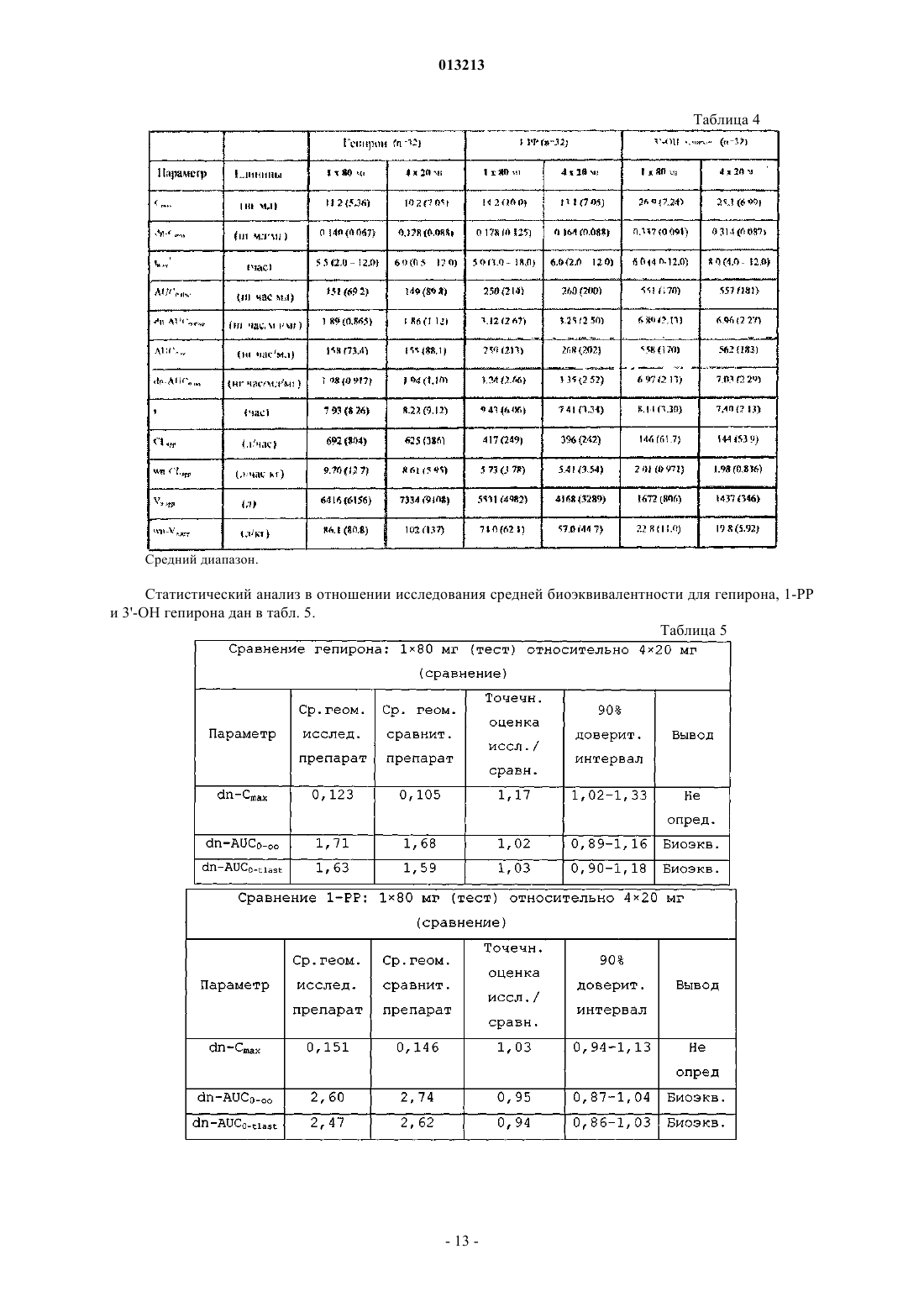
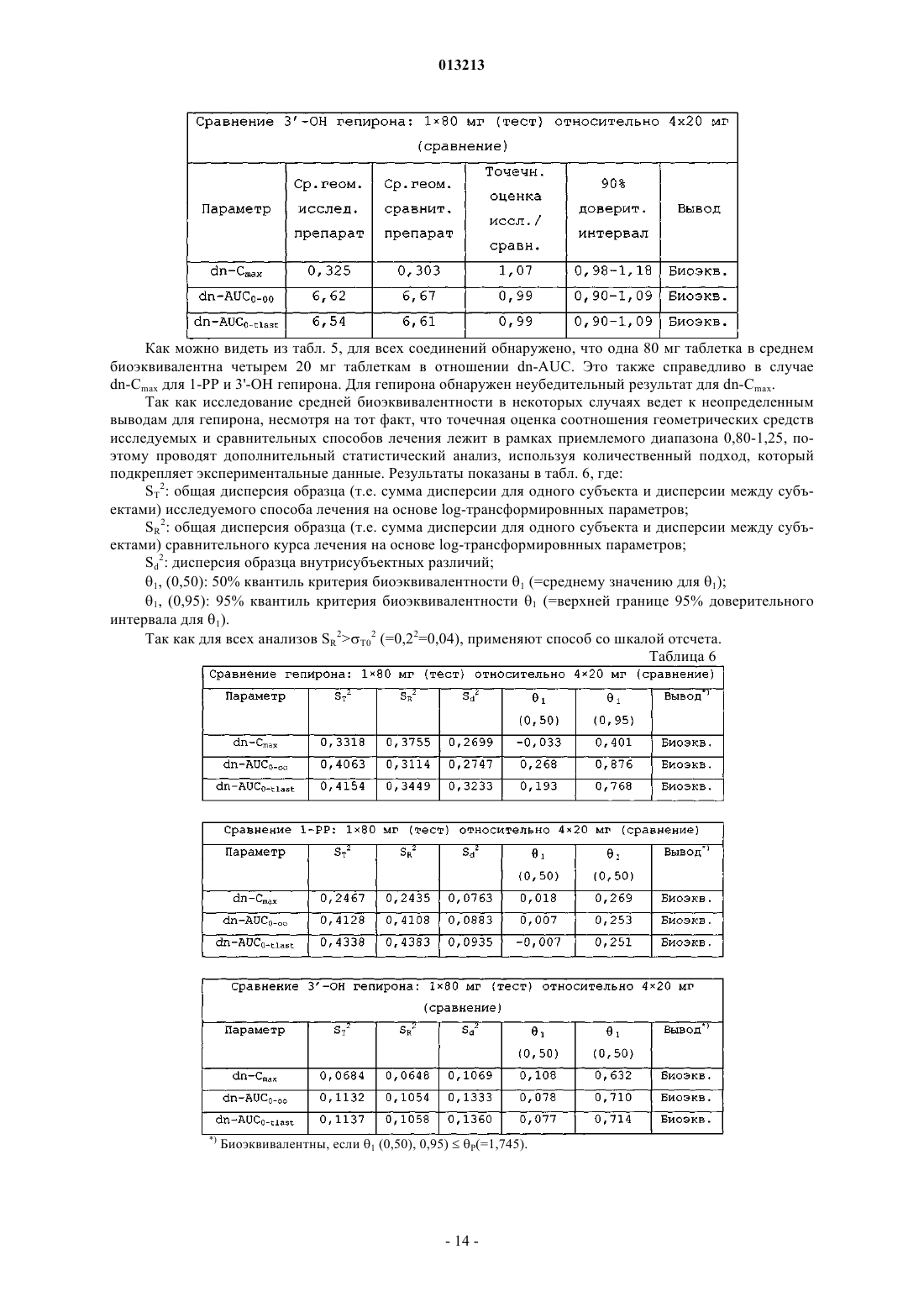
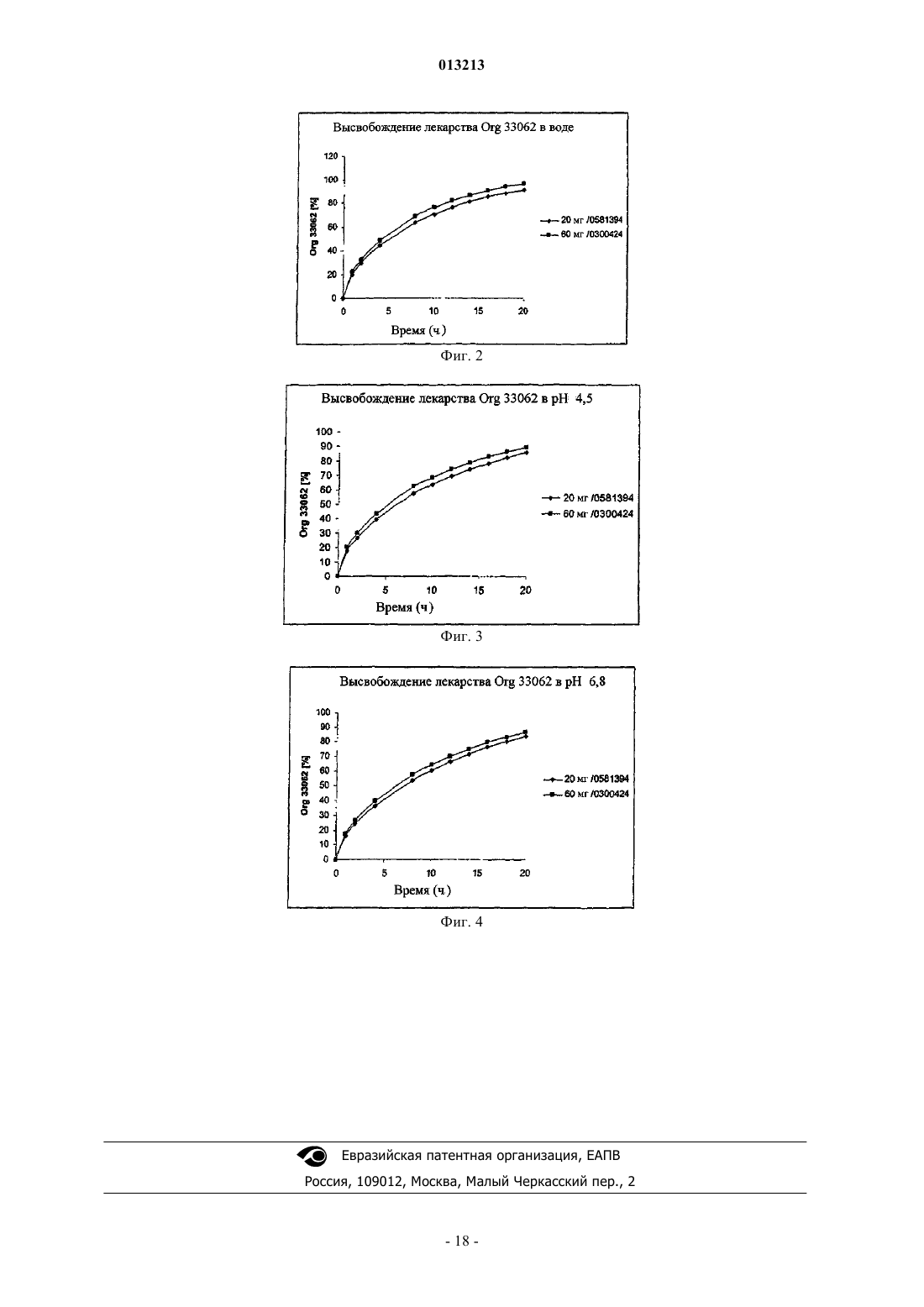
013213 Предпосылки изобретения Область техники, к которой относится изобретение Настоящее изобретение касается дозированной формы биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением и способов лечения депрессии посредством введения этой дозированной формы нуждающемуся в этом субъекту. Более конкретно, настоящее изобретение касается таблетированной формы биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением активного ингредиента. Настоящее изобретение также касается способа лечения депрессии у млекопитающих посредством введения нуждающемуся в этом субъекту эффективного количества дозированной формы биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением согласно настоящему изобретению. Предшествующий уровень техники Гепирон (также известный как 4,4-диметил-1-[4-[4-(2-пиримидинил)-1-пиперазинил]бутил]-2,6 пиперидиндион гидрохлорид) может быть получен способом, описанным в примере 7 патента США 4423049, Temple (который включен в данное описание во всей своей полноте в виде ссылки), и имеет следующую структуру: Известно, что гепирон и его соли обладают антидепрессивными и анксиолитическими свойствами,предположительно являясь агонистами рецептора 5-HT1A. Их обычно используют для лечения депрессии, дистимии, импульсивных расстройств, острых тревожных состояний с панической реакцией и подобного. Однако в препаратах с немедленным высвобождением гепирон имеет короткий период полувыведения. Время до достижения максимальной концентрации лекарства в кровотоке (Tmax) для гепирона составляет около 1 ч и его Т 50 (т.е. время до 50% высвобождения лекарства в контролируемых условияхin vitro) составляет около 2,5-3 ч (см. патент США 5478572, включенный в данное описание во всей своей полноте в виде ссылки). Из-за быстрого метаболизма гепирон вводили в прошлом несколькими небольшими дозами, например дозами от 5 до 10 мг, 2-3 раза в день. Однако эта схема многократного приема может вести к проблемам соблюдения режима. Кроме того, пропуск второй или третьей дозы ведет к недопустимо низким уровням гепирона в плазме. Более того, исследования показывают, что в течение 15-20 ч после приема пероральные препараты гепирона с немедленным высвобождением могут давать существенные вариации концентраций в плазме человека. (Дополнительное обсуждение см. в работе D.S.Robinson и др., ClinicalTherapeutics, 1618-1633 (2003. Однако каждый пациент требует разных уровней дозировки, как для любого медицинского соединения, чтобы конкретно адаптировать лечение к физическому состоянию, возрасту и сложности заболевания этого пациента. Таким образом, даже при форме гепирона с низкой дозой и длительным высвобождением, раскрытой в патенте США 5478572, может потребоваться многократный прием доз (т.е. 4 таблетки с дозировкой 20 мг в отличие от 1 таблетки с высокой дозировкой), что является неудобным и дорогим. По существу, остается критическая потребность в форме гепирона с высокой дозировкой и длительным высвобождением, имеющей профиль растворения, аналогичный форме гепирона с низкой дозировкой и длительным высвобождением, раскрытой в патенте США 5478572, сохраняя такую же относительную биоэквивалентность. Ранее полагали, что невозможно получить форму гепирона с высокой дозировкой и длительным высвобождением, которая не дает неудовлетворительного повышения количества 1-(2-пиримидинил)пиперазина (главного метаболита гепирона, который, как считают, ответственен за вредные побочные эффекты, включая головокружение, тошноту, головную боль и сонливость) или снижения относительной эффективности. Этот скептицизм появился потому, что для достаточного регулирования высвобождения гепирона надо было бы повысить содержание связующего до такой степени, что результирующая таблетка для перорального приема стала бы "лошадиной пилюлей" (т.е. недопустимо большой). В качестве альтернативы должна была быть приготовлена дозированная форма для доставки менее желательными способами (например, посредством внутривенного введения).-1 013213 Сущность изобретения Предметом настоящего изобретения является дозированная форма, содержащая:(a) примерно от 14 до 25 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;(b) примерно от 70 до 85 мас.% фармацевтически приемлемой целлюлозной полимерной матрицы и(c) подходящие количества одного или более фармацевтически приемлемых наполнителей, где скорость высвобождения биоактивного метаболита гепирона из дозированной формы такова, что для достижения примерно 90-95% абсорбции биоактивного метаболита гепирона требуется примерно от 18 до 24 ч. В предпочтительных вариантах осуществления изобретения (с) дополнительно содержит по меньшей мере один фармацевтически приемлемый наполнитель, выбранный из группы, включающей краситель, микрокристаллическую целлюлозу, коллоидный диоксид кремния и стеарат магния; (b) представляет собой гидроксипропилметилцеллюлозу, имеющую вязкость примерно от 15000 до 100000 сП; и концентрация (а) составляет примерно от 15,5 до 18,7 мас.% Указанный биоактивный метаболит гепирона может быть выбран из группы, включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон. Изобретение также относится к дозированной форме, которая представлена в виде таблетки, где общая масса указанной таблетки составляет от 350 до 450 мг и масса (а) в указанной таблетке составляет от 60 до 80 мг. Предпочтительно указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. В альтернативном варианте осуществления изобретения указанная таблетка имеет овальнопрямоугольную форму с плоскими гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. Другой вариант изобретения включает дозированную форму, содержащую:(a) примерно от 14,0 до 24,4 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;(b) от 70,5 до 82,1 мас.% гидроксипропилметилцеллюлозы, имеющей вязкость примерно от 15000 до 100000 сП;(e) примерно от 0,39 до 0,47 мас.% коллоидного диоксида кремния и(f) примерно от 0,29 до 1,0 мас.% стеарата магния. Предпочтительно (а) составляет примерно от 15,5 до 18,7 мас.%, а фармацевтически приемлемая соль биоактивного метаболита гепирона является гидрохлоридом. В конкретном варианте осуществления изобретения (с) представляет собой один или более оксидов железа, при этом (с) составляет от 0 примерно до 0,3 мас.%, (е) составляет примерно от 0,42 до 0,47 мас.%, где общая масса указанной таблетки составляет от 350 до 450 мг. Масса (а) в указанной таблетке составляет от 60 до 80 мг, и таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. В другом варианте осуществления указанная таблетка имеет овально-прямоугольную форму с плоскими гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. Другое осуществление изобретения включает способ получения таблетки, предусматривающий:(i) смешивание всех или части компонентов от (а) до (f);(ii) перемешивание смеси, полученной на стадии (i);(iii) добавление части или оставшихся компонентов от (а) до (f);(iv) перемешивание смеси, полученной на стадии (iii), если какие-либо компоненты добавляют на стадии (iii);(v) получение заготовки из смеси со стадии (iv);(vi) измельчение заготовки, полученной на стадии (v);(vii) добавление оставшегося компонента (f), если часть сохранена на стадиях (i) и (iv);(viii) перемешивание смеси со стадии (vii);(ix) прессование смеси со стадии (viii) с получением таблетки. Предпочтительно способ получения таблетки включает:i) смешивание всех компонентов (а), всех компонентов (с), всех компонентов (е) и 20% от общей концентрации компонента (b);ii) перемешивание смеси со стадии (i);iii) добавление к смеси со стадии (ii) всех компонентов (d), половины от общей концентрации компонента (f) и оставшихся 80% от общей концентрации компонента (b);iv) перемешивание смеси со стадии (iii);v) получение заготовки смеси со стадии (iv);vi) измельчение заготовки со стадии (v);vii) добавление оставшихся 50% компонента (f) к измельченной заготовке со стадии (vi);viii) перемешивание смеси со стадии (vii);ix) прессование смеси со стадии (viii) в конечную желательную форму. В одном из конкретных вариантов осуществления изобретения дозированная форма может содержать:(a) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;(e) примерно 0,42 мас.% коллоидного диоксида кремния и (f) примерно 0,31 мас.% стеарата магния. В одном из вариантов осуществления изобретения общая масса указанной таблетки составляет 385 мг; масса (а) в указанной таблетке составляет 60 мг; при этом указанная таблетка имеет овальнопрямоугольную форму с двояковыпуклыми гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. В другом варианте осуществления указанная таблетка имеет овально-прямоугольную форму с плоскими гранями и итоговым размером 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. В одном из вариантов дозированная форма, по существу, содержит:(a) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;(e) примерно 0,42 мас.% коллоидного диоксида кремния и (f) примерно 0,31 мас.% стеарата магния. В другом варианте осуществления дозированная форма содержит:(а) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;(e) примерно 0,39 мас.% коллоидного диоксида кремния и (f) примерно 0,29 мас.% стеарата магния. В конкретном варианте осуществления общая масса указанной таблетки составляет 410 мг; масса(а) в указанной таблетке составляет 80 мг. В другом конкретном варианте осуществления дозированная форма, по существу, содержит:(a) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;(e) примерно 0,39 мас.% коллоидного диоксида кремния и(f) примерно 0,29 мас.% стеарата магния. Данное изобретение также относится к способу лечения депрессии у нуждающегося в этом пациента, включающему введение указанному пациенту эффективного количества дозированной формы по изобретению. В предпочтительном варианте воплощения указанный пациент является человеком страдающим и указанное эффективное количество составляет от 0,01 до 40 мг/кг массы тела в день. Указанные выше предметы обозначают определенные аспекты изобретения. Дополнительные задачи, аспекты и варианты изобретения находятся в следующем подробном описании изобретения. Краткое описание чертежей Более полное понимание изобретения и многих сопутствующих преимуществ легко получить, и они станут понятнее при обращении к следующим фигурам в сочетании с их подробным описанием. На фиг. 1 показан сравнительный профиль растворения таблеток массой 20 и 60 мг, описанных в примере получения, в 0,01 М HCl (см. пример 1). На фиг. 2 показан сравнительный профиль растворения таблеток массой 20 и 60 мг, описанных в примере получения, в воде (см. пример 1). На фиг. 3 показан сравнительный профиль растворения таблеток массой 20 и 60 мг, описанных в примере получения, в среде с рН 4,5 (см. пример 1). На фиг. 4 показан сравнительный профиль растворения таблеток массой 20 и 60 мг, описанных в примере получения, в среде с рН 6,8 (см. пример 1).-3 013213 Подробное описание изобретения Если не определено специально, все используемые здесь технические и научные термины имеют те же значения, которые обычно понятны специалистам в области биохимических, химических, фармакологических и медицинских наук. Все способы и материалы, аналогичные или эквивалентные описанным здесь способам и материалам, можно использовать при практическом применении или проверке настоящего изобретения, при том,что здесь описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие упоминаемые здесь сноски включены во всей своей полноте в виде ссылок. В случае противоречия настоящее описание, включая определения, является определяющим. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения, если не указано иное. Настоящее изобретение частично основано на открытии заявителя, что можно получить форму биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением, где дозированная форма имеет профиль растворения и биоэквивалентность (для 1-РР, 3'-ОН гепирона и гепирона), сопоставимые с характеристиками формы гепирона с низкой дозировкой и длительным высвобождением, раскрытой в патенте США 5478572, несмотря на понижение итогового соотношения между активными ингредиентами и полимером, регулирующим высвобождение (связующего). Лекарственные формы с длительным высвобождением активного ингредиента (в особенности, гепирона) предлагают много преимуществ над системами с немедленным высвобождением. На прием дозированных форм с длительным высвобождением легче получить согласие пациентов, так как их надо принимать один раз в 24 ч. Таким образом, если вводят ER-дозированные формы, не происходит недопустимого изменения концентраций в плазме, а именно нет высоких начальных уровней лекарства, которые связаны с появлением нежелательных побочных эффектов, а также быстрых спадов уровней лекарства ниже терапевтических уровней. Кроме того, в случае биоактивного метаболита гепирона благодаря медленному высвобождению поддерживают концентрации 1-РР на удовлетворительном уровне, избегая,таким образом, существенных осложнений, являющихся результатом действия этого метаболита. В общем варианте настоящее изобретение касается дозированной формы биоактивного метаболита гепирона для перорального приема с длительным высвобождением, содержащей:(1) примерно от 14 до 25 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;(2) примерно от 70 до 85 мас.% фармацевтически приемлемой целлюлозной полимерной матрицы и(3) подходящие количества одного или более фармацевтически приемлемых наполнителей, где скорость высвобождения биоактивного метаболита гепирона из дозированной формы такова, что для достижения примерно от 90 до 95% абсорбции биоактивного метаболита гепирона требуется примерно от 18 до 24 ч. В особо предпочтительном варианте настоящего изобретения дозированная форма гепирона для перорального приема с длительным высвобождением содержит (в мас.%):(а) примерно от 14,0 до 24,4% (предпочтительно, примерно от 15,5 до 18,7%) гепирона или его биоактивного метаболита в виде свободного основания или его фармацевтически приемлемой соли, например гидрохлорида;(b) примерно от 70,5 до 82,1% гидроксипропилметилцеллюлозы, имеющей вязкость примерно от 15000 до 100000 сП;(e) примерно от 0,39 до 0,47% (предпочтительно примерно от 0,42 до 0,47%) коллоидного диоксида кремния и(f) примерно от 0,29 до 1,0% стеарата магния. Хотя приведенный выше вариант определен на основе конкретных соединений для каждого компонента, следует понимать, что в пределах области настоящего изобретения эти компоненты можно заменить по отдельности или в различных комбинациях, как описано ниже. Для каждого приведенного ниже компонента следует понимать, что указанные ниже проценты по массе отражают общую концентрацию каждого компонента. Например, если имеется смесь соединений, которая попадает в область определенной группы компонентов, то указанный процент по массе отражает общее количество для этой смеси соединений. Компонент (а). В предпочтительном варианте компонент (а) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве примерно от 14,0 до 24,4 мас.%, более предпочтительно примерно от 15,5 до 18,7 мас.%. Особо предпочтительным компонентом (а) является биоактивный метаболит гепирона или его фармацевтически приемлемая соль.In vivo метаболизм гепирона дает основные фармакологически активные метаболиты: 1-(2-пиримидинил)пиперазин (1-РР) и 3'-ОН гепирон (D.S. Robinson и др., Clinical Therapeutics, p. 16181633 (2003. In vivo также образуются два дополнительных метаболита, которые также могут обладать биоактивностью: 5-ОН гепирон и 3',5-дигидроксигепирон.-4 013213 Полагают, что у людей высвобождение 1-РР, общего метаболита азапирона, отвечает за вредные побочные эффекты, включая головокружение, тошноту, головную боль и сонливость. Кроме того, 1-РР представляет собой антагонист пресинаптических -2-адренорецепторов, и сообщается, что в доклинических испытаниях он не проявляет характеристик, подобных характеристикам антидепрессантов(D.S. Robinson и др., Clinical Therapeutics, p. 1618-1633 (2003. В отличие от него биоактивные метаболиты (в частности, 3'-ОН гепирон) обладают существенным сродством к рецепторам 5-HT1A. Показано,что 3'-ОН гепирон модифицирует нейротрансмиссию 5-НТ сопоставимым с гепироном образом, хотя 3'-ОН, как обнаружено, демонстрирует полный агонизм относительно постсинаптических рецепторов в гиппокампе, тогда как гепирон является частичным агонистом (D.S. Robinson и др., Clinical Therapeutics,p. 1618-1633 (2003. Принимая во внимание вышесказанное, в варианте настоящего изобретения можно использовать один или более из биоактивных метаболитов гепирона: 3'-ОН гепирон, 5-ОН гепирон и 3',5-дигидроксигепирон, или их фармацевтически приемлемых солей. Кроме того, хотя предпочтительной является форма фармацевтически приемлемой соли, предполагается, что биоактивные метаболиты гепирона могут быть в виде гидрата, энантиомерной формы, или смеси, или кристаллической формы. Фармацевтические соединения, подходящие для введения по настоящему изобретению, могут представлять собой соли гидрохлориды, но подходящими также являются свободные основания и другие фармацевтически приемлемые соли. Выражение "фармацевтически приемлемая соль" хорошо известно в данной области, за дополнительным описанием направляем специалистов к работе S.М. Berge и др., J.Pharmaceutical Sciences, 66: 1-19 (1977), включенной здесь в виде ссылки. Подходящие для введения фармацевтически приемлемые соли по настоящему изобретению включают аддитивные соли кислот. Аддитивную соль кислоты можно получить, смешивая раствор соединения с раствором фармацевтически приемлемой нетоксической кислоты, такой как соляная кислота, бромисто-водородная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, винная кислота, угольная кислота, фосфорная кислота, хлорная кислота, серная кислота, щавелевая кислота или малоновая кислота. Если соединение несет кислотную группу, например карбокислотную группу, настоящее изобретение также рассматривает его соли, предпочтительно нетоксические фармацевтически приемлемые соли, такие как соли натрия, калия и кальция. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат,глюконат, полусульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат,нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пиктат,пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, паратолуолсульфонат, ундеканоат,валерат и подобные. Типичные соли щелочных и щелочно-земельных металлов включают соли натрия,лития, калия, кальция, магния и подобные. Дополнительные фармацевтически приемлемые соли включают, если такие подходят, соли аминогрупп. Соли аминогрупп могут также содержать четвертичные аммониевые соли, в которых атом аминоазота несет алкильную, алкенильную, алкинильную или аралкильную группу, нетоксические катионы аммония, четвертичного аммония и амина, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат,(низший алкил)сульфонат и арилсульфонат. Компонент (b). В предпочтительном варианте компонент (b) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве примерно от 70,5 до 82,1 мас.% Предпочтительным компонентом (b) является гидроксипропилметилцеллюлоза, имеющая вязкость примерно от 15000 до 100000 сП, которая представляет собой полимер с регулируемым высвобождением и связующее (известное также как агент, замедляющий высвобождение). Для пероральных препаратов и дозированных форм предпочтительно использование полимерной целлюлозной матрицы или агента, замедляющего высвобождение. Подходящие матрицы включают гидроксиалкилзамещенные алкилцеллюлозы, имеющие вязкости примерно от 15000 до 100000 сП. Примеры приемлемых образцов гидроксиметилпропилцеллюлозы (НРМС) включают марки K15M и K100M (т.е. 15000 и 100000 сП соответственно). В настоящем изобретении НРМС можно заменить (целиком или частично) или добавить, заменить некоторую долю или всю НРМС-матрицу можно дифосфатом кальция или лактозой, каждый из которых,как правило, повышает скорость растворения. В дополнение к связующему компоненту (b) препарат настоящего изобретения может также содержать вспомогательные связующие агенты, такие как сироп, гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон. Примеры подходящих наполнителей или разбавителей также включают крахмалы (например, кукурузный крахмал), лактозу, сорбит, глицин, сахарозу, глюкозу, маннит, кремниевую кислоту, цитрат натрия и дифосфат кальция. Примеры других подходящих связующих могут включать-5 013213 хитозан, альгинаты, желатин, поливинилпирролидинон, сахарозу, гуммиарабик и их смеси. В варианте настоящего изобретения соотношение гепирона к связующему (гепирон:связующее) составляет от 1:3,5 до 1:14,5. Предпочтительным связующим является гидроксиметилпропилцеллюлоза(НРМС). Компонент (с). В предпочтительном варианте компонент (с) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве от 0 примерно до 1 мас.%, предпочтительно от 0 примерно до 0,3 мас.%. Хотя компонент (с) может быть любым красителем, предпочтительно, чтобы краситель представлял собой оксид железа. В особо предпочтительном варианте оксид железа представляет собой красный оксид трехвалентного железа, желтый оксид трехвалентного железа или их смеси. Дополнительные типичные красители, которые можно использовать вместо или в дополнение к указанным выше, включают, но не ограничены этим, пигменты FDC и DC, диоксид титана, оксиды железа, природные пигменты или красители, одобренные для приема внутрь Федеральным управлением по контролю за лекарствами США, или их комбинации. Компонент (d). В предпочтительном варианте компонент (d) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве примерно от 8,0 до 16,7 мас.%. Хотя компонент (d) может быть любым разбавителем и/или вспомогательным средством для прессования, предпочтительно,чтобы разбавитель/вспомогательное средство для прессования представляло собой микрокристаллическую целлюлозу. Дополнительные разбавители могут включать, но не ограничены этим, воду или другие растворители, агенты, способствующие растворению, и эмульгаторы, например этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, эфиры жирных кислот и сорбита и их смеси. Еще в одном варианте настоящего изобретения соотношение гепирона к разбавителю (гепирон:разбавитель) составляет от 1:3 до 2,5:1. Предпочтительным разбавителем является микрокристаллическая целлюлоза. Компонент (е). В предпочтительном варианте компонент (е) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве примерно от 0,39 до 0,47 мас.%, предпочтительно примерно от 0,42 до 0,47 мас.%. Хотя компонент (е) может быть любым агентом для скольжения, предпочтительно, чтобы агент для скольжения представлял собой коллоидный кремнезем (коллоидный диоксид кремния). Дополнительные агенты для скольжения включают, но не ограничены этим, кукурузный крахмал,тальк, стеариновую кислоту или их комбинации. Компонент (f). В предпочтительном варианте компонент (f) присутствует в дозированной форме для перорального приема с длительным высвобождением в количестве примерно от 0,29 до 1,0 мас.%. Хотя компонент (f) может быть любым лубрикантом, предпочтительно, чтобы лубрикант представлял собой стеарат магния. Дополнительные лубриканты могут включать, но не ограничены этим, целлюлозу, тальк, полиэтиленгликоль, кремнеземы, лаурилсульфат натрия, стеарат кальция и их смеси. Альтернативные компоненты. В настоящем изобретении предполагается, что пероральная дозированная форма с длительным высвобождением в дополнение к компонентам (a)-(f) может также содержать различные дополнительные компоненты. На основании вышеописанного и работы Remington's Pharmaceuticals Sciences, 18th Edition(включенной в данное описание в виде ссылки), главным образом части 8 "Фармацевтические препараты и их получение" опытный специалист в пределах своей компетенции легко добавит к описанным выше предпочтительным вариантам новые соединения. В варианте настоящего изобретения пероральная дозированная форма с длительным высвобождением активного ингредиента может включать один или более дополнительных фармацевтически приемлемых носителей. Используемое здесь выражение "фармацевтически приемлемый носитель" обозначает нетоксический инертный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательный препарат. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, уже упоминались выше, следовательно, понятно,что в этом аспекте изобретения фармацевтически приемлемый носитель может представлять собой любой тип наполнителя, разбавителя, инкапсулирующего материала или вспомогательного препарата, не упоминавшийся ранее. В другом варианте пероральная дозированная форма с длительным высвобождением активного ингредиента может также включать один или более высвобождающих агентов, покрывающих агентов, подсластителей, вкусовых агентов и ароматизаторов, консервантов и антиоксидантов.-6 013213 Вкусовой агент(ы), который используют, главным образом, для маскировки вкуса и/или запаха,может представлять собой ванилин, цитрат натрия, лимонную кислоту, масло мяты, апельсиновое, лимонное масло или любой другой фармацевтически одобренный ароматизатор или агент маскировки вкуса и их комбинации. Форма и физическое состояние дозированной формы биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением. Настоящее изобретение рассматривает пероральные дозированные формы с длительным высвобождением активного ингредиента, которые подходят для перорального приема. Эти формы включают таблетки, капсулы, таблетки в виде капсул, лепешки, порошки, суспензии, сиропы и подобные подходящие формы. Предпочтительно можно упомянуть таблетку, включая таблетку, имеющую выпуклую форму,сферическую (т.е. шарообразную) форму или форму капсулы. В предпочтительном варианте пероральная дозированная форма биоактивного метаболита гепирона с длительным высвобождением представляет собой таблетку. Таблетка предпочтительно имеет овальную форму, что увеличивает площадь ее поверхности и улучшает высвобождение из нее гепирона. Более предпочтительно, если таблетка имеет овально-прямоугольную форму, которая может иметь плоские или двояковыпуклые грани. Если пероральная дозированная форма биоактивного метаболита гепирона с длительным высвобождением представляет собой таблетку, имеющую овально-прямоугольную форму, то предпочтительно, чтобы таблетка имела итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма при толщине 0,2400,025 дюйма (двояковыпуклые грани) или 0,1950,025 дюйма (плоские грани). В другом варианте настоящего изобретения итоговая масса таблетки составляет от 350 до 450 мг,предпочтительно от 375 до 425 мг, более предпочтительно от 385 до 410 мг. Кроме того, в контексте настоящего изобретения диапазон масс таблетки от 350 до 450 мг, предпочтительно от 375 до 425 мг, более предпочтительно от 385 до 410 мг соответствует общей массе стандартной дозированной формы. Следовательно, фармацевтические композиции (а именно, пероральная дозированная форма биоактивного метаболита гепирона с длительным высвобождением) по настоящему изобретению предпочтительно содержат примерно от 55 до 100 мг (предпочтительно от 60 до 80 мг, более предпочтительно 60 или 80 мг) активного ингредиента на стандартную дозу. Если требуется, на таблетки можно нанести покрытие, применяя известные способы и наполнители,которое может включать энтеросолюбильное покрытие, использующее, например, фталат гидроксипропилметилцеллюлозы. Если требуется, можно получить такие таблетки с энтеросолюбильными покрытиями известными способами, например, используя ацетатфталат целлюлозы. Они могут необязательно содержать агенты непрозрачности и могут также представлять собой композицию, которая высвобождает активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно с задержкой. Примеры покрывающих композиций, которые можно использовать, включают полимерные вещества и воски. Аналогично можно получить известными способами капсулы, например твердые или мягкие желатиновые капсулы, содержащие активное соединение с добавлением наполнителей или без них, и, если требуется, обеспечить известным способом энтеросолюбильные покрытия. Содержимое капсулы можно приготовить, применяя известные способы таким образом, чтобы получить длительное высвобождение активного соединения. В таких твердых дозированных формах активное соединение можно смешать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. В обычной практике такие дозированные формы могут также содержать дополнительные вещества, отличные от инертных разбавителей, например лубриканты для таблетирования и другие вспомогательные агенты для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль дозированные формы могут также содержать буферные агенты. Они могут необязательно содержать агенты непрозрачности и могут также представлять собой композицию, которая высвобождает активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно с задержкой. Примеры покрывающих композиций, которые можно использовать, включают полимерные вещества и воски. Можно также применять в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах твердые композиции аналогичного типа, используя такие наполнители, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и подобные. Способы лечения. Биоактивный метаболит гепирона можно вводить перорально один раз в день в виде дозированных форм с длительным высвобождением, которые содержат биоактивный метаболит гепирона, целлюлозную полимерную матрицу и подходящие количества фармацевтических наполнителей. Результирующий препарат гепирона обеспечивает продукты для перорального применения, которые высвобождают от 90 до 95% активного агента за период примерно от 19 до 24 ч.-7 013213 Следовательно, еще один вариант настоящего изобретения касается способа лечения пациента, диагностированного как страдающего от серьезной (первичной или общей) депрессии, с генерализованным чувством тревоги или без оного, включающего введение указанному пациенту эффективного количества пероральной дозированной формы биоактивного метаболита гепирона с длительным высвобождением,которая описана в настоящем изобретении. В данном варианте нуждающемуся в лечении пациенту (предпочтительно человеку, но, включая всех млекопитающих) сначала ставят диагноз как страдающему от определенного депрессивного состояния. За обсуждением оценки пациентов, диагностических критериев и др. в состоянии тревоги и депрессии отсылаем специалистов к работе DSM-IV-TR (Diagnostic and Statistical Manual of Mental Disorders,American Psychiatric Association, Washington, D.C., 2000; Depressive Disorders: 369-428, and Anxiety Disorders: 429-484). С этой целью композиция биоактивного метаболита гепирона с длительным высвобождением и дозированные формы по изобретению предназначены для доставки эффективного антидепрессивного и/или анксиолитического количества биоактивного метаболита гепирона или его фармацевтически приемлемой соли пациенту млекопитающему, предпочтительно человеку. Используемое здесь выражение "эффективные" дозы, относящееся к количеству примерно от 0,01 до 40 мг/кг массы тела в день, предполагает предпочтительно от 0,05 до 20 мг/кг массы тела в день, более предпочтительно от 0,1 до 2 мг/кг массы тела в день. Для некоторых определенных расстройств центральной нервной системы рекомендуется от 15 до 90 мг/день, предпочтительно 30-60 мг/день. См. патент США 4771053 и патент США 5478572. Альтернативно, эффективная доза или система доставки должна обеспечивать концентрации в плазме в диапазоне примерно от 1 до 20 нг/мл, предпочтительно примерно от 1 до 5 нг/мл. Как описано выше в варианте настоящего изобретения, пероральная дозированная форма биоактивного метаболита гепирона с длительным высвобождением для использования в способе по изобретению содержит (выражено в мас.%):(а) примерно от 14,0 до 24,4% (предпочтительно, примерно от 15,5 до 18,7%) биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли, например гидрохлорида;(b) примерно от 70,5 до 82,1% гидроксипропилметилцеллюлозы, имеющей вязкость примерно от 15000 до 100000 сП;(e) примерно от 0,39 до 0,47% (предпочтительно примерно от 0,42 до 0,47%) коллоидного диоксида кремния и(f) примерно от 0,29 до 1,0% стеарата магния. Как указано здесь выше, биоактивный метаболит гепирона в виде дозированной формы для перорального приема с длительным высвобождением также включает биоактивные метаболиты гепирона,выбранные из группы, включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон. В способе может использоваться одно из этих соединений. Однако также рассматриваются комбинации этих метаболитов или комбинации метаболитов с другими активными или инертными ингредиентами. Кроме того, настоящее изобретение касается способов облегчения депрессии, состояния тревоги или психологических расстройств у пациента (предпочтительно человека, но включая всех млекопитающих), нуждающегося в таком лечении, посредством введения пациенту эффективного количества или дозы гепирона или биоактивного метаболита гепирона, например 3'-ОН гепирона,3',5-дигидроксигепирона и 5-ОН гепирона. Введение гепирона или биоактивного метаболита гепирона,как здесь подразумевается, включает введение любой активной формы соли, гидрата, энантиомерной формы, смеси или кристаллической формы соединения. Также объем настоящего изобретения включает способы, в которых пероральную дозированную форму биоактивного метаболита гепирона с длительным высвобождением вводят (последовательно или одновременно) с одним или несколькими антидепрессивными или анксиолитическими агентами при комбинационной терапии для лечения депрессии и/или состояния тревоги. Способы получения. Пероральную дозированную форму биоактивного метаболита гепирона с длительным высвобождением по настоящему изобретению можно получить по следующей методике:(i) смешивание всех или части компонентов от (а) до (f);(iii) добавление части или остатка (если имеется) компонентов от (а) до (f);(iv) перемешивание смеси (если добавляли остаток на стадии (iii;(v) получение заготовки из массы;(vii) добавление остатка лубриканта (компонент (f), если оставляли часть на стадиях (i) и (iv;(ix) прессование таблеток из конечной смеси. Конечно, понятно, что указанные выше стадии можно менять местами или заменять, пока перегруппировка или замена не меняет существенным образом фармакологическую эффективность дозированной формы, получаемой описанным выше способом. В этом отношении специалиста отсылают к работе Remington's Pharmaceutical Sciences, 18th Edition (включенной здесь в виде ссылки), например к ее части 8 "Фармацевтические препараты и их получение". Кроме того, к сведению специалиста представляются методики обработки, описанные в патентах США 4423049 и 5478572 (включенные в данное описание в виде ссылок), в которых приведены подходящие примеры описанного выше способа получения пероральной дозированной формы гепирона с длительным высвобождением. В предпочтительном варианте следуют приведенной далее методике для получения пероральной дозированной формы биоактивного метаболита гепирона с длительным высвобождением по изобретению:i) смешивание всех компонентов (а), всех компонентов (с), всех компонентов (е) и 20% от общей концентрации компонента (b);ii) перемешивание смеси со стадии (i);iii) добавление к смеси со стадии (ii) всех компонентов (d), половины от общей концентрации компонента (f) и оставшихся 80% от общей концентрации компонента (b);iv) перемешивание смеси со стадии (iii);v) получение заготовки из смеси со стадии (iv);vi) измельчение заготовки со стадии (v);vii) добавление оставшихся 50% компонента (f) к измельченной заготовке со стадии (vi);viii) перемешивание смеси со стадии (vii);ix) прессование смеси со стадии (viii) в виде конечной желательной формы. Обычно получаемые смеси прессуют на стадии (ix) в таблетки или микрогранулы. Если получают микрогранулы, на них необязательно наносят верхнее покрытие из обычного покрывающего адъюванта(адъювантов) и затем получают таблетки или заполняют ими капсулы. В случае, когда желательно энтеросолюбильное покрытие, это покрытие обычно добавляют после стадии (ix). Понятно, что можно увеличить масштаб каждого из описанных выше способов получения до промышленно приемлемого масштаба, и способы никоим образом не ограничены индивидуальными способами получения дозированных форм. Предполагается также, что можно производить изменения каждой стадии (индивидуально или коллективно) для упрощения производства пероральной дозированной формы биоактивного метаболита гепирона с длительным высвобождением по изобретению, пока модификации не изменяют состав конечного продукта за пределы переносимости, описанные выше, или биоэффективности получаемого продукта. Приведенное выше описание изобретения касается метода и способа его получения и использования таким образом, чтобы специалист в данной области был способен его выполнить и использовать, эта возможность обеспечивается, в частности, для предмета обсуждения приложенной формулы изобретения, которая составляет часть оригинального описания. Используемые выше выражения "выбранный из группы, включающей" "выбранный из" и подобные включают смеси перечисленных материалов. Где указан числовой предел или диапазон, включены конечные точки. Также включены все конкретные величины и поддиапазоны в рамках числовых пределов или диапазонов, как если бы были подробно выписаны. В этом отношении, если указано выражение "примерно", его следует понимать так, что включены указанные величины, а также величины, которые отклоняются от указанного значения на 1%(выше или ниже в зависимости от того, определяет ли "примерно" верхнюю или нижнюю границу),предпочтительно на 0,5% от указанного значения. Приведенное выше описание представлено для того, чтобы дать возможность специалисту в данной области выполнить и применить изобретение, и приведено в контексте конкретного применения и потребностей. Специалисту в данной области ясны различные модификации предпочтительных вариантов,и определенные здесь общие принципы можно применить к другим вариантам и применениям, не отклоняясь от духа и области изобретения. Таким образом, не предполагается, что это изобретение ограничено показанными вариантами, но должно предоставлять самую широкую область, согласующуюся с раскрытыми здесь принципами и отличительными признаками. Описывая обычным образом данное изобретение, можно получить дополнительное понимание, обращаясь к некоторым конкретным примерам, которые приведены здесь только для иллюстрации и не предназначены для ограничения, если не указано иное.-9 013213 Иллюстративные примеры Пример получения. Следуя описанной выше методике и патенту США 5478572, получают пероральную дозированную форму гепирона с длительным высвобождением в виде таблетки. Как правило, эта методика включает:(i) смешивание всего гепирона гидрохлорида, всего красителя, всего коллоидного диоксида кремния и 20% от общей массы гидроксипропилметилцеллюлозы;(ii) перемешивание смеси со стадии (i) в течение 15 мин и затем разрушение комков, используя пластину Fitzmill 0020;(iii) добавление к смеси со стадии (ii) всей микрокристаллической целлюлозы, 50% от общей массы стеарата магния и оставшихся 80% от общей массы гидроксипропилметилцеллюлозы;(iv) перемешивание смеси со стадии (iii) в течение 28 мин;(v) получение заготовки из смеси со стадии (iv) использование роторного таблеточного пресса;(vi) измельчение заготовки со стадии (v) использование пластины Fitzmill 0093;(vii) добавление оставшихся 50% стеарата магния к измельченной заготовке со стадии (vi);(viii) введение лубриканта/перемешивание смеси со стадии (vii) в течение 7 мин и(ix) прессование смеси со стадии (viii) в конечные таблетки желательной формы. Таким способом получают таблетки овально-прямоугольной формы, имеющие двояковыпуклые грани. Итоговые размеры таблетки составляют 0,405 дюйма (102,87 мм) на 0,338 дюйма (85,85 мм) с глубиной чаши 0,050 дюйма (12,70 мм). Ниже в табл. 1 приведены массы таблеток и количество компонентов на единицу. Таблица 1 Указывает содержание свободного основания.- 10013213 Пример 1. Профили растворения для препарата 60 мг относительно препарата 20 мг. Ниже в табл. 2 представлены сравнительные профили растворения для таблеток массой 20 и 60 мг во всех растворяющих средах SUPAC-MR. Таблица 2 Показанные выше результаты представлены графически на фиг. 1-4. Расчет F1 и F2 (см. табл. 3) для сравнительных профилей растворения демонстрирует эквивалентность таблеток во всех 4 средах. Таблица 3F1 и F2 обеспечивают проникающую способность и/или меру распределения результатов по партиям. 2 Критерии соответствуют приемлемым диапазонам значений F1 и F2. Пример 2. Биоэквивалентность препарата 80 мг относительно препарата 20 мг. Прежде были получены данные по эффективности и фармакокинетике для таблеток гепирона с длительным высвобождением, главным образом посредством введения одной или множества 20 мг таблеток гепирона с длительным высвобождением (аналогичных таблеткам, описанным выше в примере получения). Поэтому были проведены исследования для демонстрации биоэквивалентности таблеток гепирона 40 мг (данные не показаны) и 80 мг с длительным высвобождением (которые описаны выше в примере получения) относительно множества таблеток гепирона 20 мг с длительным высвобождением. Для этой цели использовали схему четырехходового перекрестного рандомицированного исследования препаратов с открытыми метками по одной дозе со стадией выведения в течение одной недели между различными курсами лечения. В течение каждого периода исследования субъектов госпитализировали в полдень перед введением гепирона до момента времени через 36 ч после введения. После выписки отбирали образцы крови через 48, 60 и 72 ч после введения. На протяжении исследования 32 субъектам (средний возраст 30,96,3 лет; средняя масса 73,88,3 кг; средний рост 178,15,6 см и средний BMI 23,32,3 кг/м 2) вводили гепирон в виде разовой пероральной дозы 40 или 80 мг. Для этой цели проводили в случайном порядке следующие курсы лечения (препарат в виде таблетки, показанный выше в примере получения): 140 мг таблетка гепирона с длительным высвобождением (данные не показаны); 220 мг таблетки гепирона с длительным высвобождением (данные не показаны); 180 мг таблетка гепирона с длительным высвобождением;- 11013213 420 мг таблеток гепирона с длительным высвобождением. После каждого лечения отбирали у субъектов образцы крови с постоянными интервалами в течение 72 ч для определения фармакокинетик гепирона, 1-РР и 3'-ОН гепирона. Для определения биоэквивалентности одной 80 мг таблетки гепирона с длительным высвобождением относительно четырех 20 мг таблеток гепирона с длительным высвобождением рассчитывают следующий фармакокинетический параметр для каждого субъекта и лечения:tmax (ТМАХ) - фактическое время достижения Cmax;Cmax (СМАХ) - измеренная максимальная концентрация в плазме после разовой дозы;dn-Cmax (DCMAX) - нормализованная по дозе Cmax, рассчитанная как Cmax/доза;z (LZ) и t1/2 (THALF) - наклонтерминальной log-линейной фазы кривой концентрация-время определяли методом линейной регрессии. Данные аппроксимировали функциейCinterc представляет пресечение с осью концентраций в нулевой момент времени. Процедуру продолжают, добавляя предшествующие точки по одной и аппроксимируя уравнение регрессии до достижения Cmax в момент времени tmax. Затем определяют терминальную log-линейную часть по данным, дающим период с наименьшей среднеквадратичной ошибкой (MSE) в регрессионном анализе. Определяют терминальную константу скорости элиминации (z) как -, из которой рассчитывают период полуэлиминации (t1/2) как log2/z. Концентрации ниже LOQ на фазе элиминации игнорируют;AUC0-tlast (AUCT) - AUC от нуля до tlast (AUC0-tlast) рассчитывают по линейной формуле трапеции,где tlast представляет последнюю временную точку с измеримой концентрацией в организме субъекта;dn-AUC0-tlast (DUCT) - нормализованную по дозе AUC0-tlast рассчитывают как AUC0-tlast/доза;AUC0- (AUC) - AUC от нуля до бесконечности рассчитывают как AUC0-=AUC0-tlast+AUCtlast-. ДляAUC0-tlas см. выше для AUCtlast-=Ctlast/z, где Ctlast является соответствующей концентрацией в момент времени tlast, используя линию регрессии, для которой рассчитано z;dn-AUC0- (DAUC) - нормализованную по дозе AUC0- рассчитывают как AUC0-/доза;CLapp (CLAPP) - истинный общий клиренс плазмы (CL) после разовой пероральной дозы равенfдоза/AUC0-, где f представляет фракционную абсолютную биодоступность перорального препарата. Так как f нельзя рассчитать только из пероральных данных, рассчитывают CL/F=доза/AUC0- и обозначают как "кажущийся клиренс" (CLapp). Вводимую дозу гепирона выражают как свободное основание. Количество свободных оснований гепирона также используют для расчета CLapp для метаболитов гепирона 1-РР и 3'-ОН;wn-CLapp (WCLAPP) - нормализованный по массе CLapp рассчитывают как CLapp, поделенный на массу тела (кг);Vz,app (VZAPP) - кажущийся объем распределения во время терминальной фазы после разовой пероральной дозы определяют какwn-Vz,app (WVZAPP) - нормализованный по массе Vz,app рассчитывают как Vz,app, поделенный на массу тела (кг). Для dn-Cmax, dn-AUC0- и dn-AUC0-tlast используют допустимый диапазон 0,80-1,25. Препараты объявляют биоэквивалентными в отношении исследуемых параметров, если 90% доверительный интервал полностью включен в допустимый диапазон. Это выполняется для гепирона, 1-РР и 3'-ОН гепирона. Для всех других фармакокинетических параметров выполняют классическую проверку гипотезы наlog-трансформированных значениях, используя аналогичные модели ANOVA как для исследования биоэквивалентности. Для гепирона, 1-РР и 3'-ОН гепирона рассчитывают следующие средние (станд. откл.) фармакокинетические параметры (см. табл. 4). Статистический анализ в отношении исследования средней биоэквивалентности для гепирона, 1-РР и 3'-ОН гепирона дан в табл. 5. Таблица 5 Как можно видеть из табл. 5, для всех соединений обнаружено, что одна 80 мг таблетка в среднем биоэквивалентна четырем 20 мг таблеткам в отношении dn-AUC. Это также справедливо в случаеdn-Cmax для 1-РР и 3'-ОН гепирона. Для гепирона обнаружен неубедительный результат для dn-Cmax. Так как исследование средней биоэквивалентности в некоторых случаях ведет к неопределенным выводам для гепирона, несмотря на тот факт, что точечная оценка соотношения геометрических средств исследуемых и сравнительных способов лечения лежит в рамках приемлемого диапазона 0,80-1,25, поэтому проводят дополнительный статистический анализ, используя количественный подход, который подкрепляет экспериментальные данные. Результаты показаны в табл. 6, где:ST2: общая дисперсия образца (т.е. сумма дисперсии для одного субъекта и дисперсии между субъектами) исследуемого способа лечения на основе log-трансформировнных параметров;SR2: общая дисперсия образца (т.е. сумма дисперсии для одного субъекта и дисперсии между субъектами) сравнительного курса лечения на основе log-трансформировнных параметров;Sd2: дисперсия образца внутрисубъектных различий; 1, (0,50): 50% квантиль критерия биоэквивалентности 1 (=среднему значению для 1); 1, (0,95): 95% квантиль критерия биоэквивалентности 1 (=верхней границе 95% доверительного интервала для 1). Так как для всех анализов SR2T02 (=0,22=0,04), применяют способ со шкалой отсчета. Таблица 6- 14013213 Результаты, полученные при количественном подходе, показывают биоэквивалентность для Cmax,AUC0- и AUC0-tlast гепирона, 1-РР и 3'-ОН гепирона в отношении одной таблетки гепирона 80 мг с длительным высвобождением и четырех таблеток гепирона 20 мг с длительным высвобождением (то же наблюдают для одной таблетки гепирона 40 мг с длительным высвобождением и двух таблеток гепирона 20 мг с длительным высвобождением). Кроме того, определено, что сравнение таблетки 40 мг и таблетки 80 мг показывает отсутствие статистически существенных различий для гепирона или его метаболитов. Это открытие показывает пропорциональность дозе гепирона в диапазоне доз 40-80 мг. В свете приведенного выше описания возможны многочисленные модификации и вариации настоящего изобретения. Таким образом, понятно, что в рамках приложенной формулы изобретение можно осуществить на практике иными способами, отличными от описанных здесь частных вариантов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Дозированная форма, содержащая:(a) примерно от 14 до 25 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;(b) примерно от 70 до 85 мас.% фармацевтически приемлемой целлюлозной полимерной матрицы и(c) подходящее количество одного или более фармацевтически приемлемых наполнителей, где скорость высвобождения биоактивного метаболита гепирона из дозированной формы такова, что для достижения примерно 90-95% абсорбции биоактивного метаболита гепирона требуется примерно от 18 до 24 ч. 2. Дозированная форма по п.1, где (с) дополнительно содержит по меньшей мере один фармацевтически приемлемый наполнитель, выбранный из группы, включающей краситель, микрокристаллическую целлюлозу, коллоидный диоксид кремния и стеарат магния. 3. Дозированная форма по п.1, где (b) представляет собой гидроксипропилметилцеллюлозу, имеющую вязкость примерно от 15000 до 100000 сП. 4. Дозированная форма по п.1, где концентрация (а) составляет примерно от 15,5 до 18,7 мас.%. 5. Дозированная форма по п.1, где указанный биоактивный метаболит гепирона выбран из группы,включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон. 6. Дозированная форма по п.1, где указанная дозированная форма представлена в виде таблетки. 7. Дозированная форма по п.6, где общая масса указанной таблетки составляет от 350 до 450 мг. 8. Дозированная форма по п.7, где масса (а) в указанной таблетке составляет от 60 до 80 мг. 9. Дозированная форма по п.6, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями. 10. Дозированная форма по п.9, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 11. Дозированная форма по п.6, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями. 12. Дозированная форма по п.11, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 13. Дозированная форма, содержащая:(a) примерно от 14,0 до 24,4 мас.% биоактивного метаболита гепирона в виде свободного основания или его фармацевтически приемлемой соли;(b) от 70,5 до 82,1 мас.% гидроксипропилметилцеллюлозы, имеющей вязкость примерно от 15000 до 100000 сП;(e) примерно от 0,39 до 0,47 мас.% коллоидного диоксида кремния и(f) примерно от 0,29 до 1,0 мас.% стеарата магния. 14. Дозированная форма по п.13, где (а) составляет примерно от 15,5 до 18,7 мас.%. 15. Дозированная форма по п.13, где фармацевтически приемлемая соль биоактивного метаболита гепирона является гидрохлоридом. 16. Дозированная форма по п.13, где указанный биоактивный метаболит гепирона выбран из группы, включающей 3'-ОН гепирон, 3',5-дигидроксигепирон и 5-ОН гепирон. 17. Дозированная форма по п.13, где (с) составляет от 0 примерно до 0,3 мас.%. 18. Дозированная форма по п.13, где (с) представляет собой один или более оксид железа. 19. Дозированная форма по п.13, где (е) составляет примерно от 0,42 до 0,47 мас.%. 20. Дозированная форма по п.13, где указанная дозированная форма представлена в виде таблетки. 21. Дозированная форма по п.20, где общая масса указанной таблетки составляет от 350 до 450 мг. 22. Дозированная форма по п.21, где масса (а) в указанной таблетке составляет от 60 до 80 мг. 23. Дозированная форма по п.20, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями.- 15013213 24. Дозированная форма по п.23, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 25. Дозированная форма по п.20, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями. 26. Дозированная форма по п.25, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 27. Способ получения таблетки по п.20, включающий:(i) смешивание всех или части компонентов от (а) до (f);(ii) перемешивание смеси, полученной на стадии (i);(iii) добавление части или оставшихся компонентов от (а) до (f);(iv) перемешивание смеси, полученной на стадии (iii), если какие-либо компоненты добавляют на стадии (iii);(v) получение заготовки из смеси со стадии (iv);(vi) измельчение заготовки, полученной на стадии (v);(vii) добавление оставшегося компонента (f), если часть сохранена на стадиях (i) и (iv);(viii) перемешивание смеси со стадии (vii);(ix) прессование смеси со стадии (viii) с получением таблетки. 28. Способ получения таблетки по п.20, включающий:i) смешивание всех компонентов (а), всех компонентов (с), всех компонентов (е) и 20% от общей концентрации компонента (b);ii) перемешивание смеси со стадии (i);iii) добавление к смеси со стадии (ii) всех компонентов (d), половины от общей концентрации компонента (f) и оставшихся 80% от общей концентрации компонента (b);iv) перемешивание смеси со стадии (iii);v) получение заготовки смеси со стадии (iv);vi) измельчение заготовки со стадии (v);vii) добавление оставшихся 50% компонента (f) к измельченной заготовке со стадии (vi);viii) перемешивание смеси со стадии (vii);ix) прессование смеси со стадии (viii) в конечную желательную форму. 29. Дозированная форма по п.20, содержащая:(a) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;(e) примерно 0,42 мас.% коллоидного диоксида кремния и(f) примерно 0,31 мас.% стеарата магния. 30. Дозированная форма по п.29, где общая масса указанной таблетки составляет 385 мг. 31. Дозированная форма по п.30, где масса (а) в указанной таблетке составляет 60 мг. 32. Дозированная форма по п.29, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями. 33. Дозированная форма по п.32, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 34. Дозированная форма по п.29, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями. 35. Дозированная форма по п.34, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 36. Дозированная форма по п.20, содержащая, по существу:(а) примерно 15,6 мас.% гидрохлорида биоактивного метаболита гепирона;(c) примерно 0,31 мас.% желтого трехвалентного оксида железа;(e) примерно 0,42 мас.% коллоидного диоксида кремния и(f) примерно 0,31 мас.% стеарата магния. 37. Дозированная форма по п.36, где общая масса указанной таблетки составляет 385 мг. 38. Дозированная форма по п.37, где масса (а) в указанной таблетке составляет 60 мг. 39. Дозированная форма по п.36, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями. 40. Дозированная форма по п.39, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 41. Дозированная форма по п.36, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями.- 16013213 42. Дозированная форма по п.41, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 43. Дозированная форма по п.20, содержащая:(a) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;(e) примерно 0,39 мас.% коллоидного диоксида кремния и(f) примерно 0,29 мас.% стеарата магния. 44. Дозированная форма по п.43, где общая масса указанной таблетки составляет 410 мг. 45. Дозированная форма по п.44, где масса (а) в указанной таблетке составляет 80 мг. 46. Дозированная форма по п.43, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями. 47. Дозированная форма по п.46, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 48. Дозированная форма по п.43, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями. 49. Дозированная форма по п.48, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 50. Дозированная форма по п.20, состоящая, по существу, из:(a) примерно 19,5 мас.% гидрохлорида биоактивного метаболита гепирона;(с-1) примерно 0,24 мас.% желтого трехвалентного оксида железа;(с-2) примерно 0,61 мас.% красного трехвалентного оксида железа;(e) примерно 0,39 мас.% коллоидного диоксида кремния и(f) примерно 0,29 мас.% стеарата магния. 51. Дозированная форма по п.50, где общая масса указанной таблетки составляет 410 мг. 52. Дозированная форма по п.51, где масса (а) указанной таблетки составляет 80 мг. 53. Дозированная форма по п.50, где указанная таблетка имеет овально-прямоугольную форму с двояковыпуклыми гранями. 54. Дозированная форма по п.53, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,2400,025 дюйма. 55. Дозированная форма по п.50, где указанная таблетка имеет овально-прямоугольную форму с плоскими гранями. 56. Дозированная форма по п.55, где указанная таблетка имеет итоговый размер 0,4000,05 дюйма на 0,3250,05 дюйма с толщиной 0,1950,025 дюйма. 57. Способ лечения депрессии у нуждающегося в этом пациента, включающий введение указанному пациенту эффективного количества дозированной формы по любому из пп.1, 6, 13, 20, 29, 36 и 43. 58. Способ по п.57, где указанный пациент является человеком. 59. Способ по п.57, где указанный пациент, кроме того, страдает от генерализованной тревоги. 60. Способ по п.57, где указанное эффективное количество составляет от 0,01 до 40 мг/кг массы тела в день.
МПК / Метки
МПК: A61K 9/20, A61P 25/00
Метки: дозированная, лечения, форма, высокой, длительным, получения, депрессии, дозировкой, способ, биоактивного, метаболита, использованием, гепирона, высвобождением
Код ссылки
<a href="https://eas.patents.su/19-13213-dozirovannaya-forma-bioaktivnogo-metabolita-gepirona-s-vysokojj-dozirovkojj-i-dlitelnym-vysvobozhdeniem-sposob-ee-polucheniya-i-sposob-lecheniya-depressii-s-ee-ispolzovaniem.html" rel="bookmark" title="База патентов Евразийского Союза">Дозированная форма биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением, способ ее получения и способ лечения депрессии с ее использованием</a>
Предыдущий патент: 3-ариламинопиридиновые производные
Следующий патент: Применение фармацевтической композиции для лечения диабета, метаболического синдрома, нейродегенеративных заболеваний и ожирения
Случайный патент: Способ диагностики угрозы прерывания беременности