Средство для превращения бактерий
Формула / Реферат
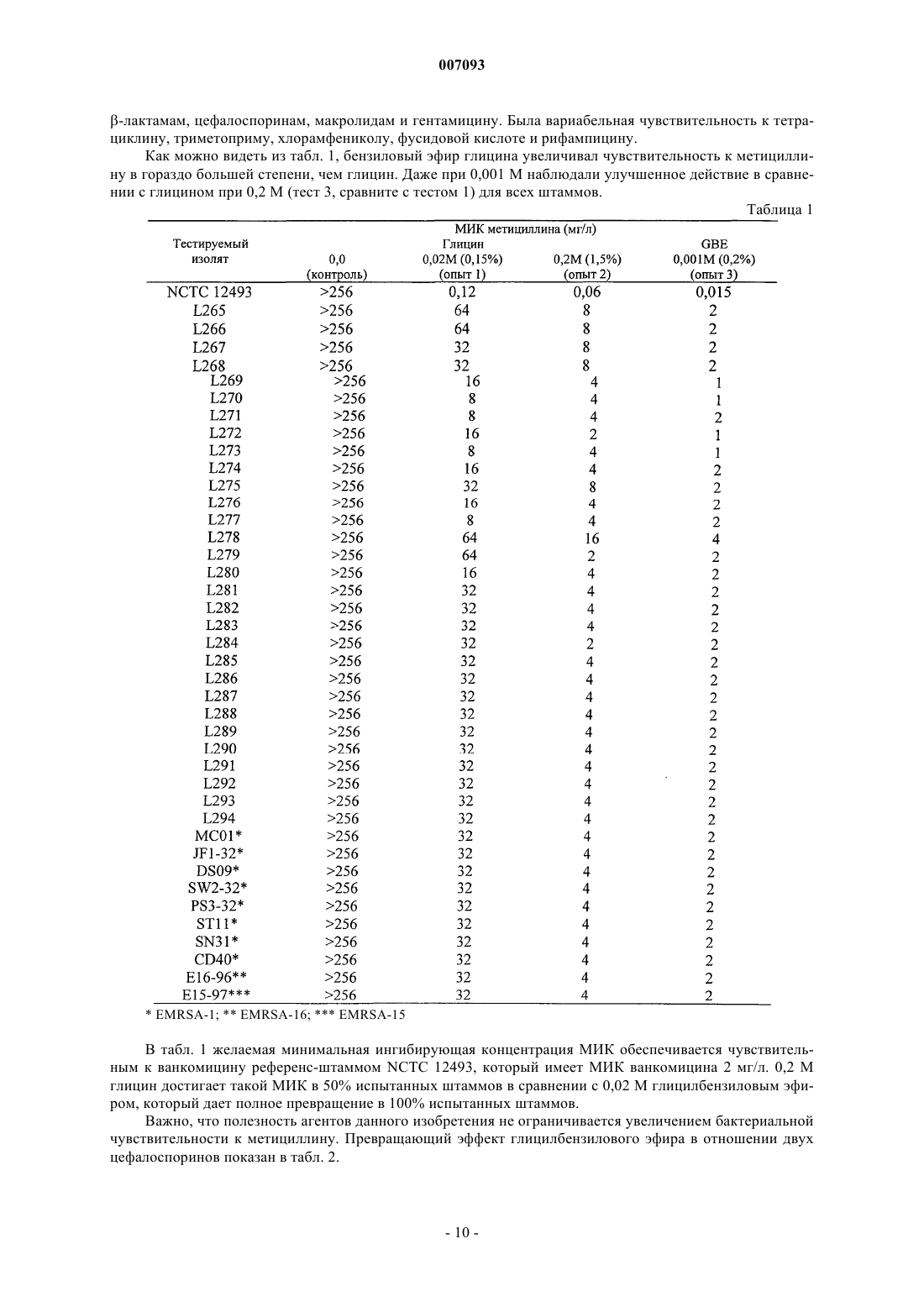
1. Способ увеличения чувствительности бактериального штамма к активным в отношении клеточной стенки антимикробным агентам, к которым бактериальный штамм или штамм-предшественник, из которого развился данный штамм, является чувствительным, предусматривающий стадию подвергания указанного бактериального штамма действию по меньшей мере одного превращающего средства, имеющего следующую формулу (I):
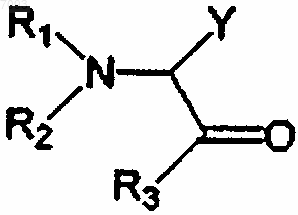
где остатки R1 и R2, каждый независимо, выбраны из алкила, алкилокси, алкилоксикарбонила, алкилкарбонилокси, алкенила, алкенилокси, алкенилоксикарбонила, алкенилкарбонилокси, алкинила, алкинилокси, алкинилоксикарбонила, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси, арилоксикарбонила, арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбамоила,
остаток R3 выбран из алкила, алкилокси, алкилкарбонилокси, алкенила, алкенилокси, алкенилкарбонилокси, алкинила, алкинилокси, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси, арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбоксила,
иные, чем R1, R2 и R3, не являются все Н, и
Y выбран из боковой цепи природной аминокислоты,
или его физиологически приемлемой соли или производного, которое превращается в соединение формулы I при физиологических условиях.
2. Способ по п.1, где Y представляет собой -H2 (т.е. "боковую цепь" глицина).
3. Способ по п.1, где один из R1 и R2 является Н.
4. Способ по п.1, где один из R1 и R2 представляет собой алкилкарбонил (более предпочтительно C2-С6-алкилкарбонил), алкенилкарбонил (более предпочтительно C2-С6-алкенилкарбонил), алкинилкарбонил (более предпочтительно С2-С6-алкинилкарбонил).
5. Способ по п.1, где один из R1 и R2 представляет собой C1-С6-алкилкарбонил и предпочтительно метилкарбонил (ацетил).
6. Способ по п.1, где R3 является алкилокси (более предпочтительно C1-С6-алкилокси), алкенилокси (более предпочтительно C2-С6-алкенилокси), алкинилокси (более предпочтительно C2-С6-алкинилокси) или арилокси (более предпочтительно фенилоксикарбонил).
7. Способ по п.1, где R3 является бензилокси.
8. Способ по п.1, где антимикробным агентом является пенициллин, цефалоспорин или их производное или аналог или гликопептид.
9. Способ по п.8, где антимикробным агентом является устойчивый к b -лактамазе пенициллин, или его производное, или аналог.
10. Способ по п.1, где антимикробным агентом является оксациллин или ванкомицин.
11. Способ по п.1, где превращающим средством является бензиловый эфир глицина, этиловый эфир глицилглицина, гиппуровая кислота, п-аминогиппуровая кислота или пропаргилглицин.
12. Применение средства, имеющего формулу (I), в изготовлении лекарственного средства для увеличения чувствительности бактериального штамма, инфицирующего, колонизирующего или несомого пациентом, к активному в отношении клеточной стенки антимикробному агенту по п.1.
13. Способ предупреждения инфекции и перекрестной инфекции, связанной с носительством бактериального штамма, предусматривающий местное нанесение на участок (участки) носительства указанного пациента количества превращающего средства формулы (I) по п.1, достаточного для превращения указанного штамма в более чувствительный к антимикробному агенту, и введение указанному пациенту терапевтически эффективного количества указанного антимикробного агента в качестве компонента композиции и/или в качестве совместно вводимого агента.
14. Способ по п.13, где указанное средство может находиться в смеси с одним или несколькими эксципиентами, носителями, эмульгаторами, растворителями, буферами, регуляторами рН, улучшающими вкус и запах агентами, красителями, консервантами или другими обычно используемыми добавками в области фармацевтических веществ в соответствии со способом введения.
15. Способ по п.13, где указанный агент способен увеличивать чувствительность к антимикробному агенту по меньшей мере одного бактериального штамма, выбранного из Staphylococcus aureus, коагулаза-отрицательных стафилококков и энтерококков, Clostridium difficile и Streptococcus pneumoniae и других грамположительных патогенов.
16. Способ по п.15, где бактериальный штамм является устойчивым к антимикробному агенту.
17. Способ по п.13, где указанное средство способно увеличивать чувствительность к антимикробному агенту по меньшей мере одного из устойчивого к метициллину и/или устойчивого к гликопептиду Staphylococcus aureus и устойчивых к ванкомицину энтерококков к антимикробному агенту, к которому является устойчивым бактериальный штамм.
18. Способ по п.17, где бактериальный штамм является устойчивым по меньшей мере к одному из метициллина и его производных или родственных антимикробных агентов, ванкомицина, тейкопланина или других родственных гликопротеидов.
19. Способ по п.13, где указанное средство способно увеличивать чувствительность к антимикробному агенту по меньшей мере одного бактериального штамма, выбранного из Staphylococcus aureus, коагулаза-отрицательных стафилококков, энтерококков, Clostridium difficile, Streptococcus pneumoniae, Streptococcus pyogenes и других стрептококков и грамположительных патогенов, в случаях, когда этот бактериальный штамм вызывает быстро угрожающую жизни инфекцию, в частности, в ослабленном хозяине, для создания "гиперчувствительности" инфицирующего организма к антимикробному агенту.
20. Способ по п.13, где указанное средство способно увеличивать чувствительность EMRSA-15, -16 и/или -17 или других EMRSA к b -лактамным (или аналогичным) антибиотикам/антимикробным агентам и/или увеличивать чувствительность EMRSA с пониженной чувствительностью к ванкомицину, тейкопланину или другому гликопептиду или VRSA к вышеуказанным антимикробным агентам.
21. Способ по п.19, где чувствительность увеличивается до уровня сравнимого неустойчивого бактериального штамма при концентрации агента 0,02 М или менее, более предпочтительно 0,002 М или менее и наиболее предпочтительно 0,001 М или менее при определении посредством стандартного теста чувствительности к антибиотикам.
22. Способ по п.13, где антимикробный агент, к которому увеличивается чувствительность, выбран из группы, состоящей из b -лактамных (и аналогичных) антибиотиков/антимикробного агента, стабильных к стафилококковым b -лактамазам, цефалоспоринов и гликопептидов.
23. Способ по п.22, где антимикробным агентом, к которому увеличивается чувствительность, является метициллин, флуклоксациллин, клоксациллин, оксациллин, имипенам, меропенам, цефтазидим, цефуроксим, ванкомицин, тейкопланин или оритаванцин.
24. Способ по п.13, где антимикробный агент, к которому увеличивается чувствительность, выбран из группы агентов, состоящей из b -лактамных (и аналогичных) антибиотиков/антимикробного агента, стабильных к стафилококковым b -лактамазам, вместе с ингибитором b -лактамазы или его производным или аналогом.
25. Способ идентификации превращающих средств в микроорганизмах, имеющих медицинское значение, с клеточными стенками, имеющими структуру, пригодную для действия на них пенициллина и родственных/аналогичных антимикробных агентов и гликопептидов, где состав поперечных мостиковых связей и муропептидных хвостов в клеточной стенке организма-мишени должны быть полностью или частично установлены, и превращающей способности индивидуальэых молекул с соответствующими остатками, выбранными для тестирования.
Текст
007093 Область техники, к которой относится изобретение Данное изобретение относится к средствам для увеличения чувствительности бактерий к антимикробным агентам и, в частности, но не только, к средствам для превращения бактерий, устойчивых к антимикробному агенту, в бактерии, имеющие увеличенную чувствительность к этому антимикробному агенту. Уровень техники Глобальное появление бактерий и других микроорганизмов, устойчивых к антибиотикам и антимикробным агентам вообще, создает главную угрозу для человечества. Распространение огромных количеств антимикробных агентов в экосфере человека на протяжении последних 60 лет ввело мощное селективное давление в отношении возникновения и распространения резистентных к антимикробным агентам бактериальных патогенов. Резистентные организмы особой эпидемиологической важности вследствие преобладания этих патогенов для вызывания перекрестной инфекции в больницах (нозокомиальной инфекции) и других учреждениях здравоохранения включают в себя метициллин-резистентные Staphylococcus aureus (MRSA) и другие грамположительные бактерии, такие как ванкомицин-резистентные энтерококки (VRE) и Clostridium difficile, и Streptococcus pneumoniae, который становится в увеличивающейся степени резистентным к -лактамам и другим антимикробным агентам, плюс грамотрицательные палочки, которые продуцируют расширенный спектр -лактамаз. Поскольку существует устойчивость к любому клинически доступному антибиотику, в частности, среди недавних штаммов эпидемическогоMRSA (EMRSA), существует перспектива постантибиотической эры, в которой существующие антимикробные агенты окажутся неэффективными.S. aureus является важной причиной приобретенной в общественных местах и внутрибольничной(нозокомиальной) инфекции и является второй наиболее важной причиной септицемии после Escherichiacoli и второй наиболее частой причиной катетер-ассоциированной инфекции и перитонита, возникающего при продолжительном амбулаторном перитонеальном диализе. S. aureus является также главной причиной инфекции костей, суставов и кожи. В целом, S. aureus является наиболее обычным бактериальным патогеном в современных больницах и общественных учреждениях и местах. Он является также одним из наиболее устойчивых к антимикробным агентам и легко передающимся патогеном, который, в среднем, может присутствовать в приблизительно трети популяции здоровых людей, облегчая таким образом распространение по всему миру эпидемических штаммов. Колонизация является предпосылкой для носительства и инфекции, и стафилококки являются хорошо известными колонизаторами кожи, ран и имплантируемых устройств. Носительство обычно встречается на специфических участках кожи, гистологически связанных с апокринными железами, в основном, в ноздрях (подбирающей зоне носа) и, вторично, подмышечных ямках и промежности. Постулировалось, что S. aureus диссеминирует из носа на руки и, следовательно, в другие участки тела, где инфекция может возникать при разрывах в дермальных поверхностях, посредством катетеризации сосудов или хирургического рассечения. Интраназально вводимый мупироцин является главной опорой для искоренения назального носительства метициллин-резистентных S. aureus (MRSA), которые являются по природе устойчивыми ко множеству антибиотиков, во время вспышек эпидемий в больницах. Ввиду увеличивающихся опасений в отношении инфекции S. aureus крайне необходимым является поиск новых и надежных способов лечения для элиминации носительства S. aureus. В начале 1950-х годов устойчивость к пенициллину, сообщаемая пенициллиназой (т.е. лактамазой), переносимой трансмиссивными плазмидами, была обычной в штаммах S. aureus, приобретаемых в больницах. Альтернативные антимикробные агенты, а именно, тетрациклин, стрептомицин и макролиды, вводили, но устойчивость развивалась быстро. Понимание химии -лактамного кольца сделало возможным разработку метициллина, полусинтетического стабильного к пенициллиназе изоксазолилпенициллина. Метициллин и последующая разработка других содержащих изоксазолил полусинтетических агентов, таких как флуклоксациллин, клоксациллин и оксациллин, произвели революцию в лечении инфекций S. aureus.MRSA были впервые обнаружены в Англии в 1960 г. и с тех пор стали хорошо признанной причиной внутрибольничной (нозокомиальной) инфекции во всем мире. MRSA являются устойчивыми ко всем клинически доступным -лактамам и цефалоспоринам и легко приобретают детерминанты устойчивости к другим антимикробным агентам, используемым в клинической медицине. Селективное давление обеспечило возникновение и всемирное распространение MRSA. Вспышки эпидемий, вызываемые "современными" эпидемическими MRSA (EMRSA) в Соединенном Королевстве, начались в начале 1980-х годов со штамма, впоследствии охарактеризованного как EMRSA-1. В настоящее время имеются 17 эпидемических типов, признанных в Соединенном Королевстве, и частота заболеваний, связанных с ними,устойчиво растет в Англии и Уэльсе с 1-2% от описанных изолятов из крови и спинно-мозговой жидкости в 1989-92 гг. до 31,7% в 1997 г. Это повышение отражает увеличивающееся преобладание эпидемических штаммов типов 15 и 16. EMRSA являются очень трансмиссивными и вариабельно приобретают устойчивость ко всем антимикробным агентам, помимо антимикробных агентов, связанных с метицил-1 007093 лином и -лактамным кольцом. Помимо EMRSA серьезная кожная инфекция ассоциировалась с внебольничным MRSA (community-acquired C-MRSA). Она представляет собой быстро растущее явление, о котором в последнее время сообщалось в США, Англии и континентальной Европе. Сообщалось также об инфекции нижних дыхательных путей. Многие из этих C-MRSA продуцируют токсин, называемыйPVL, который является лейкоцидином, ассоциированным с высокой смертностью. Серьезная инфекция,происходящая из кожного и из назального носительства (такая как внебольничная пневмония) MRSA,может быть предотвращена путем применения подходящих противостафилококковых антимикробных агентов для местного применения. Устойчивость к ванкомицинуS. aureus/MRSA Следующим зловещим проявлением является способность некоторых штаммов к приобретению пониженной или промежуточной устойчивости к гликопептидам. Гликопептидные антибиотики, в частности ванкомицин, были лекарственными средствами выбора и во многих случаях лишь единственными агентами для лечения инфекции MRSA и других устойчивых грамположительных бактерий, таких как энтерококки. Если MRSA не поддаются контролю, то клиническое применение ванкомицина или тейкопланина приобретает значение вследствие увеличивающегося количества инфекций ран и кровообращения у госпитализированных пациентов. Вскоре после сообщения Hiramatsu о промежуточно устойчивых к ванкомицину MRSA в Японии (Lancet 1997, 350, рр 1670-3) EMRSA-16 начал уменьшать его чувствительность к ванкомицину в некоторых клинических изолятах из диабетических язв ног. Новый эпидемический штамм EMRSA-17 возник на южном побережье Англии, и он обладает преимуществом в отношении уменьшенной чувствительности к ванкомицину. В настоящее время считают, что этот штамм развился из EMRSA-5, и это демонстрирует, что эпидемические штаммы непрерывно возникают даже с еще большей устойчивостью и склонностью вызывать тяжелое заболевание. Наиболее серьезным проявлением является развитие MRSA с устойчивостью высокого уровня к ванкомицину (VRSA). О них сообщалось в США, и эти штаммы несут гены, идентичные генам устойчивости к ванкомицину в VRE. Распространение VRSA представляется неизбежным и, если не будет подходящих антимикробных агентов для борьбы с носительством и инфицированием ран, то продолжение рутинной хирургии в зараженных учреждениях, по-видимому, является невозможным. Энтерококки Энтерококки, в частности, Enterococcus faecium и Е. faecalis, являются прежде всего кишечными комменсалами, но могут становиться условно-патогенными микроорганизмами, которые колонизируют и инфицируют хозяев иммунокомпраметированных, таких как пациенты с трансплантатом печени. Устойчивые к ванкомицину Е. faecium (VREF) появились и с тех пор стали важными нозокомиальными патогенами. С первого появления устойчивых к ванкомицину энтерококков в южной части Лондона и Париже в 1987 г. во многих странах с увеличивающейся частотой сообщалось об устойчивых ко многим антимикробным агентам энтерококках. Действительно, Е. faecium, устойчивый к гентамицину, ванкомицину и другим агентам, вызывал инфекции, для которых в Соединенном Королевстве не было доступных терапевтических агентов, хотя в настоящее время лицензирован хинупристин/далфопристин, который является активным (МИК 2 мг/л) против 86% изолятов Е. faecium. В США доля VREF среди энтерококков, выделенных из кровяных культур, увеличилась с 0% в 1989 г. до 25,9% в 1999 г. Главным источником VREF является, по-видимому, сырое мясо домашней птицы. Хотя антимикробная устойчивость является предметом глобального беспокойства, единственным способом, предложенным для контроля и уменьшения устойчивости, является поощрение подходящего использования антимикробных агентов. Однако ожидания, что осторожное использование антибиотиков будет приводить к обращению тенденций устойчивости, должны восприниматься с осторожностью. Концепция превращения устойчивых штаммов в чувствительные штаммы с целью возобновления применения ранее разработанных антимикробных агентов, а не разработки новых агентов, к которым будет впоследствии развиваться устойчивость, не была исследована. Целью данного изобретения является обеспечение средства для превращения бактерий (ВТА) для обращения (частичного или полного) устойчивости бактериальной клетки к антимикробному агенту. Средства для превращения бактерий являются известными и имеют следующие характеристики. 1. Когда микроорганизмы имеют клеточные стенки, устойчивые к активным в отношении клеточных стенок антимикробным агентам и эта устойчивость основана на поперечных мостиковых связях(сшивках) между клеточными стенками, ВТА превращают этот устойчивый микроорганизм из его устойчивого состояния в состояние, чувствительное к активному в отношении клеточной стенки агенту. 2. Присутствие ВТА является существенным для осуществления превращения. 3. ВТА сами по себе не являются терапевтическими агентами в концентрациях, в которых они используются в качестве ВТА. 4. Действие ВТА на микроорганизм-мишень обращается при удалении ВТА. 5. ВТА не являются ингибиторами специфического механизма устойчивости, такого как -лактамаза, насос для откачки или разрушающий антибиотик фермент.-2 007093 Данное изобретение относится к способу увеличения чувствительности бактериального штамма к антимикробному активному в отношении клеточной стенки агенту, к которому данный бактериальный штамм или штамм-предшественник, из которого развился данный штамм, является чувствительным,предусматривающему стадию подвергания указанного бактериального штамма действию по меньшей мере одного превращающего средства, имеющего следующую формулу (I): где остатки R1 и R2, каждый независимо, выбраны из алкила, алкилокси, алкилоксикарбонила, алкилкарбонилокси, алкенила, алкенилокси, алкенилоксикарбонила, алкенилкарбонилокси, алкинила, алкинилокси, алкинилоксикарбонила, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси, арилоксикарбонила, арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбамоила,остаток R3 выбран из алкила, алкилокси, алкилкарбонилокси, алкенила, алкенилокси, алкенилкарбонилокси, алкинила, алкинилокси, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси,арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбоксила,иные, чем R1, R2 и R3, не являются все Н, иY выбран из боковой цепи природной аминокислоты,или его физиологически приемлемой соли или производного, которое превращается в соединений формулы I при физиологических условиях. Серосодержащие аналоги указанных кислородсодержащих заместителей также находятся в рамках данного изобретения. Ссылка на циклические соединения предполагает включение в рамки данного изобретения гетероциклических соединений, имеющих один или более атомов N, S или О в их кольцевой системе. Подходящие заместители в любом из указанных остатков R1, R2 и R3 включают в себя галоген (например, F или Сl), гидроксил (-ОН), карбоксил (-СO2 Н), аминогруппу или амидную группу. Предпочтительно Y представляет собой -Н 2 (т.е. боковую цепь глицина). Предпочтительно один из R1 и R2 является Н. Предпочтительно один из R1 и R2 представляет собой алкилкарбонил (более предпочтительно C1 С 6-алкилкарбонил), алкенилкарбонил (более предпочтительно C2-С 6-алкенилкарбонил), алкинилкарбонил (более предпочтительно C2-С 6-алкинилкарбонил). Даже более предпочтительно один из R1 и R2 является C1-С 6-алкилкарбонилом и наиболее предпочтительно метилкарбонилом (ацетилом). Предпочтительно R3 представляет собой алкилокси (более предпочтительно C1-С 6-алкилокси), алкенилокси (более предпочтительно C2-С 6-алкенилокси), алкинилокси (более предпочтительно C2-С 6 алкинилокси) или арилокси (более предпочтительно фенилоксикарбонил). Еще более предпочтительноR3 является бензилокси. Особенно предпочтительными превращающими средствами являются такие, где R1 обозначает Н,R2 обозначает ацетил и R3 обозначает карбоксил (N-ацетилглицин) или бензилокси (бензиловый эфир Nацетилглицина) и где R1 и R2 обозначают Н и R3 обозначает бензилокси (бензиловый эфир глицина). Особенно предпочтительные превращающие средства включают в себя бензиловый эфир глицина, этиловый эфир глицилглицина, гиппуровую кислоту, парааминогиппуровую кислоту и пропаргилглицин. Способ в соответствии с данным изобретением особенно пригоден для увеличения чувствительности бактериального штамма к антимикробному агенту, такому как пенициллин и его производные и аналоги, в частности, такие, которые устойчивы к стафилококковой и подобным -лактамазам (например,оксациллин), и к гликопептидам (например, ванкомицину). Во избежание сомнения превращающие средства, применимые в способе данного изобретения,включают в себя физиологически приемлемые соли и другие производные вышеуказанных соединений формулы I, которые превращаются в соединение формулы I при физиологических условиях. Должно быть понятно, что указанные превращающие средства обычно сами по себе не имеют антимикробных свойств при превращающих количествах, т.е. при концентрациях, которые лишь потенциируют активность антимикробных агентов. Некоторые из описанных соединений могут быть антибактериальными при более высоких количествах, например, пропаргилглицин и гиппуровая кислота. Характеристики, связанные с описанной формулой и ее вариантами 1. Термин превращающий поясняется, например, превращением устойчивого к метициллину S.aureus в чувствительный к метициллину S. aureus. 2. Устойчивость к метициллину не сообщается -лактамазами. Если стафилококк является продуцентом -лактамазы, превращающее средство не будет влиять на чувствительность к антибиотикам, чувствительным к -лактамазам.-3 007093 3. Действие превращающих средств распространяется на все стафилококки, устойчивые к -лактамным антибиотикам, устойчивым к -лактамазе, в том числе цефалоспоринам. 4. Имеется также активность против устойчивых к ванкомицину энтерококков (VRE), хотя это действие является менее сильным. Считается, что активность ВТА в VRE обусловлена одной или несколькими молекулами глицина в поперечной мостиковой связи (связях) в клеточной стенке этих микроорганизмов. 5. Действие превращающих средств должно распространяться на VRSA. Данное изобретение относится также к использованию средства, имеющего формулу (I), в приготовлении лекарственного средства для увеличения чувствительности бактериального штамма, инфицирующего, колонизирующего пациента или носимого пациентом, к антимикробному агенту. Предпочтительно указанный бактериальный штамм (т.е. мишень превращения) имеет устойчивость к антимикробному агенту, подлежащему для совместного составления в рецептуру с ВТА. Далее, данное изобретение относится к способу предупреждения и/или лечения пациента от инфекции носимым бактериальным штаммом, предусматривающему введение указанному пациенту количества превращающего средства формулы (I), достаточного для превращения указанного штамма в более чувствительный к антимикробному агенту штамм, вместе с терапевтически эффективным количеством указанного антимикробного агента. Должно быть понятно, что указанный пациент может быть бессимптомным носителем данного бактериального штамма или указанный пациент может иметь симптоматическую клиническую инфекцию. Введение указанного превращающего средства (ВТА) может проводиться до, после введения антимикробного агента или одновременно с этим антимикробным агентом. Однако предпочтительно указанный превращающий агент вводят вместе с указанным антимикробным агентом или до введения указанного антимикробного агента. В случае одновременного введения превращающее средство и антимикробный агент могут вводиться в комбинации в виде единого лекарственного средства или в виде отдельных лекарственных средств. Предпочтительно, превращающее средство и антимикробный агент вводят в комбинации в виде единого лекарственного средства (т.е. совместным введением). Следует отметить, что совместно вводимый антимикробный агент должен иметь достаточную присущую ему активность в отношении вида, к которому принадлежит организм-мишень, т.е. должен иметь хорошую активность против природно чувствительных вариантов этого устойчивого организма-мишени. Введение может выполняться любым известным способом, например, внутривенной, внутримышечной или интратекальной (спинно-мозговой) инъекцией, интраназальным, местным введением в виде мази, целебной мази, крема или настойки, пероральным введением в виде таблетки, капсулы, суспензии или жидкости и назальным введением в виде спрея (например, аэрозоля). Выбор способа введения выполняют в зависимости от свойств выбранного ВТА. В каждом случае указанное средство или комбинация агентов может быть в смеси с одним или несколькими эксципиентами, носителями, эмульгаторами, растворителями, буферами, регуляторами рН,улучшающими вкус и запах агентами, красителями, консервантами или другими обычно используемыми добавками в области фармацевтических средств, подходящими для способа введения. Предпочтительно указанное средство способно увеличивать чувствительность к подходящему активному в отношении клеточной стенки антимикробному агенту по меньшей мере одного бактериального штамма, выбранного из Staphylococcus aureus, коагулаза-отрицательных стафилококков, энтерококков,Clostridium difficile и Streptococcus pneumoniae. Более предпочтительно указанный агент способен увеличивать чувствительность к антимикробному агенту по меньшей мере одного из устойчивого к метициллину Staphylococcus aureus и устойчивых к ванкомицину энтерококков, в частности, когда этот бактериальный штамм является устойчивым к антимикробному агенту, например метициллину, оксациллину,флуклоксациллину, ванкомицину. В частности, указанный агент предпочтительно способен увеличивать чувствительность EMRSA-15, -16 и/или -17 или других EMRSA к -лактамным (и аналогичным) антибиотикам/антимикробным агентам и/или увеличивать чувствительность EMRSA с пониженной чувствительностью к ванкомицину, тейкопланину или другому гликопептиду или VRSA к вышеуказанным антимикробным агентам. В каждом случае, чувствительность предпочтительно увеличивается до уровня сравнимого неустойчивого бактериального штамма при концентрации агента 0,02 М или менее, более предпочтительно 0,002 М или менее, и наиболее предпочтительно 0,001 М или менее при определении посредством стандартного теста чувствительности к антибиотикам, предпочтительно Е-теста. Указанное средство способно также увеличивать чувствительность уже чувствительного бактериального штамма, выбранного из Staphylococcus aureus, коагулаза-отрицательных стафилококков, энтерококков, Clostridium difficile, Streptococcus pneumoniae, Streptococcus pyogenes и других стрептококков и грамположительных патогенов, до гиперчувствительности к пенициллину или аналогу или производному или гликопептиду. Таким образом, указанное средство может прописываться совместно или может вводиться совместно или составляться в рецептуру совместно с подходящим антимикробным агентом в случаях, когда этот бактериальный штамм вызывает быстро угрожающую жизни инфекцию, в частности,-4 007093 в ослабленном хозяине, для создания "гиперчувствительности" инфицирующего организма к антимикробному агенту. Предпочтительно антимикробный агент, к которому увеличивается чувствительность, выбран из группы, состоящей из -лактамных (и аналогичных) антибиотиков (например, метициллина, пиперациллина, флуклоксациллина, клоксациллина, оксациллина, аугментина, офлоксациллина, имипенама и мерпенама), цефалоспоринов (например, цефтазидима и цефуроксима) и гликопептидов (например, ванкомицина, тейкопланина, гентамицина и оритаванцина). Будет понятно, что могут быть использованы два или более антимикробных агента (из одного и того же класса или предпочтительно из различных классов). Устойчивость к метициллину в стафилококках Клеточная стенка стафилококка играет важную роль в патогенезе и лечении инфекции. В грамположительных бактериях клеточная стенка состоит из слоев пептидогликана, которые поперечно сшиты пептидными мостиками. Грамотрицательные бактерии имеют тонкий пептидогликановый слой, инкапсулированный наружной клеточной мембраной. Этот пептидогликан содержит также поперечные мостиковые связи и муропептидные хвосты, на которые могут быть нацелены ВТА, как определено общими принципами, очерченными в общем виде ниже. Вследствие уникальности структуры и сборки пептидогликана он является одной из предпочтительных мишеней для антимикробных агентов, в том числе антибиотиков, природно продуцируемых несколькими типами микроорганизмов. Пептидогликан Staphylococcus aureus состоит из линейных сахарных цепей из чередующихся звеньев N-ацетилглюкозамина и Nацетилмурамовой кислоты, замещенной пентапептидом L-Ala-D-Glu-L-Lys-D-Ala-D-Ala. Характеристикой клеточной стенки S. aureus является пентаглициновая поперечная связь, которая соединяет L-Lys сD-Ala на пентапептиде соседнего звена, причем концевой D-Ala отщепляется транспептидированием. Этот гибкий пентаглициновый мостик делает возможным поперечное сшивание до 90% пептидогликановых звеньев, обеспечивая таким образом существенную стабильность клеточной стенки. Кроме того, эта пентаглициновая связь действует в качестве реципиента для поверхностных стафилококковых белков,которые ковалентно заякориваются на ней посредством реакции, подобной транспептидазной реакции. Поверхностные белки играют важную роль в адгезии и патогенности посредством взаимодействия с белками матрикса хозяина. Основная теория в отношении механизма действия -лактамов касается их структурного сходства с D-Ala-D-Ala-карбокси-концевым районом пентапептида пептидогликана. Пенициллины, цефалоспорины и другие -лактамы ацилируют серии активного сайта транспептидаз клеточной стенки с образованием стабильных ацилферментов, которые лишены каталитической активности. Ингибирование синтеза пептидогликанов ковалентным связыванием -лактамов ферментами синтеза клеточной стенки, известными как пенициллинсвязывающие белки (РВР), делает возможным автолиз S.aureus, опосредованный эндогенными автолитическими ферментами. Хотя автолиз является менее вероятным в MRSA, ген llm кодирует липофильный белок из 351 аминокислотного остатка, который ассоциирован с уменьшенной устойчивостью к метициллину, сопровождаемой увеличенным автолизом. Чувствительные к метициллину S. aureus продуцируют четыре основных РВР с молекулярными массами приблизительно 85, 81, 75 и 45 кДа, соответственно обозначаемыми РАР 1, 2, 3 и 4 (в соответствии с принятой договоренностью, РВР нумеруются в порядке уменьшения молекулярной массы). Устойчивость к пенициллину в S. aureus первоначально была приобретена в форме -лактамаз или пенициллиназ,в настоящее время продуцируемых приблизительно 90% клинических изолятов. Структурный ген лактамазы, blaZ, и два регуляторных гена, blaI и blaRI, обычно находятся на трансмиссивной плазмиде,хотя в некоторых штаммах была идентифицирована хромосомная локализация. Считается, что индукция-лактамазы инициируется связыванием -лактамов с трансмембранным доменом передающего сигнал РВР, кодируемого blaRI (PBP3), приводящим в конце концов к деградации репрессора с потерей его ДНК-связывающих свойств, так что становится возможной транскрипция blaZ. Способ, при помощи которого комплекс BlaRI-пенициллин вызывает деградацию репрессора, является неясным, хотя считается,что деградация могла бы происходить либо вследствие 1) конформационных изменений BlaRI, индуцируемых активацией протеазы в цитоплазматическом домене в результате связывания -лактама, либо вследствие 2) инактивирующей репрессор протеазы, кодируемой предполагаемым геном blaR2, которую комплекс BlaRrI-пенициллин либо активирует, либо заставляет индуцироваться, -лактамазы катализируют инактивацию пенициллина и других -лактамов (в зависимости от класса -лактамазы) ковалентным связыванием с -лактамным кольцом. По существу, это является такой же реакцией, которая имеет место, когда -лактамы связываются с активным сайтом РВР, за исключением того, что эта реакция является негидролитической и необратимой. Некоторые РВР имеют детектируемую -лактамазную активность, в том числе РВР 4 S. aureus. Однако высокомолекулярные РВР (например, РВР 1, 2 и 3 в S. aureus),в основном, участвуют в транспептидировании пептидогликана, тогда как низкомолекулярные РВР проявляют только карбоксипептидазную активность. Устойчивость к метициллину в S. aureus и коагулаза-отрицательных стафилококках определяется образованием специфического РВР, РВР 2 а, который имеет уменьшенную аффинность в отношении лактамных соединений. Низкоаффинный РВР 2 а придает внутреннюю устойчивость к практически всем-лактамным антимикробным агентам, в том числе цефалоспоринам. РВР 2 а действует в качестве транспептидазы в синтезе клеточной стенки в MRSA, когда присутствуют высокие концентрации -лактамов,что ингибирует активность нормальных РВР, 1-4. РВР 2 а кодируется структурным геном mесА, локализованным на хромосоме устойчивого к метициллину стафилококка. Экспрессия РВР 2 а регулируется двумя регуляторными генами на mес-ДНК, mecI и mecRI, локализованными впереди от mесА, которые кодируют репрессорный белок mесА и белок передачи сигнала, соответственно. MRSA, несущие интактные mecI и mecRI вместе с mесА, называют пре-MRSA. Поскольку интактный продукт mecI сильно репрессирует экспрессию РВР 2 а, пре-MRSA является, по-видимому, чувствительным к метициллину. Была высказана гипотеза, что удаление репрессорной функции в отношении mесА является предпосылкой для конститутивной экспрессии устойчивости к метициллину в S. aureus, несущей mес-ДНК. Существует гомология между mecI и blaI, mecRI и blaRI и промоторными и N-концевыми частями blaZ иmесА. Эта гомология является достаточно сильной для того, чтобы blaI мог восстанавливать нормальный индуцибельный фенотип у изолятов S. aureus, что приводит к большим количествам конститутивной продукции РВР 2 а вследствие отсутствия или дефекта в локусе mecI. Увеличенное продуцирование РВР 2 а может быть связано с устойчивостью к ванкомицину (см. ниже). После обнаружения РВР 2 а стало понятным, что фенотипическая экспрессия устойчивости к метициллину не коррелировала с количеством экспрессируемого РВР 2 а. В 1983 г. было показано, что необходимы несколько дополнительных генов, независимых от mесА, для сохранения высокого уровня устойчивости к метициллину в MRSA. Эти гены были названы fem, так как считалось, что они обеспечивают факторы, существенные для устойчивости к метициллину, или aux, т.е. вспомогательные (auxiliary) факторы. Хотя первоначально считали, что факторы fem и aux представляли дополнительные гены, рекрутированные стафилококками после приобретения mесА для дополнительного улучшения и укрепления устойчивости к метициллину и ее гомогенности, становилось все более ясным, что гены fem были природными компонентами всех стафилококков и участвовали в образовании пентапептидного мостика и модификации этого мостика или муропептида. Синтез пентаглицинового мостика происходит на мембраносвязанном предшественнике липида II NAG-(-1,4)-NAM-(L-Ala-D-Glu-L-Lys-D-ALa-D-Ala)-пирофосфорилундекапреноле посредством последовательного добавления глицина к -аминогруппе лизина с использованием глицил-тРНК в качестве донора независимым от рибосом образом. Были описаны шесть генов fem (femA, femB, femC, femD, femE, femF). Гены femA и femB являются близкородственными, но отличными генами, которые образуют часть оперона. Было показано, что как femA, так и femB участвуют в образовании пентаглицинового мостика. FemA, продукт гена femA, является ответственным за добавление глицинов 2 и 3 к этому мостику, тогда как FemB, продукт femB, добавляет глицины 4 и 5. Был предложен гипотетический ген femX как ответственный за белок, который добавляет первый глицин. В стафилококках были идентифицированы другие FеmА,В-подобные факторы, такие как Lif вStaphylococcus simulans и Ерr в Staphylococcus capitis, которые защищают эти организмы от их собственной глицилглицин-эндопептидазы. Затем были идентифицированы три новых гена, fmhA, В и С. Этиfem-подобные гены являются ответственными за введение 1-2 остатков серина в пентапептидный мостик в коагулаза-отрицательных стафилококках и могут, при определенных условиях, включать остатки серина в положения 3 или 5 в этом мостике в некоторых штаммах S. aureus. Затем было показано, что fmHB является постулируемым femX, который добавлял остатки глицина в положение 1 в пентаглициновом межпептидном мостике. Ингибирование образования пентаглицинового мостика уменьшает устойчивость к метициллину без влияния на синтез РВР 2', приводя к гипервосприимчивости к -лактаму (гиперчувствительности). Таким образом, пентапептидный мостик имеет важную функцию в поддержании стабильности клеточной стенки, в том числе устойчивости к антимикробным агентам. Данная заявка придает также большое значение пригодности эндогенных эндопептидаз в качестве мишени для превращения, так как природная активность этих ферментов может использоваться для превращения чувствительности бактериальных клеток к определенным активным в отношении клеточных стенок агентов, примером чего является превращение устойчивых к метициллину штаммов в чувствительные к метициллину штаммы. Устойчивость к ванкомицину Гликопептидные антибиотики являются ингибиторами синтеза пептидогликанов. В отличие от лактамов и родственных антимикробных агентов, гликопептиды не связываются непосредственно с ферментами биосинтеза клеточной стенки (РВР), а образуют комплекс с карбоксигруппой концевого Dаланина пентапептида-предшественника клеточной стенки. Это блокирует продвижение к последующим стадиям трансгликозимерования в синтезе пептидогликанов и препятствует реакциям, катализируемымD,D-транспептидазами и D,D-карбоксипептидазами, необходимым для заякоривания пептидгликанового комплекса. С первого появления VRE (ванкомицин-резистентных энтерококков) было очевидно, что штаммы могут быть разделены по их типу и уровню устойчивости к гликопептидам. В настоящее время имеются семь генотипических классов для характеристики гликопептид-резистентных энтерококков: vanA, обнаруживаемый преимущественно в Е. faecium и Е. faecalis, который придает устойчивость к 256 мг/л ван-6 007093 комицина и 32 мг/л тейкопланина; vanB, обнаруженный в Е. faecium, E. faecalis и Streptococcus bovis,который придает устойчивость к 4-1000 мг/л ванкомицина и 1,0 мг/л тейкопланина; vanC1 (Е. gallinarium), vanC2 (Е. casseliflavus), vanC3 (E. flavescens), который придает устойчивость к 2-32 мг/л ванкомицина и 1,0 мг/л тейкопланина; vanD, который придает устойчивость к 64-256 мг/л ванкомицина и 4-32 мг/л тейкопланина в Е. faecium; и vanE, который придает устойчивость к 16 мг/л ванкомицина и 0,5 мг/л тейкопланина в Е. faecalis. VRE типа VanA обеспечивают основную модель достижения резистентности высокого уровня к ванкомицину: вместо образования пентапептидных звеньев клеточной стенки с хвостами D-Ala-D-Ala, с которыми связываются ванкомицин и другие гликопептиды, гликопептидами индуцируется кластер генов vanA для образования хвостов D-Ala-D-Lac, с которыми ванкомицин и тейкопланин не связываются. Кластер генов vanA содержится на транспозируемом элементе TN1546, а сам генvanA продуцирует белок 39 кДа, локализованный в цитоплазматической мембране. Этот белок является лигазой, которая синтезирует преимущественно D-Ala-D-Lac. Кроме vanA, имеются два других гена:vanH, который кодирует фермент дегидрогеназу, продуцирующую D-lac из пирувата, и vanX, который кодирует металлодипептидазу, которая преимущественно гидролизует D-Ala-D-Ala. Активация транскрипции vanHAX регулируется двухкомпонентной регуляторной системой VanRS, содержащей геныvanS, сенсора сигнала, и vanR, регулятора ответа. Остальная часть кластера генов vanA включает в себя два дополнительных гена, vanY (D,D-карбоксипептидаза, которая отщепляет концевой D-Ala от остатков пентапептида и может увеличивать уровень устойчивости к гликопептидам дополнительно элиминацией мишеней связывания, т.е. D-Ala-DS-Ala) и vanZ (который опосредует увеличенную устойчивость к тейкопланину). Возникновение в конце концов устойчивых к ванкомицину MRSA было предвосхищено, так как было показано экспериментально, что гены vanA из VRE могут быть перенесены в дефицитный по рекомбинации S. aureus. Однако это не случилось на практике ни с S. aureus, ни с коагулазаотрицательными стафилококками. По-видимому, в MRSA устойчивость к ванкомицину не встречается без толерантности к -лактамам, и толерантные штаммы S. aureus, вызывающие эндокардит, ассоциированы с увеличенной смертностью. Толерантность к ванкомицину возникала также в Streptococcus pneumoniae, и толерантные штаммы более легко превращаются в высокоустойчивые штаммы. Это, повидимому, опосредовано изменениями ДНК в двухкомпонентной системе сенсор-регулятор (VncSVncR), которая опосредует изменения в экспрессии генов, связанных с образованием клеточной стенки. Аминокислотные последовательности VncS и VncR обнаруживают 38% гомологию с регуляторной системой VanSB-VanRB, связанной с устойчивостью к гликопептидам в ванкомицин-резистентном Е. faecalis(VREF), и являются, возможно, релевантными в отношении MRSA. Действительно, сверхпродуцирование цитоплазматического белка 37 кДа, который, как считается, является D-лактатдегидрогеназой, аналогичной VanH в VREF, было связано с устойчивостью к ванкомицину в штамме S. aureus. Эта стафилококковая D-лактатдегидрогеназа может также находиться под контролем механизмов трансдукции сигналов, сходных с двухкомпонентными гомологичными районами в S. pneumoniae, и MRSA, возможно,имеют последовательности, гомологичные VanSB-VanRB/VncR-VncS. Устойчивость к ванкомицину вMRSA достигалась скорее другим способом, чем приобретение новых генетических элементов, а именно изменением состава клеточной стенки, которое в сильной степени регулируется ферментами, классически чувствительными к пенициллину (РВР). Сверхпродукция РВР 2 а, утолщенная клеточная стенка, содержащая неамидированный компонент с высоким содержанием глутамина, и увеличение синтеза клеточной стенки, - все цитировались в качестве механизмов. До сих пор еще не было показано, что появление в клеточной мембране дегидрогеназы, гомологичной VanH в энтерококках, является важным в клинических штаммах, хотя существует определенный потенциал в отношении развития устойчивости высокого уровня к ванкомицину при участии этого белка. В настоящее время этот тип устойчивости к ванкомицину, встречающийся в S. aureus, был описан как промежуточная или уменьшенная (чувствительность), которую обычно трудно детектировать рутинными диагностическими способами. Основным способом детектирования является отсутствие успеха при лечении. Однако в настоящее время в США были выделены штаммы VRSA, и ожидается, что они широко распространятся по всему миру или будут свидетельствовать о появлении подобных штаммов в других местах. Терапевтическое применение тейкопланина является несколько противоречивым, так как он не был одобрен для применения в США и может селекционировать на ванкомицин-резистентный S. aureus.MRSA с уменьшенной чувствительностью к гликопептидам, выделенный из диабетических язв стоп, был ассоциирован с использованием тейкопланина, и неудача лечения была связана с увеличенными МИК(минимальными ингибирующими концентрациями) тейкопланина. Известно, что высокие концентрации экзогенного глицина влияют на синтез клеточной стенки. Более специфический интерес представляет открытие того, что глицин уменьшает МИК метициллина против MRSA: De Jonge et al. (Antimicrobial Agents and Chemotherapy (1996), 40, pp. 1498-1503) использовали концентрации глицина в среде для выращивания, которые приводили к пептидогликану, в котором муропептиды с D-Ala-D-Ala-концом были заменены муропептидами с D-Ala-глицин-концом. Эти авторы сделали вывод, что исчезновение муропептидов с D-Ala-D-Ala-концами в пептидогликане и сопутст-7 007093 вующее уменьшение устойчивости свидетельствуют о центральной роли имеющих D-Ala-D-Ala-концы предшественников в устойчивости к метициллину. Авторы считают, что выраженный эффект ВТА формулы I заключается в том, что концевой муропептидный хвост в стафилококках становится хвостом DAla-ВТА, и что это оказывает превращающую активность либо отдельно, либо вместе с другими эффектами против устойчивости к метициллину и устойчивости к ванкомицину. Начальные эксперименты с MRSA, распространенными в Соединенном Королевстве в 1980-х годах, обнаружили, что 2% глицин превращал все MRSA в чувствительные к метициллину штаммы. Это имело место только в присутствии глицина, клетки не были постоянно затронутыми. Затем был идентифицирован более активный агент, бензиловый эфир глицина (GBE), который обнаруживал превращающую активность при уровнях 0,1-1%. В присутствии GBE MRSA были также чувствительными к цефалоспоринам и другим -лактамным агентам, которые не гидролизовались стафилококковой лактамазой, т.е. устойчивость к пенициллину была стабильной вследствие продуцирования этого фермента. Достигнутая чувствительность была соизмеримой с чувствительностью, достигаемой посредством этих агентов при тестировании против чувствительных к метициллину штаммов, как обсуждалось выше. Насколько известно авторам данного изобретения, использование GBE в качестве превращающего средства для клинического лечения инфекции MRSA не было продвинутым. Также не было исследовано использование GBE для превращения штаммов, устойчивых к "нелактамным активным в отношении клеточной стенки" антимикробным агентам, например, гликопептидным антимикробным агентам. Следующие общие принципы должны соблюдаться для идентификации превращающих средств в микроорганизмах с клеточными стенками.GBE (бензиловый эфир глицина) является первым ВТА (средством для превращения бактерий) с полезной активностью, против которой может оцениваться эффективность других соединений. Способ идентификации остатков состоит в установлении состава поперечных (мостиковых) связей в клеточной стенке организма-мишени (т.е. выбранного организма) и тестировании превращающей способности этих индивидуальных молекул в отношении антимикробных агентов, активных в отношении клеточной стенки. Остатки, которые повторяются в любой конкретной поперечной связи, вероятно, указывают на молекулы с более полезной эффективностью. Выбранные организмы будут включать в себя инфекционные микроорганизмы с поперечными (мостиковыми) связями в клеточной стенке и дипептидными муропептидными хвостами, например, грамотрицательные и грамположительные бактерии, Chlamydia и т.д. Аминокислотные остатки в поперечных мостиковых связях клеточной стенки являются мишенями для идентичных или структурно сходных остатков, содержащихся в молекулах, обладающих большей эффективностью, чем эффективность, достигаемая одними аминокислотами. Остатки одной или нескольких аминокислот, входящих в поперечные мостиковые связи клеточной стенки, являются структурами, которые обнаруживают увеличенную эффективность в сравнении с превращающей активностью одних аминокислот. В случае MRSA поперечная мостиковая связь состоит из пяти молекул глицина, для которых Nацетилглицин и бензиловый эфир глицина являются двумя исходными ВТА-соединениями. Эти основные ВТА демонстрируют, каким образом молекулы с остатком глицина могут экспонировать карбоксильные или аминоостатки, связанные с пентаглициновой поперечной связью в S. aureus. Кроме того, эндопептидазы, такие как глицилглицин-эндопептидаза стафилококков, могут быть также потенциальными превращающими мишенями, поскольку природная активность этих ферментов может использоваться для превращения чувствительности бактериальных клеток к определенным активным в отношении клеточных стенок агентам, примером чего является превращение метициллинрезистентных штаммов в чувствительные к метициллину штаммы. Точные молекулярные взаимодействия ВТА, описанных в данной заявке, неизвестны, но взаимодействие с глицилглициндипептидазами и другими ферментами, участвующими в образовании и ремоделировании поперечных связей клеточной стенки и муропептидных хвостов, являются наиболее вероятными. Целью данной заявки является также использование подобного подхода для идентификации ВТА,специфических для устойчивости к ванкомицину, которая в VRE и VRSA основана на изменении муропептидных хвостов клеточной стенки из D-Ala-D-Ala в D-Ala-D-Lac или других вариациях. Таким образом, ВТА могли бы содержать остатки D-Ala-D-Lac или другие вариации или быть способными прямо заменять концевую аминокислоту с образованием D-Ala-ВТА-концов. Скрининг таких соединений на превращающую активность должен использовать способы, описанные в данной заявке. Таким образом, целью данной заявки является обеспечение разработки всех молекул, которые взаимодействуют с поперечными мостиковыми связями и муропептидными хвостами в клеточных стенках микроорганизмов, представляющих интерес для медицины, либо прямо, либо опосредованно сходным образом с тем, как это установлено для GBE так, что эти организмы превращаются в организмы с клинически релевантной чувствительностью, т.е. чувствительностью, которая поддается лечению подходящим активным в отношении клеточной стенки антимикробным агентом, одновременно прописываемым или одновременно вводимым с этим ВТА.-8 007093 Примеры Для нахождения веществ, родственных GBE, которые могут иметь увеличенную эффективность,различные вещества, в том числе вещества с дополнительными глициновыми остатками и бензилаты,были подвергнуты скринингу. Скрининг проводили с использованием агара Isosensitest (Oxoid, UK), в который были включены различные количества потенциальных ВТА при концентрациях 0,01-1,0%. Затем этот агар с включенными ВТА использовали таким же образом, как и в стандартном тесте на устойчивость к антибиотикам, с использованием дисков с 10 мкг метициллина. Тест-организм инокулировали на поверхность агара при концентрации, подходящей для достижения конфлюентного роста после 18 ч инкубирования при 30 С. После инкубирования диаметры зон сравнивали с диаметрами, получаемыми на контрольной чашке (только Isosensitest) для каждого тестируемого организма. Бензиловый эфир глицина (GBE) [С 9 Н 11NO2] (сравнительный пример) трет-бутиловый эфир глицина [C7H7N2O2] (пример 1) ангидрид глицина [C4 Н 6N2 О 2] (пример 2) этиловый эфир глицина [C4H9NO2] (пример 3)N,N-диметилглицин [(CH3)2NCH2CO2H] (пример 4) этиловый эфир N,N-диметилглицина [(СН 3)2NСН 2 СO2 С 2 Н 5] (пример 5) метиловый эфир глицина [С 3 Н 7NO2] (пример 6) диглицин (глицилглицин) [C4H8N2O3] (пример 7) метиловый эфир глицилглицина [С 5 Н 10N2O3] (пример 8) этиловый эфир глицина [С 6 Н 12N2O3] (пример 9) бензиловый эфир глицилглицина [С 11 Н 14N2O3] (пример 10) триглицин [С 6 Н 11N3O4] (пример 11)Arg-Gly [C8H17N5O3] (пример 38) Все приведенные выше вещества, в том числе сам глицин, превращали референс-штамм MRSA (типовой штамм) и различные выбранные MRSA (OMRSA), EMRSA-1 и EMRSA-16 в чувствительные штаммы. Гидантоиновая кислота имела низкий уровень активности против ванкомицин-резистентных энтерококков (VRE), тогда как GBE и этиловый эфир глицилглицина имели более высокую активность в огношении VRE и MRSA, чем бензиловый эфир глицилглицина. п-аминогиппуровая кислота имела улучшенную активность в сравнении с гиппуровой кислотой и GBE. Различные соли могут иметь измененную активность и стабильность, как и другие аналоги, в том числе пептидные, бензилатные, амино- и ацетатные варианты и удлиненные соединения. Табл. 1 показывает улучшенное действие на чувствительность к метициллину бензилового эфира глицина (GBE) (пример 10) на различных выделенных из пациентов MRSA (L-ряда) и референсштаммах. В момент выделения изоляты от пациентов были устойчивыми ко всем клинически доступным-лактамам, цефалоспоринам, макролидам и гентамицину. Была вариабельная чувствительность к тетрациклину, триметоприму, хлорамфениколу, фусидовой кислоте и рифампицину. Как можно видеть из табл. 1, бензиловый эфир глицина увеличивал чувствительность к метициллину в гораздо большей степени, чем глицин. Даже при 0,001 М наблюдали улучшенное действие в сравнении с глицином при 0,2 М (тест 3, сравните с тестом 1) для всех штаммов. Таблица 1 В табл. 1 желаемая минимальная ингибирующая концентрация МИК обеспечивается чувствительным к ванкомицину референс-штаммом NCTC 12493, который имеет МИК ванкомицина 2 мг/л. 0,2 М глицин достигает такой МИК в 50% испытанных штаммов в сравнении с 0,02 М глицилбензиловым эфиром, который дает полное превращение в 100% испытанных штаммов. Важно, что полезность агентов данного изобретения не ограничивается увеличением бактериальной чувствительности к метициллину. Превращающий эффект глицилбензилового эфира в отношении двух цефалоспоринов показан в табл. 2. Бензиловый эфир глицина превращает тестируемый MRSA в чувствительный к цефтазидиму и цефуроксиму, делая таким образом эти два лекарственных средства, которые никогда не имели полезной активности против MRSA, снова активными против MRSA. Потенциал полезной активности in vivo показан в табл. 3, которая показывает МИК метициллина в 1% плазме человека для изолятов MRSA от 19 пациентов для бензилового эфира глицина и глицина в качестве эталона. Хранящуюся в замороженном состоянии плазму от пяти субъектов объединяли. Таблица 3 Плазма человека может связывать или иным образом инактивировать чужеродные вещества, и хорошая активность в плазме свидетельствует о хорошей активности in vivo. Аппроксимации из приведенных выше данных предполагают, что активность глицина снижалась на приблизительно 75%, а активность бензилового эфира глицина снижалась на приблизительно 75-50%. Это может быть обусловлено скорее связыванием белком, чем ферментативной деградацией, что указывает на ценную стабильность invivo. И в этом случае увеличение чувствительности к метициллину является значительно увеличенным для бензилового эфира глицина в сравнении с глицином. Табл. 4 показывает способность бензилового эфира глицина и N-ацетилглицина (NAGly) (пример 4) превращать MRSA с промежуточной устойчивостью к гликопептидам в чувствительные к гликопептидам штаммы. Эти результаты показывают, что бензиловый эфир глицина и N-ацетилглицин могут восстанавливать активность ванкомицина в промежуточно-резистентном к ванкомицину MRSA (VISA) и активность тейкопланина в промежуточно-резистентном к тейкопланину MRSA (TISA) посредством снижения МИК ниже общепринятого порога устойчивости МИК 8 мг/л, который определяет промежуточную устойчивость, при очень низких концентрациях (0,001 М). Средства данного изобретения не ограничиваются обращением резистентности в Streptococcus. Тест-штаммами в табл. 5 являются изоляты из пациентов ванкомицин- и гентамицин-резистентного Enterococcus faecium. В момент выделения они были обычно резистентными ко всем клинически используемым антимикробным агентам. Таблица 5 В табл. 5 желаемая МИК для превращения обеспечивается чувствительным к ванкомицину референс-штаммом АТСС 29212, который имеет МИК ванкомицина 2 мг/л. 0,2 М глицин достигает этого желаемого значения в 50% испытанных штаммов в сравнении с 0,02 М GBE, который дает полное превращение в 100% испытанных штаммов. Как упоминалось ранее, обычной причиной аутоинфекции является S. aureus, носимый на ноздрях. Данные в табл. 6 показывают, что бензиловый эфир глицина увеличивает чувствительность уже чувствительных бактерий к метициллину (и косвенно к другим родственным антибиотикам, таким как флуклоксациллин). Превращающие средства данного изобретения могут быть также использованы в комбинации с подходящим антимикробным агентом для устранения назального носительства MRSA перед хирургией сердца или перед другими инвазивными процедурами, несущими в себе риск аутоинфекции. Табл. 7 демонстрирует активность пяти ВТА-соединений в соответствии с данным изобретением. Четыре клинических изолята выделяли из пациентов во время первых трех месяцев 2003 г. Самые поздние изоляты использовали так, как они представляют эволюцию штамма, в частности, в эпидемическийMRSA, примером чего является большая способность проявлять пониженную чувствительность к гликопептидам. Включали также MRSA с промежуточной устойчивостью, когда устойчивость к метициллину достигалась другим способом, чем продуцирование РВР 2 а. Пониженная чувствительность EMRSA-17 к ванкомицину преобразуется средствами для превращения бактерий (ВТА), как и устойчивость к цефалексину, который является обычно минимально активным против стафилококков. Таблица 7 Для клинического применения эти агенты могут вводиться системно (например, внутривенно) при тяжелых системных инфекциях, таких как септицемия. Однако ожидается, что одним из главных применений этих агентов будет местное введение для последующего лечения локальных инфекций или введение в качестве части программы для элиминирования устойчивых бактерий из их носителя, например,перед хирургическим вмешательством, для предупреждения диссеминации инфекции перед ее возникновением. Далее следует неисчерпывающий перечень антибиотиков, которые могут быть включены с превращающими средствами данного изобретения, и их предпочтительные способы введения: Пероральное введение: флуклоксациллин, клоксациллин, оксациллин, пиперациллин; внутривенное (IV) введение: ванкомицин, меропенем, флуклоксациллин, клоксациллин, оксациллин, пиперациллин, цефуроксим; внутримышечное (IM) введение: флуклоксациллин, цефуроксим, цефтриаксон; местное введение: флуклоксациллин, оксациллин, цефалексин. Общие соображения, касающиеся композиций Когда речь идет о системном введении, предпочтительной обычно является комбинированная форма, если полупериоды существования в организме превращающего средства и антимикробного агента являются сравнимыми. Например, пенициллины обычно имеют полупериод существования приблизительно 1,5-2 ч и вводятся 3-4 раза в день. С другой стороны, тейкопланин имеет полупериод существования 12 ч, и его вводят обычно 1 раз в день. Таким образом, превращающее средство должно быть выбрано таким образом, чтобы оно имело соответствующий полупериод существования или, альтернативно,вводилось отдельно по отличающейся схеме введения. Обычно превращающее средство должно находиться в достаточной концентрации для получения уровней in vivo, которые будут выполнять превращение в бактериях-мишенях во время приблизительно того же самого периода, что и полупериод существования антимикробного агента. Должно быть, конечно, понятно, что действительная концентрация превращающего средства не связана с концентрацией антимикробного агента в композиции. Должно быть также понятно, что, если организм-мишень является бактериальным штаммом, который эволюционировал из исходного предшественника, существенным является то, что совместно приготовляемый или совместно вводимый антибиотик имеет демонстрируемую полезную активность против исходного штамма-предшественника организма-мишени. Это является обязательным требованием, так как превращающее средство полностью или частично уменьшает устойчивость эволюционировавшего организма-мишени самое большое до устойчивости чувствительного эквивалентного штамма. Пример 1 лекарственного средства. Бензиловый эфир глицина, этиловый эфир глицилглицина, гиппуровую кислоту, паминогиппуровую кислоту или пропаргилглицин и флуклоксациллин или оксациллин смешивают с па- 14007093 рафиновым воском, софтисаном, гидроксипропилметилцеллюлозой, полиглицерил-4-капратом и глицерином с получением мази, содержащей 0,2 мас.% ВТА и 1 мас.% флуклоксациллина или оксациллина. Схема лечения. Мазь втирают в инфицированный участок 3-4 раза в день, пока инфекция не элиминируется, или наносят в глубокую рану при наложении повязки. Этот препарат может быть также нанесен в место введения внутрисосудистого устройства в качестве профилактической меры против связанного с канюлей или катетером инфицирования. Пример 2 лекарственного средства.N-ацетилглицин или один из ВТА, перечисленных в табл. 7, и цефуроксим или оксациллин или другой подходящий антимикробный агент смешивают с инертным жидким носителем с получением 1%(масса/объем) каждого активного ингредиента, и дозы вводят в аэрозольный аппликатор. Схема лечения. Это лекарственное средство распыляют интраназально 3-4 раза в день в течение пяти дней перед хирургическим вмешательством (или во время вспышки эпидемии в больнице) для элиминации носительства S. aureus в ноздрях. Лечение может быть продолжено после хирургии, если это желательно, или в том случае, если происходит повторная инокуляция участка носительства бактерий. Этот спрей может быть также использован для введения антимикробного продукта в хирургическую рану перед ее закрытием для предупреждения инфекции (например, грудинные раны, протезы или трансплантаты костей и суставов). Этот спрей может быть также использован для введения антимикробного продукта в хронические язвы (например, диабетические язвы ног) перед наложением повязки или в том случае, если язву оставляют открытой. Пример 3 лекарственного средства. 1,0% раствор ВТА (например, как в табл. 7) плюс подходящий антимикробный агент, такой как оксациллин или цефуроксим, готовят в виде раствора, например обычного физиологического солевого раствора. Схема обработки для сосудистого трансплантата. Трансплантат сосуда помещают в этот раствор и оставляют мокнуть перед трансплантацией. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ увеличения чувствительности бактериального штамма к активным в отношении клеточной стенки антимикробным агентам, к которым бактериальный штамм или штамм-предшественник, из которого развился данный штамм, является чувствительным, предусматривающий стадию подвергания указанного бактериального штамма действию по меньшей мере одного превращающего средства, имеющего следующую формулу (I): где остатки R1 и R2, каждый независимо, выбраны из алкила, алкилокси, алкилоксикарбонила, алкилкарбонилокси, алкенила, алкенилокси, алкенилоксикарбонила, алкенилкарбонилокси, алкинила, алкинилокси, алкинилоксикарбонила, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси, арилоксикарбонила, арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбамоила,остаток R3 выбран из алкила, алкилокси, алкилкарбонилокси, алкенила, алкенилокси, алкенилкарбонилокси, алкинила, алкинилокси, алкинилкарбонилокси, каждый из которых может быть замещенным или незамещенным, имеющим прямую цепь или разветвленным или циклическим, арила, арилокси,арилкарбонилокси, каждый из которых может быть замещенным или незамещенным, и карбоксила,иные, чем R1, R2 и R3, не являются все Н, иY выбран из боковой цепи природной аминокислоты,или его физиологически приемлемой соли или производного, которое превращается в соединение формулы I при физиологических условиях. 2. Способ по п.1, где Y представляет собой -H2 (т.е. боковую цепь глицина). 3. Способ по п.1, где один из R1 и R2 является Н. 4. Способ по п.1, где один из R1 и R2 представляет собой алкилкарбонил (более предпочтительноC2-С 6-алкилкарбонил), алкенилкарбонил (более предпочтительно C2-С 6-алкенилкарбонил), алкинилкарбонил (более предпочтительно С 2-С 6-алкинилкарбонил). 5. Способ по п.1, где один из R1 и R2 представляет собой C1-С 6-алкилкарбонил и предпочтительно метилкарбонил (ацетил).(более предпочтительно C2-С 6-алкенилокси), алкинилокси (более предпочтительно C2-С 6-алкинилокси) или арилокси (более предпочтительно фенилоксикарбонил). 7. Способ по п.1, где R3 является бензилокси. 8. Способ по п.1, где антимикробным агентом является пенициллин, цефалоспорин или их производное или аналог или гликопептид. 9. Способ по п.8, где антимикробным агентом является устойчивый к -лактамазе пенициллин, или его производное, или аналог. 10. Способ по п.1, где антимикробным агентом является оксациллин или ванкомицин. 11. Способ по п.1, где превращающим средством является бензиловый эфир глицина, этиловый эфир глицилглицина, гиппуровая кислота, п-аминогиппуровая кислота или пропаргилглицин. 12. Применение средства, имеющего формулу (I), в изготовлении лекарственного средства для увеличения чувствительности бактериального штамма, инфицирующего, колонизирующего или несомого пациентом, к активному в отношении клеточной стенки антимикробному агенту по п.1. 13. Способ предупреждения инфекции и перекрестной инфекции, связанной с носительством бактериального штамма, предусматривающий местное нанесение на участок (участки) носительства указанного пациента количества превращающего средства формулы (I) по п.1, достаточного для превращения указанного штамма в более чувствительный к антимикробному агенту, и введение указанному пациенту терапевтически эффективного количества указанного антимикробного агента в качестве компонента композиции и/или в качестве совместно вводимого агента. 14. Способ по п.13, где указанное средство может находиться в смеси с одним или несколькими эксципиентами, носителями, эмульгаторами, растворителями, буферами, регуляторами рН, улучшающими вкус и запах агентами, красителями, консервантами или другими обычно используемыми добавками в области фармацевтических веществ в соответствии со способом введения. 15. Способ по п.13, где указанный агент способен увеличивать чувствительность к антимикробному агенту по меньшей мере одного бактериального штамма, выбранного из Staphylococcus aureus, коагулазаотрицательных стафилококков и энтерококков, Clostridium difficile и Streptococcus pneumoniae и других грамположительных патогенов. 16. Способ по п.15, где бактериальный штамм является устойчивым к антимикробному агенту. 17. Способ по п.13, где указанное средство способно увеличивать чувствительность к антимикробному агенту по меньшей мере одного из устойчивого к метициллину и/или устойчивого к гликопептидуStaphylococcus aureus и устойчивых к ванкомицину энтерококков к антимикробному агенту, к которому является устойчивым бактериальный штамм. 18. Способ по п.17, где бактериальный штамм является устойчивым по меньшей мере к одному из метициллина и его производных или родственных антимикробных агентов, ванкомицина, тейкопланина или других родственных гликопротеидов. 19. Способ по п.13, где указанное средство способно увеличивать чувствительность к антимикробному агенту по меньшей мере одного бактериального штамма, выбранного из Staphylococcus aureus, коагулаза-отрицательных стафилококков, энтерококков, Clostridium difficile, Streptococcus pneumoniae,Streptococcus pyogenes и других стрептококков и грамположительных патогенов, в случаях, когда этот бактериальный штамм вызывает быстро угрожающую жизни инфекцию, в частности, в ослабленном хозяине, для создания "гиперчувствительности" инфицирующего организма к антимикробному агенту. 20. Способ по п.13, где указанное средство способно увеличивать чувствительность EMRSA-15, -16 и/или -17 или других EMRSA к -лактамным (или аналогичным) антибиотикам/антимикробным агентам и/или увеличивать чувствительность EMRSA с пониженной чувствительностью к ванкомицину, тейкопланину или другому гликопептиду или VRSA к вышеуказанным антимикробным агентам. 21. Способ по п.19, где чувствительность увеличивается до уровня сравнимого неустойчивого бактериального штамма при концентрации агента 0,02 М или менее, более предпочтительно 0,002 М или менее и наиболее предпочтительно 0,001 М или менее при определении посредством стандартного теста чувствительности к антибиотикам. 22. Способ по п.13, где антимикробный агент, к которому увеличивается чувствительность, выбран из группы, состоящей из -лактамных (и аналогичных) антибиотиков/антимикробного агента, стабильных к стафилококковым -лактамазам, цефалоспоринов и гликопептидов. 23. Способ по п.22, где антимикробным агентом, к которому увеличивается чувствительность, является метициллин, флуклоксациллин, клоксациллин, оксациллин, имипенам, меропенам, цефтазидим,цефуроксим, ванкомицин, тейкопланин или оритаванцин. 24. Способ по п.13, где антимикробный агент, к которому увеличивается чувствительность, выбран из группы агентов, состоящей из -лактамных (и аналогичных) антибиотиков/антимикробного агента,стабильных к стафилококковым -лактамазам, вместе с ингибитором -лактамазы или его производным или аналогом.- 16007093 25. Способ идентификации превращающих средств в микроорганизмах, имеющих медицинское значение, с клеточными стенками, имеющими структуру, пригодную для действия на них пенициллина и родственных/аналогичных антимикробных агентов и гликопептидов, где состав поперечных мостиковых связей и муропептидных хвостов в клеточной стенке организма-мишени должны быть полностью или частично установлены, и превращающей способности индивидуальных молекул с соответствующими остатками, выбранными для тестирования.
МПК / Метки
МПК: A61K 45/00
Метки: превращения, средство, бактерий
Код ссылки
<a href="https://eas.patents.su/18-7093-sredstvo-dlya-prevrashheniya-bakterijj.html" rel="bookmark" title="База патентов Евразийского Союза">Средство для превращения бактерий</a>
Предыдущий патент: Лечение расстройств мочеиспускания
Следующий патент: Полимерная смесь
Случайный патент: Балансировочный груз с патроном, содержащим материал для балансировки