Водорастворимые пролекарства противоракового действия
Номер патента: 2400
Опубликовано: 25.04.2002
Авторы: Ю Донг-Фанг, Уоллейс Сидни, Ли Чун, Янг Дэвид Дж.
Формула / Реферат
1. Композиция, включающая противоопухолевое лекарственное средство, конъюгированное с водорастворимым полимером или сополимером, причем указанный водорастворимый полимер или сополимер выбирают из группы, включающей поли-(d-глутаминовую кислоту), поли-(l-глутаминовую кислоту), поли- (dl-глутаминовую кислоту), поли-(d-аспарагиновую кислоту), поли-(l-аспарагиновую кислоту) и поли(dl-аспарагиновую кислоту) и их сополимеры, где используемое противоопухолевое лекарственное средство представляет собой паклитаксел, доцетаксел, этопзид, тенипозид, камптотецин или эпотилон.
2. Композиция по п.1, где противоопухолевое лекарственное средство выбирают из паклитаксела, доцетаксела и камптотецина.
3. Композиция по п.2, где сополимер дополнительно определяют как сополимер с поликапролактоном, полигликолевой кислотой и полимолочной кислотой.
4. Композиция по любому из предшествующих пунктов, где полимер/сополимер имеет молекулярный вес от 5000 до около 100000, предпочтительно от 20000 до 80000.
5. Композиция по любому из предшествующих пунктов, где водорастворимый полимер/сополимер конъюгирован с 2'- или 7-гидроксилом паклитаксела или доцетаксела.
6. Композиция по любому из предшествующих пунктов, включающая от 2 до 35 вес.% противоопухолевого лекарственного средства.
7. Композиция по п.1, где паклитаксел конъюгирован с полиглутаминовой кислотой.
8. Применение композиции по любому из пп.1-7 для лечения рака, для уменьшения, по меньшей мере, одного симптома системной аутоиммунной болезни или для ингибирования артериального рестеноза или артериальной окклюзии после сосудистой травмы.
9. Применение по п.8, где рак представляет собой рак молочной железы, яичников, злокачественную меланому, рак легких, желудка, простаты, ободочной кишки, головы и шеи, лейкемию или саркому Капоши.
10. Имплантируемое медицинское устройство, в частности стент, с покрытием в виде композиции, включающей паклитаксел, конъюгированный с водорастворимыми полиаминокислотами, в количестве, эффективном для ингибирования пролиферации клеток гладких мышц.
Текст
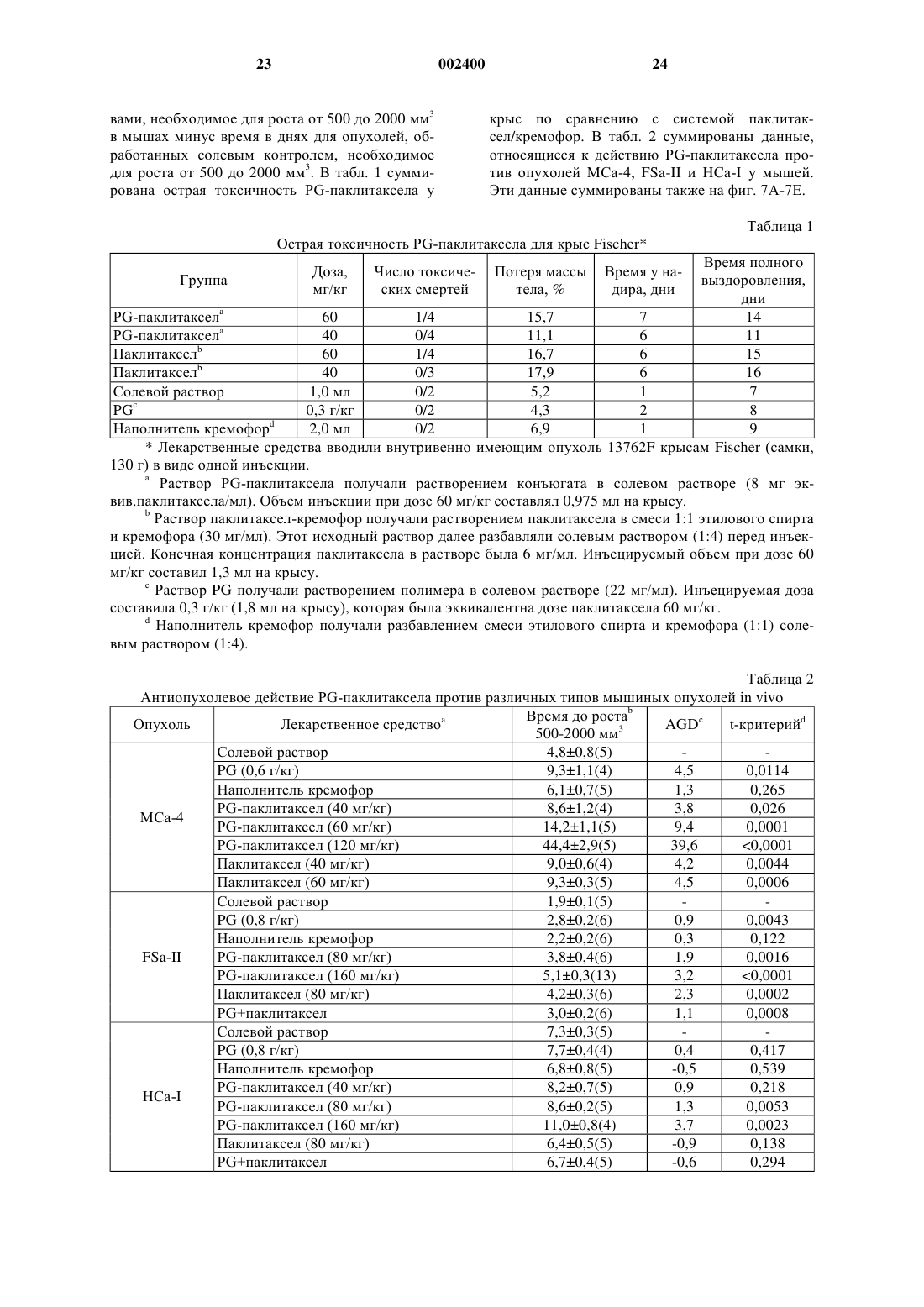
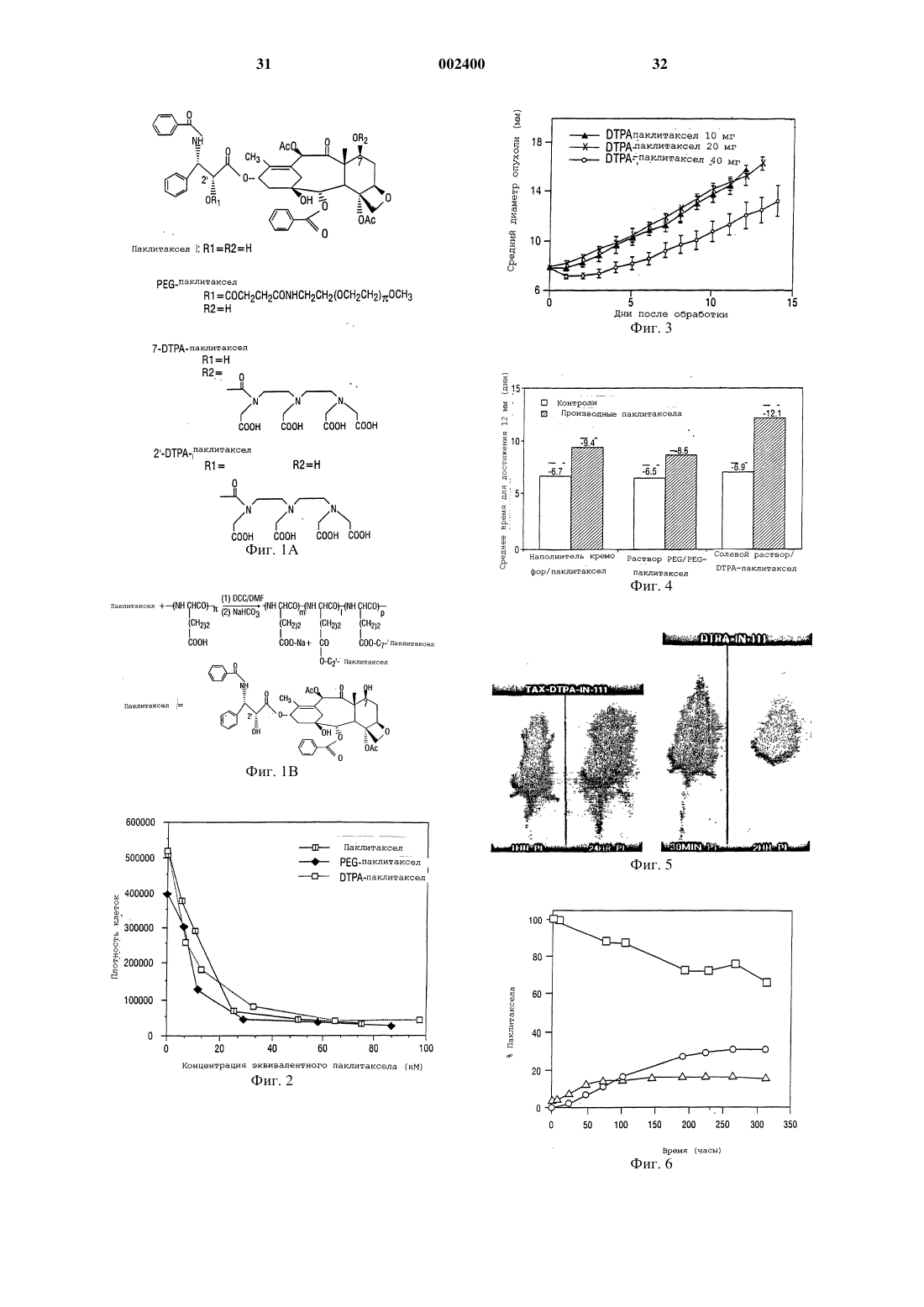
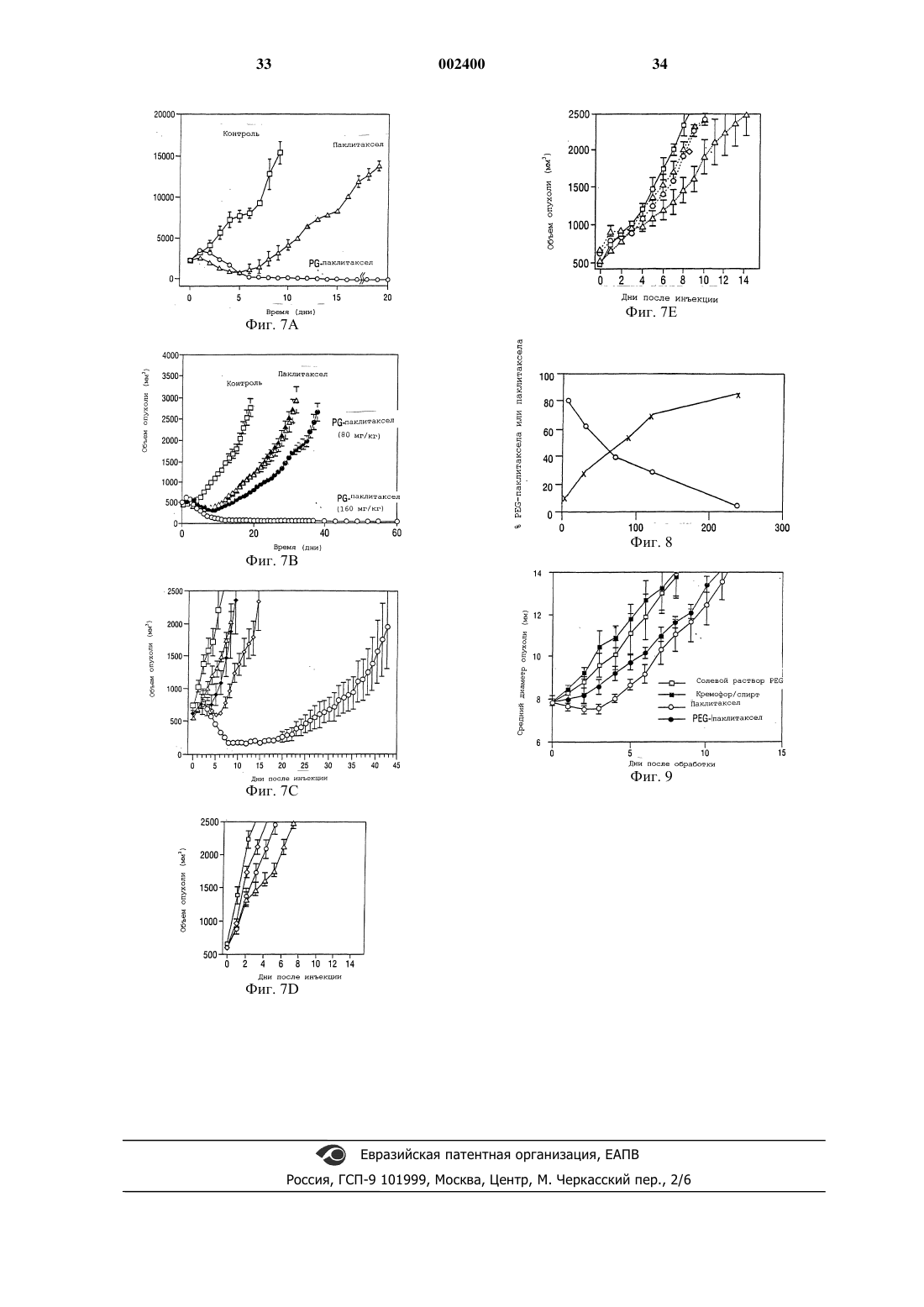
1 Настоящее изобретение относится к фармацевтическим композициям, которые используются при лечении рака, аутоиммунных болезней и рестеноза. Настоящее изобретение относится также к получению фармацевтических антираковых средств, таких как паклитаксел(таксол) и доцетаксел (таксотер), особенно к получению водорастворимого паклитаксела,путем конъюгирования этого лекарственного средства с водорастворимыми фрагментами различных химических соединений. Предпосылки создания изобретения Паклитаксел, как средство против клеточных микротрубок, экстрагированный из игл и коры тикового дерева Taxus brevifolia, проявил интересное антиопухолевое действие в испытаниях при лечении рака человека в стадии I и в испытаниях при лечении ранней стадии II и III(Horwitz et al., 1933). Это испытание было описано, главным образом, для запущенного рака яичников и молочной железы. Существенная активность была подтверждена в случаях мелкоклетчатого и немелкоклетчатого рака легкого,рака головы и шеи и метастатической меланомы. Однако основной трудностью при разработке паклитаксела для использования в клинических испытаниях была его нерастворимость в воде. Доцетаксел полусинтетически получают из 10-деацетилбаккатина III, нецитотоксичного предшественника, экстрагированного из иглTaxus baccata и этерифицированного химически синтезированной боковой цепью (Cortes andPazdur, 1995). Было показано, что к доцетакселу восприимчивы различные раковые клеточные линии, включая рак молочной железы, легкого,яичников и колоректальный рак и меланомы. В клинических испытаниях доцетаксел использовали для достижения полной или частичной восприимчивости при раке молочной железы,яичников, головы и шеи и злокачественной меланоме. Паклитаксел, как правило, изготовляют в виде концентрированного раствора, содержащего 6 мг паклитаксела на миллилитр кремофораEL (полиоксиэтилированное касторовое масло) и обезвоженного спирта (50%, об./об.), его нужно до введения далее разбавить (Goldspiel,1994). Количество кремофора EL, необходимого для доставки требуемых доз паклитаксела, значительно выше, чем количество, которое вводят с любым другим лекарственным средством, которое изготовляют в кремофоре. Кремофору было приписано несколько токсичных действий,включая расширение кровеносных сосудов,одышку и гипотензию. Было также показано,что этот наполнитель вызывает серьезную повышенную чувствительность у лабораторных животных и людей (Weiss et al., 1990). Действительно, максимальная доза паклитаксела, которую можно ввести мышам внутривенной инъекцией болюса, определяется острой летальной 2 токсичностью наполнителя кремофора (Eisemann et al., 1994). Кроме этого, известно, что кремофор EL, поверхностно-активное вещество,выщелачивает фталатные пластификаторы, такие как ди-(2-этилгексил)фталат (ДЭГФ) из поливинилхлоридных мешочков и трубок для внутривенного введения. Известно, что ДЭГФ вызывает гепатотоксичность у животных и карциногенен для грызунов. Показано также, что этот препарат паклитаксела со временем образует частицы вещества и, таким образом, во время введения необходимо фильтрование(Goldspiel, 1994). Поэтому, для получения и введения растворов паклитаксела необходимы специальные меры предосторожности, чтобы обеспечить безопасную доставку лекарственного средства пациенту, и эти меры предосторожности неизбежно ведут к более высокой стоимости. Предыдущие попытки получения растворимого в воде паклитаксела включали получение пролекарства паклитаксела путем введения солюбилизирующих частей, таких как сукцинат и аминокислота, в положение 2'-гидроксильной группы или 7-гидроксильной группы (Deutsch etal., 1989; Mathew et al., 1992). Однако эти пролекарства оказались недостаточно химически стабильными. Например, Deutsch et al. (1989) сообщают о получении 2'-сукцинатного производного паклитаксела, но растворимость натриевой соли составляет только около 0,1%, а соли триэтаноламина и N-метилглюкамина имели растворимость только около 1%. Кроме того, сообщалось, что эфиры аминокислот нестабильны. Схожие результаты сообщались Mathew etal. (1992). Greenwald et al. описали синтез хорошо растворимых в воде 2'- и 7-эфиров таксола с полиэтиленгликолем (Greenwald et al., 1994),однако, не сообщалось ни о каких данных,имеющих отношения к антиопухолевой активности этих соединений in vivo (Greenwald et al.,1995). Другие попытки разрешить эти проблемы включали микрокапсулирование паклитаксела как в липосомах, так и в наносферах (Bartoni andBoitard, 1990). Сообщалось, что липосомная готовая препаративная форма так же эффективна, как свободный паклитаксел, однако, физически стабильны были только липосомные готовые препаративные формы, содержащие менее 2% паклитаксела (Sharma and Straubinger, 1994). К сожалению, оказалось, что готовая препаративная форма в виде наносфер токсична. Следовательно, до сих пор имеется потребность в растворимой в воде готовой препаративной форме паклитаксела, которая может доставить эффективные количества паклитаксела и доцетаксела,без недостатков, вызванных нерастворимостью этого лекарственного средства. Другим препятствием широко распространенному использованию паклитаксела являются ограниченные источники его получения, что 3 делает терапию паклитакселом дорогой. Например, курс лечения может стоить несколько тысяч долларов. Имеется дополнительный неблагоприятный момент, заключающийся в том, что не все опухоли восприимчивы к терапии паклитакселом в результате его недоставки в опухоль. Следовательно, существует безотлагательная потребность в эффективных готовых препаративных формах паклитаксела и родственных лекарственных средств, которые растворимы в воде и имеют длительный период полувыведения из сыворотки крови, для лечения опухолей,аутоиммунных болезней, таких как ревматоидный артрит, а также для профилактики рестеноза сосудов, подвергнутых травмам, таким как пластические операции на сосудах и реконструкции просветов сосудов. Краткое изложение сущности изобретения Настоящее изобретение пытается преодолеть эти и другие недостатки, присущие известному уровню техники, путем получения композиций, содержащих химиотерапевтическое и антиангиогенное лекарственное средство, такое как паклитаксел или доцетаксел, конъюгированный с растворимым в воде полимером, таким как полиглутаминовая кислота или полиаспарагиновая кислота. Показано, что эти композиции эффективны в качестве антиопухолевых средств против моделей опухоли и, как предполагается, по меньшей мере, так же эффективны, как паклитаксел или доцетаксел, против любой из болезней или состояний, для которых, как известно, эффективны таксаны или таксоиды. Композиции этого изобретения обеспечивают растворимые в воде таксоиды, в результате чего преодолеваются недостатки, связанные с нерастворимостью самих этих лекарственных средств, и обеспечивается преимущество регулируемого высвобождения, так что опухоли на моделях животных исчезают после одного внутривенного введения. Способы, описанные в настоящей заявке,можно также использовать для получения растворимых в воде конъюгатов полимеров с другими терапевтическими средствами и лекарственными средствами, включая этопзид, тенипозид, камптотецин и эпотилоны. В частности, эти средства со свободной гидроксильной группой можно конъюгировать с полимерами сходными химическими реакциями, как описано здесь для паклитаксела. Такое конъюгирование будет вполне в пределах квалификации обычного специалиста в области химии, и, как таковое, будет находиться в пределах объема заявленного изобретения. Используемое здесь выражение "конъюгированный с растворимым в воде полимером" означает ковалентное связывание лекарственного средства с полимером. Понятно также, что растворимые в воде конъюгаты настоящего изобретения можно вводить в сочетании с другими лекарственными 4 средствами, включая другие антиопухолевые или антираковые лекарственные средства. Такие комбинации известны в данной области. Растворимый в воде паклитаксел или доцетаксел настоящего изобретения можно в некоторых видах лечения комбинировать, например, с платиновым лекарственным средством, антибиотиком, таким как доксорубицин или даунорубицин, или другими лекарственными средствами,которые используют в комбинации с таксолом. Конъюгирование химиотерапевтических лекарственных средств с полимерами является привлекательным подходом к снижению системной токсичности и улучшению терапевтического индекса. Полимеры с молекулярной массой выше чем 30 кДа не способны легко диффундировать через нормальные капилляры и гломерулярный эндотелий, таким образом оберегая нормальную ткань от неуместной, медиированной лекарственным средством, токсичности (Maeda and Matsumura, 1989; Reynolds,1995). С другой стороны, хорошо установлено,что злокачественные опухоли часто имеют нарушенный капиллярный эндотелий и более высокую проницаемость, чем сосудистая сеть нормальной ткани (Maeda and Matsumura, 1989;Fidler et al., 1987). Таким образом, конъюгат полимер-лекарственное средство, который будет обычно оставаться в сосудистой сети, может селективно просачиваться из кровеносных сосудов в опухоли, приводя к накоплению в опухоли активного терапевтического лекарственного средства. Кроме того, конъюгаты полимерлекарственные средства могут действовать в качестве депо лекарственного средства для длительного высвобождения, что приводит к длительному воздействию лекарственного средства на опухолевые клетки. И, наконец, растворимые в воде полимеры можно использовать для стабилизации лекарственных средств, а также для солюбилизации иначе нерастворимых соединений. В настоящее время были исследованы различные синтетические и природные полимеры для изучения их способности повысить опухоль-специфическую доставку лекарственного средства (Kopecek, 1990; Maeda and Matsumura,1989). Однако в настоящее время только несколько таких полимеров получили клиническую оценку, включая SMANCS в Японии иKopecek and Kopeckova, 1993). В настоящем описании подразумевается,что таксоид означает те соединения, которые включают паклитаксел и доцетаксел, и другие химические соединения, которые имеют скелет таксана (Cortes and Pazdur, 1995) и которые можно выделить из природных источников, таких как тис, или из клеточной культуры, или которые могут быть химически синтезированными молекулами, предпочтительно химическим соединением общей химической формулы(бензоилокси)-2 а,3,4,4 а,5,6,9,10,11,12,12 а,12bдодекагидро-4,11-дигидрокси-4 а,8,13,13-тетраметил-5-оксо-7,11,-метано-1 Н-циклодека[3,4] бенз-[1,2-b]оксет-9-иловый эфир [2aR-[2a,4,4,6,9(R,S),11,12,12a,12b-(бензоиламино)гидроксибензолпропановой кислоты. Понятно, что каждый из паклитаксела и доцетаксела более эффективен, чем другие,против некоторых типов опухолей и что на практике настоящего изобретения следует лечить этим растворимым в воде конъюгатом таксоида те опухоли, которые более восприимчивы к конкретному таксоиду. В некоторых примерах осуществления настоящего изобретения паклитаксел или доцетаксел может быть конъюгирован с растворимым в воде полимером, полимер предпочтительно конъюгируется с 2'- или 7-гидроксилом или с обоими гидроксилами паклитаксела или доцетаксела. Таким образом, когда для конъюгирования лекарственного средства используют функциональные группы, как указано выше,С 2'-гидроксил паклитаксела,разрушаемую связь, в этом случае эфирную, используют для гарантии того, что активное лекарственное средство высвобождается из полимерного носителя. Предпочтительные полимеры включают поли-(l-глутаминовую кислоту), поли(d-глутаминовую кислоту), поли-(dl-глутаминовую кислоту), поли-(l-аспарагиновую кислоту), поли(d-аспарагиновую кислоту), поли-(dl-аспарагиновую кислоту) и сополимеры перечисленных выше полиаминокислот с поликапролактоном,полигликолевой кислотой и полимолочной кислотой, причем особенно предпочтительны полиаспарагиновые кислоты и полиглутаминовые кислоты. Полиглутаминовые кислоты или полиаспарагиновые кислоты по настоящему изобретению предпочтительно имеют молекулярную массу от около 5000 до около 100000, причем более предпочтительно от около 20000 до около 80000 или даже от около 30000 до около 60000. Понятно, что композиции настоящего изобретения можно диспергировать в фармацевтически приемлемом растворе-носителе, как описывается ниже. Такой раствор может быть стерильным или асептическим и может включать воду, буферы, изотонические агенты или другие ингредиенты, известные специалистам данной области, которые не будут вызывать аллергическую или другую вредную реакцию при введении субъекту-животному или человеку. Кроме того, настоящее изобретение может быть также описано как фармацевтическая композиция,содержащая химиотерапевтическое или антираковое лекарственное средство, такое как паклитаксел или доцетаксел, конъюгированное с высокомолекулярным, растворимым в воде полимером. Фармацеватическая композиция может включать полиглутаминовые кислоты или полиаспарагиновые кислоты. 6 Настоящее изобретение может также быть представлено в виде способа лечения рака у субъекта. Этот способ включает получение композиции, содержащей химиотерапевтическое лекарственное средство, такое как паклитаксел или доцетаксел, конъюгированное с растворимым в воде полимером и диспергированное в фармацевтически приемлемом растворе, и введение раствора субъекту в количестве, эффективном для лечения опухоли. Предпочтительные композиции содержат паклитаксел или доцетаксел, конъюгированный с полиглутаминовыми кислотами или полиаспарагиновыми кислотами, более предпочтительно с поли-(lглутаминовой кислотой) или поли-(lаспарагиновой кислотой). Понятно, что композиции данного изобретения эффективны против любого типа рака, для которого, как показано,эффективен неконъюгированный таксоид, и который будет включать, но не ограничиваться ими, рак молочной железы, рак яичников, злокачественную меланому, рак легких, рак желудка, рак ободочной кишки, рак головы и шеи или лейкемию. Настоящее изобретение можно также определить в широком смысле как способ снижения, по меньшей мере, одного симптома системной аутоиммунной болезни, включающий введение субъекту, имеющему системную аутоиммунную болезнь, эффективного количества композиции, содержащей паклитаксел или доцетаксел,конъюгированный с поли-lглутаминовой кислотой или поли-l-аспарагиновой кислотой. Особый интерес в контексте настоящего описания представляет лечение ревматоидного артрита, который, как известно,в некоторых случаях восприимчив к таксолу при введении его в стандартной готовой форме кремофора (патент США 5583153). Как и при лечении опухолей, предполагается, что эффективность растворимых в воде таксоидов настоящего изобретения не будет уменьшаться изза конъюгации с растворимой в воде частью и что растворимое в воде пролекарство может действовать в качестве готовой препаративной формы с регулируемым высвобождением, которая высвобождает активное лекарственное средство в течение некоторого периода времени. Следовательно, предполагается, что композиции настоящего изобретения так же эффективны,как и таксол, например, против ревматоидного артрита, но будут проявлять преимущество регулируемого высвобождения. Понятно также,что композиции таксоидов настоящего изобретения можно использовать в комбинации с другими лекарственными средствами, такими как ингибитор развития кровеносных сосудов(AGM-1470) (Oliver et al., 1994) или метотрексат. Установление того факта, что паклитаксел ингибирует также рестеноз после баллонной ангиопластики, указывает на то, что раствори 7 мые в воде паклитакселы и доцетакселы настоящего изобретения найдут различное применение помимо прямого парентерального введения (WO 9625176). Например, предполагается,что растворимый в воде паклитаксел можно будет использовать в качестве покрытия для имплантированных медицинских средств, таких как трубки, шунты, катетеры, искусственные имплантаты, штифты, электрические имплантаты, такие как кардиостимуляторы, и особенно для артериальных или венозных стентов, включая расширяемые баллоном стенты. Предполагается, что водорастворимый паклитаксел может быть связан с имплантируемым медицинским устройством или растворимый в воде паклитаксел может быть пассивно адсорбирован на поверхности имплантируемого устройства. Например, стенты покрывают конъюгатами полимер-лекарственное средство путем погружения стента в раствор конъюгата полимерлекарственное средство или распылением такого раствора на стент. Подходящие материалы для имплантируемого устройства должны быть биосовместимы и нетоксичны, их можно выбрать из металлов, таких как сплавы никельтитан, сталь, или биосовместимых полимеров,гидрогелей, полиуретанов, полиэтиленов, сополимеров этилен-винилацетат и так далее. В предпочтительном примере осуществления растворимый в воде паклитаксел, особенно конъюгат (PG)-паклитаксел, наносят на стент для введения в артерию или в вену после баллонной ангиопластики. Данное изобретение можно представить в широком аспекте как способ ингибирования артериального рестеноза или артериальной окклюзии после травмы сосудов, предусматривающий введение субъекту, нуждающемуся в этом, композиции, содержащей паклитаксел или доцетаксел, конъюгированный с поли-l-глутаминовой кислотой или поли-lаспарагиновой кислотой. На практике это может быть, например, пациент с коронарным шунтированием, хирургической операцией на сосудах,трансплантированным органом или пластической операцией на коронарных или артериальных сосудах; композицию можно вводить непосредственно внутривенно или даже нанести на стент, и стент имплантировать в случае травмы сосудов. Примером осуществления изобретения,следовательно, является имплантируемое медицинское устройство, которое покрывают композицией, содержащей паклитаксел или доцетаксел, конъюгированный с полиглутаминовой кислотой или полиаспарагиновой кислотой, в количестве, эффективном для ингибирования пролиферации клеток гладких мышц. Предпочтительное устройство представляет собой стент,покрытый композициями настоящего изобретения, причем в некоторых случаях стент приспособлен для использования после баллонной ан 002400 8 гиопластики, а покрытие эффективно для ингибирования рестеноза. В некоторых предпочтительных примерах осуществления изобретение может быть описано как композиция, содержащая полиглутаминовые кислоты, конъюгированные с 2'- или 7 гидроксилом, или тем и другим, паклитаксела,или даже композиция, содержащая полиаспарагиновую кислоту, конъюгированную с 2'- или 7 гидроксилом, или тем и другим, паклитаксела. Используемые здесь термины "полиглутаминовая кислота" или "полиглутаминовые кислоты" включают поли-(l-глутаминовую кислоту), поли-(d-глутаминовую кислоту) и поли-(dlглутаминовую кислоту) и термины "полиаспарагиновая кислота" или "полиаспарагиновые кислоты" включают поли-(l-аспарагиновую кислоту), поли-(d-аспарагиновую кислоту) и поли(dl-аспарагиновую кислоту). Если не указано особо, все используемые здесь технические или научные термины имеют общепринятые значения, которые понятны специалисту в области, к которой относится это изобретение. Хотя на практике или при испытании можно использовать любые способы и материалы, аналогичные или эквивалентные описанным в настоящем изобретении, ниже представлены предпочтительные из них. Фиг. 1 Ахимическая структура паклитаксела, конъюгата PEG-паклитаксел и DTPAпаклитаксел; фиг. 1 В - химическая структура и реакционная схема получения конъюгата PGпаклитаксел; фиг. 2 - влияние паклитаксела, PEGпаклитаксела и DTPA-паклитаксела на пролиферацию клеток меланомы В 16; фиг. 3 - антиопухолевое действие DTPAпаклитаксела на опухоли молочной железы МСа-4; фиг. 4 - среднее время (сутки) для достижения диаметра опухоли 12 мм после обработки паклитакселом, DTPA-паклитакселом и PEGпаклитакселом; фиг. 5 - гамма-сцинтиграммы мышей,имеющих опухоли МСа-4, после внутривенной инъекции 111In-DТРА-паклитаксела и 111InDTPA. Стрелка обозначает опухоль; фиг. 6 - гидролитическое разложение PGпаклитаксела, определяемое в физиологическом растворе с фосфатным буфером (PBS) при рН 7,4 и 37 С; представляет процентное содержание паклитаксела, оставшегося присоединенным к растворимому PG; представляет процентное содержание высвобожденного паклитаксела; представляет процентное содержание продуцированного метаболита-1; фиг. 7 А - антиопухолевое действие PGпаклитаксела на крыс с мышиной опухолью молочной железы (13762F); 9 представляет восприимчивость к одной внутривенной дозе PG (0,3 г/кг); представляет восприимчивость к паклитакселу (40 мг/кг); представляет восприимчивость кPG-паклитакселу (60 мг эквив. паклитаксела/кг); фиг. 7 В - антиопухолевое действие PGпаклитаксела и паклитаксела на мышей, имеющих опухоли ОСа-1; представляет восприимчивость к одной внутривенной дозе PG(0,8 г/кг); представляет восприимчивость к паклитакселу (80 мг/кг); представляет восприимчивость кPG-паклитакселу (160 мг эквив. паклитаксела/кг); фиг. 7 С - антиопухолевое действие PGпаклитаксела на мышей, имеющих карциному МСа-4 молочной железы; представляет восприимчивость к одной внутривенной дозе солевого раствора; представляет восприимчивость к одной внутривенной дозе PG (0,6 г/кг); представляет восприимчивость кPG-паклитакселу (120 мг/кг); фиг. 7D - антиопухолевое действие PGпаклитаксела против саркомы (FSA-II) мягких тканей у мышей; представляет восприимчивость к одной внутривенной дозе солевого раствора; представляет восприимчивость к одной внутривенной дозе PG (0,8 мг/кг); представляет восприимчивость к паклитакселу (80 мг/кг); представляет восприимчивость к конъюгату PG-паклитаксел (160 мг эквив. паклитаксела/кг); фиг. 7 Е - антиопухолевое действие PGпаклитаксела против сингенной гепатокарциномы (НСа-I) у мышей; представляет восприимчивость к одной внутривенной дозе солевого раствора; представляет восприимчивость к одной внутривенной дозе PG (0,8 г/кг); представляет восприимчивость кPG-паклитакселу (160 мг эквив. паклитаксела/кг); фиг. 8 - профиль высвобождения паклитаксела из PEG-паклитаксела в фосфатном буфере (рН 7,4); паклитаксел; 10 фиг. 9 - антиопухолевое действие PGпаклитаксела на опухоли молочной железы МСа-4; представляет восприимчивость к одной внутривенной инъекции солевого раствора PEG (60 мг/кг); представляет восприимчивость к наполнителю кремофор/спирт; представляет одну дозу паклитаксела, 40 мг/кг тела; представляет PEG-паклитаксел при дозе 40 мг эквив. паклитаксела/кг массы тела. Подробное описание изобретения Настоящее изобретение возникает из открытия новых, растворимых в воде готовых препаративных форм паклитаксела и доцетаксела и неожиданной эффективности этих готовых препаративных форм против опухолевых клеток in vivo. Конъюгированный с поли-(lглутаминовой кислотой) паклитаксел (PGпаклитаксел), введенный мышам, имеющим карциному яичников (ОСа-I), вызывал значительное замедление роста опухоли по сравнению с такой же дозой паклитаксела без PG. Мыши, обработанные только паклитакселом или комбинацией свободного паклитаксела иPG, обнаруживали сначала замедленный рост опухоли, но опухоли снова вырастали до величин, сравнимых с необработанной контрольной группой, через десять суток. Кроме того, при максимально толерантной дозе (МТД) конъюгата PG-паклитаксел (160 мг эквив. паклитаксела/кг) рост опухолей полностью подавляли,опухоли сжимались, и мыши, наблюдаемые в течение двух месяцев после обработки, оставались без опухоли (МТД: определяется как максимальная доза, которая вызывает 15% или менее потерю массы тела в течение двух недель после одной внутривенной инъекции). В параллельном исследовании изучали антиопухолевую активность конъюгата PG-паклитаксел у крыс с аденокарциномой молочной железы (13762F) крыс. И снова полную ликвидацию опухоли наблюдали при дозе 40-60 мг эквив. паклитаксела/кг конъюгата PG-паклитаксел. Эти неожиданные результаты показывают, что конъюгат полимер-лекарственное средство, PG-паклитаксел, успешно ликвидирует вполне установленные твердые опухоли как у мышей, так и у крыс, после одной внутривенной инъекции. Кроме того, с периодом полупревращения 40 суток при рН 7,4 PG-паклитаксел представляет собой одно из наиболее стабильных, растворимых в воде известных производных паклитаксела (Deutsch et al., 1989; Mathew et al., 1992; Zhaoand Kingston, 1991). Показано также, что DTPA-паклитаксел эффективен так же, как и паклитаксел, в анализе антиопухолевой активности in vitro с использованием клеточной линии меланомы В 16. DTPAпаклитаксел не проявляет никакого значитель 11 ного отличия в антиопухолевой активности при сравнении с паклитакселом в действии против опухоли молочной железы при дозе 40 мг/кг массы тела в виде одной инъекции. Кроме того,было показано, что меченый 111 индиeм DTPAпаклитаксел аккумулируется в опухоли МСа-4,что показала гамма-сцинтиграфия, демонстрируя,что конъюгированные с хелатообразователем антиопухолевые лекарственные средства настоящего изобретения пригодны и эффективны для получения изображения опухолей. Новые соединения и способы настоящего изобретения обеспечивают значительный прогресс, по сравнению с предшествующими, так как предполагается, что растворимые в воде паклитакселы повышают эффективность антираковой терапии на основе паклитаксела путем получения водорастворимых композиций с регулируемым высвобождением, полученных из паклитаксела. Такие композиции исключают необходимость использования растворителей,которые ассоциируются с побочными действиями, наблюдаемыми для предыдущих композиций паклитаксела. Кроме того, паклитаксел,меченый радиоактивным изотопом, который,как показано, сохраняет антиопухолевую активность, можно также использовать для получения изображения опухолей. Кроме того, настоящее изобретение позволяет определить, будет ли паклитаксел поглощаться конкретной опухолью, посредством сцинтиграфии, однофотонной эмиссионной компьютерной томографии(SPECT) или позитронной эмиссионной томографии (PET). Это определение можно затем использовать для принятия решения об эффективности антиракового лечения. Эта информация может быть полезной при проведении практикующим врачом отбора пациентов, которых нужно подвергать терапии паклитакселом. Паклитаксел можно сделать водорастворимым двумя путями: путем конъюгирования паклитаксела с водорастворимыми полимерами,которые служат в качестве носителей лекарственных средств, и путем превращения антиопухолевого средства в его производные с помощью водорастворимых хелатирующих агентов. Последний подход предоставляет также возможность для мечения радионуклидами (например, 111In, 90Y, 166 Но, 68Ga, 99mТc) для нуклеарного изображения и/или радиотерапии. Структуры паклитаксела, конъюгата полиэтиленгликольпаклитаксел (PEG-паклитаксел), полиглутаминовая кислота-паклитаксел (PG-паклитаксел) и диэтилентриаминпентауксусная кислота-паклитаксел (DTPA-паклитаксел) приводятся на фиг. 1. В некоторых осуществлениях настоящего изобретения DTPA-паклитаксел или другие конъюгаты паклитаксел-хелатирующий агент,такие как, например, ЕDТА-паклитаксел, DТТРпаклитаксел или DОТА-паклитаксел, можно(III) и так далее). Эти соли можно будет использовать в качестве терапевтических средств для лечения опухолей. Во-вторых,DTPAпаклитаксел или другие конъюгаты паклитаксел-хелатирующие агенты можно будет использовать в качестве диагностических средств, которые, когда их метят радионуклидами, такими как 111In или 99mТc, можно использовать в качестве радиоактивных меток для обнаружения некоторых опухолей в сочетании с нуклеарными методиками получения изображения. Понятно, что кроме паклитаксела (таксола) и доцетаксела (таксотера) для использования в композициях и способах настоящего изобретения можно приспособить другие производные таксана и что все такие композиции и способы должны включаться в прилагаемую формулу изобретения. Изучения токсичности, фармакокинетика и распределение в тканях DTPA-паклитаксела показало, что у мышей значение LD50 (50% летальная доза) DTPA-паклитаксела, наблюдаемое с внутривенной (iv) инъекцией одной дозы, составляет около 110 мг/кг массы тела. Прямое сравнение с паклитакселом трудно провести изза ограничений доза-объем, налагаемых ограниченной растворимостью паклитаксела и токсичностью наполнителя, связанными с внутривенным введением. Однако в свете раскрытия настоящего изобретения специалист в области химиотерапии может определить эффективные и максимально переносимые дозы в клинических исследованиях для использования при лечении людей. В некоторых осуществлениях данного изобретения стент с покрытием из конъюгатов "полимер-паклитаксел" можно использовать для профилактики рестеноза, непроходимости артерий после баллонной ангиопластики. Недавние результаты клинических испытаний, использующих расширяемые стенты в пластической операции на коронарных сосудах, показали существенную пользу такого стента в раскрытии просвета сосудов и снижении рестеноза по сравнению со стандартной баллонной ангиопластикой (Serruys et al., 1994). В соответствии с гипотезой восприимчивости к повреждению,образование неоинтима связывается с повышенной пролиферацией клеток. В настоящее время популярное мнение заключается в том,что критическим процессом, приводящим к повреждениям сосудов, как при самопроизвольном, так и ускоренном атеросклерозе, является пролиферация клеток гладких мышц(SMC)(Phillips-Hughes and Kandarpa, 1996). Поскольку фенотипическая пролиферация SMC после артериального повреждения имитирует фенотипическую пролиферацию опухолевых клеток, возможно, что антираковые лекарственные средства можно использовать для профи 13 лактики аккумуляции неоинтимальных SMC. Стенты, покрытые связанными с полимером антипролиферативными средствами, которые способны высвобождать эти средства в течение пролонгированного периода времени с достаточной концентрацией, будут, таким образом,предупреждать прорастание гиперпластичной интимы и среды внутрь просвета, тем самым снижая рестеноз. Поскольку было показано, что паклитаксел подавляет индуцированный коллагеном артрит на модели мыши (Oliver et al., 1994), предполагается, что готовые препаративные формы по настоящему изобретению можно также использовать при лечении аутоиммунных и/или воспалительных болезней, таких как ревматоидный артрит. Паклитаксел, связанный с тубулином,смещает равновесие в сторону стабильных микротрубчатых полимеров и делает это лекарственное средство сильным ингибитором репликации эукариотных клеток путем блокирования клеток в поздней мистической стадии G2. В подавлении артрита паклитакселом могут принимать участие несколько механизмов. Например,фазово-специфическое цитотоксическое действие паклитаксела может воздействовать на быстро пролиферирующие воспалительные клетки,и, кроме того, паклитаксел ингибирует митоз,миграцию, хемотаксис, внутриклеточный перенос клеток и продуцирование H2O2 нейтрофилами. Кроме того, паклитаксел может иметь антиангиогенную активность (активность, направленную против развития кровеносных сосудов), осуществляемую путем блокирования миграции координированных эндотелиальных клеток (Oliver et al, 1994). Следовательно, предполагается, что конъюгированные с полимерами пролекарства настоящего изобретения так же полезны, как свободный паклитаксел, при лечении ревматоидного артрита. Описанная здесь готовая препаративная форма конъюгированного с полимером паклитаксела будет иметь также преимущество, заключающееся в замедленном или длительном высвобождении этого лекарственного средства и более высокой растворимости. Аспект лечения артрита заключается также в том, что готовую препаративную форму можно инъецировать или имплантировать непосредственно в участки пораженных суставов. Фармацевтические композиции паклитаксела или доцетаксела, пригодные для инъекционного использования, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий. Во всех случаях форма должна быть стерильна и должна быть жидкой для инъекции. Она должна быть стабильной в условиях производства и хранения и должна предохраняться от загрязняющего воздействия микроорганизмов, таких как бактерии и грибы. Носителем может быть растворитель или дисперсионная среда, содержащая, 002400 14 например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), пригодные смеси их и растительные масла. Предохранение от действия микроорганизмов можно осуществить при помощи различных антибактериальных и антигрибковых средств, например парабенов,хлорбутанола, фенола, сорбиновой кислоты,тимерозала и тому подобное. Во многих случаях может быть предпочтительно включение изотонических агентов, например сахаров или хлорида натрия. Стерильные инъецируемые растворы получают введением активных соединений в требуемом количестве в подходящий растворитель,когда требуется, с различными другими ингредиентами, перечисленными выше, с последующей стерилизацией фильтрованием. Обычно дисперсии получают введением различных стерилизованных активных ингредиентов в стерильный наполнитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов предпочтительные способы получения представляют методики сушки в вакууме и сушки распылением, которые дают порошок активного ингредиента плюс любого дополнительного требуемого ингредиента из их предварительно фильтрованного для стерилизации раствора. Используемый здесь термин "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и антигрибковые средства и изотонические агенты и тому подобное. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области. В терапевтических композициях предполагается использование любой общепринятой среды или агента, за исключением среды или агента, не совместимого с активным ингредиентом. В композиции можно также ввести дополнительные активные ингредиенты. Термин "фармацевтически приемлемый" относится также к молекулярным частицам и композициям, которые не вызывают аллергическую или похожую неблагоприятную реакцию при введении животному или человеку. Для парентерального введения, например в водном растворе, раствор следует, если необходимо, подходящим образом забуферить и жидкий разбавитель сначала сделать изотоническим при помощи достаточного количества солевого раствора или глюкозы. Эти определенные водные растворы особенно подходят для внутривенного и внутрибрюшинного введения. В связи с этим, стерильные водные среды, которые можно применять, должны быть хорошо из 15 вестны специалисту данной области в свете раскрытия настоящего изобретения. Следующие примеры включаются для иллюстрации предпочтительных примеров осуществления изобретения. Специалистам должно быть понятно, что методики, описанные в примерах, которые следуют далее, представляют описанные автором изобретения методики для нормального функционирования на практике изобретения и, следовательно, могут рассматриваться как предпочтительные методики для его применения на практике. Однако специалистам данной области в свете настоящего описания должно быть понятно, что можно сделать много изменений в конкретных описанных осуществлениях и все же получить такой же или сходный результат без отступления от сущности и объема изобретения. Пример 1. DTPA-Паклитаксел. Синтез конъюгата DТРА-паклитаксел. К раствору паклитаксела (100 мг, 0,117 ммоль) в сухом ДМФ (2,2 мл) добавляли ангидрид диэтилентриаминпентауксусной кислоты(DTPA А) (210 мг, 0,585 ммоль) при 0 С. Реакционную смесь перемешивали при 4 С в течение ночи. Суспензию фильтровали (фильтр Millipore 0,2 мкм) для удаления непрореагировавшего ангидрида DTPA. Фильтрат выливали в дистиллированную воду, перемешивали при 4 С в течение 20 мин и собирали осадок. Сырой продукт очищали препаративной ТСХ на пластинках с C18-силикагель и проявляли в смеси ацетонитрил/вода (1:1). Паклитаксел имел величину Rf 0,34. Полосу, выше полосы паклитаксела, с величиной Rf от 0,65 до 0,75 удаляли соскабливанием и элюировали смесью ацетонитрил/вода (1:1), и удаляли растворитель, получая 15 мг DTPA-паклитаксела в качестве продукта(выход 10,4%): т.пл. 226 С (разложение). УФспектр (натриевая соль в воде) имел максимальное поглощение у 228 нм, которое характеристично также для паклитаксела. Масс-спектр:(М+К). В 1H ЯМР-спектре (DMSO-d6) резонанс групп NCH2 СН 2N и СН 2 СООН у DTPA появлялся в виде сложного ряда сигналов у 2,712,96 м.д. и в виде мультиплета у 3,42 м.д., соответственно. Резонанс С 7-Н у 4,10 м.д. в паклитакселе смещается к 5,51 м.д., что позволяет предполагать этерификацию в 7 положении. Остальная часть спектра была в согласии со структурой паклитаксела. Натриевую соль DTPA-паклитаксела также получают добавлением раствораDTPAпаклитаксела в этаноле в эквивалентное количество 0,05 М NаНСО 3 с последующей лиофилизацией. Соль получают в виде растворимого в воде твердого порошка (растворимость 20 мг эквивалентного паклитаксела/мл). Гидролитическая стабильность конъюгата 16 Гидролитическую стабильность DTPAпаклитаксела изучали в ускоренных условиях. Говоря кратко, 1 мг DTPA-паклитаксела растворяли в 1 мл 0,5 М водного раствора NaHCO3 (pH 9,3) и анализировали ВЭЖХ. Система для ВЭЖХ состояла из колонки Nova-Pak 1503,9(ацетонитрил/метанол/0,02 М ацетат аммония = 4:1:5) пропускали со скоростью 1,0 мл/мин с УФ-детектированием у 228 нм. Время удерживания DTPA-паклитаксела и паклитаксела было 1,38 и 8,83 мин, соответственно. Площади пиков определяли количественно и сравнивали со стандартными кривыми для определения концентраций DTPA-паклитаксела и паклитаксела. Оцененный период полупревращения в 0,5 М растворе NаНСО 3 составляет около 16 дней при комнатной температуре. Влияние DTPA-паклитаксела на рост клеток меланомы мышей. В 16 in vitro. Клетки засевали в планшетах на 24 лунки при концентрации 2,5104 клеток/мл и выращивали в смеси 50:50 минимальной поддерживающей среды (DEM), модифицированной Дульбекко, и среды F12, содержащей 10% телячьей сыворотки, при 37 С в течение 24 ч в имеющей влажность 97% атмосфере с 5,5%CO2. Среду затем заменяли свежей средой, содержащей паклитаксел или DTPA-паклитаксел в диапазоне концентраций от 510-9M до 7510-9M. Через 40 ч клетки высвобождали обработкой трипсином и подсчитывали в счетчикеCoulter. Конечные концентрации ДМСО (использовали для растворения паклитаксела) и 0,05 М раствора бикарбоната натрия (использовали для растворения DTPA-паклитаксела) в клеточной среде были меньше, чем 0,01%. Это количество растворителя не оказывало какоелибо влияние на рост клеток, как определено контрольными исследованиями. Влияние DTPA-паклитаксела на рост клеток меланомы В 16 представлено на фиг. 2. После 40 ч инкубации с различными концентрациями DTPA-паклитаксел и паклитаксел сравнивали в отношении цитотоксичности. IС 50 для паклитаксела и DТРА-паклитаксела составляют 15 и 7,5 нМ соответственно. Антиопухолевое действие на модель карциномы молочной железы (МСа-4). Самок мышей C3Hf/Kam инокулировали карциномой молочной железы (МСа-4) в мышцы правого бедра (5105 клеток/мышь). Когда опухоли вырастали до 8 мм (приблизительно через 2 недели), давали одну дозу паклитаксела или DTPA-паклитаксела с 10, 20 и 40 мг эквивалентного паклитаксела/кг массы тела. В контрольных исследованиях использовали солевой 17 раствор и смесь абсолютный спирт/кремофор,50/50, разбавленную солевым раствором (1:4). Рост опухоли определяли ежедневно путем измерения трех ортогональных диаметров опухоли. Когда размер опухоли достигал 12 мм в диаметре, вычисляли задержку роста опухоли. Мышей умерщвляли, когда размер опухолей был приблизительно 15 мм. Кривая роста опухоли приводится на фиг. 3. По сравнению с контрольными экспериментами как паклитаксел, так и DTPA-паклитаксел,проявляли антиопухолевое действие при дозе 40 мг/кг. Эти данные анализировали также для определения среднего числа дней, необходимых для того, чтобы опухоль достигла в диаметре 12 мм. Статистический анализ показал, что DTPAпаклитаксел значительно задерживал рост опухоли по сравнению с контролем, где обрабатывали солевым раствором при дозах 40 мг/кг (р 0,01). Среднее время для достижения диаметра опухоли 12 мм было 12,1 дня для DTPAпаклитаксел по сравнению с 9,4 дня для паклитаксела (фиг. 4). Радиомечение конъюгата DТРА-паклитаксел 111In. В V-склянку на 2 мл добавляли последовательно 40 мкл применяемого в качестве буфера 0,6 М ацетата натрия (рН 5,3), 40 мкл как буфера 0,06 М цитрата натрия (рН 5,5), 20 мкл раствораDTPA-паклитаксела в этаноле (2% мас./об.) и 20 мкл раствора 111InCl3 (1,0 мКи) в буфере ацетат натрия (рН 5,5). После периода инкубации 30 мин при комнатной температуре меченый 111In конъюгат DTPA-паклитаксела очищали пропусканием смеси через картридж С 18 Sep-Pac с использованием солевого раствора и затем этанола в качестве подвижной фазы. Свободный 111InDTPA (3%) удаляли солевым раствором, тогда как 111In-DТРА-паклитаксел собирали в промывке этанолом. Этанол выпаривали в атмосфере газообразного азота и меченый продукт пересоздавали в солевом растворе. Выход радиоактивного химического продукта: 84%. Анализ 111In-DТРА-паклитаксела. Для анализа реакционной смеси и чистоты конъюгата 111In-DTPA-паклитаксел использовали ВЭЖХ. Система состояла из бинарного насоса LDC, колонки Waters 1008,0 мм (внутренний диаметр), заполненной силикагелем ODS 5 мкм. Колонку элюировали при скорости потока 1 мл/мин градиентной смесью воды и метанола(градиент от 0 до 85% метанола в течение 15 мин). Градиентную систему контролировали детектором с кристаллом NaI и УФ/Виддетектором Spectra-Physics. Как доказано анализом ВЭЖХ, очистка картриджем Sep-Pak удалила часть 111In-DTPA, который имел время удерживания 2,7 мин. 111In-DTPA, вероятно, было образован из следов загрязняющего DTPA в конъюгате DTPA-паклитаксел. Радиохроматограмма 111In-DTPA-пaклитaкceлa коррелировала с его УФ-хроматограммой, указывая, что пик у 18 12,3 мин действительно был целевым соединением. В тех же самых хроматографических условиях паклитаксел имел время удерживания 17,1 мин. Радиохимическая чистота конечного препарата была 90%, как определено анализом ВЭЖХ. Сцинтиграфия всего тела. Самок мышей C3Hf/Kam инокулировали карциномой молочной железы в мышцы правого бедра (5105 клеток). Когда опухоли вырастали до 12 мм в диаметре, мышей делили на две группы. В группе I мышей анестезировали внутрибрюшинной инъекцией пентабарбитала натрия, затем вводили 111In-DТРА-паклитаксел(100-200 мКи) через хвостовую вену. Над мышами (3 на группу) помещали -камеру, снабженную коллиматором средней энергии. Ряд 5 минутных данных собирали через 5, 30, 60, 120,240 мин и 24 ч после инъекции. В группе II применяли те же самые методики за исключением того, что мышей инъецировали 111In-DTPA в качестве контроля. На фиг. 5 приводятся гамма-сцинтиграфии животных, инъецированных 111In-DTPA и 111In-DТРА-паклитаксел. 111InDTPA характеризовался быстрым удалением из плазмы, быстрой и высокой экскрецией в моче с минимальным удерживанием в почках и незначительным удерживанием в опухоли, печени,кишечнике и других органах или частях тела. В противоположность этому, 111In-DTPA-паклитаксел проявлял фармакологический профиль,сходный с профилем паклитаксела (Eiseman etal., 1994). Радиоактивность головного мозга была незначительной. Печень и почки имели самые высокие отношения ткань:плазма. Гепатобилиарная экскреция радиомеченого DTPAпаклитаксел или его метаболитов была одним из главных путей освобождения крови от этого лекарственного средства. В отличие от паклитаксела значительное количество 111In-DТРАпаклитаксела экскретировалось также через почки, которые играли только небольшую роль в освобождении от паклитаксела. Опухоль существенно поглощала 111In-DТРА-паклитаксел. Эти результаты показывают, что 111In-DТРАпаклитаксел способен обнаруживать некоторые опухоли и количественно определять поглощение 111In-DТРА-паклитаксела в опухолях, что, в свою очередь, может помочь в выборе пациентов для лечения паклитакселом. Пример 2. Полиглутаминовая кислотапаклитаксел. Настоящий пример демонстрирует конъюгирование паклитаксела с растворимым в воде полимером, поли-(l-глутаминовой кислотой)(PG). Потенциал растворимых в воде полимеров, используемых в качестве носителей лекарственных средств, хорошо определен (Kopecek,1990; Maeda and Matsumura, 1989). Помимо его способности придавать растворимость в противном случае нерастворимым лекарственным 19 средствам, конъюгат лекарственное средствополимер действует также в качестве депо медленного высвобождения для регулируемого высвобождения лекарственного средства. Синтез PG-паклитаксела.PG выбрали в качестве носителя для паклитаксела, поскольку он может легко разрушаться лизосомными ферментами, стабилен в плазме и содержит достаточно функциональных групп для присоединения лекарственного средства. С PG было конъюгировано несколько антиопухолевых лекарственных средств, включая адриамицин (Van Heeswijk et al., 1985; Hoes etAra-C (Kato et al., 1984). Натриевую соль PG (MW 34 К, Sigma, 0,35 г) растворяли в воде. рН водного раствора устанавливали до 2 с использованием 0,2 М НСl. Осадок собирали, диализовали против дистиллированной воды и лиофилизовали, получая 0,29 г PG. К раствору PG (75 мг, повторяемое звено(0,073 ммоль) и следовое количество диметиламинопиридина (DMAP). Реакции давали проходить при комнатной температуре в течение 4 ч. Тонкослойная хроматография (ТСХ, диоксид кремния) показала полное превращение паклитаксела (Rf=0,55) в конъюгате с полимером (Rf=0,подвижная фаза СНСl3/-МеОН=10:1). Реакционную смесь выливали в хлороформ. Получаемый осадок собирали и сушили в вакууме, получая 65 мг конъюгата полимер-лекарственное средство. Путем изменения массового отношения паклитаксела к PG в исходных материалах можно синтезировать полимерные конъюгаты с различными концентрациями паклитаксела. Натриевую соль конъюгатаPGпаклитаксел получали растворением продукта в 0,5 М NаНСО 3. Водный раствор PG-паклитаксела диализовали против дистиллированной воды (MWCO 1000) для удаления загрязняющих примесей с низкой молекулярной массой и избытка соли МаНСО 3. Лиофилизация диализата давала 88,6 мг белого порошка. Содержание паклитаксела в этом полимерном конъюгате определяли УФ (описана ниже) как 21%(мас./мас.). Выход (превращение в связанный с полимером паклитаксел, УФ): 93%. PGпаклитаксел с более высоким содержанием паклитаксела (вплоть до 35%) можно синтезировать этим способом простым повышением используемого отношения паклитаксела к PG. 1(ОСОСН 3) и 1.18-1.20 м.д. (С-СН 3) относят к алифатическим компонентам паклитаксела. Другие резонансные сигналы паклитаксела были скрыты резонансными сигналами PG. Резонансные сигналы PG у 4.27 м.д. (Н-), 2.21 м.д.(Н-) и 2.04 м.д. (Н-) находятся в соответствии со спектром чистого PG. Связи конъюгированного с полимером паклитаксела слишком плохо разрешаются, чтобы измеряться с достаточной точностью. Растворимость в воде была 20 мг паклитаксела/мл. Характеристика PG-паклитаксела. Ультрафиолетовый спектр (УФ) получали на спектрометре Beckman DU-640 (Fullerton,CA). Содержание паклитаксела, конъюгированного с PG, устанавливали УФ на основе стандартной кривой, полученной с известными концентрациями паклитаксела в метаноле ( = 228 нм), при предположении, что конъюгат полимера в воде и свободное лекарственное средство в метаноле имеют те же самые коэффициенты молярной экстинкции и что оба подчиняются закону Lambert Beer. Как показал его УФспектр, PG-паклитаксел имеет характеристическое поглощение паклитаксела со сдвигамиот 228 до 230 нм. Концентрацию паклитаксела вPG-паклитакселе оценивали на основе стандартной кривой, полученной с известными концентрациями паклитаксела в метаноле при поглощении 228 нм, при предположении, что конъюгат полимера в воде при 230 нм и свободное лекарственное средство в метаноле при 228 нм имеют те же самые коэффициенты молярной экстинкции и что оба подчиняются закону Lambert Beer. Изучение PG-паклитаксела гельпроникающей хроматографией. Относительную молекулярную массу PGпаклитаксела характеризовали гельпроникающей хроматографией (ГПХ). Система для ГПХ состояла из двух насосов III модели LDC, соединенных с моделью градиента LDC, колонки для ГПХ с гелем PL и фотоиодидного детектораWaters 990. Элюент (ДМФ) пропускали со скоростью 1,0 мл/мин с УФ-детектированием при 270 нм. Конъюгирование паклитаксела с PG приводило к повышению в молекулярной массеPG-паклитаксел, на что указывает смещение времени удерживания от 6,4 мин PG до 5,0 мин конъюгата PG-паклитаксела при анализе ГПХ. Вычисленная молекулярная массаPGпаклитаксела, содержащего 15-25% паклитаксела (мас./мас.) находится в диапазоне 45-55 кДа. Сырой продукт содержал загрязняющую примесь с низкой молекулярной массой (время удерживания от 8,0 до 10,0 и 11,3 мин), которую можно эффективно удалить превращением PGпаклитаксела в его натриевую соль с последующим диализом.PG-паклитаксел растворяли в забуференных фосфатом растворах (PBS, 0,01M) при рН 6,0, рН 7,4 и рН 9,6 при концентрации эквивалентного паклитаксела 0,4 мМ. Раствор инкубировали при 37 С с легким встряхиванием. При выбранных интервалах времени отбирали аликвоты (100 мкл), смешивали с равным объемом метанола и анализировали высокоэффективной жидкостной хроматографией (ВЭЖХ). Система ВЭЖХ состояла из колонки с диоксидом кремния с обращенной фазой (Nova-Рас, Waters, CA),подвижной фазы метанол-вода (2:1, об./об.),подаваемой со скоростью потока 1,0 мл/мин, и фотоиодидного детектора. Концентрацию связанного с PG паклитаксела, свободного паклитаксела и других продуктов разрушения в каждом образце вычисляли путем сравнения площадей пиков с отдельно полученной стандартной кривой для паклитаксела, при предположении, что коэффициент молярной экстинкции каждого пика при 228 нм тот же, что и коэффициент экстинкции паклитаксела. Период полуразложения конъюгата, составляющий 132, 40 и 4 дня при рН 6,0, 7,4 и 9,6 соответственно, определяли линейным регрессионным анализом методом наименьших квадратов. Анализ ВЭЖХ показал, что инкубация PG-паклитаксела в PBSрастворах продуцировала паклитаксел и несколько других соединений, включая соединение, которое более гидрофобно, чем паклитаксел (метаболит-1). На самом деле, количество метаболита-1, который, как очень вероятно, был 7-эпипаклитакселом, выделенного в PBS при рН 7,4, превышало количество паклитаксела после 100 часов инкубации (фиг. 6). Исследования in vitro. Аликвоты, полученные из РВS-раствора при рН 7,4, подвергали анализу по методу полимеризации тубулина. Реакцию сборки тубулина проводили при 32 С в РЕМ-буфере (рН 6,9) при концентрации тубулина (бычий головной мозг, Cytoskeleton Inc., Boulder, СО) 1 мг/мл(10 мкМ) в присутствии испытываемых образцов (1,0 мкМ эквив. паклитаксела) и 1,0 мМ ГТФ. За полимеризацией тубулина следовало измерение поглощения раствора при 340 нм на протяжении времени. Через 15 мин для измерения СаСl2-индуцированной деполимеризации микротрубочек добавляли хлорид кальция (125 мМ) . Хотя PG-паклитаксел, свежерастворенный в PBS, был неактивен в продуцировании микротрубочек, аликвоты PG-паклитаксела, инкубированные в течение трех дней, приводили к полимеризации тубулина. Образованные микротрубочки были стабильны против СаСl2 индуцированной деполимеризации. Влияние PG-паклитаксела на рост клеток исследовали также путем анализа с солью тетразолия (МТТ) (Mosmann, 1983). Клетки MCF-7 или клетки 13762F засевали при концентрации 2 22104 клеток/мл в микротитрационном планшете на 96 лунок, обрабатывали через 24 ч различными концентрациями PG-паклитаксела, паклитаксела или PG и инкубировали в течение дополнительных 72 ч. Затем к каждой лунке добавляли раствор МТТ (20 мкл, 5 мг/мл) и инкубировали в течение 4 ч. Супернатант отсасывали, и формазан МТТ, образованный метаболически жизнеспособными клетками, измеряли флуоресцентным ридером для прочтения микропланшетов при длине волны 590 нм. На протяжении периода трех дней PG-паклитаксел ингибировал пролиферацию опухолевых клеток до степени, схожей со степенью свободного паклитаксела. Для клеточной линии опухоли молочной железы человека MCF-7 получающиеся в результате величины IC50 были 0,59 мкМ для паклитаксела и 0,82 мкМ для PGпаклитаксела (измерено в эквивалентных единицах паклитаксела). По отношению к клеточной линии 13762F чувствительность для PGпаклитаксела (IС 50 = 1,86 мкМ) сравнима с чувствительностью паклитаксела (IC50 = 6,79 мкМ). Для обоих клеточных линий IC50 только одногоPG была выше, чем 100 мкМ. Антиопухолевая активность in vivo. Всю работу с животными проводили при благоприятных для животных условиях в Раковом центре M.D.Anderson в соответствии с установленными руководствами. Мышей С 3 Н/Каm разводили и выдерживали в отсутствие патогенов в благоприятных условиях в Departament of Experimental Radiation Oncology. Одиночные опухоли были продуцированы в мышце правого бедра самки мыши С 3 Н/Каm(25-30 г) посредством инъекции 5105 клеток мышиной карциномы яичников (Оса-1), карциномы молочной железы (МСа-4), гепатокарциномы (НСа-I) или волокнистой саркомы (FSaII). В параллельном исследовании самкам крысFischer 344 (125-150 г) инъекцией вводили 1,0105 жизнеспособных опухолевых клеток 13762F в 0,1 мл PBS. Обработки начинали, когда опухоли у мышей вырастали до 500 мм 3 (10 мм в диаметре), или когда опухоли у крыс вырастали до 2400 мм 3 (средний диаметр 17 мм). Одну дозу PG-паклитаксела в солевом растворе или паклитаксела в наполнителе кремофоре давали в количествах, варьируемых от 40 до 160 мг эквив. паклитаксела/кг массы тела. В контрольных экспериментах использовали солевой раствор,наполнитель кремофор [смесь кремофор/этанол,50/50, разбавленная солевым раствором (1:4)],раствор PG (MW 38K) в солевом растворе и смесь паклитаксел/PG. Рост опухоли определяли ежедневно (фиг. 7 А, 7 В, 7 С, 7D и 7 Е) измерением трех ортогональных диаметров. Объем опухоли вычисляли по формуле (АхВхС)/2. Абсолютная задержка роста (ADG) у мышей определяется как время в днях для опухолей, обработанных различными лекарственными средст 23 вами, необходимое для роста от 500 до 2000 мм 3 в мышах минус время в днях для опухолей, обработанных солевым контролем, необходимое для роста от 500 до 2000 мм 3. В табл. 1 суммирована острая токсичность PG-паклитаксела у 24 крыс по сравнению с системой паклитаксел/кремофор. В табл. 2 суммированы данные,относящиеся к действию PG-паклитаксела против опухолей МСа-4, FSa-II и НСа-I у мышей. Эти данные суммированы также на фиг. 7 А-7 Е. Таблица 1PGc 0,3 г/кг 0/2 4,3 2 Наполнитель кремофорd 2,0 мл 0/2 6,9 1 Лекарственные средства вводили внутривенно имеющим опухоль 13762F 130 г) в виде одной инъекции. а Раствор PG-паклитаксела получали растворением конъюгата в солевом растворе (8 мг эквив.паклитаксела/мл). Объем инъекции при дозе 60 мг/кг составлял 0,975 мл на крысу.b Раствор паклитаксел-кремофор получали растворением паклитаксела в смеси 1:1 этилового спирта и кремофора (30 мг/мл). Этот исходный раствор далее разбавляли солевым раствором (1:4) перед инъекцией. Конечная концентрация паклитаксела в растворе была 6 мг/мл. Инъецируемый объем при дозе 60 мг/кг составил 1,3 мл на крысу. с Раствор PG получали растворением полимера в солевом растворе (22 мг/мл). Инъецируемая доза составила 0,3 г/кг (1,8 мл на крысу), которая была эквивалентна дозе паклитаксела 60 мг/кг.d Наполнитель кремофор получали разбавлением смеси этилового спирта и кремофора (1:1) солевым раствором (1:4). Таблица 2 Антиопухолевое действие PG-паклитаксела против различных типов мышиных опухолей in vivo Время до ростаb Опухоль Лекарственное cpeдcтвoa Мышей, имеющих опухоли 500 мм 3 в левом бедре, обрабатывали различными дозами PGпаклитаксела (40-120 мг эквив. паклитаксела/кг) в солевом растворе или паклитаксела в наполнителе кремофоре внутривенно в виде одной инъекции. Контрольных животных обрабатывали солевым раствором (0,6 мл), наполнителем кремофором (0,5 мл), раствором PG в солевом растворе или PG (г/кг) плюс паклитаксел (80 мг/кг).b Рост опухоли определяли ежедневным измерением трех ортогональных диаметров циркулями и объем вычисляли как (axbxc)/2. В скобках указывается число мышей, используемых в каждой группе. Время в днях для роста от 500 до 2000 мм 3 представляет среднее значениестандартное отклонение. с Абсолютная задержка роста (AGD), определенная как время в днях для опухолей, обработанных различными лекарственными средствами, необходимое для роста от 500 до 2000 мм 3, минус время в днях для опухолей, обработанных солевым контролем, необходимое для роста от 500 до 2000 мм 3.d Время в днях для роста от 500 до 2000 мм 3 сравнивали для групп обработки и группы солевого раствора с использованием t-критерия Стьюдента. р-величины получали по двухстороннему критерию,считается, что они значимые, когда ниже чем 0,05 или равны 0,05. Пример 3. Полиэтиленгликоль-паклитаксел. Синтез конъюгата полиэтиленгликольпаклитаксел (PEG-паклитаксел). Синтез выполняли в две стадии. Сначала 2'-сукцинилпаклитаксел получали по описанной методике (Deutsch et al, 1989). Паклитакселу(288 мг, 2,22 ммоль) давали реагировать в безводном пиридине (6 мл) при комнатной температуре в течение 3 ч. Пиридин затем выпаривали и остаток обрабатывали водой, перемешивали в течение 20 мин и фильтровали. Осадок растворяли в ацетоне, медленно добавляли воду и собирали чистые кристаллы, получая 180 мг 2'сукцинилпаклитаксела. PEG-паклитаксел синтезировали реакцией сочетания, медиированной(180 мг, 0,72 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Сырой продукт хроматографировали на силикагеле с элюированием этилацетатом, затем смесью хлороформ-метанол (10:1). Это давало 350 мг продукта. 1H ЯМР (СDСl3)2.76 (м, янтарная кислота, СОСН 2 СН 2 СО 2),3.63 (PEG,OCH2CH2O),4.42 (С 7-Н) и 5.51 (С 2'-Н). Максимальное УФ-поглощение было у 288 нм,которое характеристично для паклитаксела. Присоединение к PEG в значительной степени повышает водную растворимость паклитакселаPEG-паклитаксел растворяли в фосфатном буфере (0,01 М) при различных значениях рН и концентрации 0,4 мМ и растворы инкубировали при 37 С с легким встряхиванием. Через выбранные интервалы времени отбирали аликвоты(200 мкл) и лиофилизовали. Получаемые сухие порошки снова растворяли в метиленхлориде для гельпроникающей хроматографии (анализ ГПХ). Система для ГПХ состояла из колонки со смешанным слоем геля PL Perkin-Elmer, изократного насоса LC Perkin-Elmer, интерфейса серии 900 РЕ Nelson, УФ/Вид-детектора SpectraPhysics и блок данных. Элюент (метиленхлорид) пропускали со скоростью 1,0 мл/мин с УФдетектором, установленным у 228 нм. Время удерживания PEG-паклитаксела и паклитаксела было 6,1 и 8,2 мин, соответственно. Количественно определяли площади пиков и вычисляли процентное содержание оставшегося PEGпаклитаксела и процентное содержание высвобожденного паклитаксела. Период полураспадаPEG-паклитаксела, определенный линейным анализом методом наименьших квадратов при рН 7,4, был 54 мин. Период полураспада при рН 9,0 был 7,6 мин. Профили высвобождения паклитаксела из PEG-паклитаксела при рН 7,4 приводятся на фиг. 8. Изучение цитотоксичностиPEGпаклитаксела с использованием клеток мышиной меланомы В 16 in vitro. По методике, описанной при изучении цитотоксичности DTPA-паклитаксела, клетки меланомы засевали в планшетах на 24 лунки при концентрации 2,5104 клеток/мл и выращивали в смеси 50:50 минимальной поддерживающей среды, модифицированной Дульбекко (DME), и среды F12, содержащей 10% сыворотки телят,при 37 С в течение 24 ч в атмосфере с влажностью 97%, содержащей 5,5% СО 2. Эту среду затем заменяли свежей средой, содержащей паклитаксел или его производные с концентрациями, составляющими от 510-9 до 7510-9 М. Через 40 ч клетки высвобождали обработкой трипсином и подсчитывали в счетном устройстве Coulter. Конечные концентрации DMSO (использовали для растворения паклитаксела) и 0,05 М раствора бикарбоната натрия (использовали для растворения PEG-паклитаксела) в среде клеток были ниже, чем 0,01%. Это количество растворителя не оказывает какого-либо влияния на рост клеток, как определено контрольными экспериментами. Кроме того, PEG в диапазоне концентраций, используемых для генерирования эквивалентной концентрации пакли 27 таксела от 5l0-9 М до 7510-9 М, также не влияет на пролиферацию клеток. Антиопухолевое действие PEG-паклитаксела на опухоли МСа-4 у мышей. Для оценки антиопухолевой активностиPEG-паклитаксела против твердых опухолей молочной железы клетки МСа-4 (5105 клеток) инъецировали в мышцу правого бедра самки мыши C3Hf/Kam. Как написано в примере 1 сPEG-паклитакселом, когда опухоли вырастали до 8 мм (приблизительно 2 недели), давали одну дозу паклитаксела или PEG-паклитаксела с 10,20 и 40 мг эквивалентного паклитаксела/кг массы тела. Паклитаксел сначала растворяли в абсолютном этаноле с равным объемом кремофора. Этот исходный раствор далее разбавляли(1:4 по объему) стерильным физиологическим раствором в пределах 15 мин до инъекции. PEGпаклитаксел растворяли в солевом растворе (6 мг эквив. паклитаксела/мл) и фильтровали через стерильный фильтр (Millipore, 4,5 мкм). В контрольных экспериментах использовали солевой раствор, наполнитель паклитаксела, смесь абсолютный спирт:кремофор (1:1), разбавленную солевым раствором (1:4), и раствор PEG в солевом растворе (600 мг/кг массы тела). Рост опухоли определяли ежедневно путем измерения трех ортогональных диаметров опухоли. Когда размер опухоли достигал 12 мм в диаметре, вычисляли задержку роста опухоли. Кривая роста опухоли приводится на фиг. 9. При дозе 40 мг/кг, как PEG-паклитаксел, так и паклитаксел, эффективно задерживали рост опухоли. Паклитаксел был более эффективным,чем PEG-паклитаксел, хотя разница не была статистически значимой. Обработанным паклитакселом опухолям требовалось 9,4 дня для достижения 12 мм в диаметре, тогда как обработанным PEG-паклитакселом опухолям требовалось 8,5 дней. Статистически эти величины были значимыми (р 0,05) по сравнению с их соответствующими контрольными величинами,которые были 6,7 дней для наполнителя паклитаксела и 6,5 дней для солевого раствора PEG(фиг. 4). Несмотря на то, что заявленные композиции и способы представлены в описании, исходя из предпочтительных примеров осуществления изобретения, для специалистов данной области должны быть очевидны возможные изменения в композициях и способах без отступления от идеи, сущности и объема изобретения. Должно быть очевидно, что описанные здесь агенты можно заменить на некоторые другие им родственные как по химической, так и по физиологической природе, и получить при этом те же самые или аналогичные результаты. Все эти подобные замены и изменения, очевидные для специалистов данной области, находятся в пределах объема изобретения, определенного следующей формулой изобретения.taxols. 6. Preparation of water-soluble taxol phosphates," J. Nat. Prod, 54:1607-1611,1991. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция, включающая противоопухолевое лекарственное средство, конъюгированное с водорастворимым полимером или сополимером, причем указанный водорастворимый полимер или сополимер выбирают из группы, включающей поли-(d-глутаминовую кислоту), поли-(l-глутаминовую кислоту), поли-(dlглутаминовую кислоту), поли-(d-аспарагиновую 30 кислоту), поли-(l-аспарагиновую кислоту) и поли-(dl-аспарагиновую кислоту) и их сополимеры, где используемое противоопухолевое лекарственное средство представляет собой паклитаксел, доцетаксел, этопзид, тенипозид, камптотецин или эпотилон. 2. Композиция по п.1, где противоопухолевое лекарственное средство выбирают из паклитаксела, доцетаксела и камптотецина. 3. Композиция по п.2, где сополимер дополнительно определяют как сополимер с поликапролактоном, полигликолевой кислотой и полимолочной кислотой. 4. Композиция по любому из предшествующих пунктов, где полимер/сополимер имеет молекулярный вес от 5000 до около 100000,предпочтительно от 20000 до 80000. 5. Композиция по любому из предшествующих пунктов, где водорастворимый полимер/сополимер конъюгирован с 2'- или 7 гидроксилом паклитаксела или доцетаксела. 6. Композиция по любому из предшествующих пунктов, включающая от 2 до 35 вес.% противоопухолевого лекарственного средства. 7. Композиция по п.1, где паклитаксел конъюгирован с полиглутаминовой кислотой. 8. Применение композиции по любому из пп.1-7 для лечения рака, для уменьшения, по меньшей мере, одного симптома системной аутоиммунной болезни или для ингибирования артериального рестеноза или артериальной окклюзии после сосудистой травмы. 9. Применение по п.8, где рак представляет собой рак молочной железы, яичников, злокачественную меланому, рак легких, желудка, простаты, ободочной кишки, головы и шеи, лейкемию или саркому Капоши. 10. Имплантируемое медицинское устройство, в частности стент, с покрытием в виде композиции, включающей паклитаксел, конъюгированный с водорастворимыми полиаминокислотами, в количестве, эффективном для ингибирования пролиферации клеток гладких мышц.
МПК / Метки
МПК: A61M 36/00, A61K 35/00, A61P 35/00, A01N 43/02, C07D 305/00
Метки: водорастворимые, действия, противоракового, пролекарства
Код ссылки
<a href="https://eas.patents.su/18-2400-vodorastvorimye-prolekarstva-protivorakovogo-dejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">Водорастворимые пролекарства противоракового действия</a>
Предыдущий патент: Способ удаления конденсирующихся компонентов из потока природного газа, система завершения скважины
Следующий патент: N-связанные мочевины и карбаматы сложных гетероциклических тиоэфиров
Случайный патент: Растворимый рецептор br43x2 и способы его применения