Ген-доставочный комплекс для чрескожной доставки чужеродного генетического материала в антиген-презентирующие клетки и способы его использования
Формула / Реферат
1. Ген-доставочный комплекс для чрескожной доставки чужеродного генетического материала в антиген-презентирующие клетки (АПК), содержащий чужеродный генетический материал и носитель невирусной природы, причем носитель имеет специфическую аффинность по отношению к чужеродному генетическому материалу и рецептору, локализованному на антиген-презентирующей клетке.
2. Ген-доставочный комплекс по п.1, где чужеродный генетический материал представлен молекулой ДНК, кодирующей зависимый от обратной транскриптазы вирус или мутантный зависимый от обратной транскриптазы вирус.
3. Ген-доставочный комплекс по п.2, где чужеродный генетический материал представлен молекулой ДНК, кодирующей, по крайней мере, один белок дефектного по репликации и/или дефектного по сборке вируса иммунодефицита человека.
4. Ген-доставочный комплекс по п.3, где чужеродный генетический материал представлен молекулой ДНК, кодирующей, по крайней мере, один белок негативного по интегразе мутанта дитропного первичного изолята вируса иммунодефицита человека.
5. Ген-доставочный комплекс по п.4, где ДНК включает один или несколько стоп-кодонов в одной или нескольких рамках считывания гена интегразы.
6. Ген-доставочный комплекс по п.1, выбранный из группы, включающей конъюгаты ДНК с сахарами, такими как глюкоза, полиэтиленимином, производными полиэтиленимина, такими как модифицированный сахаром полиэтиленимин, и их смесями.
7. Ген-доставочный комплекс по п.1, где антиген-презентирующей клеткой является клетка Лангерганса или дендритная клетка.
8. Ген-доставочный комплекс по п.1, где рецептором, локализованным на АПК, является рецептор маннозы.
9. Способ трансдукции клеток чужеродным генетическим материалом, отличающийся тем, что чужеродный генетический материал включен в ген-доставочный комплекс по любому из пп.1-8.
10. Способ получения чужеродного генного продукта in vitro, отличающийся тем, что включает
(а) трансдукцию антиген-презентирующей клетки-мишени в соответствии со способом по п.9 и
(б) культивирование указанной трансдуцированной антиген-презентирующей клетки-мишени в условиях, обеспечивающих экспрессию целевого чужеродного генного продукта.
11. Способ профилактической и терапевтической иммунизации животного путем введения животному ген-доставочного комплекса по любому из пп.1-8.
12. Способ профилактической и терапевтической иммунизации животного против инфекции, вызванной ретровирусом, отличающийся тем, что включает следующие стадии:
выделение дендритных клеток из организма животного;
обеспечение взаимодействия указанных клеток с ген-доставочным комплексом по любому из пп.1-8 и
повторное введение этих клеток в организм животного.
13. Способ профилактической и терапевтической иммунизации животного против инфекции, вызванной ретровирусом, путем введения животному ген-доставочного комплекса по любому из пп.1-8 через кожу или слизистые оболочки.
14. Способ лечения пациента с активной вирусной инфекцией, такой как, например, ВИЧ-инфекция, отличающийся тем, что включает следующие стадии:
введение пациенту, нуждающемуся в таком лечении, определенного сочетания лекарственных средств, подходящих для снижения вирусного титра;
иммунизацию пациента ген-доставочным комплексом по любому из пп.1-8 и
продолжение лечения с использованием определенного сочетания лекарственных средств, подходящих для снижения вирусного титра, до развития иммунного ответа и мониторинг вирусного титра у данного пациента и, в случае восстановления вирусного титра, возобновление лечения указанным сочетанием лекарственных средств или другим сочетанием лекарственных средств, подходящих для снижения вирусного титра, и иммунизацию пациента ген-доставочным комплексом по любому из пп.1-8.
Текст
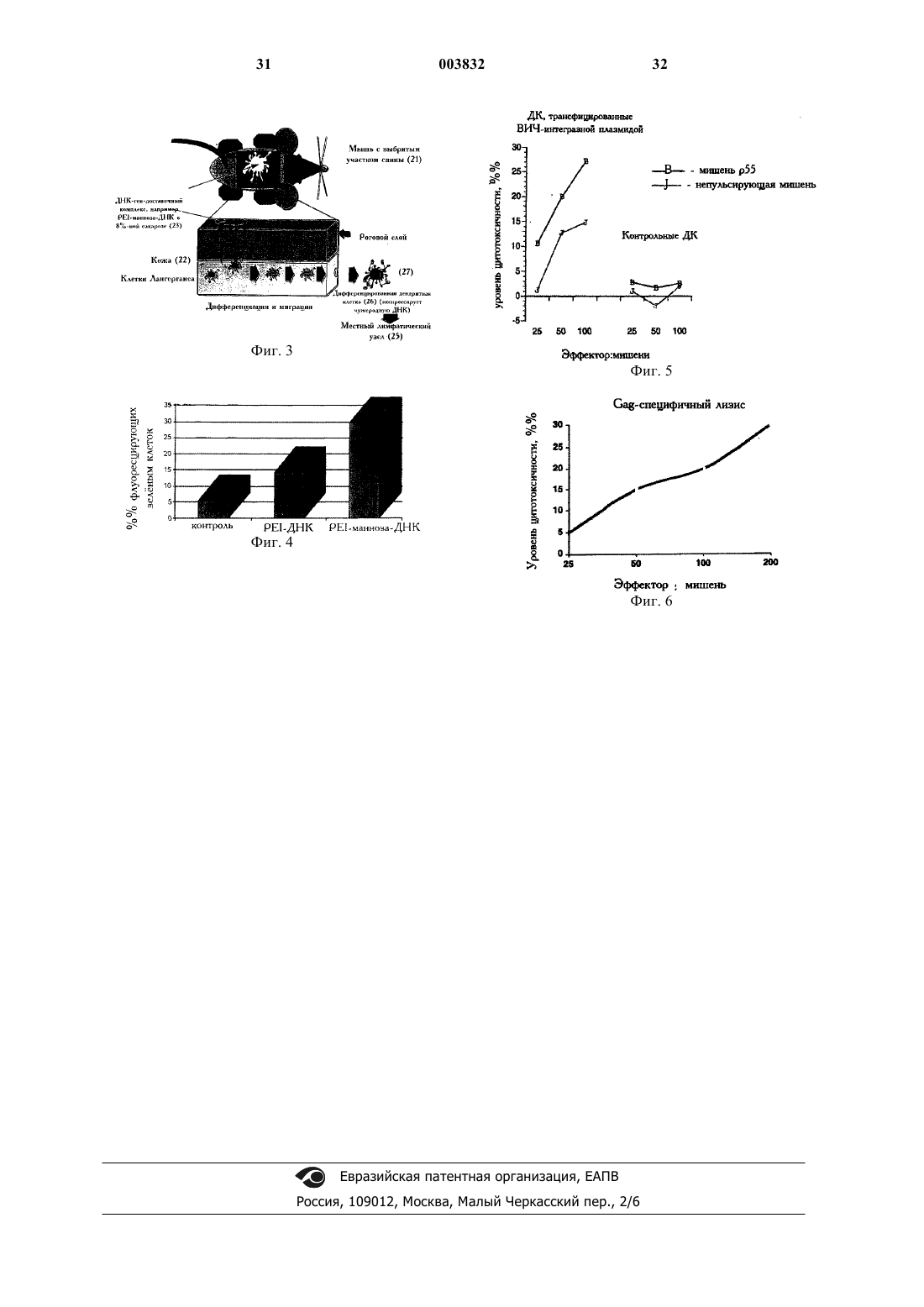
1 Область изобретения Настоящая заявка является частичным продолжением USSN 60/058933, поданной 15 сентября 1997 г., которая включена сюда в полном объеме в качестве ссылки. В целом, настоящее изобретение относится к способам и композициям, для доставки чужеродного генетического материала в клетки. Конкретно оно относится к методике опосредованной рецептором доставки генов в клетки. Ген-доставочный комплекс, совместимый с конкретным типом клеток-мишеней, образуется на основе чужеродного генетического материала, вектора и,необязательно, носителя. Этот комплекс затем связывают с данными клетками в условиях,обеспечивающих опосредованный рецептором эндоцитоз, в результате чего происходит функциональный захват или трансдукция чужеродного генетического материала. Такой способ применим не только in vitro, но также и in vivo для доставки генов в антиген-презентирующие клетки, что конкретно описывается для чрескожной доставки генов через кожу в кожные клетки Лангерганса. Данная методика, в частности, применима для профилактической и терапевтической иммунизации, при которой чужеродным генетическим материалом является иммуноген, такой как ДНК, кодирующая существенную часть антигенов и частиц, ассоциированных с патогенным вирусом, в то время, как предпочтительным является избежать такой доставки с помощью инъекции. Предпосылки изобретения Иммунная система животных характеризуется формированием двух различающихся, но при этом родственных ответов - клеточного иммунного ответа и гуморального иммунного ответа. Клеточный иммунный ответ приводит к образованию Т-лимфоцитов, которые убивают клетки, несущие чужеродные идентификационные маркеры на своей поверхности. Говорят,что клетки, которые несут такие идентификационные маркеры на своей поверхности, "презентируют" антиген, такие клетки обозначаются как антиген-презентирующие клетки (АПК). Кроме того, Т-лимфоциты также стимулируют гуморальный ответ за счет хелперного воздействия на В-клетки, являющиеся предшественниками плазмоцитов. Гуморальный иммунный ответ приводит к продукции плазматическими клетками антител,которые в растворе взаимодействуют со специфичными молекулами. Антитела (или иммуноглобулины) представляют собой белки, синтезируемые в организме животного в ответ на присутствие чужеродного вещества. Они секретируются плазматическими клетками, которые являются производными от В-лимфоцитов (Вклеток). Эти растворимые белки являются распознающими элементами в системе гуморального иммунного ответа. Каждое антитело характеризуется специфической аффинностью в от 003832 2 ношении чужеродного вещества, которое простимулировало его синтез. Соответственно, антитело характеризуется наличием в его составе участка или сайта, обозначаемого как "антигенсвязывающий сайт", который связывает чужеродное вещество. Чужеродная макромолекула,которая способна вызывать выработку антител к ней, называется антигеном. Специфическая аффинность антитела относится не ко всей макромолекуле антигена, а касается его отдельного участка, который обозначают как "антигенная детерминанта" или "эпитоп". Антитела распознают чужеродные молекулы в растворе и на мембранах вне зависимости от имеющегося молекулярного окружения. Гуморальный иммунный ответ является наиболее эффективным в отношении бактерий и вирусов во внеклеточной среде (слово "humor" является латинским эквивалентом слов "жидкость" или "жидкая среда"). Одна из стратегий выработки иммунитета по отношению к заболеванию основана на том, что индивидуум подвергается воздействию одного или нескольких антигенов, ассоциированных с вирусом или бактерией, вместо самих вирусов или бактерий. Такая вакцина известна как субъединичная вакцина, особенно она также эффективна с точки зрения стимуляции продукции антител. Т-клетки опосредуют клеточный иммунный ответ. В отличие от гуморального иммунного ответа, клеточный иммунный ответ обеспечивает разрушение инфицированных вирусом клеток, паразитов и опухолевых клеток. На поверхности Т-лимфоцитов находятся трансмембранные белки, называемые Т-клеточными рецепторами, которые распознают чужеродные молекулы, находящиеся на поверхности других клеток. Следовательно, Т-лимфоциты распознают антиген-презентирующие клетки (АПК). Т-клеточные рецепторы не распознают изолированные чужеродные молекулы (т.е. вне находящиеся АПК). Чужеродный фактор должен находиться на поверхности клетки и должен быть презентирован Т-лимфоциту конкретным мембранным белком, который кодируется высоковариабельным геномным сегментом, известным как главный комплекс гистосовместимости(МНС). Комплекс МНС кодирует трансмембранные белки трех классов. Белки МНС классаI, которые экспрессируются практически во всех типах клеток, презентируют чужеродные эпитопы цитотоксическим Т-лимфоцитам. Белки МНС класса II, которые экспрессируются в клетках иммунной системы и в фагоцитах, презентируют чужеродные эпитопы хелперным Тлимфоцитам. Белки МНС класса III являются компонентами механизма, известного как система комплемента. Существует ряд дифференцированных Тлимфоцитов, включая цитотоксические Тлимфоциты (CTL или Т-киллеры), которые обеспечивают разрушение клеток, несущих чу 3 жеродный эпитоп, связанный с белком МНС. Когда комплекс "чужеродный эпитоп/белок МНС" связывается Т-клеточным рецептором, Тлимфоцит секретирует гранулы, содержащие перфорин, который полимеризуется с образованием трансмембранных пор, что тем самым приводит к прорывам клеточной оболочки, или индуцирует клеточный лизис. Другие классы Тлимфоцитов, называемые хелперными Тклетками или Т-хелперами, секретируют пептиды и белки, называемые лимфокинами. Эти гормоноподобные молекулы контролируют движение и активность других типов клеток. Некоторыми примерами лимфокинов являются интерлейкин-2 (IL-2), интерлейкин-4 (IL-4), интерфероны, колониестимулирующие факторы гранулоцитов/макрофагов (GM-CSF) и фактор некроза опухолей (TNF). Т-лимфоциты вовлечены в каскад комплемента, тонко регулируемый каскад процессов, которые обусловливают разрушение микроорганизмов и инфицированных клеток. Более пятнадцати растворимых белков взаимодействуют с образованием мультимерных антиген-антитело комплексов, что предшествует образованию крупных отверстий в плазматической мембране клеток. Экспрессия чужеродных генов в антигенпрезентирующих клетках (АПК) может быть использована для генерирования эффективного Т-лимфоцитарного ответа у животных. Следовательно, генная инженерия и генетическое модифицирование клеток АПК является перспективным с точки зрения создания эффективной вакцины и разработки терапевтических приемов в отношении различных заболеваний, включая вирусные инфекции и злокачественные опухоли. Живые рекомбинантные вирусные векторы,экспрессирующие различные чужеродные антигены, такие как поксвирусы, аденовирусы и ретровирусы, могут быть использованы для индукции гуморального, и клеточного иммунных ответов за счет имитации вирусной инфекции. Конечно, живые ослабленные вирусы также могут быть предложены в качестве вакцин. Но также может быть применена и стратегия вакцинации с использованием ДНК. Различные вирусные гены были клонированы в состав плазмидной ДНК с последующим инъецированием в мышцы, кожу или подкожно. Такие конструкции способны экспрессировать белки и индуцировать как гуморальный, так и клеточный иммунные ответы. Было выдвинуто предположение, что вирусные заболевания могут быть подвергнуты лечению методами генетической иммунизации. Некоторые типы клеток, такие как дендритные клетки, как известно, способны захватывать антигены и мигрировать с ними из тканей тела в лимфоидную ткань. Такие клетки презентируют антигены в лимфоидных органах: то есть, они представляют чужеродный эпитоп, связанный с белком МНС. Для таких антиген 003832 4 презентирующих клеток (АПК) известно участие в механизме формирования иммунного ответа. Если такие клетки, как дендритные, модифицируются таким образом, чтобы они содержали молекулу ДНК, кодирующую инфекционный вирус, не способный эффективно воспроизводиться, то они могут не только презентировать антиген в классическом понимании этого процесса, но также могут быть искусственно изменены таким образом, чтобы вырабатывать или экспрессировать вирусные частицы и широкий круг вирусных белков. Новый подход был описан в патентном документеRGT100 А, USSN 08/803484 "Способы и композиции для профилактической и терапевтической генетической иммунизации", который включен сюда в полном объеме в качестве ссылки. В соответствии с ним гены репликативнонекомпетентных вирусов могут быть внесены в антиген-презентирующие клетки, которые затем перемещаются в органы лимфатической системы и вырабатывают полный комплемент вирусных антигенов и вирусных частиц, тем самым опосредуя как гуморальный, так и клеточный иммунные ответы. В соответствии с указанным документом дендритные клетки лимфоидных органов могут затем экспрессировать все вирусные антигены и вырабатывают "выглядящие обычным образом" вирусные частицы. Эти вирусные частицы должны, таким образом, играть ключевую роль в генерировании дополнительных иммунных ответов. В цитированном документе в разделе"Пример 13" описана трансдукция in vivo клеток, включая клетки АПК. В этом примере охарактеризованы некоторые хорошо известные методы, включая способы доставки, базирующиеся или небазирующиеся на вирусах. В примере 14 описана трансдукция in vivo клеток,включая клетки АПК. Такой подход включает:(1) прямое инъецирование ДНК; (2) инъецирование липосом или виросом, включающих такую ДНК; (3) прямое инъецирование в селезенку поксвирусов класса 4; и (4) применение ректальных и вагинальных суппозиториев, включающих ген-доставочные системы. Однако цитированный документ не описывает подробно способы доставки генов in vitro и in vivo. Это и является объектом настоящего изобретения. Имеется ряд доказательств того, что генетическое модифицирование клеток АПК эффективно с точки зрения вакцинации и новорожденных, и взрослых животных, а также человека. Было осуществлено (Ridge et al., 1996, Science, 271, 1723-1726) внутривенное инъецирование мышам дендритных клеток, экспрессирующих чужеродный антиген, выделенные от другого животного. И у новорожденных мышат,и у взрослых мышей, проинъецированных такими дендритными клетками, была установлена способность генерировать отчетливый пул цитотоксических Т-лимфоцитов, уничтожающих 5 клетки-мишени. Эти эксперименты также продемонстрировали, что дендритные клетки, экспрессирующие чужеродный антиген, могут индуцировать защитный, опосредованный клетками иммунный ответ, который может проявляться в уничтожении инфицированных клеток в случае вирусных инфекций. Кроме того, эти эксперименты показали, что возможной является иммунизация новорожденных особей с применением иммунизации, опосредованной дендритными клетками. Но эти эксперименты не основываются на использовании генетически модифицированных клеток, на применении чужеродных антигенов или вируса - т.е. того, что описано в настоящем изобретении. Сарцотти с соавт. (Sarzotti et al., 1996, Science, 271, 1726-1728) показали, что инокуляция низкими вирусными титрами обусловливает формирование защитного иммунного ответа(Th1-типа), при котором образуются цитотоксические Т-лимфоциты, в то время как инокуляция высокими вирусными титрами обусловливают незащитный иммунный ответ (Тh2-типа),при котором в основном образуются антитела. Эти ответы, основанные на цитотоксических Тлимфоцитах, являются долговременными и также могут быть вызваны у новорожденных. Высокие титры вирусов приводят к разрушению и разоружению Т-лимфоцитов до того момента,как дендритные клетки активируют Тлимфоциты. Опять-таки важным является путь введения - т.е. презентирование дендритных клеток в противопоставление инъекциям. Полученные данные согласуются с другими результатами, в соответствии с которыми воздействие низких вирусных титров в основном обусловливает индукцию клеточного (т.е. Th1-типа) иммунного ответа. У макак низкий титр вирусаSIV приводил к ответу типа Тh1 при отсутствии выработки антител и обусловливал защиту этих животных от последующих воздействий высоких титров (Clerici et al., 1994, AIDS, 8, 13911395). Сходные данные были получены и в экспериментах на человеке (Rowland-Jones et al.,1995, Nature Med., 1, 59-64). Процесс такой модификации клеток, в результате которой они включают чужеродный генетический материал, называют переносом генов, трансфекцией или трансдукцией. Ни в одном из цитировавшихся выше документов не было приведено доказательств эффективного переноса генов в антиген-презентирующие клетки, как in vitro, так и in vivo. В связи с использованием для переноса генов в такие антиген-презентирующие клетки, каковыми являются дендритные клетки, были описаны некоторые"низкоэффективные" способы in vitro, включая опосредуемый липосомами перенос, электропорацию и доставку генов с помощью ретровирусных векторов и аденовирусных векторовUSA, 94:5 1943-1948). Все эти способы in vitro включают выделение больших популяций клеток, которые подвергают лабораторной обработке приспособлениями для доставки генов. Во всех вариантах применения в отношении животных и человека необходимым является обратное внесение таких генетически модифицированных клеток. Следовательно, способы доставки генов in vitro непригодны для вакцинации или лечения большого числа индивидуумов. Известные прижизненные (in vivo) способы включают внутрикожные и внутримышечные инъекции рекомбинантными вирусными векторами, а также внутрикожные, подкожные и внутримышечные инъекции плазмидной ДНК. Ни для одного из этих способов не была продемонстрирована эффективная доставка генов в антиген-презентирующие клетки, такие как дендритные клетки, равно как и очень низкой была эффективность доставки генов через кожу к кожным клеткам Лангерганса. Краткое описание чертежей На фиг. 1 проиллюстрирована опосредованная антителом доставка гена в клетки, экспрессирующие Fc-рецепторы. На фиг. 2 проиллюстрирован механизм доставки генов в дендритные клетки и клетки Лангерганса опосредованно через рецептор маннозы с применением комплекса "РЕI-mаn"ДНК. На фиг. 3 проиллюстрирован способ доставки генов через кожу. На фиг. 4 показано сравнение эффективности трансфекции in vitro дендритных клеток человека с применением двух различных комплексов по настоящему изобретению. На фиг. 5 на основе CTL-теста показано,что трансдуцированные дендритные клетки способны генерировать цитотоксические Тлимфоциты из "необученных" Т-клеток: сравнивается уровеньцитотоксичности трансфицированных ВИЧ-интегразной плазмидой дендритных клеток с контрольными дендритными клетками. На фиг. 6 показана реакция цитотоксических Т-лимфоцитов после генетической иммунизации ex vivo по сравнению с подобным ответом, полученным при использовании трансфицированных in vivo дендритных клеток. Подробное описание чертежей На фиг. 1 показана принципиальная схема способа доставки гена, опосредованной антителом, в клетки, экспрессирующие Fc-рецепторы. Клетки-мишени [1], несущие один или несколько таких рецепторов [2 а, b, с, d], обрабатываются комплексом [3], содержащим носитель [4] и вектор [5], которые включает чужеродный генетический материал. Ген-доставочный комплекс[3] связывается на рецепторах [2 а, b, с, d] клетки[1], и вектор [4] проникает внутрь клетки благодаря механизмам эндоцитоза или фагоцитоза с образованием в клетке эндосомы [6]. Вектор [4] 7 обладает свойством разрушать эндосому [6], что обеспечивает возможность выхода чужеродного генетического материала в клетку. На фиг. 2 показана принципиальная схема способа доставки генов, опосредуемой углеводами, в клетки, экспрессирующие рецепторы маннозы. Клетки-мишени [10], которыми в этом случае являются недифференцированные клетки Лангерганса, несущие на своей поверхности один или несколько рецепторов маннозы [12],обрабатывают ген-доставочным комплексом[13], включающим полиэтилениминовый углевод (маннозу), соединенный с чужеродным генетическим материалом. Ген-доставочный комплекс [13] связывается на рецепторах [12] клетки [10], а система "PEI-манноза-ДНК" (полиэтилениминманноза-кодирующая ДНК) попадает в клетку по механизму эндоцитоза в виде эндосомы [14]. Вектор "PEI-man" обладает свойством разрушать [15] эндосому, что обеспечивает возможность выхода в цитоплазму клетки чужеродного генетического материала. Клетка дифференцируется [16] и экспрессирует белки [17],кодируемые чужеродным генетическим материалом. На фиг. 3 показаны результаты эксперимента, призванного продемонстрировать процесс опосредованной углеводом доставки гена в клетки, экспрессирующие рецепторы маннозы. Клетками-мишенями являются клетки Лангерганса в коже, для которых известна экспрессия рецепторов маннозы. Мышей [21] обездвиживали и на спине у каждой из них выбривали участок кожи [22]. Выбритую поверхность обрабатывали этиловым спиртом. На выбритую поверхность [22] каждой особи наносили гендоставочный комплекс "PEI-манноза-ДНК" в 8%-ной глюкозе [23]. Клетки Лангерганса [24],находящиеся в выбритой зоне кожи [22], поглощают доставочный комплекс в соответствии с показанным на фиг. 2, активируются и мигрируют [24] к ближайшему лимфатическому узлу[25]. В ходе перемещения клетки Лангерганса[26] и экспрессируют белок [27], кодируемый внесенной ДНК. На фиг. 4 приведены результаты сравнительных экспериментов, показывающих доставку генов in vitro с помощью комплексов "РЕIДНК" или "PEI-манноза-ДНК". Дендритные клетки человека культивировали в соответствии с описанным в тексте заявки и трансфицировали этими комплексами. В качестве чужеродной ДНК использовали ген, кодирующий зеленый флуоресцирующий белок (GFP). В этих экспериментах комплексы были растворены в растворе хлористого натрия. Проведенный эксперимент показал, что конструкция с "PEIманноза" оказывается более эффективной с точки зрения трансфицирования культивируемых дендритных клеток в сравнении с "чистой" PEIконструкцией. 8 На фиг. 5-6 показаны результаты экспериментов, которые подробно описываются в нижеследующем разделе, включающем примеры. Сущность изобретения Объектом настоящего изобретения является представление характеризующегося повышенной эффективностью способа переноса генов в клетки in vitro и in vivo. Следующим объектом настоящего изобретения является представление улучшенного способа генетической иммунизации за счет увеличения эффективности переноса генов в антиген-презентирующие клетки. Еще одним объектом настоящего изобретения является представление способа стимуляции и гуморального, и клеточного иммунных ответов на белок, вырабатываемый под контролем перенесенного генетического материала. Еще одним объектом настоящего изобретения является достижение эффективного иммунного ответа в отношении вирусных заболеваний. Другим объектом настоящего изобретения является представление вакцины против вирусных заболеваний, которая была бы эффективной и обладала повышенной безопасностью. Преимуществом настоящего изобретения является то, что оно представляет способ переноса генов in vivo, который может быть использован для иммунотерапии и вакцинации в отношении широкого круга заболеваний. Другое преимущество настоящего изобретения связано с тем, что в нем могут быть использованы любые типы ДНК или РНК, включая плазмидную ДНК, кодирующую иммуногены, такие как онкогены, аллергены, вирусные белки или различные типы дефектных по репликации вирусов, неполные вирусные частицы,равно как и плазмидную ДНК. Другим преимуществом настоящего изобретения является то, что в нем вместо ДНК могут использоваться белки, такие как онкогены(например, мутантный опухоль-супрессорный белок р 53 или белок Ras), иммуногены (обусловливающие аллергию), вирусные белки или различные типы дефектных по репликации вирусов. Эти и другие объекты и преимущества настоящего изобретения будут ясны из подробного описания и включенных в текст примеров. Объекты и преимущества настоящего изобретения достигаются путем формирования гендоставочного комплекса, включающего вектор(который включает желаемый чужеродный генетический материал) и носитель (который может связываться как с клетками, так и с гендоставочной частицей), а затем контактирование клеток-мишеней с данным комплексом в условиях, обеспечивающих эндоцитоз. Данный вектор характеризуется тем, что обеспечивает включаемому в него генетическому материалу выход из разрушающейся эндосомы и попадание желаемого генетического материала либо в цитоплазму, либо в ядро клетки. Чужеродные 9 белки могут быть экспрессированы и презентированы в иммунную систему генетически модифицированными клетками. Если чужеродный генетический материал кодирует дефектный по репликации вирус в соответствии с описанным в патентном документеRGT-100A USSN "Способы и композиции для профилактической и терапевтической генетической иммунизации",который включен в данный текст для сведения в виде библиографической ссылки, то измененные клетки-мишени смогут затем презентировать вирусные антигены и также экспрессировать вирусные частицы и белки в органах лимфатической системы, тем самым вызывая высокоэффективный клеточный иммунный ответ,равно как и гуморальный иммунный ответ. Подробное описание изобретения Настоящее изобретение наиболее тесно касается способов и композиций, предназначенных для доставки чужеродного генетического материала в клетки. Это имеет свое конкретное применение для целей повышения эффективности генетической иммунизации за счет увеличения эффективности переноса генов к некоторым клеткам, участвующим в работе иммунной системы, таким как антиген-презентирующие клетки (АПК). Хотя целью заявителей является обеспечение доставки генетического материала в клетки, заявители считают, что любая молекула подходящего размера и конфигурации может быть доставлена в клетку в соответствии с настоящим изобретением. Следовательно, другие материалы, такие как лекарственные препараты или белки, например, могут быть доставлены в клетки-мишени с применением описанных здесь способов. Настоящее изобретение основывается на некоторых естественных процессах, характерных для животных. Известно, например, что специфические белки импортируются в клетки благодаря процессу, получившему название опосредованного рецепторами (или рецепторного) эндоцитоза. В ходе этого процесса специфические белки или лиганды связываются на соответствующих рецепторах, расположенных снаружи на плазмалемме клетки. Мембрана образует впячивание или "карман" вокруг этого белка и в конечном счете интернализует лиганд. Таким образом происходит импорт белка внутрь клетки. После этого обычно образовавшаяся эндосома доставляет эти комплексы в лизосомы, где они расщепляются на составные части - пептиды. В клетках, в которых имеет место экспрессия комплекса МНС, в лизосомах происходит накопление комплексов "пептид-МНС", которые затем достигают поверхности клетки - такой процесс называют презентированием антигена. Опосредованный рецепторами эндоцитоз является способом доставки в клетки крупных молекул, таких как ключевые метаболиты, гормоны и факторы роста. Этот механизм используется мно 003832 10 гими вирусами и токсинами, которым необходимо проникнуть в клетки; также он играет важную роль в формировании иммунного ответа. Например, фагоцитирующие клетки несут рецепторы, позволяющие им поглощать комплексы "антиген-антитело". Частицы, соединенные с антителами, такие как иммуноглобулин-G, или компоненты комплемента, такие как С 3b, или они оба могут эффективно проникать внутрь клетки по механизму опосредованных рецепторами эндоцитоза и фагоцитоза. Антитела (=иммуноглобулины) характеризуются наличием дифференцированных сегментов, обеспечивающих им проявление различающихся функций. Например,иммуноглобулин-G (IgG) является Y-образной молекулой, имеющей два Fab-сегмента, включающих антиген-связывающие сайты, и Fcсегмент, который обеспечивает эффекторные функции. Мультивалентные антигены могут связываться с антителами и образовывать иммунные комплексы. Размер таких иммунных комплексов является функцией относительной концентрации антигена и антитела. Эффективность эндоцитоза может быть повышена с помощью процесса, называемого"опсонизацией". Опсонизация - это процесс, при котором антитела покрывают антигены, тем самым предоставляя возможность другим компонентам иммунной системы распознавать и реагировать на эти антигены. Иммуноглобулины с соответствующими друг другу сайтами Fab могут быть использованы для покрытия антигенных частиц, а, следовательно, клетки, экспрессирующий соответствующие Fc-рецепторы,могут распознавать Fc-сегмент опсонизованных антител и легко обусловливать их эндоцитоз. Компоненты комплемента, такие как С 3b, С 4b и С 3bi, также обладают опсонизующей активностью. Крупные иммунные комплексы по сравнению с небольшими по размеру комплексами фагоцитируются с более высокой эффективностью клетками, такими как В-лимфоциты, моноядерные фагоциты, гранулоциты, нейтрофилы и дендритные клетки, экспрессирующие рецептор Fc-сегментов иммуноглобулиновых молекул. Антитела класса IgG могут быть получены от животных путем инъецирования антигена наряду с адъювантом или без него. Также антитела могут быть клонированы и гуманизованы с использованием молекулярно-генетических методик. Другие рецепторы, которые обычно располагаются на внешней поверхности клеточных мембран клеток иммунной системы, включают,например, рецепторы трансферрина, маннозы и асиалогликопротеина, легко могут быть использованы для трансдукции клеток иммунной системы. Связывающийся с Fc-рецептором сегмент антитела также может быть замещен другим связывающимся с рецептором доменом с использованием молекулярно-генетических мето 11 дов. Для целей, сформулированных заявителями, рецепторы Fc-сегмента и соответствующие молекулы IgG являются стандартными, поскольку они служат для обеспечения выполнения функций генов, переносимых в дендритные клетки. После того, как молекула или частица попала внутрь клетки в результате эндоцитоза или фагоцитоза, она оказывается внутри белковорецепторного комплекса, называемого эндосомой. Эндосомы являются внутриклеточными компартментами с кислой реакцией, которые служат для выполнения конкретной функции. Фагосомы, образующиеся в результате фагоцитоза, - это крупные (10 х-20 х) эндосомы. Затем эндосомы сливаются с лизосомами, где содержавшийся в них материал расщепляется на небольшие продукты, такие как пептиды, нуклеотиды и углеводы. В настоящем изобретении вектору придается функция доставки чужеродного гена в клетку и предотвращения деградации этого гена. Следовательно, этот вектор должен быть способен разрушать эндосому и"выпускать" данный ген в цитоплазму (внутриклеточную жидкую среду) или в ядро. Известно несколько частиц, которые способны разрушать эндосому после опосредованного рецепторами эндоцитоза, включая вирусные ген-доставочные системы, такие как аденовирусные векторы,ретровирусные векторы, поксвирусные векторы и вирус обезьян SV40. Невирусные гендоставочные системы включают конъюгаты ДНК с полилизином, полиэтиленимином и их производными, липосомами, виросомами и химическими соединениями, которые способны повышать величину рН в эндосоме, такие как,например, хлорохин. Клетки-мишени Настоящее изобретение может быть использовано в отношении любых клеток, способных к опосредованному рецепторами эндоцитозу или фагоцитозу. Клетки-мишени должны экспрессировать рецепторный сайт, который по связыванию с комплементарной молекулой сможет переместить желаемую молекулу в эндосому или фагосому. Для целей, поставленных заявителями, такими клетками предпочтительно являются те клетки, которые участвуют в формировании иммунных ответов. Они включают клетки, которые могут быть вовлечены в опосредованный рецепторами эндоцитоз и фагоцитоз антигенов. Такие клетки включают, например, В-клетки, моноядерные фагоциты, гранулоциты и дендритные клетки. Эти клетки экспрессируют рецепторы, связывающие Fcсегменты иммуноглобулинов, или рецепторы комплемента, или оба этих типа рецепторов. Дендритные клетки и макрофаги являются предпочтительными, потому что они могут эффективно презентировать чужеродные антигены, тем самым обусловливая клеточный иммунный ответ или ответ с цитотоксическими Т 003832 12 лимфоцитами. Эти клетки также могут быть выбраны мишенями благодаря другим рецепторам, таким как рецепторы трансферрина и маннозы. Дендритные клетки находятся в лимфоидных тканях, таких как селезенка, миндалины и лимфатические узлы, но могут еще и присутствовать в крови, эпидермисе, слизистой и других периферических тканях. Эти клетки захватывают антигены и перемещаются с ними к лимфоидным тканям. В коже дендритные клетки, называемые клетками Лангерганса (а также макрофагами дермы), могут быть найдены в ее эпидермисе. После эндоцитоза антигена они мигрируют к ближайшему локальному лимфатическому узлу. Когда они находятся в лимфатическом узле, их называют "межпальцевыми" клетками: они презентируют антиген "необученным" Т-лимфоцитам, тем самым обусловливая клеточный иммунный ответ. Для увеличения эффективности переноса генов количество доступных дендритных клеток может быть максимизировано. Фактором может быть выбор места локализации. Высокие концентрации дендритных клеток можно найти,например, в коже и в слизистых, такие как слизистые рта, влагалища и прямой кишки. Недифференцированные дендритные клетки в этих тканях способны к эффективному эндоцитозу,поэтому они являются хорошей мишенью для ген-доставочного комплекса, который предназначен для доставки генов на базе опосредованного рецепторами эндоцитоза. Однако для целей эффективной экспрессии молекул МНС и презентирования антигенов также должны быть активированы дендритные клетки. В модели invitro недифференцированные дендритные клетки могут быть получены из периферической крови с GM-CSF или IL-4 или из предшественников костного мозга с GM-CSF. Активация этих недифференцированных дендритных клеток может быть индуцирована in vitro и in vivo при действии бактериальных продуктов, таких как липополисахариды и TNF (С. Watts et al.,1997, Nature, 338, 724-725). Дендритные клетки могут быть привлечены к конкретному месту и активированы связанным с иммунной системой событием, таким как повреждение клетки или ткани. Для целей настоящего изобретения привлечение и активация антиген-презентирующих клеток, включая дендритные клетки, могут быть обусловлены иммунным ответом, не связанным с вакцинацией или вирусной инфекцией. Примером может быть кожная сыпь, что является результатом восприимчивого контакта с химическими соединениями, такими как лекарственные препараты и токсины, косметические средства и антигены окружающей среды. Если химический раздражитель попадает на кожу, то сыпь или повреждения обычно должны возникнуть через 24-48 ч после такого воздействия. Данное по 13 вреждение обусловливается неоантигенами,которые создаются в результате связывания химических соединений на поверхностных белках клеток Лангерганса. Неоантигены являются ковалентно модифицированными "нормальными" белками (например, фосфорилированными),которые распознаются антителами. В этом сайте может быть найдено более высокое по сравнению с нормой количество дендритных клеток: их активация оказывается более вероятной, а,следовательно, более восприимчивыми в последующему эндоцитозу антигена. Выбор раздражающего фактора зависит от эффективности привлечения им дендритных клеток и от возможного наличия побочных эффектов. В другом варианте настоящего изобретения может быть осуществлено повреждение, ассоциированное с иммунным комплексом. В этом случае иммунные комплексы, содержащие оба компонента(антиген и антитело), могут быть использованы для активирования В-клеток и каскада реакций комплемента, в результате чего обусловливается тканевое повреждение. Поскольку клетки помечают опосредованно через конкретный класс рецепторов, а частное преимущество настоящего изобретения связано с тем, что ген-доставочный комплекс может быть сформирован так, чтобы метить конкретные типы клеток. Если ген-доставочный комплекс конструируется с использованием иммуноглобулина-G или полиэтиленимина, модифицированных с подходящих крахмала или углевода, то он может быть востребован в основном антиген-презентирующими клетками. Это может быть существенное преимущество при создании генетических вакцин. Мечение других типов клеток, экспрессирующих, например, рецепторы компонентов комплемента или рецепторы трансферрина также является пригодным в соответствии с описанным здесь выше. Ген-доставочный комплекс Ген-доставочный комплекс в соответствии с настоящим изобретением может быть использован для переноса генов in vitro или in vivo в клетки, несущие конкретный рецептор. Гендоставочный комплекс конструируется из двух составных частей: генетического материала и"доставочной частицы", - а также он может включать носитель (см. фиг. 1). В одном из вариантов генетический материал является производным от ослабленного вируса ВИЧ, а "доставочной частицей" является невирусный вектор. В другом варианте настоящего изобретения такой же или отличающийся генетический материал может быть интегрирован с вирусным вектором и носителем. В этом случае носителем предпочтительно является антитело, которое включает сайт, комплементарный рецептору,имеющемуся на поверхности клетки-мишени, а также антиген-связывающийся сайт, специфичный в отношении желательной "доставочной 14 частицы". Такой носитель является специфичным и для клетки и для доставочной частицы. Для целей генетической иммунизации IgG человека, специфичный в отношении системы доставки гены, отбирают с помощью стандартных приемов. Если в этом случае антитело, которое можно было бы приобрести на коммерческой основе, отсутствует, то оно может быть получено с применением методик, известных специалистам в данной области техники. Если система доставки гена представлена дефектным по репликации вирусам иммунодефицита человека ВИЧ-1, то IgG человека может быть использован в качестве носителя: он доступен в больших количествах при решении задач пассивной иммунотерапии. Система доставки гена может быть соединена с антителом путем их совместной инкубации в течение 5 мин при комнатной температуре. Относительные количества "доставочной частицы" и антитела определяют с учетом того, нужна ли будет опсонизация этой"ген-доставочной частицы". Генетический материал Генетический материал, которым является ДНК или РНК, переносится доставочным комплексом. Один или большее число генов могут кодироваться нитью плазмидной ДНК, двухцепочечной молекулой ДНК или молекулой РНК. С другой стороны, генетический материал может быть встроен в состав рекомбинантных вирусов, если они были выбраны в качестве "гендоставочных частиц". Если целью переноса генов является индукция иммунного ответа, то генетический материал должен экспрессировать один или большее число иммуногенных белков. Подвергнутые трансдукции клетки должны,кроме того, экспрессировать достаточное количество иммуногенных белков (различных вирусных антигенов) и вырабатывать достаточное количество вирусных частиц с целью обусловливания существенного иммунного ответа (например, чтобы защищать индивидуума от инфекции вируса дикого типа). Выбор ген-доставочной системы должен диктоваться конкретным заболеванием и выбором гена (генов), предназначенного к переносу. Когда желательным является конструирование вакцины для зависимого от обратной транскриптазы вируса, такого как ВИЧ, ДНК предпочтительно кодирует, по крайней мере, существенную часть дефектного по репликации или дефектного по сборке вируса или целиком вирус, дефектный по репликации или сборке. Примерами являются, тем самым не ограничиваясь, нулевые по интегразе мутанты дитропного первичного изолята, такого как ВИЧ-1/LW и его производные, характеризующиеся делецией в сайте протеазного расщепления продукта гена"Способы и композиции для профилактического и терапевтического генетического иммунитета",поданную 20 февраля 1997 г., которая в данный 15 текст включена для сведения в качестве библиографической ссылки. Когда желательным является конструирование противоопухолевой вакцины, предпочтительным иммуногеном является ДНК, кодирующая один или большее число онкогенов. Другие конструкции на основе ДНК могут быть молекулами ДНК, кодирующими дефектный по репликации папилломавирус человека (обусловливает рак шейки матки), дефектные по репликации вирусы гепатита А, В и С (вызывают гепатиты и рак печени) и ДНК,кодирующие дефектные по репликации вирусы животных, такие как вирус коровьего лейкоза или вирус иммунодефицита кошачьих. Выбор доставочной системы, включающей чужеродный генетический материал, может включать:(а) дефектный по репликации BИЧ или другой ретровирус; (b) рекомбинантный аденовирус; (с) плазмиду или линеаризованную ДНК или РНК,соединенную с PEI или с дериватом PEI; (d) виросому, включающую любую ДНК или РНК; (е) липосому, содержащую ДНК или РНК; (f) комплекс, состоящий из плазмидной ДНК, полилизина и вируса; (g) углевод, соединенный с любой ДНК или РНК. Доставочная система С целью эффективной доставки генов в клетку ген-доставочная система должна включать ген или гены, которые предназначены для переноса, а также должны характеризоваться способностью разрушать эндосому (или фагосому) в отличие от генов, предназначенных для внесения в лизосому или к выделению на внешней поверхности клетки с последующим разрушением. Кроме того, ген-доставочная система должна обеспечивать внедрение чужеродного генетического материала в состав генетического материала данной клетки. Ген-доставочная система может включать либо вирусный, либо невирусный вектор. Вирусные ген-доставочные системы включают рекомбинантные вирусные векторы, такие как аденовирусные векторы, ретровирусные векторы, поксвирусные векторы, мутантные вирусы(описанные выше) и виросомы. Гендоставочные системы невирусной природы включают молекулы ДНК, соединенные с углеводом, полилизином, полиэтиленимином, производными полиэтиленимина и липосомы, наряду с их возможными производными. Предпочтительными являются невирусные ген-доставочные системы, такие как те, в которых используются углеводы, производные углеводов, липосомы, производные липосом и полиэтиленимин или производные полиэтиленимина. Наиболее предпочтительными среди них являются производные углеводов и полиэтиленимин, адаптированные для распознавания их рецепторами маннозы, находящимися на поверхности клеток иммунной системы. Невирусные ген-доставочные системы обладают рядом преимуществ по сравнению с ви 003832 16 русными ген-доставочными системами: 1) вопервых, невирусный вектор не распознается иммунной системой, поэтому по отношению к нему не генерируется иммунный ответ. В результате наиболее вероятно, что индивидуумы,которым вводят окончательную дозу вакцины,проявят толерантность и у них сформируется иммунный ответ в случае повторной иммунизации; 2) невирусные системы потенциально являются более безопасными по сравнению с вирусными системами, потому что отсутствует вероятность того, что такая система мутирует в неожиданном направлении; 3) невирусные системы могут быть синтезированы химическим путем в больших количествах, т.е. они потенциально являются более экономичными. Предпочтительный вариант настоящего изобретения основывается на катионном полимере - полиэтиленимине (PEI). PEI связывается с ДНК с образованием комплекса. Комплекс"РЕI-ДНК" может попадать в эндосому внутри антиген-презентирующих клеток кожи (клеток Лангерганса) в результате эндоцитоза, опосредуемого рецептором асиалогликопротеина. Затем компонент PEI данного комплекса использует процессы блокировки и набухания эндосомы в качестве механизма выхода в цитоплазму(Н. Pollard, J.S. Remy, G. Loussouarn, S. Demolombe, J.P. Behr, 27 марта 1998, J. Biol. Сhеm.,273(13), 7507-7511). PEI также может быть модифицирован таким образом, чтобы распознаваться другими рецепторами. Например, производное PEI, такое как модифицированный углеводом PEI, дает сходные результаты, за исключением того, что внутрь клетки он попадает опосредованно через рецепторы маннозы. Такие производные могут быть получены в лабораторных условиях. Например, изотиоцианантофенилфенильное производное маннозы может быть присоединено к PEI, имеющему молекулярную массу 25 кД, с образованием лиганда(или же остатка маннозы, характеризующегося низким уровнем аффинности по отношению к рецептору маннозы - 1 мМ). Другая возможность связана с использованием производного от линейного PEI с молекулярной массой 22 кД маннотенпаозного лиганда. (Эти материалы были любезно предоставлены Д-ром Жан-Поль Бером: J.-P. Behr, Lab. Chim. Genet., Fac. Pharm.,CNRS UMR 7514, 74 route Rhin, F-67401 Illkirch,Франция). Рецептор маннозы - это трансмембранный гликопротеин с молекулярной массой 175 кД,который специфическим образом экспрессируется на поверхности макрофагов и клеток Лангерганса. Эктодомен рецептора маннозы содержит восемь сайтов распознавания углеводов. Рецептор маннозы распознает параметры углеводов, которые характерны для широкого круга бактерий, паразитов, дрожжей, грибов и маннозилированных лигандов (К. Takahashi, M.J.Cell Tissue Res., 292(2), 311-323). В отличие от рецептора Fc-сегмента, рецептор маннозы может самовосстанавливаться после освобождения от"груза" (лиганда) (Stahl et al., 1980, Cell, 19,207). Соответственно он способен интернализовывать лиганды в повторяющихся циклах по типу, сходному с таковым у рецептора трансферрина, обеспечивая тем самым эффективную возможность захвата антигена (Goldstein et al.,1985, Annu. Rev. Cell. Biol, 1, 1). Недавно было установлено, что опосредованное рецептором маннозы поглощение антигенов обусловливает примерно на два порядка более эффективное презентирование антигенов Т-лимфоцитами по сравнению с антигенами, интернализуемыми в растворенном виде (Engering et al., 1997, Eur. J.Immunol, 27, 2417-2425). Такое усиление презентирования антигенов обусловливается высокоэффективным поглощением антигенов с участием рецептора маннозы. С этих позиций заявители считают, что распознавание рецептора маннозы может обеспечивать как специфичность в отношении антиген-презентирующих клеток, так и повышенную эффективность попадания в эндосомы конкретного комплекса с сохранением его функциональности. Носитель В соответствии с настоящим изобретением носитель является частью ген-доставочного комплекса, который обеспечивает контакт гендоставочной системы с клеточным рецептором. В одном из вариантов таким носителем является иммуноглобулин-G (IgG). IgG является Yобразной молекулой, включающей два сегментаIgG используется в качестве носителя, он специфически распознает клетки, несущие Fcрецепторы. Для изменения специфичности носителя,необходимого для распознавания других типов клеток, Fc-сегмент антитела может быть замещен другим рецептор-связывающимся доменом,таким как комплемент, углевод или трансферрин. Поскольку в случае, когда носителем является антитело, образуются крупные комплексы,то предпочтительным является сочетание гендоставочной системы и носителя в эквивалентных пропорциях. Когда желательным является опсонизация частицы, количество носителя должно в значительной степени превышать количество ген-доставочных "частиц". Эффективность и эндоцитоза, и фагоцитоза возрастает тогда, когда используются крупные комплексы и опсонизованные частицы. Предпочтительно опсонизовать ген-доставочный комплекс с помощью носителя. Когда опсонизованный ген 003832 18 доставочный комплекс, сформированный путем соединения антитела с ген-доставочной "частицей", включающей чужеродный генетический материал, вводят индивидууму, достигается максимально возможный уровень клеточного иммунного ответа по отношению к гуморальному иммунному ответу. Дендритные клетки будут активироваться в присутствие опсонизованных комплексов, а, следовательно, эндоцитоз окажется более эффективным. Также многочисленные антитела будут блокировать антигенные детерминанты (эпитопы) ген-доставочной "частицы". Таким образом, генерирования прямого иммунного ответа на доставочные "частицы" ожидать не приходится. Также некоторые антигены, образовавшие комплекс с антителами,будут связываться на Fc-рецепторе В-клеток,дополнительно подавляя зависимый от них иммунный ответ. Однако клеточный иммунитет все равно будет простимулирован, потому что данный комплекс будет подвергаться эндоцитозу или фагоцитозу антиген-презентирующими клетками разного типа, включая дендритные клетки и макрофаги. В предпочтительном варианте носитель соединяют с ген-доставочной системой невирусной природы по ковалентному типу. PEI может быть химическим путем модифицирован углеводами (например, маннозой, глюкозой,галактозой и т.п.). В этом случае носителем является углеводный лиганд, который распознается рецептором маннозы. Для изменения специфичности носителя углевод может быть заменен на другие рецептор-связывающиеся домены. Доставка генов in vivo Ген-доставочный комплекс может быть внесен непосредственно в кровяное русло, в кожу или другие участки, в которых имеются клетки, соответствующие специфичности связывания носителя. Такой комплекс может быть напрямую применен на коже или поверхности слизистой. В этом случае предпочтительным является то, чтобы клетки Лангерганса активировались на поверхности. Активация может быть достигнута путем стимуляции рецептора(например, рецептора маннозы), активации токсина (холерный токсин), повреждением ткани или клетки, такое как воспаление, а также может являться следствием стимуляции другим антигеном. Такой комплекс может быть введен перорально с помощью применяемой для искусственного вскармливания педиатрической трубки,вагинально или ректально в случаях взрослых или новорожденных человека или животных. Новорожденные могут лучше реагировать на пероральное введение по сравнению со взрослыми индивидуумами. С другой стороны, гендоставочный комплекс может быть включен в состав суппозитория и введен во влагалище или в прямую кишку. 19 В случае использования вирусной гендоставочной системы доставочная "частица" может быть напрямую инъецирована индивидууму в мышцы или кожу в присутствии или в отсутствие адъювантов в два приема с целью обеспечения высокого титра выработки антителin vivo. Первая инъекция в основном должна приводить к гуморальному иммунному ответу. Следовательно, в результате будет реализована способность выработки большого количества антител. Когда концентрация иммуноглобулинаIgG оказывается достаточной для опсонизации поставочных "частиц" (что может быть оценено или определено экспериментальным путем),доставочная "частица" может быть введена во второй раз в соответствии с описанным выше в 1-3. Выбор участка для повторного введения должен выбираться тщательным образом, чтобы быть уверенным в том, что в нем имеются клетки, способные к фагоцитозу или эндоцитозу опсонизованных антигенов. Лечение активной инфекции Вакцина в соответствии с настоящим изобретением также может быть использована в способе лечения активной ВИЧ-инфекции. Вирус иммунодефицита человека характеризуется интенсивной репликацией и быстрым мутированием: следовательно, поскольку иммунная система способна обеспечивать эффективный иммунный ответ на данный тип ВИЧ-частицы,то для "опережения" иммунной системы должно образовываться достаточное количество новых вариантов вирусной частицы. Поскольку репликация вируса дикого типа может быть подавлена либо до того, как иммунная система будет в значительной степени повреждена, либо на протяжении периода времени, достаточного для восстановления работы иммунной системы, то вакцина по настоящему изобретению может быть использована для усиления способности иммунной системы распознавать новые варианты данного вируса, тем самым составляя способ контролирования репликации вируса у индивидуумов, которые уже являются инфицированными. Известны комбинации лекарственных средств, которые эффективны в отношении, по крайней мере, временного подавления репликации вируса ВИЧ. Заявители установили, что сочетания лекарственных средств, включая, в частности, гидроксимочевину, один или большее число ингибиторов обратной транскрипты и, что необязательно, один или большее число протеазных ингибиторов, являются эффективными, а в ряде случаев имеется возможность прекращения химиотерапии в течение длительного периода времени: см. USSN 09/056691,выданный 8 апреля 1998 г., "Способ подавления ВИЧ путем комбинированного применения гидроксимочевины, аналога нуклеозида и протеазного ингибитора", USSN 09/048753, выданный 26 марта 1998 г., "Способ подавления ВИЧ с 20 использованием гидроксимочевины и ингибитора обратной транс-криптазы in vitro", и USSN 09/048756, выданный 26 марта 1998 г., "Способ достижения in vivo некомпетентности по репликации в популяции ВИЧ": все эти документы включены в данный текст для сведения в библиографических ссылках. Настоящее изобретение представляет способ лечения пациента с диагнозом активной ВИЧ-инфекции с использованием подходящего сочетания лекарственных средств до тех пор, когда титр вирусов в крови достигает достаточно низкого уровня: менее чем примерно 50 тыс. копий в 1 мл, предпочтительнее менее чем 10 тыс. копий в 1 мл, более предпочтительно менее чем 200-500 копий в 1 мл. Затем пациента вакцинируют в соответствии с настоящим изобретением с учетом того, что комбинация лекарственных средств подавляет репликацию вируса дикого типа. Нижеследующие примеры приведены с целью проиллюстрировать практическое применение настоящего изобретения. Они ни в чем не ограничивают настоящее изобретение или формулу изобретения, которая приведена ниже. Примеры 1. Экспрессия плазмидной ДНК, кодирующей дефектный по репликации ВИЧ, в культивируемых дендритных клетках. Имеется несколько источников дендритных клеток (ДК). ДК могут быть выделены из позитивных по белкуCD34+ клетокпредшественников кроветворения, находящихся в костном мозге. Моноядерные клетки костного мозга могут быть разделены путем центрифугирования в градиенте Ficoll-Hypaque. Эти клетки отбирают с использованием антител к CD34 человека, соединенных с намагниченными шариками (Dynal Detachabeads): клетки CD34+ высвобождают с намагниченных шариков с использованием высокоаффинного поликлонального антитела, специфичного в отношении к моноклональному антителу CD34. Эти клетки могут дифференцироваться в ДК при их культивировании в присутствие фактора роста стволовых клеток (GM-CSF) и TNF (В. Canque, M.Rosenzwajg et al., 1996, "The effect of in vitro human immunodeficiency virus infection of dendriticcell differentiation and function", Blood, 88(11),4215-4228). Производные от моноцитов ДК были получены на основе моноядерных клеток периферической крови в присутствии факторов GMCSF и IL-4 (A. Bender, M. Sapp et al., 1996, "Improved methods for the generation of dendritic cellsfrom nonproliferating progenitors in human blood",J. Immunol. Methods, 196(2), 121-135). На 4-й день эти клетки трансфицировали липофектамином, соединенным с плазмидной ДНК, кодирующей HIV-1/LWint- (дефектный по репликации и сборке вирус ВИЧ, описанный в USSN 08/803484). Липофектамин, являющийся доступной на коммерческой основе катионной ли 21 посомой, применяется в качестве трансфицирующего агента (получен от Gibco BRL LifeTechnology, PM, Gaithersburg, MD, США): спустя 48 ч клетки промывали и тестировали. Чистота ДК, определявшаяся с помощью клеточного сортера с возбуждением флуоресценции, измеряющего параметры поверхностных маркеровFACS были найдены следующие типы ДК: CD3-,CD19-, CD56-, CD14- и HLA-DR+. Также в пермеабилизованных клетках методом FACS проводили измерение уровня экспрессии ВИЧбелков, кодируемых генами Gag, Env и Tat. Уровень неспецифического связывания изотопно помеченного контрольного иммуноглобулина был таким же, что и при контрольной трансдукции, и при трансдукции конкретной плазмиды. В трех независимых экспериментах заявители обнаружили, что 25-37% ДК, трансдуцированных вирусом HIV-1/LWint-, экспрессировали белки Gag, Env и Tat. Следовательно, 25-37% клеток в образце, претерпевшем трансдукцию,экспрессируют ВИЧ-белки. Образцы трансдуцированных и контрольных клеток были также контр-окрашены с использованием антител р 24 и В 7-2, чтобы показать экспрессию антигенов в ДНК, но не в макрофагах. Эти результаты получились на удивление хорошими: при использовании тех же самых методов в отношении другой плазмидной ДНК (кодирующей под контролем CMV гемагглютинин, детерминируемый геном вируса гриппа) эти белки экспрессируются лишь 5-8% трансфицированных клеток. Эти результаты показали, что дефектный ВИЧ может быть эффективно экспрессирован трансдуцированными ДК. 2. ДНК, кодирующая дефектные по репликации вирусы, как более эффективные антигены по сравнению с ДНК, кодирующими один или несколько вирусных белков. В независимом эксперименте заявители провели сравнение экспрессии двух различных ВИЧ-плазмид в ДК: HIV-1/LWint- и LTR-tat. Обе эти конструкции регулируются одним и тем же промотором - HIV-1-LTR, - и экспрессия обеих конструкций зависит от трансактивацииTat. Трансфекция была осуществлена в соответствии с описанным в примере 1, а спустя 48 ч экспрессию белка Tat анализировали методомFACS. Заявители обнаружили, что 32% ДК,трансфицированных плазмидой HIV-1/LWint-,экспрессировали белок Tat. Напротив, только 10% клеток ДК, трансфицированных конструкцией LTR-tat, экспрессировали тот же самый белок Tat. Эти результаты признаются удивительными, потому что в данном сравнительном эксперименте ожидалась одинаковая эффективность работы двух разных конструкций. Дефектные по репликации вирусы определенно характеризуются способностью образовывать вирусные частицы, которые могут выходить из клетки. Поскольку презентация антигена зави 003832 22 сит от экспрессии гена в ДК, то проведенный эксперимент отчетливо свидетельствует о том,что молекулы ДНК, кодирующей дефектные вирусы, являются более эффективными антигенами, чем молекулы ДНК, кодирующей один или большее число вирусных белков. 3. Активация новых цитотоксических лимфоцитов в трансдуцированных культивируемых ДК in vitro. После осуществления трансдукции ДК культивировали с аналогичными Т-клетками в соотношении 1:10. Спустя 7 дней эти Т-клетки использовали в качестве эффектора, призванного лизировать популяцию моноцитов/макрофагов, происходящую от того же донора, которую активировали белком р 55 - белком BИЧ,используемым в качестве стандартного маркера. Такая активность цитотоксических лимфоцитов(ТCL) была измерена с применением теста "Crrelase". Как видно из фиг. 5, ТCL индуцированные трансдуцированными ДК, специфическим образом и эффективно лизируют клеткимишени. Поскольку индукция ТCL в условиях invitro более затруднительна, чем in vivo, проведенные эксперименты показали, что клетки,которые были подвергнуты генетической иммунизации, могут активировать новые ТCL таким образом, чтобы они эффективно лизировали инфицированные клетки in vivo. Более того,проведенный эксперимент также показал, что ДНК, кодирующая дефектный вирус, не только эффективно экспрессирует гены ВИЧ, но и также может эффективно генерировать иммунный ответ. 4. Генетическая иммунизация ex vivo с использованием трансдуцированных ДК. Для целей оценки эффективности генетической иммунизации обезьян in vivo дендритные клетки были получены на материале 40 мл периферической крови, взятой у свинохвостых макак. Клетки трансфицировали плазмидойLW/int- с использованием полиэтиленимина в соответствии с описанным в примере 5. Трансфицированные ДК промывали и инъецировали свинохвостым макакам через 36-48 ч после трансфекции. Одну часть трансфицированных ДК инъецировали подкожно и одну часть инъецировали внутривенно. Спустя 4 недели и только после единственной попытки иммунизации у одной из обезьян уже был выявлен ответ по индукции ТCL (фиг. 6): это подтверждает, что результаты, полученные в модели in vitro, могут быть воспроизведены на животных in vivo. С другой стороны, неполные ВИЧ-вакцины, применяемые в настоящее время в клинических испытаниях в фазе III, не проявляют активности по индукции какого-либо ТCL-ответа, даже после неоднократных попыток иммунизации. 5. Опосредованный полиэтиленимином перенос генов в культивируемые дендритные клетки. 23 Дендритные клетки были трансдуцированы плазмидой, кодирующей HIV-1/LWint- в соответствии с описанным в примере 1, за исключением того, что полиэтиленимин (PEI был любезно предоставлен Д-ром Бером) был использован вместо липофектамина. Клетки были протестированы так же, как это было описано в примере 1, и более чем 60% дендритных клеток,трансдуцированных с помощью полиэтиленимина, экспрессировали белки вируса ВИЧ-1 в противоположность 25-37% клеток, трансдуцированных с использованием липофектамина. Поскольку до настоящего времени применение липофектамина считалось наилучшим способом переноса генов, предназначенного для внесения плазмидной ДНК в ДК, проведенный эксперимент показал, что PEI является самой эффективной невирусной ген-доставочной системой,предназначенной для переноса генов в ДК. Однако и PEI, и липофектамин проявляют значительный уровень токсичности по отношению к дендритным клеткам, на что указывают данные теста с окрашиванием трипановым синим. 6. Специфическое распознавание ДК с помощью рецептора маннозы. Недифференцированные ДК были получены в соответствии с описанным в примере 1 и трансфицированы молекулами ДНК, кодирующими зеленый флуоресцирующий белок (GFP). Заявители использовали эту ДНК в качестве маркера генной экспрессии, потому что клетки,экспрессирующие этот зеленый флуоресцирующий белок, светятся зеленым светом в ответ на стимуляцию флуоресценции. Следовательно,трансфицированные клетки могут быть визуализованы с помощью флуоресцентной микроскопии и проточной цитометрии на прибореPEI, модифицированный различными углеводами, был выбран с целью маркирования рецептора маннозы на поверхности дендритных клеток, поскольку рецептор маннозы распознает все параметры углеводов на поверхности бактерий, паразитов, дрожжей и грибов. ДНК соединяли с PEI и с различными полиэтилениминами,несущими углеводы (приобретены у д-ра Ж.-П. Бера (J.-P. Behr, Lab. Chim. Genet., Fac. Pharm.,CNRS UMR 7514, 74 route Rhin, F-67401 Illkirch,Франция). ДНК в количестве 2 мкг инкубировали с различными производными PEI в 150 мМNaCl (N:P-соотношение - 10:1) при комнатной температуре в течение приблизительно 5 мин. Затем ДК трансдуцировали полученными комплексами в течение 6 ч, промывали и анализировали флуоресцирующие зеленым цветом клетки спустя 48 ч. Было обнаружено, что наиболее эффективной углеводной модификацией 24 Таблица 1 Использование различных комплексов для трансдукции дендритных клеток in vitro% клеток, экспрессируюЭксперимент щих зеленый флуоресцирующий белок 1. Контроль 4 3. PEI-манноза-ДНК 43 4. PEI-галактоза-ДНК 23 5. PEI-глюкоза-ДНК 19 7. Опосредованный PEI-маннозой перенос генов in vitro в культивируемые дендритные клетки. Несущий остаток маннозы полиэтиленимин (PEI-манноза) является изотиоцианантофенилфенильным производным маннозы, присоединенным к PEI с молекулярной массой 25 кД, в результате чего образуется искомый лиганд(или остаток маннозы с низким уровнем аффинности по отношению к рецептору маннозы - 1 мМ). Ранее было установлено, что проникновение, опосредуемое рецептором асиалогликопротеином (используемым PEI) нуждается в том,что проникающий комплекс был заряжен. Следовательно, нужно использовать большее количество PEI по сравнению с ДНК. Если комплекс является нейтральным (т.е. PEI нейтрализован ДНК), то такой комплекс не способен проникать с помощью рецептора асиалогликопротеина(М.А. Zanta, О. Boussif, A. Adib, J.P. Behr, Nov.Dec. 1997, Bioconjug Chem., 8(6), 839-844). Эти исследователи сформировали нацеленный на гепатоциты комплекс: он характеризуется некоторыми ключевыми свойствами, которые, как предполагается, будут давать преимущество в доставке генов в печени: 1) электростатически нейтральные частицы, которые избегают неспецифического связывания на других клетках; и 2) избегание эндоцитоза, опосредуемого рецептором асиалогликопротеином. Эта система была основана на 5%-ном несущем галактозу полиэтилениминовым (PEI-галактоза) полимером,который сочетали с плазмидной ДНК так, чтобы достичь нейтральности. Было установлено, что при использовании комплексов PEI-манноза-ДНК меньшее количество ДНК необходимо для нейтрализации PEIманнозы по сравнению с собственно PEI. Тестирование с помощью гель-электрофореза в условиях различных соотношений N:P в комплексах РЕI-ДНК показало, что при соотношенииN:P=5:1 комплекс "РЕI-манноза:ДНК" характеризуется нейтральным зарядом в противоположность величине N:P=3:1 комплекса РЕIДНК. Нейтрализация PEI с помощью ДНК зависит от соотношения N:P (азот: фосфат): 1 мкг ДНК= 3 х 109 молярного Р и 1 мМ PEI=109 молярного N на 1 мкл. Это означает, что, например, соотношение 10:1 соответствует смеси 3 мкл 10 мМ PEI и 1 мкг ДНК. 25 Дендритные клетки человека были выделены в соответствии с описанным выше. Чистота ДК, оценивавшаяся с помощью FACS, составила 99%. Путем измерения жизнеспособности клеток с помощью окрашивания трипановым синим было обнаружено, что комплекс PEIманноза характеризовался меньшим уровнем токсичности по сравнению с PEI. Также было установлено, что и PEI, и PEI-манноза способны вносить ДНК внутрь ДК, однако, более эффективный является комплекс PEI-манноза. При соотношении N:P=5:1 комплекс PEI-маннозаДНК является нейтральным: следовательно,данный комплекс способен проникать в ДК только опосредованно через рецептор маннозы. В этих условиях 30% ДК экспрессировали зеленый флуоресцирующий белок. С другой стороны, комплекс РЕI-ДНК при соотношенииN:P=5:1 имеет заряд: соответственно, он проникает в клетки через с участием рецептора асиалогликопротеина. В этих условиях 14% ДК экспрессировали зеленый флуоресцирующий белок(фиг. 4). 8. Доставка генов in vivo в клетки Лангерганса кожи. В коже единственными клетками, которые способны к эндоцитозу маннозилированных лигандов, являются клетки Лангерганса. Следовательно, основная проблема связана с тем, может ли комплекс PEI-манноза проникать в кожу и трансфицировать in vivo клетки Лангерганса. Был сформирован комплекс PEI-манноза и ДНК, кодирующей зеленый флуоресцирующий белок (GFP). Эксперименты с различными гендоставочными комплексами были проведены в соответствии с изображенным на фиг. 3. Комплекс включал 50 мкг ДНК и 8,25 мкл 100 мМ(оптимальная концентрация - 8%). Мышей линии BALB/c усыпляли, и им выбривали спину. Комплексы наносили на кожу в количестве 0,1 мл на 1 ч или вводили подкожно в соответствии с обозначенным в табл. 2. Через 6 ч после иммунизации мышей умерщвляли, а образцы кожи помещали в среду DMEM, к которой добавляли 10% плодной телячьей сыворотки и антибиотики. В этих условиях клетки, включая клетки Лангерганса, мигрируют из кожи. Спустя один день мигрировавшие клетки отбирали и анализировали методом проточной цитометрии на приборе FACS: такой анализ может позволить распознать клетки, экспрессирующие зеленый флуоресцирующий белок. В проведенном анализе были протестированы только крупные и плотные клеточные популяции, потому что и дендритные клетки, и клетки Лангерганса известны как крупные, образующие плотные скопления клетки.% клеток, экспрессиЭксперимент рующих зеленый флуоресцирующий белок 1. Контроль 0,84 2. РЕI-ДНК подкожно 0,20 3. ДНК подкожно 1,74 4. РЕI-ДНК через кожу 6,52 5. ДНК через кожу 29,10 6. РЕI-манноза-ДНК 22,99 через кожу Проведенные эксперименты показали, что 1) доставка гена через кожу обусловливает более эффективный перенос гена в клетки Лангерганса, чем доставка путем подкожной инъекции(сравнение результатов экспериментов 2/4 или 3/5). Это важно потому, что одна из наилучших современных методологий вакцинаций основана на подкожных инъекциях. 2) Проникновение через рецепторы маннозы является более эффективным с точки зрения трансфекции клеток Лангерганса in vivo по сравнению с проникновением опосредованно через рецептор асиалогликопротеинов (сравнение результатов экспериментов 4/6). Проведенные эксперименты invivo подтвердили данные, полученные в экспериментах in vitro (см. фиг. 4). Следовательно,модифицированная углеводом ген-доставочная система является предпочтительной для трансдукции антиген-презентирующих клеток. 9. Миграция трансдуцированных клеток Лангерганса в лимфатические узлы. Мыши линии BALB/c были подготовлены так же, как это описано в примере 8: комплексPEI-манноза-ДНК в количестве 0,1 мл наносили на кожу на 1 ч. Спустя 2 дня животных умерщвляли и удаляли у них лимфатические узлы (ЛУ). Подмышечные ЛУ анализировали потому, что они являются локальными ЛУ для спинной части тела и в них должны быть обнаружены соответствующие мигрирующие клетки Лангерганса. ЛУ замораживали, измельчали и анализировали под флуоресцентным микроскопом. ЛУ экспериментальных мышей сравнивали с ЛУ контрольных особей. Заявители идентифицировали примерно 15 флуоресцирующих зеленым светом клеток, расположенных в коже: эти клетки характеризовались способностью мигрировать в ЛУ и экспрессировать зеленый флуоресцирующий белок. Морфология этих "зеленых" клеток напоминала морфологию ДК: они были крупными клетками и характер распределения флуоресценции зеленого цвета имел "неровный" тип, характерный и для ДК (другие клетки, например, клетки линии 293, проявляют рассеянные по цитоплазме параметры зеленой флуоресценции) . Кроме того, клетки Лангерганса являются единственным типом клеток,способных воспринимать антигены и мигриро 27 вать с ними к ЛУ. Эти клетки также были единственными клетками кожи, несущими рецептор маннозы, необходимый для восприятия доставочного комплекса, после активации которого известна миграция этих клеток к ЛУ. Проведенные эксперименты показывают,что комплексы PEI-манноза-ДНК способны проникать через кожу и доставлять ДНК в клетки Лангерганса. Клетки Лангерганса были активированы и мигрировали в местный ЛУ, экспрессируя по достижении ЛУ гены из состава входящей в данные конструкции ДНК. Известно, что реинъецированные в тело культивировавшиеся ДК мигрируют к ЛУ и генерируют эффективный иммунный ответ. В настоящем изобретении показано, что выделение ДК in vitro не является необходимым для переноса генов в клетки Лангерганса или для обеспечения экспрессии генов в органах лимфатической системы. Также заявителями было показано, что экспрессия в ДК дефектного по репликации вируса обусловливает эффективную индукцию ответа по цитотоксическим Т-лимфоцитам и invitro, и in vivo (см. выше). Следовательно, было показано, что доставка генов через кожу с использованием молекулярных комплексов (подобных комплексам PEI-манноза-ДНК) может быть использована с целью генерирования иммунных ответов в отношении белков, кодируемых данной ДНК. 10. Комплексы ДНК-углевод, предназначенные для трансдукции клеток Лангерганса кожи. Результаты экспериментов, приведенные в табл. 2, подтверждают, что комплекс ДНКуглевод в отсутствие PEI-маннозы может быть использован для трансдукции клеток Лангерганса in vivo. Соединенная с углеводом ДНК в отсутствие PEI оказывается более эффективной при использовании в способах введения подкожно или через кожу по сравнению с комплексом ДНК-РЕI (см. табл. 2: эксперименты 3/5). Это считается очень удивительным. Этот результат показывает, что углеводы (например,8%-ная глюкоза, использовавшаяся в данном эксперименте) также может образовывать комплекс с ДНК и доставлять эту ДНК в клетки Лангерганса опосредованно через рецептор маннозы. Важно то, что наиболее эффективная доставка гена в клетки Лангерганса in vivo была сопряжена с использованием комплекса ДНК и углевода при применении введения через кожу. Предполагается, что иммунизация с использованием комплекса ДНК-углевод также должна обусловливать миграцию клеток Лангерганса в местный лимфатический узел. Основанием для такого предположения является то,что такой же механизм используется при проникновении в клетки Лангерганса - при проникновении опосредованно через рецептор маннозы. Преимущества использования углеводов в качестве адъювантов в применяемых в настоя 003832 28 щее время методиках вакцинации связаны с тем,что более значительная доля клеток Лангерганса будет вовлечена в генерирование иммунного ответа. Это, как можно предположить, обусловит повышение эффективности существующих методологий вакцинации. Примером является смешивание с углеводами вакцин, предназначенных для подкожного, через кожу и внутримышечного инъецирования ДНК и белковых антигенов. 11. Применение иммунизации через кожу. Данная технология должна обусловить настоящую революцию в способах иммунизации,поскольку она не требует применения игл и шприцов (инъекций). Описанная в настоящем изобретении иммунизация через кожу является очень простым способом, который может быть применен для экономичной вакцинации и в развитых, и в развивающихся странах. Простота данной методологии и тот факт,что антиген-презентирующие клетки подвержены эффективной трансдукции, позволяют использовать любые последовательности ДНК,способные генерировать иммуногенный белок. Соответственно, широчайший спектр заболеваний может стать мишенью для иммунизации,например, инфекционные заболеваний и раковые заболевания. Единственным путем искоренения инфекционных заболеваний, таких как ВИЧинфекция, гепатит, малярия, является применение простой и дешевой вакцинации населения. Вакцины, введение которых не требует проведения "уколов", будут особенно привлекательны для родителей маленьких детей. В принципе, применение настоящего изобретения позволяет разрабатывать безопасные вакцины. Изредка встречающиеся негативные проявления в ответ на классические вакцины обусловливаются аллергическими реакциями на побочные продукты, связанные с процессом производства вакцины. Когда такие дополнительные материалы (яичный альбумин, например) могут быть исключены, частота негативных реакций может быть соответствующим образом снижена. Данный подход может быть применен для иммунизации в ходе лечения заболеваний как в сочетании с химиотерапией, так и без нее. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ген-доставочный комплекс для чрескожной доставки чужеродного генетического материала в антиген-презентирующие клетки(АПК), содержащий чужеродный генетический материал и носитель невирусной природы, причем носитель имеет специфическую аффинность по отношению к чужеродному генетическому материалу и рецептору, локализованному на антиген-презентирующей клетке. 29 2. Ген-доставочный комплекс по п.1, где чужеродный генетический материал представлен молекулой ДНК, кодирующей зависимый от обратной транскриптазы вирус или мутантный зависимый от обратной транскриптазы вирус. 3. Ген-доставочный комплекс по п.2, где чужеродный генетический материал представлен молекулой ДНК, кодирующей, по крайней мере, один белок дефектного по репликации и/или дефектного по сборке вируса иммунодефицита человека. 4. Ген-доставочный комплекс по п.3, где чужеродный генетический материал представлен молекулой ДНК, кодирующей, по крайней мере, один белок негативного по интегразе мутанта дитропного первичного изолята вируса иммунодефицита человека. 5. Ген-доставочный комплекс по п.4, где ДНК включает один или несколько стопкодонов в одной или нескольких рамках считывания гена интегразы. 6. Ген-доставочный комплекс по п.1, выбранный из группы, включающей конъюгаты ДНК с сахарами, такими как глюкоза, полиэтиленимином, производными полиэтиленимина,такими как модифицированный сахаром полиэтиленимин, и их смесями. 7. Ген-доставочный комплекс по п.1, где антиген-презентирующей клеткой является клетка Лангерганса или дендритная клетка. 8. Ген-доставочный комплекс по п.1, где рецептором, локализованным на АПК, является рецептор маннозы. 9. Способ трансдукции клеток чужеродным генетическим материалом, отличающийся тем,что чужеродный генетический материал включен в ген-доставочный комплекс по любому из пп.1-8. 10. Способ получения чужеродного генного продукта in vitro, отличающийся тем, что включает(а) трансдукцию антиген-презентирующей клетки-мишени в соответствии со способом по п.9 и(б) культивирование указанной трансдуцированной антиген-презентирующей клетки Фиг. 1 30 мишени в условиях, обеспечивающих экспрессию целевого чужеродного генного продукта. 11. Способ профилактической и терапевтической иммунизации животного путем введения животному ген-доставочного комплекса по любому из пп.1-8. 12. Способ профилактической и терапевтической иммунизации животного против инфекции, вызванной ретровирусом, отличающийся тем, что включает следующие стадии: выделение дендритных клеток из организма животного; обеспечение взаимодействия указанных клеток с ген-доставочным комплексом по любому из пп.1-8 и повторное введение этих клеток в организм животного. 13. Способ профилактической и терапевтической иммунизации животного против инфекции, вызванной ретровирусом, путем введения животному ген-доставочного комплекса по любому из пп.1-8 через кожу или слизистые оболочки. 14. Способ лечения пациента с активной вирусной инфекцией, такой как, например,ВИЧ-инфекция, отличающийся тем, что включает следующие стадии: введение пациенту, нуждающемуся в таком лечении, определенного сочетания лекарственных средств, подходящих для снижения вирусного титра; иммунизацию пациента ген-доставочным комплексом по любому из пп.1-8 и продолжение лечения с использованием определенного сочетания лекарственных средств, подходящих для снижения вирусного титра, до развития иммунного ответа и мониторинг вирусного титра у данного пациента и, в случае восстановления вирусного титра, возобновление лечения указанным сочетанием лекарственных средств или другим сочетанием лекарственных средств, подходящих для снижения вирусного титра, и иммунизацию пациента ген-доставочным комплексом по любому из пп.1-8.
МПК / Метки
МПК: C12N 15/11, A61P 31/14, A61K 48/00
Метки: доставки, ген-доставочный, комплекс, генетического, использования, чужеродного, способы, клетки, чрескожной, материала, антиген-презентирующие
Код ссылки
<a href="https://eas.patents.su/17-3832-gen-dostavochnyjj-kompleks-dlya-chreskozhnojj-dostavki-chuzherodnogo-geneticheskogo-materiala-v-antigen-prezentiruyushhie-kletki-i-sposoby-ego-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Ген-доставочный комплекс для чрескожной доставки чужеродного генетического материала в антиген-презентирующие клетки и способы его использования</a>