Способ двухстадийной промывки газа
Формула / Реферат
1. Способ отмывки сернистого водорода и диоксида углерода из газа, получаемого посредством газификации углеродсодержащей биомассы, который включает:
а) обеспечение контакта газа с первым абсорбирующим раствором, содержащим ионы переходных металлов, причем переходные металлы выбраны из меди, цинка, железа, кобальта и их смесей, в кислом водном растворе, и связывание сернистого водорода с первым абсорбирующим раствором;
в) извлечение газа из стадии а);
г) обеспечение контакта газа, извлеченного на стадии в), со вторым абсорбирующим раствором, содержащим органический растворитель, при температуре, составляющей от -40 до 50°С, и связывание диоксида углерода со вторым абсорбирующим раствором;
е) извлечение промытого газа из стадии г).
2. Способ по п.1, отличающийся тем, что концентрация ионов переходных металлов в промывочном растворе меньше примерно 1000 мас.ч./млн, предпочтительно меньше примерно 100 мас.ч./млн, в пересчете на массу первого абсорбирующего раствора.
3. Способ по п.1 или 2, отличающийся тем, что ионы переходных металлов являются ионами меди, предпочтительно в форме CuSO4.
4. Способ по п.1, отличающийся тем, что контакт газа с первым абсорбирующим раствором происходит при температуре, составляющей от 10 до 80°С, и при давлении, составляющем от 1 до 50 бар.
5. Способ по п.1, отличающийся тем, что контакт газа со вторым абсорбирующим раствором происходит при температуре, составляющей от -30 до -10°С.
6. Способ по любому из предыдущих пунктов, отличающийся тем, что концентрация H2S в газе, извлеченном на стадии е), меньше 20 ч./млрд, предпочтительно меньше 1 ч./млрд.
7. Способ по п.1, отличающийся тем, что первый и/или второй абсорбирующий раствор регенерируют после извлечения газа.
8. Способ получения углеводородов или их производных из сырьевого материала в форме биомассы, включающий:
а) газификацию сырьевого материала в форме биомассы в присутствии кислорода и/или пара с получением газа, содержащего монооксид углерода, диоксид углерода, водород, воду и углеводороды;
б) промывку газа, полученного на стадии а), с использованием способа по п.1;
в) преобразование в реакторе для химического синтеза по меньшей мере значительной части монооксида углерода и водорода, содержащихся в газе, в продукт, выбранный из углеводородной композиции и производных углеводородов;
г) извлечение углеводородов или их производных в качестве продукта.
9. Способ по п.8, дополнительно включающий после стадии а) стадию а1) риформинга смол.
10. Способ по п.8 или 9, дополнительно включающий после стадии а1) стадию а2) удаления компонентов смол, например нафталина, из газа.
11. Способ по пп.8, 9 или 10, дополнительно включающий после стадии а2) стадию а3) регулирования соотношения водорода и монооксида углерода.
12. Способ по пп.8, 9, 10 или 11, отличающийся тем, что стадии б) предшествует стадия гидролиза карбонилсульфида.
13. Способ по любому из предыдущих пунктов, отличающийся тем, что второй абсорбирующий раствор содержит органический растворитель, выбранный из метанола, этанола, калиевых солей диэтиламиноуксусной кислоты и диметиламиноуксусной кислоты, натриевой соли 2-аминопропановой кислоты, натриевых солей аминопропионовой кислоты и натрия фенолята, трибутилфосфата, пропиленкарбоната, N-метилпирролидона или их смесей.
14. Способ по любому из предыдущих пунктов, отличающийся тем, что второй абсорбирующий раствор, содержащий органический растворитель, содержит метанол, предпочтительно состоит, по существу, из метанола.
Текст
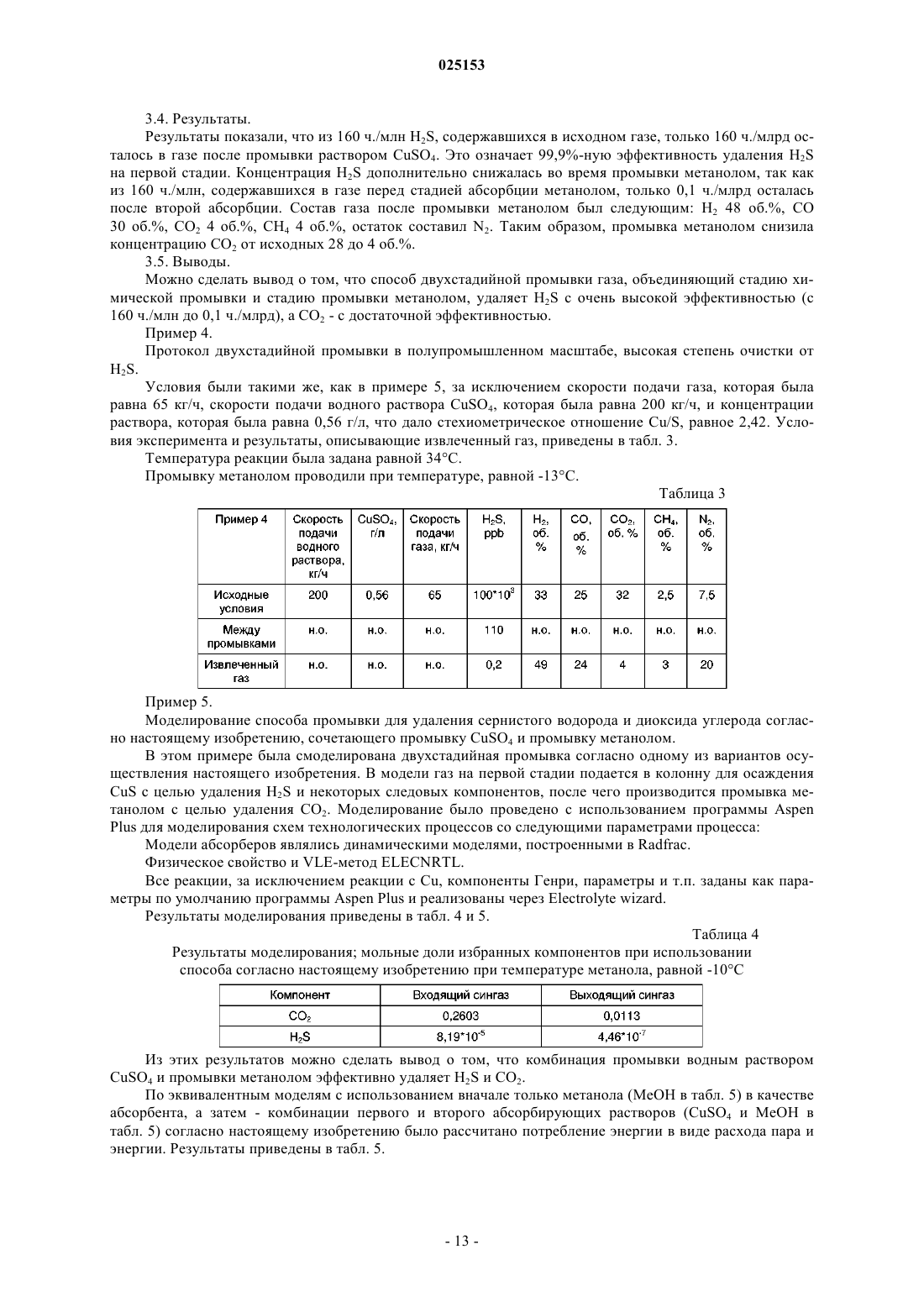
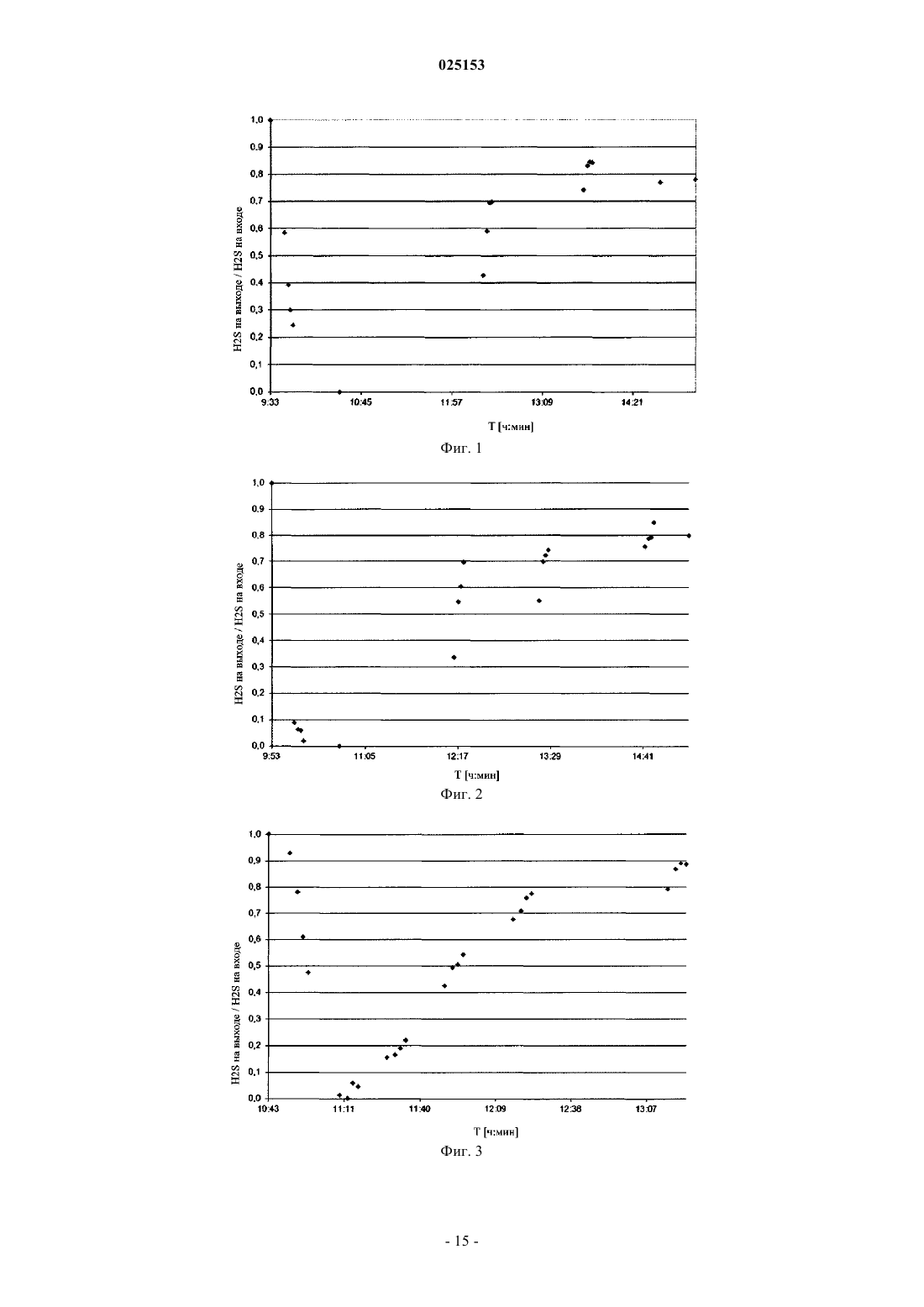
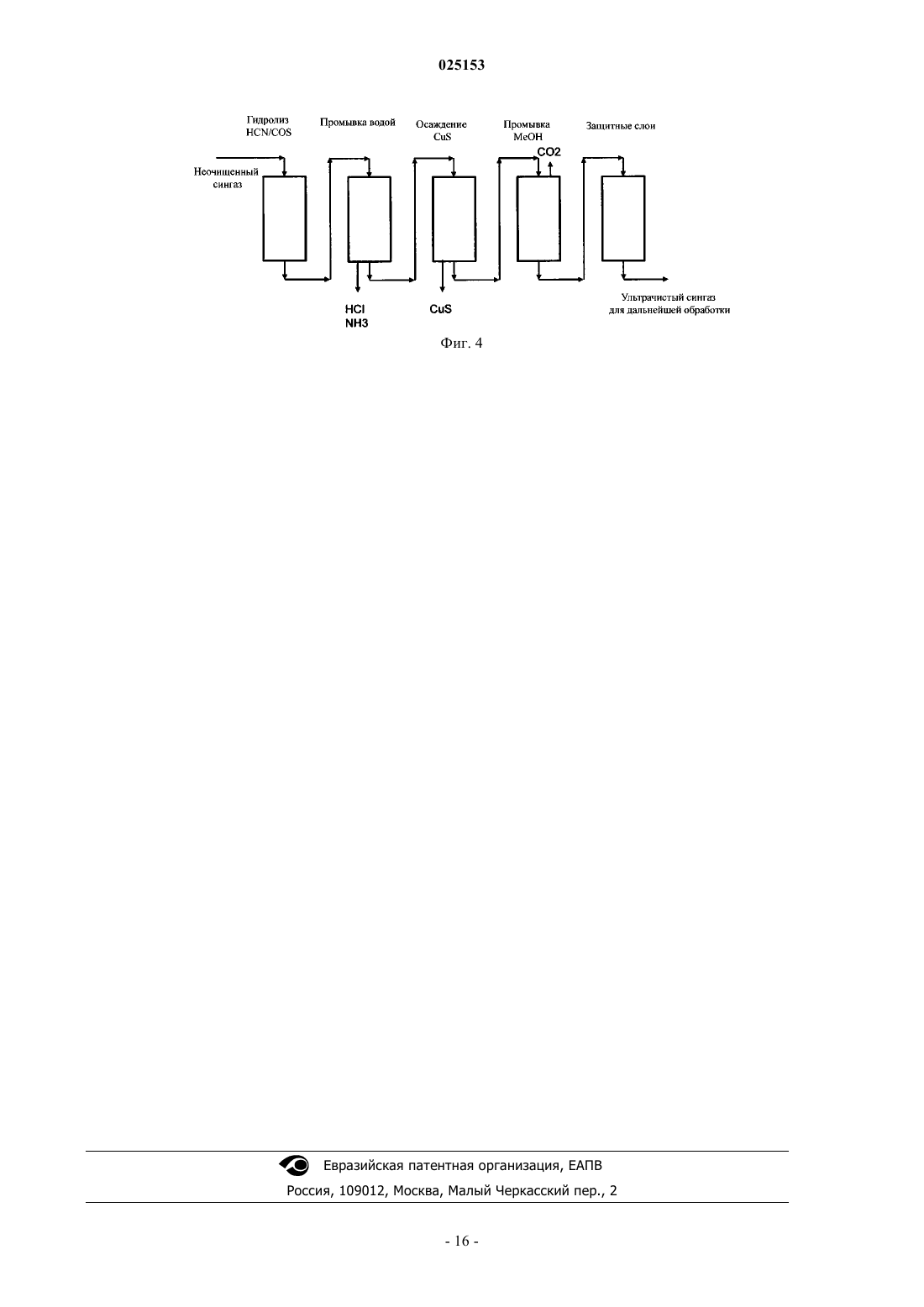
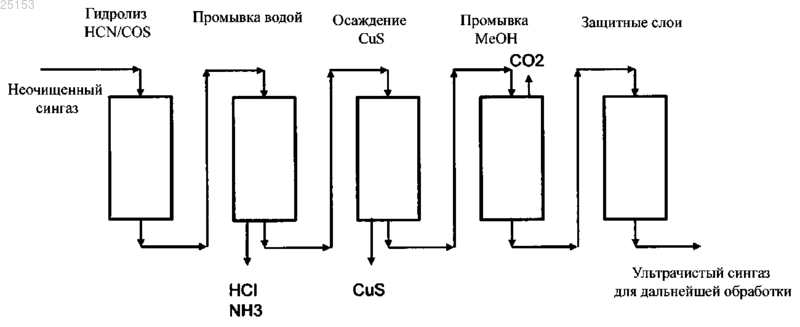
СПОСОБ ДВУХСТАДИЙНОЙ ПРОМЫВКИ ГАЗА Изобретение относится к области получения углеводородов посредством газификации углеродсодержащего материала. Оно обеспечивает способ двухстадийной промывки газа в качестве части очистки газа. Более конкретно, описан способ удаления сернистого водорода и диоксида углерода из синтез-газа, полученного посредством газификации. Предложено использование новой комбинации подходов к промывке для этой прикладной задачи. В качестве специфической прикладной задачи данный процесс используют как часть процесса превращения биомассы в жидкость (BTL). Область техники Настоящее изобретение относится к области получения углеводородов посредством газификации углеродсодержащего материала. Оно обеспечивает способ двухстадийной промывки газа в качестве части процесса очистки сингаза. Более конкретно, описан способ удаления сернистого водорода и диоксида углерода из синтез-газа, полученного посредством газификации. Предложено использование новой комбинации подходов к промывке для этой прикладной задачи, один из которых включает химическую реакцию, а другие основаны на физической абсорбции. В качестве специфической прикладной задачи этот процесс используют как часть процесса превращения биомассы в жидкость (BTL, от англ. "biomass toliquid"). Предшествующий уровень техники При газификации углеродсодержащего материала преимущественно образуются монооксид углерода и водород - смесь, известная под названием сингаз. Диоксид углерода, вода и различные углеводороды являются распространенными побочными продуктами в продукте газификации. В зависимости от источника и состава углеродсодержащего сырьевого материала и условий газификации концентрации побочных продуктов и производных, обычно присутствующих в качестве загрязнений, могут быть разными, что влияет на стратегии очистки. В процессе газификации серу и ее производные, происходящие из биомассы, в основном преобразуют в сернистый водород (H2S) и карбонилсульфид (COS). По сравнению с газификацией каменного угля газификация сырьевого материала, являющегося биомассой, обеспечивает очень низкие концентрации сульфидных, относительно низкие концентрации азотистых и низкие концентрации зольных загрязнений. Концентрация диоксида углерода обычно выше, чем при газификации каменного угля. Эти концентрации загрязнений все еще остаются вредными для дальнейшей химической переработки, и газ необходимо очищать. Снижение концентрации сернистого водорода является обязательным для функционирования катализаторов на последующих стадиях очистки сингаза. С другой стороны, диоксид углерода, как правило, не участвует в последующих реакциях. Причина удаления СО 2 связана с оптимизацией потоков и снижением объемов рециркулируемых потоков и размеров оборудования. В этом случае трудно использовать стратегии, используемые при газификации каменного угля. Диоксид углерода, сернистый водород и карбонилсульфид совместно называют кислым газом, поскольку они растворяются в воде с образованием кислот. Одним из наиболее распространенных способов очистки газа является абсорбция, которую используют для удаления кислого газа из природного газа и синтез-газа. Показано, что при очистке синтез-газа, полученного из биомассы, абсорбция с использованием жидкого растворителя является более эффективной, чем абсорбция твердыми веществами. Для физической абсорбции обычно используют органические растворители при низких температурах и высоком давлении. Грубо говоря, чем выше давление, чем ниже температура, и чем выше степень чистоты абсорбента, тем лучше эффект промывки. Для химической абсорбции обычно используют растворы солей мышьяка, различных аминов и карбонатов. Абсорбент обычно регенерируют посредством повышения температуры и/или снижения давления. На предшествующем уровне технике описаны эффективные абсорбенты для удаления кислого газа с использованием, например, метанола. Для того чтобы абсорбция с использованием метанола была эффективной и для исключения потерь абсорбента необходимы низкие температуры. Очень хорошо известным коммерческим процессом с использованием метанола является процесс десульфуризации, продаваемый под торговым названием Rectisol. Процесс десульфуризации Rectisol не требует гидролизаCOS до H2S и может снизить содержание соединений серы в сингазе до относительно низких уровней. Метанол обладает высоким сродством к углеводородам и кислому газу. Он также обладает способностью удалять не только соединения серы и СО 2, но и многие важные микрокомпоненты (карбонилы, HCN),что превращает промывку Rectisol в практичный процесс. Затем сингаз повторно нагревают до примерно 350 С и пропускают через неподвижный слой сорбента для соединений серы, например защитный слойZnO, для дальнейшего снижения содержания соединений серы в сингазе. Большие различия температур в различных фазах процесса требуют больших затрат энергии и удорожают обработку сингаза. На предшествующем уровне техники в публикации ЕР 2223889 описана установка, обеспечивающая дальнейшее развитие многостадийной промывки метанолом в качестве части комбинированного цикла с интегрированной газификацией (IGCC). С использованием описанной установки в многостадийном процессе, являющемся вариантом процесса Rectisol, из газа дополнительно удаляют СО 2. Однако,поскольку процесс относится к области производства энергии, требования к уровню очистки отличаются от требований, предъявляемых в химической промышленности и производстве топлива, где необходима более высокая степень очистки. В другой публикации согласно предшествующему уровню техники (US 2010/163803) описан процесс получения газообразных продуктов из неочищенного синтез-газа, полученного посредством газификации угля и/или тяжелой нефти. Происхождение газа придает ему характерный профиль компонентов. В описании процесса указано, как потоки конвертированного и неконвертированного газа очищают от серосодержащих компонентов и СО 2 в процессе отмывки кислого газа, более конкретно в процессе криогенной промывки метанолом. Также описана аппаратура, подходящая для такого процесса. Серосо-1 025153 держащие компоненты и СО 2 удаляют совместно, промывки не обеспечивают разделения этих компонентов. Кроме физической абсорбции, описанной выше, на предшествующем уровне техники также известна химическая абсорбция. Газ, содержащий большие объемы сернистого водорода, можно освободить от сернистого водорода, вначале направив поток газа в водные растворы, содержащие ионы меди, для абсорбции сернистого водорода, а затем окислив полученный таким образом сульфид меди воздухом или газообразным кислородом с получением элементарной серы. В публикации DE 2304497 согласно предшествующему уровню техники описаны водная абсорбирующая среда, которая содержит довольно высокие концентрации ионов меди (28,9 г Cu в 1400 мл воды), и абсорбция сернистого водорода, осуществляемая посредством пропускания пузырьков газа через водную среду. В другой публикации согласно предшествующему уровню техники (ЕР 0986432 В 1) описан способ избирательного удаления сернистого водорода из газов, одновременно содержащих H2S и СО 2. Если эти компоненты содержались в газе с соотношением СО 2 к H2S, равным 2:1, то таким способом избирательно удаляли 99% H2S. Однако, если указанное соотношение было равно 200:1, то удаление H2S составило 95%. Существует потребность в альтернативном способе удаления сернистых компонентов и диоксида углерода из сингаза, получаемого посредством газификации углеродсодержащего материала, в частности посредством газификации биомассы. Кроме того, существует потребность в удалении сернистых компонентов и диоксида углерода из сингаза энергетически эффективным способом. Также существует постоянная потребность в упрощении, повышении эффективности и выявлении возможностей синергизма вBTL-процессе. Сущность изобретения Авторы настоящего изобретения неожиданно обнаружили, что способ промывки, включающий две различные стадии абсорбции, одна из которых включает химическую абсорбцию, а вторая - физическую абсорбцию, обеспечивает высокочистый продукт при меньших затратах энергии, чем в способах согласно предшествующему уровню техники. В качестве первого аспекта настоящего изобретения предложен способ отмывки сернистого водорода и диоксида углерода из газа, получаемого посредством газификации углеродсодержащей биомассы, включающий: а) обеспечение контакта газа с первым абсорбирующим раствором, содержащим ионы переходных металлов, причем переходные металлы выбраны из меди, цинка, железа, кобальта и их смесей, в кислом водном растворе; б) связывание сульфид-ионов с первым абсорбирующим раствором; в) извлечение газа из стадии б); г) обеспечение контакта газа, извлеченного на стадии в), со вторым абсорбирующим раствором, содержащим органический растворитель; д) связывание диоксида углерода со вторым абсорбирующим раствором; е) извлечение промытого газа из стадии д). Данный способ и варианты его осуществления обладают рядом преимуществ. Одним из преимуществ является технологическая схема процесса, в которой потребность в термическом кондиционировании и теплообменном оборудовании, в частности для охлаждения, значительно снижена по сравнению с процессами, в которых используется только промывка метанолом. Двухстадийная схема промывки необходима из-за высоких концентраций H2S и СО 2, однако неожиданно оказалось, что удаление H2S на первой стадии абсорбции влияет на вторую стадию абсорбции за счет выполнения требований к условиям абсорбции, например - обеспечения более высокой температуры для промывки органическим растворителем. Кроме того, уменьшаются затраты энергии. Поскольку способ согласно настоящему изобретению особенно хорошо подходит для промывки сингаза, получаемого из биомассы, то комбинация промывок, особенно в указанной последовательности,обеспечивает эффективную обработку газа, содержащего высокие молярные концентрации H2S и СО 2. Показано, что этот способ обеспечивает промытый газ, содержащий H2S в концентрации менее 20 частей на миллиард (ч./млрд) и даже в более низких концентрациях - менее 1 ч./млрд. Во втором аспекте настоящего изобретения при использовании в качестве части процесса превращения биомассы в жидкость метод промывки совместно с другими стадиями процесса обеспечивает усовершенствованный способ получения углеводородов или их производных. В этом случае способ включает следующие стадии: 1) газификация сырьевого материала, являющегося биомассой, в присутствии кислорода и/или пара с получением газа, содержащего монооксид углерода, диоксид углерода, водород, воду и углеводороды; 2) необязательно стадия риформинга смол; 3) необязательно удаление компонентов смол, например, нафталина, из газа; 4) необязательно регулирование соотношения водорода и монооксида углерода; 5) промывка по п.1 формулы изобретения; 6) преобразование в реакторе для химического синтеза по меньшей мере значительной части монооксида углерода и водорода, содержащихся в газе, в продукт, выбранный из углеводородной композиции и производных углеводородов; 7) извлечение продукта. Если синтез на стадии 6) является синтезом Фишера-Тропша (ФТ), то стадия 5) протокола промывки снижает содержание кислых газов в газе, подаваемом в процесс синтеза Фишера-Тропша, до концентраций порядка 20 ч./млрд, что соответствует требованиям катализаторов, используемых в синтезе Фишера-Тропша, а концентрация СО 2 достаточно низка для того, чтобы была исключена его аккумуляция в процессе. Краткое описание графических материалов Фиг. 1 иллюстрирует эксперимент, состоявший в обеспечении контакта газа с первым абсорбирующим раствором (в данном случае с водным раствором CuSO4), связывании H2S этим раствором и извлечении газа согласно стадиям а), б) и в) из п.1 формулы изобретения. На фигуре показан график зависимости отношения молярной концентрации H2S на выходе из промывочного резервуара к молярной концентрации H2S на входе в промывочный резервуар от времени [ч:мин]. Эксперимент был начат в 9:33, и последний результат был получен в 15:11. Фиг. 2 иллюстрирует другой эксперимент, состоявший в обеспечении контакта газа с первым абсорбирующим раствором (в данном случае с водным раствором CuSO4), связывании H2S этим раствором и извлечении газа согласно стадиям а), б) и в) из пункта 1 формулы изобретения. На рисунке показан график зависимости отношения молярной концентрации H2S на выходе из промывочного резервуара к молярной концентрации H2S на входе в промывочный резервуар от времени [ч:мин]. Эксперимент был начат в 9:53, и последний результат был получен в 15:16. Фиг. 3 иллюстрирует другой эксперимент, состоявший в обеспечении контакта газа с первым абсорбирующим раствором (в данном случае с водным раствором CuSO4), связывании H2S этим раствором и извлечении газа согласно стадиям а), б) и в) из пункта 1 формулы изобретения. На рисунке показан график зависимости отношения молярной концентрации H2S на выходе из промывочного резервуара к молярной концентрации H2S на входе в промывочный резервуар от времени [ч:мин]. Эксперимент был начат в 10:43, и последний результат был получен в 13:22. Фиг. 4 содержит простую блок-схему варианта осуществления способа удаления H2S и СО 2 в виде двухстадийного процесса согласно настоящему изобретению. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение обеспечивает новый способ отмывки сернистого водорода (H2S) и диоксида углерода (СО 2) из газа, получаемого посредством газификации углеродсодержащей биомассы. Характерным для данного способа является то, что он включает две последовательные промывки, одна из которых включает химическую реакцию, а вторая основана на физической абсорбции. Первая промывка включает: а) обеспечение контакта газа с первым абсорбирующим раствором, содержащим ионы переходных металлов, причем переходные металлы выбраны из меди, цинка, железа, кобальта и их смесей, в кислом водном растворе; б) связывание сульфид-ионов с первым абсорбирующим раствором; в) извлечение газа из стадии б). Первая промывка избирательно удаляет из газа сернистый водород. Эффективность удаления является высокой. По меньшей мере 90%, предпочтительно по меньшей мере 95%, сернистого водорода, содержащегося в подаваемом газе, может быть удалено на этой стадии. Вторая промывка включает: г) обеспечение контакта газа, извлеченного на стадии в) со вторым абсорбирующим раствором, содержащим органический растворитель; д) связывание диоксида углерода со вторым абсорбирующим раствором; е) извлечение промытого газа из стадии д). Вторая промывка принципиально удаляет диоксид углерода. Поскольку концентрация сернистого водорода уже значительно снижена после первой стадии промывки, то абсорбирующую способность второго абсорбента можно использовать главным образом для удаления диоксида углерода. Авторы настоящего изобретения обнаружили, что концентрация сернистого водорода дополнительно снижается в ходе второй промывки, что позволяет получить извлеченный газ такой высокой степени чистоты, что в некоторых случаях можно исключить защитные слои, удаляющие H2S, перед реакциями синтеза. При использовании способа согласно настоящему изобретению выбор условий для второй промывки может быть менее жестким, чем при проведении соответствующей промывки органическим растворителем изолированно. Для получения желаемых уровней чистоты нет необходимости доводить температуру, давление, рециркуляцию и т.п. до экстремальных уровней. Особенно примечательна температура,при которой был достигнута высокая степень чистоты в эксперименте. Еще одним преимуществом настоящего изобретения является то, что при проведении последовательного удаления H2S вначале и СО 2 после этого, эти отдельные процессы являются, по существу, независимыми друг от друга. В частности, вторую стадию промывки можно довести до уровня чистоты, требующегося для дальнейшей обработки, не нарушая ультрачистого характера первой стадии абсорбции. Такое независимое управление процессом удаления кислых газов возможно только при использовании способа согласно настоящему изобретению. При использовании в контексте настоящего изобретения термин "абсорбирующий раствор" относится к промывочной жидкости, используемой для промывки газа. Для целей обработки свежий раствор предпочтительно является истинным раствором, т.е. все его компоненты солюбилизированы в растворителе. Специалисту в данной области техники будет очевидно, что во время использования (в частности,если имеет место химическая реакция) этот абсорбирующий раствор может содержать твердые вещества или преципитаты. Под "связыванием газа с абсорбирующим раствором" преимущественно понимают абсорбцию газа раствором. Сюда относятся все фазы абсорбции, массоперенос из газа на поверхность раздела газрастворитель, растворение газа в жидкой фазе, а в случае химического абсорбента - соответствующая химическая реакция. Двухстадийный способ предпочтительно удаляет по меньшей мере 99% H2S, содержащегося в исходном газе, более предпочтительно по меньшей мере 99,9%. Что касается диоксида углерода, то его удаление составляет по меньшей мере 90%, более предпочтительно по меньшей мере 95% СО 2, содержащегося в исходном газе. При описании способа, измерений и результатов указанные пропорции являются процентными содержаниями в общем объеме сухого газа, если не указано иное. Иллюстрация способа приведена на фиг. 4, где приведена простая блок-схема варианта осуществления способа удаления H2S и СО 2 в форме двухстадийного способа согласно настоящему изобретению. На фиг. 4 неочищенный сингаз подают в необязательный гидролитический реактор, в котором осуществляется конверсия HCN и COS, затем следует необязательный реактор для водной промывки, из выпускного отверстия которого отводятся водные растворы HCl и NH3. Сущность настоящего изобретения состоит в следующих двух реакторах. Первым из них является реактор, обозначенный на фиг. 4 как блок осаждения CuS. В этом реакторе газ вступает в контакт с разбавленным водным раствором CuSO4. При взаимодействии с сульфид-ионами, происходящими от газообразного сернистого водорода, медь образует CuS, который практически нерастворим в воде и выпадает в осадок из раствора. Извлеченный таким образом газ направляют в блок для промывки метанолом для удаления СО 2. Метанол обладает хорошей способностью удалять кислые газы, однако большая часть газообразного сернистого водорода уже удалена на предыдущей стадии, так что этот блок предназначен исключительно для удаления СО 2. Согласно варианту осуществления настоящего изобретения, изображенному на фиг. 4, газ подают в абсорбер (блок осаждения CuS) из газопромывателя (водная промывка). Первую стадию абсорбции кислым водным раствором можно провести при той же температуре, что и промывку водой, охлаждение необходимо только перед второй промывкой метанолом. Необязательно, ниже по течению относительно этих блоков можно добавить защитный слой (фиг. 4) или несколько защитных слоев для безопасности или на случай аномальных ситуаций. Неожиданно было показано, что сочетание первого и второго абсорбентов по п.1 формулы изобретения обеспечивает желаемый уровень чистоты и раздельное извлечение СО 2 и H2S со снижением затрат энергии по сравнению с одностадийной промывкой метанолом, в ходе которой осуществляется одновременное удаление H2S и СО 2. Характеристики исходного газа. При очистке сингаза, получаемого посредством газификации биомассы, кислые газы преимущественно состоят из H2S, CO2 и COS. В примере характерного состава газовая композиция, подаваемая для отмывки кислого газа, содержит в качестве основных компонентов (в пересчете на сухой газ) от 20 до 40 об.% Н 2, от 10 до 30 об.% СО, а в качестве загрязнений кислого газа - от 50 до 400 ч./млн H2S, от 20 до 40 об.% СО 2 и от 5 до 50 ч./млн COS и других микрокомпонентов. Особыми характеристиками очищаемого газа, получаемого из биомассы, являются высокие концентрации H2S и СО 2. Если необходимо извлечь эти компоненты по отдельности, то на предшествующем уровне техники предлагается использовать физическую абсорбцию, поскольку химические абсорбенты обычно удаляют СО 2 и H2S одновременно. Ионы переходных металлов. В способе отмывки сернистого водорода и диоксида углерода из газа, получаемого посредством газификации углеродсодержащей биомассы, первая стадия способа включает обеспечение контакта газа с первым абсорбирующим раствором, содержащим ионы переходных металлов в кислом водном растворе. Данная стадия эффективно удаляет H2S. Авторы настоящего изобретения обнаружили, что в кислых водных растворах ионы переходных металлов, например ионы Cu2+, быстро реагируют с H2S в жидкой фазе даже при очень низких концентрациях ионов металлов. Результаты представлены в заявке на патент ЕР 11153704 (еще не опубликована), в которой описан способ очистки газификационного газа (сингаза) посредством абсорбции загрязнений, содержащихся в сингазе, жидкой абсорбционной средой, содержащей ионы металлов, способные связывать сульфид-ионы с образованием твердых сульфидов, обладающих малой растворимостью в воде и водных растворах. Соответственно, вышеуказанные ионы металлов,-4 025153 предпочтительно и преимущественно двухвалентные ионы переходных металлов, обладают способностью переводить сульфиды, содержащиеся в газовой фазе в форме H2S, из газа в первый абсорбирующий раствор. После реакции с этим раствором газ извлекают для дальнейшей обработки. В другом документе согласно предшествующему уровню техники обсуждается теория, в частности,характеристики осаждения, в абзацах с 27 по 43. Однако авторы настоящего изобретения разработали эту идею дальше и показали, что в случае, когда абсорбцию ионами переходных металлов с целью удаления H2S в качестве первой промывки сочетают с промывкой метанолом с целью удаления СО 2, эти две промывки совместно проявляют неожиданный синергизм. Соответственно, во время первой стадии обеспечивают контакт газа с первым абсорбирующим раствором, т.е. с кислым водным промывочным раствором, содержащим ионы переходных металлов, способные связывать сульфид-ионы из сульфидных соединений, содержащихся в газе. Концентрация катионов переходных металлов мала, например, водный раствор имеет концентрацию ионов переходных металлов в диапазоне от примерно 0,00001 до 0,1 М. Значительная часть сульфидных загрязнений, содержащихся в газе, может быть преобразована в сульфиды переходных металлов. Полученные таким образом сульфиды предпочтительно осаждаются в водном растворе, за счет чего сульфидные загрязнения удаляются из газа. Очищенный газ отделяют от водного раствора. Ионы металлов, т.е. катионы, промывочного раствора получают из переходных металлов, выбранных из меди, цинка, железа, кобальта и их смесей. Предпочтительно, промывочный раствор содержит двухвалентные катионы металлов (Ме 2+), меди (Cu2+), цинка (Zn2+) или железа (Fe2+) или их смеси, поскольку эти катионы реагируют с сульфид-ионами (S2) с образованием солей, обладающих очень малой растворимостью в воде. На практике, большинство подходящих солей, используемых в качестве источников катионов металлов, содержат следы других производных металлов, например коммерческая сольCuSO4 содержит также некоторое количество одновалентной меди в форме Cu2SO4. Показано, что медь является относительно дешевой и ее успешно использовали в экспериментальных исследованиях, в частности в форме CuSO4. Ионы переходных металлов получают из водорастворимых солей металлов посредством растворения этих солей в воде. В одном из вариантов осуществления настоящего изобретения водный раствор получают посредством растворения от примерно 1 до 10000 частей, предпочтительно от примерно 50 до 5000 мас.ч. соли металла в 1000000 мас.ч. воды. При использовании для удаления H2S из сингаза, получаемого посредством газификации биомассы,концентрация соединения, содержащего ионы металла, в промывочном растворе может быть меньше примерно 1000 мас.ч./млн, предпочтительно меньше 100 мас.ч./млн, в пересчете на массу абсорбирующей жидкости. Это обеспечивает очень эффективный и рентабельный интегрированный способ удаленияH2S и других указанных выше загрязнений из сингаза. Концентрация ионов Ме 2+ в водном промывочном растворе обычно составляет от примерно 0,00005 моль/л до 0,005 ммоль/л, предпочтительно от примерно 0,0001 до примерно 0,001 моль/л. Водный промывочный раствор является кислым или слабокислым; предпочтительно он имеет рН примерно от 1 до 6,5, в частности примерно от 1 до 5. рН будет варьироваться в указанном диапазоне в зависимости от выбранных катионов металлов. Например, в варианте осуществления настоящего изобретения, в котором источником катионов металла является CuSO4, водный раствор имеет рН по меньшей мере около 3, предпочтительно от 4 до 5. Обычно газ контактирует с промывочным раствором при температуре от 10 до 80 С и давлении от 1 до 50 бар (абсолютное давление). Соответственно, промывку можно проводить при температуре и давлении окружающей среды (от 20 до 25 С и 1 бар(а, хотя также можно использовать данную технологию при более низких температурах (от 10 до менее чем 20 С) и при повышенных температурах (от более чем 25 до 80 С). Давление может превышать 1 бар(а), например, оно может составлять от примерно 1,5 до 50 бар(а). Обычно сингаз, получаемый посредством газификации, извлекают при более высокой температуре,чем указано выше. Поэтому в одном из вариантов осуществления настоящего изобретения газификационный газ охлаждают до температуры, лежащей в вышеуказанном диапазоне (от 10 до 80 С), перед тем как привести его в контакт с промывочной жидкостью. Если температура выше 80 С, то реакция протекает быстро, но осадок образуется в виде очень мелких частиц, которые трудно отделить от промывочной жидкости. Если температура ниже 10 С, то необходимость охлаждения увеличивает эксплуатационные расходы. Существует возможность извлечь некоторое количество тепла, содержащегося в газификационном газе, посредством контакта его с охлаждающей средой, например - с охлаждающей водой, в теплообменнике. Однако, поскольку водная промывка является первой, необходимость в охлаждении существует только для второй промывки, что обеспечивает эффективность использования энергии как в способе промывки согласно настоящему изобретению, так и в общем производстве газа и дальнейшей его очистке. В таких условиях могут также абсорбироваться кислотные соединения, такие как хлористый водо-5 025153 род. Кроме того, водный раствор, содержащий ионы металлов, можно использовать в кислой форме. Поэтому он будет способен абсорбировать другие загрязнения, такие как аммиак (NH3) и хлористый водород (HCl), а также другие щелочные и кислотные загрязнения. Для процесса в целом это является дополнительным преимуществом. Молярное отношение катионов металлов к сульфидным соединениям, содержащимся в газе, подлежащем очистке (например, отношение Me2+/S2- в исходном газе), в характерном случае больше 1, предпочтительно в диапазоне от примерно 1,4 до примерно 6. Неожиданно оказалось, что использование ионов металлов является эффективным, и нет необходимости в большом их избытке, поскольку реакция протекает практически необратимо, так как осажденный MeS уходит из раствора. Технологическое оборудование. Технически контакт газа с первым абсорбирующим раствором, содержащим ионы переходных металлов в кислом водном растворе, может быть осуществлен в тарельчатой или наполненной колонне и/или посредством распыления или атомизации. В первом предпочтительном варианте осуществления настоящего изобретения контакт сингаза с абсорбционной средой происходит при распылении или атомизации абсорбционной среды в газ. Предпочтительно контакт сингаза с абсорбционной средой происходит на поверхности раздела между газом и капельками абсорбционной среды. Во втором предпочтительном варианте осуществления настоящего изобретения газ, подлежащий очистке, в виде пузырьков подают в резервуар с мешалкой, содержащий абсорбционную среду. В третьем варианте осуществления настоящего изобретения можно использовать абсорбционные башни с тарелками и/или набивкой, работающие в противоточном режиме. Конкретный тип оборудования зависит от концентрации ионов металлов в растворе и количества газа и содержания в нем загрязнений. Одним из способов осуществления процесса химической абсорбции является использование химической распылительной абсорбции в сочетании с ситовыми тарелками над секциями распылительной камеры, как описано и показано на фиг. 6 заявки ЕР 11153704. Соответственно, в конкретном варианте осуществления настоящего изобретения, основанном на подходе с использованием распылительной камеры, промывочный раствор контактирует с газом в распылительной камере, имеющей, по существу, вертикальную центральную ось; газ подают в распылительную камеру снизу или сверху и получают с противоположного конца, т.е. он перемещается в направлении центральной оси распылительной камеры. Промывочный раствор подают через распылительные сопла, образующие по меньшей мере две распылительные зоны, расположенные последовательно вдоль центральной оси на различных высотах в распылительной камере. Газ подают в распылительную камеру,например в камеру вышеописанного типа, через газораспределители, расположенные ниже самой нижней распылительной зоны, а сульфид металла удаляют из абсорбера совместно с использованной промывочной жидкостью через выпускное отверстие, расположенное в нижней части камеры. В одном из вариантов осуществления настоящего изобретения, в котором используется регенерация, после абсорбции сульфидов кристаллы MeS и другие твердые вещества отделяют от циркулирующей промывочной жидкости. Блок для промывки с использованием ионов переходных металлов может также состоять из двух секций для водной промывки в присутствии Ме 2+ (пронумерованных в направлении движения потока газа), причем в первой секции используется разбавленная водная промывочная жидкость, содержащая ионы Ме 2+, а во второй секции используется другая водная промывочная жидкость с довольно высокой концентрацией ионов Ме 2+. Необходимое количество ионов Ме 2+ подают в форме водного раствора Ме 2+ во вторую промывочную секцию и обеспечивают его циркуляцию. Синтез-газ из первой промывочной секции подают во вторую промывочную секцию, где почти весь H2S, содержащийся в синтез-газе, удаляется посредством противоточной промывки. Результаты очистки с использованием ионов переходных металлов в кислых водных промывочных жидкостях являются очень хорошими. Способом согласно настоящему изобретению можно удалить значительную долю сернистого водорода из газа. По меньшей мере 98 об.%, предпочтительно по меньшей мере 99,5 об.%, сернистого водорода удаляется из газа. В результате, в предпочтительном варианте осуществления настоящего изобретения концентрация сернистого водорода в газе после первой стадии промывки составляет менее чем примерно 100 объемных частей на миллиард (об.ч./млрд), в частности менее чем примерно 50 об.ч./млрд. Эта концентрация дополнительно снижается посредством второй промывки,которая главным образом удаляет диоксид углерода, но снижает и содержание сернистого водорода до значений менее 20 ч./млрд, предпочтительно менее 10 ч./млрд или даже менее 1 ч./млрд. Газ, очищенный посредством первой абсорбции, является исходным газом для второй стадии абсорбции, где используется раствор, содержащий органический абсорбент. Промывка вторым абсорбирующим раствором, содержащим органический абсорбент. После стадии контакта газа с первым абсорбирующим раствором извлеченный газ приводят в контакт со вторым абсорбирующим раствором, содержащим органический абсорбент. Существуют различные абсорбенты для этой стадии промывки. Распространенными органическими абсорбентами являются спирты, например метанол и этанол. Другими коммерчески доступным реагентами являются калиевые соли диэтиламиноуксусной кислоты и диметиламиноуксусной кислоты, натрие-6 025153 вая соль 2-аминопропановой кислоты, натриевая соль аминопропионовой кислоты и натрия фенолят. Трибутилфосфат считался плохим растворителем для СО 2, однако в комбинации с первой стадией абсорбции согласно настоящему изобретению его эффективность повышается. Пригодным органическим растворителем также является пропиленкарбонат, который особенно хорошо подходит для процессов, в которых парциальное давление СО 2 высоко. Другим подходящим абсорбентом из этой категории является N-метилпирролидон, который является стабильным, не коррозионным и легко доступным растворителем. Для удаления других загрязнений (например, COS) N-метилпирролидон можно разбавить водой. В целом, указанные растворители обычно содержат некоторое количество воды и, если они получены посредством регенерации, некоторое количество загрязнений. Характерный второй абсорбирующий раствор содержит метанол. Промывка метанолом была известна на предшествующем уровне техники, и специалисту в данной области техники известно большое количество литературы (например, Esteban, A., V. Hernandez and K. Lunsford, "Exploit the Benefits ofMethanol", Proceedings of the 79th Annual Convention, Gas Processors Accociation, Nulsa, Oklahoma, 2000),которой он может руководствоваться при выборе и оптимизации технологических условий. В настоящем изобретении промывку метанолом используют совместно с промывкой водным раствором, содержащим ионы переходных металлов, и эта комбинация дает хорошие результаты в случае газов, содержащих H2S и большое количество СО 2 в качестве загрязнений. Цель промывки метанолом состоит в снижении концентрации СО 2 в синтез-газе с целью снижения общего содержания инертных веществ в исходном газе для синтеза Фишера-Тропша. После удаления смол синтез-газ охлаждают перед промывкой метанолом и удаляют сконденсировавшуюся воду. Затем синтез-газ охлаждают до температуры абсорбции и подают в колонну для промывки метанолом. Синтезгаз, выходящий из колонны для промывки метанолом, имеет концентрацию СО 2, примерно равную 1-5 мол.%, предпочтительно меньше 4 мол.% и более предпочтительно около 2 мол.%. Извлеченный газ после нагревания пропускают через защитные слои. В случае газа, полученного посредством газификации биомассы, использование органического растворителя обеспечивает дополнительное преимущество, состоящее в удалении ароматических загрязнений, выбранных из бензола, толуола и нафталина. Если на стадии абсорбции удается достичь достаточно низкой концентрации, то нет необходимости в дополнительном отделении, или, необязательно, можно использовать только простые защитные слои. В контексте настоящего изобретения комбинация первой стадии абсорбции и второй стадии абсорбции обеспечивает преимущества по сравнению с решениями на предшествующем уровне техники. Поскольку первая стадия абсорбции эффективно удаляет H2S, то условия на второй стадии абсорбции не должны быть такими жесткими, как в процессах согласно предшествующему уровню техники. Авторы настоящего изобретения продемонстрировали, что вместо очень холодных условий (-40 или даже -70 С),традиционно использовавшихся, например, для промывок метанолом, вторую стадию абсорбции можно провести при температурах, равных -23 и -13 С, и провели модельные опыты при температуре -10 С с превосходными результатами. Эти результаты обеспечивают значительные преимущества для проектирования процесса и выбора рабочих параметров. При использовании первой и второй стадий абсорбции согласно настоящему изобретению требования к условиям второй стадии абсорбции могут быть менее жесткими. Обычно в случае физической абсорбции повышение давления, снижение температуры и повышение степени чистоты абсорбента приводят к лучшему эффекту промывки. Однако авторы настоящего изобретения пришли к выводу, что поскольку H2S удален из газа, высокий уровень удаления СО 2 можно получить при менее жесткой регенерации органического растворителя, и/или при более высокой температуре абсорбции, и/или при более низком давлении. Извлечение СО 2. Поток СО 2, полученный посредством регенерации метанола, охлаждают в две стадии: конденсируют углеводороды из сингаза и снижают выбросы метанола в вытяжную башню для СО 2 посредством охлаждения. Охлажденный поток СО 2 нагревают для предотвращения нежелательной конденсации влаги,содержащейся в воздухе, вблизи вытяжной башни. Потребление энергии. Способ согласно настоящему изобретению, определенный в п.1 формулы изобретения, включает две стадии химической абсорбции. В процессах абсорбции потребление энергии определяют три стадии. Предпочтительно выбирают параметры, обеспечивающие низкое потребление энергии. Первой стадией является кондиционирование газа (предварительное нагревание или предварительное охлаждение газа), подлежащего промывке, перед подачей на стадию абсорбции. Для химической абсорбции применимый температурный диапазон гораздо шире, и потребность в термическом кондиционировании на этой стадии обычно ниже, чем в случае физической абсорбции. Во многих случаях нет необходимости в кондиционировании, поскольку химическую промывку можно выполнить при температуре предыдущей стадии процесса. Следующей энергоемкой фазой являются стадии абсорбции. В данном случае, в зависимости от реагентов, условий и выбранного уровня чистоты потребность в охлаждении или нагревании реактора и/или реагентов существует, в частности, при физической абсорбции. Третьей точкой, где необходимо учитывать потребление энергии, является регенерация абсорбента. Регенерация абсорбента. Согласно одному из вариантов осуществления настоящего изобретения способ может дополнительно включать регенерацию первого или второго абсорбирующего раствора или, необязательно, обоих растворов. В зависимости от вида абсорбента и требуемого уровня чистоты специалистам в данной области техники известны три процедуры регенерации. Наиболее простым и дешевым способом регенерации является моментальная регенерация, при которой давление абсорбента понижают, например постепенно. Концентрацию кислого газа определяет последняя стадия, давление во время которой немного выше, чем давление окружающей среды. Посредством вакуумирования на последней стадии можно дополнительно снизить концентрацию кислого газа в абсорбенте. Если необходим более высокий уровень чистоты, регенерацию можно осуществить посредством десорбционной обработки абсорбента инертным газом. При десорбционной обработке давление абсорбента снижают, после чего снижают и парциальные давления газов, подлежащих удалению, посредством подачи инертного газа в реактор. Отрицательной стороной такой системы регенерации является разбавление потока кислого газа используемым инертным газом. Оба способа регенерации - моментальный и десорбционная обработка - оставляют некоторое количество кислого газа в абсорбционном растворителе. Для случаев, когда концентрация сернистого водорода, подлежащего удалению, очень низка, таких способов достаточно. Однако в случае высоких концентраций сернистого водорода необходима регенерация, основанная на кипячении растворителя, например - горячая регенерация. Такая регенерация обеспечивает очень высокую степень чистоты газа,подлежащего промывке, а также высокую концентрацию кислого газа в отходящих газах. Принцип, лежащий в основе этого способа, состоит в том, что растворимость газа в абсорбирующем растворителе снижается при повышении температуры. Растворитель нагревают до его температуры кипения, при этом испаряющийся растворитель уносит загрязнения. Если после этого охладить и сконденсировать пар, то его можно повторно использовать для абсорбции. Горячая регенерация требует дорогих теплообменников и потребляет огромное количество тепла для испарения растворителя. Это самый дорогой из перечисленных способов. Тем не менее, горячая регенерация часто бывает необходимой в случае химических абсорбентов, поскольку кислые газы химически связываются с ними. В случае физического абсорбента (в данном случае - метанола) наиболее подходящей является регенерация посредством резкого или постепенного снижения давления из-за строгой корреляции между растворимостью кислого газа и парциальным давлением. Если необходима высокая степень чистоты, то регенерацию физического абсорбента можно осуществить посредством обработки инертным газом или посредством кипячения или дистилляции растворителя. Предпочтительно регенерированный абсорбционный раствор можно вернуть в процесс промывки и повторно использовать после установления соответствующих условий реакции. В одном из вариантов осуществления настоящего изобретения, в котором комбинацию промывок согласно настоящему изобретению используют в качестве части процесса превращения биомассы в газ,регенерация второго абсорбирующего раствора, содержащего органический растворитель, может быть предназначена для обеспечения всего процесса. Метанол, полученный из колонны для промывки метанолом, вначале направляют в испарительный барабан для отделения СО, в котором преимущественно отделяют СО и возвращают в основной поток. Затем выходящий из барабана метанол обрабатывают пониженным давлением для извлечения СО 2, который используют в воронках-затворах для подачи биомассы. В завершение полученный метанол обрабатывают пониженным давлением для получения исходного продукта для средней части колонны для промывки метанолом. Часть метанола, обработанного пониженным давлением, направляют в регенерационную колонну,где метанол обрабатывают смесью воздуха и азота для получения очень чистого материала, подаваемого в верхнюю часть колонны для промывки метанолом. Азот добавляют к воздуху, используемому для десорбции, для снижения концентрации кислорода ниже предела взрываемости. Часть регенерированного метанола подают в другую колонну для просушивания метанола, где из метанола удаляют воду. Связанные загрязнения накапливаются в рециркулирующем метаноле, поэтому часть метанола сливают в бак для отходов МеОН. Следует отметить, что требования к регенерации в процессе согласно настоящему изобретению являются менее жесткими, чем в процессах, где используют только промывку метанолом, поскольку синергический эффект двух процессов абсорбции обеспечивает высокий уровень чистоты. Выделение сульфидов металлов. Кроме того, из водного раствора или взвеси можно удалить сульфиды металлов, которые обладают плохой растворимостью в водной среде, с использованием любого способа разделения твердых веществ и жидкости. Выделение твердых веществ является простым, и доступно много способов разделения, таких как фильтрация, осаждение или гидроциклоны. Такое выделение предпочтительно по сравнению со способами согласно предшествующему уровню техники, где регенерацию абсорбента, содержащего H2S,-8 025153 обычно проводили в регенерационной секции. Из регенерационной секции согласно предшествующему уровню техники кислые газы, отделенные от абсорбента, направляли в установку для получения серы,где преобразовывали H2S в элементарную серу (S). Такие расходы можно полностью исключить. Осадок сульфида металла можно обработать с целью разделения металла и производного серы, и затем выделить оба компонента. Например, если сульфидом металла является CuS, выделенные твердые вещества можно использовать в качестве сырьевого материала в медной промышленности для получения металлической меди или других соединений меди, а серу, выделенную из этого процесса, можно использовать в качестве сырьевого материала для получения серной кислоты, которое обычно производится на том же производственном участке. Использование очищенного газа. После обработки согласно п.1 формулы изобретения получают очищенный газ. Концентрация H2S в газе, извлеченном на стадии д), меньше 20 ч./млрд, предпочтительно меньше 10 ч./млрд, и наиболее предпочтительно меньше 1 ч./млрд. Очищенный газ находит несколько применений. Его можно использовать для получения водорода, метанола, этанола, диметилового эфира или альдегидов, необязательно посредством гидроформилирования, или непосредственно использовать в двигателях, например для получения электроэнергии. Кроме того, из сингаза можно получить синтетический природный газ (СПГ). Очищенный газ можно также использовать для получения углеводородной композиции, содержащей С 4-С 90 углеводороды, необязательно - после дополнительной очистки. В частности, углеводородную композицию можно получить в процессе Фишера-Тропша (ФТ). В качестве специфического варианта осуществления всего процесса удаление кислого газа можно использовать в процессе получения углеводородов или их производных из сырьевого материала в форме биомассы. В этом случае способ включает стадии: 1) стадию газификации сырьевого материала в форме биомассы в присутствии кислорода и/или пара с получением газа, содержащего монооксид углерода, диоксид углерода, водород, воду и углеводороды; 2) необязательно стадию риформинга смол; 3) необязательно стадию удаления компонентов смол, например нафталина, из газа; 4) необязательно стадию регулирования соотношения водорода и монооксида углерода; 5) стадию промывки по п.1 формулы изобретения; 6) стадию преобразования в реакторе для химического синтеза по меньшей мере значительной части монооксида углерода и водорода, содержащихся в газе, в продукт, выбранный из углеводородной композиции и производных углеводородов; 7) извлечение продукта. Согласно предпочтительному варианту осуществления настоящего изобретения стадии проводят в указанном порядке от 1) до 7). Несмотря на то что промывка согласно п.1 формулы изобретения обозначена здесь как стадия промывки 5), следует понимать, что она включает все признаки п.1 формулы изобретения. Удаление H2S необходимо для защиты катализаторов синтеза. Кроме того, при применении этого способа для получения углеводородов с использованием синтеза Фишера-Тропша, несмотря на то что СО 2 в ходе синтеза выступает как инертное вещество, он влияет на селективность синтеза, сдвигая его в сторону С 5+ продуктов, поэтому, по меньшей мере, частичное удаление СО 2 является желательным для всего процесса. В отличие от процессов очистки сингаза, полученного из каменного угля, которые были описаны в публикациях на предшествующем уровне техники, при удалении кислого газа из газа, полученного из биомассы, уделяется внимание и удалению СО 2. Другим значительным аргументом в пользу процесса согласно настоящему изобретению является то, что высокое давление способствует как абсорбции, так и последующему синтезу Фишера-Тропша. Если давление повышают перед абсорбцией или, по меньшей мере, перед второй промывкой в способе согласно настоящему изобретению, нет необходимости изменять давление после промывок. Специалисту в данной области техники будет понятно, что повышение давления во время стадии абсорбции выше уровня, необходимого для синтеза Фишера-Тропша, нежелательно, хотя и возможно. В характерном случае давление, используемое во время синтеза Фишера-Тропша, составляет от 20 до 60 бар, предпочтительно от 20 до 30 бар, что практически определяет верхний предел для процесса абсорбции. В одном из вариантов осуществления данного способа использование железа и кобальта в качестве ионов металлов в первом абсорбирующем растворе является предпочтительным, поскольку они используются в других частях полного процесса, в частности в качестве катализаторов синтеза ФишераТропша. Однако медь является предпочтительным ионом металла, в частности в форме CuSO4. Необязательно процесс может содержать стадию риформинга смол, например согласно публикацииFI 20105201. В публикации описан способ очистки газификационного газа от дегтеподобных соединений и аммиака с использованием катализаторов при высоких температурах. Предкаталитическая зона содержит слои катализатора, состоящего из циркония/благородного металла, за которыми следует истинно каталитическая зона риформера, содержащая слой (или слои) никелевого или иного катализатора риформинга. Кислород или другой окислитель и, необязательно, пар могут быть поданы в зону риформинга для повышения температуры. Для каталитического синтеза Фишера-Тропша молярное отношение водорода к монооксиду углерода предпочтительно составляет от 1,7 до 2,2, более предпочтительно примерно равно 2. Для того чтобы отрегулировать это отношение, специалист в данной области техники может сделать выбор между различными стратегиями. Это отношение можно отрегулировать с использованием реакции конверсии водяным паром (WGS), либо посредством конверсии кислого газа, либо после соответствующего удаления кислого газа, т.е. очистки газа от кислых газов. Другой подход состоит в добавлении водорода, полученного в других стадиях процесса и из другого процесса, для регулирования этого отношения. В некоторой степени карбонилсульфид (COS) может быть гидролизован на первой стадии абсорбции согласно настоящему изобретению. Однако иногда необходим отдельный гидролиз. Согласно варианту осуществления способа получения углеводородов стадии 5) предшествует стадия гидролиза карбонилсульфида. При этом гидролизе образуется H2S, который затем удаляют во время первой стадии абсорбции, а СО 2 удаляют на второй стадии абсорбции процесса промывки согласно настоящему изобретению. Это выгодно в тех случаях, когда синтез-газ содержит мешающие количества карбонилсульфида. Карбонилсульфид обладает плохой растворимостью в физических и химических абсорбентах, что создает трудности при очистке. Кроме того, согласно одному из вариантов осуществления настоящего изобретения выгодно также использовать водяной газопромыватель перед стадиями промывки, чтобы минимизировать содержаниеNH3 и HCl на стадии осаждения переходными металлами. NH3 и HCl мешают на стадии осаждения металлами, и их удаление способствует получению более чистого осадка CuS. Описанные ниже эксперименты были проведены для того, чтобы подтвердить идею настоящего изобретения. Их следует трактовать как иллюстрирующие некоторые примеры осуществления настоящего изобретения, но не ограничивающие его. Описание примеров осуществления изобретения Экспериментальная часть. Способ согласно настоящему изобретению является способом двухстадийной промывки. Первая стадия - абсорбция с использованием водного раствора, содержащего ионы переходных металлов, была описана в поданной ранее заявителем заявке на патент ЕР 11153704. Эти эксперименты, в данной публикации описанные как примеры 1 и 2, также применимы к первой стадии настоящего изобретения. На этой первой стадии газ, подлежащий очистке, приводят в контакт с первым абсорбирующим раствором, содержащим ионы переходных металлов, причем переходные металлы выбраны из меди, цинка, железа, кобальта и их смесей, в кислом водном растворе (в экспериментах- с водным раствором CuSO4); при этом сернистый водород связывается с первым абсорбирующим раствором, а газ извлекают. Вторая стадия - абсорбция холодным метанолом - многократно описана на предшествующем уровне техники. В качестве второй стадии согласно настоящему изобретению промывка абсорбентом, содержащим органический растворитель, обладает особым признаком, состоящим в преимущественном удалении диоксида углерода, поскольку производные серы уже удалены. Ее можно описать как приведение в контакт газа, извлеченного после первой промывки, со вторым абсорбирующим раствором, содержащим органический растворитель, связывание диоксида углерода со вторым абсорбирующим раствором и заключительное извлечение промытого газа, предпочтительно для дальнейшей обработки. Эксперименты, проведенные с целью подтверждения эффективности комбинации вышеуказанных стадий, включают результаты полупромышленного испытания (примеры 3 и 4) и моделирования полного процесса (пример 5). Пример 1. Полунепрерывные испытания по удалению H2S посредством абсорбции с использованием водного раствора сульфата меди (CuSO4) в качестве модельного абсорбента для первого абсорбирующего раствора. 1.1. Материалы и методы. Испытания с абсорбцией были проведены с использованием микрореакторного оборудования для реакции конверсии водяным паром (WGS). Полунепрерывные испытания по удалению H2S посредством абсорбции с использованием в качестве абсорбента водного раствора сульфата меди (CuSO4) были проведены в простой газопромывной склянке объемом 0,5 л с магнитной мешалкой, помещенной в технологическую линию микрореактора перед постоянно включенным масс-спектрометром. Испытания с абсорбцией были проведены при комнатной температуре и атмосферном давлении. Общая объемная скорость газа, подаваемого в WGS-реактор, была равна 12 дм 3/ч. Основной состав исходного газа приведен в табл. 1. Таблица 1 Основной состав исходного газа Загрязняющие компоненты были закуплены в компании AGA в виде газовых смесей, разбавленных водородом - H2S/H2, COS/H2 и NH3/H2. В подаваемом газе концентрация H2S была равна 500 об.ч./млн во всех экспериментах. В некоторых испытаниях в подаваемом газе также было использовано 85 ч./млнCOS и 800 ч./млн NH3. Однако практически весь карбонилсульфид был гидролизован еще до абсорбционной склянки, поскольку невозможно было обойти каталитический реактор, где происходил гидролизCOS в качестве побочной реакции в реакции конверсии водяным паром. Полученный газ анализировали в режиме реального времени с использованием масс-спектрометра(ГХ-МС, но газохроматографическое разделение не использовали). Предел количественного определения зависит от компонента, и в данных масс-спектрометрических измерения предел количественного определения составлял примерно 1 ч./млн. В экспериментах с абсорбцией, проведенных в лаборатории, в газопромывной пузырьковой склянке, описанной выше, была выполнена следующая программа испытаний: Концентрация CuSO4 в различных экспериментах варьировалась от разбавленного раствора с концентрацией, равной 50 частям на миллион, до 500 ч./млн. Массоперенос в пузырьковой газопромывной склянке активировали посредством перемешивания. Скорость абсорбции H2S в водном растворе CuSO4 измеряли при различных концентрациях CuSO4. Производили идентификацию/количественное определение кристаллизованных твердых компонентов, содержащих медь, и распределение по размеру кристаллизованных частиц. 1.2. Результаты. Скорости подачи различных загрязняющих компонентов в синтез-газ, поступающий в WGSреактор, в экспериментах были следующими: испытание 1 - концентрация CuSO4 - 0,01 мас.%, концентрация H2S в исходном газе - 500 об.ч./млн; испытание 2 - концентрация CuSO4 - 0,01 мас.%, концентрация H2S в исходном газе - 500 об.ч./млн,NH3 - 800 об.ч./млн, карбонилсульфид (COS) - 85 об.ч./млн; испытание 3 - концентрация CuSO4 - 0,0051 мас.%, концентрация H2S в исходном газе - 500 об.ч./млн, NH3 - 800 об.ч./млн, карбонилсульфид (COS) - 85 об.ч./млн. Отношение молярного потока H2S на выходе из газопромывной склянки к молярному потоку H2S на входе в газопромывную склянку в различных экспериментах показано в виде функции времени на фиг. 1-3. 1.3. Выводы.CuSO4 был способен полностью удалять 500 ч./млн H2S (молярная фракция) из исходного газа в водных растворах с концентрациями 0,01 и 0,005 мас.%. Продуктом является твердый осадок CuS. Слишком высокий рН приводил к осаждению, например, гидроксидов металлов или карбонатов,при этом не происходило удаления сернистого водорода, или он удалялся в меньшем количестве. Образование карбоната также зависело от парциального давления СО 2. Слишком низкий рН приводил к отсутствию образования осадка, в этом случае не происходило удаления сернистого водорода (результаты не приведены).NH3 в исходном газе не влиял на удаление H2S сульфатом меди. Что касается результатов, приведенных на фиг. 1-3, то следует отметить, что экспериментальная установка была следующей: склянку с водным промывочным раствором сульфата меди помещали между двумя холодильниками продукта реактора и волюметрическим газовым расходомером барабанного типа. При открытии клапанов газ можно было направить к волюметрическому газовому расходомеру барабанного типа через водный раствор CuSO4, а затем - к газовому хроматографу-масс-спектрометру, после чего газ направляли к волюметрическому газовому расходомеру барабанного типа для отведения. Первая точка на графике соответствует моменту времени непосредственно перед подачей газа в склянку с раствором CuSO4. В этот момент времени осаждение Cu еще не обнаруживается. Затем была взята серия из 4 образцов в течение 7 мин, после короткого перерыва была взята новая серия из 4 образцов в течение 7 мин и т.д. Точки на графиках, в которых концентрация H2S равна 0, соответствуют точкам полного удаленияH2S из газа. Вскоре после того как вся медь была израсходована, концентрация H2S снова начала возрастать. В некоторых испытаниях в исходном газе содержался карбонилсульфид. При пропускании через конверсионный реактор он практически полностью гидролизовался, так как исходный газ также содержал воду: Поэтому в газе, подававшемся на промывку с использованием CuSO4, содержание H2S было боль- 11025153 ше, чем в газе, подававшемся в систему. Этот эффект можно было видеть по результатам анализов, так как количество COS в эффлюенте составляло 0-3 ч./млн. Пример 2. Испытание по удалению H2S из сингаза посредством абсорбции в абсорбционной колонне с наполнителем. Испытания по удалению H2S из сингаза посредством абсорбции в абсорбционной колонне с наполнителем были проведены на полупромышленной испытательной установке. Эффективность абсорбера была испытана на установке для получения сингаза в Варкаусе, Финляндия. Технические характеристики абсорбера и справочные данные приведены ниже. Абсорбер: абсорбер с наполнителем, наполнитель - металл, размер частиц металла - 2 дюйма или 50 мм, площадь поверхности - 100 м 2/м 3; высота: 9 м, диаметр: 0,1 м. Исходный газ: скорость подачи: 50-60 кг/ч; давление: 30 бар, температура: 25 С; состав (в мол.%): СО 21, СО 2 30, Н 2 31, СН 4 3, N215, H2S 140 ч./млн, нафталин 100 ч./млн, бензол 1200 ч./млн, следовые количества NH3 и COS. Подаваемый абсорбент:CuSO4-вода, концентрация 0,15 мас.%; скорость подачи варьировала, эквивалентное молярное отношение Cu2+ к H2S составляло 1,5-6. Молярный % H2S в выходящем газе измеряли с помощью постоянно включенного газоанализатора сернистого водорода. Измеренная мольная доля H2S в выходящем сингазе составляла не менее 70 ч./млрд при эквивалентном молярном отношении Cu2+ к H2S в выходящем газе, равном 6. В результате была определена корреляция между концентрацией S в полученном газе и стехиометрическим отношением Cu/S в исходном газе. При стехиометрических отношениях в диапазоне от 1 до 5 наблюдали практически линейную зависимость, тогда как стехиометрическое отношение Cu/S, равное 1,5, приводило к менее чем 3 об.ч./млн H2S, а отношение, равное 5, приводило к 90 об.ч./млрд H2S в полученном газе. Пример 3. Протокол двухстадийной промывки в полупромышленном масштабе. 3.1. Экспериментальное оборудование. Эксперименты с абсорбцией были выполнены в периодическом режиме на полупромышленной установке. Исходным газом был сингаз, полученный на установке для производства сингаза в Варкаусе,Финляндия. Абсорбционная колонна с наполнителем была использована для промывки водным раствором, т.е. для первой стадии. Результаты измеряли с помощью стандартных анализаторов: СН 4, СО и СО 2 - посредством газовой хроматографии; Н 2 - с помощью пламенно-ионизационного детектора (ПИД), а содержание серы - с помощью анализатора Hobre Novasulf HG400. 3.2. Материалы. Исходный газ, т.е. газ, подлежащий очистке, был получен посредством газификации биомассы. Поэтому имели место небольшие флуктуации состава исходного газа. Состав исходного газа приведен в табл. 2. Таблица 2 Состав исходного газа 3.3. Проведение экспериментов. Общая скорость подачи газа была равна 50 кг/ч. В начале первой стадии абсорбции подача CuSO4 была равна нулю. После начала эксперимента водный раствор подавали со скоростью, равной 300 кг/ч. Использовали и свежий, и рециркулирующий раствор. В подаваемом водном растворе концентрация CuSO4 была равна 0,210 г/л. С учетом скоростей подачи это давало стехиометрическое отношение Cu/S, равное 1,10. Температуру реакции устанавливали равной 29 С. Промывку метанолом проводили при температуре, равной -23 С, и скорость подачи метанола в промывную колонну была равна 500 кг/ч. Эксперимент продолжался в течение 12,5 ч. 3.4. Результаты. Результаты показали, что из 160 ч./млн H2S, содержавшихся в исходном газе, только 160 ч./млрд осталось в газе после промывки раствором CuSO4. Это означает 99,9%-ную эффективность удаления H2S на первой стадии. Концентрация H2S дополнительно снижалась во время промывки метанолом, так как из 160 ч./млн, содержавшихся в газе перед стадией абсорбции метанолом, только 0,1 ч./млрд осталась после второй абсорбции. Состав газа после промывки метанолом был следующим: Н 2 48 об.%, СО 30 об.%, СО 2 4 об.%, СН 4 4 об.%, остаток составил N2. Таким образом, промывка метанолом снизила концентрацию СО 2 от исходных 28 до 4 об.%. 3.5. Выводы. Можно сделать вывод о том, что способ двухстадийной промывки газа, объединяющий стадию химической промывки и стадию промывки метанолом, удаляет H2S с очень высокой эффективностью (с 160 ч./млн до 0,1 ч./млрд), а СО 2 - с достаточной эффективностью. Пример 4. Протокол двухстадийной промывки в полупромышленном масштабе, высокая степень очистки отH2S. Условия были такими же, как в примере 5, за исключением скорости подачи газа, которая была равна 65 кг/ч, скорости подачи водного раствора CuSO4, которая была равна 200 кг/ч, и концентрации раствора, которая была равна 0,56 г/л, что дало стехиометрическое отношение Cu/S, равное 2,42. Условия эксперимента и результаты, описывающие извлеченный газ, приведены в табл. 3. Температура реакции была задана равной 34 С. Промывку метанолом проводили при температуре, равной -13 С. Таблица 3 Пример 5. Моделирование способа промывки для удаления сернистого водорода и диоксида углерода согласно настоящему изобретению, сочетающего промывку CuSO4 и промывку метанолом. В этом примере была смоделирована двухстадийная промывка согласно одному из вариантов осуществления настоящего изобретения. В модели газ на первой стадии подается в колонну для осажденияCuS с целью удаления H2S и некоторых следовых компонентов, после чего производится промывка метанолом с целью удаления СО 2. Моделирование было проведено с использованием программы AspenPlus для моделирования схем технологических процессов со следующими параметрами процесса: Модели абсорберов являлись динамическими моделями, построенными в Radfrac. Физическое свойство и VLE-метод ELECNRTL. Все реакции, за исключением реакции с Cu, компоненты Генри, параметры и т.п. заданы как параметры по умолчанию программы Aspen Plus и реализованы через Electrolyte wizard. Результаты моделирования приведены в табл. 4 и 5. Таблица 4 Результаты моделирования; мольные доли избранных компонентов при использовании способа согласно настоящему изобретению при температуре метанола, равной -10 С Из этих результатов можно сделать вывод о том, что комбинация промывки водным растворомCuSO4 и промывки метанолом эффективно удаляет H2S и СО 2. По эквивалентным моделям с использованием вначале только метанола (МеОН в табл. 5) в качестве абсорбента, а затем - комбинации первого и второго абсорбирующих растворов (CuSO4 и МеОН в табл. 5) согласно настоящему изобретению было рассчитано потребление энергии в виде расхода пара и энергии. Результаты приведены в табл. 5. Таблица 5 Потребление энергии в форме пара и электричества, использованных для стадий абсорбции Эти результаты подтверждают эффективность данного способа в отношении потребления пара и электричества. Они подтверждают энергетическую эффективность удаления сернистых компонентов и диоксида углерода из сингаза. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ отмывки сернистого водорода и диоксида углерода из газа, получаемого посредством газификации углеродсодержащей биомассы, который включает: а) обеспечение контакта газа с первым абсорбирующим раствором, содержащим ионы переходных металлов, причем переходные металлы выбраны из меди, цинка, железа, кобальта и их смесей, в кислом водном растворе, и связывание сернистого водорода с первым абсорбирующим раствором; в) извлечение газа из стадии а); г) обеспечение контакта газа, извлеченного на стадии в), со вторым абсорбирующим раствором, содержащим органический растворитель, при температуре, составляющей от -40 до 50 С, и связывание диоксида углерода со вторым абсорбирующим раствором; е) извлечение промытого газа из стадии г). 2. Способ по п.1, отличающийся тем, что концентрация ионов переходных металлов в промывочном растворе меньше примерно 1000 мас.ч./млн, предпочтительно меньше примерно 100 мас.ч./млн, в пересчете на массу первого абсорбирующего раствора. 3. Способ по п.1 или 2, отличающийся тем, что ионы переходных металлов являются ионами меди,предпочтительно в форме CuSO4. 4. Способ по п.1, отличающийся тем, что контакт газа с первым абсорбирующим раствором происходит при температуре, составляющей от 10 до 80 С, и при давлении, составляющем от 1 до 50 бар. 5. Способ по п.1, отличающийся тем, что контакт газа со вторым абсорбирующим раствором происходит при температуре, составляющей от -30 до -10 С. 6. Способ по любому из предыдущих пунктов, отличающийся тем, что концентрация H2S в газе, извлеченном на стадии е), меньше 20 ч./млрд, предпочтительно меньше 1 ч./млрд. 7. Способ по п.1, отличающийся тем, что первый и/или второй абсорбирующий раствор регенерируют после извлечения газа. 8. Способ получения углеводородов или их производных из сырьевого материала в форме биомассы, включающий: а) газификацию сырьевого материала в форме биомассы в присутствии кислорода и/или пара с получением газа, содержащего монооксид углерода, диоксид углерода, водород, воду и углеводороды; б) промывку газа, полученного на стадии а), с использованием способа по п.1; в) преобразование в реакторе для химического синтеза по меньшей мере значительной части монооксида углерода и водорода, содержащихся в газе, в продукт, выбранный из углеводородной композиции и производных углеводородов; г) извлечение углеводородов или их производных в качестве продукта. 9. Способ по п.8, дополнительно включающий после стадии а) стадию а 1) риформинга смол. 10. Способ по п.8 или 9, дополнительно включающий после стадии а 1) стадию а 2) удаления компонентов смол, например нафталина, из газа. 11. Способ по пп.8, 9 или 10, дополнительно включающий после стадии а 2) стадию а 3) регулирования соотношения водорода и монооксида углерода. 12. Способ по пп.8, 9, 10 или 11, отличающийся тем, что стадии б) предшествует стадия гидролиза карбонилсульфида. 13. Способ по любому из предыдущих пунктов, отличающийся тем, что второй абсорбирующий раствор содержит органический растворитель, выбранный из метанола, этанола, калиевых солей диэтиламиноуксусной кислоты и диметиламиноуксусной кислоты, натриевой соли 2-аминопропановой кислоты, натриевых солей аминопропионовой кислоты и натрия фенолята, трибутилфосфата, пропиленкарбоната, N-метилпирролидона или их смесей. 14. Способ по любому из предыдущих пунктов, отличающийся тем, что второй абсорбирующий раствор, содержащий органический растворитель, содержит метанол, предпочтительно состоит, по существу, из метанола.
МПК / Метки
МПК: B01D 53/52, C10J 3/00, C10K 1/08
Метки: способ, газа, промывки, двухстадийной
Код ссылки
<a href="https://eas.patents.su/17-25153-sposob-dvuhstadijjnojj-promyvki-gaza.html" rel="bookmark" title="База патентов Евразийского Союза">Способ двухстадийной промывки газа</a>
Предыдущий патент: Конструкция пептидного каркаса
Следующий патент: Пакет для настаивания и его производство
Случайный патент: Соединения и композиции в качестве модуляторов активности tlr