Рекомбинантная бактерия и способ получения хондроитина биотехнологическим путем
Номер патента: 25126
Опубликовано: 30.11.2016
Авторы: Дали Симона, Трилли Антонио, Багатин Франческа, Бузиелло Иммаколата
Формула / Реферат
1. Рекомбинантная бактерия, продуцирующая хондроитин, представляющий собой линейный гликозаминогликан, образованный остатками D-глюкуроновой кислоты (GlcUA) и N-ацетил-D-галактозамина (GalNAc), связанными посредством связей β1-3 (GlcUA®GalNAc) и β1-4 (GalNAc®GlcUA), отличающаяся тем, что указанная рекомбинантная бактерия получена из бактерии, принадлежащей к группе K-антигена, которая включает роды Escherichia, Haemophilus, Campylobacter, Gloeocapsa или Vibrio, причем в указанной бактерии ген kfoE делетирован или инактивирован путем полного или частичного его замещения либо посредством вставки в него нуклеотидной последовательности, где указанный ген кодирует фермент, ответственный за присоединение остатков фруктозы к линейному остову хондроитина, выбранный из группы, состоящей из:
(A) белка, содержащего аминокислотную последовательность SEQ ID NO: 2, обладающего фруктозилтрансферазной активностью;
(B) белка, содержащего аминокислотную последовательность SEQ ID NO: 2, модифицированную путем делеции, замещения или вставки одного или нескольких аминокислотных остатков, и обладающего фруктозилтрансферазной активностью; и
(C) белка, содержащего аминокислотную последовательность, гомологичную по меньшей мере на 50% аминокислотной последовательности SEQ ID NO: 2, и обладающего фруктозилтрансферазной активностью.
2. Рекомбинантная бактерия по п.1, в которой ген kfoE имеет нуклеотидную последовательность, выбранную из группы, состоящей из:
(a) нуклеотидной последовательности, которая содержит последовательность SEQ ID NO: 1 и кодирует белок, обладающий фруктозилтрансферазной активностью;
(b) нуклеотидной последовательности, которая кодирует белок, обладающий фруктозилтрансферазной активностью, и гибридизуется с нуклеотидной последовательностью, содержащей нуклеотидную последовательность, комплементарную последовательности SEQ ID NO: 1; и
(c) нуклеотидной последовательности, которая кодирует белок, обладающий фруктозилтрансферазной активностью, и содержит нуклеотидную последовательность, гомологичную по меньшей мере на 50% нуклеотидной последовательности SEQ ID NO: 1.
3. Рекомбинантная бактерия по любому из пп.1 и 2, в которой ген kfoE инактивирован путем полного или частичного его замещения кассетой резистентности к канамицину с ее последующим удалением, что приводит к полной или частичной делеции гена kfoE.
4. Рекомбинантная бактерия по п.3, происходящая из бактерии вида Escherichia coli.
5. Рекомбинантная бактерия по п.4, происходящая из серотипа бактерии вида Escherichia coli, принадлежащего группе 2 K-антигена.
6. Рекомбинантная бактерия по п.5, происходящая из штамма U1-41 Escherichia coli O5:K4:H.
7. Рекомбинантная бактерия по любому из пп.1 и 2, представляющая собой Escherichia coli DSM23578 или Escherichia coli DSM23644.
8. Рекомбинантная бактерия по п.7, представляющая собой Escherichia coli DSM23644.
9. Способ получения хондроитина биотехнологическим путем, включающий следующие стадии:
(A) культивирование в соответствующей среде рекомбинантной бактерии по любому из пп.1-8;
(B) извлечение из культуральной среды продуцированного бактериями хондроитина и его очистку.
10. Способ по п.9, где указанной рекомбинантной бактерией является Escherichia coli DSM23578 или Escherichia coli DSM23644.
11. Способ по п.9, где указанной рекомбинантной бактерией является Escherichia coli DSM23644.
Текст
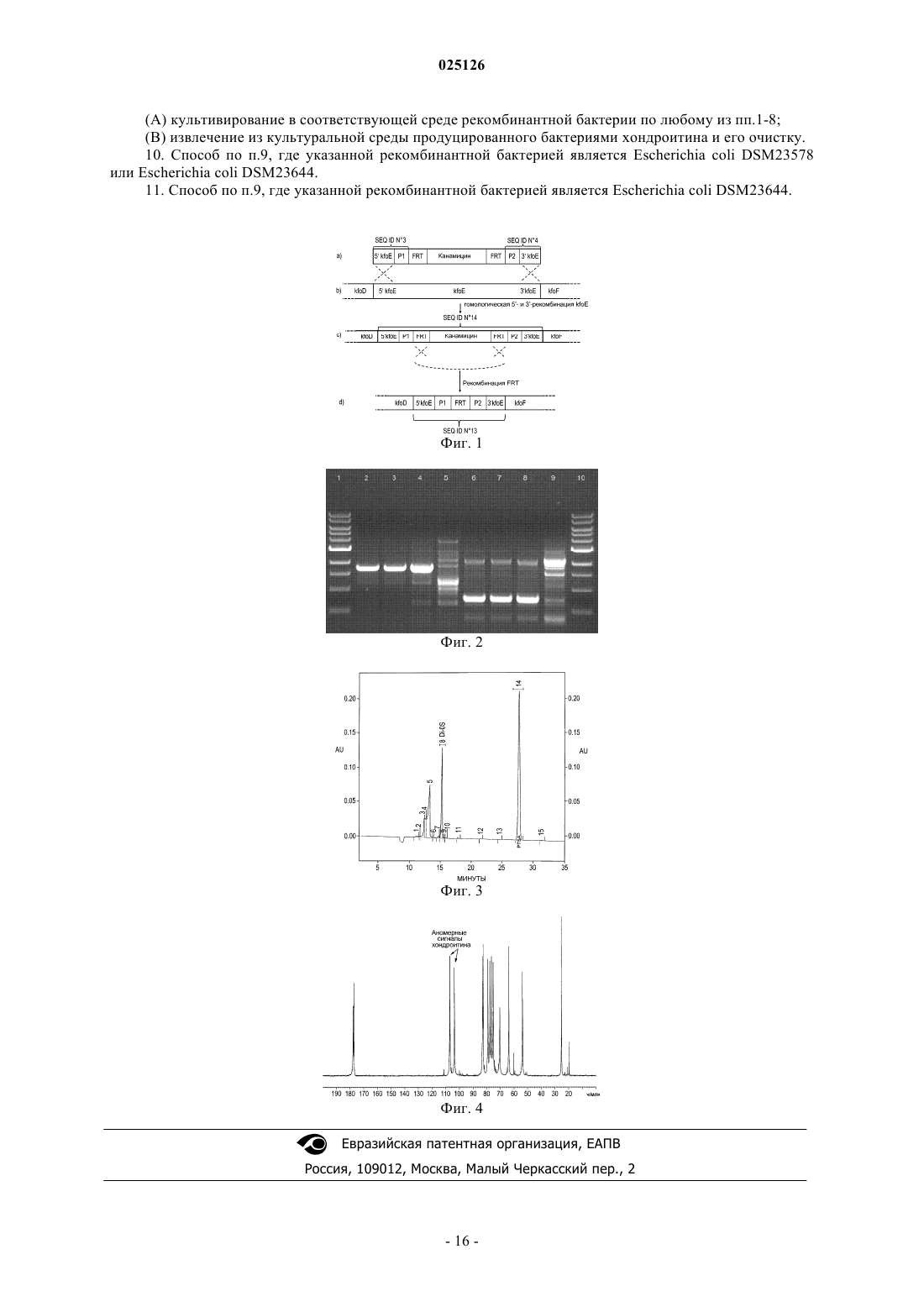
РЕКОМБИНАНТНАЯ БАКТЕРИЯ И СПОСОБ ПОЛУЧЕНИЯ ХОНДРОИТИНА БИОТЕХНОЛОГИЧЕСКИМ ПУТЕМ Изобретение относится к рекомбинантной бактерии, продуцирующей хондроитин, которую получают путем инактивации гена, кодирующего фермент, ответственный за присоединение остатков фруктозы к линейному остову хондроитина, в бактерии, продуцирующей фруктозилированное производное хондроитина, а также к способу получения хондроитина путем культивирования указанной бактерии. 025126 Объект изобретения Настоящее изобретение связано с новой рекомбинантной бактерией, продуцирующей хондроитин,и способом получения хондроитина биотехнологическим путем. В настоящем изобретении термин хондроитин относится к линейному полисахариду, определяемому как линейный гликозаминогликан, составленный альтернативными остатками D-глюкуроновой кислоты (GlcUA) и N-ацетил-D-галактозамина (GalNAc), связанными посредством связей 1-3(GlcUAGalNAc) и 1-4 (GalNAcGlcUA). Предпосылки создания изобретения Хондроитинсульфат является гликозаминогликаном, в котором глюкуроновая кислота (GlcUA) и Nацетил-D-галактозамин (GalNAc) линейно и альтернативно связаны соответственно 1-3-связью и 1-4 связью, с образованием линейной полисахаридной цепи, которая в различной степени сульфирована по остаткам GalNAc. В организме животных он присутствует в хрящах и соединительной ткани, играя важную роль в клеточной адгезии, регенерации тканей, в прорастании нервов и пр. Получение хондроитина неживотного происхождения является важной и необходимой ступенью на пути к получению хондроитинсульфата неживотного происхождения. В доступной патентной литературе описано несколько способов получения хондроитина неживотного происхождения. Кроме того, было клонировано и секвенировано несколько генов хондроитинсинтазы, полученных как из животных, так и из микроорганизмов. Предложен способ получения хондроитина с помощью рекомбинантной грамположительной бактерии Bacillus со встроенным геном хондроитинсинтазы, полученным из Pasteurella multocida (US 2007/0281342 A1). В другом изобретении описан способ получения хондроитина путем встраивания обоих генов, kfoC и kfoA, полученных из Escherichia coli O5:K4:H4, в бактерию, получающую UDP-глюкуроновую кислоту(WO 2008/133350). В другом изобретении описан in vitro синтез хондроитина в ферментативной системе, содержащей как хондроитинсинтазу Escherichia coli O5:K4:H4, так и предшественники реакции (US 2009/0263867A1). Известно, что Escherichia coli O5:K4:H4 способна получать капсулярный полисахарид (полисахаридK4), имеющий такую же структуру остова, что и структура остова хондроитина, с которым остатки фруктозы соединяются через остатки GlcUA (см., например, N. Volpi, Glycoconj. J. 25: 451-457(2008. Следовательно, полисахарид K4 состоит из повторяющегося трисахаридного элемента, содержащего фрагмент D-глюкуроновой кислоты (GlcUA) и фрагмент N-ацетил-D-галактозамина (GalNAc), соединенного посредством 1-3 (GlcUAGalNAc), и остатка фруктозы, связанного с C3-гидроксильной группой остатка GlcUA. Остатки фруктозы, таким образом, образуют разветвления полученного в результате линейного полисахарида. Удаления остатков фруктозы достигали путем гидролиза в кислых условиях (N. Volpi, Electrophoresis 25, 692-696 (2004. Несмотря на обширные и тщательные исследования как кластера генов капсулярных антигенов Escherichia coli O5:K4:H4, так и метаболических путей, ведущих к образованию сахаров, образующих линейный полисахарид K4, до сих пор не удалось идентифицировать гликозилтрансферазную активность,ответственную за присоединение фруктозных фрагментов к линейному полисахариду, с получением полисахарида K4. Элементом новизны настоящего изобретения является непосредственное получение высокомолекулярного хондроитина с помощью рекомбинантной бактерий, полученной путем инактивации гена, кодирующего фермент, ответственный за добавление остатков фруктозы к хондроитиновому остову, что позволяет избежать необходимости подвергать полисахарид K4 гидролитическому удалению остатков фруктозы, связанных с фрагментами GlcUA, для получения хондроитина. Подробное описание изобретения Целью настоящего изобретения является получение рекомбинантной бактерии, продуцирующей хондроитин, определяемый как линейный гликозаминогликан, состоящий из альтернативных остатков Dглюкуроновой кислоты (GlcUA) и N-ацетил-D-галактозамина (GalNAc), соединенных соответственно 13-связью и 1-4-связью, характеризующегося тем, что в указанной бактерии ген, кодирующий фермент,ответственный за присоединение остатков фруктозы к остову хондроитина, является инактивированным. Следовательно, в соответствии с одним из аспектов настоящего изобретения предложена рекомбинантная бактерия, продуцирующая хондроитин, характеризующаяся тем, что указанная бактерия получена таким путем, при котором исходно присутствующий в нем ген, который кодирует белок, ответственный за присоединение остатков фруктозы к остову хондроитина, подвергают инактивации, при этом указанная инактивация включает в себя делецию или замену, полностью или частично, указанного гена,или его дезинтеграцию путем вставки дополнительной нуклеотидной последовательности. В соответствии с предпочтительным аспектом настоящего изобретения рекомбинантную бактерию согласно на-1 025126 стоящему изобретению, полученную путем инактивации гена, кодирующего белок, обладающий фруктозилтрансферазной активностью, получают из бактерии, которая относится к роду Escherichia coli и предпочтительно принадлежит группе 2 К-антигенов, которая включает в себя хорошо известные серотипы,такие как K1, K5, K7, K12. Хотя согласно репрезентативному воплощению настоящего изобретения рекомбинантная бактерия,способная продуцировать хондроитин, получена из Escherichia coli O5:K4:H4, тем не менее может быть использована любаая из бактерий, принадлежащих к группе К-антигенов, независимо от того, имеет ли они какую-либо генную гомологию с Escherichia coli O5:K4:H4. Примеры указанных бактерий включают в себя бактерии, принадлежащие к роду Haemophilus, такие как H. influenzae (Branefors-Helander P., Carbohydr. Res., vol. 88, Jan 15, 1981), Campylobacter, например С. jejuni (McNally D.J., Jarrell H.C., Li J.,Khieu N.H., Vinogradov E., Szymanski C.M., Brisson J.R., FEBS J, vol. 272,17, 4407-4422, Sept. 2005),Gloeocapsa, например G. gelatinosa (Raungsomboon S., Chidthaisong A., Bunnag B., Inthorn D., Harvey N.W.,Water Res., vol. 40,20, 3759-3766, Dec. 2006), а также Vibrio, например V. cholerae (Knirel Y.A., Widmalm G., Senchenkova S.N., Jansson P.E., Weintraub A., Eur. J. Biochem, vol. 247, 402-410, July 1997). Более предпочтительно, чтобы указанная бактерия, из которой получена рекомбинантная бактерия согласно настоящему изобретению, продуцирующая хондроитин, являлась бактерией Escherichia coli серотипа O5:K4:H4, который содержит ген kfoE, кодирующий белок, который обладает фруктозилтрансферазной активностью. Известно, что ген kfoE локализован внутри генного кластера антигенов K4 Е. coli (GenBankAB079602), который содержит гены, которые, как было обнаружено авторами настоящего изобретения,имеют существенную гомологию с генами из других бактериями, такими, которые, вероятнее всего, участвуют в образовании бактериальной капсулы (Т. Ninomiya, N. Sugiura, A. Tawada, K. Sugimoto, H. Watanabe and K. Kimata, Biol. Chem., vol. 277,24, 21567-75 June 14, 2002). Наиболее предпочтительной бактерией, используемой для получения рекомбинантной бактерии согласно настоящему изобретению, является Escherichia coli O5:K4:H4, штамм U1-41, доступный из АТСС(Американская Коллекция Типовых Культур, Manassas-Virginia, US) под номером доступа АТСС 23502. В соответствии с репрезентативным воплощением настоящего изобретения указанная рекомбинантная бактерия является бактерией, продуцирующей хондроитин, при этом ген, подвергаемый инактивации, является геном, кодирующим белок, выбранный из группы, состоящей из следующих белков (А),(В) и (С):(A) белка, содержащего аминокислотную последовательность SEQ ID NO: 2 и обладающего фруктозилтрансферазной активностью;(B) белка, содержащего аминокислотную последовательность SEQ ID NO: 2, модифицированную путем делеции, замены или вставки одной или нескольких аминокислот и обладающую фруктозилтрансферазной активностью;(C) белка, содержащего аминокислотную последовательность, имеющую по меньшей мере 50% гомологию с аминокислотной последовательностью SEQ ID NO: 2 и обладающую фруктозилтрансферазной активностью. Бактерией согласно настоящему изобретению является бактерия, в которой инактивированным геном является ген kfoE или нуклеотидная последовательность выбранная из группы, состоящей из следующих (a), (b) и (c):(a) нуклеотидной последовательности, содержащей нуклеотидную последовательность SEQ ID NO: 1 и кодирующей белок, обладающий фруктозилтрансферазной активностью;(b) нуклеотидной последовательности, которая гибридизуется с нуклеотидной последовательностью, содержащей нуклеотидную последовательность, которая комплементарна последовательности SEQ(c) нуклеотидной последовательности, содержащей нуклеотидную последовательность, имеющую по меньшей мере 50% гомологию с нуклеотидной последовательностью SEQ ID NO: 1, и кодирующей белок, обладающий фруктозилтрансферазной активностью. Объектом настоящего изобретения является продуцирующая хондроитин бактерия, в которой инактивацию гена kfoE получают путем модификации его нуклеотидной последовательности, например путем делеции или замены, полностью или частично, нуклеотидной последовательности, описанной выше в подпунктах (a), (b) или (c). Другим объектом настоящего изобретения является бактерия, в которой инактивацию гена kfoE получают путем вставки одного или нескольких нуклеотидов в нуклеотидную последовательность, описанную выше в подпунктах (a), (b) или (c). Согласно наиболее предпочтительному аспекту настоящего изобретения рекомбинантное производное штамма U1-41 Escherichia coli O5:K4:H4 (который далее будет обозначаться как Е. coli K4) получают путем инактивации гена kfoE, кодирующего предполагаемую фруктозилтрансферазу, посредством нуклеотидной делеции. В настоящем изобретении описано то, как дезинтеграция гена kfoE приводит к непосредственному получению полисахарида K4, лишенного фруктозных остатков, то есть хондроитина.-2 025126 Согласно дальнейшему предпочтительному аспекту настоящего изобретения рекомбинантная Е.coli K4 согласно изобретению получена способом дезинтеграции хромосомных генов, в котором ПЦРпраймеры обеспечивают гомологию с геном-мишенью (Datsenko and Wanner, PNAS, vol. 97,12, 66406645, June 6, 2000). Рекомбинантный штамм K4 E. coli согласно настоящему изобретению подвергают инактивации хромосомного гена kfoE, во-первых, путем замены большей части его нуклеотидной последовательности экзогенным геном с резистентностью к канамицину ("первая генетическая модификация"), а затем путем делеции встроенного гена с помощью вектора, экспрессирующего рекомбиназу FLP ("вторая генетическая модификация"). Рекомбинантный штамм K4 E.coli, полученный после первой генетической модификации, обозначаемый здесь как Е. coli K4 (kfoE/kanR), был депонирован 30 апреля 2010 г. в Немецкой Коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH,Inhoffenstrasse 7B, 381 24 Braunschweig, Germany) в соответствии с Будапештским Соглашением под номером доступа DSM23578. Рекомбинантный штамм K4 E.coli, полученный после второй генетической модификации, обозначаемый здесь как Е. coli K4 (kfoE), был депонирован 26 мая 2010 г. в Немецкой Коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Inhoffenstrasse 7B, 381 24 Braunschweig, Germany) в соответствии с Будапештским Соглашением под номером доступа DSM23644. Инактивации гена kfoE добивались путем 3 последовательных трансформаций бактерии, во-первых,плазмидой, экспрессирующей красную рекомбиназу (pKD46), во-вторых, фрагментом ДНК, полученным из матрицы плазмиды (pDK4), соответствующим образом модифицированной для получения гомологии с геном kfoE, и в-третьих, плазмидой-помощником, экспрессирующей фермент рекомбиназу FLP(рСР 20). Для того чтобы получить первую генетическую модификацию Е. coli K4, использовали оба элемента: и плазмиду pKD46 (GenBank: AY048746), и линейный фрагмент ДНК. Плазмида pKD46, используемая на первой стадии трансформации Е. coli K4, состоит из 2154 нуклеотидов из фага лямбда и из гена,кодирующего резистентность к ампициллину. Указанная плазмида вызывает промоцию и повышение скорости рекомбинации при использовании линейных фрагментов ДНК. Линейный фрагмент ДНК, используемый в последующей трансформации Е. coli K4, получен методом ПЦР с использованием нескольких пар праймеров, которые включают в себя расширение гомологии и для гена kfoE, и для матрицы плазмиды pKD4, несущей кассету резистентности к канамицину (GenBank: AY 048743). Данная процедура дает возможность генерировать линейный фрагмент ДНК, несущий кассету резистентности к канамицину, имеющий на своих концах 5'- и 3'-гомологичные концы гена kfoE. В одном из воплощений настоящего изобретения трансформацию бактерии осуществляли путем электропорации, которая была выбрана в силу ее способности легко вырабатывать двойные трансформанты, которые могут быть получены из планшетов, содержащих как ампициллин, так и канамицин. Однако несмотря на то, что электропорация является предпочтительной технологией, такой результат может быть достигнут любым известным способом трансформации, таким как трансформация хлоридом кальция или декстран-DEAE-трансформация. Для того чтобы проверить корректность локализации замены исходной ДНК-последовательности кассетой резистентности к канамицину в трансформантах Е. coli K4 (kfoE/kanR), было предпринято несколько ПЦР-амплификации с использованием 2 близлежащих локус-специфических пар праймеров: с помощью первой пары праймеров можно было продемонстрировать образование нового соединения между оставшимся 5'-концом kfoE и встроенным геном kan, тогда как с помощью второй пары праймеров можно было продемонстрировать образование нового соединения между встроенным геном кап и оставшимся 3'-концом kfoE. Плазмидой-помощником, используемой для удаления кассеты резистентности к канамицину ("вторая генетическая модификация"), была плазмида рСР 20, несущая дрожжевой ген рекомбиназы FLP и ген резистентности к ампициллину. Обе плазмиды, pKD46 и рСР 20, являются чувствительными к температуре векторами, которые последовательно удаляли из трансформантных штаммов Е. coli K4 путем нагревания при 43C. Анализ секвенирования был предпринят в отношении Е. coli K4 (kfoE/kanR) с целью подтверждения замены гена kfoE, полностью или частично, кассетой резистентности к канамицину. Сходным образом, был предпринят анализ секвенирования в отношении Е. coli K4 (kfoE) с целью последующей проверки осуществления делеции кассеты резистентности к канамицину, приводящего к окончательному получению бактериального штамма с дезинтеграцией гена kfoE. Способ, используемый для успешного конструирования рекомбинантного штамма Е. coli K4, способного получать негликозилированный вариант природного гликозаминогликана, имеет многопрофильную применимость и может быть успешно использован в отношении других гликозилированных продук-3 025126 тов, когда такое гликозилирование желательно предотвратить. В заключение, был разработан способ получения бактерии, способной продуцировать негликозилированные варианты природных гликозаминогликанов. Другой объект настоящего изобретения связан с обеспечением способа биотехнологического получения хондроитина, включающего в себя следующие стадии:(1) культивирование в подходящей среде бактерии и(2) извлечение хондроитина, получаемого из его бульонной культуры. Любая рекомбинантная бактерия, способная продуцировать хондроитин, полученная согласно описанному выше способу инактивации гена, кодирующего фермент, ответственный за присоединение остатков фруктозы к хондроитину, может быть использована на стадии культивирования. В соответствии с предпочтительным воплощением настоящего изобретения рекомбинантная бактерия, полученная из штамма Е. coli K4, такого как Е. coli DSM23644, используется в качестве рекомбинантной бактерии, обладающего способностью продуцировать непосредственно хондроитин. Способ, привлеченный для культивирования бактерии Е. coli DSM23644, является общим способом,применимым для культивирования членов рода Escherichia. Указанный способ основан на предпочтительном, но не исключительном, применении культивационной среды, содержащей на 1 л: K2HPO4 3H2O 9,7 г, KH2PO4 8 г, цитрата натрия 5 Н 2 О 0,5 г, MgCl2 7 Н 2 О 0,2 г, казаминовых кислот 20 г, (NH4)2SO4 20 г,глюкозы 2 г, дрожжевого экстракта 10 г. Более высокие уровни получения хондроитина могут быть достигнуты путем соответствующей модификации композиции базальной среды и/или добавления в культуру дополнительных питательных веществ посредством подпитки субстратной подложки. Условия культивирования определяются таким образом, чтобы максимизировать бактериальный рост и получение хондроитина. Обычно культивирование производят при температурах 25 и 40C в течение периода от 8 до 72 ч. Супернатант собирают предпочтительно путем центрифугирования и используют для последующей очистки и характеристики получаемого хондроитина. Очистку хондроитина осуществляли в соответствии с адаптированными способами, описаннымиRodriguez и Jann (Eur. J. Biochem, vol. 177, 117-124, Октябрь, 1988). Вкратце, указанный способ, заимствованный для очистки хондроитина, основан на нескольких стадиях преципитации, начиная с культурального супернатанта и кончая сушкой под вакуумом. Идентичность получаемого продукта может быть установлена целым рядом способов, предпочтительно путем комбинирования способов, дающих возможность подтвердить структуру полисахаридной цепи и отсутствие в ней фруктозных остатков. Отсутствие фруктозы в очищенном продукте может быть успешно установлено путем кислотного гидролиза полученного продукта, в условиях, при которых, как известно, фруктоза высвобождается из нативного полисахарида K4, с последующим специальным анализом по определению фруктозы, высвобождаемой вследствие этого. Указанный тест стабильно показывал, что полисахарид, извлекаемый из культур бактерии Е. coli DSM23644, не содержит фруктозу, в отличие от нативного полисахарида K4,полученного из штамма U1-41 Escherichia coli O5:K4:H4, который постоянно получал полисахарид, содержащий фруктозу в количествах, ожидаемых в соответствии со структурной формулой полисахаридаK4. Дальнейшее подтверждение идентичности продукта, извлекаемого из культур бактерии Е. coliDSM23644, было получено путем переваривания указанного продукта ферментом хондроитиназой ABC,которая, как известно, полностью расщепляет до дисахаридов полисахарид хондроитин, свободный от остатков фруктозы, но не расщепляет нативный полисахарид K4. Иными словами, хондроитиназа ABC не способна расщепить нативный полисахарид K4. Эксперименты по расщеплению хондроитиназой ABC продукта, извлекаемого из культур бактерии Е. coliDSM23644, дают количество дисахаридного продукта, ожидаемого в случае полного расщепления, таким образом подтверждая природу полисахаридного остова и, в частности, отсутствие фруктозных остатков. В соответствии с одним из воплощений настоящего изобретения, для подтверждения функции kfoE в качестве гена, кодирующего фруктозилтрансферазную активность K4, конструировали рекомбинантную плазмиду, несущую нуклеотидную последовательность kfoE, и вводили в штамм K4 Е. coli (kfoE),чтобы способствовать восполнению утраченной функции. Вкратце, ген kfoE амплифицировали и клонировали в плазмиду pTrcHis (Invitrogen Corporation,5791 Van Allen Way PO Box 6482 Carlsbad, California) внутри рестрикционных сайтов Ncol и BamHI. Конструкцию pTrcHis-kfoE использовали для трансформации путем электропорации рекомбинантной Е.coli (kfoE), и трансформанты отбирали при 37C на планшетах, содержащих 100 мкг/мл ампициллина. Трансформанты Е. coli (kfoE), несущие конструкцию pTrcHis-kfoE, культивировали и полисахаридK4 очищали в соответствии со способом Rodriguez и Jann (Eur. J. Biochem, vol. 177, 117-124, October 1988), и с целью количественного определения фруктозы, присутствующей в полученном продукте, свободную фруктозу определяли как до, так и после гидролиза под действием 0,2 М трифторуксусной кислоты в течение 1 ч при 99C. Свободную фруктозу, определяемую до и после гидролиза, принимали за-4 025126 фруктозу, связанную со стартовой молекулой K4. В продукте, извлеченном из культуры Е. coliDSM23644, трансформированной конструкцией pTrcHis-kfoE, было показано наличие связанной фруктозы, что подтверждает то, что в данном штамме утрата фруктозилтрансферазной активности была восполнена плазмидой. Описание графического материала На фиг. 1 схематически показаны генетические модификации, которым подвергали штамм U1-41Escherichia coli O5:K4:H4 при получении конструкции Е. coli K4 (kfoE/kanR) и Е. coli K4 (kfoE):a) фрагмент ДНК, несущий кассету резистентности к канамицину (канамицин), фланкирован двумя рекомбинационными последовательностями FRT (мишени, распознаваемые флиппазой); ген резистентности к канамицину получен из матрицы плазмиды pKD4 с помощью сайтов примирования Р 1 и Р 2;b) подробная структура кластера генов К-антигена штамма U1-41 E. coli O5:K4:H4, где kfoD и kfoF являются фланкирующими генами гена kfoE;c) хромосомная ДНК Е. coli K4 (kfoE/kanR) с показанной дезинтеграцией гена kfoE путем замены фрагмента исходной ДНК геном резистентности к канамицину (канамицин);d) хромосомная ДНК Е. coli K4 (kfoE) с показанной финальной делецией большей части гена kfoE. На фиг. 2 показаны результаты ПЦР-амплификации, выполненной на 3 трансформантах Е. coli K4(kfoE/kanR), с целью верификации последовательности остальных фланкирующих областей 3'- и 5'-kfoE: полосы 1 и 10 соответствуют молекулярному весу маркера (ДНК-маркер в 1000 нуклеотидов); полосы 2-4: продукт ПЦР оставшегося 3'-конца kfoE указанных 3 трансформантов; полосы 6-8: продукт ПЦР оставшегося 5'-конца kfoE указанных 3 трансформантов; полосы 5 и 9: продукт ПЦР штамма U1-41 Escherichia coli O5:K4:H4, полученного соответственно с помощью 3'- и 5'-пар праймеров. На фиг. 3 показана хроматограмма полисахарида, получаемого штаммом Е. coli DSM23644, анализируемая методом капиллярного электрофореза после расщепления хондроитиназой ABC, где показан ненасыщенный -дисахарид (di-0S), типичный для расщепления хондроитина под действием хондроитиназы ABC (пик 8). На фиг. 4 показан 13 С-ЯМР-спектр хондроитина, получаемого посредством штамма E.coliDSM23644, полученного в соответствии с примером 3. Примеры Пример 1. Конструирование штамма Е. coli K4 (kfoE/kanR). Конструирование линейного фрагмента ДНК (фиг. 1 а), несущего оба гомологичных конца геновkanR и kfoE, осуществляли методом ПЦР с помощью вектора pKD4 в качестве матрицы и следующих ПЦР-праймеров: OL151: atgcttctaataatgtctggttcctatgttcaacaagaatgtgtaggctggagctgcttc (SEQ ID NO: 3) OL152:tcatactgcagcctccttaaaaatttcatataatctaaatgcacatatgaatatcctcctta (SEQ ID NO: 4). В каждой олигонуклеотидной последовательности первые 40 нуклеотидов обеспечивают гомологию гена kfoE, а оставшиеся 20 нуклеотидов обеспечивают гомологию матрицы плазмиды pKD4 (сайты примирования Р 1 и Р 2). ПЦР осуществляли со 120 нг ДНК-матрицы в соответствии со следующими условиями: 94C3 мин, (94C1 мин, 40C1 мин, 68C2 мин.)5 циклов, (94C1 мин, 59C1 мин, 68C2 мин.)30 циклов, 68C10 мин, 4C10 мин. Продукт ПЦР был очищен в геле, и бактерии были трансформированы. Штамм U1-41 Escherichia coli O5:K4:H4 (фиг. 1b) был получен и трансформирован плазмидойpKD46 в соответствии с тем, как описано Datsenko и Wanner (PNAS, vol. 97,12, 6640-6645, June 2000),затем его наносили на содержащую ампициллин среду. Ампициллин-резистентные трансформанты были идентифицированы и изолированы. Два трансформанта верифицировали путем экстракции плазмиды и ПЦР с использованием следующих праймеров и в следующих условиях:OL149: ccactcataaatcctcatagag (SEQ ID NO: 5), OL150: ccaacttacttctgacaacgat (SEQ ID NO: 6) при 94C3 мин, (94C1 мин, 43C1 мин, 68C2,5 мин.)30 циклов, 68C10 мин, 4C10 мин. Продукт ПЦР подвергали анализу методом электрофореза в 0,8% агарозном геле и идентифицировали продукт размером в 1799 пар нуклеотидов, в полном соответствии с ожидаемым размером продукта. Один из двух трансформантов pKD46 подвергли последующей электропорации с использованием ДНК-фрагмента, несущего и кассету резистентности к канамицину, и гомологичные концы kfoE. Используя селекцию планшетов в среде, содержащей как ампициллин, так и канамицин, изолировали рекомбинанты, несущие замену большей части нуклеотидной последовательности kfoE геном резистентности к канамицину. Три двойных трансформанта были верифицированы путем ПЦР-амплификации обеих, 3'- и 5'фланкирующих областей kfoE, с использованием следующих подходящих для этого праймеров: OL153:aatccgacggggactgtagatt (SEQ ID No: 7), OL142: aactgttcgccaggctcaag (SEQ ID NO: 8), OL143: gcgttttcccttgtccagat (SEQ ID NO: 9), OL1 54: gctaatgtatatgattgccaggt (SEQ ID NO: 10) при 95C5 мин, (94C1 мин,-5 025126 47C1 мин, 68C2 мин)30 циклов, 68C100 мин, 4C10 мин. Продукты ПЦР подвергали анализу методом электрофореза в 0,8% агарозном геле и идентифицировали соответственно два продукта размером в 1773 пары нуклеотидов для 3'-концевой амплификации и размером в 769 пар нуклеотидов для 5'-концевой амплификации гена kfoE, в полном соответствии с ожидаемым размером продукта (фиг. 2). В порядке верификации ориентации гена резистентности к канамицину и для того, чтобы удостовериться в корректном направлении тринскрипции гена, был осуществлен дополнительный анализ трансформантов путем секвенирования Е. coli K4 (kfoE/kanR) (фиг. 1 с с использованием следующих олигонуклеотидов: OL153: aatccgacggggactgtagatt (SEQ ID NO: 7) OL154: gctaatgtatatgattgccaggt (SEQ ID NO: 10). Полученная в результате нуклеотидная последовательность идентифицирована как SEQ ID NO: 14. Пример 2. Конструирование штамма Е. coli K4 (kfoE). Чтобы получить штамм Е. coli K4 (kfoE), лишенный кассеты резистентности к канамицину и несущий делецию большей части гена kfoE с сопутствующей потерей функции, предприняли дополнительную трансформацию штамма Е. coli K4 (kfoE/kanR) плазмидой рСР 20. После стадии электропорации трансформанты отбирали на среде, содержащей ампициллин, при 30C, а затем колонию подвергали очистке. Предполагаемые трансформанты выращивали на неселективных планшетах при 43C, а затем тестировали на предмет потери резистентности ко всем антибиотикам. Трансформанты штамма Е. coli K4 (kfoE) верифицировали путем секвенирования оставшихся фланкирующих 3'- и 5'-концов kfoE (фиг. 1d, с использованием следующих олигонуклеотидов: OL1 69:tgaggtgattgttggtaaaccttggtg (SEQ ID NO: 11), OL1 66: tactgtttctgcttgcccccgagtt (SEQ ID NO: 12). Полученная в результате нуклеотидная последовательность идентифицирована как SEQ ID NO: 13. Пример 3. Культивирование E. coli DSM23644 и анализ хондроитина. Культивирование E. coli DSM23644 осуществляли согласно Rodriguez и Jann (Eur. J. Biochem., vol. 177, 117-124, October 1988). Вкратце, вегетативную стадию культивирования осуществляли, начиная с 0,5 мл размороженного штамма, засевая матрас, содержащий 20 мл культурального бульона, состоящего, из расчета на 1 л, из 9,7 г K2HPO4 3H2O, 8 г KH2PO4, 0,5 г цитрата натрия 5 Н 2 О, MgCl2 7 Н 2 О 0,2 г, казаминовых кислот 20 г,сульфата аммония 20 г, глюкозы 2 г, дрожжевого экстракта 10 г, инкубировали при 37C в течение 16 ч,со встряхиванием при 180 об/мин и с горизонтальным смещением в 2,5 см. Последующую стадию культивирования проводили в периодической культуре, в 500-мл встряхиваемом матрасе, содержащем 85 мл бульонной культуры, как описано выше, высеваемой с 0,05% вегетативной культуры, полученной, как описано выше, и инкубируемой при 37C в течение 48 ч, со встряхиванием при 180 об/мин и с горизонтальным смещением в 2,5 см. В конце инкубации культуру собирали путем центрифугирования и супернатант подвергали очистке с целью выделения и получения характеристик хондроитина. Очистку хондроитина осуществляли в соответствии с адаптированным способом, описанным Rodriguez и Jann (Eur. J. Biochem., vol. 177, 117-124, October 1988). Вкратце, полисахарид осаждали из культурального супернатанта с помощью цетавлона (алкилтриметиламмония бромид, CAS NO: 71 92-88-3), экстрагировали с помощью 0,5 М NaOH при 3C, производили нейтрализацию и последовательно очищали 3 циклами преципитации 80% этанолом. Конечную стадию очистки осуществляли 90% холодным фенолом, pH 6,8, для осаждения контаминирующих белков, восстанавливая таким образом водную фазу путем центрифугирования. Очищенный хондроитин восстанавливали из водной фазы путем осаждения 80% этанолом и сушили под вакуумом. Для установления природы получаемого хондроитина было использовано несколько аналитических подходов. Первый подход был основан на присутствии или отсутствии фруктозы в извлекаемом из культуры продукте после кислотного гидролиза, осуществляемого посредством обработки 0,2 М трифторуксусной кислотой в течение 1 ч при 99C. Чтобы количественно оценить присутствие фруктозы в полученном продукте, свободную фруктозу определяли как перед гидролизом, так и после него. Анализ фруктозы проводили ферментативным путем с помощью набора EnzyPlus сахарозы/D-глюкозы/D-фруктозы, поставляемого компанией BIOCONTROL(BioControl Systems Inc. 12822 SE 32nd Street Bellevue, WA 98005, United States). Разницу между свободной фруктозой, присутствующей после гидролиза, и фруктозой, присутствующей перед гидролизом, принимали в качестве фруктозы, связанной с исходной молекулой K4. Продукт, извлеченный из культуры E. coli DSM23644, не обнаруживал наличие связанной фруктозы, что подтверждает то, что данный штамм получает полисахарид, свободный от фруктозы. Отсутствие связанной фруктозы в полисахариде, извлеченном из культур Е. coli DSM2 3644, как описано выше, было подтверждено ферментативным расщеплением хондроитиназой ABC. Дополнительно было продемонстрировано, что при расщеплении очищенного хондроитина хондроитиназой ABC получался ненасыщенный -дисахарид (di-0S), типичный для расщепленного хондроитина, что под-6 025126 тверждается капиллярным электрофорезом (СЕ) с использованием технологии мицеллярной электрокинетической хроматографии (МЕСК) (фиг. 3). Подтверждение структуры di-0S было получено с помощью соответствующего ссылочного стандартного -дисахарида (с эквивалентной электрофоретической элюцией). Количественное определение полученного di-0S осуществляли с помощью дополнительной калибровочной кривой. Наконец, очищеный хондроитиновый полисахарид, получаемый Е. coli DSM23644, был охарактеризован 13C-ЯМР (фиг. 4). С использованием такой технологии было показано, что искомый продукт является спектрально идентичным продукту, полученному после удаления фруктозы из нативного полисахарида K4 путем кислотного гидролиза. Пример 4. Опосредованное плазмидой восполнение функции kfoE. В порядке верификации функции kfoE как гена, кодирующего активность фруктозилтрансферазыK4, конструировали рекомбинантную плазмиду, несущую нуклеотидную последовательность kfoE дикого типа, и вводили ее в штамм K4 Е. coli (kfoE), чтобы способствовать восполнению утраченной функции. Ген kfoE амплифицировали с использованием следующих олигонуклеотидов: OL172: acaacatgttactaataatgtctggttcctatgttc (SEQ ID NO: 15), OL173: actggatccttatcatactgcagcctcctta (SEQ ID NO: 16). Плазмиду pTrcHis (4400 п.н. - Invitrogen Corporation, 5791 Van Allen Way PO Box 6482 Carlsbad, California) использовали для введения амплифицированного и очищенного в геле гена kfoE (1569 п.н.) в соответствующие сайты клонирования. 70 нг вектора pTrcHis, обработанного ферментами рестрикции Ncol and BamHI, и 75 нг гена kfoE,имеющего совместимые Pcil/BamHI-переваренные концы, подвергали реакции лигирования при 25C в течение 15 мин. Затем 50 мкл DH5-компетентных клеток Escherichia coli (Invitrogen Corporation, 5791 Van AllenWay PO Box 6482 Carlsbad, California) подвергали электропорации с использованием 5 мкл лигирующей смеси, и при 37C было отобрано пять трансформантов на планшетах, содержащих 100 мкг/мл ампициллина. После очистки колонии сконструированную плазмиду pTrcHis-kfoE экстрагировали и расщепляли под действием рестрикционного фермента Mfe I, который способен разрезать ДНК-конструкцию внутри встроенной последовательности kfoE. Посредством анализа путем гель-элктрофореза 3 из 5 трансформантов после обработки ферментомMfe I имели ожидаемую длину в 5887 п.н., и анализ последовательности подтвердил корректность инсерции гена kfoE. Верифицированную конструкцию pTrcHis-kfoE использовали для трансформации путем электропорации рекомбинантного штамма Е. coli DSM23644, и трансформанты отбирали на планшетах, содержащих 100 мкг/мл ампициллина. Отобранные трансформанты культивировали в условиях, описанных в примере 3, и полисахарид K4 подвергали очистке в соответствии с методикой, описанной Rodriguez и Jann (Eur. J. Biochem, vol. 177,117-124, October 1988). С целью количественного определения фруктозы, присутствующей в полученном продукте, свободную фруктозу определяли как до, так и после гидролиза под действием 0,2 М трифторуксусной кислоты в течение 1 ч при 99C. Свободную фруктозу, определяемую до и после гидролиза, принимали за фруктозу, связанную со стартовой молекулой K4. В продукте, извлеченном из культуры Е. coliDSM23644, трансформированной конструкцией pTrcHis-kfoE, было показано наличие связанной фруктозы, что подтверждает то, что в данном штамме утрата фруктозилтрансферазной активности была восполнена плазмидой. Анализ фруктозы проводили ферментативным путем с помощью набора EnzyPlus сахарозы/Dглюкозы/D-фруктозы. Разницу между свободной фруктозой, присутствующей после гидролиза, и фруктозой, присутствующей перед гидролизом, принимали в качестве фруктозы, связанной с исходной молекулой K4. Продукт, извлеченный из культуры E.coli DSM23644, трансформированной конструкцией pTrcHiskfoE, не обнаруживал наличие связанной фруктозы, что подтверждает то, что в данном штамме утрата фруктозилтрансферазной активности была восполнена плазмидой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантная бактерия, продуцирующая хондроитин, представляющий собой линейный гликозаминогликан, образованный остатками D-глюкуроновой кислоты (GlcUA) и N-ацетил-Dгалактозамина (GalNAc), связанными посредством связей 1-3 (GlcUAGalNAc) и 1-4 (GalNAcGlcUA), отличающаяся тем, что указанная рекомбинантная бактерия получена из бактерии, принадлежащей к группе K-антигена, которая включает роды Escherichia, Haemophilus, Campylobacter, Gloeocapsa или Vibrio, причем в указанной бактерии ген kfoE делетирован или инактивирован путем полного или частичного его замещения либо посредством вставки в него нуклеотидной последовательности, где указанный ген кодирует фермент, ответственный за присоединение остатков фруктозы к линейному остову хондроитина, выбранный из группы, состоящей из:(A) белка, содержащего аминокислотную последовательность SEQ ID NO: 2, обладающего фруктозилтрансферазной активностью;(B) белка, содержащего аминокислотную последовательность SEQ ID NO: 2, модифицированную путем делеции, замещения или вставки одного или нескольких аминокислотных остатков, и обладающего фруктозилтрансферазной активностью; и(C) белка, содержащего аминокислотную последовательность, гомологичную по меньшей мере на 50% аминокислотной последовательности SEQ ID NO: 2, и обладающего фруктозилтрансферазной активностью. 2. Рекомбинантная бактерия по п.1, в которой ген kfoE имеет нуклеотидную последовательность,выбранную из группы, состоящей из:(a) нуклеотидной последовательности, которая содержит последовательность SEQ ID NO: 1 и кодирует белок, обладающий фруктозилтрансферазной активностью;(c) нуклеотидной последовательности, которая кодирует белок, обладающий фруктозилтрансферазной активностью, и содержит нуклеотидную последовательность, гомологичную по меньшей мере на 50% нуклеотидной последовательности SEQ ID NO: 1. 3. Рекомбинантная бактерия по любому из пп.1 и 2, в которой ген kfoE инактивирован путем полного или частичного его замещения кассетой резистентности к канамицину с ее последующим удалением,что приводит к полной или частичной делеции гена kfoE. 4. Рекомбинантная бактерия по п.3, происходящая из бактерии вида Escherichia coli. 5. Рекомбинантная бактерия по п.4, происходящая из серотипа бактерии вида Escherichia coli, принадлежащего группе 2 K-антигена. 6. Рекомбинантная бактерия по п.5, происходящая из штамма U1-41 Escherichia coli O5:K4:H. 7. Рекомбинантная бактерия по любому из пп.1 и 2, представляющая собой Escherichia coliDSM23578 или Escherichia coli DSM23644. 8. Рекомбинантная бактерия по п.7, представляющая собой Escherichia coli DSM23644. 9. Способ получения хондроитина биотехнологическим путем, включающий следующие стадии:(A) культивирование в соответствующей среде рекомбинантной бактерии по любому из пп.1-8;(B) извлечение из культуральной среды продуцированного бактериями хондроитина и его очистку. 10. Способ по п.9, где указанной рекомбинантной бактерией является Escherichia coli DSM23578 или Escherichia coli DSM23644. 11. Способ по п.9, где указанной рекомбинантной бактерией является Escherichia coli DSM23644.
МПК / Метки
МПК: C08L 5/08, A61K 31/737, C08B 37/00, C12R 1/19, C08B 37/08
Метки: хондроитина, путем, способ, биотехнологическим, бактерия, получения, рекомбинантная
Код ссылки
<a href="https://eas.patents.su/17-25126-rekombinantnaya-bakteriya-i-sposob-polucheniya-hondroitina-biotehnologicheskim-putem.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантная бактерия и способ получения хондроитина биотехнологическим путем</a>
Предыдущий патент: Применение высокой скорости сдвига в доставке лекарственных средств
Следующий патент: Способ вычисления вариограммной модели скважины и постоянное устройство для вычисления посредством программы вариограммной модели скважины
Случайный патент: Способ получения сливок и содержащий их пищевой продукт