Замещенные пиперазиноны и их терапевтическое применение
Номер патента: 3430
Опубликовано: 24.04.2003
Авторы: Йю Кристоф, Лезюр Брижитт, Жибуло Тьерри, Анри Маргерит
Формула / Реферат
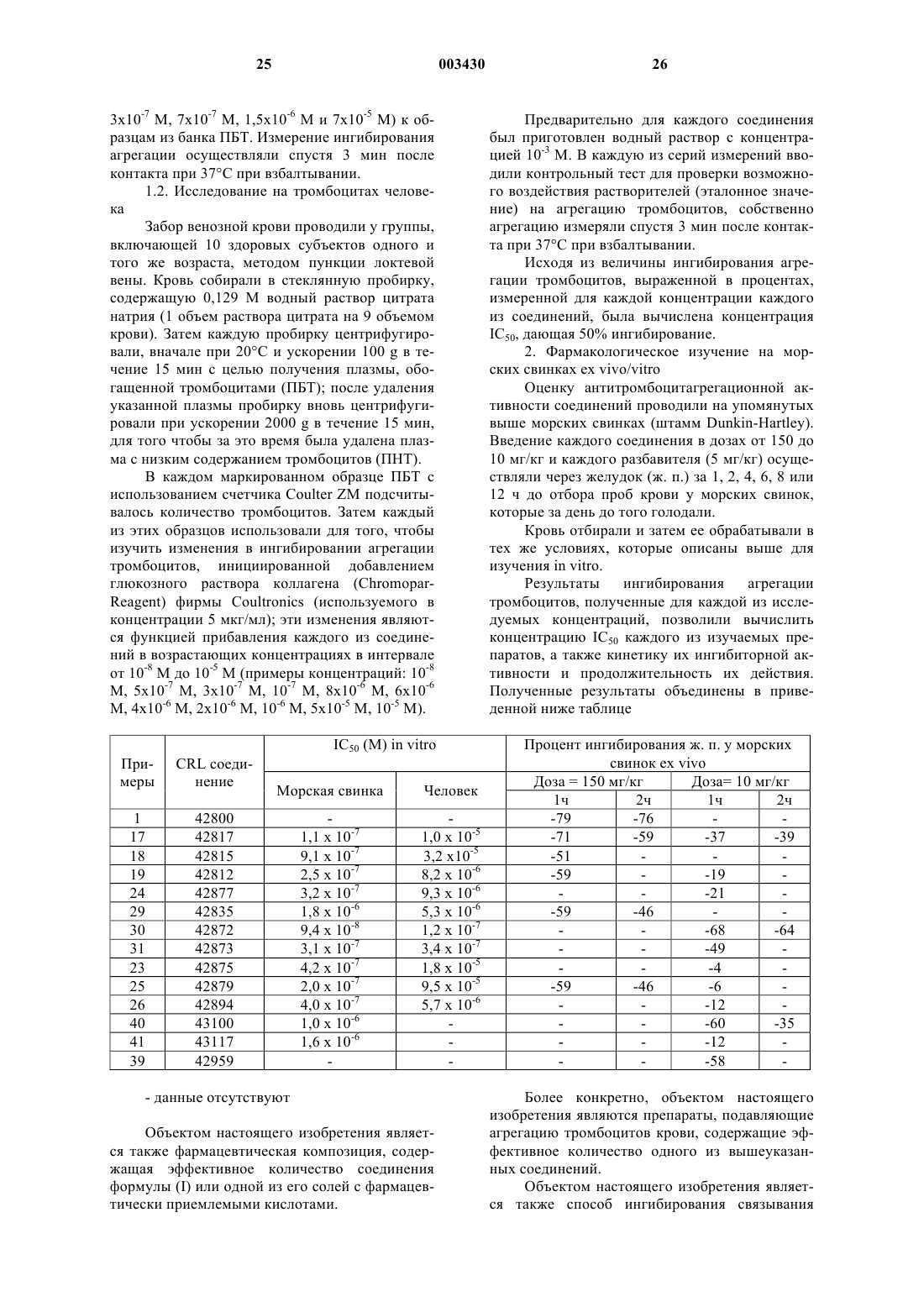
1. Соединение общей формулы (I)
в которой
R1 выбирают из водорода, C1-C4алкильной группы и фенил (C1-C4алкильной) группы;
R2 выбирают из водорода, гидроксильной группы и группы, являющейся защитной для амидиногруппы;
R3 выбирают из групп формулы
-NH-CO-R6,
где R6 выбирают из C1-C4алкоксильной, C3-C7алкилоалкоксильной группы, бензилоксигруппы, метоксифенильной, диметоксифенильной, бензодиоксолильной и бензодиоксанильной группы,
и групп формулы
-NH-SO2-R7,
где R7 выбирают из
C1-C5алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильной и трифторметильной групп;
моно- или бициклических C3-C12циклоалкильных групп;
моно-, би- или трициклических C6-C14арильных групп;
гетероарильных групп, выбранных из пиридильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной и изоксазолильной группы;
фенил (C1-C4)алкильной и нафтил (C1-C4)алкильной групп;
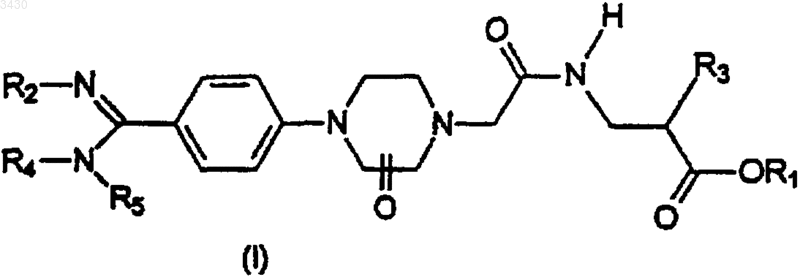
и групп формулы
в которой n = 1, 2 или 3;
арильные или гетероарильные группы R7, необязательно замещены одной или более группами, независимо выбранными из галогенов, C1-C4алкильной, трифторметильной групп, C1-C4алкилтиогруппы, C1-C4алкилоксигруппы, C1-C4алкилсульфонильной группы, нитрогруппы, ди((C1-C4)алкил)аминогруппы, фенильной группы, нафтильной группы и гетероарильных групп, выбранных из тиенильной, фурильной и пиридильной группы, и из групп -COOR, -CH2-COOR или -O-CH2COOR, где R представляет собой C1-C4алкильную группу;
R4 и R5 независимо друг от друга выбирают из водорода, C1-C5алкильной группы или вместе с атомом азота они образуют группу, выбранную из пиперидильной и морфолинильной групп;
оксогруппа находится в положении 2 или 3 пиперазина;
или его аддитивная соль с фармацевтически приемлемой кислотой.
2. Соединение по п.1, в котором R3 представляет собой -NH-SO2-R7 группу.
3. Соединение по п.2, котором R7 выбирают из фенильной и толильной групп.
4. Соединение по п.3, выбранное из
(2S)-3-{[2-(4-{4-[амино(имино)метил]фенил}-2-оксопиперазино)ацетил]амино}-2-[(фенилсульфонил)амино]этилпропаноата,
(2S)-3-{[2-(4-{4-[амино(имино)метил]фенил}-2-оксопиперазино)ацетил]амино}-2-[(фенилсульфонил)амино]пропионовой кислоты,
(2S)-3-{[2-(4-{4-[амино[(этоксикарбонил)имино]метил]-фенил}-2-оксопиперазино)ацетил]амино}-2-{[фенилсульфонил]амино}пропионовой кислоты,
(2S)-3-{[2-(4-{4-[имино(морфолино)метил]фенил}-2-оксопиперазино)ацетил]амино}-2-{[4-толуолсульфонил]амино}этилпропаноата,
(2S)-3-{[2-(4-{4-[амино(имино)метил]фенил}-2-оксопиперазино)ацетил]амино}-2-{[4-толуолсульфонил]амино}пропионовой кислоты,
или его аддитивной соли с фармацевтически приемлемой кислотой.
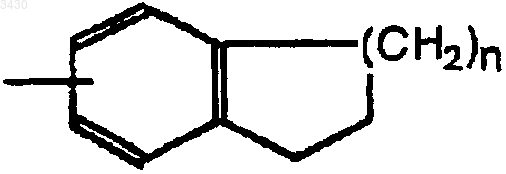
5. Способ получения соединения формулы (I) по п.1 путем:
а) взаимодействия кислоты формулы
в которой группа Z является предшественником группы

с амином формулы
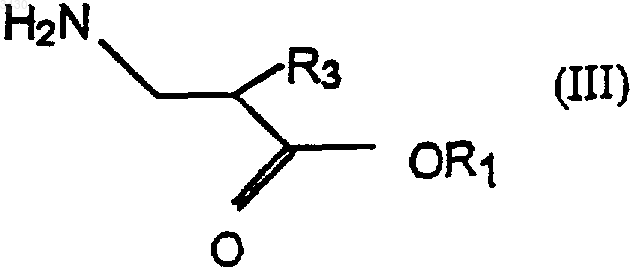
для получения соединения формулы
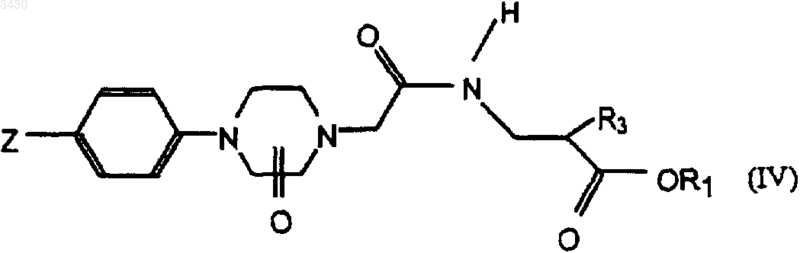
и
б) превращения группы Z в группу
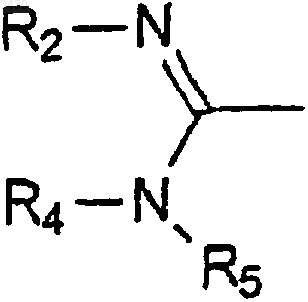
6. Терапевтическая композиция, содержащая в качестве активного соединения соединение по любому из пп.1-4.
7. Применение соединения по любому из пп.1-4 для получения антитромботического медицинского препарата.
8. Способ ингибирования связывания фибриногена с тромбоцитами крови млекопитающих, включающий введение эффективного количества соединения по п.1.
9. Способ ингибирования у пациента агрегации тромбоцитов крови, включающий введение этому пациенту эффективного количества соединения по п.1.
10. Способ лечения тромбоза у пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
11. Способ предотвращения риска возникновения тромбоза у пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
Текст
1 Настоящее изобретение касается новых соединений, которые представляют собой ингибиторы связывания фибриногена с рецепторами тромбоцитов GpIIb/IIIa, терапевтическое применение которых возможно в качестве антитромботического средства. При патологических процессах, приводящих к образованию тромба (сгустка крови), а затем к его увеличению в объеме, ключевым этапом является агрегация тромбоцитов, поскольку она является причиной возникновения этого явления. Более конкретно, начиная с возникновения тромба (в частности, при артериальном кровообращении) совместное действие нескольких зависимых друг от друга биохимических реакций вызывает агрегацию значительного и возрастающего количества тромбоцитов,превращая растворимый фибриноген в нерастворимые волокна фибрина, которые увеличивают объем массы тромбоцитов, что вначале происходит в местах реального поражения сосуда артерии, а затем все больше и больше - в просвете этого сосуда. При таком механизме агрегации тромбоцитов активация рецепторов GpIIb/IIIa является причиной усиления агрегации тромбоцитов. Фибриноген, который может связываться с этими рецепторами с помощью двух своих димеров, усиливает связывание тромбоцитов и таким образом вызывает образование тромбоцитной массы, которая создает тромб в месте разрыва атеросклеротической бляшки. Такой механизм агрегации тромбоцитов особенно активен во всех случаях артериального тромбоза: возникает ли он при проведении кардиологического вмешательства (подкожная ангиопластика в просвете сосуда; внедрение стента), коронарной хирургии (аортокоронарное шунтирование; операция на сердечном клапане),в случае острых сердечных заболеваний (инфаркт миокарда, нестабильная стенокардия,острые коронарные синдромы и т. д.) или при церебральной ишемии определенного вида или,наконец, в случае ишемии миокарда, которая может усложнить реакцию на антитромбозное лечение. Таким образом, снижение или предотвращение активации тромбоцитов в контакте с разрушенной атеросклеротической бляшкой представляет собой новый и эффективный терапевтический подход к лечению тромбоза (в частности, артериального тромбоза) и является поэтому эффективным способом предотвращения возникновения острых коронарных синдромов,включая нестабильную стенокардию и инфаркт миокарда. Настоящее изобретение направлено на новые конкурирующие ингибиторы связывания фибриногена на рецепторах GpIIb/IIIa, которые можно использовать в качестве антитромбозных лекарственных средств. 2 Настоящее изобретение направлено также на обеспечение соединений, которые можно вводить перорально, что дает увеличенный срок воздействия и возможность избежать риск кровотечения. Одним из объектов настоящего изобретения являются соединения общей формулыR2 выбирают из водорода, гидроксильной группы и группы, являющейся защитной для амидино группы;-NH-SO2-R7,где R7 выбирают из C1-C5 алкильных групп, необязательно замещенных одной или более группами, выбранными из галогенов, гидроксильной и трифторметильной группы; моно- или бициклических С 3-C12 циклоалкильных групп; моно-, би- или трициклических C6-C14 арильных групп; гетероарильных групп, выбранных из пиридильной, тиенильной, хинолильной, бензодиоксанильной, бензодиоксолильной и изоксазолильной группы; фенил (C1-C4) алкильной и нафтил (C1-C4) алкильной группы; и групп формулы в которой n = 1, 2 или 3; причем указанные арильные или гетероарильные группы R7 необязательно замещены одной или более группами, независимо выбранными из галогенов, C1-C4 алкильной группы, трифторметильной группы, C1-C4 алкилтио-, C1-C4 алкилоксигруппы, C1-C4 алкилсульфонильной группы, нитро-, диC1-C4)алкил)амино-группы,фенильной группы, нафтильной группы, а гетероарильные группы выбраны из тиенильной,фурильной,пиридильной групп и из-COOR, -CH2-COOR или -O-CH2COOR групп,где R представляет собой C1-C4 алкильную группу,R4 и R5 независимо друг от друга выбирают из водорода, C1-C5 алкильной группы или они вместе с атомом азота образуют группу,выбираемую из пиперидильной и морфолинильной групп, 3 оксогруппа находится в втором положении или третьем положении пиперазина; и их аддитивные соли с фармацевтически приемлемыми кислотами. В качестве защитных групп для указанной амидиногруппы могут быть названы этоксикарбонильная, бензилоксикарбонильная, п-нитробензилоксикарбонильная и трет-бутоксикарбонильная группы. В качестве примеров арильных групп могут быть названы фенильная, -нафтильная, нафтильная, флуоренильная и бифенилильная группы. Указанные C1-C5 алкильные группы могут быть линейными или разветвленными. В качестве примеров можно назвать метильную,этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную и пентильную группы. Аналогично C1-C4 алкоксигруппы могут быть линейными или разветвленными. В качестве примеров можно назвать метокси-, этокси-,пропокси-, изопропокси-, бутокси- и изобутоксигруппы. Упомянутые галогены можно выбрать из фтора, хлора, брома и йода. Термином "аддитивные соли фармацевтически приемлемых кислот" обозначены соли,которые обеспечивают определенные биологические свойства свободных оснований при отсутствии нежелательного воздействия. Такими солями могут быть, в частности, соли, образованные неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота,серная кислота, азотная кислота или фосфорная кислота; кислыми солями металлов, такими как двузамещенный ортофосфат натрия и однозамещенный сульфат калия, и органическими кислотами. Соединения формулы (I) могут быть получены а) взаимодействием кислоты формулы и б) превращением указанной группы Z в группу Кислоты формулы (II) могут взаимодействовать с аминами формулы (III) в полярном растворителе таком как диметилформамид, тетрагидрофуран или этилацетат в присутствии связующего вещества (DCC/HOBT, бензилоксифталата (ВОР) или изобутилхлорформиата) при температуре от 15 до 50 С. Если Z представляет собой NC-группу, то указанную группу Z можно превратить в амидоксим путем добавления гидроксиламина к этой нитрильной группе в присутствии подходящего основания (K2 СО 3, Et3N или C2H5ONa) в спиртовом растворителе. Гидрогенолиз полученных соединений, осуществленный в смеси уксусного ангидрида и уксусной кислоты в присутствии палладия на угле, дает соединения формулы (I), в которой R2 представляет собой водород. Если Z представляет собой NC-группу, то указанную группу Z также можно превратить в имидат путем добавления этанола в присутствии НСl в этилацетате. Полученный имидат затем превращают в соединения формулы (I), в которой R2 представляет собой водород, -NR4R5 представляет собой или пиперидильную, или морфолинильную группу, путем взаимодействия с соответствующим амином в среде этанол/этилацетат. Соединения формулы (II), содержащие 2 пиперазиноновую группу, в случае, когда Z представляет собой нитрильную группу, можно получить по следующей схеме для получения соединения формулы 4-Фторбензонитрил взаимодействует с избытком этилендиамина в апротонном растворителе с получением 4-(2-аминоэтил)бензонитрила, который затем подвергают реакции моноалкилирования этилбромацетатом в полярном 5 растворителе, таком как этанол или ацетонитрил, в присутствии неорганического основания или третичного амина. Ацилирование хлорацетилхлоридом при последующих циклизации и гидролизе дает кислоту (1). Соединения формулы (II), содержащие 3 пиперазиноновую группу, когда Z представляет собой нитрильную группу, можно получить по следующей схеме 4-(2-Аминоэтил)бензонитрил подвергают диалкилированию этилбромацетатом; циклизацию осуществляют в присутствии третичного амина, неорганического основания или их смеси; после гидролиза получают кислоту (2). Аддитивные соли получают стандартным образом путем взаимодействия соединения формулы (I) с фармацевтически приемлемой кислотой в подходящем растворителе. Аддитивные соли при обработке их сильным основанием можно превратить в основания. Сведения, подтверждающие возможность осуществления изобретения Следующие далее примеры иллюстрируют получение соединений формулы (I). А - получение соединений формулы (II) А-1. Синтез 2-[4-(4-цианофенил)-2-оксопиперазино]уксусной кислоты (соединение 1). а) 4-(2-Аминоэтиламино)бензонитрил (соединение 1 а). Суспензию 4-фторбензонитрила (167 г,1,38 моль), этилендиамина (330 г, 5,5 моль) и карбоната калия (300 г, 2,17 моль) в 2 л толуола нагревали в колбе с обратным холодильником в течение 6 ч. После охлаждения до комнатной температуры смесь отфильтровывали и промывали толуолом, фильтрат выпаривали, чтобы получить желтое масло, которое перекристаллизовывали из толуола. Полученное вещество отфильтровывали, промывали толуолом и высушивали в вакууме при 50 С с получением 200 г твердого вещества слегка желтого цвета. Выход = 90% Температура плавления = 85 С 1H-ЯМР (400 МГц, СDСl3):1.2 (bs, 2H),2.9 (t, 2H), 3.12 (q, 2H), 4.7 (bs, 1H), 6.5 (d, 2H),7.3 (d, 2H). б) 2-2-(Хлорацетил)-2-(4-цианоанилино) этиламиноэтилацетат (соединение 1 б). К суспензии 4-(2-аминоэтиламино)бензонитрила (80,5 г, 0,5 моль) и диизопропилэтиламина [ДИЭА] (65 г, 0,5 моль) в 800 мл ацетонитрила добавляли этилбромацетат (84 г, 0,5 6 моль). Перемешивание проводили в течение 18 ч при комнатной температуре. Большую часть ацетонитрила выпаривали, а остаток переносили в дихлорметан. Полученный раствор промывали водой и высушивали над сульфатом натрия; неочищенный продукт пропускали через короткую колонку с диоксидом кремния[элюент:дихлорметан, затем дихлорметан/метанол в соотношении 20/1] для получения масла. Полученный выше продукт растворяли в 1 л тетрагидрофурана. Добавляли диизопропилэтиламин (51 г, 0,4 моль), затем при температуре примерно 5 С медленно вводили хлорацетилхлорид (45 г, 0,4 моль). После перемешивания при комнатной температуре в течение 18 ч добавляли 1 л этилацетата, смесь 3 раза промывали водой, высушивали над сульфатом натрия и выпаривали. В результате получали твердое вещество, которое смешивали со смесью дихлорметан/эфир (1/3). Суспензию отфильтровывали, промывали смесью дихлорметан/эфир(1/3) и высушивали в вакууме с получением 100 г кристаллического твердого вещества бежевого цвета. Выход = 62% 1(dd, 4H), 7.3 (dd, 4H). в) 2-[4(4-Цианофенил)-2-оксопиперазино] этилацетат (соединение 1 в). Суспензию 2-2-(хлорацетил)-2-(4-цианоанилино)-этиламиноэтилацетата (152 г, 0,47 моль), диизопропилэтиламина (73 г, 0,57 моль) и йодистого натрия (85 г, 0,57 моль) в 1200 мл ацетонитрила нагревали в колбе с обратным холодильником в течение 2 ч. Растворитель выпаривали, а остаток переносили в дихлорметан и промывали водой, высушивали над сульфатом натрия и выпаривали до получения коричневого масла, которое перекристаллизовывали из смеси циклогексан/этилацетат с получением 125 г кристаллического твердого вещества коричневатого цвета. Выход = 93% Температура плавления = 108 С 1H-ЯМР (400 МГц, CDCl3):1.3 (t, 3H),3.65 (m, 4H), 4.05 (s, 2H), 4.2 (m, 4H), 6.8 (d, 2H),7.5 (d, 2H). г) 2-[4-(4-Цианофенил)-2-оксопиперазино] уксусная кислота (соединение 1 г). 2-[4-(4-Цианофенил)-2-оксопиперазино] этилацетат (20,7 г, 72 ммоль) растворяли в 80 мл метанола, 80 мл тетрагидрофурана и 100 мл воды. Затем в полученный раствор при перемешивании добавляли моногидрат гидроксида лития(4 г, 98 ммоль). Перемешивание продолжали в течение 20 мин, затем органический растворитель удаляли в вакууме. К полученной суспензии добавляли приблизительно 100 мл воды и полученную смесь подкисляли. Полученный(67 г, 0,4 моль) в 400 мл ацетонитрила нагревали в колбе с обратным холодильником в течение 18 ч. Неочищенный продукт отфильтровывали и пропускали через короткую колонку с диоксидом кремния (элюент:дихлорметан) с получением 58 г коричневого масла. Выход = 87% 1MS-Cl: m/z 287 (M+H)+ б) 2-[4-(4-Цианофенил)-3-оксопиперазино] уксусная кислота (соединение 2 б). Суспензию 2-[2-(4-цианоанилино)этил(2 этокси-2-оксоэтил)амино]этилацетата (58 г,0,174 моль), диизопропилэтиламина (DIEA) (4 г,0,03 моль) и карбоната калия (24 г, 0,174 моль) в 400 мл ацетонитрила нагревали в колбе с обратным холодильником в течение 2 дней. Смесь отфильтровывали и промывали в дихлорметане. Фильтрат выпаривали для получения твердого вещества коричневого цвета, которое растворяли в 150 мл метанола и 50 мл воды при последующем добавлении моногидрата гидроксида лития (8,4 г, 0,2 моль). После перемешивания при комнатной температуре в течение 30 мин половинное количество метанола удаляли в вакууме с получением суспензии. Добавляли приблизительно 100 мл воды и смесь подкисляли при 5 С. Полученный продукт отфильтровывали, промывали водой и высушивали в вакууме при 50 С для получения 27,2 г порошка бежевого цвета. Выход = 55% Температура плавления = 120 С 1H-ЯМР (200 МГц, ДМСО-d6):2.95 (t,2H), 3.3 (s, 2H), 3.4 (s, 2H), 3.7 (t, 2H), 7.65 (d,2H), 7.85 (d, 2H). Б. Получение промежуточных соединений формулы IV Б-1. Синтез (2S)-3-2[(4-(4-цианофенил)-2 оксопиперазино)ацетил]амино-2-[(фенилсульфонил)амино]этилпропаноата (соединение 3). Изобутилхлорформиат (1,1 г, 8 ммоль) добавляли к суспензии 2-[4-(4-цианофенил)-2 оксопиперазино]уксусной кислоты (1) (2,02 г, 003430 8 7,8 ммоль) и N-метилморфолина (1,6 г, 15,8 ммоль) в 50 мл тетрагидрофурана при температуре приблизительно 5 С. Через 20 мин при 5 С добавляли гидрохлорид(2S)-3-амино-2(фенилсульфониламино)этилпропаноата (2,39 г,7,8 ммоль). Перемешивание продолжали в течение 18 ч для получения вязкой суспензии. Затем добавляли 100 мл этилацетата, полученный продукт отфильтровывали и промывали сначала водой, а затем этилацетатом и эфиром. После высушивания было получено 2,8 г твердого вещества белого цвета. Выход = 70% 1H-ЯМР (400 МГц, ДМСО-d6):1.0 (t, 3 Н),3.2 (m, 1H), 3.4 (m, 3 Н), 3.45 (t, 2H), 3.8 (q, 2 Н),3.95 (m, 5H), 7.0 (d, 2H), 7.55 (m, 5H), 7.75 (d,2H), 8.15 (t, 1H), 8.4 (bd, 1H). Описанный выше способ использовали для синтеза следующих соединений. Б-2. (2S)-3-2-[(4-(4-Цианофенил)-2-оксопиперазино)ацетил]амино-2-[(3-пиридилсульфонил)амино]этилпропаноат (соединение 4). Исходное вещество: дигидрохлорид (2S)-3 амино-2-[(3-пиридилсульфонил)амино]этилпропаноата. Выход = 74% 1(соединение 16). Гексафторфосфат бромтрипирролидинофосфония [РуВrоР] (1,04 г, 2,23 ммоль), диизопропилэтиламин (DIEA) (0,78 мл, 4,46 ммоль) и трифторацетат (2S)-3-амино-2-[(1,1'-бифенил)-4 илсульфониламино]метилпропаноата (0,5 г, 1,15 ммоль) добавляют последовательно к раствору 2-[4-(4-цианофенил)-2-оксопиперазино]уксусной кислоты (соединение 1) (0,29 г, 1,12 ммоль) в 7 мл диметилформамида. Перемешивание продолжали в течение 5 ч. Потом добавляли этилацетат и образовавшуюся органическую фазу сначала промывали 5%-ной лимонной кислотой,а затем водой и высушивали над сульфатом натрия. После хроматографии на диоксиде кремния (дихлорметан/метанол в соотношении 9/1) 11 было получено 0,58 г твердого вещества белого цвета. Выход = 90%(d, 2H). Описанный выше способ использовали для синтеза следующих соединений. Б-15. (2S)-3-2-[(4-(4-Цианофенил)-2-оксопиперазино)ацетил]амино-2-[(3-трифторметилфенилсульфонил)амино]метилпропаноатMS-ES: m/z 466 (M + Н)+ Б-21. Синтез (2S)-3-(2-[(4-(4-цианофенил)-3 оксопиперазино)ацетил]амино-2-[(фенилсульфонил)амино]этилпропаноата (соединение 24). Изобутилхлорформиат (1,47 г, 10,8 ммоль) добавляли к суспензии 2-[4-(4-цианофенил)-3 оксопиперазино]уксусной кислоты (соединение 2) (2,59 г, 10 ммоль) и N-метилморфолина (2,2 г,21,8 ммоль) в 50 мл тетрагидрофурана при температуре приблизительно 5 С. Полученную смесь перемешивали при комнатной температуре в течение 20 мин; затем добавляли гидрохлорид 2-(S)-3-амино-2-(фенилсульфониламино) этилпропаноата (10,2 ммоль). Перемешивание продолжали в течение 18 ч. После этого добавляли 100 мл этилацетата и воду и после расслоения полученную органическую фазу отделяли, промывали ее водой и высушивали над сульфатом натрия. Сырой продукт очищали тонкослойной хроматографией (дихлорметан/метанол при соотношении 15/1) с получением 2,5 г твердого белого вещества. Выход = 48% 1 Н-ЯМР (400 МГц, CDCl3):1.0 (t, 3H),2.85 (m, 1H), 2.95 (m, 1H), 3.1 (s, 2H), 3.3 (m,1H), 3.35 (s, 2H), 3.7 (m, 3H), 3.85 (q, 2H), 3.9 (bs,1H), 5.7 (bs, 1H), 7.35 (m, 4 Н), 7.4 (m, 1H), 7.55(d, 2H), 7.7 (d, 2H). Б-22. Синтез (2S)-3-2-[(4-(4-цианофенил)-2 оксопиперазино)ацетил]амино-2-[(фенилсульфонил)амино]пропионовой кислоты (соединение 25). Изобутилхлорформиат (2,9 г, 21,2 ммоль) добавляли к суспензии 2-[4-(4-цианофенил)-2 оксопиперазино]уксусной кислоты (соединение 1) (5,18 г, 20 ммоль) и N-метилморфолина (2,5 г,25 ммоль) в 100 мл тетрагидрофурана при 5 С; после перемешивания в течение 20 мин добавляли смесь(2S)-3-амино-2-(фенилсульфониламино)пропионовой кислоты (5 г, 20,5 ммоль) и диизопропилэтиламина (2,8 г, 21,7 ммоль) в 30 мл воды и 50 мл тетрагидрофурана. Перемешивание продолжали в течение 2 ч. Органический растворитель выпаривали, добавляли воду, а затем полученную смесь подкисляли для получения суспензии, которую экстрагировали этилацетатом. Экстракты промывали водой и высушивали над сульфатом натрия. После проведения тонкослойной хроматографии (дихлорметан/метанол/уксусная кислота при соотношении 10/1/0,5) было получено 4,6 г продукта. Выход = 47%(d, 2H), 8.15 (t, 1H), 8.2 (d, 1H). Следующее соединение было синтезировано согласно описанному выше процессу. Б-23. (2S)-3-2-[(4-(4-Цианофенил)-2-оксопиперазино)ацетил]амино-2-[(4-толуолсульфонил)амино]пропионовая кислота (соединение 26). Исходное вещество: (2S)-3-амино-2-[(4 толуолсульфонил)амино]пропионовая кислота. Выход = 55% 1(соединение 16) (0,6 г, 1,04 ммоль) в 10 мл тетрагидрофурана и 1,2 мл водного раствора 1NLiOH перемешивали при комнатной температуре в течение ночи. Добавляли этилацетат и полученную смесь затем подкисляли 1N НСl до рН 2. Органическую фазу отделяли после расслоения, а водную фазу экстрагировали этилацетатом. Полученные органические фазы объединяли, промывали водой и высушивали над сульфатом натрия. Растворитель выпаривали, а остаток подвергали хроматографии на диоксиде кремния [элюент: дихлорметан/метанол/уксусная кислота при соотношении 10/1/0,5] с получением 0,44 г белого твердого вещества. Выход = 76%(d, 2H), 8.00 (d, 2H). Метод, описанный выше, использовался для синтеза следующих соединений. Б-25. (2S)-3-2-[(4-(4-Цианофенил)-2-оксопиперазино)ацетил]амино-2-[(3-трифторметилфенилсульфонил)амино]пропионовая кислота(0,68 г, 9,78 ммоль) в 100 мл этанола нагревали в колбе с обратным холодильником в течение 20 ч. Осадок отфильтровывали, промывали этанолом и высушивали в вакууме с получением 1,9 г твердого вещества белого цвета. Выход = 78%MS-ES: m/z 569 (М + Na)+ 1 Н-ЯМР (400 МГц, ДMCO-d6):1.0 (t, 3H),3.1 (m, 1H), 3.55 (m, 3H), 3.5 (bs, 2 Н), 3.75 (q,2H), 3.8-4.0 (m, 5H), 5.65 (s, 2H), 6.85 (d, 2H),7.55 (m, 5H), 7.75 (d, 2H), 8.1 (t, 1H), 3.35 (bd,1H), 9.35 (bs, 1H). Способ, описанный в примере 1, использовали для синтеза следующих соединений. Пример 2. (2S)-3-[2-(4-4-[Амино(гидроксиимино)метил]фенил-2-оксопиперазино)аце 15 тил]амино)-2-[(3-пиридилсульфонил)амино] этилпропаноат (CRL 42814). Исходное вещество: соединение 4. Выход = 75%(4,43 г, 9,13 ммоль), триэтиламина (2,3 г, 22,7 ммоль) и гидрохлорида гидроксиламина (1,58 г,22,7 ммоль) в 150 мл этанола нагревали в колбе с обратным холодильником в течение 16 ч. Осадок отфильтровывали, промывали этанолом и высушивали в вакууме с получением 4,05 г твердого вещества бежевого цвета. Выход = 86% 1 Н-ЯМР (400 МГц, ДМСО-d6):3.15 (m,1H), 3.35-4.05 (m, 10H), 5.8 (s, 2H), 6.9 (d, 2H),7.6 (m, 4H), 7.8 (d, 2H), 8.1 (m, 2H), 9.5 (bs, 1H). Тем же способом синтезируется описанный ниже продукт. Пример 16. (2S)-3-[2-(4-4-[Амино(гидроксиимино)метил]фенил-2-оксопиперазино)ацетил]амино-2-[4-толуолсульфонил]аминопропионовая кислота. Исходное вещество: соединение 26. Выход = 55%(пример 1) (1,5 г, 2,75 ммоль) растворяли в 50 мл уксусной кислоты. Добавляли 600 мг уксусного ангидрида (5,6 моль) и 0,76 г 10%-ного палладия на угле. Гидрогенолиз проводили в течение 3 ч при комнатной температуре и под давлением 50 фунтов на квадратный дюйм (psi). Катализатор отфильтровывали, а раствор выпаривали досуха. Полученное твердое вещество растворяли в 150 мл воды и обрабатывали углем. Полученный раствор отфильтровывали. Фильтрат подвергали сушке сублимацией с получением 1,3 г твердого вещества белого цвета. Выход = 80%(d, 4 Н), 8.3 (t, 1H). Описанный в примере 17 способ использовали для синтеза следующих соединений. Пример 18. Диацетат (2S)-3-[2-(4-4-[амино(имино)метил]фенил-2-оксопиперазино)ацетил]амино-2-[(3-пиридилсульфонил)амино]этилпропаноата (CRL 42815). Исходное вещество: пример 2. Выход = 74%(2S)-3-[2-(4-4-[Амино(гидроксиимино) метил]фенил-2-оксопиперазино)ацетил]амино-2-[(фенилсульфонил)амино]пропионовую кислоту (пример 15) (3,1 г, 6 ммоль) растворяли в 150 мл уксусной кислоты и 1,6 г уксусного 21 ангидрида (15,7 ммоль) и добавляли 1,5 г 10%ного палладия на угле. Гидрогенолиз проводили в течение 4 ч при комнатной температуре под давлением 50 фунтов на квадратный дюйм (psi). Смесь отфильтровывали, выпаривали досуха и добавляли 200 мл воды и 10 мл 4N НСl. Смесь обрабатывали углем и затем высушивали сублимацией с получением 1 г твердого вещества слегка желтого цвета. Выход = 31%(CRL 43203). Суспензию, содержащую (2S)-3-2-[(4-(4 цианофенил)-2-оксопиперазино)ацетил]амино 2-[(1,1'-бифенил)-4-илсульфонил]аминопропионовую кислоту (соединение 27) (0,65 г, 1,15 ммоль), триэтиламин (0,43 мл, 2,9 ммоль) и гидрохлорид гидроксиламина (0,2 г, 2,9 ммоль) в 20 мл этанола, нагревали в колбе с обратным холодильником в течение 18 ч. Полученный продукт отфильтровывали, промывали этанолом и высушивали в вакууме с получением 0,42 г твердого вещества белого цвета. Полученный выше амидоксим (0,42 г, 0,71 ммоль) растворяли в 30 мл уксусной кислоты и 0,175 мл уксусного ангидрида (1,9 ммоль) и к нему добавляли 0,19 г 10%-ного палладия на угле. Гидрогенолиз проводили при комнатной температуре под давлением 50 фунтов на квадратный дюйм (psi) в течение 4 ч. Катализатор отфильтровывали и выпаривали досуха для получения твердого вещества бежевого цвета. Очистка методом высокоэффективной жидкостной хроматографии(вода/ацетонитрил/0,2%-й трифторацетат) с последующей сушкой сублимацией давали 8 мг продукта. 22 Способ, описанный в примере 32, использовали для синтеза следующих соединений. Пример 33. Трифторацетат (2S)-3-[2-(44-[амино(имино)метил]-фенил-2-оксопиперазино)ацетил]амино-2-[(4-фторфенил)сульфонил]аминопропионовой кислоты (CRL 43204). Исходное вещество: соединение 31. 23 Ацетат (2S)-3-[2-(4-4-[амино(имино)метил]фенил-2-оксопиперазино)ацетил]амино-2[(фенилсульфонил)амино]этилпропаноата (пример 17) был превращен в гидрохлорид путем добавления раствора 2N соляной кислоты с последующей сушкой сублимацией. К полученному таким образом раствору гидрохлорида (2,83 г, 5 ммоль) в 50 мл диметилформамида при 5 С последовательно добавляли триэтиламин (1,25 г, 12,4 ммоль) и этилхлорформиат (0,65 г, 6 ммоль). Перемешивание продолжали при комнатной температуре в течение 18 ч. Добавляли воду и смесь экстрагировали этилацетатом, полученные экстракты высушивали над сульфатом натрия. После хроматографии на диоксиде кремния (этилацетат/метанол при соотношении 10/1) было получено 1,2 г твердого вещества желтоватого цвета. Выход = 40%(2,45 г, 4,6 ммоль) в 3 мл этанола добавляли 40 мл 4N раствора солянокислого этилацетата при 5C. Перемешивание продолжали при комнатной температуре в течение 40 ч. Смесь упаривали досуха с получением твердого вещества бежевого цвета. К суспензии полученного выше имидата(1,4 г, 2,3 ммоль) в 5 мл этанола и 40 мл этилацетата добавляли морфолин (1,6 г, 18 ммоль). После перемешивания в течение 24 ч при комнатной температуре неочищенный продукт отфильтровывали и перекристаллизовывали из смеси этилацетата и этанола с получением 0,86 г твердого вещества белого цвета. Выход = 58%(d, 2H), 8.35 (t, 1H), 8.4 (bs, 1H), 9.4 (bs, 2H). Способ, описанный в примере 40, использовали для синтеза следующих соединений. Пример 41. (2S)-3-[2-(4-4-[Имино(пиперидино)метил]фенил-2-оксопиперазино)ацетил]амино-2-[4-толуолсульфонил]амино этилпропаноат (CRL 43117). Исходные вещества: соединение 9 и пиперидин. Выход = 27%(m, 1H), 3.3 (m, 1H), 3.4 (m, 4H), 3.65 (m, 4 Н),3.8 (q, 2H), 3.9 (m, 2H), 4.0 (m, 2H), 7.05 (d, 2H),7.35 (d, 2H), 7.45 (d, 2H), 7.65 (d, 2H), 8.25 (t,1H), 8.35 (bs, 1H), 9.05 (bs, 1H), 9.15 (bs, 1H). Ингибирующая активность соединений формулы (I) в отношении агрегации тромбоцитов изучалась in vitro, т.е. при непосредственном контакте в стандартных условиях растворов этих соединений с переменной концентраций со свежевыделенными из пробы цельной крови тромбоцитами. Использовались пробы крови лабораторных животных (морских свинок) и здоровых людей, не получавших никаких веществ или лекарственных средств, которые могли бы препятствовать свертыванию крови. Антитромбозная и антиагрегирующая активность этих соединений изучалась также ex vivо/vitro,т.е. после введения морским свинкам заявленных соединений, чтобы измерить интенсивность и продолжительность антиагрегирующего действия, вызванного фракцией тестируемого продукта, поглощенного и циркулирующего в крови. 1. Фармакологические испытания in vitro 1.1. Исследование на тромбоцитах морских свинок. Забор крови проводили у самцов морских свинок Dunkin-Hartley (весящих приблизительно 330 г) методом интракардиальной пункции при скорости 4,5 мл на 0,5 мл тринатрийцитрата(концентрация водного раствора 1,55%), с тем,чтобы предотвратить свертывание крови. Плазму, обогащенную тромбоцитами (ПБТ), получали после центрифугирования пробирок с цельной кровью при ускорении в 150 g в течение 15 мин. Эти образцы ПБТ собирают в общий банк плазмы. Содержащиеся в них тромбоциты подсчитывают с помощью автоматического гематологического устройства Coulter ZM; при необходимости, для того, чтобы концентрация тромбоцитов в плазме составляла от 200 000 до 400 000 тромбоцитов/мм 3, проводится разбавление. Одновременно другие образцы из этого общего банка служили для приготовления плазмы с низким содержанием тромбоцитов (ПНТ) путем ее центрифугирования при ускорении 1500 g в течение 15 мин. Кинетическое исследование агрегации тромбоцитов проводили при добавлении раствора коллагена (1 мкг/мл) к некоторому объему ПБТ, при этом использовали агрегометр Chronolog Corporation (490-D1 или 560 VS), который возникновение тромбов выявляет оптическим путем. Определение концентрации, дающей 50% ингибирование (IC50), проводили, добавляя заданный объем растворителя (контрольный образец) и исследуемых соединений в возрастающих концентрациях (1,5 х 10-8 М, 7 х 10-8 М, 1,5 х 10-7 М, 25 3 х 10-7 М, 7 х 10-7 М, 1,5 х 10-6 М и 7 х 10-5 М) к образцам из банка ПБТ. Измерение ингибирования агрегации осуществляли спустя 3 мин после контакта при 37 С при взбалтывании. 1.2. Исследование на тромбоцитах человека Забор венозной крови проводили у группы,включающей 10 здоровых субъектов одного и того же возраста, методом пункции локтевой вены. Кровь собирали в стеклянную пробирку,содержащую 0,129 М водный раствор цитрата натрия (1 объем раствора цитрата на 9 объемом крови). Затем каждую пробирку центрифугировали, вначале при 20 С и ускорении 100 g в течение 15 мин с целью получения плазмы, обогащенной тромбоцитами (ПБТ); после удаления указанной плазмы пробирку вновь центрифугировали при ускорении 2000 g в течение 15 мин,для того чтобы за это время была удалена плазма с низким содержанием тромбоцитов (ПНТ). В каждом маркированном образце ПБТ с использованием счетчика Coulter ZM подсчитывалось количество тромбоцитов. Затем каждый из этих образцов использовали для того, чтобы изучить изменения в ингибировании агрегации тромбоцитов, инициированной добавлением глюкозного раствора коллагена (ChromoparReagent) фирмы Coultronics (используемого в концентрации 5 мкг/мл); эти изменения являются функцией прибавления каждого из соединений в возрастающих концентрациях в интервале от 10-8 М до 10-5 М (примеры концентраций: 10-8 М, 5 х 10-7 М, 3 х 10-7 М, 10-7 М, 8 х 10-6 М, 6 х 10-6 М, 4 х 10-6 М, 2x10-6 М, 10-6 М, 5 х 10-5 М, 10-5 М).- данные отсутствуют Объектом настоящего изобретения является также фармацевтическая композиция, содержащая эффективное количество соединения формулы (I) или одной из его солей с фармацевтически приемлемыми кислотами. 26 Предварительно для каждого соединения был приготовлен водный раствор с концентрацией 10-3 М. В каждую из серий измерений вводили контрольный тест для проверки возможного воздействия растворителей (эталонное значение) на агрегацию тромбоцитов, собственно агрегацию измеряли спустя 3 мин после контакта при 37 С при взбалтывании. Исходя из величины ингибирования агрегации тромбоцитов, выраженной в процентах,измеренной для каждой концентрации каждого из соединений, была вычислена концентрацияIC50, дающая 50% ингибирование. 2. Фармакологическое изучение на морских свинках ех vivo/vitro Оценку антитромбоцитагрегационной активности соединений проводили на упомянутых выше морских свинках (штамм Dunkin-Hartley). Введение каждого соединения в дозах от 150 до 10 мг/кг и каждого разбавителя (5 мг/кг) осуществляли через желудок (ж. п.) за 1, 2, 4, 6, 8 или 12 ч до отбора проб крови у морских свинок,которые за день до того голодали. Кровь отбирали и затем ее обрабатывали в тех же условиях, которые описаны выше для изучения in vitro. Результаты ингибирования агрегации тромбоцитов, полученные для каждой из исследуемых концентраций, позволили вычислить концентрацию IC50 каждого из изучаемых препаратов, а также кинетику их ингибиторной активности и продолжительность их действия. Полученные результаты объединены в приведенной ниже таблице Процент ингибирования ж. п. у морских свинок ex vivo Доза = 150 мг/кг Доза= 10 мг/кг 1 ч 2 ч 1 ч 2 ч-58 Более конкретно, объектом настоящего изобретения являются препараты, подавляющие агрегацию тромбоцитов крови, содержащие эффективное количество одного из вышеуказанных соединений. Объектом настоящего изобретения является также способ ингибирования связывания 27 фибриногена с тромбоцитами крови млекопитающих, который включает введение этим млекопитающим эффективного количества одного из вышеуказанных соединений, способ лечения тромбоза у пациента, включающий введение пациенту эффективного количества одного из вышеуказанных соединений, способ предотвращения риска возникновения тромбоза у пациента, включающий введение пациенту эффективного количества одного из вышеуказанных соединений. Соединения формулы (I) могут быть использованы, в частности, в приведенных ниже областях их применения:i) резкое предотвращение риска развития артериального тромбообразования в случае коронарной хирургии (коронарное шунтирование) или кардиологического вмешательства (подкожная ангиопластика, эндартэктомия, внедрение стента),в таких случаях вышеуказанные соединения включают в общепринятое превентивное лечение тромбоза артерий; пероральное введение ацетилсалициловой кислоты, начинающееся до проведения такого вмешательства (перорально 150-500 мг/сутки) с продолжением по следующей схеме: внутривенное вливание нефракционированного гепарина, которое проводят,начиная с периода самого вмешательства и затем продолжая его в течение от 48 до 96 ч, затем введение соединения формулы I одновременно с введением аспирина может быть проведено или перорально (0,5-1,5 мг/кг), или путем внутривенного вливания (0,25-1 мг/кг/24 ч) в сочетании с таблетками или без них. Спустя 48 ч, если это лечение проводилось внутривенным способом, его можно заменить пероральным введением (0,25-10 мг/кг двумя дозами с интервалами в 12 ч) для ускорения лечения в стационаре, а затем - амбулаторного лечения;ii) вторичная профилактика риска возникновения тромбоза артерий у пациентов, подверженных случаям нестабильной стенокардии или инфаркта миокарда: в таких ситуациях высокая биодоступность заявляемых соединений (а именно возможность быстрого достижения таких концентраций циркуляции, которые эффективны, поскольку они способны ингибировать связывание фибриногена с тромбоцитами) делает возможным использовать заявляемые лекарственные препараты перорально в течение того периода, в котором для пациента имеется риск возникновения тромбоза артерий. В таких случаях эти соединения можно вводить предпочтительно 1-3 оральными дозами в сутки, причем благодаря их высокой биодоступности и продолжительному сроку их действия эта доза выбирается в диапазоне 0,5-10 мг/кг. Фармацевтические составы, содержащие один из указанных в настоящем описании активных компонентов, включают указанное активное вещество или в виде основания, или 28 фармацевтически приемлемой соли, или же в форме пролекарства, включающего сложноэфирную группу, причем эта группа утрачивается in vivo после орального введения. Такие фармакологические составы включают известное специалистам в данной области получение вспомогательных средств и средств доставки,которые выбирают из диапазона фармацевтических средств, описанных в фармакопеях. Среди примеров средств для получения фармацевтических форм, предназначенных для орального применения, можно упомянуть крахмал, стеарат магния, тальк, желатин, агар, пектин, лактозу,полиэтиленгликоли и т.д. Фармацевтические формы, которые можно использовать, следует выбирать из следующих возможных: способные или неспособные расщепляться таблетки, капсулы, лепешки, гранулы, порошки. Согласно определенным патологическим состояниям,требующим лечения, и морфологии каждого пациента, суточная оральная доза должна составлять от 0,02 до 50 мг/кг/сутки, вводимых за 1-3 дозы, распределенных равномерно с тем,чтобы поддерживать эффективный уровень заполнения рецепторов тромбоцитов GpIIb/IIIa. В случае внутривенного использования фармацевтические формы, предназначенные для лечения острой фазы, разработаны так, чтобы на основе подавления агрегации тромбоцитов, являющейся функцией немедленного развития реакции на воздействие, была возможна адаптация к индивидуальной дозировке. В этом контексте лиофилизат и готовый для использования раствор для вливания готовят так, что возможно индивидуально изменять дозировку в пределах диапазона 0,01 мг/кг/сутки - 20 мг/кг/сутки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)R2 выбирают из водорода, гидроксильной группы и группы, являющейся защитной для амидиногруппы;R3 выбирают из групп формулы-NH-SO2-R7,где R7 выбирают из C1-C5 алкильных групп, необязательно замещенных одной или более груп 29 в которой n = 1, 2 или 3; арильные или гетероарильные группы R7,необязательно замещены одной или более группами, независимо выбранными из галогенов, C1C4 алкильной, трифторметильной групп, C1C4 алкилтиогруппы, C1-C4 алкилоксигруппы, C1C4 алкилсульфонильной группы, нитрогруппы,диC1-C4)алкил)аминогруппы, фенильной группы, нафтильной группы и гетероарильных групп, выбранных из тиенильной, фурильной и пиридильной группы, и из групп -COOR, -CH2COOR или -O-CH2COOR, где R представляет собой C1-C4 алкильную группу;R4 и R5 независимо друг от друга выбирают из водорода, C1-C5 алкильной группы или вместе с атомом азота они образуют группу, выбранную из пиперидильной и морфолинильной групп; оксогруппа находится в положении 2 или 3 пиперазина; или его аддитивная соль с фармацевтически приемлемой кислотой. 2. Соединение по п.1, в котором R3 представляет собой -NH-SO2-R7 группу. 3. Соединение по п.2, котором R7 выбирают из фенильной и толильной групп. 4. Соединение по п.3, выбранное из(2S)-3-[2-(4-4-[амино(имино)метил]фенил-2-оксопиперазино)ацетил]амино-2-[4 толуолсульфонил]аминопропионовой кислоты,или его аддитивной соли с фармацевтически приемлемой кислотой. 5. Способ получения соединения формулы для получения соединения формулы 6. Терапевтическая композиция, содержащая в качестве активного соединения соединение по любому из пп.1-4. 7. Применение соединения по любому из пп.1-4 для получения антитромботического медицинского препарата. 8. Способ ингибирования связывания фибриногена с тромбоцитами крови млекопитающих, включающий введение эффективного количества соединения по п.1. 9. Способ ингибирования у пациента агрегации тромбоцитов крови, включающий введение этому пациенту эффективного количества соединения по п.1. 10. Способ лечения тромбоза у пациента,включающий введение этому пациенту эффективного количества соединения по п.1. 11. Способ предотвращения риска возникновения тромбоза у пациента, включающий введение этому пациенту эффективного количества соединения по п.1.
МПК / Метки
МПК: A61K 31/495, C07D 241/08
Метки: замещенные, пиперазиноны, применение, терапевтическое
Код ссылки
<a href="https://eas.patents.su/16-3430-zameshhennye-piperazinony-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные пиперазиноны и их терапевтическое применение</a>
Предыдущий патент: Измельченный вулканизат и способ его получения
Следующий патент: Резьбовое трубное соединение
Случайный патент: Способ передачи и хранения значения и счетчик электроэнергии с хранением значения