Система доставки лекарственного средства для введения водорастворимого катионного и амфифильного фармацевтически активного вещества
Формула / Реферат
1. Система доставки лекарственного средства для введения по меньшей мере одного фармацевтически активного вещества, которое по своей природе является катионным амфифилом, в виде частиц комплекса, образованного указанным фармацевтически активным веществом и натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей, при этом указанные частицы комплекса имеют эффективный средний размер менее примерно 100 нм, причем
частицы указанного комплекса являются, по существу, аморфными;
частицы указанного комплекса заключены внутрь наночастиц, образованных натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей;
отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или их комбинации к массе указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1.
2. Система доставки лекарственного средства по п.1, отличающаяся тем, что указанное фармацевтически активное вещество обладает собственной растворимостью в воде, равной по меньшей мере 4 мг/мл, и указанный комплекс представляет собой нековалентный комплекс, обладающий растворимостью в воде менее 0,1 мг/мл.
3. Система доставки лекарственного средства по п.1 или 2, отличающаяся тем, что эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм.
4. Система доставки лекарственного средства по любому из пп.1-3, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1.
5. Система доставки лекарственного средства по п.1 или 2, содержащая по меньшей мере одно другое фармацевтически активное вещество, обладающее собственной растворимостью в воде менее примерно 100 мкг/мл, при этом указанное другое фармацевтически активное вещество находится в форме частиц с эффективным средним размером менее примерно 100 нм, при этом
частицы указанного другого фармацевтически активного вещества являются, по существу, аморфными;
частицы указанного другого фармацевтически активного вещества заключены совместно с частицами данного комплекса внутрь указанных наночастиц;
отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или их комбинации к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1.
6. Система доставки лекарственного средства по п.5, отличающаяся тем, что эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм.
7. Система доставки лекарственного средства по п.5 или 6, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1.
8. Система доставки лекарственного средства по любому из пп.5-7, отличающаяся тем, что указанное другое фармацевтически активное вещество имеет эффективный средний размер частиц менее примерно 50 нм и/или эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм.
9. Система доставки лекарственного средства по любому из пп.5-8, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1.
10. Система доставки лекарственного средства по любому из пп.1-9, отличающаяся тем, что по меньшей мере одно из указанных фармацевтически активных веществ представляет собой цитотоксическое или цитостатическое соединение.
11. Система доставки лекарственного средства по любому из пп.1-10, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение.
12. Система доставки лекарственного средства по п.11, отличающаяся тем, что указанное цитотоксическое или цитостатическое соединение представляет собой протонированную форму доксорубицина, митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина или комбинации указанных веществ.
13. Система доставки лекарственного средства по п.12, отличающаяся тем, что указанное соединение представляет собой протонированную форму доксорубицина.
14. Система доставки лекарственного средства по п.12, отличающаяся тем, что указанное соединение представляет собой протонированную форму митоксантрона.
15. Система доставки лекарственного средства по любому из пп.5-14, отличающаяся тем, что указанное другое фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение.
16. Система доставки лекарственного средства по п.15, отличающаяся тем, что указанное цитотоксическое или цитостатическое соединение представляет собой таксан.
17. Система доставки лекарственного средства по п.16, отличающаяся тем, что указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ.
18. Система доставки лекарственного средства по п.5, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество и указанное другое фармацевтически активное вещество представляют собой цитотоксические или цитостатические соединения.
19. Система доставки лекарственного средства по п.18, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество представляет собой протонированную форму доксорубицина, митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина или комбинации указанных веществ.
20. Система доставки лекарственного средства по п.19, отличающаяся тем, что указанное соединение представляет собой протонированную форму доксорубицина.
21. Система доставки лекарственного средства по п.19, отличающаяся тем, что указанное соединение представляет собой протонированную форму митоксантрона.
22. Система доставки лекарственного средства по п.18, отличающаяся тем, что указанное другое фармацевтически активное вещество представляет собой таксан.
23. Система доставки лекарственного средства по п.22, отличающаяся тем, что указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ.
24. Система доставки лекарственного средства по любому из пп.1-23 для применения при лечении рака.
25. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и систему доставки лекарственного средства по любому из пп.1-24.
26. Лекарственная форма, содержащая фармацевтически приемлемый носитель и систему доставки лекарственного средства по любому из пп.1-24, в форме водного раствора, геля, крема, мази, таблетки, капсулы или гелевой капсулы (софтгеля).
27. Применение натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей для получения системы доставки лекарственного средства по любому из пп.1-24.
28. Способ получения системы доставки лекарственного средства по п.1 или 2, согласно которому размер указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял менее примерно 100 нм, путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1.
29. Способ получения системы доставки лекарственного средства по п.5, согласно которому размер частиц указанного другого фармацевтически активного вещества и частиц указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял менее примерно 100 нм, путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1.
30. Способ получения системы доставки лекарственного средства по п.1 или 2, согласно которому
указанное по меньшей мере одно фармацевтически активное вещество обрабатывают первым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с получением частиц указанного комплекса;
полученные частицы указанного комплекса затем обрабатывают вторым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе.
31. Способ по п.30, согласно которому указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, при этом общее количество натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей в указанном водном растворе является достаточным для образования частиц указанного комплекса и растворения указанного комплекса.
32. Способ получения системы доставки лекарственного средства по п.5, согласно которому
указанное другое фармацевтически активное вещество обрабатывают первым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанного другого фармацевтически активного вещества в указанном первом водном растворе;
указанное по меньшей мере одно фармацевтически активное вещество обрабатывают вторым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с образованием частиц указанного комплекса;
полученные частицы указанного комплекса обрабатывают в указанном втором водном растворе натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе.
33. Способ по п.32, согласно которому указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, при этом общее количество натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей в указанном водном растворе является достаточным для
растворения указанного другого фармацевтически активного вещества;
образования частиц указанного комплекса;
растворения указанного комплекса.
34. Применение системы доставки лекарственного средства по любому из пп.1-24 для получения лекарственного средства для лечения рака.
35. Способ лечения рака, согласно которому фармацевтическую композицию по п.25 или лекарственную форму по п.26 вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении.
36. Применение фармацевтической композиции по п.25 или лекарственной формы по п.26 для получения лекарственного средства для лечения рака.
37. Способ лечения рака, согласно которому систему доставки лекарственного средства по любому из пп.1-24 вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении.
Текст
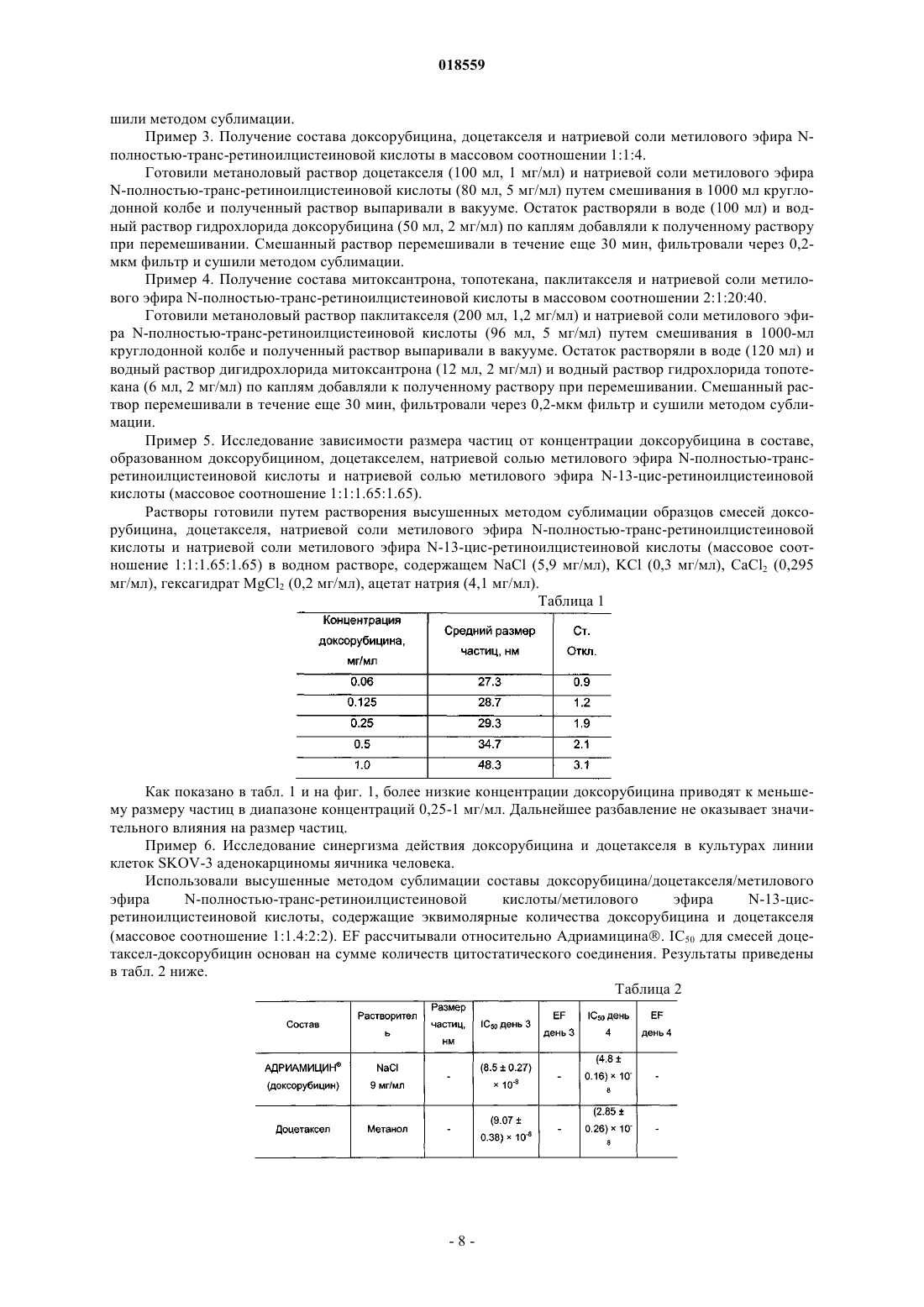
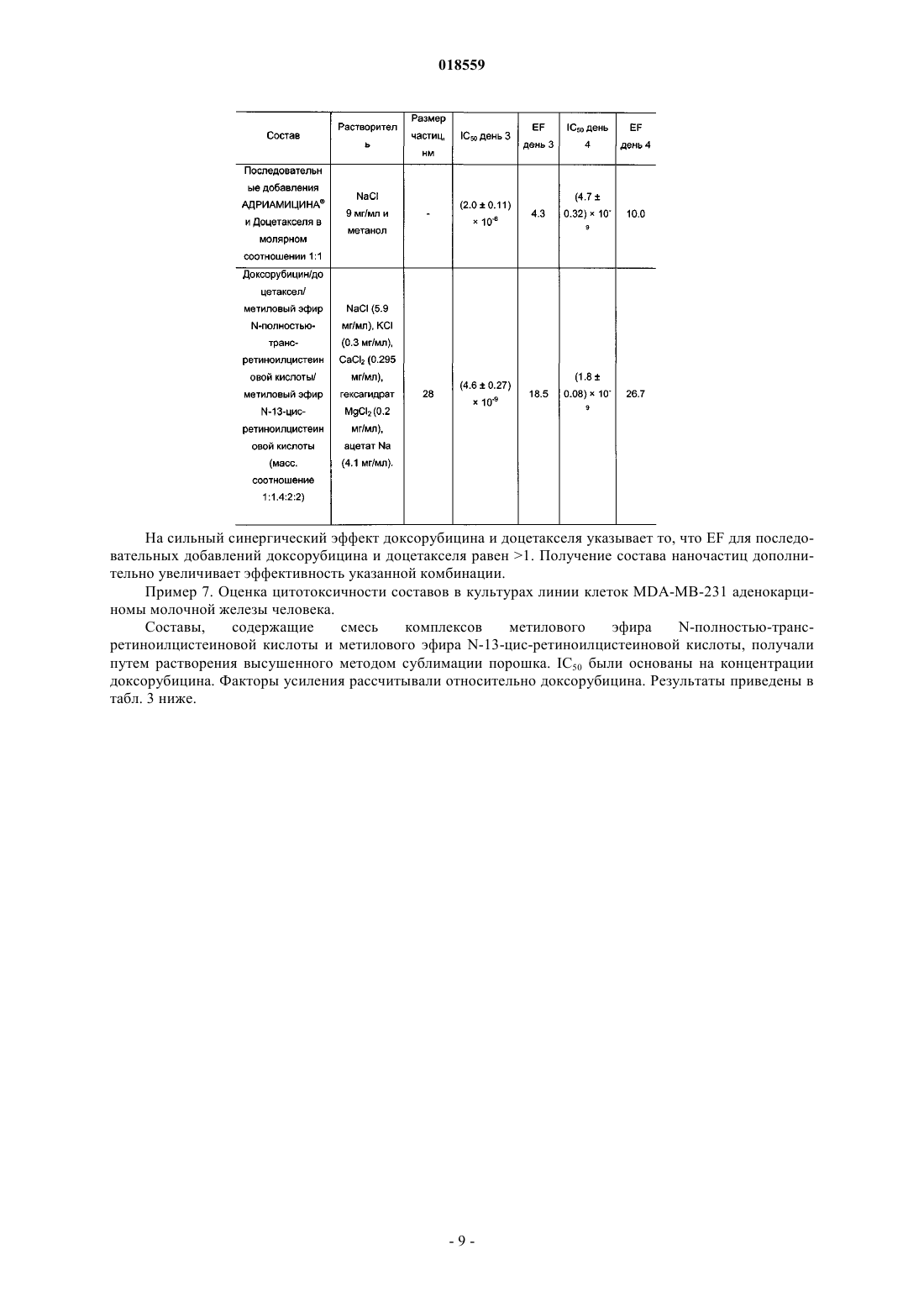
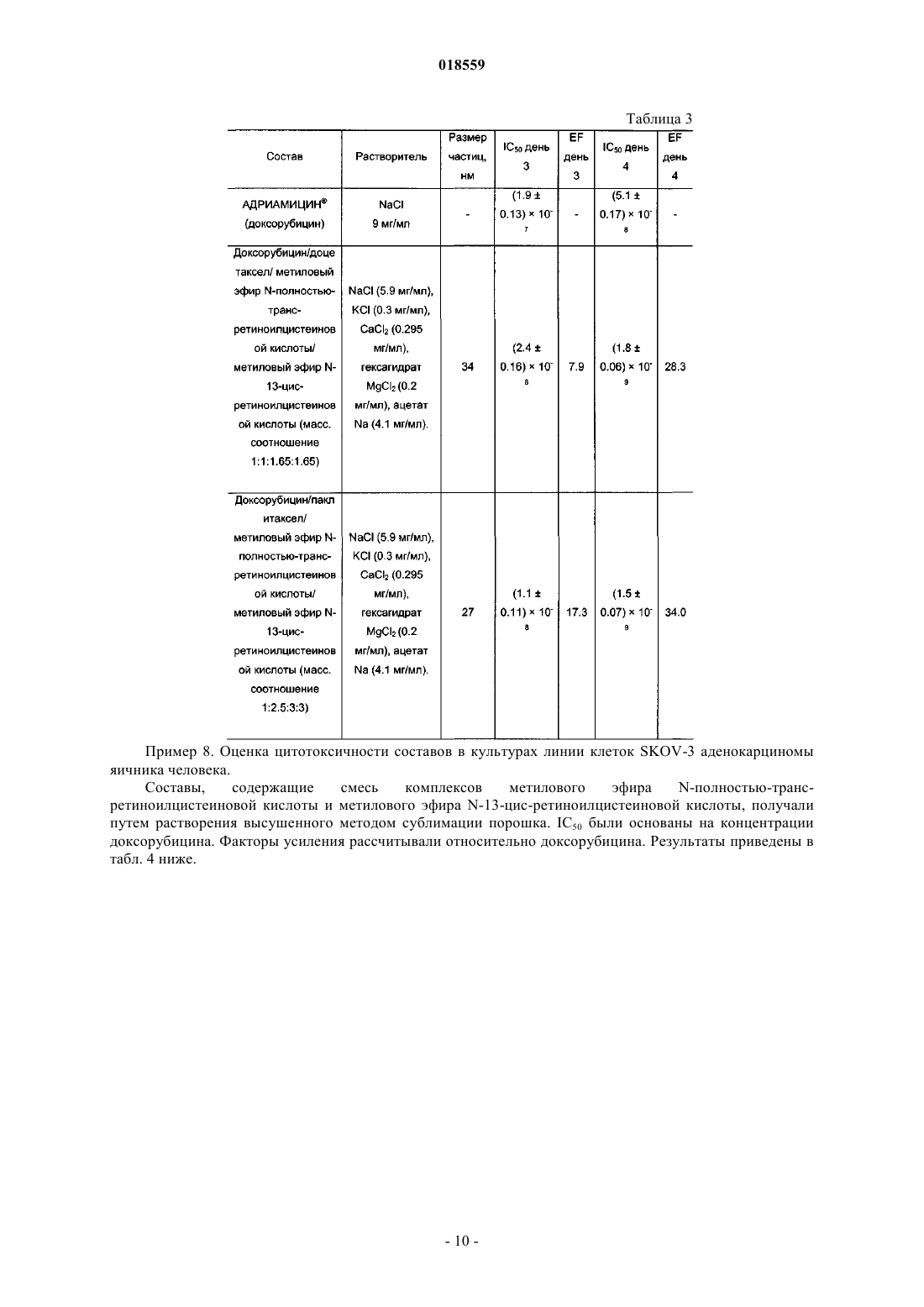
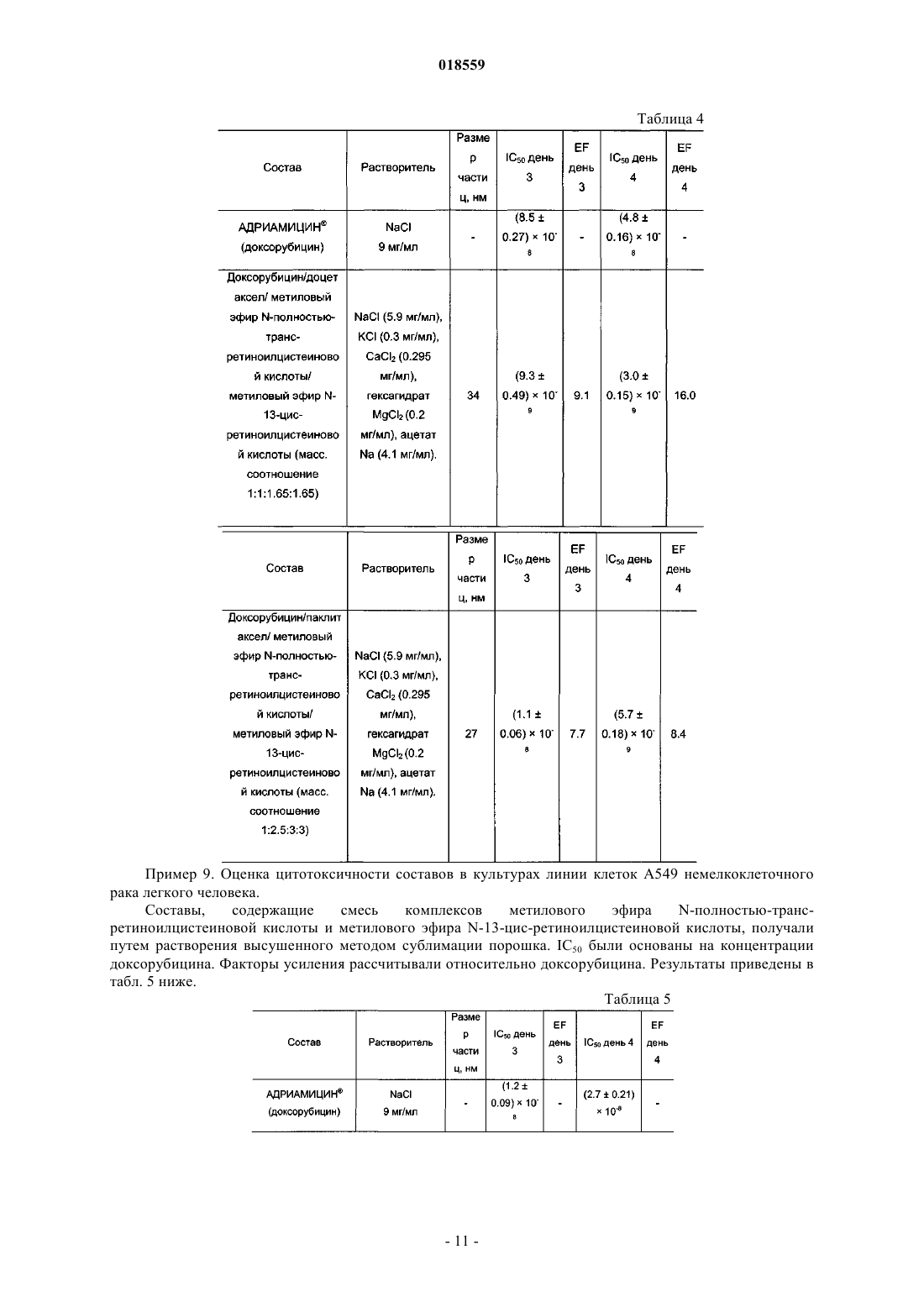
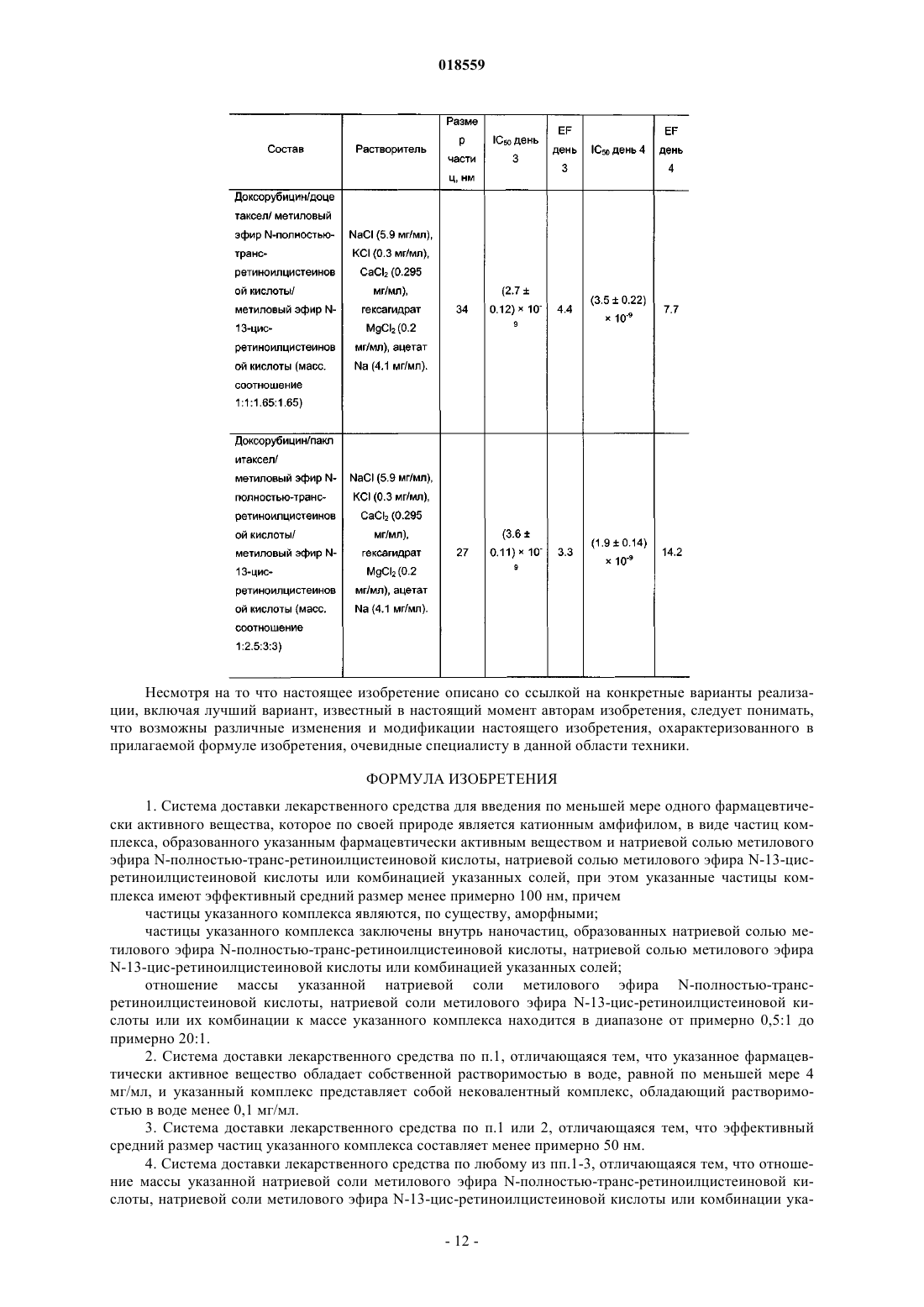
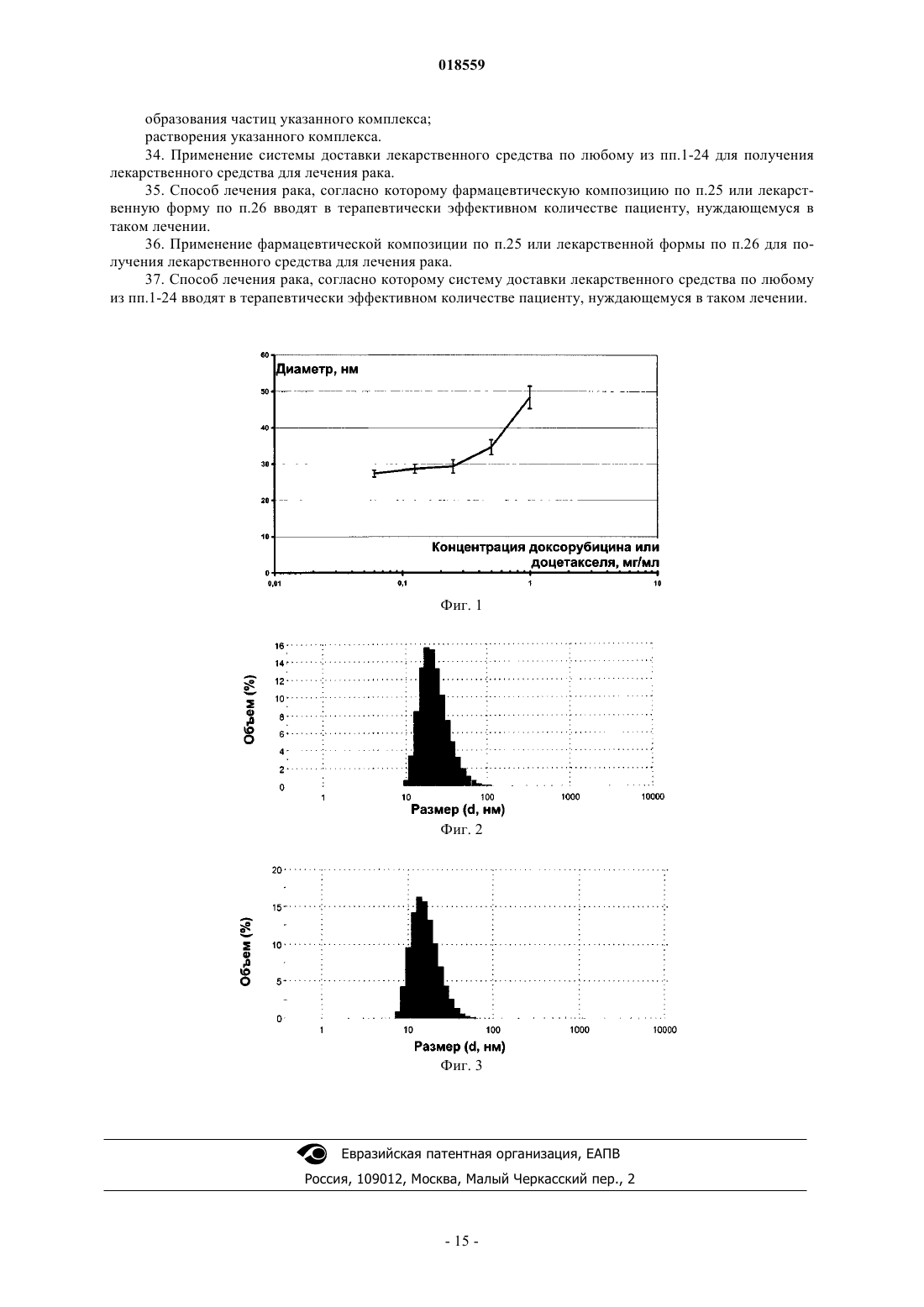
СИСТЕМА ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ВВЕДЕНИЯ ВОДОРАСТВОРИМОГО КАТИОННОГО И АМФИФИЛЬНОГО ФАРМАЦЕВТИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА В изобретении предложена система доставки лекарственного средства (СДЛ) для введения водорастворимого, катионного и амфифильного фармацевтически активного вещества (ФАВ), при этом указанная СДЛ содержит аморфные частицы размером 100 нм плохо растворимого в воде комплекса ФАВ с натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и/или натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты,при этом указанные частицы заключены внутри наночастиц, образованных натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и/или натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты, причем массовое отношение натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и/или натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты к указанному комплексу составляет от примерно 0,5:1 до примерно 20:1. Также предложена фармацевтическая композиция, содержащая указанную СДЛ, способы получения указанной СДЛ и указанной фармацевтической композиции, а также применение указанной СДЛ и фармацевтической композиции для лечения рака. Область техники Настоящее изобретение относится к системе доставки лекарственного средства для введения фармацевтически активных веществ, к фармацевтической композиции, содержащей указанную систему доставки лекарственного средства, и к способам получения указанной системы доставки лекарственного средства. Кроме того, настоящее изобретение также относится к применению указанной системы доставки лекарственного средства для получения лекарственного средства для лечения рака. Уровень техники Недостатком лекарственных средств, обладающих узкими терапевтическими индексами, является то, что небольшие изменения дозы могут вызывать токсическое действие. Для пациентов, принимающих указанные лекарственные средства, часто необходимо тщательное наблюдение, позволяющее корректировать дозировку лекарственного средства с обеспечением надежных и стабильных результатов. Существует сильная потребность в устранении необходимости указанного наблюдения без снижения надежности и стабильности результатов. Данная потребность становится особенно выраженной, когда указанные лекарственные средства используют в комбинированной терапии. Комбинированную терапию, представляющую собой совместное введение двух или более лекарственных средств для лечения одного заболевания, применяют для лечения множества патологических состояний, таких как, например, туберкулез, лепра, рак, малярия и ВИЧ/СПИД. Во многих случаях комбинированная терапия обладает рядом преимуществ, таких как более низкий показатель терапевтических неудач, более низкие показатели смертности, более медленное развитие резистентности, а также меньшая необходимость в разработке новых лекарственных средств. Однако комбинированная терапия также имеет ряд потенциальных недостатков, таких как антагонизм между комбинируемыми лекарственными средствами, приводящий к снижению их индивидуальной активности, повышенный риск неблагоприятных взаимодействий между лекарственными средствами, повышенная стоимость по сравнению с монотерапией и увеличение вероятности лекарственного токсикоза. Комбинированную терапию широко применяют при лечении различных видов раковых заболеваний, т.к. она обеспечивает улучшенные показатели выживаемости по сравнению с монотерапией. Более благоприятный результат может быть достигнут путем комбинирования противоопухолевых агентов,обладающих разным механизмом действия, что обеспечивает синергическое или аддитивное действие в ходе терапии. Основная проблема, связанная с комбинированной химиотерапией, представляет собой увеличение токсичности по сравнению с последовательным введением отдельных агентов. Это нельзя компенсировать путем ограничения доз, т.к. ограничение привело бы к получению доз, являющихся ниже терапевтических. Разные агенты также обладают разными фармакокинетическими свойствами, что затрудняет поддержание концентраций всех агентов на оптимальных синергических уровнях в тканях, на которые направлено воздействие. Доксорубицин (doxorubicin) представляет собой лекарственное средство, широко применяемое в комбинированной химиотерапии. Доксорубицин обладает исключительной противоопухолевой активностью, но, к сожалению, также относительно низким терапевтическим индексом, а также широким спектром побочных эффектов, ограничивающим его применение. Один из указанных побочных эффектов представляет собой кардиотоксичность, как правило, проявляющуюся в виде острого или подострого синдрома. Более значительное лекарственное воздействие может приводить к повреждению миокарда,поэтому рекомендуется, чтобы кумулятивная доза доксорубицина в течение жизни не превышала 450550 мг/м 2. Указанная кардиотоксичность представляет собой основную причину недопустимости применения доксорубицина у пожилых пациентов и пациентов с заболеванием сердца на доклинической стадии. Было предпринято несколько попыток получения комбинации антрациклины/таксаны, например доксорубицина и доцетакселя (docetaxel), с использованием традиционных составов. Данные соединения демонстрируют высокую активность в монотерапии, обладая разными механизмами действия: доксорубицин ингибирует продвижение фермента топоизомеразы II по всему клеточному циклу, в то время как доцетаксел препятствует делению митотических клеток между метафазой и анафазой путем предотвращения физиологической деполимеризации/"разборки" микротрубок. Было показано, что предложенные комбинации более эффективны по сравнению с соответствующими видами монотерапии, но также обладают более высокой токсичностью. Это не позволяет применять указанную терапию в качестве стандартного способа лечения различных видов рака, особенно в случае некоторых состояний, таких как фебрильная нейтропения. Краткое описание изобретения Необходимо создать систему доставки лекарственного средства, которая уменьшила бы необходимость тщательного наблюдения за пациентами, принимающими лекарственные средства с узким терапевтическим индексом. Одна из задач настоящего изобретения заключается в получении указанной системы доставки лекарственного средства. Другая задача настоящего изобретения заключается в получении системы доставки лекарственного средства, обеспечивающей снижение или устранение связанной с лекарственным средством токсичности в связи с комбинированной терапией. Таким образом, один из вариантов реализации настоящего изобретения относится к системе доставки лекарственного средства для введения по меньшей мере одного фармацевтически активного вещества, которое по своей природе является катионным амфифилом, при этом фармацевтически активное вещество присутствует в указанной системе доставки лекарственного средства в виде частиц комплекса,образованного указанным фармацевтически активным веществом и натриевой солью метилового эфираN-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинацией указанных солей, при этом указанные частицы указанного комплекса имеют эффективный средний размер, равный менее примерно 100 нм, при этом частицы указанного комплекса являются, по существу, аморфными; частицы указанного комплекса заключены внутрь наночастиц, образованных натриевой солью метилового эфираN-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинацией указанных солей; и отношение массы указанной натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1. Настоящая система доставки лекарственного средства обеспечивает значительное улучшение терапевтических индексов для целого ряда лекарственных средств. Побочные эффекты, вызываемые главным образом высокими концентрациями лекарственных средств непосредственно после инфузий, значительно снижаются при применении настоящей системы доставки лекарственного средства, т.к. указанная система доставки имитирует длительную инфузию. Инкапсулированные вещества защищены от метаболизирования и высвобождаются постепенно путем растворения/разрушения частиц, что способствует поддержанию концентрации лекарственного средства в пределах терапевтического окна. Следует отметить, что помимо применения концентраций, приводящих к токсическому действию, настоящее изобретение позволяет также избежать применения субтерапевтических концентраций, которые иначе могли бы приводить к развитию резистентности к лекарственным средствам. Инкапсулирование различных видов лекарственных средств внутрь наночастиц, достигаемое с помощью настоящей системы доставки лекарственного средства, обеспечивает одновременный перенос данных веществ к месту действия, синхронизируя в остальном различные фармакокинетические характеристики указанных веществ (например, период полувыведения доцетакселя в пять раз больше периода полувыведения доксорубицина), таким образом стимулируя синергическое действие компонентов комбинации. Настоящее изобретение подходит для создания комбинированных составов двух или более видов фармацевтически активных веществ, таких как, например, противоопухолевые вещества. В число лекарственных средств, которые могут быть использованы в настоящих системах доставки лекарственных средств, входят водорастворимые противоопухолевые агенты, например агенты, содержащие одну или более аминогрупп, например гидрохлориды антрациклина. В соответствии с одним из аспектов настоящего изобретения растворимость указанных солей антрациклина значительно уменьшают путем замены хлорид-аниона на анион метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, метилового эфира N-13-цис-ретиноилцистеиновой кислоты или их комбинации. Полученные нерастворимые комплексы позволяют помещать данные производные антрациклина в наночастицу настоящей системы доставки лекарственного средства, обеспечивая замедленное высвобождение указанных лекарственных средств. Примерами таких антрациклинов являются доксорубицин, даунорубицин(daunorubicin), эпирубицин (epirubicin), идарубицин (idarubicin), митоксантрон (mitoxantrone) и природные, синтетические и полусинтетические аналоги указанных веществ. Другие виды веществ, которые можно применять в комбинациях, предложенных согласно настоящему изобретению, включают водонерастворимые противоопухолевые агенты, такие как таксаны, например паклитаксел (paclitaxel), доцетаксел, и природные, синтетические и полусинтетические аналоги указанных веществ; алкалоиды барвинка, такие как, например, винкристин (vincristine), винбластин (vinblastine), винорелбин (vinorelbine), виндезин (vindesine) и природные, синтетические и полусинтетические аналоги указанных веществ; ингибиторы топоизомеразы, такие как, например, иринотекан (irinotecan), топотекан (topotecan),этопозид (etoposide), тенипозид (teniposide) и природные, синтетические и полусинтетические аналоги указанных веществ; алкилирующие агенты, такие как, например, амсакрин (amsacrine), прокарбазин (procarbazine), бисхлорнитрозомочевина и аналоги указанных веществ. Комбинированные составы согласно настоящему изобретению могут быть получены в виде различных водных растворов. Указанные составы можно вводить непосредственно или высушить методом сублимации для дальнейшего применения. Размер частиц в полученных системах доставки лекарственных средств согласно настоящему изобретению находится в диапазоне примерно от 8 до 100 нм. Криогенная просвечивающая электронная микроскопия показывает, что системы доставки лекарственных средств согласно настоящему изобретению, содержащие таксаны и доксорубицин, состоят из нитевидных частиц размером примерно 20 нм, которые иногда объединены в более крупные агрегаты. Растворение составов приводит к уменьшению размера агрегатов. Краткое описание чертежей Настоящее изобретение описано более подробно в приведенных далее описании, примерах и прилагаемых чертежах, где на фиг. 1 показан размер частиц, образованных доксорубицином, доцетакселем, натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты (массовое соотношение 1:1:1.65:1.65) при различных разбавлениях; растворитель: водный раствор NaCl (5,9 мг/мл), KCl (0,3 мг/мл), CaCl2 (0,295 мг/мл), гексагидрата MgCl2 (0,2 мг/мл), ацетата натрия (4,1 мг/мл); на фиг. 2 показано распределение по размерам частиц по объему состава, полученному путем растворения высушенной методом сублимации смеси доксорубицина, доцетакселя, натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и натриевой соли метилового эфира N-13 цис-ретиноилцистеиновой кислоты (массовое соотношение 1:1:1.65:1.65); растворитель: водный растворNaCl (5,9 мг/мл), KCl (0,3 мг/мл), CaCl2 (0,295 мг/мл), гексагидрата MgCl2 (0,2 мг/мл), ацетата натрия (4,1 мг/мл); концентрация доксорубицина составляет 0,5 мг/мл; на фиг. 3 показано распределение по размерам частиц по объему состава, полученному путем растворения высушенной методом сублимации смеси доксорубицина, паклитакселя, натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и натриевой соли метилового эфира N13-цис-ретиноилцистеиновой кислоты (массовое соотношение 1:2.5:3:3); растворитель: водный растворNaCl (5,9 мг/мл), KCl (0,3 мг/мл), CaCl2 (0,295 мг/мл), гексагидрата MgCl2 (0,2 мг/мл), ацетата натрия (4,1 мг/мл); концентрация паклитакселя составляет 1 мг/мл. Описание вариантов реализации изобретения Перед раскрытием и описанием настоящего изобретения следует отметить, что настоящее изобретение не ограничено конкретными конфигурациями, стадиями способов и веществами, указанными в настоящем описании, т.к. указанные конфигурации, стадии способа и вещества могут в некоторой степени варьироваться. Также следует понимать, что используемая в настоящем описании терминология применяется только для цели описания конкретных вариантов реализации и не является ограничивающей,т.к. объем настоящего изобретения ограничивается только пунктами прилагаемой формулы изобретения и соответствующими эквивалентами. Следует отметить, что в настоящем описании и формуле изобретения формы единственного числа включают множества объектов, если из контекста явным образом не следует иное. В настоящем описании, если не указано иное, термин "примерно", модифицирующий количество компонента в системах доставки лекарственных средств или композициях согласно настоящему изобретению, или количество, используемое в способах согласно настоящему изобретению, относится к колебанию значений численной величины, которое может происходить, например, при проведении стандартных измерений и процедур обработки жидкостей, используемых для получения концентратов, или применения растворов в реальных условиях; вследствие неизбежной ошибки, вносимой при проведении данных процедур; вследствие различий в получении, источнике или чистоте компонентов, используемых для создания систем доставки лекарственных средств или композиций или осуществления указанных способов и т.п. Термин "примерно" также включает количества, отличающиеся вследствие разных состояний равновесия для композиции, получаемой из конкретной исходной смеси. Независимо от модифицирования термином "примерно", формула изобретения включает эквиваленты указанных количеств. В настоящем описании, если не указано иное, термин "система доставки лекарственного средства" относится к составу или устройству, обеспечивающему доставку терапевтического агента (агентов) к заданной области (областям) внутри организма и/или своевременное высвобождение терапевтического агента (агентов). В настоящем описании, если не указано иное, термин "размер частиц" относится к Z-среднему диаметру, измеренному путем динамического рассеяния света с использованием красного лазера с длиной волны 633 нм. Термин "эффективный средний размер частиц менее примерно 100 нм" означает, что по меньшей мере 90% частиц имеют размер менее примерно 100 нм при измерении с помощью вышеуказанного метода. В настоящем описании, если не указано иное, термин "наночастица" относится к микроскопической частице, размер которой измеряется в нанометрах. Наночастицы согласно настоящему изобретению, как правило, находятся в диапазоне от примерно 1 до примерно 999 нм в диаметре и могут содержать заключенную, инкапсулированную или включенную биологически активную молекулу. В настоящем описании, если не указано иное, термин "растворимость" вещества относится к способности данного вещества растворяться в определенном растворителе при приблизительно комнатной температуре, под которой понимают температуру от примерно 15 до примерно 38C. В настоящем описании, если не указано иное, термин "аморфный" означает твердую структуру, которая либо является некристаллической, либо состоит из очень маленьких кристаллов, обладающих размером частиц примерно 10 нм или меньше. В настоящем описании, если не указано иное, термин "цитотоксическое соединение" относится к соединению, обладающему способностью блокировать рост или убивать клетки. В настоящем описании, если не указано иное, термин "цитостатическое соединение" относится к соединению, обладающему способностью приводить клетки, необязательно лизированные или убитые, в постоянное непролиферативное состояние. В настоящем описании, если не указано иное, термин "производное" относится к соединению, образованному из исходной структуры либо напрямую путем химической реакции исходной структуры или путем "модификации", представляющей собой частичное замещение исходной структуры, либо путем создания и синтеза de novo. Производные могут представлять собой синтетические или метаболические продукты ферментативной реакции клетки или ферментативной реакции in vitro. В одном из вариантов системы доставки лекарственного средства согласно настоящему изобретению фармацевтически активное вещество обладает собственной растворимостью в воде по меньшей мере 4 мг/мл и указанный комплекс представляет собой нековалентный комплекс, обладающий растворимостью в воде менее 0,1 мг/мл. В другом варианте системы доставки лекарственного средства согласно настоящему изобретению указанный комплекс обладает эффективным средним размером частиц менее чем примерно 50 нм. Более мелкие частицы с меньшей вероятностью могут быть обнаружены ретикулоэндотелиальной системой,защищающей организм от внедрения микроорганизмов, таких как вирусы и бактерии. В другом варианте системы доставки лекарственного средства согласно настоящему изобретению отношение массы указанной натриевой соли метилового эфираN-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. В другом варианте реализации настоящего изобретения система доставки лекарственного средства содержит по меньшей мере одно другое фармацевтически активное вещество, обладающее собственной растворимостью в воде менее примерно 100 мкг/мл; при этом указанное другое фармацевтически активное вещество находится в форме частиц с эффективным средним размером менее примерно 100 нм, причем частицы указанного фармацевтически активного вещества, по существу, аморфны; частицы указанного другого фармацевтически активного вещества заключены совместно с частицами данного комплекса внутрь указанных наночастиц и отношение массы указанной натриевой соли метилового эфира Nполностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1. В соответствии с одним из аспектов данного варианта реализации указанный комплекс обладает эффективным средним размером частиц менее примерно 50 нм. В соответствии с другим аспектом данного варианта реализации отношение массы указанной натриевой соли метилового эфира Nполностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. В соответствии с другим аспектом данного варианта реализации указанное другое фармацевтически активное вещество обладает эффективным средним размером частиц менее примерно 50 нм и/или указанный комплекс обладает эффективным средним размером частиц менее примерно 50 нм. В соответствии с еще одним аспектом данного варианта реализации отношение массы указанной натриевой соли метилового эфираN-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. В другом варианте реализации настоящего изобретения по меньшей мере одно из указанных фармацевтически активных веществ представляет собой цитотоксическое или цитостатическое соединение. В другом варианте реализации настоящего изобретения по меньшей мере одно указанное фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение. В соответствии с одним из аспектов данного варианта реализации указанное цитотоксическое или цитостатическое соединение представляет собой протонированную форму доксорубицина, митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина (mechlorethamine) или комбинации указанных соединений. В соответствии с более конкретным аспектом данного варианта реализации указанное соединение представляет собой протонированную форму доксорубицина; в соответствии с другим более конкретным аспектом данного варианта реализации указанное соединение представляет собой протонированную форму митоксантрона. В соответствии с другим аспектом варианта реализации настоящего изобретения, в котором система доставки лекарственного средства содержит по меньшей мере одно другое фармацевтически активное вещество, обладающее собственной растворимостью в воде менее примерно 100 мкг/мл, указанное другое фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение. В соответствии с другим аспектом данного варианта реализации указанное цитотоксическое или цитостатическое соединение представляет собой таксан. В соответствии с еще одним аспектом данного варианта реализации указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ. В соответствии с другим аспектом данного варианта реализации по меньшей мере одно указанное фармацевтически активное вещество и указанное другое фармацевтически активное вещество представляют собой цитотоксическое или цитостатическое соединение; в соответствии с одним из аспектов данного варианта реализации по меньшей мере одно указанное фармацевтически активное вещество представляет собой протонированную форму доксорубицина, митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина или комбинации указанных соединений; в соответствии с конкретным аспектом данного варианта реализации указанное соединение представляет собой протонированную форму доксорубицина; в соответствии с другим конкретным аспектом данного варианта реализации указанное соединение представляет собой протонированную форму митоксантрона; в соответствии с другим конкретным аспектом данного варианта реализации указанное другое фармацевтически активное вещество представляет собой таксан; в соответствии с другим конкретным аспектом данного варианта реализации указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ. Другой вариант реализации настоящего изобретения относится к указанной системе доставки лекарственного средства для применения при лечении рака. Другой вариант реализации настоящего изобретения относится к фармацевтической композиции,содержащей фармацевтически приемлемый носитель и систему доставки лекарственного средства данного вида. В соответствии с одним из аспектов данного варианта реализации указанная фармацевтическая композиция находится в форме водного раствора, геля, крема, мази, таблетки, капсулы или гелевой капсулы (софтгеля). Другой вариант реализации настоящего изобретения относится к применению натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей для получения системы доставки лекарственного средства согласно настоящему изобретению. Еще один вариант реализации настоящего изобретения относится к способу получения системы доставки лекарственного средства согласно настоящему изобретению, согласно которому размер указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял менее примерно 100 нм, путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1. Еще один вариант реализации настоящего изобретения относится к способу получения системы доставки лекарственного средства согласно настоящему изобретению, содержащей по меньшей мере одно другое фармацевтически активное вещество, согласно которому размер частиц указанного другого фармацевтически активного вещества и частиц указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял примерно менее 100 нм, путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1. Другой вариант реализации настоящего изобретения относится к способу получения системы доставки лекарственного средства согласно настоящему изобретению, согласно которому по меньшей мере одно указанное фармацевтически активное вещество подвергают воздействию первого водного раствора натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с получением частиц указанного комплекса; и полученные частицы указанного комплекса затем подвергают воздействию второго водного раствора натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе. В соответствии с одним из аспектов данного варианта реализации указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, в котором общее количество натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей является достаточным для образования частиц указанного ком-5 018559 плекса и растворения указанного комплекса. Другой вариант реализации настоящего изобретения относится к способу получения системы доставки лекарственного средства согласно настоящему изобретению, содержащей по меньшей мере одно другое фармацевтически активное вещество, согласно которому указанное другое фармацевтически активное вещество подвергают воздействию первого водного раствора натриевой соли метилового эфираN-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанного другого фармацевтически активного вещества в указанном первом водном растворе; по меньшей мере одно указанное фармацевтически активное вещество подвергают воздействию второго водного раствора натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с получением частиц указанного комплекса; и полученные частицы указанного комплекса подвергают воздействию в указанном втором водном растворе натриевой солью метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе. В соответствии с одним из аспектов данного варианта реализации указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, в котором общее количество натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей является достаточным для растворения указанного другого фармацевтически активного вещества; образования частиц указанного комплекса и растворения указанного комплекса. Другой вариант реализации настоящего изобретения относится к системе доставки лекарственного средства, полученной любым из указанных способов согласно настоящему изобретению. Другой вариант реализации настоящего изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и указанную систему доставки лекарственного средства; в соответствии с аспектом данного варианта реализации фармацевтическая композиция находится в форме водного раствора, геля, крема, мази, таблетки, капсулы или гелевой капсулы (софтгеля). Другой вариант реализации настоящего изобретения относится к применению системы доставки лекарственного средства согласно настоящему изобретению для получения лекарственного средства для лечения рака. Другой вариант реализации настоящего изобретения относится к способу лечения рака, согласно которому фармацевтическую композицию согласно настоящему изобретению вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении. Другой вариант реализации настоящего изобретения относится к применению фармацевтической композиции согласно настоящему изобретению для получения лекарственного средства для лечения рака. Другой вариант реализации настоящего изобретения относится к способу лечения рака, согласно которому систему доставки лекарственного средства согласно настоящему изобретению вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении. Настоящее изобретение более подробно проиллюстрировано в следующих неограничивающих примерах. Примеры Материалы и способы. Используемые составы были либо свежеприготовленными, либо полученными путем восстановления высушенных методом сублимации фармацевтически активных веществ с натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей с применением конкретного раствора для восстановления. Доксорубицин приобретали у Mercian Corporation, Япония. Паклитаксел приобретали у SigmaAldrich AB, Швеция. Доцетаксел приобретали у ScinoPharm Тайвань, Ltd. Митоксантрон и Топотекан приобретали у Chemtronica KB, Швеция. Адриамицин приобретали в аптеках и растворяли согласно инструкции изготовителей. Размер частиц в составах измеряли методом динамического рассеяния света с использованием красного лазера (633 нм, Nano-ZS, Malvern Instruments Ltd.). Для того чтобы построить график размера частиц, рассчитывали средние значения для трех независимых измерений. Доверительный интервал измерений по оси Y принимали равным +/- величине стандартного отклонения. Для оценки цитотоксичности in vitro клетки линий клеток различных опухолей человека приобретали у Американской Коллекции Типовых Культур (American Type Culture Collection) (Rockville, Md.,США): линию клеток MDA-MB-231 аденокарциномы молочной железы человека (АТСС-НТВ-26, серия 3576799), линию клеток SKOV-3 аденокарциномы яичника человека (АТСС-НТВ-77, серия 3038337) и линию клеток А 549 немелкоклеточного рака легкого человека (ATCC-CCL-185, серия 3244171). КлеткиMDA-МВ-231 выращивали в культуральной среде MEM (минимальной поддерживающей среде) с добавлением 2 мМ L-глутамина, 10% фетальной бычьей сыворотки (FBS) и антибиотиков. Клетки SKOV-3 культивировали в культуральной среде МакКоя 5 А с добавлением 1,5 мМ L-глутамина, 10% FBS и антибиотиков. Все среды и добавки приобретали у Sigma-Aldrich Co. (St. Louis, Mi., США). Культивирование клеток всех линий осуществляли в колбах для культивирования 25 или 75 см 2 BD Falcon (Becton Dickinson Labware). Клетки А 549 культивировали в культуральной среде Ham's F-12 с добавлением 1 мМ Lглутамина, 10% FBS и антибиотиков. Культивирование клеток всех линий осуществляли в колбах для культивирования 25 или 75 см 2 BD Falcon. Тестирование цитотоксичности лекарственного средства осуществляли с использованием 96 луночных планшетов для культивирования BD Falcon для прилипающих клеток (Becton DickinsonLabware). В данные планшеты высевали клетки с плотностью 8103 клеток на лунку для MDA-MB-231,10103 клеток на лунку для SKOV-3 или 6103 клеток на лунку для А 549 в объеме 200 мкл на лунку. Как колбы, так и планшеты для культивирования инкубировали для роста клеток при 37 С во влажной атмосфере, содержавшей воздух (95%) и CO2 (5%). Культуры клеток в планшетах для культивирования оставляли для обеспечения прилипания в течение инкубации длительностью 24 ч. На 1 день после высевания клеток 4 мкл растворы подвергаемых тестированию составов с различными концентрациями в подходящих растворителях добавляли в лунки,содержащие культуры (эксперименты по определению зависимости "доза-эффект"). В контрольных культурах 4 мкл растворителей добавляли в качестве контроля с помощью растворителя. Клетки инкубировали в течение 2-4 последующих дней. В конце периода инкубации прилипшие клетки отделяли путем трипсинизации и количество жизнеспособных клеток рассчитывали с использованием метода с исключением трипанового синего с применением гемоцитометра. Все эксперименты проводили по меньшей мере три раза и данные получали из среднего значения трех определений, каждое из которых проводили в четырех повторениях. Результаты выражали в виде среднего количества клетоксреднеквадратическая погрешность (SE) и различия между контрольной и тестируемой серией оценивали посредством tкритерия Стьюдента. Цитотоксичность лекарственного средства оценивали исходя из степени ингибирования роста клеток. Ингибирование роста клеток тестируемыми лекарственными средствами рассчитывали следующим образом: В контрольной серии 4 мкл различных растворителей, используемых для тестирования лекарственного средства, добавляли к культурам в качестве отрицательного контроля с помощью растворителя. Различия между данными контрольными сериями были незначительными; поэтому для расчетов использовали среднее значение отрицательных контролей. Водные растворы Адриамицина (гидрохлорида доксорубицина) и метанольные растворы доцетакселя использовали в качестве положительных контролей. Различия в ингибировании роста данными лекарственными средствами в различных растворителях были незначительными, поэтому для расчетов использовали среднее значение ингибирования положительных контролей. Среднее значение IC50SE рассчитывали на основе данных по меньшей мере трех отдельных экспериментов. Факторы усиления (EF) рассчитывали путем деления IC50 лекарственного средства контрольного сравнения на IC50 состава согласно настоящему изобретению. Пример 1. Получение водонерастворимой соли доксорубицина и метилового эфира N-полностьютранс-ретиноилцистеиновой кислоты. Готовили водный раствор натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты (2 мл, 5 мг/мл) и гидрохлорида доксорубицина (6 мл, 2 мг/мл) путем смешивания в 10-мл пробирке. Во время смешивания происходило выпадение мелкодисперсного осадка. Осадок отделяли путем центрифугирования пробирки со скоростью 3000 об/мин в течение 10 мин. Надосадочную жидкость удаляли и осадок встряхивали с 10 мл воды с последующим центрифугированием. По завершении трех дополнительных процедур промывки, как описано выше, надосадочную жидкость фильтровали через 0,2-мкм фильтр с удалением возможных больших агрегатов продукта. Растворимость комплекса доксорубицина измеряли методом УФ при длине волны 350 нм и растворимость составляла 0,0002 мг/мл. Пример 2. Получение состава доксорубицина, паклитакселя и натриевой соли метилового эфира N13-цис-ретиноилцистеиновой кислоты в массовом соотношении 1:2.5:7. Готовили метаноловый раствор паклитакселя (200 мл, 1,2 мг/мл) и натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты (134,4 мл, 5 мг/мл) путем смешивания в 1000 мл круглодонной колбе и полученный раствор выпаривали в вакууме. Остаток растворяли в воде (120 мл) и водный раствор гидрохлорида доксорубицина (48 мл, 2 мг/мл) по каплям добавляли к полученному раствору при перемешивании. Смешанный раствор перемешивали в течение еще 30 мин, фильтровали через 0,2-мкм фильтр и су-7 018559 шили методом сублимации. Пример 3. Получение состава доксорубицина, доцетакселя и натриевой соли метилового эфира Nполностью-транс-ретиноилцистеиновой кислоты в массовом соотношении 1:1:4. Готовили метаноловый раствор доцетакселя (100 мл, 1 мг/мл) и натриевой соли метилового эфираN-полностью-транс-ретиноилцистеиновой кислоты (80 мл, 5 мг/мл) путем смешивания в 1000 мл круглодонной колбе и полученный раствор выпаривали в вакууме. Остаток растворяли в воде (100 мл) и водный раствор гидрохлорида доксорубицина (50 мл, 2 мг/мл) по каплям добавляли к полученному раствору при перемешивании. Смешанный раствор перемешивали в течение еще 30 мин, фильтровали через 0,2 мкм фильтр и сушили методом сублимации. Пример 4. Получение состава митоксантрона, топотекана, паклитакселя и натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты в массовом соотношении 2:1:20:40. Готовили метаноловый раствор паклитакселя (200 мл, 1,2 мг/мл) и натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты (96 мл, 5 мг/мл) путем смешивания в 1000-мл круглодонной колбе и полученный раствор выпаривали в вакууме. Остаток растворяли в воде (120 мл) и водный раствор дигидрохлорида митоксантрона (12 мл, 2 мг/мл) и водный раствор гидрохлорида топотекана (6 мл, 2 мг/мл) по каплям добавляли к полученному раствору при перемешивании. Смешанный раствор перемешивали в течение еще 30 мин, фильтровали через 0,2-мкм фильтр и сушили методом сублимации. Пример 5. Исследование зависимости размера частиц от концентрации доксорубицина в составе,образованном доксорубицином, доцетакселем, натриевой солью метилового эфира N-полностью-трансретиноилцистеиновой кислоты и натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты (массовое соотношение 1:1:1.65:1.65). Растворы готовили путем растворения высушенных методом сублимации образцов смесей доксорубицина, доцетакселя, натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты и натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты (массовое соотношение 1:1:1.65:1.65) в водном растворе, содержащем NaCl (5,9 мг/мл), KCl (0,3 мг/мл), CaCl2 (0,295 мг/мл), гексагидрат MgCl2 (0,2 мг/мл), ацетат натрия (4,1 мг/мл). Таблица 1 Как показано в табл. 1 и на фиг. 1, более низкие концентрации доксорубицина приводят к меньшему размеру частиц в диапазоне концентраций 0,25-1 мг/мл. Дальнейшее разбавление не оказывает значительного влияния на размер частиц. Пример 6. Исследование синергизма действия доксорубицина и доцетакселя в культурах линии клеток SKOV-3 аденокарциномы яичника человека. Использовали высушенные методом сублимации составы доксорубицина/доцетакселя/метилового эфираN-13-цисретиноилцистеиновой кислоты, содержащие эквимолярные количества доксорубицина и доцетакселя(массовое соотношение 1:1.4:2:2). EF рассчитывали относительно Адриамицина. IC50 для смесей доцетаксел-доксорубицин основан на сумме количеств цитостатического соединения. Результаты приведены в табл. 2 ниже. Таблица 2 На сильный синергический эффект доксорубицина и доцетакселя указывает то, что EF для последовательных добавлений доксорубицина и доцетакселя равен 1. Получение состава наночастиц дополнительно увеличивает эффективность указанной комбинации. Пример 7. Оценка цитотоксичности составов в культурах линии клеток MDA-MB-231 аденокарциномы молочной железы человека. Составы,содержащие смесь комплексов метилового эфираN-полностью-трансретиноилцистеиновой кислоты и метилового эфира N-13-цис-ретиноилцистеиновой кислоты, получали путем растворения высушенного методом сублимации порошка. IC50 были основаны на концентрации доксорубицина. Факторы усиления рассчитывали относительно доксорубицина. Результаты приведены в табл. 3 ниже. Пример 8. Оценка цитотоксичности составов в культурах линии клеток SKOV-3 аденокарциномы яичника человека. Составы,содержащие смесь комплексов метилового эфираN-полностью-трансретиноилцистеиновой кислоты и метилового эфира N-13-цис-ретиноилцистеиновой кислоты, получали путем растворения высушенного методом сублимации порошка. IC50 были основаны на концентрации доксорубицина. Факторы усиления рассчитывали относительно доксорубицина. Результаты приведены в табл. 4 ниже. Пример 9. Оценка цитотоксичности составов в культурах линии клеток А 549 немелкоклеточного рака легкого человека. Составы,содержащие смесь комплексов метилового эфираN-полностью-трансретиноилцистеиновой кислоты и метилового эфира N-13-цис-ретиноилцистеиновой кислоты, получали путем растворения высушенного методом сублимации порошка. IC50 были основаны на концентрации доксорубицина. Факторы усиления рассчитывали относительно доксорубицина. Результаты приведены в табл. 5 ниже. Таблица 5 Несмотря на то что настоящее изобретение описано со ссылкой на конкретные варианты реализации, включая лучший вариант, известный в настоящий момент авторам изобретения, следует понимать,что возможны различные изменения и модификации настоящего изобретения, охарактеризованного в прилагаемой формуле изобретения, очевидные специалисту в данной области техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Система доставки лекарственного средства для введения по меньшей мере одного фармацевтически активного вещества, которое по своей природе является катионным амфифилом, в виде частиц комплекса, образованного указанным фармацевтически активным веществом и натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цисретиноилцистеиновой кислоты или комбинацией указанных солей, при этом указанные частицы комплекса имеют эффективный средний размер менее примерно 100 нм, причем частицы указанного комплекса являются, по существу, аморфными; частицы указанного комплекса заключены внутрь наночастиц, образованных натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфираN-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей; отношение массы указанной натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или их комбинации к массе указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1. 2. Система доставки лекарственного средства по п.1, отличающаяся тем, что указанное фармацевтически активное вещество обладает собственной растворимостью в воде, равной по меньшей мере 4 мг/мл, и указанный комплекс представляет собой нековалентный комплекс, обладающий растворимостью в воде менее 0,1 мг/мл. 3. Система доставки лекарственного средства по п.1 или 2, отличающаяся тем, что эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм. 4. Система доставки лекарственного средства по любому из пп.1-3, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации ука- 12018559 занных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. 5. Система доставки лекарственного средства по п.1 или 2, содержащая по меньшей мере одно другое фармацевтически активное вещество, обладающее собственной растворимостью в воде менее примерно 100 мкг/мл, при этом указанное другое фармацевтически активное вещество находится в форме частиц с эффективным средним размером менее примерно 100 нм, при этом частицы указанного другого фармацевтически активного вещества являются, по существу, аморфными; частицы указанного другого фармацевтически активного вещества заключены совместно с частицами данного комплекса внутрь указанных наночастиц; отношение массы указанной натриевой соли метилового эфира N-полностью-трансретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или их комбинации к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 0,5:1 до примерно 20:1. 6. Система доставки лекарственного средства по п.5, отличающаяся тем, что эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм. 7. Система доставки лекарственного средства по п.5 или 6, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. 8. Система доставки лекарственного средства по любому из пп.5-7, отличающаяся тем, что указанное другое фармацевтически активное вещество имеет эффективный средний размер частиц менее примерно 50 нм и/или эффективный средний размер частиц указанного комплекса составляет менее примерно 50 нм. 9. Система доставки лекарственного средства по любому из пп.5-8, отличающаяся тем, что отношение массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса находится в диапазоне от примерно 1:1 до примерно 10:1. 10. Система доставки лекарственного средства по любому из пп.1-9, отличающаяся тем, что по меньшей мере одно из указанных фармацевтически активных веществ представляет собой цитотоксическое или цитостатическое соединение. 11. Система доставки лекарственного средства по любому из пп.1-10, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение. 12. Система доставки лекарственного средства по п.11, отличающаяся тем, что указанное цитотоксическое или цитостатическое соединение представляет собой протонированную форму доксорубицина,митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина или комбинации указанных веществ. 13. Система доставки лекарственного средства по п.12, отличающаяся тем, что указанное соединение представляет собой протонированную форму доксорубицина. 14. Система доставки лекарственного средства по п.12, отличающаяся тем, что указанное соединение представляет собой протонированную форму митоксантрона. 15. Система доставки лекарственного средства по любому из пп.5-14, отличающаяся тем, что указанное другое фармацевтически активное вещество представляет собой цитотоксическое или цитостатическое соединение. 16. Система доставки лекарственного средства по п.15, отличающаяся тем, что указанное цитотоксическое или цитостатическое соединение представляет собой таксан. 17. Система доставки лекарственного средства по п.16, отличающаяся тем, что указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ. 18. Система доставки лекарственного средства по п.5, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество и указанное другое фармацевтически активное вещество представляют собой цитотоксические или цитостатические соединения. 19. Система доставки лекарственного средства по п.18, отличающаяся тем, что указанное по меньшей мере одно фармацевтически активное вещество представляет собой протонированную форму доксорубицина, митоксантрона, эпирубицина, даунорубицина, идарубицина, топотекана, иринотекана, винбластина, винкристина, винорелбина, амсакрина, прокарбазина, мехлорэтамина или комбинации указанных веществ. 20. Система доставки лекарственного средства по п.19, отличающаяся тем, что указанное соединение представляет собой протонированную форму доксорубицина. 21. Система доставки лекарственного средства по п.19, отличающаяся тем, что указанное соединение представляет собой протонированную форму митоксантрона. 22. Система доставки лекарственного средства по п.18, отличающаяся тем, что указанное другое фармацевтически активное вещество представляет собой таксан. 23. Система доставки лекарственного средства по п.22, отличающаяся тем, что указанный таксан выбран из паклитакселя, доцетакселя и производных указанных веществ. 24. Система доставки лекарственного средства по любому из пп.1-23 для применения при лечении рака. 25. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и систему доставки лекарственного средства по любому из пп.1-24. 26. Лекарственная форма, содержащая фармацевтически приемлемый носитель и систему доставки лекарственного средства по любому из пп.1-24, в форме водного раствора, геля, крема, мази, таблетки,капсулы или гелевой капсулы (софтгеля). 27. Применение натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей для получения системы доставки лекарственного средства по любому из пп.1-24. 28. Способ получения системы доставки лекарственного средства по п.1 или 2, согласно которому размер указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял менее примерно 100 нм, путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфираN-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к массе указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1. 29. Способ получения системы доставки лекарственного средства по п.5, согласно которому размер частиц указанного другого фармацевтически активного вещества и частиц указанного комплекса контролируют таким образом, чтобы эффективный средний размер частиц составлял менее примерно 100 нм,путем регулирования отношения массы указанной натриевой соли метилового эфира N-полностьютранс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей к общей массе указанного другого фармацевтически активного вещества и указанного комплекса таким образом, чтобы указанное отношение находилось в диапазоне от примерно 0,5:1 до примерно 20:1. 30. Способ получения системы доставки лекарственного средства по п.1 или 2, согласно которому указанное по меньшей мере одно фармацевтически активное вещество обрабатывают первым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты,натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с получением частиц указанного комплекса; полученные частицы указанного комплекса затем обрабатывают вторым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе. 31. Способ по п.30, согласно которому указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, при этом общее количество натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей в указанном водном растворе является достаточным для образования частиц указанного комплекса и растворения указанного комплекса. 32. Способ получения системы доставки лекарственного средства по п.5, согласно которому указанное другое фармацевтически активное вещество обрабатывают первым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей до растворения указанного другого фармацевтически активного вещества в указанном первом водном растворе; указанное по меньшей мере одно фармацевтически активное вещество обрабатывают вторым водным раствором натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты,натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей с образованием частиц указанного комплекса; полученные частицы указанного комплекса обрабатывают в указанном втором водном растворе натриевой солью метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой солью метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинацией указанных солей до растворения указанных частиц указанного комплекса в указанном втором водном растворе. 33. Способ по п.32, согласно которому указанный первый водный раствор и указанный второй водный раствор представляют собой один и тот же водный раствор, при этом общее количество натриевой соли метилового эфира N-полностью-транс-ретиноилцистеиновой кислоты, натриевой соли метилового эфира N-13-цис-ретиноилцистеиновой кислоты или комбинации указанных солей в указанном водном растворе является достаточным для растворения указанного другого фармацевтически активного вещества; образования частиц указанного комплекса; растворения указанного комплекса. 34. Применение системы доставки лекарственного средства по любому из пп.1-24 для получения лекарственного средства для лечения рака. 35. Способ лечения рака, согласно которому фармацевтическую композицию по п.25 или лекарственную форму по п.26 вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении. 36. Применение фармацевтической композиции по п.25 или лекарственной формы по п.26 для получения лекарственного средства для лечения рака. 37. Способ лечения рака, согласно которому систему доставки лекарственного средства по любому из пп.1-24 вводят в терапевтически эффективном количестве пациенту, нуждающемуся в таком лечении.
МПК / Метки
МПК: A61K 9/14, A61K 47/48, A61P 35/00
Метки: лекарственного, доставки, активного, введения, система, средства, амфифильного, вещества, водорастворимого, фармацевтически, катионного
Код ссылки
<a href="https://eas.patents.su/16-18559-sistema-dostavki-lekarstvennogo-sredstva-dlya-vvedeniya-vodorastvorimogo-kationnogo-i-amfifilnogo-farmacevticheski-aktivnogo-veshhestva.html" rel="bookmark" title="База патентов Евразийского Союза">Система доставки лекарственного средства для введения водорастворимого катионного и амфифильного фармацевтически активного вещества</a>
Предыдущий патент: Способ и установка для удаления диоксида углерода из сырьевого газа
Следующий патент: Инструмент для эндоскопических применений и способ его получения
Случайный патент: Кольцевой хроматограф