Композиция, содержащая пептиды основного белка миелина, ее применение и способ лечения или профилактики рассеянного склероза или оптического неврита
Формула / Реферат
1. Композиция для лечения или профилактики рассеянного склероза или оптического неврита, которая содержит следующие пептиды основного белка миелина:
MBP 30-44,
MBP 83-99,
MBP 131-145 и
MBP 140-154,
в приблизительном соотношении 1:1:1:1.
2. Применение композиции по п.1 для получения лекарственного средства для лечения рассеянного склероза.
3. Применение композиции по п.1 для получения лекарственного средства для лечения оптического неврита.
4. Способ лечения или профилактики рассеянного склероза у пациента, который включает стадию введения композиции по п.1 пациенту.
5. Способ лечения или профилактики оптического неврита у пациента, который включает стадию введения композиции по п.1 пациенту.
6. Способ по п.4 или 5, в котором композицию вводят согласно протоколу с увеличением дозы.
7. Способ по любому из пп.4-6, где композицию вводят HLA-DQ6 или HLA-DR2-положительным пациентам.
8. Набор для получения композиции по п.1, который включает следующие пептиды основного белка миелина:
MBP 30-44,
MBP 83-99,
MBP 131-145 и
MBP 140-154.
Текст
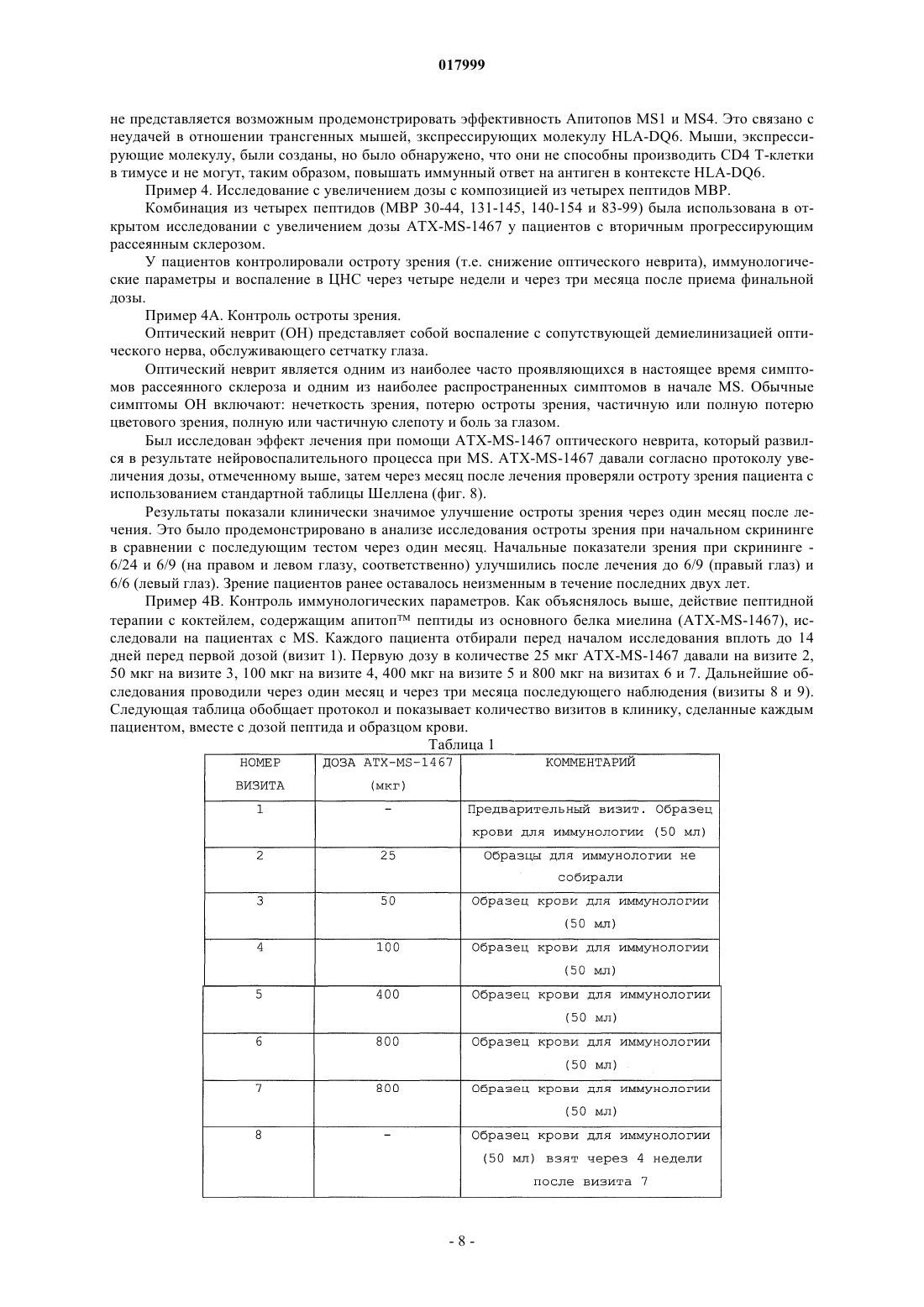
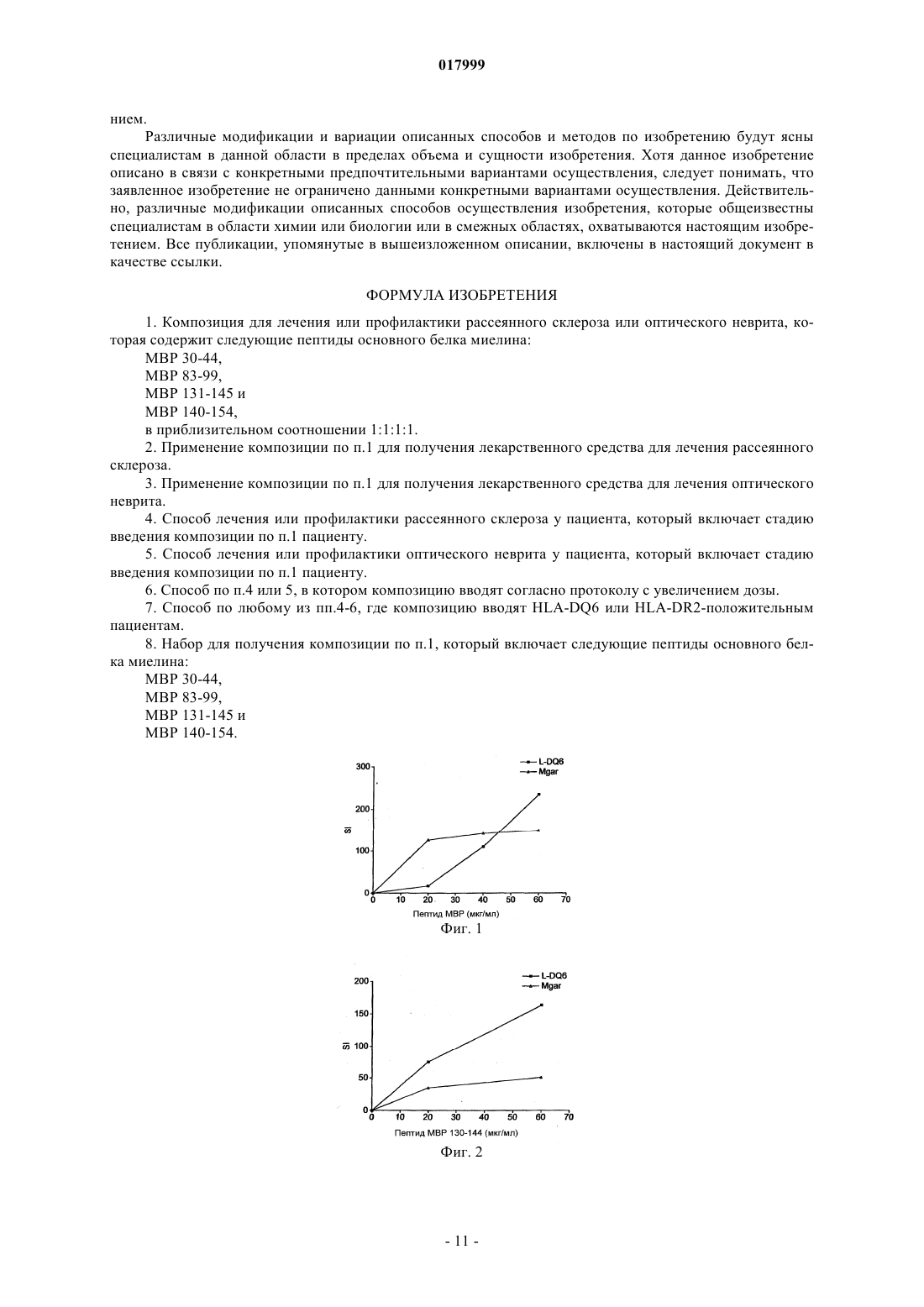
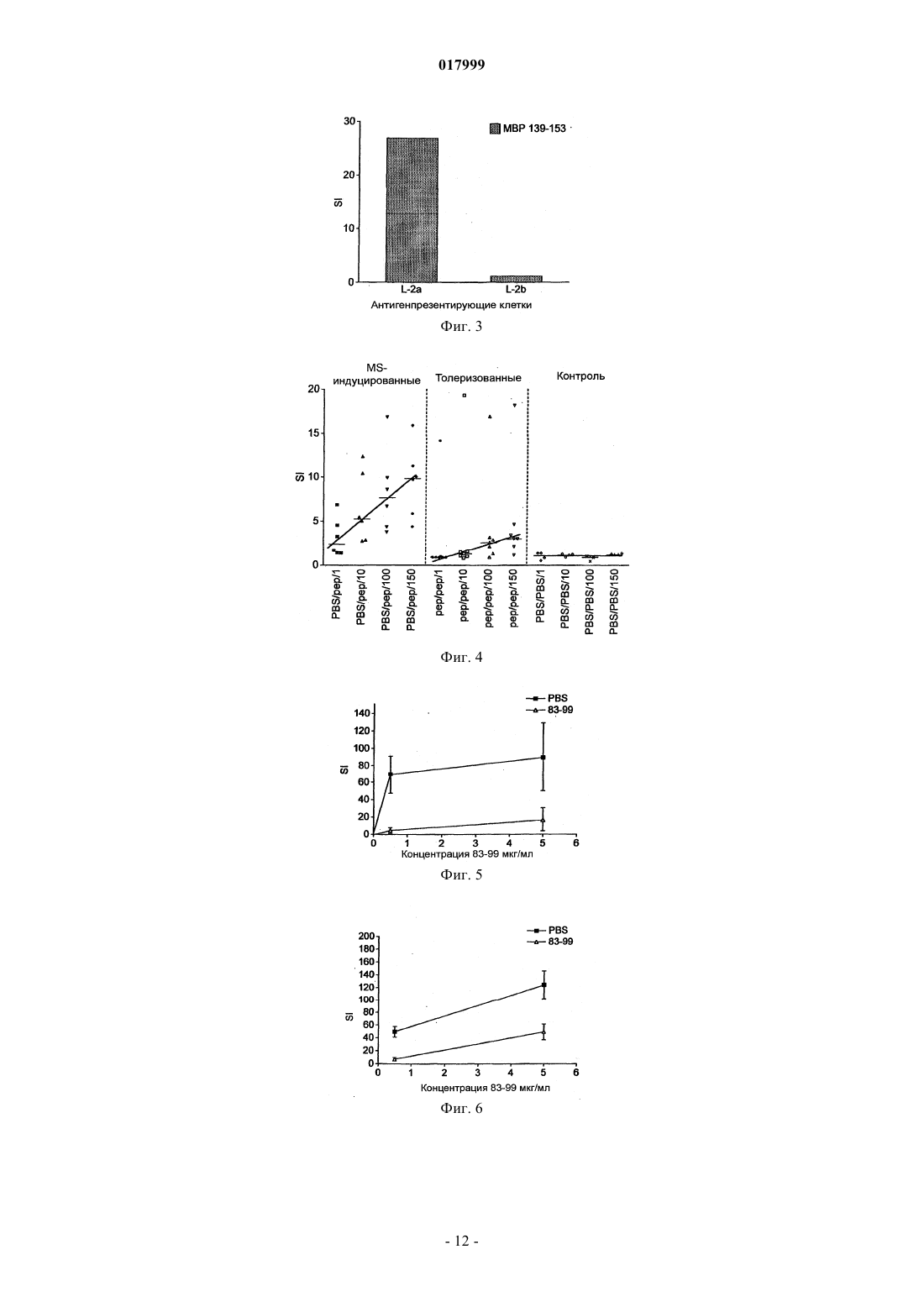
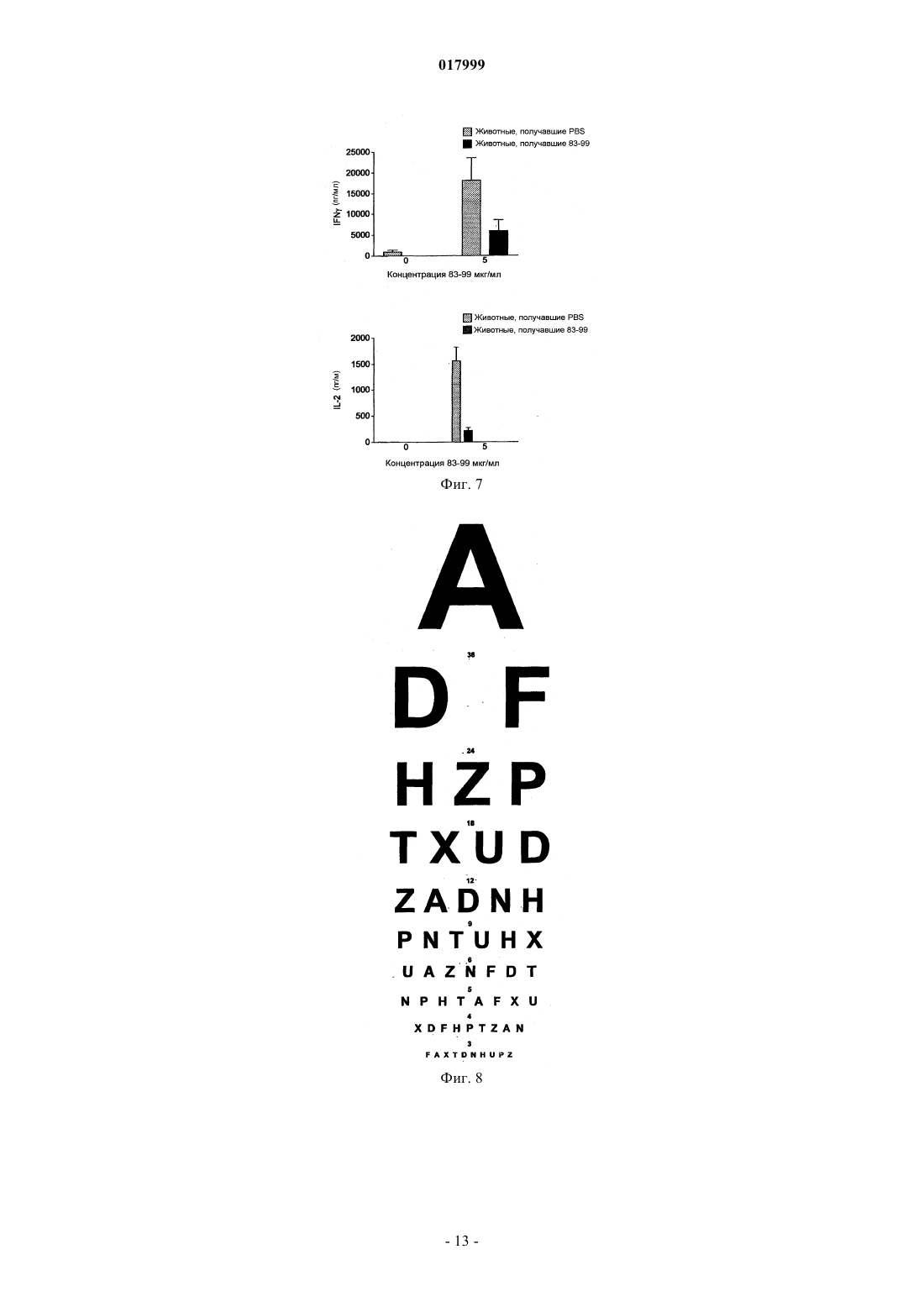
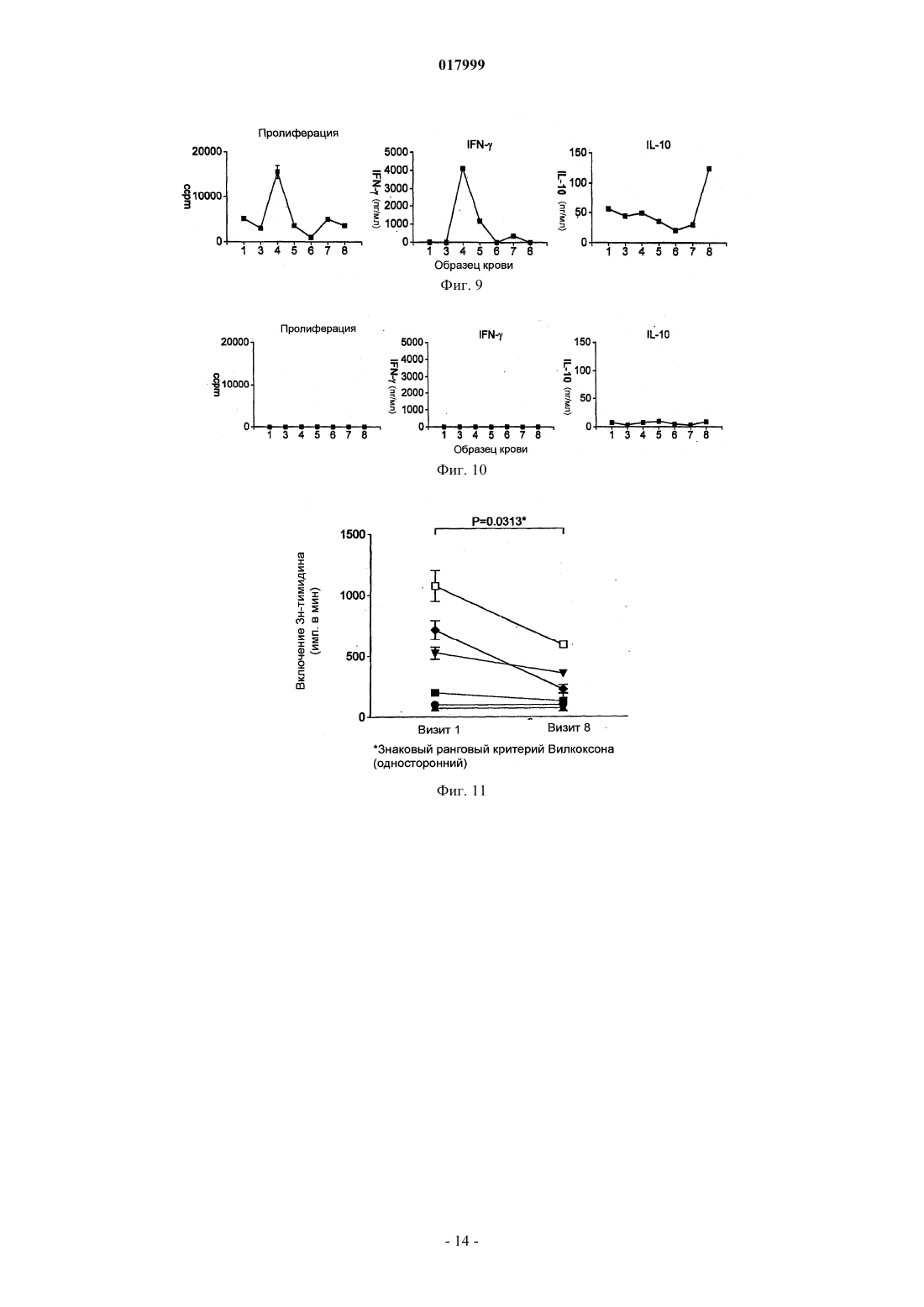
КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПЕПТИДЫ ОСНОВНОГО БЕЛКА МИЕЛИНА, ЕЕ ПРИМЕНЕНИЕ И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАССЕЯННОГО СКЛЕРОЗА ИЛИ ОПТИЧЕСКОГО НЕВРИТА Изобретение относится к композиции, которая содержит следующие пептиды основного белка миелина: MBP 30-44, MBP 83-99, MBP 131-145 и MBP 140-154. Данную композицию можно использовать для лечения заболевания, в частности рассеянного склероза и/или оптического неврита, и данное изобретение также относится к указанному применению и способам. Изобретение относится к композиции, которая содержит пептиды основного белка миелина. Композицию можно использовать для лечения рассеянного склероза. Введение Рассеяный склероз Рассеянный склероз (MS) является наиболее распространенным инвалидизирующим неврологическим заболеванием, поражающим молодых людей. Около 85000 человек в Великобритании страдаютMS. При рассеянном склерозе (MS) воспаление нервной ткани приводит к потере миелина, жирового вещества, которое выступает в качестве защитной изоляции нервных волокон в головном и спинном мозге. Такая потеря миелина, или демиелинизация, оставляет множественные области рубцовой ткани, или склероза, вдоль нервных клеток. В результате, склероз приводит к множественным неврологическим признакам и симптомам, обычно с рецидивами и ремиссиями. Обычные симптомы MS включают снижение или потерю зрения, спотыкание и неровную походку,невнятную речь, а также частое мочеиспускание и недержание мочи. Помимо этого, MS может приводить к изменениям настроения и депрессии, мышечным спазмам и тяжелому параличу. В настоящее время считается, что MS является аутоиммунным заболеванием, опосредованным аутореактивными Т-клетками. Существующее лечение MS, как правило, направлено на подавление иммунной системы. Например,один из способов лечения включает трансплантацию костного мозга и введение цитостатиков и иммуносупрессивных лекарственных средств. Такое лечение эффективно для части пациентов, но является дорогостоящим и имеет довольно высокие риски осложнений. Кроме того, применение цитостатиков при лечении MS считается спорным, потому что их эффекты неясны, а возможные побочные эффекты являются тяжелыми. Лечение интерфероном-бета (IFN) ослабляет симптомы MS у части пациентов и, вследствие этого,широко используется. Однако механизм действия интерферона-бета неясен, а лечение IFN эффективно не для всех пациентов. Более того, лечение IFN осложняется формированием анти-IFN антител у большинства пациентов (Giovannoni, G., Munschauer, F. E., 3rd, и Deisenhammer, F. (2002). Neutralisingantibodies to interferon beta during the treatment of multiple sclerosis. J Neurol Neurosurg Psychiatry 73, 465469). В настоящее время не существует эффективного способа лечения MS. Лечение направлено лишь на уменьшение симптомов заболевания, обычно за счет общего подавления иммунной системы. Таким образом, существует острая необходимость в терапии, которая специфично нацелена на местный иммунный ответ, связанный с началом заболевания и его прогрессированием. Синтетические пептидыMetzler и Wraith (Int. Immunol. 5:1159-1165 (1993 были первыми исследователями, которые описали использование синтетических пептидов для подавления аутоиммунного ответа на мышиной модели с экспериментальным аутоиммунным энцефаломиелитом (ЕАЕ), общеизвестной модели MS in vivo. В этом исследовании пептиды, полученные из MBP, вводили интраназально, и было обнаружено, что уровень супрессии заболевания напрямую связан с антигенным действием использованных пептидов. Позже, в 1995, Liu и Wraith (Int. Immunol. 7:1255-1263) показали, что также можно вызвать супрессию ЕАЕ у мышей путем внутрибрюшинного введения растворимых пептидов, полученных из MBP. В этом исследовании была достигнута супрессия как Th1, так и Th2-ответа, и было показано, что введение пептидов после начала иммунного ответа может приводить к подавлению происходящих иммунных реакций. Однако было обнаружено, что не все пептиды, способные действовать в качестве Т-клеточных эпитопов, способны вызывать толерантность. Пептид 89-101 основного белка миелина (MBP) после иммунизации представляет собой иммунодоминантный антиген и также является крайне эффективным иммуногеном как с точки зрения праймирования Т-клеточной реактивности, так и индукции ЕАЕ. Однако была показана неэффективность этого пептида для индукции толерантности при введении в растворе (Anderton и Wraith (1998) Eur. J. Immunol. 28:1251-1261). Авторы настоящего изобретения ранее показали, что существует связь между способностью пептида связываться с молекулой МНС I или II класса и быть презентированным Т-клетке без дополнительного процессинга антигена и его способностью индуцировать толерантность in vivo. Можно ожидать, что пептиды, которые не зависят от процессинга антигена (т.е. не требуют дополнительного процессинга антигена для того, чтобы связаться с МНС), будут вызывать толерантность in vivo. Эти пептиды называют "апитопы", от Antigen Processing independent epiTOPES. В WO 02/16410 описаны следующие апитопы основного белка миелина (МВР): 30-44, 80-94, 83-99,81-95, 82-96, 83-97, 84-98, 110-124, 130-144, 131-145, 132-146 и 133-147. В WO 03/064464 в качестве апитопов определены следующие пептиды МВР: 134-148; 135-149; 136150; 137-151; 138-152 и 140-154. Сущность изобретения Авторы настоящего изобретения обнаружили, что "коктейль" из четырех пептидов МВР, каждый из которых является апитопом, особенно эффективен для лечения MS. Полагают, что комбинация четырех пептидов может оказывать синергическое действие. В первом аспекте, таким образом, настоящее изобретение относится к композиции, которая содержит следующие пептиды основного белка миелина: МВР 30-44; МВР 83-99; МВР 131-145 и МВР 140-154. Композиция может состоять преимущественно из МВР 30-44, 83-99, 131-145 и 140-154. Композицию можно использовать для лечения или профилактики заболевания, в частности, рассеянного склероза. Композицию можно использовать для лечения или профилактики оптического неврита, в частности, оптического неврита, обусловленного рассеянным склерозом. Во втором аспекте настоящее изобретение относится к способу лечения или профилактики рассеянного склероза и/или оптического неврита путем введения пациенту композиции по первому аспекту изобретения. В способе второго аспекта по изобретению композицию можно вводить, следуя протоколу с увеличением дозы. Обнаружено, что два пептида в коктейле связываются с HLA-DQ6 (MBP 30-44 и 131-145), а два - сHLA-DR2 (MBP 140-154 и 83-99). Комбинированное использование этих апитопов обеспечивает более широкий охват различных гаплотипов главного комплекса гистосовместимости (МНС), наблюдаемых у пациентов с MS, чем при терапии одним пептидом. Способ второго аспекта по изобретению может включать введение композиции HLA-DQ6 илиHLA-DR2-положительным пациентам. В третьем аспекте настоящее изобретение относится к набору, который включает следующие пептиды основного белка миелина:MBP 30-44; МВР 83-99; МВР 131-145 и МВР 140-154 для совместного, раздельного или последовательного введения. Введение к фигурам Фиг. 1 - презентация МВР 30-44 посредством HLA-DQ6 Т-клеточному клону MS 49:D3; фиг. 2 - презентация МВР 130-144 посредством HLA-DQ6 Т-клеточному клону MS 17:A2; фиг. 3 - презентация МВР 139-153 посредством L-клеток, трансфецированных HLA-DR2a и HLADR2b, Т-клеточному клону N5:19; фиг. 4 - пролиферативный ответ клеток лимфоузла после толеризации Апитопом MS6; фиг. 5 - пролиферация спленоцитов в ответ на Апитоп MS7. Спленоциты получены от мышей, которых лечили посредством интраназального введения либо PBS, либо Апитопа MS7 (83-99); фиг. 6 - пролиферация спленоцитов в ответ на Апитоп MS7. Спленоциты получены от мышей, которых лечили посредством подкожного/чрезкожного введения либо PBS, либо Апитопа MS7 (83-99); фиг. 7 - выработка IFN и IL-2 спленоцитами, полученными от мышей, которых лечили посредством подкожного/чрезкожного введения либо PBS, либо Апитопа MS7 (83-99) фиг. 8 - пример таблицы Шеллена; фиг. 9 - ответы РВМС пациентов на основной белок миелина человека (МВР); фиг. 10 - ответы РВМС пациентов на ATX-MS-14 67; фиг. 11 - сравнение пролиферативного ответа Т-клеток на МВР до (визит 1) и после (визит 8) лечения с помощью ATX-MS-1467. Подробное описание Первый аспект изобретения относится к композиции, которая содержит несколько пептидов основного белка миелина. Основной белок миелина Основной белок миелина (МВР) представляет собой белок массой 18,5 кДа, который может быть выделен из белого вещества головного мозга человека. Зрелый белок содержит 170 аминокислот, и его последовательность широко доступна в литературе (см. например: Chou et al. (1986) J. Neurochem. 46:4753, фигура 1; Kamholz et al. (1986), PNAS 83:4962-4966, фигура 2; патент США 5817 62 9, SEQ ID NO: 1; Roth et al. (1987), J. Neurosci. Res. 17:321-328, фигура 4; Medeveczky et al. (2006), FEBS Letters 580:545552, фигура 3 В). Пептиды МВР Термин "пептид" используется в обычном значении и обозначает серию остатков, как правило, L-2 017999 аминокислот, соединенных один с другим обычно посредством пептидных связей между -амино и карбоксильной группами соседних аминокислот. Термин включает модифицированные пептиды и синтетические аналоги пептидов. Пептиды, использованные в композиции и наборе по настоящему изобретению, могут быть получены с использованием химических способов (Peptide Chemistry, A practical Textbook. Mikos Bodansky,Springer-Verlag, Berlin.). Например, пептиды могут быть синтезированы твердофазными методами(Roberge JY et al. (1995) Science 269: 202-204), гидролизованы на ионообменной смоле и очищены посредством препаративной высокоэффективной жидкостной хроматографии (например, Creighton (1983)Proteins Structures And Molecular Principles, WH Freeman и Со, New York NY). Автоматический синтез может быть осуществлен, например, с использованием ABI 43 1 A Peptide Synthesizer (Perkin Elmer) в соответствии с инструкциями производителя. Пептид может альтернативно быть получен рекомбинантными методами или посредством выщепления из более длинного полипептида. Например, пептид может быть получен выщеплением из полноразмерного MBP. Состав пептида может быть подтвержден аминокислотным анализом или секвенированием (например, методом деградации по Эдману). Пептиды, использованные в композициях и наборах по настоящему изобретению, представлены ниже:H-Gly-Phe-Lys-Gly-Val-Asp-Ala-Gln-Gly-Thr-Leu-Ser-Lys-Ile-Phe-NH2 Термины "MBP 30-44", "MBP 83-99", "MBP 131-145" и "MBP 140-154" включают модифицированные пептиды. Например, пептиды могут быть мутированы посредством аминокислотной вставки, делеции или замены, при условии, что сохраняется МНС-связывающая специфичность немодифицированного пептида вместе с его способностью быть презентированным Т-клетке. Пептид может иметь, например,5, 4, 3, 2, 1 или 0 мутаций по сравнению с немодифицированной последовательностью. Альтернативно (или кроме того) модификации могут быть проведены без изменения аминокислотной последовательности пептида. Например, могут быть введены D-аминокислоты или другие неприродные аминокислоты, обычная амидная связь может быть замещена связями сложноэфирного или алкильного остова, могут быть включены N- или С-алкильные заместители, модификации боковой цепи и ограничительные связи, такие как дисульфидные мостики и связи амида боковой цепи или сложноэфирные. Такие изменения могут давать лучшую стабильность пептида in vivo и увеличивать биологическое время жизни. Модификации эпитопов могут быть сделаны, основываясь на прогнозировании для более эффективной Т-клеточной индукции, полученных с использованием программы "Peptide Binding Predictions",разработанной K. Parker (NIH), которую можно найти по адресу http://www-bimas.dcrt.nih.gov/cgibin/molbio/kenparkercomboform (см. также Parker, K. С et al. 1994. J.Immunol. 152:163). Пептиды MBP могут быть введены в композицию в нейтральной форме и в форме соли. Фармацевтически приемлемые соли включают кислые соли присоединения (образованные с помощью свободных аминогрупп пептида) и те, которые образованы с помощью неорганических кислот, таких как, например,хлористо-водородная или фосфорная кислоты, или органических кислот, таких как уксусная, щавелевая,винная и малеиновая. Соли, образованные с помощью свободных карбоксильных групп, могут также быть производными неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, 2 этиламиноэтанол, гистидин и прокаин. Композиция Композиция по настоящему изобретению может использоваться для профилактического или терапевтического применения. Композиция может быть получена в подходящей для инъекции форме, в виде раствора жидкости или суспензии; может также быть получена в виде твердой формы, подходящей для растворения или суспендирования в жидкости перед инъекцией. Препарат может также быть в виде эмульсии, или пептиды инкапсулированы в липосомы. Активные ингредиенты могут быть смешаны с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Удобными эксципиентами являются, например, вода, физиологический раствор (например, фосфатно-солевой буфер), декстроза, глицерин, этанол, или подобные им, и их сочетания. Кроме того, при желании, композиция может содержать незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие реагенты и/или рН-буферные вещества. Буферные соли включают фосфат, цитрат, ацетат. Хлористо-водородную кислоту и/или гидроксид натрия можно использовать для корректирования рН. Для стабилизации можно использовать дисахариды, такие как сахароза или трегалоза. В композиции относительное соотношение пептидов (MBP 30-44:МВР 83-99:МВР 131-145:МВР 140-154) может быть приблизительно 1:1:1:1. Альтернативно, относительное соотношение каждого пептида может быть изменено, например, для того, чтобы сфокусироваться на толерогенном ответе определенной субпопуляции аутореактивных Т-клеток или, если обнаружено, что один пептид работает лучше,чем остальные у определенных типов HLA. После получения, композиция может быть помещена в стерильный контейнер, который затем запаивается и хранится при низкой температуре, например 4 С, или композиция может быть высушена сублимацией. Удобно, если композицию получают в виде лиофилизованной (высушенной сублимацией) пудры. Лиофилизация обеспечивает возможность долгосрочного хранения в стабилизированной форме. Методы лиофилизации хорошо известны в данной области, см., например, http://www.devicelink.com/ivdt/archive/97/01/006.html. Наполнители, такие как маннит, декстран или глицин, широко используются перед лиофилизацией. Композицию можно вводить удобным способом, таким как пероральный, внутривенный (в случае водорастворимой), внутримышечный, подкожный, сублингвальный, интраназальный, чрезкожный или в виде суппозиториев или имплантов (например, с использованием молекул медленного высвобождения). Композиция может преимущественно вводиться интраназальным, подкожным или чрезкожным путем. Способ и фармацевтическую композицию по изобретению можно использовать для лечения человека. Обычно, лечащий врач определяет фактическую дозу, которая наиболее подходит для отдельного пациента и которая может варьировать в зависимости от возраста, веса и ответа конкретного пациента. В предпочтительном варианте осуществления можно следовать протоколу "увеличения дозы", когда совокупность доз дается пациенту в возрастающей концентрации. Такой подход был использован,например, для пептидов фосфолипазы А 2 в иммунотерапии аллергии к пчелиному яду (Mller et al.(1998) J. Allergy Clin Immunol. 101:747-754 и Akdis et al. (1998) J. Clin. Invest. 102:98-106). Наборы Удобно, когда четыре пептида MBP можно вводить вместе в форме смешанной композиции или коктейля. Однако в некоторых случаях, при которых предпочтительнее предоставлять пептиды раздельно в виде набора для совместного, раздельного, последовательного или комбинированного введения. Например, набор может включать четыре пептида в раздельных контейнерах, или два контейнера,содержащие по два пептида каждый. Содержимое контейнеров можно комбинировать или не комбинировать перед введением. Набор может также включать устройства для смешивания и/или для введения (например, распылитель для интраназального введения; или шприц и иглу для подкожной/чрезкожной дозы). Набор может также включать инструкции по использованию. Фармацевтическую композицию или набор по изобретению можно использовать для лечения и/или профилактики заболевания. В частности, композицию/набор можно использовать для лечения и/или профилактики рассеянного склероза и/или оптического неврита. Рассеянный склероз Рассеянный склероз (MS) является наиболее распространенным неврологическим нарушением среди молодых людей (в возрасте от 20 до 40 лет), поражая около 385000 человек в Европе и 300000 в США. Это хроническое дегенеративное заболевание центральной нервной системы, при котором происходит постепенное очаговое разрушение миелина во всех областях головного и/или спинного мозга, что препятствует нервной связи и вызывает мышечную слабость, потерю координации, речевые и зрительные нарушения. Через 10 лет приблизительно половина пациентов, которым изначально был поставлен диагноз возвратно-ремиттирующий MS (RRMS), отмечает снижение частоты обострений, но усиление нарушения функций. Это состояние известно как вторичный прогрессирующий MS (SPMS). По некоторым оценкам,в течение 25 лет приблизительно у 90% больных RRMS переходит во вторичный прогрессирующий тип. Как и RRMS, тяжесть вторичного прогрессирующего MS может изменяться. Для некоторых пациентов возрастание и прогрессирование нарушения функций происходит постепенно, у других это случается более быстро. В основном, однако, восстановление после обострений становится все менее и менее полным, симптомы имеют тенденцию к усилению, и нарушение функций растет. Клинически атаки становятся менее выраженными, и имеется тенденция к исчезновению ремиссий, но большая часть ткани ЦНС в данный момент не разрушена, и накопление повреждений более выражено на ЯМР. Композицию по изобретению можно использовать для лечения пациентов с недавно начавшимсяMS, RRMS или SPMS. Композиция по настоящему изобретению может ослаблять или улучшать один или несколько симптомов MS, которые включают снижение или потерю зрения, спотыкание и неровную походку, невнят-4 017999 ную речь, частое мочеиспускание и недержание мочи, изменения настроения и депрессию. SPMS может сопровождаться мышечными спазмами и тяжелым параличом. В частности, композиция может улучшать оптический неврит. Оптический неврит Оптический неврит (ОН) представляет собой воспаление с сопутствующей демиелинизацией оптического нерва, обслуживающего сетчатку глаза. Это переменное состояние, и может проявляться любым из следующих симптомов: нечеткость зрения, потеря остроты зрения, частичная или полная потеря цветового зрения, полная или частичная слепота и боль за глазом. Оптический неврит является одним из наиболее часто проявляющихся в настоящее время симптомов рассеянного склероза и одним из наиболее распространенных симптомов в начале развития MS. ОН может, однако, быть проявлением другого заболевания, а не MS, такого как ишемическая оптическая невропатия. В 70% случаев ОН присутствует унилатерально (только на одном глазу). Чаще всего, оптический неврит изначально поражает людей в возрасте от 15 до 50 лет. Исследования показывают, что в этой возрастной группе, более чем у 50% пациентов развивается рассеянный склероз в течение 15 лет. Как и в случае MS, у женщин вероятность появления ОН приблизительно в два раза выше, чем у мужчин, и распространенность ОН у европеоидов выше, чем в других расовых группах. Основными симптомами оптического неврита являются: потеря остроты зрения (нечеткость зрения); глазная боль; дисхроматопсия (снижение цветового зрения); двигательные и звуковые фосфены (зрительные ощущения вспышек, вызванные движением глаз из стороны в сторону или звуком); симптом Утхофа, ухудшение симптомов с повышением температуры или упадком сил. Лечение ОН с помощью композиции по настоящему изобретению может предотвращать, ослаблять или улучшать любые из этих симптомов. Для наблюдения за прогрессированием ОН острота зрения может быть удобно измерена с использованием таблицы Шеллена. Примеры Следующие примеры служат для иллюстрации настоящего изобретения, но не являются ограничивающими. Изобретение относится, в частности, к специфическим вариантам осуществления, описанным в данных примерах. В целях примеров следующие названия можно использовать для пептидов МВР: Композиция четырех пептидов называется ATX-MS-1467 Пример 1. Идентификация ограниченных по HLA-DQ6 Т-клеточных эпитопов основного белка миелина. Гены МНС класса II передают восприимчивость к рассеянному склерозу (Nepom и Ehrlich (1991)Ann. Rev. Immunol. 9: 493-525). Среди европеоидов средней и центральной Европы, Австралии и Северной Америки ассоциация связана с молекулой МНС HLA-DR2 (DR2a [DRB50101] и DR2b[DRB11501], Haines et al. (1998) Human Mol. Genet. 7: 1229-1234). Хотя DR2 и DQ6 аллели МНС находятся в различных локусах, существует значительное неравновесие по сцеплению между этими двумя аллелями. Конкордантность между этими двумя аллелями составляет 99%, гораздо выше ожидаемого, в случае если бы аллели были ассоциированы случайным образом. Таким образом, увеличивается возможность того, что определенные Т-клеточные эпитопы, связанные с MS, могут быть скорее ограничены поHLA-DQ6, чем по HLA-DR2. Целью данного исследования было установить, презентируются ли Т-клеточные эпитопы МВР человека с помощью молекулы HLA-DQ6 Т-клеточным клонам, выделенным от HLA-DR2-положительных пациентов с MS. Т-клеточную активацию измеряли посредством Т-клеточной пролиферации с использованием инкорпорации [3 Н]-тимидина. Пептидные антигены Пептиды MBP 30-44, 130-144 и 139-153 были синтезированы с использованием L-аминокислот и стандартной F-moc химии на синтезаторе пептидов Abimed AMS 422. Антигенпрезентирующие клетки В качестве антигенпрезентирующих клеток были использованы L-клетки, трансфецированные руют HLA-DQ, DP и DR. Т-клеточные клоны Т-клеточные клоны MS 49:D3 и MS 17:A2 были получены от пациентов с MS, и клон N5:19 был получен от здорового человека. Все три клона были выделены у DR2-положительных индивидуумов. Анализ презентации антигена Антигенпрезентирующие клетки инкубировали с различными концентрациями пептида и соответствующими Т-клетками. Пролиферацию и, таким образом, активацию Т-клеток измеряли посредством инкорпорации [3 Н]тимидина и выражали в виде индекса стимуляции (SI = корректированное число импульсов в минуту(ссрm) от культуры, содержащей пептиды/серпа от культуры без пептидов). Результаты Когда пептид МВР 30-44 презентировался L-клетками, трансфецированными HLA-DQ6, Тклеточный клон MS 49:D3 давал очень сильный пролиферативный ответ (в 1,5 раза больше по сравнению с контрольными клетками Mgar) при самой высокой концентрации пептида (фиг. 1). Когда МВР 130-144 презентировался L-клетками, трансфецированными HLA-DQ6, еще более сильный ответ был индуцирован у MS 17:A2 Т-клеток (увеличение пролиферации в 3,24 раза по сравнению с контрольными клеткамиMgar - фиг. 2). Третий Т-клеточный клон N5:19, выделенный от индивидуума с DR2, ответил на основной эпитоп МВР 140-154 и на серию перекрывающихся 15-мерных пептидов, покрывающих этот регион (138-156). Пептид 139-153 стимулировал пролиферацию Т-клеточного клона N5:19, когда он был презентирован Lклетками, трансфецированными HLA-DR2a, но не в случае L-клеток, трансфецированных HLA-DR2b(фигура 3). Вывод Т-клеточные клоны, выделенные от HLA-DR2-положительных индивидуумов, отвечают на ограниченные по HLA-DQ6 MBP Т-клеточные эпитопы. Это означает, что ассоциация HLA-DR2 с рассеянным склерозом не ограничивается DR2 MBP Т-клеточными эпитопами, но может быть также ограничена поDQ6. В композиции МВР по настоящему изобретению два пептида связываются с HLA-DQ6 (МВР 30-44 и 131-145) и два связываются с HLA-DR2 (МВР 140-154 и 83-99). Таким образом, терапия пептидами с помощью этих апитопов может быть направлена на HLA-DR2 или HLA-DQ6 индивидуумов. Пример 2. Индукция толерантности с помощью Апитопа MS6 у HLA:DR2 трансгенной мыши. Это исследование было спланировано для того, чтобы показать, что апитоп (Апитоп MS6), когда он презентируется молекулой МНС класса II, может вызывать иммунологическую толерантность на гуманизированной мышиной модели рассеянного склероза. Апитоп MS6 является апитопом, выбранным из Тклеточных эпитопов МВР, представляет собой МВР 140-154, презентируется посредством МНС класса II на антигенпредставляющих клетках и может стимулировать Т-клетки без процессинга (см. WO 03/064464). Была использована мышиная модель, трансгенная по молекуле МНС человека HLA:DR2(DRB11501) (Madsen et al. (1999) Nature Genetics 23:343-347). Индукцию толерантности или изменения в популяции CD4+ Т-клеток у мыши после введения апитопа можно проконтролировать по снижению Т-клеточной пролиферации после стимуляции антигеномin vivo. Пептидный синтез Апитоп MS6 (пептид МВР 140-154) был синтезирован с использованием L-аминокислот и стандартной F-moc химии на синтезаторе пептидов Abimed AMS 422. Мыши и индукция толерантности В исследовании были использованы HLA:DR2 трансгенные мыши в возрасте 8-12 недель. У мышей вызывали толерантность посредством предварительного введения 100 мкг Апитопа MS6 в 25 мкл фосфатно-солевого буфера (PBS) или 25 мкл PBS в чистом виде, путем интраназального введения на -8, -6 и-4 дни перед иммунизацией в день 0. Вслед за толеризацией, мыши были иммунизированы подкожно 100 мкл эмульсии, содержащей равные объемы полного адъюванта Фрейнда (CFA), PBS, содержащего 200 мкг Апитопа MS6 и 400 мкгMycobacterium tuberculosis, убитой нагреванием. Контрольная группа мышей, предварительно толеризованная посредством PBS интраназально, была иммунизирована без пептида. Через 10 дней после подкожной иммунизации подколенные и паховые лимфоузлы удаляли и оценивали Т-клеточную активацию, анализируя пролиферацию Т-клеток в ответ на различные концентрации Апитопа MS6. Пролиферацию измеряли посредством инкорпорации [3 Н]-тимидина и выражали в виде индекса стимуляции (SI = корректированное число импульсов в минуту (ccpm) от культуры, содержащей пептиды/ccpm от культуры без пептидов). Результаты Мыши группы А, которые были толеризованы PBS и затем иммунизированы Апитопом MS6, ответили на антигенную стимуляцию, когда она была проведена повторно с Апитопом MS6 дозозависимым способом (фиг. 4). С увеличением концентрации пептида SI увеличился по медиане от 2,5 до 10. Все мыши в этой группе продемонстрировали, что введение PBS интраназально не может вызвать толерантность к Апитопу MS6. Напротив, интраназальное предварительное введение Апитопа MS6 оказывает серьезное воздействие на пролиферативный ответ лимфоцитов, стимулированных этим пептидом. Лимфоциты мышей из группы В были неспособны к ответу в какой-либо значительной степени, даже при высокой концентрации пептида - 150 мкг/мл (медиана SI - 3, фигура 4). Эти данные подтверждают, что Апитоп MS6 вызывает толерантность у лимфоцитов от HLA-DR2 мышей. Лимфоциты, выделенные у мыщей, которым предварительно вводили PBS и иммунизировали PBS(Группа С), не показали никакого ответа на Апитоп MS6 (фигура 4). Отсутствие ответа на пептид у Группы С подтверждает, что пролиферативный ответ, наблюдаемый в группе А, действительно был ответом на иммунизацию Апитопом MS6. Вывод Эти данные подтверждают гипотезу, что пептид МВР (Апитоп MS6), который не требует процессинга и связывается с молекулой МНС класса II HLA:DR2, может вызывать толерантность при введении интраназально. Пример 3. Индукция толерантности с помощью Апитопа MS7 (МВР 83-99) у мышей, трансгенных по двум генам (HLA:DR2 и Т-клеточный рецептор (МВР) 82-100). Данное исследование изучает способность Апитопа MS7 (пептида МВР 83-99) вызывать толерантность у мышей, трансгенных по двум генам и экспрессирующих HLA:DR2 вместе с Т-клеточным рецептором для связанного с HLA:DR2 пептида основного белка миелина (МВР) 82-100. Спленоциты от данных животных, трансгенных по двум генам, пролиферируют in vitro в ответ на Апитоп MS7. Снижение или исчезновение in vitro ответа спленоцитов на апитоп, вслед за его повторным введением in vivo, указывает на то, что состояние толерантности достигнуто. Вызывать толерантность пробовали с использованием как интраназального, так и подкожного/чрезкожного путей введения апитопа. Индукция толерантности Были использованы группы из 6 или 7 сопоставимых по возрасту (8-12 недель) и полу мышей,трансгенных по двум генам. В первом эксперименте одной группе вводили 10 раз интраназально 100 мкг Апитопа MS7 в 25 мкл PBS через одинаковые интервалы в течение трех недель. Контрольная группа получала чистый PBS. Во втором эксперименте такое же количество пептида давали посредством подкожного/чрезкожного введения в 100 мкл PBS. Контрольная группа получила такой же объем PBS. Анализ пролиферации Через три дня после последнего введения пептида или PBS, удаляли селезенки и готовили клеточные суспензии. Спленоциты инкубировали с 0,5 или 5 мкг/мл Апитопа MS7, и оценивали пролиферацию с помощью инкорпорации [3 Н]-тимидина после 48, 72 и 96 часов культивирования. Результаты выражены в виде индекса стимуляции (SI = число импульсов в минуту (cpm) от культуры, содержащей антиген/число импульсов в минуту без антигена). Измерение цитокинов Во втором эксперименте, где толерантность была индуцирована через подкожный/чрезкожный путь введения, собирали супернатанты клеточной культуры спленоцитов через 48 и 72 ч культивирования и анализировали на наличие IFN и интерлейкина-2 (IL-2) с использованием иммуноферментного анализа(ELISA). Результаты Во всех трех исследованных временных точках спленоциты мышей, которым вводился PBS, как при интраназальном, так и при подкожном/чрезкожном путях введения, показали сильную пролиферацию в ответ на Апитоп MS7; сила ответа повышалась с увеличением концентрации пептида. Поразительное снижение пролиферации наблюдали в культуре спленоцитов мышей, получавших Апитоп MS7 посредством обоих путей введения. Как показано на фиг. 5, после 72 ч средний SI, наблюдаемый в культурах, содержащих 5 мкг/мл Апитопа MS7, был 17 у мышей, получавших интраназально Апитоп MS7. В соответствующих культурах от контрольных мышей, получавших PBS, средний наблюдаемый SI был 89. Аналогично, как показано на фигуре 6, введение Апитопа MS7 посредством подкожного/чрезкожного пути привело к снижению SI в среднем от 124 у животных, получавших PBS, до 49 у животных, получавших Апитоп MS7. Уровни IFNy и IL-2, определенные в супернатантах культур после 48 часов культивирования, показаны на фигуре 7. Видно, что повторное лечение пептидом in vivo вызывает впечатляющее снижение секреции обоих цитокинов, параллельно со снижением пролиферативного ответа. Вывод Данные результаты показывают, что толерантность к Апитопу MS7 может быть успешно вызвана на мышиной модели, созданной для имитации человеческой системы, и поддерживают возможность его использования в терапии рассеянного склероза. Кроме того, его эффективность сохраняется при введении посредством подкожного/чрескожного пути, т.е. предпочтительного пути введения для людей. Несмотря на то что эффективность Апитопов MS6 и MS7 была показана in vivo, в настоящее время не представляется возможным продемонстрировать эффективность Апитопов MS1 и MS4. Это связано с неудачей в отношении трансгенных мышей, зкспрессирующих молекулу HLA-DQ6. Мыши, экспрессирующие молекулу, были созданы, но было обнаружено, что они не способны производить CD4 Т-клетки в тимусе и не могут, таким образом, повышать иммунный ответ на антиген в контексте HLA-DQ6. Пример 4. Исследование с увеличением дозы с композицией из четырех пептидов MBP. Комбинация из четырех пептидов (MBP 30-44, 131-145, 140-154 и 83-99) была использована в открытом исследовании с увеличением дозы ATX-MS-1467 у пациентов с вторичным прогрессирующим рассеянным склерозом. У пациентов контролировали остроту зрения (т.е. снижение оптического неврита), иммунологические параметры и воспаление в ЦНС через четыре недели и через три месяца после приема финальной дозы. Пример 4 А. Контроль остроты зрения. Оптический неврит (ОН) представляет собой воспаление с сопутствующей демиелинизацией оптического нерва, обслуживающего сетчатку глаза. Оптический неврит является одним из наиболее часто проявляющихся в настоящее время симптомов рассеянного склероза и одним из наиболее распространенных симптомов в начале MS. Обычные симптомы ОН включают: нечеткость зрения, потерю остроты зрения, частичную или полную потерю цветового зрения, полную или частичную слепоту и боль за глазом. Был исследован эффект лечения при помощи ATX-MS-1467 оптического неврита, который развился в результате нейровоспалительного процесса при MS. ATX-MS-1467 давали согласно протоколу увеличения дозы, отмеченному выше, затем через месяц после лечения проверяли остроту зрения пациента с использованием стандартной таблицы Шеллена (фиг. 8). Результаты показали клинически значимое улучшение остроты зрения через один месяц после лечения. Это было продемонстрировано в анализе исследования остроты зрения при начальном скрининге в сравнении с последующим тестом через один месяц. Начальные показатели зрения при скрининге 6/24 и 6/9 (на правом и левом глазу, соответственно) улучшились после лечения до 6/9 (правый глаз) и 6/6 (левый глаз). Зрение пациентов ранее оставалось неизменным в течение последних двух лет. Пример 4 В. Контроль иммунологических параметров. Как объяснялось выше, действие пептидной терапии с коктейлем, содержащим апитоп пептиды из основного белка миелина (ATX-MS-1467), исследовали на пациентах с MS. Каждого пациента отбирали перед началом исследования вплоть до 14 дней перед первой дозой (визит 1). Первую дозу в количестве 25 мкг ATX-MS-1467 давали на визите 2,50 мкг на визите 3, 100 мкг на визите 4, 400 мкг на визите 5 и 800 мкг на визитах 6 и 7. Дальнейшие обследования проводили через один месяц и через три месяца последующего наблюдения (визиты 8 и 9). Следующая таблица обобщает протокол и показывает количество визитов в клинику, сделанные каждым пациентом, вместе с дозой пептида и образцом крови. Таблица 1 Образцы крови забирали на визите 1, и визитах с 3 до 9, и тестировали на иммунный ответ к различным антигенам, включая очищенное белковое производное (PPD) Mycobacterium tuberculosis, в качестве позитивного контроля, очищенный основной белок миелина (MBP) человека и ATX-MS-1467. Иммунный ответ оценивали, учитывая Т-клеточную пролиферацию in vitro, секрецию цитокинов в супернатантах тканевой культуры и выработку РНК цитокинов. Результаты Наблюдали значительный ответ на MBP, с пиком пролиферации к визиту 3 (фиг. 9). Это коррелировало с пиком секреции интерферона гамма. Важно, однако, что уровень секреции интерферона гамма снижался после третьего визита и был на фоновом уровне к визиту 8. Уровни IL-10 не изменялись существенно до визита 7, после которого происходило значительное увеличение секреции данного цитокина. Уровни IL-4, IL-5 и TNF альфа были близки к фоновым в ответ на MBP во всех временных точках. Никакого пролиферативного ответа или увеличенного цитокинового ответа не наблюдали для ATXMS-1467 (фиг. 10). Вывод Ответ на MBP, наблюдаемый к визиту 3, демонстрирует повышенную секрецию IL-2 и интерферона гамма, которая коррелирует с пиком пролиферации в данной временной точке. Предполагается, что такое усиление ответа обусловлено введением пептидов. Важно, однако, что за временным увеличением цитокиновой секреции следует возвращение интерферона гамма к исходным уровням. Было также значительное увеличение секреции IL-10 после второго введения ATX-MS-14 67 в самой высокой дозе. Ранее было показано на животных моделях, что специфическая иммунотерапия синтетическими пептидами эффективна и приводит к индукции регуляторных Т-клеток, секретирующих IL-10. Индукция регуляторных Т-клеток, секретирующих IL-10, у мышей,подразумевает временный ответ на пептиды с секрецией интерферона гамма на низком уровне (Burkhartet al., 1999 Int Immunol 11: 1625-1634; Sundstedt et al., 2003 J Immunol 170:1240-1248). За этим следует снижение интерферона гамма и сопутствующее увеличение IL-10. Кинетика секреции цитокинов, выявленная после лечения с помощью ATX-MS-1467, фактически воспроизводит паттерн, ранее наблюдавшийся у экспериментальных мышей, подтверждая, что ATX-MS-1467 может индуцировать регуляторные Т-клетки, секретирующие IL-10. Пример 4 С. Ответ на MBP значительно снижается в результате лечения с помощью ATX-MS-1467. Шесть пациентов с вторичным прогрессирующим рассеянным склерозом (SPMS) были внесены в список и завершили фазу клинического испытания I/IIa, выполненную по протоколу увеличения дозы,изложенному в примере 4 В.HLA-генотипирование показало, что шесть пациентов демонстрируют широкий спектр гаплотиповHLA, включая 5 гаплотипов HLA-DR15, ассоциированных с MS. Широкое распределение HLA-DRB1 у пациентов, вовлеченных в данное исследование, означает, что ATX-MS-1467 будет безопасен и хорошо переносим пациентами с MS, независимо от их HLA-DR генотипа. Лечение пациентов с помощью ATX-MS-1467 не вызывает выработку антипептидных антител. Это указывает на то, что использование ATX-MS-1467 безопасно и коррелирует с отсутствием осложнений в месте инъекции или проявлениями аллергии, связанными с исследованием. Тщательный анализ Т-клеточного ответа показал, что:a) лечение ATX-MS-1467 не имеет неспецифического иммуносупрессивного действия. Это ясно продемонстрировано фактом сохранения иммунного ответа на очищенное белковое производное, антиген из микобактерии туберкулеза (данные не показаны);b) лечение ATX-MS-1467, с использованием данного протокола, не приводит к агрессивному иммунному ответу на ATX-MS-1467 или основной белок миелина (данные не показаны);c) сравнение Т-клеточного пролиферативного ответа до (визит 1) и после (визит 8) лечения ATXMS-1467 выявило значительное снижение ответа на основной белок миелина (фиг. 11). Все три индивидуума, которые отвечали на MBP при визите 1, показали снижение ответа на белок на визите 8. Если брать всех пациентов вместе, то имеются указания на значительное снижение ответа на МВР от визита 1 к визиту 8 (Р=0,0313). Материалы и методы Составы и дозы Каждый из четырех пептидов производят независимо по контракту с использованием твердофазного пептидного синтеза и очищен с использованием ВЭЖХ. Пептиды хранят в лиофилизованном виде.ATX-MS-1467 представляет собой 1:1:1:1 смесь Апитопов MS1, MS4, MS6 и MS7 в фосфатносолевом буфере для чрезкожного введения. Две концентрации ATX-MS-1467, обозначенные ATX-MS-1467A и ATX-MS-1467B и содержащие 4 мг/мл и 0,5 мг/мл пептида, соответственно, были приготовлены для того, чтобы сделать возможным увеличение дозы. Режим использует пять инъекций с увеличением дозы (общая доза - 25, 50, 100, 400 и 800 мкг), которые даются от 7 до 14 дней раздельно. Пациенты затем получают вторую дозу 800 мкг в период от с 7 до 14 дня после первой дозы в 800 мкг. После получения всех шести доз исследуемого препарата пациента оценивали через четыре недели и через 3 месяца после финальной дозы. Проверка остроты зрения Использовали таблицу Шеллена стандартного размера для проверки на расстоянии 6 метров с подсветкой сзади, пациент сидит на расстоянии 6 м (фиг. 8). Каждый глаз исследовали раздельно для самой нижней строчки в таблице, которую пациент может прочитать. Результаты затем обозначали как Острота зрения = 6/ (строка, которую пациент прочел). Иммуноанализi) Т-клеточная пролиферация. Криоконсервированные РВМС высаживают в 1 мл культур, содержащих 1,5106 клеток в -МЕМ, в 48-луночные планшеты для культивирования тканей (Nunc International, Costar, Corning Inc. New YorkUSA). Ответ на МВР и пептидные антигены в различных концентрациях контролируют на протяжении периода в 10 дней. Контрольные лунки не содержат антиген. После 20 ч или 2, 4, 6, 8 и 10 дней культивирования две аликвоты клеточной суспензии по 100 мкл отбирают из каждой культуры в 1 мл для измерения пролиферации в ответ на антиген по захвату [3 Н] тимидина.ii) Измерение секретируемых цитокинов (IL-2 и IL-4, IL-5, IL-10, TNF- и IFN): Cytometric Bead Array анализ. Уровни цитокинов в супернатанте культуры определяют с использованием Cytometric Bead Assay(Becton Dickenson Biosciences, Cowley, Oxford, UK) согласно инструкциям производителя. После сбора данных по образцам, с использованием FACS Calibur (BD Biosciences), результаты генерируются в виде графиков и таблиц с помощью программного обеспечения BD CBA. Минимальные уровни цитокинов,поддающиеся количественному определению, следующие: IL-2 и IL-4 - 2,6 пг/мл, IL-5 - 2,4 пг/мл, IL-10 иTNF- - 2,8 пг/мл, IFN - 7,1 пг/мл. Количественная ПЦР в реальном времени для измерения РНК цитокинов (IL-2, IL-10, IFN и TNFa) Для анализа IL-2, IL-10, IFN и TNF-, проводили ПЦР в конечном объеме 20 мкл, содержащем кДНК, ПЦР буфер, 6,25 мМ MgCl2, 0,4 мМ смесь dNTP, прямой и обратный праймеры (концентрации прямого праймера: IL-2 - 300 нМ, IL-10 - 600 нМ, IFN - 600 нМ, TNF- - 600 нМ, концентрации обратного праймера: IL-2 - 600 нМ, IL-10 - 900 нМ IFN- - 900 нМ, TNF- - 600 нМ), 200 нМ зонда FAMTAMRA и 0,05 U/мкл Platinum Taq-полимеразы (Invitrogen). Условия циклов представлены ниже: начальная денатурация при 94 С в течение 30 с, затем 35 циклов по 15 с при 94 С и 1 мин при 60 С. Для 2 микроглобулина смесь для ПЦР, описанную выше, дополняли 0,1 мкМ прямого и обратного праймеров, 3 мМ MgCl2 и производили количественный анализ с использованием SYBR Green I (MolecularProbes Inc., X30000 разведение исходного раствора). После денатурации в течение 1 мин при 95 С амплификация продолжалась 35 циклов - 15 с при 94 С, 1 мин при 61 С и 1 мин при 72 С. ПЦР реакции и флюоресцентную детекцию полученных ампликонов проводили на Opticon 2 (MJ Research, USA). Исходный уровень флюоресценции устанавливали с использованием измерений от цикла 1 до цикла 10. Величины Ct рассчитывали, определяя точку, в которой флюоресценция в 8-10 раз превышает стандартное отклонение от базового уровня. Образцы были продублированы, и количество копий рассчитывали по стандартной кривой для каждой ДНК-мишени. Различия в числе внесенных копий РНК и синтезе кДНК корректировались посредством нормализации экспрессии цитокина к экспрессии -2 микроглобулина.HLA типирование Анализ экспрессии гена HLA выполняли с помощью стандартной техники конформационного полиморфизма однонитевой ДНК с использованием полимеразной цепной реакции на ДНК, выделенной из лейкоцитов периферической крови. HLA-тип каждого пациента использовали для интерпретации результатов иммунологических анализов. Анализ сывороточных анти-пептидных антител 96-луночные плашки покрывают 1-10 мкг/мл каждого апитопа MS1, MS4, MS6 или MS7 при рН 9,6 в течение ночи при 4 С. Плашки промывают четыре раза фосфатно-солевым буфером, рН 7,2, 0,05%Tween (PBS-Tween), и лунки блокируют с помощью 5% FCS в PBS в течение 1 ч при комнатной температуре. Сыворотку разводят 1:100 в PBS-Tween и инкубируют в продублированных лунках в течение одного часа при комнатной температуре. После 4 промываний козлиные антитела против IgG человека,конъюгированные с пероксидазой хрена (Sigma) и разведенные 1:12000 в PBS, добавляли в каждую лунку и инкубировали плашки в течение одного часа при комнатной температуре. После 4 промываний 0,4 мг/мл о-фенилендиамин дигидрохлоридом (Sigma) добавляли 30% пероксид водорода и инкубировали при комнатной температуре в течение 15-20 мин. Окрашивание останавливали с помощью 2,0 М H2SO4(50 мкл) и измеряли величину оптической плотности (OD) при 490 нм с помощью спектрофотометра для чтения планшетов с ELISA. Результаты представлены в виде OD для сыворотки, разведенной 1:100. ЯМР-сканирование Воспаление в ЦНС исследовали ЯМР-сканированием с использованием контрастирования с гадолинием. Исследовали объем и количество увеличившихся бляшек и сравнивали с исходным сканирова- 10017999 нием. Различные модификации и вариации описанных способов и методов по изобретению будут ясны специалистам в данной области в пределах объема и сущности изобретения. Хотя данное изобретение описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что заявленное изобретение не ограничено данными конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления изобретения, которые общеизвестны специалистам в области химии или биологии или в смежных областях, охватываются настоящим изобретением. Все публикации, упомянутые в вышеизложенном описании, включены в настоящий документ в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для лечения или профилактики рассеянного склероза или оптического неврита, которая содержит следующие пептиды основного белка миелина:MBP 140-154,в приблизительном соотношении 1:1:1:1. 2. Применение композиции по п.1 для получения лекарственного средства для лечения рассеянного склероза. 3. Применение композиции по п.1 для получения лекарственного средства для лечения оптического неврита. 4. Способ лечения или профилактики рассеянного склероза у пациента, который включает стадию введения композиции по п.1 пациенту. 5. Способ лечения или профилактики оптического неврита у пациента, который включает стадию введения композиции по п.1 пациенту. 6. Способ по п.4 или 5, в котором композицию вводят согласно протоколу с увеличением дозы. 7. Способ по любому из пп.4-6, где композицию вводят HLA-DQ6 или HLA-DR2-положительным пациентам. 8. Набор для получения композиции по п.1, который включает следующие пептиды основного белка миелина:
МПК / Метки
МПК: A61K 38/17, A61P 25/00, A61P 37/00
Метки: оптического, пептиды, применение, способ, миелина, рассеянного, основного, профилактики, лечения, содержащая, композиция, склероза, белка, неврита
Код ссылки
<a href="https://eas.patents.su/16-17999-kompoziciya-soderzhashhaya-peptidy-osnovnogo-belka-mielina-ee-primenenie-i-sposob-lecheniya-ili-profilaktiki-rasseyannogo-skleroza-ili-opticheskogo-nevrita.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция, содержащая пептиды основного белка миелина, ее применение и способ лечения или профилактики рассеянного склероза или оптического неврита</a>
Предыдущий патент: Способ высокотемпературного выщелачивания
Следующий патент: Пептидомиметики с активностью антагонистов глюкагона и агонистов glp-1
Случайный патент: Пероральная ветеринарная композиция, ее применение в лечении и способ лечения путем ее введения