Применение спинозинов для заживления ран
Формула / Реферат
1. Применение спинозина или его физиологически приемлемого производного или соли для приготовления лекарственного средства для стимуляции или ускорения заживления ран у млекопитающего.
2. Применение по п.1, в котором указанный спинозин представляет собой спинозад или его физиологически приемлемое производное или соль.
3. Применение по п.1, в котором процессы заживления у указанного млекопитающего не нарушены.
4. Применение по п.1, в котором процессы заживления у указанного млекопитающего нарушены.
5. Применение по п.1, в котором указанный спинозин предназначен для местного нанесения на рану.
6. Применение по п.1, в котором указанный спинозин предназначен для перорального введения.
7. Применение по п.1, в котором указанный спинозин предназначен для парентерального введения.
8. Применение по п.1, в котором указанное млекопитающее представляет собой жвачное животное.
9. Применение по п.1, в котором указанное жвачное животное представляет собой овцу.
10. Применение по п.1, в котором указанное млекопитающее представляет собой человека.
11. Применение по п.1, в котором указанное млекопитающее представляет собой кошку, собаку или лошадь.
Текст
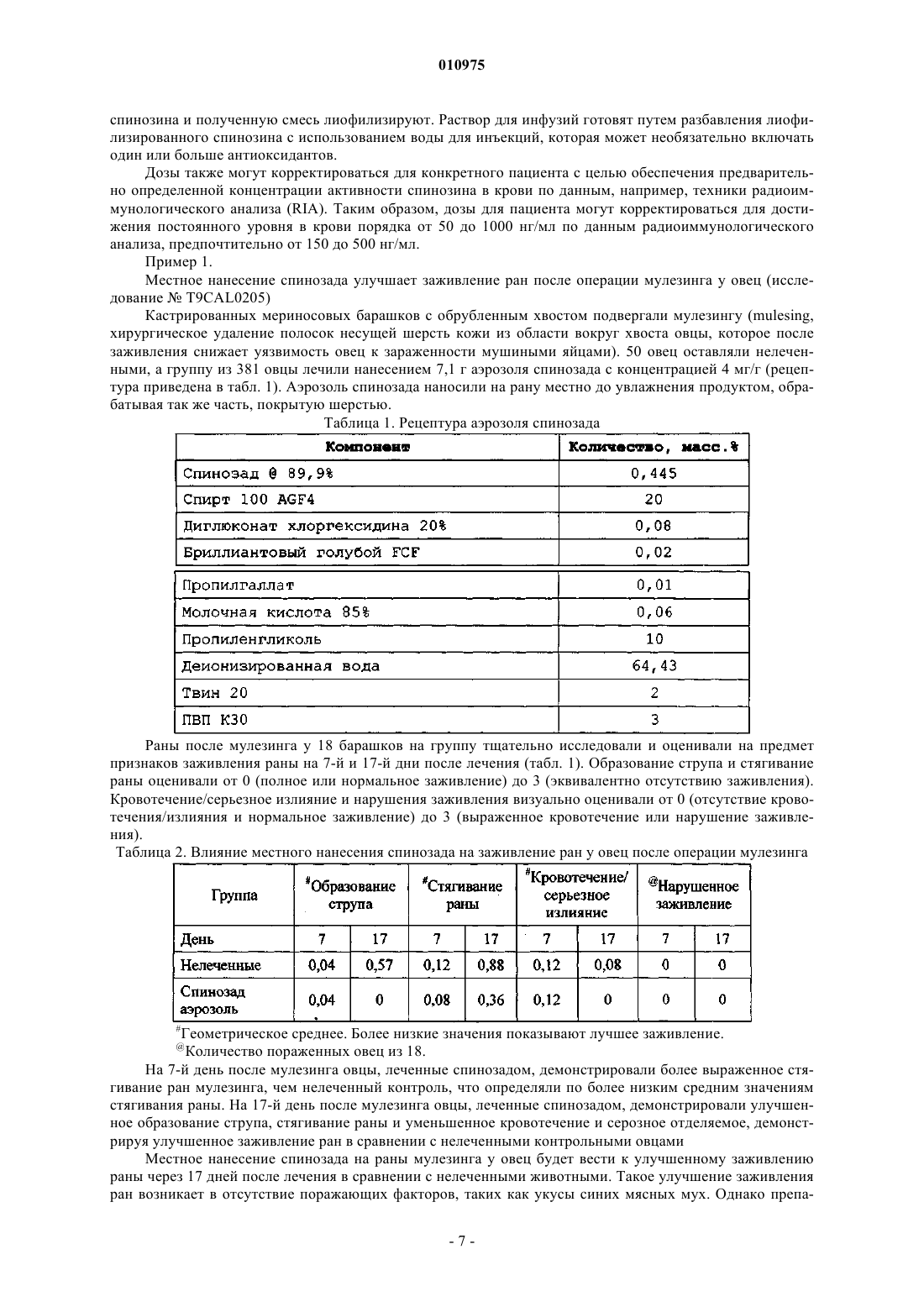
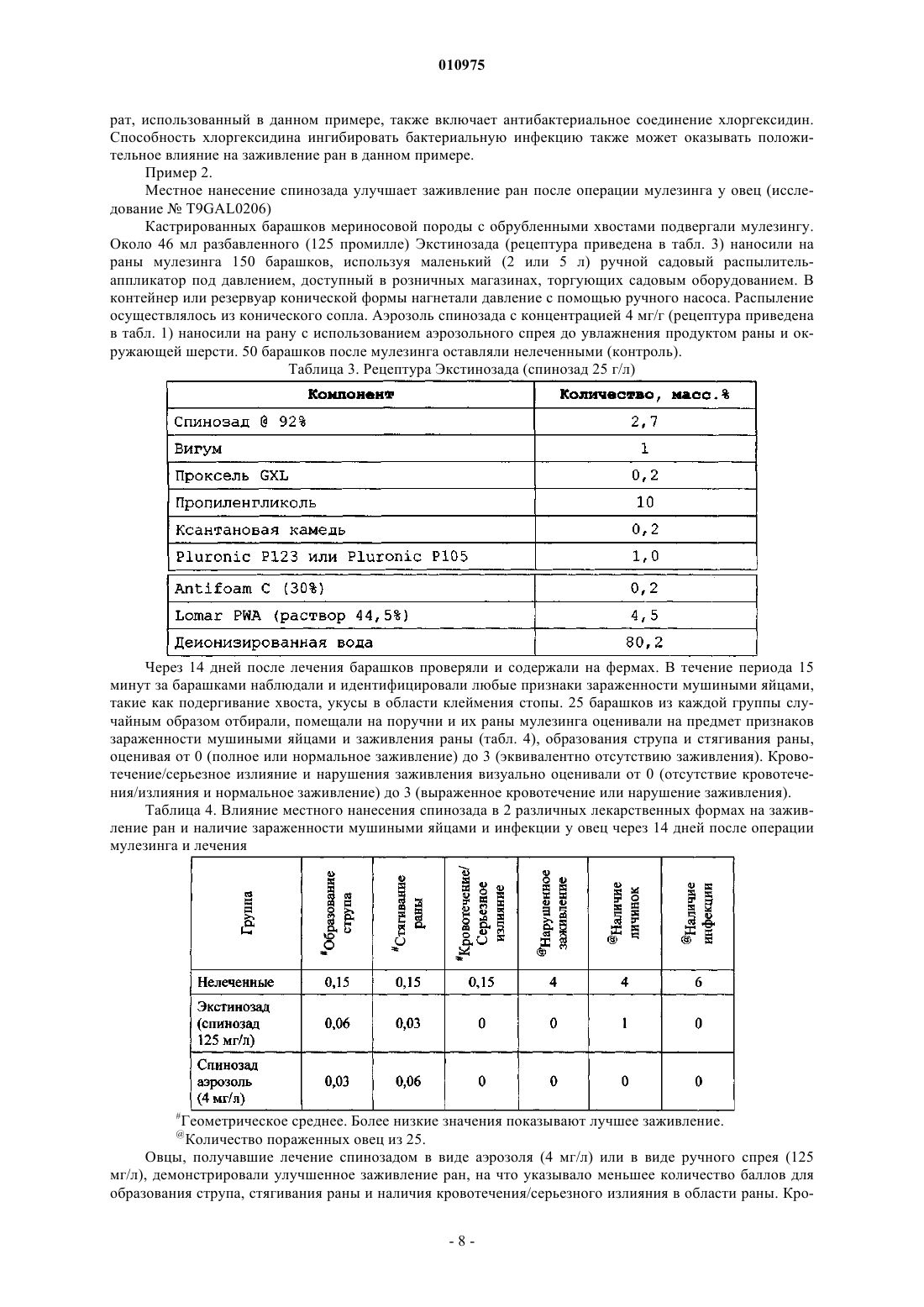
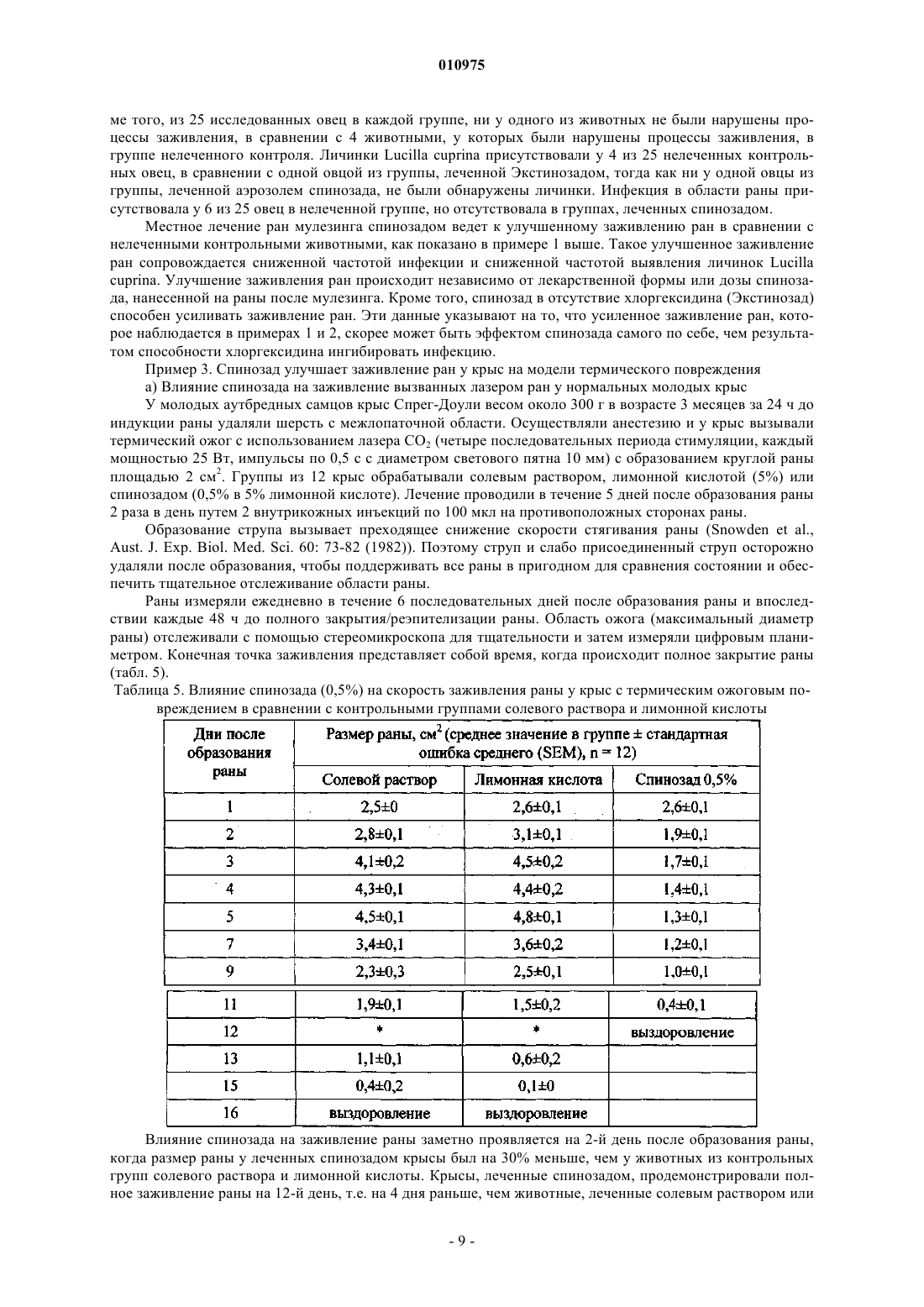
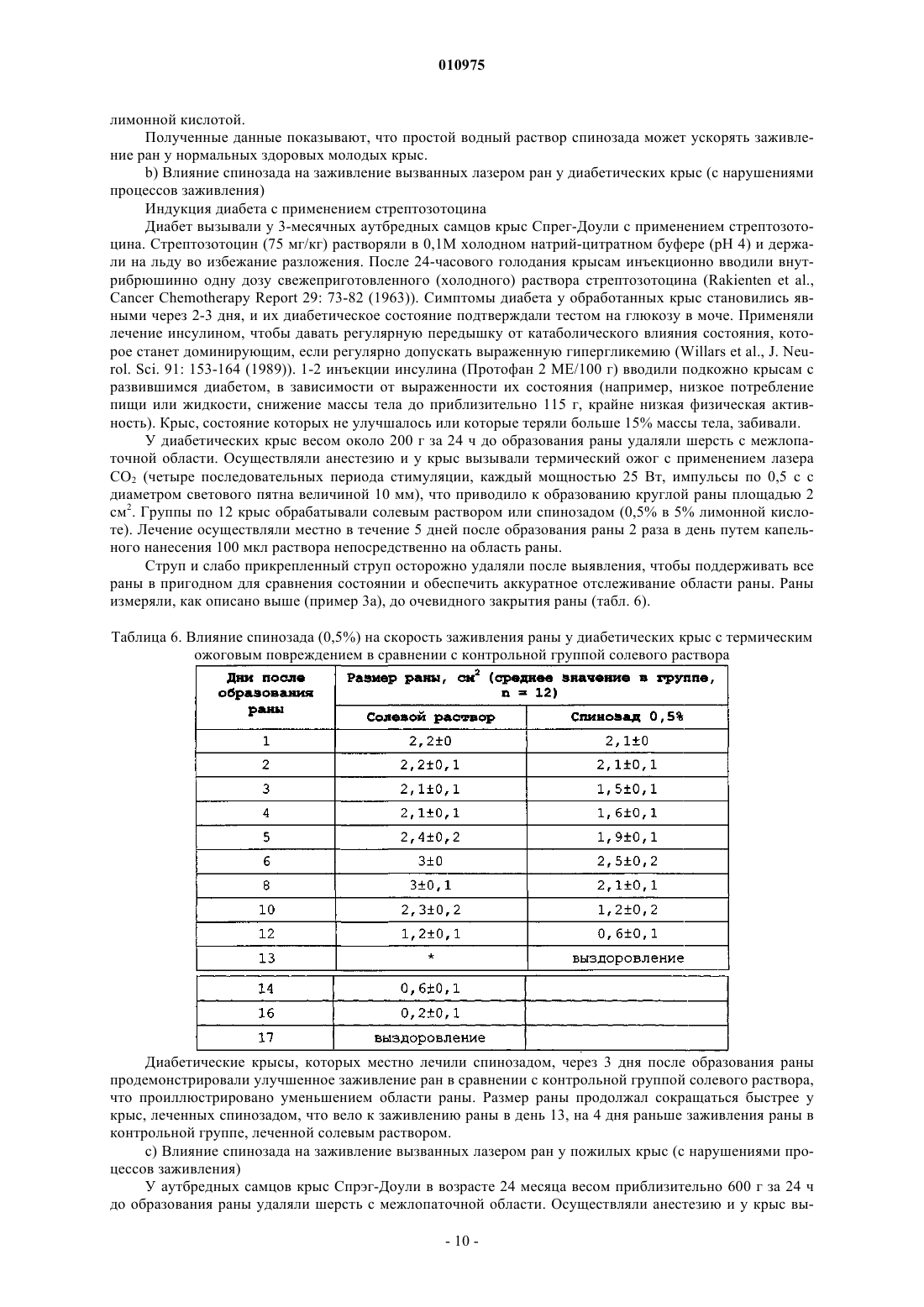
010975 Данное изобретение направлено на терапевтическое применение спинозинов у человека для стимуляции или ускорения заживления ран у лиц с нормальным или нарушенным процессом заживления. Спинозины или их физиологически активные производные или соли могут применяться по терапевтическим показаниям у людей, нуждающихся в росте и регенерации мягких тканей. Нарушения процессов заживления ран представляют собой значительный источник заболеваемости у людей и могут приводить к осложнениям, таким как незаживающие раны. У нормального индивидуума заживление ран достигается с помощью неосложненного эндогенного процесса. Напротив, нарушения процессов заживления ран связаны с различными патологическими состояниями, такими как диабет, инфекция, угнетение иммунитета, ожирение и недоедание. Предпосылки для создания изобретения Заживление ран представляет собой комплексный биологический процесс с участием внеклеточного матрикса, кровяных клеток, клеток паренхимы, а также медиаторов, таких как цитокины. После достижения гемостаза в ране, т.е. точки, когда останавливается кровотечение, начинается процесс заживления. Он протекает в три стадии: воспаление, образование ткани (пролиферация) и регенерация ткани(ремоделирование). После повреждения заживление начинается очень быстро; например, реэпителизация кожных ран начинается на протяжении часов (Singer and Clark, New Eng. J. Med. 341(10): 738-746 (1999. Процесс заживления ран инициируется миелинизированными афферентными сенсорными нервами, которые, в свою очередь, опосредуют нейрогенное воспаление, иммунологические реакции (Eglezos et al.,Adv. Exp. Biol. Med. 273: 499-503 (1989); Immunol. Cell Biol. 69: 285-294 (1991 и поддержание тонуса сосудов (KhalilHelme, Brain Res. 500: 256-262 (1989); Brain Res. 527: 292-298 (1990, представляющие собой существенные компоненты заживления. После инициирования процесса заживления сенсорными нервами процесс заживления регулируется факторами роста и цитокинами, которые влияют на миграцию клеток, пролиферацию клеток и выработку белка. В состоянии гемостаза белки, такие как фибрин и фибронектин, взаимодействуют для свертывания крови, и стимулируется высвобождение цитокинов и факторов роста. После повреждения начинается воспаление. Воспалительные реакции протекают в три отдельных фазы, каждая из которых явно опосредуется различными механизмами: (1) острая преходящая фаза, которая характеризуется местной вазодилатацией и повышенной проницаемостью капилляров; (2) продленная подострая фаза, которая наиболее явно характеризуется инфильтрацией клетками лейкоцитов и фагоцитов; и (3) хроническая пролиферативная фаза, в ходе которой происходит дегенерация ткани и фиброз. В процесс воспаления вовлечено множество различных механизмов. Способность осуществлять воспалительную реакцию важна для выживания в условиях взаимодействия с патогенными факторами окружающей среды и повреждения, хотя в некоторых ситуациях и при некоторых заболеваниях воспалительная реакция может обостряться и сохраняться без явной пользы. В ходе воспаления происходит инфильтрация раны нейтрофилами (полиморфноядерные лейкоциты, ПЯЛ), моноцитами и макрофагами. Данные фагоцитарные клетки высвобождают факторы роста для пролиферативной фазы, ферментные медиаторы (протеазы), которые расщепляют белки, а также способствуют фагоцитозу бактерий, погибших и гибнущих клеток, таким образом, очищая рану. В следующей фазе начинается пролиферация. Откладывается коллаген, образуя рубцовую ткань. Фибробласты вырабатывают протеогликаны, которые связывают волокна коллагена вместе. Со временем коллаген расщепляется протеазами и ремоделируется в более прочную структуру рубца. Спинозины (также известные, как факторы А 83453) представляют собой пестициды для сельского хозяйства, животноводства, а также для домашних животных, которые продемонстрировали активность против: 1) насекомых ряда Lepidoptera, 2) членов ряда Homoptera, 3) членов ряда насекомых Diptera, 4) членов ряда Coleoptera и 5) членов ряда Anoprula. Препараты, пригодные для применения в сельском хозяйстве, животноводстве и введения домашним животным, включают различного рода суспензии, таблетки, капсулы, жидкости и добавки к рациону. Спинозад (продукт, который главным образом включает спинозин А - 85%, а также спинозин D 15%) в настоящее время зарегистрирован в Австралии и Новой Зеландии для лечения вшей у овец, а также для лечения и профилактики укусов мухи мясной синей у овец. В Бразилии спинозад зарегистрирован для местного применения и контроля некоторых видов клещей, мух и вшей, а также в качестве антисептика и заживляющего репеллента для лечения вызванного личинками овода миаза и кожных ран у крупного рогатого скота, овец, коз, лошадей, свиней, птицы и собак. Известно, что спинозины полезны для контроля заражения вшами у людей (патент США 6063771 и ЕР 1252820). Препараты, пригодные в качестве таких педикулоцидных средств для человека, также описаны в указанных патентах. Несмотря на знания относительно эктопаразитоцидной активности спинозинов и коммерческое зарегистрированное применение, заявителями было обнаружено, что спинозин или его физиологически активное производное или соль обладают ранозаживляющей активностью независимо от рецептуры, содержащей антисептический агент/дезинфектант. Краткое описание изобретения Данное изобретение относится к способам лечения ран у человека, предназначенным для стимуляции и ускорения заживления ран, в том числе плохо заживающих или хронических ран, кожных заболе-1 010975 ваний и аллергических заболеваний, особенно связанных с кожей расстройств, а также связанных с ними патологических состояний или симптомов, путем введения спинозина или его физиологически приемлемого производного или соли человеку, который в этом нуждается. Предпочтительно данные способы осуществляются путемвведения спинозада или его физиологически приемлемого производного или соли. Подробное описание изобретения Данное изобретение обеспечивает способы стимуляции и ускорения заживления ран у человека, которые включают введение спинозина или его физиологически приемлемого производного или соли человеку, который в этом нуждается. В другом аспекте данное изобретение обеспечивает применение спинозина или его физиологически приемлемого производного или соли, или препарата, содержащего спинозин или его производное или соль, для производства лекарственного средства для стимуляции или ускорения заживления ран у человека. Спинозины представляют собой природные продукты ферментации. Они представляют собой макролиды, получаемые культивированием Saccharopolyspora spinosa. При ферментации образуются несколько факторов, включая спинозин А и спинозин D (которые называют также А 83543 А и A83543D). Спинозин А и спинозин D представляют собой два спинозина, наиболее активные в качестве инсектицидов. Продукт для применения в сельском хозяйстве, который состоит главным образом из данных спинозинов (приблизительно 85% А и 15% D) коммерчески доступен от Dow AgroSciences под названием спинозад. Продукт против эктопаразитов, включающий спинозад, коммерчески доступен от Eli LillyСо. Название спинозад является производным от сокращения спинозинов А и D. Каждый спинозин содержит 12-членное макроциклическое кольцо, которое является частью тетрациклической системы колец, к которой присоединены два разных сахара - аминосахар форозамин и нейтральный сахар 2N,3N,4N-три-O-метилрамноза. Такая уникальная структура выделяет спинозины среди других макроциклических соединений. Спинозин А (А 83543 А) был первым идентифицированным спинозином, который был выделен из ферментационного бульона Saccharapolyspora spinosa. Последующее исследование ферментационного бульона выявило, что продуцирующий штамм S. spinosa вырабатывает большое количество спинозинов,которые были маркированы от А до J (A8354 3A до J). В сравнении со спинозином А спинозины B-J характеризуются отличиями в моделях замещения аминогруппы форозамина, выбранных положений тетрациклической системы колец и 2N,3N,4N-три-O-метилрамнозы. Штаммы S. spinosa, которые используют в настоящее время, вырабатывают смесь спинозинов, в которой основными компонентами являются спинозин А (85%) и спинозин D (15%). Другие спинозины, названные буквами от K до W, были получены из мутантных штаммов S. spinosa. Термин спинозин или его физиологически приемлемое производное или соль в данном описании обозначает индивидуальный фактор спинозина (А, В, С, D, E, F, G, H, J, K, L, М, N, О, Р, Q, R, S, T, U, V,W или Y), а также N-деметильное производное отдельного фактора спинозина, их комбинацию или физиологически приемлемую соль. Для удобства термин спинозин в данном описании также будет использоваться для обозначения отдельного спинозина или его физиологически приемлемого производного или соли, или их комбинации. Наиболее предпочтительным для заживления ран у человека является спинозад, или его физиологически приемлемое производное, или соль. ЕР 375316 описывает спинозины А-Н и J (которые называют факторами А 83453 А, В, С, D, E, F, G,Н и J) и их соли. Mynderse et al. описывали спинозины L-N (которые они называли факторами А 83543 L,М и N), их N-деметильные производные, а также их соли, в патенте США 5202242; a Turner et al. описали спинозины Q-T (которые они называют факторами А 83453 Q, R, S и Т), их N-деметильные производные,а также их соли, в патенте США 5591606 и патенте США 5631155. Указанные патенты включены в данное описание путем ссылки. Спинозины K, О, Р, U, V, W и Y описаны, например, Carl V. DeAmicis,James E. Dripps, Chris J. Hatton и Laura I. Karr в American Chemical Society's Symposium Series: Phytochemicals for Pest Control, Chapter 11, "Physical и Biological Properties of Spinosyns: Novel Macrolide PestControl Agents from Fermentation," pages 146-154 (1997). Патент США 6001981, в котором описаны различные синтетические производные спинозинов, а также патент США 6455504, где описаны различные аналоги спинозина, включены в данное описание путем ссылки. В данных работах описаны детали, касающиеся ферментации и выделения спинозинов, а также технологий получения синтетических производных. Каждый из патентов США и патентная заявка ЕР описывают различные типы препаратов, паразитоцидную активность и возможности введения животным и применения в сельском хозяйстве для спинозинов, а также их физиологически приемлемых производных или солей. В патентах США 6063771 и 6342482, а также в ЕР 1252820 описаны препараты и применение спинозинов или их физиологически приемлемых производных или солей для контроля вшей у человека, а также способы приготовления таких препаратов. Как упоминалось выше, препараты спинозада коммерчески доступны от Dow AgroSciences, 9330Company, P.O. Box 708, 2001 W. Main Street, Greenfield, Indiana, 46140, U.S.A. Кроме того, S. spinosa и мутантные штаммы депонированы в Agricultural Research Service Patent Culture Collection (NRRL) Na-2 010975tional Center for Agricultural Utilization Research, ARS, USDA, 1815 North University Street, Peoria, Illinois,61604, USA (NRRL 18395, 18537, 18538, 18539, 18719, 18720, 18743, 18823 и 30141; патент США 6455504). Спинозины могут вступать в реакции с образованием солей. Соли, которые являются приемлемыми с физиологической точки зрения, также полезны в способах по данному изобретению. Соли получают с применением стандартных методик получения солей. Например, спинозин А может быть нейтрализован подходящей кислотой с образованием кислотно-аддитивной соли. Кислотно-аддитивные соли спинозинов являются особенно полезными. Примеры пригодных кислотно-аддитивных солей включают соли,образованные путем реакции с органической или неорганической кислотой, например серной, хлористоводородной, фосфорной, уксусной, янтарной, лимонной, молочной, малеиновой, фумаровой, холевой,памоевой, слизевой, глутаминовой, камфарной, глутаровой, гликолевой, фталевой, винной, муравьиной,лауриновой, стеариновой, салициловой, метансульфоновой, бензолсульфоновой, сорбиновой, пикриновой, бензойной, коричной и т.п. кислотами. Все соотношения, процентные отношения и доли, которые обсуждаются в данном описании, подразумевают по массе, если не указано иное. Рана означает повреждение у человека, при котором ткань разрезана, разорвана, разбита, обожжена или травмирована другим способом, или результат расстройства или заболевания, приводящего к такому повреждению. Заживление в данном изобретении подразумевает стимуляцию или ускорение времени от момента возникновения раны (при введении спинозина) до стягивания раны (полное закрытие раны). Термин ткань обозначает массу клеток в организме человека, которые объединены вместе для выполнения конкретной функции. Ткань включает, не ограничиваясь ими, кость, кожу, соединительную и нервную ткань, такую как спинной мозг. Термины лечение и терапия в данном описании означают лечебную терапию. Нуждающиеся в лечении, включают человека с раной, расстройством или заболеванием. Введение в сочетании с одним или больше дополнительных терапевтических агентов включает одновременное (сопутствующее) и последовательное введение человеку в любом порядке. Терапевтически эффективное количество представляет собой минимальное количество активного агента (например, спинозина и, наиболее предпочтительно, спинозада), которое необходимо для достижения терапевтической пользы у человека. Например, терапевтически эффективное количество для человека, страдающего от раны, представляет собой такое количество, которое вызывает, способствует,ускоряет или другим образом ведет к улучшению патологических симптомов, прогрессу заживления,физиологическим состояниям, которые стимулируют или уменьшают сопротивление заживлению. Носители в данном описании включают фармацевтически приемлемые носители, вспомогательные вещества или стабилизаторы, которые в используемых дозах и концентрациях нетоксичны для человека, который контактирует с ними. Физиологически приемлемый носитель часто представляет собой буферизованный водный раствор. Примеры физиологически приемлемых носителей включают буферы,такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, в том числе аскорбиновую кислоту; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин,глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоины, такие как натрий; и/или неионные поверхностно-активные вещества, такие как полиоксиэтиленсорбитановые эфиры жирных кислот (Твин), полиэтиленгликоль(ПЭГ) и блок-сополимеры полиоксиэтилена/полиоксипропилена (PLURONIC). Спинозины по данному изобретению и, наиболее конкретно, спинозад, стимулируют нейрогенную активацию заживления и последующей воспалительной активности, вовлеченной в рост и пролиферацию клеток. Соответственно, композиции по настоящему изобретению могут применяться для стимуляции пролиферации эпителиальных клеток и базальных кератиноцитов для заживления раны, конкретно, кожных ран. Такие раны могут иметь поверхностную природу или могут быть глубокими и включать повреждение дермы и эпидермиса кожи. Спинозины полезны для лечения разнообразных ран и патологических состояний. Например, спинозины активны in vivo в различных моделях заживления ран. У человека, которому вводят спинозины, раны могут заживать с нормальной скоростью, или процессы заживления ран могут быть нарушены. При введении индивидууму, у которого процесс заживления ран не нарушен, спинозины вводят для ускорения нормального процесса заживления ран. При введении индивидууму с нарушением процессов заживления ран спинозины вводят для облегчения заживления ран, которые в противном случае будут заживать медленно или не будут заживать вообще. Многие болезни и состояния могут вести к нарушению процессов заживления. Такие болезни и состояния включают диабет (например, сахарный диабет 2 типа), лечение стероидными и нестероидными фармакологическими агентами, а также ишемическую блокаду или повреждение. Многие факторы роста показали способность стимулировать заживление ран у индивидуумов с нарушением процессов заживления ран. Такие факторы роста включают гормон-высвобождающий фактор,-3 010975 тромбоцитарный фактор роста, а также основные факторы роста фибробластов. Таким образом, данное изобретение также включает введение как минимум одного спинозина в сочетании с одним или больше факторами роста или другими агентами, которые способствуют заживлению ран. Спинозины по данному изобретению способствуют заживлению анастомозных или других ран, вызванных хирургическими вмешательствами у человека, у которого раны заживают с нормальной скоростью или процессы заживления нарушены. Спинозины по данному изобретению и, конкретно, спинозад являются клинически полезными для стимуляции заживления ран, включая хирургические раны, раны в результате иссечения, глубокие раны,включающие повреждение дермы и эпидермиса, повреждения мягких тканей, такие как разрывы мышц,ранение тканей глаза, ранение дентальных тканей, раны ротовой полости, раны и язвы слизистой оболочки пищеварительного тракта, диабетические язвы, кожные язвы, язвы локтевого сустава, артериальные язвы, язвы вследствие веностаза, ожоги, вызванные воздействием тепла, контактом с очень высокими или очень низкими температурами, контактом с химическими реактивами, у нормальных индивидуумов, а также подверженным действию условий, которые ведут к аномалиям заживления ран, таким как уремия, недоедание, дефицит витаминов, ожирение, инфекция, угнетения иммунитета и осложнения,связанные с системным лечением стероидами, радиотерапия, а также антинеопластические средства и антиметаболиты. Композиции также полезны для стимуляции заживления ран, связанных с ишемией и ишемическим повреждением, например хронические язвы вен ног, вызванные нарушением возврата и/или недостаточностью венозной кровеносной системы; для стимуляции восстановления кожи после утраты кожи; повышение напряжения растяжимого эпидермиса и толщины эпидермиса; а также повышения сцепления пересаженной кожной ткани к ложу раны и стимуляции реэпителизации из ложа раны. В данном описании термин индивидуум означает человека. В препаратах спинозинов могут использоваться пригодные фармацевтические разбавители, полезные для составления фармацевтических композиций. Такие разбавители включают, не ограничиваясь ими, солевой раствор, буферизованный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации. Рецептура должна соответствовать способу введения. Предпочтительно, фармацевтические композиции будут разработаны для введения. Спинозин может вводиться в виде фармацевтических композиций в сочетании с одним или больше фармацевтически приемлемых вспомогательных веществ. Следует понимать, что при введении пациенту-человеку общая суточная доза фармацевтических композиций по данному изобретению будет определяться лечащим врачом в соответствии с медицинской оценкой. Конкретный уровень терапевтически эффективных доз для любого конкретного пациента будет зависеть от многих факторов, в том числе от вида и степени выраженности реакции, которая должна быть достигнута; конкретной композиции, в том числе присутствия или отсутствия другого агента; возраста, массы тела, общего состояния здоровья, пола и питания пациента; времени введения, способа введения и скорости выведения композиции; длительности лечения; медикаментов (таких как химиотерапевтический агент), применяемых в комбинации или одновременно с конкретной композицией и т.п. факторов, хорошо известных из уровня техники в медицине. Пригодные рецептуры, известные из уровня техники, можно найти в Remington's PharmaceuticalSciences (последнее издание), Mach Publishing Company, Easton, PA. Таким образом, эффективное количество спинозинов для целей согласно данному описанию (включая эффективное количество спинозина), определяется подобными соображениями. Фармацевтические композиции по данному изобретению могут вводиться традиционными способами, например перорально, ректально, местно, внутривенно, внутрибрюшинно, внутримышечно, внутрисуставно, подкожно, интраназально, ингаляционно, в глаза или трансдермально. Предпочтительными путями введения являются парентеральное и местное введение. Термин парентеральный в данном описании означает способы введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, надчревную, подкожную и внутрисуставную инъекцию или инфузию. Фармацевтические композиции вводят в количестве, эффективном для лечения конкретного показания. В большинстве случаев дозы спинозина составляют от приблизительно 0,5 мкг/мг до приблизительно 50 мг/кг массы тела ежедневно, с учетом способов введения, симптомов и т.д. Однако дозы могут быть низкими, например, 0,05 мкг/кг массы тела. Например, в конкретном случае местного введения вводимые дозы составляют предпочтительно от приблизительно 0,2 до 2 мкг/см 2. В случае интраназального или внутриглазного введения вводимые дозы предпочтительно составляют от приблизительно 0,05 до приблизительно 50 мкг/кг массы тела, и более предпочтительно от приблизительно 0,5 до приблизительно 5 мкг/кг массы тела. В целом, эффективное с фармацевтической точки зрения общее количество спинозина для парентерального введения будет находиться в интервале от приблизительно 0,5 мкг/кг массы тела пациента в сутки до 5 мг/кг массы тела пациента в сутки, хотя, как отмечалось выше, оно будет зависеть от конкретной терапевтической ситуации. При беспрерывном введении спинозин типично вводится со скоростью от приблизительно 10 до приблизительно 100 мкг/кг/ч, путем 1-4 инъекций в сутки или путем беспрерывных подкожных инфузий, например, с использованием мини-насоса. Также может применяться рас-4 010975 твор для внутривенного введения в полиэтиленовом пакете или бутыли. По-видимому, курс лечения спинозином является оптимальным, если он длится дольше определенного минимального периода, который для человека составляет 1-5 дней. Длительность лечения, необходимая для наблюдения за изменениями, а также интервал наблюдения за реакцией после лечения будут зависеть от желательного эффекта. Для парентерального введения в одном из вариантов спинозин вводят в препарат смешиванием его с желательной степенью чистоты в дозированной инъекционной форме (раствор, суспензия или эмульсия) с приемлемым с фармацевтической точки зрения носителем, т.е. нетоксичным для реципиентов при используемых дозах и концентрациях, а также совместимым с другими ингредиентами препарата. В целом, препараты готовят путем обеспечения однородного и тщательного контакта спинозина с жидкими носителями или тонко измельченными твердыми носителями, или обоими видами. Затем при необходимости продукту придают желательную форму. В случае носителя для парентерального применения предпочтительным является раствор, изотоничный с кровью реципиента. Примеры таких носителей растворителей включают воду, солевой раствор, раствор Рингера и раствор декстрозы. Неводные растворители, такие как жирные масла и этилолеат, также являются полезными согласно данному описанию, как и липосомы. Пригодные препараты, известные из уровня техники, можно найти в Remington'sPharmaceutical Sciences (последнее издание), Mach Publishing Company, Easton, PA. Для местного применения могут быть использованы такие лекарственные формы, как мази, кремы и гели, в дозах, описанных выше для композиций. Пригодные лекарственные формы, известные из уровня техники, можно найти в Remington's Pharmaceutical Sciences (последнее издание), Mach PublishingCompany, Easton, PA. Мази в целом готовят с использованием (1) маслянистой основы, т.е. состоящей из жирных масел или углеводородов, таких как белая нефть или минеральное масло, или (2) абсорбирующей основы, т.е. состоящей из любой безводной субстанции или субстанций, которые могут абсорбировать воду, например, безводного ланолина. Обычно после образования основы, маслянистой или абсорбирующей, активный ингредиент (спинозины) добавляют в количествах, обеспечивающих желательную концентрацию. Кремы представляют собой эмульсии масло-в-воде. Они состоят из масляной фазы (внутренняя фаза), которая типично включает жирные масла, углеводороды и т.п., такие как воски, нефть, минеральное масло и т.п., и водной фазы (беспрерывная фаза), которая включает воду и любые водорастворимые вещества, такие как добавленные соли. Две фазы стабилизируют использованием эмульгирующего агента, например поверхностно-активного агента, такого как натрий лаурилсульфат; гидрофильные коллоиды, такие как акациевая камедь, коллоидные глины, вигум и т.п. При образовании эмульсии активный ингредиент (спинозины) обычно добавляют в количествах, необходимых для достижения желательной концентрации. Гели включают основу, выбранную из маслянистой основы, воды или эмульсионно-суспензионной основы, такой как описанная выше. К основе добавляют желирующий агент, который образует в основе матрикс, повышая ее вязкость. Примерами желирующих агентов являются гидроксипропилцеллюлоза,полимеры акриловой кислоты и т.п. Активный ингредиент (спинозины) обычно добавляют к лекарственной форме в желательной концентрации в точке, предшествующей добавлению желирующего агента. Фармацевтические препараты для перорального применения готовят по известным методикам с использованием хорошо известных и легкодоступных ингредиентов. При составлении композиций активный ингредиент обычно предварительно смешивают с фармацевтически приемлемым носителем или разбавляют носителем или заключают в носитель, который может иметь форму капсулы, саше, бумажного пакетика или другой емкости. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который действует как растворитель, вспомогательное вещество или среда для активного ингредиента. Таким образом, композиция может быть в форме таблеток, пилюль,порошков, пастилок, суспензий, эмульсий, растворов, сиропов, мягких и твердых желатиновых капсул и т.п. Кроме активного или терапевтического ингредиента в дозах, описанных выше для композиций, таблетки содержат большое количество инертных материалов, известных как добавки или вспомогательные вещества. Такие материалы помогают осуществить удовлетворительную обработку и обеспечить характеристики прессования рецептуры и включают разбавители, связующие вещества, вещества, способствующие скольжению, и смазывающие вещества. Дополнительная группа вспомогательных веществ помогает придать конечной таблетке дополнительные желательные физические характеристики. В эту группу входят разрыхлители, красители, в случае жевательных таблеток - ароматизаторы и подсластители, в случае таблеток с контролируемым высвобождением - полимеры или воски или другие материалы,замедляющие растворение. Фармацевтически приемлемый означает, что носитель, разбавитель или вспомогательное вещество должны быть совместимы с другими ингредиентами лекарственной формы и не должны наносить вред реципиенту. Дополнительные детали, включая примеры лекарственных форм, можно найти в Remington's Pharmaceutical Sciences (последнее издание) Mach Publishing Company, Easton, PA.-5 010975 Данные композиции также охватывают повязки для ран или бандажи, включающие терапевтически эффективное количество спинозина или фармацевтически приемлемого его производного или соли. Бандаж или перевязочный материал для ран включает внешнюю тканевую основу, предпочтительно эластомерную тканевую основу; и внутреннюю подкладку, где внутренняя подкладка включает внешнюю мембранную поверхность, предпочтительно сделанную из пленкообразующего материала, включающую терапевтически эффективное количество спинозина или его приемлемого с физиологической точки зрения производного или соли, предпочтительно спинозад или его приемлемое с физиологической точки зрения производное или соль, в дозах, описанных выше для композиций в матрице. Подкладка может быть сделана цельной или отдельной от внешней тканевой основы. Спинозин идеально встраивается в мембранную матрицу, но также может встраиваться в материал внутренней подкладки, составляющий мембрану. Терапевтически активный агент удерживается в полимерной матрице таким образом, что его миграция ингибируется и осуществляется постепенное высвобождение спинозина во времени. В другом аспекте перевязочный материал для ран включает абсорбирующую подкладку, содержащую проницаемую для жидкости контактирующую с телом прокладку, отдельный внешний покрывающий лист, необязательно непроницаемый для жидкости, и расположенное между ними тело абсорбента. Внутреннее пространство и/или тело абсорбента сделано из материалов, которые инкорпорируют терапевтически эффективное количество спинозина в матрицу или промежуточное пространство для обеспечения того, чтобы спинозин постоянно находился в непосредственной близости к ране. Внутренняя поверхность или подкладка бандажа предпочтительно сделана из природного или синтетического мембранного или пленкообразующего материала, органического или неорганического, животного или растительного происхождения, или из пластических материалов. Например, из желатина или из растительных камедей, или из гидрофильных или гидрофобных пленкообразующих пластических материалов, таких как поливинилхлориды, полиацетаты или полиамиды, которые отлиты в форме или нанесены обычным способом, как пленка или мембрана. Пригодные полимерные материалы включают, не ограничиваясь ими, силастик или другие материалы на основе силикона, полиэтилен терефталат (ПЭТ), дакрон, трикотажный дакрон, велюровый дакрон, полиглацин, нейлон, шелк, полиэтилен (ПЭ), полиуретан, поливинилхлоридсиластановый эластомер, силикон, резину, поли-(метилметакрилат) (ПММА), латекс, полипропилен (ПП), полиолефин, целлюлозу, поливиниловый спирт (ПВС), поли(гидроксиэтилметакрилат) (ПГЭМА), поли(гликолевую кислоту), поли(акрилонитрил) (ПАН), фторэтилен-когекса-фторпропилен (ФЭП), тефлон (ПТФЭ), их сополимеры и смеси. Самый простой способ инкорпорирования терапевтически активных соединений в полимерный материал представляет собой непосредственное смешивание терапевтически активного вещества с пластичной смолой перед отливкой или подобный способ. Пленка или мембрана в идеале сделана из гидрофобного полимера, который является жидким и проницаемым для газов, но непроницаемым для микроорганизмов. Гидрофобность пленки или мембраны представляет собой полезную особенность, поскольку это уменьшает тенденцию пленки или мембраны прикрепляться к области раны. Количество спинозинов, введенное в рецептуру, не является критичным; концентрация должна находиться в интервале, достаточном для осуществления легкого нанесения препарата на область раны в количестве, которое будет доставлять желательное количество спинозинов. Обычно количество лекарственной формы для нанесения на рану будет зависеть от размера раны и концентрации спинозинов в лекарственной форме. В целом препарат будет наноситься на рану в количестве, обеспечивающем от приблизительно 0,1 до приблизительно 5 мкг спинозинов на см 2 раны. Предпочтительно наносимое количество спинозинов будет варьировать от приблизительно 0,2 до приблизительно 2 мкг/см 2 и наиболее предпочтительно от приблизительно 0,25 мкг до приблизительно 0,5 мкг/см 2. Спинозины также могут вводиться в глаз для лечения расстройств, патологий и повреждений слезной железы у человека в виде жидкости, капель или загущенной жидкости, геля. Спинозины также могут вводиться интраназально на слизистую оболочку носа для лечения расстройств, повреждений и патологий слизистой оболочки носа и эпителия синусовых пазух у человека в виде жидких капель или в форме спрея. Спинозины типично вводят в растворители в концентрации от приблизительно 0,01 до 50 мг/мл,предпочтительно от 0,01 мкг/мл до 10 мг/мл при рН от приблизительно 5 до приблизительно 8, предпочтительно от приблизительно 6 до приблизительно 7, наиболее предпочтительно при рН приблизительно 6,2. Следует понимать, что использование некоторых из перечисленных ниже вспомогательных веществ,носителей или стабилизаторов может вести к образованию солей спинозина. Обычно спинозин будет храниться в однодозовых или многодозовых контейнерах, например герметично укупоренных ампулах или флаконах, в виде водного раствора или в виде лиофилизированной лекарственной формы для разбавления. В качестве примера лиофилизированной лекарственной формы флаконы объемом 3 мл наполняют 1 мл стерилизованного фильтрацией 1% (мас./об.) водного раствора-6 010975 спинозина и полученную смесь лиофилизируют. Раствор для инфузий готовят путем разбавления лиофилизированного спинозина с использованием воды для инъекций, которая может необязательно включать один или больше антиоксидантов. Дозы также могут корректироваться для конкретного пациента с целью обеспечения предварительно определенной концентрации активности спинозина в крови по данным, например, техники радиоиммунологического анализа (RIA). Таким образом, дозы для пациента могут корректироваться для достижения постоянного уровня в крови порядка от 50 до 1000 нг/мл по данным радиоиммунологического анализа, предпочтительно от 150 до 500 нг/мл. Пример 1. Местное нанесение спинозада улучшает заживление ран после операции мулезинга у овец (исследованиеT9CAL0205) Кастрированных мериносовых барашков с обрубленным хвостом подвергали мулезингу (mulesing,хирургическое удаление полосок несущей шерсть кожи из области вокруг хвоста овцы, которое после заживления снижает уязвимость овец к зараженности мушиными яйцами). 50 овец оставляли нелеченными, а группу из 381 овцы лечили нанесением 7,1 г аэрозоля спинозада с концентрацией 4 мг/г (рецептура приведена в табл. 1). Аэрозоль спинозада наносили на рану местно до увлажнения продуктом, обрабатывая так же часть, покрытую шерстью. Таблица 1. Рецептура аэрозоля спинозада Раны после мулезинга у 18 барашков на группу тщательно исследовали и оценивали на предмет признаков заживления раны на 7-й и 17-й дни после лечения (табл. 1). Образование струпа и стягивание раны оценивали от 0 (полное или нормальное заживление) до 3 (эквивалентно отсутствию заживления). Кровотечение/серьезное излияние и нарушения заживления визуально оценивали от 0 (отсутствие кровотечения/излияния и нормальное заживление) до 3 (выраженное кровотечение или нарушение заживления). Таблица 2. Влияние местного нанесения спинозада на заживление ран у овец после операции мулезинга Геометрическое среднее. Более низкие значения показывают лучшее заживление. Количество пораженных овец из 18. На 7-й день после мулезинга овцы, леченные спинозадом, демонстрировали более выраженное стягивание ран мулезинга, чем нелеченный контроль, что определяли по более низким средним значениям стягивания раны. На 17-й день после мулезинга овцы, леченные спинозадом, демонстрировали улучшенное образование струпа, стягивание раны и уменьшенное кровотечение и серозное отделяемое, демонстрируя улучшенное заживление ран в сравнении с нелеченными контрольными овцами Местное нанесение спинозада на раны мулезинга у овец будет вести к улучшенному заживлению раны через 17 дней после лечения в сравнении с нелеченными животными. Такое улучшение заживления ран возникает в отсутствие поражающих факторов, таких как укусы синих мясных мух. Однако препа-7 010975 рат, использованный в данном примере, также включает антибактериальное соединение хлоргексидин. Способность хлоргексидина ингибировать бактериальную инфекцию также может оказывать положительное влияние на заживление ран в данном примере. Пример 2. Местное нанесение спинозада улучшает заживление ран после операции мулезинга у овец (исследованиеT9GAL0206) Кастрированных барашков мериносовой породы с обрубленными хвостами подвергали мулезингу. Около 46 мл разбавленного (125 промилле) Экстинозада (рецептура приведена в табл. 3) наносили на раны мулезинга 150 барашков, используя маленький (2 или 5 л) ручной садовый распылительаппликатор под давлением, доступный в розничных магазинах, торгующих садовым оборудованием. В контейнер или резервуар конической формы нагнетали давление с помощью ручного насоса. Распыление осуществлялось из конического сопла. Аэрозоль спинозада с концентрацией 4 мг/г (рецептура приведена в табл. 1) наносили на рану с использованием аэрозольного спрея до увлажнения продуктом раны и окружающей шерсти. 50 барашков после мулезинга оставляли нелеченными (контроль). Таблица 3. Рецептура Экстинозада (спинозад 25 г/л) Через 14 дней после лечения барашков проверяли и содержали на фермах. В течение периода 15 минут за барашками наблюдали и идентифицировали любые признаки зараженности мушиными яйцами,такие как подергивание хвоста, укусы в области клеймения стопы. 25 барашков из каждой группы случайным образом отбирали, помещали на поручни и их раны мулезинга оценивали на предмет признаков зараженности мушиными яйцами и заживления раны (табл. 4), образования струпа и стягивания раны,оценивая от 0 (полное или нормальное заживление) до 3 (эквивалентно отсутствию заживления). Кровотечение/серьезное излияние и нарушения заживления визуально оценивали от 0 (отсутствие кровотечения/излияния и нормальное заживление) до 3 (выраженное кровотечение или нарушение заживления). Таблица 4. Влияние местного нанесения спинозада в 2 различных лекарственных формах на заживление ран и наличие зараженности мушиными яйцами и инфекции у овец через 14 дней после операции мулезинга и лечения Геометрическое среднее. Более низкие значения показывают лучшее заживление. Количество пораженных овец из 25. Овцы, получавшие лечение спинозадом в виде аэрозоля (4 мг/л) или в виде ручного спрея (125 мг/л), демонстрировали улучшенное заживление ран, на что указывало меньшее количество баллов для образования струпа, стягивания раны и наличия кровотечения/серьезного излияния в области раны. Кро-8 010975 ме того, из 25 исследованных овец в каждой группе, ни у одного из животных не были нарушены процессы заживления, в сравнении с 4 животными, у которых были нарушены процессы заживления, в группе нелеченного контроля. Личинки Lucilla cuprina присутствовали у 4 из 25 нелеченных контрольных овец, в сравнении с одной овцой из группы, леченной Экстинозадом, тогда как ни у одной овцы из группы, леченной аэрозолем спинозада, не были обнаружены личинки. Инфекция в области раны присутствовала у 6 из 25 овец в нелеченной группе, но отсутствовала в группах, леченных спинозадом. Местное лечение ран мулезинга спинозадом ведет к улучшенному заживлению ран в сравнении с нелеченными контрольными животными, как показано в примере 1 выше. Такое улучшенное заживление ран сопровождается сниженной частотой инфекции и сниженной частотой выявления личинок Lucillacuprina. Улучшение заживления ран происходит независимо от лекарственной формы или дозы спинозада, нанесенной на раны после мулезинга. Кроме того, спинозад в отсутствие хлоргексидина (Экстинозад) способен усиливать заживление ран. Эти данные указывают на то, что усиленное заживление ран, которое наблюдается в примерах 1 и 2, скорее может быть эффектом спинозада самого по себе, чем результатом способности хлоргексидина ингибировать инфекцию. Пример 3. Спинозад улучшает заживление ран у крыс на модели термического повреждения а) Влияние спинозада на заживление вызванных лазером ран у нормальных молодых крыс У молодых аутбредных самцов крыс Спрег-Доули весом около 300 г в возрасте 3 месяцев за 24 ч до индукции раны удаляли шерсть с межлопаточной области. Осуществляли анестезию и у крыс вызывали термический ожог с использованием лазера CO2 (четыре последовательных периода стимуляции, каждый мощностью 25 Вт, импульсы по 0,5 с с диаметром светового пятна 10 мм) с образованием круглой раны площадью 2 см 2. Группы из 12 крыс обрабатывали солевым раствором, лимонной кислотой (5%) или спинозадом (0,5% в 5% лимонной кислоте). Лечение проводили в течение 5 дней после образования раны 2 раза в день путем 2 внутрикожных инъекций по 100 мкл на противоположных сторонах раны. Образование струпа вызывает преходящее снижение скорости стягивания раны (Snowden et al.,Aust. J. Exp. Biol. Med. Sci. 60: 73-82 (1982. Поэтому струп и слабо присоединенный струп осторожно удаляли после образования, чтобы поддерживать все раны в пригодном для сравнения состоянии и обеспечить тщательное отслеживание области раны. Раны измеряли ежедневно в течение 6 последовательных дней после образования раны и впоследствии каждые 48 ч до полного закрытия/реэпителизации раны. Область ожога (максимальный диаметр раны) отслеживали с помощью стереомикроскопа для тщательности и затем измеряли цифровым планиметром. Конечная точка заживления представляет собой время, когда происходит полное закрытие раны(табл. 5). Таблица 5. Влияние спинозада (0,5%) на скорость заживления раны у крыс с термическим ожоговым повреждением в сравнении с контрольными группами солевого раствора и лимонной кислоты Влияние спинозада на заживление раны заметно проявляется на 2-й день после образования раны,когда размер раны у леченных спинозадом крысы был на 30% меньше, чем у животных из контрольных групп солевого раствора и лимонной кислоты. Крысы, леченные спинозадом, продемонстрировали полное заживление раны на 12-й день, т.е. на 4 дня раньше, чем животные, леченные солевым раствором или-9 010975 лимонной кислотой. Полученные данные показывают, что простой водный раствор спинозада может ускорять заживление ран у нормальных здоровых молодых крыс.b) Влияние спинозада на заживление вызванных лазером ран у диабетических крыс (с нарушениями процессов заживления) Индукция диабета с применением стрептозотоцина Диабет вызывали у 3-месячных аутбредных самцов крыс Спрег-Доули с применением стрептозотоцина. Стрептозотоцин (75 мг/кг) растворяли в 0,1 М холодном натрий-цитратном буфере (рН 4) и держали на льду во избежание разложения. После 24-часового голодания крысам инъекционно вводили внутрибрюшинно одну дозу свежеприготовленного (холодного) раствора стрептозотоцина (Rakienten et al.,Cancer Chemotherapy Report 29: 73-82 (1963. Симптомы диабета у обработанных крыс становились явными через 2-3 дня, и их диабетическое состояние подтверждали тестом на глюкозу в моче. Применяли лечение инсулином, чтобы давать регулярную передышку от катаболического влияния состояния, которое станет доминирующим, если регулярно допускать выраженную гипергликемию (Willars et al., J. Neurol. Sci. 91: 153-164 (1989. 1-2 инъекции инсулина (Протофан 2 ME/100 г) вводили подкожно крысам с развившимся диабетом, в зависимости от выраженности их состояния (например, низкое потребление пищи или жидкости, снижение массы тела до приблизительно 115 г, крайне низкая физическая активность). Крыс, состояние которых не улучшалось или которые теряли больше 15% массы тела, забивали. У диабетических крыс весом около 200 г за 24 ч до образования раны удаляли шерсть с межлопаточной области. Осуществляли анестезию и у крыс вызывали термический ожог с применением лазера СО 2 (четыре последовательных периода стимуляции, каждый мощностью 25 Вт, импульсы по 0,5 с с диаметром светового пятна величиной 10 мм), что приводило к образованию круглой раны площадью 2 см 2. Группы по 12 крыс обрабатывали солевым раствором или спинозадом (0,5% в 5% лимонной кислоте). Лечение осуществляли местно в течение 5 дней после образования раны 2 раза в день путем капельного нанесения 100 мкл раствора непосредственно на область раны. Струп и слабо прикрепленный струп осторожно удаляли после выявления, чтобы поддерживать все раны в пригодном для сравнения состоянии и обеспечить аккуратное отслеживание области раны. Раны измеряли, как описано выше (пример 3a), до очевидного закрытия раны (табл. 6). Таблица 6. Влияние спинозада (0,5%) на скорость заживления раны у диабетических крыс с термическим ожоговым повреждением в сравнении с контрольной группой солевого раствора Диабетические крысы, которых местно лечили спинозадом, через 3 дня после образования раны продемонстрировали улучшенное заживление ран в сравнении с контрольной группой солевого раствора,что проиллюстрировано уменьшением области раны. Размер раны продолжал сокращаться быстрее у крыс, леченных спинозадом, что вело к заживлению раны в день 13, на 4 дня раньше заживления раны в контрольной группе, леченной солевым раствором. с) Влияние спинозада на заживление вызванных лазером ран у пожилых крыс (с нарушениями процессов заживления) У аутбредных самцов крыс Спрэг-Доули в возрасте 24 месяца весом приблизительно 600 г за 24 ч до образования раны удаляли шерсть с межлопаточной области. Осуществляли анестезию и у крыс вы- 10010975 зывали термический ожог с использованием лазера СО 2 (четыре последовательных периода стимуляции,каждый мощностью 25 Вт, импульсы по 0,5 с с диаметром светового пятна величиной 10 мм), что приводило к образованию круглой раны площадью 2 см 2. Группы по 12 крыс обрабатывали солевым раствором или спинозадом (0,5% в 5% лимонной кислоте). Лечение осуществляли местно 2 раза в день в течение 5 дней после образования раны, путем капельного нанесения 100 мкл раствора непосредственно на область раны. Струп и слабо прикрепленный струп осторожно удаляли после выявления, чтобы поддерживать все раны в пригодном для сравнения состоянии и обеспечить аккуратное отслеживание области раны. Раны измеряли, как описано выше (пример 3a) до очевидного закрытия раны (табл. 7). Таблица 7. Влияние спинозада (0,5%) на скорость заживления раны у пожилых крыс с термическим ожоговым повреждением в сравнении с контрольной группой солевого раствора Пожилые крысы, которых местно лечили спинозадом, демонстрировали улучшенное заживление ран в сравнении с контрольной группой солевого раствора через 3 дня после образование раны, что проиллюстрировано уменьшением области раны. Размер раны продолжал сокращаться у крыс, леченных спинозадом, вплоть до 6-го дня, тогда как в группе крыс, обработанных солевым раствором, в течение этого периода размер раны увеличивался. У крыс, леченных спинозадом, размер раны оставался меньшим в сравнении с животными из контрольной группы солевого раствора, с полным заживлением раны на 15-й день, т.е. на 6 дней раньше полного заживления раны у животных контрольной группы, обработанных солевым раствором. Спинозад улучшает скорость заживления ран при местном нанесении или внутрикожном введении. Спинозад улучшает заживление ран у крыс пожилого возраста с хроническими дефицитами сенсорных нервов. Полученные данные указывают на то, что спинозад может усиливать заживление ран через зависимые от сенсорных нервов и независимые от сенсорных нервов механизмы. Таким образом,спинозад может лечить хронические возрастные язвы, связанные со старением. Спинозад улучшает заживление ран у крыс с искусственно вызванным диабетом, ведущим к другой форме дефицита сенсорных нервов. Полученные данные также указывают на то, что ранозаживляющие свойства спинозада могут модулироваться как через зависимые от сенсорных нервов, так и через независимые от сенсорных нервов пути. Таким образом, спинозад может лечить хронические язвы и другие виды ран, связанных с недостаточным заживлением у больных диабетом. Спинозад улучшает заживление у нормальных здоровых молодых крыс с интактными сенсорными нервами. Эти данные указывают на то, что спинозад может осуществлять свое действие через механизм,независимый от сенсорных нервов, или может усиливать функционирование сенсорных нервов. Таким образом, у здоровых пациентов-людей спинозад может усиливать заживление ран, например, полученных в результате травмы или хирургического вмешательства. Результаты примера 3 показывают, что спинозад может стимулировать заживление ран через различные механизмы и должен быть эффективным у людей с нормальными или нарушенными процессами заживления.- 11010975 Диабетические крысы и пожилые крысы в целом демонстрируют период запаздывания перед любой значительной реакцией на травму (табл. 6 и 7) в сравнении со здоровыми молодыми крысами (табл. 5). Такой период запаздывания приписывали общему снижению активности афферентных сенсорных нейронов у больных диабетом (Gibran et al., J. Surg. Res. 108: 122:128 (2002 и пожилых (KhalilHelme, J.Gerontol. Biol. Sci. 51A(5): B354-B361 (1996 крыс, очевидному в течение воспалительной фазы заживления ран. Спинозад способен оказывать ранозаживляющее действие у диабетических крыс, возможно, в результате стимуляции местных афферентных сенсорных нервов или использования механизмов, независимых от активации афферентных сенсорных нервов. Действие спинозада является более выраженным у контрольных животных с интактными сенсорными нервами (табл. 5). Такой эффект особенно очевиден на протяжении ранней воспалительной фаз(дни 2-5), раннего компонента пролиферативной фазы (дни 2-6), с дальнейшим позитивным влиянием на протяжении позднего компонента пролиферативной фазы (дни 6-8) и фазы ремоделирования (дни 9-12). По-видимому, спинозад также оказывает влияние в ходе фазы ремоделирования в процессе заживления раны, которая включает клеточную инфильтрацию и пролиферацию. В ходе этой фазы дерма реагирует на повреждение выработкой коллагена и белков матрикса, что ведет к закрытию раны и выздоровлению. Таким образом, спинозад может действовать на медиаторы, влияющие на клеточную инфильтрацию и активацию, такие как цитокины, хемокины и другие сигнальные вещества клетки, или может непосредственно усиливать образование матрикса и ремоделирование кожи в области раны. Пример 3 показывает, что спинозад улучшает заживление ран на протяжении трех фаз заживления. Данные примера 3 подтверждают результаты примеров 1 и 2, показывая, что спинозад способствует заживлению ран, как хирургических, так и образованных путем термического ожога. Спинозад усиливает заживление ран у двух видов животных. Пример 4. Исследования механизма действия усиления заживления ран спинозадом у крыс с использованием волдырной модели нейрогенного воспаления а) Влияние дозы спинозада на сосудистый кровоток Нейрогенные воспалительные реакции оценивали с использованием хорошо изученного метода(KhalilHelme, Brain Res. 527: 292-298 (1990. Осуществляли анестезию аутбредных самцов крыс Спрег-Доули пентобарбиталом натрия (60 мг/кг внутрибрюшинно). Общую анестезию поддерживали дополнительными инъекциями в дозе 15 мг/кг. Показано, что данный метод анестезии не изменяет базовых реакций вазодилатации в периферических микрососудах (KhalilHelme, Brain Res. 500: 256-262(1989. В левой яремной вене устанавливали канюлю с полиэтиленовой трубкой для внутривенного введения раствора гепарина в солевом растворе или медикаментов. Температуру тела поддерживали на уровне 37 С. По окончании эксперимента животных умерщвляли высокой дозой барбитурата. В центральной области подкладки задней лапы анестезированных крыс вызывали образование волдырей с использованием вакуума -40 кПа в течение 30 мин, который подводили через металлический отсасывающий колпачок, нагретый до 40 С. После образования волдыря эпидермис (поверхность эпителия) удаляли и над основанием волдыря устанавливали камеру из плексигласа с входными и выходными отверстиями. По поверхности волдыря осуществляли перфузию раствором Рингера, поддерживая ее с помощью перистальтического насоса со скоростью 4 мл/ч для получения базового уровня параметров. Относительный кровоток контролировали во времени с помощью лазерного флоуметра по Доплеру через зонд, расположенный непосредственно над основанием волдыря, и относительный ток крови (вольты) беспрерывно регистрировали на записывающем устройстве. Спинозад разбавляли 5% лимонной кислотой в растворе Рингера и осуществляли им перфузию основания волдыря в течение периода до 30 мин. Таблица 8. Влияние различных концентраций спинозада на кровоток над основанием волдыря в сравнении с раствором Рингера Перфузия спинозада в концентрации 0,5% через волдырную рану оказывает наиболее выраженный эффект на сосудистый кровоток, с точки зрения как выраженности реакции, так и ее длительности. Раствор спинозада 0,05% оказывает положительное влияние на кровоток, хотя выраженность реакции меньше в сравнении с 0,5% раствором спинозада. Спинозад в концентрации 5% вызывает немедленную реакцию с пиком сниженной величины и длительности в сравнении с реакцией, полученной при использовании 0,5% раствора спинозада. Поддержание выраженности реакции, которое наблюдалось при применении 0,5% спинозада, указывает на взаимодействие с нервными путями пептида, родственного гену кальцитонина (CGRP), тогда как десенсибилизацию, которая наблюдается при применении более высокой концентрации спинозада, часто связывают с путями, опосредованными веществом Р. Полученные- 12010975 данные показывают, что спинозад оказывает положительное влияние на сосудистый кровоток, что является важным условием заживления ран. Такой эффект может быть результатом непосредственного действия на кровеносные сосуды или высвобождения из сенсорных нервов пептидов, таких как CGRP и вещество Р, которые, в свою очередь, опосредуют сосудистую реакцию.b) Влияние антагонистов пептидов сенсорных нервов и ингибитора синтазы оксида азота на сосудистую реакцию крыс на 0,5% спинозад Нейрогенные воспалительные реакции оценивали с применением хорошо изученного метода (KhalilHelme, Brain Res. 527: 292-298 (1990. Осуществляли анестезию аутбредных самцов крыс СпрегДоули пентобарбиталом натрия (60 мг/кг внутрибрюшинно). Общую анестезию поддерживали дополнительными инъекциями в дозе 15 мг/кг. Показано, что данный метод анестезии не изменяет базовых реакций вазодилатации в периферических микрососудах (KhalilHelme, Brain Res. 500: 256-262 (1989. В левой яремной вене устанавливали канюлю с полиэтиленовой трубкой для внутривенного введения раствора гепарина в солевом растворе или медикаментов. Температуру тела поддерживали на уровне 37 С. По окончании эксперимента животных умерщвляли высокой дозой барбитурата. В центральной области подкладки задней лапы анестезированных крыс вызывали образование волдырей с использованием вакуума -40 кПа в течение 30 мин, который подводили через металлический отсасывающий колпачок, нагретый до 40 С. После образования волдыря эпидермис (поверхность эпителия) удаляли и над основанием волдыря устанавливали камеру из плексигласа с входными и выходными отверстиями. По поверхности волдыря осуществляли перфузию раствора Рингера, поддерживая ее с помощью перистальтического насоса со скоростью 4 мл/ч для получения базового уровня параметров. Относительный кровоток контролировали во времени с помощью лазерного флоуметра по Доплеру через зонд, расположенный непосредственно над основанием волдыря, и относительный ток крови(вольты) беспрерывно регистрировали на записывающем устройстве. Спинозад разбавляли 5% лимонной кислотой в растворе Рингера и осуществляли его перфузию на основании волдыря в течение периода до 30 мин. Для подкладки одной лапы у каждой крысы осуществляли перфузию 0,5% спинозада, тогда как для подкладки другой лапы у каждой крысы осуществляли перфузию антагониста или ингибитора в течение 10 мин с последующей одновременной перфузией 0,5% спинозада в течение 30 мин. Перфузию CGRP8-37 (антагонист CGRP; Auspep, VIC, Австралия) осуществляли в концентрации 1 мкМ, перфузию метилового эфира N-нитро-L-аргинина (L-NAME, ингибитор эндотелиальной синтазы оксида азота; Cayman Chemical Co., MI, США) осуществляли с концентрацией 100 мкМ и перфузию спантида II (антагонист II вещества Р; Auspep, VIC, Австралия) осуществляли с концентрацией 10 мкМ. Таблица 9. Влияние антагонистов пептидов сенсорных нервов и ингибитора эндотелиальной синтазы оксида азота на сосудистую реакцию волдырей подкладки лапы у крыс на перфузию 0,5% спинозада и относительный вклад эффекторов в активность спинозада Кровоток в ответ на стимуляцию спинозидом снижался в присутствии антагонистов пептидовCGRP и SP и в присутствии ингибитора синтазы оксида азота (табл. 9). Эти данные указывают на то, что эффект спинозада на сосудистый кровоток опосредуется через пути CGRP, вещества Р и оксида азота. Вклад CGRP, вещества Р и эндотелиального оксида азота в эффект спинозада составляет 27, 34 и 24%,соответственно (табл. 9). Профиль сосудистой реакции в присутствии антагониста CGRP показывает сходную выраженность реакции на протяжении перфузии, указывая на то, что опосредование эффекта спинозада CGRP является постоянным во времени. Профили сосудистой реакции в присутствии антагониста вещества Р (спантид) или ингибитора эндотелиальной синтазы оксида азота (L-NAME) показывают, что реакция снижается со временем. Это указывает на то, что вещество Р и эндотелиальная синтаза оксида азота в большей степени вовлекаются в опосредование эффекта спинозада на протяжении поздних стадий реакции. Взятые вместе, полученные данные показывают, что влияние спинозада на сосудистый кровоток- 13010975 опосредуется пептидами сенсорных нервов веществом Р и CGRP, а также через эндотелиальный оксид азота. Участие в данном процессе эндотелиального оксида азота указывает на то, что спинозад может действовать непосредственно на эндотелий кровеносных сосудов, а также через иннервацию кровеносных сосудов в ране сенсорными нервами. Кроме того, действие спинозада является длительным и опосредуется через различными эффекторами на различных стадиях реакции. Такие данные могут объяснить различие профилей заживления ран у леченных спинозадом крыс и контрольных крыс на модели термического повреждения (пример 3), особенно раннее заживление ран у крыс с нарушениями процесса заживление (больные диабетом, пожилые крысы). Способность ингибиторов и антагонистов нейропептидов ингибировать действие спинозада на сосудистый кровоток указывает на то, что свойство спинозада вызывать раннее заживление ран реализуется через пути сенсорных нервов при участии комбинации нейропептидов. Такая активность должна усиливать раннюю воспалительную стадию процесса заживления ран, которая в большой мере инициируется активностью сенсорных нервов (Steinhoff et al., Arch.Dermatol. 139: 1479-1488 (2003. Действительно, данные примера 3 показывают, что у нормальных молодых крыс и крыс с нарушенными процессами заживления действие спинозада на стягивание ран явно выражено в течение первых 5 дней заживления. с) Влияние спинозада на сосудистую реакцию на протяжении ранней и поздней фаз острого воспаления Нейрогенные воспалительные реакции оценивали с применением хорошо изученного метода (KhalilHelme, Brain Res. 527: 292-298 (1990. Осуществляли анестезию аутбредных самцов крыс СпрегДоули пентобарбиталом натрия (60 мг/кг внутрибрюшинно). Общую анестезию поддерживали дополнительными инъекциями в дозе 15 мг/кг. Показано, что данный метод анестезии не изменяет базовых реакций вазодилатации в периферических микрососудах (KhalilHelme, Brain Res. 500: 256-262 (1989. В левой яремной вене устанавливали канюлю с полиэтиленовой трубкой для внутривенного введения раствора гепарина в солевом растворе или медикаментов. Температуру тела поддерживали на уровне 37 С. По окончании эксперимента животных умерщвляли высокой дозой барбитурата. В центральной области подкладки задней лапы анестезированных крыс вызывали образование волдырей с использованием вакуума -40 кПа в течение 30 мин, который подводили через металлический отсасывающий колпачок, нагретый до 40 С. После образования волдыря эпидермис (поверхность эпителия) удаляли и над основанием волдыря устанавливали камеру из плексигласа с входными и выходными отверстиями. По поверхности волдыря осуществляли перфузию раствора Рингера, поддерживая ее с помощью перистальтического насоса со скоростью 4 мл/ч для получения базового уровня параметров. Относительный кровоток контролировали во времени с помощью лазерного флоуметра по Доплеру через зонд, расположенный непосредственно над основанием волдыря, и относительный ток крови(вольты) беспрерывно регистрировали на записывающем устройстве. Спинозад (0,5%) разбавляли 5% лимонной кислотой в растворе Рингера и осуществляли его перфузию на основании волдыря в течение периода до 30 мин. Для волдыря подкладки одной лапы у каждой крысы немедленно осуществляли перфузию спинозада (ранняя фаза), тогда как для волдыря подкладки другой лапы осуществляли перфузию через 5 ч после образования волдыря (поздняя фаза). Таблица 10. Влияние 0,5% спинозада на сосудистую реакцию волдырей подкладки лапы на протяжении ранней (немедленно после травмы) и поздней (5 ч после травмы) фаз острого воспаления Нейрогенные эффекторы преимущественно принимают участие в ранней фазе воспалительной реакции, тогда как в поздней фазе воспалительной реакции принимают участие компоненты иммунной системы, такие как нейтрофилы и моноциты. Таким образом, на ранней и поздней фазах воспалительной реакции спинозад оказывает практически в равной степени выраженное воздействие (табл. 10); полученные данные указывают на то, что спинозад действует не только на нейрогенные медиаторы воспаления(также показано в примере 4b), но также оказывает значительное влияние на иммунологические медиаторы воспалительной реакции. Данный результат является значительным вследствие вовлечения иммунных медиаторов в восстановление здоровья и активацию клеток в ходе фаз пролиферации и ремоделирования заживления ран (дни 6-12). Как было отмечено ранее в примере 3, влияние спинозада на заживление ран осуществляется в воспалительной, пролиферативной фазах и фазе ремоделирования. Данные настоящего примера обеспечивают доказательство того, что спинозад стимулирует и нейрогенный, и иммунологический пути для опосредования ранозаживляющего действия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение спинозина или его физиологически приемлемого производного или соли для приго- 14010975 товления лекарственного средства для стимуляции или ускорения заживления ран у млекопитающего. 2. Применение по п.1, в котором указанный спинозин представляет собой спинозад или его физиологически приемлемое производное или соль. 3. Применение по п.1, в котором процессы заживления у указанного млекопитающего не нарушены. 4. Применение по п.1, в котором процессы заживления у указанного млекопитающего нарушены. 5. Применение по п.1, в котором указанный спинозин предназначен для местного нанесения на рану. 6. Применение по п.1, в котором указанный спинозин предназначен для перорального введения. 7. Применение по п.1, в котором указанный спинозин предназначен для парентерального введения. 8. Применение по п.1, в котором указанное млекопитающее представляет собой жвачное животное. 9. Применение по п.1, в котором указанное жвачное животное представляет собой овцу. 10. Применение по п.1, в котором указанное млекопитающее представляет собой человека. 11. Применение по п.1, в котором указанное млекопитающее представляет собой кошку, собаку или лошадь.
МПК / Метки
МПК: A61K 31/7048, A61P 17/02
Метки: заживления, применение, ран, спинозинов
Код ссылки
<a href="https://eas.patents.su/16-10975-primenenie-spinozinov-dlya-zazhivleniya-ran.html" rel="bookmark" title="База патентов Евразийского Союза">Применение спинозинов для заживления ран</a>
Предыдущий патент: Меркаптоимидазолы в качестве антагонистов рецепторов ccr2
Следующий патент: Композиция, содержащая вещества, регулирующие рост и/или развитие растений, и способы ее применения
Случайный патент: Аэрозольные препараты для внутрилёгочного введения лекарств с получением системного действия