Глюкагоноподобный пептид-1, улучшающий ответ &beta-клеток на глюкозу у субъектов с нарушением толерантности к глюкозе
Формула / Реферат
1. Способ лечения человека с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному человеку композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанный компонент в количестве, эффективном для увеличения чувствительности и ответа b-клеток поджелудочной железы на изменения уровня глюкозы в плазме, что измеряется хронометрированием и количественным определением секреции инсулина в ответ на увеличения уровня глюкозы в плазме.
2. Способ по п.1, где рецептор-связывающее соединение выбирают из (a) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида-1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками.
3. Способ по п.2, где рецептор-связывающее соединение представляет собой глюкагоноподобный пептид-1.
4. Способ по п.2, где рецептор-связывающее соединение представляет собой глюкагоноподобный пептид-1 (7-37), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly (SEQ. ID NO: 3).
5. Способ по п.2, где рецептор-связывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg (NH2) (SEQ. ID NO:4).
6. Способ по п.2, где рецептор-связывающее соединение представляет собой вариантный пептид, в котором комбинация замен, делеций и вставок в аминокислотной последовательности отличается не более чем на десять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1.
7. Способ по п.1, дополнительно предусматривающий введение средства, которое повышает время полужизни указанного соединения in vivo.
8. Способ по п.1, где рецептор-связывающее соединение экспрессируется полинуклеотидом.
9. Способ по п.1, где рецептор-связывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000.
10. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для увеличения регулярности инсулиновых ответов и их амплитуд в ответ на изменение содержания глюкозы в плазме.
11. Способ по п.10, где рецептор-связывающее соединение выбирают из (a) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида-1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками.
12. Способ по п.11, где рецептор-связывающее соединение представляет собой глюкагоноподобный пептид-1.
13. Способ по п.11, где рецептор-связывающее соединение представляет собой глюкагоноподобный пептид-1 (7-37), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly (SEQ. ID NO:3).
14. Способ по п.11, где рецептор-связывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg (NH2) (SEQ. ID NO:4).
15. Способ по п.11, где рецептор-связывающее соединение представляет собой вариантный пептид, в котором комбинация замен, делеций и вставок в аминокислотной последовательности отличается не более чем на десять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1.
16. Способ по п.10, где рецептор-связывающее соединение экспрессируется полинуклеотидом.
17. Способ по п.10, где рецептор-связывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000.
18. Способ по п.10, где путь введения выбирают из группы, состоящей из внутривенного, подкожного, внутримышечного, внутрибрюшинного, инъецируемого депо с пролонгированным высвобождением, глубокого вдувания через дыхательные пути (легкие) с пролонгированным высвобождением, щечного введения или доставки с помощью пластыря.
19. Способ по п.10, дополнительно предусматривающий введение средства, которое повышает время полужизни указанного рецептор-связывающего соединения in vivo.
20. Способ по п.19, где указанное средство вводят одновременно с композицией.
21. Способ по п.19, где указанное средство коваленто связано с рецептор-связывающим соединением.
22. Способ по п.18, где внутривенное введение осуществляют в диапазоне доз примерно от 0,3 до 2,0 пмоль/кг в минуту.
23. Способ по п.18, где непрерывное подкожное введение осуществляют в диапазоне доз примерно от 1,0 до 20, 0 пмоль/кг в минуту.
24. Способ лечения человека с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение человеку композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для замедления или подавления потери контроля над глюкозой плазмы и развития инсулиннезависимого сахарного диабета.
25. Способ по п.24, где рецептор-связывающее соединение выбирают из (a) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида-1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками.
26. Способ по п.25, где рецептор-связывающее соединение представляет собой глюкагоноподобный пептид-1.
27. Способ по п.25, где рецептор-связывающее соединение представляет собой глюкагоноподобноый пептид-1 (7-37), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly (SEQ. ID NO:3).
28. Способ по п.25, где рецептор-связывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg (NH2) (SEQ. ID NO:4).
29. Способ по п.25, где рецептор-связывающее соединение представляет собой вариантный пептид, в котором комбинация замен, делеций и вставок в аминокислотной последовательности отличается не более чем на пять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1.
30. Способ по п.24, где рецептор-связывающее соединение экспрессируется полинуклеотидом.
31. Способ по п.24, где рецептор-связывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000.
32. Способ по п.24, где путь введения выбирают из группы, состоящей из внутривенного, подкожного, внутримышечного, внутрибрюшинного, инъецируемого депо с пролонгированным высвобождением, глубокого вдувания через дыхательные пути (легкие) с пролонгированным высвобождением, щечного введения или доставки с помощью пластыря.
33. Способ по п.32, где внутривенное введение осуществляют в диапазоне доз примерно от 0,1 до 10,0 пмоль/кг в минуту.
34. Способ по п.32, где непрерывное подкожное введение осуществляют в диапазоне доз примерно от 1,0 до 75,0 пмоль/кг в минуту.
35. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для улучшения ответов в виде секреции инсулина b-клетками на колебания уровней экзогенной глюкозы.
36. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для улучшения нормализации характеристик секреции инсулина при нарушенной толерантности к глюкозе.
37. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для понижения уровней инсулина у индивидуума с нарушенной толерантностью к глюкозе.
38. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для снижения инсулинорезистентности у индивидуума с нарушенной толерантностью к глюкозе.
39. Способ лечения индивидуума, симптомы (заболевания) которого указывают на повышенный риск проявления цереброваскулярного нарушения, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для увеличения регулярности инсулиновых ответов и их амплитуд в ответ на изменение содержания глюкозы в плазме, и для понижения уровней инсулина в плазме.
Текст
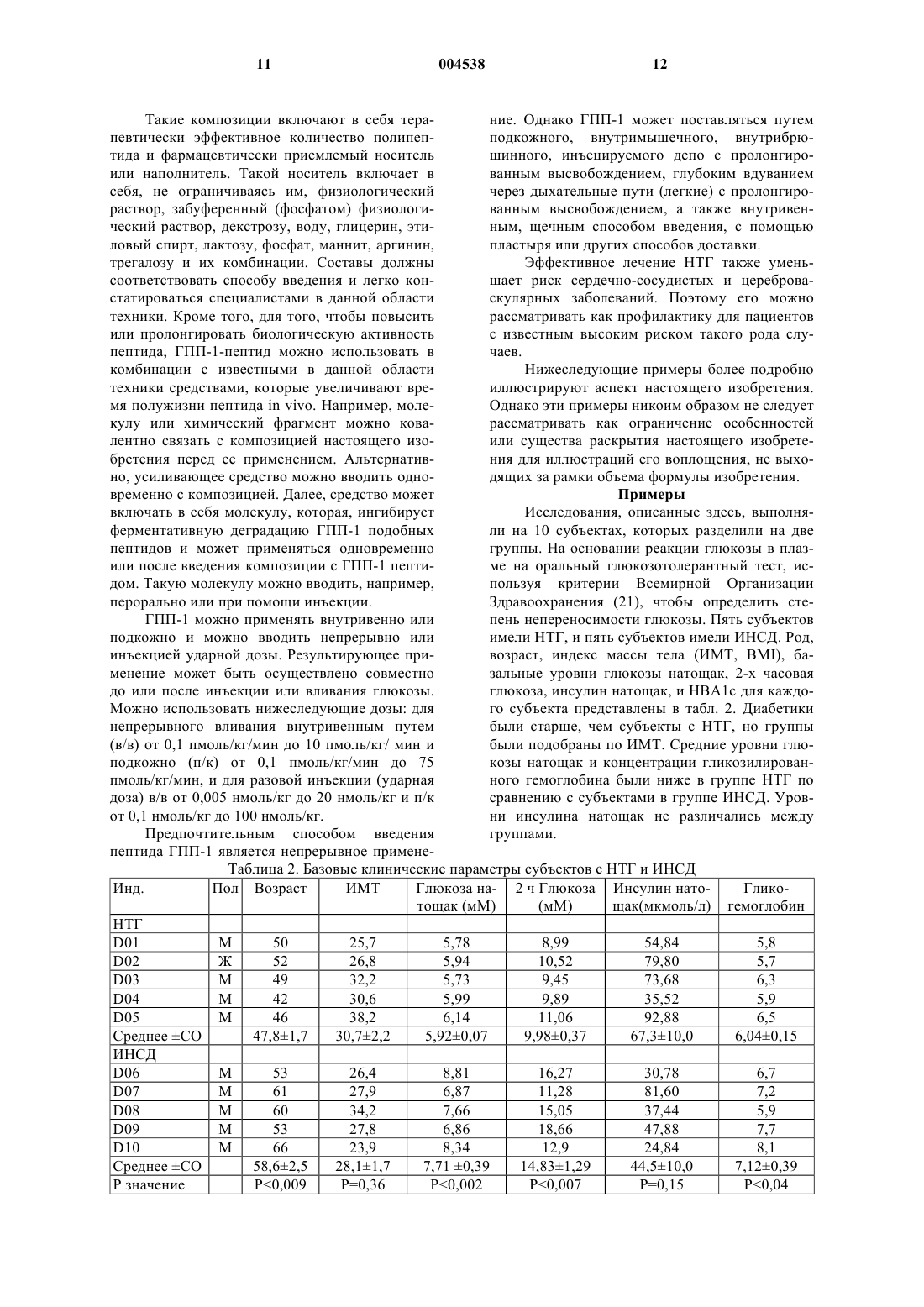
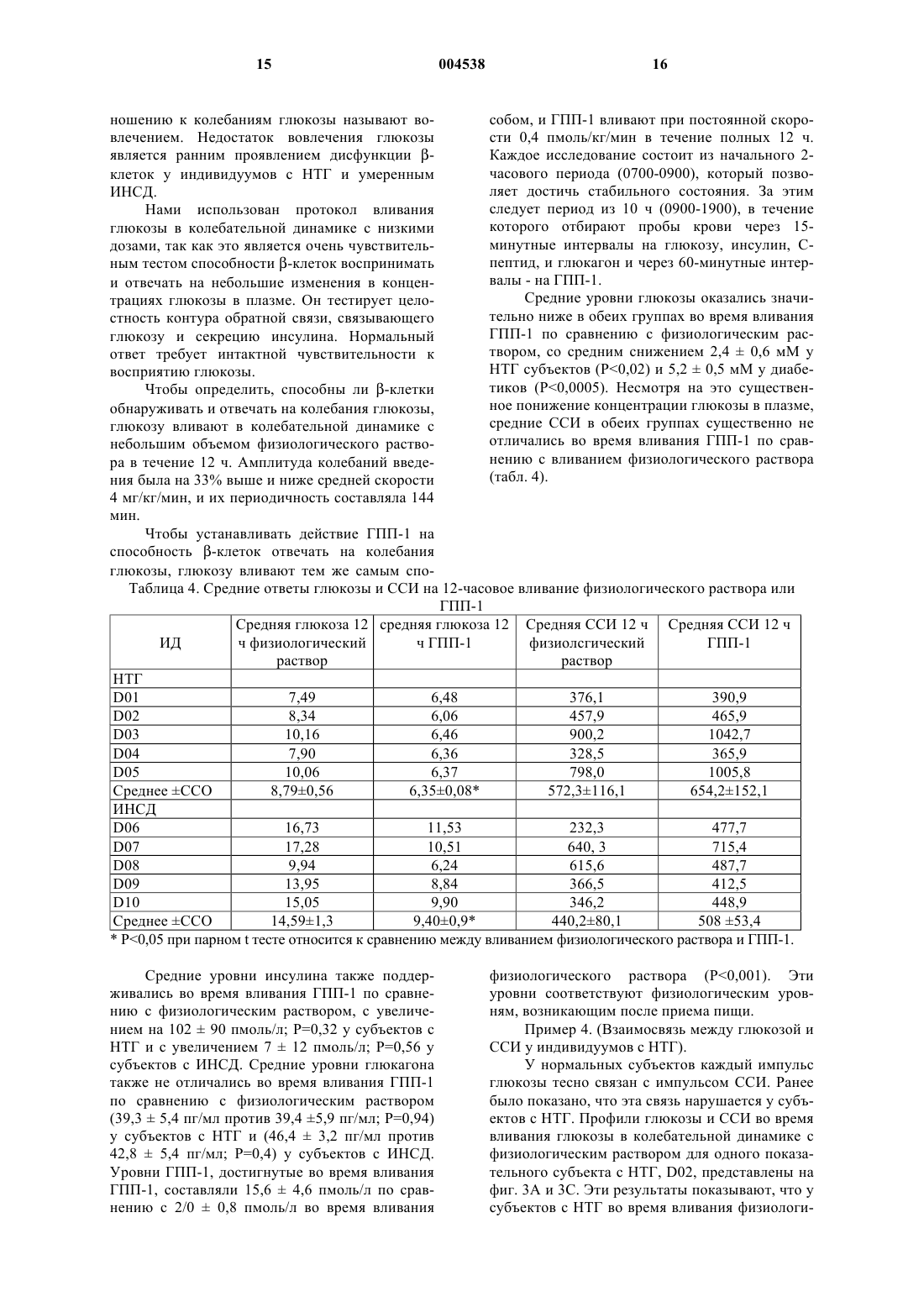
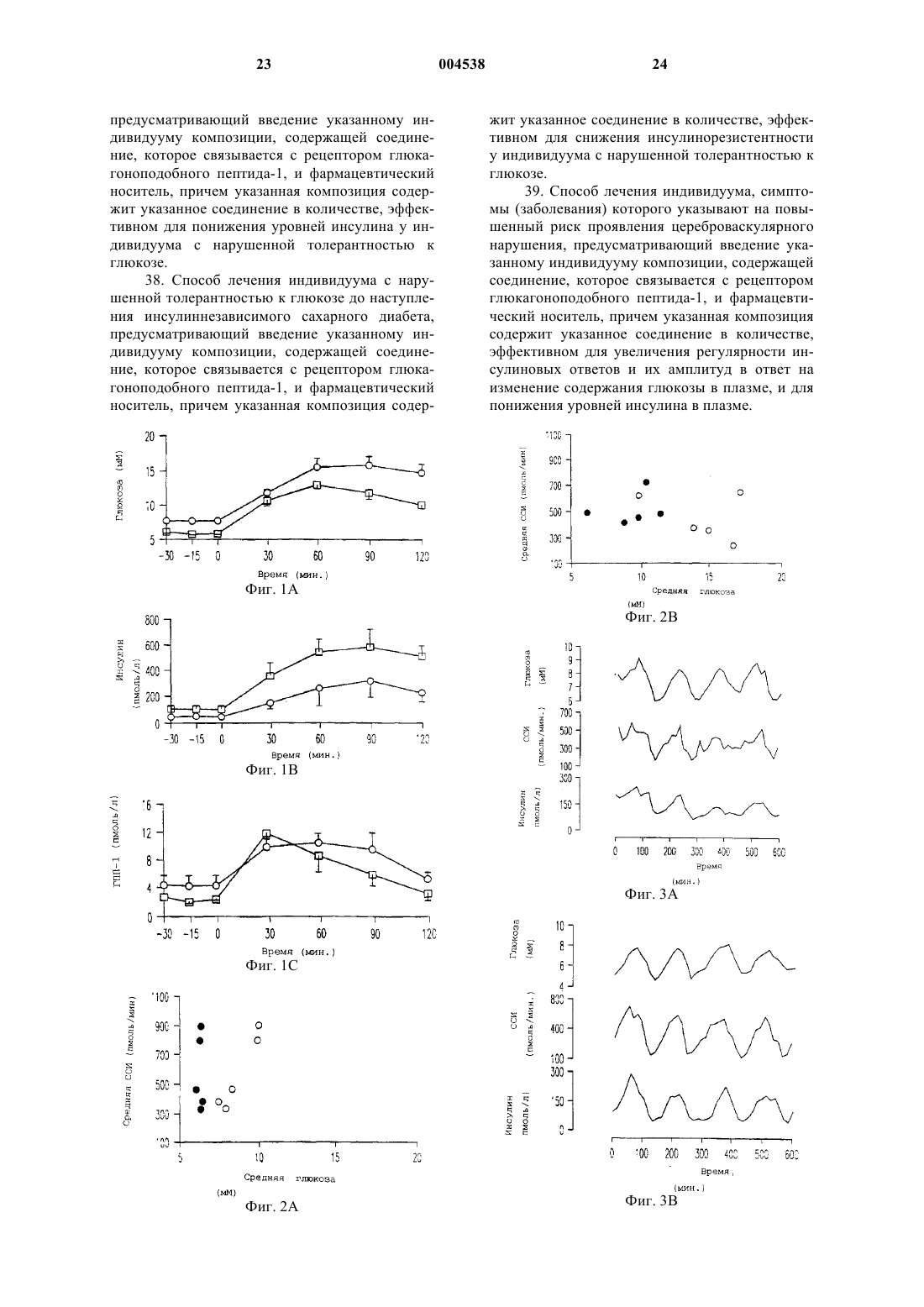
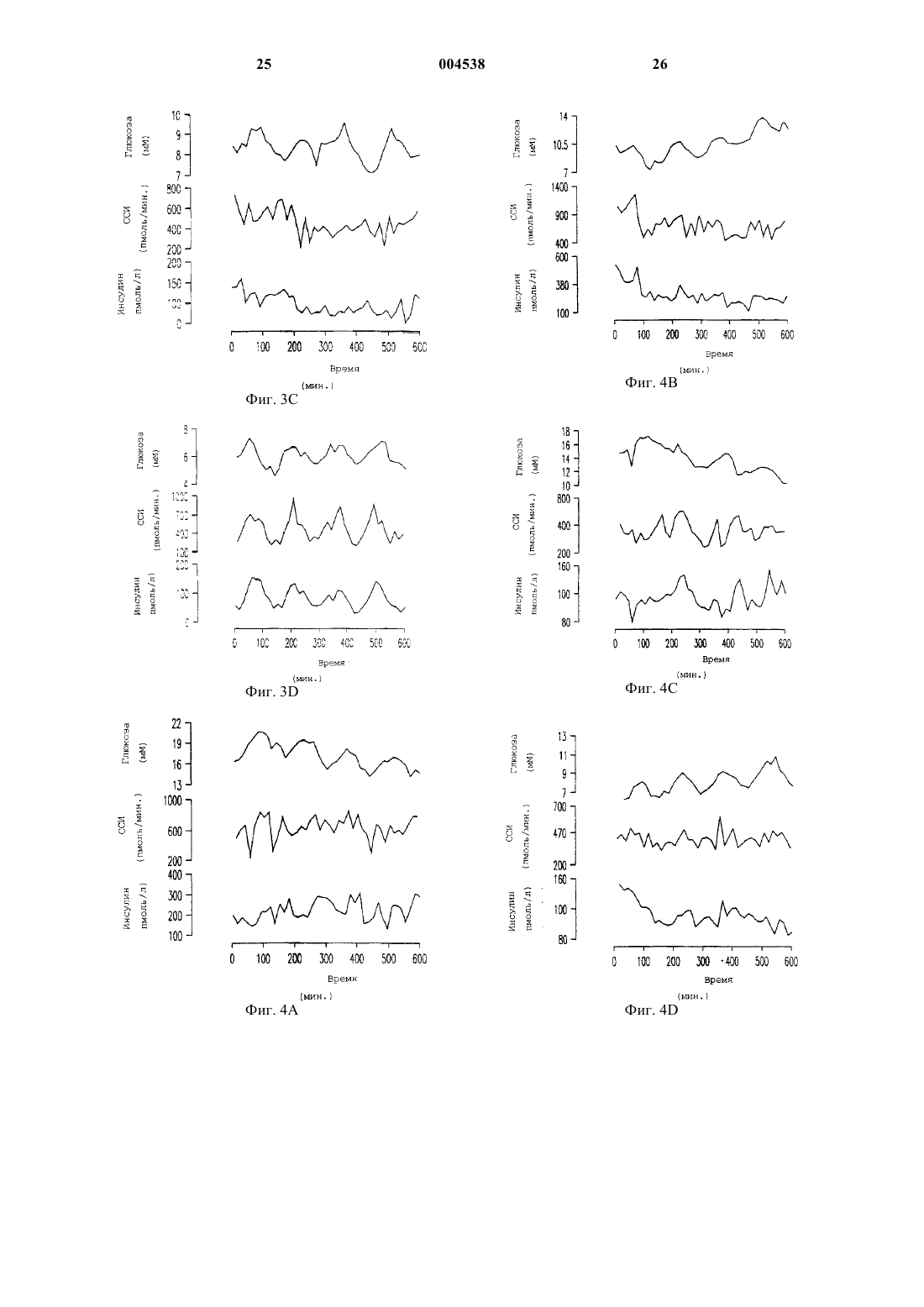
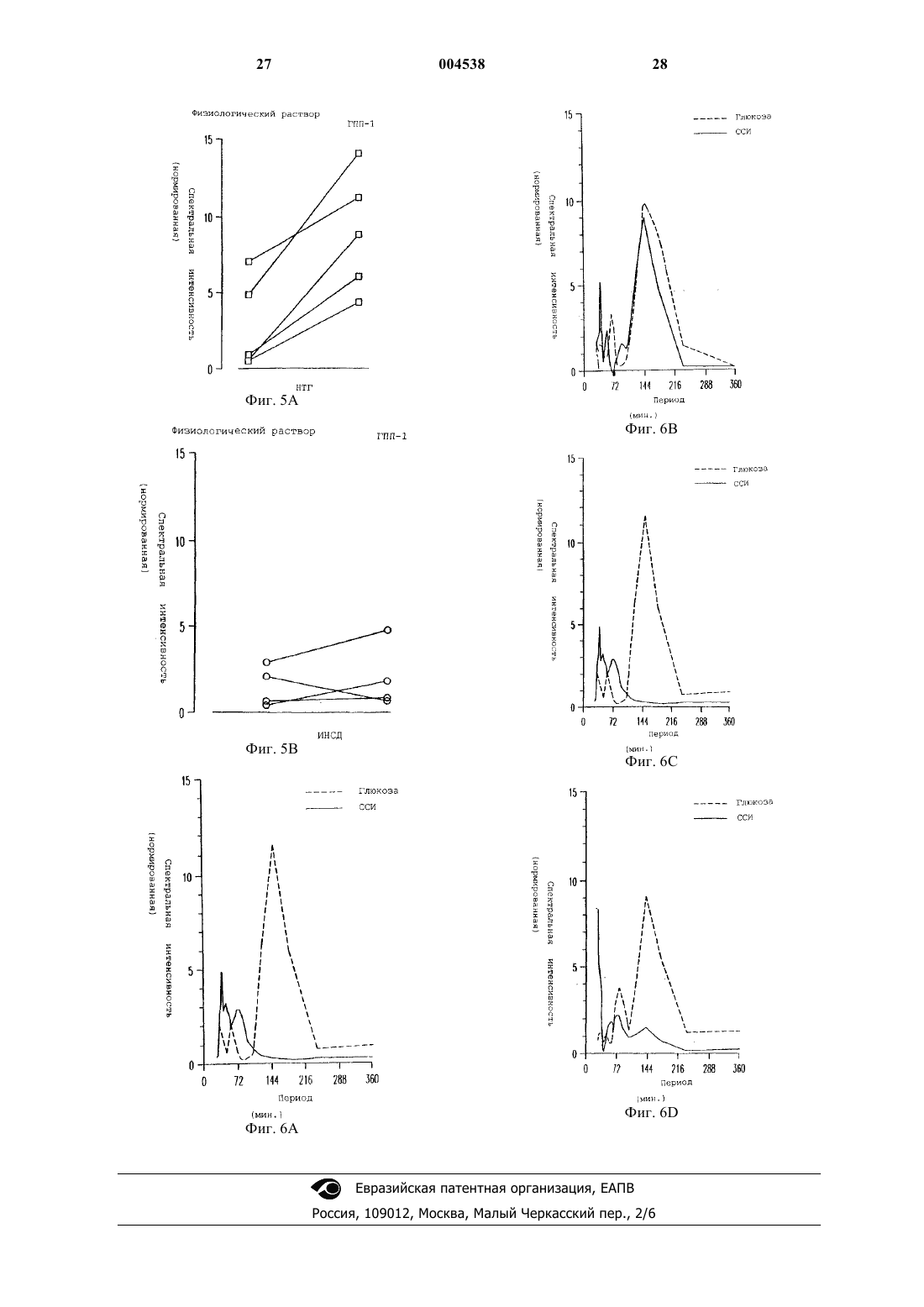
1 Данная заявка является частичным продолжением и претендует на право преимущества даты подачи предварительной заявки США 60/089044, поданной 12 июня 1998. Нарушение толерантности к глюкозе широко распространено среди населения США. Распространенность нарушения толерантности к глюкозе возрастает с 11% среди общего числа населения в возрасте 20-74 лет до 24% среди общего числа населения 40-75 летнего возраста с наследственной предрасположенностью к диабету и массой тела больше, чем 120% от нормальной. Для субъектов с нарушением толерантности к глюкозе существует повышенный риск развития сердечнососудистого заболевания, а также инсулиннезависимого сахарного диабета (ИНСД, NIDDM), известного также как диабет типа 2. Нарушение толерантности к глюкозе(НТГ) характеризуется ранними едва различимыми нарушениями функции -клеток поджелудочной железы, сопровождаемой инсулинорезистентностью. Эти ранние нарушения включают в себя нарушение способности -клеток воспринимать и отвечать на небольшие изменения концентраций глюкозы в плазме соответствующими уровнями секреции инсулина, и умеренный сдвиг вправо на кривой дозовой зависимости ответа на глюкозу секрецией инсулина. Способность -клеток воспринимать глюкозу и быстро отвечать секрецией инсулина теряется в начале развития НТГ, когда 2-часовые уровни глюкозы повышаются минимально. Ухудшение функции контроля за глюкозой при НТГ со временем преимущественно обусловлено прогрессирующим ухудшением функции -клеток. Это ведет во многих случаях к ухудшению состояний гиперинсулинемии, ожирения, и сердечнососудистых заболеваний, иногда известных как Синдром X. Во многих случаях прогрессирование состояний НТГ приводит к окончательной потере функции контроля за глюкозой и губительному наступлению ИНСД. Как указывалось, состояние НТГ влечет за собой серьезный риск для здоровья. Пациент с НТГ часто тучен и имеет высокий уровень инсулина в плазме, который зачастую является токсичным. Эти высокие уровни инсулина обычно являются результатом непрерывно возрастаемой неспособности мышцы, другой ткани и жировых клеток утилизовывать инсулин,осуществляя усваивание глюкозы из плазмы крови. Состояние НТГ создает повышенный риск для развития целого ряда сердечнососудистых заболеваний. Глюкагоноподобный пептид-1 (ГПП-1,GLP-1), природный тонкокишечный пептид,секретируется L-клетками кишечника и действует как гормон внутренней секреции (инкретин), стимулируя панкреатические -клетки секретировать инсулин глюкозозависимым спо 004538 2 собом. Его терапевтический потенциал при ИНСД был продемонстрирован ранее, в том смысле, что экзогенное вливание фармакологических доз ГПП-1 обычно понижало уровни глюкозы в плазме. Однако ГПП-1 существенно не улучшал функцию -клеток при ИНСД. Nathan DM, Schreiber E, Fogel Н, Mojsov S, Habenersubjects with NIDDM, Diabetologia 40:205-211,1997. Состояние НТГ в настоящее время не поддается излечению. Однако оно является распознаваемым состоянием болезни, связанным с серьезным риском для здоровья. Вообще состояние НТГ прогрессивно ухудшается в терминах проявления своих симптомов и часто ведет к потере регулирования глюкозы в плазме, что и составляет диабет типа 2. Существует потребность в лечении указанного состояния. Многочисленные исследования на протяжении последних нескольких лет показали, что применение ГПП-1 в случаях ИНСД понижает уровни глюкозы и инсулина в крови и, следовательно, должно представлять собой многообещающую терапию для этого заболевания. Однако на сегодняшний день не существует исследований, которые показали бы, что ГПП-1 обладает потенциальной возможностью исправить потерю способности -клеток к восприятию и быстрому ответу секрецией инсулина, когда содержание глюкозы в крови возрастает. Это то ухудшение в способности отвечать и тесно связывать чувствительность к увеличению уровней глюкозы в крови с секрецией инсулина клетками, которое является основной причиной состояния НТГ. В предыдущих исследованиях применение ГПП-1 субъектам с ИНСД продемонстрировало способность нормализовать уро 3 вень глюкозы в плазме натощак и стимулировать общую секрецию инсулина -клетками. Однако ГПП-1, вливаемый накануне вечером субъектам с ИНСД, не улучшал реакции на глюкозу при приеме пищи на следующий день. В тех случаях когда ГПП-1 вливали в течение 19 ч, накануне вечером и во время трех стандартных приемов пищи субъектам с ИНСД, уровни глюкозы в плазме понижались, но нарушенная,происходящая после приема пищи функция клеток улучшалась лишь слегка. Ответы -клеток на пролонгированное вливание ГПП-1 субъектам с НТГ ранее не изучались и, поскольку не имелось никакого указания на то, что результат будет отличаться от вливаний ГПП-1 субъектам с ИНСД, до сих пор детальных исследований действия ГПП-1 на ответы -клеток на небольшие увеличения и уменьшения концентраций глюкозы в плазме не проводилось. В соответствии с этим, существует потребность в способе подавления развития НТГ и восстановления нормального метаболизма глюкозы. Поэтому целью настоящего изобретения является разработка способа восстановления или улучшения функции и чувствительности клеток, и тем самым особенностей секреции инсулина, в ответ на уровни глюкозы в плазме у организма-хозяина, имеющего нарушение толерантности к глюкозе. Другой целью изобретения является разработка способа замедления или предотвращения ухудшения функции -клеток, которое является ответственным за прогрессирование нарушения толерантности к глюкозе и потерю контроля над глюкозой в плазме, что характеризует возникновение ИНСД. Следующая цель изобретения состоит в уменьшении интенсивности действия НТГ на сердечно-сосудистые заболевания, и тем самым в снижении риска сердечно-сосудистого заболевания и внезапного приступа. Способ осуществления этих и других целей становится очевидным из нижеследующего детального описания. Изобретателями было обнаружено, что применение ГПП-1 субъектами с нарушением толерантности к глюкозе восстанавливает четко скоординированный ответ секреции инсулина на увеличение уровней глюкозы в плазме, тем самым восстанавливая особенности ответа секреции инсулина -клетками на увеличение уровня глюкозы в плазме, являющееся характерным для нормальных субъектов без НТГ. Таким образом настоящее изобретение касается способа лечения организма-хозяина,имеющего нарушенную толерантность к глюкозе и инсулинорезистентность, с помощью ГПП 1 в количестве, эффективном для восстановления, улучшения или нормализации чувстви 004538 4 тельности и функции -клеток и особенностей секреции инсулина -клетками у этого организма-хозяина. При выполнении описанных здесь примеров изобретателями неожиданно было обнаружено, что применение ГПП-1 субъектами с НТГ, в отличие от беспорядочного и нескоординированного ответа инсулина, типичного для субъектов с НТГ, драматически восстанавливает чувствительную, быструю и скоординированную секрецию инсулина -клетками в ответ на дискретное пульсирующее увеличение глюкозы в плазме, подобное картине секреции инсулина,обнаруживаемой у нормальных пациентов. Краткое описание рисунков На фиг. 1 показаны ответы глюкозы, инсулина и ГПП-1 на оральное введение 75 мг глюкозы пяти субъектам с нарушением толерантности к глюкозе (НТГ) и пяти пациентам с инсулино-независимым сахарным диабетом (ИНСД). На фиг. 1 А показан средний ответ глюкозы. На фиг. 1 В показан ответ инсулина. На фиг. 1 С показывает ответ ГПП-1. На фиг. 2 представлено сравнение средних скоростей секреции инсулина (ССИ, ISR) и средних концентраций глюкозы для каждого субъекта во время вливания глюкозы с вливанием физиологического раствора (О) или вливанием ГПП-1 . На фиг. 2 А приведено сравнение для субъектов с НТГ. На фиг. 2 В приведено сравнение для субъектов с ИНСД. На фиг. 3 представлены профили глюкозы,скоростей секреции инсулина (ССИ, ISR) и концентраций инсулина для двух субъектов с НТГ,субъектов D01 и D02. На фиг. 3 А и 3 С показаны ответы на вливание физиологического раствора. На фиг. 3 В и 3D приведены ответы на вливание ГПП-1. На фиг. 4 представлено сравнение уровней глюкозы, скоростей секреции инсулина (ССИ,ISR) и уровней инсулина для двух субъектов с ИНСД, субъектов D07 и D09. На фиг. 4 А и 4 С показаны профили во время вливания физиологического раствора. На фиг. 4 В и 4D - профили во время вливания ГПП-1. На фиг. 5 представлено сравнение спектральных анализов секреции инсулина у субъектов во время вливаний физиологического раствора и ГПП-1. Результаты, показанные слева(5 А), соответствуют субъектам с НТГ. Результаты справа (5 В) соответствуют таковым у субъектов с ИНСД. На фиг. 6 представлено сравнение нормированной спектральной интенсивности во время вливания физиологического раствора и во время вливания ГПП-1. На фиг. 6 А показано сравнение нормированной спектральной интенсивности во время вливания физиологического раствора и вливания ГПП-1 у субъекта с НТГ(D02). На фиг. 6 В показано сравнение нормированной спектральной интенсивности во время 5 вливания физиологического раствора и вливания ГПП-1 у субъекта с ИНСД (D07). Изобретателями обнаружено, что введение ГПП-1 субъектам с нарушением толерантности к глюкозе (НТГ, IGT) восстанавливает или улучшает функцию -клеток поджелудочной железы и способность -клеток быстро отвечать секрецией инсулина координированным способом в ответ на небольшие увеличения или изменения в концентрациях глюкозы в плазме, т.е. пульсирующую секрецию инсулина, подобно картине секреции инсулина, обнаруживаемой у субъектов без НТГ. Эта картина секреции инсулина не восстанавливается у субъектов, у которых уже обнаружен ИНСД, характеризующийся потерей контроля над глюкозой в плазме. Функцию -клеток количественно определяют посредством нормированной спектральной интенсивности. Спектральная интенсивность является мерой функции -клеток, которая не зависит от корректировки чувствительности инсулина. Изобретателями было установлено,что у субъектов с НТГ пептид ГПП-1 улучшает спектральную интенсивность в нормальном диапазоне. Профили спектральной интенсивности указывают на то, что вовлечение или строгая координация уровней глюкозы в плазме и колебаний секреции инсулина восстанавливается до нормальных уровней у субъектов с НТГ после введения ГПП-1. Это улучшение динамики колебаний секреции инсулина является важным для поддержания нормального гомеостаза глюкозы. Например, было установлено, что вливание инсулина, имитирующее колебания в пределах периода в 120 мин, более эффективно для понижения концентраций глюкозы в плазме,чем постоянные вливания инсулина (27). Настоящее изобретение обеспечивает композицию, включающую в себя соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и является эффективной для улучшения у субъектов с НТГ способности-клеток воспринимать небольшие изменения в концентрациях глюкозы в плазме и отвечать на них. В одном варианте воплощения изобретения рецептор-связывающим соединением является глюкагоноподобный пептид-1. В другом варианте воплощения рецептор-связывающее соединение представляет собой вариабельный пептид,в котором комбинация замещений, делеций и вариантов отличается не более, чем на десять аминокислот от глюкагоноподобного пептида-1. Рецептор-связывающее соединение может дополнительно включать в себя полинуклеотид или средство, которое активирует высвобождение ГПП-1, молекулу, которая активирует рецептор ГПП-1, или соединение, связывающее рецептор ГПП-1, включая химически сконструированную молекулу, аналоги пептида или агонисты ГПП-1. 6 Изобретателями обнаружено, что введение человеческого ГПП-1 повышает или восстанавливает вовлечение ответов секреции инсулина на небольшие изменения или увеличения уровня глюкозы в плазме. В соответствии с этим,композиция настоящего изобретения полезна в терапевтическом лечении для нормализации нарушения толерантности к глюкозе. Изобретателями здесь установлено, что вливание низкой дозы ГПП-1 может улучшать функцию -клеток, заключающуюся в секретировании инсулина в ответ на повышение уровней глюкозы в плазме. Таким образом, ГПП-1 можно также использовать для улучшения сохранения функции -клеток у субъектов с НТГ. Кроме того, применение ГПП-1 регулирует или нормализует картины секреции инсулина, что приводит к общему понижению уровня инсулина в плазме при НТГ. Эта нормализация, в свою очередь, ослабляет состояние инсулинорезистентности. Термин "ГПП-1, GLP-1", или глюкагоноподобный пептид-1, включает в себя ГПП-1 миметики и, как используется в контексте настоящего изобретения, может включать в себя глюкагоноподобные пептиды и родственные пептиды и аналоги глюкагоноподобного пептида-1,которые связываются с белком рецептора глюкагоноподобного пептида-1 (ГПП-1), таким как белок рецептора амида ГПП-1(7-36), и имеет соответствующее биологическое действие на секрецию инсулина как амида ГПП-1 (7-36),который является природной биологически активной формой ГПП-1. См. Goke, В and Byrne,M, Diabetic Medicine. 1996, 13:854-860. Рецепторы ГПП-1 представляют собой белки клеточной поверхности, найденные, например, на продуцирующих инсулин панкреатических -клетках. К глюкагоноподобным пептидам и аналогам будут причислены разновидности, имеющие инсулинотропную активность, являющиеся агонистами, т.е., активаторами, молекулы ГПП-1 рецептора, и активность вторичного мессенджера, кроме прочего, на инсулино-продуцирующих -клетках. Агонисты глюкагоноподобного пептида, которые проявляют активность через этот рецептор, описаны в следующих публикациях: ЕП 0708179 А 2; Hjorth, S.A. et al., J.International Diabetes Federation Congress Abstracts, Diabetologia Supplement (1997; Irwin,D.M. et al., Proc. Natl. Acad. Sci. USA. 94:79157920 (1997); Mosjov, S. Int. J. Peptide Protein Res. 40:333-343 (1992). Глюкагоноподобные молекулы включают в себя полинуклеотиды, которые экспрессируют агонисты ГПП-1, т.е. активаторы 7 молекулы ГПП-1 рецептора и активность ее вторичного мессенджера, обнаруженные, помимо прочего, на продуцирующих инсулин клетках. ГПП-1 миметики, которые также являются агонистами -клеток, включают, например, химические соединения, конкретно предназначенные для активации рецептора ГПП-1. Антагонисты глюкагоноподобного пептида-1 также известны - например, см. Watanabe, Y. et al.,J. Endocrlnol. 140(1):45-52 (1994), и включают в себя амин эксендина (9-39), аналог эксендина,который является потенциальным антагонистом рецепторов ГПП-1(см.,например,WО 97/46584). В последних публикациях описаны ГПП-1 окуня Black Widow и ГПП-1 Ser2,смотри G.G. Holz, J.F. Hakner/Comparative Biochemistry and Physiology, Part В 121 (1998) 177184 и Ritzel, et al., A synthetic glucagon-like peptide-1 analog with improved plasma stability, J.Endocrinol 1998 Oct.; 159(1):93-102. Другие варианты воплощения изобретения включают в себя химически синтезированные глюкагоноподобные полипептиды, а также любые полипептиды или их фрагменты, которые являются в основном, гомологичными. Термин"в основном гомологичный", который может относиться как к последовательности нуклеиновых кислот, так и к аминокислотным последовательностям, означает, что данная конкретная последовательность, например, мутантная последовательность, отличается от исходной последовательности одной или несколькими заменами, делециями или добавками, результирующее влияние которых не приводит к неблагоприятному функциональному различию между исходной и данной последовательностями. Для целей настоящего изобретения последовательности, имеющие более, чем 50 процентную гомологию, и предпочтительно более, чем 90 процентную гомологию, имеющие эквивалентную биологическую активность в усилении ответов-клеток на уровень глюкозы в плазме и эквивалентные характеристики экспрессии, считаются в основном гомологичными. Для целей определения гомологии отсечением зрелой последовательности следует пренебречь. Последовательности, имеющие меньшие степени гомологии,сравнимую биологическую активность и эквивалентные характеристики экспрессии, считают эквивалентами. ГПП-пептиды и глюкагон млекопитающих кодируются одним и тем же геном. В подвздошной кишке фенотип процессируется в два основных пептидных гормона класса ГПП, а именно ГПП-1 и ГПП-2. Известны четыре ГПП 1 родственных пептида, которые процессируются из фенотипических пептидов. ГПП-1 (1-37) имеет последовательность His Asp Glu Phe Glu 8 ГПП-1 (1-37) амидируется посредством посттрансляционного процессинга с получением ГПП-1 (1-36) NH2, который имеет последовательность His Asp Glu Phe Glu Arg His Ala GluLys Gly Arg (NH2) (SEQ. ID NO:2); или подвергается ферментативной обработке с получением ГПП-1 (7-37), который имеет последовательность His Ala Glu Gly Thr Phe Thr Ser Asp ValNO:3). ГПП-1 (7-37) также может быть амидирован с получением амида ГПП-1 (7-36), который является природной формой молекулы ГПП-1, и который имеет последовательностьTrp Leu Val Lys Gly Arg (NH2) (SEQ. ID NO:4) и в природной форме молекулы ГПП-1. Кишечные L-клетки секретируют ГПП-1(SEQ.ID NO:4) в соотношении 1 к 5, соответственно. Эти укороченные формы ГПП-1 имеют короткое время полу жизни in situ, т.е. меньше 10 мин, и инактивируются аминопептидазой IV с образованием Glu Gly Thr Phe Thr Ser Asp ValLeu Val Lys Gly Arg (NH2) (SEQ. ID NO:6) воздействуют на продуцирование печенью глюкозы, но не стимулируют продуцирование или высвобождение инсулина из поджелудочной железы. Существует шесть пептидов в ядах ящерицы-ядозуба, которые гомологичны ГПП-1. Их последовательности сравниваются с последовательностью ГПП-1 в табл. 1. Таблица 1h=Q8, Q9 Гeлoдepмин(SEQ.ID No:13). Основные гомологии, как указано выделенными областями в табл. 1, представляют собой пептиды с и h, полученные из b и g, соответственно. Все 6 встречающихся в природе пептидов (а, b, d, е, f и g) являются гомологичными в положениях 1, 7, 11 и 18. ГПП-1 и эксендины 3 и 4 (a, b и d), кроме того, гомологичны по положениям 4, 5, 6, 8, 9, 15, 22, 23, 25, 26 и 29. A, S и G в положении 2 структурно подобны. Остатки D и Е (Asp и Glu) в положении 3 структурно подобны. F(Phe) и I(Ile) в положениях 22 и 23 структурно подобны Y(Tyr) и L(Leu),соответственно. Аналогично, L и I в положении 26 структурно эквивалентны. Таким образом, из 30 остатков ГПП-1, эксендины 3 и 4 идентичны по 15 положениям и эквивалентны по 5 добавочным положениям. Положения, где очевидны радикальные структурные изменения, соответствующие остаткам 16, 17, 19, 21, 24, 27, 28 и 30. Кроме того, эксендины имеют 9 добавочных остатков на карбоксильном конце. ГПП-1-подобные пептиды можно получить методом твердофазного химического пептидного синтеза. Кроме того, ГПП-1 можно получить путем обычных рекомбинантных методов, используя стандартные методики, описанные, например, в публикации Sambrook and Maniaitis. Используемый здесь термин "рекомбинантный" означает, что белок получают из рекомбинантных (например, микробных или относящихся к млекопитающему) систем экспрессии, которые генетически модифицированы таким образом, чтобы содержать ген экспрессии ГПП-1 или его биологически активных аналогов. ГПП-1-подобные пептиды могут быть выделены и очищены от рекомбинантных клеточных культур методами, которые включают в себя но, не ограничиваясь ими, осаждение сульфатом аммония или этанолом, кислотную экстракцию, анионо- или катионообменную хроматографию, фосфоцеллюлозную хроматографию, гидрофобную хроматографию, аффинную хроматографию, гидроксилапатитную хроматографию и лектиновую хроматографию. На конечных стадиях очистки может быть использована жидкостная хроматография высокого разрешения (ВЭЖХ). Полипептиды согласно изобретению могут представлять собой природный очищенный продукт или продукт химического синтеза, или они могут быть получены рекомбинантными методами из прокариотических или эукариоти 004538 10 ческих организмов-хозяев (например, клеток бактерий, дрожжей, высших растений, насекомых и млекопитающих в культуре или in viva). В зависимости от организма-хозяина, используемого в рекомбинантном способе получения,полипептиды настоящего изобретения обычно являются не-гликозилированными, но могут быть и гликозилированными. Активность ГПП-1 может быть определена стандартными способами, обычно методами скрининга рецептор-связывающей активности,которые включают в себя получение соответствующих клеток, которые экспрессируют на своей поверхности рецептор ГПП-1, например, клеточные линии инсулиномы, такие как клетки(1992) и ЕП 0708170 А 2. Помимо измерения специфического связывания меченого вещества с мембраной, использующего методы радиоиммунного анализа, можно также измерять активность цАМФ (сАМP) или глюкозо-зависимое продуцирование инсулина. В одном способе полинуклеотид, кодирующий рецептор настоящего изобретения, используют для трансфекции клеток, которые тем самым экспрессируют белок GLP-1 рецептора. Таким образом, например,эти способы можно использовать для скрининга агониста рецептора, приводя такие клетки в контакт с соединениями, подлежащими скринингу, и определяя, генерируют ли такие соединения сигнал, т.е. активируют ли рецептор. Поликлональные и моноклональные антитела можно использовать, чтобы обнаружить,очистить и идентифицировать ГПП-1 подобные пептиды, используемые в способах, описанных здесь. Антитела, такие как ABGA1178, обнаруживают неповрежденный нерасщепленный ГПП-1 (1-37) или усеченный по N-концу ГПП-1(7-37) или (7-36) амид. Другие антитела обнаруживают С-конец молекулы-предшественникаспособ, который позволяет вычитанием вычислить количество биологически активного усеченного пептида, т.е. ГПП-1 (7-37) или (7-36) амида (Orskov et al. Diabetes, 1993, 42:658-661;Orskov et al. J. Clin. Invest. 1991, 87:415-423). Другие методы скрининга включают в себя использование клеток, которые экспрессируют рецептор ГПП-1, например, трансфицированные клетки СНО, в системе, регистрирующей внеклеточный рН или ионные изменения, вызванные активацией рецептора. Например, потенциальные агонисты можно подвергнуть контакту с клеткой, которая экспрессирует белковый рецептор ГПП-1, и ответ вторичного мессенджера,например, сигнальную трансдукцию или ионные или рН изменения, можно измерить, чтобы определить, является ли потенциальный агонист эффективным. Белки, связывающие рецептор глюкагоноподобного пептида-1, настоящего изобретения можно использовать в комбинации с подходящим фармацевтическим носителем. Такие композиции включают в себя терание. Однако ГПП-1 может поставляться путем певтически эффективное количество полипепподкожного, внутримышечного, внутрибрютида и фармацевтически приемлемый носитель шинного, инъецируемого депо с пролонгироили наполнитель. Такой носитель включает в ванным высвобождением, глубоким вдуванием себя, не ограничиваясь им, физиологический через дыхательные пути (легкие) с пролонгирораствор, забуференный (фосфатом) физиологиванным высвобождением, а также внутривенческий раствор, декстрозу, воду, глицерин, этиным, щечным способом введения, с помощью ловый спирт, лактозу, фосфат, маннит, аргинин,пластыря или других способов доставки. трегалозу и их комбинации. Составы должны Эффективное лечение НТГ также уменьсоответствовать способу введения и легко коншает риск сердечно-сосудистых и церебровастатироваться специалистами в данной области скулярных заболеваний. Поэтому его можно техники. Кроме того, для того, чтобы повысить рассматривать как профилактику для пациентов или пролонгировать биологическую активность с известным высоким риском такого рода слупептида, ГПП-1-пептид можно использовать в чаев. комбинации с известными в данной области Нижеследующие примеры более подробно техники средствами, которые увеличивают вреиллюстрируют аспект настоящего изобретения. мя полужизни пептида in vivo. Например, молеОднако эти примеры никоим образом не следует кулу или химический фрагмент можно коварассматривать как ограничение особенностей лентно связать с композицией настоящего изоили существа раскрытия настоящего изобретебретения перед ее применением. Альтернативния для иллюстраций его воплощения, не выхоно, усиливающее средство можно вводить однодящих за рамки объема формулы изобретения. временно с композицией. Далее, средство может Примеры включать в себя молекулу, которая, ингибирует Исследования, описанные здесь, выполняферментативную деградацию ГПП-1 подобных ли на 10 субъектах, которых разделили на две пептидов и может применяться одновременно группы. На основании реакции глюкозы в плазили после введения композиции с ГПП-1 пептиме на оральный глюкозотолерантный тест, исдом. Такую молекулу можно вводить, например,пользуя критерии Всемирной Организации перорально или при помощи инъекции. Здравоохранения (21), чтобы определить стеГПП-1 можно применять внутривенно или пень непереносимости глюкозы. Пять субъектов подкожно и можно вводить непрерывно или имели НТГ, и пять субъектов имели ИНСД. Род,инъекцией ударной дозы. Результирующее привозраст, индекс массы тела (ИМТ, BMI), баменение может быть осуществлено совместно зальные уровни глюкозы натощак, 2-х часовая до или после инъекции или вливания глюкозы. глюкоза, инсулин натощак, и HBA1c для каждоМожно использовать нижеследующие дозы: для го субъекта представлены в табл. 2. Диабетики непрерывного вливания внутривенным путем были старше, чем субъекты с НТГ, но группы(в/в) от 0,1 пмоль/кг/мин до 10 пмоль/кг/ мин и были подобраны по ИМТ. Средние уровни глюподкожно (п/к) от 0,1 пмоль/кг/мин до 75 козы натощак и концентрации гликозилированпмоль/кг/мин, и для разовой инъекции (ударная ного гемоглобина были ниже в группе НТГ по доза) в/в от 0,005 нмоль/кг до 20 нмоль/кг и п/к сравнению с субъектами в группе ИНСД. Уровот 0,1 нмоль/кг до 100 нмоль/кг. ни инсулина натощак не различались между Предпочтительным способом введения группами. пептида ГПП-1 является непрерывное применеТаблица 2. Базовые клинические параметры субъектов с НТГ и ИНСД Инд. Пол Возраст ИМТ Глюкоза на- 2 ч Глюкоза Инсулин натоГликотощак (мМ) 13 Уровень глюкозы в плазме измеряли глюкозооксидазным методом (YSI, 1500 G, SchlagCompany, Bergisch-Gladbach, Germany). Коэффициент вариации этого метода составляет 2%. Инсулин в плазме измеряли Abbott IMx Microparticle иммуноферментным анализом. Средний коэффициент вариации внутри серий испытаний составлял 5%. С-пептид в плазме измеряли, как ранее описано в (22), Faber OK, Binder С, Markussen, J, Heding LG, Naithani VK, Kuzuya H,Blix P, Horwitz DL, Rubenstein AH. Characterization of seven c-peptide antisera. Diabetes 27, Suppl 1:170-177, 1978. Нижний предел чувствительности анализа составлял 0,02 пмоль/мл, и коэффициент вариации внутри серий испытаний составлял в среднем 6%. Глюкагон измеряли, используя коммерчески доступный набор для радиоиммуноанализа (Biermann, Bad Nauheim,Germany), и коэффициент вариации внутри серий испытаний составлял в среднем 8%. ИРГПП-1 (IR-GLP) измеряли, используя специфическое поликлональное антитело GA 1178 (Affinity Research, Nottingham, UK) (23). Оно имело 100% реактивность в отношении ГПП-1(136)амида и укороченного ГПП-1(7-36)амида. Иммунореактивное ГПП-1 подобное вещество экстрагировали из образцов плазмы на кассетах С-18, используя ацетонитрил для элюирования образцов. Предел детектирования анализа составлял 2 фмоль/пробирку. Антисыворотка перекрестно не реагировала с ГПП, панкреатическим глюкагоном, глицентином, оксинтомодулином или ГПП-2. Коэффициенты вариации внутри и между сериями испытаний составляли 3,4% и 10,4%, соответственно. Все результаты выражены как среднее значениеССО. Анализ данных выполнен с использованием статистической системы анализа(SAS Version 6 Edition, for Personal Computers,SAS Institute, Inc., Cary, NC). Значимость различий в пределах индивидуума, вызываемых вливанием ГПП-1, определяют, используя парные tтесты. Полагают, что различия существенны,если Р 0,05. Использовались стандартные кинетические параметры для клиренса С-пептида, отрегулированные для возраста, пола и площади поверхности тела (24), Van Cauter E, Mestrez, F, Sturis J,Polonsky KS. Estimation insulin secretion ratesand standard kinetic parameters for C-peptide. Diabetes 41:365-377, 1992. Эти параметры использовали, чтобы получить, через каждый 15 минутный интервал между отбором проб крови,ССИ из концентраций С-пептида в плазме деконволюцией, как описано ранее (25,26). Диабетиков лечили только диетой за исключением одного субъекта D07, которого ранее лечили пероральным гипогликемическим средством; это лечение было прекращено за 4 недели до исследования. Ни один из диабетических пациентов никогда не получал инсулин. 14 Все субъекты содержались на поддерживающей вес диете, содержащей по меньшей мере 200 г углеводов в день в течение двух недель до исследования. Каждого субъекта исследовали по трем отдельным поводам. Все исследования выполняли после 12-часового голодания накануне, начиная в 0700, если не оговорено особо, в лежачем положении исследуемого. Внутривенный катетер помещали в каждое предплечье, один для осуществления отбора крови и один для введения глюкозы и ГПП-1, когда требуется. Во всех экспериментах рука с катетером для отбора пробы содержалась в согревающем защитном слое,чтобы гарантировать артериализацию венозной пробы. В нижеследующих примерах ГПП-1 вводят субъектам в форме амида ГПП-1(7-36). Пример 2. Оральный глюкозотолерантный тест. Пробы крови отбирались для измерения глюкозы, С-пептида, инсулина, глюкагона и ГПП-1 через 30 минутные интервалы в течение 120 минут после глотания 75 г глюкозы (Boehringer, Mannheim, Mannheim, Germany). Инкрементные площади под кривой (ППК, AUC) от 0 до 120 мин подсчитывают для глюкозы,инсулина, С-пептида, глюкагона и ГПП-1. Концентрации глюкозы используют для определения степени непереносимости глюкозы в соответствии с критериями Всемирной Организации Здравоохранения. Ответ групп с НТГ и ИНСД на пероральную глюкозу представлен в табл. 3. Реакция субъектов по глюкозе, инсулину и ГПП-1 в ответ на 75 мг глюкозы представлены на фиг. 1. ППК (AUC) для глюкозы от 0 до 120 мин был меньше в группе с НТГ, но ППК (AUC) для инсулина, С-пептида, глюкагона, и GLP-1 не отличались. Таблица 3. Ответ на пероральную глюкозу 2 ч ППК НТГ n=5 ИНСД n=5 Глюкоза (мМ.мин/л) 129041 162876 Инсулин (пмоль.мин/л) 53,75010,648 26,08310,047 С-пептид (пмоль.мин/л) 29340 18048 Глюкагон (нмоль.мин/л) 81301324 6858920 ГПП-1 (пмоль.мин/л) 805141 983111 Р 0,05 для НТГ против ИНСД После построения кривой зависимости средних ССИ от средних уровней глюкозы наблюдали, что ГПП-1 вызывает существенное снижение уровней глюкозы без значительного изменения средних скоростей секреции инсулина (фиг. 2). Пример 3. (Применение вливания глюкозы в колебательной динамике). Периферийное введение глюкозы в колебательной динамике приводит к регулярным колебаниям глюкозы в плазме. У нормальных субъектов -клетка способна обнаруживать и отвечать на периодические увеличения и уменьшения в уровне глюкозы параллельными изменениями в секреции инсулина. Это упорядочение колебаний секреции инсулина по от 15 собом, и ГПП-1 вливают при постоянной скороношению к колебаниям глюкозы называют вости 0,4 пмоль/кг/мин в течение полных 12 ч. влечением. Недостаток вовлечения глюкозы является ранним проявлением дисфункции Каждое исследование состоит из начального 2 часового периода (0700-0900), который позвоклеток у индивидуумов с НТГ и умеренным ляет достичь стабильного состояния. За этим ИНСД. следует период из 10 ч (0900-1900), в течение Нами использован протокол вливания которого отбирают пробы крови через 15 глюкозы в колебательной динамике с низкими минутные интервалы на глюкозу, инсулин, Сдозами, так как это является очень чувствительпептид, и глюкагон и через 60-минутные интерным тестом способности -клеток воспринимать валы - на ГПП-1. и отвечать на небольшие изменения в конценСредние уровни глюкозы оказались значитрациях глюкозы в плазме. Он тестирует целотельно ниже в обеих группах во время вливания стность контура обратной связи, связывающего ГПП-1 по сравнению с физиологическим расглюкозу и секрецию инсулина. Нормальный твором, со средним снижением 2,40,6 мМ у ответ требует интактной чувствительности к НТГ субъектов (Р 0,02) и 5,20,5 мМ у диабевосприятию глюкозы. тиков (Р 0,0005). Несмотря на это существенЧтобы определить, способны ли -клетки ное понижение концентрации глюкозы в плазме,обнаруживать и отвечать на колебания глюкозы,средние ССИ в обеих группах существенно не глюкозу вливают в колебательной динамике с отличались во время вливания ГПП-1 по сравнебольшим объемом физиологического раствонению с вливанием физиологического раствора ра в течение 12 ч. Амплитуда колебаний введе(табл. 4). ния была на 33% выше и ниже средней скорости 4 мг/кг/мин, и их периодичность составляла 144 мин. Чтобы устанавливать действие ГПП-1 на способность -клеток отвечать на колебания глюкозы, глюкозу вливают тем же самым споТаблица 4. Средние ответы глюкозы и ССИ на 12-часовое вливание физиологического раствора или ГПП-1 Средняя глюкоза 12 средняя глюкоза 12 Средняя ССИ 12 ч Средняя ССИ 12 ч ИД ч физиологический ч ГПП-1 физиолсгический ГПП-1 раствор раствор НТГD10 15,05 9,90 346,2 448,9 Среднее ССО 14,591,3 9,400,9 440,280,1 508 53,4 Р 0,05 при парном t тесте относится к сравнению между вливанием физиологического раствора и ГПП-1. Средние уровни инсулина также поддерживались во время вливания ГПП-1 по сравнению с физиологическим раствором, с увеличением на 10290 пмоль/л; Р=0,32 у субъектов с НТГ и с увеличением 712 пмоль/л; Р=0,56 у субъектов с ИНСД. Средние уровни глюкагона также не отличались во время вливания ГПП-1 по сравнению с физиологическим раствором(39,35,4 пг/мл против 39,4 5,9 пг/мл; Р=0,94) у субъектов с НТГ и (46,43,2 пг/мл против 42,85,4 пг/мл; Р=0,4) у субъектов с ИНСД. Уровни ГПП-1, достигнутые во время вливания ГПП-1, составляли 15,64,6 пмоль/л по сравнению с 2/00,8 пмоль/л во время вливания физиологического раствора (Р 0,001). Эти уровни соответствуют физиологическим уровням, возникающим после приема пищи. Пример 4. (Взаимосвязь между глюкозой и ССИ у индивидуумов с НТГ). У нормальных субъектов каждый импульс глюкозы тесно связан с импульсом ССИ. Ранее было показано, что эта связь нарушается у субъектов с НТГ. Профили глюкозы и ССИ во время вливания глюкозы в колебательной динамике с физиологическим раствором для одного показательного субъекта с НТГ, D02, представлены на фиг. 3 А и 3 С. Эти результаты показывают, что у субъектов с НТГ во время вливания физиологи 17 ческого раствора имеет место потеря тесной взаимосвязи между глюкозой и ССИ с многочисленными независимыми от глюкозы колебаниями ССИ. В присутствии возникающих после приема пищи физиологических уровней ГПП-1(фиг. 3 В и 3D) картина ответов секреции инсулина на глюкозу улучшается у субъекта с НТГ,при этом за каждым импульсом глюкозы следует импульс ССИ. Следовательно, ГПП-1 улучшает способность -клетки отвечать на вливание экзогенной глюкозы у субъекта с НТГ. Пример 5. (Взаимосвязь между глюкозой и ССИ у индивидуумов с ИНСД). На фиг. 4 представлены профили глюкозы и ССИ для одного субъекта с ИНСД, D07. В противоположность субъектам с НТГ, несмотря на понижение концентраций глюкозы в плазме и поддержание ССИ, картина ответов секреции инсулина на глюкозу не улучшается во время вливания ГПП-1 (фиг. 4 В и 4D), причем многочисленные независимые от глюкозы колебания ССИ сохраняются. Профили глюкозы и ССИ во время вливания глюкозы в колебательной динамике с физиологическим раствором представлены на фиг. 4 А и 4 С. Пример 6. (Влияние ГПП-1 на спектральную интенсивность при НТГ и ИНСД). Чтобы определить, влечет ли за собой глюкоза секрецию инсулина у индивидуальных субъектов, временные профили секреции инсулина анализируют спектральным анализом. Анализ спектральной интенсивности используют для оценки присутствия тесной связи между колебаниями глюкозы и колебаниями ССИ. Этот метод оценивает регулярность секреторных колебаний инсулина при заранее заданной частоте. Спектральные пики соответствуют доминирующей периодичности, а высота пиков соответствует спектральной интенсивности. Каждый спектр нормируют, принимая общее отклонение каждой серии равным 100%, и выражают в виде нормированной спектральной интенсивности. Средняя нормированная спектральная интенсивность для глюкозы у субъектов с НТГ составляла 11,21,5 во время вливания физиологического раствора и 13,21,6 во время вливания ГПП-1 (Р=0,19), и у субъектов с ИНСД 6,51,8 во время вливания физиологического раствора и 9,80,7 во время вливания ГПП-1(Р=0,18). Фиг. 5 ясно демонстрирует, что вливание ГПП-1 субъектам с НТГ усиливает ответы секреции инсулина на колебания глюкозы в плазме, приводя к более высокой степени вовлечения секреции инсулина в ответ на глюкозу. Это действие определяют количественно, сравнивая нормированную спектральную интенсивность профилей секреции инсулина. Спектральная интенсивность для ССИ возрастает с 2,91,4 во время вливания физиологического раствора до 8,91,7 во время вливания ГПП-1; (Р 0,006) 18 и она не изменяется у субъектов с ИНСД (1,10,5 до 1,50,8; Р=0,6). Спектральный анализ колебательных профилей глюкозы подтверждает существование пиков в спектрах плазменной глюкозы на 144 минутах, соответствующих периоду вливания экзогенной глюкозы. Индивидуальные спектры интенсивности для глюкозы и ССИ для одного субъекта с НТГ (фиг. 6 А) и одного субъекта с ИНСД (фиг. 6 В) во время вливания физиологического раствора и во время вливания ГПП-1 представлены на фиг. 6. Они соответствуют данным, представленным на фиг. 3 С и 3D, и фиг. 4 А и 4 В. Спектральная интенсивность возрастает от 0,6 до 8,9 для субъекта с НТГ, и минимально изменяется от 0,28 до 1,51 для субъекта с ИНСД. Пики в спектрах плазменной глюкозы возникали на 144 мин. Во время вливания физиологического раствора доминирующий спектральный пик для ССИ не возникал на 144 минутах, а скорее был около 0,2. Спектральная интенсивность в случае вливания ГПП-1 была 1,5. Во время вливания физиологического раствора имело место недостаточное вовлечение(рис. 3 А), поскольку спектральная интенсивность для ССИ на 144 мин. составляла 0,6. Во время вливания ГПП-1 (рис. 3 В) периодичность доминирующего спектрального пика для ССИ возникала на 144 минутах, демонстрируя, что ГПП-1 вызывал вовлечение -клетки у этого субъекта. Среднее значение нормированной спектральной интенсивности у контрольных субъектов с определенным индексом веса (BMI 28,3) с нормальной толерантностью к глюкозе составляло 7,20,6(9). Результаты этого исследования показали,что непрерывное вливание физиологических,возникающих после приема пищи, уровней ГПП-1 снижает концентрации глюкозы в плазме и стимулирует секрецию инсулина у субъектов с НТГ и ИНСД. Наиболее важно то, что ГПП-1 восстанавливает способность -клетки воспринимать и отвечать на глюкозу в плазме у всех субъектов с НТГ (определено количественно посредством нормированной спектральной интенсивности), с переменным ответом у субъектов, у которых был диагностирован ИНСД. Возможные механизмы, благодаря которым с помощью ГПП-1 улучшалась функция клеток, включают в себя форсирование регулирования воспринимающих глюкозу элементов,устранение глюкотоксичности и улучшение инсулинорезистентности. ГПП-1 и глюкоза оказывают синергическое инсулинотропное действия на -клетки, включая стимулирование образования циклической АМФ (АМР), секрецию инсулина, биосинтез инсулина и экспрессию гена проинсулина. 19 Эти примеры демонстрируют, что непрерывное вливание физиологических уровней ГПП-1 понижает концентрации глюкозы в плазме и стимулирует секрецию инсулина у субъектов с НТГ и ИНСД. Наиболее важно то,что ГПП-1 восстанавливал способность клеток воспринимать и отвечать на небольшие изменения в концентрациях глюкозы в плазме у субъектов с НТГ, в то время как у субъектов с ИНСД это имело место с переменным успехом. У субъектов с НТГ было отмечено существенное увеличение спектральной интенсивности,меры функции -клеток, которая не зависит от коррекции изменений чувствительности инсулина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения человека с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение указанному человеку композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанный компонент в количестве, эффективном для увеличения чувствительности и ответа -клеток поджелудочной железы на изменения уровня глюкозы в плазме, что измеряется хронометрированием и количественным определением секреции инсулина в ответ на увеличения уровня глюкозы в плазме. 2. Способ по п.1, где рецепторсвязывающее соединение выбирают из (а) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида 1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками. 3. Способ по п.2, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1. 4. Способ по п.2, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1 (7-37), который имеет последовательность His Ala Glu Gly ThrArg Gly (SEQ. ID NO: 3). 5. Способ по п.2, где рецепторсвязывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36),который имеет последовательность His Ala GluLys Gly Arg (NH2) (SEQ. ID NO:4). 6. Способ по п.2, где рецепторсвязывающее соединение представляет собой вариантный пептид, в котором комбинация за 004538 20 мен, делеций и вставок в аминокислотной последовательности отличается не более чем на десять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1. 7. Способ по п.1, дополнительно предусматривающий введение средства, которое повышает время полужизни указанного соединения in vivo. 8. Способ по п.1, где рецепторсвязывающее соединение экспрессируется полинуклеотидом. 9. Способ по п.1, где рецепторсвязывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000. 10. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета,предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для увеличения регулярности инсулиновых ответов и их амплитуд в ответ на изменение содержания глюкозы в плазме. 11. Способ по п.10, где рецепторсвязывающее соединение выбирают из (а) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида 1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками. 12. Способ по п.11, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1. 13. Способ по п.11, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1 (7-37), который имеет последовательность His Ala Glu Gly ThrArg Gly (SEQ. ID NO:3). 14. Способ по п.11, где рецепторсвязывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36),который имеет последовательность His Ala GluLys Gly Arg (NH2) (SEQ. ID NO:4). 15. Способ по п.11, где рецепторсвязывающее соединение представляет собой вариантный пептид, в котором комбинация замен, делеций и вставок в аминокислотной последовательности отличается не более чем на десять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1. 21 16. Способ по п.10, где рецепторсвязывающее соединение экспрессируется полинуклеотидом. 17. Способ по п.10, где рецепторсвязывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000. 18. Способ по п.10, где путь введения выбирают из группы, состоящей из внутривенного,подкожного, внутримышечного, внутрибрюшинного, инъецируемого депо с пролонгированным высвобождением, глубокого вдувания через дыхательные пути (легкие) с пролонгированным высвобождением, щечного введения или доставки с помощью пластыря. 19. Способ по п.10, дополнительно предусматривающий введение средства, которое повышает время полужизни указанного рецепторсвязывающего соединения in vivo. 20. Способ по п.19, где указанное средство вводят одновременно с композицией. 21. Способ по п.19, где указанное средство коваленто связано с рецептор-связывающим соединением. 22. Способ по п.18, где внутривенное введение осуществляют в диапазоне доз примерно от 0,3 до 2,0 пмоль/кг в минуту. 23. Способ по п.18, где непрерывное подкожное введение осуществляют в диапазоне доз примерно от 1,0 до 20, 0 пмоль/кг в минуту. 24. Способ лечения человека с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, предусматривающий введение человеку композиции,содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для замедления или подавления потери контроля над глюкозой плазмы и развития инсулиннезависимого сахарного диабета. 25. Способ по п.24, где рецепторсвязывающее соединение выбирают из (а) пептида, который включает аминокислотную последовательность глюкагоноподобного пептида 1, и (b) вариантного пептида, включающего аминокислотную последовательность, которая отличается от последовательности глюкагоноподобного пептида-1 одним или несколькими заменами, делециями или вставками. 26. Способ по п.25, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1. 27. Способ по п.25, где рецепторсвязывающее соединение представляет собой глюкагоноподобный пептид-1 (7-37), который имеет последовательность His Ala Glu Gly Thr 22 28. Способ по п.25, где рецепторсвязывающее соединение представляет собой амид глюкагоноподобного пептида-1 (7-36),который имеет последовательность His Ala GluLys Gly Arg (NH2) (SEQ. ID NO:4). 29. Способ по п.25, где рецепторсвязывающее соединение представляет собой вариантный пептид, в котором комбинация замен, делеций и вставок в аминокислотной последовательности отличается не более чем на пять аминокислот от аминокислотной последовательности глюкагоноподобного пептида-1. 30. Способ по п.24, где рецепторсвязывающее соединение экспрессируется полинуклеотидом. 31. Способ по п.24, где рецепторсвязывающее соединение представляет собой органическую молекулу, имеющую молекулярную массу не более примерно 5000. 32. Способ по п.24, где путь введения выбирают из группы, состоящей из внутривенного,подкожного, внутримышечного, внутрибрюшинного, инъецируемого депо с пролонгированным высвобождением, глубокого вдувания через дыхательные пути (легкие) с пролонгированным высвобождением, щечного введения или доставки с помощью пластыря. 33. Способ по п.32, где внутривенное введение осуществляют в диапазоне доз примерно от 0,1 до 10,0 пмоль/кг в минуту. 34. Способ по п.32, где непрерывное подкожное введение осуществляют в диапазоне доз примерно от 1,0 до 75,0 пмоль/кг в минуту. 35. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета,предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для улучшения ответов в виде секреции инсулина -клетками на колебания уровней экзогенной глюкозы. 36. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета,предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для улучшения нормализации характеристик секреции инсулина при нарушенной толерантности к глюкозе. 37. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета, 23 предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве, эффективном для понижения уровней инсулина у индивидуума с нарушенной толерантностью к глюкозе. 38. Способ лечения индивидуума с нарушенной толерантностью к глюкозе до наступления инсулиннезависимого сахарного диабета,предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содер 004538 24 жит указанное соединение в количестве, эффективном для снижения инсулинорезистентности у индивидуума с нарушенной толерантностью к глюкозе. 39. Способ лечения индивидуума, симптомы (заболевания) которого указывают на повышенный риск проявления цереброваскулярного нарушения, предусматривающий введение указанному индивидууму композиции, содержащей соединение, которое связывается с рецептором глюкагоноподобного пептида-1, и фармацевтический носитель, причем указанная композиция содержит указанное соединение в количестве,эффективном для увеличения регулярности инсулиновых ответов и их амплитуд в ответ на изменение содержания глюкозы в плазме, и для понижения уровней инсулина в плазме.
МПК / Метки
МПК: A61K 38/26
Метки: толерантности, глюкагоноподобный, ответ, beta-клеток, глюкозу, улучшающий, нарушением, пептид-1, субъектов, глюкозе
Код ссылки
<a href="https://eas.patents.su/15-4538-glyukagonopodobnyjj-peptid-1-uluchshayushhijj-otvet-beta-kletok-na-glyukozu-u-subektov-s-narusheniem-tolerantnosti-k-glyukoze.html" rel="bookmark" title="База патентов Евразийского Союза">Глюкагоноподобный пептид-1, улучшающий ответ &beta-клеток на глюкозу у субъектов с нарушением толерантности к глюкозе</a>
Предыдущий патент: Композиция на основе аскорбиновой кислоты и способ лечения стареющей или поврежденной кожи
Следующий патент: Комбинационная терапия для лечения резистентной депрессии
Случайный патент: Композиции, содержащие ингибитор вич протеазы, а именно as vx 478, и водорастворимое соединение витамина e, а именно витамин e-tpgs.