Аналог диазонамида а
Номер патента: 13692
Опубликовано: 30.06.2010
Авторы: Харран Патрик, Уилльямс Ноэлль, Берджетт Энтони
Формула / Реферат
1. Соединение формулы
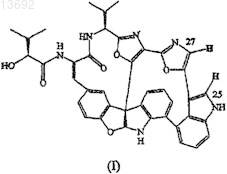
или его фармацевтически приемлемые соли, или конъюгаты.
2. Соединение по п.1 в форме фармацевтически приемлемой соли.
3. Конъюгат по п.1, в котором соединение формулы 1 соединено с направляющим агентом.
4. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение по п.1 и дополнительно включает фармацевтически приемлемый наполнитель.
5. Способ лечения пролиферативных заболеваний, включающий введение пациенту эффективного количества соединения по п.1 или фармацевтически приемлемой композиции.
6. Способ получения соединения формулы
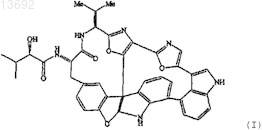
включающий обработку соединения формулы
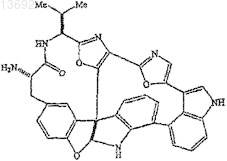
или защищенную его форму, имеющую защитную группу вместо водорода по меньшей мере у одного атома азота кольца, активированным сложным эфиром (S)-2-гидрокси-3-метилбутановой кислоты или его защищенной формой, имеющей защитную группу на 2-гидроксильной группе;
с последующим удалением защитных групп, которые были на амине или гидроксильной группе.
7. Способ по п.6, в котором в качестве активированного сложного эфира (S)-2-гидрокси-3-метилбутановой кислоты используют N-гидроксисукцинимидный эфир (S)-2-гидрокси-3-метилбутановой кислоты.
Текст
013692 Область техники Изобретение относится к аналогу диазонамида А, который обладает противоопухолевой активностью. Также раскрыт способ получения данного соединения. Предшествующий уровень техники Диазонамид А является митотическим агентом, разрушающим веретенца, впервые выделенным из морского организма Diazona angulata. Были предприняты множественные попытки синтезировать данное соединение и его аналоги. Публикация РСТ WO 03/106438 описывает предполагаемый путь синтеза; однако структура диазонамида А, обеспечиваемая в данной публикации, является неверной. Патент США 7022720 ('720) правильно раскрывает структуру диазонамида А и описывает синтез некоторых его аналогов, комбинированных путем использования каталитической эндоциклизации Хека, стереорегулируемой пинаконовой перегруппировки, затрагивающей цикл, и индольное арилирование через внутренний фотоиндуцированный перенос электрона. Приведена общая структура некоторых аналогов. Дочерняя заявка,раскрывающая приоритет данного патента, была подана 31 октября 2005 года и опубликована как 2006/0089397, и включает структуру аналога, соединение J, ниже заявленную. Патент '720 не описывает конкретно соединение настоящего изобретения, которое неожиданно обладает сильной антимитотической активностью. Раскрытие изобретения Настоящее изобретение относится к соединению формулы(соединение J) и его фармацевтически приемлемой соли. Изобретение также относится к фармацевтическим композициям, содержащим данное соединение и/или его соли, модифицированным формам данного соединения, связанным со стабилизирующими или целевыми агентами, и способам лечения пролиферативных заболеваний, в частности Taxolрезистентных раков, с использованием данных соединений и композиций. В другом аспекте изобретение относится к способам получения соединения J и его солей. Краткое описание чертежей Фиг. 1 показывает способность соединения J ингибировать рост различных линий раковых клеток в сравнении с диазонамидом А, гидроксилированной формой соединения J, паклитакселем и винбластином. Фиг. 2 показывает кривую процента выживаемости в зависимости от концентрации лекарственного средства против линии овариальных раковых клеток РТХ 10 с соединением J и паклитакселем. Фиг. 3 является графиком, показывающим фармакокинетику соединения J. Фиг. 4 А и 4 В показывают влияние соединения J в сравнении с паклитакселем в ксенотрансплантате клеток НСТ 116 и РС-3. Фиг. 5 А и 5 В показывают, что соединение J не оказывает никакого влияния на пролиферацию нейтрофилов или количество клеток in vivo. Способы воплощения изобретения Было показано, что соединение J, как описано ниже в примерах, обладает сильной антимитотической активностью по отношению к некоторым видам рака, в частности видам рака, которые являются устойчивыми к Taxol. Соединение J может использоваться в виде свободного основания, или в виде фармацевтически приемлемой соли, или их смеси. Подходящие соли включают соли неорганических кислот, такие как гидрохлориды, гидробромиды, сульфаты, гидросульфаты и подобное, или соли органических кислот, такие как ацетаты, формиаты, малеаты и подобное. К тому же, соединение J может объединяться с агентами, такими как целевые агенты. В число подобных агентов входят антитела или их иммунологически активные фрагменты, включающие однонитевые формы антитела, направленные против опухолевых антигенов или против рецепторов, или интегрины, связанные с опухолями, пептидомиметики, направленные против этих частей, и подобное. К тому же, соединение J может объединяться с наполнителем, таким как полиэтиленгликоль, для изменения фармакокинетики. Композиции согласно изобретению включают стандартные композиции, такие как композиции, изложенные в Remington's Pharmaceutical Sciences последнее издание, Mack Publishing Co., Easton, PA,включенное в описание путем ссылки. Подобные композиции включают композиции, предназначенные-1 013692 для пероральной доставки, замедленного высвобождения, местного введения, парентерального введения или любого другого подходящего способа введения, определенного лечащим врачом или ветеринаром. Таким образом, введение может быть систематическим или местным. Подходящие наполнители или эксципиенты включают лизосомы, мицеллы, наночастицы, полимерные матрицы, буферы и полный диапазон композиций, известный практикующим врачам. Соединение J является особенно полезным в лечении пролиферативных заболеваний, в частности,опухолей и злокачественных новообразований, связанных с молочной железой, яичником, легкими, толстой кишкой, простатой, меланомой, толстой кишкой, поджелудочной железой, глиомой, карциномой и подобным. Композиции, которые включают соединение J и/или его соль, и/или его конъюгаты, могут также быть использованы в сочетании с другими лекарственными средствами, такими как дополнительные противоопухолевые агенты или другие соединения, такие как паллиативные соединения, которые способствуют усвоению питательных веществ или общему здоровью. Соединение J легко синтезируют посредством обработки свободного аминосодержащего промежуточного соединения S-2,5-диоксопирролидин-1-ил-2-гидрокси-3-метилбутаноата. При этом свободный амин превращают в 3-метил-2-гидроксибутилат. Специалисты в данной области признают, что данное взаимодействие может быть выполнено с другими активированными сложными эфирами 2-гидрокси-3-метилбутаноата, такими как, например, сложный эфир N-гидроксибензотриазола, сложный эфир перфторфенила, сложные эфиры Nгидроксифталимида, активированные сложные эфиры, полученные в результате реакции карбоновой кислоты с карбодиимидом, и другие активированные сложные эфиры, обычно используемые для ацилирования амина с образованием амидной связи; таким образом, изобретение обеспечивает способ получения соединения J путем взаимодействия активированного производного 2-гидрокси-3-метилбутаноата,которое необязательно может быть защищено в положении 2-гидроксила с вышеописанным амином. Амин также, необязательно, может быть в защищенной форме, например, он может иметь защитные группы на одном или обоих атомах азота индола и атоме азота индолина. Подходящими защитными группами гидроксила являются арильные группы, силильные группы, ацетали пирана и подобное. Подходящими защитными группами для атомов азота кольца аминосоединения, которые не взаимодействуют с активированным сложным эфиром гидроксибутаноата, являются ацильные группы, такие как карбаматы или трифторацетаты, также как и силильные группы. Подходящие защитные группы и способы их присоединения и удаления хорошо известны в данной области и описаны, например, в Т.Н. Greene,Protective Groups in Organic Synthesis, 2nd ed. Для иллюстрации, но без ограничения изобретения, предложены следующие примеры. Примеры 116 описывают синтез соединения J. Примеры 17-20 описывают его биологическую активность. Пример 1. 7-Броминдол 2-Бромнитробензол (1,10 кг, 5,45 моль) растворяли в тетрагидрофуране (10 л) при комнатной температуре. Данный раствор охлаждали при перемешивании в бане, поддерживая температуру -78 С. Когда внутренняя температура достигала -40 С, добавляли винилмагнийбромид (16,3 л, 16,3 моль) с такой скоростью, чтобы поддерживать внутреннюю температуру при -40 С. После завершения добавления реакционную смесь удалили из бани и оставили медленно нагреваться до температуры -30 С в течение 45 мин. Иногда это требует охлаждения. Реакционный раствор при -30 С гасили быстрым добавлением слегка охлажденного (10 С) насыщенного водного раствора NH4Cl (10 л). Произошло небольшое вспенивание (обратное гашение в раствор хлорида аммония также удовлетворительно). В результате получают двухфазную смесь с некоторыми нерастворившимися солями магния в виде геля. Смесь перемешивали в течение 30 мин и разделили. Водный слой снова экстрагировали тетрагидрофураном (10 л). Объединенные органические слои упарили при пониженном давлении на бане при температуре 35 С, и образующееся темное масло забирали в хлористый метилен (5 л) и высушивали над Na2SO4. Смесь отфильтровывали и концентрировали. Образовавшееся вещество хроматографировали, элюируя 2% этилацетат гексаны, получив 7-броминдол (557 г, выход 52%) в виде желтоватого твердого вещества. 1 Н ЯМР(CDC13): согласуется с предложенной структурой. Пример 2. 2-Ацетамидо-3-(7-бром-1 Н-индол-3-ил)пропионовая кислота В 3-горлую круглодонную колбу емкостью 5 л, снабженную мешалкой, термопарой и холодильником, заполненную азотом, помещали соединение, получаемое в примере 1 (252,1 г, 1,29 моль), затем уксусную кислоту (1,5 л) и уксусный ангидрид (760 мл, 8,04 моль). После перемешивания в течение 20 мин загружали L-серин (266,9 г, 2,53 моль). Эту смесь перемешивали в течение 4 ч до подъема температуры до 40 С. После того как почти все твердые вещества были растворены, реакционную смесь нагревали до температуры 90 С с последующим повышением температуры до 110 С. Затем реакционную смесь охлаждали до 80 С, перемешивали при данной температуре, и за ходом реакции следили по ВЭЖХ. Через 5 ч реакция была завершена, о чем судили по отсутствию 7-броминдола на хроматограмме. Нагревание отстанавливали и реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре. Добавили метанол (450 мл) и реакционную смесь концентрировали в вакууме при температуре око-2 013692 ло 50 С до вязкой черной смолы. К остатку добавили метанол (3 л), и после энергичного перемешивания большая часть остатка перешла в раствор, оставляя мелкий осадок. К данной смеси добавили H2SO4 (52,5 мл) и реакционную смесь перемешивали с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли тетрагидрофураном (3 л). Раствор загружали в 12 литровый сепаратор, содержащий насыщенный водный NaHCO3 (4 л). Данную смесь экстрагировали метил-трет-бутиловым эфиром (34 л). Органические слои объединяли и промывали рассолом и высушивали над Na2SO4, затем концентрировали в вакууме, получив смесь коричневого твердого вещества и коричневого масла. К неочищенному продукту добавили хлористый метилен (500 мл), и некоторое количество твердого белого вещества осталось нерастворенным. Эти кристаллы отфильтровывали, получая около 10 г продукта. К фильтрату добавляли затравку кристаллов, и через 30 мин осаждалось коричневое твердое вещество. Новую смесь фильтровали и добавляли больше затравки кристаллов для получения третьей порции остатка, и эту третью смесь также фильтровали. Добавление затравки кристаллов к фильтрату не привело к получению дополнительного продукта. Фильтрат концентрировали в вакууме с получением коричневой пены, которую еще раз растворяли в хлористом метилене (600 мл). К раствору медленно добавили метил-трет-бутиловый эфир (МТБЭ) (1250 мл), который осаждал коричневое твердое вещество. Смесь фильтровали и фильтрат добавляли к другим неочищенным образцам, затем очищали колоночной хроматографией, элюируя смесью хлористый метилен-гексаны. Ни одна из фракций, содержащих продукт, не была очень чистой (диапазон: 50-75%), поэтому их перекристаллизовывали из МТБЭ с получением бледно-желтого порошка. Эти образцы объединяли с образцами после перекристаллизации с получением целевого соединения (139 г, выход 33%, чистота 75%). 1H ЯМР (CDCl3): согласуется с предлагаемой структурой. Пример 3. Гидрохлорид метилового эфира 2-амино-3-(7-бром-1 Н-индол-3-ил)пропионовой кислоты К перемешиваемой смеси соединения, полученного в примере 2 (342 г, 1,05 моль), в метаноле (3,4 л) медленно добавляли H2SO4 (340 мл). Образующуюся темно-коричневую смесь нагревали с обратным холодильником в течение 16 ч, после которых ВЭЖХ анализ указал на завершение реакции. Реакционную смесь охлаждали до комнатной температуры и медленно выливали в перемешиваемую смесь воды(4,8 л), гидрокарбоната натрия (342 г) и хлористого метилена (4,8 л). Перемешивание продолжали в течение 1,5 ч. Слои разделяли и водный слой повторно дважды экстрагировали хлористым метиленом (3,0 л). Объединенные экстракты высушивали над сульфатом натрия и концентрировали до черной смолы. Вещество растворяли в хлористом метилене (3,0 л). Медленно добавляли при внешнем охлаждении 1NHCl в диэтиловом эфире (1,1 л). Суспензию охлаждали до температуры бани со льдом и отфильтровывали. Твердые вещества дважды промывали хлористым метиленом (500 мл) и три раза гексаном (500 мл). Твердые вещества высушили до постоянной массы в вакуумной печи при температуре 32 С с получением желаемого соединения (267,4 г, выход 76%). 1H ЯМР (CDCl3): согласуется с предлагаемой структурой. Пример 4. Метиловый эфир 2-S)-2-(бензилоксикарбониламино)-3-метилбутанамидо)-3-(7-бром 1 Н-индол-3-ил)пропионовой кислоты Соединение, полученное в примере 3 (256,6 г, 770 ммоль), TBTU (296,4 г, 1,2 экв.) и Cbz-L-валин(212,7 г, 1,1 экв. ) растворяли в диметилформамиде (ДМФА, безводный, 2700 мл) и охлаждали до температуры 0 С в течение 30 мин. Медленно добавляли диизопропилэтиламин (DIEA, 268 мл) и оставляли раствор нагреваться до комнатной температуры. Перемешивание продолжали в течение 4 ч, после которых ВЭЖХ анализ указал на завершение реакции. Реакционную смесь разбавляли этилацетатом (11 л) и водой (7,5 л). Смесь перемешивали в течение 1 ч и оставляли расслаиваться. Органический слой один раз промывали водой (7,5 л), дважды рассолом (7,5 л) и дважды насыщенным NaHCO3 (7,5 л). Вещество высушивали сульфатом натрия и концентрировали до коричнево-черного твердого вещества. Вещество извлекали в хлористый метилен (7,5 л) и объединяли с 22,2 г другой партии схожего качества вещества и силикагелем (400 г). Растворитель удаляли для закрепления неочищенного соединения на силикагеле. Данное вещество было разделено на две половины, каждую половину хроматографировали на колонке с силикагелем 6 дюймов 4 фута. Каждую элюировали хлористым метиленом (20 л), затем 5% ацетоном в хлористом метилене (20 л), затем 8% ацетоном в хлористом метилене (30 л) с получением желаемого соединения (383 г, выход 89%). 1 Н ЯМР (CDCl3): согласуется с предлагаемой структурой. Пример 5. Метиловый эфир 2-S)-1-(бензилоксикарбониламино)-2-метилпропил)-5-(7-бром-1 Ниндол-3-ил)оксазол-4-карбоновой кислоты К перемешиваемому раствору соединения, полученного в примере 4 (361,4 г, 681 ммоль), растворенного в тетрагидрофуране (15 л), добавляли дихлордицианохинон (340,8 г, 1500 ммоль) и нагревали с обратным холодильником в течение 6 ч, после которых ВЭЖХ анализ указал на завершение реакции. Реакционную смесь концентрировали до 1/4 ее объема и разбавляли этилацетатом (12 л). Образующийся черный раствор промывали три раза насыщенным водным NaHCO3 (5,5 л). Органический слой высушивали над сульфатом натрия и концентрировали с получением желаемого соединения в виде черного твердого вещества (392 г, выход 100%). 1H ЯМР (CDCl3): согласуется с предлагаемой структурой.-3 013692 Пример 6. Гидробромид метилового эфира 2-S)-1-амино-2-метилпропил)-5-(7-бром-1 Н-индол-3 ил)оксазол-4-карбоновой кислоты К раствору 33% HBr в уксусной кислоте (1,33 л) добавляли соединение, полученное в примере 5(403,4 г, 766 ммоль), и энергично перемешивали в течение 1 ч и 20 мин. Смесь медленно и тщательно добавляли к МТБЭ (12 л) с внешним охлаждением и энергично перемешивали. Смесь перемешивали в течение 1 ч при температуре 0 С и отфильтровывали в атмосфере N2. Гигроскопичные твердые вещества промывали МТБЭ (1 л) и высушивали до постоянной массы в вакуумной печи с получением желаемого соединения (277,5 г, 76,5%) в виде мелкого коричневого твердого вещества. 1H ЯМР (CDCl3): согласуется с предлагаемой структурой. Пример 7. Метиловый эфир 2-S)-1-(S)-2-(бензилоксикарбониламино)-3-(4 гидроксифенил)пропанамидо)-2-метилпропил)-5-(7-бром-1 Н-индол-3-ил)оксазол-4-карбоновой кислоты К диизопропилэтиламину (225 мл, 1290 ммоль), перемешиваемому при температуре 0 С, добавляли соединение, полученное в примере 6 (277,5 г, 586,5 ммоль), Cbz-L-тирозин (194,2 г, 615,9 ммоль) и TBTU(207,2 г, 1,1 экв.) в диметилформамиде (безводный, 2,77 л). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 ч, после которых ВЭЖХ анализ указывал на завершение реакции. Реакционный раствор медленно выливали в насыщенный водный NaHCO3 (12,0 л) и перемешивали 30 мин. Осадок отфильтровывали и тщательно промывали водой. Образовавшееся коричневое вещество высушивали до постоянной массы в вакуумной печи при температуре 40 С с получением желаемого соединения (435 г). Желаемое соединение дополнительно очищали перекристаллизацией. Желаемое соединение растворяли в изопропаноле (9,0 л) при температуре 70 С. Нерастворимое вещество удаляли фильтрацией и фильтрат нагревали, медленно добавляя гексаны (9,0 л). Суспензию оставляли охлаждаться до комнатной температуры, используя баню со льдом. Охлажденную смесь перемешивали один раз при температуре ледяной бани в течение 30 мин и отфильтровывали. Твердое вещество промывали гексанами и высушивали до постоянной массы при температуре 40 С в вакуумной печи с получением чистого желаемого соединения (264 г, выход 61%). 1H ЯМР (CDCl3): согласуется с предлагаемой структурой. Пример 8. Соединение, полученное в примере 7 (45,0 г, 65 ммоль), растворяли в тетрагидрофуране (325 мл) и быстро добавляли к раствору PhI(Oac)2 (20 г, 62 ммоль) и LiOAc (12,7 г, 196 ммоль) в 2,2,2 трифторэтаноле (13,0 л) при температуре -20 С. Раствор перемешивали при температуре -20 С в течение 25 мин, добавляя твердый NaHCO3 (117,5 г). Холодную баню удаляли и перемешивание продолжали дополнительные 30 мин. Смесь отфильтровывали при температуре 10 С и концентрировали фильтрат. Остаток, 94,6 г, извлекали в CHCl3-тетрагидрофуран (3:1, 300 мл) и подвергали воздействию ультразвуком в течение 10 мин. Выпавший в осадок нежелательный диастереомер удаляли фильтрацией и фильтрат концентрировали с получением желаемого соединения. Вышеописанные операции были осуществлены в общей сложности 3 раза с получением суммарно 223,6 г неочищенного желаемого соединения. Неочищенное соединение сначала очищали фильтрацией через подушку силикагеля, элюируя 100% этилацетатом. Получали 179,9 г вещества, которое дополнительно очищали многократной колоночной хроматографией. Первую колонку элюировали смесью хлористый метилен-тетрагидрофуран 6:1. Получали 71,1 г вещества, которое извлекали в хлористый метилен-тетрагидрофуран 6:1 (200 мл) и выдерживали в течение ночи в холодильнике. Выпавший в осадок нежелательный диастереомер удаляли фильтрацией и фильтрат концентрировали с получением 66,6 г соединения. Это вещество хроматографировали 2 раза, элюируя хлористым метиленомтетрагидрофураном 15:1 с получением двух фракций желаемого соединения (16,8 г и 9,3 г). 1H ЯМР В колбу, содержащую соединение, синтезированное в примере 8 (102 мг, 0,148 ммоль), добавляли метанол (3,6 мл). Раствор охлаждали на бане со льдом и водой в течение 15 мин. По каплям при температуре 0 С добавляли основной раствор LiOH в воде (35,4 мг, 0,6 мл, 1,48 ммоль). Смесь оставляли нагреваться до комнатной температуры (все осадки растворились) и перемешивали в течение 4 ч. После проверки ЖХ-МС оставалось менее 1% исходного вещества. К реакционной смеси добавляли примерно 10 г льда и температуру реакционной смеси снижали до 0 С. При 0 С по каплям добавляли водный HCl (1 н,1,6 мл) для доведения рН реакционной смеси между 2 и 3. Для экстракции желаемой кислоты был использован этилацетат (220 мл). Объединенные органические слои промывали водой (10 мл), рассолом(10 мл) и высушивали над Na2SO4. Раствор концентрировали с получением 100 мг желаемого соединения, которое использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (ДМСО-d6): согласуется с предлагаемой структурой. Пример 10. В сухую колбу, содержащую соединение, синтезированное в примере 9 (100 мг), добавляли гидрохлорид 2-амино-1-(7-гидрокси-1 Н-индол-3-ил)этанона (50,3 мг, 0,222 ммоль) и безводный ДМФА (0,5 мл). При комнатной температуре в атмосфере N2 добавляли триэтиламин (31 мкл, 0,222 ммоль). Предварительно приготовленный желтый раствор DHOBt (8,45 мг, 0,0518 ммоль), EDC-HCl (42,6 мг, 0,222 ммоль) и триэтиламина (31 мкл, 0,222 ммоль) в безводном ДМФА (2,0 мл) добавляли к раствору при комнатной температуре. Смесь перемешивали при температуре от 41 до 42 С в атмосфере N2 в течение 6 ч. Реакционную смесь разбавляли этилацетатом (30 мл) с последующей промывкой водой (10 мл), 10% водным NaHSO4 (10 мл), водой (210 мл), насыщенным водным NaHCO3 (10 мл), водой (210 мл) и рассолом (10 мл). Раствор высушивали над Na2SO4, фильтровали и упаривали с получением желаемого соединения (130 мг). 1H ЯМР (ДМСО-d6): согласуется с предлагаемой структурой. Пример 11. В сухую колбу, содержащую соединение, синтезированное в примере 10, добавляли безводный тетрагидрофуран (0,9 мл) и CH2Cl2 (2,7 мл). Полученный раствор охлаждали на водяной бане со льдом в течение 15 мин. При температуре 0 С добавляли уксусный ангидрид (42 мкл, 0,444 ммоль) и пиридин (18 мкл, 0,222 ммоль). Затем смесь нагревали до комнатной температуры и перемешивали в течение 3,5 ч в атмосфере N2. За реакцией следили посредством ЖХ-МС. Реакционный раствор разбавляли этилацетатом (30 мл) с последующей промывкой водой (10 мл) и рассолом (10 мл) и высушивали над Na2SO4. По-5 013692 сле концентрирования получали 136 мг неочищенного продукта. После флэш-хроматографии, элюируя этилацетат/CH2Cl2 (30/70-35/65), получали желаемое соединение (80 мг, суммарный выход после трех последних стадий 61%). 1H ЯМР (ДМСО-d6): согласуется с предлагаемой структурой. Пример 12. В сухую колбу, снабженную магнитной мешалкой, помещали трифенилфосфин (474 мг, 1,81 ммоль) и гексахлорэтан (428 мг, 1,81 ммоль). Добавляли безводный CH2Cl2 (18,5 мл) и полученный раствор хорошо охлаждали на водяной бане со льдом в атмосфере N2. К раствору медленно добавляли триэтиламин (351 мкл, 2,52 ммоль) с последующим перемешиванием в течение 10 мин при температуре 0 С. По каплям прибавляли раствор соединения, синтезированного в примере 11 (160 мг, 0,180 ммоль), в безводном CH2Cl2 (9,5 мл) и поддерживали температуру от 0 до 2 С. После добавления реакционную смесь перемешивали при температуре 0 С в течение 10 мин (общее время должно быть не менее чем 15 мин). Для гашения реакционной смеси добавили воду (34 мкл). Весь растворитель упаривали при пониженном давлении при температуре 15 С. Для осаждения трифенилфосфиноксида добавляли этилацетат (5 мл). После фильтрации фильтрат концентрировали снова и вышеописанную методику повторили дважды для удаления дополнительного трифенилфосфиноксида. Фильтрат концентрировали с последующей очисткой флэш-хроматографией, элюируя этилацетат-толуол (60:40) с получением желаемого соединения (110 мг, выход 70%). 1H ЯМР (ДМСО-d6): согласуется с предлагаемой структурой. Пример 13. Раствор соединения, синтезированного в примере 12, в ацетонитриле (10,0 мг, 4 мл) поместили в кварцевую пробирку с последующим барботажем N2 в течение 30 мин. По каплям добавили основной раствор LiOH в H2O (0,596 мг, 0,60 мл). Реакционный раствор окрасился в темно-желтый цвет и был дегазирован азотом в течение 30 мин. Кварцевую пробирку поместили в фотореактор, облучаемый электролампой 300 нм. Реакционный раствор, барботируемый азотом, облучали в течение 45 мин. Данную реакцию повторили 12 раз. Объединенные реакционные смеси разбавляли этилацетатом (200 мл) с последующими промывками насыщенным NH4Cl (50 мл), H2O (50 мл), рассолом (50 мл) и высушивали над В сухую колбу, содержащую соединение, синтезированное в примере 13 (0,150 ммоль), добавляли сухой K2CO3 (61 мг) и безводный ДМФА (4 мл). К реакционной смеси при комнатной температуре добавляли раствор 4-нитрофенилтрифторметансульфоната в безводном ДМФА (61 мг, 1,3 мл). Полученный желто-коричневый раствор перемешивали при комнатной температуре в атмосфере N2 в течение 1 ч. Затем смесь разбавляли этилацетатом (100 мл) с последующей промывкой насыщенным водным NH4Cl(220 мл), H2O (520 мл), рассолом (220 мл) и высушивали над Na2SO4. После концентрирования продукт очищали флэш-хроматографией, элюируя смесью этилацетат-CH2Cl2 (30:70) с получением желаемого соединения (50 мг, общий выход для двух последних стадий 38%). 1H ЯМР (ДМСО-d6): согласуется с предлагаемой структурой. Пример 15. В колбу, содержащую соединение, синтезированное в примере 14 (50 мг, 0,057 ммоль), добавляли МеОН (5 мл) и триэтиламин (29 мкл, 0,205 ммоль) с последующей продувкой N2. Затем в атмосфере N2 добавляли Pd(OH)2/C (95 мг). Быстро присоединяли баллон, наполненный газообразным водородом, и продували колбу водородом 4 раза. Реакционную смесь оставляли на 3 ч. Смесь фильтровали через слой целита и остаток промывали МеОН (210 мл). Фильтрат концентрировали и разбавляли этилацетатом (50 мл). Раствор промывали H2O (310 мл) и рассолом (10 мл) и высушивали над Na2SO4. После концентрирования получали желаемое соединение (33 мг); оно было использовано на следующей стадии без дополнительной очистки. Пример 16. В сухую колбу, содержащую соединение, синтезированное в примере 15 (2 мг, 0,0469 ммоль), добавляли безводный тетрагидрофуран (1,1 мл). К реакционной смеси при комнатной температуре добавляли раствор (S)-2,5-диоксопирролидин-1-ил-2-гидрокси-3-метилбутаноата (11,1 мг, 0,0516 ммоль) в безводном тетрагидрофуране (0,3 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере N2 в течение 2 часов. Реакционную смесь разбавляли CH2Cl2 (50 мл) с последующей промывкой насыщенным NaHCO3 (25 мл), H2O (5 мл) и рассолом (5 мл) и высушивали над Na2SO4. После концентрирования целевой продукт очищали флэш-хроматографией, элюируя МеОН-CH2Cl2 (3:9), с получением желаемого соединения (19 мг, выход 58%). Масс-спектр (ESI) m/z: 697,2 (М+1). 1H ЯМР (ДМСО-d6): со-7 013692 гласуется с предлагаемой структурой. Пример 17. Ингибирование различных клеточных линий соединением J Ряд линий опухолевых клеток, представляющих рак молочной железы, легких, толстой кишки, яичника и простаты, также как и меланому, исследовали в стандартных условиях роста в присутствии различных количеств диазонамида А, гидроксилированной формой соединения J, соединения J, паклитакселя и винбластина. Результаты изображены на фиг. 1 как концентрация, которая уменьшает рост факторов двух (GI50). В окошке, показанном на фиг. 1, АВ-4 является гидроксилированной формой соединения J и АВ-5 является соединением J. Как показано, все тестируемые лекарственные средства имели очень низкие концентрации GI50 в линиях опухолевых клеток молочной железы MDA-MB-435, но диазонамид А,соединение J и винбластин были более эффективными по отношению к MDA-MB-231, чем другие лекарственные средства. В легких и толстой кишке гидроксилированная форма соединения J была менее эффективна, чем другие лекарственные средства. Все тестируемые лекарственные средства имели очень низкие концентрации (единицы нМ) GI50 в линиях опухолевых овариальных клеток OVCAR3, но паклитаксел был значительно менее эффективным против линий опухолевых овариальных клеток IGR-OVl иSKMEL-2, чем остальные четыре лекарственных средства. В меланоме соединение J и его гидроксилированная форма были менее эффективными, чем остальные лекарственные средства, но в линиях клеток простаты РС-3 и LnCAP все лекарственные средства показали хорошие результаты (гидроксилированная форма соединения J была менее активна в отношении РС-3). Дополнительные эксперименты, тестирующие воздействие соединения J и паклитакселя на выживаемость овариальных опухолевых клеточных линий РТХ 10 показаны на фиг. 2. Изображенные в отношении добавленной концентрации, эти данные показывают, что соединение J является более эффективным в снижении процента выживаемых клеток, чем паклитаксел. На фиг. 2 кружки означают соединениеJ и звездочки означают паклитаксел. Пример 18. Фармакокинетика Соединение J было введено внутривенно мыши, содержащей ксенотрансплантат опухоли, выращенной из раковых клеток молочной железы MDA-MB-435. Внутриопухолевую концентрацию соединения J измеряли как функцию времени. Результаты представлены на фиг. 3. Как суммировано, конечный период полувыведения данного соединения составляет 297,6 мин, площадь под кривой равна 3010224 миннг/мл и объем распределения составляет 2,9 л/кг. Пример 19. Активность in vivo Как показано на фиг. 4 А и 4 В, соединение J сравнимо с паклитакселем в ингибировании роста ксенотрансплантатов НСТ 116 и ксенотрансплантатов РС-3. Детали приготовления мышиных моделей, содержащих ксенотрансплантаты НСТ 116 или РС-3 клетки, описаны в разделе, следующем за этими примерами. После того как опухоли выросли, была начата терапия с использованием соединения J или паклитакселя. Как показано на фиг. 4 А, 20 мг/кг соединения J, введенного IV, замедляют рост опухоли аналогично паклитакселу в той же самой концентрации. На фиг. 4 Аобозначает контрольную мышь, квадраты обозначают 5 мг/кг соединения J, ромб обозначает 20 мг/кг соединения J, наклонная линия обозначает 20 мг/кг паклитакселя. Как видно, паклитаксел и соединение J в схожих концентрациях дают схожие кривые ингибирования роста, к тому же, у четырех из 10 животных, на которых проводили исследования, опухоли отсутствовали в течение пяти месяцев и не показали никакой потери веса. В схожей модели, использующей клетки РС-3 в качестве ксенотрансплантата, также 20 мг/кг либо соединения J, либо паклитакселя значительно ингибируют рост опухоли. На фиг. 4 В квадраты обозначают контроль, темные кружки соответствуют точкам на графике для соединения J, и светлые звездочки являются точками на графике для паклитакселя. Пример 20. Действие на пролиферацию нейтрофилов и количество клеток Как показано на фиг. 5, хотя паклитаксел приводит к уменьшению количества нейтрофилов в костном мозге непериферической крови при дозе 5 и 20 мг/кг, соединение J в тех же концентрациях не оказывает никакого эффекта на количество клеток. В дополнение к измерению воздействия на опухоли было получено воздействие паклитаксела и соединения J на нейтрофилы в костном мозге и крови. Как показано на фиг. 5 А, хотя паклитаксел при 20 мг/кг значительно снижает количество нейтрофилов в костном мозге, сравнимая доза соединения J не оказывает воздействия. Приведены данные в виде GR1+ клеток в одной бедренной кости. На фиг. 5 В аналогично количество нейтрофилов в периферической крови значительно снизилось до 5 мг/кг и до 20 мг/кг паклитакселя, но влияние на них схожих количеств соединения J не было значительно. Эти данные сведены в таблицу как ANC (клеток/мл). Полученные данные ингибирования роста опухолевых клеток ксенотрансплантата соединением J в сравнении с паклитакселем показаны ниже.-8 013692 Таблица 1. Краткие данные об эффективности соединения J- опухолевые клетки простаты PC3 и опухолевые клетки толстой кишки НСТ 116 (собранные из опухолевого репозитория Division of Cancer Treatment and Diagnosis (DCTD) of the NCI)- 10% термоинактивированная (30' 56 С) фетальная телячья сыворотка (cat 100-106, Gemini BioProducts)- 0,1 мМ MEM раствор заменимых аминокислот (cat 11140-050, Invitrogen) 10 Ед/мл пенициллина/10 мкг/мл стрептомицина (cat 15140-122, Invitrogen)- 1 мМ пируват натрия (cat 11360-070)- солевой фосфатный буферный раствор, не содержащий Са 2+/Mg2+, 5% декстроза в воде- чашка для культивирования 150 мм 25 мм (Cat 430599, Corning Inc.)- 10 и 25 мл пипетки, стандартный пипетатор, наконечники для пипеток р 200 и р 1000 и стандартный pipetmen- бестимусные NCr-nu/nu мыши 6-12-недельного возраста, обоих полов (код рода: 01 В 74, поставщики NCI Frederick Animal Production Program, включая Charles River Labs and Taconic Farms). Для данных экспериментов брали женских особей мыши в возрасте приблизительно 7 недель.- 50 и 15 мл одноразовые пластиковые конические пробирки (Falcon или схожий продавец)- раствор трипанового синего (0,4%) (Cat T8154, Sigma)- гемацитометр фазового контраста Hausser (Cat 02-671-54, Fisher)- весы для взвешивания мыши (точность до 0,2 г)- установка для вивария, свободная от известных патогенов (бестимусные мыши должны по возможности содержаться в изоляции от обычных мышей - отдельные комнаты или клеткимикроизоляторы, снабженные отдельным притоком воздуха; все жилище, подстилка, вода должны быть автоклавированы перед использованием; должна быть использована стандартная пища для облученной мыши; животные должны быть пересажены из клеток в ламинарный бокс, исследователи, содержащие мышей, должны быть соответствующе одеты - одноразовый халат, шапочка, бахилы, перчатки, маска)- паклитаксел (Cat ANP0010, Polymed Therapeutics) Методика 1) Быстро оттаять клетки PC3 или НСТ 116 (при необходимости) при 37 С на водяной бане. Перенести содержимое в 9 мл полной среды RPMI. Центрифугировать 5' при 1200 об./мин (240g). Удалить среду и ресуспендировать осадок в 8 мл полной среды RPMI. Поместить в культуральную чашку размером 100 мм 25 мм во влажный инкубатор при 5% CO2, 37 С. 2) Оставить расти в течение 5-10 дней, разделить (аспирированная среда, промытая 3-5 мл PBS, добавлено 1 мл трипсин-ЭДТА, инкубировано 3-5' при 37 С, добавлена среда до желаемого объема и перенесена в многолуночный планшет) от 1:8 до 1:10 каждые 3-4 дня, если необходимо дать клеткам войти в фазу логарифмического роста. 3) Когда клетки достаточно выросли, начать распространять в чашку 150 мм 25 мм. Авторы использовали 20 мл среды в 150 мм чашке 2 мл трипсина для разделения. Когда они почти сливаются, то должно быть 2107 клеток/150 мм чашка. 4) Заранее спланировать время, прибытия nu/nu мышей так, чтобы они могли акклиматизироваться к жилищу для животных в течение 1 недели до введения опухолевых клеток. В течение этого времени пометить или промаркировать уши в соответствии со стандартной практикой для вивариев. 5) Собрать клетки PC3 или НСТ 116, когда, как ожидается, имеется достаточное количество клеток для общего количества исследуемых мышей (общее число мышей = 7 мышей/группаобщеегрупп предполагаемые группы: контроль с наполнителем, положительный контроль с паклитакселем, АВ-5 + до 5 дополнительных мышей для учета изменения частоты съемок ксенотрансплантата, например 26 мышей). Запланировать ввести 10 миллионов клеток/мышей и учесть потерю клеток/объема в процессе инъекции. То есть, если необходимо сделать инъекции 30 мышам, то запланировать собрать достаточно клеток для по меньшей мере 35 инъекций - 3510 миллионов клеток = 3,5108 клеток. В существующем НСТ 116 эксперименте вводили 7,5106 клеток на одну мышь. Пять мышей из группы были использованы для обработки АВ-5 и четыре мыши были использованы для контроля и обработки паклитакселем. В существующем PC3 эксперименте вводили 107 клеток. Шесть мышей из группы были использованы для контрольной обработки и пять мышей из группы были использованы для обработки АВ-5 и паклитакселем. Группы меньшего размера были необходимы из-за ограничений в доступности АВ-5. 6) Собрать клетки как для разделения на стадиях 2 и 3, описанных выше. Полезно собирать только по 10 чашек за раз и помещать собранные клетки на лед, поскольку понадобится обработать большое количество чашек для одного эксперимента. Промыть чашки дополнительной средой 1-2 раза в добавление к среде, использованной вначале для разбавления трипсина и собранных клеток. Клетки с 10 чашками вместе с промывочными жидкостями хорошо поместятся в одной конической колбе на 50 мл. Все стадии должны быть проведены с использованием асептических методик, и клетки и центрифуги должны оставаться охлажденными в течение выполнения. 7) Как только клетки собраны, центрифугировать при 5' 1200 об./мин (240g). Ресуспендировать осадок в 5-10 мл простой (свободной от сыворотки и добавок) RPMI. Объединить осадки и затем сосчитать клеточные популяции в объединенных осадках, разбавленных до концентрации, пригодной для счета. Отсчитать на стандартном гемацитометре 50 мкл + 50 мкл трипанового синего. Отцентрифугировать клетки, как ранее, и дополнительно дважды повторить свободную от сыворотки промывку для того, чтобы удостовериться в полном удалении сыворотки. Может быть полезно снова разделить клетки на не- 10013692 сколько конических пробирок на 50 мл для счета и промывки, но удостовериться, что они помещены обратно в одну пробирку для окончательного центрифугирования. 8) Ресуспендировать осадок, принимая во внимание объем самого осадка, в 4107 мл среды, свободной от сыворотки. Пипетирование или аккуратное встряхивание приемлемо. 9) Собрать клетки на льду в виварий, где в клетках уже должны быть готовы для инъекций мыши. 10) Набрать 0,8-0,9 мл клеток в туберкулиновый шприц на 1 см 3. Присоединить иглу 25G и осторожно выбить пузырьки так, чтобы в шприце осталось 0,7 мл клеток, готовых к инъекции. Оставшиеся клетки оставить на льду. 11) Удерживать левой рукой мышь, крепко держа за хвост и кожу позади головы, так чтобы мышь не могла двигаться, но еще была способна дышать. Протереть протирочным спиртом кожу для инъекции и приподнять участок вялой кожи. С правой ножкой микротома на игле аккуратно ввести шприц и иглу,содержащие клетки, непосредственно под кожу мыши и медленно ввести 0,2 мл клеток (1107 клеток). Поверхность инъекции должна образовывать выпуклую область под кожей. Вернуть мышей в клетки. 12) Начать измерения размеров опухоли штангенциркулем с нониусом (измерить длину и высоту и вычислить объем (LW2)/2 в течение трех дней со дня инъекции. Также измерять вес мыши. В общем,вес мыши должен быть измерен в то же самое время каждый день (с точностью 1-2 ч) для того, чтобы избежать ежедневных флуктуаций. Измерять объем опухоли по меньшей мере один дополнительный раз с интервалом в 2-3 дня, чтобы убедиться, что объем опухоли увеличивается. Лечение может быть начато,когда объем опухоли составит между 150-250 мм 3. Данное значение должно быть достигнуто через 5-10 дней после исходной инъекции. Не использовать мышей, чьи опухоли значительно выпадают из этого диапазона. По существующему эксперименту PC3 лечение было начато через 5 дней после инъекции опухоли и через 8 дней после инъекции опухоли по существующему эксперименту НСТ 116. 13) До первого дня лечения разделить паклитаксел и АВ-5/соединение J на аликвоты отдельных доз. Возможно оценить вес мышей в первый день терапии на основании весов, измеренных во время первоначального периода роста опухоли. Достаточная аликвота соединения на пробирку для ряда мышей из обрабатываемой группы + 1,5-2 дополнительные дозы. Как паклитаксел, так и соединение J давали по 20 мг/кг. Для минимизирования потерь соединения и максимизирования точности авторы взвешивали 20-30 мг соединения и растворяли его в этаноле. Затем аликвоты требуемого количества соединения пипетировали в отдельные пробирки и высушивали в вакууме. Аликвоты хранили высушенными при -20 С в тефлоновых или стеклянных пробирках. 14) В первый день лечения случайным образом сгруппировали мышей, так чтобы средний объем опухоли в группе был постоянным. При использовании самцов может понадобиться множество клеток,поскольку из-за драк нецелесообразно перегруппировывать самцов nu/nu мышей с новыми nu/nu мышами. 15) Приготовить исходный раствор 1:1 кремафор:этанол. Приготовить соединение J и паклитаксел для инъекции сначала разбавлением 20 мкл/доза кремафор:этанол с энергичным встряхиванием или, при необходимости, воздействием ультразвука. Разбавить в 5% декстрозе, так чтобы конечная концентрация кремафор:этанол составила 10% (например, добавить 180 мкл 5% декстрозы на дозу). Встряхивайте для смешивания. Раствор должен быть несколько вязким. Паклитаксел может потребовать несколько большую концентрацию наполнителя для поддерживания в растворе (до 20%). По существующим экспериментам PC3 и НСТ 116 было использовано 20% наполнителя для композиции паклитакселя и 10% для композиции АВ-5. 16) Нагреть с помощью 150W лампой хвост. Авторы выбрали нагревание только хвоста, но годятся также стандартные методики, используемые в виварии. Поместить мышь в Tailveiner. Промыть вену промывочным спиртом и медленно ввести 0,2 мл в течение 5 с. 17) С интервалом в один день должно быть введено шесть доз (q2dx6). По существующим экспериментам PC3 и НСТ 116 дозы вводили понедельник/среда/пятница в течение двух недель (q2-3d6). 18) Мыши должны быть взвешены, и каждая доза должны быть перерассчитана. 19) Объем и вес опухоли должен измеряться каждые 3-4 дня (понедельник/пятница) в течение нескольких месяцев, следующих после инъекции. У контрольных мышей в течение 30-40 дней опухоль должна достичь 20 мм в максимальном диаметре (размер - наиболее благоприятный для умерщвления мыши). Как паклитаксел, так и соединение J должны вызвать значительную регрессию в течение курса лечения у 40-80% мышей. или его фармацевтически приемлемые соли, или конъюгаты. 2. Соединение по п.1 в форме фармацевтически приемлемой соли. 3. Конъюгат по п.1, в котором соединение формулы 1 соединено с направляющим агентом. 4. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение по п.1 и дополнительно включает фармацевтически приемлемый наполнитель. 5. Способ лечения пролиферативных заболеваний, включающий введение пациенту эффективного количества соединения по п.1 или фармацевтически приемлемой композиции. 6. Способ получения соединения формулы включающий обработку соединения формулы или защищенную его форму, имеющую защитную группу вместо водорода по меньшей мере у одного атома азота кольца, активированным сложным эфиром (S)-2-гидрокси-3-метилбутановой кислоты или его защищенной формой, имеющей защитную группу на 2-гидроксильной группе; с последующим удалением защитных групп, которые были на амине или гидроксильной группе. 7. Способ по п.6, в котором в качестве активированного сложного эфира (S)-2-гидрокси-3 метилбутановой кислоты используют
МПК / Метки
МПК: A61P 35/00, C07D 291/00, A61K 31/42
Метки: аналог, диазонамида
Код ссылки
<a href="https://eas.patents.su/15-13692-analog-diazonamida-a.html" rel="bookmark" title="База патентов Евразийского Союза">Аналог диазонамида а</a>
Предыдущий патент: Композиция с высокой осмотической активностью антимикробного, противовоспалительного и регенерационного действия
Следующий патент: Модульное непрерывное производство микроорганизмов
Случайный патент: Новая кристаллическая форма производного пиридазино [4,5-в] индола












