Конъюгаты гксф
Формула / Реферат
1. Физиологически активный конъюгат, имеющий формулу
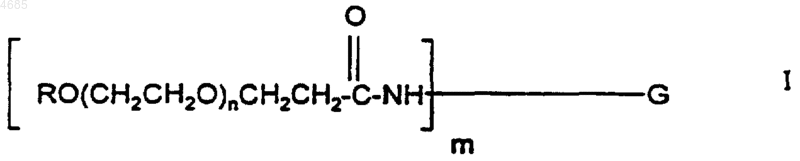
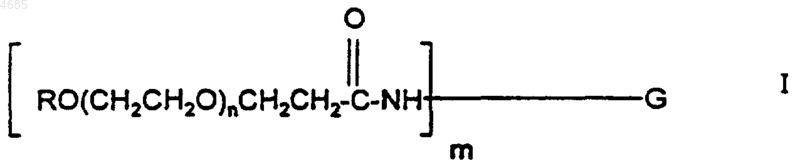
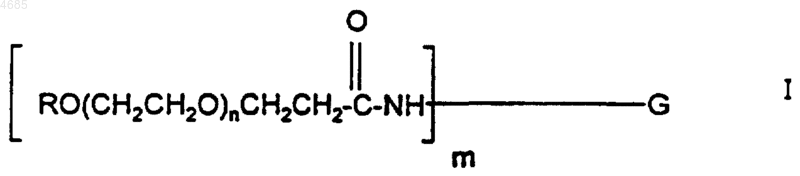
где G представляет гранулоцитарный колониестимулирующий фактор, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью в указанном конъюгате, R представляет алкил с прямой или разветвленной цепью, имеющий от одного до шести атомов углерода, n представляет целое число от 420 до 550, а m представляет целое число от 1 до 5.
2. Конъюгат по п.1, где R представляет метил.
3. Конъюгат по п.2, где n равно 450-490.
4. Конъюгат по п.2, где m равно целому числу от 1 до 4.
5. Конъюгат по п.4, где m равно 2.
6. Конъюгат по п.1, где гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1.
7. Конъюгат по п.1, где n равно от 450 до 490.
8. Конъюгат по п.1, где m равно целому числу от 1 до 4.
9. Конъюгат по п.8, где m равно 2.
10. Конъюгат по п.1, который имеет более продолжительное время полужизни в кровотоке и более высокую гранулопоэтическую активность in vivo, чем соответствующий неконъюгированный гранулоцитарный колониестимулирующий фактор.
11. Конъюгат по п.10, где гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1.
12. Физиологически активный конъюгат, имеющий формулу
где R представляет метил; n равно 450-490; m равно 2; а G представляет мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью данного конъюгата.
13. Композиция, содержащая физиологически активные конъюгаты, имеющие формулу

где G в каждом конъюгате представляет гранулоцитарный колониестимулирующий фактор, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью в данных конъюгатах; R в каждом конъюгате независимо представляет алкил с прямой или разветвленной цепью, имеющий от одного до шести атомов углерода; n в каждом конъюгате независимо представляет целое число от 420 до 550; m в каждом конъюгате независимо представляет целое число от 1 до 4; процентное содержание конъюгатов, где m=1, составляет от 18 до 25%; процентное содержание конъюгатов, где m=2, составляет от 50 до 66%; процентное содержание конъюгатов, где m=3, составляет от 12 до 16%; а процентное содержание конъюгатов, где m=4, составляет вплоть до 5%.
14. Композиция по п.13, где в каждом конъюгате R представляет метил.
15. Композиция по п.13, где n и R являются одинаковыми в каждом конъюгате.
16. Композиция по п.13, где n равно от 450 до 490.
17. Композиция по п.13, где в каждом конъюгате гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1.
18. Композиция, содержащая физиологически активные конъюгаты, имеющие формулу
где R представляет метил; n является одинаковым в каждом конъюгате и представляет целое число от 450 до 490; G представляет мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью данного конъюгата, и где m в каждом конъюгате независимо представляет целое число от 1 до 4; процентное содержание конъюгатов, где m=1, составляет от 18 до 25%; процентное содержание конъюгатов, где m=2, составляет от 50 до 66%; процентное содержание конъюгатов, где m=3, составляет от 12 до 16%; а процентное содержание конъюгатов, где m=4, составляет вплоть до 5%.
19. Способ получения конъюгата ПЭГ-ГКСФ, имеющего более продолжительное время полужизни в кровотоке и более высокую гранулопоэтическую активность in vivo, чем соответствующий неконъюгированный ГКСФ, где указанный способ заключается в ковалентном связывании реагента формулы
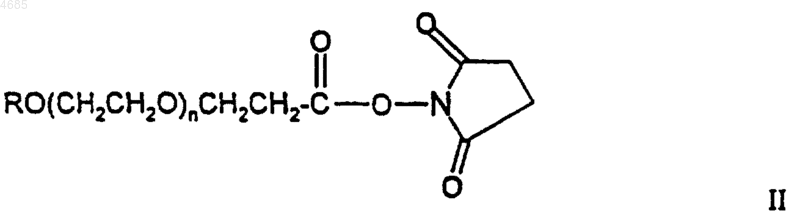
с указанным ГКСФ с получением указанного конъюгата.
20. Способ по п.19, где указанным ГКСФ является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1.
Текст
1 Предпосылки создания изобретения Гранулоцитарный колониестимулирующий фактор (ГКСФ) представляет собой фармацевтически активный белок, который регулирует пролиферацию, дифференцировку и функциональную активацию нейтрофильных гранулоцитов (Metcalf, Blood 6:257 (1986); Yan et al.,Blood 84(3): 795-799 (1994); Bensinger et al.,Blood 81(11): 3158-3163 (1993); Roberts et al.,Expt'l Hematology 22:1156-1163 (1994); Neben etal. Blood 81(7): 1960-1967 (1993. ГКСФ может стимулировать мобилизацию стволовых клеток и клеток-предшественников костного мозга и используется для лечения пациентов, у которых наблюдается недостаток гранулоцитов после химиотерапии, или для предварительной подготовки пациентов к трансплантации костного мозга. В патенте США 5214132 описан мутеин человеческого ГКСФ, который отличается от нативного чГКСФ в положениях 1, 3, 4, 5 и 17,где вместо аминокислот нативного ГКСФ этот мутеин имеет Ala, Thr, Туr, Arg и Ser, соответственно (см. также Kuga et al., Biochem. Biophys.al. (Blood 75(9): 1788-1793 (1 мая 1990 описывают производное рчГКСФ, в котором осуществлена замена аминокислот в пяти положенияхN-концевой области рчГКСФ, в результате чего это производное обнаруживало более высокую специфическую активность, чем интактный рчГКСФ, в двух анализах, проведенных на мышиных и/или человеческих клеткахпредшественниках костного мозга. В патенте США 5218092 описан мутеин человеческого ГКСФ, который отличается от нативного чГКСФ тем, что в положениях 1, 3, 4, 5, 17, 145 и 147, вместо аминокислот нативного ГКСФ,этот мутеин имеет Аlа, Thr, Туr, Arg, Ser, Asn иSer, соответственно. Содержание патентов США 5214132 и 5218092 включено в настоящее описание посредством ссылки. Биологическая доступность белковых терапевтических средств, таких как ГКСФ, часто ограничена коротким периодом полужизни в плазме и восприимчивостью к деградации под действием протеазы, что препятствует его максимальному клиническому использованию. Исследования других терапевтических белков показали, что эти проблемы могут быть решены путем конъюгации указанного белка с полимером, таким как полиэтиленгликоль (ПЭГ),обычно посредством присоединения части, ковалентно связанной как с белком, так и ПЭГ. Было показано, что такие конъюгированные с ПЭГ биомолекулы обладают клинически полезными свойствами (Inada et al., J. Bioact. andCompatible Polymers, 5:343 (1990); Delgado et al.,Critical Reviews in Therapeutic Drug Carrier Systems, 9:249 (1992); и Katre, Advanced Drug Delivery Systems, 10:91 (1993. Среди них имеются биомолекулы, которые обладают более высокой 2 физической стабильностью и термостабильностью, невосприимчивостью к ферментативной деградации, повышенной растворимостью, более продолжительными временем полужизни in"ПЭГ-ГКСФ",имеющие структуры, отличающиеся от конъюгата настоящего изобретения, описаны в публикации европейской патентной заявкиЕР 0335423; в публикации европейской патентной заявки ЕР 0401384; R.W. Niven et al., J. Controlled(1992. Краткое описание изобретения Настоящее изобретение относится к новому классу ПЭГ-производных ГКСФ. Конъюгат настоящего изобретения имеет амидный линкер,как будет описано ниже. По сравнению с немодифицированным ГКСФ (то есть, ГКСФ без присоединенного ПЭГ), этот конъгогат обладает более продолжительными временем полужизни в кровотоке и присутствия в плазме, пониженным уровнем выведения и повышенной гранулопоэтической активностью in vivo. Кроме того, по сравнению с конъюгатами ПЭГ-ГКСФ, конъюгат настоящего изобретения обладает лучшими гранулопоэтическими свойствами. Другие конъюгаты "ПЭГ-ГКСФ" описаны в публикации европейской патентной заявкиЕР 0335423; в публикации европейской патентной заявкиЕР 0401384; R.W. Niven et al., там же. Однако,конъюгат настоящего изобретения имеет структуру, отличающуюся от структуры этих конъюгатов, обладает лучшими свойствами, а в частности, обнаруживают продолжительную высокую гранулопоэтическую активность in vivo при низких дозах. Предпочтительным ГКСФ настоящего изобретения является мутеин ГКСФ, который обладает свойствами, эквивалентными или превосходящими свойства нативного ГКСФ, и имеет то же самое применение, что и ГКСФ. Этот мутеин имеет ту же самую аминокислотную последовательность, что и ГКСФ, за исключением того, что в положениях 1, 3, 4, 5 и 17, вместо аминокислот нативного ГКСФ он имеет Ala,Thr, Tyr, Arg и Ser, соответственно (мутеин ГКСФ) (см. фиг. 1). Этот мутеин описан в патенте США 5214132, который включен в настоящее описание посредством ссылки. Физиологически активный конъюгат ПЭГГКСФ настоящего изобретения имеет формулу Частью настоящего изобретения также являются композиции заявленных конъюгатов, гдеm и n могут означать различные целые числа для конъюгатов в данной композиции. Конъюгат настоящего изобретения имеет то же самое применение, что и ГКСФ. В частности, конъюгат настоящего изобретения может быть использован для лечения пациентов, у которых наблюдается недостаток гранулоцитов после химиотерапии, или для предварительной подготовки пациентов к трансплантации костного мозга по той же схеме, которая применяется при использовании ГКСФ для лечения этих состояний. Однако конъюгат настоящего изобретения имеет улучшенные свойства, включая более высокую стабильность, лучшую растворимость, более продолжительное время полужизни в кровотоке и присутствия в плазме. Описание графического материала Фиг. 1 - первичная структура мутеина ГКСФ. Мутеин ГКСФ имеет структуру, отличающуюся от структуры человеческого ГКСФ дикого типа в положениях 1, 3, 4, 5 и 17, где он вместо аминокислот нативного ГКСФ имеетAla, Thr, Tyr, Arg и Ser, соответственно. Фиг. 2 - реагенты пэгилирования. Фиг. 3 - разделение 20 кДа ПЭГ-модифицированнного и немодифицированного мутеина ГКСФ. Типичный профиль элюции ПЭГреакционной смеси. Колонка: 1-2 мл FractogelEMD SO3 650S. Уравновешивающий буфер: 10 мМ ацетат аммония, рН 4,5. Буферы для элюции: 1) 0,15 М NaCl в уравновешивающем буфере; 2) 0,5 М NaCl в уравновешивающем буфере. Фиг. 4 - активность мутеина ПЭГ-ГКСФ на 5-й день после одной инъекции. Самкам крысC57BL/6J подкожно инъецировали 25,2 мкг пэгилированных конъюгатов мутеина ГКСФ; на пятый день после введения из ретроорбитального синуса брали образцы венозной крови. Гематологический анализ и определение лейкоцитарной формулы проводили на счетчике Coulter; число полученных нейтрофилов стандартизировали по отношению к наполнителю (контролю) для каждого эксперимента. Данные представлены как среднее значениестандартная ошибка для 4 мышей на группу. Фиг. 5 - увеличение числа ПМН в зависимости от массы ПЭГ (кДа) в конъюгатах "связанный с амидом и мочевиной мутеин ГКСФ ПЭГ". Для конъюгатов, полученных с реагентомSPA, ПМН=0,277 Mw + 3,95. Для конъюгатов,полученных с использованием реагента, содержащего мочевину, ПМН=0,152 Mw + 2,54. Фиг. 6 - активность мутеина ПЭГ-ГКСФ на 7-й день после одной инъекции. Самкам крысC57BL/6J подкожно инъецировали 25,2 мкг конъюгатов "ПЭГ-мутеин ГКСФ"; на пятый день после введения из ретроорбитального синуса брали образцы венозной крови. Гематологический анализ и определение лейкоцитарной формулы проводили на счетчике Coulter; число полученных нейтрофилов стандартизировали по отношению к наполнителю (контролю) для ка 004685 4 ждого эксперимента. Данные представлены как среднее значениестандартная ошибка для 4 мышей на группу. Фиг. 7 - анализ на мобилизацию мышиных колоний СКПК. Фиг. 8 - анализ на мобилизацию мышиных колоний СКПК. Фиг. 9 - анализ на мобилизацию мышиных колоний СКПК. Фиг. 10 - анализ на мобилизацию мышиных колоний СКПК. Фиг. 11 - анализ на мобилизацию мышиных колоний СКПК. Подробное описание изобретения Заявленное изобретение относится к физиологически активному конъюгату "ПЭГГКСФ", имеющему формулу где G представляет гранулоцитарный колониестимулирующий фактор без тех его аминогрупп, которые участвуют в амидной связи с полиэтиленгликолевой частью, как показано в формуле 1, R представляет низший алкил, n представляет целое число от 420 до 550, a m представляет целое число от 1 до 5. Числа n и m выбирают так, чтобы полученный конъюгат формулы I обладал физиологической активностью, сравнимой с активностью немодифицированного ГКСФ, причем,указанная активность может быть аналогична соответствующей активности немодифицированного ГКСФ, превышать эту активность или составлять часть этой активности, n представляет число этиленоксидных остатков в звене ПЭГ. Одна субъединица ПЭГ OCH2CH2 имеет молекулярную массу примерно 44 Да, m представляет число звеньев ПЭГ, присоединенных к молекуле ГКСФ. Конъюгат настоящего изобретения может иметь одно, два, три, четыре, пять или шесть звеньев ПЭГ на молекулу ГКСФ. Таким образом, молекулярная масса этого конъюгата(исключая молекулярную массу ГКСФ) зависит от числа n и m. n может иметь значение от 420 до 550, что соответствует образованию конъюгата, в котором каждое звено ПЭГ имеет среднюю молекулярную массу приблизительно от 18 до 25 кДа на звено ПЭГ. Предпочтительно n имеет значение 450-490, что соответствует образованию конъюгата, в котором каждое звено ПЭГ имеет среднюю молекулярную массу приблизительно 20 кДа. m может иметь значение 1,2, 3, 4 или 5. Предпочтительно m равно 1-4, а особенно предпочтительно m равно 2. Молекулярная масса ПЭГ-части конъюгатов настоящего изобретения составляет в пределах приблизительно от 18 кДа (n=420, m=1) до 125 кДа(n=550, m=5). Если n равно 420-550, а m равно целому числу от 1 до 4, то молекулярная масса ПЭГ-части конъюгатов настоящего изобретения"приблизительно", относящийся к определенному значению молекулярной массы, означает,что величина этой массы может иметь отклонения от этого значения в приемлемом диапазоне,определенном стандартными аналитическими методами. В предпочтительном конъюгате n равно 450-490, а m равно 1-4, причем в данном случае молекулярная масса ПЭГ-части данных конъюгатов находится в пределах приблизительно от 20 (n=450; m=1) до 86 кДа (n=490; m=4). В другом предпочтительном конъюгате, n равно 420550, а m равно 2, и в этом случае молекулярная масса ПЭГ-части данных конъюгатов находится в пределах приблизительно от 37 (n=420) до 48 кДа (n=550). В особенно предпочтительном конъюгате n равно 450-490, а m равно 2, и в этом случае молекулярная масса ПЭГ-части данных конъюгатов находится в пределах приблизительно от 40 (n=450) до 43 кДа (n=490).R может представлять любой низший алкил, который означает алкильную группу,имеющую от одного до шести атомов углерода,такую как метил, этил, изопропил и т.п. Такими алкилами могут быть разветвленные алкилы. Предпочтительным алкилом является метил. ГКСФ означает природный или рекомбинантный, предпочтительно человеческий белок,который получают из любых обычных источников, таких как ткань, синтезом белка и из клеточной культуры с природными или рекомбинантными клетками. В объем настоящего изобретения входят любые белки, обладающие активностью ГКСФ, такой как мутеины или другие модифицированные белки. Получение и выделение ГКСФ из природных или рекомбинантных источников хорошо известно специалистам (см. например, патент США 4810643 и 5532341, содержание которых включено в настоящее описание посредством ссылки). Предпочтительным конъюгатом ГКСФ является конъюгат с мутеином ГКСФ, описанным в патенте США 5214132. Физиологически активный конъюгат формулы I обладает активностью ГКСФ, которая означает любую одну или множество любых известных активностей ГКСФ, определенных различными аналитическими методами, известными специалистам. В частности, конъюгат настоящего изобретения обладает активностью ГКСФ, которая, как показано, заключается в его способности увеличивать число ПМН. Эта активность ГКСФ является известной. Такая активность в конъюгате может быть определена аналитическими методами, хорошо известными специалистам, например с помощью анализов,описанных ниже (см. также Asano et al., Jpn. 6 Конъюгат формулы I получают путем ковалентного связывания ГКСФ с таким реагентом, как сукцинимидилпропионовая кислота Реагент формулы II может быть получен стандартными методами в соответствии с известными процедурами (см. патент США 5672662, содержание которого вводится в настоящее описание посредством ссылки). n является таким, как оно было определено выше в формуле I, и выбрано для получения конъюгата с нужной молекулярной массой. Предпочтительными являются такие реагенты, в которых n равно 450-490 (мол. масса = 20 кДа). Другие молекулярные массы могут быть получены путем варьирования n в ПЭГ-спиртовом исходном материале для реагента формулы II стандартными методами. SРА-реагент формулы II с молекулярными массами 5, 10, 15 и 20 кДа может быть получен от Shearwater Polymers, Inc.(Huntsville, Alabama). Реагент формулы II может быть конъюгирован с ГКСФ стандартными методами. Присоединение осуществляют через амидную связь. В частности, реагент формулы II взаимодействует, главным образом, с одной или несколькими первичными аминогруппами (например, с Nконцом и лизиновыми боковыми цепями) ГКСФ с образованием амидной связи между ГКСФ и полимерным остовом ПЭГ. Группа NH, показанная в формуле I, происходит от этой первичной аминогруппы (или аминогрупп) ГКСФ, которая реагирует с реагентом формулы II с образованием амидной связи. Таким же образом, но в меньшей степени реагент формулы II может реагировать с гидроксильной группой серина в положении 66 ГКСФ, в результате чего образуется сложноэфирная связь между ГКСФ и полимерным остовом ПЭГ. Эти реакционные условия хорошо известны специалистам и подробно описаны ниже. Присоединение реагентов к ГКСФ может быть осуществлено известными методами. В настоящем изобретении может быть использован ПЭГ с любой выбранной молекулярной массой (n). Так, например, реакция может быть проведена в растворе с рН 5-10, при температуре от 4 С до комнатной, в течение периода времени от 30 мин до 20 ч, с использованием молярного отношения реагента к белку, составляющего от 4:1 до 30:1. Реакционные условия могут быть выбраны так, чтобы данная реакция была направлена на получение преимущественно нужной степени замещения. В основном,низкая температура, низкий рН (например, рН 5) и короткое время проведения реакции способствуют уменьшению числа присоединенных 7 ПЭГ (более низкое m). Высокая температура,значение рН от нейтрального до высокого (например, рН 7) и более продолжительное время реакции способствуют увеличению числа присоединенных ПЭГ (более высокое m). Так, например, если используется 5 кДа-реагент формулы II, то при рН 7,3 и молярном отношении реагента к белку, составляющем 30:1, при температуре 4 С и времени реакции 30 мин продуцируется преимущественно моно-ПЭГ-конъюгат; при температуре 4 С и времени реакции,составляющем 4 ч, продуцируется преимущественно ди-ПЭГ-конъюгат; а при комнатной температуре и времени реакции, составляющем 4 ч,продуцируется преимущественно три-ПЭГконъюгат. Реакцию прекращают путем подкисления реакционной смеси и замораживания при-20 С. В основном, предпочтительным является рН от 7 до 7,5, а предпочтительным молярным отношением реагента к белку является отношение от 4:1 до 6:1. Для разделения конъюгатов с разными зарядами могут быть использованы такие методы очистки, как катионообменная хроматография,которая способствует эффективному разделению конъюгатов на конъюгаты с различными молекулярными массами. Так, например, катионообменная колонка может быть загружена, а затем промыта 20 мМ ацетатом натрия, рН 4,и проэлюирована линейным (0 М-0,5 М) градиентом NaCl, забуференным при рН от 3 до 5,5, а предпочтительно при рН 4,5. Содержание фракций, полученных путем проведения катионообменной хроматографии, может быть идентифицировано по молекулярной массе стандартными методами, например с помощью масс-спектроскопии, электрофореза в ПAАГ с ДСН или любыми другими известными методами разделения молекулярных частиц по молекулярной массе. Затем фракцию, соответствующим образом идентифицированную как фракцию, содержащую конъюгат формулы I, имеющий нужное число (m) присоединенных ПЭГ,отделяют в свободной форме от немодифицированного ГКСФ и от конъюгатов, имеющих другие числа присоединенных ПЭГ. Частью настоящего изобретения является также композиция конъюгатов, где конъюгаты,имеющие различные значения m, включены в соответствующих соотношениях. Предпочтительной композицией настоящего изобретения является смесь конъюгатов, где m равно 1, 2, 3 и 4. Процентное содержание конъюгатов, гдеm=1, составляет 18-25%, процентное содержание конъюгатов, где m=2, составляет 50-66%,процентное содержание конъюгатов, где m=3,составляет 12-16%, а процентное содержание конъюгатов, где m=4, составляет вплоть до 5%. Такую композицию получают посредством реакции реагента пэгилирования с ГКСФ в молярном отношении от 4 до 6:1 (избыток реагента). Реакционную смесь оставляют на 20 ч при тем 004685 8 пературе от 4 до 8 С, при рН, близком к 7,5, для прохождения реакции. По окончании реакции добавляют уксусную кислоту. Полученный конъюгат очищают от остаточного немодифицированного белка, избытка реагента пэгилирования и других примесей и буферных компонентов, присутствующих в процессе реакции. Наряду с пэгилированным белком, в качестве побочных продуктов реакции продуцируютсяN-гидроксисукцинимид и полиэтиленгликолькарбоновая кислота. Нижеследующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объема. В этих примерах используется мутеин ГКСФ. Другие виды ГКСФ могут быть также конъюгированы с ПЭГ методами, проиллюстрированными в настоящем описании. Пример 1. Реагенты пэгилирования. 1. Амидный линкер GABA (P-6GA-1, P12GA-1). Амидные линкерные реагенты GABA содержат 2 цепи ПЭГ с мол. массой либо 6, либо 12 кДа. Структуры см. на фиг. 2-А. 2. Амидный линкер (Р-5 аm-1, Р-10am-1). Были продуцированы амидные линкеры,имеющие мол. массу 5 и 10 кДа. Структуры см. на фиг. 2-В. 3. Амидный линкер. Этот реагент представляет собой коммерчески доступную сукцинимидилпропионовую кислоту (SPA), полученную с использованием молекул ПЭГ с 5, 10, 15 и 20 кДа, и их общая структура проиллюстрирована на фиг. 2-С. 4. Карбамидный линкер. Этот реагент был получен с использованием молекул ПЭГ, имеющих мол.массу 5, 10 и 25 кДа, и его типичная структура проиллюстрирована на фиг. 2-D. 5. Уретановый линкер. Были продуцированы уретановые линкеры с 10 и 20 кДа и их структура показана на фиг. 2 Е. 6. Уретановый линкер. Структура этого коммерчески доступного 36 кДа-ПЭГ-реагента, проиллюстрированного на фиг. 2-G, имеет один конец ПЭГ-реагента,кэппированный трет-бутильной группой. Этот реагент имеет самую высокую молекулярную массу ПЭГ, используемую в этом примере. 7. Тио-уретановый линкер. Структура этого реагента пэгилирования показана на фиг.2-F. Молекулярная масса ПЭГ,используемого в этом реагенте, составляла 20 кДа. Нижеследующие реагенты были получены от Kyowa Hakko Kogyo Co., Ltd. Tokyo, Japan: 1) мутеин Г-КСФ, называемый мутеином ГКСФ; мутеин ГКСФ, конъюгированный с реагентом разветвленного метоксиполиэтиленгликоля (мПЭГ), содержащим 2 цепи м-ПЭГ, имеющего мол.массу либо 6, либо с 12 кДа (PEG-GABA 9NHS, см. фиг. 2 А); и мутеин ГКСФ, конъюгированный с линейным сложноэфирным/амидным 5- и 10 кДа-м-ПЭГ-реагентом (см. фиг. 2 В). Реагенты, м-ПЭГ-сукцинимидилпропионовая кислота-NHS (ПЭГ-SPA), имеющие молекулярные массы 5, 10, 15 и 20 кДа, были закуплены у фирмы Shearwater Polymers (Huntsville, Alabama,см. фиг. 2 С). Нижеследующие реагенты для присоединения ПЭГ к белку были получены отHoffmann-La Roche, Inc: 1) м-ПЭГ-карбамидный линкер (5, 10 и 25 кДа, см. фиг. 2D), 2) м-ПЭГуретановый линкер (10 и 20 кДа, см. фиг. 2 Е), и 3) м-ПЭГ-тиоуретановый линкер (10 и 20 кДа,см. фиг. 2F), а трет-бутил-м-ПЭГ-уретановый линкерный реагент со средней молекулярной массой 36 кДа был получен от DDI Pharmaceuticals Inc. (Mountainview, СА, см. фиг. 2G). Реакции пэгилирования На реакции пэгилирования влияют следующие факторы: 1) рН, 2) температура, 3) время реакции, 4) молярное отношение белка к ПЭГ-реагенту и 5) концентрация белка. При определенной регуляции этих факторов можно направлять данную реакцию на продуцирование преимущественно моно-, ди-, три- и т.п. ПЭГ-конъюгатов. Так, например, реакционными условиями для реагента SРА-ПЭГ 5000 (Nгидроксисукцинимид) Shearwater Polymers являются: 1) рН 7,3, 2) температура 4 С для монои ди-ПЭГ, и комнатная температура для триПЭГ, 3) время реакции для моно-ПЭГ 30 мин; для ди- и три-ПЭГ 4 ч и 4) молярное отношение белка к реагенту 1:30. Для всех реагентов, оптимальные реакционные условия для продуцирования ПЭГ нужного типа определяют отдельно. Эти данные указаны в табл. I. Реакцию прекращают путем подкисления реакционной смеси и замораживания ее при температуре-20 С. Выделение модифицированного и свободного мутеина ГКСФ из реакционной смеси (катионный обмен с использованием сульфопропила (СП Реакционную смесь, содержащую приблизительно 5 мг белка, 10-20-кратно разбавляли водой и рН доводили до 4,5 с использованием ледяной уксусной кислоты. Затем разбавленный образец наносили на колонку, предварительно загруженную 1-2 мл Fractogel EMD SO3 - 650S(ЕМ Separations, Gibbstown, New Jersey), и уравновешенную 10 мМ ацетатом аммония, рН 4,5. Неадсорбированный реагент и побочные продукты реакции удаляли проточным методом. Модифицированный мутеин ГКСФ элюировали в ступенчатом градиенте с использованием 0,15 М NaCl в уравновешивающем буфере. Оставшийся на колонке немодифицированный мутеин ГКСФ постадийно элюировали 0,5 М NaCl в уравновешивающем буфере. Выделенную смесь конъюгата "мутеин ГКСФ-ПЭГ" подвергали стерильной фильтрации на 0,2 мкм-фильтре и 10 хранили в замороженном виде при -20 С. Характеризация конъюгатов "мутеин ГКСФ-ПЭГ". Определение белка Концентрацию белка в очищенных конъюгатах "мутеин ГКСФ-ПЭГ" определяли с использованием А 280=0,86 для 1 мг/мл раствора. Анализ с помощью электрофореза в ПААГ с ДСН Этот анализ проводили с использованием 12 и 15%-ных полиакриламидных гелей или 816%-ных полиакриламидных градиентных гелей в условиях восстановления, как описано Laemmli, Nature 227:680-685, 1970. Определение процентного состава Процентный состав каждого вида (моно-,ди-, три- и т.п.) в различных реакционных смесях конъюгата "мутеин ГКСФ-ПЭГ" определяли в соответствии с денситометрическими измерениями ДСН-ПААГ-гелей, окрашенных кумасси синим (см. табл. II). Определение массы ПЭГ в конъюгатах "мутеин ГКСФ-ПЭГ" Общую массу замещенного ПЭГ в различных препаратах определяли исходя из средней молекулярной массы ПЭГ, путем идентификации отдельных ПЭГ-конъюгатов (моно-, ди- и т.п.), исходя из электрофоретической подвижности, числа присоединенных молекул ПЭГ и процентного состава на основе денситометрических измерений ДСН-ПААГ-гелей, окрашенных кумасси синим. Общая масса ПЭГ конкретного препарата представляет собой сумму его отдельных масс ПЭГ. Отдельную массу ПЭГ вычисляли по следующему уравнению: масса ПЭГ = мол.м.ПЭГ хмолекул ПЭГ х % состав, где мол. масса ПЭГ =5, 10, 20 кДа и т.п.молекул ПЭГ =1, 2, 3 для моно, ди, три,соответственно. Для определения общей массы ПЭГ была также использована масс-спектрометрия(MALDI-TOF). В данном случае, масс-спектр позволял идентифицировать и определить молекулярную массу отдельных ПЭГ-конъюгатов. Молекулярная масса ПЭГ, присоединенного к каждому ПЭГ-конъюгату, представляет собой общую молекулярную массу отдельных ПЭГконъюгатов минус молекулярная масса мутеина ГКСФ (18,9 кДа). Эти величины, умноженные на % состав, дают отдельные массы ПЭГ; и их сумма составляет общую массу ПЭГ. Оба этих метода были использованы для определения масс ПЭГ различных препаратов. Результаты систематизированы в табл. II. Определение уровней эндотоксичности Уровни эндотоксичности определяли методом LAL в соответствии с инструкциями производителей (Associates of Cape Cod, Inc., WoodsHople, Massachusetts). Биологические активности Биологический анализ in vitro на клетках(1991) 19:2767-2773). Результаты и обсуждения Реакция присоединения ПЭГ В целом, результаты показали, что для получения нужного количества конъюгатов (см. табл. I и II), менее реакционноспособные реагенты, такие как карбамидный линкер, требуют более высоких значений рН, более высокой температуры и более высокого молярного отношения белок:реагент, а также более длительного времени проведения реакции. Выделение модифицированного и свободного мутеина ГКСФ из реакционной смеси Типичный профиль элюции показан на фиг. 4. Для удаления следовых количеств примесей и эндотоксина и для осуществления замены буфера для хранения конечного продукта,помимо катионообменной хроматографии, может потребоваться проведение дополнительных стадий, таких как гельпроникающая хроматография. Масштаб метода разделения с использованием сильного катионообменника был увеличен до 30 мг для 20 кДа SPA (амидных) и 20 кДа-уретановых конъюгатов. С использованием этой процедуры были получены почти количественные выходы.% состав и масса ПЭГ. Результаты определения процентного состава и массы ПЭГ систематизированы в табл.II. В эксперименте, проведенном авторами изобретения, в случае использования ПЭГконъюгатов с высокой молекулярной массойGABA), идентификация типа ПЭГ для определения % состава реакционной смеси, исходя из электрофоретической подвижности, является не очень надежной. Для определения массы ПЭГ и идентификации высокомолекулярных и в высокой степени замещенных ПЭГ-конъюгатов, необходимо проводить комбинацию анализов,таких как электрофорез в ДСН-ПААГ, СПВЭЖХ и МС-анализ MALDI-TOF. Однако, моно-ПЭГ и ПЭГ-конъюгаты, полученные с использованием низкомолекулярных ПЭГреагентов (например, 5 кДа) могут быть идентифицированы достаточно точно исходя из их ДСН-ПААГ-профилей. Уровни эндотоксичности С применением метода LAL (лимулюстеста), во всех ПЭГ-конъюгатах было обнаружено 1 ЭЕ/мг эндотоксина (ЭЕ - эндотоксиновая единица), за исключением одного конъюгата, происходящего от уретанового реагента. В этом ПЭГ-конъюгате эндотоксин был обнаружен только после разведения. Было подтверждено, что присутствие эндотоксина не является следствием загрязнения в процессе разведения, а поэтому ингибирование в анализеLAL мог вызвать некий неизвестный материал,присутствующий в данном образце при более 12 высокой концентрации белка. После разведения образца, и вслед за этим разведения ингибирующего материала, был получен положительный результат анализа на эндотоксин. Биологическая активность Биологические активности in vitro и in vivo всех конъюгатов "мутеин ГКСФ - ПЭГ" представлены в табл. II. В основном, наблюдается обратная зависимость междуvitroактивностью и степенью замещения, а также молекулярной массой (Mw) ПЭГ. В противоположность этому, с увеличением Mw замещенного ПЭГ наблюдается увеличение in vivoактивности. Это наблюдение было сделано также другими авторами (Satako-Ishikawa et al. CellStruct Funct. 17 (3) :157-60, 1992). Было высказано предположение, что химическое присоединение ПЭГ-молекул к полипептидному остову мутеина ГКСФ продуцирует некоторую форму конформационных изменений, которые негативно влияют на взаимодействия "рецептор/лиганд", что приводит к снижению аффинности связывания. Кроме того, относительно короткое время инкубирования при проведении анализа in vitro, вероятно, недостаточно для достижения пика активности. С другой стороны,in vivo-анализ на мышах является значительно более продолжительным (дни) и заканчивается через несколько дней после инъекции лекарственного средства. Это более длительное время инкубирования в сочетании с увеличенным временем полужизни в кровотоке конъюгата"ПЭГ-мутеин ГКСФ" компенсирует любую потерю аффинности благодаря пэгилированию. В результате этого достигается максимальная биологическая активность in vivo. Другая гипотеза заключается в том, что конъюгат "ПЭГмутеин ГКСФ" при его инъекции действует как пролекарство. В этом случае, ПЭГ-часть конъюгата "ПЭГ-мутеин ГКСФ" каким-либо образом постоянно отщепляется, что приводит к замедленному высвобождению незначительных количеств свободного мутеина ГКСФ, который способствует поддержанию и усилению in vivoактивности. Однако гипотеза относительно действия конъюгата как пролекарства, не объясняет наблюдаемого базового значения in vivoактивности через 7 дней после введения начальной дозы. Механизм действия в качестве пролекарства маловероятен, поскольку амидная связь между белком и ПЭГ является стабильной и трудно расщепляемой. Из числа 15 исследованных конъюгатов"мутеин ГКСФ-ПЭГ", in vivo-активности P12GA-1, 20 кДа SPA, 20 кДа уретана и 36 кДа уретана были значительно выше, чем активности остальных препаратов (см. фиг. 4 и табл. II). В целом, наблюдается прямая зависимость между молекулярной массой молекулы ПЭГ и увеличением in vivo-активности. Это проиллюстрировано на фиг.5, где увеличение числа ПМН выражается как функция всей массы ПЭГ 13 в ПЭГ-конъюгатах, связанных с амидом (SPA) и мочевиной. Отбор и характеризация конъюгатов "мутеин ГКСФ-ПЭГ" После тщательной оценки химических свойств конъюгатов, биологических свойств и создания лекарственных препаратов для 15 ПЭГ-конъюгатов, для последующей оценки были выбраны три конъюгата: 1) P-12GA-1, 2) 20 кДа SPA и 3) 20 кДа уретан. Полученные из 20 кДа SPA моно-, ди- и три-ПЭГ-конъюгаты, присутствующие в СП-очищенной смеси, оценивали путем сравнения "голова к голове", в результате чего было установлено, что все три конъюгата сохраняли высокую гранулопоэтическую активность у мышей-самок C57BL/6J в течение 5 дней при введении одной дозы 25,2 мкг (табл.III и фиг.4). В противоположность этому, для достижения аналогичной активности, дозы немодифицированного мутеина ГКСФ необходимо вводить ежедневно (данные не показаны). Во всех случаях, за исключением двух (20 кДа SPA и P-12GA-1), in vivo-активность возвращалась до нормальных уровней на 7 день после введения начальных доз мышам (фиг. 6). Как 20 кДаSPA, так и Р-12GА-1-конъюгаты обнаруживали повышенную активность при более низкой дозе,8,4 мкл, и эта активность возвращалась до нормальных уровней на 7 день (см. табл. III). Данные процентного состава (табл. III) показывают,что оба препарата 20 кДа SPA и P-12GA-1 приблизительно на 50% содержат димер, а оставшиеся 50% распределяются между мономером и тримером. В используемых экспериментальных условиях, 20 кДа-уретановый реагент продуцирует преимущественно моно-ПЭГ (см. табл. III).In vitro-активность всех оцененных ПЭГконъюгатов, являющихся преимущественно мономерным производным,обнаруживала обычную картину обратной зависимости от степени замещения, а также от молекулярной массы ПЭГ. In vivo биологическая активность оцененных ПЭГ-конъюгатов обнаруживала прямую зависимость от молекулярной массы ПЭГ в пределах оцененного интервала молекулярных масс(фиг. 5). Заключение Из оцененных 15 конъюгатов "мутеин ГКСФ-ПЭГ", хорошие профили in vivoактивности обнаруживали препараты P-12GA-1,20 кДа SPA и 20 кДа-уретанового линкера. В целом, наилучшие свойства, а также экономичность производства, обнаруживал конъюгат "20 кДа-ПЭГ-мутеин ГКСФ". 14 Таблица I. Реакционные условия, используемые для получения различных ПЭГ-конъюгатов Таблица II. Состав, масса ПЭГ и данные биологической активности различных конъюгатов% состав и массу присоединенного ПЭГ вычисляли исходя из денситометирических измерений ДСН-ПААГ,окрашенного кумасси синим , или с помощью МСанализа MALDI-TOF . (а), (b), (с): каждый представляет собой отдельный биоанализ; приведены данные ПМН на день 5. Таблица III. Состав, масса ПЭГ, сайты присоединения ПЭГ и данные биологической активности для трех лучших молекул Мышам-самкам C57BL/6J вводили 8,4 или 25,2 мкг либо ND-28, (ежедневно), либо ПЭГконъюгата (одну дозу). На день 5 и на день 7 после начала введения доз, брали образцы венозной крови и проводили определение лейкоцитарной формулы.определяли исходя из денситометрических измерений окрашенного кумасси ДСН-ПААГ.определяли с помощью МС MALDI-TOF. 15 Пример 2. Получение 20 кДа ПЭГ, конъюгированного с мутеином рчГКСФ. Модификацию мутеина ГКСФ с использованием 20 кДа метокси-ПЭГ-сукцинимидилпропионовой кислоты (SPA) осуществляли следующим образом. ПЭГ-реагент растворяли в дистиллированной воде при концентрации 200 мг/мл и добавляли в раствор мутеина ГКСФ ( 5 мг/мл) в молярном отношении от 4:1 до 6:1 (избыточный реагент). Реакция протекала при 48 С в течение 20 ч при рН 7,5. В конце реакции, для ее прекращения добавляли ледяную уксусную кислоту. Пэгилированный мутеин ГКСФ (также называемый ПЭГГ) затем очищали от остаточного немодифицированного мутеина, избыточного ПЭГ-реагента и других примесей и буферных компонентов, присутствовавших во время модификации. Наряду с пэгилированным белком, в качестве побочных реакционных продуктов продуцировались Nгидроксисукцинимид и полиэтиленгликолькарбоновая кислота. ПЭГГ очищали с использованием катионообменной хроматографии с последующей ультрафильтрацией. Катионообменную колонку загружали и промывали 20 мМ ацетатом натрия,рН 4,0. В результате элюирования линейным градиентом хлорида натрия, ПЭГГ отделялся от всех других компонентов реакционной смеси. Затем проводили ультрафильтрацию/диафильтрацию для концентрирования ПЭГГ до 4,0 мг/мл и замены буфера на 50 мМ хлорида натрия, 20 мМ ацетата натрия, рН 6,0. Продукты пяти серий пэгилирования и очистки, проведенных в вышеуказанных условиях, анализировали с использованием катионообменной хроматографии, и этот анализ продемонстрировал воспроизводимость реакции пэгилирования мутеина ГКСФ. Эта реакция пэгилирования продемонстрировала воспроизводимость при увеличении ПЭГГ до 2,5 г (конечный выход ПЭГГ) в следующих оптимальных условиях: отношение 20 кДа-SРА-ПЭГ : мутеин = 4 6:1; рН 7,5, 4 С, 20 ч. Определяли средний процентный состав смеси ПЭГГ, который составлял 21,7% моно-ПЭГГ (% отн.станд.откл. = 16,6), 60,3% ди-ПЭГГ (% отн.станд.откл. = 6,6),15,1% три-ПЭГГ (% отн.станд.откл. = 4,0) и 2,9% тетра-ПЭГГ (% отн.станд.откл. = 26,1), как указано в табл. IV. Таблица IV. Катионообменный анализ относительного процентного состава моно-, ди-, три- и тетра-ПЭГГ и в пяти стадиях синтеза ПЭГГ и очистки 16 Пример 3. Мобилизация стволовых клеток периферической крови. Была разработана методика для мобилизации как первичных стволовых клеток, так и коммитированных предшественников костного мозга, и для размножения клеток-предшественников, циркулирующих в периферической крови. Эти стимулированные клетки могут оказаться способными опосредовать раннее и замедленное восстановление после летальной дозы облучения и приживление трансплантата после трансплантации костного мозга или стволовых клеток. Neben S. Marcus, КMauch P:(1993). Восполнение стволовых клеток периферической крови (СКПК) может способствовать сокращению времени восстановления гемопоэтических клеток у пациентов с индуцированной химиотерапией гипоплазией костного мозга, или у пациентов, прошедших курс лечения другими методами миелоабляционной терапии.Experimental Hematology 22:1156 (1994). Для стимуляции мобилизации были использованы как факторы роста, так и химиотерапевтические лекарственные средства. BodineHematology 23:293 (1995). После стимуляции СКПК, мобилизованные клетки собирали путем лейкафереза и хранили в состоянии заморозки вплоть до их использования. Существующие клинические протоколы предусматривают повторный сбор концентратов СКПК путем лейкафереза после стандартной химиотерапии с высокими дозами (СНТ) и повторное ежедневное введение доз или непрерывную инфузию с использованием факторов роста, которая может иногда продолжаться две недели или более.cisplatin. Blood 79:1193 (1992). Исследования,описанные ниже, осуществляли с использованием двух мышиных моделей мобилизации СКПК,где первой моделью служили нормальные мыши, а второй моделью служили мыши, подвергнутые химиотерапии. Эти эксперименты по мобилизации стволовых клеток продемонстрировали повышенную эффективность пэгилированного мутеина ГКСФ настоящего изобретения(ПЭГГ) по сравнению с NEUPOGEN (ГКСФ). Было также установлено явное преимущество 17 пэгилированного мутеина с использованием значительно меньших и более эффективных доз. Эти исследования выявили способность к размножению мобилизованных незрелых мышиных СКПК, стимулированных in vitro с использованием множества факторов роста на седьмой день, при анализе колоний на агаре. Помимо оценки способности образовывать колонии, была проведена оценка полного гематологического профиля и подсчитано абсолютное число нейтрофилов (ANC) в крови всех мышей. Были также определены сывороточные уровни ГКСФ. После оптимизации анализа было осуществлено несколько экспериментов с различной продолжительностью и оценены высокие и низкие дозы ГКСФ. Были использованы экспериментальные модели для оценки мобилизации,индуцированной ГКСФ и циклофосфамидом(цитоксаном), а также для оценки комбинированной терапии с использованием СНТ и цитокина. Материалы и методы. Во всех экспериментах использовали 6-10-недельных самок мышейC57BL/6J, поставляемых из The Jackson Laboratory. Мышам инъецировали В/б на день -1 либо 200 мг/кг цитоксана, либо забуференный фосфатом физиологический раствор в качестве носителя (PBS). На день 0, животных инъецировали s.c. 0,1 мл либо NEUPOGEN (ГКСФ), либо ПЭГГ (20 кДа SPA присоединенный пэгилированный мутеин, партияP20W3), либо РВSноситель, содержащий 1% сыворотку здоровой мыши. Мышам, которые получили Neupogen,ежедневно вводили инъекции в аналогичной дозе, а всем другим мышам вводили носитель. В день умерщвления, из ретроорбитального синуса анестезированных мышей брали периферическую кровь в пробирки, содержащие EDTA. Для каждой группы, небольшой объем собранной цельной крови добавляли в 35 мм 2-чашки для культивирования тканей (с тремя повторами),содержащие 1000 ед/мл рекомбинантного мышиного (рек.мыш.) интерлейкина-3, 100 нг/мл фактора роста стволовых клеток и 1000 ед/мл рек.мыш. интерлейкина-6, в общем объеме 1 мл среды RPMI 1640, дополненной 15% фетальной бычьей сывороткой и 0,35% агара Difco. Культуры на твердом агаре инкубировали в течение одной недели при 37 С в 5% СO2-содержащей атмосфере с повышенной влажностью. Колонии подсчитывали с использованием стереоскопического препаративного микроскопа при темнопольном освещении. Результаты: В первой описанной стадии исследования, нормальным мышам вводили ежедневные инъекции 25 мкг/мышь NEUPOGEN на дни 0-5, или одну инъекцию 25 мкг/мышь ПЭГГ на день 0. Мышей умерщвляли на 3-7 день. Как показано на фиг. 7, мобилизация, продемонстрированная по образованию колоний, значительно увеличивалась для мышей, которым инъецировали NEUPOGEN, на 3 18 и 4 день, но постепенно возвращалась на базовые уровни на 5 день (несмотря на инъекцииNEUPOGEN на протяжении 5 дней). С другой стороны, у мышей, которым были инъецированы ПЭГГ, обнаруживалось более высокое число колоний, которое оставалось на уровне "плато" на протяжении 7 дней. Парадигма химиотерапевтической модели была аналогичной. Мыши СНТ-группы получали инъекцию цитоксана на день -1. В последующие дни мышам давали только наполнитель, а другие мыши подвергались комбинированной терапии либо ежедневными инъекциямиNEUPOGEN на день 0-5, либо одной инъекцией ПЭГГ на день 0. На фиг. 8 показан пик числа колоний у мышей, обработанных цитоксаном на день 4, причем, в последующие дни, их число постепенно возвращалось на базовый уровень. Группы, обработанные NEUPOGEN и ПЭГГ,обнаруживали пик на 5-й день, что свидетельствовало о значительном увеличении числа колоний. Однако в течение 6- и 7-го дня, число колоний у мышей, обработанных цитоксаном + ПЭГГ, оставались на очень высоком уровне по сравнению с группой, обработанной цитоксаном+ NEUPOGEN. На фиг. 9 продемонстрирован синергический эффект комбинированной терапии по сравнению с эффектом, наблюдаемым при обработке одним цитоксаном или одним ГКСФ. Результаты второго исследования представлены на фиг. 10 и 11. Нормальные мыши,которым ежедневно в течение 10 дней вводили инъекции более низкой дозы NEUPOGEN, 3 мкг/мышь, обнаруживали относительно низкий уровень "многофазной" мобилизации в течение всего наблюдаемого периода исследования. Животные, которым вводили одну инъекцию дозы ПЭГГ 3 мкг/мышь, обнаруживали приблизительно в пять раз большее число мобилизованных предшественников в периферической крови на 4-й день, хотя этот эффект был единственной"вспышкой", которая наблюдалась, главным образом, в течение 6 дней. У мышей, обработанных цитоксаном, одна доза 3 мкг/мышь ПЭГГ индуцировала уровень мобилизации СКПК, который был приблизительно эквивалентен уровню мобилизации, наблюдавшемуся у мышей, получавших в течение 10 дней ежедневные дозы 3 мкг/день (фиг. 11). Обе группы обнаруживали пики мобилизации предшественников на 5-й день, и величина этих пиков была идентичной. Их различие заключается, очевидно, лишь в том, что NEUPOGEN обнаруживал слегка более продолжительное действие. Число колоний у СНТ-модели в 4-10 раз превышало число колоний, наблюдаемое у нормальных мышиных моделей. Эти эксперименты продемонстрировали,что существует два потенциальных преимущества пэгилированного мутеина по сравнению с 19 сравнению с NEUPOGEN, способность ПЭГ индуцировать мобилизацию СКПК является более эффективносй как у нормальных мышей,так и мышей, подвергнутых химиотерапии. Вовторых, как было показано, у мышей пэгилированный мутеин является более эффективным,чем NEUPOGEN, при его использовании в более низких дозах и в более эффективных режимах введения, чем те дозы и режимы, которые обычно используются с применением клинического продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Физиологически активный конъюгат,имеющий формулу где G представляет гранулоцитарный колониестимулирующий фактор, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью в указанном конъюгате, R представляет алкил с прямой или разветвленной цепью, имеющий от одного до шести атомов углерода, n представляет целое число от 420 до 550, a m представляет целое число от 1 до 5. 2. Конъюгат по п.1, где R представляет метил. 3. Конъюгат по п.2, где n равно 450-490. 4. Конъюгат по п.2, где m равно целому числу от 1 до 4. 5. Конъюгат по п.4, где m равно 2. 6. Конъюгат по п.1, где гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ, имеющий последовательность,показанную на фиг. 1. 7. Конъюгат по п.1, где n равно от 450 до 490. 8. Конъюгат по п.1, где m равно целому числу от 1 до 4. 9. Конъюгат по п.8, где m равно 2. 10. Конъюгат по п.1, который имеет более продолжительное время полужизни в кровотоке и более высокую гранулопоэтическую активность in vivo, чем соответствующий неконъюгированный гранулоцитарный колониестимулирующий фактор. 11. Конъюгат по п.10, где гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1. 12. Физиологически активный конъюгат,имеющий формулу где R представляет метил; n равно 450-490; m равно 2; a G представляет мутеин ГКСФ,имеющий последовательность, показанную на фиг. 1, без тех его аминогрупп, которые обра 004685 20 зуют амидную связь с полиэтиленгликолевой частью данного конъюгата. 13. Композиция, содержащая физиологически активные конъюгаты, имеющие формулу где G в каждом конъюгате представляет гранулоцитарный колониестимулирующий фактор,без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью в данных конъюгатах; R в каждом конъюгате независимо представляет алкил с прямой или разветвленной цепью, имеющий от одного до шести атомов углерода; n в каждом конъюгате независимо представляет целое число от 420 до 550; m в каждом конъюгате независимо представляет целое число от 1 до 4; процентное содержание конъюгатов, где m=1, составляет от 18 до 25%; процентное содержание конъюгатов,где m=2, составляет от 50 до 66%; процентное содержание конъюгатов, где m=3, составляет от 12 до 16%; а процентное содержание конъюгатов, где m=4, составляет вплоть до 5%. 14. Композиция по п.13, где в каждом конъюгате R представляет метил. 15. Композиция по п.13, где n и R являются одинаковыми в каждом конъюгате. 16. Композиция по п.13, где n равно от 450 до 490. 17. Композиция по п.13, где в каждом конъюгате гранулоцитарным колониестимулирующим фактором является мутеин ГКСФ,имеющий последовательность, показанную на фиг. 1. 18. Композиция, содержащая физиологически активные конъюгаты, имеющие формулу где R представляет метил; n является одинаковым в каждом конъюгате и представляет целое число от 450 до 490; G представляет мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1, без тех его аминогрупп, которые образуют амидную связь с полиэтиленгликолевой частью данного конъюгата, и где m в каждом конъюгате независимо представляет целое число от 1 до 4; процентное содержание конъюгатов, где m=1, составляет от 18 до 25%; процентное содержание конъюгатов, где m=2, составляет от 50 до 66%; процентное содержание конъюгатов, где m=3, составляет от 12 до 16%; а процентное содержание конъюгатов, где m=4,составляет вплоть до 5%. 19. Способ получения конъюгата ПЭГГКСФ, имеющего более продолжительное время полужизни в кровотоке и более высокую гранулопоэтическую активность in vivo, чем соответствующий неконъюгированный ГКСФ, 21 где указанный способ заключается в ковалентном связывании реагента формулы 22 с указанным ГКСФ с получением указанного конъюгата. 20. Способ по п.19, где указанным ГКСФ является мутеин ГКСФ, имеющий последовательность, показанную на фиг. 1 Фиг. 1. Первичная структура мутеина ГКСФ Фиг.3. Выделение 20 кДа ПЭГ-модифицированного и немодифицированного мутеина ГКСФ. Типичный профиль элюции для ПЭГреакционной смеси. Колонка: 1-2 мл Fractogel EMD Фиг. 4. Активность мутеина ПЭГ- ГКСФ на 5-й день после одной инъекции. Крысам-самкам C57BL/6J подкожно инъецировали 25,2 мкг пэгилированных конъюгатов мутеина ГКСФ; на пятый день после введения, из ретроорбитального синуса брали образцы венозной крови. Гематологический анализ и определение лейкоцитарной формулы проводили на счетчике Coulter; число полученных нейтрофилов стандартизировали по отношению к наполнителю (контролю) для каждого эксперимента. Данные представлены как среднее значениестанд. ошибка для 4 мышей на группу. Фиг. 7. Анализ на мобилизацию мышиных колоний СКПК. Фиг. 5. Увеличение числа ПМН в зависимости от массы ПЭГ (кДа) в конъюгатах "связанный с амидом и мочевиной мутеин ГКСФ - ПЭГ. Фиг. 8. Анализ на мобилизацию мышиных колоний СКПК Фиг. 6. Активность мутеина ПЭГ-ГКСФ на 7-й день после одной инъекции. Крысам-самкам C57BL/6J подкожно инъецировали 25,2 мкг конъюгатов "ПЭГ-мутеин ГКСФ"; на пятый день после введения, из ретроорбитального синуса брали образцы венозной крови. Гематологический анализ и определение лейкоцитарной формулы проводили на счетчике Coulter; число полученных нейтрофилов стандартизировали по отношению к наполнителю (контролю) для каждого эксперимента. Данные представлены как среднее значениестанд. ошибка для 4 мышей на группу. Фиг. 9. Анализ на мобилизацию мышиных колоний СКПК Фиг. 10. Анализ на мобилизацию мышиных колоний СКПК Фиг. 11. Анализ на мобилизацию мышиных колоний PBSC
МПК / Метки
МПК: A61K 47/48, C07K 14/535
Код ссылки
<a href="https://eas.patents.su/14-4685-konyugaty-gksf.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты гксф</a>
Предыдущий патент: Новая кристаллическая форма n-[4- [2- ( 2-амино-4,7-дигидро-4-оксо-3h-пирроло[ 2,3-d]пиримидин-5-ил) этил] бензоил] -l-глутаминовой кислоты и способ ее получения
Следующий патент: Лекарственный препарат для перорального применения
Случайный патент: Способ борьбы с тлей на растениях












