Производные пиридонкарбоновой кислоты и антибактериальная композиция на их основе
Формула / Реферат
1. Стереохимически чистое замещенное производное пиридонкарбоновой кислоты, представленное формулой (I)
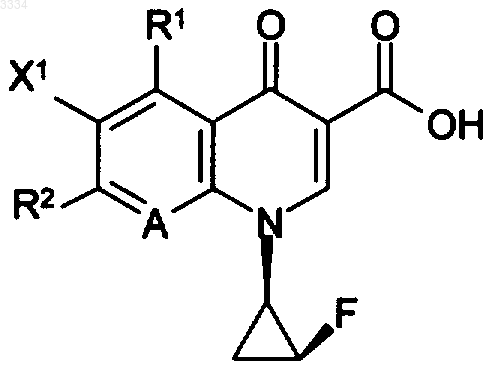
где X1 представляет атом фтора,
R1 представляет аминогруппу, атом водорода,
R2 обозначает группу, представленную формулой (II)
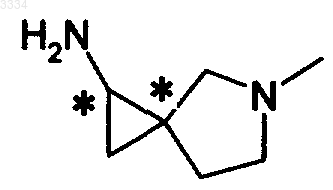
А представляет атом углерода, замещенный метильной группой.
2. Стереохимически чистое соединение по п.1, которое представляет собой 5-амино-7-[1-амино-5-аза-спиро[2,4]гептан-5-ил]-6-фтор-1-[(1R,2S)-2-фторциклопропил]-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту или ее соль.
3. Стереохимически чистое соединение по п.1, которое представляет собой 7-амино-[1-амино-5-азаспиро[2,4]гептан-5-ил]-6-фтор-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту или ее соль.
4. Антибактериальная композиция, которая содержит эффективное количество соединения формулы (1) или его соли в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Область техники Данное изобретение относится к антибактериальному соединению, которое может использоваться в виде лекарственных средств для людей, лекарственных средств для животных,лекарственных средств для рыб или антибактериальных консервантов, а также к содержащим его антибактериальному средству или препаратам. Предпосылки изобретения Хотя производные хинолона, имеющие 1 амино-5-азаспиро[2,4]гептильную группу, описаны в европейских патентных публикациях 550016 А и 550025 А, ничего не известно о производном хинолона по настоящему изобретению, имеющему 1-амино-5-азабиспиро[2,4] гептильную группу в положении 7 и галогенциклопропильную группу в положении 1, которое представляет собой один изомер. В последние годы были найдены синтетические хинолоновые антибактериальные средства, обладающие не только антибактериальной активностью, но также превосходным биологическим распределением, таким как пероральная всасывающая способность, распределение в органах, степень экскреции с мочой и тому подобное, и ряд таких соединений теперь применяется в клинике в качестве химиотерапевтических средств, эффективных против различных инфекционных заболеваний. Однако в последние годы в клинической области возросло наличие бактериальных штаммов, имеющих низкую восприимчивость к этим лекарственным средствам. Кроме того, как и в случае Staphylococcusaureus (MRSA), имеющему меньшую чувствительность против -лактамных антибиотиков,число штаммов, имеющих низкую чувствительность к синтетическим хинолоновым антибактериальным средствам, возросло даже среди штаммов, которые устойчивы к другим лекарственным средствам, не являющихся синтетическими хинолоновыми антибактериальными средствами. Вследствие этого разработка лекарственных средств, имеющих более высокую эффективность, является актуальной в клинической области. Описание изобретения Авторы настоящего изобретения полагают,что строение заместителей в положениях 7 и 1 играет важную роль в антибактериальной активности, эффективности и безопасности синтетических хинолоновых антибактериальных средств. Вследствие этого авторы настоящего изобретения провели интенсивные исследования по созданию соединения, имеющего высокую антибактериальную активность против широкого спектра бактерий, включая хинолонустойчивые штаммы, и в результате этого нашли, что производное хинолона, имеющее в положении 7 заместитель, образованный из гетероциклического спиросоединения, гетероатомом которого является азот, проявляют сильную 2 антибактериальную активность против грамотрицательных и грамположительных бактерий,в частности, хинолонустойчивых бактерий,включая MRSA, и что не только антибактериальную активность, но также превосходную эффективность и безопасность можно достичь в случае производного хинолона, у которого положение 1 замещено галогенциклопропильной группой, в частности, фторциклопропильной группой. У производного хинолона по настоящему изобретению имеется только пара энантиомеров, относящаяся к остатку галогенциклопропанового кольца в положении 1, даже при отсутствии стереоизомерии заместителей в других положениях. Это возникает по причине стереохимической связи между радикалом пиридонкарбоновой кислоты и атомом галогена циклопропанового кольца. Когда изомеры, образованные этим путем, являются рацемическими,такое производное является смесью антиподов и его можно вводить в качестве лекарственного средства как таковое. С другой стороны, когда стереоизомерия также имеется в других положениях, в частности, у заместителя в положении 7, кроме стереоизомерии радикала галогенциклопропенового кольца, производное хинолона включает диастереоизомеры, что подразумевает наличие 4 или более стереоизомеров. Поскольку смесь диастереомеров является смесью соединений,имеющих разные физические свойства, эту смесь вводить в качестве лекарственного средства трудно. Авторы настоящего изобретения приложили много усилий для разработки хинолинового соединения, состоящего из одного стереоизомера даже в случае 1-(1,2-цис-2-галогенциклопропил)замещенного производного хинолона, которое имеет диастереомеры. В результате этого авторы настоящего изобретения достигли успеха в получении каждого энантиомера цис-2-фторциклопропиламина в виде чистого соединения. Авторам настоящего изобретения удалось также получить каждый из энантиомеров производного хинолона, присутствие которых основано на конфигурации фторциклопропанового кольца, в виде чистого изомера из чистого цис-2-фторциклопропиламина. Авторам настоящего изобретения удалось также получить каждый изомер гетероциклического спиросоединения,имеющий асимметричный атом углерода и азот в качестве гетероатома, в виде чистого соединения. Успех в получении такого производного хинолона и гетероциклического спиросоединения, имеющего атом азота в качестве гетероатома, оба из которых могут использоваться в качестве промежуточных продуктов, делает возможным синтез оптически активного производ 3 ного хинолона в виде отдельного диастереомера. Согласно этому настоящее изобретение стало возможным на основе обнаружения того факта, что новое производное хинолона по настоящему изобретению, которое имеет группу,образованную из гетероциклического спиросоединения, в положении 7, и галогенциклопропильную группу в положении 1, является соединением с высокой безопасностью и проявляет превосходную активность против широкого спектра бактериальных видов, включая хинолонустойчивые штаммы. Соответственно этому настоящее изобретение относится к производному пиридонкарбоновой кислоты, представленному формулой А представляет атом углерода, замещенный метильной группой,или его соли. Настоящее изобретение относится также к вышеуказанному соединению или его соли, в котором R2 в формуле (I) представляет стереохимически чистый заместитель. Настоящее изобретение относится также к антибактериальному средству, которое содержит вышеуказанное соединение формулы (I) или его соль в качестве активного ингредиента. Другие объекты и преимущества настоящего изобретения станут ясными из описания. Далее описаны заместители соединения по настоящему изобретению, представленного формулой (I). Когда R1 представляет аминогруппу, эта группа может быть защищена обычными защитными группами. Примеры таких защитных групп включают алкоксикарбонильные группы, например третбутоксикарбонил, 2,2,2-трихлорэтоксикарбонил и тому подобное, аралкилоксикарбонильные группы, например бензилоксикарбонил, параметоксибензилоксикарбонил, паранитробензилоксикарбонил и тому подобное, ацильные группы,например ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и тому подобное, алкильные или аралкильные группы, например трет-бутил, бензил, паранит 003334R2 обозначает группу, представленную следующей формулой (II) которая образована из гетероциклического спиросоединения, представленного следующей формулой(хотя здесь показывается случай, в котором атом азота кольца пирролидина замещен водородом, он может быть замещен другим заместителем, например защитной группой для атома азота). Эта группа имеет аминогруппу в качестве заместителя у спирокольца из метиленовой цепи. Поскольку этот радикал как бы имеет структуру алициклического циклического амина, авторы настоящего изобретения считают,что эта структура играет важную роль в появлении замечательных свойств соединения по настоящему изобретению. Термин "гетероциклическое спиросоединение", применяемый здесь, обозначает соединение, которое имеет структуру, образованную замещением атома углерода, создающего циклическую структуру алициклического спиросоединения, гетероатомом, например атомом азота, и тому подобное. Присоединение R2 в положение 7 кольца хинолина может быть осуществлено наиболее предпочтительно по кольцевому атому азота, а также и по кольцевому атому углерода группыR2. Когда R2 имеет стереоизомерию и соединение, содержащее хинолоновое кольцо, подвергают взаимодействию со смесью стереоизомеров гетероциклического спиросоединения, являющегося исходным для заместителя,представленного формулой (II), полученное производное хинолона становится смесью диастереомеров из-за наличия 1,2-цис-2 галогенциклопропильной группы в положении 1. Поэтому, когда R2 имеет стереоизомерию,желательно подвергать взаимодействию только один из изомеров гетероциклического спиросоединения с соединением, содержащим хинолоновое кольцо. Когда R2 вводят в положение 7 хинолона и,по меньшей мере, один из R3 и R4 гетероциклического спиросоединения представляет атом 5 водорода, его можно ввести в реакцию в виде соединения, у которого R3 или R4 является не атомом водорода, а обычной защитной группой. Примеры таких защитных групп включают алкоксикарбонильные группы, например третбутоксикарбонильную, 2,2,2-трихлорэтоксикарбонильную и тому подобное, аралкилоксикарбонильные группы, например бензилоксикарбонил, параметоксибензилоксикарбонил, паранитробензилоксикарбонил и тому подобное, ацильные группы, например ацетил, метоксиацетил,трифторацетил, хлорацетил, пивалоил, формил,бензоил и тому подобное, алкильные или аралкильные группы, например трет-бутил, бензил,паранитробензил, параметоксибензил, трифенилметил и тому подобное, алкилсульфонильные группы или галогеналкилсульфонильные группы, например метансульфонил, трифторметансульфонил и тому подобное, и арилсульфонильные группы, например бензолсульфонил,толуолсульфонил и тому подобное. Далее описана галогенциклопропильная группа в N1-положении. Что касается стереохимического окружения этого радикала, особенно желательно, чтобы атом галогена и часть пиридонкарбоновой кислоты имели цис-конфигурацию относительно кольца циклопропана. Энантиомерные изомеры образуются только этим цис-2-галогенциклопропильным радикалом в положении 1, вне зависимости от стереоизомерии заместителей других положений, в частности R2 в положении 7. Сильная антибактериальная активность и высокая безопасность обнаружены у каждого из этих изомеров. Когда соединение (I) по настоящему изобретению имеет структуру, которой присущи стереоизомеры, и такое соединение по настоящему изобретению вводят людям и животным,желательно вводить соединение, представляющее собой индивидуальный диастереомер. Термин "представляющий собой индивидуальный диастереомер" обозначает не только случай, в котором другой диастереомер совершенно отсутствует, но также случай химически чистой степени. Другими словами, другой диастереомер может содержаться в такой степени, которая не оказывает влияние на физические константы и физиологическую активность. Кроме того, термин "стереохимически чистый" обозначает, что, когда соединение имеет несколько изомерных разновидностей, обусловленных его асимметричным атомом углерода, соединение состоит только из одного из этих изомерных разновидностей. Термин "чистый" в этом случае можно рассматривать таким же образом, как в вышеуказанном случае диастереомера. Производное пиридонкарбоновой кислоты по настоящему изобретению можно применять в свободном виде или в виде кислотноаддитивной соли по его карбоксильной группе. 6 Примеры кислотно-аддитивной соли включают соли неорганических кислот, например гидрохлорид, сульфат, нитрат, гидробромид, гидроиодид, фосфат и тому подобное, и соли органических кислот,например ацетат,метансульфонат, бензолсульфонат, толуолсульфонат, цитрат, малеат, фумарат, лактат и тому подобное. Соль по карбоксильной группе может быть любой солью из неорганических и органических солей, например солью лития, солью натрия,солью калия и подобными солями щелочных металлов, солью магния, солью кальция и подобными солями щелочно-земельных металлов,аммониевой солью, солью триэтиламина, сольюN-метилглюкамина, солью трис(гидроксиметил) аминометана и тому подобными солями. Кроме того, эти свободные формы, кислотно-аддитивные соли и соли карбоксильной группы производного пиридонкарбоновой кислоты могут присутствовать в виде гидратов. С другой стороны, производные хинолона,у которых радикал карбоновой кислоты является сложным эфиром, пригодны в качестве синтетических промежуточных продуктов и пролекарств. В качестве синтетических промежуточных продуктов пригодны, например, алкиловые эфиры, бензиловые эфиры, алкоксиалкиловые эфиры, фенилалкиловые эфиры и фениловые эфиры. Примерами сложных эфиров, которые применяют в качестве пролекарств, являются эфиры, которые легко гидролизуются в живом организме с образованием свободной карбоновой кислоты, например, ацетоксиметиловый эфир, пивалоилоксиметиловый эфир, ацетоксикарбониловый эфир, эфир холина, диметиламиноэтиловый эфир, 5-инданиловый эфир, фталидиниловый эфир и оксоалкиловые эфиры, например 5-алкил-2-оксо-1,3-диоксол-4-илметиловый эфир, 3-ацетокси-2-оксобутиловый эфир и тому подобное. Соединение по настоящему изобретению,представленное формулой (I), можно получить различными способами. В предпочтительном примере его можно получить взаимодействием гетероциклического спиросоединения формулыR2-H (где R2 такой, как определен для вышеуказанной формулы (II) в отношении формулы (I),за исключением того, что R3 и/или R4 может образовать защитную группу Rx атома азота) или его кислотно-аддитивной соли с соединением (содержащее хинолоновое кольцо соединения), представленным формулой (IV) где Х представляет группу, которая является уходящей группой, например, атом фтора, атом 7 хлора, атом брома, алкилсульфонильная группа,имеющая от 1 до 3 атомов углерода, или арилсульфонильная группа, например бензолсульфонильная группа, толуолсульфонильная группа или тому подобное;R представляет атом водорода, фенильную группу, ацетоксиметильную группу, пивалоилоксиметильную группу, этоксикарбонильную группу, группу холина, диметиламиноэтильную группу, 5-инданильную группу, фталидинильную группу, 5-алкил-2-оксо-1,3-диоксол-4 илметильную группу, 3-ацетокси-2-оксобутильную группу, алкильную группу, имеющую от 1 до 6 атомов углерода, алкоксиметильную группу, имеющую от 2 до 7 атомов углерода, или фенилалкильную группу, состоящую из алкиленовой группы, имеющей от 1 до 6 атомов углерода, и фенильной группы; или группу, представленную формулой (V) где каждый из R11 и R12 представляет атом фтора или низшую алкилкарбонилоксигруппу; и Х 1, X2, R1 и А такие, как определены для формулы (I). Защитная группа Rx для атома азота представляет любую группу, обычно используемую в этой области, примеры таких защитных групп включают алкоксикарбонильные группы, например трет-бутоксикарбонил, 2,2,2-трихлорэтоксикарбонил и тому подобное, аралкилоксикарбонильные группы, например бензилоксикарбонил,параметоксибензилоксикарбонил,паранитробензилоксикарбонил и тому подобное, ацильные группы, например ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и тому подобное, алкильные или аралкильные группы, например третбутил, бензил, паранитробензил, параметоксибензил, трифенилметил и тому подобное, алкилсульфонильные или галогеналкилсульфонильные группы, например метансульфонил, трифторметансульфонил и тому подобное, и арилсульфонильные группы, например бензолсульфонил, толуолсульфонил и тому подобное. Когда R представляет алкильную группу,имеющую от 1 до 6 атомов углерода, алкоксиметильную группу, имеющую от 2 до 7 атомов углерода, или аралкильную группу, состоящую из алкиленовой группы, имеющей от 1 до 6 атомов углерода, и фенильной группы, интересующее соединение, представленное формулой (I),можно получить путем преобразования полученных эфиров карбоновой кислоты в соответствующую карбоновую кислоту в кислых или основных условиях, которые обычно используют для гидролиза эфиров, и, если необходимо,удалением защитной группы в соответствующих подходящих условиях. Когда R в соединении формулы (IV) обозначает группу, представленную вышеуказан 003334 8 ной формулой (V), его преобразование в соответствующую карбоновую кислоту можно осуществить путем обработки продукта кислотным или основным соединением после реакции замещения гетероциклическим спиросоединением. Реакцию замещения гетероциклического спиросоединения соединением формулы (IV) можно проводить в растворителе или без него. Когда применяют растворитель, он должен быть инертным в условиях реакции. Примеры подходящих растворителей включают диметилсульфоксид, пиридин, ацетонитрил, этанол, хлороформ, диметилформамид, диметилацетамид, Nметилпирролидон, тетрагидрофуран, воду, 3 метоксибутанол и их смеси. Реакцию можно проводить при температуре обычно от комнатной температуры до 200 С,предпочтительно от 25 до 150 С. Время реакции от около 30 мин до 48 ч, реакция обычно завершается за время от около 30 мин до 2 ч. Реакцию удобно проводить в присутствии акцептора кислоты, который включает неорганические основания, например, карбонаты и бикарбонаты щелочных металлов или щелочноземельных металлов, и органические основные соединения, например триэтиламин, пиридин и тому подобное. Гетероциклическое спиросоединение, у которого гетероатом является азотом, можно получить, например, следующим способом. А именно, 1-бензилоксикарбонил-3-гидроксипирролидин подвергают взаимодействию с оксалилхлоридом и диметилсульфоксидом с получением 1-бензилоксикарбонил-3-пирролидона. Это соединение затем подвергают взаимодействию с раствором, полученным из цинка, тетрахлорида титана и дихлорметана, в результате чего получают 1-бензилоксикарбонил-3-метиленпирролидин. Это соединение подвергают взаимодействию с этилдиазоацетатом в присутствии родиевого катализатора, получая 5 бензилоксикарбонил-3-этоксикарбонил-5-азаспиро[2.4]гептан. Хотя это соединение представляет собой смесь диастереомеров, эти изомеры можно отделить друг от друга колоночной хроматографией на силикагеле или высокоэффективной жидкостной хроматографией. Каждый из полученных таким образом изомеров подвергают взаимодействию с основанием обычным способом для проведения гидролиза эфира, посредством чего получают 5 бензилоксикарбонил-5-азаспиро[2,4]гептан-1 карбоновую кислоту. Когда это соединение подвергают реакции Курциуса в присутствии трет-бутанола, его можно преобразовать сразу в защищенный 5-бензилоксикарбонил-1-третбутоксикарбониламино-5-азаспиро[2,4]гептан. Эту реакцию можно легко осуществить при использовании дифенилфосфорилазида, но синтез промежуточного азида не ограничивается этим способом и можно применять любой обычный 9 синтетический способ. Хотя каждое из полученных таким образом соединений является рацемическим, содержащим пару диастереомеров, было найдено, что оптические изомеры этого соединения можно разделить высокоэффективной жидкостной хроматографией, используя хиральную колонку. Когда бензилоксикарбонильную группу удаляют из полученного таким образом изомера 5-бензилоксикарбонил 1-трет-бутоксикарбониламино-5-азаспиро[2,4] гептана каталитическим гидрированием обычным способом, получают 1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептан, представляющий собой один оптический изомер. цис-2-Фторциклопропиламин,представляющий собой один изомер, который пригоден для синтеза соединения формулы (I), который представляет собой также один изомер, можно синтезировать, например, в соответствии со способом, описанным в JP-A-2-231475 (термин"JP-A", используемый здесь, обозначает "непрошедшую экспертизу опубликованную заявку на патент Японии"). Соединение формулы (IV),представляющее собой один изомер, можно синтезировать из полученного таким образом оптически активного производного цис-2 фторциклопропиламина, например, в соответствии со способом, описанным в JP-A-2-231475. Поскольку соединение по настоящему изобретению проявляет сильную антибактериальную активность, его можно применять в качестве лекарственных средств для человека,животных и рыб или консервантов агрохимикатов и кормов. Когда соединение по настоящему изобретению применяют в качестве лекарственного средства для человека, его доза может быть в диапазоне от 50 мг до 1 г, предпочтительно от 100 до 300 мг, на взрослого человека в день. Когда его применяют для животных, его доза варьируется в зависимости от цели введения (лечение или профилактика), вида и размера каждого животного, которому вводят это соединение, вида инфекционных патогенных бактерий и степени инфекции, но обычно она находится в диапазоне от 1 до 200 мг, предпочтительно,от 5 до 100 мг, в день на 1 кг массы тела животного. Суточную дозу можно применять один раз в день или ее можно делить на 2-4 дозы на день. Если необходимо, суточная доза может превышать указанный выше диапазон. Поскольку соединение по настоящему изобретению активно для широкого ряда микроорганизмов, которые вызывают различные типы инфекционных болезней, оно может излечивать, предупреждать или облегчать болезни,вызванные этими патогенными микроорганизмами. Примеры бактерий и подобных бактериям микроорганизмов, чувствительных к соединению настоящего изобретения, включают родCampylobacter, Chlamydia trachomatis и тому подобное. Примеры болезней, вызванных этими патогенными микроорганизмам, включают фолликулит, фурункул, карбункул, рожистое воспаление, флегмону, лимфангиит, гнойное воспаление, подкожный абсцесс, гидраденит, концентрированные угри, инфекционную атерома, периректальный абсцесс, мастит, поверхностную вторичную инфекцию, например раны, ожоговой раны, операционной раны и тому подобное,фаринголарингит, острый бронхит, тонзиллит,хронический бронхит, бронхоэктаз, диффузный панбронхиолит, вторичную инфекцию хронической респираторной болезни, пневмонию, пиелонефрит, цистит, простатит, эпидидимит, гонококковый уретрит, негонококковый уретрит,холецистит, холангит, бактериальную дизентерию, энтерит, аднексит матки, внутриматочную инфекцию, бартолинит, блефарит, ячмень, дакриоцистит, тарзаденит, корнеальную язву, воспаление среднего уха, синусит, воспаление периодонта, воспаления надкостницы черепа, воспаление челюсти, перитонит, эндокардит, сепсис, менингит, кожную инфекцию и тому подобное. Соединение по настоящему изобретению эффективно также против различных микроорганизмов, которые вызывают инфекционные болезни у животных, например животных, которые принадлежат к роду Escherichia, Salmonella, Pasteurelle, Haemophilus, Bordetella,Staphylococcus, Mycoplasma и тому подобное. Иллюстративные примеры таких болезней включают колибактериоз, пуллороз, куриный сальмонеллез, холеру птиц, инфекционный катар верхних дыхательных путей, стафилококковую инфекцию, инфекцию микоплазмой и тому подобное в случае птиц, колибактериоз, сальмонеллез, пастереллез, инфекцию haemophilus,атрофический ринит, экссудативный эпидермис,инфекцию микоплазмой и тому подобное в случае свиней, колибактериоз, сальмонеллез, геморрагический сепсис, инфекцию микоплазмой,коровью плевропневмонию, коровий мастит и тому подобное в случае домашнего крупного скота, колисепсис, инфекцию сальмонеллами,геморрагический сепсис, маточную эмпиему,цистит и тому подобное в случае собак и экссудативный плеврит, цистит, хронический ринит,инфекцию haemophilus, диарею котят, инфекцию микопазмой и тому подобное в случае кошек. Антибактериальное средство, которое содержит соединение по настоящему изобрете 11 нию, можно получить с применением различных, обычно используемых способов получения лекарственных средств путем выбора подходящей лекарственной формы, соответствующей каждому методу введения. Примеры лекарственной формы антибактериального средства,которая содержит соединение настоящего изобретения в качестве активного компонента,включают пероральные препараты, например,таблетки, порошки, капсулы, растворы, сиропы, эликсиры, масляные или водные суспензии и тому подобное. При применении в качестве инъекций,препарат может содержать стабилизирующее средство, антисептическое средство и солюбилизирующее средство. В зависимости от ситуации, раствор, который может содержать такие вспомогательные вещества, можно помещать в контейнеры и изготовлять твердый препарат сушкой замораживанием или подобным образом, который перед его применением нужно снова растворять. Кроме того, контейнер можно заполнить разовой дозой или несколькими дозами. Антибактериальное средство по настоящему изобретению можно изготовить также в форме препаратов для наружного применения,например, растворов, суспензий, эмульсий, гелей, кремов, лосьонов, спреев и тому подобное. Твердые препараты содержат фармацевтически приемлемые добавки вместе с активным соединением, их можно получить смешиванием этих добавок, необязательно выбранных, например, из наполнителей, связующих, дезинтегрирующих средств,солюбилизирующих средств, увлажнителей, смазывающих веществ и тому подобное. Жидкие препараты включают растворы,суспензии, эмульсии и подобные формы, которые могут содержать суспендирующие средства, эмульгирующие средства и подобные средства в качестве добавок. Когда соединение по настоящему изобретению применяют для животных, его можно вводить, например, способом, в котором соединение вводят перорально непосредственно или после добавления его в корма, или другим способом, в котором соединение изготовляют в виде раствора и затем вводят перорально непосредственно или после добавления в питьевую воду или корма, или инъекцией. Когда соединение по настоящему изобретению вводят животным, его можно изготовить необязательно в форме порошков, тонкоизмельченной пудры, растворимых порошков, сиропов или инъекций в соответствии с обычно применяемыми в этой области способами. Примеры готовых препаративных форм фармацевтических препаратов приведены далее. 12 Пример препарата 1 (капсулы): Соединение целевого примера 2 Кукурузный крахмал Кальциевая соль карбоксиметилцеллюлозы Гидроксиметилцеллюлоза Стеарат магния Всего Пример препарата 2 (раствор): Соединение целевого примера 1 1-10 г Уксусная кислота или гидроксид натрия 0,5-2 г Этилпараоксибензоат 0,1 г Очищенная вода 88,9-98,4 г Всего 100 г Пример препарата 3 (порошок для применения в смеси с кормом): Соединение целевого примера 2 Кукурузный крахмал Коллоидальный кремневый ангидрид Всего Лучший способ осуществления изобретения Примеры Следующие целевые и ссылочные примеры приводятся для дальнейшей иллюстрации настоящего изобретения, но никоим образом не для его ограничения. Антибактериальную активность оптически активных соединений,представляющих интерес, определяли в соответствии со стандартным методом, разработанным Японским обществом химиотерапии. Результаты приводятся в таблице в виде МИК Пример А. 1-Бензилоксикарбонил-3-пирролидон. Раствор 16,58 мл (233,6 ммоль) диметилсульфоксида в дихлорметане (40 мл) добавляют по каплям к раствору 10,19 мл (116,8 ммоль) оксалилхлорида в дихлорметане (200 мл) при-78 С и смесь перемешивают в течение 10 мин при той же температуре. К реакционному раствору добавляют по каплям раствор 23,50 г описанного в литературе 1-бензилоксикарбонил-3 гидроксипирролидина в 200 мл дихлорметана при -78 С, затем смесь перемешивают при той же температуре в течение 60 мин. Этот раствор смешивают с 74,02 мл (531,1 ммоль) триэтиламина при -78 С и смесь перемешивают в тече 13 ние 60 мин при такой же температуре и затем в течение 60 мин при комнатной температуре. После завершения реакции в реакционный раствор по каплям добавляют 500 мл воды и органический слой отделяют. Водный слой промывают дихлорметаном (100 мл 2) и объединенный органический слой промывают насыщенным солевым раствором (300 мл 1). После сушки органического слоя над сульфатом магния растворитель выпаривают. Получаемый остаток подвергают колоночной хроматографии на силикагеле, получая 20,1 г (86%) указанного в заголовке соединения в виде масляного продукта из элюата смеси н-гексан/этилацетат(2 Н, с), 7,30-7,37 (5 Н, м). Пример Б. 1-Бензилоксикарбонил-3-метиленпирролидин. 8,44 мл (77 моль) тетрахлорида титана добавляют по каплям к 350 мл раствора в тетрагидрофуране, содержащего 36,6 г (600 мл) цинка, при 0 С и смесь перемешивают в течение 60 мин при такой же температуре. К этому охлажденному реакционному раствору при 0 С добавляют по каплям 24,32 мл (350 ммоль) дибромметана, растворенного в 100 мл тетрагидрофурана, и смесь затем перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют по каплям раствор 15,35 г (70 ммоль) 1-бензилоксикарбонил-3 пирролидона в тетрагидрофуране (100 мл) при комнатной температуре и затем смесь перемешивают 50 мин при той же температуре. После завершения реакции реакционный раствор смешивают с 500 мл 1 н. соляной кислоты и экстрагируют этилацетатом (5002) и органический слой промывают насыщенным солевым раствором (3001). После сушки органического слоя над безводным сульфатом натрия растворитель выпаривают. Получаемый остаток подвергают колоночной хроматографии на силикагеле, получая 12,4 г (82%) указанного в заголовке соединения в виде маслянистого продукта из элюата смеси н-гексан/этилацетат (2:1). 1 Н ЯМР (400 МГц, СDСl3): 2,57 (2 Н, шир. с), 3,55 (2 Н, дд, J = 7,82,16,12 Гц), 4,01 (2 Н, д, J = 5,86 Гц), 4,97 (2 Н, 2 с),5,14 (2 Н, с), 7,29-7,38 (5 Н, м). Пример В. 5-Бензилоксикарбонил-3 этоксикарбонил-5-азаспиро[2,4]гептан, (а), (b). 8,2 г (37,7 ммоль) 1-бензилоксикарбонил-3 метиленпирролидина растворяют в 300 мл циклогексана и смешивают с 100 мг димера ацетата родия. К полученной таким образом смеси добавляют по каплям 0,5 мМ раствор этилдиазоацетата в дихлорметане в течение 20 ч при кипячении с обратным холодильником. После окончания добавления по каплям растворитель выпаривают и полученный остаток подвергают колоночной хрома 003334 14 тографии с силикагелем, получая 4,12 г (36%) указанного в заголовке соединения (а) и 4,05 г (35%) указанного в заголовке соединения (b), каждое из которых в виде маслянистого продукта получают из элюата смеси н-гексан/этилацетат (2:1). Одновременно выделяют 2,3 г исходного продукта. Изомер (а) 1 Н ЯМР (400 МГц, СDСl3)(а) растворяют в 20 мл этанола, охлаждают на ледяной бане и смешивают с 20,4 мл 1 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при комнатной температуре в течение 3,5 ч. После завершения реакции реакционный раствор подкисляют добавлением 10% водного раствора лимонной кислоты, этанол выпаривают и затем полученный водный слой экстрагируют этилацетатом (50 мл 4). Органические слои объединяют и сушат над сульфатом натрия. Выпариванием растворителя получают 2,86 г (76%) указанного в заголовке соединения в виде маслянистого продукта. 1 Н ЯМР (400 МГц, СDСl3)(b) растворяют в 20 мл этанола, охлаждают на ледяной бане и смешивают с 20,0 мл 1 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при комнатной температуре в течение 3,5 ч. После завершения реакции реакционную смесь подкисляют добавлением 10% водного раствора лимонной кислоты, этанол выпаривают и затем полученный водный слой экстрагируют этилацетатом (50 мл 4). Органические слои объединяют и сушат над сульфатом натрия. Выпариванием растворителя получают 3,07 г (84%) указанного в заголовке соединения в виде масляного продукта. 1 Н ЯМР (400 МГц, CDCl3)(а) и разделение ВЭЖХ (1-а; 2-а). 2,86 г (10,39 ммоль) 5-бензилоксикарбонил-5-азаспиро[2,4]гептан-1-карбоновой кислоты (а) растворяют в 50 мл трет-бутанола. К этому раствору добавляют по каплям 4,29 г(15,6 ммоль) азида дифенилфосфорной кислоты и 2,90 мл (20,8 ммоль) триэтиламина в этом порядке при комнатной температуре, затем кипятят в течение 18 ч. После завершения реакции растворитель выпаривают и получаемый остаток подвергают колоночной хроматографии с силикагелем, получая 2,0 г (55%) указанного в заголовке соединения в виде масляного продукта из элюата смеси н-гексан/этилацетат (2:1). Этот продукт разделяют на стереоизомеры(1-а) и (2-а) ВЭЖХ с хиральной колонкой. Колонка: CHIRALPAK AD, 225 см Подвижная фаза: н-гексан:изопропанол = 75:25 Скорость течения: 7,0 мл/мин Температура: комнатная температура Детектирование: УФ (254 нм) Оптические изомеры имеют следующие времена удерживания: Соединение (1-а): 12 мин Соединение (2-а): 14 мин Изомер (1-а), 860 мг (24%); 1 Н ЯМР (400 МГц, СDСl3)(b) и разделение ВЭЖХ (1-b: 2-b). 3,05 г (11,08 ммоль) 5-бензилоксикарбонил-5-азаспиро[2,4]гептан-1-карбоновой кислоты (b) растворяют в 55 мл трет-бутанола. К этому раствору добавляют по каплям 4,57 г (16,6 ммоль) азида дифенилфосфорной кислоты и 3,09 мл (22,1 ммоль) триэтиламина в этом порядке при комнатной температуре, затем кипятят с обратным холодильником в течение 18 ч. После завершения реакции растворитель выпаривают и полученный остаток подвергают колоночной хроматографии с силикагелем, получая 1,7 г (44%) указанного в заголовке соединения в виде маслянистого продукта из элюата смеси н-гексан/этилацетат (2:1). Этот продукт разделяют на стереоизомеры 16 Подвижная фаза: н-гексан:изопропанол = 50:50 (об./об.) Скорость течения: 5,0 мл/мин Температура: комнатная температура Детектирование: УФ (254 нм) Оптические изомеры имеют следующие времена удерживания: Соединение (1-b): 19 мин Соединение (2-b): 28 мин Изомер (1-b), 844 мг (22%); 1 Н ЯМР (400 МГц, СDCl3) 346 мг (1,00 ммоль) 5-Бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (1-а) растворяют в 30 мл этанола и раствор смешивают с 350 мг 10% палладия на угле и гидрируют в течение 4 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 10 мл ацетонитрила и суспензию смешивают с 210 мг (0,67 ммоль) 5-амино-6,7,8-трифтор-1-[(1R,2S)]-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 0,93 мл (6,67 ммоль) триэтиламина и смесь кипятят с обратным холодильником в течение 24 ч. После выпаривания растворителя полученный таким образом остаток смешивают с хлороформом, промывают водой,10% водным раствором лимонной кислоты и насыщенным солевым раствором, в этом порядке, и затем сушат над безводным сульфатом натрия, затем выпаривают растворитель. Полученное таким образом трет-бутилкарбаматное производное смешивают с 3 мл концентрированной соляной кислоты, перемешивают при комнатной температуре в течение 30 мин, при помощи водного раствора гидроксида натрия устанавливают рН 7,4 и затем экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. После выпаривания растворителя полученный остаток перекристаллизо 17 вывают из этанола, получая 190 мг (69%) указанного в заголовке соединения. Точка плавления: 195-198 С[]25d = +6,86 (с = 0,495, 0,1 н. водный раствор гидроксида натрия) 1 Н ЯМР (400 МГц, 0,1 н. NaOD): 0,48-0,51 (1 Н, м), 0,82-0,85 (1 Н, м), 1,511,57 (2 Н, м), 1,83-1,88 (1 Н, м), 2,00-2,07 (1 Н, м),2,32-2,35 (1 Н, м), 3,39 (2 Н, с), 3,74 (3 Н, шир. с),8,21 (1 Н, с). Элементный анализ для С 19 Н 19N4O3F31/4 Н 2 О: Вычислено: С 55,27; Н 4,76; N 13,57 Найдено: С 55,46; Н 4,77; N 13,43 Целевой пример 2. 5-Амино 7-[1-амино-5 азаспиро[2,4]гептан-5-ил]-6,8-дифтор-1[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4 оксохинолин-3-карбоновая кислота [изомер I (2 а)]. 346 мг (1,00 ммоль) 5-бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (2-а) растворяют в 30 мл этанола и раствор смешивают с 350 мг 10% палладия на угле и гидрируют в течение 4 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 10 мл ацетонитрила и суспензию смешивают с 210 мг (0,67 ммоль) 5-амино-6,7,8-трифтор-1-[(1R,2S)]-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 0,93 мл (6,67 ммоль) триэтиламина и смесь кипятят с обратным холодильником в течение 24 ч. После выпаривания растворителя полученный таким образом остаток смешивают с хлороформом, промывают водой,10% водным раствором лимонной кислоты и насыщенным солевым раствором, в этом порядке, и затем сушат над безводным сульфатом натрия, затем выпаривают растворитель. Полученное таким образом трет-бутилкарбаматное производное смешивают с 3 мл концентрированной соляной кислотой, перемешивают при комнатной температуре в течение 30 мин, при помощи водного раствора гидроксида натрия устанавливают рН 7,4 и затем экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. После выпаривания растворителя получаемый остаток перекристаллизовывают из этанола, получая 113 мг (41%) указанного в заголовке соединения. Точка плавления: 216-219 С[]25d = +52,38 (с = 0,399, 0,1 н. водный раствор гидроксида натрия) 1 Н ЯМР (400 МГц, 0,1 н. NaOD): 0,47-0,49 (1 Н, м), 0,79-0,82 (1 Н, м), 1,501,58 (2 Н, м), 1,79-1,86 (1 Н, м), 1,98-2,04 (1 Н, м),2,30-2,33 (1 Н, м), 3,36 (2 Н, с), 3,72 (3H, шир. с),8,21 (1 Н, с). Элементный анализ для С 19 Н 19N4O3F31/4 Н 2O: Вычислено: С 55,27; Н 4,76; N 13,57 Найдено: С 55,39; Н 4,80; N 13,37. Целевой пример 3. 5-Амино-7-[1-амино-5 азаспиро[2,4]гептан-5-ил]-6,8-дифтор-1[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4 оксохинолин-3-карбоновая кислота [изомер I (1b)]. 346 мг (1,00 ммоль) 5-бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (1-b) растворяют в 30 мл этанола и раствор смешивают с 350 мг 10% палладия на угле и гидрируют в течение 4 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 10 мл ацетонитрила и суспензию смешивают с 210 мг (0,67 ммоль) 5-амино-6,7,8-трифтор-1-[(1R,2S)]-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 0,93 мл (6,67 ммоль) триэтиламина и смесь кипятят с обратным холодильником в течение 18 ч. После выпаривания растворителя полученный таким образом остаток смешивают с хлороформом, промывают водой,10% водным раствором лимонной кислоты и насыщенным солевым раствором, в этом порядке, и затем сушат над безводным сульфатом натрия, затем выпаривают растворитель. Полученное таким образом трет-бутилкарбаматное производное смешивают с 5 мл концентрированной соляной кислотой, перемешивают при комнатной температуре в течение 30 мин, при помощи водного раствора гидроксида натрия устанавливают рН 7,4 и затем экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. После выпаривания растворителя полученный остаток перекристаллизуют из смеси этанол-эфир, получая 198 мг (78%) указанного в заголовке соединения. Точка плавления: 129-131 С[]25d = +51,76 (с = 0,597, 0,1 н. водный раствор гидроксида натрия) 1: 0,47-0,49 (1 Н, м), 0,86-0,89 (1 Н, м), 1,541,60 (2 Н, м), 1,74-1,85 (2 Н, м), 2,34-2,36 (1 Н, м),2,34-2,36 (1 Н, м), 3,57-3,83 (5 Н, м), 8,23 (1 Н, с). Элементный анализ для С 19 Н 19N4O3F31/4 Н 2O: Вычислено: С 54,09; Н 4,90; N 13,28 Найдено: С 53,84; Н 4,84; N 13,05. 346 мг (1,00 ммоль) 5-бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (2-b) растворяют в 30 мл этанола и раствор смешивают с 350 мг 10% палладия на угле и гидрируют в течение 4 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 10 мл ацетонитрила и суспензию смешивают с 210 мг (0,67 ммоль) 5-амино-6,7,8-трифтор-1-[(1R,2S)]-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 0,93 мл (6,67 ммоль) триэтиламина и смесь кипятят с обратным холодильником в течение 18 ч. После выпаривания растворителя полученный таким образом остаток смешивают с хлороформом, промывают водой,10% водным раствором лимонной кислоты и насыщенным солевым раствором, в этом порядке, и затем сушат над безводным сульфатом натрия, затем выпаривают растворитель. Полученное таким образом трет-бутилкарбаматное соединение смешивают с 5 мл концентрированной соляной кислотой, перемешивают при комнатной температуре в течение 30 мин, при помощи водного раствора гидроксида натрия устанавливают рН 7,4 и затем экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. После выпаривания растворителя получаемый остаток перекристаллизуют из смеси этанол-эфир, получая 222 мг (81%) указанного в заголовке соединения. Точка плавления: 180-181 С[]25d = +8,24 (с = 0,46, 0,1 н. водный раствор гидроксида натрия) 1 Н ЯМР (400 МГц, 0,1 н. NaOD): 0,45-0,47 (1 Н, м), 0,84-0,88 (1 Н, м), 1,511,59 (2 Н, м), 1,70-1,83 (2 Н, м), 2,32-2,35 (1 Н, м),3,53-3,79 (5 Н, м), 8,22 (1 Н, с). Элементный анализ для С 19 Н 19N4O3F3 1 H2O: Вычислено: С 53,52; Н 4,96; N 13,14 Найдено: С 53,32; Н 5,00; N 13,00. Целевой пример 5. 5-Амино-7-[1-амино-5 азаспиро[2,4]гептан-5-ил]-6-фтор-1-[(1R,2S)-2 фторциклопропил]-8-метил-1,4-дигидро-4 оксохинолин-3-карбоновая кислота [изомер II 693 мг (2,00 ммоль) 5-бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (1-а) растворяют в 60 мл этанола и раствор смешивают с 600 мг 10% палладия на угле и гидрируют в течение 2 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 6 мл диметилсульфоксида и суспензию смешивают с 312 мг (1,00 ммоль) 5-амино-6,7-дифтор-1-[(1R,2S)]-2-фторциклопропил]-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 2,00 мл (14,35 ммоль) триэтиламина и смесь нагревают при 150-160 С в течение 19 ч в потоке азота. После выпаривания растворителя полученный таким образом остаток смешивают с хлороформом,промывают водой, 10% водным раствором лимонной кислоты и насыщенным солевым раствором, в этом порядке, и затем сушат над безводным сульфатом натрия, затем выпаривают растворитель. Полученное таким образом третбутилкарбаматное соединение смешивают с 5 мл концентрированной соляной кислоты, перемешивают при комнатной температуре в течение 20 мин, промывают хлороформом (50 мл 3), при помощи водного раствора гидроксида натрия устанавливают рН 7,4 и затем экстрагируют хлороформом и экстракт сушат над безводным сульфатом натрия. После выпаривания растворителя полученный раствор очищают препаративной ТСХ (проявление нижним слоем смеси хлороформ:метанол:вода = 7:3:1) и перекристаллизуют из смеси этанол-эфир, получая 142 мг (35%) указанного в заголовке соединения. Точка плавления: 118-120 С.[]25d = -266,46 (с = 0,486, 0,1 н. водный раствор гидроксида натрия) 1: 0,46-0,48 (1 Н, м), 0,76-0,79 (1 Н, м), 1,071,18 (1 Н, м), 1,42-1,53 (1 Н, м), 1,78-1,84 (1 Н, м),2,04-2,11 (1 Н, м), 2,28 (3H, с), 2,33-2,36 (1 Н, м),3,01 (1 Н, д, J = 9,28 Гц), 3,42 (2 Н, д, J = 9,27 Гц),3,73-3,76 (1 Н, м), 3,89-3,94 (1 Н, м), 7,81 (1 Н, с). Элементный анализ для C20H22N4O3F23/4 1,22 г мг (3,52 ммоль) 5-бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (1-а) растворяют в 100 мл этанола и раствор смешивают с 1,00 г 10% палладия на угле и гидрируют в течение 3 ч при атмосферном давлении. После завершения реакции 10% палладий на угле удаляют фильтрованием и этанол выпаривают. Полученный таким образом остаток суспендируют в 5 мл сульфолана и суспензию смешивают с 690 мг(2,00 ммоль) хелата BF2 с 6,7-дифтор-1[(1R,2S)]-2-фтор-1-циклопропил]-1,4-дигидро-8 метил-4-оксохинолин-3-карбоновой кислотой и 0,86 мл триэтиламина и смесь нагревают при 35 С в течение 12 ч в потоке азота. После выпаривания триэтиламина полученный таким образом остаток смешивают с 10 мл воды и перемешивают при комнатной температуре в течение 30 мин. Образованные таким образом кристаллы промывают водой, собирают фильтрованием и растворяют в 25 мл смешанного растворителя метанол:вода = 9:1 и полученный раствор смешивают с 5 мл триэтиламина и кипятят с обратным холодильником в течение 1 ч. После выпаривания растворителя полученный таким образом остаток смешивают с 5 мл концентрированной соляной кислоты, перемешивают при комнатной температуре в течение 10 мин и затем промывают хлороформом (50 мл 2). При помощи 20% водного раствора гидроксида натрия рН реакционного раствора устанавливают 7,3 и экстрагируют хлороформом (30 мл 3). Экстракт сушат над сульфатом натрия и растворитель выпаривают. Полученный остаток разделяют и очищают препаративной ТСХ (проявление нижним слоем смеси хлороформ: метанол:вода = 7:3:1) и перекристаллизовывают из смеси этанол-эфир, получая 92 мг (12%) указанного в заголовке соединения. Точка плавления: 103-109 С.[]25d = -185,14 (с = 0,350, 0,1 н. водный раствор гидроксида натрия) 1 Н ЯМР (400 МГц, 0,1 н. NaOD)(1 Н, см), 7,68 (1 Н, д, J = 13,68 Гц), 8,46 (1 Н, с). Элементный анализ для С 20 Н 21N3O3F21/4EtOH: Вычислено: С 61,42; Н 5,66; N 10,48 Найдено: С 61,69; Н 5,71; N 10,19. Целевой пример 7. 7-[1-Амино-5 азаспиро[2,4]гептан-5-ил]-6-фтор-1-[(1R,2S)-2 фторциклопропил]-1,4-дигидро-8-метил-4-оксо 1,34 г мг (3,87 ммоль) 5-Бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (2-b) растворяют в 50 мл метанола и раствор смешивают с 1,20 г 5% палладия на угле и гидрируют в течение 2 ч при атмосферном давлении. После завершения реакции 5% палладий на угле удаляют фильтрованием и метанол выпаривают. Полученный таким образом остаток суспендируют в 7 мл сульфолана и суспензию смешивают с 690 мг (2,00 ммоль) дифтор-6,7-дифтор-1-[(1R,2S)]-2-фторциклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3 карбоксилат-O,O'бора и 0,31 мл (2,20 ммоль) триэтиламина и смесь перемешивают при комнатной температуре в течение 19 ч в потоке азота. Реакционный раствор смешивают с 10% водным раствором лимонной кислоты и таким образом осажденную твердую часть собирают фильтрованием. После промывания водой его растворяют в 100 мл 10% водного этанола, смешивают с 0,5 мл триэтиламина и кипятят с обратным холодильником в течение 18 ч. После выпаривания растворителя полученный таким образом остаток смешивают с 10% водным раствором лимонной кислоты и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают. Полученный таким образом остаток подвергают колоночной хроматографией с силикагелем (хлороформ:метанол = 9:1), получая Вос-соединение. Его смешивают с 10 мл концентрированной соляной кислоты, перемешивают при 0 С в течение 2 ч, устанавливают рН 12 водным раствором гидроксида натрия и затем рН 7,4 соляной кислотой. После экстракции хлороформом органический слой сушат над безводным сульфатом натрия и растворитель выпаривают. После этого полученный остаток перекристаллизовывают из этанола, получая 319 мг (41%) указанного в заголовке соединения. 1[]25d = -213,27 (с = 0,407, 0,1 н. водный раствор гидроксида натрия) Элементный анализ для С 20 Н 21F2N3O3: Вычислено: С 61,69; Н 5,44; N 10,79 Найдено: С 61,53; Н 5,49; N 10,73. Целевой пример 8. Гидрохлорид 5-амино 7-[1-амино-5-азаспиро[2,4]гептан-5-ил]-6-фтор 1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-8 метил-4-оксохинолин-3-карбоновой кислоты. 1,36 г мг (4,0 ммоль) 5-Бензилоксикарбонил-1-трет-бутоксикарбониламино-5-азаспиро[2,4]гептана (2-b) растворяют в 50 мл метанола и раствор смешивают с 1,2 г 5% палладия на угле и перемешивают в атмосфере водорода в течение 2 ч. Катализатор удаляют фильтрованием через целит (промывание водой) и фильтрат концентрируют при пониженном давлении для удаления растворителя. Остаток растворяют в DMC (30 мл). К раствору добавляют 6,7-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4 дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту (624 мг, 2,0 ммоль) и триэтиламин (3 мл). Смесь нагревают при 140 С в течение 15 ч в атмосфере азота и затем концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют 10% водный раствор лимонной кислоты (50 мл) и экстрагируют СНСl3 (50 мл 2). Экстракт сушат над безводным сульфатом натрия и концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют конц. HCl (5 мл) и Бактерии/Соединение ( примера) Е. coli, NIHJ 24 перемешивают в течение 1 ч. К раствору добавляют Н 2O (50 мл) и промывают СНСl3 (50 мл 2). Водный слой подщелачивают до рН 12 добавлением 1 н. NaOH, промывают СНСl3 (502) и затем нейтрализуют до рН 7,4 добавлением 1 н. HCl. Раствор экстрагируют СНСl3 (3005) и экстракт сушат над безводным сульфатом натрия и концентрируют при пониженном давлении для удаления растворителя. Остаток растворяют в 1 н. HCl (2 мл) и раствор концентрируют досуха при пониженном давлении. Перекристаллизация остатка из этанола дает 29 мг(1 Н, м), 0,94-0,88 (1 Н, м), 0,53-0,47 (1 Н, м). Элементный анализ для C20H22F2N4O3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стереохимически чистое замещенное производное пиридонкарбоновой кислоты,представленное формулой (I) А представляет атом углерода, замещенный метильной группой. 2. Стереохимически чистое соединение по п.1, которое представляет собой 5-амино-7-[1 амино-5-азаспиро[2,4]гептан-5-ил]-6-фтор-1[(1R,2S)-2-фторциклопропил]-8-метил-1,4 дигидро-4-оксохинолин-3-карбоновую кислоту или ее соль. 3. Стереохимически чистое соединение по п.1, которое представляет собой 7-амино-[1 амино-5-азаспиро[2,4]гептан-5-ил]-6-фтор[(1R,2S)-2-фторциклопропил]-1,4-дигидро-8 метил-4-оксохинолин-3-карбоновую кислоту или ее соль. 4. Антибактериальная композиция, которая содержит эффективное количество соединения формулы (1) или его соли в качестве активного ингредиента вместе с фармацевтически приемлемым носителем. 26 Евразийский патент действует на территории всех Договаривающихся государств, кроме
МПК / Метки
МПК: A61K 31/4747, A61P 31/04, C07D 215/12
Метки: кислоты, основе, антибактериальная, пиридонкарбоновой, производные, композиция
Код ссылки
<a href="https://eas.patents.su/14-3334-proizvodnye-piridonkarbonovojj-kisloty-i-antibakterialnaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридонкарбоновой кислоты и антибактериальная композиция на их основе</a>
Предыдущий патент: Производные аминоантрациклинона и их применение в лечении амилоидоза
Следующий патент: Способ приготовления шипучего гранулята, содержащего железистый глюконат, полученный таким способом гранулят и таблетки с таким же содержанием
Случайный патент: Противораковое соединение и содержащая его фармацевтическая композиция


















