Производные тиохроманпиразолов и гербицидная композиция на их основе
Номер патента: 1810
Опубликовано: 27.08.2001
Авторы: Сакамото Масаси, Насуно Итиро, Коике Казуеси, Накамура Казуфуми
Формула / Реферат
1. Производные тиохроманпиразола общей формулы

или его соль, где
R1 обозначает атом водорода или С1-С4-алкильную группу;
R2 обозначает С1-С4-алкильную группу;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу;
L обозначает группу формулы -СН- или -СН2-, необязательно замещенную атомом галогена или С1-С4-алкилом;
---- представляет необязательную двойную связь;
Q обозначает атом водорода или группу -А-В,
[в которой А выбирают из группы, состоящей из -SО2, -СО- и -СН2СО-,
В выбирают из группы, состоящей из С1-С8-алкильной группы, С3-С8-циклоалкильной группы и группы формулы (V)
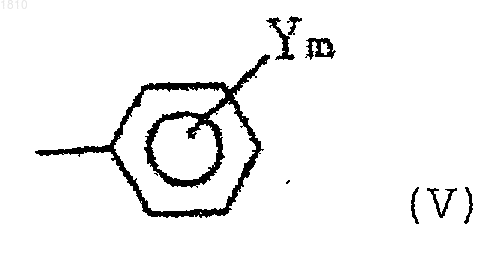
где Y представляет атом галогена, нитрогруппу, С1-С4 алкил, С1-С4-алкокси или С1-С4-галоидалкил; m равно 0, 1 или 2];
n равно 0,1 или 2;
k равно 0 или 1;
при условии, что если L представляет группу формулы -СН-, незамещенную или замещенную атомом галогена или С1-С4 алкилом, то ---- представляет двойную связь и k=0;
и если L означает группу формулы -СH2-, незамещенную или замещенную атомом галогена или С1-С4-алкилом, то ---- означает одинарную связь, k=1 и X5 и X7, кроме определений, указанных для них выше, могут объединяться с образованием ненасыщенной связи.
2. Производное пиразола по п.1, представленное формулой (1-В)
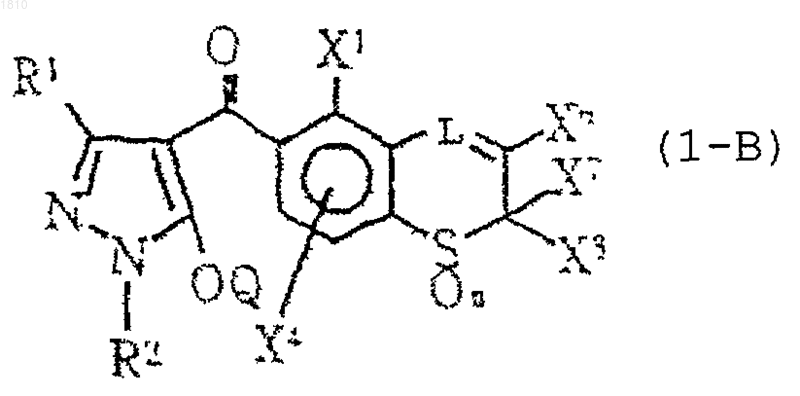
где R1 обозначает атом водорода или С1-С4-алкильную группу;
R2 обозначает С1-С4-алкильную группу;
L представляет группу формулы -СН, необязательно замещенную атомом галогена и С1-С4-алкильной группой;
каждый из Х1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу;
Q обозначает атом водорода или группу -А-В
[в которой А выбирают из группы, состоящей из -SO2, -CO- и -СН2СО-,
В выбирают из группы, состоящей из С1-С8-алкильной группы, С3-С8-циклоалкильной группы и группы формулы (V)
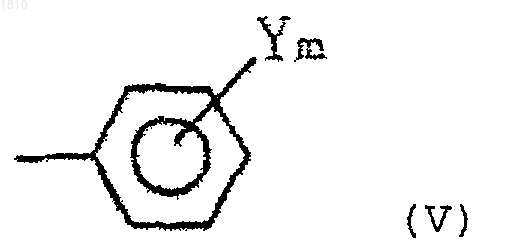
(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С1-С4-алкильной группы, С1-С4-алкоксигруппы и С1-С4-галогеналкильной группы, и m - целое число 0, 1 или 2)]; и
n = 0, 1 или 2,
или его соль.
3. Производное пиразола формулы (1-В) или его соль по п.2, где n=0.
4. Производное пиразола формулы (1-В) или его соль по п.2, где каждый из Х1 и X4 независимо обозначает С1-С4-алкильную группу.
5. Производное пиразола по п.1 формулы (1-С)
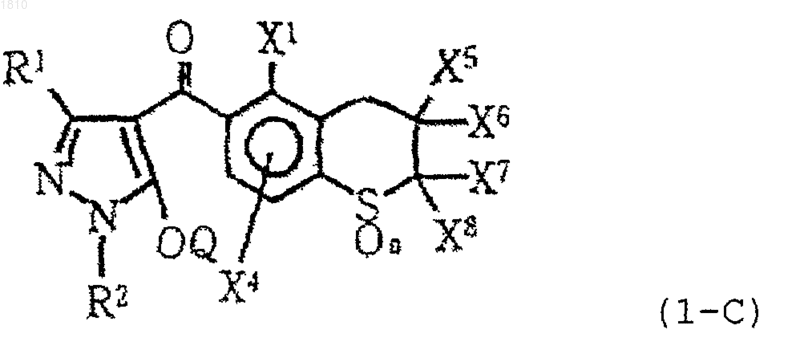
или его соль,
где R1 обозначает атом водорода или С1-С4-алкильную группу;
R2 обозначает С1-С4-алкильную группу;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу; или Х5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;
Q обозначает атом водорода или группу -А-В
[в которой А выбирают из группы, состоящей из -SO2, -CO- и -СН2СО-,
В выбирают из группы, состоящей из С1-С8-алкильной группы, С3-С8-циклоалкильной группы и группы формулы (V)
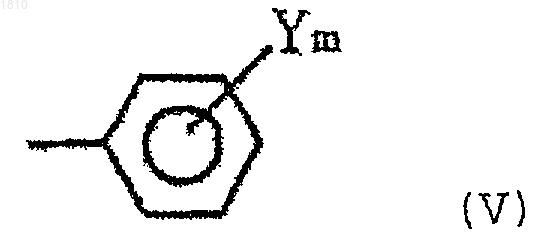
(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С1-С4-алкильной группы, С1-С4-алкоксигруппы и С1-С4-галогеналкильной группы, и m - целое число 0, 1 или 2)]; и
n=0, 1 или 2,
или его соль.
6. Производное пиразола формулы (1-С) или его соль по п.5, где Х1 обозначает С1-С4-алкильную группу и X4 обозначает С1-С4-алкильную группу.
7. Производное пиразола формулы (1-С) или его соль по п.5, где n=0 или 2.
8. Производное пиразола по п.1 формулы (1-D)
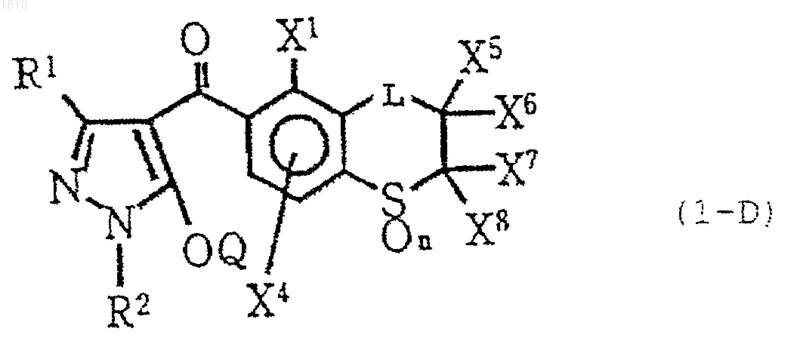
где R1 обозначает атом водорода или С1-С4-алкильную группу;
R2 обозначает С1-С4-алкильную группу;
L обозначает группу формулы -СН2-, замещенную атомом галогена или С1-С4-алкильной группой;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;
Q обозначает атом водорода или группу -А-В
[в которой А выбирают из группы, состоящей из -SO2, -CO- и -СН2СО-,
В выбирают из группы, состоящей из С1-С8-алкильной группы, С3-С8-циклоалкильной группы и группы формулы (V)
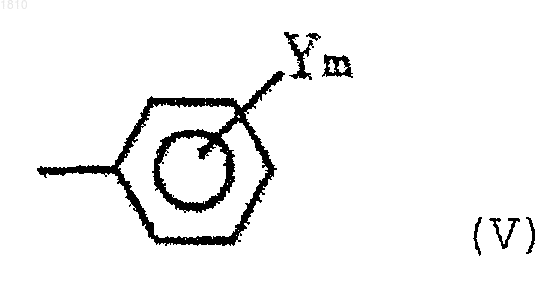
(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С1-С4-алкильной группы, С1-С4-алкоксигруппы и С1-С4-галогеналкильной группы, и m - целое число 0, 1 или 2)]; и
n=0, 1 или 2,
или его соль.
9. Производное пиразола формулы (1-D) или его соль по п.8, где каждый из X1 и X4 независимо обозначает С1-С4-алкильную группу.
10. Производное пиразола формулы (1-D) или его соль по п.8, где L обозначает группу формулы -СH2-, замещенную С1-С4-алкильной группой.
11. Производное пиразола формулы (1-D) или его соль по п.10, где L обозначает группу формулы -СН2-, замещенную метилом или этилом.
12. Производное ароматической карбоновой кислоты формулы (II)
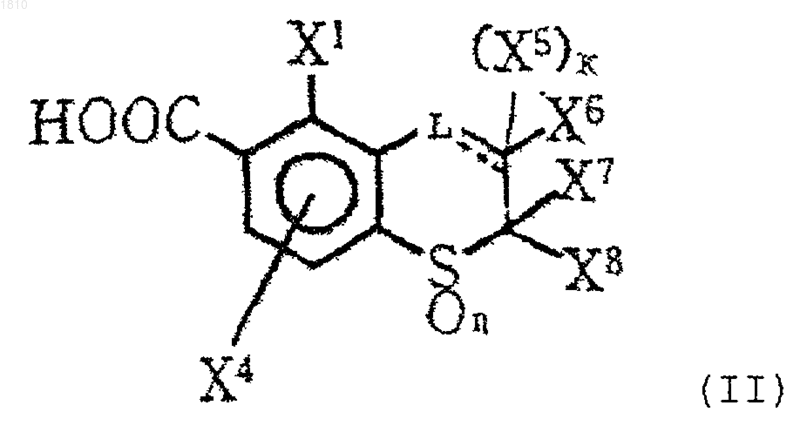
или его соль,
где L представляет группу формулы -СН- или -СН2-, необязательно замещенную атомом галогена или С1-С4-алкильной группой;
---- представляет необязательную двойную связь;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу;
n=0, 1 или 2,
k=0 или 1;
при условии, что если L означает группу формулы -СН-, незамещенную или замещенную атомом галогена или С1-С4 алкильной группой, то
---- означает двойную связь и k=0;
и если L означает группу формулы -СН2-, незамещенную или замещенную атомом галогена или С1-С4-алкильной группой, то
---- означает одинарную связь, k=1 и X5 и X7, кроме определений, указанных для них выше, могут объединяться с образованием ненасыщенной связи.
13. Производное ароматической карбоновой кислоты по п.12 формулы (II-В)
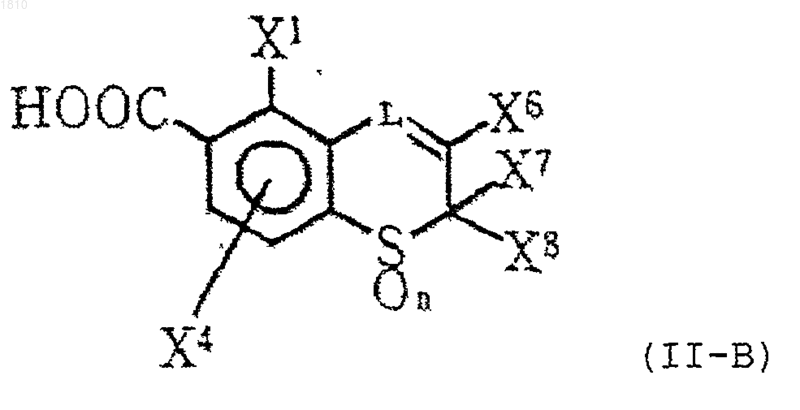
где L означает группу формулы -СН-, необязательно замещенную атомом галогена или С1-С4-алкильной группой;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу; и
n=0, 1 или 2,
или его соль.
14. Производное ароматической карбоновой кислоты по п.12 формулы (II-C)
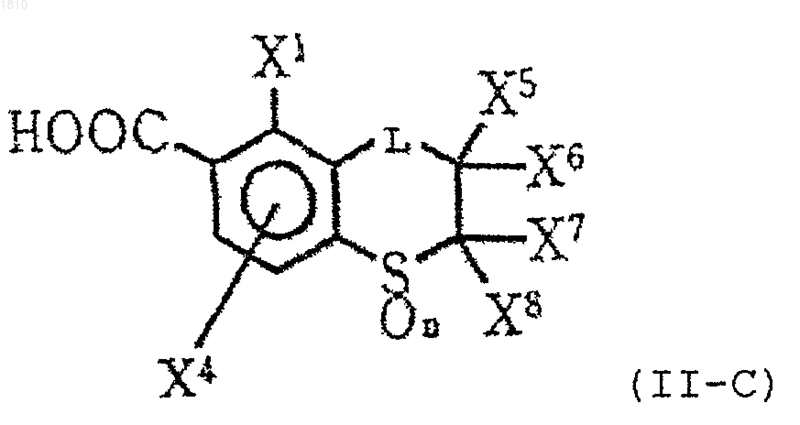
где L означает группу формулы -CH2-;
каждый из Х1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом; и
n=0, 1 или 2,
или его соль.
15. Производное ароматической карбоновой кислоты по п.12 формулы (II-D)
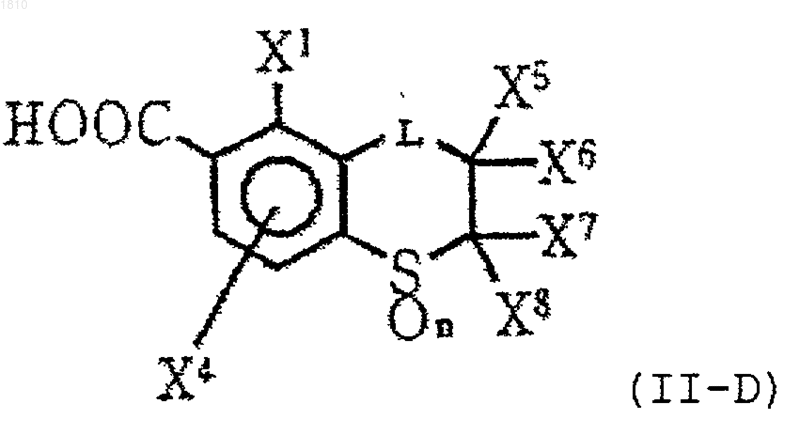
где L означает группу формулы -СН2-, замещенную атомом галогена или С1-С4-алкильной группой;
каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С1-С4-алкильной группы;
каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С1-С4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;
n=0, 1 или 2,
или его соль.
16. Гербицидная композиция, включающая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество производного пиразола или его соли по любому из пп.1-11.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Данное изобретение относится к новым производным пиразола, гербицидам, содержащим производные пиразола в качестве активных ингредиентов, и промежуточным продуктам, пригодным для получения производных пиразола. Технические предпосылки и проблемы, решаемые данным изобретением Гербициды являются очень важными химикалиями для экономии затрат в борьбе с сорняками и улучшения урожая сельскохозяйственных и садовых культур и поэтому интенсивно изучались и разрабатывались на протяжении многих лет, в результате чего были предложены для практического применения разнообразные гербициды. Однако в настоящее время все еще желательна разработка новых продуктов с высокой гербицидной эффективностью, в частности, таких, которые могут избирательно уничтожать только сорняки при низких рабочих дозах и отсутствии фитотоксичности в отношении сельскохозяйственных культур. Во время возделывания кукурузы и т.д. обычно применяли гербицид на основе триазина, такой как алахлор и метлахлор. Однако атразин обнаруживает низкую эффективность в отношении травянистых сорняков и, с другой стороны, алахлор и метлахлор проявляют низкую эффективность в отношении широколиственных сорняков. Поэтому в настоящее время трудно бороться со злаковыми и широколистными сорняками одновременно при помощи одного гербицида. Кроме того, применение указанных выше гербицидов нежелательно в связи с проблемой окружающей среды, возникающей из-за необходимости высокой нормы расхода этих гербицидов. Известно, что в орошаемом (затопляемом) рисовом поле разнообразные сорняки, однолетние злаки, такие как куриное просо, однолетние сорняки семейства осоковых (Cyperaceous), такие как зонтик, однолетние широколистные сорняки, такие как монохория и ротала ветвистая, и многолетние сорняки, такие как Sagitariapygmaea, рдест, восточный водный подорожник,камыш, болотница игольчатая, ситничек поздний, чилим (водяной орех), стрелолист и таволга, растут вместе с культурой риса и при культивировании риса очень важно эффективно бороться с этими сорняками при низких дозах гербицидов в связи с загрязнением окружающей среды и без проявления фитотоксичности в отношении риса падди. В общем, известно, что соединения, обладающие гербицидной эффективностью в отношении куриного проса, являются фитотоксичными для риса падди, и особенно важно разработать химический препарат,который имеет высокую гербицидную эффективность в отношении куриного проса как травянистого сорняка и обладает превосходной межродовой избирательностью между рисом и куриным просом. 2 Между тем, известно, что специфические 4-бензоилпиразолы обладают гербицидной эффективностью (JP-A-63-122672, JP-A-63-122673,JP-A-63-170365, JP-A-1-52759, JP-A-2-173 и JPA-2-288866) и пирозолат следующей химической формулы входит в число гербицидов,имеющихся на рынке в настоящее время. Далее, соединение (А), типичный пример производных 4-бензоилпиразола, описанных в упомянутых выше публикациях, имеет следующую химическую формулу (Соединение 35 в Указанные выше производные 4 бензоилпиразола обладают гербицидной активностью, хотя эта активность является практически недостаточной. В частности, их гербицидная активность в отношении злаковых сорняков,таких как куриное просо и лисохвост, очень низка. При их использовании в качестве гербицида в затопляемом рисовом поле они могут проявлять фитотоксичность в отношении риса падди, так как имеют низкую избирательность между рисом и травянистыми сорняками. Поэтому данные заявители предложили производные пиразола, имеющие тиохромановое кольцо, и зарегистрировали соответствующие патентные заявки (JP-A-185526 и International Laid-open Patent Publication WO93/18031). Типичными примерами (В) и (С) соединений,описанных в вышеуказанных первичных заявках, являются следующие соединения. Соединение (В): Соединение 66, описанное в International Laid-open Patent Publication 3 Представленные выше соединения обладают высокой гербицидной активностью, хотя они могут быть улучшены в отношении безопасности для затопляемого риса. Данное изобретение было сделано в связи с приведенными выше обстоятельствами, и целью его является обеспечение производных пиразола, которые могут контролировать широкий диапазон суходольных сорняков и сорняков затопляемого рисового поля, в частности, куриное просо в рисовом поле, при низкой дозе без проявления фитотоксичности в отношении таких культур, как кукуруза, рис и т.д., обеспечение гербицида, содержащего такое производное пиразола, и промежуточного продукта для получения производного пиразола. Описание изобретения Первым аспектом данного изобретения является производное пиразола формулы где R1 обозначает атом водорода или С 1-С 4 алкильную группу,R2 обозначает С 1-С 4-алкильную группу,X1 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы,каждый из X2, Х 3, X5, X6, X7 и X8, независимо, обозначает атом водорода или С 1-С 4 алкильную группу или X2 и X5 могут образовывать ненасыщенную связь путем связывания друг с другом, или X5 и X7 могут образовывать ненасыщенную связь путем связывания друг с другом,X4 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы,Q обозначает атом водорода или группу где Y выбран из группы, состоящей из атома галогена, нитрогруппы, С 1-С 4-алкильной группы, С 1-С 4-алкоксигруппы и C1-С 4-галогеналкильной группы и m является числом 0, 1 или 2,n обозначает 0, 1 или 2 и р обозначает 1,при условии, что, когда X2 и X3 оба обозначают С 1-С 4-алкильные группы, то исключен случай, когда X5, X6, X7 и X8 все являются атомами водорода, или его соль. Вторым аспектом данного изобретения является гербицид, содержащий производное пи 001810 4 разола, приведенной выше формулы (I) и/или его соль в качестве активного ингредиента. Далее, третьим аспектом данного изобретения является производное ароматической карбоновой кислоты формулы (II), используемое для получения производного пиразола формулы где X1 выбран из группы, состоящей из атома галогена и С 1-С 4-алкильной группы,каждый из X2, X3, X5, X6, X7 и X8, независимо, обозначает атом водорода или С 1-С 4 алкильную группу или X2 и X5 могут образовывать ненасыщенную связь путем связывания друг с другом, или X5 и X7 могут образовывать ненасыщенную связь путем связывания друг с другом,X4 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы,n обозначает 0, 1 или 2 и р обозначает 1,при условии, что, когда X2 и X3 оба обозначают С 1-С 4-алкильные группы, то исключен случай, когда X5, X6, X7 и X8 все являются атомами водорода, или его соль. Предпочтительные варианты для эксплуатации изобретения Новое производное является соединением формулы В формуле (I) R1 обозначает атом водорода или С 1-С 4-алкильную группу, предпочтительно атом водорода. R2 обозначает С 1-С 4-алкильную группу. С 1-С 4-алкильная группа в качестве R1 иR2, каждая, включает метил, этилпропильные группы, такие как н-пропил и изопропил, и бутильные группы, такие как н-бутил и изобутил. С 1-С 4-алкильная группа в качестве R2 предпочтительно представляет собой этил.X1 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы. Атом галогена в качестве X1 включает фтор, хлор, бром и йод. С 1-С 4-алкильная группа в качестве Х 1 включает группы, описанные дляR1 и R2. X1 предпочтительно является С 1-С 4 алкильной группой, более предпочтительно метилом. Каждый из X2, X3, X5, X6, X7 и X8, независимо, обозначает атом водорода или С 1-С 4 алкильную группу, или X2 и X5 могут образовывать ненасыщенную связь путем связывания друг с другом, или X5 и X7 могут образовывать ненасыщенную связь путем связывания друг с другом. С 1-С 4-Алкильная группа включает 5 группы, описанные для R1 и R2. Предпочтительно каждый из этих заместителей обозначает,независимо, атом водорода, метил или этил, илиX4 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы. Атом галогена включает атомы галогена, описанные для Х 1, и С 1-С 4-алкильная группа включает группы, описанные для R1 и R2. X4 является предпочтительно атомом водорода или С 1-С 4-алкильной группой, более предпочтительно - метилом. Положение, в котором X4 является заместителем, предпочтительно является положением 8 на кольце тиохромана.Q обозначает атом водорода или группу формулы -А-В, в которой А выбран из группы,состоящей из -SO2, -CO- и -СН 2 СО-, и В выбран из группы, состоящей из С 1-С 8-алкильной группы, С 3-С 8-циклоалкильной группы и группы формулы С 1-С 8-алкильная группа в качестве одного варианта В включает метил, этил, пропил, бутил, пентил, гексил, гептил и октил, и алкинильная группа, имеющая, по меньшей мере, 3 атома углерода, может быть линейной или разветвленной. Предпочтительны этил, н-пропил или изопропил. С 3-С 8-циклоалкильная группа в качестве другого варианта В включает циклопропил, циклобутил, циклопентил, циклогексил,циклогептил и циклооктил и предпочтительным является циклогексил. Далее, в группе формулы (V) в качестве другого варианта В, Y является атомом водорода, нитрогруппой, С 1-С 4-алкильной группой, С 1 С 4-алкоксигруппой или С 1-С 4-галогеналкильной группой. Атом галогена включает атомы галогена, описанные для X1 и X4. С 1-С 4-алкильная группа включает группы, описанные для R1 иR2, и предпочтительным является метил. С 1-С 4 алкоксигруппа включает метокси, этокси, линейную или разветвленную пропоксигруппу и линейную или разветвленную бутоксигруппу.C1-С 4-галогеналкильная группа включает группы, полученные замещением атомов водорода,С 1-С 4-алкильной группы, описанной для R1 и R2,атомами галогена, описанными для Х 1 и X4. Конкретно, С 1-С 4-галогеналкильная группа включает -CH2F, -CHF2, -СF3, -СF2 СF3, -ССl3 иm, который обозначает число Y, является целым числом 0, 1 или 2. Одним из предпочтительных вариантов комбинации А с В группы -А-В, является, например, вариант, когда А обозначает -SO2-, В обозначает С 1-С 4-алкильную группу или фенильную группу, замещенную 1 или 2 атомами галогена, нитрогруппой (группами), С 1-С 4 алкильной группой (группами) или С 1-С 4 алкоксигруппой (группами) (группу формулы(V) , в которой Y является атомом галогена,нитрогруппой, С 1-С 4-алкильной группой или С 1 С 4-алкоксигруппой и m является 1 или 2). Другим предпочтительным вариантом комбинации А с В группы -А-В является вариант, когда А обозначает -СО- или -СН 2 СО-, В обозначает С 1-С 8-алкильную группу или замещенную галогеном или не замещенную галогеном фенильную группу (группу формулы (V), в которой Y является атомом галогена и m является 0, 1 или 2).n обозначает число атомов кислорода и является целым числом 0, 1 или 2. То есть, когда n обозначает 0, представлен сульфид. Когда n обозначает 1, представлен сульфоксид. Когда n обозначает 2, представлен сульфон. При р равном 1, производное пиразола общей формулы (I) представляет производное пиразола общей формулы Производное пиразола общей формулы (I),в которой Q обозначает водород, то есть, соединение формулы может иметь следующие три структуры вследствиe таутомерии, и производное пиразола данного изобретения включает все представленные выше структуры. Далее, производное пиразола формулы (Iа) является кислотным соединением и может легко превращаться в соль обработкой основанием. Производное пиразола данного соединения включает также такую соль. Основание может быть выбрано из известных оснований без каких-либо проблем, хотя примеры такого основания включают органические основания, такие как амины и анилины, и неорганические основания, такие как соединения натрия и соединения калия. Амины включают моноалкиламин,диалкиламин и триалкиламин. Алкильной группой этих алкиламинов является, как правило,С 1-С 4-алкильная группа. Анилины включают анилин, моноглкиланилин и диалкиланилин. 7 Алкильной группой этих алкиланилинов является, как правило, С 1-С 4-алкильная группа. Соединения натрия включают гидроксид натрия и карбонат натрия, а соединения калия включают гидроксид калия и карбонат калия. Гербицид данного изобретения содержит новое производное пиразола формулы (I) и/или его соль в качестве активного ингредиента. Гербицид может быть приготовлен смешиванием этих соединений с жидким носителей, таким как растворитель, или твердым носителем, таким как тонкоизмельченный порошок минерала, с получением смачивающегося порошка, эмульгирующегося концентрата, дуста или гранул. При приготовлении препаративной формы гербициду придают эмульгирующие свойства, способность к образованию дисперсий и к распылению добавлением поверхностно-активного вещества. При использовании гербицида данного изобретения в форме смачивающегося порошка,как правило, используют композицию, приготовленную смешиванием 10-55 вес.% производного пиразола и/или его соли данного изобретения, 40-88 вес.% твердого носителя и 2-5 вес.% поверхностно-активного вещества. Далее, при использовании его в форме концентрата эмульсии, как правило, его готовят смешиванием 2050 вес.% производного пиразола и/или его соли данного изобретения, 35-75 вес.% растворителя и 5-15 вес.% поверхностно-активного вещества. С другой стороны, при его использовании в форме дуста, как правило, его готовят смешиванием 1-15 вес.% производного пиразола и/или его соли данного изобретения, 80-97 вес.% твердого носителя и 2-5 вес.% поверхностноактивного вещества. Далее, при его использовании в форме гранул смешивают 1-15 вес.% производного пиразола и/или его соли данного изобретения, 80-97 вес.% твердого носителя и 2-5 вес.% поверхностно-активного вещества. Вышеупомянутый твердый носитель может быть выбран из тонких минеральных порошков, которые включают оксиды, такие как диатомовая земля и гашеная известь, фосфаты,такие как апатит, сульфаты, такие как гипс, и силикаты, такие как тальк, пироферрит, глина,каолин, бентонит, активированная кислотой глина, белая сажа, порошкообразный кварц и порошкообразный диоксид кремния. Растворитель выбирают из органических растворителей, и характерные примеры органических растворителей включают ароматические углеводороды, такие как бензол, толуол и ксилол, хлорированные углеводороды, такие как охлортолуол, трихлорэтан и трихлорэтилен,спирты, такие как циклогексанол, амиловый спирт и этиленгликоль, кетоны, такие как изофорон, циклогексанон и циклогексенилциклогексанон, простые эфиры, такие как бутилцеллюлоза, диэтиловый эфир и метилэтиловый эфир, сложные эфиры, такие как изопро 001810 8 пил-ацетат, бензилацетат и метилфталат, амиды,такие как диметилформамид, и их смеси. Далее, поверхностно-активные вещества могут быть выбраны из анионогенных, неионогенных, катионогенных и амфотерных (аминокислота и бетаин) поверхностно-активных веществ. В комбинации с производным пиразола приведенной выше общей формулы (I) и/или его солью гербицид данного изобретения может содержать в качестве активного ингредиента другой гербицидно активный компонент может быть выбран из известных гербицидов, таких как феноксигербициды, гербициды на основе дифенилового эфира, триазина, мочевины, карбамата, тиокарбамата, кислого анилида, пиразола, фосфорной кислоты, сульфонилмочевины и оксадиазона. Другой гербицидно активный компонент может быть подходящим образом выбран из перечисленных выше гербицидов. Далее, гербицид данного изобретения может содержать, при необходимости, инсектицид,фунгицид, регулятор роста растений и удобрение. Производное пиразола формулы (I), заявленное в данном изобретении, получают следующими способами (1) и (2). Ниже подробно объясняется сначала способ (1) получения производного пиразола. Способ (1) получения производного пиразола В представленной выше схеме реакций Q1 является группой -А-В, в которой А выбран из группы, состоящей из -SО 2, -СО- и -СН 2 СО-, В выбран из группы, состоящей из С 1-С 8 алкильной группы, С 3-С 8-циклоалкильной группы и группы формулы где Y выбран из группы, состоящей из атома галогена, нитрогруппы, С 1-С 4-алкильной группы, С 1-С 4-алкоксигруппы и C1-С 4-галогеналкильной группы, и m обозначает число Y и является целым числом 0, 1 или 2. Далее R1, R2, 9X1, X2, X3, X4, X5, X6, X7 и X8, р и n имеют значения, определенные ранее в общей формуле (I),a Hal обозначает атом галогена. Далее будет объяснен постадийно способ получения (1).(Стадия 1) Соединение формулы (II) и соединение формулы (III) взаимодействуют друг с другом в инертном растворителе в присутствии дегидратирующего агента, такого как ДЦК (N,N'дициклогексилкарбодиимид), КДИ (1,1-карбонилдиимидазол) или ЭДК (1-(3-диметиламинопропил)-3-этилкарбодиимид), и основания с образованием производного пиразола формулы (la). Количество соединения формулы (III) равно предпочтительно 1,03,0 моль на моль соединения формулы (II). Далее, количество дегидратирующего агента равно предпочтительно 1,0-1,5 моль на моль соединения формулы (II). Тип основания не ограничивается особо, хотя предпочтительным является карбонат калия или карбонат натрия. Количество основания равно предпочтительно 0,5-2,0 моль на моль соединения формулы (II). Растворитель для этой реакции не ограничивается особо, если он является инертным относительно реакции. Растворитель предпочтительно выбран из ацетонитрила, 1,4 диоксана,трет-амилового спирта,третбутилового спирта и изопропилового спирта. Температура реакции может быть выбрана в диапазоне от 0 С до точки кипения растворителя, хотя предпочтительна температура около 80 С. Время реакции 1-48 ч, хотя, как правило,оно составляет около 8 ч. В качестве промежуточного продукта реакции образуется сложный эфир, который может быть выделен такими средствами, как колоночная хроматография на силикагеле, хотя обычно эту реакцию проводят без выделения эфирного промежуточного продукта. При выделении эфирного промежуточного продукта к нему добавляют основание для дальнейшего прохождения этой реакции, в результате которой можно получить целевое производное пиразола (la) . Количество основания, используемое в этом случае, равно 0,5-3,0 эквивалентов, предпочтительно 0,5-1,5 эквивалентов относительно эфирного промежуточного продукта. Температура реакции обычно 80-150 С, предпочтительно 100-120 С. Время реакции обычно 0,5-8 ч,предпочтительно приблизительно 1-2 ч. После завершения этой реакции, согласно общепринятому способу, растворитель отгоняют, остаток разделяют на слои органическим растворителем и водой, водный слой нейтрализуют кислотой, такой как соляная кислота, и экстрагируют этилацетатом, органический слой сушат над дегидратирующим агентом (осушителем), таким как безводный сульфат натрия, и растворитель отгоняют с получением целевого производного пиразола (la).(Стадия 2) Соединение (1 а), полученное в стадии 1,взаимодействует с Q1-Hal (IV) (где Q1 и Hal имеют определенные ранее значения) в инертном растворителе в присутствии основания с образованием соединения (la). В этой стадии молярное отношение соединения (1 а) к соединению (IV) равно предпочтительно 1:1 - 1:3. Для сбора галоидоводорода,образующегося в качестве побочного продукта реакции, используют предпочтительно основание, такое как карбонат натрия, карбонат калия,триэтиламин или пиридин, по меньшей мере, в эквимолярном количестве относительно исходного материала формулы (la). Температуру реакции устанавливают предпочтительно в диапазоне от комнатной температуры до точки кипения растворителя. Растворителем, применяемым в этой реакции, могут быть ароматические углеводороды, такие как бензол и толуол, простые эфиры, такие как диэтиловый эфир, кетоны, такие как метилэтилкетон, и галогенированные углеводороды, такие как метиленхлорид и хлороформ. Можно использовать также двухфазный растворитель, состоящий из указанного выше растворителя и воды. В этом случае более желательный результат может быть получен путем добавления катализатора фазового переноса, такого как кроун-эфир или хлорид бензилтриэтиламмония, к реакционной системе. После завершения этой реакции, согласно общепринятому способу, реакционную смесь разделяют на слои, конечный продукт экстрагируют из водного слоя органическим растворителем, таким как дихлорметан, органический слой дегидратируют и затем растворитель отгоняют,посредством чего может быть выделено целевое производное пиразола (Id). Производное ароматической карбоновой кислоты (II), используемое для реакции с соединением формулы (III) в указанном выше способе где X1 выбран из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы,каждый из X2, X3, X5, X6, Х 7 и X8 , независимо, обозначает атом водорода или С 1-С 4 алкильную группу или X2 и X5 могут образовывать ненасыщенную связь путем связывания друг с другом, или X5 и X7 могут образовывать ненасыщенную связь путем связывания друг с другом,X4 обозначает атом водорода, атом галогена или С 1-С 4-алкильную группу,n обозначает 0, 1 или 2, и р обозначает 1,при условии, что, когда X2 и X3 оба обозначают С 1-С 4-алкильные группы, то исключен 11 случай, когда Х 5, X6, X7 и Х 8 все являются атомами водорода,является новым соединением, не описанным в литературе, и это производное ароматической карбоновой кислоты формулы (II) применимо в качестве промежуточного продукта, для получения производного пиразола данного изобретения. Характерные примеры X1 , X 2 , X 3 , X4 , X 5 ,6X , X7 и X8 в формуле (II) включают описанные выше для производного пиразола формулы (I). Производное ароматической карбоновой кислоты формулы (II) является кислотным веществом и может легко превращаться в соль обработкой его основанием. Эта соль также включена в производное ароматической карбоновой кислоты данного изобретения. Основание может быть выбрано из известных оснований без каких-либо ограничений. Например, основания включают органические основания, такие как амины и анилины, и неорганические основания, такие как соединения натрия и соединения калия. Амины включают моноалкиламин, диалкиламин и триалкиламин. Алкильной группой этих алкиламинов является, как правило, С 1 С 4 -алкильная группа. Анилины включают анилин, моноалкиланилин и диалкиланилин. Алкильной группой этих алкиланилинов являются, как правило, С 1 -С 4 -алкильная группа. Соединения натрия включают гидроксид натрия и карбонат натрия, а соединения калия включают гидроксид калия и карбонат калия. Производное ароматической карбоновой кислоты общей формулы (II) , в которой р обозначает 1 (где X2 и X5 не связаны друг с другом,и X5 и X7 не связаны друг с другом) , может быть получено способами, показанными в следующих схемах реакций 1-5. Схема получения 1 показывает способ получения производного ароматической карбоновой кислоты общей формулы (IIх), где X6 является водородом. В представленной выше схеме получения Х 1, X2, X3, X4, X5, X6, X7, X8 и Hal имеют указанные выше значения. Тиофенол формулы (VI) в качестве исходного материала может быть получен известным способом (например, "Shin-Jikken Kagaku Koza 14, Syntheses and Reactions of Organic Compounds, 111, page 1, 704, chap. 8.1, Thiols, f. Synthesis through dithiocarbonate ester", Maruzen,issued Feb. 22, 1986).(Стадия 1) Исходный материал формулы (VI) и соединение формулы (VII) взаимодействуют друг с другом в инертном растворителе, таком как ацетон, диэтиловый эфир или диметилформамид в присутствии основания, такого как безводный карбонат калия, гидроксид натрия, гидроксид калия, безводный карбонат натрия или триэтиламин, с образованием соединения формулы (VIII). Соединение формулы (VII) и основание используют в количествах 1,0-1,5 мол.экв. и 1,0-1,5 мол.экв., соответственно, относительно исходного материала формулы (VI). Обычно,температура реакции равна предпочтительно 080 С, и время реакции предпочтительно равно приблизительно 1-8 ч.(Стадия 2) Соединение формулы (VIII) замыкают в кольцо или циклизуют добавлением дегидратирующего-конденсирующего агента, такого как полифосфорная кислота, серная кислота или пентаоксид фосфора, с получением соединения формулы (IX) (производного тиохромана). Количество дегидратирующего-конденсирующего агента равно 1-10 мол.экв. относительно соединения формулы (VIII). Как правило, температура реакции равна предпочтительно приблизительно 0-100 С, и время реакции составляет предпочтительно приблизительно 1-8 ч.(Стадия 3) Галогенирующий реагент, такой как бром,сульфурилхлорид или хлор, реагирует с соединением формулы (IX) в присутствии растворителя, такого как метиленхлорид, хлороформ или четыреххлористый углерод, с образованием соединения формулы (X), где галоген является заместителем в положении 6. Обычно температура реакции равна предпочтительно приблизительно 0-80 С, и время реакции равно предпочтительно приблизительно 1-80 ч.(Стадия 4) Соединение формулы (X) взаимодействует с магнием (Мg) с образованием реактива Гриньяра и диоксид углерода (СО 2) взаимодействует с ним с образованием соединения (XI) (n=0,сульфидное соединение), которое является производным ароматической карбоновой кислоты формулы (IIX), где карбоксильная группа введена в положение 6, обеспеченным данным изобретением. Растворитель предпочтительно выбран из простых эфиров, таких как диэтиловый эфир и тетрагидрофуран. Температура реакции равна предпочтительно 0-70 С, особенно предпочтительно 20-60 С. Время реакции составляет, как правило, приблизительно 1-7 ч. Количество магния (Мg) для получения реактива Гриньяра равно предпочтительно 1,13,5 мол.экв. относительно соединения формулы(X). Реакцию Гриньяра предпочтительно проводят в присутствии одновременно алкилиодида,такого как метилиодид, или алкилбромида, такого как этилбромид, так как реакция в этом случае протекает хорошо. Количество галогенированного алкила, используемого в этом случае,равно предпочтительно 0,1-2,5 мол.экв. относительно соединения формулы (X). Реакцию между реактивом Гриньяра и диоксидом углерода (СО 2) проводят введением диоксида углерода из газового контейнера в реактив Гриньяра или введением диоксида углерода, генерируемого сухим льдом (твердый диоксид углерода), в реактив Гриньяра. Сухой лед можно добавлять непосредственно к реактиву Гриньяра для реакции.(Стадия 5) Окислитель (например, пероксид водорода, перуксусная кислота или метапериодат натрия) взаимодействует с соединением формулы(например, уксусной кислоте, воде или метаноле) с образованием соединения (XII) (n=1, сульфоксидное соединение/n=2, сульфоновое соединение), которое является производным ароматической карбоновой кислоты формулы (IIх),обеспечиваемым данным изобретением. При реакции соединения (XI) с 1 эквивалентом окислителя получают сульфоксидное соединение (соединение (XII), в котором n=1). При реакции соединения (XI) с 2 эквивалентами окислителя получают сульфон (соединение (XII), в котором n=2). Схема получения 2 Схема получения 2 также показывает способ получения производного ароматической карбоновой кислоты общей формулы (IIх), в котором X6 представляет собой водород.(Стадии 1 и 2) Стадии 1 и 2 получения соединения (IX) из исходного материала (IV) через соединение(VIII) являются такими же, что и при получении соединения (IX) из соединения (VI) в схеме 1.(Стадия 3) Кислота Льюиса, такая как хлорид алюминия, хлорид цинка или хлорид железа, или "протонные" кислоты, такие как фтористый водород,серная кислота или фосфорная кислота, и ацетилхлорид, взаимодействуют с соединением формулы(IX) в присутствии растворителя, такого как дихлорметан, нитрометан, ацетонитрил или бензол, с образованием соединения (XIII), имеющего ацетильную группу, введенную в его положение 6. Количество кислоты Льюиса или "протонной" кислоты равно 1,0-1,5 мол.экв. относительно соединения формулы (IX), и количество ацетилхлорида равно 1,0-1,5 мол.экв. относительно соединения формулы (IX). Обычно, температура реакции равна предпочтительно приблизительно 0-80 С, и время реакции составляет предпочтительно приблизительно 1-8 ч.(Стадия 4) Окислитель (например, пероксид водорода, перуксусная кислота или метапериодат натрия) реагирует с соединением (XIII) (сульфид) в растворителе (например, уксусная кислота,вода или метанол) с образованием соединения(XIV) (n=1, сульфоксидное, соединение/n=2,сульфоновое соединение). При реакции соединения (XIII) с 1 эквивалентом окислителя получают сульфоксидное соединение (соединение(XIII) с 2 эквивалентами окислителя получают сульфоновое соединение (соединение (XIV), в котором n=2).(ацетильная группа) в положении 6 в карбоксильную группу без окисления атома серы (S) кольца тиохромана описан в J. Am. Chem. Soc. 66, page 1, 612 (1944). То есть, метилкетосоединение формулы (XIII) взаимодействует с иодом 15 в пиридине и затем разрушается щелочью, в результате чего получают соединение (XI) (n=0,сульфидное соединение), которое является производным ароматической карбоновой кислоты формулы (IIх), обеспечиваемым данным изобретением.(Стадия 5) Метилкетосоединение (XIV) превращают в соединение (XII) (n=1, сульфоксидное соединение/n=2, сульфоновое соединение), которое является производным ароматической карбоновой кислоты (IIх) данного изобретения, реакцией метилкетосоединения (XIV) в галоформной реакции в присутствии окислителя (например,перманганата, хромовой кислоты, галогена, кислорода или серной кислоты). Производное ароматической карбоновой кислоты общей формулы (IIх) можно получить по следующей схеме получения 3. Схема получения 3(Стадия 1) Тиофенол формулы (VI) взаимодействует со спиртом формулы (XV) в ароматическом растворителе, таком как бензол или толуол, или галогенированном углеводородном растворителе, таком как дихлорэтан или тетрахлорэтан, в присутствии кислотного катализатора, такого как серная кислота, п-толуолсульфокислота,метансульфокислота, муравьиная кислота или уксусная кислота, с образованием соединения формулы (XVI). Количество спирта формулы (XV) равно 1,0-3,0 мол.экв, относительно тиофенола формулы (VI). Количество кислотного катализатора равно 0,01-1,0 мол.экв. относительно тиофенола. В качестве растворителя с тем же успехом можно использовать уксусную кислоту или муравьиную кислоту. Температуру реакции можно установить в диапазоне от комнатной температуры до точки кипения растворителя, хотя обычно она находится в пределах от 50 С до 100 С.(Стадия 2) Реактив Гриньяра взаимодействует с соединением формулы (XVI) с образованием спирта (XVII). Реакция этой стадии является хорошо известной реакцией Гриньяра и ее детали опускаются.(Стадия 3) Это стадия, в которой дегидратирующий агент, такой как полифосфорная кислота, пентаоксид дифосфора (Р 2O5), серная кислота, или кислотный катализатор, такой как метансульфокислота или п-толуолсульфокислота, реагирует со спиртом формулы (XVII) с образованием соединения формулы (XIX). В качестве растворителя может быть использован ароматический углеводород, такой как бензол или толуол, или галогенсодержащий углеводородный растворитель, такой как дихлорэтан или тетрахлорэтан. В качестве растворителя можно также использовать полифосфорную кислоту или серную кислоту. Температуру реакции можно установить в диапазоне от комнатной температуры до точки кипения растворителя, хотя она предпочтительно находится в пределах от 50 до 100 С.(Стадия 4) Это стадия, в которой галогенирующий агент, такой как тионилхлорид, оксихлорид фосфора или пентаоксид фосфора, взаимодействует со спиртом формулы (XVII) с образованием галогенсодержащего соединения формулы(XVIII). Количество галогенирующего агента равно 1,0-1,5 мол.экв. относительно спирта формулы (XVII). Растворитель специально не ограничивается, если он является инертным в отношении реакции, хотя его выбирают из растворителей, описанных в стадии 3. В качестве растворителя можно использовать тионилхлорид или оксихлорид фосфора. Температуру реакции можно устанавливать в диапазоне от комнатной температуры до точки кипения растворителя, хотя обычно ее устанавливают в пределах от 60 до 80 С.(Стадия 5) Это стадия, в которой кислота Льюиса, такая как хлорид алюминия, хлорид цинка или хлорид железа, взаимодействует с галогенсодержащим соединением формулы (XVIII) с образованием соединения формулы (XIX). Предпочтителен хлорид алюминия. Количество кислоты Льюиса равно 1,0-1,5 мол.экв. относительно соединения формулы (XIX). В качестве растворителя предпочтителен галогенированный углеводородный растворитель, такой как метиленхлорид или дихлорэтан. Температуру реакции можно устанавливать в диапазоне от комнатной температуры до точки кипения растворителя, хотя реакция обычно протекает хорошо приблизительно при комнатной температуре. Соединение формулы (XIX) получают согласно описанным выше стадиям и последующие процедуры проводят так же, как в схеме 17 получения 1 или 2 с получением ароматической карбоновой кислоты общей формулы (IIх). Схема получения 4 Схема получения 4 показывает способ получения производного ароматической карбоновой кислоты общей формулы (IIх), в котором оба X3 и X8 являются атомами водорода.(Стадия 1) Бромированное производное тиохроман-4 она (XX) в качестве исходного материала может быть получено известным способом, например,способом, описанным в JP-A-58-198483 и InternationalWО 88/06155. Реактив Гриньяра взаимодействует с бромированным производным тиохроман-4 она формулы (XX) для превращения его в производное тиохроманола формулы (XXI). Реакция в этой стадии является типичной реакцией Гриньяра и ее детали опускаются.(Стадия 2) Это стадия, в которой производное тиохроманола формулы (XXI) дегидратируют в органическом растворителе в присутствии кислотного катализатора с получением производного 3,4-дегидротиохромана формулы (XXII). Кислотный катализатор выбирают из серной кислоты, п-толуолсульфокислоты, метансульфокислоты и трифторметансульфокислоты. Количество кислотного катализатора равно 0,0011,0 мол.экв., предпочтительно 0,01-0,1 мол.экв. относительно производного тиохроманола(XXI). Растворителем могут быть ароматические углеводородные растворители, такие как бензол и толуол, и галогенированные углеводородные растворители, такие как 1,2-дихлорэтан,1,1,1-трихлорэтан или четыреххлористый углерод. Температура реакции обычно 60-120 С,предпочтительно 80-100 С.(Стадия 3) Это стадия, в которой производное 3,4 дигидротиохромана формулы (XXII) восстанавливают с получением производного тиохромана формулы (XXIII). Способ восстановления не ограничивается специально, хотя восстановление предпочтительно проводят водородом в присутствии катализатора, такого как палладий или платина, в условиях атмосферного давления или повышенного давления. После этого проводят карбоксилирование и окисление, как в приведенной выше схеме 18 получения 1, с получением ароматической карбоновой кислоты общей формулы (IIх). Схема получения 5 Схема получения 5 показывает способ получения производного ароматической карбоновой кислоты общей формулы (IIх), в котором X5 является водородом.(XXIV) взаимодействует друг с другом в присутствии основного катализатора, такого как пиридин, пиперидин или триэтиламин, с образованием сульфида формулы (XVIа). Растворитель, применяемый в этой реакции, особо не ограничивается, если он является инертным в отношении реакции. Предпочтителен галогенированный углеводородный растворитель, такой как 1,2-дихлорэтан, 1,1,1-трихлорэтан или 1,1,2,2-тетрахлорэтан. Температуру реакции можно устанавливать в диапазоне от комнатной температуры до точки кипения растворителя,хотя обычно эта реакция протекает хорошо при приблизительно комнатной температуре. Количество ненасыщенного в положениях ,кетона формулы (XXIV) равно 1-5 моль, предпочтительно 1,0-1,5 моль на моль тиофенола формулы(VI). Последующие стадии 2-5 можно проводить так же, как в схеме 3, и их детали опускаются. Затем соединение (XIX), полученное в стадии 3 или 5, взаимодействует так же, как в схеме получения 1 или 2, с образованием производного ароматической карбоновой кислоты формулы (IIх). Схема получения 6 Схема получения 6 показывает способ получения производного ароматической карбоновой кислоты общей формулы (IIх), в котором X2 и X5 являются атомами водорода.(XVIа), полученный в стадии 1 в схеме получения 5, восстанавливают для образования спирта формулы (XVIIb). Применяемый восстановитель не очень ограничивается, хотя предпочтительно используют боргидрид натрия. Количество боргидрида натрия равно 0,25-1 мол.экв. относительно сульфида формулы (XVIа). Растворитель предпочтительно выбирают из спиртовых растворителей, таких как метанол и этанол. Обычно реакция протекает хорошо при температуре реакции в диапазоне от 0 С до комнатной температуры и нагревания не требуется. Последующие стадии 2, 3 и 4 можно проводить так же, как стадии 3, 4 и 5 в схеме получения 3, и их детали опускаются. Затем соединение (ХIХb), полученное в стадии 2 или 4, реагирует так же, как в схеме получения 1 или 2, с образованием производного ароматической карбоновой кислоты формулы (IIх). Производное ароматической карбоновой кислоты общей формулы (II), в котором Х является водородом, может быть получено согласно следующей схеме получения 7. Схема получения 7.(Стадии 1 и 2) Это стадии, в которых исходный материал формулы (XXXVIII), полученный в стадиях 1-3 в схеме получения 1 или в стадиях 1-3 в схеме 20 получения 4, обрабатывают так же, как в стадиях 4 и 5 в схеме получения 1, через производное ароматической карбоновой кислоты формулы(XXXIX) (n=0, сульфидное соединение) с образованием производного ароматической карбоновой кислоты формулы (ХХХХ) (n=1, сульфоновое соединение/n=2, сульфоксидное соединение). Детали этих реакций см. в описании схемы получения 1.(ХХХХ) восстанавливают с образованием производного ароматической карбоновой кислоты(ХХХХI) (n=1 или 2). Способ восстановления особо не ограничивается. Например, имеется способ, в котором восстановление проводят водородом при атмосферном давлении или повышенном давлении в присутствии катализатора, такого как палладий или оксид платины, или восстановление проводят непосредственно в присутствии порошка цинка без применения катализатора. Для акцептирования хлористого водорода, образованного в этой реакции, одновременно присутствует основание, такое как триэтиламин, пиридин, гидроксид натрия или гидроксид калия, в количестве, равном или большем, чем эквивалентная масса, относительно соединения формулы (ХХХХ). В качестве растворителя предпочтительно использовать спиртовой растворитель, такой как метанол или этанол. Для полного растворения исходного материала предпочтительно использовать этанол с содержанием воды приблизительно 60%. Температура реакции обычно равна 20-120 С, и время реакции составляет приблизительно 1-12 ч. Производное ароматической карбоновой кислоты формулы (II), в котором X2 и X5 вместе образуют связь, то есть, соединение формулы(IIza), получают согласно следующим схемам получения 8 или 9.(Стадия 1) Это стадия, в которой эфир бензойной кислоты формулы (ХХХХII) и производное меркаптопропионовой кислоты формулы (ХХХХIII) подвергают реакции конденсации с образованием производного фенилтиопропионовой кислоты формулы (XXXXIV). Эту стадию предпочтительно проводят в апротонном полярном растворителе, таком как N-метилпирролидон илиN,N-диметилформамид, в присутствии основания. Основанием может быть карбонат калия или карбонат натрия. Количество основания равно 1,0-3,0 мол.экв. относительно сложного эфира бензойной кислоты. Температуру реакции устанавливают в диапазоне от комнатной температуры до точки кипения растворителя, хотя предпочтительна температура в пределах 80 С 130 С. Время реакции равно обычно 1-8 ч.(Стадия 2) Это стадия, в которой производное фенилтиопропионовой кислоты (XXXXIV), полученное в стадии 1, конденсируют и циклизуют с образованием производного тиохроман-4-она формулы (XXXXV). Способ конденсации включает (i) способ, в котором производное фенилтиопропионовой кислоты (XXXXIV) дегидратируют и циклизуют в присутствии кислотного катализатора, такого как фтористый водород, серная кислота, пентаоксид фосфора, фосфорная кислота, полифосфорная кислота, хлорид олова, хлорид цинка,хлорид алюминия или Амберлит (торговое название ионообменной смолы), и (ii) способ, в котором производное фенилтиопропионовой кислоты (XXXXIV) реагирует с хлорирующим агентом, таким как тионилхлорид, с образованием хлорангидрида кислоты, и хлорангидрид кислоты циклизуется в присутствии кислотного катализатора, подобного применяемому в способе (i). Растворитель, используемый в этой реакции, особо не ограничивается, если он инертен в отношении реакции, и предпочтительно выбран из углеводородных растворителей, таких как пентан и гексан, и галогенсодержащих растворителей, таких как дихлорметан и 1,2 дихлорэтан. Также предпочтительно использование полифосфорной кислоты как в качестве растворителя, так и в качестве кислотного катализатора. В способе конденсации-циклизации (i) количество кислотного катализатора равно 0,0120 мол.экв., предпочтительно 1,0-10 мол.экв. относительно производного фенилтиопропионовой кислоты (XXXXIV). Температура реакции обычно находится в диапазоне от комнатной температуры до 120 С, хотя предпочтительна температура 50-100 С. Время реакции обычно 30 мин-8 ч, хотя предпочтительно реакция протекает 30 мин-2 ч. В способе циклизации-конденсации (ii) количество хлорирующего агента равно 1,0-3,0 мол.экв., предпочтительно 22 1,1-1,5 мол.экв. относительно производного фенилтиопропионовой кислоты (XXXXIV). Температура для хлорирования обычно находится в диапазоне от 0 до 120 С, предпочтительно от 30 мин до 2 ч. Количество кислотного катализатора, используемое в способе циклизации (ii), равно 0,01-1,0 мол.экв., предпочтительно 0,1-1,0 мол.экв. относительно хлорангидрида кислоты. Температура для реакции в присутствии кислотного катализатора обычно находится в диапазоне от комнатной температуры до 120 С,предпочтительно от комнатной температуры до 80 С. Время реакции составляет обычно от 30 мин до 8 ч, предпочтительно от 2 до 4 ч.(Стадия 3) Это стадия, в которой производное тиохроман-4-она (XXXXV), полученное в стадии 2,восстанавливают с получением производного гидрокситиохромада формулы (XXXXVI). Способ восстановления особо не ограничивается и, например, восстановление проводят(i) по способу с применением восстановителя,такого как боргидрид натрия, в растворителе,инертном относительно данной реакции, таком как спирт или дихлорметан, или (ii) по способу гидрирования при атмосферном давлении или повышенном давлении в присутствии восстанавливающего катализатора, такого как палладий или никель. В способе восстановления (i) количество восстановителя равно 1,0-5,0 мол.экв., предпочтительно 1,1-2,0 мол.экв. относительно производного тиохроман-4-она(XXXXV). Температуру реакции устанавливают обычно -20-50 С, предпочтительно 0-20 С. Время реакции обычно составляет от 30 мин до 8 ч, предпочтительно от 30 мин до 2 ч. В способе восстановления (ii) количество восстановителя равно 1-50 мас.%, предпочтительно 10-20 мас.% относительно производного тиохроман-4 она (XXXXV). Давление водорода обычно равно атмосферному давлению 100 кг/см 2, предпочтительно 10-50 кг/см 2. Температуру реакции устанавливают обычно в диапазоне от комнатной температуры до 100 С, и время реакции составляет от 1 до 8 ч. В предпочтительном варианте стадии 3 восстановление проводят в растворителе, таком как этанол или дихлорэтан, в присутствии боргидрида натрия. В этом предпочтительном варианте температура реакции находится в диапазоне от 0 С до комнатной температуры, и время реакции составляет от 30 мин до 2 ч. При проведении восстановления в присутствии боргидрида натрия реакционную смесь после завершения реакции выливают в смесь воды со льдом и для экстракции добавляют дихлорметан. Полученный органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, после чего растворитель отгоняют с получением неочищенного продукта. Неочищенный продукт может быть подан непосредст 23 венно в следующую стадию реакции без его очистки.(Стадия 4) Стадия 4 является стадией, в которой производное гидрокситиохромана (XXXXVI), полученное в стадии 3, окисляют с получением оксида гидрокситиохромана (XXXXVII), хотя это окисление в основном такое же, что и окисление в стадии 5 в схеме получения 1, и может быть проведено в соответствии с этой стадией. Поэтому детали этого окисления опускаются.(Стадия 5) Стадия 5 является стадией, в которой оксид гидрокситиохромана (XXXXVII), полученный в стадии 4, дегидратируют с получением 3,4-дегидротиохромана (XXXXVIII), хотя эта дегидратация в основном такая же, что и в стадии 2 в схеме получения 4, и может проводиться в соответствии с этой стадией. Поэтому детали этой дегидратации опускаются.(Стадия 6) Стадия 6 является стадией, в которой 3,4 дегидротиохроман (XXXXVIII), полученный в стадии 5, гидролизуют с получением целевой ароматической карбоновой кислоты (IIza,X3=водород). Этот гидролиз является хорошо известным гидролизом сложного эфира и поэтому его детали опускаются. Стадию 6 можно проводить перед стадией 4 или перед стадией 5. Схема получения 9 Схема получения 9 показывает способ получения производного ароматической карбоновой кислоты формулы (IIza), в котором X3 является водородом. Соединение формулы (XXII) в качестве исходного материала получают согласно стадиям 1 и 2 в схеме 4. Последовательные стадии 1 и 2 по существу одинаковы со стадиями 4 и 5 в схеме получения 1 и поэтому их детали опускаются. Новое производное пиразола формулы (I),в котором оба X2 и X5 являются атомами водорода, обеспечиваемое данным изобретением, то есть, производное пиразола общей формулы (If) или (Ig), также получают по следующему способу.(Стадия 1) Это стадия, в которой производное пиразола формулы (Iе) восстанавливают с получением производного пиразола (If) данного изобретения. Восстановление предпочтительно проводят способом с применением водорода, имеющего атмосферное давление или повышенное давление, в присутствии катализатора, такого как палладий или оксид платины. Количество катализатора равно 5-20 мас.% относительно производного пиразола формулы (Ie). В качестве растворителя предпочтительно применение спирта, такого как метанол или этанол. Температура реакции от комнатной температуры до приблизительно 80 С, хотя обычно реакция хорошо протекает при комнатной температуре. Время реакции приблизительно от 2 ч до 24 ч.(Стадия 2) Стадия 2 является стадией, в которой производное пиразола (Ig) получают реакцией производного пиразола (If) с Q-Hal. Эта стадия 2 по существу одинакова со стадией 2 в способе (1) получения производного пиразола, в котором можно ознакомиться с деталями. 5-Гидроксипиразол общей формулы (III) в качестве исходного материала для получения производного пиразола (1) данного изобретения может быть получен одним из следующих способов в зависимости от его заместителя. В следующих схемах реакций R1 и R2, имеют значения, указанные в общей формуле (I). Пункты (1) (3) показывают способ получения 5-гидроксипиразола общей формулы (III), в котором R2 является атомом водорода. Пункты (4) и (5) показывают способ получения 5-гидроксипиразола общей формулы (III),в котором R2 обозначает С 1-С 4-алкильную группу, С 1-С 4-галогеналкильную группу или С 2-С 4 алкоксиалькильную группу. Примеры Данное изобретение будет объясняться далее подробно со ссылкой на примеры, хотя данное изобретение не должно быть ограничено этими примерами. Пример 1 получения промежуточного соединения. 1,1-Диоксид 4,5,8-триметилтиохроман-6 карбоновой кислоты, используемый в качестве исходного материала в препаративном примере 1, который будет описан позднее, получали в следующих стадиях: Стадия (1) Трехгорлую колбу на 300 мл загружали 55 мл (55 ммоль, 3 экв.) 1 М раствора метилбромида магния (МеМgВr) и 100 мл тетрагидрофурана(ТГФ) и смесь охлаждали льдом в токе азота. К этой смеси добавляли по каплям раствор 5,0 г(18,4 ммоль) 6-бром-5,8-диметилтиохроман-4 она в 15 мл ТГФ и смесь перемешивали при комнатной температуре в течение 3 ч и затем нагревали с обратным холодильником в течение 2 ч. К реакционной смеси добавляли 5% НСl и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и раствори 001810Dean Stark, загружали 5,4 г (18,8 ммоль) 6-бром 4,5,8-триметилтиохроман-4-ола, полученного в стадии (1), 100 мл бензола и 10 мг (0,06 ммоль,0,0032 экв.) п-толуолсульфокислоты и смесь нагревали с обратным холодильником в течение 1 ч. После охлаждения реакционную смесь последовательно промывали водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли и полученный остаток (неочищенный продукт) очищали колоночной хроматографией на силикагеле (проявляющий растворитель: гексан,этилацетат) с получением 1,4 г (выход 27%) 6 бром-4,5,8-триметил-3,4-дегидротиохромана. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 2,29 (3 Н, с), 2,42 (3 Н, с), 2,99 (2 Н, дд),6,02 (Н, т), 7,22 (Н, с). Стадия (3) Портативный реактор на 100 мл загружали 1,32 г 6-бром-4,5,8-триметил-3,4-дегидротиохроман, 0,55 г 5% Pd/C и 20 мл хлороформа и смеси давали реагировать при давлении водорода 5 кг/см 2 G при комнатной температуре в течение 6 ч. После завершения реакции катализатор отделяли фильтрованием и растворитель отгоняли с получением 1,21 г (выход 91%) 6 бром-4,5,8-триметилтиохромана. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 1,15 (3 Н, д), 2,20 (3 Н, с), 2,38 (3 Н, с),1,8-2,3 (Н, м), 2,9-3,1 (2 Н, м), 3,2-3,4 (2 Н, м),7,20 (Н, с). Стадия (4) Трехгорлую колбу на 50 мл загружали 15 мл ТГФ и 0,43 г (18 ммоль) магния и добавляли 0,97 (9 ммоль) этилбромида по каплям для активации смеси. Затем добавляли по каплям раствор 1,21 (4,5 ммоль) 6-бром-4,5,8-триметилтиохромана в 3 мл ТГФ и смесь нагревали с обратным холодильником в течение 6 ч. Реакционной смеси давали остыть до комнатной температуры и барботировали ее газообразным СО 2. Реакцию останавливали добавлением 5% соляной кислоты и реакционную смесь экстрагировали этилацетатом. Органический слой экстрагировали водным раствором карбоната натрия и водный слой промывали этилацетатом и нейтрализовали 5% соляной кислотой. Образованную таким образом карбоновую кислоту экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом натрия. Растворитель отгоняли с по 27 лучением 0,75 г (выход 71%) 4,5,8 триметилтиохроман-6-карбоновой кислоты. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 1,14 (3 Н, д), 2,33 (3 Н, с), 1,75-2,35 (2 Н,м), 2,55 (3 Н, с), 2,9-3,1 (2 Н, м), 3,2-3,5 (2 Н, м),7,60 (Н, с). Стадия (5) Колбу в форме баклажана на 30 мл загружали 0,75 г (3,2 ммоль) 4,5,8-триметилтиохроман-6-карбоновой кислоты, 1,1 г (9,5 ммоль) 30% пероксида водорода и 1 мл уксусной кислоты и смеси давали реагировать при 100 С в течение 2 ч. Реакционную смесь выливали в водный раствор бисульфита натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель отгоняли с получением 0,76 г (выход 98%) 1,1 диоксида 4,5,8-триметилтиохроман-6-карбоновой кислоты. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 1,35 (3 Н, д), 2,0-2,4 (Н, м), 2,57 (3 Н, с),2,77 (3 Н, с), 3,3-3,8 (4 Н, м), 7,67 (Н, с). Пример 2 получения промежуточного соединения. 1,1-Диоксид 4-этил-5,8-диметилтиохроман-6-карбоновой кислоты, используемый в качестве исходного материала в препаративном примере 2, который будет описан позднее, получали в следующих стадиях. Стадия (1) 0,5 мл триэтиламина добавляли к смеси,содержащей 10,0 г (72,5 ммоль) 2,5-диметилтиофенола, 7,32 г (87,0 ммоль) этилвинилкетона и 30 мл дихлорэтана, и смесь перемешивали в течение 1 ч. Смесь разбавляли дихлорметаном,промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и фильтровали и растворитель удаляли при пониженном давлении с получением 16,1 г (выход 100%) (2,5-диметилфе 001810 28 нил)-3-оксопентилсульфида в виде бесцветного прозрачного масла. ЯМР(2 Н, к, J=7 Гц), 2,6-2,9 (2 Н, м), 3,0-3,3 (2 Н, м),6,9-7,2 (3 Н, м). Стадия (2) 1,65 г (43,6 ммоль) боргидрида натрия постепенно добавляли к 16,1 г (72,6 ммоль) (2,5 диметилфенил)-3-оксо-пентилсульфида и 64 мл этанола при 0 С и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь выливали в лед и водный раствор, содержащий 5% соляную кислоту, и экстрагировали дихлорэтаном. Экстракт сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением 16,3 г (2,5 диметилфенил)-3-гидроксипентилсульфида в виде бесцветного прозрачного масла. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 0,59 (3 Н, т), 1,3-1,9 (4 Н, м), 2,31 (6 Н, с),2,9-3,1 (2 Н, м), 3,6-3,9 (Н, м), 6,8-7,2 (3 Н, м). Стадия (3) 4,94 мл (67,8 ммоль) тионилхлорида постепенно добавляли по каплям к смеси, содержащей 10,0 г (45,2 ммоль) (2,5-диметилфенил)3-гидроксипентилсульфида и 30 мл дихлорэтана, и смесь перемешивали при 60 С в течение 2 ч. Реакционную смесь охлаждали при комнатной температуре и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли дихлорметан, смесь промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением 10,9 г (выход 99%)(2,5-диметилфенил)-3-хлорпентилсульфида в виде неочищенного продукта. Это соединение использовали для последующей реакции без какой-либо дополнительной очистки. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 1,03 (3 Н, т), 1,5-2,4 (4 Н, м), 2,32 (6 Н, с),2,8-3,2 (2 Н, м), 3,9-4,2 (Н, м), 6,8-7,2 (3 Н, м). Стадия (4) Смесь 9,40 г (38,7 ммоль) (2,5-диметилфенил)-3-хлорпентилсульфида с дихлорметаном постепенно добавляли по каплям к суспензии, содержащей 5,18 г (38,7 ммоль) хлорида алюминия и 20 мл метиленхлорида, при 0 С и полученную смесь перемешивали при 0 С в течение 2 ч и затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в смесь воды со льдом и экстрагировали метиленхлоридом. Экстракт сушили над безводным сульфатом натрия, фильтровали и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией (силикагель; гексан-гексан/этилацетат =(9,26 ммоль) 4-этил-5,8-диметилтиохромана и дихлорэтан, добавляли по каплям к смешанному раствору, содержащему 1,49 г (11,1 ммоль) хлорида алюминия, 0,82 мл (11,6 ммоль) ацетилхлорида и 6 мл дихлорметана, при 0 С и смесь перемешивали в течение 1,5 ч. Реакционную смесь выливали в лед и раствор, содержащий 5% соляную кислоту, и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором бисульфита натрия, сушили над безводным сульфатом натрия и фильтровали с получением 1,66 г (выход 72%) 6-ацетил-4 этил-5,8-диметилтиохромана. ЯМР(3 Н, м), 7,21(Н, с). Стадия (6) Смешанному раствору, содержащему 1,66 г (6,68 ммоль) 6-ацетил-4-этил-5,8-диметилтиохромана, 2,28 (20,1 ммоль) 30% водного раствора пероксида водорода и 2,0 мл уксусной кислоты, давали реагировать при 80 С в течение 2 ч. Реакционную смесь охлаждали при комнатной температуре, добавляли 2% водный раствор бисульфита натрия и смесь экстрагировали этилацетатом, промывали насыщенным водным раствором бикарбоната натрия, затем насыщенным водным раствором хлорида натрия, фильтровали и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией (силикагель; гексан/ этилацетат = 2:1) с получением 1,03 (выход 55%) 6-ацетил-4-этил-5,8-диметил-тиохроман 1,1-диоксида. ЯМР(2 Н, м), 2,31 (3 Н, с), 2,53 (3 Н, с), 2,75 (3 Н, с),2,9-3,8 (3 Н, с), 7,20 (Н, с). Стадия (7) 13 мл водного раствора гипохлорита натрия добавляли по каплям к смешанному раствору, содержащему 1,03 г (3,67 ммоль) 6 ацетил-4-этил-5,8-диметилтиохроман-1,1 диоксида и 4 мл диоксана, при 0 С и смесь перемешивали при 0 С в течение 1 ч. Далее смесь перемешивали при комнатной температуре в течение ночи. 5 мл 20% водного раствора сульфита натрия добавляли к смеси и смесь промывали дихлорметаном. Водный слой подкисляли(рН 1) концентрированной соляной кислотой,экстрагировали этилацетатом, сушили над без 001810 30 водным сульфатом натрия, фильтровали и растворитель отгоняли при пониженном давлении с получением 0,90 г (выход 87%) 4-этил-5,8 диметилтиохроман-1,1-диоксида. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 1,07(3 Н, т), 1,5-1,8 (2 Н, м), 2,3-2,7 (2 Н, м), 2,49 (3 Н,с), 2,9 (3 Н, с), 3,0-3,9 (3 Н, м), 7,55 (Н, с). Пример 3 получения промежуточного соединения. 5,8-Диметил-3,4-дегидротиохроман-6 карбоновую кислоту, используемую в качестве исходного материала в препаративном примере 3, который будет описан позднее, получали в следующих стадиях. Стадия (1) В колбе в форме баклажана 100 мл растворяли в 30 мл метанола 5,0 г (18,4 ммоль) 6-бром 5,8-диметилтиохроман-4-она в качестве галогенированного производного тиохроман-4-она и добавляли 0,35 г (9,2 ммоль, 0,5 экв.) боргидрида натрия в качестве восстановителя при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч, затем добавляли разбавленную кислоту и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем растворитель отгоняли с получением 0,49 г (выход 95%) 6-бром-5,8-диметилтиохроман-4-ола. ЯМРDean Stark, загружали 4,0 г (16,6 ммоль) 6-бром 5,8-диметилтиохроман-4-ола, полученного в стадии (1), 100 мл бензола и 10 мг (0,06 ммоль,0,0036 экв.) п-толуолсульфокислоты, и смесь нагревали с обратным холодильником в течение 1 ч. После охлаждения реакционную смесь последовательно промывали водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 2,6 г (выход 69%) 6-бром-5,8 диметил-3,4-дегидротиохромана. ЯМР 31 Стадия (3) Трехгорлую колбу на 200 мл загружали 50 мл ТГФ и 0,56 г (23 ммоль, 1,2 экв.) магния и смесь активировали добавлением 2 кусочков иода и 5 капель этилбромида. Затем добавляли по каплям раствор 4,88 г (19 ммоль) 6-бром-5,8 диметил-3,4-дегидротиохромана, полученного в стадии (2) , в 5 мл ТГФ и смесь нагревали с обратным холодильником в течение 4 ч. Реакционной смеси давали остыть до комнатной температуры и затем барботировали ее газообразным диоксидом углерода в течение 2 ч. Реакцию останавливали добавлением по каплям 5% соляной кислоты и реакционную смесь экстрагировали этилацетатом. Полученный органический слой экстрагировали водным раствором карбоната калия, водный слой промывали этилацетатом, нейтрализовали добавлением 5% соляной кислоты и экстрагировали этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 1,9 г (выход 46%) 5,8-диметил-3,4-дегидротиохроман-6-карбоновой кислоты. ЯМР(м.д.,растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 2,32 (3 Н, с), 2,60 (3 Н, с), 3,33 (2 Н, дд),5,9-6,1 (Н, м), 6,8 (Н, д), 7,67 (Н, с). ИК таблетка КВr, см-1) 3300-2600, 1680. Пример 4 получения промежуточного соединения. 1,1-Диоксид 5-метил-3,4-дегидротиохроман-6-карбоновой кислоты, используемый в качестве исходного материала в препаративном примере 4, который будет описан позднее, получали в следующих стадиях. Стадия (1) 80 мл (100 г, 621 ммоль) 3,4 дихлортолуола в качестве галогензамещенного производного бензола добавляли к раствору 100 г (750 ммоль, 1,21 экв.) хлорида алюминия в 32 качестве кислотного катализатора в 250 мл 1,2 дихлорэтана и затем добавляли по каплям при комнатной температуре 55 мл (774 ммоль, 1,25 экв.) ацетилхлорида в качестве ацетилирующего агента. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем перемешивали при 70-75 С в течение 5 ч. После охлаждения реакционную смесь постепенно добавляли к 300 мл смеси воды со льдом и разделяли на два слоя. Полученный органический слой концентрировали. Полученный водный слой экстрагировали этилацетатом с получением органического слоя и этот органический слой добавляли к полученному выше концентрированному органическому слою. Смесь органических слоев промывали 5% соляной кислотой один раз, водным раствором карбоната натрия два раза и насыщенным водным раствором хлорида натрия один раз и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 125,1 г(3 Н, с), 2,58 (3 Н, с), 7,50 (Н, с), 7,97 (Н, с). Стадия (2) 1,350 мл (1,96 моль, 3 экв.) 12,9% гипохлорита натрия в качестве окислителя разбавляли 400 мл воды и охлаждали до 8 С на льду. К этой смеси добавляли по каплям раствор 132,3 г (652 ммоль) 3,4-дихлор-6-метилацетофенона, полученного в стадии (1), в 130 мл диоксана при 10 С или более низкой температуре и затем добавляли еще 130 мл диоксана. Затем баню со льдом удаляли, и смесь перемешивали при комнатной температуре. После того, как температура внутри реакционной системы достигала 15 С,реакционную смесь опять перемешивали при охлаждении льдом в течение 1 ч. Затем ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3,0 ч. Затем добавляли 50 мл водного раствора, содержащего 10,0 г (79 ммоль) сульфита натрия. Реакционную смесь промывали дважды метиленхлоридом и затем добавляли 170 мл концентрированной соляной кислоты с охлаждением на льду. Смесь экстрагировали 3 раза этилацетатом и затем полученный органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 119,3 г (выход 83%) 3,4-дихлор-6 метилбензойной кислоты в виде неочищенного продукта. ЯМР (м.д., растворитель: ацетон d-6, внутренний стандарт: тетраметилсилан): 2,59 (3 Н, с),7,52 (Н, с), 8,04 (Н, с). Стадия (3) 92,1 г (421 ммоль) 3,4-дихлор-6-метилбензойной кислоты, полученной в стадии (2) растворяли в 550 мл этанола в качестве как этери 33 фицирующего агента, так и растворителя, добавляли 20 мл концентрированной серной кислоты в качестве кислотного катализатора и смесь нагревали с обратным холодильником в течение 7 ч. Этанол отгоняли при пониженном давлении, добавляли ледяную воду и смесь экстрагировали этилацетатом два раза. Полученный органический слой последовательно промывали водным раствором карбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 103,4 г (выход 97%) этил 2,4 дихлор-6-метилбензоата в виде неочищенного продукта. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 1,39(Н, с). Стадия (4) 23,4 мл (268 ммоль, 1,1 экв.) 3 меркаптопропионовой кислоты добавляли к 215 мл раствора 53,7 г (231 ммоль) этил 3,4-дихлор 6-метилбензоата, полученного в стадии (3), и 37,9 г (268 ммоль, 1,1 экв.) карбоната калия вN,N-диметилформамиде (ДМФ) при комнатной температуре и затем смесь перемешивали при нагревании при 120-125 С в течение 20 мин. Реакционную смесь охлаждали до приблизительно 50 С, добавляли этилацетат и воду и для удаления ДМФ и нейтральных компонентов реакционную смесь промывали этилацететом 4 раза и один раз гексаном. К полученному водному слою добавляли концентрированную соляную кислоту для осаждения кристаллов, смеси давали стоять в течение некоторого времени,кристаллы извлекали фильтрованием и промывали три раза водой. Полученные таким образом кристаллы растворяли в этилацетате, полученный органический слой промывали насыщенным водным раствором NaCl и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 50,4 г (выход 60%) 3-(2-хлор-4-этоксикарбонил 5-метилфенилтио)пропионовой кислоты в виде неочищенного продукта. ЯМР (м.д.,растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 1,38(3 Н, т), 2,58 (3 Н, т), 2,79 (2 Н, т), 3,35 (2 Н, т),7,33 (Н, с), 7,87 (Н, с). Стадия (5) 167 г полифосфорной кислоты в качестве кислотного катализатора нагревали до 80-85 С и к ней добавляли на протяжении 5 мин 47,7 г(157 ммоль) 3-(2-хлор-4-этокси-карбонил-5 метилфенилтио)пропионовой кислоты, полученной в стадии (4). Затем смесь перемешивали при нагревании в течение 1 ч и 20 мин. Реакционной смеси давали остыть до комнатной температуры и затем добавляли ее медленно к смеси, содержащей 191 г (1,80 моль) карбоната натрия и лед, и смесь перемешивали при комнат 001810 34 ной температуре, пока карбонат натрия не растворялся почти полностью. Реакционную смесь экстрагировали этилацетатом дважды и полученный органический слой промывали насыщенным водным раствором хлорида натрия один раз и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 41,3 г (выход 85%) 8 хлор-6-этоксикарбонил-5-метилтиохроман 4 она в виде неочищенного продукта. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 1,38(3 Н, т), 2,58 (3 Н, с), 2,9-3,1 (2 Н, м), 3,3-3,5 (2 Н,м), 4,34 (2 Н, к), 7,81 (Н, с). Стадия (6) 88,4 г (311 ммоль) 8-хлор-6-этоксикарбонил-5-метил-тиохроман-4-она, полученного в стадии (5), растворяли в 200 мл этанола и затем растворяли в 200 мл дихлорметана. Этот раствор охлаждали до 5-10 С и добавляли 5,9 г (155 ммоль) боргидрида натрия. Реакционную смесь перемешивали при указанной температуре в течение 30 мин и затем перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь выливали в 400 мл 5% водный раствор соляной кислоты и экстрагировали 900 мл дихлорметана. Затем полученный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 86,8 г (выход 97%) 8-хлор-6 этоксикарбонил-5-метилтиохроман-4-ола. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 1,35(3 Н, т), 1,6-3,7 (5 Н, м), 2,62 (3 Н, с), 4,1-4,8 (Н,шир.с), 4,32 (2 Н, к), 5,13 (Н, м), 7,71 (Н, с). Стадия (7) 25,8 г (90,0 ммоль) 8-хлор-6-этоксикарбонил-5-метил-тиохроман-4-ола, полученного в стадии (6), растворяли в 70 мл уксусной кислоты, добавляли 46,0 мл (0,45 моль, 5,0 экв.) 30% водного раствора пероксида водорода и смесь перемешивали при нагревании при 80 С в течение 4 ч. Реакционной смеси давали остыть и полученный твердый материал извлекали фильтрованием, промывали 200 мл воды и сушили при пониженном давлении с получением 21,9 г (выход 95%) 8-хлор-6-этоксикарбонил-4 гидрокси-5-метилтиохроман-1,1-диоксида. ЯМР (м.д., растворитель: дейтерохлороформ, внутренний стандарт: тетраметилсилан): 1,40 (3 Н, т), 2,59 (3 Н, с), 2,5-4,2 (4 Н, м), 4,40(2 Н, к), 5,09 (Н, шир. с), 7,67 (Н, с). Стадия (8) 10,0 г (31,3 ммоль) 8-хлор-6-этоксикарбонил-4-гидрокси-5-метилтиохроман-1,1 диоксид, полученный в стадии (7), растворяли в 30 мл этанола и добавляли 50 мл 16% водного раствора гидроксида калия и 6,1 г (93,3 ммоль,3,0 экв.) порошка цинка. Смесь перемешивали при нагревании при 50 С в течение 3 ч. После завершения реакции порошок цинка отфильтро 35 вывали. При охлаждении реакционной смеси добавляли 2 н. водный раствор соляной кислоты до рН смеси 1. Затем смесь экстрагировали дважды этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и растворитель отгоняли с получением 11,5 г (выход 100%) 1,1-диоксида 4-гидрокси-5 метилтиохроман-6-карбоновой кислоты. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 2,5-2,8(2 Н, м), 2,69 (3 Н, с), 3,1-4,1 (2 Н, м), 5,22 (Н, т),7,75 (Н, д), 7,94 (Н, д). Т.пл. 172-173 С Стадия (9) 3,0 г (11,8 ммоль) 1,1-диоксида 4 гидрокси-5-метилтио-хроман-6-карбоновой кислоты, полученного в стадии (8), растворяли в 10 мл толуола, добавляли 0,1 мл концентрированной серной кислоты и смесь перемешивали с нагреванием при 70 С в течение 5 ч. После завершения реакции во время охлаждения реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия до рН смеси 10. Затем примеси экстрагировали этилацетатом. К водному слою на бане со льдом добавляли 5% соляную кислоту до рН 1. Смесь экстрагировали дважды этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Затем растворитель отгоняли с получением 2,5 г (выход 89%) 1,1-диоксида 5-метил 3,4-дегидротиохроман-6-карбоновой кислоты. ЯМР (м.д., растворитель: дейтеро-ацетон,внутренний стандарт: тетраметилсилан): 2,62(3 Н, с), 4,10 (2 Н, м), 6,45 (Н, ддд), 7,20 (Н, д),7,83 (Н, д), 7,95 (Н, д). Т.пл. 183-186 С Далее будут объяснены примеры получения нового производного пиразола для достижения первой цели данного изобретения. Препаративный пример 1. Колбу в форме баклажана на 50 мл загружали 0,76 г (2,8 ммоль) 1,1-диоксида 4,5,8 триметилтиохроман-6-карбоновой кислоты, 0,35 г (2,1 ммоль, 1,1 экв.) 1-этил-5-гидроксипиразола и 5 мл трет-амилового спирта и добавляли раствор 0,70 г (3,4 ммоль, 1,2 экв.) N,N'дициклогексил-карбодиимида (ДЦК) в 5 мл трет-амилового спирта при комнатной температуре. Смеси давали реагировать при комнатной температуре в течение 2 ч, затем добавляли 0,58 г (2,8 ммоль, 1,5 экв.) карбоната калия и смеси давали реагировать при 100 С в течение 6 ч. Растворитель отгоняли, остаток распределяли в 30 мл воды и 30 мл этилацетата. ДЦК-мочевину в качестве нерастворимого материала отделяли фильтрованием. Органический слой экстрагировали дважды 10 мл. 5% водного раствора карбоната калия. Водные слои объединяли и подкисляли концентрированной соляной кислотой и 36 после экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия с получением 0,77 г неочищенного продукта. Неочищенный продукт перекристаллизовывали из этанола с получением 0,52 г(выход 51%) 4,5, 8-триметил-6-(1-этил-5 гидроксипиразол-4-ил)карбонилтио-хроман-1,1 диоксида (Соединения 302). Препаративный пример 2. 0,9 г (3,2 ммоль) 1,1-диоксида 4-этил-5,8 диметил-тиохроман-6-карбоновой кислоты, полученного в примере 2 получения промежуточного соединения, 0,43 г (3,8 ммоль) 1-этил-5 гидроксипиразола и 0,79 г (3,8 ммоль) ДЦК добавляли к 5 мл трет-амилового спирта и смеси давали реагировать при комнатной температуре в течение 2,5 ч. После этого добавляли 0,31 г(2,2 ммоль) карбоната калия и смеси давали реагировать при 80 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель отгоняли при пониженном давлении. К остатку для его растворения добавляли 2% водный раствор карбоната натрия и нерастворимый материал отфильтровывали. Полученный водный раствор промывали этилацетатом и добавляли 12 н. соляную кислоту таким образом, чтобы смесь имела рН 1. Полученное маслянистое вещество экстрагировали этилацетатом. Этилацетатный слой отделяли, промывали насыщенным водным раствором хлорида натрия и растворитель отгоняли при пониженном давлении с получением 1,2 г (выход 100%) 4-этил-5,8-диметил-6-(1-этил-5-гидроксипиразол-4-ил)карбонилтиохроман-1,1-диоксида (Соединения 301). Препаративный пример 3.(Стадия 1) Колбу в форме баклажана на 100 мл загружали 0,96 г (4,4 ммоль) 5,8-диметил-3,4 дегидротиохроман-6-карбоновой кислоты, полученной в примере 3 получения промежуточного соединения, 0,54 г (4,8 ммоль, 1,1 экв.) 1 этил-5-гидроксипиразола и 10 мл дихлорметана и добавляли 1,08 г (5,2 ммоль, 1,2 экв.) ДЦК в качестве дегидратирующего агента. Смеси давали реагировать при комнатной температуре в течение 2 ч. Нерастворимую ДЦК-мочевину отфильтровывали, фильтрат концентрировали и затем очищали колоночной хроматографией на силикагеле (проявляющий растворитель: этилацетат:гексан, смесь 1:1). К 0,81 г (2,6 ммоль) эфирного промежуточного соединения, полученного в результате очистки, добавляли 0,53 г(3,9 ммоль, 1,5 экв.) карбоната натрия в качестве основания и 2,0 мл 1,4-диоксана и смеси давали реагировать далее при 120 С в течение 2 ч. После завершения реакции растворитель отгоняли и остаток разделяли на слои добавлением 50 мл этилацетата и 50 мл воды. Полученный водный слой нейтрализовали 5% соляной кислотой и затем экстрагировали 37 этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,63 г (выход 57%) 5,8-диметил-6-(1-этил 5-гидроксипиразол-4-ил)карбонил-3,4-дегидротиохромана (соединения 289).(Стадия 2) Колбу в форме баклажана на 30 мл загружали 75 мг (0,24 ммоль) 5,8-диметил-6-(1-этил 5-гидроксипиразол-4-ил)карбонил-3,4-дегидротиохромана, полученного в стадии (1), 7 мг оксида платины и 3 мл этанола и смесь подвергали гидрированию при комнатной температуре при атмосферном давлении. После проведения реакции в течение 8 ч оксид платины отфильтровывали и этанол отгоняли с получением 67 мг (выход 88%) 5,8-диметил-6-(1-этил-5-гидроксипиразол-4-илтиохромана (Соединения 290). Выход после стадий (1) и (2) был 50%. Препаративный пример 4. 5-Метил-6-(1-этил-5-гидроксипиразол-4 ил)карбонилтиохроман -1,1-диоксид (Соединение 303) получали по существу так же, как в препаративном примере 3, за исключением того,что вместо 5,8-диметил-3,4-дегидротиохроман 6-карбоновой кислоты использовали 1,1 диоксид-5-метил-3,4-дегидротиохроман-6 карбоновой кислоты, полученный в примере 10 получения промежуточного соединения. Препаратный пример 5. Колбу в форме баклажана на 30 мл загружали 0,25 г (0,69 ммоль) 4,5,8-триметил-6-(1 этил-5-гидроксипиразол-4-ил)карбонилтиохроман-1,1-диоксида, 5 мл дихлорметана, 5 мл воды и 0,09 г (0,69 ммоль, 1 экв.) карбоната калия и добавляли по каплям 0,11 г (0,76 ммоль, 1,1 экв.) н-пропансульфонилхлорида с перемешиванием при комнатной температуре. Добавляли 5 мг хлорида бензилтриэтиламмония (ВТЕАС) и смеси давали реагировать при вышеуказанной температуре в течение 2 ч и затем разделяли на два слоя. Водный слой экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,35 г неочищенного продукта, который перекристаллизовывали из этанола с получением 0,31 г (выход 95%) 4,5,8-триметил-6-(1-этил-5-н-пропансульфонилоксипиразол-4-ил)карбонилтиохроман 1,1-диоксида (соединения 304). Препаративный пример 6. Колбу в форме баклажана на 30 мл загружали 0,18 г (0,50 ммоль) 4,5,8-триметил-6-(1 этил-5-гидроксипиразол-4-ил)карбонилтиохроман-1,1-диоксид а, 5 мл дихлорметана, 5 мл воды и 0,07 г (0,50 ммоль, 1 экв.) карбоната натрия и добавляли по каплям раствор 0,10 г (0,55 ммоль, 1,1 экв.) п-толуолсульфонилхлорида в 1 мл дихлорметана с перемешиванием при комнатной температуре. Добавляли 5 мг хлорида 38 бензилтриэтиламмония (ВТЕАС) и смеси давали реагировать при вышеуказанной температуре в течение 2 ч и затем разделяли на слои. Водный слой экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,30 г неочищенного продукта, который затем перекристаллизовывали из этанола с получением 0,20 г (выход 77%) 4,5,8-триметил-6-(1-этил-5-п-толуолсульфонилоксипиразол-4-ил)карбонилтиохроман 1,1-диоксида (соединения 305). Препаративный пример 7. Колбу в форме баклажана на 30 мл загружали 0,30 г (0,86 ммоль) 5-метил-6-(1-этил-5 гидроксипиразол-4-ил)карбонил-тиохроман-1,1 диоксида, 25 мл дихлорметана, 5 мл воды и 0,14 г (0,86 ммоль, 1 экв.) карбоната калия. При перемешивании этой смеси при комнатной температуре добавляли по каплям 0,14 г (0,95 ммоль,1,1 экв.) н-пропансульфонилхлорида. Добавляли 5 мг хлорида триэтиламмония ВТЕАС), смеси давали реагировать при вышеуказанной температуре в течение 2 ч и затем разделяли на слои. Водный слой экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,2 г неочищенного продукта, который затем перекристаллизовывали из этанола с получением 0,18 г (выход 48%) 5 метил-6-(1-этил-5-н-пропансульфонилоксипиразол-4-ил)карбонилтиохроман-1,1-диоксида (соединения 309). Препаративный пример 8. 5 мл дихлорметана, 5 мл воды и 0,10 г(0,72 ммоль, 1 экв.) карбоната калия добавляли к 0,26 г (0,75 ммоль) 5-метил-6-(1-этил-5 гидроксипиразол-4-ил)карбонилтиохроман-1,1 диоксида в колбе типа баклажана на 30 мл. При перемешивании смеси при комнатной температуре добавляли по каплям раствор 0,16 г (0,82 ммоль, 1,1 экв.) п-толуолсульфонилхлорида в 1 мл дихлорметана. Добавляли 5 мг хлорида триэтиламмония (ВТЕАС), смеси давали реагировать при вышеуказанной температуре в течение 2 ч и затем разделяли на слои. Водный слой экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,24 г неочищенного продукта, который затем перекристаллизовывали из этанола с получением 0,14 г (выход 92%) 5-метил-6-(1 этил-п-толуолсульфонилоксипиразол-4-ил)карбонилтиохроман-1,1-диоксида (соединения 310). Препаративный пример 9. Колбу в форме баклажана на 30 мл загружали 0,24 г (0,69 ммоль) 5-метил-6-(1-этил-5 гидроксипиразол-4-ил)карбонилтиохроман-1,1 39 диоксид, полученный в препаративном примере 4, 5 мл дихлорметана и 0,07 г (0,89 ммоль, 1,3 экв.) пиридина. При перемешивании смеси с охлаждением на льду добавляли по каплям 0,11 г (0,76 ммоль, 1,1 экв.) хлорангидрида циклогексанкарбоновой кислоты. Смесь перемешивали при охлаждении льдом в течение 30 мин и затем ей давали реагировать при комнатной температуре в течение 2 ч. Реакцию останавливали добавлением 5 мл воды и затем водный слой экстрагировали дихлорметаном. Органический слой промывали 5% соляной кислотой, 5% водным раствором карбоната калия и затем насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли с получением 0,35 г неочищенного продукта, который затем перекристаллизовывали из этанола с получением 5-метил-6(1-этил-5-циклогексилкарбонилоксипиразол-4 ил)карбонилтиохроман-1,1-диоксида (Соединение 311). Табл. 2 иллюстрирует структурные формулы исходных материалов или реагентов, используемых в препаративных примерах 1-9 и структуру Соединений, полученных в этих примерах вместе с их выходами, а табл. 3 показывает физические свойства соединений, полученный в препаративных примерах 1-9.Toho Chemical Co., Ltd.) однородно измельчали и смешивали для приготовления носителя для смачивающегося порошка. 90 мас.ч. указанного выше носителя и 10 мас.ч. одного из соединений данного изобретения, полученных в приведенных выше примерах получения, однородно измельчали и смешивали с получением гербицида. В сравнительных примерах гербицидов 1 и 3 гербициды готовили подобным образом с использованием 10 мас.ч. следующего соединения (х), а в сравнительных примерах гербицидов 2 и 4 гербициды готовили подобным образом с использованием 10 вес.ч. следующего соединения (у). Соединение (х): имеющийся на рынке Пиразолат Далее будут описаны примеры гербицида,который воплощает достижение второй цели данного изобретения.(2) Биологический тест (Тест обработки листьев, примеры гербицидов 1-5 и сравнительные примеры гербицидов 1 и 2) Семена сорняков, таких как просо африканское, куриное просо, щетинник зеленый,дурнишник, лимнохарис и щирица гибридная, и семена кукурузы, пшеницы и ячменя высевали в сосудах Вагнера на 1/5000 ар, наполненных суходольной почвой, и закрывали слоем суходольной почвы. Семена проращивали в теплице и на стадии 1-2 листа этих растений заранее определенное количество гербицида, приготовленного,как описано выше в (1), суспендировали в воде и равномерно разбрызгивали на листовые и стеблевые части при отношении 200 л/10 ар. После этого растения выращивали в теплице и на 20-й день после обработки гербицид оценивали на гербицидную активность. Эти результаты показаны в табл. 4. Гербицидная эффективность и фитотоксичность в отношении сельскохозяйственных культур показаны на основе следующих оценок. Отношение веса оставшихся растений к необработанным определяли на основе уравнения: отношение веса оставшихся растений к необработанным = (вес оставшихся растений в обработанной делянке/вес оставшихся растений в необработанной делянке) х 100. Это уравнение приложимо также к последующим биологическим тестам.(Оценки) Гербицидная Отношение веса оставшихся эффективность растений к необработанным 2 41-60 3 21-40 4 1-20 5 0 Фитотоксичность в Отношение веса осотношении сельскохо- тавшихся растений к зяйственных культур необработанным Гербицидная эффективность просо афр. 0 5 лимноха- щирица кукуруза пшеница ячмень рис гибридная 4 0 5 5 сано выше в (1), суспендировали в воде и равномерно разбрызгивали на поверхность почвы. После этого растения выращивали в теплице и на 20 й день после обработки гербициды оценивали на гербицидную эффективность. Эти результаты показаны в табл. 5. Гербицидная эффективность и фитотоксичность в отношении сельскохозяйственных культур представлена на основе оценок, описанных в тесте обработки листьев (2).(3) Биологический тест (Тест обработки суходольной почвы, примеры гербицидов 6-10 и сравнительные примеры гербицидов 3 и 4). Семена сорняков, таких как африканское просо, куриное просо, дурнишник, лимнохарис и щирица гибридная, и семена кукурузы, пшеницы и ячменя высевали в сосудах Вагнера на 1/5000 ар,наполненных суходольной почвой, и покрывали суходольной почвой. Затем заранее определенное количество гербицида, приготовленного, как опи примера гербицида Гербицидная эффективность просо афр. 0 1 щетинник дурнишзеленый ник 0 0 4 0(4) Биологический тест (Тест обработки суходольной почвы, примеры гербицидов 11-21 и сравнительный пример гербицидов 5). Семена сорняков, таких как африканское просо, куриное просо, щетинник зеленый, дур лимноха- щирица кукуруза рис гибридная 0 5 5 5 нишник, лимнохарис и щирица гибридная, и семена кукурузы высевали в сосуды Вагнера на 1/5000 ар, наполненные суходольной почвой и закрывали слоем суходольной почвы. Затем заранее определенное количество гербицида, при 45 фективность и фитотоксичность в отношении кукурузы. Эти результаты показаны в табл. 6. Гербицидную эффективность и фитотоксичность в отношении сельскохозяйственных культур оценивали на основе оценок, описанных в тесте обработки листьев (2). готовленного, как описано выше в (1), суспендировали в воде и равномерно разбрызгивали на поверхность почвы. После этого растения выращивали в теплице и на 20-й день после обработки гербицид оценивали на гербицидную эфпримера гербицида Гербицидная эффективность просо ку- щетинник лимнохадурнишник риное зеленый рис 5 5 2 1 5 1 1 5 5 5 5 5 5 5 5 5 5 4 0 5 3 3 1 5 0 Как объяснено в деталях выше, данное изобретение обеспечивает новое производное пиразола, которое может избирательно защищать одновременно от травянистых сорняков и от широколистных сорняков при низкой дозе при помощи любой из обработок, таких как обработка листьев и обработка почвы, без индуцирования фитотоксичности в отношении ценных сельскохозяйственных культур, таких как кукуруза, пшеница и ячмень, и обеспечивает гербицид, содержащий новое производное пиразола в качестве активного ингредиента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные тиохроманпиразола общей формулыR1 обозначает атом водорода или С 1-С 4 алкильную группу;R2 обозначает С 1-С 4-алкильную группу; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу;L обозначает группу формулы -СН- или-СН 2-, необязательно замещенную атомом галогена или С 1-С 4-алкилом;представляет необязательную двойную связь;Q обозначает атом водорода или группуk равно 0 или 1; при условии, что если L представляет группу формулы -СН-, незамещенную или замещенную атомом галогена или С 1-С 4 алкилом,топредставляет двойную связь и k=0; и если L означает группу формулы -СH2-,незамещенную или замещенную атомом галогена или С 1-С 4-алкилом, тоозначает одинарную связь, k=1 и X5 и X7, кроме определений,указанных для них выше, могут объединяться с образованием ненасыщенной связи. 2. Производное пиразола по п.1, представленное формулой (1-В) где R1 обозначает атом водорода или С 1-С 4 алкильную группу;L представляет группу формулы -СН, необязательно замещенную атомом галогена и С 1 С 4-алкильной группой; каждый из Х 1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу;Q обозначает атом водорода или группу(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С 1-С 4-алкильной и С 1-С 4 группы,С 1-С 4-алкоксигруппы галогеналкильной группы, и m - целое число 0,1 или 2)]; иn = 0, 1 или 2,или его соль. 3. Производное пиразола формулы (1-В) или его соль по п.2, где n=0. 4. Производное пиразола формулы (1-В) или его соль по п.2, где каждый из Х 1 и X4 независимо обозначает С 1-С 4-алкильную группу. 5. Производное пиразола по п.1 формулы или его соль,где R1 обозначает атом водорода или С 1 С 4-алкильную группу;R2 обозначает С 1-С 4-алкильную группу; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу; или Х 5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;Q обозначает атом водорода или группу(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С 1-С 4-алкильной группы,С 1-С 4-алкоксигруппы и С 1-С 4 галогеналкильной группы, и m - целое число 0,1 или 2)]; иn=0, 1 или 2,или его соль. 6. Производное пиразола формулы (1-С) или его соль по п.5, где Х 1 обозначает С 1-С 4 алкильную группу и X4 обозначает С 1-С 4 алкильную группу. 7. Производное пиразола формулы (1-С) или его соль по п.5, где n=0 или 2. 48 8. Производное пиразола по п.1 формулы где R1 обозначает атом водорода или С 1-С 4 алкильную группу;L обозначает группу формулы -СН 2-, замещенную атомом галогена или С 1-С 4 алкильной группой; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;Q обозначает атом водорода или группу(в которой Y выбирают из группы, состоящей из атома галогена, нитрогруппы, С 1-С 4-алкильной группы, С 1-С 4-алкоксигруппы и С 1-С 4-галогеналкильной группы, и m - целое число 0, 1 или 2)]; иn=0, 1 или 2,или его соль. 9. Производное пиразола формулы (1-D) или его соль по п.8, где каждый из X1 и X4 независимо обозначает С 1-С 4-алкильную группу. 10. Производное пиразола формулы (1-D) или его соль по п.8, где L обозначает группу формулы -СH2-, замещенную С 1-С 4-алкильной группой. 11. Производное пиразола формулы (1-D) или его соль по п.10, где L обозначает группу формулы -СН 2-, замещенную метилом или этилом. 12. Производное ароматической карбоновой кислоты формулы (II) или его соль,где L представляет группу формулы -СНили -СН 2-, необязательно замещенную атомом галогена или С 1-С 4-алкильной группой;представляет необязательную двойную связь; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу;n=0, 1 или 2,k=0 или 1; при условии, что если L означает группу формулы -СН-, незамещенную или замещенную атомом галогена или С 1-С 4 алкильной группой,тоозначает двойную связь и k=0; и если L означает группу формулы -СН 2-,незамещенную или замещенную атомом галогена или С 1-С 4-алкильной группой, тоозначает одинарную связь, k=1 и X5 и 7X , кроме определений, указанных для них выше, могут объединяться с образованием ненасыщенной связи. 13. Производное ароматической карбоновой кислоты по п.12 формулы (II-В) где L означает группу формулы -СН-, необязательно замещенную атомом галогена или С 1-С 4 алкильной группой; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу; иn=0, 1 или 2,или его соль. 14. Производное ароматической карбоновой кислоты по п.12 формулы (II-C) 50 где L означает группу формулы -CH2-; каждый из Х 1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом; иn=0, 1 или 2,или его соль. 15. Производное ароматической карбоновой кислоты по п.12 формулы (II-D) где L означает группу формулы -СН 2-, замещенную атомом галогена или С 1-С 4 алкильной группой; каждый из X1 и X4 независимо выбирают из группы, состоящей из атома водорода, атома галогена и С 1-С 4-алкильной группы; каждый из X5, X6, X7 и X8 независимо обозначает атом водорода или С 1-С 4-алкильную группу; или X5 и X7 могут образовывать ненасыщенную связь благодаря соединению друг с другом;n=0, 1 или 2,или его соль. 16. Гербицидная композиция, включающая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество производного пиразола или его соли по любому из пп.1-11. Евразийский патент действует на территории всех Договаривающихся государств,кроме AM и MD.
МПК / Метки
МПК: A01N 43/56, C07D 409/06
Метки: производные, тиохроманпиразолов, основе, гербицидная, композиция
Код ссылки
<a href="https://eas.patents.su/26-1810-proizvodnye-tiohromanpirazolov-i-gerbicidnaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиохроманпиразолов и гербицидная композиция на их основе</a>
Предыдущий патент: Гемисульфат карбоциклического нуклеозида и его применение при лечении вирусных инфекций
Следующий патент: Способ упрочнения коллагеновых оболочек
Случайный патент: Устройство и способ переноса заряда












