Кристаллическая форма (2s)-(-)-n-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамида
Формула / Реферат
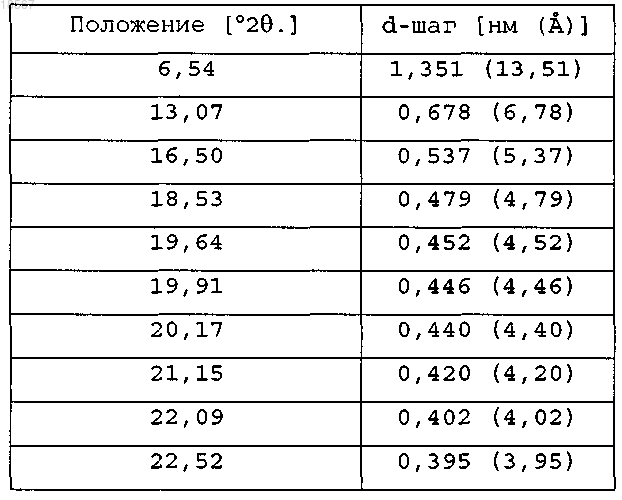
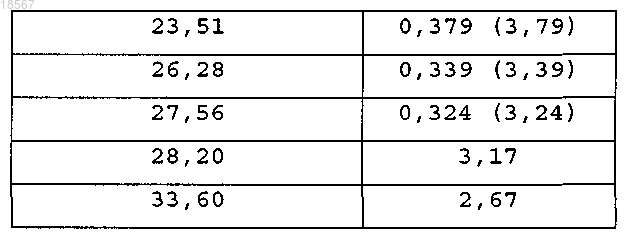
1. Кристаллическая форма (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамида формулы (IS)
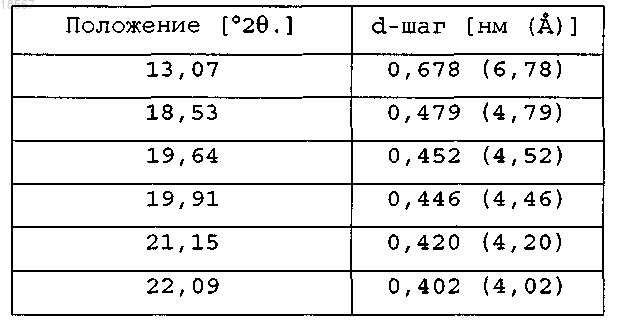
содержащая следующие пики, полученные дифракцией рентгеновских лучей на порошке:
и характеризующаяся температурой начала плавления 100,4°C и/или теплотой плавления 96,2 Дж/г.
2. Кристаллическая форма по п.1, содержащая следующие пики, полученные дифракцией рентгеновских лучей на порошке:
3. Фармацевтическая композиция для лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, боли и злоупотреблением психоактивными веществами, или для нейропротекции, содержащая кристаллическую форму по п.1 и фармацевтически приемлемый носитель.
4. Способ получения фармацевтической композиции, включающий смешивание кристаллической формы по п.1 и фармацевтически приемлемого носителя.
5. Способ лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, боли и злоупотреблением психоактивными веществами, или способ нейропротекции, заключающийся во введении субъекту, нуждающемуся в лечении, терапевтически эффективного количества кристаллической формы по п.1.
6. Способ по п.5, в котором расстройство выбрано из группы, состоящей из депрессии, эпилепсии и сопутствующих расстройств, и расстройств, связанных с нарушением метаболизма глюкозы.
7. Способ лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, боли, злоупотреблением психоактивными веществами, или способ нейропротекции, заключающийся во введении субъекту, нуждающемуся в лечении, терапевтически эффективного количества композиции по п.3.
8. Способ по п.7, в котором расстройство выбрано из группы, состоящей из депрессии, эпилепсии и сопутствующих расстройств, и расстройств, связанных с нарушением метаболизма глюкозы.
9. Применение кристаллической формы по п.1 для получения лекарственного средства для лечения (а) тревожного состояния и сопутствующих расстройств; (b) биполярной депрессии; (с) мании; (d) депрессии; (е) эпилепсии и сопутствующих расстройств; (f) эпилептогенеза; (g) расстройств, связанных с нарушением метаболизма глюкозы; (h) расстройств, связанных с нарушением метаболизма липидов; (i) мигрени; (j) ожирения; (k) болей; (l) злоупотребления психоактивными веществами; или для получения нейропротекторного средства для лечения субъектов, нуждающихся в лечении.
Текст
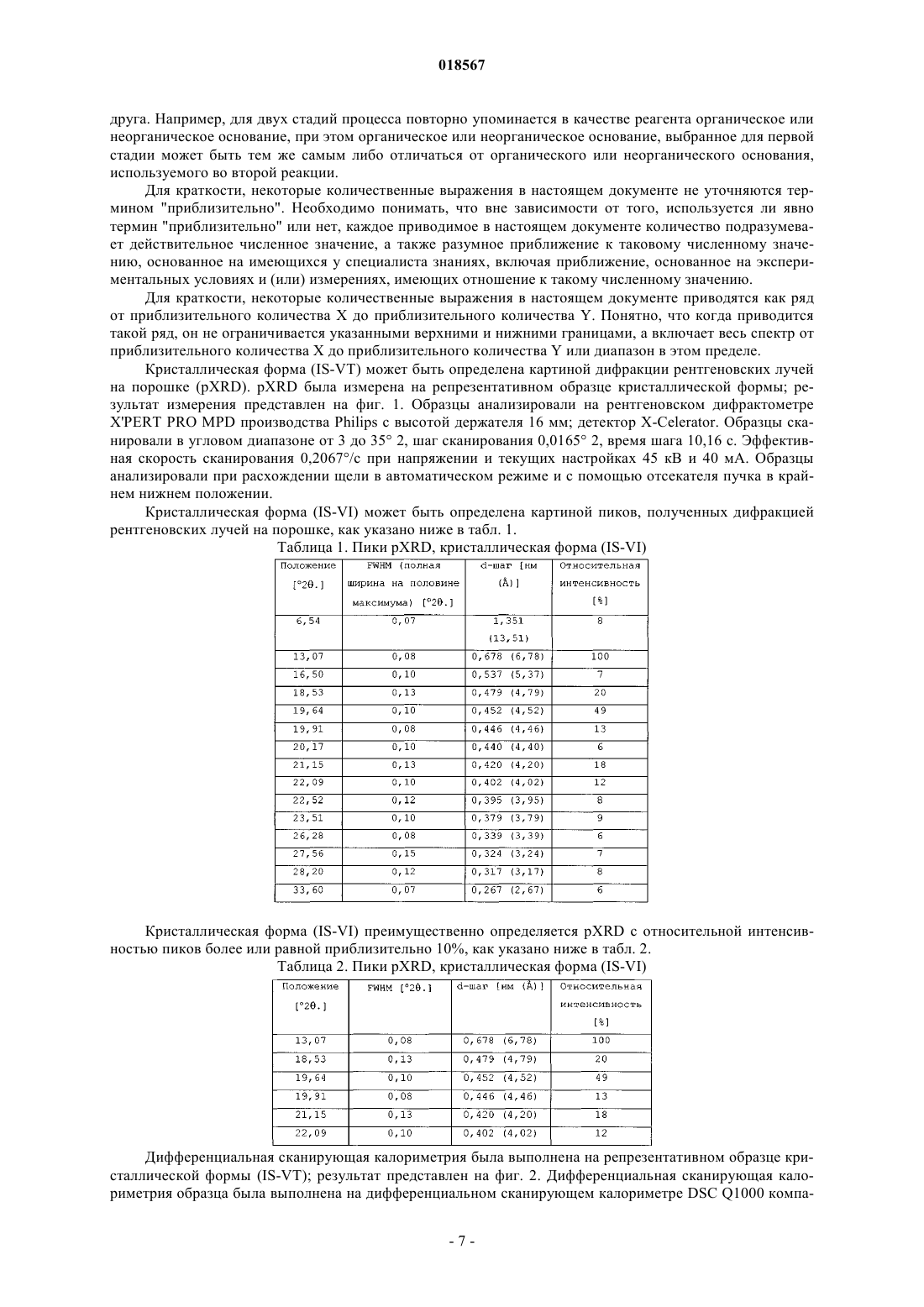
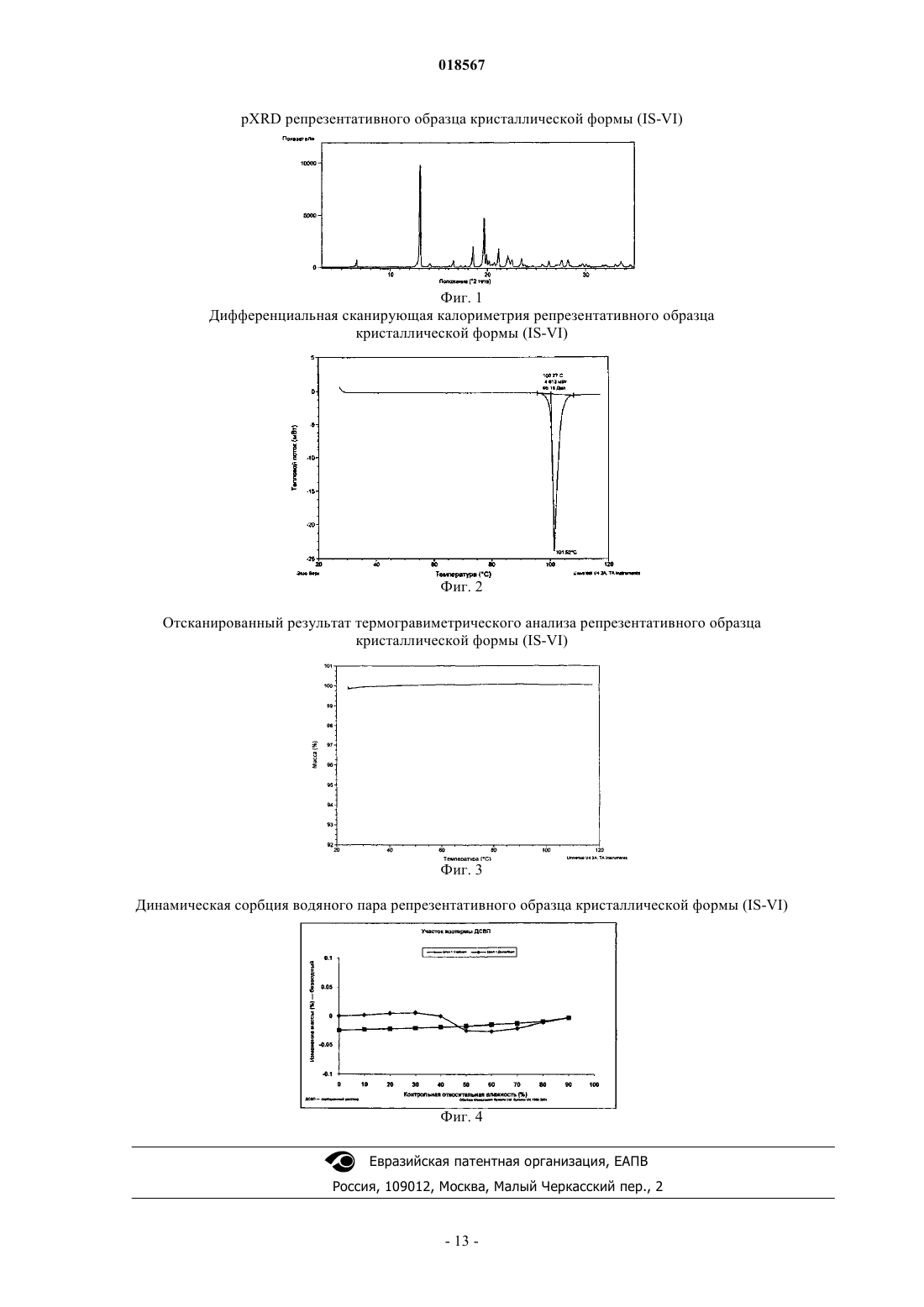
(2S)-(-)-N-(6-хлор-2,3 дигидробензо[1,4]диоксин-2-илметил)сульфамида, фармацевтическим композициям, содержащим указанную кристаллическую форму, а также к использованию указанной кристаллической формы для лечения тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании,депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов,мигрени, ожирения, болей, злоупотребления психоактивными веществами, а также в качестве нейропротекторного средства. Настоящее изобретение также относится к созданию процесса получения новой кристаллической формы.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Изобретение относится к новой кристаллической форме (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамида, фармацевтическим композициям, содержащим указанную кристаллическую форму, а также к использованию указанной кристаллической формы для лечения тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы,расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, болей, злоупотребления психоактивными веществами, а также в качестве нейропротекторного средства. Настоящее изобретение также относится к созданию процесса получения новой кристаллической формы. Предпосылки создания изобретения Публикация патента США 2006-0041008 А 1 от 23 февраля 2006 г. раскрыла пригодность производных бензолсульфамида для лечения эпилепсии и сопутствующих расстройств, публикация патента США 2007-0155826 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения биполярных расстройств и мании, публикация патента США 2007-0155827 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения депрессии, публикация патента США 2007-0155824 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения эпилептогенеза, публикация патента США 2007-0155821 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения расстройств, связанных с нарушением метаболизма глюкозы, а также для лечения расстройств, связанных с нарушением метаболизма липидов,публикация патента США 2007-0191474 А 1 от 16 августа 2007 г. раскрыла пригодность производных бензолсульфамида для лечения мигрени, публикация патента США 2007-015823 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида в качестве нейропротекторов, публикация патента США 2008-0027131 А 1 от 31 января 2008 г. раскрыла пригодность производных бензолсульфамида для лечения ожирения, публикация патента США 2007-0155822 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения болей, публикация патента США 2007-0155825 А 1 от 05 июля 2007 г. раскрыла пригодность производных бензолсульфамида для лечения злоупотребления психоактивными веществами и (или) зависимости от них; указанные документы полностью включены в настоящий документ путем ссылки. Краткое описание изобретения Настоящее изобретение относится к получению новой кристаллической формы соединения формулы (IS) также известного как (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид. Новая кристаллическая форма соединения формулы (IS), именуемая в дальнейшем кристаллической формой(IS-VI), может быть определена, например, картиной дифракции рентгеновских лучей. Характерной для изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и кристаллическую форму (IS-VI). Примером изобретения является фармацевтическая композиция, полученная смешиванием кристаллической формы (IS-VI) с фармацевтически приемлемым носителем. Поясняющим изобретение является способ получения фармацевтической композиции, содержащей смесь кристаллической формы (IS-VI) с фармацевтически приемлемым носителем. Настоящее изобретение также связано со способами лечения тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств,эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, болей, злоупотребления психоактивными веществами, а также в качестве нейропротекторного средства, заключающиеся во введении субъекту, нуждающемуся в лечении, эффективного количества кристаллической формы (IS-VI). Другим примером изобретения является применение кристаллической формы (IS-VI) для получения лекарственного средства для лечения: (а) тревожного состояния и сопутствующих расстройств; (b) биполярной депрессии; (с) мании; (d) депрессии; (e) эпилепсии и сопутствующих расстройств; (f) эпилептогенеза; (g) расстройств, связанных с нарушением метаболизма глюкозы; (h) расстройств, связанных с нарушением метаболизма липидов; (i) мигрени; (j) ожирения; (k) болей; (l) злоупотребления психоактивными веществами; и (m) в качестве нейропротекторного средства у субъектов, нуждающихся в лечении. Краткое описание чертежей На фиг. 1 представлена характерная картина дифракции рентгеновских лучей кристаллической формы (IS-VI) для соединения формулы (IS), измеренная как описано в настоящем документе. На фиг. 2 представлена характерная картина дифференциальной сканирующей калориметрии кристаллической формы (IS-VI) соединения формулы (IS), измеренная как описано в настоящем документе. На фиг. 3 представлено отсканированное изображение результата термогравиметрического анализа кристаллической формы (IS-VI) соединения формулы (IS), измеренного как описано в настоящем доку-1 018567 менте. На фиг. 4 представлено отсканированное изображение результата динамической сорбции водяного пара кристаллической формой (IS-VI) соединения формулы (IS), измеренного как описано в настоящем документе. Подробное описание изобретения Настоящее изобретение относится к получению новой кристаллической формы соединения формулы (IS) именуемой в настоящем документе кристаллической формой (IS-VI). Настоящее изобретение также связано с применением кристаллической формы (IS-VI) для лечения тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств,связанных с нарушением метаболизма липидов, мигрени, ожирения, болей, злоупотребления психоактивными веществами, а также в качестве нейропротекторного средства. Настоящее изобретение также связано с созданием фармацевтических композиций, содержащих кристаллическую форму (IS-VI). Если соединение в соответствии с настоящим изобретением имеет хотя бы один хиральный центр,то оно может, соответственно, существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или несколькими хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Необходимо понимать, что все подобные изомеры и их смеси попадают в рамки настоящего изобретения. Предпочтительно, когда соединение представлено энантиомером с энантиомерным избытком, превышающим или равным приблизительно 80%, более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 90%, еще более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 95%, еще более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 98%, более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 99%. Используемый в настоящем документе термин "выделенная форма" означает, если не указано иное,что соединение присутствует в форме, выделенной из какой-либо твердой смеси с другим соединением(соединениями), системы растворителей или биологической среды. В одном из вариантов осуществления настоящего изобретения кристаллическая форма (IS-VI) представлена выделенной формой. Используемый в настоящем документе термин "в значительной степени чистая форма" означает,если не указано иное, что мольный процент примесей в выделенном соединении, либо кристаллической форме составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящего изобретения кристаллическая форма (IS-VI) представлена в значительной степени чистой формой. Используемый в настоящем документе термин "в значительной степени свободный от иного полиморфа либо кристаллической формы (форм)" применительно к соединению формулы (I) означает, если не указано иное, что мольный процент иного полиморфа или кристаллической формы (форм) в выделенном основании формулы (I) составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящего изобретения кристаллическая форма (IS-VI) представлена формой, в значительной степени свободной от иного полиморфа или кристаллической формы (форм). Используемые в настоящем документе термины "тревожное состояние и сопутствующие расстройства" и "тревожное состояние или сопутствующие расстройства" включают тревожное состояние и сопутствующие расстройства, в том числе генерализованное тревожное расстройство, острое стрессовое расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство,социальную фобию (также известную как социальное тревожное расстройство), специфические фобии,панические расстройства с или без агорафобии, агорафобию без панических расстройств в анамнезе, тревожное состояние в связи с общим заболеванием, злоупотребление психоактивными веществами, вызванное тревожным расстройством, а также тревожные расстройства без дополнительных уточнений (так как диагностические критерии данных состояний описаны в Diagnostic and Statistical Manual of MentalDisorders, 4th Edition, Text Revision, American Psychiatric Association, 2000, включенном в настоящий документ путем ссылки). Тревожное состояние и сопутствующие расстройства представлены группой,включающей генерализованное тревожное расстройство, острое стрессовое расстройство, посттравматическое стрессовое расстройство, а также обсессивно-компульсивное расстройство. Наиболее часто термин "тревожное состояние и сопутствующие расстройства" относится к генерализованному тревожному расстройству. Биполярное расстройство является психическим расстройством, характеризующимся непредска-2 018567 зуемыми колебаниями настроения от мании (или гипомании) к депрессии. Используемый в настоящем документе термин "биполярное расстройство" включает биполярное расстройство I, биполярное расстройство II, циклотимическое расстройство, а также биполярное расстройство без дополнительных уточнений. Биполярное расстройство характеризуется депрессивной и маниакальной (или гипоманиакальной) фазами; фазы циклические. Биполярное расстройство является биполярным расстройством I или биполярным расстройством II. Используемый в настоящем документе термин "биполярная депрессия" означает депрессию, ассоциированную с признаками или симптоматикой биполярного расстройства. Таким образом, способы лечения биполярной депрессии в рамках настоящего изобретения относятся к способам лечения депрессии и (или) депрессивной фазы биполярного расстройства. Используемый в настоящем документе термин "цикличность" или "биполярная цикличность" относится, если не указано иное, к чередованию депрессивной и маниакальной фаз настроения, характерному для биполярного нарушения. Таким образом, настоящее изобретение включает способы стабилизации цикличности, в том числе, помимо прочего, снижения частоты циклов и (или) уменьшения выраженности маниакальной и (или) депрессивной фаз. Используемый в настоящем документе термин "мания" включает манию или маниакальную фазу настроения, независимо от причины. Используемый в настоящем документе термин "биполярная мания" означает манию, ассоциированную с признаками или симптоматикой биполярного расстройства. Таким образом, способы лечения биполярной мании в рамках настоящего изобретения относятся к способам лечения мании и (или) маниакальной фазы биполярного расстройства. Используемый в настоящем документе термин "депрессия" включает большое депрессивное расстройство (как единичные, так и рецидивирующие случаи), униполярную депрессию, депрессию, устойчивую к лечению, стойкую депрессию, депрессию, сопровождающуюся тревожностью, а также дистимию (также известную как дистимическое расстройство). Кроме того, термин "депрессия" включает любое большое депрессивное расстройство, дистимическое расстройство, а также депрессивное расстройство без дополнительных уточнений, как определено их диагностическими критериями, перечисленными в Diagnostic and Statistical Manual of Mental Disorders, 4th Edition, Text Revision, American Psychiatric Association, 2000. Депрессия преимущественно представлена большим депрессивным расстройством, униполярной депрессией, депрессией, устойчивой к лечению, стойкой депрессией либо депрессией, сопровождающейся тревожностью. Наиболее часто термин "депрессия" относится к большому депрессивному расстройству. Если не указано иное, используемые в настоящем документе термины "эпилепсия и родственные патологические состояния" или "эпилепсия или родственное патологическое состояние" обозначают любое заболевание, при котором у субъекта (предпочтительно взрослого человека, ребенка или младенца) отмечаются один или большее количество припадков и(или) тремор. Подходящие примеры включают,помимо прочего, эпилепсию (включая, помимо прочего, локализационно-обусловленные эпилепсии, генерализованные эпилепсии, эпилепсии как с генерализованными, так и фокальными приступами и тому подобные), припадки как осложнение заболевания или патологического состояния (например, припадки,ассоциированные с энцефалопатией, фенилкетонурией, ювенильной формой болезни Гоше, прогрессивной миоклонической эпилепсией Лундборга, инсультом, травмой головы, стрессом, гормональными изменениями, приемом или прекращением приема медикаментов, алкоголя, лишением сна и тому подобными состояниями), эссенциального тремора, синдрома беспокойных ног и тому подобных. Предпочтительно заболеванием является эпилепсия (вне зависимости от типа, лежащей в основе причины или происхождения), эссенциальный тремор или синдром беспокойных ног, более предпочтительно эпилепсия(вне зависимости от типа, лежащей в основе причины или происхождения) или эссенциальный тремор. Эпилептогенез является двухфазным процессом. Первой фазой эпилептогенеза является инициирование эпилептогенного процесса, предшествующее первому эпилептическому припадку или симптомам аналогичных нарушений, сопровождающихся припадком, что часто является результатом повреждения либо травмы головного мозга, в том числе инсульта, болезни (например, инфекции, такой как менингит),травмы после случайного удара по голове либо хирургического вмешательства, выполненного на головном мозге. Вторая фаза эпилептогенеза сопряжена с процессом, в ходе которого ткани головного мозга,уже вовлеченные в эпилептические припадки либо аналогичные нарушения, сопровождающиеся припадком, становятся еще более восприимчивыми к припадкам увеличенной частоты и(или) тяжести и(или) становятся менее поддающимися лечению. Используемый в настоящем документе термин "расстройства, связанные с нарушением метаболизма глюкозы" означает любое расстройство, характеризующееся повышением уровня глюкозы. К расстройствам, связанным с нарушением метаболизма глюкозы, относятся: повышение уровня глюкозы,преддиабетические состояния, сниженная толерантность к глюкозе при пероральном введении, неудовлетворительный контроль гликемии, сахарный диабет II типа, синдром X (также известный как метаболический синдром), гестационный диабет, резистентность к инсулину, гипергликемия, а также потеря мышечной массы в результате гипергликемии (кахексия). Лечение расстройств, связанных с нарушением метаболизма глюкозы, может включать снижение уровня глюкозы, улучшение контроля гликемии, снижение резистентности к инсулину и (или) предупреждение развития расстройств, связанных с нарушением метаболизма глюкозы (например, предупреждение развития у пациента со сниженной толерантностью к глюкозе при пероральном введении либо с повышенным уровнем глюкозы сахарного диабета II типа). Используемый в настоящем документе термин "расстройства, связанные с нарушением метаболизма липидов" означает любое расстройство, характеризующееся отклонением от нормы уровня липидов. К расстройствам, связанным с нарушением метаболизма липидов, относятся: повышенный уровень триглицеридов, низкий уровень холестерина ЛПВП, а также дислипидемия; преимущественно повышенный уровень триглицеридов либо низкий уровень холестерина ЛПВП. Лечение расстройств, связанных с нарушением метаболизма липидов, может включать снижение уровня триглицеридов, повышение уровня холестерина ЛПВП и (или) улучшение показателя соотношения триглицериды/ЛПВП. Используемый в настоящем документе термин "мигрень" означает хроническое эпизодическое изнуряющее клиническое состояние, диагностируемое по наличию пульсирующей односторонней головной боли от умеренной до выраженной интенсивности, длящейся от 4 до 72 ч, которое включает мигрень без ауры и мигрень с аурой. Используемый в настоящем документе термин "мигрень без ауры" означает по меньшей мере пять приступов, отвечающих следующим критериям: (а) приступ головной боли длится 4-72 ч, при этом головная боль имеет по меньшей мере два из следующих признаков: односторонняя локализация, пульсирующий характер, интенсивность от умеренной до выраженной, оказывает прямое влияние на повседневную активность, усиливается при ходьбе по лестнице либо аналогичных действиях; (b) головная боль сопровождается по меньшей мере одним из следующих явлений: тошнота и(или) рвота, а также свето- и звукобоязнь. Используемый в настоящем документе термин "мигрень с аурой" означает по меньшей мере два приступа, сопровождающихся по меньшей мере тремя из четырех следующих признаков: (а) один или несколько полностью обратимых симптомов, сопровождающий ауру; (b) по меньшей мере один симптом, сопровождающий ауру, развивается постепенно в течение более 4 мин, либо два или несколько симптомов проявляются последовательно; (с) симптомы длятся не более 60 мин; (d) головная боль появляется до, во время или после ауры с интервалами между аурой и головной болью приблизительно 60 мин. Используемый в настоящем документе термин "предупреждение" включает предупреждение приступов мигрени (головных болей), снижение частоты приступов мигрени (головных болей), уменьшение тяжести приступов мигрени (головных болей) и(или) снижение продолжительности приступов мигрени(головных болей). Используемый в настоящем документе термин "ожирение" означает индекс массы тела (ИМТ), превышающий или равный 25, предпочтительно - ИМТ, превышающий или равный 30. Используемый в настоящем документе термин "ожирение" относится как к субъектам (пациентам) с избыточной массой тела, так и к субъектам (пациентам) с ожирением. Используемый в настоящем документе термин "боли" включает острые и хронические воспалительные и нейропатические боли (преимущественно при диабетической нейропатии). Кроме того, боль может быть централизованно-опосредованной, периферически-опосредованной; боль может быть вызвана повреждением структурных тканей, повреждением мягких тканей либо прогрессирующим заболеванием. Любая централизованно-опосредованная, периферически-опосредованная, вызванная повреждением структурных тканей, повреждением мягких тканей либо прогрессирующим заболеванием боль может быть острой или хронической. Используемый в настоящем документе термин "боль" включает, если не указано иное, воспалительную боль, централизованно-опосредованную боль, периферически-опосредованную боль, висцеральную боль, боль, связанную со структурными нарушениями, онкологическую боль, боль, связанную с повреждением мягких тканей, боль, связанную с прогрессирующим заболеванием, нейропатическую боль, острую боль, связанную с острым повреждением, острую боль, связанную с травмой, острую боль,связанную с хирургическим вмешательством, головную боль, зубную боль, боль в спине (преимущественно поясничная боль), хроническую боль, связанную с нейропатологией, а также хроническую боль в постинсультном периоде. Одним из вариантов осуществления настоящего изобретения является способ лечения острой боли. Другим вариантом осуществления настоящего изобретения является способ лечения хронической боли. Еще одним вариантом осуществления настоящего изобретения является способ лечения нейропатической боли, преимущественно при диабетической нейропатии. Другим вариантом осуществления настоящего изобретения является способ лечения воспалительной боли. В вариантах осуществления настоящего изобретения боль вызвана причинами из следующей группы, состоящей из остеоартрита, ревматоидного артрита, фибромиалгии, головной боли, зубной боли,ожога, солнечного ожога, укуса животного (укусы собак, кошек, змей, пауков, насекомых и т.п.), нейрогенного мочевого пузыря, доброкачественной гипертрофии предстательной железы, интерстициального цистита, ринита, контактного дерматита/гиперчувствительности, зуда, экземы, фарингита, мукозита, эн-4 018567 терита, целлюлита, каузалгии, неврита седалищного нерва, невралгии в височно-нижнечелюстном суставе, периферического неврита, полиневрита, культевой боли, фантомной боли, послеоперационной кишечной непроходимости, холецистита, болевого синдрома после мастэктомии, нейропатической боли в ротовой полости, боли Шарко, рефлекторной симпатической дистрофии, синдрома Гийена-Барре, парестетической мералгии, синдрома жжения в полости рта, постгерпетической невралгии, невралгии тройничного нерва, периферической нейропатии, двусторонней периферической нейропатии, диабетической нейропатии, постгерпетической невралгии, невралгии тройничного нерва, неврита зрительного нерва,постфебрильного неврита, мигрирующего неврита, сегментарного неврита, неврита Гомбо, нейронита,шейно-плечевой невралгии, черепной невралгии, невралгии коленчатого узла, невралгии языкоглоточного нерва, мигренозной невралгии, идиопатической невралгии, межреберной невралгии, невралгии в области молочных желез, невралгии Мортона, синдрома носоресничного нерва, затылочной невралгии,эритромелалгии, невралгии Слудера, невралгии крылонебного узла, невралгии надглазничного нерва,невралгии видиева нерва, воспалительных заболеваний кишечника, синдрома раздраженного кишечника,схваток, родов, менструальных спазм, рака, болей в спине, боли в пояснице, запястного туннельного синдрома. К острой боли относится боль, вызванная острым повреждением, травмой, болезнью либо хирургическим вмешательством (например, операции на открытой грудной клетке (включая операции на открытом сердце или шунтирование. Острая боль включает также, помимо прочего, головную боль, послеоперационную боль, боль, вызванную камнями в почках, боль в желчном пузыре, боль, вызванную камнями в желчном пузыре, родовые боли, ревматическую боль, зубную боль, боль в результате спортивных травм, запястный туннельный синдром, ожоги, скелетно-мышечные растяжения и деформации, мышечно-сухожильные деформации, шейно-плечевой болевой синдром, диспепсию, язву желудка, язву двенадцатиперстной кишки, дисменорею, а также эндометриоз. Хроническая боль включает боль, вызванную воспалением, остеоартритом, ревматоидным артритом, а также осложнениями болезни, острым повреждением или травмой. Хроническая боль включает также, помимо прочего, головную боль, боль в верхней части спины или в пояснице (обусловленную системной, местной либо первичной спинальной патологией (обусловленной радикулопатией, боль в костях (обусловленную остеоартритом, остеопорозом, костными метастазами либо неизвестными причинами), тазовые боли, боль, связанную с травмами спинного мозга, сердечные боли в области грудной клетки, несердечные боли в области грудной клетки, боли центрального генеза после инсульта, миофасциальные боли, онкологическую боль, боли при СПИДе, боли при серповидно-клеточной анемии, гериатрические боли либо боль, вызванную мигренью, головную боль, боль при невралгии тройничного нерва, синдроме височно-нижнечелюстного сустава, фибромиалгическом синдроме, остеоартрите, ревматоидном артрите, подагре, фиброзите либо компрессионном синдроме верхней апертуры грудной клетки. Нейропатическая боль включает боль, вызванную хроническими заболеваниями или изнуряющими состояниями. Хронические заболевания или изнуряющие состояния, которые могут приводить к нейропатическим болям, включают, помимо прочего, боли при диабетической периферической нейропатии,постгерпетическую невралгию, невралгию тройничного нерва, боль после инсульта, боль, ассоциированную с рассеянным склерозом, боль при идиопатической или посттравматической нейропатии, а также мононеврите, ВИЧ-ассоциированную нейропатическую боль, онкологическую нейропатическую боль,нейропатическую боль при запястном туннельном синдроме, боль, ассоциированную с повреждениями спинного мозга, комплексный регионарный болевой синдром, нейропатическую боль, ассоциированную с фибромиалгией, поясничную и шейную боль, рефлекторную симпатическую дистрофию, синдром фантомной конечности, а также прочие боли, ассоциированные с хроническими и изнуряющими состояниями. Используемый в настоящем документе термин "лечение злоупотребления психоактивными веществами" включает лечение злоупотребления психоактивными веществами либо лечение зависимости от них, что включает, помимо прочего, лечение привыкания, абстиненции, а также прочие симптомы зависимости или злоупотребления. Используемый в настоящем документе термин "психоактивные вещества", относящийся к веществам, которыми злоупотребляют или от которых испытывают зависимость,включает разрешенные или запрещенные вещества, к которым у субъекта либо пациента может развиться зависимость. Соответствующие примеры включают, помимо прочего, алкоголь, кокаин, героин, метамфетамин, кетамин, экстази, никотин, оксиконтин (оксикодон), кодеин, морфин и подобные вещества. Используемый в настоящем документе термин "нейропротекция" означает защиту нейронов головного мозга, центральной или периферической нервной системы (преимущественно нейронов головного мозга или спинного мозга) от гибели и (или) повреждения. Предпочтительно нейроны получают защиту от гибели или повреждения, вызванного окислительным стрессом, например, радикалами кислорода. Термин "острые нейродегенеративные расстройства", относящийся к способам настоящего изобретения, включает, помимо прочего, различные типы острых нейродегенеративных расстройств, связанных с гибелью или повреждением нейронов, в том числе цереброваскулярную недостаточность, очаговую травму мозга, диффузное повреждение мозга, повреждение спинного мозга, то есть церебральную ишемию либо инфаркт, включающий эмболическую закупорку и тромботическую закупорку, реперфузию после острой ишемии, перинатальное гипоксически-ишемическое поражение, остановку сердца, внутричерепное кровоизлияние любого типа (в том числе, помимо прочего, эпидуральное, субдуральное, субарахноидальное и интрацеребральное), а также внутричерепное и внутрипозвоночное поражение (в том числе, помимо прочего, контузию, проникновение, сдвиг, компрессию и разрыв), а также синдром детского сотрясения. Острые нейродегенеративные расстройства преимущественно являются результатом инсульта, острого ишемического повреждения, травмы головы либо повреждения спинного мозга. Термин "хронические нейродегенеративные расстройства", относящийся к способам настоящего изобретения,включает, помимо прочего, болезнь Альцгеймера, болезнь Пика, болезнь диффузных телец Леви, прогрессирующий надъядерный паралич (болезнь Стила-Ричардсона-Олыпевского), мультисистемную дегенерацию (синдром Шая-Дрейджера), хронические эпилептические состояния, ассоциированные с нейродегенерацией, болезни двигательных нейронов, включая боковой амиотрофический склероз, дегенеративные атаксии, корковую базальную дегенерацию, боковой амиотрофический склерозпаркинсонизм-деменция (комплекс острова Гуам), подострый склерозирующий панэнцефалит, болезнь Хантингтона, болезнь Паркинсона, синуклеопатии (в том числе множественная системная атрофия), первичную прогрессирующую афазию, стриатонигральную дегенерацию, болезнь Мачадо-Джозефа (спиномозжечковая атаксия типа 3) и оливомостомозжечковые дегенерации, синдром Жилль де ла Туретта,бульбарный и псевдобульбарный паралич, спинальную и спинобульбарную мышечную атрофию (болезнь Кеннеди), рассеянный склероз, первичный латеральный склероз, семейную спастическую параплегию, болезнь Верднига-Гоффманна, болезнь Кугельберга-Веландер, болезнь Тея-Сакса, болезнь Сандхоффа, семейную спастическую болезнь, болезнь Вольфарта-Кугельберга-Веландер, спастический парапарез, прогрессирующую многоочаговую лейкоэнцефалопатию, семейную дисавтономию (синдром Райли-Дея), а также прионные болезни (в том числе, помимо прочего, болезнь Крейтцфельдта-Якоба, болезнь Герстманна-Штреусслера-Шейнкера, куру, а также фатальная семейная инсомния). Хронические нейродегенеративные расстройства представлены преимущественно болезнью Альцгеймера, болезнью Паркинсона, рассеянным склерозом, а также церебральным параличом. Прочие расстройства, проявляющиеся гибелью или повреждением нейронов, и по существу предполагаемые к включению в способы настоящего изобретения, включают деменцию, независимо от этиологии, в том числе возрастную и прочие виды деменции, состояния, сопровождающиеся потерей памяти,в том числе деменцию, ассоциированную с болезнью Альцгеймера, сосудистую деменцию, диффузное поражение белого вещества (болезнь Бинсвангера), деменцию эндокринного или метаболического происхождения, деменцию в результате травмы головы и диффузного повреждения мозга, деменцию боксеров, а также деменцию лобной доли. В настоящее изобретение включены также способы нейропротекции (то есть способы предупреждения гибели и (или) повреждения нейронов) после повреждения головного мозга, центральной или периферической нервной системы в результате химического, токсического, инфекционного, радиационного и (или) травматического повреждения. Способы настоящего изобретения относятся преимущественно к предупреждению гибели или повреждения нейронов после травмы головы и (или) позвоночника, повреждения головного мозга независимо от причины. Используемый в настоящем документе термин "субъект" обозначает животное, предпочтительно млекопитающее, наиболее предпочтительно человека, которое являлось объектом лечения, наблюдения или эксперимента. Субъект перенес и (или) продемонстрировал по меньшей мере один симптом болезни или расстройства для лечения и (или) предупреждения. Используемый в настоящем документе термин "терапевтически эффективное количество" обозначает такое количество активного соединения или фармацевтического агента, которое вызывает биологически или медицински значимый ответ со стороны системы тканей/органов, организма животного или человека, ожидаемый исследователем, ветеринаром, врачом или иным клиницистом, и который включает облегчение симптоматики заболевания или патологического состояния, подвергшегося лечению. Используемый в настоящем документе термин "лекарственное средство/композиция", как предполагается, обозначает продукт, включающий определенные ингредиенты в определенных количествах,также как любой продукт, являющийся прямым либо опосредованным результатом комбинирования таких специфических ингредиентов в специфических количествах. Специалисту в данной области будет понятно, что для получения необходимого продукта все стадии реакции, если не указано иное, должны выполняться согласно известным способам в надлежащих условиях. Специалисту в данной области будет понятно, что в то время как реакционная стадия, описываемая в настоящем изобретении, может протекать в разнообразных растворителях или системах растворителей,указанная реакционная стадия также может протекать в смесях приемлемых растворителей или систем растворителей. Специалисту в данной области будет понятно, что в представленных в настоящем документе техническом описании и формуле изобретения, где реагент или класс/тип реагента (например, основание,растворитель и т.д.) упоминается более чем для одной стадии процесса, индивидуальные реагенты независимо выбираются для каждого шага реакции и могут быть теми же самыми либо отличаться друг от друга. Например, для двух стадий процесса повторно упоминается в качестве реагента органическое или неорганическое основание, при этом органическое или неорганическое основание, выбранное для первой стадии может быть тем же самым либо отличаться от органического или неорганического основания,используемого во второй реакции. Для краткости, некоторые количественные выражения в настоящем документе не уточняются термином "приблизительно". Необходимо понимать, что вне зависимости от того, используется ли явно термин "приблизительно" или нет, каждое приводимое в настоящем документе количество подразумевает действительное численное значение, а также разумное приближение к таковому численному значению, основанное на имеющихся у специалиста знаниях, включая приближение, основанное на экспериментальных условиях и (или) измерениях, имеющих отношение к такому численному значению. Для краткости, некоторые количественные выражения в настоящем документе приводятся как ряд от приблизительного количества X до приблизительного количества Y. Понятно, что когда приводится такой ряд, он не ограничивается указанными верхними и нижними границами, а включает весь спектр от приблизительного количества X до приблизительного количества Y или диапазон в этом пределе. Кристаллическая форма (IS-VT) может быть определена картиной дифракции рентгеновских лучей на порошке (pXRD). pXRD была измерена на репрезентативном образце кристаллической формы; результат измерения представлен на фиг. 1. Образцы анализировали на рентгеновском дифрактометреX'PERT PRO MPD производства Philips с высотой держателя 16 мм; детектор X-Celerator. Образцы сканировали в угловом диапазоне от 3 до 35 2, шаг сканирования 0,0165 2, время шага 10,16 с. Эффективная скорость сканирования 0,2067/с при напряжении и текущих настройках 45 кВ и 40 мА. Образцы анализировали при расхождении щели в автоматическом режиме и с помощью отсекателя пучка в крайнем нижнем положении. Кристаллическая форма (IS-VI) может быть определена картиной пиков, полученных дифракцией рентгеновских лучей на порошке, как указано ниже в табл. 1. Таблица 1. Пики pXRD, кристаллическая форма (IS-VI) Кристаллическая форма (IS-VI) преимущественно определяется pXRD с относительной интенсивностью пиков более или равной приблизительно 10%, как указано ниже в табл. 2. Таблица 2. Пики pXRD, кристаллическая форма (IS-VI) Дифференциальная сканирующая калориметрия была выполнена на репрезентативном образце кристаллической формы (IS-VT); результат представлен на фиг. 2. Дифференциальная сканирующая калориметрия образца была выполнена на дифференциальном сканирующем калориметре DSC Q1000 компа-7 018567 нии ТА Instruments. Полученный образец анализировали в открытой алюминиевой ячейке для образцов компании ТА Instrument при нагревании от температуры окружающей среды до 120C и изменении температуры 10C/мин с охлаждением в жидком азоте. Кристаллическая форма (IS-VI) показала температуру начала плавления 100,4C, пиковую температуру плавления 101,5C и теплоту плавления 96,2 Дж/г. Термогравиметрический анализ был выполнен на репрезентативном образце кристаллической формы; результат представлен на фиг. 3. Потеря массы образца была измерена с помощью термогравиметрического анализатора TGA Q5000IR компании ТА Instruments. Полученный образец анализировали при нагревании от температуры окружающей среды до 120C и изменении температуры 10C/мин с охлаждением в жидком азоте. В результате термогравиметрического анализа потеря массы при нагревании от температуры окружающей среды до температуры плавления образца включительно не произошла, из чего следует, что кристаллическая форма (IS-VI) не является гидратом. Для определения гигроскопичности репрезентативный образец кристаллической формы (IS-VI) был подвергнут динамической сорбции водяного пара в условиях циклической влажности; результат представлен на фиг. 4. Анализ образца проводили с использованием динамической паровой сорбционной системы Surface Measurement System DVS-1. Был проведен полный цикл анализа образца в пошаговом режиме при 25C и изменении относительной влажности от 0 до 90% с шагом 10%. Были соблюдены равновесные условия: dm/dt 0,0007%/мин, dm/dt окно 5 мин, минимальный и максимальный этап 15 и 360 мин. Данные регистрировали с интервалом 1 мин. В качестве газа-носителя использовали азот. Результаты измерения динамической сорбции водяного пара показали, что кристаллическая форма (IS-VT) не гигроскопична. Приведенные выше результаты показывают, что кристаллическая форма (IS-VI) соединения формулы (IS) устойчива к температурным воздействиям и влажности, что делает ее хорошо пригодной для заключения в твердые лекарственные формы. Настоящее изобретение также включает фармацевтические композиции, содержащие кристаллическую форму (IS-VI) с фармацевтически приемлемым носителем. Лекарственные средства, содержащие в качестве активных ингредиентов одно или несколько соединений, описываемых в настоящем изобретении, могут быть приготовлены при помощи тщательного смешивания соединения или соединений с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей. Носитель может иметь широкое разнообразие форм, в зависимости от предполагаемого способа введения (например, пероральный, парентеральный). Так, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и тому подобные. Для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие агенты, лубриканты, связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. Твердые пероральные лекарственные формы также могут покрываться оболочками из таких веществ, как сахара, либо кишечно-растворимым покрытием для модулирования основного места всасывания. Для парентерального введения носитель, как правило, состоит из стерильной воды, при этом, в целях улучшения растворимости или консервации, могут добавляться другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут изготавливаться с использованием водных носителей вместе с соответствующими добавками. Для приготовления фармацевтических композиций, описываемых в настоящем изобретении, одно или несколько соединений, описываемых в настоящем изобретении в качестве активного ингредиента,тщательно смешиваются с фармацевтическим носителем, в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом такой носитель может иметь широкое разнообразие форм, в зависимости от лекарственной формы, требуемой для предполагаемого способа введения,например, пероральный или парентеральный, как, например, внутримышечное введение. Для получения пероральных лекарственных форм могут использоваться любые из обычных фармацевтических сред. Так, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и тому подобные. Для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители,гранулообразующие агенты, лубриканты, связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. В связи с легкостью назначения таблетки и капсулы представляют собой наиболее удобную в употреблении пероральную дозированную лекарственную форму, в которой с очевидностью используются твердые фармацевтические носители. При необходимости таблетки могут покрываться оболочкой из Сахаров либо кишечно-растворимым покрытием стандартными способами. Для парентеральных лекарственных форм носитель, как правило, состоит из стерильной воды, хотя другие ингредиенты, например, в целях улучшения растворимости или консервации, могут также включаться в состав. Также могут быть получены инъекционно вводимые суспензии или растворы, в этом случае могут использоваться соответствующие водные носители, суспендирующие агенты и подобные компоненты. Описываемые в настоящем документе фармацевтические композиции включают, в расчете на едини-8 018567 цу дозы, например, таблетку, капсулу, дозу порошка, чайную ложку и т.п., такое количество активного ингредиента, которое необходимо для обеспечения эффективной дозы в соответствии с описанием приведенным выше. Описываемые в настоящем документе фармацевтические композиции содержат в расчете на единицу дозы, например, таблетку, капсулу, дозу порошка, инъекцию, суппозиторий, чайную ложку и тому подобные единицы, приблизительно от 0,1 до 100 0 мг, либо в иных дозах в этих пределах, и могут назначаться в количестве приблизительно от 0,01 до 300 мг/кг/день, либо в иных дозах в этих пределах, предпочтительно приблизительно от 0,5 до 50 мг/кг/день, либо в иных дозах в этих пределах. Дозы, однако, могут варьировать, в зависимости от потребности пациента, тяжести состояния и используемого соединения. Возможно ежедневное дозирование либо периодическая ревизия дозы. Предпочтительно использование этих композиций в виде дозированных лекарственных форм, например, в виде таблеток, пилюль, капсул, дозированных порошков, гранул, стерильных растворов или суспензий для парентерального введения, дозируемых аэрозолей или жидкостей для разбрызгивания,капель ампул, аутоинъекторов или суппозиториев; для перорального, парентерального, интраназального,сублингвального или ректального приема, либо для назначения при помощи ингаляции или вдувания. В альтернативном варианте осуществления композиция может быть представлена в виде лекарственной формы, назначаемой один раз в неделю или месяц; например, нерастворимая соль активного соединения,такая как деканоат, может быть адаптирована для внутримышечной инъекции с формированием тканевого депо. Для получения твердых лекарственных форм, таких как таблетки, основной активный ингредиент смешивается с фармацевтическим носителем, например, обычными ингредиентами, используемыми для приготовления таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбитол, тальк, стеариновая кислота, стеарат магния, дикальция фосфат или камедь, и другими фармацевтическими разбавителями, например, водой, с образованием твердой преформулирующей композиции, содержащей гомогенную смесь соединений, описываемых в настоящем изобретении, либо их фармацевтически приемлемых солей. Характеристика таких преформулирующих композиций в качестве гомогенных означает, что активные ингредиенты равномерно диспергированы внутри композиции, так что композиция может быть немедленно поделена на равноэффективные дозированные лекарственные формы, такие как таблетки,пилюли и капсулы. Такая твердая преформулирующая композиция затем оказывается поделенной на дозированные лекарственные формы описанных выше типов, содержащие от 0,1 до приблизительно 500 мг активного ингредиента, описываемого в настоящем изобретении. Таблетки или пилюли такого нового состава могут покрываться оболочкой либо иначе формироваться, с тем чтобы обеспечивать создание дозированной лекарственной формы, имеющей преимущества длительного действия. Например, таблетка или пилюля может включать внутренний и внешний дозированные компоненты, последний из которых является своего рода конвертом, заключающим в себе предыдущий компонент. Эти два компонента могут быть разделены кишечно-растворимым слоем, который служит для защиты от расщепления в желудке и позволяет внутреннему компоненту оказаться в просвете двенадцатиперстной кишки, сохранив свою интактность, либо способствует его пролонгированному высвобождению. Для создания подобных кишечно-растворимых оболочек могут быть использованы различные материалы, подобные материалы включают ряд полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозный. Жидкие лекарственные формы, содержащие новые композиции, описываемые в настоящем изобретении, могут быть инкорпорированы для перорального введения либо для введения инъекционным путем и включают водные растворы, сиропы с соответствующими вкусовыми добавками, водные или масляные суспензии и эмульсии с соответствующими вкусовыми добавками и съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, также как и эликсиры и сходные лекарственные формы. Приемлемые диспергирующие или суспендирующие агенты для водных суспензий включают синтетическую или природную камедь, такую как трагакант, гуммиарабик, альгинат, декстран, карбоксиметилцеллюлозу натрия, метилцеллюлозу, поливинилпирролидинон или желатин. Способы лечения, описываемые в настоящем изобретении, могут также применяться с использованием фармацевтической композиции, содержащей любое из описанных в настоящем документе соединений и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать от 0,01 до 1000 мг соединения либо в иных дозах в этих пределах, предпочтительно приблизительно от 10 до 500 мг соединения, и может быть сформирован в виде любой формы, пригодной для выбранного способа приема лекарства. Носители включают необходимые и инертные фармацевтические носители, в том числе, помимо прочего, связывающие вещества,добавки для улучшения разрушаемости таблеток, лубриканты, ароматизаторы, подсластители, консерванты, красители и оболочки. Композиции, приемлемые для перорального введения, включают твердые формы, такие как пилюли, таблетки, таблетки в форме капсулы, капсулы (каждая включает варианты с немедленным высвобождением, пролонгированным и непрерывным высвобождением), гранулы, порошки, и жидкие формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Формы, приемлемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии. Преимущественно соединения, рассматриваемые в настоящем изобретении, могут назначаться в виде однократной дневной дозы, либо суммарная дневная доза может назначаться многократными дозами дважды, трижды или четырежды в день. Более того, соединения, рассматриваемые в настоящем изобретении, могут назначаться интраназально при помощи местного использования приемлемых интраназальных средств доставки или посредством трансдермальных кожных пластырей, хорошо известных специалистам в данной области. Для назначения трансдермально, прием должен, без сомнения, быть непрерывным, а не перемежающимся на протяжении всего режима дозирования. Например, для перорального введения в форме таблетки или капсулы активный компонент лекарства может комбинироваться с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерол, вода и им подобными. Более того, в случае необходимости или при желании могут использоваться соответствующие связывающие вещества; лубриканты, дезинтегрирующие агенты, красители также могут быть включены в смесь. Подходящие связывающие вещества включают, помимо прочего, крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, подсластитель из кукурузы, природные и синтетические камеди, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и им подобные соединения. Дезинтеграторы включают, помимо прочего, крахмал, метилцеллюлозу, агар, бентонит,ксантановую камедь и им подобные. Жидкие формы в соответствующим образом ароматизированных суспендирующем и диспергирующем агентах, таких как синтетические и природные камеди, например, трагакант, гуммиарабик, метил-целлюлоза и им подобные. Для парентерального введения необходимы стерильные суспензии и растворы. Изотонические среды, обычно содержащие подходящие консерванты, применяются в тех случаях,когда требуется внутривенное введение. Для приготовления фармацевтических композиций, описываемых в настоящем изобретении, соединение формулы (I) в качестве активного ингредиента тщательно смешивается с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом такой носитель может иметь широкое разнообразие форм, в зависимости от лекарственной формы,требуемой для предполагаемого способа введения (например, перорального или парентерального). Соответствующие фармацевтически приемлемые носители хорошо известны специалистам. Описания некоторых из таких фармацевтически приемлемых носителей могут быть найдены в публикации The Handbook of Pharmaceutical Excipients, опубликованной Американской фармацевтической ассоциацией и Фармацевтическим обществом Великобритании. Способы приготовления фармацевтических композиций/лекарственных средств описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets, Second Edition, Revised and Expanded, Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications, Volumes 1-2, edited by Avis et al; и Pharmaceutical Dosage Forms: Disperse Systems, Volumes 1-2, edited by Lieberman et al; опубликованных Marcel Dekker, Inc. Соединения в рамках настоящего изобретения могут вводиться в любой из вышеуказанных композиций согласно определенному специалистом режиму дозирования для лечения тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств,связанных с нарушением метаболизма липидов, мигрени, ожирения, болей, злоупотребления психоактивными веществами, а также в качестве нейропротекторного средства. Суточная доза лекарственных средств может варьировать в широких пределах, составляющих для взрослого пациента от 1,0 до 5000 мг в день, либо в иных дозах в этих пределах. Для перорального введения фармацевтические композиции предпочтительно поставляются в виде таблеток, содержащих 0,01,0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 и 500 мг активного ингредиента в целях симптоматической коррекции дозы у пациента, получающего лечение. Эффективное количество лекарства обычно обеспечивается дозой приблизительно от 0,1 мг/кг до 1000 мг/кг веса тела в день, либо в иных дозах в этих пределах. Предпочтительными являются дозы приблизительно от 0,5 до 500 мг/кг веса тела в день, либо иные дозы в этих пределах. Более предпочтительно -приблизительно от 1,0 до 250 мг/кг веса тела в день, либо иные дозы в этих пределах. Соединения могут назначаться по режиму от 1 до 4 раз в день. Оптимальные назначаемые дозы могут легко определяться специалистами и будут варьировать в зависимости от используемого соединения, способа введения, силы лекарственного средства и степени выраженности патологического состояния. Кроме того, факторы, связанные с личными особенностями конкретных пациентов, включая возраст, вес тела, особенности диеты и времени введения лекарственного средства, в результате приведут к необходимости коррекции назначенных доз лекарственных средств. Специалисту будет понятно, что как in vivo, так и in vitro испытания, проводимые с использованием подходящих, известных и общепринятых клеточных и (или) животных моделей, позволяют предположительно оценивать способность тестируемого соединения оказывать лечебное или профилактическое действие по отношению к данному заболеванию. Специалисту также будет понятно, что клинические испытания на людях, включая первичные испытания на человеке, оценку эффективности доз, испытания на группах здоровых добровольцев и (или) пациентов, страдающих данным заболеванием, могут осуществляться в соответствии со способами, хорошо известными в медицинской и клинической практике. Следующие примеры предлагаются в целях способствования пониманию сути настоящего изобретения и не предназначены для того (и не должны быть истолкованы так), чтобы ограничивать какимлибо образом рамки данного изобретения, раскрываемого в следующих далее пунктах его формулы. Пример 1. Кристаллическая форма (IS-VI). В четырехгорлую реакционную колбу емкостью 5 л, оснащенную верхней мешалкой, капельной воронкой, колбонагревателем, устройством контроля температуры и точкой вывода азота, был помещен(2S)-(-)-N-(6-хлор-2,3-дигидробензо [1,4]диоксин-2-илметил)-сульфамид (300 г, 1,08 моль) и 50% IPAгептан (1500 мл, 7,36 моль). Полученную смесь нагревали до 75C. В смеси наблюдался некоторый осадок. Горячая смесь была профильтрована через фильтровальную бумагу под легким вакуумом в подогреваемой фильтрационной колбе. Колбу обмыли 50% IPA-гептаном (200 мл). После горячей фильтрации температура реакционной смеси составила 62C. При охлаждении до 46C в течение 20 мин. осадок не наблюдали. При охлаждении до 30C осадок отсутствовал. Полученную смесь нагревали до 40C, затем в течение 30 мин. добавляли гептан (175 мл, 1,19 моль). После добавления гептана наблюдали выпадение твердого осадка. Добавление гептана прекращали при быстром увеличении количества твердого осадка со значительным повышением температуры (+4C). После охлаждения до комнатной температуры в течение 1 ч твердый осадок отфильтровали и промыли 10% IPA-гептаном (100 мл). После фильтрации и высушивания исследуемое соединение было выделено в виде твердого вещества белого цвета. Дифракция рентгеновских лучей на порошке показала, что была выделена кристаллическая форма(2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамид (9,3 кг), активированный уголь (0,3 кг), изопропиловый спирт (15,5 кг) и н-гептан (15,4 кг) были помещены в реактор. Полученную смесь нагревали до обратного оттока и фильтровали горячей. Фильтр промывали горячей смесью изопропилового спирта (1,7 кг) и н-гептана (1,7 кг). Фильтрат охлаждали до 50-54C и затравливали необходимыми полиморфными формами (0,02 кг). Полученную смесь взбалтывали при 50-54C 30 мин,затем к смеси добавляли н-гептан (14,4 кг) при 50-54C в течение 20 мин. Смесь охлаждали до 0-5C в течение 1 ч, затем взбалтывали при указанной температуре в течение 2 ч. Затем смесь фильтровали, осадок на фильтре промывали н-гептаном и высушивали в вакууме при 50-60C до получения исследуемого соединения в требуемой полиморфной форме (что определяли дифракцией рентгеновских лучей на порошке). Пример 3. Пероральная форма, прогноз. В качестве конкретного осуществления лекарственной формы для перорального применения, 100 мг кристаллической формы, полученной в соответствии с примером 1 или примером 2, приготавливаются в сочетании с достаточно мелко измельченной лактозой, обеспечивающей общую массу от 580 до 590 мг, предназначенную для заполнения твердой желатиновой капсулы размера O. Приведенное выше техническое описание содержит сведения о принципах, лежащих в основе настоящего изобретения, и иллюстрирующие его примеры, однако следует понимать, что практическое применение изобретения распространяется на все обычные вариации, адаптации и (или) модификации, в соответствии с нижеприведенными пунктами и их эквивалентами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма (2S)-(-)-N-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил) сульфамида формулы (IS) содержащая следующие пики, полученные дифракцией рентгеновских лучей на порошке: и характеризующаяся температурой начала плавления 100,4C и/или теплотой плавления 96,2 Дж/г. 2. Кристаллическая форма по п.1, содержащая следующие пики, полученные дифракцией рентгеновских лучей на порошке: 3. Фармацевтическая композиция для лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств, связанных с нарушением метаболизма липидов, мигрени, ожирения, боли и злоупотреблением психоактивными веществами, или для нейропротекции, содержащая кристаллическую форму по п.1 и фармацевтически приемлемый носитель. 4. Способ получения фармацевтической композиции, включающий смешивание кристаллической формы по п.1 и фармацевтически приемлемого носителя. 5. Способ лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств,связанных с нарушением метаболизма липидов, мигрени, ожирения, боли и злоупотреблением психоактивными веществами, или способ нейропротекции, заключающийся во введении субъекту, нуждающемуся в лечении, терапевтически эффективного количества кристаллической формы по п.1. 6. Способ по п.5, в котором расстройство выбрано из группы, состоящей из депрессии, эпилепсии и сопутствующих расстройств, и расстройств, связанных с нарушением метаболизма глюкозы. 7. Способ лечения расстройства, выбранного из группы, состоящей из тревожного состояния и сопутствующих расстройств, биполярной депрессии и мании, депрессии, эпилепсии и сопутствующих расстройств, эпилептогенеза, расстройств, связанных с нарушением метаболизма глюкозы, расстройств,связанных с нарушением метаболизма липидов, мигрени, ожирения, боли, злоупотреблением психоактивными веществами, или способ нейропротекции, заключающийся во введении субъекту, нуждающемуся в лечении, терапевтически эффективного количества композиции по п.3. 8. Способ по п.7, в котором расстройство выбрано из группы, состоящей из депрессии, эпилепсии и сопутствующих расстройств, и расстройств, связанных с нарушением метаболизма глюкозы. 9. Применение кристаллической формы по п.1 для получения лекарственного средства для лечения(а) тревожного состояния и сопутствующих расстройств; (b) биполярной депрессии; (с) мании; (d) депрессии; (е) эпилепсии и сопутствующих расстройств; (f) эпилептогенеза; (g) расстройств, связанных с нарушением метаболизма глюкозы; (h) расстройств, связанных с нарушением метаболизма липидов; (i) мигрени; (j) ожирения; (k) болей; (l) злоупотребления психоактивными веществами; или для получения нейропротекторного средства для лечения субъектов, нуждающихся в лечении.pXRD репрезентативного образца кристаллической формы (IS-VI) Фиг. 1 Дифференциальная сканирующая калориметрия репрезентативного образца кристаллической формы (IS-VI) Фиг. 2 Отсканированный результат термогравиметрического анализа репрезентативного образца кристаллической формы (IS-VI) Фиг. 3 Динамическая сорбция водяного пара репрезентативного образца кристаллической формы (IS-VI)
МПК / Метки
МПК: C07D 319/16, A61K 31/357, A61P 3/04, A61P 25/24, A61P 25/00, A61P 25/30
Метки: форма, 2s)-(-)-n-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамида, кристаллическая
Код ссылки
<a href="https://eas.patents.su/14-18567-kristallicheskaya-forma-2s-n-6-hlor-23-digidrobenzo14dioksin-2-ilmetilsulfamida.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая форма (2s)-(-)-n-(6-хлор-2,3-дигидробензо[1,4]диоксин-2-илметил)сульфамида</a>
Предыдущий патент: Фармацевтические комбинации 5-фторурацила и производных 1,4-дигидропиридина и их применение для лечения рака
Следующий патент: Высокоскоростная сварка трением с перемешиванием
Случайный патент: Способ переработки резиносодержащих отходов